VCAR组合物和使用方法
文献发布时间:2023-06-19 09:30:39
相关申请
本申请要求2017年12月20日提交的临时申请USSN 62/608,571和2017年12月21日提交的临时申请USSN 62/608,894的权益,其各自的内容通过全文引用并入本文。
本公开内容的领域
本公开内容涉及分子生物学,更具体地,涉及嵌合抗原受体,并涉及包含一种或多种VCAR的转座子,以及其制备和使用方法。
通过引用并入序列表
于2018年12月19日创建的命名为“POTH-034_001WO_SeqListing_ST25_R.txt”并且大小为54.4MB的文件的内容通过全文引用并入本文。
背景
对于在不使用传统抗体序列或其片段的情况下指导免疫细胞的特异性的方法,在本领域中存在长期但未满足的需要。本公开内容提供了优异的嵌合抗原受体。
概述
本公开内容提供了嵌合抗原受体(CAR),其包含:(a)包含抗原识别区的胞外域,其中所述抗原识别区包含至少一个单结构域抗体;(b)跨膜结构域,和(c)包含至少一个共刺激结构域的胞内域。在一些实施方案中,单结构域抗体包含人或人源化序列。在一些实施方案中,单结构域抗体包含非天然存在的序列。在一些实施方案中,单结构域抗体包含重组或嵌合序列。在一些实施方案中,单结构域抗体包含VHH或编码VHH的序列。在一些实施方案中,单结构域抗体包含VH或编码VH的序列。在一些实施方案中,单结构域抗体包含本公开内容的VH或编码本公开内容的VH的序列。
本公开内容提供了嵌合抗原受体(CAR),其包含:(a)包含抗原识别区的胞外域,其中所述抗原识别区包含至少一个VHH;(b)跨膜结构域,和(c)包含至少一个共刺激结构域的胞内域。如在整个公开内容中所使用的,包含VHH的CAR被称为VCAR。在某些实施方案中,抗原识别区可包含两个VHH以产生双特异性或串联VCAR。在某些实施方案中,抗原识别区可包含三个VHH以产生三特异性VCAR。
在本公开内容的VCAR的某些实施方案中,胞外域可以进一步包含信号肽。替代地或额外地,在某些实施方案中,胞外域可进一步包含抗原识别区和跨膜结构域之间的铰链。在某些实施方案中,胞外域可进一步包含信号肽。替代地或额外地,在某些实施方案中,胞外域可进一步包含抗原识别区和跨膜结构域之间的铰链。
在本公开内容的VCAR的某些实施方案中,VHH包含以下氨基酸序列或由以下氨基酸序列组成:
或VHH包含以下核酸序列或由以下核酸序列组成:
在本公开内容的VCAR的某些实施方案中,VHH包含以下氨基酸序列或由以下氨基酸序列组成:
或VHH包含以下核酸序列或由以下核酸序列组成:
在本公开内容的VCAR的某些实施方案中,VHH包含以下氨基酸序列或由以下氨基酸序列组成:
或VHH包含以下核酸序列或由以下核酸序列组成:
在本公开内容的VCAR的某些实施方案中,VHH包含以下氨基酸序列或由以下氨基酸序列组成:
或VHH包含以下核酸序列或由以下核酸序列组成:
在本公开内容的VCAR的某些实施方案中,VHH包含以下氨基酸序列或由以下氨基酸序列组成:
或VHH包含以下核酸序列或由以下核酸序列组成:
在本公开内容的VCAR的某些实施方案中,VHH包含以下氨基酸序列或由以下氨基酸序列组成:
或VHH包含以下核酸序列或由以下核酸序列组成:
本公开内容提供了嵌合抗原受体(CAR),其包含:(a)包含抗原识别区的胞外域,其中所述抗原识别区包含至少一个VH;(b)跨膜结构域,和(c)包含至少一个共刺激结构域的胞内域。如在整个公开内容中所使用的,包含VH的CAR称为VCAR。在某些实施方案中,抗原识别区可包含两个VH以产生双特异性或串联VCAR。在某些实施方案中,抗原识别区可包含三个VH以产生三特异性VCAR。在某些实施方案中,胞外域可进一步包含信号肽。替代地或额外地,在某些实施方案中,胞外域可进一步包含抗原识别区和跨膜结构域之间的铰链。在某些实施方案中,胞外域可进一步包含信号肽。替代地或额外地,在某些实施方案中,胞外域可进一步包含抗原识别区和跨膜结构域之间的铰链。
在本公开内容的VCAR的某些实施方案(包括以下那些:其包含含有抗原识别区的胞外域)中,其中抗原识别区包含至少一个VH,VH包含人序列或人源化序列。
在本公开内容的VCAR(包括以下那些:其包含含有抗原识别区的胞外域)的某些实施方案中,其中抗原识别区包含至少一个VH,VH包含非天然存在的序列。
在本公开内容的VCAR(包括以下那些:其包含含有抗原识别区的胞外域)的某些实施方案中,其中抗原识别区包含至少一个VH,VH不是天然存在的。
在本公开内容的VCAR(包括以下那些:其包含含有抗原识别区的胞外域)的某些实施方案中,其中抗原识别区包含至少一个VH,VH包含重组或嵌合序列。
在本公开内容的VCAR(包括以下那些:其包含含有抗原识别区的胞外域)的某些实施方案中,其中抗原识别区包含至少一个VH,VH通过亲和力选择和重组的体外程序产生。
在本公开内容的VCAR的某些实施方案中,VH包含以下氨基酸序列或由以下氨基酸序列组成:
或VH包含以下核酸序列或由以下核酸序列组成:
在本公开内容的VCAR的某些实施方案中,VH包含以下氨基酸序列或由以下氨基酸序列组成:
或VH包含以下核酸序列或由以下核酸序列组成:
在本公开内容的VCAR的某些实施方案中,VH包含以下氨基酸序列或由以下氨基酸序列组成:
或VH包含以下核酸序列或由以下核酸序列组成:
在本公开内容的VCAR的某些实施方案中,VH包含以下氨基酸序列或由以下氨基酸序列组成:
或VH包含以下核酸序列或由以下核酸序列组成:
在本公开内容的VCAR的某些实施方案中,VH包含以下氨基酸序列或由以下氨基酸序列组成:
或VH包含以下核酸序列或由以下核酸序列组成:
在本公开内容的VCAR的某些实施方案中,VH包含以下氨基酸序列或由以下氨基酸序列组成:
或VH包含以下核酸序列或由以下核酸序列组成:
在本公开内容的VCAR的某些实施方案中,VCAR包含单结构域抗体、VHH、VH或其组合。在一些实施方案中,单结构域抗体、VHH或VH包含重组序列和/或嵌合序列或由重组序列和/或嵌合序列组成。在一些实施方案中,单结构域抗体、VHH或VH包含人序列和/或人源化序列或由人序列和/或人源化序列组成。
在本公开内容的VCAR的某些实施方案中,VCAR包含单结构域抗体。在一些实施方案中,单结构域抗体是VHH或VH抗体。在一些实施方案中,VH抗体是UniDab抗体。在一些实施方案中,VH抗体不是天然存在的单克隆抗体的片段。
在本公开内容的VCAR的某些实施方案中,信号肽可包含编码人CD2、CD3δ、CD3ε、CD3γ、CD3ζ、CD4、CD8α、CD19、CD28、4-1BB或GM-CSFR信号肽的序列。在本公开内容的VCAR的某些实施方案中,信号肽可包含编码人CD8α信号肽的序列。人CD8α信号肽可包含含有MALPVTALLLPLALLLHAARP(SEQ ID NO:18012)的氨基酸序列。人8α信号肽可包含含有MALPVTALLLPLALLLHAARP(SEQ ID NO:18012)的氨基酸序列或与含有MALPVTALLLPLALLLHAARP(SEQ ID NO:18012)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。人CD8α信号肽可由包含atggcactgccagtcaccgccctgctgctgcctctggctctgctgctgcacgcagctagacca(SEQ ID NO:18013)的核酸序列编码。
在本公开内容的VCAR的某些实施方案中,跨膜结构域可包含编码人CD2、CD3δ、CD3ε、CD3γ、CD3ζ、CD4、CD8α、CD19、CD28、4-1BB或GM-CSFR跨膜结构域的序列。在本公开内容的VCAR的某些实施方案中,跨膜结构域可包含编码人CD8α跨膜结构域的序列。
CD8α跨膜结构域可包含含有IYIWAPLAGTCGVLLLSLVITLYC(SEQ ID NO:18014)的氨基酸序列或与含有IYIWAPLAGTCGVLLLSLVITLYC(SEQ ID NO:18014)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。CD8α跨膜结构域可由包含atctacatttgggcaccactggccgggacctgtggagtgctgctgctgagcctggtcatcacactgtactgc(SEQ ID NO:18015)的核酸序列编码。
在本公开内容的VCAR的某些实施方案中,胞内域可包含人CD3ζ胞内域。
在本公开内容的VCAR的某些实施方案中,至少一个共刺激结构域可包含人4-1BB、CD28、CD40、ICOS、MyD88、OX-40细胞内区段,或其任何组合。在本公开内容的VCAR的某些实施方案中,至少一个共刺激结构域可包含CD28和/或4-1BB共刺激结构域。CD3ζ共刺激结构域可包含含有RVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR(SEQ ID NO:18016)的氨基酸序列或与含有RVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR(SEQ ID NO:18016)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。CD3ζ共刺激结构域可由包含cgcgtgaagtttagtcgatcagcagatgccccagcttacaaacagggacagaaccagctgtataacgagctgaatctgggccgccgagaggaatatgacgtgctggataagcggagaggacgcgaccccgaaatgggaggcaagcccaggcgcaaaaaccctcaggaaggcctgtataacgagctgcagaaggacaaaatggcagaagcctattctgagatcggcatgaagggggagcgacggagaggcaaagggcacgatgggctgtaccagggactgagcaccgccacaaaggacacctatgatgctctgcatatgcaggcactgcctccaagg(SEQ ID NO:18017)的核酸序列编码。4-1BB共刺激结构域可包含含有KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL(SEQ ID NO:18018)的氨基酸序列或与含有KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL(SEQ ID NO:18018)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。4-1BB共刺激结构域可由包含aagagaggcaggaagaaactgctgtatattttcaaacagcccttcatgcgccccgtgcagactacccaggaggaagacgggtgctcctgtcgattccctgaggaagaggaaggcgggtgtgagctg(SEQ ID NO:18019)的核酸序列编码。4-1BB共刺激结构域可位于跨膜结构域和CD28共刺激结构域之间。
在本公开内容的VCAR的某些实施方案中,铰链可包含衍生自人CD8α、IgG4和/或CD4序列的序列。在本公开内容的VCAR的某些实施方案中,铰链可包含衍生自人CD8α序列的序列。铰链可包含含有TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACD(SEQID NO:18020)的人CD8α氨基酸序列或与含有TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACD(SEQID NO:18020)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。人CD8α铰链氨基酸序列可由包含actaccacaccagcacctagaccaccaactccagctccaaccatcgcgagtcagcccctgagtctgagacctgaggcctgcaggccagctgcaggaggagctgtgcacaccaggggcctggacttcgcctgcgac(SEQ ID NO:18021)的核酸序列编码。
本公开内容的VHH和/或VCAR可以以选自以下的至少一种亲和力结合抗原:小于或等于10
本公开内容提供了抗BCMA VCAR。本公开内容提供了包含本公开内容的VCAR和至少一种药学可接受的载体的组合物。
本公开内容提供了包含本公开内容的VCAR的转座子。
本公开内容的转座子可包含用于鉴定、富集和/或分离表达转座子的细胞的选择基因。示例性选择基因编码对于细胞生存力和存活所必需的任何基因产物(例如转录物、蛋白、酶)。示例性选择基因编码对于赋予对药物攻击的抗性所必需的任何基因产物(例如转录物、蛋白、酶),在选择基因编码的基因产物不存在的情况下,细胞对于所述药物攻击是敏感的(或者其可能对细胞是致命的)。示例性选择基因编码对于在缺乏一种或多种营养物的细胞培养基中的生存力和/或存活所必需的任何基因产物(例如,转录物、蛋白、酶),所述一种或多种营养物是在选择基因不存在的情况下的细胞生存力和/或存活所必需的。示例性选择基因包括,但不限于,neo(赋予对新霉素的抗性)、DHFR(编码二氢叶酸还原酶并赋予对氨甲蝶呤的抗性)、TYMS(编码胸苷酸合成酶)、MGMT(编码O(6)-甲基鸟嘌呤-DNA甲基转移酶)、多药耐药基因(MDR1)、ALDH1(编码醛脱氢酶1家族,成员A1)、FRANCF、RAD51C(编码RAD51旁系同源物C)、GCS(编码葡糖基神经酰胺合酶)和NKX2.2(编码NK2同源异型框2)。
本公开内容的转座子可包含诱导型促凋亡多肽,其包含(a)配体结合区、(b)接头和(c)促凋亡多肽,其中诱导型促凋亡多肽不包含非人序列。在某些实施方案中,非人序列包含限制位点。在某些实施方案中,配体结合区可以是多聚体配体结合区。本公开内容的诱导型促凋亡多肽也可被称为“iC9安全开关”。在某些实施方案中,本公开内容的转座子可包含诱导型胱天蛋白酶多肽,其包含(a)配体结合区、(b)接头和(c)胱天蛋白酶多肽,其中诱导型促凋亡多肽不包含非人序列。在某些实施方案中,本公开内容的转座子可包含诱导型胱天蛋白酶多肽,其包含(a)配体结合区、(b)接头和(c)胱天蛋白酶多肽,其中诱导型促凋亡多肽不包含非人序列。在某些实施方案中,本公开内容的转座子可包含诱导型胱天蛋白酶多肽,其包含(a)配体结合区、(b)接头和(c)截短的胱天蛋白酶9多肽,其中诱导型促凋亡多肽不包含非人序列。在本公开内容的诱导型促凋亡多肽、诱导型胱天蛋白酶多肽或截短的胱天蛋白酶9多肽的某些实施方案中,配体结合区可包含FK506结合蛋白12(FKBP12)多肽。在某些实施方案中,包含FK506结合蛋白12(FKBP12)多肽的配体结合区的氨基酸序列可包含在序列的位置36的修饰。修饰可以是缬氨酸(V)对位置36的苯丙氨酸(F)的取代(F36V)。在某些实施方案中,FKBP12多肽由包含
在本公开内容的诱导型促凋亡多肽、诱导型胱天蛋白酶多肽或截短的胱天蛋白酶9多肽的某些实施方案中,接头区由包含GGGGS(SEQ ID NO:18024)的氨基酸或包含GGAGGAGGAGGATCC(SEQ ID NO:18025)的核酸序列编码。在某些实施方案中,编码接头的核酸序列不包含限制位点。
在本公开内容的截短的胱天蛋白酶9多肽的某些实施方案中,截短的胱天蛋白酶9多肽由在序列的位置87不包含精氨酸(R)的氨基酸序列编码。替代地或额外地,在本公开内容的诱导型促凋亡多肽、诱导型胱天蛋白酶多肽或截短的胱天蛋白酶9多肽的某些实施方案中,截短的胱天蛋白酶9多肽由在序列的位置282不包含丙氨酸(A)的氨基酸序列编码。在本公开内容的诱导型促凋亡多肽、诱导型胱天蛋白酶多肽或截短的胱天蛋白酶9多肽的某些实施方案中,截短的胱天蛋白酶9多肽由包含
在诱导型促凋亡多肽的某些实施方案中,其中多肽包含截短的胱天蛋白酶9多肽,诱导型促凋亡多肽由包含
本公开内容的转座子可包含至少一个自我切割肽,其位于,例如,一个或多个本公开内容的VHH或VCAR和本公开内容的选择基因之间。本公开内容的转座子可包含至少一个自我切割肽,其位于,例如,一个或多个本公开内容的VHH或VCAR和本公开内容的诱导型促凋亡多肽之间。本公开内容的转座子可包含至少两个自我切割肽,即,位于例如本公开内容的诱导型促凋亡多肽的上游或紧邻上游的第一自我切割肽,和位于例如本公开内容的诱导型促凋亡多肽的下游或紧邻上游的第二第一自我切割肽。
至少一个自我切割肽可包括,例如,T2A肽、GSG-T2A肽、E2A肽、GSG-E2A肽、F2A肽、GSG-F2A肽、P2A肽或GSG-P2A肽。T2A肽可包含含有EGRGSLLTCGDVEENPGP(SEQ ID NO:18030)的氨基酸序列或与含有EGRGSLLTCGDVEENPGP(SEQ ID NO:18030)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-T2A肽可包含含有GSGEGRGSLLTCGDVEENPGP(SEQ ID NO:18031)的氨基酸序列或与含有GSGEGRGSLLTCGDVEENPGP(SEQ ID NO:18031)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-T2A肽可包含含有ggatctggagagggaaggggaagcctgctgacctgtggagacgtggaggaaaacccaggacca(SEQ ID NO:18032)的核酸序列。E2A肽可包含含有QCTNYALLKLAGDVESNPGP(SEQ ID NO:18033)的氨基酸序列或与含有QCTNYALLKLAGDVESNPGP(SEQ ID NO:18033)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-E2A肽可包含含有GSGQCTNYALLKLAGDVESNPGP(SEQ ID NO:18034)的氨基酸序列或与含有GSGQCTNYALLKLAGDVESNPGP(SEQ ID NO:18034)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。F2A肽可包含含有VKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18035)的氨基酸序列或与含有VKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18035)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-F2A肽可包含含有GSGVKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18036)的氨基酸序列或与含有GSGVKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18036)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。P2A肽可包含含有ATNFSLLKQAGDVEENPGP(SEQ ID NO:18037)的氨基酸序列或与含有ATNFSLLKQAGDVEENPGP(SEQ ID NO:18037)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-P2A肽可包含含有GSGATNFSLLKQAGDVEENPGP(SEQ ID NO:18038)的氨基酸序列或与含有GSGATNFSLLKQAGDVEENPGP(SEQ ID NO:18038)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。
本公开内容的转座子可包含第一和第二自我切割肽,即,位于例如一个或多个本公开内容的VHH或VCAR的上游的第一自我切割肽,和位于例如一个或多个本公开内容的VHH或VCAR的下游的第二自我切割肽。第一和/或第二自我切割肽可包含,例如,T2A肽、GSG-T2A肽、E2A肽、GSG-E2A肽、F2A肽、GSG-F2A肽、P2A肽或GSG-P2A肽。T2A肽可包含含有EGRGSLLTCGDVEENPGP(SEQ ID NO:18030)的氨基酸序列或与含有EGRGSLLTCGDVEENPGP(SEQID NO:18030)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-T2A肽可包含含有GSGEGRGSLLTCGDVEENPGP(SEQ ID NO:18031)的氨基酸序列或与含有GSGEGRGSLLTCGDVEENPGP(SEQ ID NO:18031)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-T2A肽可包含含有ggatctggagagggaaggggaagcctgctgacctgtggagacgtggaggaaaacccaggacca(SEQ ID NO:18032)的核酸序列。E2A肽可包含含有QCTNYALLKLAGDVESNPGP(SEQ ID NO:18033)的氨基酸序列或与含有QCTNYALLKLAGDVESNPGP(SEQ ID NO:18033)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-E2A肽可包含含有GSGQCTNYALLKLAGDVESNPGP(SEQ ID NO:18034)的氨基酸序列或与含有GSGQCTNYALLKLAGDVESNPGP(SEQ ID NO:18034)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。F2A肽可包含含有VKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18035)的氨基酸序列或与含有VKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18035)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-F2A肽可包含含有GSGVKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18036)的氨基酸序列或与含有GSGVKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18036)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。P2A肽可包含含有ATNFSLLKQAGDVEENPGP(SEQ ID NO:18037)的氨基酸序列或与含有ATNFSLLKQAGDVEENPGP(SEQ ID NO:18037)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-P2A肽可包含含有GSGATNFSLLKQAGDVEENPGP(SEQ ID NO:18038)的氨基酸序列或与含有GSGATNFSLLKQAGDVEENPGP(SEQ ID NO:18038)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。
本公开内容提供了包含本公开内容的转座子的组合物。在某些实施方案中,组合物可进一步包含含有编码转座酶的序列的质粒。编码转座酶的序列可以是mRNA序列。
本公开内容的转座子可包含piggyBac转座子。在这种方法的某些实施方案中,转座子是具有编码嵌合抗原受体的序列的质粒DNA转座子,所述编码嵌合抗原受体的序列侧翼为两个顺式调节绝缘子元件。在某些实施方案中,转座子是piggyBac转座子。本公开内容的转座酶可包括piggyBac转座酶或相容酶。在某些实施方案中,且尤其是在其中转座子是piggyBac转座子的那些实施方案中,转座酶是piggyBac或超级piggyBac(Super piggyBac,SPB)转座酶。在某些实施方案中,且尤其是在其中转座酶是超级piggyBac(SPB)转座酶的那些实施方案中,编码转座酶的序列是mRNA序列。
在本公开内容的方法的某些实施方案中,转座酶是piggyBac(PB)转座酶。piggyBac(PB)转座酶可包含与以下序列具有至少75%、80%、85%、90%、95%、99%或其之间的任何百分比同一性的氨基酸序列或由其组成:
在本公开内容的方法的某些实施方案中,转座酶是包含一种氨基酸序列或由该氨基酸序列组成的piggyBac(PB)转座酶,所述氨基酸序列具有在以下序列的位置30、165、282或538的一个或多个处的氨基酸取代:
在某些实施方案中,转座酶是包含一种氨基酸序列或由该氨基酸序列组成的piggyBac(PB)转座酶,所述氨基酸序列具有在SEQ ID NO:14487的序列的位置30、165、282或538的两处或更多处的氨基酸取代。在某些实施方案中,转座酶是包含一种氨基酸序列或由该氨基酸序列组成的piggyBac(PB)转座酶,所述氨基酸序列具有在SEQ ID NO:14487的序列的位置30、165、282或538的三处或更多处的氨基酸取代。在某些实施方案中,转座酶是包含一种氨基酸序列或由该氨基酸序列组成的piggyBac(PB)转座酶,所述氨基酸序列具有在SEQ ID NO:14487的序列的以下位置30、165、282和538的每一处的氨基酸取代。在某些实施方案中,在SEQ ID NO:14487的序列的位置30的氨基酸取代是缬氨酸(V)取代异亮氨酸(I)。在某些实施方案中,在SEQ ID NO:14487的序列的位置165的氨基酸取代是丝氨酸(S)取代甘氨酸(G)。在某些实施方案中,在SEQ ID NO:14487的序列的位置282的氨基酸取代是缬氨酸(V)取代甲硫氨酸(M)。在某些实施方案中,在SEQ ID NO:14487的序列的位置538的氨基酸取代是赖氨酸(K)取代天冬酰胺(N)。
在本公开内容的方法的某些实施方案中,转座酶是超级piggyBac(SPB)转座酶。在某些实施方案中,本公开内容的超级piggyBac(SPB)转座酶可包含SEQ ID NO:14487的序列的氨基酸序列或由其组成,其中位置30的氨基酸取代是缬氨酸(V)取代异亮氨酸(I),位置165的氨基酸取代是丝氨酸(S)取代甘氨酸(G),位置282的氨基酸取代是缬氨酸(V)取代甲硫氨酸(M),且位置538的氨基酸取代是赖氨酸(K)取代天冬酰胺(N)。在某些实施方案中,超级piggyBac(SPB)转座酶可包含与以下序列具有至少75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
本公开内容提供了包含本公开内容的VCAR的载体。在某些实施方案中,载体是病毒载体。载体可以是重组载体。
本公开内容的病毒载体可包含分离或衍生自逆转录病毒、慢病毒、腺病毒、腺伴随病毒或其任何组合的序列。病毒载体可包含分离或衍生自腺伴随病毒(AAV)的序列。病毒载体可包含重组AAV(rAAV)。本公开内容的示例性腺伴随病毒和重组腺伴随病毒包含两个或更多个反向末端重复(ITR)序列,其位置顺式邻接编码本公开内容的VHH或VCAR的序列。本公开内容的示例性腺伴随病毒和重组腺伴随病毒包括,但不限于所有血清型(例如AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8和AAV9)。本公开内容的示例性腺伴随病毒和重组腺伴随病毒包括,但不限于自我互补的AAV(scAAV)和含有一种血清型的基因组和另一种血清型的衣壳的AAV杂合体(例如AAV2/5、AAV-DJ和AAV-DJ8)。本公开内容的示例性腺伴随病毒和重组腺伴随病毒包括,但不限于rAAV-LK03。
本公开内容的病毒载体可包含选择基因。选择基因可编码对于细胞生存力和存活所必需的基因产物。选择基因可编码当通过选择性细胞培养条件攻击时,对于细胞生存力和存活所必需的基因产物。选择性细胞培养条件可包含对细胞生存力或存活有害的化合物,且其中基因产物赋予对所述化合物的抗性。本公开内容的示例性选择基因可包括,但不限于neo(赋予对新霉素的抗性)、DHFR(编码二氢叶酸还原酶并赋予对氨甲蝶呤的抗性)、TYMS(编码胸苷酸合成酶)、MGMT(编码O(6)-甲基鸟嘌呤-DNA甲基转移酶)、多药耐药基因(MDR1)、ALDH1(编码醛脱氢酶1家族,成员A1)、FRANCF、RAD51C(编码RAD51旁系同源物C)、GCS(编码葡糖基神经酰胺合酶)、NKX2.2(编码NK2同源异型框2)或其任何组合。
本公开内容的病毒载体可包含诱导型促凋亡多肽,其包含(a)配体结合区、(b)接头和(c)促凋亡多肽,其中诱导型促凋亡多肽不包含非人序列。在某些实施方案中,非人序列包含限制位点。在某些实施方案中,配体结合区可以是多聚体配体结合区。本公开内容的诱导型促凋亡多肽也可被称为“iC9安全开关”。在某些实施方案中,本公开内容的病毒载体可包含诱导型胱天蛋白酶多肽,其包含(a)配体结合区、(b)接头和(c)胱天蛋白酶多肽,其中诱导型促凋亡多肽不包含非人序列。在某些实施方案中,本公开内容的病毒载体可包含诱导型胱天蛋白酶多肽,其包含(a)配体结合区、(b)接头和(c)胱天蛋白酶多肽,其中诱导型促凋亡多肽不包含非人序列。在某些实施方案中,本公开内容的病毒载体可包含诱导型胱天蛋白酶多肽,其包含(a)配体结合区、(b)接头和(c)截短的胱天蛋白酶9多肽,其中诱导型促凋亡多肽不包含非人序列。在本公开内容的诱导型促凋亡多肽、诱导型胱天蛋白酶多肽或截短的胱天蛋白酶9多肽的某些实施方案中,配体结合区可包含FK506结合蛋白12(FKBP12)多肽。在某些实施方案中,包含FK506结合蛋白12(FKBP12)多肽的配体结合区的氨基酸序列可包含在序列的位置36的修饰。修饰可以是缬氨酸(V)对位置36的苯丙氨酸(F)的取代(F36V)。在某些实施方案中,FKBP12多肽由包含
在本公开内容的诱导型促凋亡多肽、诱导型胱天蛋白酶多肽或截短的胱天蛋白酶9多肽的某些实施方案中,接头区由包含GGGGS(SEQ ID NO:18024)的氨基酸或包含GGAGGAGGAGGATCC(SEQ ID NO:18025)的核酸序列编码。在某些实施方案中,编码接头的核酸序列不包含限制位点。
在本公开内容的截短的胱天蛋白酶9多肽的某些实施方案中,截短的胱天蛋白酶9多肽由在序列的位置87不包含精氨酸(R)的氨基酸序列编码。替代地或额外地,在本公开内容的诱导型促凋亡多肽、诱导型胱天蛋白酶多肽或截短的胱天蛋白酶9多肽的某些实施方案中,截短的胱天蛋白酶9多肽由在序列的位置282不包含丙氨酸(A)的氨基酸序列编码。在本公开内容的诱导型促凋亡多肽、诱导型胱天蛋白酶多肽或截短的胱天蛋白酶9多肽的某些实施方案中,截短的胱天蛋白酶9多肽由包含
在诱导型促凋亡多肽的某些实施方案中,其中多肽包含截短的胱天蛋白酶9多肽,诱导型促凋亡多肽由包含
本公开内容的病毒载体可包含至少一个自我切割肽。在一些实施方案中,载体可包含至少一个自我切割肽,并且其中自我切割肽位于CAR和选择基因之间。在一些实施方案中,载体可包含至少一个自我切割肽,并且其中第一自我切割肽位于CAR的上游且第二自我切割肽位于CAR的下游。本公开内容的病毒载体可包含至少一个自我切割肽,其位于例如本公开内容的VCAR、VCAR或VCAR的一个或多个和本公开内容的诱导型促凋亡多肽之间。本公开内容的病毒载体可包含至少两个自我切割肽,即,位于例如本公开内容的诱导型促凋亡多肽的上游或紧邻上游的第一自我切割肽,和位于例如本公开内容的诱导型促凋亡多肽的下游或紧邻上游的第二第一自我切割肽。自我切割肽可包括,例如,T2A肽、GSG-T2A肽、E2A肽、GSG-E2A肽、F2A肽、GSG-F2A肽、P2A肽或GSG-P2A肽。T2A肽可包含含有EGRGSLLTCGDVEENPGP(SEQ ID NO:18030)的氨基酸序列或与含有EGRGSLLTCGDVEENPGP(SEQID NO:18030)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-T2A肽可包含含有GSGEGRGSLLTCGDVEENPGP(SEQ ID NO:18031)的氨基酸序列或与含有GSGEGRGSLLTCGDVEENPGP(SEQ ID NO:18031)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-T2A肽可包含含有ggatctggagagggaaggggaagcctgctgacctgtggagacgtggaggaaaacccaggacca(SEQ ID NO:18032)的核酸序列。E2A肽可包含含有QCTNYALLKLAGDVESNPGP(SEQ ID NO:18033)的氨基酸序列或与含有QCTNYALLKLAGDVESNPGP(SEQ ID NO:18033)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-E2A肽可包含含有GSGQCTNYALLKLAGDVESNPGP(SEQ ID NO:18034)的氨基酸序列或与含有GSGQCTNYALLKLAGDVESNPGP(SEQ ID NO:18034)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。F2A肽可包含含有VKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18035)的氨基酸序列或与含有VKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18035)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-F2A肽可包含含有GSGVKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18036)的氨基酸序列或与含有GSGVKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18036)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。P2A肽可包含含有ATNFSLLKQAGDVEENPGP(SEQ ID NO:18037)的氨基酸序列或与含有ATNFSLLKQAGDVEENPGP(SEQ ID NO:18037)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-P2A肽可包含含有GSGATNFSLLKQAGDVEENPGP(SEQ ID NO:18038)的氨基酸序列或与含有GSGATNFSLLKQAGDVEENPGP(SEQ ID NO:18038)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。
本公开内容提供了包含本公开内容的VCAR的载体。在某些实施方案中,载体是纳米颗粒。本公开内容的示例性纳米颗粒载体包括,但不限于核酸(如RNA、DNA、合成核苷酸、修饰的核苷酸或其任何组合)、氨基酸(L-氨基酸、D-氨基酸、合成氨基酸、修饰的氨基酸,或其任何组合)、聚合物(如聚合物囊泡(polymersome))、胶束、脂质(如脂质体)、有机分子(如碳原子、片材、纤维、管)、无机分子(如磷酸钙或金)或其任何组合。纳米颗粒载体可以被动地或主动地穿过细胞膜转运。
本公开内容的纳米颗粒载体可包含选择基因。选择基因可编码对于细胞生存力和存活所必需的基因产物。选择基因可编码当通过选择性细胞培养条件攻击时,对于细胞生存力和存活所必需的基因产物。选择性细胞培养条件可包含对细胞生存力或存活有害的化合物并且其中基因产物赋予对所述化合物的抗性。本公开内容的示例性选择基因可包括,但不限于neo(赋予对新霉素的抗性)、DHFR(编码二氢叶酸还原酶并赋予对氨甲蝶呤的抗性)、TYMS(编码胸苷酸合成酶)、MGMT(编码O(6)-甲基鸟嘌呤-DNA甲基转移酶)、多药耐药基因(MDR1)、ALDH1(编码醛脱氢酶1家族,成员A1)、FRANCF、RAD51C(编码RAD51旁系同源物C)、GCS(编码葡糖基神经酰胺合酶)、NKX2.2(编码NK2同源异型框2)或其任何组合。
本公开内容的纳米颗粒载体可包含诱导型促凋亡多肽,其包含(a)配体结合区、(b)接头和(c)促凋亡多肽,其中诱导型促凋亡多肽不包含非人序列。在某些实施方案中,非人序列包含限制位点。在某些实施方案中,配体结合区可以是多聚体配体结合区。本公开内容的诱导型促凋亡多肽也可被称为“iC9安全开关”。在某些实施方案中,本公开内容的纳米颗粒载体可包含诱导型胱天蛋白酶多肽,其包含(a)配体结合区、(b)接头和(c)胱天蛋白酶多肽,其中诱导型促凋亡多肽不包含非人序列。在某些实施方案中,本公开内容的纳米颗粒载体可包含诱导型胱天蛋白酶多肽,其包含(a)配体结合区、(b)接头和(c)胱天蛋白酶多肽,其中诱导型促凋亡多肽不包含非人序列。在某些实施方案中,本公开内容的纳米颗粒载体可包含诱导型胱天蛋白酶多肽,其包含(a)配体结合区、(b)接头和(c)截短的胱天蛋白酶9多肽,其中诱导型促凋亡多肽不包含非人序列。在本公开内容的诱导型促凋亡多肽、诱导型胱天蛋白酶多肽或截短的胱天蛋白酶9多肽的某些实施方案中,配体结合区可包含FK506结合蛋白12(FKBP12)多肽。在某些实施方案中,包含FK506结合蛋白12(FKBP12)多肽的配体结合区的氨基酸序列可包含在序列的位置36的修饰。修饰可以是缬氨酸(V)对位置36的苯丙氨酸(F)的取代(F36V)。在某些实施方案中,FKBP12多肽由包含
在本公开内容的诱导型促凋亡多肽、诱导型胱天蛋白酶多肽或截短的胱天蛋白酶9多肽的某些实施方案中,接头区由包含GGGGS(SEQ ID NO:18024)的氨基酸或包含GGAGGAGGAGGATCC(SEQ ID NO:18025)的核酸序列编码。在某些实施方案中,编码接头的核酸序列不包含限制位点。
在本公开内容的截短的胱天蛋白酶9多肽的某些实施方案中,截短的胱天蛋白酶9多肽由在序列的位置87不包含精氨酸(R)的氨基酸序列编码。替代地或额外地,在本公开内容的诱导型促凋亡多肽、诱导型胱天蛋白酶多肽或截短的胱天蛋白酶9多肽的某些实施方案中,截短的胱天蛋白酶9多肽由在序列的位置282不包含丙氨酸(A)的氨基酸序列编码。在本公开内容的诱导型促凋亡多肽、诱导型胱天蛋白酶多肽或截短的胱天蛋白酶9多肽的某些实施方案中,截短的胱天蛋白酶9多肽由包含
在诱导型促凋亡多肽的某些实施方案中,其中多肽包含截短的胱天蛋白酶9多肽,诱导型促凋亡多肽由包含
本公开内容的纳米颗粒载体可包含至少一个自我切割肽。在一些实施方案中,纳米颗粒载体可包含至少一个自我切割肽,并且其中自我切割肽位于VCAR和纳米颗粒之间。在一些实施方案中,纳米颗粒载体可包含至少一个自我切割肽,并且其中第一自我切割肽位于VCAR的上游且第二自我切割肽位于VCAR的下游。在一些实施方案中,纳米颗粒载体可包含至少一个自我切割肽,并且其中第一自我切割肽位于VCAR和纳米颗粒之间且第二自我切割肽位于VCAR的下游。在一些实施方案中,纳米颗粒载体可包含至少一个自我切割肽,并且其中第一自我切割肽位于VCAR和纳米颗粒之间且第二自我切割肽位于VCAR的下游,例如,VCAR和选择基因之间。
本公开内容的纳米颗粒载体可包含至少一个自我切割肽,其位于,例如,一个或多个本公开内容的VHH或VCAR和本公开内容的诱导型促凋亡多肽之间。本公开内容的纳米颗粒载体可包含至少两个自我切割肽,即,位于例如本公开内容的诱导型促凋亡多肽的上游或紧邻上游的第一自我切割肽,和位于例如本公开内容的诱导型促凋亡多肽的下游或紧邻上游的第二第一自我切割肽。自我切割肽可包含,例如,T2A肽、GSG-T2A肽、E2A肽、GSG-E2A肽、F2A肽、GSG-F2A肽、P2A肽或GSG-P2A肽。T2A肽可包含含有EGRGSLLTCGDVEENPGP(SEQ IDNO:18030)的氨基酸序列或与含有EGRGSLLTCGDVEENPGP(SEQ ID NO:18030)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-T2A肽可包含含有GSGEGRGSLLTCGDVEENPGP(SEQ ID NO:18031)的氨基酸序列或与含有GSGEGRGSLLTCGDVEENPGP(SEQ ID NO:18031)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-T2A肽可包含含有ggatctggagagggaaggggaagcctgctgacctgtggagacgtggaggaaaacccaggacca(SEQ ID NO:18032)的核酸序列。E2A肽可包含含有QCTNYALLKLAGDVESNPGP(SEQ ID NO:18033)的氨基酸序列或与含有QCTNYALLKLAGDVESNPGP(SEQ ID NO:18033)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-E2A肽可包含含有GSGQCTNYALLKLAGDVESNPGP(SEQ ID NO:18034)的氨基酸序列或与含有GSGQCTNYALLKLAGDVESNPGP(SEQ ID NO:18034)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。F2A肽可包含含有VKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18035)的氨基酸序列或与含有VKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18035)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-F2A肽可包含含有GSGVKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18036)的氨基酸序列或与含有GSGVKQTLNFDLLKLAGDVESNPGP(SEQ ID NO:18036)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。P2A肽可包含含有ATNFSLLKQAGDVEENPGP(SEQ ID NO:18037)的氨基酸序列或与含有ATNFSLLKQAGDVEENPGP(SEQ ID NO:18037)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。GSG-P2A肽可包含含有GSGATNFSLLKQAGDVEENPGP(SEQ ID NO:18038)的氨基酸序列或与含有GSGATNFSLLKQAGDVEENPGP(SEQ ID NO:18038)的氨基酸序列具有至少70%、80%、90%、95%或99%同一性的序列。
本公开内容提供了包含本公开内容的载体的组合物。
本公开内容提供了包含本公开内容的VCAR的细胞。本公开内容提供了包含本公开内容的转座子的细胞。在某些实施方案中,包含本公开内容的VCAR、转座子或载体的细胞可在细胞表面上表达VCAR。细胞可以是任何类型的细胞。优选地,细胞是免疫细胞。免疫细胞可以是T细胞、天然杀伤(NK)细胞、天然杀伤(NK)样细胞、细胞因子诱导的杀伤(CIK)细胞、造血祖细胞、外周血(PB)衍生的T细胞或脐带血(UCB)衍生的T细胞。优选地,免疫细胞是T细胞。T细胞可以是早期记忆细胞、干细胞样T细胞、T
可用于过继治疗的本公开内容的修饰的细胞可以是自体的或同种异体的。
本公开内容提供了在细胞表面上表达VCAR的方法,其包括:(a)获得细胞群体,(b)使细胞群体与包含本公开内容的VCAR或编码VCAR的序列的组合物在足以转移VCAR穿过细胞群体中至少一个细胞的细胞膜的条件下接触,由此产生修饰的细胞群体;(c)在适合转座子整合的条件下培养修饰的细胞群体;和(d)从修饰的细胞群体扩增和/或选择至少一个在细胞表面上表达VCAR的细胞。
在这种表达VCAR的方法的某些实施方案中,细胞群体可包含白细胞和/或CD4+和CD8+白细胞。细胞群体可包含最优化比例的CD4+和CD8+白细胞。CD4+与CD8+白细胞的最优化比例并不在体内天然存在。细胞群体可包含肿瘤细胞。
在这种表达VCAR的方法的某些实施方案中,转座子或载体包含VCAR或编码VCAR的序列。
在这种表达VCAR的方法的某些实施方案中,足以转移编码VCAR的序列穿过细胞群体中至少一个细胞的细胞膜的条件包括核转染。
在这种表达VCAR的方法的某些实施方案中,其中足以转移编码VCAR的序列穿过细胞群体中至少一个细胞的细胞膜的条件包括以下至少一种:施加指定电压下的一个或多个电脉冲、缓冲剂和一种或多种补充因子。在某些实施方案中,缓冲剂可包括PBS、HBSS、OptiMEM、BTXpress、Amaxa Nucleofector、人T细胞核转染缓冲剂或其任何组合。在某些实施方案中,一种或多种补充因子可包括(a)重组人细胞因子、趋化因子、白介素或其任何组合;(b)盐、矿物质、代谢物或其任何组合;(c)细胞培养基;(d)细胞DNA感应、代谢、分化、信号转导、一种或多种凋亡途径或其组合的抑制剂;和(e)修饰或稳定一种或多种核酸的试剂。重组人细胞因子、趋化因子、白介素或其任何组合可包括IL2、IL7、IL12、IL15、IL21、IL1、IL3、IL4、IL5、IL6、IL8、CXCL8、IL9、IL10、IL11、IL13、IL14、IL16、IL17、IL18、IL19、IL20、IL22、IL23、IL25、IL26、IL27、IL28、IL29、IL30、IL31、IL32、IL33、IL35、IL36、GM-CSF、IFN-γ、IL-1α/IL-1F1、IL-1β/IL-1F2、IL-12p70、IL-12/IL-35p35、IL-13、IL-17/IL-17A、IL-17A/F异二聚体、IL-17F、IL-18/IL-1F4、IL-23、IL-24、IL-32、IL-32β、IL-32γ、IL-33、LAP(TGF-β1)、淋巴毒素-α/TNF-β、TGF-β、TNF-α、TRANCE/TNFSF11/RANK L或其任何组合。盐、矿物质、代谢物或其任何组合可包括HEPES、烟酰胺、肝素、丙酮酸钠、L-谷氨酰胺、MEM非必需氨基酸溶液、抗坏血酸、核苷、FBS/FCS、人血清、血清替代物、抗生素、pH调节剂、厄尔氏盐、2-巯基乙醇、人转铁蛋白、重组人胰岛素、人血清白蛋白、Nucleofector PLUS补充剂、KCL、MgCl2、Na2HPO4、NAH2PO4、乳糖酸钠、甘露醇、琥珀酸钠、氯化钠、CINa、葡萄糖、Ca(NO3)2、Tris/HCl、K2HPO4、KH2PO4、聚乙烯亚胺、聚乙二醇、泊洛沙姆188、泊洛沙姆181、泊洛沙姆407、聚乙烯吡咯烷酮、Pop313、Crown-5,或其任何组合。细胞培养基可包括PBS、HBSS、OptiMEM、DMEM、RPMI 1640、AIM-V、X-VIVO 15、CellGro DC培养基、CTS OpTimizer T细胞扩增SFM、TexMACS培养基、PRIME-XV T细胞扩增培养基、ImmunoCult-XF T细胞扩增培养基或其任何组合。细胞DNA感应、代谢、分化、信号转导、一种或多种凋亡途径或其组合的抑制剂包括TLR9、MyD88、IRAK、TRAF6、TRAF3、IRF-7、NF-KB、1型干扰素、促炎细胞因子、cGAS、STING、Sec5、TBK1、IRF-3、RNA pol III、RIG-1、IPS-1、FADD、RIP1、TRAF3、AIM2、ASC、胱天蛋白酶1、Pro-IL1B、PI3K、Akt、Wnt3A的抑制剂、糖原合酶激酶-3β(GSK-3β)的抑制剂(如TWS119)、巴弗洛霉素(Bafilomycin)、氯喹、奎纳克林、AC-YVAD-CMK、Z-VAD-FMK、Z-IETD-FMK或其任何组合。修饰或稳定一种或多种核酸的试剂包括pH调节剂、DNA结合蛋白、脂质、磷脂、CaPO4、有或没有NLS序列的净中性电荷DNA结合肽、TREX1酶或其任何组合。
在这种表达VCAR的方法的某些实施方案中,适合于整合本公开内容的VCAR或编码VCAR的序列的条件包括以下至少一种:缓冲剂和一种或多种补充因子。在某些实施方案中,本公开内容的转座子或载体包含本公开内容的VCAR或编码VCAR的序列。在某些实施方案中,缓冲剂可包括PBS、HBSS、OptiMEM、BTXpress、Amaxa Nucleofector、人T细胞核转染缓冲剂或其任何组合。在某些实施方案中,一种或多种补充因子可包括(a)重组人细胞因子、趋化因子、白介素或其任何组合;(b)盐、矿物质、代谢物或其任何组合;(c)细胞培养基;(d)细胞DNA感应、代谢、分化、信号转导、一种或多种凋亡途径或其组合的抑制剂;和(e)修饰或稳定一种或多种核酸的试剂。重组人细胞因子、趋化因子、白介素或其任何组合可包括IL2、IL7、IL12、IL15、IL21、IL1、IL3、IL4、IL5、IL6、IL8、CXCL8、IL9、IL10、IL11、IL13、IL14、IL16、IL17、IL18、IL19、IL20、IL22、IL23、IL25、IL26、IL27、IL28、IL29、IL30、IL31、IL32、IL33、IL35、IL36、GM-CSF、IFN-γ、IL-1α/IL-1F1、IL-1β/IL-1F2、IL-12 p70、IL-12/IL-35p35、IL-13、IL-17/IL-17A、IL-17A/F异二聚体、IL-17F、IL-18/IL-1F4、IL-23、IL-24、IL-32、IL-32β、IL-32γ、IL-33、LAP(TGF-β1)、淋巴毒素-α/TNF-β、TGF-β、TNF-α、TRANCE/TNFSF11/RANK L或其任何组合。盐、矿物质、代谢物或其任何组合可包括HEPES、烟酰胺、肝素、丙酮酸钠、L-谷氨酰胺、MEM非必需氨基酸溶液、抗坏血酸、核苷、FBS/FCS、人血清、血清替代物、抗生素、pH调节剂、厄尔氏盐、2-巯基乙醇、人转铁蛋白、重组人胰岛素、人血清白蛋白、Nucleofector PLUS补充剂、KCL、MgCl2、Na2HPO4、NAH2PO4、乳糖酸钠、甘露醇、琥珀酸钠、氯化钠、CINa、葡萄糖、Ca(NO3)2、Tris/HCl、K2HPO4、KH2PO4、聚乙烯亚胺、聚乙二醇、泊洛沙姆188、泊洛沙姆181、泊洛沙姆407、聚乙烯吡咯烷酮、Pop313、Crown-5,或其任何组合。细胞培养基可包括PBS、HBSS、OptiMEM、DMEM、RPMI 1640、AIM-V、X-VIVO 15、CellGro DC培养基、CTS OpTimizer T细胞扩增SFM、TexMACS培养基、PRIME-XV T细胞扩增培养基、ImmunoCult-XF T细胞扩增培养基或其任何组合。细胞DNA感应、代谢、分化、信号转导、一种或多种凋亡途径或其组合的抑制剂包括TLR9、MyD88、IRAK、TRAF6、TRAF3、IRF-7、NF-KB、1型干扰素、促炎细胞因子、cGAS、STING、Sec5、TBK1、IRF-3、RNA pol III、RIG-1、IPS-1、FADD、RIP1、TRAF3、AIM2、ASC、胱天蛋白酶1、Pro-IL1B、PI3K、Akt、Wnt3A的抑制剂、糖原合酶激酶-3β(GSK-3β)的抑制剂(如TWS119)、巴弗洛霉素、氯喹、奎纳克林、AC-YVAD-CMK、Z-VAD-FMK、Z-IETD-FMK或其任何组合。修饰或稳定一种或多种核酸的试剂包括pH调节剂、DNA结合蛋白、脂质、磷脂、CaPO4、有或没有NLS序列的净中性电荷DNA结合肽、TREX1酶或其任何组合。
在这种表达VCAR的方法的某些实施方案中,扩增和选择步骤依次发生。扩增可在选择之前发生。扩增可在选择之后发生,且任选地,进一步的(即第二)选择可在扩增之后发生。
在这种表达VCAR的方法的某些实施方案中,扩增和选择步骤可同时发生。
在这种表达VCAR的方法的某些实施方案中,扩增可包括使修饰的细胞群体的至少一个细胞与抗原接触,以通过VCAR刺激至少一个细胞,由此产生扩增的细胞群体。抗原可在基质表面上呈递。基质可具有任何形式,包括,但不限于表面、孔、珠或多个珠,以及基质。基质可进一步包含顺磁性或磁性组分。在这种表达VCAR的方法的某些实施方案中,抗原可在基质表面上呈递,其中基质是磁珠,且其中磁体可以用于从修饰和扩增的细胞群体去除或分离磁珠。抗原可在细胞或人工抗原呈递细胞表面上呈递。本公开内容的人工抗原呈递细胞可包括,但不限于肿瘤细胞和干细胞。
在这种表达VCAR的方法的某些实施方案中,其中转座子或载体包含选择基因,且其中选择步骤包括使修饰的细胞群体的至少一个细胞与选择基因对其赋予抗性的化合物接触,由此将表达选择基因的细胞鉴定为在选择中存活和将未能表达选择基因的细胞鉴定为未能在选择步骤中存活。
在这种表达VCAR的方法的某些实施方案中,扩增和/或选择步骤可进行10-14天的时间段,包括端点。
本公开内容提供了包含本公开内容的方法的修饰、扩增和选择的细胞群体的组合物。
本公开内容提供了在有需要的受试者中治疗癌症的方法,包括给受试者施用本公开内容的组合物,其中VCAR特异性结合肿瘤细胞上的抗原。在某些实施方案中,肿瘤细胞可以是恶性肿瘤细胞。在某些实施方案中,包括给受试者施用包含本公开内容的修饰的细胞或细胞群体的组合物,该细胞或细胞群体可以是自体的。在某些实施方案中,包括给受试者施用包含本公开内容的修饰的细胞或细胞群体的组合物,该细胞或细胞群体可以是同种异体的。
本公开内容提供了在有需要的受试者中治疗自身免疫状况的方法,包括给受试者施用本公开内容的组合物,其中VCAR特异性结合受试者的自身免疫细胞上的抗原。在某些实施方案中,自身免疫细胞可以是特异性结合受试者的靶细胞上的自身抗原的淋巴细胞。在某些实施方案中,自身免疫细胞可以是B淋巴细胞(即B细胞)。在某些实施方案中,自身免疫细胞可以是T淋巴细胞(即T细胞)。在某些实施方案中,包括给受试者施用包含本公开内容的修饰的细胞或细胞群体的组合物,该细胞或细胞群体可以是自体的。在某些实施方案中,包括给受试者施用包含本公开内容的修饰的细胞或细胞群体的组合物,该细胞或细胞群体可以是同种异体的。
本公开内容提供了在有需要的受试者中治疗感染的方法,包括给受试者施用本公开内容的组合物,其中VCAR特异性结合包含感染原的细胞、与感染原相联系的细胞或暴露于感染原的细胞上的抗原。在一些实施方案中,与感染原相联系的细胞可以与感染原处于空气联系(例如,感染原通过空气传播或吸入)或流体联系(例如,传染原在水性或生物流体中携带)。引起宿主细胞感染的感染原可以是细菌、病毒、酵母或微生物。感染原可以在细胞或细胞的宿主生物(受试者)中诱发示例性状况,包括但不限于病毒感染、免疫缺陷状况、炎性状况和增生性病症。在某些实施方案中,感染引起结核、小头症、神经退行性变或疟疾。在某些实施方案中,感染在受试者的胎儿中引起小头症。在某些实施方案(包括其中感染在受试者的胎儿中引起小头症的那些)中,感染原是病毒,并且其中病毒是寨卡病毒。在某些实施方案中,免疫缺陷状况是获得性免疫缺陷综合征(AIDS)。在某些实施方案中,增生性病症是癌症。在某些实施方案中,癌症是宫颈癌,并且其中感染原是人乳头瘤病毒(HPV)。在某些实施方案中,包括给受试者施用包含本公开内容的修饰的细胞或细胞群体的组合物,该细胞或细胞群体可以是自体的。在某些实施方案中,包括给受试者施用包含本公开内容的修饰的细胞或细胞群体的组合物,该细胞或细胞群体可以是同种异体的。
本公开内容提供了在有需要的受试者中治疗肥大细胞疾病的方法,包括给受试者施用本公开内容的组合物,其中VCAR特异性结合肥大细胞上的抗原。在某些实施方案中,VCAR特异性结合受试者的肥大细胞上的抗原。在某些实施方案中,肥大细胞疾病可包括但不限于与肥大细胞过度增生相关的病症、与具有异常活性的肥大细胞相关的病症以及与肥大细胞数量异常和异常肥大细胞活性两者相关的病症。与肥大细胞过度增生相关的示例性病症包括但不限于肥大细胞增多症、皮肤肥大细胞增多症(例如色素性荨麻疹或斑疹性皮肤肥大细胞增多症)、全身性肥大细胞增多症(包括肥大细胞白血病)和局限性肥大细胞增生。与具有异常活性的肥大细胞相关的示例性病症包括但不限于肥大细胞激活综合征(MCAS)或肥大细胞激活病症(MCAD)、过敏性疾病(包括过敏反应)、哮喘、炎性疾病(包括例如关节组织的自身免疫相关的炎症,关节炎等)或其任何组合。在某些实施方案中,包括给受试者施用包含本公开内容的修饰的细胞或细胞群体的组合物,该细胞或细胞群体可以是自体的。在某些实施方案中,包括给受试者施用包含本公开内容的修饰的细胞或细胞群体的组合物,该细胞或细胞群体可以是同种异体的。本公开内容提供了在有需要的受试者中治疗退行性疾病的方法,包括给受试者施用本公开内容的组合物,其中VCAR特异性结合有害细胞或衰老细胞上的抗原。在某些实施方案中,VCAR特异性结合受试者的有害细胞或衰老细胞上的抗原。在某些实施方案中,退行性疾病可以包括但不限于神经退行性病症、代谢病症、血管病症和衰老。示例性神经退行性病症包括但不限于与神经元、神经胶质细胞或小神经胶质细胞的一种或多种的功能或功效丧失相关的病症。示例性神经退行性病症包括但不限于与干扰神经元、神经胶质细胞或小神经胶质细胞的一种或多种的功能或降低其功效的信号传导分子、蛋白或朊病毒的一种或多种的积累相关的病症。示例性的代谢病症包括但不限于与线粒体病症、电子转运链的中断、ATP的细胞产生的中断、神经元、神经胶质细胞或小神经胶质细胞的一种或多种的一个或多个线粒体的功能丧失或功效降低相关的病症。示例性的代谢病症包括但不限于与以下相关的病症:循环血流丧失或流向神经元、神经胶质细胞或小神经胶质细胞的血流减少(例如中风);神经元、神经胶质细胞或小神经胶质细胞的短暂或永久性缺氧状态(例如,足以在细胞中释放自由基);在受试者的睡眠状态中循环CNS的丧失或或流向神经元、神经胶质细胞或小神经胶质细胞的CNS流减少,其足以降低该睡眠状态中神经元、神经胶质细胞或小神经胶质细胞的废物清除功效。示例性衰老病症包括但不限于与以下相关的病症:神经元、神经胶质细胞或小神经胶质细胞的一个或多个染色体上增加的缩短的或缩短的端粒;神经元、神经胶质细胞或小神经胶质细胞中端粒酶的功能丧失或功效降低;或神经元、神经胶质细胞或小神经胶质细胞中DNA修复机制的功能丧失或功效降低。在某些实施方案中,有害细胞或衰老细胞在包含该有害细胞或衰老细胞的网络中干扰另一细胞的功能或降低其功效,并且,有害细胞或衰老细胞的靶向去除改善或恢复该网络的功能或提高其功效。在某些实施方案中,有害细胞或衰老细胞可以转化第二细胞的功能或功效,并且有害细胞或衰老细胞的靶向去除阻止第二细胞的转化。在某些实施方案中,退行性疾病是神经退行性病症,并且有害细胞或衰老细胞是干细胞、免疫细胞、神经元、神经胶质或小神经胶质细胞。在某些实施方案中,退行性疾病是代谢病症,并且有害细胞或衰老细胞是干细胞、体细胞、神经元、神经胶质细胞或小神经胶质细胞。在某些实施方案中,退行性疾病是血管病症,并且有害细胞或衰老细胞是干细胞、体细胞、免疫细胞、内皮细胞、神经元、神经胶质细胞或小神经胶质细胞。在某些实施方案中,退行性疾病是衰老,并且有害细胞或衰老细胞是卵母细胞、精子、干细胞、体细胞、免疫细胞、内皮细胞、神经元、神经胶质细胞或小神经胶质细胞。在某些实施方案中,包括给受试者施用包含本公开内容的修饰的细胞或细胞群体的组合物,该细胞或细胞群体可以是自体的。在某些实施方案中,包括给受试者施用包含本公开内容的修饰的细胞或细胞群体的组合物,该细胞或细胞群体可以是同种异体的。
本公开内容提供了在有需要的受试者中调整细胞治疗的方法,包括给受试者施用包含细胞的组合物,所述细胞包含含有诱导型促凋亡多肽的组合物的转座子或载体,其中可以通过使细胞与诱导剂接触,在细胞中选择性诱导凋亡。在某些实施方案中,细胞是自体的。在某些实施方案中,细胞是同种异体的。在该方法的某些实施方案中,细胞治疗是过继细胞治疗。在该方法的某些实施方案中,调整细胞治疗包括终止细胞治疗。在该方法的某些实施方案中,调整细胞治疗包括耗尽在细胞治疗中提供的部分细胞。在某些实施方案中,该方法进一步包括施用诱导剂的抑制剂以抑制细胞治疗的调整,从而恢复细胞治疗的功能和/或功效的步骤。
本公开内容的调整细胞治疗的方法可以用于响应于例如恢复的体征或疾病严重性/进展减弱的体征、疾病缓解/停止的体征和/或不良事件的发生而终止或减少治疗。如果疾病的体征或症状再次出现或严重程度增加和/或不良事件得到解决,可以通过抑制诱导剂来恢复本公开内容的细胞治疗。
附图简述
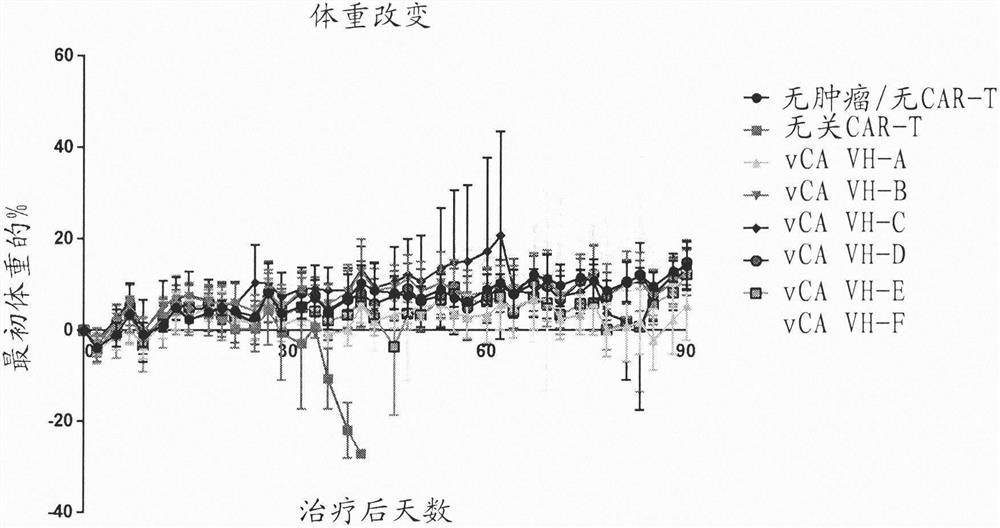
图1是显示对于本公开内容的VCAR,重量变化相对治疗后天数的图。
图2是显示对于本公开内容的VCAR,肿瘤负荷相对治疗后天数的图。
图3是显示对于本公开内容的VCAR,存活百分比相对治疗后天数的图。
图4是生物发光信号所显示的肿瘤负荷相对VH-A(三角形)、无关CAR(正方形)或无肿瘤/无CAR-T(圆圈)的治疗后天数的图。
图5是生物发光信号所显示的肿瘤负荷相对VH-B(三角形)、无关CAR(正方形)或无肿瘤/无CAR-T(圆圈)的治疗后天数的图。
图6是生物发光信号所显示的肿瘤负荷相对VH-C(三角形)、无关CAR(正方形)或无肿瘤/无CAR-T(圆圈)的治疗后天数的图。
图7是生物发光信号所显示的肿瘤负荷相对VH-D(三角形)、无关CAR(正方形)或无肿瘤/无CAR-T(圆圈)的治疗后天数的图。
图8是生物发光信号所显示的肿瘤负荷相对VH-E(三角形)、无关CAR(正方形)或无肿瘤/无CAR-T(圆圈)的治疗后天数的图。
图9是生物发光信号所显示的肿瘤负荷相对VH-F(三角形)、无关CAR(正方形)或无肿瘤/无CAR-T(圆圈)的治疗后天数的图。
图10A是提供本公开内容的示例性VH的构架和CDR序列的共有序列的表。
图10B是本公开内容的示例性VH的比对。从上到下,序列对应于构架VH-B(SEQ IDNO:18050)、VH-D(SEQ ID NO:18051)、VH-A(SEQ ID NO:18052)、VH-E(SEQ ID NO:18053)、VH-F(SEQ ID NO:18054)和VH-C(SEQ ID NO:18055)的共有序列。
图11是描绘装甲(armored)T细胞上的限制点信号传导蛋白的敲除效率的柱状图。当从正常健康供体分离时,原代人T细胞通常处于静息状态。使用Cas-CLOVER敲除限制点受体PD-1、TGFBR2、LAG-3、TIM-3和CTLA-4。在y-轴上显示百分比敲除。如通过流式细胞术所测量的,基因编辑导致在细胞表面的蛋白表达的30-70%丧失。
图12是原代T细胞中野生型、无效和转换受体(switch receptor)及它们对细胞内信号传导(抑制性或刺激性)的影响的示意图。在T细胞上内源表达的野生型抑制性受体与其内源配体的结合导致抑制信号的传递,这部分降低了T细胞效应子功能。然而,限制点受体蛋白,例如PD1(上图)或TGFBRII(下图)的细胞内结构域(ICD)的突变(突变的无效)或缺失(截短的无效)降低或消除当一种或多种关联配体结合时它的信号传导能力。因此,工程化的突变或截短的无效受体在修饰的T细胞表面上的表达导致与内源表达的野生型受体竞争与一种或多种游离内源配体的结合,有效地降低或消除通过内源表达的野生型受体对抑制信号的递送。具体而言,任何由突变的或无效受体的结合都掩蔽一种或多种内源配体与野生型受体结合,并导致有效递送至修饰的T细胞的限制点信号传导的总水平稀释,从而降低或阻断修饰的T细胞的限制点抑制和功能耗尽。通过用来自共刺激分子(例如CD3z、CD28、4-1BB)或不同的抑制分子(例如CTLA4、PD1、Lag3)的ICD来置换野生型ICD,产生了转换受体。在前一种情况下,由修饰的转换受体对一种或多种内源配体的结合导致阳性信号向T细胞的递送,从而有助于增强修饰的T细胞的刺激并可能增强靶肿瘤细胞杀伤。在后一种情况下,由修饰的转换受体对一种或多种内源配体的结合导致阴性信号向T细胞的递送,从而消除修饰的T细胞的刺激,并可能降低靶肿瘤细胞杀伤。在受体图中显示了信号肽(紫色箭头)、细胞外结构域(ECD)(亮绿色)、跨膜结构域(黄色)、细胞内信号传导结构域(ICD)(橙色)和置换ICD(绿色)。“*”表示突变的ICD。“+”表示存在限制点信号。“-”表示不存在限制点信号。
图13是显示PD1和TGFBRII无效受体的设计的示意图。显示了PD1(上图)和TGFBRII(下图)的截短的无效受体的信号肽结构域(SP)、跨膜结构域(TM)和细胞外结构域(ECD)。上部四个分子中的第一个是野生型PD-1受体,其编码野生型PD-1 SP和TM。对于PD1无效受体,描绘了用人T细胞CD8a受体的SP或TM结构域(红色)置换PD1野生型SP或TM结构域(绿色;浅绿色)。第二个分子编码CD8a SP连同天然PD-1 TM,第三个编码野生型PD-1 SP和替代的CD8a TM,且第四个编码替代的CD8a SP和TM两者。类似地,对于TGFβRII的无效受体,用人T细胞CD8a受体的SP结构域(红色)置换野生型TGFBRII SP(粉红色)。图的左侧列出了构建体的名称和每种构建体蛋白的氨基酸长度(aa)。
图14是描绘通过流式细胞术测定的原代人T细胞的表面上PD1和TGFBRII无效受体的表达的一系列直方图。在原代人T细胞的表面上表达来自图13的六种截短的无效构建体的每一种。用抗-PD1(上部;蓝色直方图)或抗-TGFβRII(下部;蓝色直方图)或同种型对照或仅第二抗体(secondary)(灰色直方图)对T细胞进行染色。门控对PD-1或TGFβRII表达染色阳性的细胞(门上方显示频率),并在每个阳性直方图上方显示平均荧光强度(MFI)值。每个图的上方都描绘了无效受体构建体的名称。两种无效受体基因策略,用替代的CD8a置换野生型SP得到成功表达。02.8aSP-PD-1和02.8aSP-TGFβRII导致在T细胞表面的最高水平表达。02.8aSP-PD-1无效受体表现出43,680的MFI,其是内源T细胞PD-1表达的177倍和野生型PD-1无效受体的2.8倍。02.8aSP-TGFβRII无效受体表现出13,809的MFI,其是内源T细胞TGFβRII表达的102倍和野生型TGFβRII无效受体的1.8倍。对于PD1和TGRBRII两者,用替代的CD8a SP置换野生型SP导致无效或转换受体增强的表面表达,这有助于分别使在一种或多种内源配体结合时限制点抑制或共刺激最大化。
图15A-B是描绘用于在T细胞中表达的NF-KB诱导型载体的一对示意图。开发了两种T细胞激活NF-KB诱导型载体;一种具有正向取向(A)的基因表达系统(GES),且另一种是互补方向(B),两者都在组成型EF1a启动子之前。这些载体还指导由T2A序列分开的CAR分子和DHFR选择基因的表达。条件性NF-KB诱导型系统和EF1a指导的基因两者都是可以使用电穿孔(EP)永久整合到T细胞中的piggyBac转座子的一部分。一旦整合到基因组中,T细胞就将组成型表达膜表面上的CAR和细胞内的DHFR,而NF-KB诱导型基因GFP的表达仅在T细胞激活时才将表达到最高水平。
图16是描绘激活的T细胞中GFP的NF-KB诱导型表达的一对图。用表达在EF1a启动子控制下的抗-BCMA CAR和DHFR突变蛋白基因的piggyBac载体以及不存在(无GES对照)或存在驱动正向(pNFKB-GFP正向)或反向取向(pNFKB-GFP反向)的GFP表达的NF-KB诱导型表达系统的情况下对T细胞进行核转染(nucleofected)。在有氨甲蝶呤选择的情况下培养细胞,直到细胞几乎完全静息(第19天),并在第5天和第19天评估GFP表达。在第5天,所有T细胞均增殖并被高度刺激,而带有NFKB诱导型表达盒的细胞由于强NFκB活性而产生高水平的GFP。无GES对照细胞不表达可检测水平的GFP。到第19天,GES T细胞几乎完全静息,且GFP表达显著低于第5天(~1/8MFI),这是因为NFκB活性较低。在第19天仍观察到GFP表达,这可能是由于GFP蛋白的长半衰期(~30小时),或通过例如TCR、CAR、细胞因子受体或生长因子受体信号的NFκB活性的基础水平。
图17是描绘在存在BCMA+肿瘤细胞的情况下GFP的NF-KB诱导型表达的抗-BCMACAR介导的激活的一系列图。T细胞是未修饰的(模拟T细胞)或用表达在EF1a启动子控制下的抗-BCMA CAR和DHFR突变蛋白基因的piggyBac载体以及不存在(无GES对照)或存在驱动正向(pNFKB-GFP正向)或反向取向(pNFKB-GFP反向)的GFP表达的NF-KB诱导型表达系统的情况下进行核转染。在具有或不具有氨甲蝶呤选择(模拟T细胞)的情况下,将所有细胞培养22天,直到细胞几乎完全静息。然后在不存在(无刺激)或存在BCMA-(K562)、BMCA+(RPMI8226)或阳性对照抗-CD3抗-CD28激活试剂(CD3/28刺激)的情况下刺激细胞3天。在所有条件下用无GES对照或模拟T细胞都不可检测GFP表达。然而,虽然当与BCMA-K562细胞一起培养时,pNFKB-GFP正向和反向转座的细胞相对于无刺激对照显示少量GFP表达,但它们均在有BCMA+肿瘤细胞存在的情况下或在阳性对照条件下显示了基因表达的急剧上调。在与BCMA+肿瘤细胞共培养的pNFKB-GFP正向和反向转座的细胞之间几乎没有观察到GFP表达的差异。
图18是证实诱导型基因的表达水平可以通过在启动子之前的应答元件的数目来调节的一系列图。T细胞用piggyBac载体进行核转染,所述piggyBac载体编码抗-BCMACARTyrin及其后的选择基因,两者均在人EF1a启动子控制下。进一步地,载体另外编码驱动截短的CD19蛋白(dCD19)表达的条件性NF-KB诱导型基因表达系统,并包括从0到5不等的许多NFKB应答元件(RE),无GES(无GES),或接受电穿孔脉冲但没有piggyBac核酸(模拟)。仅显示了关于反向(相反)方向/取向的GES的数据。所有细胞培养18天,并包括使用氨甲蝶呤添加对于piggyBac修饰的T细胞的选择。然后使用抗-CD3抗-CD28珠激活试剂刺激细胞3天,并在第0、3和18天通过FACS评估dCD19表面表达,并且将数据显示为FACS直方图和靶蛋白染色的MFI。在第0天,在用编码GES的载体转座的所有T细胞中都检测到了低水平的表面dCD19表达。在刺激后3天,对于所有表达GES的T细胞,观察到dCD19表达的剧烈上调,而在具有更高数目的RE的那些中,表面表达的增加倍数更大。因此,表面dCD19表达与GES中编码的RE的数目成正比。在不带有GES的T细胞表面未检测到dCD19:无GES和模拟对照。
图19是Csy4-T2A-Clo051-G4S接头-dCas9构建体图的示意绘图(实施方案2)。
图20是pRT1-Clo051-dCas9双重NLS构建体图的示意绘图(实施方案1)。
图21是一对图,其比较了对于本公开内容的Cas-Clover融合蛋白的实施方案1(pRT1-Clo051-dCas9双重NLS,如图20中所示)或实施方案2(Csy4-T2A-Clo051-G4S接头-dCas9,如图19中所示)敲除全T细胞中的B2M(左)或Jurkat细胞中的T细胞受体的α-链(右)的表达的功效。对于右图,如所指出的,以10μg或20μg提供融合蛋白。
图22是对实施方案1(pRT1-Clo051-dCas9双重NLS,如图20所示)和实施方案2(Csy4-T2A-Clo051-G4S接头-dCas9,如图19所示)的每一种存在下mRNA的凝胶电泳分析的照片。如所示的,两者在敲低mRNA表达方面都是有效的。
图23是UniRat
图24是用于鉴定免疫后由UniRat
图25是一对热图,显示下一代测序(NGS)分析如何揭示扩展的VH序列谱系。热图中红色(高)或蓝色(低)的程度表明由于免疫,VH序列家族已扩展。一些高等级的VH序列是单个动物所独有的。其它高等级的VH序列出现在多于一种动物中,表明这些序列家族的趋同选择。
图26是一系列流式细胞术图,显示表达P-PSMA-101并包含T
详述
本公开内容提供了嵌合抗原受体(CAR),其包含至少一个VHH(VCAR)。本公开内容的嵌合抗原受体可以包含多于一个VHH。例如,双特异性VCAR可以包含特异性结合两个不同抗原的两个VHH。
本公开内容的VHH蛋白特异性结合抗原。包含一个或多个特异性结合抗原的VHH的本公开内容的嵌合抗原受体可用于指导细胞(例如细胞毒性免疫细胞)对特定抗原的特异性。
本公开内容提供嵌合抗原受体(CAR),其包含含有单结构域抗体的抗原识别区(VCAR)。在一些实施方案中,单结构域抗体是VHH抗体。在一些实施方案中,单结构域抗体是VH抗体。
本公开内容的嵌合抗原受体可以包含人CD2、CD3δ、CD3ε、CD3γ、CD3ζ、CD4、CD8α、CD19、CD28、4-1BB或GM-CSFR的信号肽。本公开内容的铰链/间隔区结构域可以包含人CD8α、IgG4和/或CD4的铰链/间隔区/茎。本公开内容的细胞内结构域或胞内域可以包含人CD3ζ的细胞内信号传导结构域,并且可以进一步包含人4-1BB、CD28、CD40、ICOS、MyD88、OX-40细胞内区段或其任何组合。示例性的跨膜结构域包括但不限于人CD2、CD3δ、CD3ε、CD3γ、CD3ζ、CD4、CD8α、CD19、CD28、4-1BB或GM-CSFR跨膜结构域。
本公开内容提供了基因修饰细胞,例如T细胞、NK细胞、造血祖细胞、外周血(PB)衍生的T细胞(包括来自G-CSF动员的外周血的T细胞)、脐带血(UCB)衍生的T细胞,通过将本公开内容的VCAR引入这些细胞而使所述细胞对一种或多种抗原具有特异性。可以通过编码本公开内容的VCAR的转座子和包含编码本公开内容的转座酶的序列(优选地,编码本公开内容的转座酶的序列是mRNA序列)的质粒的电转移来修饰本公开内容的细胞。
本公开内容的VH
本公开内容提供了嵌合抗原受体(CAR),其包含单结构域抗体(VCAR)。在一些实施方案中,单结构域抗体包括VH。在一些实施方案中,VH分离或衍生自人序列。在一些实施方案中,VH包含人CDR序列和/或人构架序列和非人或人源化序列(例如大鼠Fc结构域)。在一些实施方案中,VH是完全人源化的VH。在一些实施方案中,VH既不是天然存在的抗体也不是天然存在的抗体的片段。在一些实施方案中,VH不是单克隆抗体的片段。在一些实施方案中,VH是UniDab
在一些实施方案中,使用UniRat
本公开内容的VCAR可以包含至少一个本公开内容的VH。在一些实施方案中,本公开内容的VH可被修饰以去除Fc结构域或其部分。在一些实施方案中,本公开内容的VH的构架序列可以被修饰以例如改善表达、降低免疫原性或改善功能。
本公开内容的示例性VCAR
在本公开内容的VCAR的一些实施方案中,VCAR包含与以下氨基酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的氨基酸序列的至少一种:
VH-A:
在本公开内容的VCAR的一些实施方案中,VCAR的氨基酸序列由包含与以下核苷酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列的核苷酸序列编码:
VH-A:
在本公开内容的VCAR的一些实施方案中,VCAR包含与以下氨基酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的氨基酸序列的至少一种:
VH-B:
在本公开内容的VCAR的一些实施方案中,VCAR的氨基酸序列由包含与以下核苷酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列的核苷酸序列编码:
VH-B:
在本公开内容的VCAR的一些实施方案中,VCAR包含与以下氨基酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的氨基酸序列的至少一种:
VH-C:
在本公开内容的VCAR的一些实施方案中,VCAR的氨基酸序列由包含与VH-C的核苷酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列的核苷酸序列编码:
在本公开内容的VCAR的一些实施方案中,VCAR包含与以下氨基酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的氨基酸序列的至少一种:
VH-D:
在本公开内容的VCAR的一些实施方案中,VCAR的氨基酸序列由包含与以下核苷酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列的核苷酸序列编码:
VH-D
在本公开内容的VCAR的一些实施方案中,VCAR包含与以下氨基酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的氨基酸序列的至少一种:
VH-E:
在本公开内容的VCAR的一些实施方案中,VCAR的氨基酸序列由包含与以下核苷酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列的核苷酸序列编码:
VH-E
在本公开内容的VCAR的一些实施方案中,VCAR包含与以下氨基酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的氨基酸序列的至少一种:
VH-F:
在本公开内容的VCAR的一些实施方案中,VCAR的氨基酸序列由包含与以下核苷酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列的核苷酸序列编码:
VH-F
在本公开内容的VCAR的一些实施方案中,VCAR包含编码VH-A、VH-B、VH-C、VH-D、VH-E或VH-F的序列。在本公开内容的VCAR的一些实施方案中,VCAR包含两个编码VH-A、VH-B、VH-C、VH-D、VH-E或VH-F的序列。
免疫和免疫前体细胞
在某些实施方案中,本公开内容的免疫细胞包括淋巴祖细胞、天然杀伤(NK)细胞、T淋巴细胞(T细胞)、干记忆T细胞(stem memory T cell)(T
在某些实施方案中,免疫前体细胞包括可以分化为一种或多种类型的免疫细胞的任何细胞。在某些实施方案中,免疫前体细胞包括可以自我更新并发育成免疫细胞的多能干细胞。在某些实施方案中,免疫前体细胞包括造血干细胞(HSC)或其后代。在某些实施方案中,免疫前体细胞包括可以发育成免疫细胞的前体细胞。在某些实施方案中,免疫前体细胞包括造血祖细胞(HPC)。
造血干细胞(HSC)是多能的自我更新细胞。来自淋巴和髓系的所有分化的血细胞均产生自HSC。HSC可在成体骨髓、外周血、动员的外周血、腹膜透析流出物和脐带血中找到。
本公开内容的HSC可以分离或衍生自原代或培养的干细胞。本公开内容的HSC可以分离或衍生自胚胎干细胞、多能干细胞、多潜能干细胞、成体干细胞或诱导的多潜能干细胞(iPSC)。
本公开内容的免疫前体细胞可以包括HSC或HSC后代细胞。本公开内容的示例性HSC后代细胞包括但不限于多能干细胞、淋巴祖细胞、天然杀伤(NK)细胞、T淋巴细胞(T细胞)、B淋巴细胞(B细胞)、髓样祖细胞、嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、单核细胞和巨噬细胞。
通过本公开内容的方法产生的HSC可以保持“原始”干细胞的特征,所述“原始”干细胞尽管分离或衍生自成体干细胞并且尽管定型成单系,但共有胚胎干细胞的特征。例如,通过本公开内容的方法产生的“原始”HSC在分裂之后保持其“干性(stemness)”并且不分化。因此,作为过继细胞治疗,通过本公开内容的方法产生的“原始”HSC不仅补充其数目,而且在体内扩增。当作为单剂施用时,通过本公开内容的方法产生的“原始”HSC可以是治疗上有效的。在一些实施方案中,本公开内容的原始HSC是CD34+。在一些实施方案中,本公开内容的原始HSC是CD34+和CD38-。在一些实施方案中,本公开内容的原始HSC是CD34+,CD38-和CD90+。在一些实施方案中,本公开内容的原始HSC是CD34+,CD38-,CD90+和CD45RA-。在一些实施方案中,本公开内容的原始HSC是CD34+,CD38-,CD90+,CD45RA-和CD49f+。在一些实施方案中,本公开内容的最原始HSC是CD34+,CD38-,CD90+,CD45RA-和CD49f+。
在本公开内容的一些实施方案中,可以根据本公开内容的方法修饰原始HSC、HSC和/或HSC后代细胞以表达外源序列(例如,嵌合抗原受体或治疗蛋白)。在本公开内容的一些实施方案中,修饰的原始HSC、修饰的HSC和/或修饰的HSC后代细胞可以前向分化以产生修饰的免疫细胞,包括但不限于,本公开内容的修饰的T细胞、修饰的天然杀伤细胞和/或修饰的B细胞。
本公开内容的修饰的T细胞可以衍生自修饰的造血干祖细胞(hematopoieticstem and progenitor cell)(HSPC)或修饰的HSC。
与传统的生物制剂和化疗剂不同,本公开内容的修饰的T细胞具有在抗原识别时迅速繁殖的能力,从而可能消除重复治疗的需要。为了实现这一点,在一些实施方案中,本公开内容的修饰的T细胞不仅驱动起始应答,而且还作为有生存力的记忆T细胞的稳定群体持续存在于患者中以预防可能的复发。替代地,在一些实施方案中,当不期望时,本公开内容的修饰的T细胞不持续存在于患者中。
已经将加强的努力集中于开发不通过非抗原依赖性(tonic)信号传导导致T细胞耗尽的抗原受体分子,以及含有早期记忆T细胞(尤其是干细胞记忆(T
在本公开内容的方法的一些实施方案中,免疫细胞前体分化成或能够分化成早期记忆T细胞、干细胞样T细胞、幼稚T细胞(T
在本公开内容的方法的一些实施方案中,免疫细胞是早期记忆T细胞、干细胞样T细胞、幼稚T细胞(T
在本公开内容的方法的一些实施方案中,免疫细胞是早期记忆T细胞。
在本公开内容的方法的一些实施方案中,免疫细胞是干细胞样T细胞。
在本公开内容的方法的一些实施方案中,免疫细胞是T
在本公开内容的方法的一些实施方案中,免疫细胞是T
在本公开内容的方法的一些实施方案中,所述方法修饰和/或所述方法产生多个修饰的T细胞,其中所述多个修饰的T细胞的至少2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比表达早期记忆T细胞的一种或多种细胞表面标记。在某些实施方案中,多个修饰的早期记忆T细胞包括至少一个修饰的干细胞样T细胞。在某些实施方案中,多个修饰的早期记忆T细胞包括至少一个修饰的T
在本公开内容的方法的一些实施方案中,所述方法修饰和/或所述方法产生多个修饰的T细胞,其中所述多个修饰的T细胞的至少2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比表达干细胞样T细胞的一种或多种细胞表面标记。在某些实施方案中,多个修饰的干细胞样T细胞包括至少一个修饰的T
在本公开内容的方法的一些实施方案中,所述方法修饰和/或所述方法产生多个修饰的T细胞,其中所述多个修饰的T细胞的至少2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比表达干记忆T细胞(T
在本公开内容的方法的一些实施方案中,所述方法修饰和/或所述方法产生多个修饰的T细胞,其中所述多个修饰的T细胞的至少2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比表达中央记忆T细胞(T
在本公开内容的方法的一些实施方案中,所述方法修饰和/或所述方法产生多个修饰的T细胞,其中所述多个修饰的T细胞的至少2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比表达幼稚T细胞(T
在本公开内容的方法的一些实施方案中,所述方法修饰和/或所述方法产生多个修饰的T细胞,其中所述多个修饰的T细胞的至少2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比表达效应T细胞(修饰的T
在本公开内容的方法的一些实施方案中,所述方法修饰和/或所述方法产生多个修饰的T细胞,其中所述多个修饰的T细胞的至少2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比表达干细胞样T细胞、干记忆T细胞(T
在本公开内容的方法的一些实施方案中,缓冲剂包含免疫细胞或其前体。缓冲剂维持或增强免疫细胞或其前体(包括T细胞)的细胞生存力水平和/或干细胞样表型。在某些实施方案中,在核转染前,缓冲剂维持或增强原代人T细胞的细胞生存力水平和/或干细胞样表型。在某些实施方案中,在核转染期间,缓冲剂维持或增强原代人T细胞的细胞生存力水平和/或干细胞样表型。在某些实施方案中,在核转染后,缓冲剂维持或增强原代人T细胞的细胞生存力水平和/或干细胞样表型。在某些实施方案中,缓冲剂以任何绝对或相对丰度或浓度包含KCl、MgCl
在本公开内容的方法的一些实施方案中,所述方法包括使本公开内容的免疫细胞(包括本公开内容的T细胞)与T细胞扩增组合物接触。在本公开内容的方法的一些实施方案中,将本公开内容的转座子和/或转座酶引入本公开内容的免疫细胞的步骤可以进一步包括使免疫细胞与T细胞扩增组合物接触。在一些实施方案,包括其中方法的引入步骤包括电穿孔或核转染步骤的那些中,可以用本公开内容的与T细胞扩增组合物接触的免疫细胞进行电穿孔或核转染步骤。
在本公开内容的方法的一些实施方案中,T细胞扩增组合物包含磷;辛酸、棕榈酸、亚油酸和油酸中的一种或多种;固醇;和链烷、基本上由其组成或由其组成。
在产生本公开内容的修饰的T细胞的方法的某些实施方案中,扩增补充物包含一种或多种细胞因子。一种或多种细胞因子可包括任何细胞因子,包括但不限于,淋巴因子。示例性的淋巴因子包括,但不限于,白介素-2(IL-2)、白介素-3(IL-3)、白介素-4(IL-4)、白介素-5(IL-5)、白介素-6(IL-6)、白介素-7(IL-7)、白介素-15(IL-15)、白介素-21(IL-21)、粒细胞巨噬细胞集落刺激因子(GM-CSF)和干扰素-γ(INFγ)。一种或多种细胞因子可以包括IL-2。
在本公开内容的方法的一些实施方案中,T细胞扩增组合物包含人血清白蛋白、重组人胰岛素、人转铁蛋白、2-巯基乙醇和扩增补充物。在这个方法的某些实施方案中,T细胞扩增组合物进一步包含辛酸、烟酰胺、2,4,7,9-四甲基-5-癸炔-4,7-二醇(TMDD)、己二酸二异丙酯(DIPA)、正丁基苯磺酰胺、1,2-苯二甲酸、双(2-甲基丙基)酯、棕榈酸、亚油酸、油酸、硬脂酸酰肼、油酰胺、固醇和链烷中的一种或多种。在这个方法的某些实施方案中,T细胞扩增组合物进一步包含辛酸、棕榈酸、亚油酸、油酸和固醇中的一种或多种。在这个方法的某些实施方案中,T细胞扩增组合物进一步包含以下中的一种或多种:浓度为0.9mg/kg-90mg/kg(包括端点)的辛酸;浓度为0.2mg/kg-20mg/kg(包括端点)的棕榈酸;浓度为0.2mg/kg-20mg/kg(包括端点)的亚油酸;浓度为0.2mg/kg-20mg/kg(包括端点)的油酸;和浓度为约0.1mg/kg-10mg/kg(包括端点)的固醇。在这个方法的某些实施方案中,T细胞扩增组合物进一步包含浓度为约9mg/kg的辛酸、浓度为约2mg/kg的棕榈酸、浓度为约2mg/kg的亚油酸、浓度为约2mg/kg的油酸和浓度为约1mg/kg的固醇中的一种或多种。在这个方法的某些实施方案中,T细胞扩增组合物进一步包含以下中的一种或多种:浓度为6.4μmol/kg-640μmol/kg(包括端点)的辛酸;浓度为0.7μmol/kg-70μmol/kg(包括端点)的棕榈酸;浓度为0.75μmol/kg-75μmol/kg(包括端点)的亚油酸;浓度为0.75μmol/kg-75μmol/kg(包括端点)的油酸;和浓度为0.25μmol/kg-25μmol/kg(包括端点)的固醇。在这个方法的某些实施方案中,T细胞扩增组合物进一步包含浓度为约64μmol/kg的辛酸、浓度为约7μmol/kg的棕榈酸、浓度为约7.5μmol/kg的亚油酸、浓度为约7.5μmol/kg的油酸和浓度为约2.5μmol/kg的固醇中的一种或多种。
在某些实施方案中,T细胞扩增组合物包含人血清白蛋白、重组人胰岛素、人转铁蛋白、2-巯基乙醇和扩增补充物中的一种或多种,以产生多个扩增的修饰的T细胞,其中所述多个修饰的T细胞的至少2%表达早期记忆T细胞、干细胞样T细胞、干记忆T细胞(T
如本文所用的,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与37℃的包含人血清白蛋白、重组人胰岛素、人转铁蛋白、2-巯基乙醇和扩增补充物中的一种或多种的培养基互换使用。替代地或额外地,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含磷、辛脂肪酸、棕榈脂肪酸、亚油脂肪酸和油酸中的一种或多种的培养基互换使用。在某些实施方案中,培养基包含的磷的量为可以存在于例如Iscove改良Dulbecco培养基((IMDM);可在ThermoFisher Scientific以目录号12440053获得)中的量的10倍。
如本文所用的,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与37℃的包含人血清白蛋白、重组人胰岛素、人转铁蛋白、2-巯基乙醇、Iscove’s MDM和扩增补充物中的一种或多种的培养基互换使用。替代地或额外地,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含以下元素中的一种或多种的培养基互换使用:硼、钠、镁、磷、钾和钙。在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含以相应的平均浓度存在的以下元素中的一种或多种的培养基互换使用:3.7mg/L的硼、3000mg/L的钠、18mg/L的镁、29mg/L的磷、15mg/L的钾和4mg/L的钙。
如本文所用的,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与37℃的包含人血清白蛋白、重组人胰岛素、人转铁蛋白、2-巯基乙醇和扩增补充物中的一种或多种的培养基互换使用。替代地或额外地,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含以下组分中的一种或多种的培养基互换使用:辛酸(CAS编号124-07-2)、烟酰胺(CAS编号98-92-0)、2,4,7,9-四甲基-5-癸炔-4,7-二醇(TMDD)(CAS编号126-86-3)、己二酸二异丙酯(DIPA)(CAS编号6938-94-9)、正丁基苯磺酰胺(CAS编号3622-84-2)、1,2-苯二甲酸、双(2-甲基丙基)酯(CAS编号84-69-5)、棕榈酸(CAS编号57-10-3)、亚油酸(CAS编号60-33-3)、油酸(CAS编号112-80-1)、硬脂酸酰肼(CAS编号4130-54-5)、油酰胺(CAS编号3322-62-1),固醇(例如,胆固醇)(CAS编号57-88-5)和链烷(例如,十九烷)(CAS编号629-92-5)。在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含以下组分中的一种或多种的培养基互换使用:辛酸(CAS编号124-07-2)、烟酰胺(CAS编号98-92-0)、2,4,7,9-四甲基-5-癸炔-4,7-二醇(TMDD)(CAS编号126-86-3)、己二酸二异丙酯(DIPA)(CAS编号6938-94-9)、正丁基苯磺酰胺(CAS编号3622-84-2)、1,2-苯二甲酸、双(2-甲基丙基)酯(CAS编号84-69-5)、棕榈酸(CAS编号57-10-3)、亚油酸(CAS编号60-33-3)、油酸(CAS编号112-80-1)、硬脂酸酰肼(CAS编号4130-54-5)、油酰胺(CAS编号3322-62-1)、固醇(例如,胆固醇)(CAS编号57-88-5)、链烷(例如,十九烷)(CAS编号629-92-5)和酚红(CAS编号143-74-8)。在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含以下组分中的一种或多种的培养基互换使用:辛酸(CAS编号124-07-2)、烟酰胺(CAS编号98-92-0)、2,4,7,9-四甲基-5-癸炔-4,7-二醇(TMDD)(CAS编号126-86-3)、己二酸二异丙酯(DIPA)(CAS编号6938-94-9)、正丁基苯磺酰胺(CAS编号3622-84-2)、1,2-苯二甲酸、双(2-甲基丙基)酯(CAS编号84-69-5)、棕榈酸(CAS编号57-10-3)、亚油酸(CAS编号60-33-3)、油酸(CAS编号112-80-1)、硬脂酸酰肼(CAS编号4130-54-5)、油酰胺(CAS编号3322-62-1)、酚红(CAS编号143-74-8)和羊毛脂醇。
在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与37℃的包含人血清白蛋白、重组人胰岛素、人转铁蛋白、2-巯基乙醇和扩增补充物中的一种或多种的培养基互换使用。替代地或额外地,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含以下离子中的一种或多种的培养基互换使用:钠、铵、钾、镁、钙、氯离子(chloride)、硫酸根和磷酸根。
如本文所用的,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与37℃的包含人血清白蛋白、重组人胰岛素、人转铁蛋白、2-巯基乙醇和扩增补充物中的一种或多种的培养基互换使用。替代地或额外地,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含以下游离氨基酸中的一种或多种的培养基互换使用:组氨酸、天冬酰胺、丝氨酸、谷氨酸、精氨酸、甘氨酸、天冬氨酸、谷氨酸、苏氨酸、丙氨酸、脯氨酸、半胱氨酸、赖氨酸、酪氨酸、甲硫氨酸、缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸和色氨酸。在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含相应平均摩尔百分比的以下游离氨基酸中的一种或多种的培养基互换使用:组氨酸(约1%)、天冬酰胺(约0.5%)、丝氨酸(约1.5%)、谷氨酰胺(约67%)、精氨酸(约1.5%)、甘氨酸(约1.5%)、天冬氨酸(约1%)、谷氨酸(约2%)、苏氨酸(约2%)、丙氨酸(约1%)、脯氨酸(约1.5%)、半胱氨酸(约1.5%)、赖氨酸(约3%)、酪氨酸(约1.5%)、甲硫氨酸(约1%)、缬氨酸(约3.5%)、异亮氨酸(约3%)、亮氨酸(约3.5%)、苯丙氨酸(约1.5%)和色氨酸(约0.5%)。在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含相应平均摩尔百分比的以下游离氨基酸中的一种或多种的培养基互换使用:组氨酸(约.78%)、天冬酰胺(约0.4%)、丝氨酸(约1.6%)、谷氨酰胺(约67.01%)、精氨酸(约1.67%)、甘氨酸(约1.72%)、天冬氨酸(约1.00%)、谷氨酸(约1.93%)、苏氨酸(约2.38%)、丙氨酸(约1.11%)、脯氨酸(约1.49%)、半胱氨酸(约1.65%)、赖氨酸(约2.84%)、酪氨酸(约1.62%)、甲硫氨酸(约0.85%)、缬氨酸(约3.45%)、异亮氨酸(约3.14%)、亮氨酸(约3.3%)、苯丙氨酸(约1.64%)和色氨酸(约0.37%)。
如本文所用的,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与37℃的包含人血清白蛋白、重组人胰岛素、人转铁蛋白、2-巯基乙醇、Iscove’s MDM和扩增补充物中的一种或多种的培养基互换使用。替代地或额外地,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含磷、辛脂肪酸、棕榈脂肪酸、亚油脂肪酸和油酸中的一种或多种的培养基互换使用。在某些实施方案中,培养基包含的磷的量为可以存在于例如Iscove改良Dulbecco培养基((IMDM);可在ThermoFisher Scientific以目录号12440053获得)中的量的10倍。
在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含辛酸、棕榈酸、亚油酸、油酸和固醇(例如胆固醇)中的一种或多种的培养基互换使用。在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含以下中的一种或多种的培养基互换使用:浓度为0.9mg/kg-90mg/kg(包括端点)的辛酸;浓度为0.2mg/kg-20mg/kg(包括端点)的棕榈酸;浓度为0.2mg/kg-20mg/kg(包括端点)的亚油酸;浓度为0.2mg/kg-20mg/kg(包括端点)的油酸;和浓度为约0.1mg/kg-10mg/kg(包括端点)的固醇(其中mg/kg=百万分率)。在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含浓度为约9mg/kg的辛酸、浓度为约2mg/kg的棕榈酸、浓度为约2mg/kg的亚油酸、浓度为约2mg/kg的油酸和浓度为约1mg/kg的固醇中的一种或多种(其中mg/kg=百万分率)的培养基互换使用。在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含浓度为9.19mg/kg的辛酸、浓度为1.86mg/kg的棕榈酸、浓度为约2.12mg/kg的亚油酸、浓度为约2.13mg/kg的油酸和浓度为约1.01mg/kg的固醇中的一种或多种(其中mg/kg=百万分率)的培养基互换使用。在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含浓度为9.19mg/kg的辛酸、浓度为1.86mg/kg的棕榈酸、浓度为2.12mg/kg的亚油酸、浓度为约2.13mg/kg的油酸和浓度为1.01mg/kg的固醇中的一种或多种(其中mg/kg=百万分率)的培养基互换使用。在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含以下中的一种或多种的培养基互换使用:浓度为6.4μmol/kg-640μmol/kg(包括端点)的辛酸;浓度为0.7μmol/kg-70μmol/kg(包括端点)的棕榈酸;浓度为0.75μmol/kg-75μmol/kg(包括端点)的亚油酸;浓度为0.75μmol/kg-75μmol/kg(包括端点)的油酸;和浓度为0.25μmol/kg-25μmol/kg(包括端点)的固醇。在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含浓度为约64μmol/kg的辛酸、浓度为约7μmol/kg的棕榈酸、浓度为约7.5μmol/kg的亚油酸、浓度为约7.5μmol/kg的油酸和浓度为约2.5μmol/kg的固醇中的一种或多种的培养基互换使用。
在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含浓度为约63.75μmol/kg的辛酸、浓度为约7.27μmol/kg的棕榈酸、浓度为约7.57μmol/kg的亚油酸、浓度为约7.56μmol/kg的油酸和浓度为约2.61μmol/kg的固醇中的一种或多种的培养基互换使用。在某些实施方案中,术语“含补充物的T细胞扩增组合物”或“T细胞扩增组合物”可与包含浓度为约63.75μmol/kg的辛酸、浓度为约7.27μmol/kg的棕榈酸、浓度为约7.57μmol/kg的亚油酸、浓度为7.56μmol/kg的油酸和浓度为2.61μmol/kg的固醇中的一种或多种的培养基互换使用。
在本公开内容的生产修饰的T细胞(例如干细胞样T细胞、T
在本公开内容的生产修饰的T细胞(例如干细胞样T细胞、T
在本公开内容的生产修饰的T细胞(例如干细胞样T细胞、T
在本公开内容的生产修饰的T细胞(例如干细胞样T细胞、TSCM和/或TCM)的方法的某些实施方案中,方法包括使修饰的T细胞与包含组蛋白脱乙酰酶(HDAC)抑制剂的组合物接触。在一些实施方案中,包含HDAC抑制剂的组合物包含丙戊酸(valproic acid)、苯基丁酸钠(NaPB)或其组合或由其组成。在一些实施方案中,包含HDAC抑制剂的组合物包含丙戊酸或由其组成。在一些实施方案中,包含HDAC抑制剂的组合物包含苯基丁酸钠(NaPB)或由其组成。
在本公开内容的生产修饰的T细胞(例如干细胞样T细胞、T
在本公开内容的生产修饰的T细胞(例如干细胞样T细胞、T
在某些实施方案中,本公开内容的修饰的免疫或免疫前体细胞是天然杀伤(NK)细胞。在某些实施方案中,NK细胞是从淋巴祖细胞分化的细胞毒性淋巴细胞。
本公开内容的修饰的NK细胞可以衍生自修饰的造血干祖细胞(HSPC)或修饰的HSC。
在某些实施方案中,非激活的NK细胞衍生自耗尽CD3的白细胞去除术(leukopheresis)(含有CD14/CD19/CD56+细胞)。
在某些实施方案中,使用Lonza 4D核转染仪(nucleofector)或BTX ECM 830(500V,700usec脉冲持续时间,0.2mm电极隙,一个脉冲)电穿孔NK细胞。所有的Lonza 4D核转染仪程序都被考虑在本公开内容的方法范围内。
在某些实施方案中,在杯中于100μL P3缓冲剂中每次电穿孔对5x10E6细胞进行电穿孔。然而,对于商业制造方法,这个每体积的细胞比例是可伸缩的。
在某些实施方案中,通过与另外的细胞系共培养来刺激NK细胞。在某些实施方案中,另外的细胞系包括人工抗原呈递细胞(aAPC)。在某些实施方案中,刺激在电穿孔后的第1、2、3、4、5、6或7天发生。在某些实施方案中,刺激在电穿孔后的第2天发生。
在某些实施方案中,NK细胞表达CD56。
在某些实施方案中,本公开内容的修饰的免疫或免疫前体细胞是B细胞。B细胞是在细胞表面表达B细胞受体的一种类型的淋巴细胞。B细胞受体与特定抗原结合。
本公开内容的修饰的B细胞可以衍生自修饰的造血干祖细胞(HSPC)或修饰的HSC。
在某些实施方案中,使用本公开内容的方法修饰HSPC,且然后将其在人IL-3、Flt3L、TPO、SCF和G-CSF存在下引发用于B细胞分化达至少3天、至少4天、至少5天、至少6天或至少7天。在某些实施方案中,使用本公开内容的方法修饰HSPC,且然后将其在人IL-3、Flt3L、TPO、SCF和G-CSF存在下引发用于B细胞分化达5天。
在某些实施方案中,在引发后,将修饰的HSPC细胞转移至饲养细胞层并每两周饲养一次,以及每周转移至新鲜的饲养层一次。在某些实施方案中,饲养细胞为MS-5饲养细胞。
在某些实施方案中,将修饰的HSPC细胞用MS-5饲养细胞培养至少7、14、21、28、30、33、35、42或48天。在某些实施方案中,将修饰的HSPC细胞用MS-5饲养细胞培养33天。
转座系统
本公开内容的示例性转座子/转座酶系统包括但不限于piggyBac转座子和转座酶、piggyBac样转座子和转座酶、Sleeping Beauty转座子和转座酶、Helraiser转座子和转座酶以及Tol2转座子和转座酶。
piggyBac转座酶识别转座子末端上的转座子特异性反向末端重复序列(ITR),并将ITR之间的内容物移动到TTAA染色体位点中。对于可以包含在ITR之间的关注的基因,piggyBac转座子系统没有有效载荷限制。在某些实施方案中,且,特别地,在其中转座子是piggyBac转座子的那些实施方案中,转座酶是piggyBac或超级piggyBac(SPB)转座酶。在某些实施方案中,且,特别地,在其中转座酶是超级piggyBac(SPB)转座酶的那些实施方案中,编码转座酶的序列是mRNA序列。
在本公开内容的方法的某些实施方案中,转座酶是piggyBac(PB)转座酶。piggyBac(PB)转座酶可包含与以下序列具有至少75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在本公开内容的方法的某些实施方案中,转座酶是piggyBac(PB)转座酶,其包含在以下序列的位置30、165、282或538中的一个或多个处具有氨基酸取代的氨基酸序列或由其组成:
在某些实施方案中,转座酶是piggyBac(PB)转座酶,其包含在SEQ ID NO:14487的序列的位置30、165、282或538的两个或更多个处具有氨基酸取代的氨基酸序列或由其组成。在某些实施方案中,转座酶是piggyBac(PB)转座酶,其包含在SEQ ID NO:14487的序列的位置30、165、282或538的三个或更多个处具有氨基酸取代的氨基酸序列或由其组成。在某些实施方案中,转座酶是piggyBac(PB)转座酶,其包含在SEQ ID NO:14487的序列的下述位置30、165、282和538的每一个处都具有氨基酸取代的氨基酸序列或由其组成。在某些实施方案中,SEQ ID NO:14487的序列的位置30处的氨基酸取代是缬氨酸(V)对异亮氨酸(I)的取代。在某些实施方案中,SEQ ID NO:14487的序列的位置165处的氨基酸取代是丝氨酸(S)对甘氨酸(G)的取代。在某些实施方案中,SEQ ID NO:14487的序列的位置282处的氨基酸取代是缬氨酸(V)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487的序列的位置538处的氨基酸取代是赖氨酸(K)对天冬酰胺(N)的取代。
在本公开内容的方法的某些实施方案中,转座酶是超级piggyBac(SPB)转座酶。在某些实施方案中,本公开内容的超级piggyBac(SPB)转座酶可以包含SEQ ID NO:14487的序列的氨基酸序列或由其组成,其中位置30处的氨基酸取代是缬氨酸(V)对异亮氨酸(I)的取代,位置165处的氨基酸取代是丝氨酸(S)对甘氨酸(G)的取代,位置282处的氨基酸取代是缬氨酸(V)对甲硫氨酸(M)的取代,且位置538处的氨基酸取代是赖氨酸(K)对天冬酰胺(N)的取代。在某些实施方案中,超级piggyBac(SPB)转座酶可以包含与以下序列具有至少75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在本公开内容的方法的某些实施方案,包括其中转座酶包含在位置30、165、282和/或538处的上述突变的那些实施方案中,piggyBac或超级piggyBac转座酶可以进一步包含在SEQ ID NO:14487或SEQ ID NO:14484的序列的位置3、46、82、103、119、125、177、180、185、187、200、207、209、226、235、240、241、243、258、296、298、311、315、319、327、328、340、421、436、456、470、486、503、552、570和591中的一个或多个处的氨基酸取代。在某些实施方案,包括其中转座酶包含在位置30、165、282和/或538处的上述突变的那些实施方案中,piggyBac或超级piggyBac转座酶可以进一步包含在位置46、119、125、177、180、185、187、200、207、209、226、235、240、241、243、296、298、311、315、319、327、328、340、421、436、456、470、485、503、552和570中的一个或多个处的氨基酸取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置3处的氨基酸取代是天冬酰胺(N)对丝氨酸(S)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置46处的氨基酸取代是丝氨酸(S)对丙氨酸(A)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置46处的氨基酸取代是苏氨酸(T)对丙氨酸(A)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置82处的氨基酸取代是色氨酸(W)对异亮氨酸(I)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置103处的氨基酸取代是脯氨酸(P)对丝氨酸(S)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置119处的氨基酸取代是脯氨酸(P)对精氨酸(R)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置125处的氨基酸取代是丙氨酸(A)对半胱氨酸(C)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置125处的氨基酸取代是亮氨酸(L)对半胱氨酸(C)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置177处的氨基酸取代是赖氨酸(K)对酪氨酸(Y)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置177处的氨基酸取代是组氨酸(H)对酪氨酸(Y)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置180处的氨基酸取代是亮氨酸(L)对苯丙氨酸(F)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置180处的氨基酸取代是异亮氨酸(I)对苯丙氨酸(F)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置180处的氨基酸取代是缬氨酸(V)对苯丙氨酸(F)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置185处的氨基酸取代是亮氨酸(L)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置187处的氨基酸取代是甘氨酸(G)对丙氨酸(A)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置200处的氨基酸取代是色氨酸(W)对苯丙氨酸(F)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置207处的氨基酸取代是脯氨酸(P)对缬氨酸(V)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置209处的氨基酸取代是苯丙氨酸(F)对缬氨酸(V)的取代。在某些实施方案中,SEQ IDNO:14487或SEQ ID NO:14484的位置226处的氨基酸取代是苯丙氨酸(F)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置235处的氨基酸取代是精氨酸(R)对亮氨酸(L)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置240处的氨基酸取代是赖氨酸(K)对缬氨酸(V)的取代。在某些实施方案中,SEQID NO:14487或SEQ ID NO:14484的位置241处的氨基酸取代是亮氨酸(L)对苯丙氨酸(F)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置243处的氨基酸取代是赖氨酸(K)对脯氨酸(P)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置258处的氨基酸取代是丝氨酸(S)对天冬酰胺(N)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置296处的氨基酸取代是色氨酸(W)对亮氨酸(L)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置296处的氨基酸取代是酪氨酸(Y)对亮氨酸(L)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置296处的氨基酸取代是苯丙氨酸(F)对亮氨酸(L)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置298处的氨基酸取代是亮氨酸(L)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置298处的氨基酸取代是丙氨酸(A)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置298处的氨基酸取代是缬氨酸(V)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置311处的氨基酸取代是异亮氨酸(I)对脯氨酸(P)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置311处的氨基酸取代是缬氨酸对脯氨酸(P)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置315处的氨基酸取代是赖氨酸(K)对精氨酸(R)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置319处的氨基酸取代是甘氨酸(G)对苏氨酸(T)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置327处的氨基酸取代是精氨酸(R)对酪氨酸(Y)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置328处的氨基酸取代是缬氨酸(V)对酪氨酸(Y)的取代。在某些实施方案中,SEQID NO:14487或SEQ ID NO:14484的位置340处的氨基酸取代是甘氨酸(G)对半胱氨酸(C)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置340处的氨基酸取代是亮氨酸(L)对半胱氨酸(C)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置421处的氨基酸取代是组氨酸(H)对天冬氨酸(D)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置436处的氨基酸取代是异亮氨酸(I)对缬氨酸(V)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置456处的氨基酸取代是酪氨酸(Y)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置470处的氨基酸取代是苯丙氨酸(F)对亮氨酸(L)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置485处的氨基酸取代是赖氨酸(K)对丝氨酸(S)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置503处的氨基酸取代是亮氨酸(L)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置503处的氨基酸取代是异亮氨酸(I)对(M)甲硫氨酸的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置552处的氨基酸取代是赖氨酸(K)对缬氨酸(V)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置570处的氨基酸取代是苏氨酸(T)对丙氨酸(A)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置591处的氨基酸取代是脯氨酸(P)对谷氨酰胺(Q)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置591处的氨基酸取代是精氨酸(R)对谷氨酰胺(Q)的取代。
在本公开内容的方法的某些实施方案,包括其中转座酶包含在位置30、165、282和/或538处的上述突变的那些实施方案中,piggyBac转座酶可以包含或超级piggyBac转座酶可以进一步包含在SEQ ID NO:14487或SEQ ID NO:14484的序列的位置103、194、372、375、450、509和570中的一个或多个处的氨基酸取代。在本公开内容的方法的某些实施方案,包括其中转座酶包含在位置30、165、282和/或538处的上述突变的那些实施方案中,piggyBac转座酶可以包含或超级piggyBac转座酶可以进一步包含在SEQ ID NO:14487或SEQ ID NO:14484的序列的位置103、194、372、375、450、509和570中的两个、三个、四个、五个、六个或更多个处的氨基酸取代。在某些实施方案,包括其中转座酶包含在位置30、165、282和/或538处的上述突变的那些实施方案中,piggyBac转座酶可以包含或超级piggyBac转座酶可以进一步包含在SEQ ID NO:14487或SEQ ID NO:14484的序列的位置103、194、372、375、450、509和570处的氨基酸取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置103处的氨基酸取代是脯氨酸(P)对丝氨酸(S)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置194处的氨基酸取代是缬氨酸(V)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置372处的氨基酸取代是丙氨酸(A)对精氨酸(R)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置375处的氨基酸取代是丙氨酸(A)对赖氨酸(K)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置450处的氨基酸取代是天冬酰胺(N)对天冬氨酸(D)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置509处的氨基酸取代是甘氨酸(G)对丝氨酸(S)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置570处的氨基酸取代是丝氨酸(S)对天冬酰胺(N)的取代。在某些实施方案中,piggyBac转座酶可包含在SEQ ID NO:14487的位置194处的缬氨酸(V)对甲硫氨酸(M)的取代。在某些实施方案,包括其中piggyBac转座酶可包含在SEQ ID NO:14487的位置194处的缬氨酸(V)对甲硫氨酸(M)的取代的那些实施方案中,piggyBac转座酶可以进一步包含在SEQ ID NO:14487或SEQ ID NO:14484的序列的位置372、375和450处的氨基酸取代。在某些实施方案中,piggyBac转座酶可包含在SEQ ID NO:14487的位置194处的缬氨酸(V)对甲硫氨酸(M)的取代、在SEQ ID NO:14487的位置372处的丙氨酸(A)对精氨酸(R)的取代和在SEQID NO:14487的位置375处的丙氨酸(A)对赖氨酸(K)的取代。在某些实施方案中,piggyBac转座酶可包含在SEQ ID NO:14487的位置194处的缬氨酸(V)对甲硫氨酸(M)的取代、在SEQID NO:14487的位置372处的丙氨酸(A)对精氨酸(R)的取代、在SEQ ID NO:14487的位置375处的丙氨酸(A)对赖氨酸(K)的取代和在SEQ ID NO:14487的位置450处的天冬酰胺(N)对天冬氨酸(D)的取代。
sleeping beauty转座子通过识别ITR并将ITR之间的内容物移动到TA染色体位点中的Sleeping Beauty转座酶转座到靶基因组中。在各种实施方案中,SB转座子介导的基因转移或使用许多类似的转座子中的任何一种的基因转移可用于本公开内容的组合物和方法中。
在某些实施方案中,且,特别地,在其中转座子是Sleeping Beauty转座子的那些实施方案中,转座酶是Sleeping Beauty转座酶或高活性的Sleeping Beauty转座酶(SB100X)。
在本公开内容的方法的某些实施方案中,Sleeping Beauty转座酶包含与以下序列具有至少75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列:
在本公开内容的方法的某些实施方案中,高活性的Sleeping Beauty(SB100X)转座酶包含与以下序列具有至少75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列:
Helraiser转座子由Helitron转座酶转座。Helitron转座酶转移Helraiser转座子,即,一种在约3000至3600万年前活跃的来自蝙蝠基因组中的古老元件。本公开内容的示例性Helraiser转座子包括Helibat1,其包含含有以下序列的核酸序列:
与其它转座酶不同,Helitron转座酶不含有RNA酶-H样催化结构域,而是包含由复制起始子结构域(Rep)和DNA解旋酶结构域组成的RepHel基序。Rep结构域是HUH核酸酶超家族的核酸酶结构域。
本公开内容的示例性Helitron转座酶包含含有以下序列的氨基酸序列:
在Helitron转座中,靠近转座子3′端的发夹起终止子的作用。然而,这个发夹可被转座酶绕过,导致侧翼序列的转导。此外,Helraiser转座生成了共价闭合环状中间体。此外,Helitron转座可缺乏靶位点重复。在Helraiser序列中,转座酶的侧翼是称为LTS(5’末端序列)和RTS(3’末端序列)的左和右末端序列。这些序列以保守的5′-TC/CTAG-3′基序终止。具有形成发夹终止结构的可能性的19bp回文序列位于RTS上游11个核苷酸处,且由序列GTGCACGAATTTCGTGCACCGGGCCACTAG(SEQ ID NO:14500)组成。
Tol2转座子可以分离或衍生自青鳉鱼的基因组,并且可以类似于hAT家族的转座子。本公开内容的示例性Tol2转座子由包含约4.7千碱基的序列编码,并含有编码Tol2转座酶的基因,其含有四个外显子。本公开内容的示例性Tol2转座酶包含含有以下序列的氨酸序列:
本公开内容的示例性Tol2转座子,包括反向重复序列、亚端序列和Tol2转座酶,由包含以下序列的核酸序列编码:
本公开内容的示例性转座子/转座酶系统包括但不限于piggyBac和piggyBac样转座子和转座酶。
PiggyBac和piggyBac样转座酶识别转座子末端上的转座子特异性反向末端重复序列(ITR),并将ITR之间的内容物移动到TTAA或TTAT染色体位点中。对于可以包含在ITR之间的关注的基因,piggyBac或piggyBac样转座子系统没有有效载荷限制。
在某些实施方案中,且,特别地,在其中转座子是piggyBac转座子的那些实施方案中,转座酶是piggyBac、超级piggyBac(SPB)转座酶。在某些实施方案中,且,特别地,在其中转座酶是piggyBac、超级piggyBac(SPB)的那些实施方案中,编码转座酶的序列是mRNA序列。
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。piggyBac(PB)或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶,其包含在以下序列的位置30、165、282或538中的一个或多个处具有氨基酸取代的氨基酸序列或由其组成:
在某些实施方案中,转座酶是piggyBac或piggyBac样转座酶,其包含在SEQ IDNO:14487的序列的位置30、165、282或538的两个或更多个处具有氨基酸取代的氨基酸序列或由其组成。在某些实施方案中,转座酶是piggyBac或piggyBac样转座酶,其包含在SEQ IDNO:14487的序列的位置30、165、282或538的三个或更多个处具有氨基酸取代的氨基酸序列或由其组成。在某些实施方案中,转座酶是piggyBac或piggyBac样转座酶,其包含在SEQ IDNO:14487的序列的下述位置30、165、282和538的每一个处都具有氨基酸取代的氨基酸序列或由其组成。在某些实施方案中,SEQ ID NO:14487的序列的位置30处的氨基酸取代是缬氨酸(V)对异亮氨酸(I)的取代。在某些实施方案中,SEQ ID NO:14487的序列的位置165处的氨基酸取代是丝氨酸(S)对甘氨酸(G)的取代。在某些实施方案中,SEQ ID NO:14487的序列的位置282处的氨基酸取代是缬氨酸(V)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ IDNO:14487的序列的位置538处的氨基酸取代是赖氨酸(K)对天冬酰胺(N)的取代。
在本公开内容的方法的某些实施方案中,转座酶是超级piggyBac(SPB)或piggyBac样转座酶。在某些实施方案中,本公开内容的超级piggyBac(SPB)或piggyBac样转座酶可以包含SEQ ID NO:14487的序列的氨基酸序列或由其组成,其中位置30处的氨基酸取代是缬氨酸(V)对异亮氨酸(I)的取代,位置165处的氨基酸取代是丝氨酸(S)对甘氨酸(G)的取代,位置282处的氨基酸取代是缬氨酸(V)对甲硫氨酸(M)的取代,且位置538处的氨基酸取代是赖氨酸(K)对天冬酰胺(N)的取代。在某些实施方案中,超级piggyBac(SPB)或piggyBac样转座酶可以包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在本公开内容的方法的某些实施方案,包括其中转座酶包含在位置30、165、282和/或538处的上述突变的那些实施方案中,piggyBac、超级piggyBac或piggyBac样转座酶可以进一步包含在SEQ ID NO:14487或SEQ ID NO:14484的序列的位置3、46、82、103、119、125、177、180、185、187、200、207、209、226、235、240、241、243、258、296、298、311、315、319、327、328、340、421、436、456、470、486、503、552、570和591中的一个或多个处的氨基酸取代。在某些实施方案,包括其中转座酶包含在位置30、165、282和/或538处的上述突变的那些实施方案中,piggyBac、超级piggyBac或piggyBac样转座酶可以进一步包含在位置46、119、125、177、180、185、187、200、207、209、226、235、240、241、243、296、298、311、315、319、327、328、340、421、436、456、470、485、503、552和570中的一个或多个处的氨基酸取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置3处的氨基酸取代是天冬酰胺(N)对丝氨酸(S)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置46处的氨基酸取代是丝氨酸(S)对丙氨酸(A)的取代。在某些实施方案中,SEQ ID NO:14487或SEQID NO:14484的位置46处的氨基酸取代是苏氨酸(T)对丙氨酸(A)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置82处的氨基酸取代是色氨酸(W)对异亮氨酸(I)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置103处的氨基酸取代是脯氨酸(P)对丝氨酸(S)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置119处的氨基酸取代是脯氨酸(P)对精氨酸(R)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置125处的氨基酸取代是丙氨酸(A)对半胱氨酸(C)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置125处的氨基酸取代是亮氨酸(L)对半胱氨酸(C)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置177处的氨基酸取代是赖氨酸(K)对酪氨酸(Y)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置177处的氨基酸取代是组氨酸(H)对酪氨酸(Y)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置180处的氨基酸取代是亮氨酸(L)对苯丙氨酸(F)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置180处的氨基酸取代是异亮氨酸(I)对苯丙氨酸(F)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置180处的氨基酸取代是缬氨酸(V)对苯丙氨酸(F)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置185处的氨基酸取代是亮氨酸(L)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQID NO:14484的位置187处的氨基酸取代是甘氨酸(G)对丙氨酸(A)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置200处的氨基酸取代是色氨酸(W)对苯丙氨酸(F)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置207处的氨基酸取代是脯氨酸(P)对缬氨酸(V)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置209处的氨基酸取代是苯丙氨酸(F)对缬氨酸(V)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置226处的氨基酸取代是苯丙氨酸(F)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置235处的氨基酸取代是精氨酸(R)对亮氨酸(L)的取代。在某些实施方案中,SEQ ID NO:14487或SEQID NO:14484的位置240处的氨基酸取代是赖氨酸(K)对缬氨酸(V)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置241处的氨基酸取代是亮氨酸(L)对苯丙氨酸(F)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置243处的氨基酸取代是赖氨酸(K)对脯氨酸(P)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置258处的氨基酸取代是丝氨酸(S)对天冬酰胺(N)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置296处的氨基酸取代是色氨酸(W)对亮氨酸(L)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置296处的氨基酸取代是酪氨酸(Y)对亮氨酸(L)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置296处的氨基酸取代是苯丙氨酸(F)对亮氨酸(L)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置298处的氨基酸取代是亮氨酸(L)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置298处的氨基酸取代是丙氨酸(A)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQID NO:14484的位置298处的氨基酸取代是缬氨酸(V)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置311处的氨基酸取代是异亮氨酸(I)对脯氨酸(P)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置311处的氨基酸取代是缬氨酸对脯氨酸(P)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置315处的氨基酸取代是赖氨酸(K)对精氨酸(R)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置319处的氨基酸取代是甘氨酸(G)对苏氨酸(T)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置327处的氨基酸取代是精氨酸(R)对酪氨酸(Y)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置328处的氨基酸取代是缬氨酸(V)对酪氨酸(Y)的取代。在某些实施方案中,SEQID NO:14487或SEQ ID NO:14484的位置340处的氨基酸取代是甘氨酸(G)对半胱氨酸(C)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置340处的氨基酸取代是亮氨酸(L)对半胱氨酸(C)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置421处的氨基酸取代是组氨酸(H)对天冬氨酸(D)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置436处的氨基酸取代是异亮氨酸(I)对缬氨酸(V)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置456处的氨基酸取代是酪氨酸(Y)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置470处的氨基酸取代是苯丙氨酸(F)对亮氨酸(L)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置485处的氨基酸取代是赖氨酸(K)对丝氨酸(S)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置503处的氨基酸取代是亮氨酸(L)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置503处的氨基酸取代是异亮氨酸(I)对(M)甲硫氨酸的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置552处的氨基酸取代是赖氨酸(K)对缬氨酸(V)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置570处的氨基酸取代是苏氨酸(T)对丙氨酸(A)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ IDNO:14484的位置591处的氨基酸取代是脯氨酸(P)对谷氨酰胺(Q)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置591处的氨基酸取代是精氨酸(R)对谷氨酰胺(Q)的取代。
在本公开内容的方法的某些实施方案,包括其中转座酶包含在位置30、165、282和/或538处的上述突变的那些实施方案中,piggyBac或piggyBac样转座酶或可以包含或超级piggyBac转座酶可以进一步包含在SEQ ID NO:14487或SEQ ID NO:14484的序列的位置103、194、372、375、450、509和570中的一个或多个处的氨基酸取代。在本公开内容的方法的某些实施方案,包括其中转座酶包含在位置30、165、282和/或538处的上述突变的那些实施方案中,piggyBac或piggyBac样转座酶可以包含或超级piggyBac转座酶可以进一步包含在SEQ ID NO:14487或SEQ ID NO:14484的序列的位置103、194、372、375、450、509和570中的两个、三个、四个、五个、六个或更多个处的氨基酸取代。在某些实施方案,包括其中转座酶包含在位置30、165、282和/或538处的上述突变的那些实施方案中,piggyBac或piggyBac样转座酶可以包含或超级piggyBac转座酶可以进一步包含在SEQ ID NO:14487或SEQ ID NO:14484的序列的位置103、194、372、375、450、509和570处的氨基酸取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置103处的氨基酸取代是脯氨酸(P)对丝氨酸(S)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置194处的氨基酸取代是缬氨酸(V)对甲硫氨酸(M)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置372处的氨基酸取代是丙氨酸(A)对精氨酸(R)的取代。在某些实施方案中,SEQID NO:14487或SEQ ID NO:14484的位置375处的氨基酸取代是丙氨酸(A)对赖氨酸(K)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置450处的氨基酸取代是天冬酰胺(N)对天冬氨酸(D)的取代。在某些实施方案中,SEQ ID NO:14487或SEQ ID NO:14484的位置509处的氨基酸取代是甘氨酸(G)对丝氨酸(S)的取代。在某些实施方案中,SEQID NO:14487或SEQ ID NO:14484的位置570处的氨基酸取代是丝氨酸(S)对天冬酰胺(N)的取代。在某些实施方案中,piggyBac或piggyBac样转座酶可包含在SEQ ID NO:14487的位置194处的缬氨酸(V)对甲硫氨酸(M)的取代。在某些实施方案,包括其中piggyBac或piggyBac样转座酶可包含在SEQ ID NO:14487的位置194处的缬氨酸(V)对甲硫氨酸(M)的取代的那些实施方案中,piggyBac或piggyBac样转座酶可以进一步包含在SEQ ID NO:14487或SEQID NO:14484的序列的位置372、375和450处的氨基酸取代。在某些实施方案中,piggyBac或piggyBac样转座酶可包含在SEQ ID NO:14487的位置194处的缬氨酸(V)对甲硫氨酸(M)的取代、在SEQ ID NO:14487的位置372处的丙氨酸(A)对精氨酸(R)的取代和在SEQ ID NO:14487的位置375处的丙氨酸(A)对赖氨酸(K)的取代。在某些实施方案中,piggyBac或piggyBac样转座酶可包含在SEQ ID NO:14487的位置194处的缬氨酸(V)对甲硫氨酸(M)的取代、在SEQ ID NO:14487的位置372处的丙氨酸(A)对精氨酸(R)的取代、在SEQ ID NO:14487的位置375处的丙氨酸(A)对赖氨酸(K)的取代和在SEQ ID NO:14487的位置450处的天冬酰胺(N)对天冬氨酸(D)的取代。
在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自昆虫。在某些实施方案中,所述昆虫是粉纹夜蛾(Trichoplusia ni)(GenBank检索号AAA87375;SEQ ID NO:16796)、黑点银纹夜蛾(Argyrogramma agnata)(GenBank检索号GU477713;SEQ ID NO:14534,SEQ ID NO:16797)、冈比亚按蚊(Anopheles gambiae)(GenBank检索号XP_312615(SEQ ID NO:16798);GenBank检索号XP_320414(SEQ ID NO:16799);GenBank检索号XP_310729(SEQ ID NO:16800))、棉蚜(Aphis gossypii)(GenBank检索号GU329918;SEQ IDNO:16801,SEQ ID NO:16802)、豌豆蚜(Acyrthosiphon pisum)(GenBank检索号XP_001948139;SEQ ID NO:16803)、小地老虎(Agrotis ipsilon)(GenBank检索号GU477714;SEQ ID NO:14537,SEQ ID NO:16804)、家蚕(Bombyx mori)(GenBank检索号BAD11135;SEQID NO:14505)、二化螟(Chilos uppressalis)(GenBank检索号JX294476;SEQ ID NO:16805,SEQ ID NO:16806)、黑尾果蝇(Drosophila melanogaster)(GenBank检索号AAL39784;SEQ ID NO:16807)、棉铃虫(Helicoverpa armigera)(GenBank检索号ABS18391;SEQ ID NO:14525)、烟芽夜蛾(Heliothis virescens)(GenBank检索号ABD76335;SEQ IDNO:16808)、银锭夜蛾(Macdunnoughia crassisigna)(GenBank检索号EU287451;SEQ IDNO:16809,SEQ ID NO:16810)、棉红铃虫(Pectinophora gossypiella)(GenBank检索号GU270322;SEQ ID NO:14530,SEQ ID NO:16811)、赤拟谷盗(Tribolium castaneum)(GenBank检索号XP_001814566;SEQ ID NO:16812)、银纹夜蛾(Ctenoplusia agnata)(也称为黑点银纹夜蛾)、Messour bouvieri、苜蓿切叶蜂(Megachile rotundata)、美洲东部熊蜂(Bombus impatiens)、甘蓝夜蛾(Mamestra brassicae)、小麦瘿蚊(Mayetioladestructor)或意大利蜜蜂(Apis mellifera)。
在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自昆虫。在某些实施方案中,昆虫是粉纹夜蛾(AAA87375)。
在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自昆虫。在某些实施方案中,昆虫是家蚕(BAD11135)。
在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自甲壳动物。在某些实施方案中,甲壳动物是多蚤溞(Daphnia pulicaria)(AAM76342,SEQ ID NO:16813)。
在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自脊椎动物。在某些实施方案中,脊椎动物是热带爪蟾(Xenopus tropicalis)(GenBank检索号BAF82026;SEQID NO:14518)、智人(Homo sapiens)(GenBank检索号NP_689808;SEQ ID NO:16814)、小鼠(Mus musculus)(GenBank检索号NP_741958;SEQ ID NO:16815)、食蟹猕猴(Macacafascicularis)(GenBank检索号AB179012;SEQ ID NO:16816,SEQ ID NO:16817)、大鼠(Rattus norvegicus)(GenBank检索号XP_220453;SEQ ID NO:16818)或小棕蝠(Myotislucifugus)。
在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自尾索动物。在某些实施方案中,尾索动物是玻璃海鞘(Ciona intestinalis)(GenBank检索号XP_002123602;SEQ ID NO:16819)。
在某些实施方案中,piggyBac或piggyBac样转座酶在染色体位点内的序列5’-TTAT-3’(TTAT靶序列)处插入转座子。
在某些实施方案中,piggyBac或piggyBac样转座酶在染色体位点内的序列5’-TTAA-3’(TTAA靶序列)处插入转座子。
在某些实施方案中,piggyBac或piggyBac样转座子的靶序列包含5’-CTAA-3’、5’-TTAG-3’、5’-ATAA-3’、5’-TCAA-3’、5’AGTT-3’、5’-ATTA-3’、5’-GTTA-3’、5’-TTGA-3’、5’-TTTA-3’、5’-TTAC-3’、5’-ACTA-3’、5’-AGGG-3’、5’-CTAG-3’、5’-TGAA--3’、5’-AGGT-3’、5’-ATCA-3’、5’-CTCC-3’、5’-TAAA-3’、5’-TCTC-3’、5’TGAA-3’、5’-AAAT-3’、5’-AATC-3’、5’-ACAA-3’、5’-ACAT-3’、5’-ACTC-3’、5’-AGTG-3’、5’-ATAG-3’、5’-CAAA-3’、5’-CACA-3’、5’-CATA-3’、5’-CCAG-3’、5’-CCCA-3’、5’-CGTA-3’、5’-GTCC-3’、5’-TAAG-3’、5’-TCTA-3’、5’-TGAG-3’、5’-TGTT-3’、5’-TTCA-3’5’-TTCT-3’和5’-TTTT-3’或由其组成。
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自家蚕。所述piggyBac或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
所述piggyBac(PB)或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座酶与核定位信号融合。在某些实施方案中,与核定位信号融合的piggyBac或piggyBac样转座酶的氨基酸序列由包含以下序列的多核苷酸序列编码:
在某些实施方案中,piggyBac或piggyBac样转座酶是高活性的。高活性的piggyBac或piggyBac样转座酶是一种比其所衍生自的天然存在的变体活性更高的转座酶。在某些实施方案中,高活性的piggyBac或piggyBac样转座酶分离或衍生自家蚕。在某些实施方案中,piggyBac或piggyBac样转座酶是SEQ ID NO:14505的高活性变体。在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含与以下序列具有至少90%同一性的序列:
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含SEQ ID NO:14576。在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶比SEQ ID NO:14505的转座酶活性更高。在某些实施方案中,高活性的piggyBac或piggyBac样转座酶与SEQ IDNO:14505具有至少90%、至少95%、至少96%、至少97%、至少98%或至少99%或其间任何百分比的同一性。
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含在选自92、93、96、97、165、178、189、196、200、201、211、215、235、238、246、253、258、261、263、271、303、321、324、330、373、389、399、402、403、404、448、473、484、507、523、527、528、543、549、550、557、601、605、607、609、610或其组合的位置处的氨基酸取代(相对于SEQ ID NO:14505)。在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含Q92A、V93L、V93M、P96G、F97H、F97C、H165E、H165W、E178S、E178H、C189P、A196G、L200I、A201Q、L211A、W215Y、G219S、Q235Y、Q235G、Q238L、K246I、K253V、M258V、F261L、S263K、C271S、N303R、F321W、F321D、V324K、V324H、A330V、L373C、L373V、V389L、S399N、R402K、T403L、D404Q、D404S、D404M、N441R、G448W、E449A、V469T、C473Q、R484K T507C、G523A、I527M、Y528K Y543I、E549A、K550M、P557S、E601V、E605H、E605W、D607H、S609H、L610I或其任何组合的氨基酸取代。在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含Q92A、V93L、V93M、P96G、F97H、F97C、H165E、H165W、E178S、E178H、C189P、A196G、L200I、A201Q、L211A、W215Y、G219S、Q235Y、Q235G、Q238L、K246I、K253V、M258V、F261L、S263K、C271S、N303R、F321W、F321D、V324K、V324H、A330V、L373C、L373V、V389L、S399N、R402K、T403L、D404Q、D404S、D404M、N441R、G448W、E449A、V469T、C473Q、R484K T507C、G523A、I527M、Y528K Y543I、E549A、K550M、P557S、E601V、E605H、E605W、D607H、S609H和L610I的氨基酸取代。
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含非野生型的氨基酸的一个或多个取代,其中对野生型氨基酸的一个或多个取代包括E4X、A12X、M13X、L14X、E15X、D20X、E24X、S25X、S26X、S27X、D32X、H33X、E36X、E44X、E45X、E46X、I48X、D49X、R58X、A62X、N63X、A64X、I65X、I66X、N68X、E69X、D71X、S72X、D76X、P79X、R84X、Q85X、A87X、S88X、Q92X、V93X、S94X、G95X、P96X、F97X、Y98X、T99X、I145X、S149X、D150X、L152X、E154X、T157X、N160X、S161X、S162X、H165X、R166X、T168X、K169X、T170X、A171X、E173X、S175X、S176X、E178X、T179X、M183X、Q184X、T186X、T187X、L188X、C189X、L194X、I195X、A196X、L198X、L200X、A201X、L203X、I204X、K205X、A206X、N207X、Q209X、S210X、L211X、K212X、D213X、L214X、W215X、R216X、T217X、G219X、V222X、D223X、I224X、T227X、M229X、Q235X、L237X、Q238X、N239X、N240X、P302X、N303X、P305X、A306X、K307X、Y308X、I310X、K311X、I312X、L313X、A314X、L315X、V316X、D317X、A318X、K319X、N320X、F321X、Y322X、V323X、V324X、L326X、E327X、V328X、A330X、Q333X、P334X、S335X、G336X、P337X、A339X、V340X、S341X、N342X、R343X、P344X、F345X、E346X、V347X、E349X、I352X、Q353X、V355X、A356X、R357X、N361X、D365X、W367X、T369X、G370X、L373X、M374X、L375X、H376X、N379X、E380X、R382X、V386X、V389X、N392X、R394X、Q395X、S399X、F400X、I401X、R402XT403X、D404X、R405X、Q406X、P407X、N408X、S409X、S410X、V411X、F412X、F414X、Q415X、I418X、T419X、L420X、N428XV432X、M434X、D440X、N441X、S442X、I443X、D444X、E445X、G448X、E449X、Q451X、K452X、M455X、I456X、T457X、F458X、S461X、A464X、V466X、Q468X、V469X、E471X、L472X、C473X、A474X、K483X、W485X、T488X、L489X、Y491X、G492X、V493X、M496X、I499X、C502X、I503X、T507X、K509X、N510X、V511X、T512X、I513X、R515X、E517X、S521X、G523X、L524X、S525X、I527X、Y528X、E529X、H532X、S533X、N535X、K536X、K537X、N539X、I540X、T542X、Y543X、Q546X、E549X、K550X、Q551X、G553X、E554X、P555X、S556X、P557X、R558X、H559X、V560X、N561X、V562X、P563X、G564X、R565X、Y566X、V567X、Q570X、D571X、P573X、Y574X、K576X、K581X、S583X、A586X、A588X、E594X、F598X、L599X、E601X、N602X、C603X、A604X、E605X、L606X、D607X、S608X、S609X或L610X的取代(相对于SEQ ID NO:14505)。可以在美国专利号10,041,077中找到高活性氨基酸取代的列表,所述专利的内容通过全文引用并入本文。
在某些实施方案中,piggyBac或piggyBac样转座酶是整合缺陷的。在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶是可以切除其相应转座子,但以比相应的野生型转座酶更低的频率整合被切除的转座子的转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶是SEQ ID NO:14505的整合缺陷变体。
在某些实施方案中,有切除能力的、整合缺陷的piggyBac或piggyBac样转座酶包含非野生型的氨基酸的一个或多个取代,其中对野生型氨基酸的一个或多个取代包括R9X、A12X、M13X、D20X、Y21K、D23X、E24X、S25X、S26X、S27X、E28X、E30X、D32X、H33X、E36X、H37X、A39X、Y41X、D42X、T43X、E44X、E45X、E46X、R47X、D49X、S50X、S55X、A62X、N63X、A64X、I66X、A67X、N68X、E69X、D70X、D71X、S72X、D73X、P74X、D75X、D76X、D77X、I78X、S81X、V83X、R84X、Q85X、A87X、S88X、A89X、S90X、R91X、Q92X、V93X、S94X、G95X、P96X、F97X、Y98X、T99X、W012X、G103X、Y107X、K108X、L117X、I122X、Q128X、I312X、D135X、S137X、E139X、Y140X、I145X、S149X、D150X、Q153X、E154X、T157X、S161X、S162X、R164X、H165X、R166X、Q167X、T168X、K169X、T170X、A171X、A172X、E173X、R174X、S175X、S176X、A177X、E178X、T179X、S180X、Y182X、Q184X、E185X、T187X、L188X、C189X、L194X、I195X、A196X、L198X、L200X、A201X、L203X、I204X、K205X、N207X、Q209X、L211X、D213X、L214X、W215X、R216X、T217X、G219X、T220X、V222X、D223X、I224X、T227X、T228X、F234X、Q235X、L237X、Q238X、N239X、N240X、N303X、K304X、I310X、I312X、L313X、A314X、L315X、V316X、D317X、A318X、K319X、N320X、F321X、Y322X、V323X、V324X、N325X、L326X、E327X、V328X、A330X、G331X、K332X、Q333X、S335X、P337X、P344X、F345X、E349X、H359X、N361X、V362X、D365X、F368X、Y371X、E372X、L373X、H376X、E380X、R382X、R382X、V386X、G387X、T388X、V389X、K391X、N392X、R394X、Q395X、E398X、S399X、F400X、I401X、R402XT403X、D404X、R405X、Q406X、P407X、N408X、S409X、S410X、Q415X、K416X、A424X、K426X、N428X、V430X、V432X、V433X、M434X、D436X、D440X、N441X、S442X、I443X、D444X、E445X、S446X、T447X、G448X、E449X、K450X、Q451X、E454X、M455X、I456X、T457X、F458X、S461X、A464X、V466X、Q468X、V469X、C473X、A474X、N475X、N477X、K483X、R484X、P486X、T488X、L489X、G492X、V493X、M496X、I499X、I503X、Y505X、T507X、N510X、V511X、T512X、I513X、K514X、T516X、E517X、S521X、G523X、L524X、S525X、I527X、Y528X、L531X、H532X、S533X、N535X、I540X、T542X、Y543X、R545X、Q546X、E549X、L552X、G553X、E554X、P555X、S556X、P557X、R558X、H559X、V560X、N561X、V562X、P563X、G564X、V567X、Q570X、D571X、P573X、Y574X、K575X、K576X、N585X、A586X、M593X、K596X、E601X、N602X、A604X、E605X、L606X、D607X、S608X、S609X或L610X的取代(相对于SEQ ID NO:14505)。可以在美国专利号10,041,077中找到整合缺陷的氨基酸取代的列表,所述专利的内容通过全文引用并入本文。
在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,整合缺陷的转座酶包含与SEQ ID NO:14608具有至少90%同一性的序列。
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自家蚕。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含对应于SEQ ID NO:14506的5′序列和对应于SEQ ID NO:14507的3′序列。在某些实施方案中,一个piggyBac或piggyBac样转座子末端与SEQ ID NO:14506具有至少85%、至少90%、至少95%、至少98%、至少99%同一性或其间任何百分比的同一性,且另一个piggyBac或piggyBac样转座子末端与SEQ ID NO:14507具有至少85%、至少90%、至少95%、至少98%、至少99%或其间任何百分比的同一性。在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14506和SEQ ID NO:14507或SEQ ID NO:14509。在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14508和SEQ ID NO:NO:14507或SEQ ID NO:14509。在某些实施方案中,5′和3′转座子末端在其末端共有紧邻5′-TTAT-3靶插入位点的CCCGGCGAGCATGAGG(SEQ IDNO:14510)的16bp重复序列,所述重复序列在两个末端取向相反。在某些实施方案中,5′转座子末端从包含5′-TTATCCCGGCGAGCATGAGG-3(SEQ ID NO:14511)的序列开始,且3′转座子以包含这个序列的反向互补序列:5′-CCTCATGCTCGCCGGGTTAT-3′(SEQ ID NO:14512)的序列结束。
在某些实施方案中,piggyBac或piggyBac样转座子包含一个末端,所述末端包含SEQ ID NO:14506或SEQ ID NO:14508的至少14、16、18、20、30或40个连续核苷酸。在某些实施方案中,piggyBac或piggyBac样转座子包含一个末端,所述末端包含SEQ ID NO:14507或SEQ ID NO:14509的至少14、16、18、20、30或40个连续核苷酸。在某些实施方案中,piggyBac或piggyBac样转座子包含与SEQ ID NO:14506或SEQ ID NO:14508具有至少90%同一性的一个末端。在某些实施方案中,piggyBac或piggyBac样转座子包含与SEQ ID NO:14507或SEQ ID NO:14509具有至少90%同一性的一个末端。
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含CCCGGCGAGCATGAGG(SEQID NO:14510)的序列。在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14510的ITR序列。在某些实施方案中,piggyBac或piggyBac样转座子包含TTATCCCGGCGAGCATGAGG(SEQ ID NO:14511)的序列。在某些实施方案中,piggyBac或piggyBac样转座子包含来自SEQ ID NO:14511的至少16个连续核苷酸。在某些实施方案中,piggyBac或piggyBac样转座子包含CCTCATGCTCGCCGGGTTAT(SEQ ID NO:14512)的序列。在某些实施方案中,piggyBac或piggyBac样转座子包含来自SEQ ID NO:14512的至少16个连续核苷酸。在某些实施方案中,piggyBac或piggyBac样转座子包含一个末端,所述末端包含来自SEQ ID NO:14511的至少16个连续核苷酸,和一个末端,所述末端包含来自SEQ ID NO:14512的至少16个连续核苷酸。在某些实施方案中,piggyBac或piggyBac样转座子包含SEQID NO:14511和SEQ ID NO:14512。在某些实施方案中,piggyBac或piggyBac样转座子包含TTAACCCGGCGAGCATGAGG(SEQ ID NO:14513)的序列。在某些实施方案中,piggyBac或piggyBac样转座子包含CCTCATGCTCGCCGGGTTAA(SEQ ID NO:14514)的序列。
在某些实施方案中,piggyBac或piggyBac样转座子可具有包含SEQ ID NO:14506和SEQ ID NO:14507,或这些中的任一个或两者的与SEQ ID NO:14506或SEQ ID NO:14507具有至少90%序列同一性的变体的末端,并且piggyBac或piggyBac样转座酶具有SEQ IDNO:14504或SEQ ID NO:14505的序列,或与SEQ ID NO:14504或SEQ ID NO:14505具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的序列。在某些实施方案中,piggyBac或piggyBac样转座子包含插入一对反向重复序列之间的异源多核苷酸,其中所述转座子能够通过与SEQ ID NO:14504或SEQ ID NO:14505具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的piggyBac或piggyBac样转座酶转座。在某些实施方案中,转座子包含两个转座子末端,其各自在两个转座子末端以相反取向包含SEQ ID NO:14510。在某些实施方案中,每个反向末端重复序列(ITR)与SEQ ID NO:14510具有至少90%同一性。
在某些实施方案中,piggyBac或piggyBac样转座子能够通过piggyBac或piggyBac样转座酶在靶核酸内的序列5′-TTAT-3处插入。在某些实施方案中,piggyBac或piggyBac样转座子的一个末端包含来自SEQ ID NO:14506的至少16个连续核苷酸,且另一转座子末端包含来自SEQ ID NO:14507的至少16个连续核苷酸。在某些实施方案中,piggyBac或piggyBac样转座子的一端包含来自SEQ ID NO:14506的至少17个、至少18个、至少19个、至少20个、至少22个、至少25个、至少30个连续核苷酸,且另一转座子末端包含来自SEQ IDNO:14507的至少17个、至少18个、至少19个、至少20个、至少22个、至少25个、至少30个连续核苷酸。
在某些实施方案中,piggyBac或piggyBac样转座子包含对应于SEQ ID NO:14506和SEQ ID NO:14507的转座子末端(每个末端包含ITR),且具有对应于5′-TTAT3′的靶序列。在某些实施方案中,piggyBac或piggyBac样转座子也包含编码转座酶的序列(例如SEQ IDNO:14505)。在某些实施方案中,piggyBac或piggyBac样转座子包含对应于SEQ ID NO:14506的一个转座子末端和对应于SEQ ID NO:14516的第二转座子末端。SEQ ID NO:14516与SEQ ID NO:14507非常相似,但是在ITR之前不远处具有大的插入。尽管两个转座子末端的ITR序列相同(它们都与SEQ ID NO:14510相同),但它们具有不同的靶序列:第二转座子具有对应于5′-TTAA-3′的靶序列,从而提供证据表明,改变ITR序列不是修饰靶序列特异性所必需的。与5′-TTAA-3’靶位点相关的piggyBac或piggyBac样转座酶(SEQ ID NO:14504)与5′-TTAT-3′相关转座酶(SEQ ID NO:14505)的不同之处仅在于4个氨基酸改变(D322Y、S473C、A507T、H582R)。在某些实施方案中,与5′-TTAA-3’靶位点相关的piggyBac或piggyBac样转座酶(SEQ ID NO:14504)比5′-TTAT-3′相关piggyBac或piggyBac样转座酶(SEQ ID NO:14505)对具有5′-TTAT-3′末端的转座子的活性低。在某些实施方案中,可通过用5′-TTAT-3′来替换5′-TTAA-3’靶位点,将具有5′-TTAA-3’靶位点的piggyBac或piggyBac样转座子转化为具有5′-TTAT-3靶位点的piggyBac或piggyBac样转座酶。这种转座子可与识别5′-TTAT-3’靶序列的piggyBac或piggyBac样转座酶如SEQ ID NO:14504,或与最初与5′-TTAA-3′转座子相关的转座酶的变体一起使用。在某些实施方案中,5′-TTAA-3′和5′-TTAT-3′piggyBac或piggyBac样转座酶之间的高相似性证明,piggyBac或piggyBac样转座酶的氨基酸序列的极少改变即可改变靶序列特异性。在某些实施方案中,对任何piggyBac或piggyBac样转座子-转座酶基因转移系统的修饰,其中5′-TTAA-3’靶序列被5′-TTAT-3′靶序列替换,ITR保持相同,且转座酶是原始的piggyBac或piggyBac样转座酶或由使用低水平诱变以将突变引入转座酶产生的其变体。在某些实施方案中,可通过修饰5′-TTAT-3′-活性piggyBac或piggyBac样转座子-转座酶基因转移系统来形成piggyBac或piggyBac样转座子转座酶转移系统,其中5′-TTAT-3’靶序列被5′-TTAA-3′-靶序列替换,ITR保持相同,且piggyBac或piggyBac样转座酶是原始的转座酶或其变体。
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自家蚕。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,转座子包含来自SEQ ID NO:14577的至少16个连续碱基和来自SEQ ID NO:14578的至少16个连续碱基,以及与CCCGGCGAGCATGAGG(SEQ ID NO:14510)具有至少87%同一性的反向末端重复序列。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14595和SEQID NO:14596,并由SEQ ID NO:14505的piggyBac或piggyBac样转座酶转座。在某些实施方案中,SEQ ID NO:14595和SEQ ID:14596的ITR侧翼不是5’-TTAA-3’序列。在某些实施方案中,SEQ ID NO:14595和SEQ ID:14596的ITR侧翼为5’-TTAT-3’序列。
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子的5’末端包含SEQ ID NO:14577、SEQ ID NO:14595或SEQ ID NO:14597-14599的序列。在某些实施方案中,piggyBac或piggyBac样转座子的5’末端之前是5’靶序列。
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子的3’末端包含SEQ ID NO:14578、SEQ ID NO:14596或SEQ ID NO:14600-14601的序列。在某些实施方案中,piggyBac或piggyBac样转座子的3’末端后面是3’靶序列。在某些实施方案中,转座子由SEQ ID NO:14505的转座酶转座。在某些实施方案中,piggyBac或piggyBac样转座子的5’和3’末端共有相反取向并紧邻靶序列的SEQ ID NO:14510的16bp重复序列。在某些实施方案中,5’转座子末端从SEQ ID NO:14510开始,且3’转座子末端以SEQ ID NO:14510的反向互补序列5’-CCTCATGCTCGCCGGG-3’(SEQ ID NO:14603)结束。在某些实施方案中,piggyBac或piggyBac样转座子包含与SEQ ID NO:14510或SEQ ID NO:14603具有至少93%、至少87%或至少81%或其间任何百分比同一性的ITR。在某些实施方案中,piggyBac或piggyBac样转座子包含靶序列(其后是包含选自SEQ ID NO:88、105或107的序列的5’转座子末端)和包含SEQ ID NO:14578或106的3’转座子末端(其后是靶序列)。在某些实施方案中,piggyBac或piggyBac样转座子包含一个末端,所述末端包含与SEQ ID NO:14577具有至少90%、至少95%或至少99%或其间任何百分比同一性的序列,和一个末端,所述末端包含与SEQ ID NO:14578具有至少90%、至少95%或至少99%或其间任何百分比同一性的序列。在某些实施方案中,一个转座子末端包含来自SEQ ID NO:14577的至少14个、至少16个、至少18个或至少20个连续碱基,并且一个转座子末端包含来自SEQ ID NO:14578的至少14个、至少16个、至少18个或至少20个连续碱基。
在某些实施方案中,piggyBac或piggyBac样转座子包含两个转座子末端,其中每个转座子末端在两个转座子末端以相反取向包含与SEQ ID NO:14510具有至少81%同一性、至少87%同一性或至少93%同一性或其间任何百分比同一性的序列。一个末端可以进一步包含来自SEQ ID NO:14599的至少14个、至少16个、至少18个或至少20个连续碱基,并且另一个末端可以进一步包含来自SEQ ID NO:14601的至少14个、至少16个、至少18个或至少20个连续碱基。可以通过SEQ ID NO:14505的转座酶对piggyBac或piggyBac样转座子进行转座,并且所述转座酶可以任选地与核定位信号融合。
在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14595和SEQID NO:14596,且piggyBac或piggyBac样转座酶包含SEQ ID NO:14504或SEQ ID NO:14505。在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14597和SEQ ID NO:14596,且piggyBac或piggyBac样转座酶包含SEQ ID NO:14504或SEQ ID NO:14505。在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14595和SEQ ID NO:14578,且piggyBac或piggyBac样转座酶包含SEQ ID NO:14504或SEQ ID NO:14505。在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14602和SEQ ID NO:14600,且piggyBac或piggyBac样转座酶包含SEQ ID NO:14504或SEQ ID NO:14505。
在某些实施方案中,piggyBac或piggyBac样转座子包含5’末端,所述5’末端包含1、2、3、4、5、6或7个选自ATGAGGCAGGGTAT(SEQ ID NO:14614)、ATACCCTGCCTCAT(SEQ ID NO:14615)、GGCAGGGTAT(SEQ ID NO:14616)、ATACCCTGCC(SEQ ID NO:14617)、TAAAATTTTA(SEQID NO:14618)、ATTTTATAAAAT(SEQ ID NO:14619)、TCATACCCTG(SEQ ID NO:14620)和TAAATAATAATAA(SEQ ID NO:14621)的序列。在某些实施方案中,piggyBac或piggyBac样转座子包含3’末端,所述3’末端包含1、2或3个选自SEQ ID NO:14617、SEQ ID NO:14620和SEQID NO:14621的序列。
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自热带爪蟾。所述piggyBac或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在一些实施方案中,piggyBac或piggyBac样转座酶是SEQ ID NO:14517的高活性变体。在某些实施方案中,piggyBac或piggyBac样转座酶是SEQ ID NO:14517的整合缺陷变体。所述piggyBac或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自热带爪蟾。在某些实施方案中,piggyBac或piggyBac样转座酶是高活性的piggyBac或piggyBac样转座酶。在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含与以下序列具有至少90%同一性的序列:
在某些实施方案中,piggyBac或piggyBac样转座酶是高活性的piggyBac或piggyBac样转座酶。高活性的piggyBac或piggyBac样转座酶是一种比其所衍生自的天然存在的变体活性更高的转座酶。在某些实施方案中,高活性的piggyBac或piggyBac样转座酶比SEQ ID NO:14517的转座酶活性更高。在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含以下序列:
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含在选自氨基酸6、7、16、19、20、21、22、23、24、26、28、31、34、67、73、76、77、88、91、141、145、146、148、150、157、162、179、182、189、192、193、196、198、200、210、212、218、248、263、270、294、297、308、310、333、336、354、357、358、359、377、423、426、428、438、447、450、462、469、472、498、502、517、520、523、533、534、576、577、582、583或587的位置处的氨基酸取代(相对于SEQ ID NO:14517)。在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含Y6C、S7G、M16S、S19G、S20Q、S20G、S20D、E21D、E22Q、F23T、F23P、S24Y、S26V、S28Q、V31K、A34E、L67A、G73H、A76V、D77N、P88A、N91D、Y141Q、Y141A、N145E、N145V、P146T、P146V、P146K、P148T、P148H、Y150G、Y150S、Y150C、H157Y、A162C、A179K、L182I、L182V、T189G、L192H、S193N、S193K、V196I、S198G、T200W、L210H、F212N、N218E、A248N、L263M、Q270L、S294T、T297M、S308R、L310R、L333M、Q336M、A354H、C357V、L358F、D359N、L377I、V423H、P426K、K428R、S438A、T447G、T447A、L450V、A462H、A462Q、I469V、I472L、Q498M、L502V、E5171、P520D、P520G、N523S、I533E、D534A、F576R、F576E、K577I、I582R、Y583F、L587Y或L587W的氨基酸取代或包括这些突变的至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个或全部的其任何组合(相对于SEQ ID NO:14517)。
在某些实施方案中,高活性的piggyBac或piggyBac样转座酶包含非野生型的氨基酸的一个或多个取代,其中对野生型氨基酸的一个或多个取代包括A2X、K3X、R4X、F5X、Y6X、S7X、A11X、A13X、C15X、M16X、A17X、S18X、S19X、S20X、E21X、E22X、F23X、S24X、G25X、26X、D27X、S28X、E29X、E42X、E43X、S44X、C46X、S47X、S48X、S49X、T50X、V51X、S52X、A53X、L54X、E55X、E56X、P57X、M58X、E59X、E62X、D63X、V64X、D65X、D66X、L67X、E68X、D69X、Q70X、E71X、A72X、G73X、D74X、R75X、A76X、D77X、A78X、A79X、A80X、G81X、G82X、E83X、P84X、A85X、W86X、G87X、P88X、P89X、C90X、N91X、F92X、P93X、E95X、I96X、P97X、P98X、F99X、T100X、T101X、P103X、G104X、V105X、K106X、V107X、D108X、T109X、N111X、P114X、I115X、N116X、F117X、F118X、Q119X、M122X、T123X、E124X、A125X、I126X、L127X、Q128X、D129X、M130X、L132X、Y133X、V126X、Y127X、A138X、E139X、Q140X、Y141X、L142X、Q144X、N145X、P146X、L147X、P148X、Y150X、A151X、A155X、H157X、P158X、I161X、A162X、V168X、T171X、L172X、A173X、M174X、I177X、A179X、L182X、D187X、T188X、T189X、T190X、L192X、S193X、I194X、P195X、V196X、S198X、A199X、T200X、S202X、L208X、L209X、L210X、R211X、F212X、F215X、N217X、N218X、A219X、T220X、A221X、V222X、P224X、D225X、Q226X、P227X、H229X、R231X、H233X、L235X、P237X、I239X、D240X、L242X、S243X、E244X、R244X、F246X、A247X、A248X、V249X、Y250X、T251X、P252X、C253X、Q254X、I256X、C257X、I258X、D259X、E260X、S261X、L262X、L263X、L264X、F265X、K266X、G267X、R268X、L269X、Q270X、F271X、R272X、Q273X、Y274X、I275X、P276X、S277X、K278X、R279X、A280X、R281X、Y282X、G283X、I284X、K285X、F286X、Y287X、K288X、L289X、C290X、E291X、S292X、S293XS294X、G295X、Y296X、T297X、S298X、Y299X、F300X、E304X、L310X、P313X、G314X、P316X、P317X、D318X、L319X、T320X、V321X、K324X、E328X、I330X、S331X、P332X、L333X、L334X、G335X、Q336X、F338X、L340X、D343X、N344X、F345X、Y346X、S347X、L351X、F352X、A354X、L355X、Y356X、C357X、L358X、D359X、T360X、R422X、Y423X、G424X、P426X、K428X、N429X、K430X、P431X、L432X、S434X、K435X、E436X、S438X、K439X、Y440X、G443X、R446X、T447X、L450X、Q451X、N455X、T460X、R461X、A462X、K465X、V467X、G468X、I469X、Y470X、L471X、I472X、M474X、A475X、L476X、R477X、S479X、Y480X、V482XY483X、K484X、A485X、A486X、V487X、P488X、P490X、K491X、S493X、Y494X、Y495X、K496X、Y497T、Q498X、L499X、Q500X、I501X、L502X、P503X、A504X、L505X、L506X、F507X、G508X、G509X、V510X、E511X、E512X、Q513X、T514X、V515X、E517X、M518X、P519X、P520X、S521X、D522X、N523X、V524X、A525X、L527X、I528X、K530X、H531X、F532X、I533X、D534X、T535X、L536X、T539X、P540X、Q546X、K550X、R553X、K554X、R555X、G556X、I557X、R558X、R559X、D560X、T561X、Y564X、P566X、K567X、P569X、R570X、N571X、L574X、C575X、F576X、K577X、P578X、F580X、E581X、I582X、Y583X、T585X、Q586X、L587X、H588X或Y589X的取代(相对于SEQ ID NO:14517)。可以在美国专利号10,041,077中找到高活性氨基酸取代的列表,所述专利的内容通过全文引用并入本文。
在某些实施方案中,piggyBac或piggyBac样转座酶是整合缺陷的。在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶是可以切除其相应转座子但以比相应的天然存在的转座酶更低的频率整合被切除的转座子的转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶是SEQ ID NO:14517的整合缺陷变体。在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶相对于SEQ ID NO:14517是缺陷的。
在某些实施方案中,piggyBac或piggyBac样转座酶对于切除有活性,但是在整合中是缺陷的。在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶包含与以下序列具有至少90%同一性的序列:
在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶包含与以下序列具有至少90%同一性的序列:
在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶包含与以下序列具有至少90%同一性的序列:
在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶包含SEQ ID NO:14611。在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶包含与以下序列具有至少90%同一性的序列:
在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶包含SEQ ID NO:14612。在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶包含与以下序列具有至少90%同一性的序列:
在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶包含SEQ ID NO:14613。在某些实施方案中,整合缺陷的piggyBac或piggyBac样转座酶包含氨基酸取代,其中在位置218处的Asn被Glu或Asp置换(N218D或N218E)(相对于SEQ ID NO:14517)。
在某些实施方案中,有切除能力的、整合缺陷的piggyBac或piggyBac样转座酶包含非野生型的氨基酸的一个或多个取代,其中对野生型氨基酸的一个或多个取代包括A2X、K3X、R4X、F5X、Y6X、S7X、A8X、E9X、E10X、A11X、A12X、A13X、H14X、C15X、M16X、A17X、S18X、S19X、S20X、E21X、E22X、F23X、S24X、G25X、26X、D27X、S28X、E29X、V31X、P32X、P33X、A34X、S35X、E36X、S37X、D38X、S39X、S40X、T41X、E42X、E43X、S44X、W45X、C46X、S47X、S48X、S49X、T50X、V51X、S52X、A53X、L54X、E55X、E56X、P57X、M58X、E59X、V60X、M122X、T123X、E124X、A125X、L127X、Q128X、D129X、L132X、Y133X、V126X、Y127X、E139X、Q140X、Y141X、L142X、T143X、Q144X、N145X、P146X、L147X、P148X、R149X、Y150X、A151X、H154X、H157X、P158X、T159X、D160X、I161X、A162X、E163X、M164X、K165X、R166X、F167X、V168X、G169X、L170X、T171X、L172X、A173X、M174X、G175X、L176X、I177X、K178X、A179X、N180X、S181X、L182X、S184X、Y185X、D187X、T188X、T189X、T190X、V191X、L192X、S193X、I194X、P195X、V196X、F197X、S198X、A199X、T200X、M201X、S202X、R203X、N204X、R205X、Y206X、Q207X、L208X、L209X、L210X、R211X、F212X、L213X、H241X、F215X、N216X、N217X、N218X、A219X、T220X、A221X、V222X、P223X、P224X、D225X、Q226X、P227X、G228X、H229X、D230X、R231X、H233X、K234X、L235X、R236X、L238X、I239X、D240X、L242X、S243X、E244X、R244X、F246X、A247X、A248X、V249X、Y250X、T251X、P252X、C253X、Q254X、N255X、I256X、C257X、I258X、D259X、E260X、S261X、L262X、L263X、L264X、F265X、K266X、G267X、R268X、L269X、Q270X、F271X、R272X、Q273X、Y274X、I275X、P276X、S277X、K278X、R279X、A280X、R281X、Y282X、G283X、I284X、K285X、F286X、Y287X、K288X、L289X、C290X、E291X、S292X、S293X、S294X、G295X、Y296X、T297X、S298X、Y299X、F300X、I302X、E304X、G305X、K306X、D307X、S308X、K309X、L310X、D311X、P312X、P313X、G314X、C315X、P316X、P317X、D318X、L319X、T320X、V321X、S322X、G323X、K324X、I325X、V326X、W327X、E328X、L329X、I330X、S331X、P332X、L333X、L334X、G335X、Q336X、F338X、H339X、L340X、V342X、N344X、F345X、Y346X、S347X、S348X、I349X、L351X、T353X、A354X、Y356X、C357X、L358X、D359X、T360X、P361X、A362X、C363X、G364X、I366X、N367X、R368X、D369X、K371X、G372X、L373X、R375X、A376X、L377X、L378X、D379X、K380X、K381X、L382X、N383X、R384XG385X、T387X、Y388X、A389X、L390X、K392X、N393X、E394X、A397X、K399X、F400X、F401X、D402X、N405X、L406X、L409X、R422X、Y423X、G424X、E425X、P426X、K428X、N429X、K430X、P431X、L432X、S434X、K435X、E436X、S438X、K439X、Y440X、G442X、G443X、V444X、R446X、T447X、L450X、Q451X、H452X、N455X、T457X、R458X、T460X、R461X、A462X、Y464X、K465X、V467X、G468X、I469X、L471X、I472X、Q473X、M474X、L476X、R477X、N478X、S479X、Y480X、V482XY483X、K484X、A485X、A486X、V487X、P488X、G489X、P490X、K491X、L492X、S493X、Y494X、Y495X、K496X、Q498X、L499X、Q500X、I501X、L502X、P503X、A504X、L505X、L506X、F507X、G508X、G509X、V510X、E511X、E512X、Q513X、T514X、V515X、E517X、M518X、P519X、P520X、S521X、D522X、N523X、V524X、A525X、L527X、I528X、G529X、K530X、F532X、I533X、D534X、T535X、L536X、P537X、P538X、T539X、P540X、G541X、F542X、Q543X、R544X、P545X、Q546X、K547X、G548X、C549X、K550X、V551X、C552X、R553X、K554X、R555X、G556X、I557X、R558X、R559X、D560X、T561X、R562X、Y563X、Y564X、C565X、P566X、K567X、C568X、P569X、R570X、N571X、P572X、G573X、L574X、C575X、F576X、K577X、P578X、C579X、F580X、E581X、I582X、Y583X、H584X、T585X、Q586X、L587X、H588X或Y589X的取代(相对于SEQ ID NO:14517)。可以在美国专利号10,041,077中找到有切除能力的、整合缺陷的氨基酸取代的列表,所述专利的内容通过全文引用并入本文。
在某些实施方案中,piggyBac或piggyBac样转座酶与核定位信号融合。在某些实施方案中,SEQ ID NO:14517或SEQ ID NO:14518与核定位信号融合。在某些实施方案中,与核定位信号融合的piggyBac或piggyBac样转座酶的氨基酸序列由包含以下序列的多核苷酸序列编码:
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自热带爪蟾。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14519和SEQID NO:14520。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
[01]在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14520和SEQID NO:14519、SEQ ID NO:14521或SEQ ID NO:14523。在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14522和SEQ ID NO:14519、SEQ ID NO:14521或SEQ IDNO:14523。在某些实施方案中,piggyBac或piggyBac样转座子包含一个末端,所述末端包含来自SEQ ID NO:14519、SEQ ID NO:14521或SEQ ID NO:14523的至少14、16、18、20、30或40个连续核苷酸。在某些实施方案中,piggyBac或piggyBac样转座子包含一个末端,所述末端包含来自SEQ ID NO:14520或SEQ ID NO:14522的至少14、16、18、20、30或40个连续核苷酸。在某些实施方案中,piggyBac或piggyBac样转座子包含与SEQ ID NO:14519、SEQ ID NO:14521或SEQ ID NO:14523具有至少90%同一性的一个末端。在某些实施方案中,piggyBac或piggyBac样转座子包含与SEQ ID NO:14520或SEQ ID NO:14522具有至少90%同一性的一个末端。在一个实施方案中,一个转座子末端与SEQ ID NO:14519具有至少90%同一性,且另一个转座子末端与SEQ ID NO:14520具有至少90%同一性。
在某些实施方案中,piggyBac或piggyBac样转座子包含TTAACCTTTTTACTGCCA(SEQID NO:14524)的序列。在某些实施方案中,piggyBac或piggyBac样转座子包含TTAACCCTTTGCCTGCCA(SEQ ID NO:14526)的序列。在某些实施方案中,piggyBac或piggyBac样转座子包含TTAACCYTTTTACTGCCA(SEQ ID NO:14527)的序列。在某些实施方案中,piggyBac或piggyBac样转座子包含TGGCAGTAAAAGGGTTAA(SEQ ID NO:14529)的序列。在某些实施方案中,piggyBac或piggyBac样转座子包含TGGCAGTGAAAGGGTTAA(SEQ ID NO:14531)的序列。在某些实施方案中,piggyBac或piggyBac样转座子包含TTAACCYTTTKMCTGCCA(SEQ ID NO:14533)的序列。在某些实施方案中,piggyBac或piggyBac样转座子的一个末端包含选自SEQ ID NO:14524、SEQ ID NO:14526和SEQ ID NO:14527的序列。在某些实施方案中,piggyBac(PB)或piggyBac样转座子的一个末端包含选自SEQ IDNO:14529和SEQ ID NO:14531的序列。在某些实施方案中,piggyBac或piggyBac样转座子的每个反向末端重复序列包含CCYTTTKMCTGCCA(SEQ ID NO:14563)的ITR序列的序列。在某些实施方案中,piggyBac(PB)或piggyBac样转座子的每个末端以相反取向包含SEQ ID NO:14563。在某些实施方案中,piggyBac或piggyBac样转座子的一个ITR包含选自SEQ ID NO:14524、SEQ ID NO:14526和SEQ ID NO:14527的序列。在某些实施方案中,piggyBac或piggyBac样转座子的一个ITR包含选自SEQ ID NO:14529和SEQ ID NO:14531的序列。在某些实施方案中,piggyBac或piggyBac样转座子在两个转座子末端以相反取向包含SEQ IDNO:14533。
在某些实施方案中,piggyBac或piggyBac样转座子可具有包含SEQ ID NO:14519和SEQ ID NO:14520,或这些中的任一个或两者的与SEQ ID NO:14519或SEQ ID NO:14520具有至少90%序列同一性的变体的末端,并且piggyBac或piggyBac样转座酶具有SEQ IDNO:14517的序列,或与SEQ ID NO:14517或SEQ ID NO:14518显示至少%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比序列同一性的变体。在某些实施方案中,一个piggyBac或piggyBac样转座子末端包含来自SEQ ID NO:14519、SEQ ID NO:14521或SEQ ID NO:14523的至少14个连续核苷酸,并且另一个转座子末端包含来自SEQ ID NO:14520或SEQ ID NO:14522的至少14个连续核苷酸。在某些实施方案中,一个转座子末端包含来自SEQ ID NO:14519、SEQID NO:14521或SEQ ID NO:14523的至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少22个、至少25个、至少30个连续核苷酸,并且另一个转座子末端包含来自SEQID NO:14520或SEQ ID NO:14522的至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少22个、至少25个或至少30个连续核苷酸。
在某些实施方案中,piggyBac或piggyBac样转座酶识别具有对应于SEQ ID NO:14519的5’序列和对应于SEQ ID NO:14520的3’序列的转座子末端。它将通过在一个转座子末端的5’末端的5′-TTAA-3′序列到第二个转座子末端的3’末端的5′-TTAA-3′切割DNA(包括置于它们之间的任何异源DNA),从一个DNA分子中切除转座子,并将切除的序列插入第二个DNA分子中。在某些实施方案中,5’和3’转座子末端的截短和修饰的形式也将作为可由piggyBac或piggyBac样转座酶转座的转座子的部分起作用。例如,5’转座子末端可以用对应于SEQ ID NO:14521或SEQ ID NO:14523的序列置换,3’转座子末端可以用对应于SEQ IDNO:14522的较短序列置换。在某些实施方案中,5’和3’转座子末端在其末端共有包括5′-TTAA-3′插入位点的18bp几乎完美重复的序列(5′-TTAACCYTTTKMCTGCCA:SEQ ID NO:14533),所述序列在两个末端的取向相反。也就是说,在(SEQ ID NO:14519)和SEQ ID NO:14523中,5’转座子末端从序列5′-TTAACCTTTTTACTGCCA-3′(SEQ ID NO:14524)开始,或在(SEQ ID NO:14521)中,5’转座子末端从序列5′-TTAACCCTTTGCCTGCCA-3′(SEQ ID NO:14526)开始;3’转座子以这个序列的大约反向互补序列结束:在SEQ ID NO:14520中,它终止于5′TGGCAGTAAAAGGGTTAA-3′(SEQ ID NO:14529),在(SEQ ID NO:14522)中,它终止于5′-TGGCAGTGAAAGGGTTAA-3′(SEQ ID NO:14531)。本发明的一个实施方案是一种转座子,其包含插入在两个转座子末端之间的异源多核苷酸,所述转座子末端各自在两个转座子末端以相反取向包含SEQ ID NO:14533。在某些实施方案中,一个转座子末端包含选自SEQ IDNO:14524、SEQ ID NO:14526和SEQ ID NO:14527的序列。在一些实施方案中,一个转座子末端包含选自SEQ ID NO:14529和SEQ ID NO:14531的序列。
在某些实施方案中,piggyBac(PB)或piggyBac样转座子分离或衍生自热带爪蟾。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含来自SEQ ID NO:14573或SEQ ID NO:14574的至少16个连续碱基以及CCYTTTBMCTGCCA(SEQ ID NO:14575)的反向末端重复序列。
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含选自SEQ ID NO:14573和SEQ ID NO:14579-14585的5’转座子末端序列。在某些实施方案中,5’转座子末端序列之前是5’靶序列。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含选自SEQ ID NO:14574和SEQ ID NO:14587-14590的3’转座子末端序列。在某些实施方案中,3’转座子末端序列后面是3’靶序列。在某些实施方案中,5’和3’转座子末端共有邻接靶序列的在两个末端取向相反的14重复序列(SEQ ID NO:14575)。在某些实施方案中,piggyBac或piggyBac样转座子包含含有靶序列和选自SEQ ID NO:14582-14584和14573的序列的5’转座子末端,和包含选自SEQ ID NO:14588-14590和14574的序列(其后是3’靶序列)的3’转座子末端。
在某些实施方案中,piggyBac或piggyBac样转座子的5’转座子末端包含
(SEQ ID NO:14591)和ITR。在某些实施方案中,5’转座子末端包含
(SEQ ID NO:14592)和ITR。在某些实施方案中,piggyBac或piggyBac样转座子的3’转座子末端包含
(SEQ ID NO:14593)和ITR。在某些实施方案中,3’转座子末端包含
(SEQ ID NO:14594)和ITR。
在某些实施方案中,一个转座子末端包含与SEQ ID NO:14573具有至少90%、至少95%、至少99%或其间任何百分比同一性的序列,且另一个转座子末端包含与SEQ ID NO:14574具有至少90%、至少95%、至少99%或其间任何百分比同一性的序列。在某些实施方案中,一个转座子末端包含来自SEQ ID NO:14573的至少14个、至少16个、至少18个、至少20个或至少25个连续核苷酸,并且一个转座子末端包含来自SEQ ID NO:14574的至少14个、至少16个、至少18个、至少20个或至少25个连续核苷酸。在某些实施方案中,一个转座子末端包含来自SEQ ID NO:14591的至少14个、至少16个、至少18个、至少20个,并且另一个末端包含来自SEQ ID NO:14593的至少14个、至少16个、至少18个、至少20个。在某些实施方案中,每个转座子末端以相反取向包含SEQ ID NO:14575。
在某些实施方案中,piggyBac或piggyBac样转座子包含选自SEQ ID NO:14573、SEQ ID NO:14579、SEQ ID NO:14581、SEQ ID NO:14582、SEQ ID NO:14583和SEQ ID NO:14588的序列,以及选自SEQ ID NO:14587、SEQ ID NO:14588、SEQ ID NO:14589和SEQ IDNO:14586的序列,且piggyBac或piggyBac样转座酶包含SEQ ID NO:14517或SEQ ID NO:14518。
在某些实施方案中,piggyBac或piggyBac样转座子包含与靶序列邻接的CCCTTTGCCTGCCA(SEQ ID NO:14622)(5’ITR)和TGGCAGTGAAAGGG(SEQ ID NO:14623)(3’ITR)的ITR。
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自棉铃虫。所述piggyBac或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自棉铃虫。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自棉红铃虫。所述piggyBac或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自棉红铃虫。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自银纹夜蛾。所述piggyBac或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自银纹夜蛾。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
361 ctagggttaa(SEQ ID NO:14536)。在某些实施方案中,piggyBac或piggyBac样转座子包含CCCTAGAAGCCCAATC(SEQ ID NO:14564)的ITR序列。
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自小地老虎。所述piggyBac(PB)或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自小地老虎。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自苜蓿切叶蜂。所述piggyBac(PB)或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自苜蓿切叶蜂。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自美洲东部熊蜂。所述piggyBac(PB)或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自美洲东部熊蜂。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自甘蓝夜蛾。所述piggyBac(PB)或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自甘蓝夜蛾。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自小麦瘿蚊。所述piggyBac(PB)或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自小麦瘿蚊。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自意大利蜜蜂。所述piggyBac(PB)或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自意大利蜜蜂。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自Messor bouvieri。所述piggyBac(PB)或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自Messorbouvieri。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在本公开内容的方法的某些实施方案中,转座酶是piggyBac或piggyBac样转座酶。在某些实施方案中,piggyBac或piggyBac样转座酶分离或衍生自粉纹夜蛾。所述piggyBac(PB)或piggyBac样转座酶可包含与以下序列具有至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或其间任何百分比同一性的氨基酸序列或由其组成:
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自粉纹夜蛾。在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含以下序列:
在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14561和SEQID NO:14562,且piggyBac或piggyBac样转座酶包含SEQ ID NO:14558。在某些实施方案中,piggyBac或piggyBac样转座子包含SEQ ID NO:14609和SEQ ID NO:14610,且piggyBac或piggyBac样转座酶包含SEQ ID NO:14558。
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自棉蚜。在某些实施方案中,piggyBac或piggyBac样转座子包含CCTTCCAGCGGGCGCGC(SEQ ID NO:14565)的ITR序列。
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自二化螟。在某些实施方案中,piggyBac或piggyBac样转座子包含CCCAGATTAGCCT(SEQ ID NO:14566)的ITR序列。
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自烟芽夜蛾。在某些实施方案中,piggyBac或piggyBac样转座子包含CCCTTAATTACTCGCG(SEQ ID NO:14567)的ITR序列。
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自棉红铃虫。在某些实施方案中,piggyBac或piggyBac样转座子包含CCCTAGATAACTAAAC(SEQ ID NO:14568)的ITR序列。
在某些实施方案中,piggyBac或piggyBac样转座子分离或衍生自斑须按蚊(Anopheles stephensi)。在某些实施方案中,piggyBac或piggyBac样转座子包含CCCTAGAAAGATA(SEQ ID NO:14569)的ITR序列。
基于非转座的基因修饰方法
在本公开内容的方法的一些实施方案中,可以通过将转基因引入本公开内容的HSC或HSC后代细胞来产生本公开内容的修饰的HSC或修饰的HSC后代细胞。引入步骤可包括经由非转座递送系统递送核酸序列和/或基因组编辑构建体。
在本公开内容的方法的一些实施方案中,将核酸序列和/或基因组编辑构建体离体、体内、体外或原位引入HSC或HSC后代细胞中包括局部递送、吸附、吸收、电穿孔、旋转感染(spin-fection)、共培养、转染、机械递送、声波递送、振动递送、磁转染(magnetofection)或通过纳米颗粒介导的递送中的一种或多种。在本公开内容的方法的一些实施方案中,将核酸序列和/或基因组编辑构建体离体、体内、体外或原位引入HSC或HSC后代细胞中包括脂质体转染、磷酸钙转染、fugene转染和树状聚合物介导的转染中的一种或多种。在本公开内容的方法的一些实施方案中,通过机械转染离体、体内、体外或原位将核酸序列和/或基因组编辑构建体引入HSC或HSC后代细胞中包括细胞挤压、细胞轰击或基因枪技术。在本公开内容的方法的一些实施方案中,通过纳米颗粒介导的转染离体、体内、体外或原位将核酸序列和/或基因组编辑构建体引入HSC或HSC后代细胞中包括脂质体递送、通过胶束递送,和通过聚合体(polymerosome)递送。
在本公开内容的方法的一些实施方案中,将核酸序列和/或基因组编辑构建体离体、体内、体外或原位引入HSC或HSC后代细胞中包括非病毒载体。在一些实施方案中,非病毒载体包含核酸。在一些实施方案中,非病毒载体包括质粒DNA、线性双链DNA(dsDNA)、线性单链DNA(ssDNA)、DoggyBone
在本公开内容的方法的一些实施方案中,将核酸序列和/或基因组编辑构建体离体、体内、体外或原位引入HSC或HSC后代细胞中包括病毒载体。在一些实施方案中,病毒载体是非整合型非染色体载体。示例性的非整合型非染色体载体包括,但不限于,腺伴随病毒(AAV)、腺病毒和疱疹病毒。在一些实施方案中,病毒载体是整合型染色体载体。整合型染色体载体包括,但不限于,腺伴随载体(AAV)、慢病毒和γ-逆转录病毒。
在本公开内容的方法的一些实施方案中,将核酸序列和/或基因组编辑构建体离体、体内、体外或原位引入HSC或HSC后代细胞中包括载体的组合。示例性的非限制性载体组合包括:病毒和非病毒载体、多个非病毒载体或多个病毒载体。示例性但非限制性的载体组合包括:DNA衍生的和RNA衍生的载体的组合、RNA和逆转录酶的组合、转座子和转座酶的组合、非病毒载体和内切核酸酶的组合、病毒载体和内切核酸酶的组合。
在本公开内容的方法的一些实施方案中,基因修饰(包括将核酸序列和/或基因组编辑构建体离体、体内、体外或原位引入HSC或HSC后代细胞中)稳定整合核酸序列、瞬时整合核酸序列、产生核酸序列的位点特异性整合或产生核酸序列的偏倚整合。在一些实施方案中,核酸序列是转基因。
在本公开内容的方法的一些实施方案中,基因修饰(包括将核酸序列和/或基因组编辑构建体离体、体内、体外或原位引入HSC或HSC后代细胞中)稳定整合核酸序列。在一些实施方案中,稳定的染色体整合可以是随机整合、位点特异性整合或偏倚整合。在一些实施方案中,位点特异性整合可以是非辅助的或辅助的。在一些实施方案中,辅助的位点特异性整合与位点定向核酸酶共递送。在一些实施方案中,位点定向核酸酶包含转基因,所述转基因具有5’和3’核苷酸序列延伸,其含有与基因组整合位点的上游和下游区域的百分比同源性。在一些实施方案中,具有同源核苷酸延伸的转基因使得能够通过同源重组、微同源性(microhomology)介导的末端连接或非同源末端连接进行基因组整合。在一些实施方案中,位点特异性整合发生在安全港位点(safe harbor site)。基因组安全港位点能够以确保新插入的遗传元件可靠地起作用(例如,以治疗有效的表达水平表达)并且不给宿主基因组带来使宿主生物发生危险的有害改变的方式适应新遗传物质的整合。可能的基因组安全港包括,但不限于,人白蛋白基因的内含子序列、腺伴随病毒位点1(AAVS1)、AAV病毒在19号染色体上的天然存在的整合位点、趋化因子(C-C基序)受体5(CCR5)基因的位点和小鼠Rosa26基因座的人直向同源物的位点。
在一些实施方案中,位点特异性转基因整合发生在破坏靶基因表达的位点。在一些实施方案中,靶基因表达的破坏通过在内含子、外显子、启动子、遗传元件、增强子、阻抑基因、起始密码子、终止密码子和应答元件处的位点特异性整合发生。在一些实施方案中,通过位点特异性整合靶向的示例性靶基因包括但不限于TRAC、TRAB、PDI、任何免疫抑制基因和与同种异体排斥(allo-rejection)相关的基因。
在一些实施方案中,位点特异性转基因整合发生在导致增强的靶基因表达的位点。在一些实施方案中,靶基因表达的增强通过在内含子、外显子、启动子、遗传元件、增强子、阻抑基因、起始密码子、终止密码子和应答元件处的位点特异性整合发生。
在本公开内容的方法的一些实施方案中,可以使用酶来在宿主基因组中产生链断裂,以促进转基因的递送或整合。在一些实施方案中,酶产生单链断裂。在一些实施方案中,酶产生双链断裂。在一些实施方案中,诱导断裂的酶的实例包括但不限于:转座酶、整合酶、内切核酸酶、CRISPR-Cas9、转录激活蛋白样效应物核酸酶(TALEN)、锌指核酸酶(ZFN)、Cas-CLOVER
在本公开内容的方法的一些实施方案中,位点特异性转基因整合是由载体介导的整合位点偏倚控制的。在一些实施方案中,载体介导的整合位点偏倚由所选择的慢病毒载体控制。在一些实施方案中,载体介导的整合位点偏倚由所选择的γ-逆转录病毒载体控制。
在本公开内容的方法的一些实施方案中,位点特异性转基因整合是不稳定的染色体插入。在一些实施方案中,整合的转基因可以变得沉默、去除、切除或进一步修饰。
在本公开内容的方法的一些实施方案中,基因组修饰是不稳定的转基因整合。在一些实施方案中,不稳定的整合可以是瞬时非染色体整合、半稳定非染色体整合、半持久非染色体插入或不稳定的染色体插入。在一些实施方案中,瞬时非染色体插入可以是染色体外的(epi-chromosomal)或细胞质的。
在一些实施方案中,转基因的瞬时非染色体插入不整合到染色体中,并且修饰的遗传物质不在细胞分裂过程中复制。
在本公开内容的方法的一些实施方案中,基因组修饰是转基因的半稳定的或持久的非染色体整合。在一些实施方案中,DNA载体编码支架/基质附着区(S-MAR)组件,其与核基质蛋白结合用于非病毒载体的附加型保持,从而允许在分裂细胞的细胞核中自主复制。
在本公开内容的方法的一些实施方案中,基因组修饰是转基因的不稳定的染色体整合。在一些实施方案中,整合的转基因可以变得沉默、去除、切除或进一步修饰。
在本公开内容的方法的一些实施方案中,通过转基因插入对基因组的修饰可通过同源重组(HR)、微同源性介导的末端连接(MMEJ)、非同源末端连接(NHEJ)、转座酶介导的修饰、整合酶介导的修饰、内切核酸酶介导的修饰或重组酶介导的修饰经由宿主细胞定向双链断裂修复(同源性-定向修复)发生。在一些实施方案中,通过转基因插入对基因组的修饰可以经由CRISPR-Cas9、TALEN、ZFNs、Cas-CLOVER和Cpf1发生。
在涉及插入新的或现有的核苷酸/核酸的基因编辑系统中,除切割酶(例如核酸酶、重组酶、整合酶或转座酶)外,还必须将插入工具(例如DNA模板载体、可转座元件(转座子或逆转座子)递送至细胞。用于重组酶的这种插入工具的实例可以包括DNA载体。其他基因编辑系统要求整合酶连同插入载体、转座酶连同转座子/逆转座子等的递送。在一些实施方案中,可用作切割酶的示例性重组酶是CRE重组酶。在各种实施方案中,可以在插入工具中使用的示例性整合酶包括取自许多病毒的任一种的基于病毒的酶,所述病毒包括但不限于AAV、γ逆转录病毒和慢病毒。可以在插入工具中使用的示例性转座子/逆转座子包括但不限于piggyBac转座子、Sleeping Beauty转座子和L1逆转座子。
在本公开内容的方法的某些实施方案中,体内递送转基因。在本公开内容的方法的某些实施方案中,体内转基因递送可以通过局部递送、吸附、吸收、电穿孔、旋转感染(spin-fection)、共培养、转染、机械递送、声波递送、振动递送、磁转染(magnetofection)或通过纳米颗粒介导的递送发生。在本公开内容的方法的某些实施方案中,通过转染的体内转基因递送可以通过脂质体转染、磷酸钙转染、fugene转染和树状聚合物介导的转染发生。在本公开内容的方法的某些实施方案中,体内机械转基因递送可以通过细胞挤压、轰击和基因枪发生。在本公开内容的方法的某些实施方案中,体内纳米颗粒介导的转基因递送可以通过脂质体递送、通过胶束递送和通过聚合体递送发生。在各种实施方案中,可用作切割酶的核酸酶包括但不限于Cas9、转录激活蛋白样效应物核酸酶(TALEN)和锌指核酸酶。
在本公开内容的方法的某些实施方案中,将非病毒载体用于转基因递送。在某些实施方案中,非病毒载体是核酸。在某些实施方案中,核酸非病毒载体是质粒DNA、线性双链DNA(dsDNA)、线性单链DNA(ssDNA)、DoggyBone
在本公开内容方法的某些实施方案中,转基因递送可以通过病毒载体发生。在某些实施方案中,病毒载体是非整合型非染色体载体。非整合型非染色体载体可以包括腺伴随病毒(AAV)、腺病毒和疱疹病毒。在某些实施方案中,病毒载体是整合型染色体载体。整合型染色体载体可包括腺伴随载体(AAV)、慢病毒和γ-逆转录病毒。
在本公开内容的方法的某些实施方案中,转基因递送可以通过载体的组合发生。示例性但非限制性的载体组合可包括:病毒加非病毒载体、多于一种非病毒载体或多于一种病毒载体。示例性但非限制性的载体组合可以包括:DNA衍生的加RNA衍生的载体、RNA加逆转录酶、转座子和转座酶、非病毒载体加内切核酸酶,以及病毒载体加内切核酸酶。
在本公开内容的方法的某些实施方案中,基因组修饰可以是转基因的稳定整合、转基因的瞬时整合、转基因的位点特异性整合或转基因的偏倚整合。
在本公开内容方法的某些实施方案中,基因组修饰可以是转基因的稳定染色体整合。在某些实施方案中,稳定的染色体整合可以是随机整合、位点特异性整合或偏倚整合。在某些实施方案中,位点特异性整合可以是非辅助的或辅助的。在某些实施方案中,辅助的位点特异性整合与位点定向核酸酶共递送。在某些实施方案中,位点定向核酸酶包含转基因,所述转基因具有5’和3’核苷酸序列延伸,其含有与基因组整合位点的上游和下游区域的百分比同源性。在某些实施方案中,具有同源核苷酸延伸的转基因使得能够通过同源重组、微同源性介导的末端连接或非同源末端连接进行基因组整合。在某些实施方案中,位点特异性整合发生在安全港位点。基因组安全港位点能够以确保新插入的遗传元件可靠地起作用(例如,以治疗有效的表达水平表达)并且不给宿主基因组带来使宿主生物发生危险的有害改变的方式适应新遗传物质的整合。可能的基因组安全港包括,但不限于,人白蛋白基因的内含子序列、腺伴随病毒位点1(AAVS1)、AAV病毒在19号染色体上的天然存在的整合位点、趋化因子(C-C基序)受体5(CCR5)基因的位点和小鼠Rosa26基因座的人直向同源物的位点。
在某些实施方案中,位点特异性转基因整合发生在破坏靶基因表达的位点。在某些实施方案中,靶基因表达的破坏通过在内含子、外显子、启动子、遗传元件、增强子、阻抑基因、起始密码子、终止密码子和应答元件处的位点特异性整合发生。在某些实施方案中,通过位点特异性整合靶向的示例性靶基因包括但不限于TRAC、TRAB、PDI、任何免疫抑制基因和与同种异体排斥相关的基因。
在某些实施方案中,位点特异性转基因整合发生在导致靶基因表达增强的位点上。在某些实施方案中,靶基因表达的增强通过在内含子、外显子、启动子、遗传元件、增强子、阻抑基因、起始密码子、终止密码子和应答元件处的位点特异性整合发生。
在本公开内容的方法的某些实施方案中,可以使用酶来在宿主基因组中产生链断裂,以促进转基因的递送或整合。在某些实施方案中,酶产生单链断裂。在某些实施方案中,酶产生双链断裂。在某些实施方案中,诱导断裂的酶的实例包括但不限于:转座酶、整合酶、内切核酸酶、CRISPR-Cas9、转录激活蛋白样效应物核酸酶(TALEN)、锌指核酸酶(ZFN)、Cas-CLOVER
在本公开内容的方法的某些实施方案中,位点特异性转基因整合是由载体介导的整合位点偏倚控制的。在某些实施方案中,载体介导的整合位点偏倚由所选择的慢病毒载体控制。在某些实施方案中,载体介导的整合位点偏倚由所选择的γ-逆转录病毒载体控制。
在本公开内容的方法的某些实施方案中,位点特异性转基因整合位点是不稳定的染色体插入。在某些实施方案中,整合的转基因可以变得沉默、去除、切除或进一步修饰。在本公开内容的方法的某些实施方案中,基因组修饰是不稳定的转基因整合。在某些实施方案中,不稳定的整合可以是瞬时非染色体整合、半稳定非染色体整合、半持久非染色体插入或不稳定的染色体插入。在某些实施方案中,瞬时非染色体插入可以是染色体外的或细胞质的。在某些实施方案中,转基因的瞬时非染色体插入不整合到染色体中,并且修饰的遗传物质不在细胞分裂过程中复制。
在本公开内容的方法的某些实施方案中,基因组修饰是转基因的半稳定的或持久的非染色体整合。在某些实施方案中,DNA载体编码支架/基质附着区(S-MAR)组件,其与核基质蛋白结合用于非病毒载体的附加型保持,从而允许在分裂细胞的细胞核中自主复制。
在本公开内容的方法的某些实施方案中,基因组修饰是转基因的不稳定的染色体整合。在某些实施方案中,整合的转基因可以变得沉默、去除、切除或进一步修饰。
在本公开内容的方法的某些实施方案中,通过转基因插入对基因组的修饰可通过同源重组(HR)、微同源性介导的末端连接(MMEJ)、非同源末端连接(NHEJ)、转座酶介导的修饰、整合酶介导的修饰、内切核酸酶介导的修饰或重组酶介导的修饰经由宿主细胞定向双链断裂修复(同源性-定向修复)发生。在某些实施方案中,通过转基因插入对基因组的修饰可以经由CRISPR-Cas9、TALEN、ZFNs、Cas-CLOVER和Cpf1发生。
在本公开内容的方法的某些实施方案中,具有体内或离体基因组修饰的细胞可以是生殖细胞或体细胞。在某些实施方案中,修饰的细胞可以是人、非人、哺乳动物、大鼠、小鼠或犬细胞。在某些实施方案中,修饰的细胞可以是分化的、未分化的或永生化的。在某些实施方案中,修饰的未分化细胞可以是干细胞。在某些实施方案中,修饰的细胞可以是分化的、未分化的或永生化的。在某些实施方案中,修饰的未分化细胞可以是诱导的多能干细胞。在某些实施方案中,修饰的细胞可以是T细胞、造血干细胞、天然杀伤细胞、巨噬细胞、树突细胞、单核细胞、巨核细胞或破骨细胞。在某些实施方案中,修饰的细胞可以在细胞静止、处于激活状态、静息、处于分裂间期、处于分裂前期、处于分裂中期、处于分裂后期或处于分离末期时被修饰。在某些实施方案中,修饰的细胞可以是新鲜的、冷冻保存的、散装的(bulk)、分类为亚群、来自全血、来自白细胞去除术或来自永生化细胞系。
VCAR的生产和产生
如本领域众所周知的,至少一种本公开内容的VHH蛋白或VCAR可以任选地由细胞系、混合细胞系、永生化细胞或永生化细胞的克隆群体产生。参见,例如,Ausubel等人,编辑,Current Protocols in Molecular Biology,John Wiley&Sons,Inc.,NY,N.Y.(1987-2001);Sambrook等人,Molecular Cloning:A Laboratory Manual,第2版,Cold SpringHarbor,N.Y.(1989);Harlow和Lane,Antibodies,a Laboratory Manual,Cold SpringHarbor,N.Y.(1989);Colligan等人,编辑,Current Protocols in Immunology,JohnWiley&Sons,Inc.,NY(1994-2001);Colligan等人,Current Protocols in ProteinScience,John Wiley&Sons,NY,N.Y.,(1997-2001)。
可以改变、添加和/或去除VHH蛋白的氨基酸,以降低免疫原性或降低、增强或改变结合、亲和力、结合速率、解离速率、亲合力、特异性、半衰期、稳定性、溶解度或任何其他合适的特征,如本领域中已知的。
任选地,可以在保留对抗原的高亲和力和其他有利生物学性质的情况下对VHH蛋白进行工程化。为了实现这个目的,可以通过使用亲本和工程化序列的三维模型对亲本序列和各种概念上工程化的产品的分析过程,任选地制备VHH蛋白。三维模型是普遍可获得的,并且是本领域技术人员熟悉的。举例说明并展示所选择的候选序列的可能的三维构象结构,并且可以测量可能的免疫原性的计算机程序是可获得的(例如,Monrovia,Calif.的Xencor,Inc.的Immunofilter程序)。对这些展示的检查允许分析残基在候选序列的功能发挥中的可能作用,即,分析影响候选VHH蛋白结合其抗原的能力的残基。以此方式,可以从亲本和参考序列中选择残基并将其组合,从而获得所期望的特征,例如对一种或多种靶抗原的亲和力。替代地,或除上述程序以外,可以使用其他合适的工程化方法。
VHH蛋白的筛选
可以使用核苷酸(DNA或RNA展示)或肽展示文库,例如,体外展示,方便地实现筛选VHH与相似蛋白或片段的特异性结合。这个方法涉及针对具有所期望的功能或结构的各个成员筛选肽的大集合。展示的核苷酸或肽序列的长度可以是3至5000个或更多个核苷酸或氨基酸,常常长度为5-100个氨基酸,并且经常长度为约8-25个氨基酸。除了用于产生肽文库的直接化学合成方法以外,已经描述了几种重组DNA方法。一种类型涉及在噬菌体或细胞表面上展示肽序列。每个噬菌体或细胞均含有编码特定展示的肽序列的核苷酸序列。本公开内容的VHH蛋白可以以大范围的亲和力(KD)结合人或其他哺乳动物蛋白。在优选的实施方案中,至少一种本发明的VHH可任选地以高亲和力结合靶蛋白,例如,其KD等于或小于约10
VHH或VACR对抗原的亲和力或亲合力可以使用任何合适的方法通过实验测定。(参见,例如,Berzofsky等人,“Antibody-Antigen Interactions,”In FundamentalImmunology,Paul,W.E.,编辑,Raven Press:New York,N.Y.(1984);Kuby,JanisImmunology,W.H.Freeman and Company:New York,N.Y.(1992);和本文所述的方法)。如果在不同条件下(例如,盐浓度、pH)进行测量,则特定的VHH-抗原或VCAR-抗原相互作用的测量的亲和力可以变化。因此,亲和力和其他抗原结合参数(例如,KD、K
可以用本公开内容的VHH或VCAR进行竞争性测定,以确定什么蛋白、抗体和其他拮抗剂与本发明的VHH或VCAR竞争与靶蛋白的结合和/或共享表位区域。如本领域普通技术人员容易知道的,这些测定评价拮抗剂或配体之间对蛋白上有限数目的结合位点的竞争。在竞争之前或之后,将蛋白和/或抗体固定或使其不溶解,并且将与靶蛋白结合的样品与未结合的样品分开,例如,通过倾析(在使蛋白/抗体预先不溶解的场合)或通过离心(在蛋白/抗体在竞争性反应后沉淀的场合)。同样地,竞争性结合可以通过以下确定:功能的改变是通过VHH或VCAR与靶蛋白的结合还是不结合,例如,VCAR分子是抑制还是增强例如标记的酶促活性。如本领域众所周知的,可以使用ELISA和其他功能测定。
核酸分子
编码VHH蛋白或VCAR的本公开内容的核酸分子可以是RNA的形式,例如mRNA、hnRNA、tRNA或任何其他形式,或者可以是DNA的形式,包括,但不限于,通过克隆获得或合成产生的cDNA和基因组DNA,或其任何组合。DNA可以是三链的、双链的或单链的或其任何组合。DNA或RNA的至少一条链的任何部分都可以是编码链,也称为有义链,或者其可以是非编码链,也称为反义链。
本公开内容的分离的核酸分子可包括核酸分子,其包含任选地具有一个或多个内含子的可读框(ORF),例如,但不限于,至少一个VCAR的至少一个指定部分;核酸分子,其包含VACR的编码序列;和核酸分子,其包含与上述核苷酸序列显著不同的核苷酸序列,但是由于遗传密码的简并性,其仍编码如本文所述和/或如本领域已知的VACR。当然,遗传密码是本领域众所周知的。因此,产生这种编码本发明的特定VACR的简并核酸变体对于本领域技术人员而言将是常规的。参见,例如,Ausubel等人,上述,并且这种核酸变体包括在本发明中。
如本文所指出的,包含编码VACR的核酸的本公开内容的核酸分子可以包括,但不限于,其自身编码VHH片段的氨基酸序列的那些;整个VACR或其一部分的编码序列;VHH、片段或部分的编码序列以及额外序列,例如至少一种信号前导序列或融合肽的编码序列,其带有或不带有前述的额外编码序列,例如至少一个内含子,连同额外的非编码序列,包括但不限于非编码5′和3′序列,例如在转录、mRNA加工,包括剪接和多腺苷酸化信号(例如,mRNA的核糖体结合和稳定性)中起作用的转录的非翻译序列;编码额外氨基酸的额外编码序列,例如提供额外功能性的那些。因此,可以将编码VACR的序列与标记序列融合,所述标记序列例如编码促进包含VHH片段或部分的融合VACR的纯化的肽的序列。
与如本文所述的多核苷酸选择性杂交的多核苷酸
本公开内容提供了在选择性杂交条件下与本文公开的多核苷酸杂交的分离的核酸。因此,这个实施方案的多核苷酸可用于分离、检测和/或定量包含这种多核苷酸的核酸。例如,本发明的多核苷酸可用于鉴定、分离或扩增保藏的文库中的部分或全长克隆。在一些实施方案中,多核苷酸是分离自来自人或哺乳动物核酸文库的cDNA或以其他方式与其互补的基因组或cDNA序列。
优选地,cDNA文库包含至少80%的全长序列,优选地,至少85%或90%的全长序列,并且,更优选地,至少95%的全长序列。可以将cDNA文库标准化以增加稀有序列的表现度。低或中等严格杂交条件一般但不排他地与相对于互补序列具有降低的序列同一性的序列一起使用。对于更高同一性的序列,可以任选使用中等和高严格条件。低严格条件允许具有约70%序列同一性的序列的选择性杂交,并可用于鉴定直系同源或旁系同源序列。
任选地,本发明的多核苷酸将编码由本文所述的多核苷酸编码的VCAR的至少一部分。本发明的多核苷酸包括可用于与编码本发明的VCAR的多核苷酸选择性杂交的核酸序列。参见,例如,Ausubel,上述;Colligan,上述,各自通过引用整体并入本文。
核酸的构建
可以使用如本领域众所众所周知的(a)重组方法,(b)合成技术,(c)纯化技术和/或(d)其组合来制备本公开内容的分离的核酸。
核酸可以方便地包含除本发明的多核苷酸以外的序列。例如,可以将包含一个或多个内切核酸酶限制位点的多克隆位点插入核酸中以帮助分离多核苷酸。同样地,可插入可翻译序列以帮助分离本公开内容的翻译的多核苷酸。例如,六组氨酸标记序列提供了纯化本公开内容的蛋白的便利手段。除去编码序列,本公开内容的核酸任选地是用于克隆和/或表达本公开内容的多核苷酸的载体、衔接子或接头。
可以将额外的序列添加到这种克隆和/或表达序列中,以最优化它们在克隆和/或表达中的功能,以帮助多核苷酸的分离,或改善多核苷酸向细胞中的引入。克隆载体、表达载体、衔接子和接头的使用是本领域众所周知的。(参见,例如,Ausubel,上述;或Sambrook,上述)。
用于构建核酸的重组方法
可以使用本领域技术人员已知的许多克隆方法从生物学来源获得本公开内容的分离的核酸组合物,例如RNA、cDNA、基因组DNA或其任何组合。在一些实施方案中,在严格条件下与本发明的多核苷酸选择性杂交的寡核苷酸探针用于鉴定cDNA或基因组DNA文库中的所期望的序列。RNA的分离以及cDNA和基因组文库的构建是本领域普通技术人员众所周知的。(参见,例如,Ausubel,上述;或Sambrook,上述)。
核酸筛选和分离方法
可以基于本公开内容的多核苷酸的序列,使用探针来筛选cDNA或基因组文库。探针可用于与基因组DNA或cDNA序列杂交,以分离相同或不同生物中的同源基因。本领域技术人员将理解,可以在测定中采用各种程度的杂交严格性;且杂交或洗涤介质可以是严格的。随着杂交条件变得更加严格,探针和靶之间必须存在更大程度的互补性,以发生双链体形成。严格性程度可以通过温度、离子强度、pH和部分变性溶剂例如甲酰胺的存在中的一种或多种来控制。例如,可通过例如由在0%至50%范围内操纵甲酰胺的浓度改变反应物溶液的极性来方便地改变杂交的严格性。可检测的结合所需的互补性(序列同一性)程度将根据杂交介质和/或洗涤介质的严格性而变化。互补性程度将最佳为100%或70-100%,或其中的任何范围或值。然而,应该理解,可以通过降低杂交和/或洗涤介质的严格性来补偿探针和引物中较小的序列变化。
RNA或DNA的扩增方法在本领域中是众所周知的,并且可以基于本文给出的教导和指导,在没有过度的实验的情况下根据本公开内容使用。
DNA或RNA扩增的已知方法包括,但不限于,聚合酶链反应(PCR)和相关的扩增方法(参见,例如,美国专利号4,683,195、4,683,202、4,800,159、4,965,188,授予Mullis等人;4,795,699和4,921,794,授予Tabor等人;5,142,033,授予Innis;5,122,464,授予Wilson等人;5,091,310,授予Innis;5,066,584,授予Gyllensten等人;4,889,818,授予Gelfand等人;4,994,370,授予Silver等人;4,766,067,授予Biswas;4,656,134,授予Ringold)和RNA介导性扩增,其使用针对靶序列的反义RNA作为双链DNA合成的模板(美国专利号5,130,238,授予Malek等人,商品名为NASBA),所述参考文献的全部内容通过引用并入本文。(参见,例如,Ausubel,上述;或Sambrook,上述。)
例如,聚合酶链反应(PCR)技术可用于直接从基因组DNA或cDNA文库扩增本公开内容的多核苷酸和相关基因的序列。PCR和其他体外扩增方法也可能对例如克隆编码待表达的蛋白的核酸序列有用处,以使核酸用作探针,用于检测样品中所期望的mRNA的存在、用于核酸测序或用于其他目的。足以指导技术人员完成体外扩增方法的技术的实例在Berger,上述,Sambrook,上述,和Ausubel,上述,以及Mullis等人,美国专利号4,683,202(1987);和Innis等人,PCR Protocols A Guide to Methods and Applications,Eds.,AcademicPress Inc.,San Diego,Calif.(1990)中找到。用于基因组PCR扩增的可商购获得的试剂盒是本领域已知的。参见,例如,Advantage-GC基因组PCR试剂盒(Clontech)。另外,例如,T4基因32蛋白(Boehringer Mannheim)可用于提高长PCR产物的收率。
用于构建核酸的合成方法
还可以通过已知方法通过直接化学合成来制备本公开内容的分离的核酸(参见,例如,Ausubel等人,上述)。化学合成通常产生单链寡核苷酸,其可以通过与互补序列杂交或通过使用单链作为模板用DNA聚合酶聚合而转化为双链DNA。本领域技术人员将认识到,尽管DNA的化学合成可以限于约100个或更多个碱基的序列,但是通过连接较短的序列可以获得较长的序列。
重组表达盒
本公开内容进一步提供了包含本公开内容的核酸的重组表达盒。本公开内容的核酸序列,例如编码本公开内容的VCAR的cDNA或基因组序列,可以用于构建重组表达盒,其可以被引入至少一种所期望的宿主细胞中。重组表达盒一般将包含可操作地连接至转录起始调节序列的本公开内容的多核苷酸,所述转录起始调节序列将指导所述多核苷酸在预期宿主细胞中的转录。异源和非异源(即,内源)启动子两者均可用于指导本公开内容的核酸的表达。
在一些实施方案中,可以将用作启动子、增强子或其他元件的分离的核酸引入本公开内容的多核苷酸的非异源形式的适当位置(上游、下游或内含子中),以便上调或下调本公开内容的多核苷酸的表达。例如,可以通过突变、缺失和/或取代,体内或体外改变内源启动子。
纳米转座子
本公开内容提供了纳米转座子,其包含:(a)编码转座子插入物的序列,其包含编码第一反向末端重复序列(ITR)的序列、编码第二反向末端重复序列(ITR)的序列和ITR内序列;(b)编码主链的序列,其中编码主链的序列包含编码具有1至450个核苷酸(包括端点)的复制起点的序列和编码具有1至200个核苷酸(包括端点)的选择标记的序列;以及(c)ITR间序列。在一些实施方案中,(c)的ITR间序列包含(b)的序列。在一些实施方案中,(a)的ITR内序列包含(b)的序列。
在本公开内容的纳米转座子的一些实施方案中,编码主链的序列包含1至600个核苷酸,包括端点。在一些实施方案中,编码主链的序列由1至50个核苷酸、50至100个核苷酸、100至150个核苷酸、150至200个核苷酸、200至250个核苷酸、250至300个核苷酸、300至350个核苷酸、350至400个核苷酸、400至450个核苷酸、450至500个核苷酸、500至550个核苷酸、550至600个核苷酸组成,每个范围都包括端点。
在本公开内容的纳米转座子的一些实施方案中,ITR间序列包含1至1000个核苷酸,包括端点。在一些实施方案中,ITR间序列由1至50个核苷酸、50至100个核苷酸、100至150个核苷酸、150至200个核苷酸、200至250个核苷酸、250至300个核苷酸、300至350个核苷酸、350至400个核苷酸、400至450个核苷酸、450至500个核苷酸、500至550个核苷酸、550至600个核苷酸、600至650个核苷酸、650至700个核苷酸、700至750个核苷酸、750至800个核苷酸、800至850个核苷酸、850至900个核苷酸、900至950个核苷酸或950至1000个核苷酸组成,每个范围都包括端点。
在本公开内容的纳米转座子,包括本公开内容的短纳米转座子(SNT)的一些实施方案中,ITR间序列包含1至200个核苷酸,包括端点。在一些实施方案中,ITR间序列由1至10个核苷酸、10至20个核苷酸、20至30个核苷酸、30至40个核苷酸、40至50个核苷酸、50至60个核苷酸、60至70个核苷酸、70至80个核苷酸、80至90个核苷酸或90至100个核苷酸组成,每个范围都包括端点。
在本公开内容的纳米转座子的一些实施方案中,具有1至200个核苷酸(包括端点)的选择标记包含编码蔗糖选择标记的序列。在一些实施方案中,编码蔗糖选择标记的序列包含编码RNA-OUT序列的序列。在一些实施方案中,编码RNA-OUT序列的序列包含137个碱基对(bp)或由其组成。在一些实施方案中,具有1至200个核苷酸(包括端点)的选择标记包含编码荧光标记的序列。在一些实施方案中,具有1至200个核苷酸(包括端点)的选择标记包含编码细胞表面标记的序列。
在本公开内容的纳米转座子的一些实施方案中,编码具有1至450个核苷酸的复制起点的序列(包括端点)包含编码微型复制起点的序列。在一些实施方案中,编码具有1至450个核苷酸(包括端点)的复制起点的序列包含编码R6K复制起点的序列。在一些实施方案中,R6K复制起点包括R6Kγ复制起点。在一些实施方案中,R6K复制起点包括R6K微型复制起点。在一些实施方案中,R6K复制起点包括R6Kγ微型复制起点。在一些实施方案中,R6Kγ微型复制起点包含281个碱基对(bp)或由其组成。
在本公开内容的纳米转座子的一些实施方案中,编码主链的序列不包含重组位点、切除位点、连接位点或其组合。在一些实施方案中,纳米转座子和编码主链的序列均不包含重组位点、切除位点、连接位点或其组合的产物。在一些实施方案中,纳米转座子和编码主链的序列均不衍生自重组位点、切除位点、连接位点或其组合。
在本公开内容的纳米转座子的一些实施方案中,重组位点包含得自重组事件的序列。在一些实施方案中,重组位点包含作为重组事件的产物的序列。在一些实施方案中,重组事件包括重组酶的活性(例如,重组酶位点)。
在本公开内容的纳米转座子的一些实施方案中,编码主链的序列不进一步包含编码外源DNA的序列。
在本公开内容的纳米转座子的一些实施方案中,ITR间序列不包含重组位点、切除位点、连接位点或其组合。在一些实施方案中,ITR间序列不包含重组事件、切除事件、连接事件或其组合的产物。在一些实施方案中,ITR间序列不衍生自重组事件、切除事件、连接事件或其组合。
在本公开内容的纳米转座子的一些实施方案中,ITR间序列包含编码外源DNA的序列。
在本公开内容的纳米转座子的一些实施方案中,ITR内序列包含至少一个编码绝缘子的序列和编码能够在哺乳动物细胞中表达外源序列的启动子的序列。在一些实施方案中,哺乳动物细胞是人细胞。
在本公开内容的纳米转座子的一些实施方案中,ITR内序列包含编码绝缘子的第一序列、编码能够在哺乳动物细胞中表达外源序列的启动子的序列和编码绝缘子的第二序列。
在本公开内容的纳米转座子的一些实施方案中,ITR内序列包含编码绝缘子的第一序列、编码能够在哺乳动物细胞中表达外源序列的启动子的序列、多腺苷(polyA)序列和编码绝缘子的第二序列。
在本公开内容的纳米转座子的一些实施方案中,ITR内序列包含编码绝缘子的第一序列、编码能够在哺乳动物细胞中表达外源序列的启动子的序列、至少一个外源序列、多腺苷(polyA)序列和编码绝缘子的第二序列。
在本公开内容的纳米转座子的一些实施方案中,编码能够在哺乳动物细胞中表达外源序列的启动子的序列能够在人细胞中表达外源序列。在一些实施方案中,编码能够在哺乳动物细胞中表达外源序列的启动子的序列包含编码组成型启动子的序列。在一些实施方案中,编码能够在哺乳动物细胞中表达外源序列的启动子的序列包含编码诱导型启动子的序列。在一些实施方案中,ITR内序列包含编码能够在哺乳动物细胞中表达外源序列的第一启动子的第一序列和编码能够在哺乳动物细胞中表达外源序列的第二启动子的第二序列,其中第一启动子是组成型启动子,其中第二启动子是诱导型启动子,并且其中编码第一启动子的第一序列和编码第二启动子的第二序列以相反方向定向。在一些实施方案中,编码能够在哺乳动物细胞中表达外源序列的启动子的序列包含编码细胞类型或组织类型特异性启动子的序列。在一些实施方案中,编码能够在哺乳动物细胞中表达外源序列的启动子的序列包含编码EF1a启动子的序列、编码CMV启动子的序列、编码MND启动子的序列、编码SV40启动子的序列、编码PGK1启动子的序列、编码Ubc启动子的序列、编码CAG启动子的序列、编码H1启动子的序列或编码U6启动子的序列。
在本公开内容的纳米转座子的一些实施方案中,多腺苷(polyA)序列分离或衍生自病毒polyA序列。在一些实施方案中,多腺苷(polyA)序列分离或衍生自(SV40)polyA序列。
在本公开内容的纳米转座子的一些实施方案中,至少一个外源序列包含诱导型促凋亡多肽。在一些实施方案中,诱导型胱天蛋白酶多肽包含(a)配体结合区、(b)接头和(c)胱天蛋白酶多肽,其中诱导型促凋亡多肽不包含非人序列。在一些实施方案中,诱导型胱天蛋白酶多肽包含(a)配体结合区、(b)接头和(c)截短的胱天蛋白酶9多肽,其中诱导型凋亡蛋白多肽不包含非人序列。
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型促凋亡多肽的那些中,配体结合区包含FK506结合蛋白12(FKBP12)多肽。在一些实施方案中,配体结合区的氨基酸序列包含FK506结合蛋白12(FKBP12)多肽。在一些实施方案中,FK506结合蛋白12(FKBP12)多肽包含在序列的位置36的修饰。在一些实施方案中,修饰包括缬氨酸(V)对位置36的苯丙氨酸(F)的取代(F36V)。在一些实施方案中,FKBP12多肽由包含
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型促凋亡多肽的那些中,接头区由包含GGGGS(SEQ ID NO:14637)的氨基酸或包含GGAGGAGGAGGATCC(SEQ ID NO:14638)的核酸序列编码。在一些实施方案中,编码接头的核酸序列不包含限制位点。
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型促凋亡多肽的那些中,截短的胱天蛋白酶9多肽由在序列的位置87不包含精氨酸(R)的氨基酸序列编码。在一些实施方案中,截短的胱天蛋白酶9多肽由在序列的位置282不包含丙氨酸(A)的氨基酸序列编码。在一些实施方案中,截短的胱天蛋白酶9多肽由包含以下序列的氨基酸编码:
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型促凋亡多肽的那些中,诱导型促凋亡多肽由包含以下序列的氨基酸序列编码:
在一些实施方案中,诱导型促凋亡多肽由包含以下序列的核酸序列编码:
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型促凋亡多肽的那些中,外源序列进一步包含编码选择标记的序列。在一些实施方案中,编码选择标记的序列包括编码可检测标记的序列。在一些实施方案中,可检测标记包括荧光标记或细胞表面标记。在一些实施方案中,编码选择标记的序列包括编码在分裂细胞中有活性而在非分裂细胞中无活性的蛋白的序列。在一些实施方案中,编码选择标记的序列包括编码代谢标记的序列。在一些实施方案中,编码选择标记的序列包括编码二氢叶酸还原酶(DHFR)突变蛋白酶的序列。在一些实施方案中,DHFR突变蛋白酶包含以下氨基酸序列或由其组成:
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型凋亡多肽和/或外源序列包含编码选择标记的序列的那些中,外源序列进一步包含编码非天然存在的抗原受体的序列和/或编码治疗性多肽的序列。在一些实施方案中,非天然存在的抗原受体包括T细胞受体(TCR)。在一些实施方案中,与相应的野生型序列相比,编码TCR的序列包含插入、缺失、取代、倒位、转座或移码中的一种或多种。在一些实施方案中,编码TCR的序列包含嵌合或重组序列。在一些实施方案中,非天然存在的抗原受体包括嵌合抗原受体(CAR)。在一些实施方案中,CAR包含:(a)包含抗原识别区的胞外域、(b)跨膜结构域,和(c)包含至少一个共刺激结构域的胞内域。在一些实施方案中,CAR的(a)的胞外域进一步包含信号肽。在一些实施方案中,CAR的(a)的胞外域进一步包含抗原识别区和跨膜结构域之间的铰链。在一些实施方案中,胞内域包含人CD3ζ胞内域。在一些实施方案中,至少一个共刺激结构域包括人4-1BB、CD28、CD40、ICOS、MyD88、OX-40细胞内区段或其任何组合。在一些实施方案中,至少一个共刺激结构域包括人CD28和/或4-1BB共刺激结构域。在一些实施方案中,抗原识别区包括scFv、VHH、VH和Centyrin中的一种或多种。
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型凋亡多肽和/或外源序列包含编码选择标记的序列的那些中,外源序列进一步包含编码转座酶的序列。
在本公开内容的纳米转座子的一些实施方案中,ITR内序列包含编码选择标记的序列、外源序列、编码诱导型胱天蛋白酶多肽的序列和至少一个编码自我切割肽的序列。在一些实施方案中,至少一个编码自我切割肽的序列位于以下一个或多个之间:(a)编码选择标记的序列和外源序列、(b)编码选择标记的序列和诱导型胱天蛋白酶,和(c)外源序列和诱导型胱天蛋白酶多肽。在一些实施方案中,编码自我切割肽的第一序列位于编码选择标记的序列与外源序列之间,并且编码自我切割肽的第二序列位于外源序列与诱导型胱天蛋白酶多肽之间。
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型促凋亡多肽、编码选择标记的序列和外源序列中的一种或多种的那些中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列被piggyBac转座酶或piggyBac样转座酶识别。在一些实施方案中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列被piggyBac转座酶识别。在一些实施方案中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列被piggyBac样转座酶识别。在一些实施方案中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列包含TTAA、TTAT或TTAX识别序列。在一些实施方案中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列包含TTAA、TTAT或TTAX识别序列以及与分离或衍生自piggyBac转座酶或piggyBac样转座酶的序列具有至少50%同一性的序列。在一些实施方案中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列包含至少2个核苷酸(nt)、3nt、4nt、5nt、6nt、7nt、8nt、9nt、10nt、11nt、12nt、13nt、14nt、15nt、16nt、17nt、18nt、19nt或20nt。
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型促凋亡多肽、编码选择标记的序列和外源序列中的一种或多种的那些中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列被piggyBac转座酶或piggyBac样转座酶识别。在一些实施方案中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列包含CCCTAGAAAGATAGTCTGCGTAAAATTGACGCATG(SEQ ID NO:17096)的序列或与CCCTAGAAAGATAGTCTGCGTAAAATTGACGCATG(SEQ ID NO:17096)的序列具有至少70%同一性的序列。在一些实施方案中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列包含CCCTAGAAAGATAATCATATTGTGACGTACGTTAAAGATAATCATGCGTAAAATTGACGCATG(SEQ ID NO:17097)的序列。在一些实施方案中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列包含CCCTAGAAAGATAGTCTGCGTAAAATTGACGCATG(SEQ ID NO:17096)的序列并且包含CCCTAGAAAGATAATCATATTGTGACGTACGTTAAAGATAATCATGCGTAAAATTGACGCATG(SEQ ID NO:17097)的序列。在一些实施方案中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列包含CCCTAGAAAGATAGTCTGCGTAAAATTGACGCATG(SEQ ID NO:17096)的序列并且包含CCCTAGAAAGATAATCATATTGTGACGTACGTTAAAGATAATCATGTGTAAAATTGACGCATG(SEQID NO:17098)的序列。在一些实施方案中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列包含CCCTAGAAAGATAGTCTGCGTAAAATTGACGCATG(SEQ IDNO:17096)的序列并且包含TTAACCCTAGAAAGATAATCATATTGTGACGTACGTTAAAGATAATCATGTGTAAAATTGACGCATGTGTTTTATCGGTCTGTATATCGAGGTTTATTTATTAATTTGAATAGATATTAAGTTTTATTATATTTACACTTACATACTAATAATAAATTCAACAAACAATTTATTTATGTTTATTTATTTATTAAAAAAAACAAAAACTCAAAATTTCTTCTATAAAGTAACAAAACTTTTA(SEQ ID NO:17099)的序列。
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型促凋亡多肽、编码选择标记的序列和外源序列中的一种或多种的那些中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列被piggyBac转座酶或piggyBac样转座酶识别。在一些实施方案中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列被piggyBac转座酶识别,所述piggyBac转座酶具有与以下氨基酸序列具有至少20%同一性的氨基酸序列:
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型促凋亡多肽、编码选择标记的序列和外源序列中的一种或多种的那些中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列被SleepingBeauty转座酶识别。在一些实施方案中,Sleeping Beauty转座酶是高活性SleepingBeauty转座酶(SB100X)。
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型促凋亡多肽、编码选择标记的序列和外源序列中的一种或多种的那些中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列被Helitron转座酶识别。
在本公开内容的纳米转座子的一些实施方案,包括其中至少一个外源序列包含诱导型促凋亡多肽、编码选择标记的序列和外源序列中的一种或多种的那些中,编码第一反向末端重复序列(ITR)的序列或编码第二反向末端重复序列(ITR)的序列被Tol2转座酶识别。
本公开内容提供了包含本公开内容的纳米转座子的细胞。在一些实施方案中,细胞进一步包含转座酶组合物。在一些实施方案中,转座酶组合物包含能够识别纳米转座子的第一ITR或第二ITR的转座酶或编码该转座酶的序列。在一些实施方案中,转座酶组合物包含纳米转座子,其包含编码转座酶的序列。在一些实施方案中,细胞包含含有外源序列的第一纳米转座子和包含编码转座酶的序列的第二纳米转座子。在一些实施方案中,细胞是同种异体细胞。
本公开内容提供了包含本公开内容的纳米转座子的组合物。
本公开内容提供了包含本公开内容的细胞的组合物。在一些实施方案中,细胞包含本公开内容的纳米转座子。在一些实施方案中,不对细胞进行进一步修饰。在一些实施方案中,细胞是同种异体的。
本公开内容提供了包含本公开内容的细胞的组合物。在一些实施方案中,细胞包含本公开内容的纳米转座子。在一些实施方案中,不对细胞进行进一步修饰。在一些实施方案中,细胞是自体的。
本公开内容提供了包含多个本公开内容的细胞的组合物。在一些实施方案中,多个细胞中的至少一个细胞包含本公开内容的纳米转座子。在一些实施方案中,多个细胞的一部分包含本公开内容的纳米转座子。在一些实施方案中,该部分包含多个细胞的至少1%、2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、97%、99%或其间的任何百分比。在一些实施方案中,多个细胞中的每个细胞包含本公开内容的纳米转座子。在一些实施方案中,多个细胞不包含本公开内容的修饰的细胞。在一些实施方案中,多个细胞中的至少一个细胞未被进一步修饰。在一些实施方案中,多个细胞中的任何一个都不被进一步修饰。在一些实施方案中,多个细胞是同种异体的。在一些实施方案中,根据本公开内容的方法生产同种异体的多个细胞。在一些实施方案中,多个细胞是自体的。在一些实施方案中,根据本公开内容的方法生产自体的多个细胞。
本公开内容提供了修饰的细胞,其包含:(a)本公开内容的纳米转座子;(b)编码诱导型促凋亡多肽的序列;并且其中细胞是T细胞;(c)编码T细胞受体(TCR)的内源序列的修饰,其中该修饰降低或消除了TCR的表达或活性水平。在一些实施方案中,细胞进一步包含:(d)包含一种HLA I类组织相容性抗原,即α链E(HLA-E)的非天然存在的序列,和(e)编码β-2微球蛋白(B2M)的内源序列的修饰,其中该修饰降低或消除了主要组织相容性复合体(MHC)I类(MHC-1)的表达或活性水平。
本公开内容提供了修饰的细胞,其包含:(a)本公开内容的纳米转座子;(b)编码诱导型促凋亡多肽的序列;(c)包含一种HLA I类组织相容性抗原,即α链E(HLA-E)的非天然存在的序列,和(e)编码β-2-微球蛋白(B2M)的内源序列的修饰,其中该修饰降低或消除了主要组织相容性复合体(MHC)I类(MHC-I)的表达或活性水平。
在本公开内容的修饰的细胞的一些实施方案中,包含HLA-E的非天然存在的序列进一步包含编码B2M信号肽的序列。在一些实施方案中,包含HLA-E的非天然存在的序列进一步包含接头,其中接头位于编码B2M多肽的序列的编码序列与编码HLA-E的序列之间。在一些实施方案中,包含HLA-E的非天然存在的序列进一步包含编码肽的序列和编码B2M多肽的序列。在一些实施方案中,包含HLA-E的非天然存在的序列进一步包含位于编码B2M信号肽的序列与编码肽的序列之间的第一接头,以及位于编码B2M多肽的序列与编码HLA-E的序列之间的第二接头。
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,细胞是哺乳动物细胞。
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,细胞是人细胞。
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,细胞是干细胞。
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,细胞是分化的细胞。
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,细胞是体细胞。
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,细胞是免疫细胞或免疫细胞前体。在一些实施方案中,免疫细胞是淋巴祖细胞、天然杀伤(NK)细胞、细胞因子诱导的杀伤(CIK)细胞、T淋巴细胞(T细胞)、B淋巴细胞(B细胞)或抗原呈递细胞(APC)。在一些实施方案中,免疫细胞是T细胞、早期记忆T细胞、干细胞样T细胞、干记忆T细胞(Tscm)或中央记忆T细胞(Tcm)。在一些实施方案中,免疫细胞前体是造血干细胞(HSC)。在一些实施方案中,细胞是抗原呈递细胞(APC)。
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,细胞进一步包含基因编辑组合物。在一些实施方案中,基因编辑组合物包含编码DNA结合结构域的序列和编码核酸酶蛋白或其核酸酶结构域的序列。在一些实施方案中,基因编辑组合物包含编码核酸酶蛋白的序列或编码其核酸酶结构域的序列。在一些实施方案中,编码核酸酶蛋白的序列或编码其核酸酶结构域的序列包括DNA序列、RNA序列或其组合。在一些实施方案中,核酸酶或其核酸酶结构域包括CRISPR/Cas蛋白、转录激活蛋白样效应物核酸酶(TALEN)、锌指核酸酶(ZFN)和内切核酸酶中的一种或多种。在一些实施方案中,CRISPR/Cas蛋白包括核酸酶灭活的Cas(dCas)蛋白。
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,细胞进一步包含基因编辑组合物。在一些实施方案中,基因编辑组合物包含编码DNA结合结构域的序列和编码核酸酶蛋白或其核酸酶结构域的序列。在一些实施方案中,核酸酶或其核酸酶结构域包括核酸酶灭活的Cas(dCas)蛋白和内切核酸酶。在一些实施方案中,内切核酸酶包括Clo051核酸酶或其核酸酶结构域。在一些实施方案中,基因编辑组合物包含融合蛋白。在一些实施方案中,融合蛋白包括核酸酶灭活的Cas9(dCas9)蛋白和Clo051核酸酶或Clo051核酸酶结构域。在一些实施方案中,基因编辑组合物进一步包含向导序列。在一些实施方案中,向导序列包含RNA序列。在一些实施方案中,融合蛋白包含以下氨基酸序列或由其组成:
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,纳米转座子包含基因编辑组合物,其包含向导序列和编码融合蛋白的序列,所述融合蛋白包含编码灭活的Cas9(dCas9)的序列和编码Clo051核酸酶或其核酸酶结构域的序列。
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,细胞瞬时表达基因编辑组合物。
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,细胞是T细胞,并且向导RNA包含与编码内源TCR的靶序列互补的序列。在一些实施方案中,向导RNA包含与编码B2M多肽的靶序列互补的序列。
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,向导RNA包含与基因组DNA序列的安全港位点内的靶序列互补的序列。
在本公开内容的细胞、未修饰的细胞和修饰的细胞的一些实施方案中,Clo051核酸酶或其核酸酶结构域诱导靶序列中的单链或双链断裂。在一些实施方案中,供体序列、供体质粒或供体纳米转座子ITR内序列整合在靶序列内的单链或双链断裂的位置和/或细胞修复的位置。
本公开内容提供了包含根据本公开内容的修饰的细胞的组合物。在一些实施方案中,组合物进一步包含药学可接受的载体。
本公开内容提供了包含多个根据本公开内容的修饰的细胞的组合物。在一些实施方案中,所述组合物进一步包含药学可接受的载体。
本公开内容提供了用于治疗疾病或病症的本公开内容的组合物。
本公开内容提供了本公开内容的组合物用于治疗疾病或病症的用途。
本公开内容提供了治疗疾病或病症的方法,包括给有需要的受试者施用治疗有效量的本公开内容的组合物。在一些实施方案中,受试者在施用组合物后不发生移植物抗宿主(GvH)和/或宿主抗移植物(HvG)。在一些实施方案中,施用是全身性的。在一些实施方案中,组合物通过静脉内途径施用。在一些实施方案中,组合物通过静脉内注射或静脉内输注施用。
本公开内容提供了治疗疾病或病症的方法,包括给有需要的受试者施用治疗有效量的本公开内容的组合物。在一些实施方案中,受试者在施用组合物后不发生移植物抗宿主(GvH)和/或宿主抗移植物(HvG)。在一些实施方案中,施用是局部的。在一些实施方案中,通过肿瘤内途径、脊柱内途径、脑室内途径、眼内途径或骨内途径施用组合物。在一些实施方案中,通过肿瘤内注射或输注、脊柱内注射或输注、脑室内注射或输注、眼内注射或输注或骨内注射或输注施用组合物。
在本公开内容的治疗疾病或病症的方法的一些实施方案中,治疗有效剂量是单剂量,并且其中组合物的同种异体细胞移植和/或持续足够的时间来治疗疾病或病症。在一些实施方案中,单剂量是同时制备的至少2、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100或其间任何数目的剂量之一。
在本公开内容的治疗疾病或病症的方法的一些实施方案中,治疗有效剂量是单剂量,并且其中组合物的自体细胞移植和/或持续足够的时间来治疗疾病或病症。在一些实施方案中,单剂量是同时制备的至少2、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100或其间任何数目的剂量之一。
在本公开内容的组合物和方法的一些实施方案中,同种异体细胞是干细胞。在一些实施方案中,同种异体细胞衍生自干细胞。示例性干细胞包括但不限于胚胎干细胞、成体干细胞,诱导的多能干细胞(iPSC)、多能干细胞(multipotent stem cell)、多能干细胞(pluripotent stem cell)和造血干细胞(HSC)。
在本公开内容的组合物和方法的一些实施方案中,同种异体细胞是分化的体细胞。
在本公开内容的组合物和方法的一些实施方案中,同种异体细胞是免疫细胞。在一些实施方案中,同种异体细胞是T淋巴细胞(T细胞)。在一些实施方案中,同种异体细胞是不表达天然存在的T细胞受体(TCR)的一种或多种成分的T细胞。在一些实施方案中,同种异体细胞是表达非天然存在的抗原受体的T细胞。替代地或额外地,在一些实施方案中,同种异体细胞是表达非天然存在的嵌合刺激受体(CSR)的T细胞。在一些实施方案中,非天然存在的CSR包含转换受体或由转换受体组成。在一些实施方案中,转换受体包含细胞外结构域、跨膜结构域和细胞内结构域。在一些实施方案中,转换受体的细胞外结构域与TCR共刺激分子结合并将信号转导至同种异体细胞的细胞内空间,该细胞概括了TCR信号传导或TCR共刺激信号传导。
嵌合刺激受体(CSR)
对于给任何患者施用来说“普遍”安全的过继细胞组合物要求显著减少或消除同种异体反应性。
为此,本公开内容的同种异体细胞被修饰以中断T细胞受体(TCR)和/或一类主要组织相容性复合体(MHC)的表达或功能。TCR介导移植物抗宿主(GvH)反应,而MHC介导宿主抗移植物(HvG)反应。在优选的实施方案中,在本公开内容的同种异体细胞中消除了TCR的任何表达和/或功能,以防止可能引起受试者死亡的T细胞介导的GvH。因此,在特别优选的实施方案中,本公开内容提供了纯的TCR阴性的同种异体T细胞组合物(例如,该组合物的每个细胞以低至不可检测或不存在的水平表达)。
在优选的实施方案中,在本公开内容的同种异体细胞中减少或消除MHCI类(MHC-1,特别是HLA-A、HLA-B和HLA-C)的表达和/或功能,以防止HvG,并且因此,以改进本公开内容的同种异体细胞在受试者中的移植。本公开内容的同种异体细胞的改进的移植导致细胞的更长的持久性,并因此导致受试者更大的治疗窗口。具体地,在本公开内容的同种异体细胞中,MHC-1的结构元件β-2-微球蛋白(B2M)的表达和/或功能在本公开内容的同种异体细胞中减少或消除。
用于产生本公开内容的同种异体细胞的以上策略引发了进一步的挑战。T细胞中的T细胞受体(TCR)敲除(KO)导致作为TCR复合体的一部分的CD3-zeta(CD3z或CD3ζ)的表达丧失。TCR-KO T细胞中CD3ζ的丧失极大地降低了使用标准刺激/激活试剂(包括但不限于激动剂抗CD3mAb)最优地激活和扩增这些细胞的能力。当TCR复合体的任何一种成分的表达或功能被中断时,复合体的所有成分都会丧失,包括TCR-alpha(TCRα)、TCR-beta(TCRβ)、CD3-gamma(CD3g)、CD3-epsilon(CD3ε)、CD3-delta(CD3δ)和CD3-zeta(CD3ζ)。CD3ε和CD3ζ都是T细胞激活和扩增所需的。激动剂抗CD3mAb通常识别复合体内的CD3ε和可能的另一种蛋白,其进而向CD3ζ传导信号。CD3ζ提供T细胞激活的初级刺激(以及次级共刺激信号),以实现最优激活和扩增。在正常情况下,完整的T细胞激活取决于TCR的结合以及由一种或多种共刺激受体(例如CD28、CD2、4-1BBL等)介导的第二信号,其增强免疫反应。但是,当不存在TCR时,当使用标准的激活/刺激试剂(包括激动剂抗CD3mAb)进行刺激时,T细胞的扩增会严重减少。实际上,当使用标准的激活/刺激试剂(包括激动剂抗CD3mAb)进行刺激时,T细胞扩增减少至仅仅为正常扩增水平的20-40%。
本公开内容提供了嵌合刺激受体(CSR),以便在使用标准激活/刺激试剂(包括激动剂抗CD3mAb)刺激时,在不存在内源TCR(并且因此不存在内源CD3ζ)的情况下向同种异体T细胞递送CD3z初级刺激。
在不存在内源TCR的情况下,本公开内容的嵌合刺激受体(CSR)提供了CD3ζ刺激以增强同种异体T细胞的激活和扩增。换句话说,在不存在内源TCR的情况下,当与表达内源TCR的非同种异体T细胞相比时,本公开内容的嵌合刺激受体(CSR)将同种异体细胞从基于激活的缺点中拯救出来。在一些实施方案中,本公开内容的CSR在细胞外包含激动剂mAb表位和在细胞内包含CD3ζ刺激结构域,并且在经修饰以表达CSR的同种异体T细胞中,在功能上将表面上的抗CD28或抗CD2结合事件转化为CD3z信号传导事件。在一些实施方案中,CSR包含野生型CD28或CD2蛋白和CD3z细胞内刺激结构域,以分别产生CD28z CSR和CD2z CSR。在优选的实施方案中,CD28z CSR和/或CD2z CSR进一步表达非天然存在的抗原受体和/或治疗性蛋白。在优选的实施方案中,非天然存在的抗原受体包含嵌合抗原受体。
本文提供的数据证明,与不包含/表达本公开内容的CSR的那些细胞相比,包含/表达本公开内容的CSR的本公开内容的修饰的同种异体T细胞改进或拯救了不再表达内源TCR的同种异体T细胞的扩增。
内源性TCR敲除
本公开内容的基因编辑组合物,包括但不限于包含dCas9-Clo051的RNA为向导的融合蛋白,可以用于靶向和减少或消除本公开内容的同种异体细胞的内源性T细胞受体的表达。在优选的实施方案中,本公开内容的基因编辑组合物靶向并去除编码本公开内容的同种异体细胞的内源性T细胞受体的基因、基因的部分或基因的调控元件(例如启动子)。
表10中提供了用于生成用于靶向和去除TCR-alpha(TCR-α)的向导RNA(gRNA)模板的引物(包括T7启动子、基因组靶序列和gRNA支架)的非限制性实例。
表10.加下划线的靶序列
表11中提供了用于生成用于靶向和去除TCR-beta(TCR-β)的向导RNA(gRNA)模板的引物的非限制性实例。
表11.加下划线的靶序列
表12中提供了用于生成用于靶向和去除β-2-微管蛋白(β2M)的向导RNA(gRNA)模板的引物的非限制性实例。
表12.加下划线的靶序列
内源性MHC敲除
本公开内容的基因编辑组合物,包括但不限于包含dCas9-Clo051的RNA为向导的融合蛋白,可以用于靶向和减少或消除本公开内容的同种异体细胞的内源性MHCI、MHCII或MHC激活蛋白的表达。在优选的实施方案中,本公开内容的基因编辑组合物靶向并去除编码本公开内容的同种异体细胞的内源性内源性MHCI、MHCII或MHC激活蛋白的一种或多种成分的基因、基因的部分或基因的调控元件(例如启动子)。
表13和14中提供了用于靶向和去除MHC激活蛋白的向导RNA(gRNA)的非限制性实例。
表13.
工程化的HLA-E组合物
MHCI基因敲除(KO)使细胞抗T细胞杀伤,但也使它们易受天然杀伤(NK)细胞介导的细胞毒性作用影响(“丢失自我假设(Missing-self Hypothesis)”)(参见图23)。假设NK排斥将在诸如同种异体(allo)CAR-T治疗的治疗环境中降低这些KO细胞的体内功效和/或持久性。如在经典混合淋巴细胞反应(MLR)实验中观察到的,将MHCI保留在同种异体CAR-T细胞表面上会使它们易于被宿主T细胞杀死。据估计,一个人的T细胞中多达10%对外源MHC是特异性的,这会介导外源细胞和组织的排斥。MHCI,特别是HLA-A、B和C的靶向KO(其可以通过B2M的靶向KO实现)导致额外HLA分子(包括HLA-E)的丧失。例如,HLA-E的丧失由于“丢失自我假设”,使KO细胞更容易受到NK细胞介导的细胞毒性的影响。针对丢失自我细胞的NK介导的细胞毒性是针对病原体的防御机制,所述病原体下调受感染细胞表面的MHC,从而逃避了适应性免疫系统的细胞的检测和杀伤。
本公开内容考虑了两种策略来工程化对NK细胞介导的细胞毒性更具抗性的同种异体(MHCI-neg)T细胞(包括CAR-T细胞)。在一些实施方案中,将编码减少或防止NK杀伤的分子(例如单链HLA-E)的序列引入或递送至同种异体细胞。替代地或额外地,本公开内容的基因编辑方法保留某些内源性HLA分子(例如内源性HLA-E)。例如,第一种方法涉及将单链(sc)HLA-E分子用piggyBac(PB)递送到B2M KO T细胞。
第二种方法使用具有向导RNA的基因编辑组合物,该向导RNA对HLA-A、HLA-B和HLA-C有选择性,但对例如HLA-E或其他分子(其针对天然杀伤细胞介导的细胞毒性保护MHCI KO细胞)没有选择性。
HLA-E(其针对NK细胞介导的细胞毒性具有保护作用)的替代或额外分子包括但不限于干扰素α/β受体1(IFNAR1)、人IFNAR1、干扰素α/β受体2(IFNAR2)、人IFNAR2、HLA-G1、HLA-G2、HLA-G3、HLA-G4、HLA-G5、HLA-G6、HLA-G7、人癌胚抗原相关细胞粘附分子1(CEACAM1)、病毒血凝素、CD48、LLT1(也称为C型凝集素结构域家族2成员(CLC2D))、ULBP2、ULBP3和sMICA或其变体。
本公开内容的示例性INFAR1蛋白包含以下氨基酸序列或由其组成(
本公开内容的示例性INFAR2蛋白包含以下氨基酸序列或由其组成(
本公开内容的示例性HLA-G1蛋白包含以下氨基酸序列或由其组成(α链1,α链2,
本公开内容的示例性HLA-G2蛋白包含以下氨基酸序列或由其组成(α链1,α链2,
本公开内容的示例性HLA-G3蛋白包含以下氨基酸序列或由其组成(α链1,α链2,
本公开内容的示例性HLA-G4蛋白包含以下氨基酸序列或由其组成(α链1,α链2,
本公开内容的示例性HLA-G5蛋白包含以下氨基酸序列或由其组成(α链1,α链2,
本公开内容的示例性HLA-G5蛋白包含以下氨基酸序列或由其组成(α链1,α链2,
本公开内容的示例性HLA-G5蛋白包含以下氨基酸序列或由其组成(α链1,α链2,
本公开内容的示例性蛋白CEACAM1包含以下氨基酸序列或由其组成(细胞外,TM,
本公开内容的示例性血凝素蛋白包含以下氨基酸序列或由其组成(甲型流感病毒的HA(A/NewCaledonia/20/1999(H1N1);TM):
本公开内容的示例性CD48蛋白包含以下氨基酸序列或由其组成(
本公开内容的示例性LLT1蛋白包含以下氨基酸序列或由其组成(细胞质,TM,
本公开内容的示例性ULBP2蛋白包含以下氨基酸序列或由其组成(也称作NKG2D配体;Genbank检索号AAQ89028):
本公开内容的示例性ULBP3蛋白包含以下氨基酸序列或由其组成(也称作NKG2D配体;Genbank检索号NP_078794):
本公开内容的示例性sMICA蛋白包含以下氨基酸序列或由其组成(
本公开内容的示例性sMICA蛋白包含以下氨基酸序列或由其组成(
本公开内容的示例性sMICA蛋白包含以下氨基酸序列或由其组成(信号肽;
本公开内容的示例性sMICA蛋白包含以下氨基酸序列或由其组成(信号肽):
本公开内容的示例性bGBE三聚体(
本公开内容的示例性bGBE三聚体(
本公开内容的示例性bGBE三聚体(
本公开内容的示例性bGBE三聚体(
本公开内容的示例性gBE二聚体(
本公开内容的示例性gBE二聚体(
本公开内容的示例性gBE二聚体(
本公开内容的示例性gBE二聚体(
本公开内容的示例性WT HLA-E单体(
本公开内容的示例性WT HLA-E单体(
本公开内容的示例性WT HLA-E单体(
本公开内容的示例性WT HLA-E单体(
载体和宿主细胞
本公开内容还涉及包括本公开内容的分离的核酸分子的载体、用重组载体基因工程化的宿主细胞,以及至少一个VHH或VCAR通过如本领域所众所周知的重组技术的生产。参见,例如,Sambrook等人,上述;Ausubel等人,上述,各自整体引入本文作为参考。
例如,可以使用PB-EF1a载体。载体包含以下核苷酸序列:
可以将多核苷酸任选地连接至用于在宿主中繁殖的含有选择标记的载体。通常,将质粒载体引入沉淀物,例如磷酸钙沉淀物中,或与荷电脂质的复合体中。如果载体是病毒,则其可以使用适当的包装细胞系体外包装,且然后转导到宿主细胞中。
DNA插入片段应与适当的启动子可操作地连接。表达构建体将进一步含有用于转录起始、终止的位点,并且在转录的区域中,含有用于翻译的核糖体结合位点。由构建体表达的成熟转录物的编码部分将优选包括在开始处的翻译起始和在待翻译的mRNA的末端适当地定位的终止密码子(例如,UAA、UGA或UAG),而UAA和UAG优选用于哺乳动物或真核细胞表达。
表达载体将优选但任选地包括至少一种选择标记。这种标记包括,例如,但不限于,用于真核细胞培养的氨苄青霉素,zeocin(Sh bla基因),嘌呤霉素(pac基因),潮霉素B(hygB基因),G418/遗传霉素(neo基因),霉酚酸或谷氨酰胺合成酶(GS,美国专利号5,122,464;5,770,359;5,827,739),杀稻瘟素(bsd基因)抗性基因以及用于在大肠杆菌和其他细菌或原核生物中培养的氨苄青霉素,zeocin(Sh bla基因),嘌呤霉素(pac基因),潮霉素B(hygB基因),G418/遗传霉素(neo基因),卡那霉素,壮观霉素,链霉素,羧苄青霉素,博来霉素,红霉素,多黏菌素B或四环素抗性基因(上述专利通过引用整体并入本文)。用于上述宿主细胞的合适的培养基和条件是本领域已知的。合适的载体对技术人员将是显而易见的。可通过磷酸钙转染、DEAE-葡聚糖介导的转染、阳离子脂质介导的转染、电穿孔、转导、感染或其他已知方法实现载体构建体到宿主细胞中的引入。这种方法在本领域中进行了描述,例如Sambrook,上述,第1-4章和第16-18章;Ausubel,上述,第1、9、13、15、16章。
表达载体将优选但任选地包括至少一种选择性细胞表面标记,用于分离被本公开内容的组合物和方法修饰的细胞。本公开内容的选择性细胞表面标记包括表面蛋白、糖蛋白或蛋白的组,其将细胞或细胞亚群与另一种确定的细胞亚群区别开。优选地,选择性细胞表面标记将通过本公开内容的组合物或方法修饰的那些细胞与未通过本公开内容的组合物或方法修饰的那些细胞区别开。这种细胞表面标记包括,例如,但不限于,“命名簇(cluster of designation)”或“分类决定簇(classification determinant)”蛋白(经常缩写为“CD”),例如截短或全长形式的CD19、CD271、CD34、CD22、CD20、CD33、CD52或其任何组合。细胞表面标记进一步包括自杀基因标记RQR8(Philip B等人,Blood.2014年8月21日;124(8):1277-87)。
表达载体将优选但任选地包括至少一种选择性抗药性标记,用于分离被本公开内容的组合物和方法修饰的细胞。本公开内容的选择性抗药性标记可以包括野生型或突变的Neo、DHFR、TYMS、FRANCF、RAD51C、GCS、MDR1、ALDH1、NKX2.2或其任何组合。
至少一个本公开内容的VHH或VCAR可以以修饰的形式(例如融合蛋白)表达,并且不仅可以包括分泌信号,而且可以包括额外的异源功能区。例如,可以向VHH或VCAR的N-末端添加额外的氨基酸特别是荷电氨基酸的区域,以改善在纯化过程中或在后来的处理和贮藏过程中在宿主细胞中的稳定性和持久性。同样地,可以将肽部分添加到本公开内容的VHH或VCAR中以促进纯化。可以在最终制备VHH或VCAR或其至少一个片段之前除去这种区域。这种方法在许多标准实验室手册,例如Sambrook,上述,第17.29-17.42和18.1-18.74章;Ausubel,上述,第16、17和18章中进行了描述。
本领域普通技术人员充分了解可用于表达编码本公开内容的蛋白的核酸的众多表达系统。替代地,可以通过在含有编码本公开内容的VHH或VCAR的内源DNA的宿主细胞中启动(通过操纵),来在宿主细胞中表达本公开内容的核酸。这种方法在本领域中是众所周知的,例如,如通过引用整体并入本文的美国专利号5,580,734、5,641,670、5,733,746和5,733,761中所述的。
用于生产VHH或VCAR、其指定部分或变体的细胞培养物的例证是如本领域所已知的细菌、酵母和哺乳动物细胞。哺乳动物细胞系统经常将以细胞的单层形式存在,尽管也可以使用哺乳动物细胞悬浮液或生物反应器。在本领域中已经开发了许多能够表达完整糖基化蛋白的合适宿主细胞系,并包括COS-1(例如,ATCC CRL 1650)、COS-7(例如,ATCC CRL-1651)、HEK293、BHK21(例如,ATCC CRL-10)、CHO(例如,ATCC CRL 1610)和BSC-1(例如,ATCCCRL-26)细胞系、Cos-7细胞、CHO细胞、hep G2细胞、P3X63Ag8.653、SP2/0-Ag14、293细胞、HeLa细胞等,其容易从例如美国典型培养物保藏中心,Manassas,Va.(www.atcc.org)获得。优选的宿主细胞包括淋巴起源的细胞,例如骨髓瘤和淋巴瘤细胞。特别优选的宿主细胞是P3X63Ag8.653细胞(ATCC检索号CRL-1580)和SP2/0-Ag14细胞(ATCC检索号CRL-1851)。在特别优选的实施方案中,重组细胞是P3X63Ab8.653或SP2/0-Ag14细胞。
用于这些细胞的表达载体可以包括一种或多种以下表达控制序列,例如,但不限于,复制起点;启动子(例如,晚期或早期SV40启动子、CMV启动子(美国专利号5,168,062;5,385,839)、HSV tk启动子、pgk(磷酸甘油酸激酶)启动子、EF-1α启动子(美国专利号5,266,491)、至少一种人启动子;增强子,和/或加工信息位点,例如核糖体结合位点,RNA剪接位点,多腺苷酸化位点(例如,SV40大T Ag poly A添加位点)和转录终止序列。参见,例如,Ausubel等人,上述;Sambrook等人,上述。可用于生产本发明的核酸或蛋白的其他细胞是已知的和/或可获得的,例如,从美国典型培养物保藏中心细胞系和杂交瘤目录(www.atcc.org)或其他已知或商业来源获得。
当使用真核宿主细胞时,一般将多腺苷酸化或转录终止子序列掺入载体中。终止子序列的实例是来自牛生长素基因的多腺苷酸化序列。还可以包括用于准确剪接转录物的序列。剪接序列的实例是来自SV40的VP1内含子(Sprague等人,J.Virol.45:773-781(1983))。另外,如本领域中已知的,可以将控制在宿主细胞中复制的基因序列掺入载体中。
VH、VHH或VCAR的纯化
可以通过公知的方法从重组细胞培养物回收和纯化VHH蛋白或VCAR,所述方法包括但不限于蛋白A纯化、硫酸铵或乙醇沉淀、酸提取、阴离子或阳离子交换色谱、磷酸纤维素色谱、疏水相互作用色谱、亲和色谱、羟基磷灰石色谱和凝集素色谱。高效液相色谱(“HPLC”)也可以用于纯化。参见,例如,Colligan,Current Protocols in Immunology,或Current Protocols in Protein Science,John Wiley&Sons,NY,N.Y.,(1997-2001),例如第1、4、6、8、9、10章,其各自通过引用整体并入本文。
本公开内容的VH、VHH和/或VCAR包括纯化的产物、化学合成程序的产物以及通过重组技术从原核或真核宿主(包括例如大肠杆菌、酵母、高等植物、昆虫和哺乳动物细胞)产生的产物。取决于重组生产程序中使用的宿主,本公开内容的VCAR可以是糖基化的或可以是非糖基化的。这种方法描述于许多标准实验室手册,例如Sambrook,上述,第17.37-17.42章;Ausubel,上述,第10、12、13、16、18和20章,Colligan,Protein Science,上述,第12-14章,其全部通过引用整体并入本文。
氨基酸代码
构成本公开内容的VCAR的氨基酸经常是缩写的。可以通过由其单字母代码、其三字母代码、名称或一种或多种三核苷酸密码子表示氨基酸来指示氨基酸名称,如本领域中所众所周知的(参见Alberts,B.等人,Molecular Biology of The Cell,第三版,GarlandPublishing,Inc.,New York,1994)。如本文所规定的,本公开内容的VCAR可包含一种或多种来自自发突变和/或人类操作的氨基酸取代、缺失或添加。可以通过本领域已知的方法,例如位点定向诱变或丙氨酸扫描诱变来鉴定本公开内容的VCAR中对于功能来说必需的氨基酸(例如,Ausubel,上述,第8、15章;Cunningham和Wells,Science 244:1081-1085(1989))。后一种程序在分子中的每个残基处引入单丙氨酸突变。然后测试所得到的突变分子的生物活性,例如,但不限于,至少一种中和活性。对VCAR结合关键性的位点也可以通过结构分析,例如结晶、核磁共振或光亲和标记来鉴定(Smith等人,J.Mol.Biol.224:899-904(1992)和de Vos等人,Science 255:306-312(1992))。
如本领域技术人员将理解的,本发明包括至少一种本公开内容的生物活性VCAR。生物活性VCAR具有的比活性为天然(非合成)、内源或相关和已知VCAR的比活性的至少20%、30%或40%,且优选至少50%、60%或70%,且最优选至少80%、90%或95%-99%或更高。测定和定量酶活性和底物特异性量度的方法是本领域技术人员众所周知的。
在另一方面,本公开内容涉及如本文所述的VHH蛋白和片段,其通过有机部分的共价连接进行修饰。这种修饰可以产生具有改善的药代动力学性质(例如,增加的体内血清半衰期)的VCAR片段。有机部分可以是线线性或支化亲水聚合物基团、脂肪酸基团或脂肪酸酯基团。在特定的实施方案中,亲水聚合物基团可以具有约800至约120,000道尔顿的分子量,并且可以是聚链烷二醇(例如,聚乙二醇(PEG)、聚丙二醇(PPG))、碳水化合物聚合物、氨基酸聚合物或聚乙烯吡咯烷酮,且脂肪酸或脂肪酸酯基团可包含约8至约40个碳原子。
本公开内容的修饰的VHH蛋白和片段可包含一个或多个与抗体直接或间接地共价键合的有机部分。键合至本公开内容的VHH蛋白或片段的每个有机部分可独立地为亲水性聚合物基团、脂肪酸基团或脂肪酸酯基团。如本文所用的,术语“脂肪酸”包括单羧酸和二羧酸。如本文所用的术语“亲水性聚合物基团”,是指与在辛烷中相比,更易溶于水的有机聚合物。例如,与在辛烷中相比,聚赖氨酸更易溶于水。因此,本公开内容涵盖通过聚赖氨酸的共价连接修饰的VHH蛋白。适合于修饰本公开内容的VCAR的亲水性聚合物可以是线性或支化的并且包括,例如,聚链烷二醇(例如,PEG,单甲氧基-聚乙二醇(mPEG)、PPG等)、碳水化合物(例如,葡聚糖、纤维素、寡糖、多糖等)、亲水性氨基酸的聚合物(例如,聚赖氨酸、聚精氨酸、聚天冬氨酸等)、聚烷烃氧化物(例如,聚环氧乙烷、聚环氧丙烷等)和聚乙烯吡咯烷酮。优选地,修饰本公开内容的VCAR的亲水性聚合物作为分开的分子实体具有约800-约150,000道尔顿的分子量。例如,可以使用PEG5000和PEG 20,000,其中下标是聚合物的平均分子量(以道尔顿计)。亲水性聚合物基团可用1-约6个烷基、脂肪酸或脂肪酸酯基团取代。用脂肪酸或脂肪酸酯基团取代的亲水性聚合物可通过采用合适的方法制备。例如,包含胺基团的聚合物可以偶联至脂肪酸或脂肪酸酯的羧酸盐,并且脂肪酸或脂肪酸酯上的活化的羧酸盐(如,用N,N-羰基二咪唑活化)可以偶联至聚合物的羟基。
适合于修饰本公开内容的VHH蛋白的脂肪酸和脂肪酸酯可以是饱和的,或者可以含有一个或多个不饱和单元。适合于修饰本公开内容的VACR的脂肪酸包括,例如,正-十二烷酸(C12,月桂酸)、正-十四烷酸(C14,豆蔻酸)、正-十八烷酸(C18、硬脂酸)、正-二十烷酸(C20、花生酸)、正-二十二烷酸(C22、山萮酸)、正-三十烷酸(C30)、正-四十烷酸(C40)、顺式-Δ9-十八烷酸(C18、油酸)、全顺式-Δ5,8,11,14-二十碳四烯酸(C20,花生四烯酸)、辛二酸、十四烷二酸、十八烷二酸、二十二烷二酸等。合适的脂肪酸酯包括包含线性或支化的低级烷基的二羧酸的单酯。低级烷基可包含1-约12,优选1-约6个碳原子。
修饰的VHH蛋白和片段可使用合适的方法,如通过与一种或多种修饰剂反应来制备。如本文所用的术语“修饰剂”,是指包含活化基团的合适的有机基团(例如,亲水性聚合物、脂肪酸、脂肪酸酯)。“活化基团”是化学部分或官能团,其可在适当的条件下与第二化学基团反应,由此在修饰剂和第二个化学基团之间形成共价键。例如,胺-反应性活化基团包括亲电基团,如甲苯磺酸盐/酯、甲磺酸盐/酯、卤代(氯代、溴代、氟代、碘代)、N-羟基琥珀酰基酯(NHS)等。可与硫醇反应的活化基团包括,例如,马来酰亚胺、碘乙酰基、丙烯酰基(acrylolyl)、吡啶二硫化物(pyridyl disulfides)、5-巯基-2-硝基苯甲酸硫醇(TNB-硫醇)等。醛官能团可偶联至含有胺或酰肼的分子,且叠氮基可与三价磷基团反应以形成氨基磷酸酯(phosphoramidate)或磷酰亚胺(phosphorimide)键。将活化基团引入分子的合适的方法是本领域已知的(参见例如,Hermanson,G.T.,Bioconjugate Technoques;AcademicPress:San Diego,Calif.(1996))。活化基团可直接键合至有机基团(例如,亲水性聚合物、脂肪酸、脂肪酸酯),或通过接头部分,例如,二价C1-C12基团,其中一个或多个碳原子可被杂原子,如氧、氮或硫取代。合适的接头部分包括,例如,四乙二醇、-(CH2)3-、-NH-(CH2)6-NH-、-(CH2)2-NH-和-CH2-O-CH2-CH2-O-CH2-CH2-O-CH-NH-。例如,通过在1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)存在的情况下,使单-Boc-烷基二胺(如,单-Boc-乙二胺、单-Boc-二氨基己烷)与脂肪酸反应,以形成游离胺和脂肪酸羧酸盐/酯之间的酰胺键,可制备包含接头部分的修饰剂。Boc保护基团可通过如下从产物除去:用三氟乙酸(TFA)处理,以暴露于可偶联至另一个羧酸盐/酯的伯胺,如所述,或可与马来酸酐反应,并使所得的产物环化生成脂肪酸的活化的马来酰亚胺基衍生物(参见,例如,Thompson,等人,WO 92/16221,其中的全部教导都通过引用并入本文)。
本公开内容的修饰的VHH蛋白和片段可通过使VHH蛋白或片段与修饰剂反应来制备。例如,通过使用胺-反应性修饰剂,例如PEG的NHS酯,可以非-位点特异性方式使有机部分键合至VHH蛋白。包含键合至本公开内容的VHH蛋白的特定位点的有机部分的修饰VHH蛋白和片段可使用合适的方法,如反向蛋白水解(Fisch等人,Bioconjugate Chem.,3:147-153(1992);Werlen等人,Bioconjugate Chem.,5:411-417(1994);Kumaran等人,ProteinSci.6(10):2233-2241(1997);Itoh等人,Bioorg.Chem.,24(1):59-68(1996);Capellas等人,Biotechnol.Bioeng.,56(4):456-463(1997)),和在Hermanson,G.T.,BioconjugateTechniques;Academic Press:San Diego,Calif.(1996)中描述的方法制备。
包含另外的治疗活性成分的VH或VHH蛋白组合物
本公开内容的VHH蛋白或VCAR化合物、组合物或组合可进一步包含任何合适的辅料中的至少一种,例如但不限于稀释剂、粘合剂、稳定剂、缓冲剂、盐、亲脂性溶剂、防腐剂、佐剂等。药学可接受的辅料是优选的。此类无菌溶液的非限制性实例和制备方法在本领域中是众所周知的,例如但不限于,Gennaro编,Remington′s Pharmaceutical Sciences,第18版,Mack Publishing Co.(Easton,Pa.)1990。可以常规地选择适于本领域公知的或如本文所述的VHH蛋白或VCAR、片段或变体组合物的施用方式、溶解度和/或稳定性的药学可接受的载体。
可用于本组合物中的药物赋形剂和添加剂包括但不限于蛋白、肽、氨基酸、脂质和碳水化合物(例如,糖,包括单糖、二糖、三糖、四糖和寡糖;衍生糖,例如醛醇、醛糖酸、酯化糖等;以及多糖或糖聚合物),它们可以单独或组合存在,按重量或体积计单独或组合占1-99.99%。示例性的蛋白赋形剂包括血清白蛋白,例如人血清白蛋白(HSA)、重组人白蛋白(rHA)、明胶、酪蛋白等。还可在缓冲能力中起作用的代表性氨基酸/蛋白成分包括丙氨酸、甘氨酸、精氨酸、甜菜碱、组氨酸、谷氨酸、天冬氨酸、半胱氨酸、赖氨酸、亮氨酸、异亮氨酸、缬氨酸、甲硫氨酸、苯丙氨酸、天冬氨酸等。一种优选的氨基酸是甘氨酸。
适用于本发明的碳水化合物赋形剂包括,例如,单糖,例如果糖、麦芽糖、半乳糖、葡萄糖、D-甘露糖、山梨糖等;二糖,例如乳糖、蔗糖、海藻糖、纤维二糖等;多糖,例如棉子糖、松三糖、麦芽糖糊精、葡聚糖、淀粉等;醛醇,如甘露醇、木糖醇、麦芽糖醇、乳糖醇、木糖醇山梨糖醇(葡萄糖醇)、肌醇等。用于本发明的优选的碳水化合物赋形剂是甘露醇、海藻糖和棉子糖。
VH蛋白、VHH蛋白或VCAR组合物还可包含缓冲剂或pH调节剂;通常,缓冲剂是由有机酸或碱制备的盐。代表性的缓冲剂包括有机酸盐,例如柠檬酸、抗坏血酸、葡萄糖酸、碳酸、酒石酸、琥珀酸、乙酸或邻苯二甲酸的盐;Tris、盐酸氨丁三醇或磷酸盐缓冲剂。用于本组合物中的优选缓冲剂是有机酸盐,例如柠檬酸盐。
另外,本公开内容的VH蛋白、VHH蛋白或VCAR组合物可包括聚合物赋形剂/添加剂,例如聚乙烯吡咯烷酮、聚蔗糖类(聚合糖)、糊精(例如环糊精,例如2-羟丙基-β-环糊精)、聚乙二醇、调味剂、抗微生物剂、甜味剂、抗氧化剂、抗静电剂、表面活性剂(例如聚山梨酯,例如“TWEEN 20”和“TWEEN 80”)、脂质(例如磷脂、脂肪酸)、类固醇(例如胆固醇)和螯合剂(例如EDTA)。
适用于根据本发明的VH蛋白、VHH蛋白、VCAR、部分或变体组合物中的这些和另外的已知药物赋形剂和/或添加剂是本领域已知的,例如,如“Remington:The Science&Practice of Pharmacy”,第19版,Williams&Williams,(1995)中和“Physician′s DeskReference”,第52版,Medical Economics,Montvale,N.J.(1998)中所列,其公开内容通过引用整体并入本文。优选的载体或赋形剂材料是碳水化合物(例如糖和醛醇)和缓冲剂(例如柠檬酸盐)或聚合试剂。示例性的载体分子是粘多糖、透明质酸,其可用于关节内递送。
从白细胞分离法产物分离T细胞
可以使用封闭式系统和标准方法(例如,COBE Spectra Apheresis System)在临床地点从受试者收集白细胞分离法产物或血液。优选地,根据标准医院或规定的白细胞分离法程序在标准白细胞分离法收集袋中收集产物。例如,在本公开内容的方法的优选实施方案中,除了在白细胞分离法过程中通常使用的那些以外不包括额外的抗凝剂或血液添加剂(肝素等)。
替代地,可以直接从全血分离白细胞(WBC)/外周血单核细胞(PBMC)(使用BiosafeSepax 2(封闭式/自动(Closed/Automated)))或T细胞(使用
白细胞分离法程序和/或直接细胞分离程序可以用于本公开内容的任何受试者。
白细胞分离法产物、血液、WBC/PBMC组合物和/或T细胞组合物应包装在保温容器中,并应根据批准供临床规程使用的规定的血液收集程序的标准医院,保持于受控的室温(+19℃到+25℃)。白细胞分离法产物、血液、WBC/PBMC组合物和/或T细胞组合物不应冷藏。
在运输过程中,白细胞分离法产物、血液、WBC/PBMC组合物和/或T细胞组合物的细胞浓度不应超过0.2x10
如果白细胞分离法产物、血液、WBC/PBMC组合物和/或T细胞组合物必须贮藏例如过夜,则应将其保持于受控的室温(与上述相同)。在贮藏期间,白细胞分离法产物、血液、WBC/PBMC组合物和/或T细胞组合物的浓度应永远不超过0.2x10
优选地,白细胞分离法产物、血液、WBC/PBMC组合物和/或T细胞组合物的细胞应贮藏在自体血浆中。在某些实施方案中,如果白细胞分离法产物、血液、WBC/PBMC组合物和/或T细胞组合物的细胞浓度高于0.2x10
优选地,当开始标记和分离程序时,白细胞分离法产物、血液、WBC/PBMC组合物和/或T细胞组合物应不老于24小时。可以使用封闭式和/或自动系统(例如,CliniMACSProdigy)处理和/或制备白细胞分离法产物、血液、WBC/PBMC组合物和/或T细胞组合物,以用于进行细胞标记。
自动系统可以进行额外的血沉棕黄层分离,可能通过ficolation和/或洗涤细胞产品(例如,白细胞分离法产物、血液、WBC/PBMC组合物和/或T细胞组合物)。
封闭式和/或自动系统可以用于制备和标记用于T细胞分离的细胞(来自例如白细胞分离法产物、血液、WBC/PBMC组合物和/或T细胞组合物)。
尽管WBC/PBMC可以被直接核转染(这更容易并且节省额外的步骤),但是本公开内容的方法可以包括在核转染之前首先分离T细胞。直接对PBMC进行核转染的更容易的策略要求通过VCAR信号传导介导的VCAR+细胞的选择性扩增,其独立地被证明是不佳的扩增方法,所述扩增方法通过使T细胞功能性耗尽而直接降低了产物的体内效率。产物可以是VCAR+细胞的异质组合物,包括T细胞、NK细胞、NKT细胞、单核细胞或其任何组合,这增加了从一个患者到另一个患者的产物的变异性,并使给药和CRS管理更加困难。由于T细胞被认为是肿瘤抑制和杀伤的主要效应物,所以用于生产自体产物的T细胞分离可能导致比起其他更异质的组合物来显著的益处。
T细胞可以在单向标记程序中通过富集标记的细胞或耗尽标记的细胞来直接分离,或在两步标记程序中间接分离。根据本公开内容的某些富集策略,可以将T细胞收集在细胞收集袋中,并将非标记的细胞(非靶细胞)收集在阴性级分袋(Negative FractionBag)中。与本公开内容的富集策略相反,分别将非标记的细胞(靶细胞)收集在细胞收集袋中,并将标记的细胞(非靶细胞)收集在阴性级分袋或非靶细胞袋中。选择试剂可以包括,但不限于,抗体包被的珠。抗体包被的珠可以在修饰和/或扩增步骤之前除去,或者在修饰和/或扩增步骤之前保持在细胞上。细胞标记的以下非限制性实例中的一种或多种可用于分离T细胞:CD3、CD4、CD8、CD25、抗生物素、CD1c、CD3/CD19、CD3/CD56、CD14、CD19、CD34、CD45RA、CD56、CD62L、CD133、CD137、CD271、CD304、IFN-γ、TCRα/β和/或其任何组合。用于分离T细胞的方法可以包括一种或多种特异性结合和/或可检测地标记可用于分离T细胞的细胞标记的以下非限制性实例中的一种或多种的试剂:CD3、CD4、CD8、CD25、抗生物素、CD1c、CD3/CD19、CD3/CD56、CD14、CD19、CD34、CD45RA、CD56、CD62L、CD133、CD137、CD271、CD304、IFN-γ、TCRα/β和/或其任何组合。这些试剂可能是或可能不是“优质生产规范”(“GMP”)级的。试剂可能包括,但不限于Thermo DynaBeads和Miltenyi CliniMACS产品。本公开内容的分离T细胞的方法可以包括标记和/或分离步骤的多次重复。在本公开内容的分离T细胞的方法中的任何时刻,可以通过阳性选择或阴性选择不需要的细胞和/或不需要的细胞类型来从本公开内容的T细胞产品组合物耗尽不需要的细胞和/或不需要的细胞类型。本公开内容的T细胞产品组合物可以含有可以表达CD4、CD8和/或一种或多种别的T细胞标记的额外的细胞类型。
本公开内容的用于T细胞核转染的方法可以通过例如在WBC/PBMC的群体或组合物中的T细胞核转染的过程来消除T细胞分离的步骤,该过程在核转染后包括通过TCR信号传导的分离步骤或选择性扩增步骤。
在T细胞富集和/或分选之前或之后,可以通过阳性选择或阴性选择来耗尽某些细胞群体。可从细胞产品组合物耗尽的细胞组合物的实例可包括髓样细胞、CD25+调节T细胞(T Regs)、树突细胞、巨噬细胞、红细胞、肥大细胞、γ-δT细胞、天然杀伤(NK)细胞、天然杀伤(NK)样细胞(例如细胞因子诱导的杀伤(CIK)细胞)、诱导的天然杀伤(iNK)T细胞、NK T细胞、B细胞或其任何组合。
本公开内容的T细胞产品组合物可以包括CD4+和CD8+T细胞。在分离或选择程序期间,可以将CD4+和CD8+ T细胞分离到单独的收集袋中。CD4+ T细胞和CD8+ T细胞可以分别进行进一步处理,或在以特定比例重构(组合到相同组合物中)后进行处理。
可以重构CD4+ T细胞和CD8+ T细胞所处的特定比例取决于所用扩增技术的类型和功效、细胞培养基和/或用于扩增T细胞产品组合物的生长条件。可能的CD4+∶CD8+比例的实例包括,但不限于,50%∶50%、60%∶40%、40%∶60%75%∶25%和25%∶75%。
CD8+ T细胞表现了强有力的肿瘤细胞杀伤能力,而CD4+ T细胞提供支持CD8+ T细胞增殖能力和功能所需的许多细胞因子。因为从正常供体分离的T细胞主要是CD4+,所以在CD4+∶CD8+比例方面在体外人工调整T细胞产品组合物,以对原本将存在于体内的CD4+ T细胞与CD8+ T细胞的比例加以改良。最优化的比例也可用于自体T细胞产品组合物的离体扩增。考虑到T细胞产品组合物的人工调整的CD4+∶CD8+比例,重要的是要注意,本公开内容的产物组合物与任何内源存在的T细胞群体相比可以显著不同,且提供显著更大的益处。
用于T细胞分离的优选方法可以包括用于产生未受影响的全T细胞的阴性选择策略,从而意味着作为结果而产生的T细胞组合物包括尚未被操作并且含有内源存在的T细胞变体/比例的T细胞。
可以用于阳性选择或阴性选择的试剂包括,但不限于,磁性细胞分离珠。磁性细胞分离珠可能会或可能不会在进行本公开内容的T细胞分离方法的下一个步骤前从选择的CD4+T细胞、CD8+ T细胞群体或CD4+和CD8+ T细胞两者的混合群体中去除或耗尽。
可以制备T细胞组合物和T细胞产品组合物用于冷冻保存、在标准T细胞培养基中贮藏和/或基因修饰。
T细胞组合物、T细胞产品组合物、未刺激的T细胞组合物、静息T细胞组合物或其任何部分可以使用标准冷冻保存方法进行冷冻保存,所述方法进行了最优化以便用于以高回收率、生存力、表型和/或功能能力贮藏和回收人细胞。可以使用可商购获得的冷冻保存介质和/或规程。本公开内容的冷冻保存方法可以包括不含DMSO的冷冻保存剂(例如,CryoSOfree
T细胞组合物、T细胞产品组合物、未刺激的T细胞组合物、静息T细胞组合物或其任何部分可以贮藏在培养基中。可以对于细胞贮藏、细胞基因修饰、细胞表型和/或细胞扩增来最优化本公开内容的T细胞培养基。本公开内容的T细胞培养基可以包含一种或多种抗生素。因为在通过核转染进行基因修饰后,细胞培养基中包含抗生素可能会降低转染效率和/或细胞收率,所以对于在通过核转染进行基因修饰后最优的转染效率和/或细胞收率可以改变特定的抗生素(或其组合)及一种或多种其各自的浓度。
本公开内容的T细胞培养基可以包含血清,并且此外,对于最优的细胞结果可以改变血清组成和浓度。对于T细胞培养,人AB血清比起FBS/FCS来是优选的,这是因为尽管预期用于本公开内容的T细胞培养基中,但FBS/FCS可引入异种蛋白。血清可以从打算对其施用培养物中的T细胞组合物的受试者的血液中分离,因此,本公开内容的T细胞培养基可以包含自体血清。无血清培养基或血清替代物也可用于本公开内容的T细胞培养基中。在本公开内容的T细胞培养基和方法的某些实施方案中,无血清培养基或血清替代物相对于用异种血清补充培养基可以提供益处,包括,但不限于,具有更大的生存力、以更高效率核转染、在核转染后表现更大的生存力、显示更期望的细胞表型和/或在添加扩增技术时更大/更快地扩增的更健康的细胞。
T细胞培养基可包括可商购获得的细胞生长培养基。示例性的可商购获得的细胞生长培养基包括,但不限于,PBS、HBSS、OptiMEM、DMEM、RPMI 1640、AIM-V、X-VIVO 15、CellGro DC培养基、CTS OpTimizer T细胞扩增SFM、TexMACS培养基、PRIME-XV T细胞扩增培养基、ImmunoCult-XF T细胞扩增培养基或其任何组合。
可以制备T细胞组合物、T细胞产品组合物、未刺激的T细胞组合物、静息T细胞组合物或其任何部分用于基因修饰。用于基因修饰的T细胞组合物、T细胞产品组合物、未刺激的T细胞组合物、静息T细胞组合物或其任何部分的制备可包括在期望的核转染缓冲剂中的细胞洗涤和/或重悬。可将冷冻保存的T细胞组合物解冻,并制备用于通过核转染进行基因修饰。可以根据标准或已知规程解冻冷冻保存的细胞。冷冻保存的细胞的解冻和制备可以被最优化以产生具有更大的生存力、以更高效率核转染、在核转染后表现更大的生存力、显示更期望的细胞表型和/或在添加扩增技术时更大/更快地扩增的细胞。例如,GrifolsAlbutein(25%人白蛋白)可用于解冻和/或制备过程。
自体T细胞产品组合物的基因修饰
T细胞组合物、T细胞产品组合物、未刺激的T细胞组合物、静息T细胞组合物或其任何部分可以使用例如核转染策略例如电穿孔进行基因修饰。可以最优化待核转染的细胞总数目、核转染反应的总体积以及样品制备的精确时间控制,以产生具有更大的生存力、以更高效率核转染、在核转染后表现更大的生存力、显示更期望的细胞表型和/或在添加扩增技术时更大/更快地扩增的细胞。
可以使用例如Lonza Amaxa、MaxCyte PulseAgile、Harvard Apparatus BTX和/或Invitrogen Neon来完成核转染和/或电穿孔。包括但不限于塑料聚合物电极的非金属电极系统对于核转染可能是优选的。
在通过核转染进行基因修饰之前,可以将T细胞组合物、T细胞产品组合物、未刺激的T细胞组合物、静息T细胞组合物或其任何部分重悬在核转染缓冲剂中。本公开内容的核转染缓冲剂包括可商购获得的核转染缓冲剂。可以最优化本公开内容的核转染缓冲剂以产生具有更大的生存力、以更高效率核转染、在核转染后表现更大的生存力、显示更期望的细胞表型和/或在添加扩增技术时更大/更快地扩增的细胞。本公开内容的核转染缓冲剂可包括,但不限于,PBS、HBSS、OptiMEM、BTxpress、Amaxa核转染仪(Nucleofector)、人T细胞核转染缓冲剂及其任何组合。本公开内容的核转染缓冲剂可包含一种或多种补充因子(supplemental factor),以产生具有更大的生存力、以更高效率核转染、在核转染后表现更大的生存力、显示更期望的细胞表型和/或在添加扩增技术时更大/更快地扩增的细胞。示例性补充因子包括,但不限于,重组人细胞因子、趋化因子、白介素及其任何组合。示例性的细胞因子、趋化因子和白介素包括,但不限于,IL2、IL7、IL12、IL15、IL21、IL1、IL3、IL4、IL5、IL6、IL8、CXCL8、IL9、IL10、IL11、IL13、IL14、IL16、IL17、IL18、IL19、IL20、IL22、IL23、IL25、IL26、IL27、IL28、IL29、IL30、IL31、IL32、IL33、IL35、IL36、GM-CSF、IFN-γ、IL-1α/IL-1F1、IL-1β/IL-1F2、IL-12p70、IL-12/IL-35p35、IL-13、IL-17/IL-17A、IL-17A/F异二聚体、IL-17F、IL-18/IL-1F4、IL-23、IL-24、IL-32、IL-32β、IL-32γ、IL-33、LAP(TGF-β1)、淋巴毒素-α/TNF-β、TGF-β、TNF-α、TRANCE/TNFSF11/RANK L及其任何组合。示例性补充因子包括,但不限于,盐、矿物质、代谢物或其任何组合。示例性的盐、矿物质和代谢物包括,但不限于,HEPES、烟酰胺、肝素、丙酮酸钠、L-谷氨酰胺、MEM非必需氨基酸溶液、抗坏血酸、核苷、FBS/FCS、人血清、血清替代物、抗生素、pH调节剂、厄尔氏盐、2-巯基乙醇、人转铁蛋白、重组人胰岛素、人血清白蛋白、核转染仪PLUS补充物(Nucleofector PLUS Supplement)、KCL、MgCl2、Na2HPO4、NAH2PO4、乳糖酸钠、甘露糖醇、琥珀酸钠、氯化钠、CINa、葡萄糖、Ca(NO3)2、Tris/HCl、K2HPO4、KH2PO4、聚乙烯亚胺、聚乙二醇、泊洛沙姆188、泊洛沙姆181、泊洛沙姆407、聚乙烯吡咯烷酮、Pop313、Crown-5和其任何组合。示例性补充因子包括,但不限于,诸如PBS、HBSS、OptiMEM、DMEM、RPMI 1640、AIM-V、X-VIVO 15、CellGro DC培养基、CTSOpTimizer T细胞扩增SFM、TexMACS培养基、PRIME-XV T细胞扩增培养基、ImmunoCult-XF T细胞扩增培养基及其任何组合的培养基。示例性补充因子包括,但不限于,细胞DNA感应、代谢、分化、信号转导、凋亡途径及其组合的抑制剂。示例性抑制剂包括,但不限于,TLR9、MyD88、IRAK、TRAF6、TRAF3、IRF-7、NF-KB、1型干扰素、促炎细胞因子、cGAS、STING、Sec5、TBK1、IRF-3、RNA pol III、RIG-1、IPS-1、FADD、RIP1、TRAF3、AIM2、ASC、胱天蛋白酶1、Pro-IL1B、PI3K、Akt、Wnt3A的抑制剂、糖原合酶激酶-3β(GSK-3β)的抑制剂(例如TWS119)、巴弗洛霉素、氯喹、奎纳克林、AC-YVAD-CMK、Z-VAD-FMK、Z-IETD-FMK及其任何组合。示例性补充因子包括,但不限于,以增强细胞递送、增强核递送或转运、增强核酸向细胞核内的被促进的转运、增强染色体外核酸的降解和/或降低DNA-介导的毒性的方式修饰或稳定一种或多种核酸的试剂。示例性的修饰或稳定一种或多种核酸的试剂包括,但不限于,pH调节物、DNA结合蛋白、脂质、磷脂、CaPO4、具有或不具有NLS序列的净中性电荷DNA结合肽、TREX1酶及其任何组合。
可以在向核转染缓冲剂(任选地,包含在核转染反应小瓶或杯中)中添加细胞之前、同时或之后,将包括转座子和转座酶的转座试剂添加到本公开内容的核转染反应中。本公开内容的转座子可包含质粒DNA、纳米质粒、线性化质粒DNA、PCR产物、DOGGYBONE
本公开内容的转座子可以包含编码一种或多种全长或截短的基因的一种或多种序列。由本公开内容的转座子引入的一种或多种全长和/或截短的基因可以编码信号肽、VCAR、单链可变区片段(scFv)、铰链、跨膜结构域、共刺激结构域、嵌合抗原受体(CAR)、VCAR、嵌合T细胞受体(CAR-T或VCAR-T)、受体、配体、细胞因子、抗药基因、肿瘤抗原、同种异体或自身抗原、酶、蛋白、肽、多肽、荧光蛋白、突变蛋白或其任何组合中的一种或多种。
本公开内容的转座子可以在水、TAE、TBE、PBS、HBSS、培养基、本公开内容的补充因子或其任何组合中制备。
本公开内容的转座子可被进行设计以最优化临床安全性和/或改善可制造性。作为非限制性实例,本公开内容的转座子可被进行设计以通过消除不必要的序列或区域和/或包括非抗生素选择标记来最优化临床安全性和/或改善可制造性。本公开内容的转座子可以是或可能不是GMP级的。
本公开内容的转座酶可以由质粒DNA、mRNA、蛋白、蛋白-核酸组合或其任何组合的一种或多种序列编码。
本公开内容的转座酶可以在水、TAE、TBE、PBS、HBSS、培养基、本公开内容的补充因子或其任何组合中制备。本公开内容的转座酶或编码或递送它们的序列/构建体可以是或可能不是GMP级的。
本公开内容的转座子和转座酶可以以任何手段递送至细胞。
尽管本公开内容的组合物和方法包括通过质粒DNA(pDNA)将本公开内容的转座子和/或转座酶递送至细胞,但使用质粒用于进行递送可能使转座子和/或转座酶整合到细胞的染色体DNA中,这可能导致连续的转座酶表达。因此,本公开内容的转座子和/或转座酶可以作为mRNA或蛋白被递送至细胞,以消除染色体整合的任何可能性。
在将转座子和/或转座酶引入核转染反应中之前,可以将本公开内容的转座子和转座酶单独或相互组合进行预温育。可以最优化转座子和转座酶各自的绝对量,以及相对量,例如,转座子与转座酶的比例。
制备核转染反应后,任选地,在小瓶或杯中,可将反应装载到核转染仪装置中,并根据制造商的规程进行激活以用于递送电脉冲。可以最优化用于将本公开内容的转座子和/或转座酶(或编码本公开内容的转座子和/或转座酶的序列)递送至细胞的电脉冲条件,以产生具有增强的生存力、更高核转染效率、在核转染后更大的生存力、期望的细胞表型和/或在添加扩增技术时更大/更快的扩增的细胞。当使用Amaxa核转染仪技术时,考虑Amaxa 2B或4D核转染仪的各种核转染程序的每一种。
在本公开内容的核转染反应之后,可以将细胞轻轻地添加到细胞培养基中。例如,当T细胞经历核转染反应时,可以将T细胞添加到T细胞培养基中。本公开内容的核转染后细胞培养基可包括任何一种或多种可商购获得的培养基。可以最优化本公开内容的核转染后细胞培养基(包括本公开内容的核转染后T细胞培养基)以产生具有更大的生存力、更高核转染效率、在核转染后表现更大的生存力、显示更期望的细胞表型和/或在添加扩增技术时更大/更快地扩增的细胞。本公开内容的核转染后细胞培养基(包括本公开内容的核转染后T细胞培养基)可以包括PBS、HBSS、OptiMEM、DMEM、RPMI 1640、AIM-V、X-VIVO 15、CellGroDC培养基、CTS OpTimizer T细胞扩增SFM、TexMACS培养基、PRIME-XV T细胞扩增培养基、ImmunoCult-XF T细胞扩增培养基及其任何组合。本公开内容的核转染后细胞培养基(包括本公开内容的核转染后T细胞培养基)可以包含一种或多种本公开内容的补充因子,以增强生存力、核转染效率、核转染后的生存力、细胞表型和/或在添加扩增技术时更大/更快的扩增。示例性补充因子包括,但不限于,重组人细胞因子、趋化因子、白介素及其任何组合。示例性的细胞因子、趋化因子和白介素包括,但不限于,IL2、IL7、IL12、IL15、IL21、IL1、IL3、IL4、IL5、IL6、IL8、CXCL8、IL9、IL10、IL11、IL13、IL14、IL16、IL17、IL18、IL19、IL20、IL22、IL23、IL25、IL26、IL27、IL28、IL29、IL30、IL31、IL32、IL33、IL35、IL36、GM-CSF、IFN-γ、IL-1α/IL-1F1、IL-1β/IL-1F2、IL-12 p70、IL-12/IL-35 p35、IL-13、IL-17/IL-17A、IL-17A/F异二聚体、IL-17F、IL-18/IL-1F4、IL-23、IL-24、IL-32、IL-32β、IL-32γ、IL-33、LAP(TGF-β1)、淋巴毒素-α/TNF-β、TGF-β、TNF-α、TRANCE/TNFSF11/RANK L及其任何组合。示例性补充因子包括,但不限于,盐、矿物质、代谢物或其任何组合。示例性的盐、矿物质和代谢物包括,但不限于,HEPES、烟酰胺、肝素、丙酮酸钠、L-谷氨酰胺、MEM非必需氨基酸溶液、抗坏血酸、核苷、FBS/FCS、人血清、血清替代物、抗生素、pH调节剂、厄尔氏盐、2-巯基乙醇、人转铁蛋白、重组人胰岛素、人血清白蛋白、核转染仪PLUS补充物、KCL、MgCl2、Na2HPO4、NAH2PO4、乳糖酸钠、甘露糖醇、琥珀酸钠、氯化钠、CINa、葡萄糖、Ca(NO3)2、Tris/HCl、K2HPO4、KH2PO4、聚乙烯亚胺、聚乙二醇、泊洛沙姆188、泊洛沙姆181、泊洛沙姆407、聚乙烯吡咯烷酮、Pop313、Crown-5和其任何组合。示例性补充因子包括,但不限于,诸如PBS、HBSS、OptiMEM、DMEM、RPMI 1640、AIM-V、X-VIVO 15、CellGro DC培养基、CTS OpTimizer T细胞扩增SFM、TexMACS培养基、PRIME-XV T细胞扩增培养基、ImmunoCult-XF T细胞扩增培养基及其任何组合的培养基。示例性补充因子包括,但不限于,细胞DNA信号感应、代谢、分化、信号转导、凋亡途径及其组合的抑制剂。示例性抑制剂包括,但不限于,TLR9、MyD88、IRAK、TRAF6、TRAF3、IRF-7、NF-KB、1型干扰素、促炎细胞因子、cGAS、STING、Sec5、TBK1、IRF-3、RNA polIII、RIG-1、IPS-1、FADD、RIP1、TRAF3、AIM2、ASC、胱天蛋白酶1、Pro-IL1B、PI3K、Akt、Wnt3A的抑制剂,糖原合酶激酶-3β(GSK-3β)的抑制剂(例如TWS119),巴弗洛霉素,氯喹,奎纳克林,AC-YVAD-CMK、Z-VAD-FMK、Z-IETD-FMK及其任何组合。示例性补充因子包括,但不限于,以增强细胞递送、增强核递送或转运、增强核酸向细胞核内的易化转运、增强染色体外核酸的降解和/或降低DNA-介导的毒性的方式修饰或稳定一种或多种核酸的试剂。示例性的修饰或稳定一种或多种核酸的试剂包括,但不限于,pH调节物、DNA结合蛋白、脂质、磷脂、CaPO4、具有或不具有NLS序列的净中性电荷DNA结合肽、TREX1酶及其任何组合。
本公开内容的核转染后细胞培养基(包括本公开内容的核转染后T细胞培养基)可以于室温使用或预热至例如32℃-37℃(包括端点)。可将本公开内容的核转染后细胞培养基(包括本公开内容的核转染后T细胞培养基)预热至维持或增强细胞生存力和/或本公开内容的转座子或其部分的表达的任何温度。
本公开内容的核转染后细胞培养基(包括本公开内容的核转染后T细胞培养基)可以包含在组织培养瓶或皿、G-Rex瓶、生物反应器或细胞培养袋或任何其他标准容器中。本公开内容的核转染后细胞培养物(包括本公开内容的核转染后T细胞培养物)可以保持静止,或者替代地它们可以被扰动(例如,摇动、回荡或振荡)。
核转染后细胞培养物可包含基因修饰细胞。核转染后T细胞培养物可包含基因修饰T细胞。本公开内容的基因修饰细胞可以静息确定的时间段或通过例如添加T细胞扩增剂(Expander)技术来刺激用于扩增。在某些实施方案中,本公开内容的基因修饰细胞可以静息确定的时间段或立即通过例如添加T细胞扩增剂技术来刺激用于扩增。可以使本公开内容的基因修饰细胞静息以向其提供足够的进行适应的时间、用于发生转座的时间和/或用于进行阳性选择或阴性选择的时间,从而得到具有增强的生存力、更高核转染效率、在核转染后更大的生存力、期望的细胞表型和/或在添加扩增技术时更大/更快的扩增的细胞。本公开内容的基因修饰细胞可以静息例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或更多小时。在某些实施方案中,本公开内容的基因修饰细胞可以静息例如过夜。在某些方面,过夜是约12小时。本公开内容的基因修饰细胞可以静息例如1、2、3、4、5、6、7、8、9、10、11、12、13、14或更多天。
本公开内容的基因修饰细胞可以在核转染反应后和添加扩增剂技术之前进行选择。对于基因修饰细胞的最优选择,可以允许细胞在核转染后细胞培养基中静息至少2-14天,以促进修饰的细胞的鉴定(例如,将修饰的细胞与非修饰的细胞区别开)。
在本公开内容的转座子成功进行核转染时,早在核转染后24小时,就可在修饰的T细胞中检测到本公开内容的CAR/CARTyrin和选择标记的表达。由于转座子的染色体外表达,单独选择标记的表达可能不能将修饰的T细胞(其中已成功整合转座子的那些细胞)与未修饰的T细胞(其中未成功整合转座子的那些细胞)区别开。当转座子的染色体外表达使通过选择标记对修饰的细胞的检测模糊不清时,核转染的细胞(修饰的和未修饰的细胞两者)可以静息一段时间(例如2-14天)以允许细胞停止表达或丧失所有染色体外转座子表达。在这个延长的静息时间段后,只有修饰的T细胞对于选择标记的表达应保持阳性。对于每个核转染反应和选择过程,可以最优化这个延长的静息时间段的长度。当转座子的染色体外表达使通过选择标记对修饰的细胞的检测模糊不清时,可以在没有这个延长的静息时间段的情况下进行选择,然而,可以在较后的时间点(例如,在扩增阶段期间或之后)包括额外的选择步骤。
本公开内容的基因修饰细胞的选择可以通过任何手段进行。在本公开内容的方法的某些实施方案中,可以通过分离表达特定选择标记的细胞来进行本公开内容的基因修饰细胞的选择。本公开内容的选择标记可以由转座子中的一种或多种序列编码。作为成功转座的结果,可以由修饰的细胞表达本公开内容的选择标记(即,不是由转座子中的一种或多种序列编码)。在某些实施方案中,本公开内容的基因修饰细胞包含赋予对核转染后细胞培养基的有害化合物的抗性的选择标记。有害化合物可包括,例如,抗生素或药物,其在没有由选择标记给修饰细胞赋予的抗性的情况下将导致细胞死亡。示例性选择标记包括,但不限于,一种或多种以下基因的野生型(WT)或突变形式:neo、DHFR、TYMS、ALDH、MDR1、MGMT、FANCF、RAD51C、GCS和NKX2.2。示例性选择标记包括,但不限于,表面表达的选择标记或表面表达的标签,可以分别通过Ab-包被的磁珠技术或柱选择来靶向。可将诸如在蛋白纯化中使用的那些的可切割标签添加至本公开内容的选择标记,以用于有效的柱选择、洗涤和洗脱。在某些实施方案中,本公开内容的选择标记不是由修饰的细胞(包括修饰的T细胞)内源表达的,且因此可以在物理分离修饰的细胞中有用(通过例如细胞分选技术)。示例性的不由修饰的细胞(包括修饰的T细胞)内源表达的本公开内容的选择标记包括,但不限于,全长、突变或截短形式的CD271、CD19 CD52、CD34、RQR8、CD22、CD20、CD33及其任何组合。
本公开内容的基因修饰细胞可在核转染反应后选择性扩增。在某些实施方案中,包含VCAR的修饰的T细胞可通过VCAR刺激选择性扩增。可以通过与靶覆盖的试剂(例如表达靶的肿瘤系或正常细胞系或覆盖满靶的扩增剂珠)接触来刺激包含VCAR的修饰的T细胞。另一方面,可以通过与经辐射的肿瘤细胞、经辐射的同种异体正常细胞、经辐射的自体PBMC接触来刺激包含VCAR的修饰的T细胞。为了使本公开内容的细胞产品组合物被用于刺激的表达靶的细胞的污染减至最小,例如,当可以将细胞产品组合物直接施用于受试者时,可以使用包被有VCAR靶蛋白的扩增剂珠进行刺激。可以最优化通过VCAR刺激的包含VCAR的修饰的T细胞的选择性扩增,以避免功能上耗尽修饰的T细胞。
本公开内容的选择的基因修饰细胞可以冷冻保存、静息确定的时间段或通过添加细胞扩增剂技术来刺激用于扩增。本公开内容的选择的基因修饰细胞可以冷冻保存、静息确定的时间段或立即通过添加细胞扩增剂技术来刺激用于扩增。当选择的基因修饰细胞是T细胞时,可以通过添加T细胞扩增剂技术来刺激T细胞用于扩增。本公开内容的选择的基因修饰细胞可以静息例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或更多小时。在某些实施方案中,本公开内容的选择的基因修饰细胞可以静息例如过夜。在某些方面,过夜是约12小时。本公开内容的选择的基因修饰细胞可以静息例如1、2、3、4、5、6、7、8、9、10、11、12、13、14或更多天。可以使本公开内容的选择的基因修饰细胞静息结果产生具有增强的生存力、更高核转染效率、在核转染后更大的生存力、期望的细胞表型和/或在添加扩增技术时更大/更快的扩增的细胞的任何时间段。
选择的基因修饰细胞(包括本公开内容的选择的基因修饰T细胞)可以使用任何标准冷冻保存方法进行冷冻保存,所述方法可以进行最优化,以用于以高回收率、生存力、表型和/或功能能力贮藏和/或回收人细胞。本公开内容的冷冻保存方法可以包括可商购获得的冷冻保存介质和/或规程。
可以通过任何手段评估选择的基因修饰细胞(包括本公开内容的选择的基因修饰T细胞)的转座效率。例如,在应用扩增剂技术之前,可以通过荧光激活细胞分选术(FACS)来测量选择的基因修饰细胞(包括本公开内容的选择的基因修饰T细胞)对转座子的表达。确定选择的基因修饰细胞(包括本公开内容的选择的基因修饰T细胞)的转座效率可以包括确定表达转座子(例如VCAR)的选择的细胞的百分比。替代地或额外地,可以通过任何手段评估T细胞的纯度、转座子表达(例如CAR表达)的平均荧光强度(MFI)、VCAR(在转座子中递送的)介导表达VCAR配体的靶细胞脱粒和/或杀伤的能力和/或选择的基因修饰细胞(包括本公开内容的选择的基因修饰T细胞)的表型。
在满足某些发行(release)标准时,本公开内容的细胞产品组合物可以被发行用于施用于受试者。示例性发行标准可以包括,但不限于,特定百分比的在细胞表面表达可检测水平的VCAR的修饰的、选择的和/或扩增的T细胞。
自体T细胞产品组合物的基因修饰
本公开内容的基因修饰细胞(包括基因修饰T细胞)可以使用扩增剂技术进行扩增。本公开内容的扩增剂技术可以包括可商购获得的扩增剂技术。示例性的本公开内容的扩增剂技术包括通过TCR刺激本公开内容的基因修饰T细胞。尽管考虑用于刺激本公开内容的基因修饰T细胞的所有手段,但通过TCR刺激本公开内容的基因修饰T细胞是优选的方法,从而产生具有优越杀伤能力水平的产品。
为了通过TCR刺激本公开内容的基因修饰T细胞,可以以3∶1的珠与T细胞比使用Thermo Expander DynaBeads。如果扩增剂珠不是生物可降解的,则可以从扩增剂组合物中除去珠。例如,可以在约5天后从扩增剂组合物中除去珠。为了通过TCR刺激本公开内容的基因修饰T细胞,可以使用Miltenyi T细胞激活/扩增试剂(Miltenyi T Cell Activation/Expansion Reagent)。为了经由TCR刺激本公开内容的基因修饰T细胞,可以使用StemCellTechnologies的ImmunoCult人CD3/CD28或CD3/CD28/CD2 T细胞激活剂试剂。这个技术可能是优选的,这是因为可溶的四聚体抗体复合体将在一段时间后降解,并且将不需要从工艺中除去。
人工抗原呈递细胞(APC)可以被工程化以共表达靶抗原,并且可以用于通过本公开内容的TCR和/或VCAR来刺激本公开内容的细胞或T细胞。人工APC可包含或可衍生自肿瘤细胞系(包括,例如,永生化的髓细胞性白血病系K562),并可进行工程化以共表达多种共刺激分子或技术(例如CD28、4-1BBL、CD64、mbIL-21、mbIL-15、CAR靶分子等)。当本公开内容的人工APC与共刺激分子组合时,可以最优化条件以防止不期望的表型和功能能力即终末分化的效应T细胞的发展或出现。
经辐射的PBMC(自身或同种异体)可以表达一些靶抗原,例如CD19,并且可以用于通过本公开内容的TCR和/或VCAR来刺激本公开内容的细胞或T细胞。替代地或额外地,经辐射的肿瘤细胞可以表达一些靶抗原,并且可以用于通过本公开内容的TCR和/或VCAR来刺激本公开内容的细胞或T细胞。
板结合的和/或可溶的抗-CD3、抗-CD2和/或抗-CD28刺激可以用于通过本公开内容的TCR和/或VCAR来刺激本公开内容的细胞或T细胞。
抗原包被的珠可以展示靶蛋白,并且可以用于通过本公开内容的TCR和/或VCAR来刺激本公开内容的细胞或T细胞。替代地或额外地,用VCAR靶蛋白包被的扩增剂珠可以用于通过本公开内容的TCR和/或VCAR来刺激本公开内容的细胞或T细胞。
扩增方法被引导通过TCR或VCAR并通过基因修饰T细胞上表面表达的CD2、CD3、CD28、4-1BB和/或其他标记刺激本公开内容的细胞或T细胞。
可以在核转染后立即将扩增技术应用于本公开内容的细胞,直到核转染后约24小时。尽管在扩增程序过程中可以使用各种细胞培养基,但是本公开内容的期望的T细胞扩增培养基可以产生具有例如更高的生存力、细胞表型、总扩增或更高的用于体内持久性、移植和/或CAR-介导的杀伤的能力的细胞。可以最优化本公开内容的细胞培养基以改善/增强本公开内容的基因修饰细胞的扩增、表型和功能。扩增的T细胞的优选表型可以包括T干细胞记忆、T中央和T效应记忆细胞的混合物。扩增剂Dynabeads可能主要产生可能导致在临床上优越表现的中央记忆T细胞。
本公开内容的示例性T细胞扩增培养基可以部分或全部包括PBS、HBSS、OptiMEM、DMEM、RPMI 1640、AIM-V、X-VIVO 15、CellGro DC培养基、CTS OpTimizer T细胞扩增SFM、TexMACS培养基、PRIME-XV T细胞扩增培养基、ImmunoCult-XF T细胞扩增培养基或其任何组合。本公开内容的T细胞扩增培养基可进一步包含一种或多种补充因子。可以包含在本公开内容的T细胞扩增培养基中的补充因子增强生存力、细胞表型、总扩增或增加用于体内持久性、移植和/或VCAR-介导的杀伤的能力。可以包含在本公开内容的T细胞扩增培养基中的补充因子包括,但不限于,重组人细胞因子、趋化因子和/或白介素,例如,IL2、IL7、IL12、IL15、IL21、IL1、IL3、IL4、IL5、IL6、IL8、CXCL8、IL9、IL10、IL11、IL13、IL14、IL16、IL17、IL18、IL19、IL20、IL22、IL23、IL25、IL26、IL27、IL28、IL29、IL30、IL31、IL32、IL33、IL35、IL36、GM-CSF、IFN-γ、IL-1α/IL-1F1、IL-1β/IL-1F2、IL-12p70、IL-12/IL-35 p35、IL-13、IL-17/IL-17A、IL-17A/F异二聚体、IL-17F、IL-18/IL-1F4、IL-23、IL-24、IL-32、IL-32β、IL-32γ、IL-33、LAP(TGF-β1)、淋巴毒素-α/TNF-β、TGF-β、TNF-α、TRANCE/TNFSF11/RANK L或其任何组合。可以包含在本公开内容的T细胞扩增培养基中的补充因子包括,但不限于,盐、矿物质和/或代谢物,例如,HEPES、烟酰胺、肝素、丙酮酸钠、L-谷氨酰胺、MEM非必需氨基酸溶液、抗坏血酸、核苷、FBS/FCS、人血清、血清替代物、抗生素、pH调节剂、厄尔氏盐、2-巯基乙醇、人转铁蛋白、重组人胰岛素、人血清白蛋白、核转染仪PLUS补充物、KCL、MgCl2、Na2HPO4、NAH2PO4、乳糖酸钠、甘露糖醇、琥珀酸钠、氯化钠、CINa、葡萄糖、Ca(NO3)2、Tris/HCl、K2HPO4、KH2PO4、聚氮丙啶、聚乙二醇、泊洛沙姆188、泊洛沙姆181、泊洛沙姆407、聚乙烯吡咯烷酮、Pop313、Crown-5或其任何组合。可以包含在本公开内容的T细胞扩增培养基中的补充因子包括,但不限于,细胞DNA感应、代谢、分化、信号转导和/或凋亡途径的抑制剂,例如,TLR9、MyD88、IRAK、TRAF6、TRAF3、IRF-7、NF-KB、1型干扰素、促炎细胞因子、cGAS、STING、Sec5、TBK1、IRF-3、RNA pol III、RIG-1、IPS-1、FADD、RIP1、TRAF3、AIM2、ASC、胱天蛋白酶1、Pro-IL1B、PI3K、Akt、Wnt3A的抑制剂,糖原合酶激酶-3β(GSK-3β)的抑制剂(例如TWS119),巴弗洛霉素,氯喹,奎纳克林,AC-YVAD-CMK、Z-VAD-FMK、Z-IETD-FMK或其任何组合。
可以包含在本公开内容的T细胞扩增培养基中的补充因子包括,但不限于,以增强细胞递送、增强核递送或转运、增强核酸向细胞核内的被促进的转运、增强染色体外核酸的降解和/或降低DNA-介导的毒性的方式修饰或稳定核酸的试剂,例如,pH调节物、DNA结合蛋白、脂质、磷脂、CaPO4、具有或不具有NLS序列的净中性电荷DNA结合肽、TREX1酶或其任何组合。
可以在扩增过程期间通过使用选择性药物或化合物来选择本公开内容的基因修饰细胞。例如,在某些实施方案中,当本公开内容的转座子可以编码赋予基因修饰细胞对添加到培养基的药物的抗性的选择标记时,选择可以在扩增过程期间发生并且可能需要约1-14天培养用于发生选择。可以用作由本公开内容的转座子编码的选择标记的抗药基因的实例包括,但不限于,基因neo、DHFR、TYMS、ALDH、MDR1、MGMT、FANCF、RAD51C、GCS、NKX2.2或其任何组合的野生型(WT)或突变形式。选择标记可赋予其抗性的可以添加至培养基中的相应药物或化合物的实例包括,但不限于,G418、嘌呤霉素、氨苄青霉素、卡那霉素、氨甲蝶呤、马法兰(Mephalan)、替莫唑胺、长春新碱、依托泊苷、阿霉素、宾达氮芥、氟达拉滨、阿可达(帕米膦酸钠)、卡氮芥(卡莫司汀)、BiCNU(卡莫司汀)、硼替佐米(Bortezomib)、卡非佐米(Carfilzomib)、亚硝脲氮芥(卡莫司汀)、卡莫司汀、环磷氮芥(环磷酰胺)、环磷酰胺、安道生(环磷酰胺)、达雷木单抗(Daratumumab)、Darzalex(达雷木单抗)、Doxil(盐酸阿霉素脂质体)、盐酸阿霉素脂质体、Dox-SL(盐酸阿霉素脂质体)、埃罗妥珠单抗(Elotuzumab)、Empliciti(埃罗妥珠单抗)、Evacet(盐酸阿霉素脂质体)、Farydak(帕比司他(Panobinostat))、柠檬酸艾沙佐米(Ixazomib Citrate)、Kyprolis(卡非佐米)、来那度胺(Lenalidomide)、LipoDox(盐酸阿霉素脂质体)、Mozobil(普乐沙福(Plerixafor))、Neosar(环磷酰胺)、Ninlaro(柠檬酸艾沙佐米)、帕米膦酸钠、帕比司他、普乐沙福、泊马度胺(Pomalidomide)、Pomalyst(泊马度胺)、Revlimid(来那度胺)、Synovir(沙立度胺)、沙立度胺、酞胺哌啶酮(沙立度胺)、Velcade(硼替佐米)、唑来膦酸(Zoledronic Acid)、Zometa(唑来膦酸)或其任何组合。
本公开内容的T细胞扩增过程可以在WAVE生物反应器、G-Rex瓶中或在任何其他合适的容器和/或反应器中在细胞培养袋中发生。
本公开内容的细胞或T细胞培养物可以保持稳定、摇动、回荡或振动。
本公开内容的细胞或T细胞扩增过程可以最优化某些条件,包括,但不限于,培养持续时间、细胞浓度、T细胞培养基添加/去除的时间表、细胞大小、总细胞数目、细胞表型、细胞群体的纯度、基因修饰细胞在生长中的细胞群体中的百分比、补充物的使用和组成、扩增剂技术的添加/去除或其任何组合。
在配制作为结果而产生的扩增的细胞群体之前,可以继续本公开内容的细胞或T细胞扩增过程,直到预定终点。例如,本公开内容的细胞或T细胞扩增过程可以继续预定量的时间:至少2、4、6、8、10、12、14、16、18、20、22、24小时;至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30天;至少1、2、3、4、5、6、7、8、9、10、11、12周;至少1、2、3、4、5、6个月或至少1年。本公开内容的细胞或T细胞扩增过程可以继续,直到作为结果而产生的培养物达到预定的总细胞密度:每体积(μl、ml、L)1、10、100、1000、104、105、106、107、108、109、1010个细胞或其间任何密度。本公开内容的细胞或T细胞扩增过程可以继续,直到作为结果而产生的培养物的基因修饰细胞显示本公开内容的转座子的预定水平的表达:1%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%或其间任何百分比的阈值表达水平(表明作为结果而产生的基因修饰细胞在临床上有效的最低、最高或平均表达水平)。本公开内容的细胞或T细胞扩增过程可以继续,直到作为结果而产生的培养物的基因修饰细胞与未修饰的细胞部分的比例达到预定阈值:至少1∶10、1∶9、1∶8、1∶7、1∶6、1∶5、1∶4、1∶3、1∶2、1∶1、2∶1、2∶1、4∶1、5∶1、6∶1、7∶1、8∶1、9∶1 10∶1或其间的任何比例。
用于发行的基因修饰自体T细胞的分析
可以在本公开内容的扩增过程期间或之后评估基因修饰细胞的百分比。可以通过荧光激活细胞分选术(FACS)来测量本公开内容的基因修饰细胞对转座子的细胞表达。例如,FACS可用于确定表达本公开内容的VCAR的细胞或T细胞的百分比。替代地或额外地,可以评估基因修饰细胞或T细胞的纯度、由本公开内容的基因修饰细胞或T细胞表达的VCAR的平均荧光强度(MFI)、VCAR介导表达VCAR配体的靶细胞脱粒和/或杀伤的能力和/或VCAR+ T细胞的表型。
意欲给受试者施用的本公开内容的组合物可能需要满足一个或多个“发行标准”,所述“发行标准”表明所述组合物对于配制成药物产品和/或施用给受试者是安全和有效的。发行标准可包括要求本公开内容的组合物(例如本公开内容的T细胞产品)包含特定百分比的在其细胞表面上表达可检测水平的本公开内容的VCAR的T细胞。
扩增过程应该继续,直到已满足特定标准(例如,达到一定的总细胞数目、达到特定的记忆细胞群体、达到特定大小的群体)。
某种标准标志着扩增过程应终止的点。例如,一旦细胞达到300fL的细胞大小,就应该对其进行配制、重新激活或冷冻保存(否则,达到这个阈值以上大小的细胞可能开始死亡)。一旦细胞群体达到小于300fL的平均细胞大小就立即进行的冷冻保存在解冻和培养时可产生更好的细胞回收,这是因为细胞在冷冻保存之前尚未达到完全静止的状态(完全静止的大小为约180fL)。在扩增之前,本公开内容的T细胞可具有约180fL的细胞大小,但是在扩增后3天时可使其细胞大小成为多于四倍至约900fL。在接下来的6-12天期间,T细胞群体将慢慢减小细胞大小至在180fL时的完全静止。
用于制备用于制剂的细胞群体的方法可包括,但不限于,以下步骤:浓缩细胞群体的细胞,洗涤细胞,和/或通过抗药性或针对特定的表面表达的标记的磁珠分选进一步选择细胞。用于制备用于制剂的细胞群体的方法可以进一步包括分选步骤,以确保最终产品的安全性和纯度。例如,如果来自患者的肿瘤细胞已被用于刺激本公开内容的基因修饰T细胞或已经被基因修饰以刺激正在制备用于制剂的本公开内容的基因修饰T细胞,关键的是最终产品中不包含来自患者的肿瘤细胞。
细胞产品输注和/或冷冻保存用于输注
本公开内容的药物制剂可以被分配到用于输注、冷冻保存和/或贮藏的袋中。
可以使用标准规程和任选地可输注的冷冻保存介质将本公开内容的药物制剂冷冻保存。例如,不含DMSO的冷冻保存剂(例如,CryoSOfree
本公开内容的药物制剂可以于室温贮藏。有效的治疗可能需要多次施用本公开内容的药物制剂,且因此,药物制剂可以以可以一起贮藏但被分开以用于施用各个剂量的预先等分的“剂量”包装。
本公开内容的药物制剂可以被归档用于随后的再扩增和/或选择,以用于给在同种异体治疗的情况下的相同患者产生额外的剂量,所述患者可能需要在例如状况缓和复发后的将来的日期的施用。
制剂
如上文所指出的,本公开内容提供了稳定的制剂,其优选包含具有盐水或选择的盐的磷酸盐缓冲剂,以及保存的溶液,和含有防腐剂的制剂以及适合于药物或兽医用途的多种用途保存的制剂,其包含在药学可接受的制剂中的至少一种VCAR。保存的制剂含有至少一种已知的防腐剂或任选选自至少一种酚、间甲酚、对甲酚、邻甲酚、氯甲酚、苄醇、亚硝酸苯汞、苯氧乙醇、甲醛、氯代丁醇、氯化镁(例如,六水合物)、对羟基苯甲酸烷基酯(甲基、乙基、丙基、丁基等)、苯扎氯铵、苯索氯铵、脱氢乙酸钠和硫柳汞,聚合物,或它们在水性稀释剂中的混合物。如本领域中已知的,可以使用任何合适的浓度或混合物,例如约0.0015%,或其中的任何范围、值或分数。非限制性实例包括,无防腐剂、约0.1-2%间甲酚(例如,0.2、0.3、0.4、0.5、0.9、1.0%)、约0.1-3%苄醇(例如,0.5、0.9、1.1、1.5、1.9、2.0、2.5%)、约0.001-0.5%硫柳汞(例如,0.005、0.01)、约0.001-2.0%苯酚(例如,0.05、0.25、0.28、0.5、0.9、1.0%)、一种或多种0.0005-1.0%对羟基苯甲酸烷基酯(例如,0.00075、0.0009、0.001、0.002、0.005、0.0075、0.009、0.01、0.02、0.05、0.075、0.09、0.1、0.2、0.3、0.5、0.75、0.9、1.0%)等。
如上文所指出的,本发明提供了一种制品,其包括包装材料和至少一个小瓶,所述小瓶包含具有规定的缓冲剂和/或防腐剂的至少一种VCAR的溶液,任选地在水性稀释剂中,其中所述包装材料包括表明这种溶液可以在1、2、3、4、5、6、9、12、18、20、24、30、36、40、48、54、60、66、72小时或更长时间段期间保存的标签。本发明进一步包含一种制品,其包括包装材料,包含冻干的至少一种VCAR的第一小瓶和包含规定的缓冲剂或防腐剂的水性稀释剂的第二小瓶,其中所述包装材料包括标签,所述标签指示患者在水性稀释剂中重构所述至少一种VCAR以形成溶液,所述溶液可以在二十四小时或更长时间段期间保存。
如本文所述或如本领域所已知的,根据本发明使用的至少一种VCAR可以通过重组手段,包括从哺乳动物细胞或转基因制剂产生,或者可以从其他生物来源纯化。
本发明产品中至少一种VCAR的范围包括在重构时(如果在湿/干系统中)产生约1.0μg/ml至约1000mg/ml的浓度的量,尽管更低和更高的浓度是切实可行的并且取决于预期的递送载体,例如,溶液制剂将不同于透皮贴剂(patch)、肺、跨粘膜或渗透或微量泵方法。
优选地,水性稀释剂任选地进一步包含药学可接受的防腐剂。优选的防腐剂包括选自苯酚、间甲酚、对甲酚、邻甲酚、氯甲酚、苄醇、对羟基苯甲酸烷基酯(甲基、乙基、丙基、丁基等)、苯扎氯铵、苯索氯铵、脱氢乙酸钠和硫柳汞的那些或其混合物。制剂中使用的防腐剂的浓度是足以产生抗微生物作用的浓度。这种浓度取决于所选择的防腐剂,并且是本领域技术人员容易确定的。
其他赋形剂,例如,等渗性试剂、缓冲剂、抗氧化剂和防腐增强剂可以任选地和优选地添加至稀释剂中。等渗性试剂,例如甘油,通常于已知浓度使用。优选添加生理耐受的缓冲剂以提供改善的pH控制。所述制剂可以包含宽范围的pH,例如约pH 4至约pH 10,和约pH 5至约pH 9的优选范围,和约6.0至约8.0的最优选范围。优选地,本发明的制剂具有约6.8至约7.8的pH。优选的缓冲剂包括磷酸盐缓冲剂,最优选磷酸钠,特别是磷酸缓冲盐水(PBS)。
其他添加剂,例如药学可接受的增溶剂,例如吐温20(聚氧乙烯(20)脱水山梨糖醇单月桂酸酯)、吐温40(聚氧乙烯(20)脱水山梨糖醇单棕榈酸酯)、吐温80(聚氧乙烯(20)脱水山梨糖醇单油酸酯)、Pluronic F68(聚氧乙烯聚氧丙烯嵌段共聚物)和PEG(聚乙二醇)或非离子型表面活性剂,例如聚山梨醇酯20或80或泊洛沙姆184或188,
本发明的制剂可以通过包括将至少一种VCAR和选自苯酚、间甲酚、对甲酚、邻甲酚、氯甲酚、苄醇、对羟基苯甲酸烷基酯(甲基、乙基、丙基、丁基等)、苯扎氯铵、苯索氯铵、脱氢乙酸钠和硫柳汞的防腐剂或它们在水性稀释剂中的混合物混合的方法制备。使用常规的溶解和混合程序进行至少一种VCAR和防腐剂在水性稀释剂中的混合。为了制备合适的制剂,例如,将在缓冲的溶液中的测量量的至少一种VCAR与在缓冲的溶液中的所期望的防腐剂以足以提供所期望的浓度的蛋白和防腐剂的量组合。本领域普通技术人员将认识到这种方法的变化形式。例如,组分的添加顺序、是否使用额外的添加剂、制备制剂的温度和pH都是可以对于所使用的浓度和施用方式进行最优化的因素。
所请求保护的制剂可以作为透明溶液或作为双重小瓶提供给患者,所述双重小瓶包括用第二小瓶重构的冻干的至少一种VCAR的小瓶,所述第二小瓶含有水、防腐剂和/或赋形剂,优选在水性稀释剂中的磷酸盐缓冲剂和/或盐水和选择的盐。单溶液小瓶或需要重构的双重小瓶都可以多次重复使用,并且可以满足患者治疗的单个或多个周期,且因此可以提供比目前可用的更方便的治疗方案。
本发明请求保护的制品可用于在从立即一直到24小时或更长时间段期间施用。因此,本发明请求保护的制品为患者提供了显著的优点。本发明的制剂可以任选地安全地于约2℃至约40℃的温度贮藏,并保持蛋白的生物活性达延长的时间段,从而允许指出可以在6、12、18、24、36、48、72或96个小时或更长时间段期间保存和/或使用溶液的包装标签。如果使用了保存的稀释剂,则这种标签可以包括最多到1-12个月、半年、一年半和/或两年的使用。
本发明的至少一种VCAR的溶液可以通过包括将至少一种VCAR在水性稀释剂中混合的方法来制备。使用常规的溶解和混合程序进行混合。为了制备合适的稀释剂,例如,将在水或缓冲剂中的测量量的至少一种VCAR以足以提供所期望的浓度的蛋白和任选防腐剂或缓冲剂的量组合。本领域普通技术人员将认识到这种方法的变化形式。例如,组分的添加顺序、是否使用额外的添加剂、制备制剂的温度和pH都是可以对于所使用的浓度和施用方式进行最优化的因素。
所请求保护的产品可以作为透明溶液或作为双重小瓶提供给患者,所述双重小瓶包括用含有水性稀释剂的第二小瓶重构的冻干的至少一种VCAR的小瓶。单溶液小瓶或需要重构的双重小瓶都可以多次重复使用,并且可以满足患者治疗的单个或多个周期,且因此提供比目前可用的更方便的治疗方案。
可以通过向药房、诊所或其他这种机构和设施提供透明溶液或双重小瓶来间接地向患者提供所请求保护的产品,所述双重小瓶包括冻干的至少一种VCAR的小瓶,其用含有水性稀释剂的第二小瓶重构。在这种情况下,透明溶液可以最多到一升或甚至更大的大小,从而提供大的储存器,从中可以一次或多次提取所述至少一种VCAR溶液的较小部分用于转移到较小的小瓶中,并由药房或诊所提供给其顾客和/或患者。
公认的包括单个小瓶系统的装置包括用于递送溶液的笔式注射器(pen-injector)装备,例如BD Pens,BD
本发明请求保护的产品包括包装材料。除了管理机构要求的信息以外,包装材料还提供了可以使用产品的条件。本发明的包装材料向患者提供了对于两小瓶湿/干产品在水性稀释剂中重构至少一种VCAR以形成溶液并且在2-24小时或更长时间段期间使用所述溶液的说明书。对于单个小瓶溶液产品,标签表明这种溶液可以在2-24小时或更长时间段期间使用。本发明请求保护的产品可用于人药物产品用途。
本发明的制剂可以通过包括将至少一种VCAR和选择的缓冲剂,优选地,含有盐水或选择的盐的磷酸盐缓冲剂混合的方法制备。使用常规的溶解和混合程序进行至少一种VCAR和缓冲剂在水性稀释剂中的混合。为了制备合适的制剂,例如,将在水或缓冲剂中的测量量的至少一种VCAR与在水中的所期望的缓冲剂以足以提供所期望的浓度的蛋白和缓冲剂的量组合。本领域普通技术人员将认识到这种方法的变化形式。例如,组分的添加顺序、是否使用额外的添加剂、制备制剂的温度和pH都是可以对于所使用的浓度和施用方式进行最优化的因素。
所请求保护的稳定或保存的制剂可以作为透明溶液或作为双重小瓶提供给患者,所述双重小瓶包括冻干的VCAR的小瓶,其用第二小瓶重构,所述第二小瓶含有在水性稀释剂中的防腐剂或缓冲剂和赋形剂。单个溶液小瓶或需要重构的双重小瓶都可以多次重复使用,并且可以满足患者治疗的单个或多个周期,且因此提供比目前可用的更方便的治疗方案。
稳定VCAR的其他制剂或方法可以得到除包含VCAR的冻干粉末的透明溶液以外的那些。在非透明溶液中有包含颗粒悬浮液的制剂,所述颗粒是具有可变尺寸的结构并被不同地称为微球、微粒、纳米颗粒、纳米球(nanosphere)或脂质体的含有VCAR的组合物。可以通过使含有活性剂和聚合物的水相与非水相接触继之以蒸发非水相以引起颗粒从水相中凝聚来形成这种含有活性剂的相对同质的、基本上球形的颗粒制剂,如在美国专利号4,589,330中所教导的。多孔微粒可以使用含有分散在连续溶剂中的活性剂和聚合物的第一相并通过冷冻干燥或稀释-提取-沉淀从悬浮液中除去所述溶剂来制备,如美国专利号4,818,542中所教导的。用于这种制剂的优选聚合物是选自下述的天然或合成共聚物或聚合物:明胶琼脂、淀粉、阿拉伯半乳聚糖、白蛋白、胶原、聚乙醇酸、聚乳酸、乙交酯-L(-)丙交酯聚ε-己内酯、聚(ε-己内酯-CO-乳酸)、聚(ε-己内酯-CO-乙醇酸)、聚β-羟基丁酸、聚环氧乙烷、聚乙烯、聚烷基-2-氰基丙烯酸酯、聚甲基丙烯酸羟乙酯、聚酰胺、聚氨基酸、聚2-羟乙基DL-天冬酰胺、聚酯脲、聚(L-苯丙氨酸/乙二醇/1,6-二异氰酸己烷)(poly(L-phenylalanine/ethylene glycol/1,6-diisocyanatohexane))和聚甲基丙烯酸甲酯。特别优选的聚合物是聚酯,例如聚乙醇酸、聚乳酸、乙交酯-L(-)丙交酯聚ε-己内酯、聚(ε-己内酯-CO-乳酸)和聚(ε-己内酯-CO-乙醇酸。可用于溶解聚合物和/或活性物质的溶剂包括:水、六氟异丙醇、二氯甲烷、四氢呋喃、己烷、苯或六氟丙酮倍半水合物(sesquihydrate)。将含有活性物质的相用第二相分散的过程可包括推动所述第一相通过喷嘴中的小孔以影响液滴形成的压力。
干粉制剂可以由除冻干以外的方法产生,例如通过喷雾干燥或通过蒸发或通过结晶组合物的沉淀继之以一个或多个步骤以除去水性或非水性溶剂的溶剂萃取。喷雾干燥的VCAR制剂的制备在美国专利号6,019,968中教导。基于VCAR的干粉组合物可以通过在提供可以呼吸的干粉的条件下,在溶剂中喷雾干燥VCAR和任选地赋形剂的溶液或浆液来生产。溶剂可以包括可能容易干燥的极性化合物,例如水和乙醇。可以通过在没有氧的情况下(例如在氮气覆盖层下或通过使用氮作为干燥气体)进行喷雾干燥程序来增强VCAR稳定性。另一种相对干燥的制剂是分散在悬浮介质中的许多有孔微观结构的分散体,所述悬浮介质一般包含氢氟烷(hydrofluoroalkane)推进剂,如WO 9916419中所教导的。可以使用计量剂量吸入器将稳定的分散体施用于患者的肺。可用于商业生产喷雾干燥的药物的装置由BuchiLtd.或Niro Corp.制造。
本文所述的稳定或保存的制剂或溶液中的至少一种VCAR可以通过多种递送方法根据本发明施用于患者,包括SC或IM注射;透皮、肺、跨黏膜、植入、渗透泵、药筒、微量泵或本领域技术人员知道的其他方式,如本领域中众所周知的。
治疗应用
本发明还提供了使用本发明的至少一种VCAR调节或治疗如本领域中所已知或如本文所述的细胞、组织、器官、动物或患者中的疾病的方法,例如,将治疗有效量的VCAR施用于所述细胞、组织、器官、动物或患者或使所述细胞、组织、器官、动物或患者与治疗有效量的VACR接触。本发明还提供了用于调节或治疗细胞、组织、器官、动物或患者中的疾病,包括但不限于恶性疾病的方法。
本发明还提供了用于调节或治疗细胞、组织、器官、动物或患者中的至少一种恶性疾病的方法,所述恶性疾病包括但不限于以下中的至少一种:白血病、急性白血病、急性成淋巴性细胞白血病(ALL),急性淋巴细胞性白血病、B细胞、T细胞或FAB ALL、急性髓细胞性白血病(AML)、急性骨髓性白血病、慢性粒细胞性白血病(CML),慢性淋巴细胞性白血病(CLL)、毛细胞白血病、骨髓增生异常综合征(MDS)、淋巴瘤、霍奇金病、恶性淋巴瘤、非霍奇金淋巴瘤、伯基特淋巴瘤、多发性骨髓瘤、卡波济肉瘤、结直肠癌、胰腺癌、鼻咽癌、恶性组织细胞病、副肿瘤综合征/恶性高钙血症、实体瘤、膀胱癌、乳腺癌、结肠直肠癌、子宫内膜癌、头癌、颈癌、遗传性非息肉癌,霍奇金淋巴瘤、肝癌、肺癌、非小细胞肺癌、卵巢癌、胰腺癌、前列腺癌、肾细胞癌、睾丸癌、腺癌、肉瘤、恶性黑素瘤、血管瘤、转移性疾病、与癌相关的骨吸收、与癌相关的骨痛等。
本发明的任何方法可包括将有效量的包含至少一种VCAR的组合物或药物组合物施用于需要这种调节、治疗或疗法的细胞、组织、器官、动物或患者。这种方法可以任选地进一步包括用于治疗这种疾病或病症的共同施用或联合治疗,其中所述至少一种VCAR、其指定部分或变体的施用进一步包括在之前、同时和/或之后施用选自至少一种烷化剂、有丝分裂抑制剂和放射性药物的至少一种。合适的剂量是本领域众所周知的。参见,例如,Wells等人,编辑,Pharmacotherapy Handbook,第2版,Appleton and Lange,Stamford,Conn.(2000);PDR Pharmacopoeia,Tarascon Pocket Pharmacopoeia 2000,Deluxe Edition,Tarascon Publishing,Loma Linda,Calif.(2000);Nursing 2001 Handbook of Drugs,第21版,Springhouse Corp.,Springhouse,Pa.,2001;Health Professional′s Drug Guide2001,ed.,Shannon,Wilson,Stang,Prentice-Hall,Inc,Upper Saddle River,N.J.,所述参考文献各自通过引用整体并入本文。
优选的剂量可以任选地包括约0.1-99和/或100-500mg/kg/施用,或其任何范围、值或分数,或达到每单次或多次施用的约0.1-5000μg/ml血清浓度的血清浓度,或其任何范围、值或分数。本发明的VCAR的优选剂量范围是从约1mg/kg患者体重最多到约3、约6或约12mg/kg患者体重。
替代地,施用的剂量可以取决于已知因素而变,所述因素例如特定药剂的药物动力学特征及其施用方式和途径;接受者的年龄、健康状况和体重;症状的特性和程度,同时治疗的种类,治疗的频率,和所期望的效果。通常活性成分的剂量可以是每千克体重约0.1至100毫克。通常每次施用或持续释放形式的每千克0.1至50且优选0.1至10毫克对于获得期望的结果是有效的。
作为非限制性实例,可以在第1-40天的至少一天,或,替代地或额外地,第1-52周的至少一周,或,替代地或额外地,1-20年的至少一年,或其任何组合,使用单一,输注或重复的剂量,作为每天约0.1至100mg/kg或其任何范围、值或分数的本发明的至少一种VCAR的一次或周期性剂量提供人或动物的治疗。
适合于内部施用的剂型(组合物)通常每单位或容器包含约0.001毫克至约500毫克活性成分。在这些药物组合物中,活性成分通常将以基于组合物的总重量约0.5-99.999重量%的量存在。
对于肠胃外施用,可以将VCAR与药学可接受的肠胃外载体联合配制为或单独提供为溶液、悬浮液、乳剂、颗粒、粉末或冻干的粉末。这种载体的实例是水、盐水、林格液、葡萄糖溶液和约1-10%的人血清白蛋白。也可以使用脂质体和非水性载体,例如固定油。载体或冻干的粉剂可以含有保持等渗性(例如,氯化钠、甘露糖醇)和化学稳定性(例如,缓冲剂和防腐剂)的添加剂。通过已知或合适的技术对制剂进行灭菌。
合适的药物载体在最新版的Remington′s Pharmaceutical Sciences,A.Osol(这个领域的标准参考教科书)中描述。
替代的施用
可以根据本发明使用许多已知的和发展的方式用于施用药学有效量的根据本发明的至少一种VCAR。尽管在下面的描述中使用肺施用,但是可以根据本发明使用其他施用方式得到合适的结果。本发明的VCAR可以使用适合于通过吸入或本文所述或本领域已知的其他方式施用的多种装置和方法中的任何一种,在载体中,作为溶液、乳剂、胶体或悬浮液,或作为干粉递送。
肠胃外制剂和施用
用于肠胃外施用的制剂的可以含有无菌水或盐水,聚亚烷基二醇如聚乙二醇,植物来源的油,氢化萘等作为常见的赋形剂。可以根据已知方法通过使用适当的乳化剂或增湿剂和悬浮剂来制备用于注射的水性或油性悬浮液。用于注射的试剂可以是无毒性的,非口服可施用的稀释剂,例如在溶剂中的水性溶液,无菌可注射溶液或悬浮液。作为可用的载体或溶剂,水、林格液、等渗盐水等是允许的;作为普通溶剂或悬浮溶剂,可以使用无菌的不挥发性油。为了这些目的,可以使用任何种类的不挥发性油和脂肪酸,包括天然或合成或半合成的脂肪油或脂肪酸;天然或合成或半合成的单酰或二酰或三酰甘油。肠胃外施用是本领域已知的,且包括,但不限于,常规注射方式,如美国专利号5,851,198中所述的气体加压无针注射装置和如美国专利号5,839,446中所述的激光穿孔器装置,所述专利通过引用整体并入本文。
替代的递送
本发明进一步涉及通过肠胃外、皮下、肌内、静脉内、关节内、支气管内、腹内、囊内、软骨内、腔内、体腔内、小脑内、脑室内、结肠内、颈内、胃内、肝内、心肌内、骨内、骨盆内、心包内、腹膜内、胸膜内、前列腺内、肺内、直肠内、肾内、视网膜内、脊柱内、滑膜内、胸内、子宫内、膀胱内、病灶内、快速浓注、阴道、直肠、颊、舌下、鼻内或透皮方式施用至少一种VCAR。可以制备至少一种VCAR组合物以用于肠胃外(皮下、肌内或静脉内)或任何其他施用,特别是以液体溶液或悬浮液的形式;用于阴道或直肠施用,特别是以半固体形式,例如,但不限于,乳膏和栓剂;用于颊或舌下施用,例如,但不限于,以片剂或胶囊形式;或鼻内,例如,但不限于粉末、滴鼻剂或气溶胶或某些试剂的形式;或透皮地,例如但不限于凝胶、软膏,洗剂、悬浮液或贴剂输送系统,其具有化学增强剂(例如二甲基亚砜)来修饰皮肤结构或增加透皮贴剂中的药物浓度(Junginger等人在“Drug Permeation Enhancement;”中Hsieh,D.S.,编辑,第59-90页(Marcel Dekker,Inc.New York 1994,整体引入本文作为参考),或具有使得能够将含有蛋白和肽的制剂应用到皮肤上的氧化剂(WO 98/53847),或电场的应用来产生瞬时转运途径,例如电穿孔,或增加荷电药物通过皮肤的迁移率,例如离子电渗疗法,或超声波的应用,例如超声导入(sonophoresis)(美国专利号4,309,989和4,767,402)(上述出版物和专利通过引用整体并入本文)。
肺/鼻施用
对于肺施用,优选地,以有效达到肺的下气道或鼻窦的粒径递送至少一种VCAR组合物。根据本发明,至少一种VCAR可以通过本领域已知的用于通过吸入施用治疗剂的多种吸入或鼻装置中的任何一种来递送。这些能够将气溶胶化制剂沉积在患者的鼻窦腔或肺泡中的装置包括计量吸入器、雾化器、干粉发生器、喷雾器等。适合于引导VCAR的肺或鼻施用的其他装置在本领域中也是已知的。所有这些装置可以使用适合于用于将VCAR分配在气溶胶中的施用的制剂。这样的气溶胶可以包括溶液(水性和非水性两者)或固体颗粒组成。
计量吸入器如Ventolin计量吸入器通常使用推进剂气体,并且在吸气期间需要驱动(例如,参见WO 94/16970,WO98/35888)。干粉吸入器如Turbuhaler
优选地,通过干粉吸入器或喷雾器递送包含至少一种VCAR的组合物。用于施用本发明的至少一种VCAR的吸入装置具有几个理想的特征。例如,通过吸入装置递送是有利地可靠的、可再现的和准确的。为了良好的呼吸性,吸入装置可以任选地递送小的干燥颗粒,例如小于约10μm,优选地约1-5μm。
作为喷雾的VCAR组合物的施用
可以通过在压力下推动至少一种VCAR的悬浮液或溶液通过喷嘴来产生包含VCAR组合物的喷雾。可以选择喷嘴的尺寸和构造、施加的压力以及液体进料速度,以实现所需的输出量和粒径。电喷雾可以例如通过与毛细管或喷嘴进料相连的电场产生。有利地,通过喷雾器递送的至少一种VCAR组合物的颗粒具有小于约10μm,优选在约1μm至约5μm的范围内,最优选在约2μm至约3μm范围内的粒径。
适合与喷雾器一起使用的至少一种VCAR组合物的制剂通常包括水溶液中的VCAR组合物,其浓度为每ml溶液约0.1mg至约100mg至少一种VCAR组合物或mg/gm,或其中的任何范围、值或分数。制剂可以包含试剂,例如赋形剂、缓冲剂、等渗剂、防腐剂、表面活性剂,并且优选锌。该制剂还可以包含用于稳定VCAR组合物的赋形剂或试剂,例如缓冲剂、还原剂、散装蛋白(bulk protein)或碳水化合物。可用于配制VCAR组合物的散装蛋白包括白蛋白、鱼精蛋白等。可用于配制VCAR组合物的典型碳水化合物包括蔗糖、甘露醇、乳糖、海藻糖、葡萄糖等。VCAR组合物制剂还可以包含表面活性剂,其可以减少或防止由形成气溶胶时溶液的雾化引起的VCAR组合物的表面诱导的聚集。可以使用各种常规的表面活性剂,例如聚氧乙烯脂肪酸酯和醇,以及聚氧乙烯山梨糖醇脂肪酸酯。用量通常范围在制剂重量的0.001-14%。用于本发明目的的特别优选的表面活性剂是聚氧乙烯脱水山梨糖醇单油酸酯、聚山梨酸酯80、聚山梨酸酯20等。制剂中还可以包含本领域已知的用于配制蛋白,例如VCAR或特定部分或变体的其他试剂。
通过雾化器施用VCAR组合物
本发明的VCAR组合物可以通过雾化器例如喷射雾化器或超声雾化器施用。通常,在喷射雾化器中,使用压缩空气源来产生通过孔的高速空气射流。随着气体膨胀超过喷嘴,产生低压区域,该低压区域会通过连接到储液罐的毛细管牵拉出VCAR组合物溶液。来自毛细管的液体流在离开该管时被剪切成不稳定的细丝和液滴,形成气溶胶。可以采用一系列构造、流速和挡板类型,以从给定的喷射雾化器获得所需的性能特征。在超声雾化器中,通常使用压电换能器将高频电能用于产生振动的机械能。该能量直接或通过耦合流体传递给VCAR组合物的制剂,形成包含VCAR组合物的气溶胶。有利地,由雾化器递送的VCAR组合物的颗粒具有小于约10μm,优选在约1μm至约5μm的范围内,最优选在约2μm至约μm的范围内的粒径。
适合与雾化器(喷射或超声)一起使用的至少一种VCAR的制剂通常包含每ml溶液约0.1mg至约100mg至少一种VCAR的浓度。制剂可以包含试剂,例如赋形剂、缓冲剂、等渗剂、防腐剂、表面活性剂,并且优选锌。该制剂还可以包含用于稳定至少一种VCAR组合物的赋形剂或试剂,例如缓冲剂、还原剂、散装蛋白或碳水化合物。可用于配制至少一种VCAR组合物的散装蛋白包括白蛋白、鱼精蛋白等。可用于配制至少一种VCAR组合物的典型碳水化合物包括蔗糖、甘露醇、乳糖、海藻糖、葡萄糖等。至少一种VCAR制剂还可以包含表面活性剂,其可以减少或防止由形成气溶胶时溶液的雾化引起的至少一种VCAR的表面诱导的聚集。可以使用各种常规的表面活性剂,例如聚氧乙烯脂肪酸酯和醇,以及聚氧乙烯山梨糖醇脂肪酸酯。用量通常范围在制剂重量的0.001-14%。用于本发明目的的特别优选的表面活性剂是聚氧乙烯脱水山梨糖醇单油酸酯、聚山梨酸酯80、聚山梨酸酯20等。制剂中还可以包含本领域已知的用于配制蛋白,例如VCAR的其他试剂。
通过计量吸入器施用VCAR组合物
在计量吸入器(MDI)中,推进剂、至少一种VCAR和任何赋形剂或其他添加剂以包含液化压缩气体的混合物包含在罐中。计量阀的驱动释放作为气溶胶的混合物,其优选地包含小于约10μm,优选约1μm至约5μm,最优选约2μm至约3μm的尺寸范围的颗粒。可以通过采用通过本领域技术人员已知的各种方法生产的VCAR组合物的制剂来获得所需的气溶胶粒径,所述方法包括喷射研磨、喷雾干燥、临界点冷凝等。优选的计量吸入器包括由3M或Glaxo制造并采用氢氟烃推进剂的那些。与计量吸入器装置一起使用的至少一种VCAR的制剂通常将包括精细分割的粉末,该粉末包含作为在非水介质中的悬浮液的至少一种VCAR,例如,借助表面活性剂悬浮在推进剂中。推进剂可以是用于此目的的任何常规材料,例如氯氟烃、氢氯氟烃、氢氟烃或碳氢化合物,包括三氯氟甲烷、二氯二氟甲烷、二氯四氟乙醇和1,1,1,2-四氟乙烷、HFA-134a(氢氟烷烃-134a)、HFA-227(氢氟烷烃-227)等。优选地,推进剂是氢氟烃。可以选择表面活性剂以稳定作为推进剂中的悬浮液的至少一种VCAR,以保护活性剂免于化学降解等。合适的表面活性剂包括脱水山梨糖醇三油酸酯、大豆卵磷脂、油酸等。在一些情况下,在使用溶剂,例如乙醇时,溶液气溶胶是优选的。制剂中还可以包括本领域已知的用于配制蛋白的其他试剂。本领域普通技术人员将认识到,可以经由本文未描述的装置通过肺部施用至少一种VCAR组合物来实现本发明的方法。
口服制剂和施用
用于口服施用的制剂依赖于佐剂(例如间苯二酚和非离子表面活性剂,例如聚氧乙烯油基醚和正十六烷基聚乙烯醚)的共同施用以人工增加肠壁的通透性,以及酶抑制剂(例如,胰蛋白酶抑制剂、二异丙基氟磷酸酯(DFF)和抑肽酶)的共同施用以抑制酶促降解。在美国专利号中6,309,663教导了用于递送亲水剂的制剂,所述亲水剂包括蛋白和VCAR,以及意欲用于口服、颊、粘膜、鼻、肺、阴道跨膜或直肠施用的至少两种表面活性剂的组合。用于口服施用的固体类型剂型的活性成分化合物可以与至少一种添加剂混合,所述添加剂包括蔗糖、乳糖、纤维素、甘露醇、海藻糖、棉子糖、麦芽糖醇、右旋糖酐、淀粉、琼脂、精氨酸盐、几丁质、壳聚糖、果胶、黄芪胶、阿拉伯胶、明胶、胶原蛋白、酪蛋白、白蛋白、合成或半合成聚合物和甘油酯。这些剂型还可包含其他类型的添加剂,例如非活性稀释剂、润滑剂(例如硬脂酸镁、对羟基苯甲酸酯)、防腐剂(例如山梨酸、抗坏血酸、α-生育酚)、抗氧化剂(例如半胱氨酸)、崩解剂、粘合剂、增稠剂、缓冲剂、甜味剂、调味剂、芳香剂等。
片剂和丸剂可以进一步加工成肠溶制剂。用于口服施用的液体制剂包括乳剂、糖浆剂、酏剂、混悬剂和允许用于医用的溶液制剂。这些制剂可包含通常在所述领域中使用的非活性稀释剂,例如水。脂质体也被描述为胰岛素和肝素的药物递送系统(美国专利号4,239,754)。最近以来,已使用混合氨基酸的人工聚合物的微球(类蛋白)来递送药物(美国专利号4,925,673)。此外,在美国专利号5,879,681和美国专利号5,871,753中描述并且用于口服递送生物活性剂的载体化合物是本领域已知的。
粘膜制剂和施用
用于口服施用包封在一种或多种生物相容性聚合物或共聚物赋形剂(优选生物可降解的聚合物或共聚物)中的生物活性剂的制剂,提供了微胶囊,由于所得微胶囊的适当大小,所述微胶囊导致药剂到达动物的集合淋巴滤泡(原本称作“Peyer斑”或“GALT”)并被其吸收而不会由于该药剂通过胃肠道而失去有效性。在支气管(BALT)和大肠中可以发现类似的集合淋巴滤泡。上述组织通常称为粘膜相关淋巴网状组织(MALT)。为了通过粘膜表面吸收,施用至少一种VCAR的组合物和方法包括乳剂,其包含多个亚微米颗粒、粘膜粘附性大分子、生物活性肽和连续水相,其通过实现乳剂颗粒的粘膜粘附而促进通过粘膜表面的吸收(美国专利号5,514,670)。适于本发明乳剂的应用的粘膜表面可包括角膜、结膜、颊、舌下、鼻、阴道、肺、胃、肠和直肠的施用途径。用于阴道或直肠施用的制剂,例如栓剂,可包含例如聚亚烷基二醇、凡士林、可可脂等作为赋形剂。用于鼻内施用的制剂可以是固体,并且包含例如乳糖作为赋形剂,或者可以是滴鼻剂的水性或油性溶液。对于颊施用,赋形剂包括糖、硬脂酸钙、硬脂酸镁、预凝胶化(pregelinatined)淀粉等(美国专利号5,849,695)。
透皮制剂和施用
对于透皮施用,至少一种VCAR封装在递送装置,例如脂质体或聚合物纳米颗粒、微粒、微胶囊或微球(除非另有说明,统称为微粒))中。已知许多合适的装置,包括由合成聚合物制成的微粒,所述聚合物例如多羟基酸、例如聚乳酸、聚乙醇酸及其共聚物、聚原酸酯、聚酸酐和聚磷腈,以及天然聚合物,例如胶原蛋白、聚氨基酸、白蛋白以及其他蛋白、藻酸盐和其他多糖,以及它们的组合(美国专利号5,814,599)。
延长的施用和制剂
可期望在延长的时间段内,例如从单次施用开始的一周至一年的时间段,将本发明的化合物递送给受试者。可以使用各种缓释、贮库(depot)或植入剂型。例如,剂型可包含化合物的药学可接受的无毒盐(其在体液中具有低溶解度),例如,(a)与多元酸,例如磷酸、硫酸、柠檬酸、酒石酸、鞣酸、棕榈酸、藻酸、聚谷氨酸、萘单磺酸或二磺酸、聚半乳糖醛酸等的酸加成盐;(b)与多价金属阳离子,例如锌、钙、铋、钡、镁、铝、铜、钴、镍、镉等的盐,或与由例如N,N-二苄基-乙二胺或乙二胺形成的有机阳离子的盐;或(c)(a)和(b)的组合,例如鞣酸锌盐。另外,本发明的化合物,或优选地,相对不溶的盐,例如刚刚描述的那些,可以与例如适于注射的芝麻油一起配制在凝胶,例如单硬脂酸铝凝胶中。特别优选的盐是锌盐、单宁酸锌盐,双羟萘酸盐等。另一类型的用于注射的缓释贮库制剂将包含被分散用于包封在缓慢降解的无毒、非抗原性聚合物,例如聚乳酸/聚乙醇酸聚合物(例如美国专利号3,773,919中所述)中的化合物或盐。化合物或优选相对不溶的盐,例如上述的那些,也可以配制在胆固醇基质硅橡胶丸中,特别是用于动物中。文献中已知其他缓慢释放、贮库或植入制剂,例如气体或液体脂质体(美国专利号5,770,222和“Sustained and Controlled ReleaseDrug Delivery Systems”,J.R.Robinson ed.,Marcel Dekker,Inc.,N.Y.,1978)。
作为过继细胞治疗的修饰细胞的输注
本公开内容提供了表达一种或多种本公开内容的CAR和/或VCAR的修饰细胞,其已被选择和/或扩增用于施用于需要其的受试者。可以配制本公开内容的修饰细胞用于在包括室温和体温的任何温度贮藏。可以配制本公开内容的修饰细胞用于冷冻保存和后来的解冻。可以在药学可接受的载体中配制本公开内容的修饰细胞,用于从无菌包装直接施用于受试者。可以在具有细胞生存力和/或CAR/VCAR表达水平指示物的情况下在药学可接受的载体中配制本公开内容的修饰细胞,以确保最低水平的细胞功能和CAR/VCAR表达。可以在具有一种或多种试剂以抑制进一步的扩增和/或预防细胞死亡的情况下以规定的密度在药学可接受的载体中配制本公开内容的修饰细胞。
诱导型促凋亡多肽
本公开内容的诱导型促凋亡多肽优于现有的诱导型多肽,这是因为本公开内容的诱导型促凋亡多肽的免疫原性低得多。尽管本公开内容的诱导型促凋亡多肽是重组多肽,且因此是非天然存在的,但是进行重组以产生本公开内容的诱导型促凋亡多肽的序列不包含宿主人免疫系统能够识别为“非自身”的,且因此在接受本公开内容的诱导型促凋亡多肽、包含所述诱导型促凋亡多肽的细胞或包含所述诱导型促凋亡多肽或包含所述诱导型促凋亡多肽的细胞的组合物的受试者中诱导免疫应答的非人序列。
本公开内容提供了包含配体结合区、接头和促凋亡肽的诱导型促凋亡多肽,其中所述诱导型促凋亡多肽不包含非人序列。在某些实施方案中,非人序列包含限制位点。在某些实施方案中,促凋亡肽是胱天蛋白酶多肽。在某些实施方案中,胱天蛋白酶多肽是胱天蛋白酶9多肽。在某些实施方案中,胱天蛋白酶9多肽是截短的胱天蛋白酶9多肽。本公开内容的诱导型促凋亡多肽可以是非天然存在的。
本公开内容的胱天蛋白酶多肽包括,但不限于,胱天蛋白酶1、胱天蛋白酶2、胱天蛋白酶3、胱天蛋白酶4、胱天蛋白酶5、胱天蛋白酶6、胱天蛋白酶7、胱天蛋白酶8、胱天蛋白酶9、胱天蛋白酶10、胱天蛋白酶11、胱天蛋白酶12和胱天蛋白酶14。本公开内容的胱天蛋白酶多肽包括,但不限于,那些与凋亡相关的胱天蛋白酶多肽,包括胱天蛋白酶2、胱天蛋白酶3、胱天蛋白酶6、胱天蛋白酶7、胱天蛋白酶8、胱天蛋白酶9和胱天蛋白酶10。本公开内容的胱天蛋白酶多肽包括,但不限于,那些起始凋亡的胱天蛋白酶多肽,包括胱天蛋白酶2、胱天蛋白酶8、胱天蛋白酶9和胱天蛋白酶10。本公开内容的胱天蛋白酶多肽包括,但不限于,那些执行凋亡的胱天蛋白酶多肽,包括胱天蛋白酶3、胱天蛋白酶6和胱天蛋白酶7。
与野生型氨基酸或核酸序列相比,本公开内容的胱天蛋白酶多肽可由具有一种或多种修饰的氨基酸或核酸序列编码。编码本公开内容的胱天蛋白酶多肽的核酸序列可以被密码子优化。与野生型氨基酸或核酸序列相比,对本公开内容的胱天蛋白酶多肽的氨基酸和/或核酸序列的一种或多种修饰可以增加本公开内容的胱天蛋白酶多肽的相互作用、交联、交叉激活或激活。替代地或额外地,与野生型氨基酸或核酸序列相比,对本公开内容的胱天蛋白酶多肽的氨基酸和/或核酸序列的一种或多种修饰可以降低本公开内容的胱天蛋白酶多肽的免疫原性。
与野生型胱天蛋白酶多肽相比,本公开内容的胱天蛋白酶多肽可以被截短。例如,可以将胱天蛋白酶多肽截短以消除编码胱天蛋白酶激活和募集结构域(CARD)的序列,以消除或最小化激活局部炎症反应以及起始包含本公开内容的诱导型胱天蛋白酶多肽的细胞中的凋亡的可能性。与野生型胱天蛋白酶多肽相比,编码本公开内容的胱天蛋白酶多肽的核酸序列可以被剪接以形成本公开内容的胱天蛋白酶多肽的变体氨基酸序列。本公开内容的胱天蛋白酶多肽可由重组和/或嵌合序列编码。本公开内容的重组和/或嵌合胱天蛋白酶多肽可包含来自一种或多种不同胱天蛋白酶多肽的序列。替代地或额外地,本公开内容的重组和/或嵌合胱天蛋白酶多肽可包含来自一个或多个物种的序列(例如人序列和非人序列)。本公开内容的胱天蛋白酶多肽可以是非天然存在的。
本公开内容的诱导型促凋亡多肽的配体结合区可以包括便于或促进本公开内容的第一诱导型促凋亡多肽与本公开内容的第二诱导型促凋亡多肽二聚化的任何多肽序列,其二聚化激活或诱导促凋亡多肽的交联和细胞中凋亡的起始。
配体结合(“二聚化”)区可包括任何多肽或其功能性结构域,其将允许使用内源或非天然存在的配体(即和诱导剂)例如非天然存在的合成配体进行诱导。取决于诱导型促凋亡多肽的特性和配体(即诱导剂)的选择,配体结合区可以在细胞膜的内部或外部。各种各样的配体结合多肽及其功能性结构域,包括受体,是已知的。本公开内容的配体结合区可以包括来自受体的一种或多种序列。特别令人关注的是这样的配体结合区,其配体(例如,小的有机配体)是已知的或可容易产生的。这些配体结合区或受体可以包括,但不限于,FKBP和亲环蛋白受体、类固醇受体、四环素受体等,以及“非天然存在的”受体,其可以获得自抗体,特别是重链或轻链亚基、其突变序列、随机氨基酸序列(通过随机程序、组合合成等获得)。在某些实施方案中,配体结合区选自FKBP配体结合区、亲环蛋白受体配体结合区、类固醇受体配体结合区、亲环蛋白受体配体结合区和四环素受体配体结合区。
作为其内源结构域或其截短的活性部分,包含一个或多个受体结构域的配体结合区可以是至少约50个氨基酸,并且少于约350个氨基酸,通常少于200个氨基酸。结合区可以是例如小的(<25kDa,以允许在病毒载体中有效转染),单体的,非免疫原性的,具有合成可及的,细胞可渗透的,无毒性的配体,其可以被配置用于二聚化。
取决于诱导型促凋亡多肽的设计和合适的配体(即诱导剂)的可用性,包含一个或多个受体结构域的配体结合区可以是细胞内或细胞外的。对于疏水配体,结合区可以在膜的任一侧,但是对于亲水配体,特别是蛋白配体,结合区通常将在细胞膜的外部,除非存在以其可用于结合的形式将配体内化的转运系统。对于细胞内受体,诱导型促凋亡多肽或包含诱导型促凋亡多肽的转座子或载体可编码受体结构域序列5′或3′的信号肽和跨膜结构域,或可具有受体结构域序列5′的脂质附着信号序列。在受体结构域在信号肽和跨膜结构域之间的场合,受体结构域将是细胞外的。
抗体和抗体亚基,例如,重链或轻链,特别是片段,更特别地是可变区的全部或部分,或产生高亲和力结合的重链和轻链的融合,可以用作本公开内容的配体结合区。所考虑的抗体包括作为异位表达的人产物的那些,例如将不触发免疫应答并且通常不在外周(即,在CNS/脑区域之外)表达的细胞外结构域。这种实例包括,但不限于,低亲和力神经生长因子受体(LNGFR)和胚胎表面蛋白(即,癌胚抗原)。还进一步地,可以制备针对生理可接受的半抗原分子的抗体,并筛选各个抗体亚基的结合亲和力。可以通过恒定区的缺失、可变区的部分、可变区的诱变等来分离和修饰编码亚基的cDNA,以获得对配体具有适当亲和力的结合蛋白结构域。这样,几乎任何生理可接受的半抗原化合物都可以用作配体或提供配体的表位。代替抗体单位,可以使用内源受体,其中结合区或结构域是已知的,并且存在用于结合的有用或已知的配体。
为了使受体多聚化,诱导型促凋亡多肽的配体结合区/受体结构域的配体在配体可以具有至少两个结合位点的意义上可以是多聚体的,而每个结合位点都能够结合配体受体区(即,具有能够结合第一诱导型促凋亡多肽的配体结合区的第一结合位点和能够结合第二诱导型促凋亡多肽的配体结合区的第二结合位点的配体,其中所述第一和第二诱导型促凋亡多肽的配体结合区相同或不同)。因此,如本文所用的,术语“多聚体配体结合区”是指与多聚体配体结合的本公开内容的诱导型促凋亡多肽配体结合区。本公开内容的多聚体配体包括二聚体配体。本公开内容的二聚配体可以具有两个能够结合配体受体结构域的结合位点。在某些实施方案中,本公开内容的多聚体配体是小的合成有机分子的二聚体或更高级的寡聚体,通常不大于约四聚体,单个分子一般为至少约150Da且小于约5kDa,通常小于约3kDa。可以使用多种合成配体和受体对。例如,在涉及内源受体的实施方案中,二聚体FK506可以与FKBP12受体一起使用,二聚化环孢菌素A可以与亲环蛋白受体一起使用,二聚化雌激素与雌激素受体一起,二聚化糖皮质激素与糖皮质激素受体一起,二聚化四环素与四环素受体一起,二聚化维生素D与维生素D受体一起,等。替代低,可以使用更高级的配体,例如三聚体。对于涉及非天然存在的受体的实施方案,例如,抗体亚基、修饰的抗体亚基、包含由柔性接头隔开的串联的重链和轻链可变区的单链抗体,或修饰的受体,及其突变序列等,可以使用各种各样化合物中的任何一种。包含本公开内容的多聚体配体的单位的显著特征是每个结合位点都能够以高亲和力结合受体,并且优选地,它们能够被化学二聚化。同样地,这样的方法是可用的:平衡配体的疏水性/亲水性,从而使得它们能够以功能性水平溶解在血清中,而通过质膜扩散以用于大多数应用中。
本公开内容的诱导型促凋亡多肽的激活可以通过例如由诱导剂介导的化学诱导的二聚化(CID)来完成,以产生条件控制的蛋白或多肽。由于不稳定的二聚化剂的降解或单体竞争性抑制剂的施用,本公开内容的促凋亡多肽不仅是诱导型的,而且这些多肽的诱导也是可逆的。
在某些实施方案中,配体结合区包含FK506结合蛋白12(FKBP12)多肽。在某些实施方案中,配体结合区包含具有在位置36处的缬氨酸(V)对苯丙氨酸(F)的取代(F36V)的FKBP12多肽。在某些实施方案中,其中配体结合区包含具有在位置36处的缬氨酸(V)对苯丙氨酸(F)的取代(F36V)的FKBP12多肽,诱导剂可包括AP1903,一种合成药物(CAS索引名称:2-哌啶甲酸(2-Piperidinecarboxylic acid),1-[(2S)-1-氧代-2-(3,4,5-三甲氧基苯基)丁基]-,1,2-乙二基双[亚氨基(2-氧代-2,1-乙二基)氧基-3,1-亚苯基[(1R)-3-(3,4-二甲氧基苯基)亚丙基]]酯,[2S-[1(R*),2R*[S*[S*[1(R*),2R*]]]]]-(9Cl)CAS登记号:195514-63-7;分子式:C78H98N4O20;分子量:1411.65))。在某些实施方案中,其中配体结合区包含具有在位置36处的缬氨酸(V)对苯丙氨酸(F)的取代(F36V)的FKBP12多肽,诱导剂可包括AP20187(CAS登记号:195514-80-8和分子式:C82H107N5O20)。在某些实施方案中,诱导剂是AP20187类似物,如例如AP1510。如本文所用的,诱导剂AP20187、AP1903和AP1510可以互换使用。
AP1903 API由Alphora Research Inc.生产,且用于注射的AP1903药物产品由Formatech Inc.制备。其被配制为在25%非离子型增溶剂Solutol HS 15溶液(250mg/mL,BASF)中的5mg/mL AP1903溶液。在室温,该制剂是透明的浅黄色的溶液。冷冻时,该制剂经历可逆的相变,结果产生乳状溶液。重新加热至室温时,该相变逆转。装填为在3mL玻璃小瓶中2.33mL(约每个小瓶总计10mg用于注射的AP1903)。在确定施用AP1903的需要时,可以例如使用非-DEHP,非环氧乙烷灭菌的输注器具,在2小时期间通过静脉内(IV)输注向患者施用单个固定剂量的用于注射的AP1903(0.4mg/kg)。AP1903的剂量是对于所有患者个别计算的,且除非体重波动≥10%,否则不重新计算。在输注之前,将计算的剂量在0.9%生理盐水中在100mL中稀释。在以前的AP1903的I期研究中,在2小时期间以静脉内输注的0.01、0.05、0.1、0.5和1.0mg/kg的剂量水平用单剂用于注射的AP1903治疗24名健康志愿者。在0.01-1.0mg/kg的剂量范围内,AP1903血浆水平与剂量成正比,而平均Cmax值范围为约10-1275ng/mL。在起始输注阶段后,血液浓度显示出快速分布阶段,在给药后(post-dose)0.5、2和10小时,血浆水平分别降至最大浓度的约18%、7%和1%。用于注射的AP1903在所有剂量水平均显示是安全和良好耐受的,并显示出有利的药代动力学概况。Iuliucci J D等人,J Clin Pharmacol.41:870-9,2001。
使用的用于注射的AP1903的固定剂量例如可以是在2小时期间静脉内输注的0.4mg/kg。体外用于有效的细胞信号传导所需的AP1903的量为10-100nM(1600Da MW)。这等于16-160μg/L或~0.016-1.6μg/kg(1.6-160μg/kg)。在上述AP1903的I期研究中,最多到1mg kg的剂量是良好耐受的。因此,0.4mg/kg可能是与治疗用细胞组合的对于这个I期研究的AP1903的安全且有效剂量。
与野生型氨基酸或核酸序列相比,本公开内容的编码配体结合的氨基酸和/或核酸序列可含有序列一种或多种修饰。例如,本公开内容的编码配体结合区的氨基酸和/或核酸序列可以是密码子优化的序列。与野生型多肽相比,一种或多种修饰可以增加配体(例如,诱导剂)对本公开内容的配体结合区的结合亲和力。替代地或额外地,与野生型多肽相比,所述一种或多种修饰可以降低本公开内容的配体结合区的免疫原性。本公开内容的配体结合区和/或本公开内容的诱导剂可以是非天然存在的。
本公开内容的诱导型促凋亡多肽包含配体结合区、接头和促凋亡肽,其中所述诱导型促凋亡多肽不包含非人序列。在某些实施方案中,非人序列包含限制位点。接头可包含任何有机或无机材料,其在配体结合区二聚化时允许促凋亡多肽的相互作用、交联、交叉激活或激活,从而使得促凋亡多肽的相互作用或激活起始细胞中的凋亡。在某些实施方案中,接头是多肽。在某些实施方案中,接头是包含富含G/S的氨基酸序列的多肽(“GS”接头)。在某些实施方案中,接头是包含氨基酸序列GGGGS(SEQ ID NO:18024)的多肽。在优选的实施方案中,接头是多肽,并且编码所述多肽的核酸不含有限制性内切核酸酶的限制位点。本公开内容的接头可以是非天然存在的。
可以在任何能够在细胞中起始和/或调节本公开内容的诱导型促凋亡多肽表达的启动子的转录调节下,在该细胞中表达本公开内容的诱导型促凋亡多肽。如本文所用的术语“启动子”是指充当RNA聚合酶的起始结合位点以转录基因的启动子。例如,可以在能够起始和/或调节本公开内容的诱导型促凋亡多肽在哺乳动物细胞中的表达的任何启动子,包括,但不限于,天然、内源、外源和异源启动子的转录调节下,在哺乳动物细胞中表达本公开内容的诱导型促凋亡多肽。优选的哺乳动物细胞包括人细胞。因此,可以在能够起始和/或调节本公开内容的诱导型促凋亡多肽在人细胞中的表达的任何启动子,包括,但不限于,人启动子或病毒启动子的转录调节下,在人细胞中表达本公开内容的诱导型促凋亡多肽。用于在人细胞中表达的示例性启动子包括,但不限于,人巨细胞病毒(CMV)立即早期基因启动子、SV40早期启动子、劳斯肉瘤病毒长末端重复序列、β-肌动蛋白启动子、大鼠胰岛素启动子和甘油醛-3-磷酸脱氢酶启动子,它们各自都可用于获得本公开内容的诱导型促凋亡多肽的高水平表达。也考虑了本领域中众所周知的其他病毒或哺乳动物细胞或细菌噬菌体启动子的使用以实现本公开内容的诱导型促凋亡多肽的表达,只要所述表达水平足以起始细胞中的凋亡。通过使用具有众所周知的性质的启动子,可以最优化转染或转化后关注的蛋白表达的水平和模式。
响应特定的生理或合成信号来调节的启动子的选择可以允许本公开内容的诱导型促凋亡多肽的诱导型表达。蜕皮激素系统(Invitrogen,Carlsbad,Calif.)是一种这样的系统。设计这种系统以允许在哺乳动物细胞中关注的基因的调节的表达。它由紧密调节的表达机制组成,所述机制几乎不允许转基因的基础水平表达,但允许超过200倍的诱导性。所述系统基于果蝇属的异二聚体蜕皮激素受体,且当蜕皮激素或类似物如米乐甾酮A(muristerone A)与受体结合时,所述受体激活启动子以打开下游转基因的表达,获得高水平的mRNA转录物。在这个系统中,异二聚体受体的两个单体都从一个载体组成型表达,而驱动关注的基因表达的蜕皮激素响应性启动子在另一个质粒上。因此,将这种类型的系统工程化到关注的载体中可能是有用的。另一种可能有用的诱导型系统是最初由Gossen和Bujard开发的Tet-Off
在一些情况下,期望调节基因治疗载体中转基因的表达。例如,取决于所期望的表达水平,利用具有不同活性强度的不同病毒启动子。在哺乳动物细胞中,CMV立即早期启动子经常用于提供强的转录激活。CMV启动子于Donnelly,J.J.等人,1997.Annu.Rev.Immunol.15:617-48中进行综述。当期望降低的转基因表达水平时,也已使用了效力较低的CMV启动子的修饰形式。当期望在造血细胞中表达转基因时,经常使用逆转录病毒启动子,例如来自MLV或MMTV的LTR。取决于所期望的效果使用的其他病毒启动子包括SV40、RSV LTR、HIV-1和HIV-2LTR、腺病毒启动子(例如来自E1A、E2A或MLP区)、AAV LTR、HSV-TK和禽肉瘤病毒。
在其他实例中,可以选择发育调节的并且在特定分化的细胞中有活性的启动子。因此,例如,启动子在多能干细胞中可能没有活性,但是,例如,在多能干细胞分化成更成熟的细胞的场合,所述启动子于是可以被激活。
类似地,组织特异性启动子用于在特定组织或细胞中实现转录,从而减少对非靶向的组织的潜在毒性或不期望的影响。与诸如CMV启动子的更强启动子相比,这些启动子可能导致降低的表达,但也可能导致更有限的表达和免疫原性(Bojak,A.等人,2002.Vaccine.20:1975-79;Cazeaux,N.等人,2002.Vaccine 20:3322-31)。例如,在适当的场合,可以使用组织特异性启动子,例如PSA相关启动子或前列腺特异性腺体激肽释放酶、或肌肉肌酸激酶基因。
组织特异性或分化特异性启动子的实例包括,但不限于,以下:B29(B细胞);CD14(单核细胞);CD43(白细胞和血小板);CD45(造血细胞);CD68(巨噬细胞);结蛋白(肌肉);弹性蛋白酶-1(胰腺腺泡细胞);内皮糖蛋白(内皮细胞);纤连蛋白(分化中的细胞,愈合中的组织);和Flt-1(内皮细胞);GFAP(星形胶质细胞)。
在某些适应症中,期望在施用基因治疗载体后的特定时间激活转录。这是用像那些激素或细胞因子可调节的启动子这样的启动子完成的。可以使用的细胞因子和炎症蛋白响应性启动子包括K和T激肽原(Kageyama等人,(1987)J.Biol.Chem.,262,2345-2351)、c-fos、TNF-α、C反应蛋白(Arcone等人,(1988)Nucl.Acids Res.,16(8),3195-3207)、触珠蛋白(Oliviero等人,(1987)EMBO J.,6,1905-1912)、血清淀粉样A2、C/EBPα、IL-1、IL-6(Poli和Cortese,(1989)Proc.Nat′l Acad.Sci.USA,86,8202-8206)、补体C3(Wilson等人,(1990)Mol.Cell.Biol.,6181-6191)、1L-8、α-1酸性糖蛋白(Prowse和Baumann,(1988)MolCell Biol,8,42-51)、α-1抗胰蛋白酶、脂蛋白脂肪酶(Zechner等人,Mol.Cell.Biol.,2394-2401,1988)、血管紧张肽原(Ron等人,(1991)Mol.Cell.Biol.,2887-2895)、血纤蛋白原、c-jun(可由佛波酯、TNF-α、紫外线、视黄酸和过氧化氢诱导的)、胶原酶(由佛波酯和视黄酸诱导的)、金属硫蛋白(重金属和糖皮质激素可诱导的)、溶基质蛋白酶(可由佛波酯、白介素-1和EGF诱导的)、α-2巨球蛋白和α-1抗胰凝乳蛋白酶。其他启动子包括,例如,SV40、MMTV、人免疫缺陷病毒(MV)、莫洛尼病毒、ALV、EB病毒、劳斯肉瘤病毒、人肌动蛋白、肌球蛋白、血红蛋白和肌酸。
预计取决于所期望的作用,单独或与另一种组合的任何上述启动子都可以是有用的。选择启动子和其他调节元件,从而使得它们在所期望的细胞或组织中有功能。另外,这个启动子列表不应被解释为穷举或限制性的;连同本文公开的启动子和方法一起使用的其他启动子。
可以对本公开内容的T细胞进行基因修饰以增强其治疗潜力。替代地或额外地,可以修饰本公开内容的T细胞以使它们对免疫和/或代谢限制点较不敏感。这种类型的修饰“装甲”本公开内容的T细胞,其在修饰之后在本文中可以称为“装甲的”T细胞。可以通过例如阻断和/或稀释例如在肿瘤免疫抑制微环境内天然递送至T细胞的特定限制点信号(即限制点抑制)来产生本公开内容的装甲的T细胞。
在一些实施方案中,本公开内容的装甲的T细胞衍生自T细胞、NK细胞、造血祖细胞、外周血(PB)衍生的T细胞(包括分离或衍生自G-CSF-动员的外周血的T细胞)或脐带血(UCB)衍生的T细胞。在一些实施方案中,本公开内容的装甲的T细胞包含本公开内容的嵌合配体受体(包含单结构域抗体)/嵌合抗原受体(包含蛋白支架、抗体、ScFv或抗体模拟物的CAR)、CARTyrin(包含Centyrin的CAR)和/或VCAR(包含骆驼科动物VHH或单结构域VH的CAR)中的一种或多种。在一些实施方案中,本公开内容的装甲的T细胞包含诱导型促凋亡多肽,其包含(a)配体结合区、(b)接头和(c)截短的胱天蛋白酶9多肽,其中所述诱导型促凋亡多肽不包含非人序列。在一些实施方案中,非人序列是限制位点。在一些实施方案中,配体结合区诱导型胱天蛋白酶多肽包含FK506结合蛋白12(FKBP12)多肽。在一些实施方案中,FK506结合蛋白12(FKBP12)多肽的氨基酸序列包含在序列的位置36处的修饰。在一些实施方案中,修饰是在位置36处缬氨酸(V)对苯丙氨酸(F)的取代(F36V)。在一些实施方案中,本公开内容的装甲的T细胞包含外源序列。在一些实施方案中,外源序列包含编码治疗蛋白的序列。示例性治疗蛋白可以是核蛋白、胞质蛋白、细胞内蛋白、跨膜蛋白、细胞表面结合的蛋白或分泌的蛋白。由装甲的T细胞表达的示例性治疗蛋白可以改变装甲的T细胞的活性或可以改变第二细胞的活性。在一些实施方案中,本公开内容的装甲的T细胞包含选择基因或选择标记。在一些实施方案中,本公开内容的装甲的T细胞包含合成基因表达盒(本文也称为诱导型转基因构建体)。
在一些实施方案中,本公开内容的T细胞被修饰以沉默或降低编码抑制性限制点信号的一种或多种受体的一种或多种基因的表达,以产生本公开内容的装甲的T细胞。抑制性限制点信号的实例包括,但不限于,与本公开内容的CAR-T细胞上的PD-1受体结合的PD-L1配体或与CAR-T细胞上的TGFβRII受体结合的TGFβ细胞因子。抑制性限制点信号的受体在T细胞的细胞表面上或胞质内表达。沉默或降低编码抑制性限制点信号的受体的基因的表达导致抑制性限制点受体在本公开内容的装甲的T细胞的表面上或胞质内的蛋白表达的丧失。因此,具有沉默或降低的一种或多种编码抑制性限制点受体的基因的表达的本公开内容的装甲的T细胞对限制点信号具有抗性、非接受或不敏感。在有这些抑制性限制点信号的情况下,装甲的T细胞对抑制性限制点信号的抗性或降低的敏感性增强装甲的T细胞的治疗潜力。抑制性限制点信号包括但不限于表1中列出的示例。可以在本公开内容的装甲的T细胞中沉默的示例性抑制性限制点信号包括,但不限于,PD-1和TGFβRII。
表1.示例性抑制性限制点信号(以及诱导免疫抑制的蛋白)。本公开内容的CSR可以包含该表的蛋白中任意一种的胞内域。
在一些实施方案中,修饰本公开内容的T细胞以沉默或降低编码与限制点信号传导相关的细胞内蛋白的一种或多种基因的表达,以产生本公开内容的装甲的T细胞。本公开内容的T细胞的活性可以通过靶向与限制点信号传导途径相关的任何细胞内信号传导蛋白来增强,从而实现对一个或多个限制点途径的限制点抑制或干扰。与限制点信号传导相关的细胞内信号传导蛋白包括,但不限于,表2中列出的示例性细胞内信号传导蛋白。
表2.示例性细胞内信号传导蛋白。
在一些实施方案中,修饰本公开内容的T细胞以沉默或降低编码妨碍治疗功效的转录因子的一种或多种基因的表达,以产生本公开内容的装甲的T细胞。可以通过沉默或降低妨碍治疗功效的转录因子的表达(或阻抑功能)来增强或调节装甲的T细胞的活性。可被修饰以沉默或降低表达或阻抑其功能的示例性转录因子包括,但不限于,表3中列出的示例性转录因子。例如,可在本公开内容的装甲的T细胞中沉默或降低FOXP3基因的表达,以防止或减少T调节CAR-T细胞(CAR-Treg细胞)的形成,其表达或活性可能降低治疗功效。
表3.示例性转录因子。
在一些实施方案中,修饰本公开内容的T细胞以沉默或降低编码细胞死亡或细胞凋亡受体的一种或多种基因的表达,以产生本公开内容的装甲的T细胞。死亡受体与其内源配体的相互作用导致凋亡的起始。细胞死亡和/或细胞凋亡受体和/或配体的表达、活性或相互作用的破坏使得本公开内容的装甲的T细胞较不接受死亡信号,因此,使得本公开内容的装甲的T细胞在肿瘤环境中更有效。可以在本公开内容的装甲的T细胞中修饰的示例性细胞死亡受体是Fas(CD95)。本公开内容的示例性细胞死亡和/或细胞凋亡受体和配体包括,但不限于,表4中提供的示例性受体和配体。
表4.示例性细胞死亡和/或细胞凋亡受体和配体。
在一些实施方案中,修饰本公开内容的T细胞以沉默或降低编码代谢感应蛋白(metabolic sensing protein)的一种或多种基因的表达,以产生本公开内容的装甲的T细胞。通过本公开内容的装甲的T细胞对免疫抑制肿瘤微环境(特征在于低水平的氧、pH、葡萄糖和其他分子)的代谢感应的破坏导致T细胞功能的延长维持,以及因此,每个装甲的T细胞更多杀伤的肿瘤细胞。例如,当在低氧环境中时,HIF1a和VHL在T细胞功能中起作用。本公开内容的装甲的T细胞可能已沉默或降低一种或多种编码HIF1a或VHL的基因的表达。与代谢感应相关的基因和蛋白包括,但不限于,表5中提供的示例性基因和蛋白。
表5.示例性的代谢感应基因(和编码的蛋白)。
在一些实施方案中,修饰本公开内容的T细胞以沉默或降低编码蛋白的一种或多种基因的表达,所述蛋白赋予对癌症治疗,包括单克隆抗体的敏感性,以产生本公开内容的装甲的T细胞。因此,在存在癌症治疗(例如化学治疗、单克隆抗体治疗或另一种抗肿瘤治疗)时,本公开内容的装甲的T细胞可以起作用并且可以表现出优越的功能或功效。与赋予对癌症治疗的敏感性相关的蛋白包括,但不限于,表6中提供的示例性蛋白。
表6.赋予对癌症治疗的敏感性的示例性蛋白。
在一些实施方案中,修饰本公开内容的T细胞以沉默或降低编码生长优势因子(growth advantage factor)的一种或多种基因的表达,以产生装甲的T细胞。沉默或降低癌基因的表达对于本公开内容的装甲的T细胞可赋予生长优势。例如,在CAR-T制造过程中沉默或降低TET2基因的表达(例如破坏表达)导致了装甲的CAR-T的产生,其当与缺乏这种用于扩增的能力的非装甲的CAR-T相比时,具有显著的扩增和随后根除肿瘤的能力。这个策略可以与安全开关(safety switch)(例如,本公开内容的iC9安全开关)偶联,所述安全开关允许如果有来自受试者的不良反应或装甲的CAR-T的不受控制的生长时装甲的CAR-T的靶向破坏。示例性的生长优势因子包括,但不限于,表7中提供的因子。
表7.示例性的生长优势因子。
在一些实施方案中,修饰本公开内容的T细胞以表达修饰的/嵌合的限制点受体以产生本公开内容的装甲的T细胞。
在一些实施方案中,修饰的/嵌合的限制点受体包括无效受体、诱饵受体或显性失活受体。本公开内容的无效受体、诱饵受体或显性失活受体可以是修饰的/嵌合的受体/蛋白。本公开内容的无效受体、诱饵受体或显性失活受体可以被截短以用于细胞内信号传导结构域的表达。替代地或额外地,本公开内容的无效受体、诱饵受体或显性失活受体可以在细胞内信号传导结构域内在一个或多个对于有效信号传导而言有决定作用的或需要的氨基酸位置处突变。本公开内容的无效受体、诱饵受体或显性失活受体的截短或突变可能导致受体向细胞或在细胞内传递或转导限制点信号的能力丧失。
例如,可以通过在本公开内容的装甲的T细胞表面上表达修饰的/嵌合的PD-1无效受体来实现来自在肿瘤细胞表面上表达的PD-L1受体的免疫抑制限制点信号的稀释或阻断,所述修饰的/嵌合的PD-1无效受体有效地与也在装甲的T细胞表面上表达的内源(非修饰的)PD-1受体竞争,以减少或抑制通过装甲的T细胞的内源PD-1受体的免疫抑制限制点信号的转导。在这个示例性实施方案中,在用于结合肿瘤细胞上表达的PD-L1的两种不同的受体之间的竞争降低或减小了有效限制点信号传导的水平,从而增强了表达PD-1无效受体的装甲的T细胞的治疗潜力。
在一些实施方案中,修饰的/嵌合的限制点受体包含作为跨膜受体的无效受体、诱饵受体或显性失活受体。
在一些实施方案中,修饰的/嵌合的限制点受体包括作为膜结合的或膜连接的受体/蛋白的无效受体、诱饵受体或显性失活受体。
在一些实施方案中,修饰的/嵌合的限制点受体包括作为细胞内受体/蛋白的无效受体、诱饵受体或显性失活受体。
在一些实施方案中,修饰的/嵌合的限制点受体包括作为细胞内受体/蛋白的无效受体、诱饵受体或显性失活受体。本公开内容的示例性无效、诱饵或显性失活细胞内受体/蛋白包括,但不限于,抑制性限制点信号(如,例如在表1和2中所提供的),转录因子(如,例如在表3中提供的),细胞因子或细胞因子受体,趋化因子或趋化因子受体,细胞死亡或凋亡受体/配体(如,例如在表4中提供的),代谢感应分子(如,例如在表5中提供的),赋予对癌症治疗的敏感性的蛋白(如,例如在表6中提供的),和癌基因或抑癌基因(如,例如在表7中提供的)下游的信号传导组分。本公开内容的示例性细胞因子、细胞因子受体、趋化因子和趋化因子受体包括,但不限于,表8中提供的细胞因子和细胞因子受体以及趋化因子和趋化因子受体。
表8.示例性的细胞因子、细胞因子受体、趋化因子和趋化因子受体。
在一些实施方案中,修饰的/嵌合的限制点受体包含转换受体。示例性的转换受体可包括本公开内容的修饰的/嵌合的受体/蛋白,其中天然或野生型细胞内信号传导结构域被转换或置换为对于所述蛋白非天然的和/或不是野生型结构域的不同细胞内信号传导结构域。例如,用刺激性信号传导结构域置换抑制性信号传导结构域将把免疫抑制信号转换为免疫刺激信号。替代地,用不同的抑制性结构域置换抑制性信号传导结构域可以降低或增强抑制性信号传导的水平。转换受体的表达或超量表达可通过与内源野生型限制点受体(不是转换受体)竞争结合在免疫抑制肿瘤微环境中表达的关联限制点受体而导致关联限制点信号的稀释和/或阻断。本公开内容的装甲的T细胞可包含编码本公开内容的转换受体的序列,从而导致表达本公开内容的一种或多种转换受体,并因此改变本公开内容的装甲的T细胞的活性。本公开内容的装甲的T细胞可表达本公开内容的转换受体,所述转换受体靶向本公开内容的限制点受体、转录因子、细胞因子受体、死亡受体、代谢感应分子、癌症治疗、癌基因和/或肿瘤抑制蛋白或基因下游的细胞内表达的蛋白。
本公开内容的示例性转换受体可以包括或衍生自包括,但不限于下述的蛋白:抑制性限制点信号(如,例如在表1和2中所提供的),转录因子(如,例如在表3中提供的),细胞因子或细胞因子受体,趋化因子或趋化因子受体,细胞死亡或凋亡受体/配体(如,例如在表4中提供的),代谢感应分子(如,例如在表5中提供的),赋予对癌症治疗的敏感性的蛋白(如,例如在表6中提供的),和癌基因或肿瘤抑制基因(如,例如在表7中提供的)下游的信号传导组分。本公开内容的示例性细胞因子、细胞因子受体、趋化因子和趋化因子受体包括,但不限于,表8中提供的细胞因子和细胞因子受体以及趋化因子和趋化因子受体。
在一些实施方案中,修饰本公开内容的T细胞以表达介导条件性基因表达的嵌合配体受体(CLR)或嵌合抗原受体(CAR),以产生本公开内容的装甲的T细胞。CLR/CAR和条件性基因表达系统在装甲的T细胞核中的组合构成了合成基因表达系统,在一种或多种关联配体与CLR或一种或多种关联抗原与CAR结合时,所述合成基因表达系统被条件性地激活。这个系统可通过减少或限制例如在肿瘤环境处或之内的配体或抗原结合位点的合成基因表达来帮助“装甲”或增强修饰的T细胞的治疗潜力。
外源受体
在一些实施方案中,装甲的T细胞包含组合物,所述组合物包含(a)诱导型转基因构建体,其包含编码诱导型启动子的序列和编码转基因的序列,和(b)受体构建体,其包含编码组成型启动子的序列和编码外源受体,例如CLR或CAR的序列,其中,在将(a)的构建体和(b)的构建体整合到细胞的基因组序列中时,表达外源受体,并且其中所述外源受体在结合配体或抗原时转导细胞内信号,所述细胞内信号直接或间接靶向调节诱导型转基因(a)的表达的诱导型启动子以修饰基因表达。
在本公开内容的合成基因表达系统的一些实施方案中,所述组合物通过降低基因表达来修饰基因表达。在一些实施方案中,所述组合物通过瞬时修饰基因表达(例如,达到配体与外源受体结合的持续时间)来修饰基因表达。在一些实施方案中,所述组合物急性修饰基因表达(例如,配体可逆地结合外源受体)。在一些实施方案中,所述组合物慢性修饰基因表达(例如,配体不可逆地结合外源受体)。
在本公开内容的组合物的一些实施方案中,(b)的外源受体包括关于细胞的基因组序列的内源受体。示例性受体包括但不限于细胞内受体、细胞表面受体、跨膜受体、配体门控型离子通道和G蛋白偶联受体。
在本公开内容的组合物的一些实施方案中,(b)的外源受体包括非天然存在的受体。在一些实施方案中,非天然存在的受体是合成的、修饰的、重组的、突变的或嵌合的受体。在一些实施方案中,非天然存在的受体包含分离或衍生自T细胞受体(TCR)的一个或多个序列。在一些实施方案中,非天然存在的受体包含分离或衍生自支架蛋白的一个或多个序列。在一些实施方案中,包括其中非天然存在的受体不包含跨膜结构域的那些,非天然存在的受体与第二跨膜、膜结合的和/或细胞内受体相互作用,所述第二跨膜、膜结合的和/或细胞内受体在与非天然存在的受体接触后转导细胞内信号。
在本公开内容的组合物的一些实施方案中,(b)的外源受体包括非天然存在的受体。在一些实施方案中,非天然存在的受体是合成的、修饰的、重组的、突变的或嵌合的受体。在一些实施方案中,非天然存在的受体包含分离或衍生自T细胞受体(TCR)的一个或多个序列。在一些实施方案中,非天然存在的受体包含分离或衍生自支架蛋白的一个或多个序列。在一些实施方案中,非天然存在的受体包含跨膜结构域。在一些实施方案中,非天然存在的受体与转导细胞内信号的细胞内受体相互作用。在一些实施方案中,非天然存在的受体包含细胞内信号传导结构域。在一些实施方案中,非天然存在的受体是嵌合配体受体(CLR)。在一些实施方案中,CLR是嵌合抗原受体(CAR)。
在本公开内容的组合物的一些实施方案中,(b)的外源受体包括非天然存在的受体。在一些实施方案中,CLR是嵌合抗原受体(CAR)。在一些实施方案中,嵌合配体受体包含:(a)包含配体识别区的胞外域,其中所述配体识别区至少包含支架蛋白;(b)跨膜结构域,和(c)包含至少一个共刺激结构域的胞内域。在一些实施方案中,(a)的胞外域进一步包含信号肽。在一些实施方案中,(a)的胞外域进一步包含在所述配体识别区和所述跨膜结构域之间的铰链。
在本公开内容的CLR/CAR的一些实施方案中,信号肽包括编码人CD2、CD38、CD3ε、CD3γ、CD3ζ、CD4、CD8α、CD19、CD28、4-1BB或GM-CSFR信号肽的序列。在一些实施方案中,信号肽包括编码人CD8α信号肽的序列。在一些实施方案中,信号肽包含含有MALPVTALLLPLALLLHAARP(SEQ ID NO:17503)的氨基酸序列。在一些实施方案中,信号肽由包含atggcactgccagtcaccgccctgctgctgcctctggctctgctgctgcacgcagctagacca(SEQ IDNO:17504)的核酸序列编码。
在本公开内容的CLR/CAR的一些实施方案中,跨膜结构域包括编码人CD2、CD3δ、CD3ε、CD3γ、CD3ζ、CD4、CD8α、CD19、CD28、4-1BB或GM-CSFR跨膜结构域的序列。在一些实施方案中,跨膜结构域包括编码人CD8α跨膜结构域的序列。在一些实施方案中,跨膜结构域包含含有IYIWAPLAGTCGVLLLSLVITLYC(SEQ ID NO:17505)的氨基酸序列。在一些实施方案中,跨膜结构域由包含atctacatttgggcaccactggccgggacctgtggagtgctgctgctgagcctggtcatcacactgtactgc(SEQ ID NO:17506)的核酸序列编码。
在本公开内容的CLR/CAR的一些实施方案中,所述胞内域包括人CD3ζ胞内域。在一些实施方案中,所述至少一个共刺激结构域包括人4-1BB、CD28、CD3ζ、CD40、ICOS、MyD88、OX-40细胞内区段或其任何组合。在一些实施方案中,所述至少一个共刺激结构域包括人CD3ζ和/或4-1BB共刺激结构域。在一些实施方案中,所述CD3ζ共刺激结构域包含氨基酸序列,所述氨基酸序列包含RVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR(SEQ ID NO:17507)。在一些实施方案中,所述CD3ζ共刺激结构域由包含以下序列的核酸序列编码
在一些实施方案中,所述至少一种蛋白支架特异性结合所述配体。
在本公开内容的组合物的一些实施方案中,(b)的外源受体包括非天然存在的受体。在一些实施方案中,CLR是嵌合抗原受体(CAR)。在一些实施方案中,嵌合配体受体包含:(a)包含配体识别区的胞外域,其中所述配体识别区至少包含支架蛋白;(b)跨膜结构域,和(c)包含至少一个共刺激结构域的胞内域。在一些实施方案中,所述至少一种蛋白支架包括抗体、抗体片段、单结构域抗体、单链抗体、抗体模拟物或Centyrin(在本文中称为CARTyrin)。在一些实施方案中,配体识别区包括抗体、抗体片段、单结构域抗体、单链抗体、抗体模拟物和Centyrin中的一种或多种。在一些实施方案中,单结构域抗体包括VHH或VH(在本文中称为VCAR)或由其组成。在一些实施方案中,单结构域抗体包括包含人互补决定区(CDR)的VHH或VH或由其组成。在一些实施方案中,VH是重组或嵌合蛋白。在一些实施方案中,VH是重组或嵌合人蛋白。在一些实施方案中,抗体模拟物包括affibody、afflilin、affimer、affitin、alphabody、anticalin、avimer、DARPin、Fynomer,Kunitz结构域肽或monobody或由其组成。在一些实施方案中,Centyrin包含至少一种纤连蛋白III型(FN3)结构域的共有序列或由其组成。
在本公开内容的组合物的一些实施方案中,(b)的外源受体包括非天然存在的受体。在一些实施方案中,CLR是嵌合抗原受体(CAR)。在一些实施方案中,嵌合配体受体包含:(a)包含配体识别区的胞外域,其中所述配体识别区至少包含支架蛋白;(b)跨膜结构域,和(c)包含至少一个共刺激结构域的胞内域。在一些实施方案中,Centyrin包含至少一种纤连蛋白III型(FN3)结构域的共有序列或由其组成。在一些实施方案中,所述至少一种纤连蛋白III型(FN3)结构域衍生自人蛋白。在一些实施方案中,所述人蛋白是生腱蛋白-C。在一些实施方案中,所述共有序列包含LPAPKNLVVSEVTEDSLRLSWTAPDAAFDSFLIQYQESEKVGEAINLTVPGSERSYDLTGLKPGTEYTVSIYGVKGGHRSNPLSAEFTT(SEQ ID NO:17514)。在一些实施方案中,所述共有序列包含MLPAPKNLVVSEVTEDSLRLSWTAPDAAFDSFLIQYQESEKVGEAINLTVPGSERSYDLTGLKPGTEYTVSIYGVKGGHRSNPLSAEFTT(SEQ ID NO:17515)。在一些实施方案中,所述共有序列在以下内的一个或多个位置处被修饰:(a)包含在共有序列的位置13-16处的氨基酸残基TEDS(SEQ ID NO:17516)或由其组成的A-B环;(b)包含在共有序列的位置22-28处的氨基酸残基TAPDAAF(SEQ ID NO:17517)或由其组成的B-C环;(c)包含在共有序列的位置38-43处的氨基酸残基SEKVGEv(SEQ ID NO:17518)或由其组成的C-D环;(d)包含在共有序列的位置51-54处的氨基酸残基GSER(SEQ ID NO:17519)或由其组成的D-E环;(e)包含在共有序列的位置60-64处的氨基酸残基GLKPG(SEQ ID NO:17520)或由其组成的E-F环;(f)包含在共有序列的位置75-81处的氨基酸残基KGGHRSN(SEQ ID NO:17521)或由其组成的F-G环;或(g)(a)-(f)的任何组合。在一些实施方案中,Centyrin包含至少5种纤连蛋白III型(FN3)结构域的共有序列。在一些实施方案中,Centyrin包含至少10种纤连蛋白III型(FN3)结构域的共有序列。在一些实施方案中,Centyrin包含至少15种纤连蛋白III型(FN3)结构域的共有序列。在一些实施方案中,支架以选自小于或等于10
诱导型启动子
在本公开内容的组合物的一些实施方案中,(a)的编码诱导型启动子的序列包括编码NFκB启动子的序列。在本公开内容的组合物的一些实施方案中,(a)的编码诱导型启动子的序列包括编码干扰素(IFN)启动子的序列或编码白介素-2启动子的序列。在一些实施方案中,干扰素(IFN)启动子是IFNγ启动子。在本公开内容的组合物的一些实施方案中,诱导型启动子分离或衍生自细胞因子或趋化因子的启动子。在一些实施方案中,细胞因子或趋化因子包括IL2、IL3、IL4、IL5、IL6、IL10、IL12、IL13、IL17A/F、IL21、IL22、IL23、转化生长因子β(TGFβ)、集落刺激因子2(GM-CSF)、干扰素γ(IFNγ)、肿瘤坏死因子(TNFα)、LTα、穿孔蛋白、粒酶C(Gzmc)、粒酶B(Gzmb)、C-C基序趋化因子配体5(CCL5)、C-C基序趋化因子配体4(Ccl4)、C-C基序趋化因子配体3(Ccl3)、X-C基序趋化因子配体1(Xcl1)和LIF白介素6家族细胞因子(Lif)。
在本公开内容的组合物的一些实施方案中,诱导型启动子分离或衍生自包含与细胞分化、激活、衰竭和功能相关的表面蛋白的基因的启动子。在一些实施方案中,所述基因包括CD69、CD71、CTLA4、PD-1、TIGIT、LAG3、TIM-3、GITR、MHCII、COX-2、FASL和4-1BB。
在本公开内容的组合物的一些实施方案中,诱导型启动子分离或衍生自与CD代谢和分化相关的基因的启动子。在本公开内容的组合物的一些实施方案中,诱导型启动子分离或衍生自Nr4a1、Nr4a3、Tnfrsf9(4-1BB)、Sema7a、Zfp36l2、Gadd45b、Dusp5、Dusp6和Neto2的启动子。
诱导型转基因
在一些实施方案中,诱导型转基因构建体包含或驱动抑制性限制点信号(如,例如在表1和2中所提供的),转录因子(如,例如在表3中提供的),细胞因子或细胞因子受体,趋化因子或趋化因子受体,细胞死亡或凋亡受体/配体(如,例如在表4中提供的),代谢感应分子(如,例如在表5中提供的),赋予对癌症治疗的敏感性的蛋白(如,例如在表6和/或表9中提供的),和癌基因或肿瘤抑制基因(如,例如在表7中提供的)下游的信号传导组分的表达。本公开内容的示例性细胞因子、细胞因子受体、趋化因子和趋化因子受体包括,但不限于,表8中提供的细胞因子和细胞因子受体以及趋化因子和趋化因子受体。
表9.示例性的治疗蛋白(和增强CAR-T功效的蛋白)。
本公开内容提供了包含向导RNA和融合蛋白或编码融合蛋白的序列的组合物,其中所述融合蛋白包含dCas9和Clo051内切核酸酶或其核酸酶结构域。
小的Cas9(SaCas9)
本公开内容提供了包含可操作地连接至效应物的小Cas9(Cas9)的组合物。在某些实施方案中,本公开内容提供了一种融合蛋白,其包含DNA定位组分和效应分子、基本上由其组成或由其组成,其中所述效应物包含小Cas9(Cas9)。在某些实施方案中,本公开内容的小Cas9构建体可包含含有IIS型内切核酸酶的效应物。
具有活性催化位点的金黄色葡萄球菌(Staphylococcus aureus)Cas9的氨基酸序列。
失活的小Cas9(dSaCas9)
本公开内容提供了包含可操作地连接至效应物的失活的小Cas9(dSaCas9)的组合物。在某些实施方案中,本公开内容提供了一种融合蛋白,其包含DNA定位组分和效应分子、基本上由其组成或由其组成,其中所述效应物包含小的、失活的Cas9(dSaCas9)。在某些实施方案中,本公开内容的小的、失活的Cas9(dSaCas9)构建体可包含含有IIS型内切核酸酶的效应物。
dSaCas9序列:D10A和N580A突变(黑体、大写字母和加下划线)使催化位点失活。
失活的Cas9(dCas9)
本公开内容提供了包含可操作地连接至效应物的失活的Cas9(dCas9)的组合物。在某些实施方案中,本公开内容提供了一种融合蛋白,其包含DNA定位组分和效应分子、基本上由其组成或由其组成,其中所述效应物包含失活的Cas9(dCas9)。在某些实施方案中,本公开内容的失活的Cas9(dCas9)构建体可包含含有IIS型内切核酸酶的效应物。
在某些实施方案中,本公开内容的dCas9包含分离或衍生自酿脓葡萄球菌(Staphyloccocus pyogenes)的dCas9。在某些实施方案中,dCas9包括具有使催化位点失活的、在dCas9的氨基酸序列的位置10和840处的取代的dCas9。在某些实施方案中,这些取代是D10A和H840A。在某些实施方案中,dCas9的氨基酸序列包含以下序列:
在某些实施方案中,dCas9的氨基酸序列包含以下序列:
Clo051内切核酸酶
示例性的Clo051核酸酶结构域可以包含以下氨基酸序列、基本上由其组成或由其组成:
Cas-Clover融合蛋白
在某些实施方案中,示例性的dCas9-Clo051融合蛋白(实施方案1)可包含以下氨基酸序列、基本上由其组成或由其组成(Clo051序列加下划线,接头黑体斜体,dCas9序列(酿脓链球菌(Streptoccocus pyogenes))斜体):
在某些实施方案中,示例性的dCas9-Clo051融合蛋白(实施方案1)可包含以下核酸序列、基本上由其组成或由其组成(衍生自酿脓链球菌的dCas9序列):
在某些实施方案中,编码本公开内容的dCas9-Clo051融合蛋白(实施方案1)的核酸序列可以包括DNA。在某些实施方案中,编码本公开内容的dCas9-Clo051融合蛋白(实施方案1)的核酸序列可以包括RNA。
在某些实施方案中,示例性的dCas9-Clo051融合蛋白(实施方案2)可包含以下氨基酸序列、基本上由其组成或由其组成(Clo051序列加下划线,接头黑体斜体,dCas9序列(酿脓链球菌)斜体):
在某些实施方案中,示例性的dCas9-Clo051融合蛋白(实施方案2)可包含以下核酸序列、基本上由其组成或由其组成(衍生自酿脓链球菌的dCas9序列):
在某些实施方案中,编码本公开内容的dCas9-Clo051融合蛋白(实施方案2)的核酸序列可以包括DNA。在某些实施方案中,编码本公开内容的dCas9-Clo051融合蛋白(实施方案2)的核酸序列可以包括RNA。
实施例
为了产生具有增强的治疗潜力的装甲的T细胞,可以进行基因修饰以使T细胞对免疫学和/或代谢限制点的敏感性较低。产生装甲的T细胞的一种机制是抑制限制点信号传导是敲除各种限制点受体。Cas-CLOVER
产生装甲的T细胞的另一种策略是通过表达具有改变的或不存在的细胞内信号传导结构域的各种修饰的/嵌合的限制点受体来减少或抑制内源限制点信号传导。可以使用这个策略靶向的限制点信号包括T细胞的PD-1或TGFβRII,其分别结合PD-L1配体和TGFβ细胞因子。图12显示了用于产生两种不同抑制性受体(PD-1(上图)和TGFβRII(下图))的诱饵/无效/显性失活受体(无效受体)的各种策略的示意图。为了设计无效受体,可以将PD1或TGFβRII的细胞内结构域(ICD)突变(突变的无效)或缺失(截短的无效)。结果,无效受体的一种或多种关联配体的结合不导致限制点信号至T细胞的递送。此外,因为无效受体与野生型受体竞争与一种或多种内源配体的结合,所以任何由所述无效受体的结合都将掩蔽一种或多种内源配体与野生型受体结合。这导致有效递送至T细胞的限制点信号传导的总水平稀释,因此减少或阻断限制点抑制。图12也显示了抑制性受体PD-1(上图)和TGFβRII(下图)的转换受体设计策略。在转换受体中,野生型ICD被来自免疫刺激分子(共刺激转换)或不同的抑制性分子(抑制性转换)的ICD置换。免疫刺激分子包括但不限于CD3z、CD28、4-1BB和表1中列出的实例。抑制性分子包括但不限于CTLA4、PD1、Lag3以及表1和9中列出的实例。在前一种情况下,由修饰的转换受体对内源配体的结合导致阳性信号向T细胞的递送,从而有助于增强T细胞的刺激,促进肿瘤靶向和杀伤的继续。在后一种情况下,由修饰的转换受体对内源配体的结合导致阴性信号向T细胞的递送,从而有助于降低T细胞的刺激和活性。
为了产生装甲的T细胞,设计了许多表达替代的信号肽(SP)和跨膜结构域(TM)的截短的无效受体,并测试了它们在修饰的T细胞表面上的最大表达。图13显示了PD-1(上图)和TGFβRII(下图)的几种无效受体构建体的示意图。修饰这些蛋白的细胞外结构域(ECD),从而使得野生型信号肽(SP)和/或跨膜结构域(TM)被置换为来自人T细胞CD8a受体的那种(红色箭头)。图13所示的六个截短的无效构建体的每一个被DNA合成,且然后亚克隆到mRNAIVT DNA载体(pRT)中。对于每一个都通过IVT产生了高质量mRNA。使用电穿孔(EP)递送到原代人T细胞中进行编码六种分子中的每一种的mRNA的转染,并在EP后24小时进行FACS分析,以评价每种构建体在细胞表面上的表达水平(图14)。通过流式细胞术,用替代的CD8a置换WT SP(02.8aSP-PD-1和02.8aSP-TGFβRII)导致在T细胞表面的最高水平表达。02.8aSP-PD-1无效受体表现出43,680的MFI,其是内源T细胞PD-1表达的177倍和WT PD-1无效受体的2.8倍。02.8aSP-TGFβRII无效受体表现出13,809的MFI,其是内源T细胞TGFβRII表达的102倍和WT TGFβRII无效受体的1.8倍。这些结果表明,对于PD1和TGFβRII抑制性蛋白两者,用替代的CD8a SP置换野生型SP导致无效或转换受体增强的表面表达。这转而又将分别使在结合一种或多种天然配体时限制点抑制或共刺激达到最大。
开发了两种T细胞激活NF-KB诱导型载体(图15A和15B);一种具有正向取向(A)的基因表达系统(GES),且另一种在互补方向(B),两者都在组成型EF1a启动子之前。这些载体还指导由T2A序列分开的CAR分子和DHFR选择基因的表达。条件性NF-KB诱导型系统和EF1a指导的基因两者都是可以使用EP永久整合到T细胞中的piggyBac转座子的一部分。一旦整合到基因组中,T细胞就组成型表达膜表面上的CAR和细胞内的DHFR,而NF-KB诱导型基因GFP的表达仅在T细胞激活时才将表达到最高水平。
用表达在EF1a启动子控制下的抗-BCMA CAR和DHFR突变蛋白基因的piggyBac载体以及在不存在(无基因表达系统(GES)对照)或存在驱动正向取向(pNFKB-GFP正向)或反向取向(pNFKB-GFP反向)的GFP表达的NF-KB诱导型表达系统的情况下对T细胞进行核转染。在氨甲蝶呤选择存在下培养细胞,直到细胞几乎完全静息(第19天),并在第5天和第19天评估GFP表达。在第5天,所有T细胞均增殖并被高度刺激,而带有NFKB诱导型表达盒的细胞由于强NFκB活性而产生高水平的GFP(参见图16)。无GES对照细胞不表达可检测水平的GFP。到第19天,GES T细胞几乎完全静息,且GFP表达显著低于第5天(~1/8MFI),这是因为NFκB活性较低。在第19天仍观察到GFP表达,这可能是由于GFP蛋白的长半衰期(~30小时),或通过例如TCR、CAR、细胞因子受体或生长因子受体信号的NFκB活性的基础水平。
T细胞是未修饰的(模拟T细胞)或用表达在EF1a启动子控制下的抗-BCMA CAR和DHFR突变蛋白基因的piggyBac载体以及在不存在(无GES对照)或存在驱动正向取向(pNFKB-GFP正向)或反向取向(pNFKB-GFP反向)的GFP表达的NF-KB诱导型表达系统的情况下进行核转染。在具有或不具有氨甲蝶呤选择(模拟T细胞)的情况下,将所有细胞培养22天,直到细胞几乎完全静息。然后在不存在(无刺激)或存在BCMA-(K562)、BMCA+(RPMI8226)或阳性对照抗-CD3抗-CD28激活试剂(CD3/28刺激)的情况下刺激细胞3天。在所有条件下用无GES对照或模拟T细胞都不可检测GFP表达。然而,虽然当与BCMA-K562细胞一起培养时,pNFKB-GFP正向和反向转座的细胞比起无刺激对照来显示少量GFP表达,但它们均在有BCMA+肿瘤细胞的情况下或在阳性对照条件下显示了基因表达的剧烈上调(图17)。在与BCMA+肿瘤细胞共培养的pNFKB-GFP正向和反向转座的细胞之间几乎没有观察到GFP表达的差异。
诱导型基因的表达水平可以通过在诱导型启动子上游或之前的应答元件的数目来调节。T细胞用piggyBac载体进行核转染,所述piggyBac载体编码抗-BCMA CARTyrin及随后的选择基因,两者均在人EF1a启动子控制下(图18)。进一步地,载体额外编码驱动截短的CD19蛋白(dCD19)表达的条件性NF-KB诱导型基因表达系统,并包括从0到5不等的许多NFKB应答元件(RE),无GES(无GES),或接受电穿孔脉冲但没有piggyBac核酸(模拟)。仅显示了关于反向(相反)方向/取向的GES的数据。所有细胞培养18天,并包括使用氨甲蝶呤添加对于piggyBac-修饰的T细胞的选择。然后使用抗-CD3抗-CD28珠激活试剂刺激细胞3天,并在第0、3和18天通过FACS评估dCD19表面表达,并且将数据显示为FACS直方图和靶蛋白染色的MFI。在第0天,在用编码GES的载体转座的所有T细胞中都检测到了低水平的表面dCD19表达。在刺激后3天,对于所有表达GES的T细胞,观察到dCD19表达的剧烈上调,而在具有更高数目的RE的那些中,表面表达的增加倍数更大。因此,表面dCD19表达与GES中编码的RE的数目成正比。在不带有GES的T细胞(无GES和模拟对照)表面未检测到dCD19。
通过引用并入
除非明确地排除或以其他方式限制,否则本文引用的每个文件,包括任何相互参考的或相关的专利或申请,均通过全文引用并入本文。任何文件的引用并非承认其是相对于本文公开或请求保护的任何发明的现有技术,或者其单独或与任何其他一篇或多篇参考文件组合教导、暗示或公开了任何这种发明。进一步地,只要这个文件中术语的任何含义或定义与通过引用并入的文件中相同术语的任何含义或定义冲突,则以在这个文件中赋予给该术语的含义或定义为准。
其他实施方案
尽管已经举例说明和描述了本公开内容的特定实施方案,但是在不脱离本公开内容的精神和范围的情况下,可以做出各种其他改变和修改。所附权利要求的范围包括在本公开内容的范围内的所有这种改变和修改。
- VCAR组合物和使用方法
- 固化性组合物、固化性组合物的制造方法、固化物、和固化性组合物的使用方法
