从人诱导多能干细胞制备软骨细胞颗粒的方法及其用途
文献发布时间:2023-06-19 09:30:39
技术领域
本申请主张2018年06月25日申请的韩国专利申请第10-2018-0072875号的优先权,上述说明书的全部内容为本申请的参考文献。
本发明涉及软骨细胞颗粒的制备方法,其包括:步骤(a),通过培养人诱导多能干细胞(human induced pluripotent stem cell)来形成并获得拟胚体(embryoid body);步骤(b),诱导上述步骤(a)中获得的拟胚体成为生长细胞(outgrowth cell)并分离;以及步骤(c),以颗粒(pellet)状培养上述步骤(b)中分离的生长细胞。
本发明还涉及用于治疗关节炎的药学组合物,其包含通过上述制备方法制备的软骨细胞颗粒。
本发明还涉及预防或治疗关节炎的方法,其包括将通过上述方法制备的软骨细胞颗粒给药于关节炎患者的步骤。
背景技术
软骨(cartilage)是由软骨细胞和软骨基质组成的骨组织,通常是指形成关节一部分的组织。软骨具有高弹性和非常低的摩擦系数,起到防止骨骺摩擦的缓冲作用,从而有助于在几乎无摩擦的状态下也可使关节运动。除此之外,还构建需要弹性的部位,例如呼吸道的器官或耳廓等,或者构建需要耐压力的部位,例如肋软骨、耻骨软骨。
关节软骨(articular cartilage)是一种具有弹性的白色组织,其包围骨的末端并保护骨骼免受摩擦。关节软骨由软骨细胞(chondrocyte)组成,上述软骨细胞是以分布在由各种类型的胶原蛋白(collagen)、蛋白聚糖(proteoglycan)及柔性纤维组成的细胞外基质(extracellular matrix)与软骨基质之间的方式特殊分化的细胞。
软骨细胞通过生产细胞外基质的组合物来起到生成并维持关节软骨的作用。软骨母细胞虽然发生细胞分裂,但是一旦停止生长,在正常环境下软骨细胞不再分裂。并且,由于其被限制在称为热孔(lacuna)的小空间中,因而在软骨受损后,难以移动和恢复软骨细胞。甚至由于软骨是无血管组织,因此没有用于提供营养的血管。无血管的软骨阻碍干细胞的移动,并减少组织的再生力。这些特征意味着软骨一旦受损就几乎不可能自然愈合。因此,重要的是生产能够在体外(in vitro)生产细胞外基质的功能性软骨细胞,或获得用于移植的完全生长的软骨。
为了治疗受损的软骨组织,可以利用药物治疗剂(镇痛剂、类固醇剂、非甾体类抗炎剂等)、软骨保护剂(透明质酸(hyaluronic acid)、氨基葡萄糖(glucosamine)、软骨素(chondroitin)等),或者手术治疗(关节镜手术、胫骨近端截骨术、关节部分置换术、全膝关节置换术、骨髓刺激术、骨软骨组织移植术等)。
但是,在药物治疗剂的情况下,其仅具有非特异性地缓解疼痛或炎症反应本身的效果,而软骨保护剂仅通过向软骨细胞提供营养或缓解冲击来起到暂时保护关节的作用。
并且,在整形外科中进行各种临床手术方法,代表性的方法包括骨髓刺激术(Bonemarrow stimulation)和骨-软骨组织移植术(Osteochondral graft)。骨髓刺激术是暴露受损的软骨下骨(subchondral bone)并用含有从骨髓诱导的干细胞的血块(blood clot)填充软骨损伤的方法,其具有手术比较简单的优点,但存在手术后再生为纤维化软骨(fibrotic cartilage)而不是透明软骨(hyaline cartilage)。骨-软骨组织移植术是从患者自身的软骨组织中提取重量较轻的部位的骨-软骨结缔组织之后,将其移植到软骨损伤部位的方法,其缺点是若损伤部位较大,则无法使用。
为了克服这种手术治疗技术的缺点,正在对从外部提供治疗细胞的细胞治疗剂进行大量研究。第一次产品化的技术是自体软骨细胞移植术(Autologous ChondrocytesImplantation),该技术是从患者自身的软骨组织中的重量较轻的部位摘取一些健康软骨,并从其中分离软骨细胞并进行体外培养后将其重新注入损伤部位的方法,该技术的缺点是因两次手术而造成麻烦以及损坏健康部位的软骨,尤其由于所提取的软骨细胞的数量少,因此需要培养规定期间,在培养期间内发生无法维持软骨细胞表型(phenotype)的去分化(dedifferentiation)现象,并且在移植后,细胞的存活率下降,注入的软骨细胞不均质,由于重力作用而集中在特定部位,因而分布不均匀。
为了克服细胞治疗剂的体内分布及分化的缺点,正在使用一种将各种类型的生物材料(biomaterials)用作支架(scaffolds)来递送细胞的技术,进而正在开发一种在体外制备三维结构的人工软骨组织(tissue engineered cartilage)的组织工程技术。
在组织工程软骨制备中,支架通过向软骨细胞提供三维系统来维持软骨细胞的表型,并促进透明软骨性细胞外基质的生产。不仅如此,还将细胞递送到软骨损伤部位,并向移植部位提供物理支撑来从负载力保护细胞。当前用于将细胞递送到移植部位的支架具有各种类型,例如海绵(sponge)、凝胶(gel)、纤维及微珠(microbead)等,主要利用天然或合成生物材料来制备。在利用支架的情况下,移植术本身具有表现出高效率且可以在移植部位均匀分布的优点,但当细胞在支架中增殖或分泌细胞外基质时,该支架反而存在可能产生空间限制的缺点。尤其,由于氧气和养分供给不顺畅,水凝胶(hydrogel)状支架存在细胞的存活率和软骨分化差的缺点,膜(membrane)状支架无法形成三维软骨组织,在使用三维海绵或网(mesh)状支架的情况下,由于制备出的人工软骨与原始宿主组织(host tissue)之间的结合力低而存在难以再生软骨的缺点。并且,所有的支架都进行分解,在分解速度快的天然生物材料的情况下,细胞很可能随着分解而丢失,就临床应用而言,异种及同种来源的天然材料可以引起免疫反应,在合成材料的情况下,还会产生有害的分解产物,因而存在安全性方面不自由的缺点。
持续进行着针对不使用支架而制备三维结构的人工软骨组织的方法的研究,这种方法仅依赖于细胞及其细胞外基质合成能力来形成组织,因而难以制备符合需要移植的损伤大小的组织,因此在直接用于临床方面受到很大的限制。
并且,由于软骨损伤的形状和深度不是恒定的,因此如果实验室制备的三维结构的人工软骨大于损伤部位,则需要根据损伤的形状修剪移植物,反之,如果软骨移植物小于损伤部位,则需要通过根据损伤形状将其像马赛克一样填充的方法进行移植。以这种方式移植当前开发的组织工程软骨产品,但无法调节损伤的厚度,如果在关节软骨中移植物比周围软骨突出或凹陷,则由于异常的体重负载,会对移植物或周围正常软骨造成额外损伤。
作为制备无支架的小型软骨结构物的方法,有一种自然诱导细胞凝集的方法。可利用旋转技术生成称为凝集模式(aggregation pattern)的细胞聚集体,这在细胞以在培养基中悬浮的状态进行动态培养(dynamic culture)时,通过细胞之间的作用自然形成细胞聚集体(aggregate)。
例如,在非贴壁塑料表面上操作细胞来制备三维细胞聚集体的球体(spheroid)系统中,细胞形成三维细胞聚集体,并自然生产与透明软骨的基质类似的其自身细胞外基质。但是,由于这种培养方法无法调节制备单个细胞聚集体的细胞数量,并且可能在形成的软骨性组织之间发生融合(fusion),因此可能存在每个软骨性组织的大小及软骨分化程度的多样性,从而存在无法将其标准化为细胞治疗剂的缺点。
作为另一例,有一种使用贴壁培养皿的微质量(micromass)/微骨层(chondrosphere)培养方法,在该方法中,若将具有软骨分化能力的细胞的高浓度悬浮液滴注到贴壁培养皿中,并使其在37℃的恒温箱中静置,则细胞会在数小时至数天内结块,使其悬浮在培养基中后,在非贴壁培养皿或动态培养条件下进行三维培养。该方法的优点是能够对形成软骨性组织的细胞数量进行调节,但是能够自然形成细胞聚集体的能力根据细胞的状态存在差异,因而无法保证稳定地获得均匀化的软骨性组织。并且,在细胞外基质变硬之前一次性培养细胞聚集体的情况下,可能在形成的软骨性组织之间发生融合。
为了使形成自然细胞聚集体的细胞数量相等,还进行了使用微孔(microwell)的研究,在干细胞的三维培养中干球(hepatosphere)大时,内部中心部发生坏死,因此需要开发能够以所需大小来大量制备均匀化的干球的三维培养系统。已经提出了微成型技术(micromolding techniques)或使用基于薄二甲基聚硅氧烷(Poly-Dimethylpolysiloxane,PDMS)膜制备的直径为300~500μm的凹形微模具的技术。当在平坦的PDMS、圆柱形或凹形微孔中培养干细胞来形成球体时,在凹形微孔中形成的球体的大小和形状均匀,并且大小由凹形微孔的直径完全调节,在凹形微孔中培养的细胞比在圆柱形微孔或平坦表面形成球体更快,并且细胞易于回收,这在获得稳定球体方面具有很大的优势。在利用微模具的微-组织制备方法的情况下,由于模具已被商品化,因而在各种细胞中得到评估,但是由于这也是诱导自然细胞凝集的方法,因此不能保证可以稳定地获得均匀化的软骨性组织,并且由于制成的细胞聚集体的大小过小,因此物理强度脆弱且难以操作,从而在用作三维软骨细胞治疗剂方面存在局限性。
另一方面,在制备没有支架的小型软骨结构物的方法中,颗粒(pellet)培养是一种通过对较少数量的细胞进行离心分离来形成细胞凝集,从而从三维培养开始阶段就人工制备细胞的超高密度培养系统的方法。颗粒形成过程简单且易于重现,具有软成骨能力的细胞在该系统下合成并分泌软骨性细胞外基质来制备软骨性组织。颗粒培养法是最常用的评估干细胞分化为软骨细胞能力的方法,也已用于评估外源因素对软骨细胞产生的影响。但是,尚未评估通过颗粒培养制成的软骨结构物作为细胞治疗剂的可利用性,这是因为颗粒系统是一种用于制备高质量软骨性组织的有效方法,但由于难以制成足够的颗粒大小而被判断为难以适用于软骨损伤部位的再生。并且,一般的颗粒培养利用如下方法:将细胞悬浮液置于带盖的管(圆锥管、贮藏管、微离心分离管等)中,进行离心分离,然后进行三维培养来在每个管制备一个颗粒,因此存在难以大量培养的缺点。
因此,在将软骨细胞培养成颗粒并制成可注射形式的情况下,可以克服软骨细胞的重现可能性低的问题,并且不会因培养过程中的灌注(perfusion)问题而导致内部细胞的凋亡,通过将多个软骨细胞颗粒给药于损伤部位来无论软骨损伤部位的形状及厚度如何,均可以适用。不仅如此,由于其为可注射形式,因此不需要切开软骨损伤部位。但是,为了将其开发成治疗剂,需要一种能够制备可反复重现且均匀化的软骨性组织的技术,为了用于大面积部位的损伤,需要一种可制备大量软骨性组织的大规模培养系统。
为了克服上述问题,随着人工细胞培养技术的发展,已经报道了一种从多能干细胞(multipotent stem cell)或间充质干细胞(mesenchymal stem cell)中人工培养软骨细胞并进行移植(implantation)的方法。近年来,通过培养同种脐带血衍生的间充质干细胞(cord blood-derived mesenchymal stem cell)来移植到受损的软骨部位的技术已经产品化(韩国授权专利10-0494265)。间充质干细胞具有相对容易获得的优点,因此已被广泛用作针对类风湿性关节炎和骨关节炎等各种疾病的细胞治疗用组合物。但是其存在如下缺点:分化速度低且表型不稳定,因此在分化过程中很可能发生不必要的分化或变形,并且需要从患者身上提取大量。并且,据报道,间充质干细胞在体外经过3至4天后丧失固有特性,并且间充质干细胞的生产及分化能力根据患者的年龄或疾病状态而变化。并且还存在如下问题:植入体内后,由于与细胞肥大性有关的基因表达,导致细胞凋亡和因血管渗透而导致软骨细胞的钙化。因此,需要一种用于体外培养软骨细胞的新的细胞来源。
构成关节的软骨组织受损会导致伴随肿胀、发热和疼痛的关节炎(arthritis),关节炎的发病与种族无关,根据其原因分为100多钟。其中,最常见的形式主要是作为因老化而引起的退化性关节疾病(degenerative joint disease)的骨关节炎(osteoarthritis),此外还有作为自身免疫疾病的类风湿性关节炎(rheumatoid arthritis)和银屑病关节炎(psoriatic arthritis)、因感染引起的败血性关节炎(septic arthritis)等。尤其,退化性关节炎作为老年阶层的代表性疾病,其主要因关节衰老引起,但是,此外还因遗传因素、营养失衡、缺乏运动、过度运动或受伤、过度工作等导致关节受压的行为或错误姿势以及肥胖导致的超负荷等各种因素共同作用而导致,因此在年轻人中也经常发生。像这样,关节炎是在很宽的年龄段中发病率高的疾病,且一旦受损的组织就不易自然再生或修复,因而会长期限制患者的社交活动,并导致生活质量下降。
当前使用的大多数关节炎治疗剂是需要手术的治疗剂,并且其存在需要长期恢复的缺点,或者其软骨再生功效未得到认可。
多能干细胞是指能够分化为构成生物的所有3个胚层(germ layer)并因此分化为人体所有细胞或器官组织的多功能干细胞,通常,胚胎干细胞(embryonic stem cell)属于多能肝细胞。由于人类胚胎干细胞由可以发育为人类生命体的胚胎制成,因而存在许多道德问题,但是与成体干细胞相比,已知其具有优异的细胞增殖及分化能力。人诱导多能干细胞(human induced pluripotent stem cell,hiPSC)作为再生医学的替代细胞来源来收到了青睐。人诱导多能干细胞可通过化合物或遗传因素的组合从各种细胞获得,并且不存在像胚胎干细胞那样的道德问题,因此应用可能性高。由此,人诱导多能干细胞的发现为各种疾病的药物筛选及治疗方法的研究提供了新的策略。
与间充质干细胞不同,人诱导多能干细胞向包括软骨细胞在内的靶细胞分化的能力突出,因而可以成为用于替代如关节软骨之类的在再生力方面存在局限性的受损组织的细胞来源。并且,由于人诱导多能干细胞具有无限的增殖能力,因而判断其为可在适当的培养环境中用作培养适于大规模生产的软骨细胞的细胞来源。
用于维持及增值未分化状态的人诱导多能干细胞的培养技术非常繁琐,并且存在将人诱导多能干细胞完全分化为特定细胞需要相当长时间的缺点,因而其是开发包括分化诱导技术在内的相关技术过程中最大障碍因素之一。在当前水平下,利用人诱导多能干细胞的普遍分化诱导技术中,大多数利用通过制备拟胚体(embryoid body)的分化诱导方法。即,为了在试管内(in vitro)进行人诱导多能干细胞的细胞-特异性分化培养,需要首先解决通过悬浮培养使细胞自发凝集成称为拟胚体的球状的步骤,拟胚体在诱导谱系特异性分化中用作普通且重要的介质。
已经报道了从人诱导多能干细胞制备软骨细胞的各种方法,但这些方法存在如下局限性:从人诱导多能干细胞分化为软骨细胞所需的时间增加,或在培养的颗粒中发生软骨细胞颗粒的松散现象,或获得未完全分化(not fully mature)的软骨细胞,或分化为软骨细胞或非软骨细胞,每种软骨细胞的分化程度各不相同。
发明内容
技术问题
因此,为了开发出确保软骨细胞的重现可能性、解决大规模生产问题、向软骨细胞的分化率明显高、大小均匀且分化程度均质的软骨细胞颗粒,本发明人通过努力,最终制备出包含通过从人诱导多能干细胞获得的拟胚体的贴壁培养而诱导的生长细胞的颗粒,并以注射形式给药于软骨损伤部位来确认到软骨再生效果优异,从而完成了本发明。
本发明的目的在于,提供用于制备具有从人诱导多能干细胞(human inducedpluripotent stem cell)向软骨细胞的高分化率、大小均匀且分化程度均质的颗粒(pellet)的方法。
本发明的另一目的在于,提供具有优异的软骨再生效果且不需要手术的注射形式的用于治疗关节炎的药学组合物以及预防或治疗关节炎的方法。
解决问题的手段
为了实现上述目的,本发明提供软骨细胞颗粒的制备方法,其包括:步骤(a),通过培养人诱导多能干细胞(human induced pluripotent stem cell)来形成并获得拟胚体(embryoid body);步骤(b),诱导上述步骤(a)中获得的拟胚体成为生长细胞(outgrowthcell)并分离;以及步骤(c),以颗粒(pellet)状培养上述步骤(b)中分离的生长细胞。
根据本发明的优选一实施例,上述步骤(a)的人诱导多能干细胞可以源自脐带血单核细胞(cord blood mononuclear cell)。
根据本发明的优选一实施例,上述步骤(a)的培养可以是贴壁培养。
根据本发明的优选一实施例,上述步骤(b)的诱导可在明胶(gelatin)包被板进行。
根据本发明的优选一实施例,在上述步骤(c)中,可对分离的生长细胞进行离心分离来以颗粒状培养。
根据本发明的优选一实施例,上述离心分离可在1100~2500rpm的速度下进行。
根据本发明的优选一实施例,上述步骤(c)中分离的生长细胞中的95%~100%可以形成为软骨细胞颗粒。
根据本发明的优选一实施例,上述步骤(c)中的培养可在包含人骨形态发生蛋白(BMP,human bone morphogenetic protein)及转化生长因子-β(TGF-β,transforminggrowth factor-beta)的无血清培养基中进行。
根据本发明的优选一实施例,上述软骨细胞颗粒可含有200~5000个上述步骤(b)的生长细胞。
根据本发明的优选一实施例,上述软骨细胞颗粒可分化为透明软骨细胞。
本发明还提供包含通过上述软骨细胞颗粒的制备方法制备的软骨细胞颗粒的用于治疗关节炎的药学组合物以及预防或治疗关节炎的方法。
根据本发明的优选一实施例,上述关节炎可以为选自由骨关节炎、类风湿性关节炎、银屑病关节炎、败血性关节炎、可分离性骨软骨炎,关节韧带损伤及半月板损伤组成的组中的一种以上。
根据本发明的优选一实施例,上述药学组合物可以为可注射形式。
根据本发明的优选一实施例,上述药学组合物还可包含透明质酸(hyaluronicacid)。
根据本发明的优选一实施例,可利用注射器将上述软骨细胞颗粒给药于患者。
除非另有定义,否则本说明书中使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的含义相同的含义。通常,本说明书中使用的命名法是本技术领域公知且通常使用的命名法。
为了制备软骨细胞作为治疗关节炎的细胞治疗剂,则需要能够制备可反复重现且均匀化的软骨性组织的技术,并且为了用于大面积部位损伤,则需要可制备大量软骨性组织的大规模培养系统。由此,开发出可从干细胞人工培养和移植软骨细胞的技术。
干细胞可根据分化能力和生成时期大致分为胚胎干细胞(embryonic stem cell)和成体干细胞(adult stem cell)。成体干细胞可以从骨髓、血液、脑、皮肤等获得,因此道德问题较少,但相对于胚胎干细胞,其分化能力有限。
成体干细胞可分为多能或单能干细胞。代表性的成体干细胞包括间充质干细胞(mesenchymal stem cell,MSC)和造血母细胞(hematopoietic stem cell)。已知间充质干细胞分化为软骨细胞(chondrocyte)、成骨细胞(osteoblast)、脂肪细胞(adipocyte)、心机细胞(myocyte)及神经细胞(neuron),造血母细胞主要分化为血液中的血细胞,例如红血胞、白细胞、血小板等。
间充质干细胞是指通过分裂受精卵而从中胚层分化而来的干细胞,由于其存在于软骨、骨组织、脂肪组织、骨髓等,因而具有相对容易获得的优点,从而已被广泛用作类风湿性关节炎、骨关节炎等的细胞治疗用组合物。但是其存在如下缺点:分化速度低且表型不稳定,因此在分化过程中很可能发生不必要的分化或变形,并且需要从患者身上提取大量。并且,据报道,间充质干细胞在体外经过3至4天后丧失固有特性,并且间充质干细胞的生产及分化能力根据患者的年龄或疾病状态而变化。并且,还存在如下问题:植入体内后,由于与纤维化软骨(fibrotic cartilage)及细胞肥大性(hypertrophic)有关的基因表达,导致细胞凋亡和因血管渗透而导致软骨细胞的钙化。因此,需要一种用于体外培养软骨细胞的新的细胞来源。由此,本发明选择了人诱导多能干细胞(human induced pluripotent stemcell,hiPSC)作为新的细胞来源,并且确认到其软骨再生效果比间充质干细胞优异(图7c)。
人诱导多能干细胞是指能够分化为构成生物的所有3个胚层(germ layer)并因此分化为人体所有细胞或器官组织的多功能干细胞,制备其的目的在于解决人类胚胎干细胞所具有的诸多道德问题。由于人诱导多能干细胞具有以维持未分化性和正常核型的状态自我再生的能力,因而被判断为适合作为用于细胞治疗剂的大规模生产的细胞来源。
从人诱导多能干细胞制备软骨细胞的各种技术正在开发中,并且开发了提高分化为软骨细胞的效率的技术,其包括对人诱导多能干细胞进行贴壁培养来诱导间充质细胞的工序(韩国公开专利10-2016-0068982)。但是,利用软骨细胞分化因子(chondrogenicfactor)处理间充质细胞并进行粘附及悬浮培养的期间至少为39天,为了获得完全分化的软骨细胞,额外需要28天以上的悬浮培养期,因而从人诱导多能干细胞制备软骨细胞则需要长时间。为此,本发明人从人诱导多能干细胞形成拟胚体(embryoid body,EB),从中诱导类似于间充质的生长细胞(outgrowth cell,OG)之后,将其分化为软骨细胞。在本发明中,在软骨分化培养基(chondrogenic differentiation medium)中培养生长细胞来获得完全分化的软骨细胞所需的期间为30天,这比上述现有技术明显缩短。
用于维持及增值未分化状态的人诱导多能干细胞的培养技术非常繁琐,并且存在将人诱导多能干细胞完全分化为特定细胞需要相当长时间的缺点,因而其是开发包括分化诱导技术在内的相关技术过程中最大障碍因素之一。在当前水平下,利用人诱导多能干细胞的普遍分化诱导技术中,大多数利用通过制备拟胚体的分化诱导方法。即,为了在试管内(in vitro)进行人诱导多能干细胞的细胞-特异性分化培养,需要首先解决使细胞自发凝集成称为拟胚体的球状的步骤,拟胚体在诱导谱系特异性分化中用作普通且重要的介质。
颗粒(pellet)培养是一种通过对较少数量的细胞进行离心分离来形成细胞凝集,从而从三维培养开始阶段就人工制备细胞的超高密度培养系统的方法。颗粒形成过程简单且易于重现,具有软成骨能力的细胞在该系统下合成并分泌软骨性细胞外基质(extracellular matrix)来制备软骨性组织。
已经开发了从人诱导多能干细胞形成拟胚体,并将其培养为颗粒来分化为软骨细胞的技术,但在该技术中,由于出现软骨细胞颗粒的松散现象,因而在培养为颗粒来分化为软骨细胞的步骤中,藻酸盐凝胶(alginate gel)被用作支架(scaffold)。因此,为了比较拟胚体单细胞(EB Single cell)与拟胚体衍生的生长细胞的软骨细胞颗粒形成能力,本发明人对在分解拟胚体来将构成拟胚体的单细胞培养成颗粒状的情况和将拟胚体衍生的生长细胞培养成颗粒状的情况下形成的软骨细胞颗粒的数量进行了比较。结果,构成拟胚体的单细胞几乎未生成软骨细胞颗粒,而在将拟胚体衍生的生长细胞培养成颗粒状的情况下,软骨细胞颗粒形成率为100%(图10)。由此,确认到从拟胚体诱导生长细胞来制备软骨细胞颗粒是有效的。
已开发出一种从人诱导多能干细胞形成拟胚体衍生的生长细胞(EB-derivedoutgrowth cell),将其分化为软骨细胞注射到关节炎大鼠模型来确认到具有治疗效果的技术。这是将拟胚体衍生的生长细胞直接分化为软骨细胞而无需以颗粒状进行培养的技术,因此,本发明人对在将拟胚体衍生的生长细胞培养成颗粒状来分化为软骨细胞的情况和对拟胚体衍生的生长细胞进行单层培养(monolayer culture)来分化为软骨细胞的情况下的软骨细胞分化率进行了比较。结果,在进行颗粒培养的软骨细胞中,COL2A1(胶原II型基因(collagen type II gene))的表达高,上述COL2A1为对构成软骨的细胞外基质(extracellular matrix)的主要蛋白进行编码的基因,由此确认到在进行颗粒培养的情况下,向软骨细胞的分化率更高(图9)。
已开发出一种从人诱导多能干细胞形成拟胚体衍生的生长细胞(EB-derivedoutgrowth cell),将其单层培养之后,进行颗粒培养来分化为软成骨谱系(chondrogeniclineage)的技术。其中公开了单层培养步骤是提高向软骨细胞的分化效率的重要步骤,在通过上述技术获得的软骨细胞中未检测到II型胶原蛋白,由于聚集蛋白聚糖(aggrecan)蛋白的表达弱,因而不能获得完全分化(not fully mature)的软骨细胞。为了解决这种问题,在本发明中,使用含有人骨形态发生蛋白2(human bone morphogenetic protein2,BMP-2)的软骨分化培养基直接进行颗粒培养,而没有生长细胞的单层培养步骤,结果,确认到可以获得II型胶原蛋白和聚集蛋白聚糖蛋白的表达高的完全分化的软骨细胞(图4)。
已公开一种当从人诱导多能干细胞形成拟胚体衍生的生长细胞并在含有人骨形态发生蛋白2(human bone morphogenetic protein2,BMP-2)的培养基中培养时,向软骨细胞的分化效率高的技术。但是在上述现有技术中,已经确认到不仅分化为软骨细胞而且分化为非软骨细胞,以及每种软骨细胞的分化程度存在多样性的结果,但是在本发明中,确认到含有从人诱导多能干细胞向软骨细胞的分化率为95%以上,每个大小均匀且分化程度均质的软骨细胞的软骨细胞颗粒。
由于关节炎引起的软骨损伤的形状和深度不是恒定的,因此如果实验室制备的三维结构的人工软骨大于损伤部位,则需要根据损伤的形状修剪移植物,反之,如果软骨移植物小于损伤部位,则需要通过根据损伤形状将其像马赛克一样填充的方法进行移植。以这种方式移植当前开发的组织工程软骨产品,但无法调节损伤的厚度,如果在关节软骨中移植物比周围软骨突出或凹陷,则由于异常的体重负载,会对移植物或周围正常软骨造成额外损伤。因此,在将软骨细胞培养成颗粒并制成可注射形式的情况下,通过将多个软骨细胞颗粒给药于损伤部位来无论软骨损伤部位的形状及厚度如何,均可以适用。不仅如此,由于其为可注射形式,因此不需要切开软骨损伤部位。由于无需手术,因而不需要另外的恢复期间,不仅可通过简单的治疗缓解患者的疼痛,而且在治疗后表现出持续有效的治疗效果。由此,本发明人制备出可注射形式的软骨细胞颗粒。
为了以非侵入性方法向患者适用软骨细胞而不切开软骨损伤部位以治疗关节炎,需要大小小于临床上可用的注射(syringe)针的内部直径且均匀的软骨细胞颗粒。
在本发明中,可用于给药软骨细胞颗粒的注射针的尺寸可用为10~33号,更优选为15~25号,最优选为17~20号。通常,人类临床上广泛使用的注射针的尺寸为18号,其内部直径为573μm。因此,为了充分地含有软骨细胞且易于通过注射针排出,需要500μm以下大小的软骨细胞颗粒。
在本发明人制备的软骨细胞颗粒的情况下,由从人诱导多能干细胞获得的200个拟胚体衍生的生长细胞组成的颗粒的直径为152μm,由500个组成的颗粒的直径为182μm,由1000个组成的颗粒的直径为226μm,由2000个组成的颗粒的直径为278μm,由3000个组成的颗粒的直径为334μm,由5000个组成的颗粒的直径为462μm。这意味着本发明的软骨细胞颗粒可用用作使用注射器给药的关节炎治疗用组合物。
当本发明人以颗粒状培养从人诱导多能干细胞获得的拟胚体衍生的生长细胞时,由于在少于200个单细胞单位的生长细胞中不能很好地进行细胞的凝集,因此难以以颗粒状培养。因此,本发明的软骨细胞颗粒可含有200个至5000个生长细胞。
本发明人测量了含有软骨细胞的颗粒的软骨再生效果,上述软骨细胞由通过从人诱导多能干细胞获得的拟胚体的贴壁培养诱导的生长细胞中分化而来。在兔的手术诱导骨关节炎模型中,当给药由2000个生长细胞组成的软骨细胞颗粒的结果,受损的软骨与正常组织类似地得到了修复。由此,确认到本发明的软骨细胞颗粒的软骨再生效果优异(图11及图12),从而完成了本发明。
因此,一方面,本发明涉及软骨细胞颗粒的制备方法,其包括:步骤(a),通过培养人诱导多能干细胞(human induced pluripotent stem cell)来形成并获得拟胚体(embryoid body);步骤(b),诱导上述步骤(a)中获得的拟胚体成为生长细胞(outgrowthcell)并分离;以及步骤(c),以颗粒(pellet)状培养上述步骤(b)中分离的生长细胞。
在本发明中,术语“人诱导多能干细胞(human induced pluripotent stem cell,hiPSC)”是指分化能力水平与胚胎干细胞类似的干细胞,其利用逆向分化技术在人类的体细胞建立具有与胚胎干细胞(embryonic stem cell)类似的分化能力的未分化状态的干细胞。逆向分化技术的代表性方法包括细胞融合法(fusion with ES cell)、体细胞核转移法(somatic cell nuclear transfer)、通过基因因子重编程法(reprogramming by genefactor)等。
在本发明中,术语“拟胚体(embryoid body,EB)”是指在悬浮培养状态下生成的球体状干细胞来源的细胞团,并且具有潜在地分化为内胚层、中胚层、外胚层的能力,从而在用于确保组织-特异性分化细胞的大多数分化诱导过程中用作前体。
在本发明中,术语“生长细胞(outgrowth cell,OG)”是指为了增加细胞的贴壁性而涂有细胞外基质成分的培养板中贴壁培养拟胚体时从拟胚体延伸的细胞。
在本发明中,术语“颗粒(pellet)”是指通过离心分离细胞来实现细胞凝集并将其进行三维培养来形成的拟胚体衍生的生长细胞团。
在本发明中,术语“软骨”包括但不限于透明软骨(hyaline cartilage)、纤维化软骨(fibrotic cartilage)或弹性软骨(elastic cartilage)。无限制地包括关节软骨(articular Cartilage)、耳软骨、鼻软骨、肘关节软骨、半月板(meniscus)、膝关节软骨、肋软骨、踝关节软骨、气管软骨、喉软骨及椎椎软骨等软骨部位。
本发明的上述人诱导多能干细胞可源自各种细胞,但优选地,可以源自脐带血单核细胞(cord blood mononuclear cell,CBMC)。
根据本发明的具体实施例,在从脐带血单核细胞来源的人诱导多能干细胞生成的软骨细胞颗粒和从外周血单核细胞(peripheral blood mononuclear cell,PBMC)来源的人诱导多能干细胞生成的软骨细胞颗粒中比较了聚集蛋白聚糖基因(aggrecan gene,ACAN)及II型胶原蛋白基因(collagen type II gene,COL2A1)的表达水平,结果,确认到从脐带血单核细胞来源的人诱导多能干细胞生成的软骨细胞颗粒的表达水平显著高。由此可见,当从CBMC-hiPSC制备软骨细胞颗粒时,软骨细胞分化率增加(图8)。
根据本发明的具体实施例,在上述生长细胞在软骨分化培养基中以颗粒状培养的情况下,确认到对构成软骨的细胞外基质(extracellular matrix,ECM)的主要蛋白进行编码的基因COL2A1、ACAN及COMP(软骨寡聚基质蛋白基因,cartilage oligomeric matrixprotein gene)以及对调节其表达的转录因子进行编码的基因SOX9(sex-determiningregion Ybox 9gene)的表达增加(图4)。聚集蛋白聚糖(ACAN)是凝集在软骨的细胞外基质的蛋白聚糖(proteoglycan),其诱导与透明质酸(hyaluronan)的相互作用。II型胶原蛋白作为用于透明软骨的基础蛋白,表现出健康软骨的特征。
并且,根据本发明的具体实施例,在软骨细胞颗粒中,确认到纤维化软骨(fibrotic cartilage)的代表性基因COL1A1(I型胶原基因(collagen type I gene))和肥大性标志物(hypertrophic marker)COL10A1的表达水平低,COL2A1相对于COL1A1的表达率增加(图7)。纤维或肥大性软骨是具有分化为骨骼倾向的更成熟的类型。这表明,相对于表示纤维化软骨的基因,本发明的软骨细胞颗粒具有较高的表示透明软骨的基因表达,从而可知本发明的软骨细胞具有透明软骨的主要特性。
在本发明中,上述步骤(a)的培养可以是贴壁培养。为了在离体环境中进行培养,需要诸如培养板等表面,上述培养板涂有用于增加细胞的贴壁性的细胞外基质成分。
在本发明中,上述步骤(b)的诱导可在明胶(gelatin)包被板进行。
在本发明中,上述步骤(c)的特征在于,可对分离的生长细胞进行离心分离来以颗粒状培养,并且可通过离心分离的步骤凝集生长细胞来易于以颗粒状培养。
优选地,上述进一步的离心分离能够以1100~2500rpm进行,更优选以1300~2300rpm进行,最优选以1600~2000rpm进行。
在本发明中,在上述步骤(c)中,分离的生长细胞的95%~100%可形成为软骨细胞颗粒,更优选地,96%~100%可形成为软骨细胞颗粒,最优选地,97%~100%可形成为软骨细胞颗粒。软骨细胞颗粒所含有的生长细胞的特征在于,大小均匀,生长细胞之间均质,几乎没有分化程度差异。
在本发明中,在上述步骤(a)中,拟胚体形成步骤的特征在于,可在含有成纤维细胞生长因子2(fibroblast growth factor2,FGF-2)的培养基中培养。
成纤维细胞生长因子是通过刺激成纤维细胞来诱导强增殖性的生长因子,共有23种。其中,FGF-2广泛分布于脑垂体、脑、肾、肾上腺、胎盘、骨基质、软骨、内皮细胞、成纤维细胞等,并以同种型(isotype)存在多种。在脊椎动物中,发现了分子量分别为18、22、225、24及34kDa的5种同种型。在细胞外仅检测到18kDa形式,而其他同种型则局限于细胞内部,更具体为核内。FGF-2为在生理水平上起着非常重要作用的肽,其参与胎儿发育、血管生成、神经元分化及组织恢复。
在本发明中,上述步骤(a)的拟胚体可以在包含成纤维细胞生长因子2(FGF-2)或转化生长因子β1(TGF-β1)的培养基中在35℃至39℃下将人诱导多能干细胞培养4天至8来形成,优选地,在含有两种成分的培养基中在37℃下培养6天。
根据本发明的具体实施例,上述步骤(a)的培养基是在包含543μl/ml的碳酸氢钠(NaHCO
根据本发明的具体实施例,在对拟胚体和拟胚体衍生的生长细胞的颗粒形成能力进行了比较,结果,在通过分解拟胚体来利用拟胚体单细胞(EB Single cell)制成颗粒的情况下,未发生细胞凝集,因而几乎未生成软骨细胞颗粒,在将拟胚体衍生的生长细胞以颗粒状培养的情况下,确认到软骨细胞颗粒形成率为98%(图10)。由此可见,与以颗粒状培养拟胚体的情况相比,以颗粒状培养拟胚体衍生的生长细胞在细胞凝集方面更为有效。
在本发明中,在上述步骤(b)中,将拟胚体在含有20%胎牛血清(Fetal BovineSerum,FBS)或10%青霉素(penicillin)/链霉素(streptomycin)的培养基中培养6天至8天,优选在包含两种成分的培养基中培养7天。
本发明的特征在于,上述步骤(c)的培养可在包含人骨形态发生蛋白(BMP,humanbone morphogenetic protein)及TGF-β(转化生长因子-β,transforming growth factor-beta)的无血清培养基中进行。
人骨形态发生蛋白(BMP,human bone morphogenetic protein)是诱导成骨(osteogenesis)的蛋白因子,存在BMP-1至BMP-9的9种类型。除BMP-1之外,BMP-2至BMP-9属于转化生长因子β(TGF-β)的超家族。本发明的上述人骨形态发生蛋白可以是BMP-1至BMP-9,优选为BMP-2。
TGF-β(转化生长因子-β,transforming growth factor-beta)是通过转化正常细胞来促进增殖的生长因子,其在细胞生长、分化及细胞外基质蛋白合成中起到调节作用。本发明的TGF-β可以是TGF-β1至TGF-β3,优选为TGF-β3。
在本发明中,在上述步骤(c)中,将生长细胞在包含人成骨蛋白(human bonemorphogenetic protein2,BMP-2)、转化生长因子β3(TGF-β3)或血清替代物(knockoutserum replacement)的软骨细胞分化培养基中培养25天至35天,优选地,在含有三种成分的培养基中培养30天。
根据本发明的具体实施例,上述软骨分化培养基是在包含20%血清替代物(knockout serum replacement)、1×非必需氨基酸(1x non-essential amino acids)、1mM的L-谷氨酰胺(L-glutamine)、1%丙酮酸钠(sodium pyruvate)、1%ITS+预混物(Premix)、10-7M地塞米松(dexamethasone)、50μm抗坏血酸(ascorbic acid)及40μg/ml的L-脯氨酸(L-proline)的DMEM培养基中添加50ng/ml的人骨形态发生蛋白2(human bonemorphogenetic protein2,BMP-2)及10ng/ml的转化生长因子β3(TGF-β3)而成,软骨细分化培养基在30天内每天进行更换。
在本发明中,上述软骨细胞颗粒的直径优选为100~500μm,更优选为160~400μm,最优选为200~300μm。
本发明的软骨细胞颗粒可含有200个至5000个生长细胞,更优选地,可含有800个至3500个生长细胞,最优选地,可含有1500个至2500个生长细胞。
根据本发明的具体实施例,对将从人诱导多能干细胞形成的拟胚体衍生的生长细胞在软骨分化培养基中单层(monolayer)培养或以颗粒状培养来生成的软骨细胞的COL2A1的表达水平进行了比较,结果,确认到以颗粒状培养时COL2A1的表达更高(图9)。由此可知,当对生长细胞进行颗粒培养时,向软骨细胞的分化率增加。
本发明还可提供包含通过上述方法制备的软骨细胞颗粒的用于治疗关节炎的药学组合物。
在本发明中,术语“关节炎”是指软骨、软骨组织和/或关节组织(滑膜、关节囊、软骨下骨等)由于机械刺激或炎症反应而受伤的软骨的缺陷、损伤、缺失引起的慢性炎症。这种关节炎包括骨关节炎(osteoarthritis),其为由衰老引起的退化性关节疾病(degenerative joint disease);作为自身免疫疾病的类风湿性关节炎(rheumatoidarthritis)和银屑病关节炎(psoriatic arthritis);由感染引起的败血性关节炎(septicarthritis)、可分离性骨软骨炎、关节韧带损伤、半月板损伤等,但不限于此。
在本发明中,术语“治疗”是指(a)抑制疾病、病患或症状的发展;(b)减轻疾病、病患或症状;或(c)消除疾病、病患或症状。
本发明的药学组合物是在移植到软骨缺陷或损伤部分时通过发挥软骨再生能力来表现出对软骨损伤的改善及治疗效果的组合物,其本身可以成为用于治疗关节炎的药学组合物,或者可以与其他药理成分一同给药来用作关节炎的治疗助剂。
因此,在本说明书中,术语“治疗”或“治疗剂”包括“辅助治疗”或“治疗助剂”的含义。
本发明的用于治疗关节炎的药学组合物包括药学上可接受的载体。本发明的药学组合物中包含的药学上可接受的载体通常用于制剂中,乳糖(lactose)、葡萄糖(dextrose)、蔗糖(sucrose)、山梨糖醇(sorbitol)、甘露醇(mannitol)、淀粉、阿拉伯胶、磷酸钙(calcium phosphate)、藻酸盐(alginate)、明胶、硅酸钙(calcium silicate)、微晶纤维素(Microcrystalline Cellulose)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone)、纤维素、水、糖浆、甲基纤维素(methyl cellulose)、羟基苯甲酸甲酯(methylhydroxybenzoate)、羟基苯甲酸丙酯(propylhydroxybenzoate)、滑石粉(talc)、硬脂酸镁(Magnesium Stearate)、矿物油、盐水、磷酸盐缓冲盐水(PBS,phosphate bufferedsaline)或培养基等,但不限于此,除上述成分之外,还可包含润滑剂、湿润剂、甜味剂、调味剂、乳化剂、悬浮剂、防腐剂等。
可根据本发明所属技术领域的普通技术人员可易于实施的方法,利用药学上可接受的载体和/或赋形剂对本发明的用于治疗关节炎的药学组合物剂型化,从而制成单位容量形式或通过将其放置在大容量容器中来制备。
用于胃肠外给药的制剂包括灭菌水溶液、非水溶剂、悬浮剂,乳剂、冻干制剂、栓剂。作为栓剂的基质,可以使用维比索尔(witepsol)、聚乙二醇(Macrogol)、吐温(tween)61、可可脂、月桂酸(laurinum)、甘油明胶等。
在本发明中,上述药学组合物的特征可以是可注射形式。上述可注射形式是指可利用注射器将本发明的软骨细胞颗粒给药于需要软骨再生的部位而无需外科手术的形式,更具体地,其大小足够小,以能够通过注射针。
在本发明中,上述用于治疗关节炎的药学组合物的特征可以是,还包含透明质酸(hyaluronic acid)。
根据本发明的具体实施例,当在上述软骨细胞颗粒中添加透明质酸给药于软骨损伤部位时,确认到具有软骨再生效果(图12)。
本发明还可提供包括将通过上述方法制备的软骨细胞颗粒给药于关节炎患者的步骤的预防或治疗关节炎的方法。
能够将上述软骨细胞颗粒以治疗有效量给药于患者,在本发明中,术语“治疗有效量”是指足以以合理的受益/风险比适用于医学治疗的量,根据制剂化方法、给药方式、患者的年龄、体重,性别、病理状态、食物、给药时间、给药途径、排泄速度及反应灵敏性等因素,最佳给药量具有多种范围,本发明所属技术领域的普通技术人员可考虑上述事项来确定上述范围。上述患者优选为包括人类在内的哺乳动物,并且可以不受限制地包括正患有、以前患有或可能患有关节的潜在的关节炎患者组。
上述给药优选为利用注射器的胃肠外给药,可通过医药领域常用的途径给药,例如,可通过静脉内、腹膜内、肌内、动脉内、口服、心脏内、骨髓内、鞘内、透皮、肠、皮下、舌下或局部途径给药,最优选为通过关节内(intra-articular)给药。
发明的效果
本发明的从人诱导多能干细胞(human induced pluripotent stem cell)来源的软骨细胞颗粒(pellet)向软骨细胞的分化率显著高,大小均匀,分化程度均质,在将包含其的用于治疗关节炎的药学组合物给药于软骨损伤部位的情况下,其具有优异的软骨再生效果,且为无需手术的可注射形式,因此不仅可以通过简单的治疗缓解患者的疼痛,而且在治疗之后也可提供持续的关节炎治疗效果。
附图说明
图1为示出利用本发明的诱导多能干细胞制备其大小能够通过注射器(syringe)的3D软骨细胞簇(cluster)的过程的示意图。
图2中按左侧到右侧的顺序示出CBMC来源hiPSC的图像、形成的拟胚体(embryoidbody)的图像、从附着于明胶包被的培养板的拟胚体衍生的生长细胞(outgrowth cell)的图像及制备的软骨细胞颗粒的图像。
图3示出由微孔中生成的1000个、2000个及3000个生长细胞制成的颗粒、在软骨分化培养基(chondrogenic differentiation medium)中培养的软骨细胞颗粒及利用甲苯胺蓝(toluidine blue)对其进行染色的图像。
图4示出从根据本发明的CBMC-hiPSC生成的软骨细胞颗粒的遗传特性,其为示出在软骨分化培养基(Chondrogenic differentiation medium)中培养后的第10天、第20天及第30天在软骨细胞颗粒中测量COL2A1(collagen type II gene)、ACAN(aggrecangene)、COMP(cartilage oligomeric matrix protein gene)及SOX9(sex-determiningregion Y-box 9gene)的表达水平的结果的图(*,+p<005,**,++p<001,***,+++p<0001)。
图5示出从根据本发明的CBMC-hiPSC生成的软骨细胞颗粒的组织学分析结果,其示出在软骨分化培养基中培养后的第10天、第20天及第30天利用番红O(safranin O)、阿尔辛蓝(alcian blue)及甲苯胺蓝(toluidine blue)染色的颗粒的图像。
图6示出从根据本发明的CBMC-hiPS生成的软骨细胞颗粒的免疫组织学分析结果,(a)部分示出在软骨分化培养基中培养后的第10天、第20天及第30天利用II型胶原蛋白及聚集蛋白聚糖(aggrecan)的抗体染色的软骨细胞颗粒的图像,(b)部分示出利用I型胶原蛋白的抗体染色的软骨细胞颗粒的图像。
图7示出从根据本发明的CBMC-hiPSC或间充质干细胞(mesenchymal stem cell,MSC)生成的软骨细胞颗粒的遗传标志物的进一步分析结果,(a)部分示出在hiPSC和软骨分化培养基中培养后的第10天、第20天及第30天在软骨细胞颗粒中测量纤维化软骨(fibrotic cartilage)的代表性基因COL1A1(collagen type I gene)和肥大性标志物(hypertrophic marker)COL10A1的表达水平的结果,(b)部分示出在软骨分化培养基中培养后的第10天、第20天及第30天在软骨细胞颗粒中测量COL2A1和COL1A1的表达率的结果,(c)部分示出在软骨分化培养基中培养后的第30天在从MSC或CBMC来源hiPSC生成的软骨细胞颗粒中测量并比较ACAN、COMP、COL2A1、SOX9、COL1A1及COL10A1的相对表达水平的结果(*,+p<005,**,++p<001,***,+++p<0001)。
图8示出在利用各种细胞株来源(DF源自皮肤成纤维细胞、PBMC源自外周血单核、FLS源自骨关节炎成纤维细胞样细胞、CBMC源自脐带血单核细胞)的hiPSC制备的软骨颗粒中确认早期软骨形成标志物(Early Chondrogenic Marker)、软骨基质标志物(CartilageMatrix Marker)及肥大性或纤维化软骨标志物(Hypertrophy and Fibrotic Marker)的表达的结果。SOX9、SOX5及SOX6被确认为早期软骨形成标志物,ACAN、COL2A1及PRG4被确认为软骨基质标志物,COL1A1、COL10A1及RUNX2被确认为肥大性或纤维化软骨标志物。
图9示出按在软骨分化培养基中将根据本发明的拟胚体衍生的生长细胞(EB-derived outgrowth cell)单层(Monolayer)培养来生成的软骨细胞和以颗粒状培养来生成的软骨细胞(Macropellet)的数量(1×10^5、3×10^5及5×10^5)测量并比较SOX9、ACAN、COL2A1、COL1A1及COL10A1的表达水平的结果。
图10示出比较根据本发明的拟胚体单细胞(EB Single cell)和拟胚体衍生的生长细胞(EB-derived outgrowth cell)的软骨细胞颗粒形成能力的结果。其示出在软骨分化培养基中以颗粒状培养通过分解拟胚体来构成拟胚体的单细胞的情况和以颗粒状培养拟胚体衍生的生长细胞的情况下形成的软骨细胞颗粒的图像及形成的软骨细胞颗粒的比例。
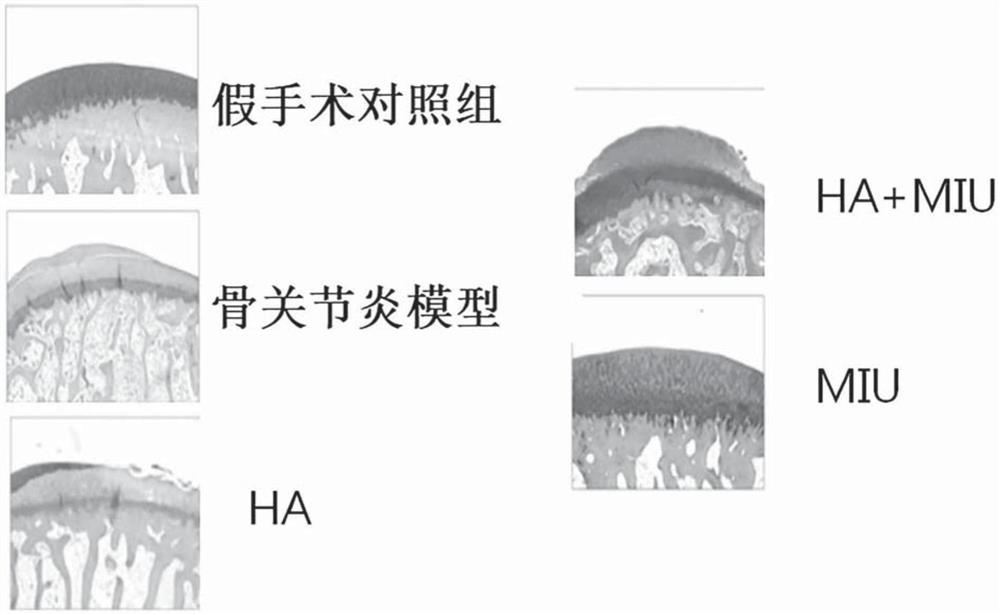
图11示出作为骨关节炎模型制备前交叉韧带横断(anterior cruciate ligamenttransection;ACLT)兔模型,并且通过注射方法分别向上述兔的关节腔内给药软骨细胞颗粒(MIU)和/或透明质酸(HA)的结果。
图12示出从根据本发明的CBMC-hiPS生成的软骨细胞颗粒的软骨再生效果,其示出在向软骨损伤模型注射含有2000个生长细胞的软骨细胞颗粒MIU(Minimal injectableunit)和/或透明质酸(hyaluronic acid,HA)的4周后,通过ICRS评分(ICRS score)方法评估软骨状态的结果(Destruction score)及其评估过程。
具体实施方式
实施例1
人诱导多能干细胞的制备
由脐带血单核细胞(cord blood mononuclear cell,CBMC)制备了人诱导多能干细胞(human induced pluripotent stem cell,hiPSC)。使用了从韩国首尔圣玛丽医院的脐带血库获得的CBMC。将脐带血用磷酸缓冲盐水(phosphate buffered saline,PBS)稀释,并通过Ficoll密度梯度(Ficoll gradient)以850xg离心分离30分钟来收集CBMC之后,洗涤及冷冻并保存直至使用。在使用之前将CBMC解冻之后,重悬于已添加CC110细胞因子鸡尾酒(Cytokine cocktail;STEMCELL)的StemSpan培养基(STEMCELL Technological,Vancouver,British Columbia,Canada)中,并在37℃的5%CO
将培养的CBMC以3×10
将获得的hiPSC在玻连蛋白(vitronectin)包被的容器(Thermo FisherScientific,Waltham,MA,USA)中培养,作为培养基使用TeSR-E8培养基(STEMCELLTechnologies)来以每天一次的周期进行替换来培养了hiPSC。
实施例2
从hiPSC形成拟胚体
将在上述实施例1中制备的CBMC来源的hiPSC重悬于Aggrewell培养基(STEMCELL)中,以2×10
实施例3
从拟胚体形成及分离生长细胞
将上述实施例2中形成并获得的拟胚体(embryoid body,EB)悬浮在含有20%胎牛血清(Fetal Bovine Serum)及10%青霉素/链霉素的DMEM培养基(Thermo FisherScientific)中,在明胶(gelatin)包被的板上在37℃下用5%CO
将形成的OG细胞从明胶包被板上分离,并使其通过40μm大小的细胞过滤网(cellstrainer;Thermo Fisher Scientific)来去除拟胚体团(EB clump),从而仅分离及获得了单细胞单位的OG细胞。
实施例4
从生长细胞制备软骨细胞颗粒以及向软骨细胞的分化
通过对在上述实施例3中分离及获得的单细胞单位的生长细胞(outgrowth cell,OG)进行计数,并以使每个颗粒形成为1×10
然后,将上述制备的软骨细胞颗粒接种到软骨分化培养基(Chondrogenicdifferentiation medium)中,并每天用新的培养基替换一次,同时在37℃下共培养30天来获得了最终分化的软骨细胞。作为上述软骨分化培养基,使用了添加有50ng/ml的人骨形态发生蛋白2(human bone morphogenetic protein2,BMP2)及10ng/ml的转化生长因子β3(human transforming growth factor beta 3,TGF-β3)的DMEM培养基(20%血清替代物(knockout serum replacement)、1×非必需氨基酸(1×non-essential amino acids)、1mM L-谷氨酰胺(L-glutamine)、1%丙酮酸钠(sodium pyruvate)、1%ITS+预混物(Premix)、10
实施例5
软骨细胞颗粒的遗传特性的分析
为了分析上述实施例4中获得的软骨细胞颗粒的遗传特性,在软骨细胞颗粒中分析了10天、20天及30天内的COL2A1(collagen type II gene)、ACAN(aggrecan gene)、COMP(cartilage oligomeric matrix protein gene)及SOX9(sex-determining region Y-box9gene)的表达水平,这些为编码构成软骨的细胞外基质(extracellular matrix)的主要蛋白的基因。
结果,如图4所示,确认到与hiPSC相比,本发明的软骨细胞颗粒中ACAN、COL2A1及COMP的表达显著增加。由此,确认到根据本发明制备的软骨细胞颗粒合成软骨的ECM成分并表现出类似软骨的特征。
实施例6
软骨细胞颗粒的组织学分析
为了上述实施例4中获得的软骨细胞颗粒的组织学分析,使用4%的多聚甲醛(paraformaldehyde)在室温下固定了2小时。一层纱布放在盒子(cassette)上,并将软骨细胞颗粒移动到纱布上。依次用乙醇溶液进行了脱水。用分级的(graded)乙醇和二甲苯(zylene)混合物(Duksan Pure Chemicals,安山,韩国)去除脱水溶液,并使石蜡(paraffin)渗透过夜。第二天,将软骨细胞颗粒固定在石蜡块上,并使用切片机(microtome)获得了7μm的切片。将载玻片在60℃下干燥10分钟。用2个循环的二甲苯将切片脱蜡。将切片用依次减少的乙醇系列(series)重新水化(rehydrate)并用流动的自来水将切片冲洗5分钟。
为了在软骨中检测细胞外基质(extracellular matrix,ECM),阿尔辛蓝(alcianblue)染色将切片在1%阿尔辛蓝溶液中培养30分钟。之后,洗涤载玻片并用核固红(nuclear fast red)复染1分钟。番红O(Safranin O)染色将切片在魏格特氏铁苏木精(weigert's iron hematoxylin)中的载玻片上培养10分钟。洗涤载玻片并在01%番红溶液中培养5分钟。甲苯胺(toluidine)染色将切片在甲苯胺蓝溶液中培养4分钟。
在染色工序之后,将切片洗涤并使其通过依次递增的乙醇系列。用2个循环的二甲苯去除乙醇并使用永久性免疫组化封片剂(VectaMount
作为阳性对照组,使用了与实施例2至实施例4相同的方法由骨髓来源间充质干细胞(bone marrow-derived mesenchymal stem cell,BMSC)制备的软骨细胞颗粒。
结果,如图5所示,分化初始步骤(第10天)中在软骨细胞颗粒的内侧部分确认到ECM的聚集。骨腔(Lacunae)是关节软骨的主要特征之一。10天后出现了空的骨腔样空缺(capacity)。但是随着向软骨细胞的分化,大小反而减少。在分化的第30天,随着ECM聚集在空缺中,其类似于关节软骨(articular cartilage)中的骨腔。
实施例7
软骨细胞颗粒的免疫组织学分析
为了对上述实施例4中获得的软骨细胞颗粒进行免疫组织学分析,将通过与上述实施例6相同的方法获得的切片在60℃下干燥2小时,并用2个循环的二甲苯脱蜡。将切片用依次递减的乙醇系列(series)重新水化(rehydrate),并用流动的自来水冲洗5分钟。
通过在沸腾的柠檬酸盐(citrate)缓冲液(Sigma-Aldrich)中培养15分钟之后冷却20分钟来诱导抗原暴露(unmasking)。然后将冷却的切片用去离子水(DW)洗涤两次。通过将切片在用DW稀释的3%过氧化氢(Sigma-Aldrich)中培养10分钟来封闭内源性过氧化物酶(peroxidase)的活性。在将切片用DW洗涤两次之后,用含0.1%吐温-20的三羟甲基氨基甲烷-缓冲盐水(tris-buffered saline,TBS;TBST)来进一步洗涤。在室温下用含有1%牛血清白蛋白(bovine serum albumin;Sigma-Aldrich,St Louis,MO,USA)的TBS将切片封闭20分钟。
将用封闭溶液稀释的第一抗体添加到切片中,并在4℃下培养过夜。第一抗体按以下比例稀释:I型胶原蛋白(collagen type I)(1/100;Abcam)、II型胶原蛋白(collagentype II,1/100;Abcam)及聚集蛋白聚糖(1/100;GeneTex,Irvine,CA,USA)。阴性对照组载玻片用无抗体的相同量的封闭溶液处理。第二天,将切片在TBST中洗涤3次,每次3分钟,并在室温下适用第二次抗体(1/200;Vector Laboratories)40分钟。用TBST洗涤切片,并在ABC试剂(Vector Laboratories)中培养30分钟。将载玻片用TBST洗涤3次,并适用DAB溶液(Vector Laboratories)1分钟。用DW洗涤切片,直到颜色被洗掉。将梅耶苏木精(Mayer'shematoxylin)适用于切片1分钟以进行复染。洗涤切片并使其通过依次递增的乙醇系列。用2个循环的二甲苯去除乙醇并使用永久性免疫组化封片剂(VectaMount
软骨的质量取决于ECM蛋白的主要类型。因此,确认特定蛋白很重要。众所周知,聚集蛋白聚糖及II型胶原蛋白是组成ECM的主要成分。II型胶原蛋白是表示透明软骨(hyaline cartilage)的主要胶原蛋白类型。
结果,如图6所示,确认到II型胶原蛋白的染色强度在CBMC-hiPSC来源软骨细胞颗粒中高于在BMSC对照组中。与染色结果相对应,在第30天,在软骨细胞颗粒的内侧检测到大部分的聚集蛋白聚糖及II型胶原蛋白。纤维化软骨(fibrotic cartilage)的主要特征是I型胶原蛋白的高表达。因此,确认到实施例4中获得的软骨细胞颗粒不具有纤维化软骨的主要特征(图7b)。I型胶原蛋白的表达相对高于BMSC对照组颗粒,但是在分化为软骨细胞的过程中保持恒定水平并且没有显著增加。
从CBMC-hiPS分化的软骨细胞可产生ECM成分蛋白,II型胶原蛋白的表达高于I型胶原蛋白。总之,确认到CBMC-hiPSC可以生成类似于透明软骨特征的软骨细胞。
实施例8
从CBMC-hiPSC及MSC生成的软骨细胞颗粒的基因表达比较
胶原蛋白是构成ECM的最丰富的蛋白质。胶原蛋白有多种类型,但I、II及X型胶原蛋白主要与软骨有关。在实施例7中,通过免疫组织学分析确认到I型胶原蛋白及II型胶原蛋白的表达(图6a及图6b)。基于此,分析了COL1A1及众所周知为肥大性(hypertrophic)软骨中表达的显性类型蛋白的COL10A1的表达。COL1A1的表达在每个观察时间点均减少,COL10A1的表达在向软骨细胞分化的过程中未改变(图7a)。
通过测定COL2A1相对于COL1A1的表达率来可以确认到COL2A1相对于COL1A1的表达率增加(图7b),这表示透明软骨基因相对于纤维化软骨基因的表达高。使用实时PCR对从CBMC-hiPS生成的软骨细胞颗粒(Chondrogenic Pellet)与从间充质干细胞生成的软骨细胞颗粒(MSC Control Pellet)进行了比较(图7c)。在Chondrogenic Pellet中,COL2A1及SOX9的表达显著高于MSC Control Pellet。相反,在MSC Control Pellet中,纤维性标志物COL1A1及肥厚性标志物COL10A1的表达显著高。由此,确认到CBMC-hiPSC比间充质干细胞更适合于生成用于玻璃软骨再生的软骨细胞。
实施例9
各种hiPSC的软骨细胞分化能力比较
为了比较各种细胞中来源的hiPSC的软骨细胞分化能力,以与实施例1至实施例4相同的方法在软骨分化培养基(实施例4)中制备源自皮肤成纤维细胞(DF)、源自外周血单核细胞(PBMC)、源自骨关节炎成纤维细胞样细胞(FLS)或源自脐带血单核细胞(CBMC)的hiPSC的软骨细胞颗粒21天。比较每个软骨细胞颗粒(D21 Pellet)中与软骨形成有关的早期软骨形成标志物(Early Chondrogenic Marker)、软骨基质标志物(Cartilage MatrixMarker)及肥大性或纤维化软骨标志物(Hypertrophy and Fibrotic Marker)的表达水平,具体地,将SOX9、SOX5及SOX6确认为早期软骨形成标志物,将ACAN、COL2A1及PRG4确认为软骨基质标志物,将COL1A1、COL10A1及RUNX2确认为肥大性或纤维化软骨标志物。
结果,如图8所示,在CBMC-hiPSC中,早期软骨形成标志物及软骨基质标志物SOX9、SOX5、SOX6、ACAN及COL2A1的表达水平最高,与其他三种hiPSC来源软骨细胞颗粒相比,肥大性或纤维化软骨标志物COL1A1、COL10A1及RUNX2的表达水平相对较低。
实施例10
比较拟胚体衍生的生长细胞颗粒和拟胚体衍生的生长细胞的软骨细胞分化能力
为了对将拟胚体衍生的生长细胞(EB-derived outgrowth cell)单层培养和情况和以颗粒状培养的情况下的软骨细胞分化能力进行比较,在上述实施例4的软骨分化培养基中,对上述实施例3中获得的1×10
结果,如图9所示,当1×10
实施例11
比较拟胚体单细胞和拟胚体衍生的生长细胞的软骨细胞颗粒形成能力
为了比较拟胚体单细胞(EB Single cell)和拟胚体衍生的生长细胞(EB-derivedoutgrowth cell)的软骨细胞颗粒形成能力,对在将拟胚体分解来构成拟胚体的单细胞在软骨分化培养基中以颗粒状培养的情况和将拟胚体衍生的生长细胞以颗粒状培养的情况下形成的软骨细胞颗粒的数量进行了比较。
结果,如图10所示,在将构成拟胚体的单细胞以颗粒状培养的情况下,软骨细胞颗粒的形成率约为11%,在将拟胚体衍生的生长细胞以颗粒状培养的情况下,软骨细胞颗粒形成率约为98%。由此,可以确认到从拟胚体诱导生长细胞来制备软骨细胞颗粒是有效的。
实施例12
骨关节炎模型中软骨再生效果的分析
旨在评估上述实施例4中制备的软骨细胞颗粒在骨关节炎动物模型中的软骨再生效果。
具体地,手术诱导模型是一种通过对侧副(collateral)或交叉韧带(cruciateligament)进行外科治疗来诱导关节(joint)的损伤并诱发骨关节炎的方法。主要使用半月板(meniscus)切除术和前交叉韧带横切术(anterior cruciate ligament transection,ACLT)。本发明人通过前交叉韧带横切术在兔中诱导了类似于自然发生的骨关节炎的软骨部位的损伤。实施前交叉韧带横切术三天后,通过关节腔内注射法注射含有2000个生长细胞的软骨细胞颗粒MIU(Minimal injectable unit)、透明质酸(hyaluronic acid,HA),或者同时注射了MIU和HA(HA+MIU)。假手术对照组(Sham control)是在剖腹后重新缝合而不会损坏软骨部位的兔。在给药MIU和/或HA后30天之后,用番红O及甲苯胺蓝染色来确认了软骨再生效果。
结果,如图11所示,当单独使用MIU或用注射器同时将MIU和H给药时,确认到在软骨损伤部位合成了许多软骨特异性基质,并与正常组织类似地再生了软骨组织。再生的软骨染成红色或蓝色。由此,可以确认到本发明的软骨细胞颗粒具有优异的软骨再生效果,尤其,与HA单独给药组相比,单独给药MIU或同时给药MIU及HA时的软骨再生效果更优异。
实施例13
骨关节炎模型中软骨再生效果的分析
以与上述实施例12相同的方法制备了骨关节炎兔模型。在注射MIU和/或HA后4周之后,将兔的软骨用伊文思蓝(Evans blue)染色,并利用作为测量软骨状态时常用方法的ICRS评分(ICRS score)方法,通过盲法测试(Blind test)对3个人的评分进行求和并计算出平均值,在下表1中示出了ICRS评分结果,分数越高,则表示骨关节炎的诱发程度,即,软骨的损伤程度越高(0=正常;1=浅表裂痕和裂缝;2=病变向下延伸至软骨深度的50%以下;3=软骨缺陷向下延伸大于软骨深度的50%;4=严重异常(0=normal;1=superficialfissures and cracks;2=Lesions extending down to<50%of cartilage depth;3=Cartilage defects extending down>50%of cartilage depth;4=SeverelyAbnormal))。
结果,如表1及图12所示,可以确认到当单独给药MIU时,软骨损伤程度平均显著低于HA单独给药组以及MIU及HA同时给药组。
表1
以上,详细描述了本发明的特定部分,本发明所属技术领域的普通技术人员可以明确理解,这些具体说明仅仅是优选实施方式,本发明的范围不限于此。因此,本发明的实质范围由所附的权利要求书及其等同技术方案而定。
产业上的可利用性
本发明所提供的软骨细胞颗粒大小均质且小,因此可通过注射给药于需要软骨再生的患者而无需外科手术,并且分化为软骨细胞,尤其是透明软骨细胞的概率高,因而具有优异的软骨再生效果,从而具有很大的产业上的可利用性。
- 从人诱导多能干细胞制备软骨细胞颗粒的方法及其用途
- 人诱导多能干细胞的制备方法及其用途
