一种提高脐血内皮细胞增殖能力及性能的方法
文献发布时间:2023-06-19 09:32:16
技术领域
本发明属于细胞治疗领域,特别涉及一种提高脐血内皮细胞增殖能力及性能的方法。
背景技术
内皮细胞(outgrowth endothelial cell,OEC),属于血管内皮前体类细胞,体外培养时呈铺路石样生长,形成细胞单层,与成熟内皮细胞形态一致,但其具有快速扩增和生成血管的能力,使之成为细胞治疗领域的新宠,研究者们希望能将其用于心脑血管疾病、心脏病、肢体缺血等疾病的治疗。Jumi Kim等(Jumi Kim,Young-Joo Jeon.Comparativeproteomic analysis of endothelial cells progenitor cells derived from cordblood-and peripheral blood for cell therapy.Biomaterials.Volume 34,Issue 6,February 2013,Pages 1669–1685.)比较了脐血内皮细胞和外周血内皮细胞的差异,发现无论是体外成血管能力还是动物的体内缺血损伤的修复实验,脐血内皮细胞都优于外周血。David A等(David A.Ingram,Laura E..Identification of a novel hierarchy ofendothelial progenitor cells using human peripheral and umbilical cordblood.blood,2004,104:2752-2760.)也报道脐血中内皮细胞体外培养时表现出更高的扩增能力,能够在长期培养中保持前体细胞特性。
虽然脐血内皮细胞相对外周血内皮细胞有相当多的好处,但是由于其适应症多为退行性疾病,类似心脑血管疾病、糖尿病足等,需要长期多次的输注,细胞量就成为了其应用的瓶颈。脐血内皮细胞原代诱导率不高,低密度下尤其生长缓慢,细胞治疗需要的细胞量比较大,如何增加细胞量,同时增强其生成血管的能力是目前临床面临亟待解决的问题。
发明内容
为了解决上述技术问题,本发明提供了一种提高脐血源内皮细胞增殖能力及性能的方法。该方法通过在间充质干细胞培养体系中加入硝酸甘油,以提高脐血内皮细胞的增殖效率及成血管能力。该方法采用可靠的供体,经分离、培养得到内皮细胞产品。制备过程简单、可靠、重复性好
本发明通过以下技术方案实现本发明的目的:
一种提高脐血内皮细胞增殖能力及性能的方法,所述方法是将间充质干细胞与内皮细胞混合共同培养。
本发明之所以选择间充质干细胞与内皮细胞混合共同培养,是因为间充质干细胞能分泌大量血管生成相关细胞因子,有助于内皮细胞的增殖和血管的形成,例如VEGF-A、VEGF-D、bFGF等,并且脐带间充质干细胞在分泌细胞因子促进血管生成方面优于骨髓间充质干细胞。内皮细胞是一种密度依赖形的细胞,增殖需要一定的细胞数量和生长因子含量,脐血内皮细胞由于细胞量的制约而不能有效用于临床,间充质细胞刚好可以提供这样的条件,作为一种基质细胞加速脐血内皮细胞的生长。同时,间充质干细胞作为一种基质细胞支持内皮细胞血管形成,增加血管形成的数量,特别是在胞外基质不能够支撑所形成的血管时,间充质细胞可以起到支撑的作用,辅助维持血管形态。
进一步地,所述间充质干细胞来源于健康人脐带;所述内皮细胞来源于健康人脐血。本发明通过大量试验研究发现脐带间来源的充质干细胞分泌的促进血管生成方面的细胞因子优于其他来源的充质干细胞,例如骨髓间充质干细胞、脂肪间充质细胞。
进一步地,所述间充质干细胞通过以下方法制备获得:将处理后的剪碎的脐带组织进行培养获得原代细胞;收集原代细胞进行传代培养,收集第3代细胞,获得间充质干细胞。
进一步地,所述间充质干细胞传代培养的具体步骤为:原代细胞收集后按1:3的比例进行传代培养,当细胞铺满瓶底约80%密度时,利用胰酶进行消化、收集,按相同的比例进行下一步传代,传代培养至第3代,收集第3代的细胞。
进一步地,所述间充质干细胞培养基为Thera PEAK
进一步地,所述内皮细胞通过以下方法制备获得:将从脐血中获取的单个核细胞培养于内皮细胞培养基中获得原代细胞,收集原代细胞进行传代培养,传至第三代收获P3代细胞。
进一步地,所述从脐血中获取的单个核细胞的具体步骤为:用生理盐水与新鲜脐血以1:1的体积比稀释,加入淋巴细胞分离液后离心;取白膜层洗涤离心,收集细胞沉淀后再洗涤离心,收集细胞的即为单个核细胞。
进一步地,所述获得P3细胞具体步骤为:将脐血单个核细胞接种在孔板中,加入内皮细胞培养基,进行培养,3天换液一次直到发现铺路石样细胞集落,继续培养4天左右,收集细胞获得原代细胞;使用胰酶对原代细胞进行消化,收集细胞悬液,离心,留取细胞沉淀,用内皮细胞培养基重悬,接种孔板中继续培养,获得P1代细胞;P1细胞70%融合后,进行消化,收集细胞悬液,离心,留取细胞沉淀,用内皮细胞培养基重悬,接种孔板中继续培养,获得P2代细胞;P2细胞70%融合后,进行消化,收集细胞悬液,离心,留取细胞沉淀,用内皮细胞培养基重悬,接种孔板中继续培养,获得P3代细胞。
进一步地,所述离心条件均为:离心时间5min,离心力500g,离心加速度7g,减速度7g,温度20℃。
进一步地,所述内皮细胞培养基为EGM-2BulletKit完全培养基中添加了体积分数10%的胎牛血清。
进一步地,所述间充质干细胞与内皮细胞混合共同培养具体步骤是:将收集到的内皮细胞以内皮细胞培养基调整密度到1×10
本发明的有益效果为:
(1)本发明将间充质干细胞在短时间内旁分泌促进血管再生的能力利用起来,首先促进了脐血内皮细胞迅速增殖,缩短应用所需要的时间,增加细胞数量;其次增强细胞成血管能力,在matrigel中能迅速成血管,提高治疗效果;再者,间充质干细胞具有辅助维持血管的能力,为长期治疗的效果提供了保证;此外,本发明得到的混合细胞的流式表型CD105>80%。
(2)在细胞治疗中,细胞总量是一个很重要的问题,外源细胞进入人体会引发一定程度的免疫反应,这些免疫反应导致细胞量减少。而本发明的方法应用后扩充了治疗总细胞量,减少由免疫反应损失细胞的比例。同时由于间充质干细胞的免疫下调作用,进一步减少了损失的细胞量,保证治疗效果
(3)对于患者来说,自体外周血的内皮细胞活性一般较差,异体细胞来源虽然丰富但免疫原性较强,不适合细胞治疗应用。脐血内皮细胞经大量文献证实,其治疗前景是优于外周血来源的,但是由于来源有限,导致细胞量受到限制而难以进入应用,本发明的方法在扩充了总细胞量、增强其作用能力的同时减少了治疗中的损耗。
附图说明
图1是倒置显微镜下观察第2代间充质干细胞的形态图。
图2是流式细胞仪检测第2代间充质干细胞的表面抗原的表达情况图。
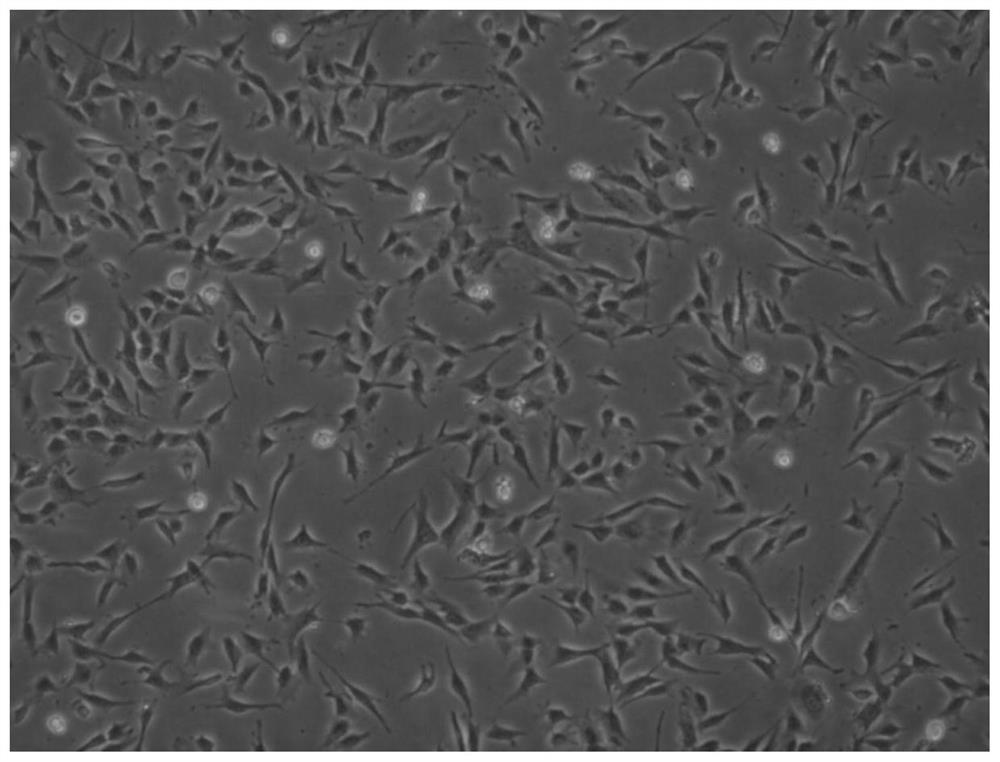
图3是倒置显微镜下观察第3代内皮细胞的形态图。
图4是流式细胞仪检测第3代内皮细胞的表面抗原的表达情况图。
图5是第3代、4代、5代和6代内皮细胞的成血管实验图。
图6是倒置显微镜下观察第2代间充质干细胞和第3代内皮细胞共培养的形态图。
图7是成血管实验图;其中,图A为第2代间充质干细胞和第3代内皮细胞共培养后的混合细胞成血管实验图;图B为内皮细胞成血管实验图;图C为间充质干细胞成血管实验图。
图8是流式细胞仪检测实施例5混合组细胞的CD105表达情况图。
具体实施方式
为了更加简洁明了的展示本发明的技术方案、目的和优点,下面结合具体实施例和附图详细说明本发明的技术方案。下列实施例中未注明具体实验条件的实验方法,通常按照常规实验条件或按照制造厂商所建议的实验条件。
间充质干细胞培养基为LONZA公司的Thera PEAK
本实施例提供一种提高脐血内皮细胞增殖能力及性能的方法,具体步骤如下:
脐血和脐带标本为通过无菌操作,由健康产妇娩出的胎盘获取。经检测乙型肝炎、丙型肝炎、梅毒、艾滋、巨细胞病毒、TORCH检测、支原体、衣原体、G-6PD和地贫等均阴性。标本采集后运回血库过程保持4~8℃运输条件。按照以下方法处理:
步骤1、制备脐带间充质干细胞
从健康人的脐带组织中提取间充质干细胞,获取的间充质干细胞进行体外培养、扩增。原代细胞收集后按1:3的比例进行传代培养,当细胞铺满瓶底约80%密度时,利用胰酶进行消化、收集,按相同的比例进行传代,最多传代培养至第3代,收集第3代的细胞,此时收集的细胞生物学性状稳定,细胞活性好,增殖能力强。具体过程如下:
1)无菌采取健康人的脐带;
2)去掉脐带里的血管和外层羊膜,留取沃顿胶质;
3)将脐带组织剪切成1~2cm
4)将剪切后的小块接种T25的培养瓶中,加入1~2mL间充质培养基,置于37℃,饱和湿度,体积分数5%二氧化碳培养箱(Thermo公司,美国)中培养;
5)经过7天后,细胞换液,3~4天后细胞可以传代。
6)利用质量分数0.25%的胰酶(GIBCO公司,美国)进行消化,收集细胞,接种在T25的培养瓶中传代培养。
7)当细胞铺满瓶底约80%密度时,利用质量分数0.25%的胰酶进行消化,收集细胞。
步骤2、制备脐血内皮细胞
从24小时内的新鲜健康人脐血中获取单个核细胞,于内皮细胞培养基中培养至P1代,具体过程如下:
1)生理盐水与50mL新鲜脐血1:1的比例稀释,混合均匀后,加入淋巴细胞分离液上,进行单个核细胞的分离,离心时间25min,离心力500g,离心加速度1g,减速度1g,温度20℃。
2)离心结束后,取白膜层(白膜层在血浆层和分离液层之间)。加入3倍体积的生理盐水,洗涤一次,离心力800g,离心8min。
3)收集细胞沉淀,用30mL的生理盐水再洗一次,离心力200g,离心时间10min,离心加速度4g,减速度4g,收集细胞沉淀,即得单个核细胞。
4)将脐血单个核细胞以1×10
5)第5天将未贴壁细胞弃去,3天换液一次直到发现铺路石样细胞集落。继续培养4天左右即可收集细胞。
6)P1传代:利用37℃预热的质量分数0.25%的胰酶进行消化,内皮细胞培养基终止消化,收集细胞悬液,离心,离心时间5min,离心力500g,离心加速度7g,减速度7g,温度20℃,去上清,留取细胞沉淀,用内皮细胞培养基重悬,接种在胶原预铺板的6孔板中培养。
7)P2传代:P1细胞70%融合后,利用37℃预热的质量分数0.25%的胰酶进行消化,内皮细胞培养基终止消化,收集细胞悬液,离心,离心时间5min,离心力500g,离心加速度7g,减速度7g,温度20℃,去上清,留取细胞沉淀,用内皮细胞培养基重悬,接种在胶原预铺板的T25培养瓶中培养。
8)P3传代:P2细胞70%融合后,利用37℃预热的质量分数0.25%的胰酶进行消化,内皮细胞培养基终止消化,收集细胞悬液,离心,离心时间5min,离心力500g,离心加速度7g,减速度7g,温度20℃,去上清,留取细胞沉淀,用内皮细胞培养基重悬,接种在胶原预铺板的T75培养瓶中培养。
步骤3、将步骤1获得的脐带间充质干细胞与步骤2获得的脐血内皮细胞按照一定的比例混合,具体操作如下:
将收集到的内皮细胞以内皮细胞培养基调整密度到1×10
1、鉴定间充质干细胞和内皮细胞
1)间充质干细胞通过以下方法鉴定
a)间充质干细胞的形态学分析及细胞计数:将培养至第2代的细胞,在倒置显微镜观察细胞状态,并拍照。
b)流式细胞仪的表型测定:取第2代细胞,经质量分数0.25%胰酶消化收集后,生理盐水离心洗涤2次。同型对照管加入鼠IgG-FITC、IgG-PE(BD公司,美国),检测管分别加入鼠抗人CD105-PE、CD90-FITC、CD73-PE、CD45-FITC、CD34-PE(BD公司,美国)各5μL。室温避光孵育30min,流式细胞仪(Fascalibur,BD公司,美国)检测。
2)内皮细胞的鉴定通过以下方法
a)内皮细胞的形态学分析及细胞计数:将P3代培养至第2天的细胞,在倒置显微镜观察,并拍照。消化传代过程中取微量细胞悬液,计数细胞数量(图3)。
b)流式细胞仪的表型测定:将第3代培养的细胞,消化传代过程中取足量细胞悬液,经离心收集后,生理盐水离心洗涤2次。同型对照管加入鼠IgG-FITC、IgG-PE,检测管分别加入鼠抗人CD309-PE、CD34-PE、CD105-PE(BD公司,美国)各5μL。室温避光孵育30min,流式细胞仪(Fascalibur,BD公司,美国)检测。
c)成血管实验鉴定:4℃融解matrigel(BD公司,美国),用预冷枪头将已完全融解的matrigel加入预冷的的96孔板,每孔40μL,37℃孵育30~60min。收获内皮细胞,重悬于EBM-2基础培养基(LONZA公司),细胞密度5×10
3)细胞鉴定结果:
倒置显微镜下观察第2代间充质干细胞形态较单一,长梭形细胞多见,少量的星形细胞,圆形细胞极少。细胞低密度时长成扁平单层细胞,细胞生长密度增加时,细胞形态变得细长,形态类似成纤维细胞,呈平行排列生长或旋涡状生长(见图1)。经流式细胞仪(Fascalibur,BD公司,美国)检测显示,细胞表面抗原CD 105、CD90、CD73阳性表达率达到95%以上,CD45、CD34阳性表达率2%以下(见图2)。综上所述,按照本发明的方法制备出的间充质干细胞纯度高,活性好,符合要求。
倒置显微镜下观察第3代(P3代)内皮细胞形态较单一,铺路石样生长。细胞低密度时呈集落生长,传代后集落不明显(见图3)。经流式细胞仪检测显示,细胞表面抗原CD309、CD34阳性表达,CD105阳性表达率达到80%以上(见图4)。经成血管实验,本发明所获得内皮细胞在3代到6代均能稳定成血管(见图5),6代以后细胞增殖速度下降。
验证内皮细胞与间充质细胞共同培养的细胞的增殖以及生成血管的能力,具体如下:
分组设计:混合组(A组,即内皮细胞与间充质细胞共同培养的细胞)、内皮胞组(OEC组或B组)和充质干细胞组(MSC组或C组)。
参照实施例步骤3:OEC组取细胞悬液A2mL加入到8mL内皮细胞培养基中。MSC组取细胞悬液B 2mL加入到8mL内皮细胞培养基中。混合A组取细胞悬液A和细胞悬液B各2mL加入到6mL内皮细胞培养基中。将3组分别加入到胶原预铺板的T75培养瓶中培养。该实验重复3次,每次实验均按照实施例3、实施例4和实施例5进行结果分析。
4天后收集上述3组细胞,对收获的细胞进行细胞计数,对比3组细胞量,用以下公式计算其增殖倍数。
增殖倍数=收获细胞量/接种细胞量
结果见表1:混合组细胞增殖率较内皮细胞组和间充质干细胞组更大,差异有统计学意义,达到本发明快速扩增的要求。
表1
4天后收集上述3组细胞,进行成血管实验分析:
4℃融解matrigel,用预冷枪头将已完全融解的matrigel加入预冷的的96孔板,每孔40μL,37℃孵育30~60min。
将收获的OEC组细胞、混合组细胞、MSC组细胞,分别重悬于EBM-2基础培养基,总细胞密度分别为5×10
收获前倒置显微镜下观察48h时的混合A组的细胞形态(见图6)。Matrigel血管形成实验中,混合组和OEC组均有不同程度的血管形成,MSC组则完全没有成血管能力。
观察成血管实验结果,如图7(图7A为混合组,图7B为OEC组,图7C为MSC组)所示;
1)18小时观察成血管实验结果,混合组细胞生成血管能力明显高于OEC组,混合培养组形成69段,OEC组形成52段。混合细胞成血管能力明显高于内皮细胞组。
2)24小时观察成血管实验结果,由于没有足够的细胞因子支持,两组细胞(混合组和OEC组)均出现不同程度的崩解,同时由于支撑力不够,胶原萎缩,导致细胞抱团,不再成为血管结构,混合组细胞中可见一些细胞附着在血管周围,并不参与成血管。
3)48小时观察成血管实验结果内皮细胞组细胞形成的血管完全崩解抱团,而混合培养组中仍有少量血管残留。
结果证明混合组细胞与OEC组细胞比较起来,有更强的血管形成能力,同时间充质细胞可以辅助维持血管形态,在胞外基质不足以支撑血管时协助支撑血管。
4天后收集上述3组细胞,经流式细胞仪检测,检测方法参照实施例2,检测结果如图8。
结果显示,OEC组的细胞表面抗原CD105阳性表达率达到80%以上,MSC组的细胞表面抗原CD105阳性表达率达到90%以上;混合组细胞的细胞表面抗原CD105阳性表达率均达到80%以上,证明混合细胞仍具有良好的干性。
上述结果表明混合细胞仍保持着干细胞特性,适合科研或临床的需求。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 一种提高脐血内皮细胞增殖能力及性能的方法
- 一种提高脐血外向生长内皮细胞增殖能力及性能的方法
