一种1-磺酰基萘酚类衍生物在防治植物病原真菌中的应用、抗菌剂
文献发布时间:2023-06-19 09:35:27
技术领域
本发明涉及一种1-磺酰基萘酚类衍生物在防治植物病原真菌中的应用、抗菌剂,属于抗菌剂技术领域。
背景技术
1-萘酚属多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)类物质,主要用于有机合成和染料工程,是农药、医药、染料、化妆品等行业的重要中间体。1-萘酚农用生物活性广谱,具有杀虫、抗菌、抑制普通小球藻生长等活性,特别是1-萘酚长期作为杀虫剂西维因的原料,使用量很大。
1-萘酚的抗菌活性已有文献报道,如周骥等在《基于显著抑菌活性原药1-萘酚和恶霉灵的乳油制备》(安徽农业科学,2017,45(5):151-153)中报道了1-萘酚对小麦赤霉病菌、油菜菌核病菌和牡丹黑斑病菌的室内抑菌活性。其中1-萘酚对小麦赤霉菌的抑菌性与现有环保型杀菌剂恶霉灵相比仍有较大差距。
发明内容
本发明的目的是提供一种1-磺酰基萘酚类衍生物在防治植物病原真菌中的应用,对小麦赤霉病菌等植物病原真菌具有显著的抑菌活性。
本发明还提供了一种用于防治植物病原真菌的抗菌剂。
为了实现以上目的,本发明的一种1-磺酰基萘酚类衍生物在防治植物病原真菌中的应用所采用的技术方案是:
一种1-磺酰基萘酚类衍生物在防治植物病原真菌中的应用,所述1-磺酰基萘酚类衍生物具有如式I所示的结构:
式I中,R为C
所述芳基为苯基、取代基取代的苯基或萘基;所述取代基取代的苯基为一或二或三或四或五取代基取代的苯基;
所述取代基取代的苯基为一取代基取代的苯基时,取代基选自卤代基、硝基、C
所述取代基取代的苯基为二或三或四或五取代基取代的苯基时,各取代基独立选自卤代基、硝基、C
所述卤代基为-F、-Cl、-Br或-I。
本发明的1-磺酰基萘酚类衍生物在的防治植物病原真菌中的应用中,具有式I所示结构的1-磺酰基萘酚类衍生物对植物病原真菌具有显著的抑菌活性,如对小麦赤霉病菌、小麦根腐病菌、小麦茎基腐病菌、水稻稻瘟病菌、玉米大斑病菌、玉米小斑病菌、玉米弯孢叶斑病菌、油菜菌核病菌、烟草枯萎病菌、烟草疫霉病菌、烟草赤星病菌、棉花枯萎病菌、黄瓜枯萎病菌、番茄灰霉病菌、白菜黑斑病菌和辣椒疫霉病菌均表现出良好的抑菌活性。
进一步的,所述杂芳基中的杂原子为N和/或S原子。所述杂芳基中杂环为5或6元杂环。
进一步的,所述杂芳基选自噻吩基、喹啉基中的一种。更进一步的,所述噻吩基为2-噻吩基(2-Thienyl)。所述喹啉基为8-喹啉基(8-Quinolyl)。
进一步的,所述取代基取代的苯基为一取代基取代的苯基时,取代基位于苯基的邻位、对位或间位。所述取代基取代的苯基为二取代基取代的苯基时,取代基位于苯基的间位和对位。如对于取代基为氯代基(-Cl)和硝基的二取代基取代的苯基,R为4-氯-3-硝基苯基。所述取代基取代的苯基为三取代基取代的苯基时,取代基位于苯基的邻位和对位。如对于取代为异丙基的三取代基取代的苯基,R为2,4,6-三异丙基苯基。
进一步的,所述取代基取代的苯基为对甲基苯基((p-Me)Ph)、对甲氧基苯基((p-OMe)Ph)、4-叔丁基苯基((p-tert-butyl)Ph)、2,4,6-三甲基苯基((2,4,6-Trimethyl)Ph)、2,4,6-三异丙基苯基((2,4,6-Triisopropyl)Ph)、4-氟苯基((p-F)Ph)、4-溴苯基((p-Br)Ph)、2-硝基苯基((o-NO
进一步的,所述萘基为1-萘基(1-Naphthyl)。
进一步的,取代基取代的苯基中含C
进一步的,取代基取代的苯基为三取代的苯基且取代基均为C
本发明的用于防治植物病原真菌的抗菌剂所采用的技术方案为:
一种用于防治植物病原真菌的抗菌剂,其有效分成包括1-磺酰基萘酚类衍生物,所述1-磺酰基萘酚类衍生物具有如式I所示的结构:
式I中,R为C
所述芳基为苯基、取代基取代的苯基或萘基;所述取代基取代的苯基为一或二或三或四或五取代基取代的苯基;
所述取代基取代的苯基为一取代基取代的苯基时,取代基选自卤代基、硝基、C
所述取代基取代的苯基为二或三或四或五取代基取代的苯基时,各取代基独立选自卤代基、硝基、C
所述卤代基为-F、-Cl、-Br或-I。
本发明的用于防治植物病原真菌的抗菌剂中有效成分含有式I结构的1-磺酰基萘酚类衍生物,因而对小麦赤霉病菌、小麦根腐病菌、小麦茎基腐病菌、水稻稻瘟病菌、玉米大斑病菌、玉米小斑病菌、玉米弯孢叶斑病菌、油菜菌核病菌、烟草枯萎病菌、烟草疫霉病菌、烟草赤星病菌、棉花枯萎病菌、黄瓜枯萎病菌、番茄灰霉病菌、白菜黑斑病菌和辣椒疫霉病菌均表现出良好的抑菌活性。
进一步的,所述杂芳基中的杂原子为N和/或S原子。所述杂芳基中杂环为5或6元杂环。
进一步的,所述杂芳基选自噻吩基、喹啉基中的一种。更进一步的,所述噻吩基为2-噻吩基(2-Thienyl)。所述喹啉基为8-喹啉基(8-Quinolyl)。
进一步的,所述取代基取代的苯基为一取代基取代的苯基时,取代基位于苯基的邻位、对位或间位。所述取代基取代的苯基为二取代基取代的苯基时,取代基位于苯基的间位和对位;所述取代基取代的苯基为三取代基取代的苯基时,取代基位于苯基的邻位和对位。
进一步的,所述取代基取代的苯基为对甲基苯基((p-Me)Ph)、对甲氧基苯基((p-OMe)Ph)、4-叔丁基苯基((p-tert-butyl)Ph)、2,4,6-三甲基苯基((2,4,6-Trimethyl)Ph)、2,4,6-三异丙基苯基((2,4,6-Triisopropyl)Ph)、4-氟苯基((p-F)Ph)、4-溴苯基((p-Br)Ph)、2-硝基苯基((o-NO
进一步的,所述萘基为1-萘基(1-Naphthyl)。
进一步的,取代基取代的苯基中含C
进一步的,取代基取代的苯基为三取代的苯基且取代基均为C
本发明中具有式I所示结构的1-磺酰基萘酚类衍生物采用包括以下步骤的方法制得:将1-萘酚和如式II所示结构的化合物在缚酸剂的作用下于有机溶剂中进行反应:
式II中,R为C
所述取代基取代的苯基为一取代基取代的苯基时,取代基选自卤代基、硝基、C
进一步的,所述杂芳基中的杂原子为N和/或S原子。所述杂芳基中杂环为5或6元杂环。
进一步的,所述杂芳基选自噻吩基、喹啉基中的一种。更进一步的,所述噻吩基为2-噻吩基(2-Thienyl)。所述喹啉基为8-喹啉基(8-Quinolyl)。
进一步的,所述取代基取代的苯基为一取代基取代的苯基时,取代基位于苯基的邻位、对位或间位。所述取代基取代的苯基为二取代基取代的苯基时,取代基位于苯基的间位和对位;所述取代基取代的苯基为三取代基取代的苯基时,取代基位于苯基的邻位和对位。
进一步的,所述取代基取代的苯基为对甲基苯基((p-Me)Ph)、对甲氧基苯基((p-OMe)Ph)、4-叔丁基苯基((p-tert-butyl)Ph)、2,4,6-三甲基苯基((2,4,6-Trimethyl)Ph)、2,4,6-三异丙基苯基((2,4,6-Triisopropyl)Ph)、4-氟苯基((p-F)Ph)、4-溴苯基((p-Br)Ph)、2-硝基苯基((o-NO
进一步的,所述萘基为1-萘基(1-Naphthyl)。
进一步的,取代基取代的苯基中含C
进一步的,取代基取代的苯基为三取代的苯基且取代基均为C
进一步的,式II所示化合物为乙基磺酰氯、苯磺酰氯、对甲基苯磺酰氯、对甲氧基苯磺酰氯、4-叔丁基苯磺酰氯、均三甲苯基磺酰氯、2,4,6-三异丙基苯磺酰氯、4-氟苯磺酰氯、4-溴苯磺酰氯、2-硝基苯磺酰氯、3-硝基苯磺酰氯、4-硝基苯磺酰氯、4-氯-3-硝基苯磺酰氯、噻吩-2-磺酰氯、1-萘磺酰氯或8-喹啉磺酰氯。
进一步的,所述缚酸剂为胺。所述胺为三乙胺。1-萘酚与三乙胺的摩尔比优选为1:1~1.5。
进一步的,所述有机溶剂为二氯甲烷、丙酮的一种或任意组合。
进一步的,1-萘酚、式II所示结构的化合物的摩尔比为1:1~1.3。
附图说明
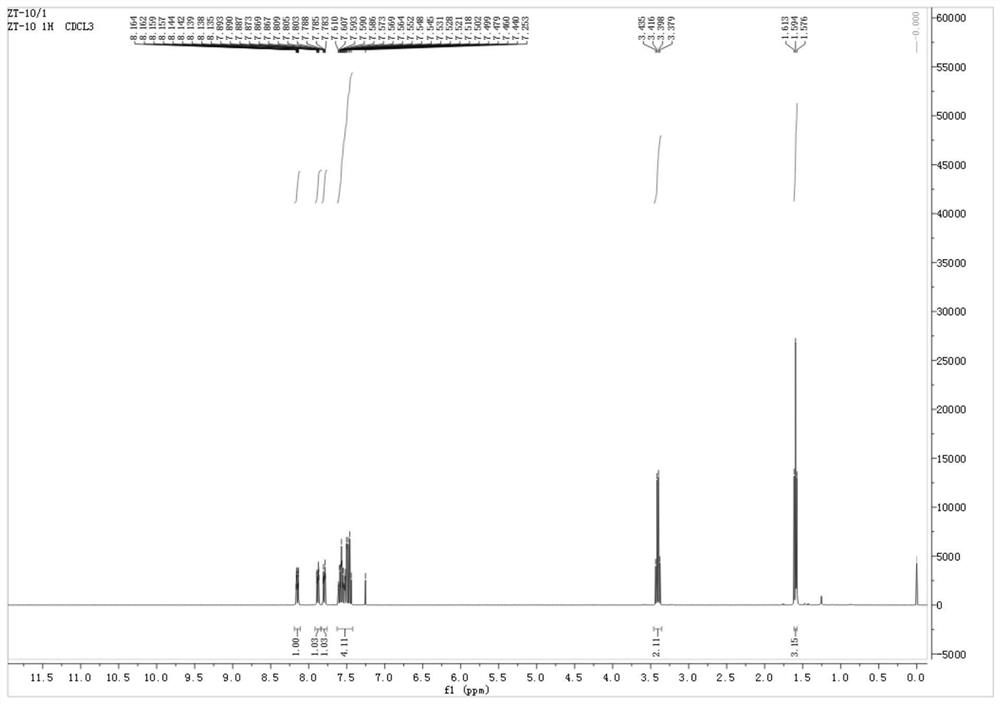
图1为本发明的具体实施方式中制得的化合物1的氢谱;
图2为本发明的具体实施方式中制得的化合物2的氢谱。
具体实施方式
以下结合具体实施方式本发明的技术方案作进一步的说明。
实施例1
本实施例的1-磺酰基萘酚类衍生物在防治植物病原真菌中的应用,为表1中化合物1~16在防治植物病原真菌中的应用。
表1化合物1~16的具体结构式以及对应结构式I中的R基团
以上化合物1~16采用包括以下步骤的方法制得:
1)在100mL烧瓶中加入5mmol的1-萘酚,5.5mmol的取代磺酰氯(即式II化合物),并加入20mL二氯甲烷使其完全溶解,然后缓慢滴加三乙胺(6mmol,Et
2)反应结束后,在反应体系中加入20mL的水,然后用二氯甲烷进行多次萃取,合并有机相,然后用饱和食盐水对有机相进行洗涤,再用无水硫酸钠对有机相进行干燥,然后将干燥后的有机相浓缩蒸干溶剂后采用硅胶柱层析法进行分离,得到目标产物;计算目标产物产率。
各化合物采用该方法进行制备时,采用的式II化合物以及目标产物的产率见表2。
表2化合物1~16在制备时采用的式II化合物以及目标产物的收率
制备化合物1~16时所得目标产物的理化性质如下:
制备化合物1时所得目标产物的理化性质如下:
1)棕色油状液体。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物1时所得目标产物的氢谱见图1,涉及的化学反应为:
制备化合物2时所得目标产物的理化性质如下:
1)白色固体,熔点117~118℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物2时所得目标产物的氢谱见图2,涉及的化学反应为:
制备化合物3时所得目标产物的理化性质如下:
1)白色固体,熔点87~88℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物3时涉及的化后反应为:
制备化合物4时所得目标产物的理化性质如下:
1)白色固体,熔点106~107℃,产率为94%。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物4时涉及的化学反应为:
制备化合物5时所得目标产物的理化性质如下:
1)白色固体,熔点72~74℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物5时涉及的反应为:
制备化合物6时所得目标产物的理化性质如下:
1)白色固体,熔点120~121℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物2时涉及的化学反应为:
制备化合物7时所得目标产物的理化性质如下:
1)白色固体,熔点76~78℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物7时涉及的化学反应为:
制备化合物8时所得目标产物理化性质如下:
1)白色固体,熔点86~88℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物8时涉及的化学反应为:
制备化合物9时所得目标产物的理化性质如下:
1)棕褐色固体,熔点100~102℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物9时涉及的化学反应为:
制备化合物10时所得目标产物的理化性质如下:
1)浅黄色固体,熔点107~109℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物10时涉及的化学反应为:
制备化合物11时所得目标产物的理化性质如下:
1)浅黄色固体,熔点87~88℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物11时涉及的化学反应为:
制备化合物12时所得目标产物的理化性质如下:
1)浅黄色固体,熔点164~166℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物12时涉及的化学反应为:
制备化合物13时所得目标产物的理化性质如下:
1)浅黄色固体,熔点127~129℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物13时涉及的化学反应为:
制备化合物14时所得目标产物的理化性质如下:
1)白色固体,熔点129~130℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+Na]
制备化合物14时涉及的化学反应为:
制备化合物15时所得目标产物的理化性质如下:
1)白色固体,熔点101~103℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+H]
制备化合物15时涉及的反应为:
制备化合物16时所得目标产物的理化性质如下:
1)白色固体,熔点186~187℃。
2)核磁共振图谱(
以氘代CDCl
3)ESI-TRAP源质谱(MS)图特征:其[M+Na]
制备化合物16时涉及的反应为:
以上化合物1~16的制备方法中,也可以将步骤1)所采用的二氯甲烷替换为丙酮,此时步骤2)中,需要在反应结束后减压浓缩去除丙酮制得粗产物,然后加入20mL二氯甲烷溶解粗产物,之后再加入20mL水,再用二氯甲烷进行多次萃取,合并有机相,然后用饱和食盐水对有机相进行洗涤,再用无水硫酸钠对有机相进行干燥,然后将干燥后的有机相浓缩蒸干溶剂后采用硅胶柱层析法进行分离,得到目标产物;以苯磺酰氯作为式II化合物以制备化合物2时,产率为99%,涉及的化学反应为:
实施例2
本实施例的用于防治植物病原真菌的抗菌剂,其中的有效成分为表1中化合物1~16中的任意一种。本实施例的用于防治植物病原真菌的抗菌剂在制备时,参照现有抗菌剂的制备方法,仅将有效成分替换为化合物1~16中选定的作为有效成分的化合物即可。如可将商品化抗菌剂恶霉灵(Hymexazol)中的有效成分的替换为等浓度的化合物1~16中选定的作为有效成分的化合物。
实验例
本实验例为抑制植物病原真菌活性试验:
1、供试植物病原真菌(共16种):小麦赤霉病菌[Fusarium graminearum Schw.]、小麦根腐病菌[Bipolaris sorokiniana(Sacc.)Shoem]、小麦茎基腐病菌[Fusariumpseudograminearum,Fpg]、水稻稻瘟病菌[Pyricularia oryzae Cav.]、玉米大斑病菌[Exserohilum turcicum(Pass.)Leonard et Suggs]、玉米小斑病菌[Helminthosporiummaydis Nisik&Miy]、玉米弯孢叶斑病菌[Currularia lunata(Boed)Wakker]、油菜菌核病菌[Sclerotinia sclerotiorum(Lib.)de Bary]、烟草枯萎病菌[Fusarium oxysporum(Schlecht)f.sp.nicotianae(Johns.)Snyder et Hansen]、烟草疫霉病菌[Phytophoranicotianae Breda de Haan Tuker]、烟草赤星病菌[Alternaria alternata Keissler]、棉花枯萎病菌[Fusarium oxysporium f.sp.Vasinfectum synder et Hansen]、黄瓜枯萎病菌[Fusarium oxysporium f.sp cucumerinum Owen]、番茄灰霉病菌[Botrytis cinereaPers.]、白菜黑斑病菌[Alternaria brassicae Sacc.]和辣椒疫霉病菌[Phytophthoracapsici Leonian],均由河南科技大学林学院植保系实验室提供。
2、供试样品及试剂:已商品化抗菌剂恶霉灵(Hymexazol)(阳性对照),实施例1中制备化合物1~16时所得目标产物(下文直接记为化合物1~16),丙酮(分析纯)。
3、生测方法:采用菌丝生长速率法。
培养基:V8培养基(其配比为:V-8蔬菜汁160mL、琼脂15g、蒸馏水1 500mL)和PDA培养基(其配比为:去皮马铃薯200g、葡萄糖20g、琼脂20g、蒸馏水定容至1 000mL)。
采用菌丝生长速率法分别测定化合物1~16对16种常见植物病原真菌的室内毒力,以商品化杀菌剂恶霉灵作为阳性对照。将化合物1~16和恶霉灵用丙酮溶解,待灭菌后的培养基冷却至60-70℃时分别与化合物1~16和恶霉灵混合,充分混匀后制成含有100ppm(100μg/mL)带药培养基,以不加药剂的为空白对照(CK),每个处理设三个重复。待培养基充分冷却后,接种生长活力一致,直径5mm的供试病原真菌菌片,于25±1℃恒温培养,待不同菌CK组菌落长到超过7cm时调查。调查时,用十字交叉法测量菌落直径,并用下述公式计算出各个样品对所测病原真菌的生长抑制率。
4、杀菌活性测定结果(见表3和4)。
表3化合物1~16以及恶霉灵的杀菌活性测定结果(1)
表4化合物1~16以及恶霉灵的杀菌活性测定结果(2)
表3和表4中数据表明,具有式I所示结构的1-磺酰基萘酚类衍生物对所测16种植物病原真菌均表现出较好的抑菌活性,其中化合物8和9对16种供试菌株的抑菌活性均高于已商品化的抗菌剂恶霉灵;另外,所有化合物1~16对辣椒疫霉病菌的抑菌活性均超过恶霉灵。因此,本发明的具有式I所示结构的1-磺酰基萘酚类衍生物抑菌活性显著。
- 一种1-磺酰基萘酚类衍生物在防治植物病原真菌中的应用、抗菌剂
- 一种1-磺酰基萘酚类衍生物在防治植物病原真菌中的应用、抗菌剂
