微型生物传感器及其用于降低量测干扰的方法
文献发布时间:2023-06-19 09:46:20
技术领域
本发明关于一种微型生物传感器,特别关于一种用于在量测生物流体中的目标分析物时可以降低量测干扰的微型生物传感器及其降低量测干扰的方法。
背景技术
基于慢性病患人口快速增长,生物体内生物流体中分析物的检测对于患者的诊断和监测非常重要,尤其是体内葡萄糖浓度的有效监测更是治疗糖尿病的关键。因此,近年来连续式葡萄糖监测(continuous glucose monitoring,CGM)系统愈发受重视,该系统具有许多相较于传统生物传感器的优点,如降低手指血液取样时的疼痛及连续监测生物流体中一个或多个目标分析物的生理参数。
连续式葡萄糖监控系统中包含基于酶的生物传感器,其用以量测体内对应于葡萄糖浓度的生理信号,且大多运用电化学方式,即以葡萄糖氧化酵素(glucose oxidase,GOx)催化葡萄糖反应生成葡萄糖酸内酯(Gluconolactone)与还原态酵素,后续还原态酵素将与体内生物流体中的氧气进行电子转移进而生成副产物过氧化氢(H
发明内容
本发明的微型生物传感器可以植入生物体皮下,用以量测生物流体中目标分析物的生理参数,且本发明的微型生物传感器中包括由不同导电材料组成的两个工作电极,其中一个工作电极可以消耗生物流体中对量测有影响的干扰物,使另一个工作电极在量测时可得到更准确的量测结果。
因此,本发明提供一种微型生物传感器,用于植入生物体皮下以进行一生物流体中一葡萄糖浓度的量测并可降低该生物流体中至少一干扰物对该量测的干扰,包括:一基板,具有相对设置的一第一表面与一第二表面;一第一工作电极,至少包括设置于该基板的该第一表面上的一第一感测段,其中该第一工作电极的该第一感测段的材质至少包含一第一导电材料;一化学试剂,至少盖覆部分该第一感测段的该第一导电材料,用于与该生物流体中的葡萄糖反应并产生过氧化氢;以及至少一第二工作电极,设置于该基板的该第一表面上并包括一第二感测段,且该第二感测段邻设于该第一感测段的至少一侧边,其中该第二工作电极的该第二感测段的材质至少包含与该第一导电材料不同的一第二导电材料,其中:当该第一工作电极经一第一工作电压驱动而使该第一感测段对该过氧化氢具有一第一灵敏度并形成一量测范围时,该第一导电材料与该过氧化氢反应产生一电流信号,且当该电流信号的数值对应该葡萄糖浓度时获得一生理信号;当该第一工作电极经该第一工作电压驱动而使该第一导电材料与该干扰物反应而产生一干扰电流信号时,该干扰电流信号与该电流信号混合输出而对该生理信号造成干扰;以及当该第二工作电极经一第二工作电压驱动时,该第二导电材料对该过氧化氢具有小于该第一灵敏度的一第二灵敏度,且该第二感测段产生接触该第一感测段周遭并可至少部分重叠于该量测范围的一去干扰范围,以消耗该干扰物进而降低该干扰电流信号的产生。
本发明另提出一种微型生物传感器,用于植入生物体皮下以进行一生物流体中一目标分析物生理参数的量测并可降低该生物流体中一干扰物对该量测的干扰,包括:一基板,具有一表面;一第一工作电极,包括设置于该表面上的一第一感测段,其中该第一感测段包含一第一导电材料;至少一第二工作电极,设置于该表面上并包括邻设于该第一感测段的至少一侧边的一第二感测段,其中该第二感测段包含一第二导电材料;以及一化学试剂,至少盖覆部分该第一导电材料,用于与该生物流体中的目标分析物反应以产生一生成物,其中:当该第一工作电极经一第一工作电压驱动而使该第一导电材料与该生成物反应以输出对应该目标分析物生理参数的一生理信号;以及当该第二工作电极经一第二工作电压驱动时,该第二导电材料消耗该干扰物,以降低该干扰物对该生理信号的干扰。
本发明另提出一种降低目标分析物量测干扰的方法,包括:提供一微型生物传感器,用于进行一生物流体中一目标分析物生理参数的量测,其中该微型生物传感器包括:具有一表面的一基板;一第一工作电极,包含设置在该表面上的一第一感测段,且该第一感测段包含一第一导电材料;至少一第二工作电极,设置在该表面上并包含一第二感测段,且该第二感测段包含一第二导电材料;以及一化学试剂,至少盖覆部分该第一导电材料,用以与该生物流体中的目标分析物反应以产生一生成物;执行一去干扰动作,该去干扰动作为以一第二工作电压驱动该第二工作电极,使该第二导电材料消耗该生物流体中一干扰物,以降低该干扰物对该量测的干扰;以及执行一量测动作,该量测动作为以一第一工作电压驱动该第一工作电极,使该第一导电材料与该生成物反应以输出对应该目标分析物生理参数的一生理信号。
附图说明
本发明的上述目的及优点在参阅以下详细说明及附随图式之后对那些所属技术领域中具有常用知识者将变得更立即地显而易见。
图1(A)为本发明的微型生物传感器的第一实施例的正面示意图。
图1(B)为本发明的微型生物传感器的第一实施例的第一工作电极及第二工作电极的配置示意图。
图2(A)为本发明图1(A)中沿A-A’线的剖面示意图。
图2(B)为本发明图1(A)中沿B-B’线的剖面示意图。
图2(C)为本发明图1(A)中沿C-C’线的剖面示意图。
图2(D)为本发明以另一制程得到的微型生物传感器的感测区域的剖面示意图。
图3(A)为本发明的微型生物传感器的第二实施例的正面示意图。
图3(B)为本发明的微型生物传感器的第二实施例的第一工作电极及第二工作电极的配置示意图。
图4为本发明图3(A)中沿A-A’线的剖面示意图。
图5(A)为本发明的微型生物传感器的第三实施例的正面示意图。
图5(B)为本发明图5(A)中沿A-A’线的剖面示意图。
图6(A)-6(C)为本发明的第一感测段及第二感测段的其他配置方式的示意图。
图6(D)为图6(C)中沿I-I’线的剖面示意图。
图7为本发明的第一感测段及第二感测段的其他配置方式的示意图。
图8(A)-8(C)为本发明的第一感测段及第二感测段的其他配置方式的示意图。
图9(A)为本发明的微型生物传感器的感测区域的剖面示意图。
图9(B)为本发明的微型生物传感器的感测区域的剖面示意图。
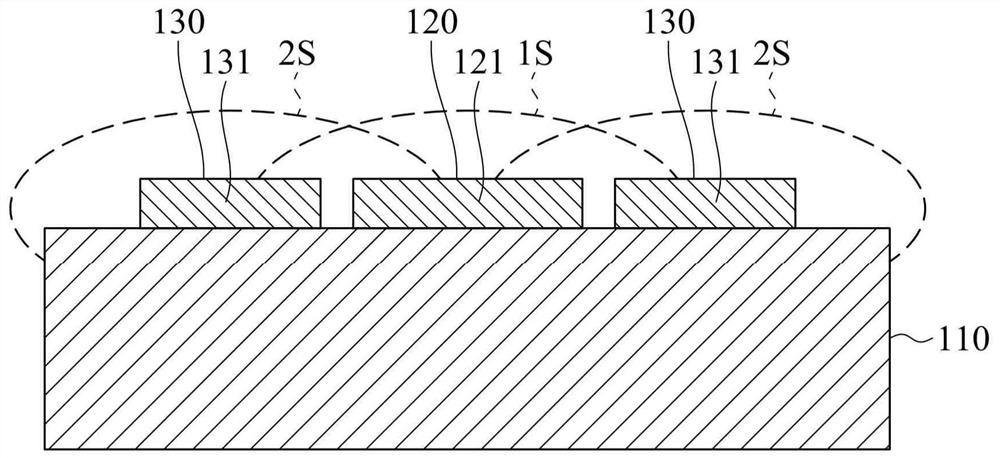
图10为本发明的微型生物传感器经驱动后第一感测段的量测范围及第二感测段的去干扰范围的示意图。
图11为控制本发明的微型生物传感器的电压并测量电流的电路的示意图。
图12为本发明降低微型生物传感器进行量测时所产生的干扰的方法流程图。
图13(A)-13(C)为本发明降低微型生物传感器进行量测时,去干扰动作与量测动作之间的时间关系示意图,其中图13(A)为去干扰动作与量测动作部分重叠,图13(B)为去干扰动作与量测动作不重叠,以及图13(C)为去干扰动作与量测动作完全重叠。
图14为本发明降低微型生物传感器进行量测时,去干扰动作与量测动作之间的时间关系示意图。
图15为本发明降低微型生物传感器进行量测时,去干扰动作与量测动作之间的时间关系示意图。
图16为本发明的微型生物传感器仅有第一感测段被驱动而产生的量测范围的示意图。
图17为一量测曲线图,说明本发明试验例与比较试验例应用于体外去干扰试验的结果,其中当第二工作电极的去干扰功能被开启时,于第一感测段所测得的电流信号为曲线C1,于第二感测段所测得的电流信号为曲线C2;以及当第二工作电极的去干扰功能未被开启时,于第一感测段所测得的电流信号为曲线C3。
图18(A)-18(B)为本发明体内去干扰试验的结果,其中图18(A)为无去干扰机制的量测曲线,图18(B)为有去干扰机制的量测曲线。
具体实施方式
以下在实施方式中详细叙述本发明的详细特征以及优点,其内容足以使任何熟悉相关技术者了解本发明的技术内容并据以实施,且根据本说明书所揭露的内容、权利要求书及图式,任何熟悉相关技术者可轻易地理解本发明相关的目的及优点。以下的实施例为进一步详细说明本发明的观点,但非以任何观点限制本发明的范围。
本发明的微型生物传感器可为连续式葡萄糖监测系统的传感器,用于植入生物体皮下以持续量测生物流体中目标分析物的生理参数。另外,本文中所提到的“目标分析物”泛指任何存在于生物体内的待测物质,例如但不限于葡萄糖、乳糖(Lactose)、尿酸等。“生物流体”可为但不限于血液或人体组织间液(Interstitial Fluid,ISF),而“生理参数”可为但不限于浓度。
请参阅图1(A),其为本发明微型生物传感器的第一实施例的正面示意图。本发明的微型生物传感器10包括具有表面111的基板110、设置于基板110的表面111上的第一工作电极120及第二工作电极130、以及盖覆于部分表面111、部分第一工作电极120及部分第二工作电极130上的绝缘层140。本发明的基板110为绝缘体。请参阅图1(B),其移除绝缘层140可更清楚示意第一工作电极120及第二工作电极130在基板110的表面111上的配置,其中基板110包括表面111、对侧表面112(请见图2(A)、图9(A)及图9(B))、第一端113及第二端114,且基板110上靠近第一端113的区域为信号输出区域115、靠近第二端114的区段为感测区域116、以及位于信号输出区域115及感测区域116之间且被绝缘层140所覆盖的区域为绝缘区域117。第一工作电极120及第二工作电极130从基板110的第一端113延伸至第二端114,第一工作电极120在感测区域116并包含第一导电材料1C的部分为第一感测段121,在信号输出区域115的部分为第一信号输出段122(如图1(A)所示),而连接第一感测段121至第一信号输出段122并至少位于绝缘区域117的部分为第一信号连接段123(如图1(B)所示)。第二工作电极130在感测区域116并包含第二导电材料2C的部分为第二感测段131,在信号输出区域115的部分为第二信号输出段132(如图1(A)所示),而连接第二感测段131至第二信号输出段132并至少位于绝缘区域117的部分为第二信号连接段133(如图1(B)所示)。本发明的第二感测段131邻设于第一感测段121的至少一侧边并以其一侧边沿着第一感测段121的至少一侧边延伸。在第一实施例中,第二感测段131沿着第一感测段121的三侧边延伸而呈U形。因此,本发明的第一感测段121与第二感测段131仅藉表面111维持彼此间的关系位置,且第一感测段121与第二感测段131因直接相邻而不存在如电极或连接线的中间物。
为了达成此等结构,在制程时,可先将第二导电材料2C形成于基板110的表面111上并图案化成如图1(B)的图形,亦即将第二导电材料2C定义出两个相互分离的区块,其中从基板110的第一端113朝向第二端114延伸并在第二端114处弯折而呈U型的其中一区块预设为第二工作电极130,而从基板110的第一端113朝向第二端114延伸并在第二端114处为前述U型结构所围绕的另外一区块预设为第一工作电极120。接着形成绝缘层140在基板110上并露出信号输出区域115与感测区域116后,可形成第一导电材料1C于第一工作电极120在感测区域116内的第二导电材料2C上,以完成第一工作电极120的第一感测段121。然而,虽未图示,第一导电材料1C也可以仅形成于第一工作电极120在感测区域116内的部分第二导电材料2C上。因此,本发明图1(A)中沿A-A’线、B-B’线及C-C’线的剖面示意图分别为图2(A)、2(B)及2(C)。在图2(A)中,本发明第一实施例的第一感测段121具有覆盖于第二导电材料2C上的第一导电材料1C,第二感测段131具有第二导电材料2C。在图2(B)中是第二感测段131的U形底部区域,故在基板110的表面111上仅有第二导电材料2C。在图2(C)中,由于第一导电材料1C仅形成于感测区域116内,故第一工作电极120位于绝缘区域117内的部分仅有第二导电材料2C且由绝缘层140覆盖。
在其他实施例中,盖覆绝缘胶140的步骤也可在形成第一导电材料1C之后执行,故第一导电材料1C实质上可以形成于第一工作电极120中所有的第二导电材料2C上。此外,在本发明中可依需求改变第二导电材料2C在图案化步骤后所保留的位置、大小与形状,故在其他实施例中,第二导电材料2C可在图案化步骤中被定义成如图1(B)所示但没有第一感测段121的图形,也就是说第一工作电极120的第二导电材料2C仅形成于信号输出区域115与绝缘区域117内,或者顶多延伸至部分的感测区域116内,然后在原来表面111预计形成第一感测段121的区域直接形成第一导电材料1C于其上,并使第一导电材料1C电性连接至第一工作电极120的其他部分(即第二导电材料2C)以完成第一感测段121的配置,此时微型生物传感器10的感测区域116的剖面图如图2(D)所示。在其他实施例中,亦可在图案化步骤时空出第一工作电极120的位置,再在盖覆绝缘层140前以第一导电材料1C形成第一工作电极120。
在本发明的微型生物传感器10中,感测区域116中的第二感测段131与第一感测段121之间的间隙不大于0.2mm。更优选地,该间隙范围为0.01mm至0.2mm;又更优选地,该间隙范围为0.01mm至0.1mm;再更优选地,该间隙范围为0.02mm至0.05mm。具体地,请参阅图2(A),在第一实施例中第一感测段121与第二感测段131的间隙距离S3与S5为0.04mm。
另外,本发明的第一导电材料1C可为碳、铂、铝、镓、金、铟、铱、铁、铅、镁、镍、钼、锇、钯、铑、银、锡、钛、锌、硅、锆中的任一者、其衍生物(如合金、氧化物或金属化合物等)或其组合,而第二导电材料2C同样可使用如上述第一导电材料1C所例举的元素或其衍生物。本发明的绝缘层140的材料可为任何能达到绝缘效果的材料,例如但不限于聚对二甲苯(Parylene)、聚酰亚胺(Polyimide)、聚二甲基硅氧烷(PDMS)、液晶高分子材料(LCP)或是MicroChem的SU-8光阻等。
请参阅图3(A),其为本发明微型生物传感器10的第二实施例的正面示意图,且图3(B)中移除绝缘层140可更清楚地示意第一工作电极120及第二工作电极130在基板110的表面111上的配置。在第二实施例中,第一工作电极120及第二工作电极130从基板110的第一端113延伸至第二端114,第一工作电极120在感测区域116中且被第一导电材料1C所覆盖的部分为第一感测段121,第二工作电极130在感测区域116并包含第二导电材料2C的部分为第二感测段131(如图3(A)所示)。在第二实施例中,第二感测段131沿着第一感测段121的一侧边延伸而未弯折,使第二感测段131仅邻设于第一感测段121的一侧边。因此,图3(A)中沿A-A’线的剖面示意图如图4所示,本发明第二实施例的第一感测段121具有覆盖于第二导电材料2C上的第一导电材料1C,以及第二感测段131具有第二导电材料2C且仅邻设于第一感测段121的一侧边。
请参阅图5(A),其为本发明微型生物传感器10的第三实施例的正面示意图。在第三实施例中,微型生物传感器10具有两个第二工作电极130,第一工作电极120及两个第二工作电极130从基板110的第一端113延伸至第二端114,且两个第二工作电极130分别沿第一工作电极120的相对两侧边延伸。第一工作电极120在感测区域116内且被第一导电材料1C所覆盖的部分为第一感测段121,两个第二工作电极130在感测区域116并包含第二导电材料2C的部分为第二感测段131。在第三实施例中,两个第二感测段131分别邻设于第一感测段121的相对两侧边。因此,图5(A)中沿A-A’线的剖面示意图如图5(B)所示,本发明第三实施例的第一感测段121具有覆盖于第二导电材料2C上的第一导电材料1C,以及两个第二感测段131具有第二导电材料2C且分别仅邻设于第一感测段121的相对两侧边。
尽管本发明的第一感测段121及第二感测段131间的配置已揭示如第一实施例至第三实施例所述,亦可有其他配置方式。举例来说,在第一实施例中,第二感测段131为沿第一感测段121中彼此相邻的三侧边延伸而呈U型,但在一变化例中,第二感测段131沿着第一感测段121的三侧边所延伸设置的长度也可进行调整而如图6(A)所示,或者第二感测段131也可仅沿第一感测段121的相邻两侧边设置而呈成L型,如图6(B)所示。在第一实施例的又一变化例中,第一工作电极120的第一信号连接段123可透过在基板110上钻孔洞118的方式穿设至基板110的对侧表面112,此时第二感测段131可围绕于第一感测段121的四侧边,如图6(C)-6(D)所示。接着,不论是在第二实施例还是第三实施例中,第二感测段131的长度均可以相对于第一感测段121进行调整而如图7至图8(C)所示。因此,前述所谓「第二感测段131邻设于第一感测段121的至少一侧边」具体指本发明的第一感测段121的周缘中邻设有第二感测段131的部分占第一感测段121的总周长的30%-100%。
再者,如图1(A)、图2(A)、图3(A)、图4、图5(A)与图5(B)所示,本发明的微型生物传感器10还包含一化学试剂层150。化学试剂层150至少覆盖于第一感测段121的第一导电材料1C上。具体地,在微型生物传感器10的制程中可将表面111及/或对侧表面112已经形成有电极的基板110浸入含有化学试剂的溶液中并调整基板110浸置的深度,使得后续形成的化学试剂层150可一次性地至少包覆微型生物传感器10的感测区域116,也就是同时覆盖于第一感测段121的第一导电材料1C与覆盖第二感测段131的第二导电材料2C上。又或者,化学试剂层150进一步可以包覆部份绝缘区域117,如图1(A)所示。藉此,覆盖于第一导电材料1C上的化学试剂层150可与生物流体中的目标分析物反应而产生生成物,后续由第一导电材料1C与生成物反应进而输出对应于目标分析物的生理信号。
在上述任一实施例中,本发明的双工作电极的配置可应用于二电极系统和三电极系统。在二电极系统中,本发明的微型生物传感器10还包括配置在基板110的相对表面112上的至少一对电极160,如图9(A)所示,图9(A)是微型生物传感器10的感测区域116的剖面示意图,而对电极160用以配合第一工作电极120或第二工作电极130动作。二电极系统中的对电极160可基于所选用的材质而兼具参考电极的功能,即本发明的对电极160可以与第一工作电极120形成电子回路,使第一工作电极120上电流畅通,以确保电化学反应在第一工作电极120上发生之余,还能提供稳定的相对电位作为参考电位。对电极160耦合到第一工作电极120和/或第二工作电极130。在其他实施例中,对电极160也可以被配置在基板110的表面111上(图未示出)。在三电极系统中,本发明的微型生物传感器10除了对电极160外还包括一参考电极170,如图9(B)所示,图9(B)是微型生物传感器10的感测区域116的剖面示意图,参考电极170用以提供参考电位。具体地,对电极160及参考电极170是分开且不电性连接的,而对电极160与第一工作电极120及/或第二工作电极130耦接。对电极160与参考电极170亦可设置于基板110的表面111上(图未示出),或分别设置于基板110的不同表面上。此外,如图所示,在本发明的一实施例中化学试剂层150实质上也覆盖于对电极160及/或参考电极170上。
必须说明的是,在本发明中所谓“驱动”为施加电压让其中一电极的电位高于另一电极的电位而使前述电位较高的电极开始进行氧化反应。因此,在第一工作电极120与对电极160之间造成第一工作电极120被驱动的电位差为第一工作电压,且在第二工作电极130与对电极160之间造成第二工作电极130被驱动的电位差为第二工作电压。
进一步配合图10来说明,本发明的微型生物传感器10的第一工作电极120被驱动而用于量测生物流体中目标分析物的生理参数,且当微型生物传感器10的第一工作电极120经第一工作电压驱动时,第一感测段121会产生一量测范围1S并对生成物具有第一灵敏度,使第一导电材料1C与生成物反应而产生电流信号,电流信号会经由第一信号连接段123传送至第一信号输出段122,且当电流信号的数值与生成物的浓度间具有比例关系时,进而获得对应生理参数的生理信号。因此,当第一工作电极120以第一工作电压驱动时,第一导电材料1C与生成物反应以输出对应目标分析物的生理参数的生理信号的动作为量测动作。然而,生物流体中含有干扰物,第一导电材料1C也会与干扰物反应而产生干扰电流信号,干扰电流信号会与电流信号混合输出而对生理信号造成干扰。
本发明的微型生物传感器10的第二工作电极130可用以消耗干扰物。当微型生物传感器10的第二工作电极130经第二工作电压驱动时,第二感测段131的第二导电材料2C对生成物具有一第二灵敏度,且每一第二感测段131均会产生一去干扰范围2S。此时,因第二感测段131相当靠近第一感测段121而使得去干扰范围2S接触第一感测段121周遭并可至少部分重叠于第一感测段121的量测范围1S,藉此第二导电材料2C会与干扰物进行氧化反应而直接且持续地消耗干扰物,降低干扰电流信号的产生,进而降低干扰物对量测动作的影响。因此,当第二工作电极130以第二工作电压驱动时,使第二导电材料2C消耗生物体中干扰物的动作为去干扰动作。
再者,当第二工作电极130经第二工作电压驱动时,第二导电材料2C亦有机会与生成物反应而产生另一电流信号,但却消耗掉原本应由第一工作电极120进行量测并藉以推知目标分析物的生理参数的生成物,进而影响实际被测得的生理参数。因此,当在一实施例中目标分析物为葡萄糖、生成物为过氧化氢、且生理参数为葡萄糖浓度时,第一导电材料1C更优选地需选用经第一工作电压驱动后对于过氧化氢具有第一灵敏度的材料,且又更优选地,第一导电材料1C可选自于金、铂、钯、铱或前述的组合。而该第二导电材料2C需不同于该第一导电材料1C,且具体来说,需选用经第二工作电压驱动后对于过氧化氢具有小于第一灵敏度的第二灵敏度的材料,甚至是经第二工作电压驱动后对于过氧化氢几乎不具灵敏度的材料(亦即第二灵敏度接近0或等于0)。更具体地,在本发明的一实施例中第一导电材料1C为铂,而第一工作电压范围建议为0.2伏特(V)至0.8伏特(V),且较优选为0.4V至0.7V,第二导电材料2C为碳,而第二工作电压范围建议为0.2V至0.8V,且较优选为0.4V至0.7V。但在本发明的另一实施例中,第一导电材料1C为铂,且第二导电材料2C为金。必须说明的是,上述铂的形态可为铂金属、铂黑(Platinum black)、铂膏(Platinum paste)、其他含铂材料或其组合。此外,第一工作电压的数值可与第二工作电压的数值相同,但本发明不以此为限。
接着,请参阅图11与图12进一步说明如何操作本发明的微型生物传感器10,其中图11为控制本发明图9(A)所示的微型生物传感器10的电压并测量电流的电路的范例的示意图,而图12为本发明降低微型生物传感器10进行量测时所产生的干扰的方法流程图。在图11中,电流感测单元201会连接至微型生物传感器10的第一工作电极120,且另一电流感测单元202会连接至对电极160。电流感测单元201、202分别量测来自第一工作电极120及对电极160的电流信号i1、i3。i2是第二工作电极130的电流信号,亦可被其他电流感测单元量测(图未示出)。在此范例中,第一工作电压为第一工作电极120的电位V1与对电极160的电位V3间的差值,且第二工作电压为第二工作电极130的电位V2与对电极160的电位V3间的差值。开关S1、S2可分别决定第一工作电极120及第二工作电极130是否通电压。而本发明的降低量测干扰的方法如图12所示包括提供微型生物传感器(步骤101),执行去干扰动作(步骤102),以及执行量测动作(步骤103)。本发明的去干扰动作与量测动作存在时间关系,其间可能的操作时序分别为:
第一种时间关系:本发明的微型生物传感器会于期间T(如2周)内进行量测,且期间T包含多个第一子时间(T1)区段及/或多个第二子时间(T2)区段,在第一子时间(T1)区段时执行去干扰动作,在第二子时间(T2)区段时执行量测动作,且去干扰动作及量测动作皆为间隔进行。也就是说,执行方式依序为在第一个T1区段执行第一次去干扰动作以消耗干扰物、在第一个T2区段执行第一次量测动作以输出对应当时生理参数的第一生理信号、在第二个T1区段执行第二次去干扰动作以消耗干扰物、再于第二个T2区段执行第二次量测动作以输出对应当时生理参数的第二生理信号,依此类推,以得到生理参数在期间T中各个T2区段的所有表现。请参考图13(A)至图13(C),其中横轴为时间,纵轴为电流,其中量测时序的线条表示第一工作电压的施加和移除,而去干扰时序的线条表示第二工作电压的施加和移除。在第一种时间关系中,T1区段与T2区段可以部份重叠(如图13(A)所示)、不重叠(如图13(B)所示)、或完全重叠(如图13(C)所示)。在期间T中,任两个T1区段间可利用移除该第二工作电压的方式停止去干扰动作以作为区隔,且在任两个T2区段间也可利用移除第一工作电压的方式停止量测动作以作为两个T2区段间的区隔。第一种时间关系中,T2区段的长度以能使电流信号对应生成物的浓度并与生理参数间呈比例关系为条件,而T1区段的长度可以与T2区段的长度相同或比T2区段的长度长,以达到有效去除干扰为目标。
此外,如图13(A)或图13(B)所示,第一次去干扰动作较优选地可比第一次量测动作早执行或同时执行,以有效地避免体内该干扰物对于该量测的干扰。也就是说,当有多次量测动作时,去干扰动作至少执行一次且其较优选地启动在不晚于各多次量测动作的第一次量测动作开始时。
第二种时间关系:本发明的微型生物传感器会于期间T(如2周)内进行量测,且期间T包含多个子时间区段,在整个期间T执行去干扰动作,并在各个子时间区段执行量测动作,且量测动作为间隔进行。也就是说,请参阅图14,第二种时间关系为在整个期间T内不间断地执行去干扰动作以消耗干扰物直到期间结束,于此同时在第一个子时间区段执行第一次量测动作以输出对应当时生理参数的第一生理信号,且执行第一次量测动作后隔一段时间再于在第二个子时间区段执行第二次量测动作以输出对应当时生理参数的第二生理信号,依此类推,以得到生理参数在期间T中各个子时间区段的所有表现。在期间T中,任两个子时间区段间可利用移除第一工作电压的方式停止量测动作,以作为间隔。第二种时间关系中,各个子时间区段的长度可以相同或不相同,且其长度同样地以使电流信号能对应生成物的浓度并与生理参数间呈比例关系为条件。
第三种时间关系:虽未图示,但第三种时间关系与第二种时间关系不同的是,第三种时间关系为在整个期间T不间断地执行量测动作,在各个子时间区段时执行去干扰动作,也就是说去干扰动作为间隔进行。
第四种时间关系:请参考图15,本发明的微型生物传感器会于期间T(如2周)内进行量测,且在整个期间T内不间断地执行量测动作,且同时也不间断地执行去干扰动作直至期间结束,以连续去除干扰物及量测生理参数。
体外(In vitro)去干扰试验
[试验例]
在试验例中使用具有第一实施例的双工作电极结构的微型生物传感器进行量测,其中第一感测段为覆盖有铂黑的碳电极、第二感测段为碳电极、第一工作电压为0.5V、以及第二工作电压为0.5V、且干扰物为乙酰胺酚。
[比较试验例]
在比较试验例中所使用的微型生物传感器与试验例相同,但不施加第二工作电压。由于不施加第二工作电压,第二感测段131不会被驱动,故仅有第一感测段121的量测范围1S,如图16所示。
接着,利用本发明的微型生物传感器进行体外去干扰试验的方式如下。首先,将试验例与比较试验例的微型生物传感器分别于不同时间区间(P1至P9)依序浸入分别含有磷酸盐缓冲生理盐水(PBS)溶液、40mg/dL葡萄糖溶液、100mg/dL葡萄糖溶液、300mg/dL葡萄糖溶液、500mg/dL葡萄糖溶液、100mg/dL葡萄糖溶液、掺入2.5mg/dL乙酰胺酚的100mg/dL葡萄糖溶液、100mg/dL葡萄糖溶液及掺入5mg/dL乙酰胺酚的100mg/dL葡萄糖溶液,试验结果如图17所示,其中在试验例中于第一感测段121所测得的电流信号为曲线C1,于第二感测段131所测得的电流信号为曲线C2,而在比较试验例中于第一感测段121所测得的电流信号为曲线C3。
从图16的时间区间P1至P5中可以看出,不论是试验例还是比较试验例的第一感测段在不同时间区段都会随着不同浓度的葡萄糖产生不同强度的电流信号,也就是说第一感测段的电流信号与生理参数之间具有比例关系,但试验例的第二感测段则没有电流信号产生,表示第二感测段对葡萄糖经由酵素催化后所衍生的副产物过氧化氢的反应性非常低,接近0或等于0。接着,从曲线C3可以看出,当将比较试验例的微型生物传感器于时间区段P7浸入含有2.5mg/dL乙酰胺酚的100mg/dL葡萄糖溶液时,相较其于时间区段P3的电流信号,第一感测段121在时间区段P7所测得的电流信号显然受到乙酰胺酚的干扰而飘高,且量测受干扰的程度在将微型生物传感器于时间区段P9浸入含有5mg/dL乙酰胺酚的100mg/dL葡萄糖溶液时更为明显。反之,从曲线C1与曲线C2可以看出,当将试验例的微型生物传感器于时间区段P7浸入含有2.5mg/dL乙酰胺酚的100mg/dL葡萄糖溶液时,其电流信号与时间区段P3的电流表现一致,也就是说当以第二工作电压驱动第二工作电极130进行去干扰动作时,可降低第一感测段121受到乙酰胺酚影响的程度,即使提高乙酰胺酚的浓度亦然。从另一方面来看,因第二工作电极130的第二感测段131用以消耗乙酰胺酚,故其在PBS溶液及葡萄糖溶液皆没有电流信号,但当有乙酰胺酚时便会产生电流信号。由此可知,当量测环境(即前述量测范围)中有乙酰胺酚,第二感测段131会消耗乙酰胺酚,降低第一感测段121的量测受乙酰胺酚干扰的可能。藉此,本发明的微型生物传感器可以量测出更准确的生理参数。
体内(In vivo)去干扰试验
在体内去干扰试验中同样使用具有本发明第一实施例的双工作电极架构的微型生物传感器进行量测,其中第一感测段为覆盖有铂黑的碳电极、第二感测段为碳电极、第一工作电压为0.5V、第二工作电压为0.5V。将微型生物传感器实际用于植入人体皮下以持续监测组织间液中的葡萄糖浓度,并于第86小时的时候服用1g普拿疼(其主要成分为乙酰胺酚),量测有去干扰机制与无去干扰机制的数据,并与传统血糖仪(Blood Glucose Meter,BGM)比较,其实验结果如图18(A)-18(B)所示,其中图18(A)为无去干扰机制的量测曲线,图18(B)为有去干扰机制的量测曲线。
在图18(A)-18(B)中,黑点为传统血糖仪所测得的数值,虚线为本发明微型生物传感器中第一工作电极的量测曲线,且实线为本发明微型生物传感器中第二工作电极的量测曲线。从图18(A)图中可以看出当没有开启去干扰功能时,在第90-96小时左右本发明微型生物传感器的第一工作电极所量测的数值均有飘高的现象(即服用1g普拿疼后4-6小时反应时间)。相反的,图18(B)图中可以看出若开启去干扰功能,本发明微型生物传感器的第二工作电极会测得相对应的电流值,且第一工作电极的量测数值无飘高的现象并可与传统血糖仪的数值相匹配。
另外,当微型生物传感器有开启去干扰功能时,其于无药物干扰期间的平均误差值为0.1mg/dL,于药物干扰期间的平均误差值为-2.1mg/dL,总误差值为-1.1mg/dL,而于药物干扰期间的平均绝对相对偏差值(Mean Absolute Relative Difference,MARD)为4.6。当微型生物传感器没有开启去干扰功能时,其于无药物干扰期间的平均误差值为-0.2mg/dL,但于药物干扰期间的平均误差值为12.6mg/dL,总误差值为6.7mg/dL,而于药物干扰期间的平均绝对相对偏差值为10.6。由此可知,藉由第二工作电极130的第二感测段131消耗干扰物的动作确实可以降低干扰物对第一感测段121量测生理信号的影响至小于或等于一误差范围,如20%,且更具体地为10%。综上所述,本发明将微型生物传感器中的第二感测段邻设于第一感测段的至少一侧边,使第二感测段得以直接且连续地消耗第一感测段周遭的干扰物,进而降低干扰物对第一感测段的量测干扰,使微型生物传感器可以量测出更准确的数据。
本发明实属难能的创新发明,深具产业价值,援依法提出申请。此外,本发明可以由所属技术领域中具有通常知识者做任何修改,但不脱离如所附申请专利范围所要保护的范围。
【符号说明】
10:微型生物传感器
110:基板
111:表面
112:对侧表面
113:第一端
114:第二端
115:信号输出区域
116:感测区域
117:绝缘区域
118:孔洞
120:第一工作电极
121:第一感测段
122:第一信号输出段
123:第一信号连接段
130:第二工作电极
131:第二感测段
132:第二信号输出段
133:第二信号连接段
140:绝缘胶
150:化学试剂层
160:对电极
170:参考电极
S101-S103:步骤
1C:第一导电材料
2C:第二导电材料
1S:量测范围
2S:去干扰范围
- 微型生物传感器及其用于降低量测干扰的方法
- 光学量测系统和量测从微型组件所发出的光的方法
