改进生物分析测定中的电化学发光信号的方法
文献发布时间:2023-06-19 10:16:30
技术领域
本发明涉及生物分析测定的改进,特别是采用离域发光基团的电致化学发光或电化学发光(ECL)的免疫分析和核酸分析。
背景技术
基于生物亲和性的生物分析测定,如免疫分析和DNA探测,在很大程度上依赖于标记技术,借助于标记技术,产生信号的单元通过共价键被连接至可与测定程序中的被测物特异性结合的生物分子的某些功能基团上。在一些竞争性的分析方法中,产生信号的单元通过共价键被连接在被测物分子上后,与样本中的被测物竞争其结合伴侣。在临床电化学发光(ECL)免疫分析中作为标记分子的是一种三联吡啶钌(II)的活性酯,如美国专利5,744,367和文献(G.F.Blackburnetal.,Clin.Chem.1991,37/9,1534-1539)中披露的[4-(N-琥珀酰亚胺基-氧羰基丙基)-4′-甲基-2,2′-联吡啶]双-(2,2′-联吡啶)钌(II)二六氟磷酸盐(图1A)。在发光基团三联吡啶钌[Ru(bpy)
Ru(bpy)
N(C
N(C
Ru(bpy)
Ru(bpy)
ECL免疫分析涉及到抗体(在夹心法中)或被测物(在竞争法中)如何被标记,被测物如何被捕获,ECL反应如何被触发以及工作电极如何再生等诸多技术细节。以ECL夹心法免疫分析为例,在一个典型的商业ECL分析中,使用图1所示的标记分子之一,用多个[Ru(bpy)
在一个特定的电压下(如相对于Ag/AgCl而言1.4V),[Ru(bpy)
事实上,反应路径一只是一种可以产生ECL的反应路径。其它可能的反应路径(如以下反应路径二至四)也被提出来解释不同条件下激发态[Ru(bpy)
Ru(bpy)
Ru(bpy)
N(C
Ru(bpy)
Ru(bpy)
Ru(bpy)
N(C
N(C
Ru(bpy)
Ru(bpy)
Ru(bpy)
N(C
N(C
Ru(bpy)
Ru(bpy)
Ru(bpy)
必须指出的是,在夹心法免疫分析中,Ru(bpy)
本发明提供一种释放(解脱、离域化或自由化)受束缚的ECL发光基团的方法,让激发态,如Ru(bpy)
发明内容
本发明提供一种方法用以将生物分析测定中处于局域状态的或固定状态的ECL发光基团释放出来。采用均相溶液中的离域的发光基团,而不是固定在固相表面的发光基团,ECL信号得以增强。本发明中的ECL发光基团采用钌(II)配合物作为示例,但其它ECL发光基团,如有机化合物和含锇、铂、铼、铱等金属的配合物也在专利范畴内。
附图说明
将结合以下附图描述本发明,在以下附图中,相同的附图标记表示相同的要素,并且其中:
图1中显示了美国专利5,744,367(A)、美国专利6,808,939(B)、WO2014203067A1(C,在本发明中用作对比标记物并表示为Ref)和美国专利申请US2016/0145281A1(D)中公开的ECL标记分子;
图2示出了三正丙胺产生仲胺(CH
图3示出了本发明的ECL标记物的四个实例--(A)具有与一个胺N中心连接的两个钌(II)配合物发光基团的阳离子标记物;(B)具有与一个胺N中心连接的两个钌(II)配合物发光基团的阴离子标记物;(C)具有连接到一个胺N中心的两个钌(II)配合物发光基团的电中性标记物;(D)具有与一个胺N中心连接的两个铱(III)配合物发光基团的电中性标记物。圆圈部分是在本发明范围内定义的ECL发光基团。
图4示出了本发明在夹心法免疫分析中的应用;
图5示出了使用电化学脱烷基过程从被标记的抗体中释放包含ECL发光基团的片段,所述被标记的抗体在免疫分析的ECL产生过程中被固定在磁微珠上;
图6示出了本发明中在竞争性免疫分析中的应用--(A)样品中的被测物与被标记的被测物竞争;(B)样品中的被测物与生物素化的被测物竞争。
图7是带有多个钌(II)配合物发光基团的具有不同等级N中心的ECL标记物的示例;
图8是包含ECL发光基团的可能片段的示例,根据本发明,这些片段可以从具有不同等级的N中心的标记物中释放。
图9是根据本发明的一个实施方案中具有两个钌配合物发光基团的标记物的制备图示;
图10是多胺树枝状标记物的汇聚型合成方法的图解,所述多胺树枝状标记物的外围具有多个钌(II)配合物发光基团;
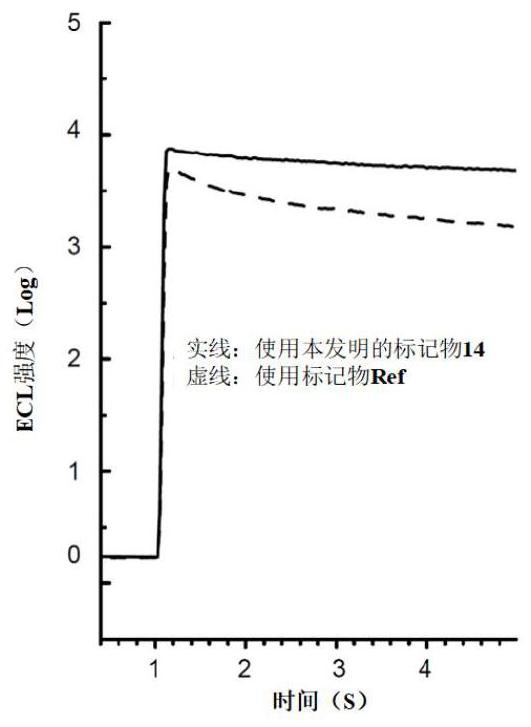
图11是从负载夹心免疫配合物的磁珠20(标记有14的抗体)上分离的钌配合物发光基团产生的ECL信号图。图中指示了抗原浓度。
图12是从负载夹心免疫复合物的磁珠20(标记为14的抗体)上分离的钌配合物发光基团和固定的钌配合物发光基团(标记为Ref的抗体)产生的ECL信号图。
具体实施方式
除非另有说明,否则本文描述的方法实践通常将包括在本领域现有技术范围内的分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学、抗体工程学和免疫学的常规技术。此类技术在文献中有充分的解释,例如“生物偶联技术”(G.T.Hermanson,Elservier,Amsterdam,2008),“分子克隆:实验室手册”,第二版(Sambrook等,1989);“寡核苷酸合成”(M.J.Gait编辑,1984);“动物细胞培养”(R.I.Freshney编辑,1987年);“酶学方法”(AcademicPress,Inc.);“分子生物学当前技术”(F.M.Ausubel等人,编辑,1987年,定期更新);“PCR:聚合酶链反应”(Mullis等,编辑,1994)。
除非另有定义,否则本文所用的技术和科学术语具有与本文所述的方法、试剂组合物和试剂盒所属领域的普通技术人员通常所理解的含义相同的含义。Wild,D.等人,《免疫测定手册》,第4版,Elservier,阿姆斯特丹(2013);Singleton等人,《微生物学和分子生物学词典》,第2版,J.Wiley&Sons,纽约(1994);March,《高级有机化学反应、机理和结构》,第四版,约翰·威利父子出版社,纽约(1992年);Lewin,B.,GenesV,牛津大学出版社(1994)出版,ISBN0-19-8542879;Kendrew,J.等人,《分子生物学百科全书》,由布莱克韦尔科学有限公司出版(1994),ISBN0-632-02182-9;和RA,Meyers,R.A.等人,《分子生物学和生物技术:综合桌面参考书》,出版社为VCHPublishers,Inc.(1995),ISBN1-56081-5698,就本申请中使用的许多术语,为本领域技术人员提供了一般指导。本文引用的所有参考文献,包括专利申请和出版物,通过引用整体并入本文。
这里,术语“解脱”、“离域”、“释放”、“自由化”和它们的动名词形式(“-ing”形式)或名词形式有时可互换使用。在本发明的范围内,解脱(离域、释放或自由化)一个“发光基团”或“ECL发光基团”或“钌配合物发光基团”是指将一个光产生单元从其固定在固相表面上的固定状态转变成在均相溶液中可移动或自由的状态。
本发明其范围内被称为“标记物”、“标记物分子”、“钌(II)标记物”和“ECL标记物”的物质可与其他物质共价键结合,该其他物质如生物活性被测物或其类似物、基于生物亲和性的被测物识别伴侣或其类似物(例如被测物特异性试剂)、以及上述识别伴侣的其他结合伴侣、或一种能够与被测物形成共价键的反应性化学物质、或如上所述的其类似物或其结合性伴侣。上述物质也可以与一种或多种结合伴侣和/或一种或多种反应性组分的组合结合。另外,上述物质也可被结合到与结合伴侣、反应性组分、或一种或多种结合伴侣和/或一种或多种反应性组分的组合连接的被测物或其类似物上。将多个上述物质直接结合或通过如上所述的其他分子结合至被测物或其类似物也在本发明的范围内。
如本文所用,术语“标记物”是指任何化学或生化物质,其本身或通过与其他试剂的物理/化学相互作用,产生能与目标被测物的量相关联的可检测信号(无论是可见的信号还是通过使用合适的仪器可检测的信号)。标记物包括但不限于含有放射性原子(放射性)的分子、发光化合物(通过光激发或通过化学反应发光)、电活性化合物(通过氧化还原反应生成电信号)、磁性颗粒(磁信号)、酶(通过与底物的反应生成可检测的物质或光学信号)、酶或酶促底物(催化化学/生化反应)。一种标记物可以由一个或多个信号产生单元和一个或多个反应性基团组成。后者容易与要标记的化学或生化分子形成共价键。
可以测量的被测物包括但不限于全细胞、细胞表面抗原、蛋白质配合物、细胞信号传导因子和/或组分、第二信使、第二信使信号传导因子和/或组分、亚细胞颗粒(例如、细胞器或膜碎片)、病毒、朊病毒、尘螨或其片段、类病毒、免疫因子、抗体、抗体片段、抗原、半抗原、脂肪酸、核酸(和合成类似物)、核糖体、蛋白质(和合成类似物)、脂蛋白、多糖、抑制剂、辅因子、半抗原、细胞受体、受体配体、脂多糖、糖蛋白、肽、多肽、酶、酶底物、酶产物、核酸加工酶(例如聚合酶、核酸酶、整合酶、连接酶、解旋酶、端粒酶等)、蛋白质加工酶(例如蛋白酶、激酶、蛋白磷酸酶、泛素蛋白连接酶等)、细胞代谢产物、内分泌因子、旁分泌因子、自分泌因子、细胞因子、激素、药理学药物、药物、治疗药物、合成有机分子、有机金属分子、镇定剂、巴比妥酸盐、生物碱、类固醇、维生素、氨基酸、糖、凝集素、重组或衍生蛋白、生物素、亲和素、链霉亲和素或样品中存在的无机分子。
根据本发明方法和试剂,一种“被测物特异性试剂”(ASR)必须理解为具有特异性结合被测物的能力的分子或生物分子(例如,一种蛋白质或抗体)。“被测物特异性试剂”(ASR)是一类生物分子,可用于识别和测量生物样本中个别化学或生物化学物质的量。ASR是例如抗体、多克隆抗体和单克隆抗体、特异性受体蛋白、配体、核酸序列和类似试剂,它们通过与样品中的物质发生特异性结合或特异性化学反应,旨在诊断应用中用来对生物样本中的个别化学或生物化学物质或配体进行鉴定和定量。简而言之,ASR是一种分析测定中的活性成分。ASR将满足亲和性和特异性结合被测物的标准。
根据本申请,“检测试剂”包括标记有至少两个ECL发光基团的被测物特异性试剂(ASR)、或标记有至少两个ECL发光基团的被测物类似物/同源物。根据测试形式,本领域技术人员已知,必须为各种分析形式(例如夹心法分析、双抗原桥接分析(DAGS)、竞争性分析、均相分析、非均相分析)选择哪种检测试剂。例如非均相免疫分析中的检测试剂可以是至少两个ECL发光基团标记的抗体。本领域技术人员已知,在分析中,检测试剂最终固定在固相上。在一个实施方案中,用于通过ECL检测来测量样品中的被测物的方法可以以均相分析来进行。在一个实施方案中,该方法可以以非均相分析来进行。在一个实施方案中,该方法可以夹心法分析形式进行。在一个实施方案中,该方法可以竞争性分析形式进行。在一个实施方案中,该方法也可以双抗原桥接分析形式(DAGS)进行。已知的免疫测定形式在以下书籍中有详细的描述:C.P.Price和D.J.Newman,《免疫测定的原理和实践》,第二版,纽约州斯托克顿出版社(1997);D.Wild等人,《免疫测定手册》,第4版,Elservier,阿姆斯特丹(2013);以及E.P.Diamondis和T.K.Christopoulos,《免疫测定》,圣地亚哥,学术出版社(1996)。
术语“发光”是指不从能量源(例如,电磁辐射源、化学反应、机械能)的温度变化获得能量的任何光发射。通常,能量源使原子的电子从低能态转变为“激发”高能态;然后电子在回落到较低能量状态时以发射光的形式释放该能量。这种光的发射通常发生在电磁光谱的可见光谱或近可见光谱范围内。术语“发光”包括但不限于诸如磷光、荧光、生物发光、放射线发光、电致发光、电化学发光和热致发光的发光现象。
在本发明的范围内,术语“发光基团”是指化合物中负责产生发光现象的官能团。在具有复杂结构的化合物中,例如,具有多个官能团(例如,反应性基团、亲水/疏水/两亲基团、吸电子/供电子基团、电平衡基团、间隔基团、连接基团、支化基团等)的结构,发光基团是产生发光现象所需的最小结构部分(例如,参见图3中的圆圈部分)。
术语“发光标记物”是指由一个或多个发光基团和一个或多个反应性基团组成的标记物,其易于与待标记的化学或生化分子形成共价键。发光标记物可以是例如荧光分子、磷光分子、放射发光分子、本发明中的电化学发光分子(即,ECL标记物)、或在点表面上具有反应性基团的量子点。具有一个发光基团和一个反应基团的电化学发光(ECL)标记物的例子在现有技术中被最频繁地公开(参见,例如,图1中的标记物和WO2003002974A2,WO2014203067A1中的其他钌配合物标记物和WO2014019711A1中的铱配合物标记物)。在US2005/0059834A1中公开了具有三个发光基团(三个钌配合物单元)和一个反应性基团(-COOH或NHS酯)的发光标记物的例子。美国专利6140138公开了具有一个发光基团(一个钌配合物)和两个反应性基团(-COOH或NHS酯)的发光标记物的例子。
“电化学发光分析法”或“ECL分析法”是从ECL发光基团通过电化学途径产生发光信号的一种分析方法。工作电极和参比电极之间的一个电压以电化学方式启动与结合到ASR或被测物类似物/同源物的ECL发光基团发光。从ECL发光基团发出的光由光电探测器测量,并指示目标被测物的存在或数量。例如美国专利No.5,543,112、5,935,779、和6,316,607中描述了ECL方法。信号调制可以最大化不同的被测物浓度,以进行精确而灵敏的测量。
在ECL分析程序中,可以将微粒悬浮在样品中以有效结合被测物。例如,颗粒可具有0.05μm至200μm、0.1μm至100μm、或0.5μm至10μm的直径,并具有能够结合被测物分子的表面组分。在一种经常使用的ECL分析系统(德国罗氏诊断公司
根据本申请,“试剂构成”或“ECL试剂构成”包含支持ECL信号产生的试剂,例如共反应剂、用于pH控制的缓冲剂、表面活性剂、防腐剂或抗菌剂、以及可选的其他组分。技术人员知道在电化学发光检测方法中产生ECL信号所需的试剂构成中存在的组分。
如本文所用,“水溶液”是溶解于水中的颗粒、物质或液体化合物的均相溶液,或具有悬浮在水溶液中的微粒(直径从0.05μm至200μm)的非均相悬浮液。水溶液也可以包含有机溶剂。有机溶剂是本领域技术人员已知的,例如胺、甲醇、乙醇、二甲基甲酰胺或二甲基亚砜。如本文所用,还应理解,水溶液可包含至多50%的有机溶剂。
在本文中,与ECL标记物共同参与ECL过程的物质被称为ECL“共反应剂”。ECL常用的共反应剂包括叔胺(例如三正丙胺(TPA))及其类似物/同系物(例如2-(二丁基氨基)乙醇等)、草酸盐和过硫酸盐。本领域技术人员知道可用于ECL检测方法的可得的共反应剂。
“固相”,也称为“固体载体”,是不溶的、功能化的、聚合的或非聚合的材料,化合物成员或试剂可以被附着或通过共价结合(通常通过连接子)到该材料上,以被固定或使它们易于与过量试剂、可溶性反应副产物、或溶剂分离(通过过滤、离心、洗涤等)。用于本文所述的方法中的固相被广泛描述于现有技术中(参见,例如,J.E.Butler,Methods,2000,22,4-23)。术语“固相”是指非流体物质,并且包括:颗粒(包括微粒和珠子),由诸如聚合物、金属(顺磁性、铁磁性颗粒)、玻璃、和陶瓷的材料制成;凝胶物质,例如二氧化硅、氧化铝、和聚合物凝胶;毛细管,其可以由聚合物、金属、玻璃和/或陶瓷制成;沸石和其他多孔物质;电极;微量滴定板;固体条;以及比色皿、试管、薄片或其他光谱仪的样品容器。分析过程中的固相组分不同于所述分析过程可能接触到的惰性固体表面之处在于,“固相”在其表面上含有至少一个旨在与捕获抗体或捕获分子相互作用的结构部分。固相可以是固定的成分,例如试管、条、比色皿、薄片、或微量滴定板,也可以是非固定的成分,例如珠子和微粒。微粒也可以被用作均相分析形式的固相。可以使用允许蛋白质和其他物质通过非共价或共价连接与其连接的多种微粒。这样的颗粒包括聚合物颗粒,例如聚苯乙烯和聚(甲基丙烯酸甲酯);金粒子,例如金纳米粒子和金胶体;以及陶瓷颗粒,例如二氧化硅、玻璃和金属氧化物颗粒。参见例如C.R.Martin等人,AnalyticalChemistry-News&Features,1998,70,322A-327A,,其通过引用并入本文。
如本文所用,“过渡金属配合物”涉及包含与合适的络合剂络合的过渡金属离子的ECL发光基团。在一个实施方案中,过渡金属选自由钌、铱、铼、锇、铕、铽、镝组成的集合;在另一个实施方案中,过渡金属是钌、铱、铼、或锇;在进一步的实施方案中,过渡金属是钌或铱。
作为说明,如现有技术(WO2003002974,WO2014203067A1,WO2014019711A1)和文献中通常所见,钌(II)或铱(III)配合物由一个通式表示。
M
其中M是钌(II)或铱(III);L
例如,在WO8706706A1、WO2003002974、EP720614(A1)和WO2014203067A1中公开了带有反应性基团或可生物共轭基团的过渡金属配合物ECL发光基团。在一个实施方案中,ECL发光基团选自现有技术中公开的阳离子ECL标记物。例如,双-(2,2′-联吡啶)[4-(N-琥珀酰亚胺基-氧羰基丙基)-4′-甲基-2,2′-联吡啶]钌(II);
Ru(bpy)
如上所述,发光基团是产生发光现象所需的最小结构部分。在本发明的范围内,ECL发光基团是在电化学激发下产生ECL所需的最小结构部分(例如,参见图3中的圆圈部分)。本领域技术人员已知,各种亲水/疏水/两亲基团、吸电子/供电子基团、电平衡基团、间隔基团、连接基团、支化基团等可以结合到络合剂L
其中R
在另一个实施方案中,ECL发光基团是铱配合物,并且选自下面的ECL标记物。Ir(6-苯基菲啶)
例如,在下面的结构中示出了用一个或多个取代基修饰的这些和其他铱配合物ECL发光基团(参见US2016/0145281A1)。
其中R
本发明提供了一种在ECL产生过程之前或期间从固定状态电化学释放ECL发光基团或含有一个或多个ECL发光基团的片段的方法。
使用本领域中实践的合成化学,技术人员能够为ECL标记物制备适当官能化的结构构件,并且能够制备本发明的ECL标记物,例如本发明示例和图10中的ECL标记物8。
在本发明的一个实施方案中,ECL标记物包括至少两个过渡金属配合物ECL发光基团(相同或不同)。因此,检测试剂包含至少两个ECL发光基团和共价连接的第二化学/生化化合物。在另一个实施方案中,第二化学/生化化合物是生物大分子。在另一个实施方案中,第二化学/生化化合物是如上所述的一种被测物特异性试剂。在另一个实施方案中,第二化学/生化化合物是一种被测物类似物/同源物或衍生物。
与经历了上述循环Ru(bpy)
基于以下事实:叔胺的电化学氧化以三种不同方式导致脱烷基化并最终导致仲胺的产生,一个适当设计的ECL标记物分子将结合至少一个叔胺结构部分,其中胺氮被两个–CH
在图4中,信号抗体被本发明的ECL标记物,例如图3中的任一标记物,标记成为检测试剂。将样品与检测试剂、捕获抗体和磁微珠混合后,在磁微珠表面形成抗体/抗原(被测物)/抗体夹心复合物。箭头表示本发明的ECL标记物的三个可电化学断裂的C-N键。按照图2中的反应路径,当启动ECL过程时,三个C-N键之一被打断。如图5所示,N中心的电氧化产生许多中间体,并且最终将含有一个或两个ECL发光基团的片段释放到溶液相中。
同样地,在图6A的竞争性免疫分析中,用本发明的标记物标记被测物而不是标记信号抗体,以使其成为检测试剂。所述被标记的被测物与通过磁微珠表面的链霉亲和素涂层而固定在磁微珠的表面上生物素化的捕获抗体形成复合物。类似地,当启动ECL过程时,三个C-N键之一会断裂,从而将包含一个或两个ECL发光基团的片段释放到溶液相中。在竞争性免疫分析中,样品中被测物的浓度与ECL信号强度成反比。
图6B是竞争性免疫分析的另一种形式。生物素化的被测物与样品中的被测物竞争,以与被标记的信号抗体结合形成抗原(被测物)/抗体复合物。在将磁微珠添加到混合物中之后,仅生物素化的被测物/抗体复合物通过强的生物素/链霉亲和素结合反应被固定在磁微珠的表面上,然后在磁场的作用下保持在工作电极的表面上。根据图2中的反应路径,标记物N中心的电氧化导致三个C-N键中一个断裂,并最终释放出包含一个或两个ECL发光基团的片段。
在一个实施例中,本发明涉及一种检测样品中被测物的方法,该方法包括以下步骤:
a)将所述样品与检测试剂一起孵育以提供结合有被测物的检测试剂,
其中,所述样品中含有被测物,
其中,所述检测试剂被一个或多个ECL标记物标记;
其中,每个所述ECL标记物含有至少一个式1的片段:
其中R
其中ECL发光基团是过渡金属配合物,并且
其中所述结合有被测物的检测试剂被固定在固相上;
b)将所述结合有被测物的检测试剂与未结合被测物的检测试剂和其他未固定化的物质分开,以提供分开的结合有被测物的检测试剂,其中,所述分开的结合有被测物的检测试剂被固定在所述固相上;
c)使所述分开的结合有被测物的检测试剂与缓冲水溶液接触,其中该缓冲水溶液包含至少一种叔胺;
d)电化学触发ECL发光基团和所述叔胺的氧化,从而释放ECL信号;和
e)检测所述电化学发光信号,从而检测所述被测物。
在一个实施例中,该方法进一步包括通过用一个或多个ECL标记物标记被测物特异性试剂来提供检测试剂的初始步骤。
在另一个实施例中,该方法还包括通过用ECL标记物标记被测物或被测物类似物/同源物/衍生物来提供所述检测试剂的初始步骤。
在另一个实施例中,该方法还包括以下步骤:
f)定量化被测物。
在另一个实施方案中,所述ECL基团R
在另一个实施例中,R
在另一个实施方案中,所述叔胺是烷基叔胺。在另一个实施方案中,所述叔胺是支链胺。在另一个实施方案中,所述叔胺是三正丙胺、三丁胺、或三乙胺、或N,N-二丁基乙醇胺。
在另一个实施方案中,所述被测物特异性试剂是单克隆抗体。
在另一个实施方案中,所述被测物特异性试剂是所述被测物或其类似物的蛋白质或核酸识别伴侣。
在另一个实施方案中,所述被测物特异性试剂是被测物的类似物/同源物/衍生物。
在另一个实施方案中,所述叔胺至少超过所述ECL标记物的浓度的10倍。例如,所述叔胺浓度为10μM至1M,优选10mM至500mM。
如上所述,本发明提供了包含可电化学分离的发光基团的ECL标记物,该发光基团可以在生物分析测定的信号产生过程中从固体表面释放出来。本发明还提供了一种在ECL标记物分子中并入叔胺结构单元以在ECL产生过程中实现电化学分离ECL发光基团的方法。
一方面,本发明中使用的ECL标记物包含式1的一个片段。例如,两个ECL基团和可生物偶联的基团通过三烷基胺N中心连接以形成本发明的式2标记物。
其中,Y
如上所述,Y
另一方面,本发明提供了一种ECL标记物,其包含多个式1的片段,并因此包含多个ECL发光基团。具体来说,两种类型的此类标记物具有以下特征:(1)仅带有外围N中心的分支骨架,每个N中心都与两个ECL发光基团相连(I型);和(2)由作为支化点的等级分级的N中心构成的分支骨架,并且仅每个外围的N中心连接两个ECL发光基团(II型)。在优选的实施方案中,所述ECL发光基团是上述含有钌(II)和铱(III)的配合物。
本发明的I型ECL标记物可通过将式2的标记物(图3所示)与分支骨架连接而制备得到,分支骨架例如为修饰的季戊四醇骨架(在Anal.Chem.,2003,75,6708-6717中描述的)、α-聚赖氨酸、或在序列中具有多个赖氨酸残基的肽。在ECL过程中进行电化学脱烷基后,用式2的ECL标记物(也在图3中示例出)或I型ECL标记物标记的检测试剂将分解为如图5的底部方框所显示的包含一个或两个ECL发光基团的自由片段。
II型ECL标记物通常是具有树枝状结构的分子。图7示出了本发明的II型ECL标记物的两个实施方案,其中,由等级分级的N中心作为支化点构成树枝状骨架,并且仅外围的N中心各自连接至两个作为ECL发光基团的钌配合物单元。
在ECL过程中电化学脱烷基后,用II型ECL标记物标记的检测试剂将在ECL免疫分析中引起更复杂的断裂。由于每个等级分级的N中心都将进行脱烷基反应,因此许多不同的片段(其包含不同数量的发光基团(如图8所示))将被从固体表面释放出来并迁移到溶液相中以产生ECL。此外,在溶液相中,含有一个或多个三烷基N中心的较大片段继续进行脱烷基过程并产生较小的片段。
图7中的II型ECL标记物分子可以通过通常在树枝状聚合物合成中使用的发散型或汇聚型方法来合成(请参阅F.
一个实施方案是基于发散-迭代途径导致在其外围具有多个氨基(-NH
汇聚型-迭代途径从外围向内至焦点开始合成。首先将所述ECL发光基团并入分支结构单元中。在基于汇聚型合成策略的一个实施方案中,将N
图9和图10示出了如何在汇聚型合成中将等级不同的胺N中心和多个金属配合物(例如Ru(bpy)
在另一个实施例中,本发明的ECL标记物可以被构造为同时具有上述I型和II型标记物的特征。例如,将式2的G1标记物(图3所示)用G2、G3或G4标记物代替,同时具有I型和II型特征的分子可以通过羧基标记物(例如,图10所示的G2、G3和G4)与如Anal.Chem.2003,75,6708-6717中所述的被修饰的季戊四醇骨架的酯化反应来合成。类似地,在另一个实施方案中,序列中具有多个赖氨酸残基的肽或α-聚赖氨酸可以被用作支链骨架以并入多个胺交联的(在G2、G3和G4标记物中的)ECL发光基团,这通过在图10所述的标记物和所述支链骨架之间形成酰胺键而实现。
通过在ECL过程中释放被固定的发光基团,本发明解决了现有技术中(M.Zhouetal.,Macromolecules2001,34,244–252;M.Zhouetal.,Anal.Chem.2003,75,6708-6717;M.Staffilani,etal.,Inorg.Chem.2003,42,7789-7798.)与密集组装的发光基团的有限可及性相关的问题,并因此使以前专利US2005/0059834A1和CA2481982A1公开的单点多标记方法重新焕发活力。如前所述,与被固定的或被结合的发光基团相比,自由化的发光基团或含有发光基团的游离片段更容易被接近且反应性更强。因此,可以从均相溶液中产生更高水平的ECL信号。此外,令我们惊讶的是,在ECL释放过程中,ECL随着时间衰减得更慢。
以下实施例阐述了本发明的精神。就是说-将一个或多个胺结构单元并入标记分子中,以便在电化学脱烷基反应时可以断开N中心的一个或多个C-N键,从而释放出一个或多个被固定的ECL发光基团进入溶液相以增强ECL信号。
1.N,N’-(((2-氨基乙基)氮烷二基)双(乙烷-2,1-二基))双(4-([2,2′-联吡啶]-4-基)丁酰胺)的合成(10)
将10.24g(70mmol)的化合物1在室温下溶解于150mL的无水THF中。向该溶液中缓慢滴加(Boc)
将2.42g(10mmol)的4-([2,2’-联吡啶]-4-基)丁酸溶解在40mL的无水DMF中。向该溶液中加入N-羟基琥珀酰亚胺(NHS,2.3g,20mmol)和N,N’-二环己基碳二亚胺DCC(4.2g,20.3mmol)。4小时后,过滤混浊的混合物。向滤液中加入1.1g(4.5mmol)的化合物2。将混合物在室温下搅拌过夜。旋转蒸发液体,得到黄色粗产物。经硅胶柱色谱纯化(20:1甲醇/二氯甲烷洗脱),得到2.7g白色固体化合物9(87%)。
将化合物3(2.7g)溶解在甲醇/水(1:2)溶液中,并将该溶液在冰/水浴中冷却30分钟。向该冷却的溶液中滴入4mL的浓盐酸。将混合物在冰/水浴中保持搅拌一小时,并在室温下再搅拌三小时。旋转蒸发液体,得到白色固体化合物10(氯化物)。
2.5-((2-(双(2--(4-([2,2'-联吡啶]]-4-基)丁酰氨基)乙基)氨基)乙基)氨基)-5-氧戊酸(11)的合成
将2.3g(3.87mmol)的化合物10和515mg(4.51mmol)的戊二酸酐混合在15mL的DMF中。将反应混合物在氮气环境下加热至50℃保持6小时。反应完成后,将溶剂DMF旋转蒸发。残余物经柱(硅胶)纯化,随后真空干燥,得到2.1g白色粉末化合物11(76%)。
3.(对-异丙基甲苯)(红菲咯啉二磺酸钠)RuCl
将在150mL甲醇中的[(对-异丙基甲苯)RuCl
4.(2,2'-联吡啶)(红菲咯啉二磺酸钠)二氯化钌(II)配合物(13)的合成
2,2'-联吡啶(0.355g,2.27mmol)和化合物12(1.785g,2.12mmol)与0.772g(18.2mmol)氯化锂在30mLDMF中混合。将该溶液在氮气下回流3.5小时。冷却至室温后,将深紫色溶液旋转蒸发,并将固体重新溶解在甲醇中。经硅胶柱色谱纯化,得到1.75g深紫色固体化合物(13)。
5.带有两个与胺单元相连的发光基团的标记物(14)的合成
将600mg(0.69mmol)的化合物13和213mg(0.3mmol)的化合物11溶解在40mL的甲醇/水(3:1)中,并将该溶液在氮气下回流3小时。在此过程中,颜色从深紫色变为亮橙色。将反应溶液过滤并浓缩至10mL,然后在硅胶柱上使用甲醇/水(2:1)进行色谱分离。通过旋转蒸发获得目标化合物,并真空干燥。产率520mg(76%)。
6.用标记物14标记甲胎蛋白(AFP)抗体(信号抗体)以形成检测试剂15
将3.4mg(1.5μmol)的标记物14溶解于500μLMES缓冲液(0.1molL
将以上获得的溶液(约500μL)加载到预先用PBS平衡的PD-10柱(装有Sephadex G-25介质,购自GEHealthcareLifeSciences)。分离过程中形成两个黄色带。收集对应于标记抗体即检测试剂15的第一条洗脱带(约750μL)。
为了确定实际的标记物与蛋白质的比率(偶联比率),使用Bradford或BCA蛋白质分析法对AFP抗体进行定量。基于标记物14的消光系数,标记物14在455nm处的吸光度与所述标记物的数量相关。在上述条件下,检测试剂15分子包含约5.5个标记物14的发光基团。
7.用Ru(2,2'-联吡啶)(红菲咯啉二磺酸盐)[4-(2,2'-联吡啶-4-基)丁酸]标记AFP抗体(图1中所示的电中性标记物,表示为Ref)以形成检测试剂16
将2.5mg(2.5μmol)的Ref以5.0mmolL
将以上获得的溶液(约0.5ml)加载到预先用PBS平衡的PD-10柱上。分离过程中形成两个黄色带。收集对应于标记抗体即检测试剂16的第一洗脱带(约0.75ml)。确定标记物Ref与抗体的结合比为6.1:1。
8.AFP捕获抗体的生物素化以形成生物素化的抗体17。
向含有2.1mg脱盐的AFP捕获抗体的2mLCBS缓冲液(pH9.5)中,加入20mM NHS-LC-生物素(MW454.54)DMF溶液的一等分试样(15μL),并孵育上述混合物1小时,然后在PBS缓冲液中透析总共20小时。通过BCA分析法将生物素化的AFP捕获抗体17的终浓度确定为1.72mg/mL。
10.与AFP检测试剂16(被Ref标记的抗体)相比,使用AFP检测试剂15(本发明的被标记物14标记的抗体)进行夹心法免疫分析。
用PBS缓冲液(pH6.0)将钌标记的(ruthenylated)AFP信号抗体15或16和生物素化的捕获AFP抗体17分别稀释至12μgmL
将1000μl的不同浓度AFP(被测物)的小牛血清溶液与20μl浓度为4.5μgmL
在每个免疫分析实验中的ECL信号衰减绘制在图11和12中。与Ref标记的抗体16相比,在测量时间范围内(图12中的四秒),检测试剂15(被本发明的标记物标记)表现出更强和更稳定的ECL信号。
根据前述说明书,本发明的这些和其他优点对于本领域技术人员将是显而易见的。因此,本领域技术人员将认识到,可以在不脱离本发明的广泛发明构思的情况下对上述实施例进行改变或修改。应当理解,本发明不限于在此描述的特定实施例,而是旨在包括在本发明的范围和精神内的所有改变和修改。
- 改进生物分析测定中的电化学发光信号的方法
- 用于提高基于固相的生物测定中信号可读性的信号产生和信号定位的方法
