DPC细胞鉴定分类用标记物基因、筛选方法及应用
文献发布时间:2023-06-19 10:19:37
【技术领域】
本发明涉及生物技术领域,具体涉及一种DPC细胞鉴定分类用标记物基因、筛选方法及应用。
【背景技术】
帕金森病(Parkinson's disease,PD)是一种发病率仅次于阿尔森海默症的神经系统退行性疾病,以老年人多见,平均发病年龄为60岁左右,目前无法治愈。帕金森病最主要的病理改变是中脑黑质多巴胺(dopamine,DA)能神经元的变性死亡,由此而引起纹状体DA含量显著性减少而致病,在临床上的具体表现为运动性症状,如静止性震颤、运动迟缓、肌强直和姿势步态障碍以及非运动性症状,如便秘、睡眠障碍、精神行为异常等。由于我国人口老龄化的加速来临,截至2014年底,我国60岁以上老年人口已经达到2.12亿,占总人口的15.5%。其中,老年神经退行性疾病,包括阿兹海默病(老年痴呆)和帕金森病,将成为困扰中国医疗系统的重大难题。据统计,我国60岁及以上人群中,帕金森病的比例为1%,而65岁以上的人群中帕金森病的比例上升到1.7%(Tian et al.,2011)。据此计算,我国仅帕金森病的患者就达到212万人,未来将达到400万人,是继肿瘤、心脑血管病之后中老年的“第三杀手”。目前,帕金森患者正趋于年轻化,青少年型帕金森病患者占总人数的10%。
老年神经退行性疾病源于神经细胞的衰老退化,一般认为,帕金森病是由于病人中脑多巴胺能神经元显著丢失引起的。目前主要以药物去补充或刺激脑内不足的左旋多巴,但药物治疗存在副作用多和长期应用后药效衰减的缺点。长期用药后,脑内神经元对药物的敏感性变差,可能会出现"异动症"或是"药效波动"。除了药物的治疗之外,帕金森临床手术治疗方式主要有两种:立体定向靶点射频损毁术(细胞刀)和深部脑核团刺激术(DBS)(Malek,2019),但均不能达到很好的疗效。目前,利用诱导干细胞(iPSC)来源,经神经干细胞定向分化而成的多巴胺能前体细胞(DPC)进行移植,对退化的多巴胺能神经元进行补充和替代,已成为干细胞再生医学的重点研究方向。然而,DPC细胞相比于神经干细胞具有相似的基因表达谱,通常神经细胞的分子标记很难对DPC细胞加以区分。
因此,挖掘一批在DPC和NSC细胞中具有表法差异的基因标志物,用于对临床治疗的DPC细胞产品进行鉴定分类,是DPC细胞临床应用中质量控制环节的关键节点之一。
【发明内容】
本发明要解决的问题是提供一种DPC细胞鉴定分类用标记物基因、筛选方法及应用,以用于对临床治疗的DPC细胞产品进行鉴定分类以及控制DPC细胞临床应用产品的质量。
鉴于此,实现本发明上述目的所采用的技术方案为:
标记物基因在DPC细胞鉴定分类中的应用,所述标记物基因为CRH,FST,GLI1,POSTN,PYCR1,RELN,SLC16A9,SLC7A2,ST8SIA3,SLC7A5,STK32B,FGF17中的一种或多种。
进一步,在上述应用中,使用所述标记物基因表达的RNA、编码的蛋白或生物学前体鉴定分类DPC细胞。
本发明的另一个目的在于,提供一种DPC细胞鉴定分类标记物基因的筛选方法,包括如下步骤:
1.分别提取iPSC细胞、NSC细胞和DPC细胞总RNA,并检测;
2.制备链特异性cDNA文库并进行库检;
3.测序并分析数据,获得RNA表达量上有差异的基因;
4.根据测得的差异表达基因群体,对基因的功能进行分析,筛选出调控神经细胞功能以或神经发育分化相关的基因。
进一步地,所述筛选方法得到标记物基因为CRH,FST,GLI1,POSTN,PYCR1,RELN,SLC16A9,SLC7A2,ST8SIA3,SLC7A5,STK32B,FGF17中的一种或多种。
进一步地,所述步骤2中制备链特异性cDNA文库的方法为:
A.富集真核生物mRNA,将mRNA打断成短片段,以mRNA为模板,用随机引物合成一链cDNA,再合成二链cDNA,纯化双链;
B.经末端修复加A尾并连接测序接头,再进行片段大小选择;
C.降解含有U的cDNA第二链;
D.PCR扩增,纯化产物,得到链特异性cDNA文库。
进一步地,所述步骤3为:将Clean reads与参考基因组序列进行比对,根据基因组的注释文件和reads比对到基因组的位置统计每个基因包含的reads数即表达量,然后进行统计检验获得差异表达基因,最后对差异表达基因进行功能注释及GO、KEGG富集检验,获得差异表达基因所富集的GO、KEGG集合。
进一步地,所述步骤4为:以表达量上升2.4倍作为阈值进行筛选DPC细胞特有的标志基因组合,对以上筛选出的基因功能进行分析,从中筛选与神经细胞发育分化或神经细胞功能相关的基因。
本发明的还有一个目的在于,提供一种检测试剂盒,包括根据标记物基因或标记物基因生物学前体设计的引物,所述标记物基因为CRH,FST,GLI1,POSTN,PYCR1,RELN,SLC16A9,SLC7A2,ST8SIA3,SLC7A5,STK32B,FGF17中的一种或多种。
本发明还有一个目的在于,提供所述试剂盒在检测DPC鉴定分类细胞标记物基因中的应用,所述试剂盒还可以用于制备帕金森病的诊断制剂。
进一步地,所述试剂盒包括核苷酸序列为SEQ ID No:1-2,SEQ ID No:3-4,SEQ IDNo:5-6,SEQ ID No:7-8,SEQ ID No:9-10,SEQ ID No:11-12,SEQ ID No:13-14,SEQ IDNo:15-16,SEQ ID No:17-18,SEQ ID No:19-20,SEQ ID No:21-22或SEQ ID No:23-24中的一组或多组引物。
进一步地,在上述应用中将所述试剂盒检测所述对应标记物基因的表达,优选地,所述检测方法为荧光定量PCR法、数字PCR法,基因芯片法,原位杂交法或流式细胞法中的一种。其中,所述的基因芯片法还包括核酸序列杂交的探针,所述核酸序列根据所述标记物基因或所述标记物基因的生物学前体设计。
相比现有技术,本发明的有益效果为:
1.本发明提供的标记物基因可作为对DPC细胞进行鉴定分类的标记物,还可以作为临床级DPC细胞制备中质量控制的检测标准,具有重要的应用价值。
2.本发明提供的标记物基因可用于制备帕金森的诊断制剂,检测方法包括用荧光定量PCR法、数字PCR法,基因芯片方法,原位杂交法或流式细胞法检测细胞中数字PCR法,基因芯片法,原位杂交法或流式细胞法检测及其编码基因,生物学前体的表达量;适用性广。
【附图说明】
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1是本发明筛选标记物基因中RNA样品制备的具体实验流程图。
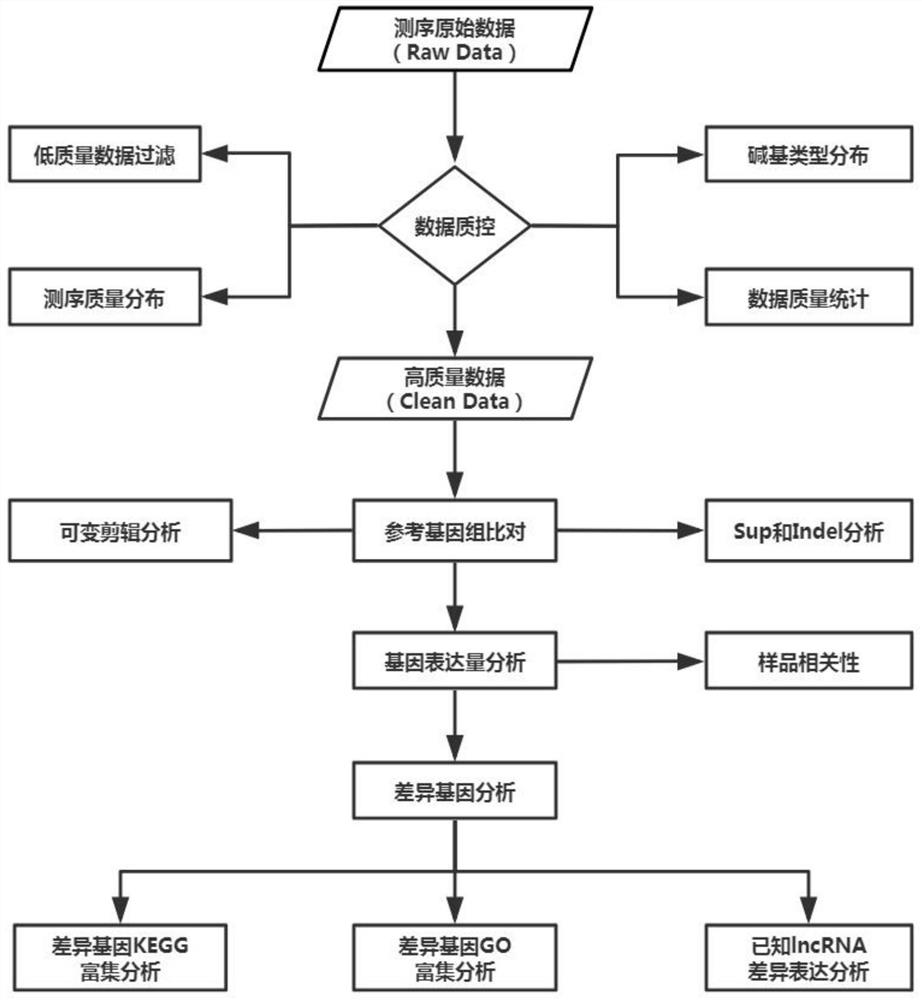
图2是本发明筛选标记物基因中对测序数据进行分析的流程图。
图3A、3B是本发明筛选标记物基因中对样本间差异表达的基因进行差异化表达分析的火山图。
图4A、4B是本发明通过荧光定量PCR法对标记物基因在不同细胞中的表达量定量分析结果示意图。
【具体实施方式】
本发明的目的在于筛选一批具有潜在应用价值的DPC细胞鉴定分类用基因标记物,以供临床级DPC细胞产品的质量控制应用。为实现上述目的,本发明首先采集诱导干细胞(iPSC,神经干细胞的初始来源细胞),NSC细胞(DPC的前体细胞)和DPC细胞(多巴胺神经元诱导分化培养24小时)样品。利用分子生物学的方法提取细胞中的总RNA,并通过高通量RNA测序结合生物信息学方法筛选到候选基因群体。随后,进一步通过生物信息学的方法筛选出一组调控神经细胞功能及神经分化相关基因,并通过实时定量PCR在不同细胞样品中验证了这一组基因的差异性表达,最终确定了CRH,FST,GLI1,POSTN,PYCR1,RELN,SLC16A9,SLC7A2,ST8SIA3,SLC7A5,STK32B,FGF17等12个相关的基因。这一组基因可作为对DPC细胞进行鉴定分类的标记物,还可以作为临床级DPC细胞制备中质量控制的检测标准,具有重要的应用价值。
本发明的内容包括提供CRH,FST,GLI1,POSTN,PYCR1,RELN,SLC16A9,SLC7A2,ST8SIA3,SLC7A5,STK32B,FGF17中的一种或多种基因、其编码基因或生物学前体在DPC细胞产品鉴定分类中的应用。
本发明的内容包括提供提帕金森的诊断制剂,包括用荧光定量PCR方法、数字PCR法,基因芯片方法,原位杂交法或流式细胞法检测细胞中数字PCR法,基因芯片方法,原位杂交法或流式细胞法检测标记物基因及其编码基因,生物学前体的表达量;所述标记物基因为CRH,FST,GLI1,POSTN,PYCR1,RELN,SLC16A9,SLC7A2,ST8SIA3,SLC7A5,STK32B,FGF17中的一种或多种。
荧光定量PCR法是通过荧光染料或荧光标记的特异性的探针,对PCR产物进行标记,以实现实时在线跟踪PCR反应中产物生成的过程,并通过相应的软件对产物的荧光值进行分析,从而推导出待测样品中的初始浓度。通过荧光定量PCR的技术,可以对传统PCR中产物的生成过程实时监测,避免了PCR反应到达平台期后造成的结果准确性下降,同时还真正实现了绝对定量,可以测定样品中的模板拷贝数。目前,荧光定量PCR检测系统已经非常成熟,相对于传统PCR反应,其具有反应快速、重复性好、灵敏度高、特异性强、结果清晰等优点。
数字PCR是一种核酸检测和定量分析的新方法,可以实现绝对定量及低丰度基因的检测。数字PCR的工作原理在于将DNA或cDNA样品分割为许多单独、平行的PCR反应,单个分子可以被扩增一百万倍或更多。数字PCR的独特优势在于可以用于生成样品中靶标分子的绝对计数,而无需标准品或内参。
基因芯片(Gene chip)又被称为DNA微阵列(DNA microarray),一般分为三种主要类型:1)核酸探针或cDNA片段通过物理作用固定在如尼龙膜和硝酸纤维膜等聚合物的表面上,然后通过同位素标记的靶基因与其杂交,通过放射自显影技术进行检测。2)在玻璃材料上用点样法固定核酸探针或cDNA片段阵列,然后与荧光标记的靶基因杂交,通过荧光信号强度进行检测。3)在玻璃材料等硬质表面上直接合成寡核苷酸探针阵列,然后与荧光标记的靶基因杂交,进行荧光信号的检测。近年来,基因芯片作为一种大规模、高通量的检测技术,已经广泛应用于临床疾病的诊断。
原位杂交是利用特定标记的已知序列的DNA或RNA核酸作为探针与细胞或组织切片中的核酸进行序列上的互补杂交,从而对特定核酸顺序进行精准定量定位的过程。原位杂交技术可以在细胞或组织的原来位置对核酸进行检测观察,但检测的灵敏度和特异性不高。
所述的利用荧光定量PCR方法检测DPC细胞产品中的CRH,FST,GLI1,POSTN,PYCR1,RELN,SLC16A9,SLC7A2,ST8SIA3,SLC7A5,STK32B,FGF17等基因表达的产品,含有一对特异性扩增上述基因的引物;所述的基因芯片,原位杂交包括与上述基因转录产物,及其编码基因,生物学前体等核酸序列杂交的探针。
本发明的目的在于提供一种可用于检测鉴定DPC细胞产品的荧光实时定量PCR试剂盒,其特征在于,所述试剂盒检测CRH,FST,GLI1,POSTN,PYCR1,RELN,SLC16A9,SLC7A2,ST8SIA3,SLC7A5,STK32B,FGF17等基因及其生物学前体,采用特异的上游和下游引物,具体引物序列如表1(引物序号单数代表Forward primer,双数代表Reversed primer)所示。
表1:
本发明所述的PCR试剂盒采用SYBR Green荧光染料,适合于目前存在市场上的所有类型荧光定量基因扩增仪,具有灵敏度高,定量快速准确、性能稳定等特点,具有良好的市场前景。
上述SYBR Green荧光定量PCR试剂盒组分包括:特异引物、内参引物、荧光定量PCR反应混合物(SYBR Green等)。其中所述的特异性引物包括上游引物和下游引物,所述内参引物为beta-actin和GAPDH内参引物。
本发明还包括提供一种DPC细胞产品的基因芯片,所述的基因芯片中包括与CRH,FST,GLI1,POSTN,PYCR1,RELN,SLC16A9,SLC7A2,ST8SIA3,SLC7A5,STK32B,FGF17等基因转录产物及其编码基因,生物学前体等的核酸序列杂交的探针。
下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解,在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。
下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。
实施例1.在诱导干细胞、NSC细胞和DPC细胞中提取RNA,并进行RNA高通量测序的样本制备
用于高通量测序RNA样品制备的具体实验流程如图1所示。利用Qiagen公司的RNeasy MinElute Cleanup Kit(Cat No./ID:74204)试剂盒按照要求,对诱导干细胞(iPSC,神经干细胞的初始来源细胞),NSC细胞(DPC的前体细胞)和DPC细胞(多巴胺神经元诱导分化培养24小时)中总RNA进行提取。
提取样品总RNA后,对抽提的总RNA样品的质量检测主要包括3种方法:
1)琼脂糖凝胶电泳分析RNA降解程度以及是否有污染;
2)Nanodrop检测RNA的纯度(OD260/280比值);
3)labchip精确检测RNA的完整性(结果如图2所示)。
RNA样品检测合格后,用带有Oligo(dT)的磁珠富集真核生物mRNA(若为原核生物,通过试剂盒去除rRNA来富集mRNA)。随后加入fragmentation buffer将mRNA打断成短片段,以mRNA为模板,用六碱基随机引物(random hexamers)合成一链cDNA,然后加入缓冲液、dNTPs和DNA polymerase I和RNaseH合成二链cDNA,随后利用AMPure XP beads纯化双链cDNA。纯化的双链cDNA先进行末端修复加A尾并连接测序接头,再用AMPure XPbeads进行片段大小选择。之后用USER酶降解含有U的cDNA第二链,使得最终的测序信息都来自于第一链cDNA,从而保留了mRNA的链方向性。最后进行PCR扩增,并用AMPure XP beads纯化PCR产物,得到链特异性cDNA文库。
待文库构建完成后,先使用Qubit3.0进行初步定量,稀释文库至1ng/uL,随后使用Qsep100对文库的insert size进行检测,insert size符合预期后,使用Q-PCR方法对文库的有效浓度进行准确定量(文库有效浓度>2nM),以保证文库质量。库检合格后,把不同文库按照有效浓度及目标下机数据量的需求pooling后进行Illumina HiSeq测序。
实施例2.RNA高通量测序后获得数据的分析
将下机数据进行过滤得到Clean reads,将Clean reads与参考基因组序列进行比对,根据基因组的注释文件和reads比对到基因组的位置统计每个基因包含的reads数即表达量,然后进行统计检验获得差异表达基因,最后对差异表达基因进行功能注释及GO、KEGG富集检验,获得差异表达基因所富集的GO、KEGG集合,整体流程如图2所示。具体分析中,RJ-1(iPSC诱导干细胞)作为标准母本细胞分别与RJ-2(NSC细胞)和RJ-3(DPC细胞)中的基因表达进行比较,分析得到的差异表达的基因如图3中的火山图3A、3B所示。差异表达火山图中的每一个点表示一个基因,横坐标表示某一个基因在两样品中表达量差异倍数的对数值;纵坐标表示基因表达量变化的统计学显著性的负对数值。横坐标绝对值越大,说明表达量在两样品间的表达量倍数差异越大;纵坐标值越大,表明差异表达越显著,筛选得到的差异表达基因越可靠。为表述清楚,图3A、3B中分别用贯穿坐标系的虚线对相邻界限进行了划分,其中两条虚线的左侧点代表下调差异表达基因(Down-Regulated Genes),两条虚线的右侧点代表上调差异表达基因(Up-Regulated Genes),两条虚线之间为non-DEGs。
实施例3.DPC细胞中12个上调表达基因的分析筛选
对实施例2中筛选出来的差异表达基因进一步进行分析,以筛选出DPC细胞特有的标志基因组合。首先,通过实施例2中的分析结果,我们筛选出DPC细胞中相对于NSC细胞上调表达的基因,这些基因的范围以表达量上升2.4倍作为阈值进行筛选。然后,我们利用NCBI网站的Pubmed文献数据库对以上筛选出的基因功能进行分析,从中筛选与神经细胞发育分化或神经细胞功能相关的基因,结果如表2所示。通过上述分析,总共12个基因被确定成为DPC细胞特异性表达的候选基因,其中包括CRH,FST,GLI1,POSTN,PYCR1,RELN,SLC16A9,SLC7A2,ST8SIA3,SLC7A5,STK32B和FGF17。
表2:
实施例4.对12个DPC细胞高表达基因在iPSC细胞,NSC细胞和DPC细胞中的表达量逐一检测确认。
为进一步验证RNA高通量测序筛选的DPC特异性表达基因的准确性,我们在分别准备了iPSC细胞(母本),NSC细胞(iPSC诱导分化的细胞)和DPC细胞(NSC细胞经多巴胺神经元诱导分化24小时)的不同细胞样品,并抽提总RNA,利用荧光定量PCR的方法检测比较上述12个基因在这些细胞中的表达量。上述基因的表达量分别在iPSC细胞与NSC细胞,以及NSC细胞与DPC细胞中进行分析比较,结果如图4A和4B所示。
4.1材料
iPSC细胞,NSC细胞和DPC细胞样品,每种细胞约5×10
4.2步骤及方法
4.2.1细胞总RNA的提取
采用Qiagen公司的RNeasy MinElute Cleanup Kit(Cat No./ID:74204)试剂盒进行样本总RNA提取,按照产品说明书进行操作。RNA质量判定标准:RNA样本的OD260/OD280值为1.7-2.2之间。
4.2.2逆转录合成cDNA
采用标准逆转录方法,简述如下:
使用专用逆转录试剂盒,取约1000ng总RNA进行反转录合成cDNA。反转录的引物采用试剂盒提供的专用引物。
4.2.3引物设计
采用在线引物设计软件,引物设计后由北京擎科生物科技有限公司合成。具体引物序列如表1中的引物序列所示。
4.2.3荧光定量PCR
用Power Green PCR Master Mix(invitrogen,货号4367659)进行扩增,具体实验操作按照产品说明书进行。扩增程序为:95°10min,(95℃15sec,60℃60sec)×45个循环。取待测样品cDNA 2-5μl作模板,分别用目的基因特异性引物和试剂盒提供的通用引物进行PCR扩增。准备好的样品用Quantagene q325荧光定量PCR仪,采用2-△△CT法进行数据的相对定量分析。
4.3实验结果
通过荧光定量PCR的方法对12个基因在不同细胞中的表达量进行相对定量并比较分析,可以确定12个基因在iPSC细胞和NSC细胞中的表达量完全符合RNA高通量测序中的表达量变化趋势。由图4A可见,比较iPSC和NSC中的基因表达量,NSC细胞中ST8SIA3,CRH,FGF17,SLC16A9,RELN基因的表达量相对于iPSC细胞上升,而SLC7A5,FST,GLI1,STK32B,POSTN,SLC7A2,PYCR1的表达量相对于iPSC细胞下降,这些结果与RNA高通量测序的结果趋势完全一致。此外,由图4A可见,比较NSC细胞和DPC细胞中的基因表达量可知,FST,CRH,GLI1,STK32B,POSTN,SLC16A9,RELN的表达趋势与RNA高通量测序中一致,相对于NSC细胞表现为上升表达,而SLC7A5,ST8SIA3,FGF17,SLC7A2,PYCR1相对于NSC细胞则表现为无明显差异或小幅下降。因此,基因表达定量PCR的结果基本验证了RNA高通量的准确性。
需要说明的是,上述实施例仅为本发明较佳的具体实施方式,并不以任何形式限制本发明,凡根据本发明的技术方案等同替换或改变获得的技术方案,均涵盖在本发明的保护范围内。
参考文献:
1.Tian YY,Tang CJ,Wu J,Zhou JS.Parkinson's disease in China.NeurolSci.2011Feb;32(1):23-30.
2.Malek N.Deep Brain Stimulation in Parkinson's Disease.NeurolIndia.2019Jul-Aug;67(4):968-978.
序列表
<110> 武汉睿健医药科技有限公司
<120> DPC细胞鉴定分类用标记物基因、筛选方法及应用
<141> 2020-12-24
<160> 24
<170> SIPOSequenceListing 1.0
<210> 1
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 1
gcagcagcaa cacaatgtta ttcg 24
<210> 2
<211> 23
<212> DNA
<213> Artificial Sequence
<400> 2
tggcattctc tttggctcag acc 23
<210> 3
<211> 21
<212> DNA
<213> Artificial Sequence
<400> 3
gctgctgctc tgccagttca t 21
<210> 4
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 4
tgtgttgtca ttcacgtcct cctc 24
<210> 5
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 5
acatcaacag cgagcacatc ca 22
<210> 6
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 6
cgaggcgtga gtatgacttc cg 22
<210> 7
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 7
ccatgtcatt gaccgtgtgc ttac 24
<210> 8
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 8
gcctccaata tgtccgatgt gatg 24
<210> 9
<211> 21
<212> DNA
<213> Artificial Sequence
<400> 9
ttcacagcag caggcgtctt g 21
<210> 10
<211> 23
<212> DNA
<213> Artificial Sequence
<400> 10
cacagccagg aagagcacat cac 23
<210> 11
<211> 23
<212> DNA
<213> Artificial Sequence
<400> 11
tccactgtga gacaagcggt tac 23
<210> 12
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 12
tcctccatcg gtagagtagt ccaa 24
<210> 13
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 13
aacagtgacc attacgtgcc agta 24
<210> 14
<211> 23
<212> DNA
<213> Artificial Sequence
<400> 14
ccacaatcag caagcatcca tcc 23
<210> 15
<211> 23
<212> DNA
<213> Artificial Sequence
<400> 15
tggttgatgc cactgccatg atc 23
<210> 16
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 16
agtctaagag cccacccaac aagg 24
<210> 17
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 17
tgacagtggc atcagagtga agag 24
<210> 18
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 18
aaggtccaga atgagtggca agaa 24
<210> 19
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 19
aggaggcagt ggacatcgta gg 22
<210> 20
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 20
cagagcagga ggttggaaca gaac 24
<210> 21
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 21
tcctggtcaa tctgtggtac tcct 24
<210> 22
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 22
ctggcttgat gtctctgtgg atga 24
<210> 23
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 23
cctggagagg aactgagtgt cacc 24
<210> 24
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 24
gcagactgag ggagatccga gaag 24
- DPC细胞鉴定分类用标记物基因、筛选方法及应用
- 抗稻瘟病基因Pid3的分子标记物组合及等位基因的筛选方法
