桦褐孔菌醇F及其在制备α-葡萄糖苷酶抑制剂药物的应用
文献发布时间:2023-06-19 10:19:37
技术领域:
本发明属于天然药物领域,具体涉及三萜类化合物桦褐孔菌醇F及其在制备α-葡萄糖苷酶抑制剂药物中的应用。
背景技术:
糖尿病是人体内胰岛素缺乏或者相对缺乏而引起的一种临床常见病,世界卫生组织(WHO)将糖尿病主要分为两种:I型糖尿病(或称胰岛素依赖型,IDDM)和II型糖尿病(或称非胰岛素依赖型,NIDDM)。其中II型糖尿病占了大多数,我国糖尿病患者有2000万以上,其中近90%为II型糖尿病,并且出现多发性、年轻化的特点,严重威胁国民健康。
α-葡萄糖苷酶是小肠内麦芽糖、蔗糖或其他寡糖的水解酶,水解最终产生葡萄糖并经小肠吸收进入血液,是餐后血糖升高的主要原因。餐后高血糖可引起机体对胰岛素的敏感性降低从而加剧II型糖尿病患者病情,甚至导致一系列并发症。因而α-葡萄糖苷酶抑制剂将显著提高对糖尿病的控制。目前市场上使用的α-葡萄糖苷酶抑制剂类药物主要为阿卡波糖、伏格列波糖、米格列醇等,但是值得注意的是,目前使用的这些抑制剂都带来了不同程度上的毒副作用,如胃肠道副作用、荨麻疹、肝功能障碍、心脏系统风险等。因此,积极发展更安全、更强效的α-葡萄糖苷酶抑制剂是必要和紧迫的。
发明内容:
本发明的第一个目的是提供具有α-葡萄糖苷酶抑制活性的桦褐孔菌醇F。
所述的桦褐孔菌醇F,其结构式如式(Ⅰ)所示:
本发明的第二个目的是提供桦褐孔菌醇F或其药学上可以接受的盐在制备α-葡萄糖苷酶抑制剂药物中的应用。所述药学上可接受的盐,这类盐包括:桦褐孔菌醇F与无机酸或与有机酸形成的酸加成的盐,所述的无机酸诸如盐酸,氢溴酸,硫酸,硝酸,磷酸等;所述的有机酸诸如乙酸,丙酸,己酸,环戊丙酸,乙醇酸,丙酮酸,乳酸,丙二酸,琥珀酸,苹果酸,马来酸,富马酸,酒石酸,柠檬酸,苯甲酸,肉桂酸,扁桃酸,甲磺酸,乙磺酸,苯磺酸,葡糖酸,谷氨酸,羟基萘甲酸,水杨酸,硬脂酸等;或在母体化合物上存在的酸性质子被金属离子,例如碱金属离子或碱土金属离子取代时形成的盐;或与有机碱形成的配位化合物,所述的有机碱诸如乙醇胺,二乙醇胺,三乙醇胺,N-甲基葡糖胺等。
所述的α-葡萄糖苷酶抑制剂药物是治疗糖尿病的药物。
所述的治疗糖尿病的药物包括桦褐孔菌醇F或其药学上可接受的盐及药学上可接受的载体。
在一个实施方式中药物组合物中含有的活性成份(即本发明的桦褐孔菌醇F)的量可以根据患者的病情、医生诊断的情况特定的加以应用,活性化合物的量或浓度在一个较宽的范围内调节,通常,活性化合物的量范围为组合物的1%~90%(重量)。
尽管本发明的桦褐孔菌醇F可以不经任何配制直接给药,但所述的各种化合物优选以与药学上可接受的辅料制备成药物制剂使用。药学上可接受的辅料包括稀释剂、润滑剂、粘合剂、崩解剂、稳定剂、溶剂等。
本发明所述稀释剂包括但不限于淀粉、微晶纤维素、蔗糖、糊精、乳糖、糖粉、葡萄糖等;所述润滑剂包括但不限于硬脂酸镁、硬脂酸、氧化钠、油酸钠、月桂醇硫酸钠、泊洛沙母等;所述粘合剂包括但不限于水、乙醇、淀粉浆、糖浆、羟丙基甲基纤维素、羧甲基纤维素钠、海藻酸钠、聚乙烯吡咯烷酮等;所述崩解剂包括但不限于淀粉泡腾混合物即碳酸氢钠和枸橼酸、酒石酸、低取代羟丙基纤维素等;所述稳定剂包括但不限于多糖如金合欢胶、琼脂、藻酸、纤维素醚和羧甲基甲壳酯等;所述溶剂包括但不限于水、平衡的盐溶液等。
在一个实施方案中,所述药物包括口服制剂与注射制剂。
在一个实施方案中,所述口服制剂为固体口服制剂、液体口服制剂,药剂学可接受的口服剂固体制剂包括,但不限于普通片剂、分散片、肠溶片、颗粒、胶囊、滴丸、散剂等,口服液体制剂有口服液、乳剂。
在一个实施方案中,所述注射剂包括,但不限于小水针、输液、冻干粉针等。
所述制剂可以根据本领域常规的工艺制备而成。
本发明的第三个目的是提供一种桦褐孔菌醇F的制备方法,其是从桦褐孔菌或其发酵培养物中分离制备得到的。
优选,是将桦褐孔菌的发酵培养物用乙酸乙酯提取,将提取液减压浓缩至干,得到粗提物,粗提物经硅胶柱,经环己烷和甲醇洗脱,收集甲醇洗脱部位浓缩干燥,然后对甲醇部位进行中低压ODS柱层析,依次用甲醇-水从体积比为30:70、50:50、70:30、80:20、90:10和100:0作为洗脱剂梯度洗脱,收集体积比80∶20甲醇-水洗脱得到的子馏分经过反相HPLC纯化得到桦褐孔菌醇F。
所述的经过反相HPLC纯化得到桦褐孔菌醇F是将子馏分经反相HPLC,使用甲醇-水80∶20,v/v,流速为12mL/min进行洗脱,在t
所述的桦褐孔菌的发酵培养物是将桦褐孔菌接种到大米培养基中发酵培养得到的,所述的大米培养基是由大米:水=70g:100mL组成。
本发明的有益效果如下:
本发明从桦褐孔菌或其发酵培养物分离出来桦褐孔菌醇F,其具有显著的抑制α-葡萄糖苷酶活性,对α-葡萄糖苷酶活性的抑制方式为典型的非竞争抑制剂,比竞争性抑制剂将更加有利于控制糖尿病患者的餐后血糖。因此可以用于制备治疗糖尿病的药物。
附图说明:
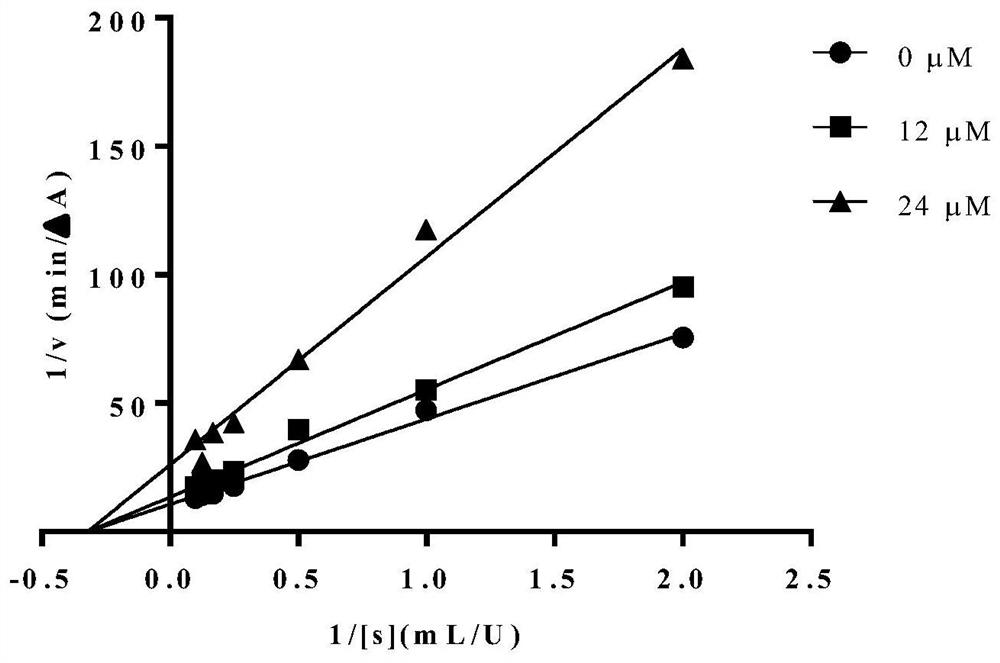
图1是桦褐孔菌醇F对α-葡萄糖苷酶抑制动力学的影响。
具体实施方式:
以下通过实施例来理解本发明,其中所述实施例说明了一些制备或使用方法。然而,要理解的是,这些实施例不限制本发明。现在已知的或进一步开发的本发明的变化被认为落入本文中描述的和以下要求保护的本发明范围之内。
下列实施例中,质谱仪为美国Waters公司生产的Waters Synapt G2 TOF质谱仪。超导核磁共振仪为Bruker AVANCEⅡAV-600。柱色谱硅胶(200-300目)均为青岛海洋化工厂产品。反相ODS填料50μm为日本YMC公司产品。中低压液相色谱仪为天津博纳艾杰尔科技有限公司产品。液相分离所使用色谱柱为YMC-Pack ODS-A column(20.0×250mm,5μm)。液相色谱用甲醇为色谱纯,水为蒸馏水,其他试剂均为分析纯。
实施例1:桦褐孔菌醇F的制备
取多孔菌科真菌灵芝属桦褐孔菌(Inonotus obliquus)干燥菌核5kg,粉碎,用10倍量(质量/体积,g/mL)的95%乙醇加热(80℃)回流提取2次,每次2小时,合并提取液,减压浓缩至原体积的1/20,得到IO;加入3倍量的乙酸乙酯萃取2次,得到乙酸乙酯萃取物IO-EA。IO-EA用2倍量(质量/体积,g/mL)的氯仿甲醇(1:1v/v)溶液溶解,均匀拌入硅胶中,挥干溶剂后将吸附有乙酸乙酯萃取物IO-EA的硅胶添加到层析柱中吸附剂的上面,进行硅胶柱层析分离,以氯仿-甲醇按体积比100:0、98:2、95:5、90:10、80:20、70:30、50:50和0:100作为洗脱剂梯度洗脱,收集氯仿-甲醇体积比98:2洗脱的馏分,浓缩得到Fr.2;以甲醇-水的体积比30:70、50:50、70:30、80:20、90:10和100:0作为洗脱剂,将Fr.2进行ODS中低压柱层析梯度洗脱,收集甲醇-水体积比80:20洗脱的馏分Fr.2.3;以80%甲醇-水为流动相,流速为12mL/min,馏分Fr.2.3经过反相HPLC制备(仪器:Shimadzu LC-20A)纯化得到化合物1(桦褐孔菌醇F)(t
实施例2:桦褐孔菌醇F的制备
桦褐孔菌菌丝接种于PDB培养基,在25℃以200r/min震荡培养7d制备种子液,再按照5%接种量接种20个装有大米培养基的三角烧瓶中,25℃,静止培养45d,得到发酵物。所述大米培养基由以下组分组成:大米70g/瓶,纯净水100mL/瓶,将70g大米加入到装有100ml水的瓶中,灭菌制得。将发酵物加入乙酸乙酯进行浸泡超声提取3次,将提取液减压浓缩至干,得到粗提物。粗提物经硅胶柱,经环己烷和甲醇洗脱,收集甲醇洗脱部位浓缩干燥。然后对甲醇部位进行中低压ODS柱层析,依次用体积比为30:70、50:50、70:30、80:20、90:10和100:0作为洗脱剂的甲醇-水梯度洗脱得到6个馏分;再将体积比80∶20甲醇-水洗脱得到的子馏分经过反相HPLC制备,使用甲醇-水(80∶20,v/v),流速为12mL/min进行洗脱,得到化合物1(桦褐孔菌醇F)(t
化合物1:白色无定形粉末;Liebermann-Burchard反应阳性;HR-ESI-MS:m/z467.3519[M-H]
其碳谱和氢谱数据如下:
化合物1经核磁共振波谱鉴定和质谱分析确定,其结构如式(I)所示,为桦褐孔菌醇F。
实施例3:桦褐孔菌醇F的体外抑制α-葡萄糖苷酶活性试验
预先配制一系列不同浓度供试样品溶液(溶于少量DMSO后,用蒸馏水稀释至相应浓度,控制DMSO的最终体积分数<0.1%)。在96孔板中,每孔加入10μL不同浓度的以上供试样品溶液,50μL α-葡萄糖苷酶水溶液(浓度为0.4U/mL)及40μL磷酸盐缓冲溶液(50mM,pH7.0)。充分混合后在37℃下孵育10min后加入50μL4-硝基苯-α-D-吡喃葡萄糖苷水溶液(浓度为2.5mM),37℃恒温孵育40min。最后加入50μL Na
为了更直观的体现桦褐孔菌醇F对α-葡萄糖苷酶的抑制作用,以阿卡波糖为阳性对照,按照上述步骤进行试验,并计算其对α-葡萄糖苷酶的半数抑制浓度(IC
在研究中,发明人还发现羊毛甾烷型三萜支链取代基的不同对该类化合物所具有的活性有着显著的影响,对其它羊毛甾烷型三萜化合物(式II和式III)按照如上所述步骤进行试验,并计算其对α-葡萄糖苷酶的半数抑制浓度(IC
结果如表1所示,可以看出,式(I)所示化合物(桦褐孔菌醇F)对α-葡萄糖苷酶有显著的抑制作用,对α-葡萄糖苷酶抑制活性为阳性药物阿卡波糖的56倍。而其他羊毛甾烷型化合物:3β-羟基-羊毛甾-8,24-二烯-21-醛(式II)和桦褐孔菌素A(式III)则对α-葡萄糖苷酶的抑制作用较低。
表1不同化合物对α-葡萄糖苷酶的抑制作用
实施例4:式(I)所示化合物对α-葡萄糖苷酶的作用方式
参照实施例2的实验方法,固定α-葡萄糖苷酶浓度为0.4U/ml(每孔50μl),调整底物pNPG的终浓度为0.5、1.5、2.5、3.5、4.5、5.5mM,桦褐孔菌醇F浓度为0、12、24μM。用双倒数作图(double-reciprocal plot),也称之Lineweaver-Burk作图。酶促反应速度的倒数(1/v)对底物浓度的倒数(1/[s])的作图。X和Y轴上的截距分别代表米氏常数(Km)和最大反应速度(Vmax)的倒数。
结果如图1所示,由图1可知,随着桦褐孔菌醇F的浓度增大,Km值不变,Vmax减小。桦褐孔菌醇F是典型的非竞争抑制,这比竞争性抑制剂将更加有利于控制糖尿病患者的餐后血糖。
- 桦褐孔菌醇F及其在制备α-葡萄糖苷酶抑制剂药物的应用
- 可作为α-葡萄糖苷酶抑制剂的桦褐孔菌提取物制备方法
