用于诱导细胞免疫应答的重组酵母裂解物
文献发布时间:2023-06-19 10:21:15
相关申请的交叉引用
本申请根据35U.S.C.§119(e)要求于2018年5月15日提交的美国临时专利申请号62/671,587的优先权权益。美国临时专利申请号62/671,587的全部披露内容通过引用并入本文。
序列表的引用
该申请含有通过EFS-Web以电子文本文件提交的序列表。名为“3923-59-PCT_ST25”的文本文件的大小为3000字节,并且记录于2019年5月13日。根据37CFR§1.52(e)(5),该文本文件中含有的信息通过引用并入本文。
技术领域
本发明总体上涉及免疫治疗性组合物(特别是用于诱导细胞免疫应答的重组酵母裂解物)及其用途。
背景技术
疫苗被广泛用于预防疾病和治疗既定疾病(治疗性疫苗)。然而,仍然迫切需要开发用于多种疾病(包括由致病性因子感染引起的那些、癌症和可以通过诱发免疫应答来治疗的其他障碍)的安全且有效的疫苗和佐剂。
当不与佐剂一起施用时,蛋白抗原(例如,亚单位疫苗,其可以通过重组DNA技术开发)诱导弱的体液(抗体)免疫,因此至今令人失望的仅表现出有限的免疫原性。亚单位疫苗以及杀灭病毒和重组活病毒疫苗的另一个缺点是,虽然它们与佐剂一起施用时似乎会刺激强烈的体液免疫应答,但它们无法引发保护性细胞免疫。佐剂在实验上用于刺激小鼠中有效的免疫应答,并且被期望用于人类疫苗中,但是很少佐剂被批准用于人类。实际上,在美国批准使用的仅有的佐剂是铝盐、氢氧化铝和磷酸铝,它们都不刺激细胞介导的免疫。铝盐配制品不能冷冻或冻干,并且此类佐剂并非对所有抗原都有效。此外,大多数佐剂不会导致细胞毒性T淋巴细胞(CTL)的诱导。需要CTL以杀灭正在合成异常蛋白(包括病毒蛋白和突变的“自身”蛋白)的细胞。目前正在对刺激CTL的疫苗进行广泛研究,以对抗多种病毒(例如,HIV、HCV、HPV、HSY、CMV、EBY)、细胞内细菌(例如结核病)、细胞内寄生物(例如,疟疾、利什曼病、血吸虫病、麻风病)和所有癌症(例如黑色素瘤、前列腺癌、卵巢癌等)。因此,通常需要刺激CTL和细胞介导的免疫的佐剂。
酵母已用于生产亚单位蛋白疫苗,包括在HIV疫苗试验和乙型肝炎疫苗中测试的那些;然而,在这些情况下,酵母用于产生蛋白质,但是酵母细胞或其亚细胞部分实际上并未递送给患者。还已经在免疫接种前将酵母喂给动物,以尝试以非特异性方式启动免疫应答(即,刺激吞噬作用以及补体和干扰素的产生)。结果是有不明确的,并且此类方案没有产生保护性细胞免疫;参见例如,Fattal-Ger-man等人,1992,Dev.Biol.Stand[生物标准化发展].77,115-120;Bizzini等人,1990,FEMS Microbial.Immunol.[欧洲微生物学会联合会微生物免疫]2,155-167。
1998年11月3日发布的美国专利号5,830,463(Duke等人)描述了携带至少一种能够调节免疫应答的化合物的非致病性酵母的用途,并证明了此类复合物在刺激细胞介导的以及体液免疫方面是有效的。特别地,美国专利号5,830,463证明了经基因工程化以表达异源抗原的酵母在施用于哺乳动物时可引发细胞介导的和体液的免疫应答。
当前需要刺激针对细胞相关抗原或内源性抗原的T细胞(并且特别是细胞毒性T淋巴细胞(CTL))介导的免疫的改善的疫苗。这些疫苗的靶标包括感染病毒、细胞内细菌和寄生物以及癌症的细胞。CTL介导的免疫的启动需要抗原肽与专职性抗原呈递细胞(APC)(特别是树突细胞(DC))表面上的主要组织相容性(MHC)1类分子缔合呈递(Ridge等人,Nature[自然]393:474-8 1998)。树突细胞是用于引发免疫应答的主要抗原呈递细胞(APC)。由于DC在激活初始CD4+和CD8+T细胞方面具有独特的能力,它们在启动MHC II类和I类限制性抗原特异性T细胞应答中都起着至关重要的作用(Ridge等人,Nature[自然]393:474-8(1998);Banchereau等人,Nature[自然]392:245-52(1998))。然而,外源引入的抗原(例如在由抗原蛋白或杀灭的病原体组成的疫苗中发现的抗原)主要经由MHC II类途径进行加工,以呈递给CD4+T细胞(Moore等人,Cell[细胞]54:777-85(1988))。这些类型的疫苗可刺激有效的体液免疫,但在刺激CD8+CTL方面相对无效。该缺点导致对特异性靶向DC以经由除MHC II类外的MHC I类来呈递抗原的疫苗策略进行研究。已经显示DC具有独特途径来加工外源抗原(特别是呈微粒形式)用于通过MHC I类途径呈递(Rodriguez等人,Nat Cell Biol[自然细胞生物学]1:362-368(1999))。在这方面,由抗原蛋白或肽与添加的佐剂组成的各种脂质体样微粒制剂显示出有望刺激CTL(Palo等人,Nat Med[自然医学]1:649-53(1995);O′Hagan,J Pharm Pharmacol[药学与药理学杂志]50:1-10(1998))。这些免疫刺激复合物(ISCOMS)的微粒性质使它们易于被募集于疫苗接种位点并被佐剂部分激活的DC吞噬。
基于树突细胞的癌症疫苗也正在深入研究中。树突细胞离体扩增并“装载”肽(衍生自可疑肿瘤抗原)或与患者的癌细胞混合(DC吞噬这些细胞并呈递肿瘤抗原)。但是,肽装载效率低下,并且需要了解所使用的特定肽。死亡肿瘤细胞和碎片的吞噬作用导致II类MHC呈递,而不是I类MHC呈递,后者是激活CTL所必需的。因此,在本领域中需要改善的疫苗,包括改善的DC疫苗。
基于全重组酵母的治疗性疫苗(即Tarmogen)引发CD4+、CD8+和Th17 T细胞应答,这些应答能够消除人中的癌细胞和感染微生物的细胞。
在1990年代,引入基于酵母的免疫治疗组合物作为通过抗原呈递细胞的MHC I类限制性途径和MHC II类限制性途径两者诱导免疫应答的新颖组合物(参见美国专利号5830463)。尽管这些组合物最初作为一种或多种外源性抗原暴露于免疫系统,但是基于酵母的免疫治疗组合物独特地能够通过MHC I类限制性途径来交叉呈递抗原而触发CD8+细胞毒性T细胞应答的诱导,以及通过MHC II类限制性途径来呈递抗原而触发CD4+T细胞应答的诱导(参见例如,美国专利号5830463和7083787,Stubbs等人,Nat.Med[自然医学].7:625-629(2001)和Lu等人,Cancer Research[癌症研究]64:5084-5088(2004))。基于酵母的免疫治疗组合物刺激模式识别受体(PRR);上调抗原呈递细胞(包括DC)上的粘附分子、共刺激分子和MHC I类和II类分子;并通过抗原呈递细胞(例如TNF-α和IL-12)诱导产生促炎性细胞因子(参见例如,Stubbs等人,同上;Brown等人,JExp.Med[实验医学杂志].197:1119-1124(2003))。
在可以被工程化以表达一种或多种抗原的基于酵母的免疫治疗性组合物的背景下,尚未完全确定基于酵母的免疫治疗在免疫系统和治疗功效方面的作用机理的复杂性。期望更好地了解不同个体如何应答基于酵母的免疫治疗组合物的免疫接种,从而能够操纵和个性化免疫治疗性策略,以更有效地在个体中引发最适合给定疾病或病症的所希望的免疫应答。
发明内容
下文描述了本发明的各个实施例。然而,本发明不限于在本发明内容中描述的实施例,因为以下的说明书中描述的发明也被明确地包括在内。
本发明的一个实施例涉及免疫原性组合物,该免疫原性组合物包含(a)由酵母制备的酵母裂解物,其中该裂解物缺乏酵母膜和酵母细胞壁;和(b)与该酵母异源的至少一种抗原。
本发明的另一个实施例涉及免疫原性制剂,该免疫原性制剂包含:(a)第一免疫原性组合物,该第一免疫原性组合物包含(i)由酵母制备的酵母裂解物,其中该裂解物缺乏酵母膜和酵母细胞壁;和(ii)与该酵母异源的至少一种抗原;以及(b)第二免疫原性组合物,该第二免疫原性组合物包含(i)选自由以下组成的组的酵母媒介物:全酵母(wholeyeast)、酵母原生质球、酵母胞质体、酵母菌蜕(ghost)、和亚细胞酵母颗粒;和(ii)与该酵母异源的至少一种抗原。在该实施例的一个方面,第一免疫原性组合物和第二免疫原性组合物以约90:10至约10:90的比例组合。
本发明的又另一个实施例涉及产生免疫原性组合物的方法,该方法包括(a)裂解酵母细胞;和(b)从裂解的细胞中去除细胞壁和细胞膜,其中这些裂解的细胞包含与该酵母异源的抗原。在该实施例的一个方面,裂解步骤通过选自由以下组成的组的方法进行:玻璃珠破碎、高压匀浆、超声处理、电裂解、物理裂解、化学裂解、和酶裂解。在该实施例的又另一个方面,去除步骤通过选自由以下组成的组的方法进行:离心、过滤和亲和层析。在一个方面,免疫原性组合物和酵母媒介物以约90∶10至约10∶90酵母单位当量的比例组合。在另一个方面,在去除细胞壁和膜的步骤之前,将裂解的酵母细胞进一步通过超声处理进行处理,以从这些细胞壁和细胞膜释放抗原。
本发明的另一个实施例涉及在受试者中引发细胞毒性T细胞免疫应答的方法,该方法包括向该受试者施用免疫原性组合物,该免疫原性组合物包含:(a)由酵母制备的酵母裂解物,其中该裂解物缺乏酵母膜和酵母细胞壁;和(b)与该酵母异源的至少一种抗原。
在该实施例的一个方面,方法进一步包括将该免疫原性组合物与包含全重组灭活酵母媒介物和与该酵母异源的至少一种抗原的组合物组合。
在该实施例的一个方面,通过选自由以下组成的组的施用途径向受试者施用免疫原性组合物:静脉内、腹膜内、皮下、皮内、结节内、肌内、透皮、吸入、鼻内、口服、眼内、关节内、颅内和脊柱内。
在该实施例的一个方面,将免疫原性组合物配制在适于通过注射向受试者施用的药学上可接受的赋形剂中。
在该实施例的一个方面,以约0.1Y.U.至约100Y.U.的剂量向受试者施用免疫原性组合物。
在该实施例的一个方面,以约10Y.U.至约80Y.U.的剂量向受试者施用免疫原性组合物。
在该实施例的一个方面,将免疫原性组合物每周施用一次。
在该实施例的一个方面,将免疫原性组合物每隔一周施用一次。
在该实施例的一个方面,将免疫原性组合物每月施用一次。
在该实施例的一个方面,组合物包含多种抗原。
本发明的仍另一个实施例涉及在受试者中引发抗原特异性体液免疫应答和抗原特异性细胞介导的免疫应答的方法,所述方法包括向该受试者施用免疫原性组合物,该免疫原性组合物包含:(a)由酵母制备的酵母裂解物,其中该裂解物缺乏酵母膜和酵母细胞壁;和(b)与该酵母异源的至少一种抗原。
在该实施例的一个方面,方法进一步包括向受试者施用全重组灭活酵母和由该酵母表达的至少一种抗原的组合。
在该实施例的一个方面,通过选自由以下组成的组的施用途径向受试者施用免疫原性组合物:静脉内、腹膜内、皮下、皮内、结节内、肌内、透皮、吸入、鼻内、口服、眼内、关节内、颅内和脊柱内。
在该实施例的一个方面,将免疫原性组合物配制在适于通过注射向受试者施用的药学上可接受的赋形剂中。
在该实施例的一个方面,以约0.1Y.U.至约100Y.U.的剂量向受试者施用免疫原性组合物。
在该实施例的一个方面,以约10Y.U.至约80Y.U.的剂量向受试者施用免疫原性组合物。
在该实施例的一个方面,将免疫原性组合物每周施用一次。
在该实施例的一个方面,将免疫原性组合物每隔一周施用一次。
在该实施例的一个方面,将免疫原性组合物每月施用一次。
在该实施例的一个方面,组合物包含多种抗原。
在上述本发明的任一个实施例的一个方面中,抗原由酵母表达。
在本文所述的任一个实施例中,在一个方面,将抗原添加到酵母裂解物中。
在本文所述的任一个实施例中,在一个方面,抗原选自由以下组成的组:病毒抗原、哺乳动物细胞表面分子、细菌抗原、真菌抗原、原生动物抗原、蠕虫抗原、外寄生物抗原、癌抗原、和肿瘤新生抗原。
在本文所述的任一个实施例中,在一个方面,在酵母裂解之前该酵母表达异源抗原。
在本文所述的任一个实施例中,在一个方面,将异源抗原添加到裂解的酵母中。
在本文所述的任一个实施例中,在一个方面,进一步包括将免疫原性组合物与由全重组灭活酵母媒介物表达的至少一种抗原组合。
在本文所述的任一个实施例中,在一个方面,酵母媒介物是热灭活的酵母细胞。
在本文所述的任一个实施例中,在一个方面,酵母来自酵母菌属(Saccharomyces)。
在本文所述的任一个实施例中,在一个方面,酵母来自酿酒酵母(Saccharomycescerevisiae)。
附图说明
图1是体内CTL测定的示意图。
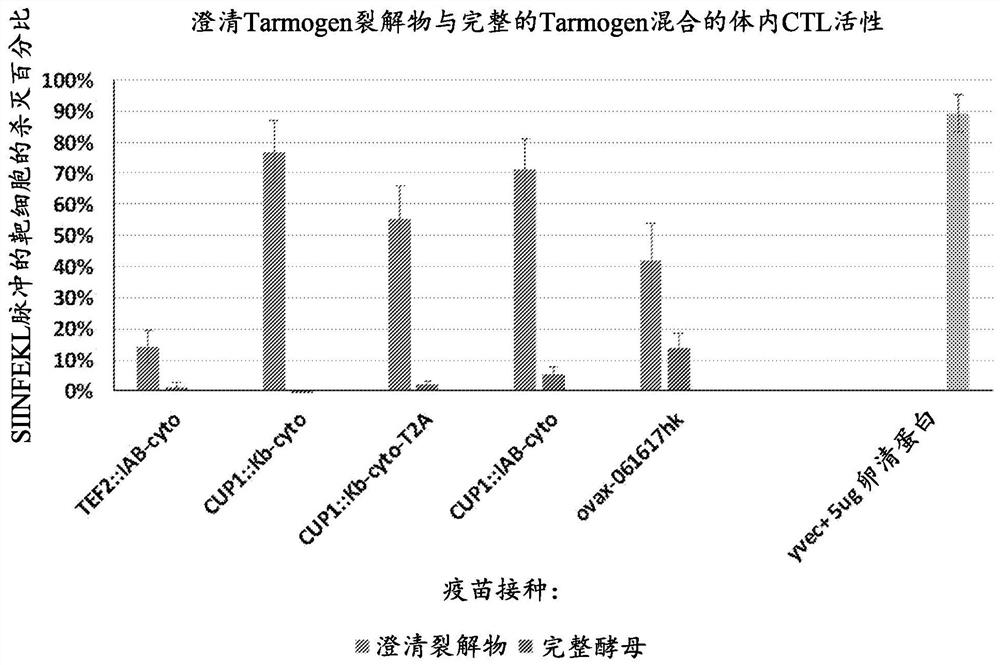
图2示出了澄清Tarmogen裂解物(每组第一条)与完整Tarmogen(每组第二条)混合比单独的完整Tarmogen更有效地在体内产生CTL介导的杀灭。TEF2:酵母翻译延伸因子的组成型启动子;CUPl:酵母铜诱导型启动子Kb-cyto:表达具有多个B16F10细胞衍生的、H-2Kb限制性新表位加H-2Kb限制性SIINFEKL(SEQ ID NO:9)表位的多肽的Tarmogen(或其裂解物);IAb-cyto:表达具有多个B16F10细胞衍生的IA(b)结合性新表位加H-2Kb限制性SIINFEKL(SEQ ID NO:9)表位的多肽的Tarmogen(或其裂解物);Yvec:空酵母载体;Ovax:表达鸡卵清蛋白的Tarmogen(或其澄清酵母裂解物(YL))。
图3示出了来自免疫接种I-A
图4示出了YE-NEO-001-93疫苗接种产生抗原特异性CD4
图5示出了向完整Tramogen中添加裂解物的作用。cI IN:表达I类新表位融合的完整酵母;cII IN:表达II类新表位融合的完整酵母;cI IN+cI YL:1.25YU的cI IN与1.25YU的cI YL混合;cII IN+cII CL:1.25YU的cII IN与1.25YU的cII YL混合。天:肿瘤激发后的天数。第8天是组中的第一条(除了cI IN+Ci YL,未显示其第8天的数据);第10天是组中的中间条(除了cI IN+Ci YL,其第一条显示的是第10天);第12天是最后一条。
具体实施方式
本发明涉及制备和使用无酵母膜和酵母细胞壁的酵母裂解物(“酵母裂解物”或“YL”)的方法,该酵母裂解物是单独使用或与完整的基于酵母的免疫治疗性组合物组合使用作为与单独使用完整的免疫治疗性组合物相比增加疾病抗原特异性CTL应答量级的手段。在不受理论约束的情况下,增加应答的基本原理是:更快/更有效地获得抗原呈递细胞(APC)、和/或将APC暴露于双链RNA和DNA或衍生自酵母细胞质的其他细胞因子可以经由更有效的MHC装载和更强的APC激活(后者可通过(例如)激活Toll样受体(TLR)3和9来发生,而单独的完整Tarmogen无法有效地激活这些Toll样受体)来改善T细胞的抗原呈递。
如本文实例中所提供的,在鼠科动物体内CTL测定中测试了YL,并将其与完整的基于酵母的免疫治疗剂(即单独的Tarmogen(T))进行比较。结果表明,在针对5种不同Tarmogen候选疫苗的两个实验中,与T相比,YL显著改善了抗原特异性体内细胞溶解活性的量级。在这些实验中,T引发0至约20%的杀灭,而YL持续引发高达约80%至95%的杀灭。
在小鼠体内CTL模型中,使用酵母表达的卵清蛋白抗原以及某些酵母表达的多表位抗原作为测试案例,本发明导致CTL活性比单独的完整Tarmogen显著改善。结果示于实例1以及图1和图2。这种改善的CTL活性可以转化为人类临床试验中对传染病和癌症的显著优势。
在本文呈现的第三实例中,使用细胞内细胞因子染色将YL与完整酵母在产生抗原特异性CD4+T细胞应答的能力方面进行了比较。在第0天和第38天,用完整的对比裂解的“I-A
在本文呈现的第四实例中,使用细胞内细胞因子染色将YL与完整酵母在其产生抗原特异性CD8+T细胞应答的能力方面进行了比较。用完整的对比裂解的酵母(这些酵母表达与阳性对照表位SIINFEKL(SEQ ID NO:9)融合的多表位(I类T细胞新表位的多联体))对小鼠进行静脉内接种。该Tarmogen称为“93”(因多表位的大小为93kDa而命名),与上面实例中使用的变体相比,它含有不同排列和数量的新表位。在第0天和第38天进行免疫接种,并且在第二次免疫接种九天后,去除脾脏,并用无抗原(仅在生长培养基中的DMSO肽溶剂,=模拟品)肽或SIINFEKL(SEQ ID NO:9)肽(这是主要的鼠类I类MHC结合表位)刺激脾细胞制品。使用ICS测量SIINFEKL(SEQ ID NO:9)特异性召回CD8+T细胞应答的量级,然后用流式细胞术进行分析。结果表明,YL免疫接种产生比完整酵母高20倍的产生IFNγ和TNFα的新表位特异性CD8+T细胞(YL免疫接种产生0.45%TNFα+IFNγ+CD8 T细胞,对比模拟品产生0.022%,图4)。
在本文呈现的第五实例中,将多表位酵母K
YL被认为与任何其他已知疫苗的运作方式不同,因为它不仅能引发TLR 2、4、和6(完整酵母),还能引发TLR 3(在裂解物中被dsRNA激活)和TLR 9(在裂解物中被dsDNA激活)。YL混合物结合的其他受体包括Dectin-1和甘露糖受体(Haller等人)(由完整Tarmogen组分结合)。这种广泛的激活可以经由多种细胞途径导致有效和完全的APC激活。另外,混合物中完整Tarmogen的存在确保了APC会发生吞噬作用,然后伴随APC成熟的抗原交叉呈递。裂解物中的异源抗原和其他细胞组分(包括DNA和RNA/RNP)将伴随完整酵母进入吞噬体,从而在此过程中诱导多种激活途径。
本发明的一个实施例涉及免疫原性组合物,该免疫原性组合物包含(a)由酵母制备的酵母裂解物,其中该裂解物缺乏酵母膜和酵母细胞壁;和(b)与该酵母异源的至少一种抗原。
本发明的另一个实施例涉及免疫原性制剂,该免疫原性制剂包含:(a)第一免疫原性组合物,该第一免疫原性组合物包含(i)由酵母制备的酵母裂解物,其中该裂解物缺乏酵母膜和酵母细胞壁;和(ii)与该酵母异源的至少一种抗原;以及(b)第二免疫原性组合物,该第二免疫原性组合物包含(i)选自由以下组成的组的酵母媒介物:全酵母、酵母原生质球、酵母胞质体、酵母菌蜕(ghost)、和亚细胞酵母颗粒;和(ii)与该酵母异源的至少一种抗原。在该实施例的一个方面,第一免疫原性组合物和第二免疫原性组合物以约90:10、约80:20、约70∶30、约60∶40、约50∶50、约40∶60、约30∶70、约20∶80或约10∶90的比例组合。在一个优选实施例中,该比例为约50∶50。替代性实施例包括使用任何上述比例的范围作为终点(例如90∶10至10∶90或80∶20至30∶70)的第一和第二免疫原性组合物。在仍另一个方面,第一免疫原性组合物在组合的组合物中的百分比为约99%、约95%、约90%、约80%、约70%、约60%、约50%、约40%、30%、约20%或约10%、或10%至99%之间的任何整数百分比。百分比基于酵母单位。
本发明的又另一个实施例涉及产生免疫原性组合物的方法,该方法包括(a)裂解酵母细胞;和(b)从裂解的细胞中去除细胞壁和细胞膜,其中这些裂解的细胞包含与该酵母异源的抗原。在该实施例的一个方面,裂解步骤通过选自由以下组成的组的方法进行:玻璃珠破碎、高压匀浆、超声处理、电裂解、物理裂解、化学裂解、和酶裂解。在该实施例的又另一个方面,去除细胞壁和膜的步骤通过选自由以下组成的组的方法进行:离心、过滤和亲和层析。在一个方面,将免疫原性组合物与包含与全重组灭活酵母异源的至少一种抗原的全重组灭活酵母媒介物组合。在该实施例中,组合物可与酵母媒介物以约90∶10、约80∶20、约70∶30、约60∶40、约50∶50、约40∶60、约30∶70、约20∶80或约10∶90酵母单位当量的比例组合。
本发明的另一个实施例涉及在受试者中引发细胞毒性T细胞免疫应答的方法,该方法包括向该受试者施用免疫原性组合物,该免疫原性组合物包含:(a)由酵母制备的酵母裂解物,其中该裂解物缺乏酵母膜和酵母细胞壁;和(b)与该酵母异源的至少一种抗原。该方法可进一步包括向受试者施用全重组灭活酵母和由酵母表达的至少一种抗原的组合。
本发明的仍另一个实施例涉及在受试者中引发抗原特异性体液免疫应答和抗原特异性细胞介导的免疫应答的方法,所述方法包括向该受试者施用免疫原性组合物,该免疫原性组合物包含:(a)由酵母制备的酵母裂解物,其中该裂解物缺乏酵母膜和酵母细胞壁;和(b)与该酵母异源的至少一种抗原。该方法可进一步包括向受试者施用全重组灭活酵母和由酵母表达的至少一种抗原的组合。
本发明的免疫原性组合物包括由酵母制备的酵母裂解物,其中该裂解物缺乏酵母膜和酵母细胞壁。这种酵母裂解物由已经裂解的酵母(即其中细胞壁和膜已被破坏,从而使酵母细胞内含物暴露于组合物的其余部分的酵母)制备。酵母裂解物可以由灭活的(如热灭活的)酵母制备或由活酵母制备。酵母可以含有从质粒或整合的染色体等位基因在酵母内部表达的疾病相关抗原。例如,可以通过玻璃珠破碎来裂解酵母,如通过与PBS和500μL经酸洗的0.2μm玻璃珠以1.5mL总体积混合并在机械搅拌机中剧烈摇动混合物直至细胞破碎(如>97%的细胞破碎)来裂解酵母。可替代地,可以通过其他方法裂解酵母,这些方法包括高压匀浆,超声处理,以及电、物理、化学和酶技术。在优选实施例中,至少约80%的细胞破碎,至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%。
用于产生酵母裂解物的酵母菌株的优选属包括酵母菌属、假丝酵母属(Candida)、隐球菌属(Cryptococcus)、汉逊酵母属(Hansenula)、克鲁维酵母菌属(Kluyveromyces)、毕赤酵母属(Pichia)、红酵母属(Rhodotorula)、裂殖酵母属(Schizosaccharomyces)和亚罗酵母属(Yarrowia),更优选地为酵母菌属、假丝酵母属、汉逊酵母属、毕赤酵母属和裂殖酵母属,并且特别优选地为酵母菌属。酵母菌株的优选物种包括酿酒酵母(Saccharomycescerevisiae)、卡尔酵母(Saccharomyces carlsbergensis)、白色假丝酵母(Candidaalbicans)、乳酒假丝酵母(Candida kefyr)、热带假丝酵母(Candida tropicalis)、罗伦隐球酵母(Cryptococcus laurentii)、新型隐球菌(Cryptococcus neoformans)、异常汉逊酵母(Hansenula anomala)、多形汉逊酵母(Hansenula polymorpha)、脆壁克鲁维酵母(Kluyveromyces fragilis)、乳酸克鲁维酵母(Kluyveromyces lactis)、马克斯克鲁维酵母乳变种(Kluyveromyces marxianus var.lactis)、巴斯德毕赤酵母(Pichia pastoris)、深红酵母(Rhodotorula rubra)、粟酒裂殖酵母(Schizosaccharomyces pombe)和解脂耶氏酵母(Yarrowia lipolytica)。
然后进一步处理裂解的酵母细胞组合物以通过任何合适的方法去除酵母膜和酵母细胞壁,从而产生缺乏酵母膜和酵母细胞壁的酵母裂解物。例如,可以通过离心从裂解的酵母中去除酵母膜和酵母细胞壁,以产生不含细胞壁和膜的裂解物(上清液),如通过在25℃下以16,000rpm将裂解的酵母离心5分钟。可替代地,破碎后可以通过离心以外的手段清除裂解物的细胞壁和膜状碎片。例如,用conA珠过滤或处理细胞是替代方法。应当认识到,虽然本发明描述的是去除酵母膜和酵母细胞壁,或者参考了缺乏酵母膜和酵母细胞壁的裂解物,但是用于去除材料的合适方法可能不能从裂解物中去除100%的酵母膜和酵母细胞壁。在一些实施例中,去除了至少约80%的酵母膜和/或酵母细胞壁,至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%。
除了缺乏酵母膜和酵母细胞壁的酵母裂解物之外,本发明的免疫原性组合物还包含与酵母异源的至少一种抗原(该术语包括抗原的免疫原性结构域)。异源抗原可以在裂解之前由酵母表达,或者抗原可以在裂解之前或之后以及从裂解物中去除酵母膜和酵母细胞壁之前或之后与酵母组合。在一些实施例中,抗原作为融合蛋白(可以包括两种或更多种抗原)提供。在一个方面,融合蛋白可包括一种或多种抗原的两个或多个免疫原性结构域,或一种或多种抗原的两个或多个表位。
本发明包括至少一种“基于酵母的免疫治疗性组合物”(该短语可与“基于酵母的免疫治疗产品”、“基于酵母的免疫治疗性组合物”、“基于酵母的组合物”、“基于酵母的免疫治疗剂”或“基于酵母的疫苗”互换使用,可以是缺乏酵母膜和酵母细胞壁的酵母裂解物)的单独使用或与完整的基于酵母的免疫治疗性组合物(如Tarmogen)组合使用。基于酵母的免疫治疗性组合物引发足以在受试者中获得至少一种治疗益处的免疫应答。更特别地,基于酵母的免疫治疗性组合物是包含YL组分(单独或与完整的基于酵母的免疫治疗性组合物组合)的组合物,并且能够引发或诱导免疫应答,如细胞免疫应答,包括但不限于T细胞介导的细胞免疫应答。在一个方面,可用于本发明的基于酵母的免疫治疗性组合物能够诱导CD8+和/或CD4+T细胞介导的免疫应答,并且在一个方面,诱导CD8+和CD4+T细胞介导的免疫应答。任选地,基于酵母的免疫治疗性组合物能够引发体液免疫应答。可用于本发明的基于酵母的免疫治疗性组合物可以例如在个体中引发免疫应答,从而治疗该个体的疾病或病症,或由疾病或病症引起的症状。
本发明的基于酵母的免疫治疗性组合物可以是“预防性的”或“治疗性的”。当预防地提供时,在疾病或病症的任何症状之前提供本发明的免疫治疗性组合物。预防性施用免疫治疗性组合物用于预防或改善或延迟任何后续疾病的发作时间。当在治疗上提供时,在疾病的症状发作时或之后提供免疫治疗性组合物。术语“疾病”是指与动物正常健康的任何偏离,并且包括出现疾病症状时的状态、以及已经发生偏离(例如,肿瘤生长、感染等)但症状尚未显现的病症。
在一个实施例中,本发明的酵母裂解物由完整的基于酵母的免疫治疗组合物制成。另外,在本发明中,这种完整的基于酵母的免疫治疗组合物可以与基于酵母裂解物的组合物组合。这种完整的基于酵母的免疫治疗组合物通常包含酵母媒介物和与酵母异源的抗原。
还在以下文献中详细描述了此类基于完整酵母的免疫治疗组合物以及制备和通常使用该组合物的方法:例如,美国专利号5,830,463、美国专利号7,083,787、美国专利号7,465,454、美国专利公开号2007-0224208、美国专利公开号US 2008-0003239,以及Stubbs等人,Nat.Med[自然医学].7:625-629(2001),Lu等人,Cancer Research[癌症研究]64:5084-5088(2004),和Bernstein等人,Vaccine[疫苗]2008年1月24日;26(4):509-21,其各自通过引用以其全文并入本文。这些基于酵母的免疫治疗性产品已表现出引发免疫应答,包括细胞和体液免疫应答。基于酵母的免疫治疗性产品能够在多种动物物种体内杀灭表达多种抗原的靶细胞,并能够经由抗原特异性CD4+和CD8+介导的免疫应答来杀灭该靶细胞。另外的研究表明,酵母被树突细胞贪婪地吞噬并直接激活树突细胞,然后以高效的方式将酵母相关蛋白呈递给CD4+和CD8+T细胞。参见,例如,Stubbs等人Nature Med[自然医学].5:625-629(2001)和美国专利号U.S.7,083,787。
在用于本发明的任何基于酵母的免疫治疗组合物中,与酵母媒介物有关的以下方面包括在本发明中。根据本发明,酵母媒介物是本发明的治疗组合物中可以与一种或多种抗原、其免疫原性结构域或其表位结合使用的任何酵母细胞(例如,全细胞或完整细胞)或其衍生物(见下文)。因此,酵母媒介物可以包括但不限于活的完整酵母微生物(即,具有其所有组分(包括细胞壁)的酵母细胞)、杀灭的(死亡的)或灭活的完整酵母微生物或其衍生物,包括:酵母原生质球(即缺乏细胞壁的酵母细胞)、酵母细胞质(即缺乏细胞壁和细胞核的酵母细胞)、酵母菌蜕(即缺乏细胞壁、细胞核和细胞质的酵母细胞)、亚细胞酵母膜提取物或其部分(也称为酵母膜颗粒,以前称为亚细胞酵母颗粒)、任何其他酵母颗粒或酵母细胞壁制剂。
酵母原生质球通常通过酵母细胞壁的酶消化产生。这种方法描述于例如Franzusoff等人,1991,Meth.Enzymol[酶学方法]194,662-674中,将其通过引用以其全文并入本文。
酵母细胞质通常通过酵母细胞去核产生。这种方法描述于例如Coon,1978,Natl.Cancer Inst.Monogr.[国家癌症研究所杂志专著]48,45-55中,将其通过引用以其全文并入本文。
酵母菌蜕通常是通过将经透化的或裂解的细胞重新密封而产生,并且可以而非必须含有该细胞的至少一些细胞器。这种方法描述于例如在Franzusoff等人,1983,J.Biol.Chem.[生物化学杂志]258,3608-3614和Bussey等人,1979,Biochim.Biophys.Acta[生物化学与生物物理学报]553,185-196,其各自通过引用以其全文并入本文。
酵母膜颗粒(亚细胞酵母膜提取物或其部分)是指缺乏天然细胞核或细胞质的酵母膜。该颗粒可以是任何大小的,包括范围从天然酵母膜的大小到通过超声处理或本领域技术人员已知的其他膜破碎方法然后重新密封产生的微粒的大小。用于产生亚细胞酵母膜提取物的方法描述于例如Franzusoff等人,1991,Meth.Enzymol.[酶学方法]194,662-674中。还可以使用含有酵母膜部分和(在制备酵母膜颗粒前由酵母重组表达抗原时)抗原或其他目的蛋白的酵母膜颗粒的部分。抗原或其他目的蛋白可以在膜内部、在膜的任一表面上或其组合(即,蛋白质既有膜内的又有膜外的,和/或跨越酵母膜颗粒的膜)运载。在一个实施例中,酵母膜颗粒是重组酵母膜颗粒,其可以是完整的、被破坏的、或被破坏并重新密封的酵母膜,其在膜表面上含有至少一种所希望的抗原或其他目的蛋白、或至少部分包埋在膜内。
酵母细胞壁制剂的一个实例是在其表面上携带抗原或至少部分包埋在细胞壁内的分离的酵母细胞壁,使得酵母细胞壁制剂在施用于动物时刺激针对疾病靶标的所希望的免疫应答。
任何酵母菌株均可用于产生酵母媒介物(用于产生酵母裂解物或与酵母裂解物组合使用)。酵母是属于以下三个纲之一的单细胞微生物:子囊菌纲、担子菌纲和不完全菌纲。关于选择用作免疫调节剂的酵母类型的一个考虑因素是酵母的致病性。在一个实施例中,该酵母是一种非致病性菌株,例如酿酒酵母。选择非致病性酵母菌株使得对施用酵母媒介物的个体的任何不良反应最小化。然而,如果酵母的致病性可以通过本领域技术人员已知的任何手段(例如,突变菌株)来消除,则可以使用致病性酵母。根据本发明的一个方面,使用非致病性酵母菌株。
可用于本发明的酵母菌株的属包括但不限于酵母菌属、假丝酵母属(可以是致病性的)、隐球菌属、汉逊酵母属、克鲁维酵母菌属、毕赤酵母属、红酵母属、裂殖酵母属和亚罗酵母属。在一方面,酵母属选自酿酒酵母、假丝酵母、汉逊酵母、毕赤酵母或裂殖酵母,并且在一个方面,使用酿酒酵母。可用于本发明的酵母菌株的物种包括但不限于酿酒酵母、卡尔酵母、白色假丝酵母、乳酒假丝酵母、热带假丝酵母,罗伦隐球酵母、新型隐球菌、异常汉逊酵母、多形汉逊酵母、脆壁克鲁维酵母、乳酸克鲁维酵母、马克斯克鲁维酵母乳变种、巴斯德毕赤酵母、深红酵母、粟酒裂殖酵母和解脂耶氏酵母。应当理解,这些物种中的许多物种包括旨在包括在上述物种内的各种亚种、类型、亚型等。在一个方面,在本发明中使用的酵母物种包括酿酒酵母、白色假丝酵母、多形汉逊酵母、巴斯德毕赤酵母和粟酒裂殖酵母。酿酒酵母是有用的,因为酿酒酵母相对容易操作并且用作食品添加剂而被“公认安全”或“GRAS”(GRAS,FDA建议的规则62FR18938,1997年4月17日)。本发明的一个实施例为能将质粒复制至特别高拷贝数的酵母菌株(例如,酿酒酵母环状(cir°)菌株)。酿酒酵母菌株是一种这样的菌株,该菌株能够支持表达载体,这些表达载体允许一种或多种靶抗原和/或抗原融合蛋白和/或其他蛋白以高水平表达。另外,任何突变的酵母菌株都可以用于本发明,包括那些表现出降低的表达的靶抗原或其他蛋白质的翻译后修饰的菌株,例如延伸N-联糖基化的酶中的突变。
在一个实施例中,本发明的酵母媒介物能够与接受酵母媒介物和抗原/药剂递送的细胞类型(如树突细胞或巨噬细胞)融合,由此实现特别有效的将酵母媒介物和(在许多实施例中)一个或多个抗原或其他药剂递送至该细胞类型。如本文所用,酵母媒介物与靶细胞类型的融合是指酵母细胞膜或其颗粒与靶细胞类型(例如树突细胞或巨噬细胞)的膜融合而导致合胞体形成的能力。如本文所用,合胞体是通过细胞合并而产生的多核原生质。许多病毒表面蛋白(包括免疫缺陷病毒,如HIV、流感病毒、脊髓灰质炎病毒和腺病毒的那些)和其他促融剂(fusogen)(如涉及卵子与精子间融合的那些)已经显示出能够实现两种膜之间(即在病毒与哺乳动物细胞膜之间或在哺乳动物细胞膜之间)的融合。例如,在其表面产生HIV gpl20/gp41异源抗原的酵母媒介物能够与CD4+T淋巴细胞融合。然而,应注意,将靶向部分掺入酵母媒介物不是必需的,尽管这可能是有些情况中所期望的。在酵母媒介物在细胞外表达抗原的情况下,这可以是本发明的酵母媒介物的另一个优点。通常,树突细胞(以及其他细胞,如巨噬细胞)容易摄取可用于本发明的酵母媒介物。
本发明的免疫原性组合物包含与形成该组合物的酵母异源的至少一种抗原。Yl或完整的免疫治疗性组合物中的抗原可以由酵母表达(对于YL,在其裂解前表达),或可以添加到免疫治疗性组合物中。一种或多种抗原可以是病毒抗原、哺乳动物蛋白、哺乳动物细胞表面分子、细菌抗原、真菌抗原、原生动物抗原、蠕虫抗原、外寄生物抗原和癌抗原。
根据本发明,本文中通用的术语“抗原”是指:蛋白质的任何部分(肽、部分蛋白质、全长蛋白质),其中该蛋白质是天然存在的或合成衍生的;细胞组合物(全细胞、细胞裂解物或破碎的细胞);微生物或细胞(全微生物、裂解物或破碎的细胞)或碳水化合物,或其他分子或其部分。在一些实施例中,抗原可针对免疫系统的元件(例如,T细胞、抗体)遇到的相同或类似抗原引发抗原特异性免疫应答(例如,体液和/或细胞介导免疫应答)。术语“癌抗原”在本文中可以与术语“肿瘤特异性抗原”、“肿瘤相关抗原”、“癌相关靶标”或“肿瘤相关靶标”或“新生抗原”互换使用。
抗原可以小至单个表位或更大,并且可以包含多个表位。因此,抗原的大小可以小至约5-16个氨基酸(例如,小肽),并且大至:蛋白质的结构域、部分蛋白质(肽或多肽)、全长蛋白质(包括多聚体和融合蛋白)、嵌合蛋白或激动剂蛋白或肽。另外,抗原可以包括碳水化合物。
当提及刺激免疫应答时,术语“免疫原”是术语“抗原”的子集,因此,在一些情况下,它可以与术语“抗原”互换使用。如本文所用,免疫原描述了引发体液和/或细胞介导的免疫应答的(即,是免疫原性的)抗原,使得在适当的情况下(例如,作为基于酵母的免疫治疗组合物的一部分)向个体施用免疫原会引发或诱导针对个体免疫系统遇到的相同或相似抗原的抗原特异性免疫应答。
给定抗原的“免疫原性结构域”可以是抗原的任何部分、片段或表位(例如,肽片段或亚基或抗体表位或其他构象表位),其含有至少一个在向动物施用时起免疫原作用的表位。例如,单个蛋白质可以含有多个不同的免疫原性结构域。免疫原性结构域不必是蛋白质内的线性序列,如在体液免疫应答的情况下。
表位在本文中定义为足以引发免疫应答的给定抗原内的单个免疫原性位点。本领域技术人员将认识到,T细胞表位在大小和组成上与B细胞表位不同,并且通过I类MHC途径呈递的表位与通过II类MHC途径呈递的表位不同。表位可以是线性序列或构象表位(保守的结合区)。
预期用于本发明的抗原包括期望针对其引发免疫应答的任何抗原,并且特别地,包括针对该抗原的治疗性免疫应答将有益于个体的任何抗原。例如,抗原可以包括但不限于与病原体相关的任何抗原,包括病毒抗原、真菌抗原、细菌抗原、蠕虫抗原、寄生物抗原、外寄生物抗原、原生动物抗原或来自任何其他感染原的抗原。抗原还可以包括与特定疾病或病症相关的任何抗原,无论是来自致病来源还是细胞来源,包括但不限于癌抗原、与自身免疫性疾病相关的抗原(例如糖尿病抗原)、过敏反应抗原(过敏原)、携带一个或多个突变氨基酸的哺乳动物细胞分子、通常由哺乳动物细胞在出生前或新生时表达的蛋白质、通过流行病学因素(例如病毒)的插入而诱导表达的蛋白质、通过基因易位而诱导表达的蛋白质、以及通过调节序列的突变而诱导表达的蛋白质。这些抗原可以是天然抗原或以某种方式(例如,改变序列或产生融合蛋白)修饰的基因工程化的抗原。应当理解,在一些实施例中(即,当抗原由酵母媒介物从重组核酸分子表达时),抗原可以是蛋白质或其任何表位或免疫原性结构域、融合蛋白或嵌合蛋白,而不是整个细胞或微生物。
可用于本发明的基于酵母的免疫治疗组合物中的其他抗原包括与抑制不希望的或有害的免疫应答有关的抗原,例如该免疫应答是如由过敏原、自身免疫抗原、致炎因子、GVHD涉及的抗原、某些癌症、感染性休克抗原以及移植排斥涉及的抗原引起。
在本发明的一个方面,可用于本发明的一种或多种免疫治疗组合物中的抗原包括任何与癌症或肿瘤相关的抗原。在一个方面,抗原包括与肿瘤出现前状态或增生状态相关的抗原。抗原也可以与癌症相关或引起癌症。这种抗原可以是肿瘤特异性抗原、肿瘤相关抗原(TAA)或组织特异性抗原,其表位及其表位激动剂。癌抗原包括但不限于来自任何肿瘤或癌症的抗原,该肿瘤或癌症包括但不限于黑色素瘤、鳞状细胞癌、乳腺癌、头颈部癌、甲状腺癌、软组织肉瘤、骨肉瘤、睾丸癌、前列腺癌、卵巢癌、膀胱癌、皮肤癌、脑癌、血管肉瘤、血管内皮瘤、肥大细胞瘤、白血病、淋巴瘤、原发性肝癌、肺癌、胰腺癌、胃肠道癌(包括结直肠癌)、肾细胞癌、造血肿瘤及其转移癌。
合适的癌抗原包括但不限于癌胚抗原(CEA)及其表位,如CAP-1、CAP-1-6D(基因库登录号M29540)、MART-1(Kawakami等人,J.Exp.Med.[实验医学杂志]180:347-352,1994)、MAGE-1(美国专利号5,750,395)、MAGE-3、GAGE(美国专利号5,648,226)、GP-100(Kawakami等人,Proc.Nat′l Acad.Sci.USA[美国国家科学院院刊]91:6458-6462,1992)、MUC-1、MUC-2、点突变Ras癌蛋白、正常和点突变p53癌蛋白(Hollstein等人,Nucleic Acids Res.[核酸研究]22:3551-3555,1994)、PSMA(Israeli等人Cancer Res.[癌症研究]53:227-230,1993)、酪氨酸酶(Kwon等人PNAS[美国科学院院报]84:7473-7477,1987)、TRP-1(gp75)(Cohen等人Nucleic Acids Res.[核酸研究]18:2807-2808,1990;美国专利号5,840,839)、NY-ESO-1(Chen等人PAS 94:1914-1918,1997)、TRP-2(Jackson等人,EMBOJ[欧洲分子生物学学会杂志],11:527-535,1992)、TAG72,KSA、CA-125、PSA、HER-2/neu/c-erb/B2(美国专利号5,550,214)、EGFR、hTERT、p73、B-RAF、腺瘤性结肠息肉病(APC)、Myc、希佩尔-林道(yonHippel-Lindau)蛋白(VHL)、Rb-1、Rb-2、雄激素受体(AR)、Smad4、MDR1、Flt-3、BRCA-1、BRCA-2、Bcr-Abl、pax3-fkhr、ews-fli-1、Brachyury、HERV-H、HERV-K、TWIST、间皮素、NGEP、此类抗原和组织特异性抗原的修饰、此类抗原的剪接变体、和/或此类抗原的表位激动剂。其他癌抗原是本领域中已知的。其他癌抗原也可以通过本领域已知的方法(例如美国专利号4,514,506中披露的那些)进行鉴定、分离和克隆。癌抗原还可包括一种或多种生长因子以及每种的剪接变体。
癌抗原也可以是由肿瘤内正常细胞蛋白的基因突变产生的非自身新生抗原。这些新突变可产生新颖的T细胞新表位,因此代表了基于酵母的免疫治疗的大量潜在新靶标。
在本发明的一个方面,可用于本发明的一种或多种免疫治疗组合物中的抗原包括与病原体或由病原体引起或与之相关的疾病或病症有关的任何抗原。此类抗原包括但不限于与病原体相关的任何抗原,包括病毒抗原、真菌抗原、细菌抗原、蠕虫抗原、寄生物抗原、外寄生物抗原、原生动物抗原或来自任何其他感染原的抗原。
在一个方面,抗原来自病毒,包括但不限于腺病毒、沙粒病毒、布尼亚病毒、冠状病毒、柯萨奇病毒、巨细胞病毒、EB病毒、虫媒病毒、嗜肝DNA病毒、肝炎病毒、疱疹病毒、流感病毒、慢病毒、麻疹病毒、腮腺炎病毒、黏液病毒、正粘病毒、乳头瘤病毒、乳多空病毒、副流感病毒、副粘病毒、细小病毒、微小RNA病毒、痘病毒、狂犬病病毒、呼吸道合胞体病毒、呼肠孤病毒、弹状病毒、风疹病毒、披膜病毒和水痘病毒。其他病毒包括T淋巴细胞营养病毒,如人T细胞淋巴营养病毒(HTLV,如HTLV-I和HTLV-II)、牛白血病病毒(BLVS)和猫白血病病毒(FLV)。慢病毒包括但不限于人(HIV,包括HIV-1或HIV-2)、猿猴(SIV)、猫(FIV)和犬(CIV)免疫缺陷病毒。在一个实施例中,病毒抗原包括来自非致癌病毒的那些。
在另一个方面,抗原来自选自以下的属的感染原:曲霉属(Aspergillus)、博德氏菌属(Bordatella)、布鲁格氏丝虫属(Brugia)、假丝酵母属(Candida)、衣原体属(Chlamydia)、球虫属(Coccidia)、隐球菌属(Cryptococcus)、恶丝虫属(Dirofilaria)、埃希氏菌属(Escherichia)、弗朗西丝氏菌属(Francisella)、淋球菌属(Gonococcus)、组织胞浆菌属(Histoplasma)、利什曼原虫属(Leishmania)、分枝杆菌属(Mycobacterium)、支原体属(Mycoplasma)、草履虫属(Paramecium)、百日咳属(Pertussis)、疟原虫属(Plasmodium)、肺炎球菌属(Pneumococcus)、肺孢子菌属(Pneumocystis)、立克次氏体属(Rickettsia)、沙门氏菌属(Salmonella)、志贺氏菌属(Shigella)、葡萄球菌属(Staphylococcus)、链球菌属(Streptococcus)、弓形体属(Toxoplasma)、霍乱弧菌属(Vibriocholerae)、和耶尔森菌属(Yersinia)。在一个方面,感染原选自恶性疟原虫(Plasmodium falciparum)或间日疟原虫(Plasmodium vivax)。
在一个方面,抗原来自选自以下的科的细菌:肠杆菌科(Enterobacteriaceae)、微球菌科(Micrococcaceae)、弧菌科(Vibrionaceae)、巴斯德杆菌科(Pasteurellaceae)、支原体科(Mycoplasmataceae)和立克次氏体科(Rickettsiaceae)。在一个方面,细菌是选自以下的属:假单胞菌属(Pseudomonas)、博德氏菌属(Bordetella)、分枝杆菌属(Mycobacterium)、弧菌属(Vibrio)、芽孢杆菌属(Bacillus)、沙门氏菌属、弗朗西丝氏菌属、葡萄球菌属、链球菌属、埃希氏菌属、肠球菌属(Enterococcus)、巴斯德菌属(Pasteurella)、和耶尔森菌属。在一个方面,细菌来自选自以下的物种:铜绿假单胞菌(Pseudomonas aeruginosa)、鼻疽假单胞菌(Pseudomonas mallei)、类鼻疽假单胞菌(Pseudomonas pseudomallei)、百日咳博德特菌(Bordetella pertussis)、结核分枝杆菌(Mycobacterium tuberculosis)、麻风分枝杆菌(Mycobacterium leprae)、土拉热弗朗西丝菌(Francisella tularensis)、霍乱弧菌(Vibrio cholerae)、炭疽芽孢杆菌(Bacillusanthracis)、肠沙门菌(Salmonella enteric)、鼠疫耶尔森菌(Yersinia pestis)、大肠杆菌(Escherichia coli)和支气管炎博德特菌(Bordetella bronchiseptica)。
在一个方面,抗原来自真菌,这种真菌包括但不限于来自酿酒酵母属物种、曲霉属物种、隐球菌属物种、球孢子菌属物种、链孢霉属物种、组织胞浆菌属物种、或芽生菌属物种的真菌。在一个方面,真菌来自选自以下的物种:烟曲霉(Aspergillus fumigatus)、黄曲霉(A.flavus)、黑曲霉(A.niger)、土曲霉(A.terreus)、构巢曲霉(A.nidulans)、粗球孢子菌(Coccidioides immitis)、波萨达斯球孢子菌(Coccidioides posadasii)或新型隐球菌(Cryptococcus neoformans)。引起侵袭性疾病的曲霉菌属最常见的物种包括烟曲霉、黄曲霉、黑曲霉、土曲霉和构巢曲霉,并且例如可发现于具有免疫抑制、或T细胞或吞噬功能障碍的患者中。烟曲霉与哮喘、肺曲霉球和侵袭性曲霉病有关。球孢子菌病,也称为圣华金山谷热(San Joaquin Valley Fever),是由粗球孢子菌引起的真菌病,并且可导致急性呼吸道感染和慢性肺部病症或扩散到脑膜、骨骼和关节。本发明的方法也靶向隐球菌病相关病症,例如在非免疫抑制的或免疫抑制的受试者(如感染了HIV的受试者)中。
在一些实施例中,抗原是融合蛋白。在本发明的一个方面,融合蛋白可以包括两个或多个抗原。在一个方面,融合蛋白可包括两个或多个免疫原性结构域,或一种或多种抗原的两个或多个表位。含有此类抗原的免疫治疗性组合物可以为广泛的患者提供抗原特异性免疫接种。例如,可用于本发明的多结构域融合蛋白可具有多个结构域,其中每个结构域由来自特定蛋白的肽组成,该肽由位于蛋白质的两侧并且包括在蛋白质中发现的突变氨基酸的至少4个氨基酸残基组成,其中该突变与特定疾病或症状相关。
在一个实施例中,使用对酵母中异源抗原的表达特别有用的构建体来生产用作本发明中使用的基于酵母的免疫治疗性组合物的组分的融合蛋白。通常,一种或多种所希望的抗原蛋白或肽在其氨基末端融合至:(a)稳定融合蛋白在酵母媒介物中的表达或防止所表达的融合蛋白的翻译后修饰的特定合成肽(此类肽详细描述于例如2004年8月12日公开的美国专利公开号2004-0156858 A1中,将其通过引用以其全文并入本文);(b)内源性酵母蛋白的至少一部分,其中任一融合伴侣均可显著增强蛋白在酵母中表达的稳定性和/或防止酵母细胞对蛋白进行翻译后修饰(此类蛋白还详细描述于例如:美国专利公开号2004-0156858 A1,同上);和/或(c)使融合蛋白在酵母表面表达的至少一部分酵母蛋白(例如,Aga蛋白,在本文中有更详细的描述)。另外,本发明包括与编码抗原的构建体的C-末端融合的肽的用途,特别是用于蛋白质的选择和鉴定。此类肽包括但不限于任何合成的或天然的肽,如肽标签(例如6X His)或任何其他短表位标签。与根据本发明的抗原的C-末端附接的肽可以在添加或不添加上述N-末端肽的情况下使用。
在一个实施例中,可用于融合蛋白的合成肽与抗原的N-末端连接,该肽由与抗原异源的至少两个氨基酸残基组成,其中该肽稳定融合蛋白在酵母媒介物中的表达或防止所表达的融合蛋白的翻译后修饰。合成肽和抗原的N-末端部分共同形成融合蛋白,其具有以下要求:(1)融合蛋白第一位的氨基酸残基是甲硫氨酸(即,合成肽中的第一个氨基酸是甲硫氨酸);(2)融合蛋白第二位的氨基酸残基不是甘氨酸或脯氨酸(即,合成肽中的第二个氨基酸不是甘氨酸或脯氨酸);(3)融合蛋白2-6位的氨基酸残基都不是甲硫氨酸(即,无论是合成肽的一部分还是蛋白质的一部分(如果合成肽少于6个氨基酸),在2-6位的氨基酸不包括甲硫氨酸);以及(4)融合蛋白第2-6位的氨基酸都不是赖氨酸或精氨酸(即,无论是合成肽的一部分还是蛋白质的一部分(如果合成肽少于5个氨基酸),第2-6位的氨基酸不包括赖氨酸或精氨酸)。合成肽可以短至两个氨基酸,但在一个方面至少是2-6个氨基酸(包括3、4、5个氨基酸),并且可以大于6个氨基酸(完整整数),多达约200个氨基酸、300个氨基酸、400个氨基酸、500个氨基酸或更多。
在一个实施例中,融合蛋白包含M-X2-X3-X4-X5-X6的氨基酸序列,其中M是甲硫氨酸;其中X2是除甘氨酸、脯氨酸、赖氨酸或精氨酸之外的任何氨基酸;其中X3是除甲硫氨酸、赖氨酸或精氨酸之外的任何氨基酸;其中X4是除甲硫氨酸、赖氨酸或精氨酸之外的任何氨基酸;其中X5是除甲硫氨酸、赖氨酸或精氨酸之外的任何氨基酸;并且其中X6是除甲硫氨酸、赖氨酸或精氨酸之外的任何氨基酸。在一个实施例中,X6残基是脯氨酸。增强酵母细胞中抗原表达的稳定性和/或防止酵母中蛋白质的翻译后修饰的示例性合成序列包括序列M-A-D-E-A-P(SEQ ID NO:10)。除了增强表达产物的稳定性外,该融合伴侣似乎不会对构建体中针对接种抗原的免疫应答产生负面影响。另外,可以设计合成融合肽以提供可以被选择剂(如抗体)识别的表位。
本发明包括向受试者递送(施用、免疫接种)本发明的组合物。施用过程可以离体或体内进行,但是通常在体内进行。离体施用是指在患者体外进行部分递送步骤,如在酵母媒介物、一种或多种抗原和任何其他药剂或组合物装载入细胞的条件下,向从患者体内取出的细胞群体(树突细胞)施用本发明的组合物,并将这些细胞返回给患者。这可以包括YL或与tarmogen混合的YL。本发明的治疗组合物可以返回给患者或施用给患者(通过任何合适的施用模式)。
施用组合物可以是全身的、黏膜的和/或接近靶位点的位置(例如,肿瘤附近)。根据要预防或治疗的病症类型、所使用的抗原、和/或靶细胞群体或组织,本领域技术人员将清楚地看到合适的施用途径。各种可接受的施用方法包括但不限于静脉内施用、腹膜内施用、肌内施用、结节内施用、冠状动脉内施用、动脉内施用(例如进入颈动脉内)、皮下施用、眶后施用、透皮递送、气管内施用、皮下施用、关节内施用、脑室内施用、吸入(例如气雾剂)、颅内、脊柱内、眼内、耳内、鼻内、口服、肺部施用、导管的浸渍以及直接注射到组织中。在一个方面,施用途径包括:静脉内、腹膜内、皮下、皮内、结节内、肌内、透皮、吸入、鼻内、口服、眼内,关节内、颅内和脊柱内。肠胃外递送可包括皮内、肌内、腹膜内、胸膜内、肺内、静脉内、皮下、心房导管和静脉导管途径。耳内递送可以包括滴耳剂,鼻内递送可以包括滴鼻剂或鼻内注射,以及眼内递送可以包括滴眼剂。气雾剂(吸入)递送也可以使用本领域标准的方法进行(参见,例如,Stribling等人,Proc.Natl.Acad.Sci.USA[美国国家科学院院刊]189:11277-11281,1992,将其通过引用以其全文并入本文)。调节黏膜免疫的其他施用途径可用于治疗病毒感染。此类途径包括支气管、皮内、肌内、鼻内、其他吸入、直肠、皮下、局部、透皮、阴道和尿道途径。在一个方面,皮下施用本发明的免疫治疗性组合物。
本发明的免疫原性组合物可被配制成适于通过注射向受试者施用的药学上可接受的赋形剂。
关于本发明的基于酵母的免疫治疗组合物,通常,合适的单个剂量是指当在合适时间段内施用一次或多次时,能够以有效地引发抗原特异性免疫应答的量向患者身体的给定细胞类型、组织或区域有效地提供本发明的组合物的剂量。例如,在一个实施例中,本发明的组合物的单个剂量为每千克接受该组合物的生物的体重约1x 10
例如,当针对抗原的免疫应答减弱或根据需要提供针对一种或多种特定抗原的免疫应答或诱导记忆应答时,施用治疗组合物的“加强剂量(boosters)”或“促进剂量(boosts)”。初次施用后,加强剂量的施用间隔可以是每隔约1、2、3、4、5、6、7或8周,每月、每两月、每季度、每年、每几年。在一个实施例中,施用方案是:以每千克生物体重约1x 10
本发明的免疫原性组合物可以每周、每隔一周和/或每月施用于受试者。组合物可以每40天施用一次。在仍另一个方面,组合物可以每60天施用一次。在仍另一个方面,组合物可以每38至40天施用一次。
在一个方面,吸入裂解物以治疗肺部疾病。这种情况无论是否与完整Tarmogen混合均可发生,并且可通过加压定量吸入器(pMDI)、雾化器和干粉吸入器(DPI)来实现。
本发明设想了产生酵母媒介物以及表达酵母媒介物、将酵母媒介物与抗原和/或其他蛋白质和/或目的药剂组合和/或缔合以产生基于酵母的免疫治疗组合物的方法。
根据本发明,术语“酵母-裂解物-抗原复合物”、“酵母媒介物-抗原复合物”或“酵母-抗原复合物”通常用于描述酵母裂解物或酵母媒介物与抗原的任何缔合,并且当如上所述使用这种组合物引发免疫应答时,可以与“基于酵母的免疫治疗组合物”互换使用。此类缔合包括通过酵母(重组酵母)表达抗原、将抗原引入酵母、将抗原物理附接到酵母上、以及将酵母和抗原混合在一起(如在缓冲液或其他溶液或配制品中)。下面详细描述了这些类型的复合物。将会认识到,酵母裂解物-抗原复合物可以通过本文所述的方法由酵母媒介物-抗原复合物形成。
在一个实施例中,用编码蛋白质(例如抗原或药剂)的异源核酸分子转染用于制备酵母媒介物的酵母细胞,以使该蛋白质由该酵母细胞表达。这种酵母在本文中也称为重组酵母或重组酵母媒介物。然后可以将酵母细胞作为完整细胞装载到树突细胞中,或者可以杀灭酵母细胞,或者可以将其衍生化(如通过形成酵母原生质球、胞质体、菌蜕或亚细胞颗粒,其任一种之后都要将衍生物装载到树突细胞中)。酵母原生质球也可以直接用重组核酸分子转染(例如,由全酵母产生原生质球,然后转染),以产生表达抗原或其他蛋白质的重组原生质球。
在一个方面,将用于制备酵母媒介物的酵母细胞或酵母原生质球用编码一种或多种抗原或其他蛋白质的重组核酸分子转染,从而使该抗原或其他蛋白质由该酵母细胞或酵母原生质球重组表达。在这个方面,将重组表达一种或多种抗原或其他蛋白质的酵母细胞或酵母原生质球用于产生包含酵母胞质体、酵母菌蜕或酵母膜颗粒或酵母细胞壁颗粒或其级分的酵母媒介物。
通常,可以通过本文描述的任何技术将酵母媒介物和一种或多种抗原或其他药剂缔合。在一个方面,酵母媒介物在细胞内装载有一种或多种抗原和/或一种或多种药剂。在另一个方面,一种或多种抗原和/或一种或多种药剂以共价或非共价的形式附接到酵母媒介物上。在又另一个方面,通过混合使酵母媒介物与一种或多种抗原和/或一种或多种药剂缔合。在另一个方面,并且在一个实施例中,一种或多种抗原和/或一种或多种药剂由酵母媒介物重组表达或由衍生了酵母媒介物的酵母细胞或酵母原生质球重组表达。
由本发明的酵母媒介物产生的抗原和/或其他蛋白质的数目是任何数目的可由酵母媒介物合理地产生的抗原和/或其他蛋白质,并且通常范围在至少一种至至少约6种或更多(包括约2种至约6种)的异源抗原和/或其他蛋白质。
使用本领域技术人员已知的技术完成抗原或其他蛋白质在本发明的酵母媒介物中的表达。简而言之,将编码至少一种所希望的抗原或其他蛋白质的核酸分子以使得该核酸分子与转录控制序列可操作地连接的方式插入表达载体,从而能够在转化为宿主酵母细胞时影响该核酸分子的组成型或调节性表达。编码一种或多种抗原和/或其他蛋白质的核酸分子可以在与一种或多种表达控制序列可操作地连接的一种或多种表达载体上。特别重要的表达控制序列是控制转录起始的那些序列(例如启动子和上游激活序列)。任何合适的酵母启动子都可用于本发明,并且多种此类启动子是本领域技术人员已知的。在酿酒酵母中表达的启动子包括但不限于编码以下酵母蛋白的基因的启动子:CUP1、醇脱氢酶I(ADH1)或II(ADH2)、磷酸甘油酸激酶(PGK)、磷酸丙糖异构酶(TPI)、翻译延伸因子EF-1α(TEF2)、甘油醛-3-磷酸脱氢酶(GAPDH;还被称为TDH3,用于磷酸丙糖脱氢酶)、半乳糖激酶(GAL1)、半乳糖-1-磷酸尿嘧啶转移酶(GAL7)、UDP-半乳糖表异构酶(GAL10)、细胞色素c1(CYC1)、Sec7蛋白(SEC7)和酸性磷酸酶(PHO5),包括杂合启动子,如ADH2/GAPDH和CYC1/GAL10启动子,并且包括ADH2/GAPDH启动子(当细胞中葡萄糖浓度低(例如,约0.1%至约0.2%)时被诱导),以及CUP1启动子和TEF2启动子。同样,已知许多上游激活序列(UAS)(也被称为增强子)。用于在酿酒酵母中表达的上游激活序列包括但不限于编码以下蛋白质的基因的UAS:PCK1、TPI、TDH3、CYC1、ADH1、ADH2、SUC2、GAL1、GAL7和GAL10,以及由GAL4基因产物激活的其他UAS,其中在一方面使用ADH2 UAS。由于ADH2 UAS被ADR1基因产物激活,当异源基因与ADH2UAS可操作地连接时,可能更优选过表达ADR1基因。用于在酿酒酵母中表达的转录终止序列包括α-因子、GAPDH和CYC1基因的终止序列。
在甲基营养型酵母中表达基因的转录控制序列包括编码醇氧化酶和甲酸脱氢酶的基因的转录控制区。
根据本发明,可以通过任何方法来完成将核酸分子转染到酵母细胞中,通过该方法将核酸分子施用到细胞中,并且包括但不限于扩散、主动转运、浴超声处理、电穿孔、微注射、脂质转染、吸附和原生质体融合。可以使用本领域技术人员已知的技术将转染的核酸分子整合到酵母染色体中,或维持在染色体外载体上。本文详细披露了携带此类核酸分子的酵母媒介物的实例。如上所讨论的,还可以通过用所希望的核酸分子转染完整的酵母微生物或酵母原生质球,在其中产生抗原,并然后使用对于本领域技术人员已知的技术进一步处理这些微生物或原生质球,以产生包含所希望的抗原或其他蛋白质的细胞质、菌壳或亚细胞酵母膜提取物或其级分,重组产生酵母细胞质、酵母菌壳和酵母膜颗粒或细胞壁制剂。
用于产生重组酵母媒介物和由酵母媒介物表达抗原和/或其他蛋白质(例如,如本文所述的药剂)的有效条件包括可以在其中培养酵母菌株的有效培养基。有效培养基通常是包含可吸收的碳水化合物、氮和磷酸盐来源,以及适当的盐、矿物质、金属和其他营养物质(例如维生素和生长因子)的水性培养基。培养基可以包含复杂的营养物质或可以是限定的基本培养基。本发明的酵母菌株可以在各种容器(包括但不限于生物反应器、锥形瓶、试管、微量滴定皿和培养皿)中培养。在适合于酵母菌株的温度、pH和氧含量下进行培养。此类培养条件完全在本领域普通技术人员的专业知识范围内(参见,例如,Guthrie等人(编辑),1991,Methods in Enzymology[酶学方法],第194卷,Academic Press[学术出版社],圣地亚哥)。
在本发明的一些方面,酵母在中性pH条件下生长,并且特别是在pH水平维持在至少5.5的培养基(即,不允许培养基的pH降至pH5.5以下)中生长。在其他方面,酵母在维持约5.5的pH水平下生长。在其他方面,酵母在维持约5.6、5.7、5.8或5.9的pH水平下生长。在另一个方面,酵母在维持约6的pH水平下生长。在另一个方面,酵母在维持约6.5的pH水平下生长。在其他方面,酵母在维持约6、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9或7.0的pH水平下生长。在其他方面,酵母在维持约7、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、或8.0的pH水平下生长。pH水平对于酵母培养很重要。本领域技术人员将认识到,培养过程不仅包括酵母培养的开始,而且还包括培养的维持。由于已知酵母培养随着时间会变成酸性(即pH降低),因此在培养过程期间必须注意监测pH水平。在本发明的范围内仍然考虑在培养基pH水平降至6以下进行酵母细胞培养,条件是在培养过程期间培养基的pH在某一点时提高到至少5.5。因此,酵母在至少pH 5.5或更高的培养基中生长的时间越长,在获得具有所期望特征的酵母方面的结果越好。
在一个方面,培养酵母使培养基的pH水平不低于pH 5.5。在一些情况中,pH降至5.5以下不超过5分钟。在其他情况中,pH降至5.5以下不超过10分钟。在其他情况中,pH降至5.5以下不超过1小时。在另一个方面,培养酵母使培养基的pH水平不低于5.0。在一些情况中,pH降至5.0以下不超过5分钟。在其他情况中,pH降至5.0以下不超过10分钟,优选地不超过20、30、40、50或60分钟。在其他情况中,pH降至5.0以下不超过1小时。因此,酵母在至少pH5.5或更高的培养基中生长的时间越长,如下所述在获得具有所期望特征的酵母方面的结果越好。
在一个方面,使用中性pH方法培养酵母细胞意指酵母细胞在中性pH下生长占酵母培养时间的至少50%。更优选地,酵母在中性pH下生长占其培养时间的至少60%,更优选地占其培养时间的至少70%,更优选地占其培养时间的至少80%,并且最优选地占其培养时间的至少90%。
在另一个方面,在中性pH下生长的酵母包括在中性pH下培养酵母细胞至少五分钟,优选地在中性pH下至少15分钟,更优选在中性pH下至少一个小时,更优选至少两个小时,甚至更优选地至少三个小时或更长时间。
如本文所用,通用的术语“中性pH”是指pH范围在约pH 5.5至约pH 8之间,并且在一个方面,在约pH 6至约8之间。本领域的技术人员将理解,当用pH计测量时,会出现微小的波动(例如,十分之一或百分之一)。因此,使用中性pH培养酵母细胞意指酵母细胞在其培养的大部分时间内都在中性pH下生长。在培养酵母中使用中性pH促进了几种生物效应,其对于将酵母用作免疫调节媒介物而言是所期望的特征。在一个方面,在中性pH下培养酵母允许酵母良好生长,且对细胞世代时间没有任何负面影响(例如,减慢倍增时间)。酵母可以继续生长到高密度,而不会失去其细胞壁的柔韧性。在另一个方面,使用中性pH允许产生具有柔韧性细胞壁的酵母和/或在所有收集密度下对细胞壁消化酶(例如,葡聚糖酶)敏感的酵母。该性状是理想的,因为具有柔性细胞壁的酵母可以诱导异常的免疫应答,如通过促进宿主酵母的细胞中细胞因子(例如干扰素-γ(IFN-γ))的分泌。另外,通过此类培养方法可以提供对位于细胞壁中的抗原的更大可及性。在另一个方面,对一些抗原使用中性pH允许通过二硫苏糖醇(DTT)处理来释放二硫化物结合抗原,当这种抗原表达酵母在较低pH(例如,pH 5)的培养基中培养时,这种释放是不可能的。最后,在另一个方面,使用中性pH方法培养的酵母引发至少TH1型细胞因子(包括但不限于IFN-γ、白介素12(IL-12)和IL-2)的产生增加,以及也可能引发其他细胞因子(如促炎性细胞因子(例如IL-6))的产生增加。
在一个实施例中,控制酵母糖基化量用于控制酵母(尤其是在表面上)的抗原表达。酵母糖基化的量会影响表面表达的抗原的免疫原性和抗原性,因为糖部分往往很大。因此,在根据本发明的酵母的调节中,应考虑酵母表面糖部分的存在及其对一个或多个靶抗原周围三维空间的影响。可以使用任何方法用来减少(或增加,如果希望)酵母的糖基化量。例如,可以使用已被选择具有低糖基化的酵母突变菌株(例如,mnn1、och1和mnn9突变体),或者可以通过突变来消除靶抗原上的糖基化受体序列。可替代地,可以使用糖基化模式缩短的酵母,例如毕赤酵母。还可以使用降低或改变糖基化的方法来处理酵母。
在本发明的一个实施例中,作为在酵母媒介物中重组表达抗原或其他蛋白质的替代方案,将酵母媒介物在细胞内装载蛋白质或肽,或根据本发明装载用作抗原和/或可用作免疫调节剂或生物反应修饰剂的碳水化合物或其他分子。随后,当前在细胞内含有抗原和/或其他蛋白质的酵母媒介物可以向患者施用或装载到运载体(如树突细胞)中。肽和蛋白质可通过本领域技术人员已知的技术(如通过扩散、主动转运、脂质体融合、电穿孔、吞噬作用、冻融循环和水浴超声)直接插入本发明的酵母媒介物中。可以直接装载肽、蛋白质、碳水化合物或其他分子的酵母媒介物包括完整酵母,以及原生质球、菌蜕或胞质体,它们在生产后可以装载抗原和其他药剂。可替代地,完整酵母可以装载抗原和/或药剂,然后可以从中制备原生质球、菌蜕、胞质体或亚细胞颗粒。在本实施例中,可将任意数目的抗原和/或其他药剂装载到酵母媒介物中,例如通过装载微生物、通过装载哺乳动物肿瘤细胞或其部分来提供从至少1、2、3、4或任何整数到数百或数千个抗原和/或其他药剂。
在本发明的另一个实施例中,抗原和/或其他药剂物理地附接到酵母媒介物上。抗原和/或其他药剂与酵母媒介物的物理附接可通过本领域适合的任何方法完成,这些方法包括共价和非共价缔合方法,其包括但不限于将抗原和/或其他药剂化学交联至酵母媒介物的外表面、或将抗原和/或其他药剂生物连接到酵母媒介物外表面(如通过使用抗体或其他结合伴侣)。例如,可以通过以下方法来实现化学交联,这些方法包括戊二醛键合、光亲和标记、用碳二亚胺处理、用能够连接二硫键的化学品处理、以及用本领域其他交联化学品标准处理。可替代地,化学品可与改变酵母膜脂质双层的电荷或细胞壁的组成的酵母媒介物接触,从而使酵母的外表面更容易与抗原和/或具有特定电荷特征的其他药剂融合或结合。靶向剂(如抗体、结合肽、可溶性受体和其他配体)也可作为融合蛋白掺入抗原中或以其他方式与抗原缔合以将该抗原与酵母媒介物结合。
当抗原或其他蛋白质在酵母表面上表达或物理上附接于酵母表面时,可在一个方面中仔细选择间隔臂以优化表面上的抗原或其他蛋白质的表达或含量。一个或多个间隔臂的大小会影响经暴露以结合到酵母表面上的抗原或其他蛋白质的量。因此,根据所使用的一种或多种抗原或一种或多种其他蛋白质,本领域技术人员将选择使酵母表面上的抗原或其他蛋白质具有适当间隔的间隔臂。在一个实施例中,间隔臂是至少450个氨基酸的酵母蛋白质。间隔臂已在上面详细讨论过。
优化抗原表面表达的另一个考虑因素是抗原和间隔臂组合是否应表达为单体或二聚体或三聚体,或甚至更多连接在一起的单元。单体、二聚体、三聚体等的使用允许抗原的适当间隔或折叠,使得抗原的一些部分(如果不是全部)以使其更具免疫原性的方式展示在酵母媒介物的表面上。
在又另一个实施例中,酵母媒介物与抗原或其他蛋白质通过更被动、非特异性或非共价结合机制(如通过将酵母媒介物与抗原或其他蛋白质在缓冲液或其他合适的配制品(例如,混合剂)中轻轻地混合)彼此缔合。
在本发明的一个实施例中,酵母媒介物和抗原或其他蛋白质均在细胞内装载到运载体(如树突细胞或巨噬细胞)中以形成本发明的治疗组合物或疫苗。可替代地,抗原或其他蛋白质可以在不存在酵母媒介物的情况下被装载到树突细胞中。
在本发明的一个实施例中,本发明中使用的酵母媒介物包括已被杀灭或灭活的酵母媒介物。杀灭或灭活酵母可通过本领域已知的各种合适方法中的任一种来完成。例如,酵母的热灭活是酵母灭活的标准方法,并且本领域技术人员可以(如果希望,通过本领域已知的标准方法)监测靶抗原的结构变化。如本文所述,以另一种灭活酵母的方式制作酵母裂解物。可替代地,还可以使用其他灭活酵母的方法,如化学方法、电气方法、放射方法或UV方法。参见,例如,标准酵母培养教科书中披露的方法,如Methods ofEnzymology[酶学方法],第194卷,Cold Spring Harbor Publishing[冷泉港出版社](1990)。所使用的任何灭活策略都应考虑靶抗原的二级、三级或四级结构,并保持这种结构以优化其免疫原性。
可使用本领域技术人员已知的多种技术,将酵母裂解物和酵母媒介物配制成本发明的基于酵母的免疫治疗组合物或产品,包括直接或首先装载到载体(如树突细胞)的向受试者施用的制剂。例如,酵母媒介物可以通过冻干法干燥。包含酵母媒介物的配制品也可以通过将酵母包装在块状物(cake)或片剂中来制备,如用于烘焙或酿造操作的酵母。在一个方面,酵母裂解物和酵母媒介物可被冷冻。此外,酵母媒介物可与药学上可接受的赋形剂(如宿主或宿主细胞耐受的等渗缓冲液)混合。此类赋形剂的实例包括水、盐水、林格溶液、右旋糖溶液、汉克溶液和其他生理平衡盐的水溶液。还可使用非水性媒介物,如固定油、芝麻油、油酸乙酯或甘油三酯。其他有用的配制品包括含有增粘剂(如羧甲基纤维素钠、山梨醇、甘油或右旋糖酐)的悬浮液。赋形剂也可以含有少量的添加剂,如增强等渗性和化学稳定性的物质。缓冲剂的实例包括磷酸盐缓冲液、碳酸氢盐缓冲液和Tris缓冲液,而防腐剂的实例包括硫柳汞、间甲酚或邻甲酚、福尔马林和苯甲醇。标准配制品可以是液体注射剂或固体,其可以在合适的液体中作为注射用悬浮液或溶液被吸收。因此,在非液体配制品中,赋形剂可包含例如右旋糖、人血清白蛋白和/或防腐剂,施用前可向其中添加无菌水或盐水。
在本发明的一个实施例中,组合物可包括生物反应修饰剂化合物,或产生此类修饰剂的能力(即,通过用编码此类修饰剂的核酸分子转染酵母媒介物)。已经在上面描述了生物反应修饰剂。
本发明的组合物可进一步包括用于保护受试者免受特定疾病或病症(包括传染病或癌症)的任何其他化合物,或治疗或改善这种感染的任何症状的任何化合物。
本发明还包括包含本文所述的任何组合物或本文所述组合物的任何单个组分的试剂盒。试剂能以自由形式存在,或可以固定在基质(如塑料皿、微阵列板、试管、测试棒等)上。试剂盒还可以包括用于检测试剂和/或用于标记阳性或阴性对照、洗涤液、稀释缓冲液等的合适试剂。试剂盒还可以包括一套使用试剂盒和解释结果的书面说明。在一个实施例中,将试剂盒配制成高通量测定试剂盒。试剂盒可制备并用于本发明的任何临床、研究或诊断方法。
关于本发明中有用的药剂,在一个方面,以约50U/kg和约15,000U/kg的受试者体重之间的量施用蛋白质或抗体。在另一个实施例中,以约0.01μg至约10mg/kg的患者体重的量、且更优选地以约0.1μg至约100μg的患者体重的量施用蛋白质或抗体。当要递送的化合物是核酸分子时,适当的单个剂量可导致每μg递送的核酸中每mg总组织蛋白质表达的至少约1pg的蛋白质。小分子是根据给定小分子指定的优选剂量来递送的,并且可以由本领域技术人员确定。
在本发明的一个方面中,药剂与基于酵母的免疫治疗组合物同时施用。在本发明的一个方面中,药剂与基于酵母的免疫治疗组合物顺序施用。在另一个实施例中,在施用基于酵母的免疫治疗组合物之前施用药剂。在另一个实施例中,在施用基于酵母的免疫治疗组合物之后施用药剂。在一个实施例中,药剂与基于酵母的免疫治疗组合物以交替剂量施用,或在一个方案中,其中以指定间隔将基于酵母的组合物在一个或多个连续剂量的药剂之间施用或与一个或多个剂量的药剂一起施用,或反之亦然。在一个实施例中,在开始施用药剂之前的一段时间内以一个或多个剂量施用基于酵母的免疫治疗组合物。换言之,基于酵母的免疫治疗性组合物作为单一疗法施用一段时间,然后添加药剂施用(与基于酵母的免疫治疗的新剂量同时施用,或以交替方式与基于酵母的免疫治疗施用)。可替代地,可在开始施用基于酵母的免疫治疗组合物之前施用一段时间的药剂。在一个方面,将酵母工程化以表达或携带药剂,或者将不同的酵母工程化或生产来表达或携带药剂。
基于病毒的免疫治疗组合物通常包含病毒载体,该病毒载体包含病毒基因组或其部分(例如,重组病毒)和编码来自致病剂或疾病状态的至少一个抗原(例如,一个或多个癌抗原、一个或多个传染病抗原、和/或其至少一个免疫原性结构域)的核酸序列。在一些实施例中,基于病毒的免疫治疗组合物进一步包括至少一种病毒载体,该病毒载体包含编码一个或多个免疫刺激分子的一个或多个核酸序列。在一些实施例中,编码免疫刺激分子和抗原的基因被插入相同的病毒载体(相同的重组病毒)。
如本文所用,关于组合物的施用,术语“同时”意指基本上在相同时间或相同给药周期内,或在通过免疫治疗组合物启动免疫系统期间的时间段内(例如,不超过1-2天)施用每种组合物,并且特别是此类组合物的第一剂量。为清楚起见,同时施用不要求在精确的同一时刻施用所有组合物,而是所有组合物的施用应在患者的一次预定剂量给药内进行,以便启动免疫系统并同时实现药剂的作用(例如,可以先施用一种组合物,然后立即或紧接地施用第二种组合物,依此类推)。在一些情况下,如当将组合物施用于同一部位时,可将组合物以混合剂形式提供,尽管即使在相同部位施用,也可在相同给药时间段对每种组合物进行顺序施用。在一个方面,将组合物在相同的1-2天内施用,并且在另一个方面在同一天施用、并且在另一个方面在相同的12小时的时间段内施用、并且在另一个方面在相同的8小时的时间段内施用、并且在另一个方面在相同的4小时的时间段内施用、并且在另一个方面在相同的1、2或3小时的时间段内施用、并且在另一个方面中在相同的1、2、3、4、6、7、8、9或10分钟内施用。
在本发明的一个实施例中,基于酵母的免疫治疗组合物和一种或多种药剂同时施用,但施用于患者的不同物理部位。例如,一种组合物或药剂可施用于个体身体的一个或多个部位,而另一种组合物或药剂可施用于个体身体的一个或多个不同部位,例如,身体的不同侧或不同引流淋巴结附近。在另一个实施例中,免疫治疗组合物和药剂同时并且在相同或基本上相邻的部位施用于患者。基本上相邻的部位是指与第一组合物或药剂施用的注射部位不完全相同、但与第一注射部位非常接近(紧邻)的部位。在一个实施例中,以混合剂的形式施用免疫治疗组合物和药剂。一些实施例可包括施用方法的组合。
在本发明的方法中,组合物和治疗组合物可施用于动物(包括任何脊椎动物),并且特别可施用于脊椎动物纲的任何成员、哺乳动物,包括但不限于灵长类动物、啮齿动物、家畜和家养宠物。家畜包括待消耗或生产有用产品的哺乳动物(例如用于羊毛生产的绵羊)。要保护的哺乳动物包括人、狗、猫、小鼠、大鼠、山羊、绵羊、牛、马和猪。
“个体”是脊椎动物,如哺乳动物,包括但不限于人。哺乳动物包括但不限于家畜、竞技动物、宠物、灵长类动物、小鼠和大鼠。术语“个体”可与术语“动物”、“受试者”或“患者”互换使用。
除非另有指明,本发明的实践将采用本领域技术人员熟知的分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学、核酸化学和免疫学的常规技术。这些技术在以下文献中有充分的解释,如Methods ofEnzymology[酶学方法],第194卷,Guthrie等人编辑,Cold Spring Harbor Laboratory Pres[冷泉港实验室出版社](1990);Biology andactivities of yeasts[酵母菌的生物学与活性],Skinner等人编辑,Academic Press[学术出版社](1980);Methods in yeast genetics:a laboratory course manual[酵母遗传的方法:实验室课程手册],Rose等人,Cold Spring Harbor Laboratory Press[冷泉港实验室出版社](1990);The Yeast Saccharomyces:Cell Cycle and Cell Biology[酵母菌:细胞周期与细胞生物学],Pringle等人编辑,Cold Spring Harbor Laboratory Press[冷泉港实验室出版社](1997);The Yeast Saccharomyces:Gene Expression[酵母菌:遗传表达],Jones等人编辑,Cold Spring Harbor Laboratory Press[冷泉港实验室出版社](1993);The Yeast Saccharomyces:Genome Dynamics,Protein Synthesis,andEnergetics[酵母菌:基因组动力学、蛋白质合成和能量学],Broach等人编辑,SpringHarbor Laboratory Press[冷泉港实验室出版社](1992);Molecular Cloning:ALaboratory Manual,second edition[分子克隆:实验室手册第二版](Sambrook等人,1989)和Molecular Cloning:A Laboratory Manual,third edition[分子克隆:实验室手册第三版](Sambrook和Russel,2001),(以下合称为“Sambrook”);Current Protocols inMolecular Biology[当代分子生物学方法](F.M.Ausubel等人编辑,1987,包括到2001年的增刊);PCR:The Polymerase Chain Reaction[PCR:聚合酶链式反应](Mullis等人编辑,1994);Harlow和Lane(1988)Antibodies,A Laboratory Manual[抗体实验室手册],ColdSpring Harbor Publications[冷泉港出版社],纽约;Harlow和Lane(1999)UsingAntibodies:A Laboratory Manual[使用抗体:实验室手册]Spring Harbor LaboratoryPress[冷泉港实验室出版社],冷泉港,纽约(以下合称为“Harlow和Lane”);Beaucage等人编辑,Current Protocols in Nucleic Acid Chemistry[当代核酸化学方案]John Wiley&Sons,Inc.[约翰威立出版有限公司],纽约,2000);Casarett and Doull’s ToxicologyThe Basic Science of Poisons[卡萨雷特和杜尔的毒理学毒物学基础科学],C.Klaassen编辑,第6版(2001);以及Vaccines[疫苗],S.Plotkin和W.Orenstein编辑,第3版(1999)。
通用定义
如本文所用,术语“类似物”是指结构上类似于另一种化合物但在组成上略有不同(如一个原子被不同元素的原子替换、或在特定官能团的存在下、或一个官能团被另一官能团替换)的化合物。因此,类似物是相对于参考化合物在功能和外观上相似或相当、但具有不同结构或来源的化合物。
术语“经取代的”、“经取代的衍生物”和“衍生物”用于描述化合物时,意指与未经取代的化合物结合的至少一个氢被不同的原子或化学部分替换。
“细胞介导的”免疫应答(可在本文任何地方与术语“细胞”免疫应答互换使用)通常是指对包括T淋巴细胞(包括细胞毒性T淋巴细胞(CTL))、树突细胞、巨噬细胞和自然杀伤细胞的免疫细胞的抗原的应答,以及伴随此类应答的所有过程,包括但不限于这些细胞的激活和增殖、CTL效应子功能、影响参与适应性免疫应答和固有免疫应答的其他细胞功能的细胞因子的产生、记忆T细胞的生成和干细胞样记忆细胞。
“疫苗接种”或“免疫接种”是指由于单独或与佐剂一起施用而引发(诱导)针对抗原或其免疫原性部分的免疫应答。疫苗接种可产生保护作用或治疗作用,其中随后暴露于抗原(或抗原来源)引发针对抗原(或来源)的免疫应答,以减少或预防动物的疾病或病症。疫苗接种的概念是本领域熟知的。与未施用该组合物相比,通过施用免疫治疗性组合物(疫苗)引发的免疫应答可以是免疫应答的任何方面(例如,细胞介导的应答、体液应答、细胞因子产生)的任何可检测的变化。
根据本发明,“异源氨基酸”是指如下氨基酸的序列,这些氨基酸是特定氨基酸序列侧翼未天然发现的(即,在体内的在天然情况下未发现),或与特定氨基酸序列的功能不相关,或者如果使用衍生给定氨基酸序列的生物的标准密码子用法来翻译天然存在的序列中的此类核苷酸,它在基因中出现时,不是由编码特定氨基酸序列的天然存在的核酸序列侧翼的核苷酸编码。因此,与抗原异源的至少两个氨基酸残基是抗原侧翼非天然发现的任两个氨基酸残基。
根据本发明,提及与本发明酵母媒介物相关的“异源”蛋白质或“异源”抗原(包括异源融合蛋白)意指该蛋白质或抗原不是酵母天然表达的蛋白质或抗原,尽管融合蛋白可包括酵母序列、或由酵母天然表达的蛋白质或其部分(例如,本文所述的Aga蛋白)。例如,出于本发明的目的,流感血球凝集素蛋白和酵母Aga蛋白的融合蛋白被认为是相对于酵母媒介物的异源蛋白,因为这种融合蛋白不是由酵母天然表达的。
根据本发明,短语“选择性结合到”是指本发明的抗体、抗原结合片段或结合伴侣优先结合到特定蛋白质的能力。更特别地,短语“选择性结合”是指一种蛋白质与另一种蛋白质(例如,抗体、其片段或结合伴侣与抗原)的特异性结合,其中如任何标准测定(例如,免疫测定)测量的结合水平在统计学上显著高于该测定的背景对照。例如,当进行免疫测定时,对照通常包括仅包含抗体或抗原结合片段(即,在不存在抗原的情况下)的反应孔/管,其中抗体或其抗原结合片段在不存在抗原的情况下的反应性量(例如,非特异性结合到孔)被视为背景。结合可使用本领域标准的多种方法来测量,这些方法包括酶免疫测定(例如,ELISA)、免疫印迹测定等)。
本发明中提及的蛋白质或多肽包括全长蛋白质、融合蛋白或此类蛋白质的任何片段、结构域、构象表位或同源物。更特别地,根据本发明,分离的蛋白质是从其天然环境中取出(即,进行了人工操作)的蛋白质(包括多肽或肽),并且可以包括纯化的蛋白质、部分纯化的蛋白质、重组产生的蛋白质、以及例如合成产生的蛋白质。因此,“分离的”并不反映蛋白质的纯化程度。在本发明的一个方面中,本发明的分离的蛋白质是重组产生的。根据本发明,术语“修饰”和“突变”可以互换使用,特别是关于蛋白质或其部分的氨基酸序列的修饰/突变。
如本文所用,术语“同源物”用于指与天然存在的蛋白质或肽的区别在于对天然存在的蛋白质或肽(即,“原型”或“野生型”蛋白质)的微小修饰但保持天然存在形式的基本蛋白质和侧链结构的蛋白质或肽。此类改变包括但不限于:一个或几个氨基酸侧链的改变;改变一个或几个氨基酸,包括缺失(例如蛋白质或肽的截短形式)、插入和/或替换;一个或几个原子的立体化学改变;和/或微小衍生化,包括但不限于:甲基化、糖基化、磷酸化、乙酰化、豆蔻酰化、异戊二烯化、棕榈酰化、酰胺化和/或糖基磷脂酰肌醇的加成。与天然存在的蛋白质或肽相比,同源物可以具有增强、减少或基本相似的特性。同源物可以包括蛋白质的激动剂或蛋白质的拮抗剂。同源物可以使用本领域已知的用于生产蛋白质的技术来生产,这些技术包括但不限于对分离的、天然存在的蛋白质的直接修饰、直接蛋白质合成、或使用例如经典或重组DNA技术对编码蛋白质的核酸序列进行修饰以产生随机或靶向突变。
给定蛋白质的同源物可包含以下、基本上由以下组成、或由以下组成:与参考蛋白的氨基酸序列具有至少约45%、或至少约50%、或至少约55%、或至少约60%、或至少约65%、或至少约70%、或至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约95%同一性、或至少约95%同一性、或至少约96%同一性、或至少约97%同一性、或至少约98%同一性、或至少约99%同一性(或45%至99%之间的任何百分比同一性,以整数增量计)的氨基酸序列。在一个实施例中,同源物包含以下、基本上由以下组成、或由以下组成:与参考蛋白的天然存在的氨基酸序列具有小于100%同一性、小于约99%同一性、小于约98%同一性、小于约97%同一性、小于约96%同一性、小于约95%同一性(依此类推增量为1%)至小于约70%同一性的氨基酸序列。
如本文所用,除非另有规定,否则对百分比(%)同一性的引用是指使用以下来进行的同源性评估:(1)BLAST2.0Basic BLAST同源性搜索,用标准默认参数,使用blastp进行氨基酸搜索并且使用blastn进行核酸搜索,其中查询序列默认过滤低复杂度区域(描述于Altschul,S.F.,Madden,T.L.,
两个特异性序列可以使用BLAST 2序列(如描述于Tatusova和Madden,(1999),“Blast 2sequences-a new tool for comparing protein and nucleotide sequences[Blast 2序列-一种比较蛋白质和核苷酸序列的新工具]”,FEMS Microbiol Lett[欧洲微生物学会联合会微生物学快报].174:247-250,将其通过引用以其全文并入本文)彼此比对。BLAST 2序列比对是在blastp或blastn中进行的,其中使用BLAST 2.0算法在两个序列之间进行空位BLAST搜索(BLAST 2.0),从而允许在结果比对中引入空位(缺失和插入)。出于清晰说明的目的,使用如下标准默认参数进行BLAST 2序列比对。
对于blastn,使用0BLOSUM62矩阵:
匹配奖励=1
错配罚分=-2
开放空位(5)和延伸空位(2)罚分
空位x_下降值(gapx_dropoff)(50)期望(expect)(10)字长大小(word size)(11)过滤器(filter)(开)
对于blastp,使用0 BLOSUM62矩阵:
开放空位(11)和延伸空位(1)罚分
空位x_下降值(gap x_dropoff)(50)期望(expect)(10)字长大小(word size)(3)过滤器(filter)(开)。
分离的核酸分子是指从其天然环境中取出(即,进行了人工操作)的核酸分子,其天然环境是在天然情况下发现核酸分子的基因组或染色体。因此,“分离的”并不一定反映核酸分子已纯化的程度,但指示该分子不包括在天然情况下发现该核酸分子的整个基因组或整个染色体。分离的核酸分子可以包括基因。包括基因的分离的核酸分子不是包括该基因的染色体片段,而是包括与该基因相关的编码区和调控区但不包括在同一染色体上天然发现的另外基因的染色体片段。分离的核酸分子还可以包括特定的核酸序列,该核酸序列的侧翼(即,在序列的5′和/或3′端)接有在天然情况下通常不在该特定核酸序列侧翼的另外的核酸(即,异源序列)。分离的核酸分子可以包括DNA、RNA(如mRNA)、或DNA或RNA的衍生物(如cDNA)。虽然短语“核酸分子”主要是指物理核酸分子,并且短语“核酸序列”主要是指核酸分子上的核苷酸序列,但这两个短语可以互换使用,尤其是对于能够编码蛋白质或蛋白质结构域的核酸分子或核酸序列而言。
重组核酸分子是如下分子,该分子可包括编码本文所述的任一种或多种蛋白质的核酸序列中的至少一种,该核酸序列可操作地连接到能够有效调节待转染细胞中一个或多个核酸分子表达的任何转录控制序列中的至少一个。虽然短语“核酸分子”主要是指物理核酸分子,并且短语“核酸序列”主要是指核酸分子上的核苷酸序列,但这两个短语可以互换使用,尤其是对于能够编码蛋白质的核酸分子或核酸序列而言。此外,短语“重组分子”主要是指可操作地连接到转录控制序列的核酸分子,但是可以与施用于动物的短语“核酸分子”互换使用。
重组核酸分子包括重组载体,该重组载体是可操作地连接到本发明编码融合蛋白的分离的核酸分子的任何核酸序列,通常是异源序列,该重组核酸分子能够重组产生融合蛋白,并且能够根据本发明将核酸分子递送到宿主细胞中。这种载体可以含有在待插入载体中的分离的核酸分子附近的非天然发现的核酸序列。该载体可以是RNA或DNA,也可以是原核的或真核的,并且在本发明的一个方面,是病毒或质粒。重组载体可用于核酸分子的克隆、测序和/或其他操作,并可用于递送此类分子(例如,在DNA疫苗或基于病毒载体的疫苗中)。重组载体可用于核酸分子的表达,也可称为表达载体。一些重组载体能够在转染的宿主细胞中表达。
在本发明的重组分子中,核酸分子可操作地连接到含有调控序列(如转录控制序列、翻译控制序列、复制起点、以及本发明的与宿主细胞相容和控制核酸分子表达的其他调控序列)的表达载体。特别地,本发明的重组分子包括可操作地连接到一个或多个表达控制序列的核酸分子。短语“可操作地连接”是指以使核酸分子在转染(即,转化、转导或转染)到宿主细胞中时被表达的方式将该分子连接到表达控制序列。
根据本发明,术语“转染”用于指能够将外源核酸分子(即重组核酸分子)插入细胞的任何方法。当术语“转化”用于指将核酸分子引入微生物细胞(如藻类、细菌和酵母)时,该术语可与术语“转染”互换使用。在微生物系统中,术语“转化”用于描述由于微生物获取外源核酸而引起的遗传改变,并且基本上与术语“转染”同义。因此,转染技术包括但不限于转化、细胞的化学处理、粒子轰击、电穿孔、微注射、脂质体感染、吸附、感染和原生质体融合。
提供以下实验结果是出于说明的目的,并不旨在限制本发明的范围。
实例
实例1
以下实例表明,将
方法:
1.每个
2.将裂解物与完整
3.1周后,向接种疫苗的小鼠眶后注射初始的同基因脾细胞,这些脾细胞已经用100μg/mL的SIINFEKL(SEQ ID NO:9)肽溶液“脉冲”孵育、洗涤以去除未结合肽、并用CFSE绿色染料标记以进行检测。同时注射未脉冲的群体,该群体用低浓度的CFSE标记使其区别于肽脉冲的群体(内部对照)。图1显示了该测定的示意图。注射的脾细胞回到脾脏。如果疫苗接种产生了SIINFEKL(SEQ ID NO:9)特异性CTL,肽脉冲的细胞将被杀灭。杀灭的程度与疫苗的功效相关。
4.从接种疫苗的、注射靶细胞的小鼠取出脾脏。将脾脏分散成单细胞悬液,去除红细胞,用流式细胞术测量CTL介导的杀灭程度。
实例2
该实例表明,卵清蛋白
表1:接种Tarmogen裂解物加完整Tarmogen的小鼠的体内CTL结果
实例3:
图3示出了来自免疫接种I-A
实例4
本实例示出了YE-NEO-001-93疫苗接种引起抗原特异性CD4
免疫接种:将雌性C57BL/6小鼠用2YU的YE-NEO-001-93YL+25μg α-CD40抗体+2YU-Yvec或用2.5YU完整的YE-NEO-001-93+25μg α-CD40抗体(n=2只小鼠/组)经眶后免疫接种。所有小鼠注射量为150μL。由于脾脏尺寸较小,将三只性别和年龄匹配的初始未免疫接种的小鼠作为阴性对照。
脾细胞收集和体外刺激:在免疫接种后第7天,从初始小鼠或接种疫苗的小鼠收集脾脏,并将每种情况下的所有小鼠合并(初始小鼠:n=3,实验疫苗接种:n=2)。制备单细胞悬液,并使用氯化铵-钾(ACK)裂解缓冲液裂解红细胞。在96孔U形底组织培养处理的板中,用5μM肽(SIINFEKL)(SEQ ID NO:9)(总体积200uL)刺激总共2x 10
细胞内细胞因子染色和流式细胞术分析:第二天,使用eBioscience FoxP3/转录因子染色缓冲液集进行ICS,如下所示。将细胞洗涤,然后用CD8 ef450、CD4 APC-CY7、CD3APC和FC阻断(24G2)1∶200在FACS缓冲液(PBS+2%FBS+2mM EDTA)中在冰上染色30min。然后将细胞洗涤、并固定/透化。使用IFNγ PE和TNFα PE-CY7在FACS缓冲液中以1∶200的比例,在FC阻断和大鼠血清(2uL/25uL)存在下在RT进行30min细胞内染色。洗涤后,在FACS缓冲液中将每种条件下的三个孔合并成单个样品,并使用BD FACSVerse
实例5
该实例显示,与单独的完整Tarmogen相比,Tarmogen澄清裂解物增强抗肿瘤活性。
小鼠单独接种完整Tarmogen或接种Tarmogen加YL(每周一次,总共3次,皮下(sc),两侧)。在第3次免疫接种后一周,在小鼠右侧、免疫接种部位后用30,000个B16F10细胞sc激发。这些B16F10细胞含有推定的新表位,其与Tarmogen疫苗携带的那些相匹配。每隔一天到第12天用数显卡尺监测肿瘤生长。cI IN:表达I类新表位融合的完整酵母;cII IN:表达II类新表位融合的完整酵母;cI IN+cI YL:1.25YU的cI IN与1.25YU的cI YL混合;cII IN+cII CL:1.25YU的cII IN与1.25YU的cII YL混合。天:肿瘤激发后的天数。
结果显示,相比单独的完整Tarmogen,CL以等量(1∶1)比例添加到完整Tarmogen中时将抗肿瘤活性提高多达约2至5倍。
虽然已经详细描述了本发明的各种实施例,但是显而易见的是,本领域技术人员可以对那些实施例进行修改和调整。然而,应明确理解,此类修改和调整在如以下权利要求所提出的本发明的范围内。
- 用于诱导细胞免疫应答的重组酵母裂解物
- 用于诱发单核细胞免疫应答的重组LAG-3或其衍生物的应用
