一种短肽及其铜离子螯合物的医药用途
文献发布时间:2023-06-19 10:29:05
技术领域
本发明涉及吸烟相关性呼吸系统疾病的治疗领域,尤其涉及一种短肽及其铜离子螯合物在肺吸烟相关性呼吸系统疾病预防及治疗中的应用。
背景技术
吸烟相关性呼吸系统疾病是一种常见的、可预防及治疗的疾病,其主要病理生理学特征为肺气肿、慢性气道炎症及气道重塑,进而导致气流受限,肺功能进行性下降,严重影响患者的生活质量。许多因素在肺气肿、慢性气道炎症及气道重塑的发生发展过程中起到重要作用,其中炎症反应、氧化应激及上皮间充质转化(epithelialmesenchymaltransition,EMT)尤为重要。目前关于吸烟相关性呼吸系统疾病的治疗主要包括支气管舒张剂、糖皮质激素、茶碱、白三烯调节剂等药物治疗,其主要以缓解症状,减少急性加重次数,改善运动耐力及健康状态为主要目的,而炎症反应、氧化应激及EMT可能成为慢阻肺治疗的新的潜在靶点。继续寻找在吸烟相关性呼吸系统疾病预防和治疗中起保护性、治疗性作用的新型抗氧化或抗炎制剂尤为重要。
甘氨酰-组氨酸-赖氨酸(Gly-His-Lys,GHK)是具有氨基酸序列甘氨酰-组氨酸-赖氨酸的活性三肽,是人血浆、唾液和尿液的正常成分,是一种与人白蛋白结合的结合肽,最早用于伤口愈合和抗衰老皮肤护理。GHK可能是皮肤修复的早期信号蛋白,存在于I型胶原的α2(I)链中,当损伤激活蛋白水解酶时,GHK被释放到损伤部位,并发挥局部愈合作用。近年来随着研究的不断深入,GHK改善伤口愈合、促进组织再生以及抗炎抗氧化的能力逐渐在骨、肝脏和胃肠壁等组织中得到证实,能够增加胶原蛋白、弹力蛋白生成,促进血管、神经生长,增强干细胞功能和促进间充质干细胞分泌营养因子。GHK是天然存在的,无毒的,并且容易与铜形成络合物,从而提高了GHK的生物利用度,尤其是具有抗氧化和消炎功能。 GHK-Cu复合物通过多种机制发挥抗氧化功能。GHK,作为三肽单独使用,可以猝灭与变性神经病和疾病有关的有毒脂肪酸脂质过氧化产物。铜成分作为金属离子激活铜和锌依赖性超氧化物歧化酶,后者可作为内源性抗氧化剂。该复合物还可以通过抑制受损组织中铁蛋白铁的释放来减少氧化损伤,从而防止炎症。在伤口愈合组织和皮肤修复中,GHK-Cu会降低促炎细胞因子的表达,例如肿瘤坏死因子(TNF)-α和转化生长因子(TGF)-β,其由于某些刺激后的异常修复和再生而在肺纤维化肺组织中过表达。因此,GHK-Cu的抗氧化和抗炎特性使其成为治疗吸烟相关性呼吸系统疾病的潜在药物。但是,迄今为止,除本发明外尚无研究检查GHK-Cu对吸烟相关性呼吸系统疾病的作用。
发明内容
鉴于现有技术存在的问题,本发明目的在于提供一种短肽及其铜离子螯合物新的医药用途,该三肽化合物在体内具有活性成分,通过抗氧化应激,抑制炎症反应以及抑制上皮细胞间充质化,为治疗吸烟相关性呼吸系统疾病药物的研发奠定了理论基础。
为了实现上述目的,本发明采用以下技术方案。
一种短肽及其铜离子螯合物在制备用于预防和/或治疗吸烟相关性呼吸系统疾病的药物中的应用,所述短肽的氨基酸序列为Gly-His-Lys。
进一步地,所述吸烟相关性呼吸系统疾病包括慢性阻塞性肺疾病、慢性支气管炎、肺气肿和吸烟相关性间质性肺疾病(smoking-related ILD,SR-ILD)等。
一种药物组合物,包括所述的短肽及其铜离子螯合物。
进一步地,所述药物组合物在制备用于预防和/或治疗吸烟相关性呼吸系统疾病的药物中的应用。
进一步地,所述吸烟相关性呼吸系统疾病包括慢性阻塞性肺疾病、慢性支气管炎、肺气肿和吸烟相关性间质性肺疾病(smoking-related ILD,SR-ILD)等。
与现有技术相比,本发明的有益效果如下。
1)本发明首次提供了GHK短肽及其铜离子螯合物在肺吸烟相关性呼吸系统疾病预防及治疗中的应用。
2)本发明提供的GHK短肽及其铜离子螯合物经实验验证,可以通过拮抗氧化应激反应及炎症反应,进而抑制小鼠吸烟相关疾病的发生,拮抗上皮细胞间充质化抑制气道周围胶原沉积及气道重塑的发生,从而抑制吸烟相关性呼吸系统疾病的发生发展。
附图说明
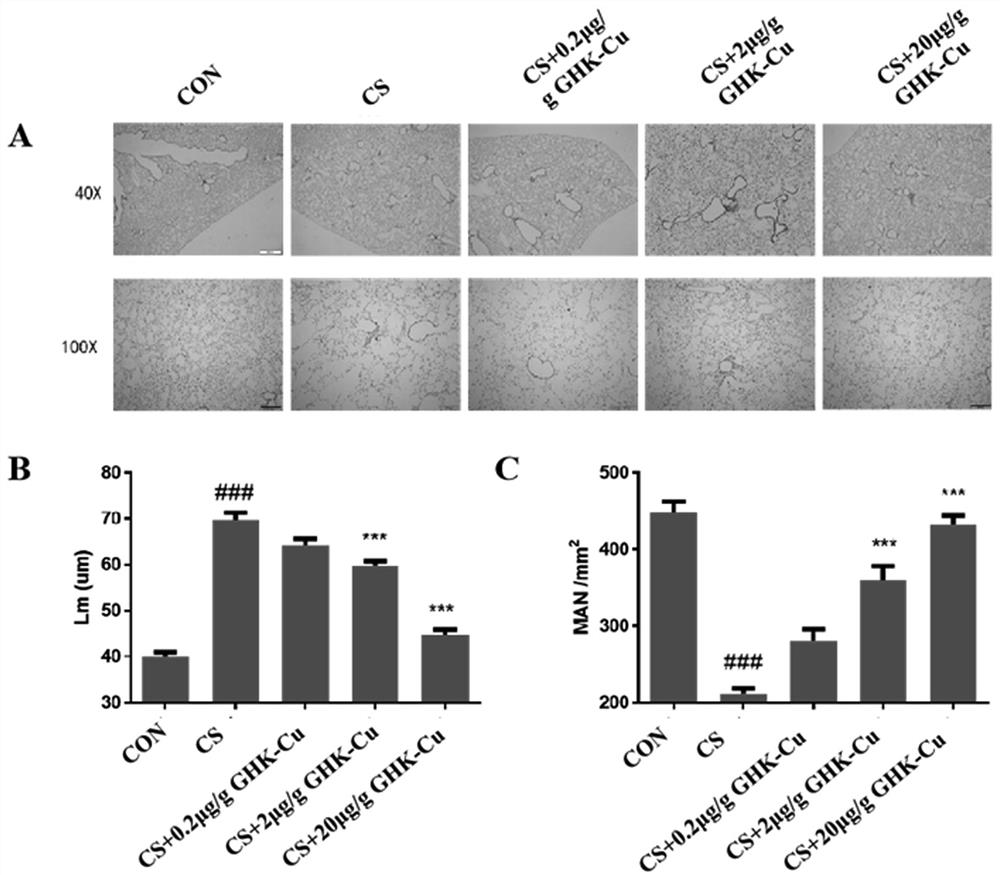
图1为苏木素-伊红(HE)染色检测本发明短肽对CS诱导的肺气肿的作用。其中,A:与对照组相比,CS组小鼠肺组织肺泡壁破坏,肺泡腔异常扩大,给予GHK-Cu干预后可部分减轻肺泡壁的破坏及肺泡腔的扩大;B-C:肺泡间壁距离用Lm测量,肺泡密度用MAN测量。数据以均数±标准误表示(n=3);与对照组相比,CS组的Lm水平显着升高,而MAN水平则显著降低;给予2μg/g及20μg/g GHK-Cu干预后,Lm显著降低,同时MAN显著增加。###,与对照组相比,
图2为ELISA检测本发明短肽对BALF中炎症因子IL1β及TNFα表达水平的影响。其中,A:CS可诱导BALF中TNFα的表达增加,给予GHK-Cu干预后可降低BALF中TNFα的表达;B:CS可诱导BALF中IL1β的表达增加,给予GHK-Cu干预后可降低BALF中IL1β的表达。###,与对照组相比,
图3为氧化应激指标的分析检测本发明短肽对CS诱导的氧化应激反应的影响。其中,A:与对照组相比,CS组T-AOC活性显著降低,给予20μg/g GHK-Cu 干预后,T-AOC活性增加;B:与对照组相比,CS组GSH活性显著降低,给予20μg/g GHK-Cu 干预后,GSH活性增加;C:与对照组比,CS组SOD活性显著降低,给予20μg/g GHK-Cu 干预后,SOD活性增加;D:与对照组比,CS组MDA活性显著增加,给予20μg/g GHK-Cu 干预后,MDA活性显著降低。 ###,与对照组相比,
图4A-4B为马松染色检测本发明短肽对CS诱导的气道周围的胶原沉积情况的影响。其中,A:应用马松染色(×200)评价气道周围的胶原沉积;B:应用阳染面积比进行各组间差异性比较。##
图5A-5D为免疫组化染色检测本发明短肽对CS诱导的小鼠肺EMT现象的影响。其中,A:免疫组化染色(×400)显示上皮指标E-cadherin在气道上皮的表达分布情况;B:应用平均光密度(AOD)值评价各组之间的E-cadherin的表达差异;C:免疫组化染色(×200)显示间充质指标α-SMA的表达分布情况;D:应用AOD值评价各组之间的α-SMA的表达差异。##
图6A-6C为Western Blot检测本发明短肽对CS诱导的MMP9/TIMP1蛋白表达失衡的影响。其中,A:应用Western Blot评价各组小鼠肺组织的MMP9及TIMP1的蛋白表达水平; B~C:应用各指标的OD与β-actin的OD值之比进行各组之间的差异性比较。##
具体实施方式
下面结合附图和具体实施例对本发明做进一步的说明。以下实施例将有助于对本发明的了解,但这些实施例仅为了对本发明加以说明,本发明并不限于这些内容。在实施例中的操作方法均为本技术领域常规操作方法。
实施例1 小鼠肺气肿模型的建立、实验分组与给药方法。
首先进行香烟烟雾提取物(cigarette smoking extract,CSE)制备,将3只已去滤嘴的香烟(万宝路,菲利普莫里斯公司,尼古丁0.8mg,焦油10mg,一氧化碳10mg)燃烧所产生的烟雾溶于15ml的磷酸盐缓冲液(phosphate buffered saline, PBS)溶液中,所获得的溶液定义为100%的CSE,应用0.22μm的滤器过滤该溶液两次。所获得的溶液应于制备后30min内应用。将C57BL/6小鼠随机分成5组:对照组,CS诱导小鼠肺气肿模型组(CS组),CS+0.2μg/g GHK-Cu组、CS+ 2μg/g GHK-Cu组、CS+20μg/g GHK-Cu。除对照组给予空气吸入外,其他三组均给予香烟烟雾暴露,将小鼠置于300L的熏烟箱内,每次点燃20支香烟,每次暴露于烟雾中30min,每日2次,持续6周。第1、12、23日给予CSE腹腔注射。GHK-Cu干预组于每日腹腔注射相应剂量的GHK-Cu,对照组及CS组给予相应剂量的生理盐水。小鼠于第43天安乐死处死,左肺应用4%的多聚甲醛灌流固定48小时,石蜡包埋。另一些小鼠应用0.5ml的PBS进行肺泡灌洗3次,收集肺泡灌洗积液(Bronchoalveolar lavage fluid,BALF)-80℃保存。右肺于-80℃保存。
实施例2 HE染色判断GHK-Cu对于CS诱导的肺气肿的影响。
一、苏木素(hematoxylin)和伊红(eosin)染色(简称HE染色)是细胞核组织学最广泛的染色方法。其基本原理为:细胞核内的染色质主要是DNA,DNA的双螺旋结构中,两边链上的磷酸基向外,带负电荷,呈酸性,很容易与带正电荷的苏木素碱性染料以离子键或氢键结合而被染色。苏木素在碱性溶液中呈蓝色,所以细胞核被染成蓝色。细胞浆内主要成分是蛋白质,为两性化合物、细胞浆的染色与PH值密切相关。伊红是一种化学合成的酸性染料,在水中离解成负电荷的阴离子,与蛋白质的氨基正电荷(阳离子)结合而使细胞浆染色,细胞浆、红细胞、肌肉、结缔组织,嗜伊红颗粒等被感染成不同程度的红色或粉红色,与蓝色的细胞核形成鲜明的对比。
1、4μm的石蜡切片被应用,将切片置于60℃烘烤箱内,烤片2小时。
2、二甲苯Ⅰ、Ⅱ、Ⅲ脱蜡各15分钟,然后放入无水乙醇Ⅰ、Ⅱ、95%、90%、80%、70%、50%各级乙醇溶液中各5分钟,再放入蒸馏水中5分钟。
3、苏木素染色:约3分钟。冲洗切片1-10s。
4、盐酸酒精分化:约10s。流水冲洗洗5-10分钟。
5、伊红染色:0.5%伊红染色3分钟,冲洗5-10分钟。
6、脱水:将切片依次置于50%乙醇、70%乙醇、80%乙醇、90%乙醇、95%乙醇、100%乙醇Ⅰ、Ⅱ各30s。
7、透明:切片放入二甲苯Ⅰ、Ⅱ中各5分钟。
8、封片:中性树胶封存,通风橱中晾干。
二、平均内衬间隔(Lm)和平均肺泡数(MAN)的计算方法。
Lm:在视野中绘制十字交叉线,并计算两条线的交点处的肺泡隔的总数。交叉线的总长度除以截距数即可得出所研究区域的Lm,即Lm =交叉线总长度/肺泡间隔数。Lm表示肺泡的平均大小。
MAN:在显微镜下通过每平方毫米的肺泡数目确定,即MAN =肺泡数目/平方毫米。MAN表示肺泡的密度。
苏木素-伊红(HE)染色及Lm和MAN定量检测结果如图1,与CS组相比,给予2μg/g及20μg/gGHK-Cu干预,可显著降低Lm,升高MAN。以上表明GHK-Cu治疗可改善CS诱导的肺气肿的形态学变化。
实施例3 ELISA检测BALF中炎性因子IL1β及TNFα的表达情况。
取出各试剂平衡至室温,试剂及样品配置时需充分混匀,并尽量避免出现气泡。
1、加样:分别设空白孔、标准孔、待测样品孔。空白孔加样品稀释液10μl,余孔分别加不同比例稀释后的标准品或待测样品100μl,覆膜,37℃孵育2h。
2、弃去液体,甩干,每孔加入生物素抗体(1X)100μl,覆膜,37℃孵育1h。
3、弃去孔内液体,甩干,洗板3次,每次浸泡1-2min,甩干并在吸水纸上轻拍将孔内液体拍干。
4、每孔加入HRP-亲和素(1X)100μl,覆膜,37℃孵育1h。
5、弃去孔内液体,甩干,洗板5次,方法同步骤3。
6、每孔加入90μl底物溶液,覆膜,37℃避光孵育15-30min。
7、每孔加入50μl终止液,终止反应。
8、立即用酶标仪在450nm波长测量各孔的光密度(OD值)。
检测结果如图2,与对照组相比,CS组的小鼠BALF中IL1β及TNFα的表达量明显增加,给予GHK-Cu干预后IL1β及TNFα的表达含量明显下调。GHK-Cu可明显减轻CS诱导的小鼠肺组织炎症反应。
实施例4 通过对氧化应激指标的分析检测GHK-Cu对CS诱导的氧化应激的影响。
新鲜获取的肺组织匀浆行生化分析。用4℃的冰盐水制备肺组织匀浆,2500rpm离心10分钟收集上清液。上清液用于检测抗氧化生物标志物,如抗氧化能力(T-AOC),超氧化物歧化酶(SOD),谷胱甘肽(GSH)和丙二醛(MDA)水平衡量肺组织氧化损伤的程度。
一、总抗氧化能力(T-AOC)检测步骤。
1、组织匀浆的制备:准确称取组织重量,按重量(g):体积(ml)=1:9的比例,加入9倍体积的生理盐水,冰水浴条件下,制备成10%的匀浆液,2500转/分离心10分钟,取上清液待测。同时,用BCA法测定匀浆蛋白浓度。
2、试剂二应用配制:每支粉剂加双蒸水120ml充分溶解(粉剂较难溶解,可在37℃水浴加速溶解)。
3、试剂三应用液:用前取贮备液用稀释液以1:19稀释,现用现配。
4、取试剂一分别加入测定管和对照管各1ml。并在测定管中加入0.1ml待测样本。
5、在测定管和对照管中分别加入试剂二和试剂三应用液各2ml和0.5ml。旋涡混匀器充分混匀,37℃水浴30分钟。
6、在测定管和对照管加入0.2ml试剂四,并在对照管内加入0.1ml待测样本。
7、在测定管和对照管内加入0.2ml试剂五,混匀,放置10分钟,波长520nm,测定各管吸光度值。
二、超氧化物歧化酶(SOD)检测步骤。
1、组织匀浆的制备:准确称取组织重量,按重量(g):体积(ml)=1:9的比例,加入9倍体积的生理盐水,冰水浴条件下,制备成10%的匀浆液,2500转/分离心10分钟,取上清液待测。同时,用BCA法测定匀浆蛋白浓度。
2、试剂一应用液的配制:用10ml贮备液加蒸馏水稀释至10ml,4℃保存。
3、试剂四应用液的配制:用时按贮备液:稀释液=1:14比例配制,现用现配。
4、试剂五:粉剂1支,用时加蒸馏水75ml,加热至70℃-80℃溶解后备用,若加热过程中水分蒸发减少,此时必须用蒸馏水补充至75ml。
5、试剂六:粉剂1支,用时加蒸馏水75ml溶解后备用,配好的试剂避光保存。
6、显色剂的配制:按试剂五:试剂六:冰乙酸=3:3:2的体积比配制,用多少配多少,配好的试剂避光保存。
7、在测定管和对照管分别加入试剂一应用液1ml。并在测定管内加入样品0.05ml,对照管内加蒸馏水0.05ml。
8、在测定管和对照管内分别加入试剂二、试剂三和试剂四应用液0.1ml,用旋涡混匀器充分混匀,置37℃恒温水浴40分钟。
9、在测定管和对照管内分别加入2ml显色剂,混匀,室温放置10分钟,于波长550nm处,测定各管吸光度值。
10、计算公式:总SOD活力(U/mgprot)=(对照OD值-测定OD值)/对照OD值÷50%×反应液总体积(ml)/取样量(ml)÷相同匀浆浓度下的蛋白含量(mgprot/ml)(注:U/mgprot指活力单位每毫克蛋白,mgprot/ml指毫克蛋白每毫升)。
三、还原型谷胱甘肽(GSH)的检测步骤。
1、组织匀浆的制备:准确称取组织重量,按重量(g):体积(ml)=1:9的比例,加入9倍体积的生理盐水,冰水浴条件下,制备成10%的匀浆液,2500转/分离心10分钟,取上清液待测。取10%组织匀浆5-10ml,以1000-2000转/分钟离心10分钟,取上清液以8000-10000转/分钟离心15分钟,沉淀物为线粒体。
2、在非酶管和酶管中分别加入0.2ml1mmol/LGSH,并在酶管内加入0.2ml待测匀浆,37℃水浴预温5分钟。
3、在非酶管和酶管内加入0.1ml试剂一应用液,37℃水浴准确反应5分钟。
4、在非酶管和酶管内加入试剂二应用液2ml,并在非酶管内加入0.2ml待测匀浆,混匀,3500-4000转/分,离心10分钟,取上清1ml做显色反应。
5、在空白管内加入GSH标准品溶剂应用液1ml,标准管加入20umol/LGSH标准液1ml,非酶管和酶管分别加入上清液1ml。
6、在空白管、标准管、非酶管和酶管内分别加入试剂三、四、五应用液各1ml、0.25ml、0.05ml。混匀,室温静置15分钟,在412nm处,测定各管OD值。
四、丙二醛(MDA)检测步骤。
1、组织匀浆的制备:准确称取组织重量,按重量(g):体积(ml)=1:9的比例,加入9倍体积的生理盐水,冰水浴条件下,制备成10%的匀浆液,2500转/分离心10分钟,取上清液待测。同时,用BCA法测定匀浆蛋白浓度。
2、试剂一每次测试前可37℃加热加速溶解直至透明。
3、试剂二用时每瓶加340ml蒸馏水混匀,4℃冷藏。
4、试剂三用时将粉剂加蒸馏水60ml,加热到90℃-100℃充分溶解后,用蒸馏水补足至60ml,再加冰醋酸60ml,混匀,配好的试剂避光冷藏。
5、混合试剂的配制:工作液Ⅰ的配制:试剂一:试剂二:试剂三=0.1:3:1,现用现配。工作液Ⅱ的配制:试剂一:试剂二:50%冰醋酸=0.1:3:1,现用现配。
6、空白管内加入0.1ml无水乙醇,标准管内加入0.1ml10nmol/ml标准品,测定管内加入0.1ml测试样品。
7、空白管、标准管、测定管分别加入4ml工作液Ⅰ。离心管盖上盖,在盖上扎一小孔,旋涡混匀器混匀,95℃水浴40分钟,取出后流水冷却,然后3500-4000转/分,离心10分钟。取上清,532nm处测各管吸光度值。
氧化应激指标检测结果如图3,CS可导致肺组织中抗氧化酶如T-AOC,SOD和GSH活性降低,及MDA活性增加。而给予20μg/gGHK-Cu干预,可抑制肺组织抗氧化酶活性的降低及MDA活性的增加。
实施例5 马松染色检测气道周围的胶原沉积情况。
马松染色是胶原纤维染色的主要方法之一,可染细胞核和选择性的显示胶原纤维和肌纤维。马松染色原理与阴离子染料分子的大小和组织的渗透有关:分子的大小由分子量体现,小分子量易穿透结构致密、渗透性低的组织,而大分子量则只能进入结构疏松的、渗透性高的组织。然而,苯胺蓝的分子量很大,因此马松染色后肌纤维呈红色,胶原纤维呈蓝色,主要用于区分胶原纤维和肌纤维。
1、4μm切片脱蜡处理至水。
2、滴加1滴(100μl)Masson复合染色液(试剂A)染色5分钟,蒸馏水冲掉染液。
3、滴加1滴(100μl)磷钼酸(试剂C)染色5分钟,甩干。
4、直接滴加1滴(100μl)苯胺蓝(试剂D)染色5分钟蒸馏水稍冲。
5、滴加1滴(100μl)分化液(试剂B)分化30-60秒(2次)。
6、95%酒精、无水酒精脱水,透明,封固。
检测结果如图4A-4B所示,与对照组相比,CS组的小鼠气道周围的胶原沉积(蓝染)明显增加,给予2μg/g及20μg/gGHK-Cu干预后,可明显减少小鼠气道周围的胶原沉积。GHK-Cu可明显减轻CS诱导的小鼠气道周围的胶原沉积。
实施例6 免疫组化的方法检测GHK-Cu对CS诱导的EMT现象的影响。
免疫组化染色是用标记的特异性抗体对组织切片或细胞标本中某些化学成分的分布和含量进行组织和细胞原位定性、定位或定量研究。免疫组化的原理为:根据抗原抗体反应和化学显色原理,组织切片或细胞标本中的抗原先和一抗结合,再利用一抗与标记生物素、荧光素等的二抗进行反应,前者再用标记辣根过氧化物酶(HRP)等的抗生素(如链霉亲和素等)结合,最后通过呈色反应或荧光来显示细胞或组织中化学成分,在化学显微镜或荧光显微镜下可清晰看见细胞内发生的抗原抗体反应产物,从而能够在细胞爬片或组织切片上原位确定某些化学成分的分布和含量。
1、石蜡切片(4μm)脱蜡、水化,自来水冲洗。
2、根据一抗的要求对组织进行相应的抗原修复,PBS冲洗3次,每次3min。
3、除去PBS,切片上滴加过氧化物酶阻断试剂,室温下孵育10min,PBS冲洗3次,每次3min。
4、除去PBS,切片上滴加正常非免疫动物血清,室温上孵育10分钟。
5、除去血清,切片上滴加第一抗体,室温下孵育60min或4℃过夜,PBS冲洗3次,每次3min。
6、除去PBS,切片上滴加生物素标记的第二抗体,室温下孵育10min,PBS冲洗3次,每次3min。
7、除去PBS,切片上滴加链霉菌抗生素蛋白-过氧化物酶试剂,室温下孵育10min,PBS冲洗3次,每次3min。
8、除去PBS,切片上滴加新鲜配制的DAB显色试剂显色。
9、自来水冲洗终止显色,苏木素复染,1%盐酸酒精分化,流水返蓝,切片梯度酒精脱水,二甲苯透明,中性树胶封固。
检测结果如图5A-5D所示,与对照组相比,CS组的小鼠上皮标志物E-cadherin的表达降低,如图5A所示,而间充质标志物α-SMA的表达升高,如图5C所示。而给予2μg/g及20μg/gGHK-Cu干预后,可明显抑制CS诱导的小鼠气道上皮细胞E-cadherin的下降及间充质标志物α-SMA的升高。GHK-Cu 可抑制CS诱导的EMT现象。
实施例7 Western Blot检测GHK-Cu对MMP9/TIMP1的蛋白表达水平的影响。
RIPA裂解液裂解小鼠肺组织。匀浆超声后低温离心取上清液,BCA蛋白浓度测定试剂盒测定蛋白浓度。加入上样缓冲液煮沸变性后取50μg/孔,4%(质量浓度)浓缩胶和10%(质量浓度)分离胶进行SDS-PAGE电泳,浓缩胶电压80V 50min,分离胶电压120V 70min。转印至PVDF膜(200mA,2h)。5%(质量浓度)BSA常温封闭1h加入一抗兔抗鼠多克隆抗体MMP9和TIMP1,室温摇床上缓慢摇动孵育过夜。TBST洗涤3次。加入二抗羊抗兔抗体1:3000,室温在侧摆摇床上缓慢摇动孵育2小时。TBST洗膜后ECL化学发光,按一抗说明书上的蛋白相对分子质量确定目的条带位置并测定灰度值,以目的条带灰度值与β-actin灰度值的比值为MMP9及TIMP1蛋白相对表达量。Western blot方法揭示短肽可逆转MMP9/TIMP1的蛋白表达失衡,结果见图6A-6C。与CS组相比,给予小鼠2μg/g及20μg/gGHK-Cu干预后,MMP9的蛋白表达水平明显下降,TIMP1的表达增加。
- 一种短肽及其铜离子螯合物的医药用途
- 用于制备氨基酸螯合物的方法,氨基酸螯合物和氨基酸螯合物的用途
