包括非标准氨基酸的组合物及其用途
文献发布时间:2023-06-19 10:36:57
交叉引用
本申请要求2018年7月9日提交的美国临时专利申请62/695,505号的权益,所述美国临时专利申请通过援引而整体地并入本文中。
背景技术
许多酶的活性取决于它们催化其各自反应所处的环境,例如,具有还原条件的缓冲液。通常,酶依赖于某些结构特征以维持它们的活性,并且这些结构特征可能受损于某些条件。例如,在还原条件下,酶的分子间和/或分子内二硫键可以被还原,导致酶的结构改变,最终降低或失去活性。例如,用于单细胞测序和单细胞PCR的许多方法需要使用苛刻的裂解缓冲液来裂解液滴内的细胞以便提取或扩增多核苷酸(例如mRNA)或者从单细胞提取蛋白质。在裂解之后,通常采用反应,该反应包括反转录反应、聚合酶催化反应例如复制和/或合成多核苷酸、连接反应、扩增反应、核酸酶催化反应,以及蛋白酶介导反应。但是,由于催化这些反应的酶所处于的裂解缓冲液的苛刻性质,故此这些反应的催化剂通常被减弱或不可能。
发明内容
本文中提供了克服这些问题的组合物和方法。本文中提供了稳定化的酶,其即使在苛刻条件、例如还原环境中也保持活性。本文中提供了包括非标准氨基酸的稳定化的酶,其在苛刻条件、例如还原缓冲液中具有酶活性,其酶活性高于在相同条件下没有非标准氨基酸的相应酶。本文中还提供了编码这些稳定化的酶的多核苷酸、用于表达和/或产生这些稳定化的酶的细胞,以及使用这些稳定化的酶的方法。在一些方面中,稳定化的酶包括稳定化的脱氧核糖核酸酶I(DNase I)多肽。
在一些方面中,本文中提供了一种组合物,所述组合物包括稳定化的脱氧核糖核酸酶I(DNase I)多肽、其功能片段或其变异体,所述稳定化的脱氧核糖核酸酶I(DNase I)多肽包括一种或多种非标准氨基酸。
在一些方面中,本文中提供了一种组合物,所述组合物包括稳定化的脱氧核糖核酸酶I(DNase I)多肽、其功能片段或其变异体,所述稳定化的脱氧核糖核酸酶I(DNase I)多肽包括一种或多种非标准氨基酸,其中所述稳定化的DNase I多肽在环境中对DNA底物的内切核酸酶活性高于不包括所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体对所述DNA底物的内切核酸酶活性。
在一些方面中,本文中提供一种组合物,所述组合物包括稳定化的脱氧核糖核酸酶I(DNase I)多肽、其功能片段或其变异体,所述稳定化的脱氧核糖核酸酶I(DNase I)多肽包括一种或多种非标准氨基酸,其中在不包括所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体不稳定化的环境中,所述稳定化的DNase I多肽没有不稳定化。
在一些方面中,本文中提供一种组合物,所述组合物包括稳定化的脱氧核糖核酸酶I(DNase I)多肽、其功能片段,或其变异体,所述稳定化的脱氧核糖核酸酶I(DNase I)多肽包括一种或多种非标准氨基酸,其中所述稳定化的DNase I多肽的解链温度(meltingtemperature,Tm)比不包括所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体的T
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的解链温度(Tm)比不包括所述一种或多种非标准氨基酸的相应重组酶、其功能片段或其变异体的T
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体在环境中对DNA底物的内切核酸酶活性高于不包括所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体对所述DNA底物的内切核酸酶活性。
在一些实施方案中,在不包括所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体不稳定化的环境中,所述稳定化的DNase I多肽、其功能片段或其变异体没有不稳定化。
在一些实施方案中,所述一种或多种非标准氨基酸中的至少一个、两个、三个、四个或更多个是硒代半胱氨酸(selenocysteine)。
在一些实施方案中,所述一种或多种非标准氨基酸中的至少两个由键直接连接。
在一些实施方案中,所述一种或多种非标准氨基酸中的至少四个由键直接连接,其中所述一种或多种非标准氨基酸中的所述至少四个中的第一对由键直接连接,并且所述一种或多种非标准氨基酸中的所述至少四个中的第二对由键直接连接。
在一些实施方案中,所述键是二硒键(diselenide bond)。
在一些实施方案中,所述二硒键是分子间键或分子内键。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的半衰期比不包括所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体的半衰期高至少1.1倍。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体与SEQ IDNO:1具有至少70%、75%、80%、85%、90%、95%的序列一致性。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体包括序列,所述序列与SEQ ID NO:1的至少25、50、75、100、125、150、175、200、225、250或261个连续氨基酸具有至少70%、75%、80%、85%、90%、95%的序列一致性。
在一些实施方案中,所述一种或多种非标准氨基酸位于SEQ ID NO:1的102位、SEQID NO:1的105位、SEQ ID NO:1的174位、或SEQ ID NO:1的210位。
在一些实施方案中,在102位处的非标准氨基酸由键直接连接到在105位处的非标准氨基酸。
在一些实施方案中,在174位处的非标准氨基酸由键直接连接到在210位处的非标准氨基酸。
在一些实施方案中,所述键是二硒键。
在一些实施方案中,所述二硒键位于相应重组酶中的二硫键的位置,所述相应重组酶没有所述一种或多种非标准氨基酸。
在一些实施方案中,所述相应稳定化的DNase I多肽、其功能片段或其变异体的所述Tm小于37℃。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的所述Tm大于37℃、40℃、45℃、50℃、55℃、60℃或65℃。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的所述Tm比所述相应重组酶、其功能片段或其变异体的所述Tm高至少10℃。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的所述Tm比所述相应重组酶、其功能片段或其变异体的所述Tm高至少15℃。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体在环境中的半衰期比不包括所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体在所述环境中的半衰期高至少1.1倍。
在一些实施方案中,所述DNase I多肽、其功能片段或其变异体在所述环境中的所述半衰期大于1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24小时或更长。
在一些实施方案中,所述DNase I多肽、其功能片段或其变异体在所述环境中的所述半衰期大于1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、2 4天或更长。
在一些实施方案中,所述稳定化的DNase I多肽在环境中对DNA底物的内切核酸酶活性比不包括所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体对所述DNA底物的内切核酸酶活性高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、10、20、30、40、50、60、70、80、90或100倍。
在一些实施方案中,所述稳定化的DNase I多肽在存在于环境中至少1、2、3、4、5、6、7、8、9、10、15、20、25、30、40或50分钟之后、对DNA底物的内切核酸酶活性比不包括所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体在存在于所述环境中至少1、2、3、4、5、6、7、8、9、10、15、20、25、30、40或50分钟之后、对所述DNA底物的内切核酸酶活性高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、10、20、30、40、50、60、70、80、90或100倍。
在一些实施方案中,所述稳定化的DNase I多肽在存在于环境中至少1、2、3、4、5、6、7、8、9、10、12、18或24小时之后、对DNA底物的内切核酸酶活性比不包括所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体在存在于所述环境中至少1、2、3、4、5、6、7、8、9、10、12、18或24小时之后、对所述DNA底物的内切核酸酶活性高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、10、20、30、40、50、60、70、80、90或100倍。
在一些实施方案中,所述DNA底物是基因组DNA。
在一些实施方案中,所述环境是温度为4℃-98℃的环境。
在一些实施方案中,所述环境是含有裂解缓冲液的环境。
在一些实施方案中,所述环境是浓度为0.01%至20%的洗涤剂的环境。
在一些实施方案中,所述洗涤剂是非离子型洗涤剂。
在一些实施方案中,所述洗涤剂是离子型洗涤剂。
在一些实施方案中,所述环境包括浓度为0.01mM至100mM的二价阳离子。
在一些实施方案中,所述二价阳离子选自由包含Mg
在一些实施方案中,所述环境包括浓度为0.01mM至100mM的还原剂。
在一些实施方案中,所述环境具有5-9的pH。
在一些实施方案中,所述环境具有6-8的pH。
在一些实施方案中,所述环境具有7-8的pH。
在一些实施方案中,所述环境具有10mM至1M的盐浓度。
在一些实施方案中,所述环境是在液滴内。
在一些实施方案中,所述环境是血液循环系统。
在一些实施方案中,所述环境具有小于-150mV、-160mV、-170mV、-180mV、-190mV、-200mV、-210mV、-220mV、-230mV、-240mV、or-250mV、-260mV、-270mV、-280mV、-290mV、-300mV、-310mV、-320mV、-330mV、-340mV、or-350mV、-360mV、-370mV、-380mV、-390mV、-400mV、-410mV、-420mV、-430mV、-440mV、or-450mV、-460mV、-470mV、-480mV、-490mV、-500mV、-510mV、-520mV、-530mV、-540mV、or-550mV、-560mV、-570mV、-580mV、-590mV或-600mV的还原电位。。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体是重组体。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体是牛的DNase I。
在一些实施方案中,一种组合物,其包括编码本文公开的组合物的多核苷酸。
在一些实施方案中,所述多核苷酸是载体。
在一些实施方案中,直接连接所述稳定化的DNase I多肽的所述一种或多种非标准氨基酸中的两个的键在环境中不断裂,其中直接连接所述相应DNase I多肽的一种或多种标准氨基酸中的两个的键在相同的环境中断裂。
在一些实施方案中,制备本文公开的组合物的方法包括表达所述稳定化的DNaseI多肽的氨基酸序列。
在一些实施方案中,表达包括在细胞中或在体外的表达。
在一些实施方案中,所述细胞是细菌细胞。
在一些实施方案中,所述细胞是基因组重新编码的细胞。
在一些实施方案中,所述细胞包括由稳定化非标准氨基酸tRNA识别的重分配的密码子,所述稳定化非标准氨基酸tRNA包括与所述重分配的密码子对应的反密码子。
在一些实施方案中,所述稳定化的DNase I多肽的所述氨基酸序列由多核苷酸序列编码,所述多核苷酸序列包括已被所述重分配的密码子取代的天然氨基酸的至少一个密码子。
在一些实施方案中,所述稳定化非标准氨基酸tRNA是硒代半胱氨酸tRNA。
在一些实施方案中,所述方法包括在所述稳定化的DNase I多肽的所述氨基酸序列被表达的条件下培养所述细胞。
在一些实施方案中,所述重分配的密码子是UAG、UAA、UGA,或其组合。
在一些方面中,本文中提供一种方法,所述方法包括将缓冲液中、反应环境中或固体表面上的DNA底物与包括一种或多种非标准氨基酸的稳定化的脱氧核糖核酸酶I(DNaseI)多肽、其功能片段,或其变异体接触;其中所述稳定化的DNase I多肽、其功能片段或其变异体相比于不包括所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体以更高的速率催化所述DNA底物的分裂或断裂。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体是本文其他部分公开的稳定化的DNase I多肽、其功能片段或变异体。
在一些实施方案中,所述DNA底物是基因组DNA。
在一些实施方案中,所述DNA底物来自单细胞。
在一些实施方案中,所述方法包括形成多个容器(vessel),每个容器都包括多个细胞中的单细胞;所述稳定化的DNase I多肽、其功能片段或其变异体;和裂解缓冲液。
在一些实施方案中,所述方法进一步包括裂解所述单细胞,由此从所述单细胞释放所述DNA底物。
在一些实施方案中,所述方法进一步包括条形码化所述DNA底物或其片段。
在一些实施方案中,所述方法进一步包括扩增所述DNA底物或其片段。
在一些实施方案中,所述扩增包括克隆扩增。
在一些实施方案中,所述方法进一步包括对所述DNA底物或其片段进行测序。
在一些实施方案中,所述测序包括全基因组测序。
在一些实施方案中,所述测序包括高通量测序、大规模并行测序、桑格测序或下一代测序。
在一些实施方案中,所述多个容器包括含固体支持体。
在一些实施方案中,所述DNA底物未附接到容器中的固体支持体。
在一些实施方案中,所述缓冲液、所述反应环境或所述固体表面包括对所述DNA底物或其片段的序列特异性的引物。
在一些实施方案中,所述多个细胞包括至少2、3、4、5、5.5、6、6.5、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10,000、15,000、20,000、25,000、30,000、35,000、40,000、45,000、50,000、60,000、70,000、80,000、90,000、100,000、200,000、300,000、400,000、500,000、600,000、700,000、800,000、900,000、1x10
在一些实施方案中,所述多个细胞来自一个或多个生物样品。
在一些实施方案中,所述一个或多个生物样品包括至少2、3、4、5、10、20、30、40、50、60、70、80、90或100或更多个样品。
在一些实施方案中,所述一个或多个生物样品来自患有疾病的受试者。
在一些实施方案中,所述多个细胞包括多个细菌细胞或多个真菌细胞。
在一些实施方案中,所述多个细胞包括多个免疫细胞。
在一些实施方案中,所述多个细胞包括多个患病细胞。
在一些实施方案中,所述多个细胞包括多个癌细胞。
援引加入
在本说明书中提及的所有出版物、专利和专利申请通过援引而并入本文中,如同每件单独的出版物、专利或专利申请被具体且单独地指明通过援引而并入。
附图说明
在随附的权利要求中具体地阐述了本公开的特征。通过参考以下详细描述和附图将获得对本公开的特征和优点的更好理解,以下详细描述阐述了利用本公开的原理的示例性实施方案,在附图中:
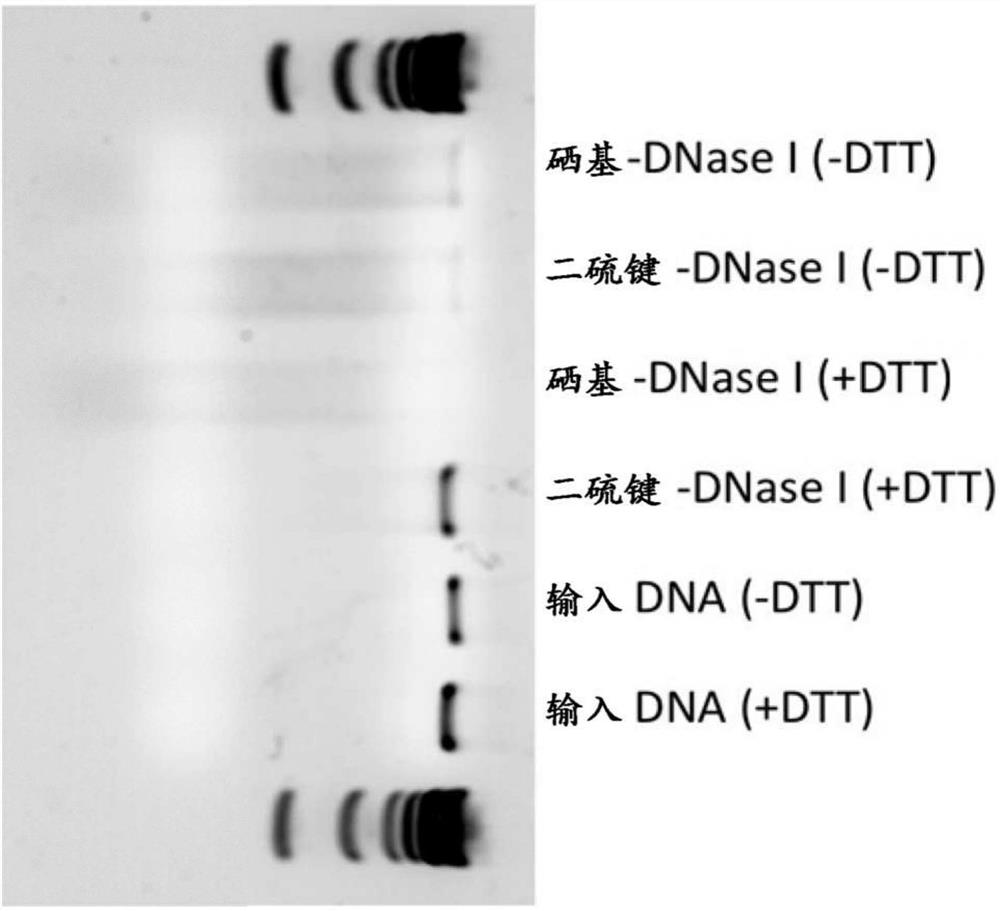
图1描绘了向0mm DTT(泳道(lane)6)、50mm DTT(泳道7)、30ng硒基-DNase(GST–硒基-DNase I融合物)或等摩尔二硫键DNase(从牛胰腺纯化的野生型DNase I,西格玛(Sigma)DN25)的混合物添加的50ng双链DNA、在增补有0mM DTT(-DTT,泳道2和3)或50mMDTT(+DTT,泳道4和5)的反应缓冲液(NEB B0303S)中在37℃孵育DNase 2小时之后的琼脂糖凝胶。将双链DNA添加到每种混合物并且在37℃酶切(digest)30min,随后在75℃热灭活10min。两种酶都在0mM DTT中酶切该DNA,但是只有硒基-DNase在50mM DTT中酶切该DNA。
具体实施方式
术语“编码”表示多核苷酸(例如基因、cDNA或mRNA)中的特定核苷酸序列的固有性质,以作为生物学过程中合成其他聚合物和大分子的模板,该聚合物和大分子具有确定的核苷酸序列(例如rRNA、tRNA和mRNA)或确定的氨基酸序列及由此获得的生物学性质。因此,如果在细胞或其他生物学系统中,对应于基因的mRNA的转录和翻译产生蛋白质,则该基因、cDNA或RNA编码该蛋白。编码链(其核苷酸序列与mRNA序列一致并且通常在序列中提供)和非编码链(用作基因或cDNA转录的模板)都可以被称为编码该基因或cDNA的蛋白质或其他产物。
术语“内源性”表示来自或产生于生物体、细胞、组织或系统内的任何材料。
术语“外源性”表示从生物体、细胞、组织或系统引入的或在生物体、细胞、组织或系统外产生的任何材料。
术语“表达”表示由启动子驱动的特定核苷酸序列的转录和/或翻译。
术语“同源”或“一致性”表示两个聚合物分子(例如两个核酸分子(例如两个核酸分子(DNA分子或两个RNA分子)之间或两个多肽分子)之间的亚单位(subunit)序列一致性。当在所述两个分子中亚基位置被相同的单体亚单位占据时;例如如果在所述两个DNA分子各自中的位置都被腺嘌呤占据,则在该位置它们是同源的或一致的。两个序列之间的同源性是匹配的或同源位置数的直接函数;例如如果两个序列中一半的位置(例如十个亚单位长度的聚合物中的五个位置)是同源的,则这两个序列是50%同源;如果90%的位置(例如9/10)是匹配的或同源的,则这两个序列是90%同源。
术语“分离的”表示从天然状态改变或去除的。例如,活的动物中的天然存在的核酸或肽不是“分离的”,但是从其天然状态的共存物质中部分地或完全地分离的相同核酸或肽是“分离的”。分离的核酸或蛋白质可以以基本上纯化的形式存在,或者可以存在于非原生环境例如宿主细胞中。
在本发明的上下文中,使用以下缩写代表通常存在的核酸碱基。“A”表示腺苷,“C”表示胞嘧啶,“G”表示鸟苷,“T”表示胸苷,以及“U”表示尿苷。
术语“可操作地连接(operably linked)”或“转录控制”表示调节序列和异源核酸序列之间的功能性连接,其导致该异源核酸序列的表达。例如,当第一核酸序列与第二核酸序列处于功能性关系中时,所述第一核酸序列与所述第二核酸序列可操作地连接。例如,如果启动子影响编码序列的转录或表达,则该启动子可操作地连接到该编码序列。可操作地连接的DNA序列可以是彼此邻接的且处于相同的阅读框(例如如果需要连接两个蛋白质编码区域)。
术语“核酸”或“多核苷酸”表示单链或双链形式的脱氧核糖核酸(DNA)或核糖核酸(RNA)及其聚合物。除非特别限定,该术语涵盖含有已知的天然核苷酸类似物的核酸,所述核酸具有与参考核酸相似的结合性质并且以与天然存在的核苷酸相似的方式来代谢。除非另外说明,特定的核酸序列还隐含地涵盖其保守修饰的变异体(例如简并密码子替换)、等位基因、直系同源基因、SNP和互补序列,以及明确示出的序列。具体而言,简并密码子替换可以通过产生其中一种或多种选择的(或全部)密码子的第三位置被混合碱基和/或脱氧肌苷残基替换的序列来实现(Batzer等人,Nucleic Acid Res.19:5081(1991);Ohtsuka等人,J.Biol.Chem.260:2605-2608(1985);和Rossolini等人,Mol.Cell.Probes 8:91-98(1994))。
本文中使用的术语"氨基酸"表示天然存在的和合成的氨基酸,以及与天然存在的氨基酸功能相似的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是由遗传密码编码的那些氨基酸,以及随后被修饰的那些氨基酸,例如羟脯氨酸、γ-羧基谷氨酸和O-磷酸丝氨酸。本文中使用的术语“氨基酸类似物”表示具有与天然存在的氨基酸相同的基本化学结构的化合物,即,与氢、羧基、氨基和R基结合的α碳,例如高丝氨酸、正亮氨酸、蛋氨酸亚砜、蛋氨酸甲基锍。这种类似物具有修饰的R基团(例如正亮氨酸)或修饰的肽主链,但是保留与天然存在的氨基酸相同的基本化学结构。本文中使用的术语“氨基酸模拟物”表示化学化合物,其具有与氨基酸的一般化学结构不同的结构,但是功能相似于天然存在的氨基酸。
术语“非标准氨基酸”表示除了20种标准氨基酸(丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸)以外的其他任何氨基酸。硒代半胱氨酸是非标准氨基酸(NSAA)。
术语“肽”、“多肽”和“蛋白”可互换地使用,并且表示包含由肽键共价连接的氨基酸残基的化合物。蛋白质或肽必须包含至少两个氨基酸,并且对蛋白质序列或肽序列可包含的氨基酸的最大数量没有限制。多肽包括任何肽或蛋白质,其包含由肽键彼此连接的两个或更多个氨基酸。本文中使用的该术语表示短链(其在本领域中也常称为例如肽、寡肽和寡聚体)和长链(其在本领域中一般称为蛋白质,其中存在许多类型)。“多肽”包括,例如,生物活性的片段、基本同源的多肽、寡肽、同二聚体、异二聚体、多肽的变异体、修饰的多肽、衍生物、类似物、融合蛋白等。多肽包括天然肽、重组肽或其组合。
术语“启动子”表示由细胞的转录机制识别的或合成机制引入的的DNA序列,其是开始多核苷酸序列的特异性转录所需的。
术语“组成型(constitutive)”启动子表示在与编码或指定基因产物的多核苷酸可操作地连接时,使在细胞的大多数或全部生理条件下在细胞中产生基因产物的核苷酸序列。
术语“诱导型”启动子表示在与编码或指定基因产物的多核苷酸可操作地连接时,基本上仅在与启动子对应的诱导物存在于细胞中时,在细胞内产生基因产物的核苷酸序列。
术语“转染的”或“转化的”或“转导的”表示将外源性核酸转移或引入宿主细胞的过程中。“转染的”或“转化的”或“转导的”细胞是用外源性核酸转染、转化或转导的细胞。所述细胞包括原代受试者细胞及其后代。
范围:在整个本公开、本发明的各种方面中,可以以范围格式(range format)呈现。应理解,范围格式的表述仅仅为了方便和简洁,并且不应被解释为对本发明的范围的不可改变的限制。因此,范围的表述应被视为已经明确地公开了所有可能的子范围,以及在该范围内的单个数值。例如,范围的表述例如1至6应被视为已经明确地公开了子范围例如1至3、1至4、1至5、2至4、2至6、3至6等,以及在该范围内的单个数值,例如,1、2、2.7、3、4、5、5.3和6。作为另一示例,范围例如95%-99%一致性包括具有95%、96%、97%、98%或99%一致性的某物,并且包括诸如96%-99%、96%-98%、96%-97%的子范围。
除非另外定义,本文中使用的全部技术和科学术语具有要求保护的主题所属领域的技术人员普遍理解的相同含义。应理解,上述一般描述和以下详细描述仅仅是示例性和解释性,并非对要求保护的任何主题的限制。在本申请中,除非另有明确地陈述,单数的使用包括复数。
蛋白质使用非标准氨基酸提供了具有极大扩展的功能性的多肽的可能性,所述多肽可以用于广泛的应用。例如,通过将硒代半胱氨酸掺入(incorporate)在多肽中,可能开发出具有增强的稳定性或活性水平的酶,并产生高活性的治疗性多肽。然而,这些方法迄今已经受阻于无法产生稳定性保留翻译途径的生物体,该翻译途径可预测且可靠地将硒代半胱氨酸掺入在编码的多肽中。本文中详述的研究说明一种稳定系统,其用于选择可掺入硒代半胱氨酸的tRNA分子和用于产生掺入硒代半胱氨酸位置的多肽。重要地,此系统可以容易地从一个生物体转移到另一生物体而无需重组工程(re-engineering)。
利用逐步发展的正交氨酰-tRNA合成酶(aaRS)/tRNA对,具有多样化学性质的超过100种NSAA已经被合成并且共翻译地被掺入蛋白中。已经基于酪氨酸或吡咯赖氨酸设计了非标准氨基酸。aaRS/tRNA可以提供在质粒上或在基因组重新编码的生物体的基因组中。正交aaRS/tRNA对可以用于将NSAA生物正交地掺入蛋白质中。基于载体的过度表达系统可以用于通过其重分配的功能而超过天然密码子功能。如果完全地消除天然UAG翻译功能,远远较低的aaRS/tRNA功能可以足以实现有效的NSAA掺入。基于基因组重新编码的生物体(Genomically recoded organism,GRO)的NSAA掺入可以使用基于载体的和/或基于基因组的aaRS/tRNA对。在没有可用的NSAA情况下,基于基因组的aaRS/tRNA对已经用于减少标准氨基酸的错误掺入。因为在基因组重新编码的生物体中UAG密码子功能已经被完全被重分配,所以NSAA、例如硒代半胱氨酸可以被掺入基因组重新编码的生物体中而没有任何表型结果。基因组重新编码的生物体中的NSAA掺入可以涉及向生长培养基增补非标准氨基酸(例如硒代半胱氨酸)和aaRS的诱导物。或者,aaRS可以被组成型表达。或者,如在本公开中,内源性丝氨酰-tRNA合成酶可以用于丝氨酰化(serylate)硒代半胱氨酸tRNA,该tRNA受到包含SelA的酶作用而产生tRNasec(载有硒代半胱氨酸的tRNA)。培养基可以增补硒源(例如亚硒酸钠)来提高tRNasec的产生。期望的蛋白质可以利用任何期望的蛋白质过度表达系统(例如T7-RNAP、组成型掺入,或者基于IPTG/异乳糖、无水四环素、阿拉伯糖、鼠李糖或其他可诱导型系统的可诱导型表达)来过度表达。蛋白质交联(二硒键)可以在蛋白折叠过程中基于邻近的几何催化自发地形成,并且该蛋白质可以作为任何其他过度表达的产物来处理。
本发明人已经开发出多肽和方法以便在基因组重新编码的生物体(GRO)中产生多肽,所述多肽折叠成生物制品,该生物制品例如由硒代半胱氨酸氨基酸之间的二硒键来稳定化。然而,半胱氨酸氨基酸之间的二硫键具有约-220mV的氧化还原电位,二硒键具有约-380mV的氧化还原电位。由于细菌细胞溶胶通常具有约-280至-300mV的氧化还原电位,因此二硒键而非二硫键避免了还原,从而它们形成并存在于细胞溶胶中。因为二硒键具有与二硫键相同的几何键角和扭转,以及非常相似的键长,所以它们可以被取代到多肽中而不破坏多肽的三维结构。此外,因为预期的体内环境(例如血液)包含还原剂、例如谷胱甘肽、白蛋白和硫氧还蛋白,多肽中的二硫键可以被还原,导致该多肽展开,并且在多个二硫键的情况中,“争抢(scramble)”二硫键,以至于不正确的半胱氨酸彼此结合。这二者均导致多肽的预期生物活性的消失。二硒键较低的氧化还原电位使得它们在暴露于血清或血清的纯化还原组分时抗还原,赋予它们比含二硫键的对应物更长的血清半衰期。
虽然可以通过固相肽合成在体外产生具有二硒键的硒代半胱氨酸的肽,但是该过程无法容易达到治疗性应用(具体地用于蛋白质)所需的产量。然而,重组硒基-蛋白质的体内产生受限于蛋白中硒代半胱氨酸可能出现的严格序列要求。特别是,硒代半胱氨酸插入序列(SECIS)元件必须出现在硒代半胱氨酸掺入位点处的编码DNA序列中,以便募集内源性硒代半胱氨酸翻译机制,包括特异性延伸因子(SelB)。反而,大肠杆菌的重新编码的菌株(其具有未分配的密码子例如琥珀终止密码子)可以与具有抗-琥珀反密码子的工程化的硒代半胱氨酸tRNA一起使用,该工程化的硒代半胱氨酸tRNA通过将琥珀终止密码子引入相应的DNA编码序列中而允许硒代半胱氨酸靶向定位到多肽中。修饰的tRNA与内源性延伸因子EF-Tu相互作用。如本领域中已知的,其他密码子可以被重新编码,通常是稀有密码子。mRNA上的密码子和tRNA上的反密码子通常是互补碱基序列的三联体。
重新编码的蛋白质可以在细菌(例如大肠杆菌)细胞中或者在体外、在翻译或连接转录-翻译系统中进行合成。编码这种重新编码的蛋白质的基因或mRNA是非天然存在的,并且是天然存在的编码序列的变异体。虽然在相关联的序列表中示出的许多蛋白质具有参与硒代半胱氨酸残基取代二硫键的全部半胱氨酸残基,但是不需要取代全部半胱氨酸残基来获得取代的益处。即使一个二硒键也可以改进蛋白质的稳定性。任何数量的二硒键(硒代半胱氨酸对)都可以取代蛋白质中的二硫键。如果蛋白质具有N个二硫键,则该蛋白质可以具有从N、N减1、N减2、N减3、N减4....减少至1个的任何数量的这种键。在半胱氨酸和硒代半胱氨酸残基之间也可能形成被称为硒基硫化物(selenylsulfide)的键。此键具有的氧化还原电位(~-270mv)低于二硫键(-220mv)但不低于细菌胞质(-280mv)。该硒基硫化物键可以用于在某些氧化还原环境中增高抗还原性。利用本文中所述的方法,通过用硒代半胱氨酸取代单个二硫键键合的半胱氨酸,或通过用半胱氨酸取代单个二硒键键合的硒代半胱氨酸,硒基硫化物可以用于取代二硒化物。
利用所述方法,以mg/L规模,在标准实验室摇瓶中,具有取代的硒代半胱氨酸的二硫键-稳定化的生物制品的序列可以在大肠杆菌的细胞溶胶中生产,并且在微生物发酵器中放大至g/L生产。
具有二硒键和二硫键的不同组合的酶包括但不限于核酸酶(例如DNase和RNase)、聚合酶、连接酶、逆转录酶、蛋白酶、限制性内切核酸酶和固碳酶(例如碳捕获酶)。
本文中公开的酶中的任何半胱氨酸都可以保持为硒代半胱氨酸,只要该硒代半胱氨酸的存在不干扰多肽的表达、折叠或预期功能。本文中提供了一种方法,所述方法用于生产和验证参与各种酶的预期二硒键中的硒代半胱氨酸的存在,所述各种酶包括但不限于核酸酶(例如DNase和RNase)、聚合酶、连接酶、逆转录酶、蛋白酶、限制性内切核酸酶和固碳酶(例如碳捕获酶)。
根据本发明,稳定化的酶可以用两个硒代半胱氨酸残基之间的二硒键进行制备和使用。此技术和修饰可以用于生产即使在苛刻条件(例如还原环境中)也保持活性的酶。本文中提供了包含非标准氨基酸的稳定化的酶,其在苛刻条件(例如还原缓冲液或裂解缓冲液中)具有的酶活性高于在相同条件下没有所述非标准氨基酸的相应酶。所述稳定化的酶可以包括稳定化的DNase I多肽。本文中还提供了编码这些稳定化的酶的多核苷酸、用于表达和/或产生这些稳定化的酶的细胞,以及使用这些稳定化的酶的方法。
具有二硒键和二硫键的不同组合的酶包括但不限于核酸酶(例如DNase和RNase)、聚合酶、连接酶、逆转录酶、蛋白酶、限制性内切核酸酶和固碳酶(例如碳捕获酶)。
在一些实施方案中,根据本发明,核酸酶可以用两个硒代半胱氨酸残基之间的二硒键进行制备和使用。示例性核酸酶包括但不限于DNase(例如牛的DNase I)、RNase等。例如,DNase I具有两个二硫键。例如,RNase A具有4个二硫键。在一些实施方案中,RNase A酶包含2、4、6或8个硒代半胱氨酸残基。在一些实施方案中,RNase A酶包含至少1、2、3或4个二硒键。例如,RNase 3具有4个二硫键。在一些实施方案中,RNase 3酶包含至少2、4、6或8个硒代半胱氨酸残基。在一些实施方案中,RNase 3酶包含至少1、2、3或4个二硒键。例如,benzonase(例如粘质沙雷氏菌核酸酶)包含至少两个必需的二硫键,并且是30kDa同二聚体。在一些实施方案中,benzonase包含至少2或4个硒代半胱氨酸残基。在一些实施方案中,benzonase包含至少1或2个二硒键。
在一些实施方案中,核酸酶可以包含一种或多种非标准氨基酸。在一些实施方案中,核酸酶可以包含一个或多个硒代半胱氨酸残基。在一些实施方案中,核酸酶可以在两个硒代半胱氨酸残基之间包含二硒键。所述二硒键可以是分子内或分子间的。在一些实施方案中,核酸酶可以包含一个或多个二硒键。在一些实施方案中,包含一种或多种非标准氨基酸的核酸酶在苛刻条件(例如还原缓冲液或裂解缓冲液中)具有的酶活性高于在相同条件下没有所述非标准氨基酸的相应核酸酶。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的核酸酶可以切割多核苷酸底物的键,其活性比没有所述一种或多种非标准氨基酸的相应核酸酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的核酸酶可以在缓冲液中切割多核苷酸底物的键,其活性比在相同的缓冲液中、没有所述一种或多种非标准氨基酸的相应核酸酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的核酸酶可以在包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中切割多核苷酸底物的键,其活性比在相同的包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中、没有所述一种或多种非标准氨基酸的相应核酸酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的核酸酶可以在氧化还原电位小于约-150mV的缓冲液中切割多核苷酸底物的键,其活性比在相同氧化还原电位的缓冲液中、没有所述一种或多种非标准氨基酸的相应核酸酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的核酸酶可以在缓冲液中切割多核苷酸底物的键,所述缓冲液的氧化还原电位小于约-160mV、小于约-170mV、小于约-180mV、小于约-190mV、小于约-200mV、小于约-210mV、小于约-220mV、小于约-230mV、小于约-240mV或小于约-250mV、小于约-260mV、小于约-270mV、小于约-280mV、小于约-290mV、小于约-300mV、小于约-310mV、小于约-320mV、小于约-330mV、小于约-340mV或小于约-350mV、小于约-360mV、小于约-370mV、小于约-380mV、小于约-390mV、小于约-400mV、小于约-410mV、小于约-420mV、小于约-430mV、小于约-440mV或小于约-450mV、小于约-460mV、小于约-470mV、小于约-480mV、小于约-490mV、小于约-500mV、小于约-510mV、小于约-520mV、小于约-530mV、小于约-540mV或小于约-550mV、小于约-560mV、小于约-570mV、小于约-580mV、小于约-590mV或小于约-600mV,所述核酸酶的活性比在相同氧化还原电位的缓冲液中、没有所述一种或多种非标准氨基酸的相应核酸酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
在一些实施方案中,根据本发明,聚合酶可以用两个硒代半胱氨酸残基之间的二硒键进行制备和使用。在一些实施方案中,聚合酶可以包含一种或多种非标准氨基酸。在一些实施方案中,聚合酶可以包含一个或多个硒代半胱氨酸残基。在一些实施方案中,聚合酶可以包含两个硒代半胱氨酸残基之间的二硒键。所述二硒键可以是分子内或分子间的。在一些实施方案中,聚合酶可以包含一个或多个二硒键。在一些实施方案中,包含一种或多种非标准氨基酸的聚合酶在苛刻条件(例如还原缓冲液或裂解缓冲液中)具有的酶活性高于在相同条件下没有所述非标准氨基酸的相应聚合酶。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的聚合酶可以催化聚合酶反应,活性比没有所述一种或多种非标准氨基酸的相应聚合酶高至少1.1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的聚合酶可以在缓冲液中催化聚合酶反应,活性比在相同缓冲液中、没有所述一种或多种非标准氨基酸的相应聚合酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的聚合酶可以在包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中催化聚合酶反应,活性比在相同的包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中、没有所述一种或多种非标准氨基酸的相应聚合酶高至少1.1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的聚合酶可以在氧化还原电位小于约-150mV的缓冲液中催化聚合酶反应,活性比在相同氧化还原电位的缓冲液中、没有所述一种或多种非标准氨基酸的相应聚合酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的聚合酶可以在缓冲液中催化聚合酶反应,所述缓冲液的氧化还原电位小于约-160mV、小于约-170mV、小于约-180mV、小于约-190mV、小于约-200mV、小于约-210mV、小于约-220mV、小于约-230mV、小于约-240mV或小于约-250mV、小于约-260mV、小于约-270mV、小于约-280mV、小于约-290mV、小于约-300mV、小于约-310mV、小于约-320mV、小于约-330mV、小于约-340mV或小于约-350mV、小于约-360mV、小于约-370mV、小于约-380mV、小于约-390mV、小于约-400mV、小于约-410mV、小于约-420mV、小于约-430mV、小于约-440mV或小于约-450mV、小于约-460mV、小于约-470mV、小于约-480mV、小于约-490mV、小于约-500mV、小于约-510mV、小于约-520mV、小于约-530mV、小于约-540mV或小于约-550mV、小于约-560mV、小于约-570mV、小于约-580mV、小于约-590mV或小于约-600mV,所述聚合酶的活性比在相同氧化还原电位的缓冲液中、没有所述一种或多种非标准氨基酸的相应聚合酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
在一些实施方案中,根据本发明,连接酶可以用两个硒代半胱氨酸残基之间的二硒键进行制备和使用。在一些实施方案中,连接酶可以包含一种或多种非标准氨基酸。在一些实施方案中,连接酶可以包含一个或多个硒代半胱氨酸残基。在一些实施方案中,连接酶可以包含两个硒代半胱氨酸残基之间的二硒键。所述二硒键可以是分子内或分子间的。在一些实施方案中,连接酶可以包含一个或多个二硒键。在一些实施方案中,包含一种或多种非标准氨基酸的连接酶在苛刻条件(例如还原缓冲液或裂解缓冲液中)具有的酶活性高于在相同条件下、没有所述非标准氨基酸的相应连接酶。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的连接酶可以将两个或多个核酸连接在一起,活性比没有所述一种或多种非标准氨基酸的相应连接酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的连接酶可以在缓冲液中将两个或多个核酸连接在一起,活性比在相同缓冲液中、没有所述一种或多种非标准氨基酸的相应连接酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的连接酶可以在包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中将两个或多个核酸连接在一起,活性比在相同的包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中、没有所述一种或多种非标准氨基酸的相应连接酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的连接酶可以在氧化还原电位小于约-150mV的缓冲液中将两个或多个核酸连接在一起,活性比在相同氧化还原电位的缓冲液中、没有所述一种或多种非标准氨基酸的相应连接酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的连接酶可以在缓冲液中将两个或多个核酸连接在一起,所述缓冲液的氧化还原电位小于约-160mV、小于约-170mV、小于约-180mV、小于约-190mV、小于约-200mV、小于约-210mV、小于约-220mV、小于约-230mV、小于约-240mV或小于约-250mV、小于约-260mV、小于约-270mV、小于约-280mV、小于约-290mV、小于约-300mV、小于约-310mV、小于约-320mV、小于约-330mV、小于约-340mV或小于约-350mV、小于约-360mV、小于约-370mV、小于约-380mV、小于约-390mV、小于约-400mV、小于约-410mV、小于约-420mV、小于约-430mV、小于约-440mV或小于约-450mV、小于约-460mV、小于约-470mV、小于约-480mV、小于约-490mV、小于约-500mV、小于约-510mV、小于约-520mV、小于约-530mV、小于约-540mV或小于约-550mV、小于约-560mV、小于约-570mV、小于约-580mV、小于约-590mV或小于约-600mV,所述连接酶的活性比在相同氧化还原电位的缓冲液中、没有所述一种或多种非标准氨基酸的相应连接酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
在一些实施方案中,根据本发明,限制性内切核酸酶可以用两个硒代半胱氨酸残基之间的二硒键进行制备和使用。在一些实施方案中,限制性内切核酸酶可以包含一种或多种非标准氨基酸。在一些实施方案中,限制性内切核酸酶可以包含一个或多个硒代半胱氨酸残基。在一些实施方案中,限制性内切核酸酶可以包含两个硒代半胱氨酸残基之间的二硒键。所述二硒键可以是分子内或分子间的。在一些实施方案中,限制性内切核酸酶可以包含一个或多个二硒键。在一些实施方案中,包含一种或多种非标准氨基酸的限制性内切核酸酶在苛刻条件(例如还原缓冲液或裂解缓冲液中)具有的酶活性高于在相同条件下没有所述非标准氨基酸的相应限制性内切核酸酶。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的限制性内切核酸酶可以切割多核苷酸底物的一个或多个键,活性比没有所述一种或多种非标准氨基酸的相应限制性内切核酸酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的限制性内切核酸酶可以在缓冲液中切割多核苷酸底物的一个或多个键,活性比在相同缓冲液中、没有所述一种或多种非标准氨基酸的相应限制性内切核酸酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的限制性内切核酸酶可以在包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中切割多核苷酸底物的一个或多个键,活性比在相同的包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中、没有所述一种或多种非标准氨基酸的相应限制性内切核酸酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的限制性内切核酸酶可以在氧化还原电位小于约-150mV的缓冲液中切割多核苷酸底物的一个或多个键,活性比在相同氧化还原电位的缓冲液中、没有所述一种或多种非标准氨基酸的相应限制性内切核酸酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的限制性内切核酸酶可以在缓冲液中切割多核苷酸底物的一个或多个键,所述缓冲液的氧化还原电位小于约-160mV、小于约-170mV、小于约-180mV、小于约-190mV、小于约-200mV、小于约-210mV、小于约-220mV、小于约-230mV、小于约-240mV或小于约-250mV、小于约-260mV、小于约-270mV、小于约-280mV、小于约-290mV、小于约-300mV、小于约-310mV、小于约-320mV、小于约-330mV、小于约-340mV或小于约-350mV、小于约-360mV、小于约-370mV、小于约-380mV、小于约-390mV、小于约-400mV、小于约-410mV、小于约-420mV、小于约-430mV、小于约-440mV或小于约-450mV、小于约-460mV、小于约-470mV、小于约-480mV、小于约-490mV、小于约-500mV、小于约-510mV、小于约-520mV、小于约-530mV、小于约-540mV或小于约-550mV、小于约-560mV、小于约-570mV、小于约-580mV、小于约-590mV或小于约-600mV,所述限制性内切核酸酶的活性比在相同氧化还原电位的缓冲液中、没有所述一种或多种非标准氨基酸的相应限制性内切核酸酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
在一些实施方案中,根据本发明,逆转录酶可以用两个硒代半胱氨酸残基之间的二硒键进行制备和使用。在一些实施方案中,逆转录酶可以包含一种或多种非标准氨基酸。在一些实施方案中,逆转录酶可以包含一个或多个硒代半胱氨酸残基。在一些实施方案中,逆转录酶可以包含两个硒代半胱氨酸残基之间的二硒键。所述二硒键可以是分子内或分子间的。在一些实施方案中,逆转录酶可以包含一个或多个二硒键。在一些实施方案中,包含一种或多种非标准氨基酸的逆转录酶在苛刻条件(例如还原缓冲液或裂解缓冲液中)具有的酶活性高于在相同条件下没有所述非标准氨基酸的相应逆转录酶。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的逆转录酶可以从RNA合成cDNA,活性比没有所述一种或多种非标准氨基酸的相应逆转录酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的逆转录酶可以在缓冲液中从RNA合成cDNA,活性比在相同缓冲液中、没有所述一种或多种非标准氨基酸的相应逆转录酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的逆转录酶可以在包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中从RNA合成cDNA,活性比在相同的包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中、没有所述一种或多种非标准氨基酸的相应逆转录酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的逆转录酶可以在氧化还原电位小于约-150mV的缓冲液中从RNA合成cDNA,活性比在相同氧化还原电位的缓冲液中、没有所述一种或多种非标准氨基酸的相应逆转录酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的逆转录酶可以在缓冲液中从RNA合成cDNA,所述缓冲液的氧化还原电位小于约-160mV、小于约-170mV、小于约-180mV、小于约-190mV、小于约-200mV、小于约-210mV、小于约-220mV、小于约-230mV、小于约-240mV或小于约-250mV、小于约-260mV、小于约-270mV、小于约-280mV、小于约-290mV、小于约-300mV、小于约-310mV、小于约-320mV、小于约-330mV、小于约-340mV或小于约-350mV、小于约-360mV、小于约-370mV、小于约-380mV、小于约-390mV、小于约-400mV、小于约-410mV、小于约-420mV、小于约-430mV、小于约-440mV或小于约-450mV、小于约-460mV、小于约-470mV、小于约-480mV、小于约-490mV、小于约-500mV、小于约-510mV、小于约-520mV、小于约-530mV、小于约-540mV或小于约-550mV、小于约-560mV、小于约-570mV、小于约-580mV、小于约-590mV或小于约-600mV,所述逆转录酶的活性比在相同氧化还原电位的缓冲液中、没有所述一种或多种非标准氨基酸的相应逆转录酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
在一些实施方案中,根据本发明,蛋白酶可以用两个硒代半胱氨酸残基之间的二硒键进行制备和使用。在一些实施方案中,蛋白酶可以包含一种或多种非标准氨基酸。在一些实施方案中,蛋白酶可以包含一个或多个硒代半胱氨酸残基。在一些实施方案中,蛋白酶可以包含两个硒代半胱氨酸残基之间的二硒键。所述二硒键可以是分子内或分子间的。在一些实施方案中,蛋白酶可以包含一个或多个二硒键。在一些实施方案中,包含一种或多种非标准氨基酸的蛋白酶在苛刻条件(例如还原缓冲液或裂解缓冲液中)具有的酶活性高于在相同条件下没有所述非标准氨基酸的相应蛋白酶。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的蛋白酶可以切割多肽底物的键,活性比没有所述一种或多种非标准氨基酸的相应蛋白酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的蛋白酶可以在缓冲液中切割多肽底物的键,活性比在相同缓冲液中没有所述一种或多种非标准氨基酸的相应蛋白酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的蛋白酶可以在包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中切割多肽底物的键,活性比在相同的包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中、没有所述一种或多种非标准氨基酸的相应蛋白酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的蛋白酶可以在氧化还原电位小于约-150mV的缓冲液中切割多肽底物的键,活性比在相同氧化还原电位的缓冲液中、没有所述一种或多种非标准氨基酸的相应蛋白酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的蛋白酶可以在缓冲液中切割多肽底物的键,所述缓冲液的氧化还原电位小于约-160mV、小于约-170mV、小于约-180mV、小于约-190mV、小于约-200mV、小于约-210mV、小于约-220mV、小于约-230mV、小于约-240mV或小于约-250mV、小于约-260mV、小于约-270mV、小于约-280mV、小于约-290mV、小于约-300mV、小于约-310mV、小于约-320mV、小于约-330mV、小于约-340mV或小于约-350mV、小于约-360mV、小于约-370mV、小于约-380mV、小于约-390mV、小于约-400mV、小于约-410mV、小于约-420mV、小于约-430mV、小于约-440mV或小于约-450mV、小于约-460mV、小于约-470mV、小于约-480mV、小于约-490mV、小于约-500mV、小于约-510mV、小于约-520mV、小于约-530mV、小于约-540mV或小于约-550mV、小于约-560mV、小于约-570mV、小于约-580mV、小于约-590mV或小于约-600mV,所述蛋白酶的活性比在相同氧化还原电位的缓冲液中、没有所述一种或多种非标准氨基酸的相应蛋白酶高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
在一些实施方案中,根据本发明,包含一个或多个催化性半胱氨酸残基(即参与催化反应的半胱氨酸,例如活性位点半胱氨酸)的酶可以用一个或多个硒代半胱氨酸残基取代一个或多个这些催化性半胱氨酸残基进行制备和使用。一个或多个硒代半胱氨酸取代可以增加或改变反应环境中的酶活性。
在一些实施方案中,根据本发明,碳捕获酶(例如固碳酶)可以用两个硒代半胱氨酸残基之间的二硒键进行制备和使用。在一些实施方案中,碳捕获酶(例如固碳酶)可以包含一种或多种非标准氨基酸。在一些实施方案中,碳捕获酶(例如固碳酶)可以包含一个或多个硒代半胱氨酸残基。在一些实施方案中,碳捕获酶(例如固碳酶)可以包含两个硒代半胱氨酸残基之间的二硒键。所述二硒键可以是分子内或分子间的。在一些实施方案中,碳捕获酶(例如固碳酶)可以包含一个或多个二硒键。在一些实施方案中,包含一种或多种非标准氨基酸的碳捕获酶(例如固碳酶)在苛刻条件(例如还原缓冲液或裂解缓冲液中)具有的酶活性高于在相同条件下没有所述非标准氨基酸的相应碳捕获酶(例如固碳酶)。例如,在一些实施方案中,碳捕获酶(例如固碳酶)、例如脱水酶(例如β-碳酸酐酶)可以包含一个或多个催化性硒代半胱氨酸取代。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的碳捕获酶(例如固碳酶)可以捕获或固定碳,活性比没有所述一种或多种非标准氨基酸的相应碳捕获酶(例如固碳酶)高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。例如,本文中提供的包含一种或多种非标准活性位点氨基酸(例如一个或多个活性位点硒代半胱氨酸残基)的酶、例如碳捕获酶(例如固碳酶)可以捕获或固定碳,活性比没有所述一种或多种非标准活性位点氨基酸的相应酶、例如碳捕获酶(例如固碳酶)高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的碳捕获酶(例如固碳酶)可以在缓冲液或环境中捕获或固定碳,活性比在相同缓冲液或环境中、没有所述一种或多种非标准氨基酸的相应碳捕获酶(例如固碳酶)高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的碳捕获酶(例如固碳酶)可以在包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中或在还原环境中捕获或固定碳,活性比在相同的包含洗涤剂、还原剂和/或还原性酶(例如还原酶)的缓冲液中或在相同的还原环境中、没有所述一种或多种非标准氨基酸的相应碳捕获酶(例如固碳酶)高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的碳捕获酶(例如固碳酶)可以在氧化还原电位小于约-150mV的缓冲液或环境中捕获或固定碳,活性比在相同氧化还原电位的缓冲液或环境中、没有所述一种或多种非标准氨基酸的相应碳捕获酶(例如固碳酶)高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。例如,本文中提供的包含一种或多种非标准氨基酸(例如一个或多个硒代半胱氨酸残基)的碳捕获酶(例如固碳酶)可以在缓冲液或环境中捕获或固定碳,所述缓冲液或所述环境的氧化还原电位小于约-160mV、小于约-170mV、小于约-180mV、小于约-190mV、小于约-200mV、小于约-210mV、小于约-220mV、小于约-230mV、小于约-240mV或小于约-250mV、小于约-260mV、小于约-270mV、小于约-280mV、小于约-290mV、小于约-300mV、小于约-310mV、小于约-320mV、小于约-330mV、小于约-340mV或小于约-350mV、小于约-360mV、小于约-370mV、小于约-380mV、小于约-390mV、小于约-400mV、小于约-410mV、小于约-420mV、小于约-430mV、小于约-440mV或小于约-450mV、小于约-460mV、小于约-470mV、小于约-480mV、小于约-490mV、小于约-500mV、小于约-510mV、小于约-520mV、小于约-530mV、小于约-540mV或小于约-550mV、小于约-560mV、小于约-570mV、小于约-580mV、小于约-590mV或小于约-600mV,所述碳捕获酶(例如固碳酶)的活性比在相同氧化还原电位的缓冲液或环境中、没有所述一种或多种非标准氨基酸的相应碳捕获酶(例如固碳酶)高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍。
在一些方面中,本文中提供一种包含稳定化的脱氧核糖核酸酶I(DNase I)多肽、其功能片段或其变异体的组合物,所述稳定化的脱氧核糖核酸酶I(DNase I)多肽包含一种或多种非标准氨基酸。在一些实施方案中,根据本发明,所述稳定化的DNase I多肽可以用两个硒代半胱氨酸残基之间的二硒键进行制备和使用。在一些实施方案中,所述稳定化的DNase I多肽可以包含一种或多种非标准氨基酸。在一些实施方案中,所述稳定化的DNaseI多肽可以包含一个或多个硒代半胱氨酸残基。在一些实施方案中,所述稳定化的DNase I多肽可以包含两个硒代半胱氨酸残基之间的二硒键。所述二硒键可以是分子内或分子间的。在一些实施方案中,所述稳定化的DNase I多肽可以包含一个或多个二硒键。在一些实施方案中,所述稳定化的DNase I多肽可以包含一个或多个催化性硒代半胱氨酸取代。
在一些方面中,本文中提供一种包含稳定化的脱氧核糖核酸酶I(DNase I)多肽、其功能片段或其变异体的组合物,所述稳定化的脱氧核糖核酸酶I(DNase I)多肽包含一种或多种非标准氨基酸,其中所述稳定化的DNase I多肽在环境中对DNA底物的内切核酸酶活性高于不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体对所述DNA底物的内切核酸酶活性。例如,所述稳定化的DNase I多肽在环境中对DNA底物的内切核酸酶活性可以比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体对所述DNA底物的内切核酸酶活性高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000或更多倍。
在一些方面中,本文中提供一种包含稳定化的脱氧核糖核酸酶I(DNase I)多肽、其功能片段或其变异体的组合物,所述稳定化的脱氧核糖核酸酶I(DNase I)多肽包含一种或多种非标准氨基酸,其中在不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体不稳定化的环境中,所述稳定化的DNase I多肽没有不稳定化。所述不稳定化可以通过使相应DNase I多肽与一种或多种不稳定化剂接触而实现。所述不稳定化可以通过使相应DNase I多肽处于不稳定化环境中而实现。使相应DNase I多肽不稳定化的环境在本文中其他部分中描述。
在一些方面中,本文中提供一种包含稳定化的脱氧核糖核酸酶I(DNase I)多肽、其功能片段或其变异体的组合物,所述稳定化的脱氧核糖核酸酶I(DNase I)多肽包含一种或多种非标准氨基酸,其中所述稳定化的DNase I多肽具有的解链温度(Tm)比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体的T
在一些实施方案中,所述组合物可以包含稳定化的脱氧核糖核酸酶I(DNase I)多肽、其功能片段或其变异体,所述稳定化的DNase I多肽包含一种或多种非标准氨基酸,其中所述稳定化的DNase I多肽的解链温度(T
在一些实施方案中,所述一种或多种非标准氨基酸中的至少一个、两个、三个、四个或更多个是硒代半胱氨酸。在一些实施方案中,所述一种或多种非标准氨基酸中的至少两个由键直接连接。
在一些实施方案中,所述一种或多种非标准氨基酸中的至少四个可以由键直接连接,其中所述一种或多种非标准氨基酸中的所述至少四个中的第一对可以由键直接连接,并且所述一种或多种非标准氨基酸中的所述至少四个中的第二对可以由键直接连接。在一些实施方案中,所述键是二硒键。在一些实施方案中,所述二硒键可以是分子间键或分子内键。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的半衰期可以比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体的半衰期的高至少1.1倍。在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的半衰期可以比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体的半衰期高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000或更多倍。在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的半衰期可以比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体的半衰期的高小于1.1倍。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体与SEQ IDNO:1可以具有至少70%、75%、80%、85%、90%、95%的序列一致性。在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体与SEQ ID NO:1可以具有至少10%、20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%或更高的序列一致性。在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体与SEQ ID NO:1可以具有小于10%的序列一致性。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体可以包括序列,所述序列与SEQ ID NO:1的至少25、50、75、100、125、150、175、200、225、250或261个连续氨基酸(contiguous amino acid)具有至少70%、75%、80%、85%、90%、95%的序列一致性。在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体可以包括序列,所述序列与SEQ ID NO:1的至少25、50、75、100、125、150、175、200、225、250或261个连续氨基酸具有至少10%、20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%或更高的序列一致性。在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体可以包括序列,所述序列与SEQ ID NO:1的至少25、50、75、100、125、150、175、200、225、250或261个连续氨基酸具有小于10%的序列一致性。
在一些实施方案中,所述DNase I包含氨基酸序列,所述氨基酸序列与ALKIAAFNIRTFGETKMSNATLASYIVRIVRRYDIVLIQEVRDSHLVAVGKLLDYLNQDDPNTYHYVVSEPLGRNSYKERYLFLFRPNKVSVLDTYQYDDGUESUGNDSFSREPAVVKFSSHSTKVKEFAIVALHSAPSDAVAEINSLYDVYLDVQQKWHLNDVMLMGDFNADUSYVTSSQWSSIRLRTSSTFQWLIPDSADTTATSTNUAYDRIVVAGSLLQSSVVPGSAAPFDFQAAYGLSNEMALAISDHYPVEVTLT(SEQ ID NO:1)的至少50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、260或261个连续氨基酸具有至少60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列一致性,其中U是非标准氨基酸、例如硒代半胱氨酸。
在一些实施方案中,所述DNase I包含氨基酸序列,所述氨基酸序列与ALKIAAFNIRTFGETKMSNATLASYIVRIVRRYDIVLIQEVRDSHLVAVGKLLDYLNQDDPNTYHYVVSEPLGRNSYKERYLFLFRPNKVSVLDTYQYDDGUESUGNDSFSREPAVVKFSSHSTKVKEFAIVALHSAPSDAVAEINSLYDVYLDVQQKWHLNDVMLMGDFNADUSYVTSSQWSSIRLRTSSTFQWLIPDSADTTATSTNUAYDRIVVAGSLLQSSVVPGSAAPFDFQAAYGLSNEMALAISDHYPVEVTLT(SEQ ID NO:1)具有至少60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列一致性,其中U是非标准氨基酸、例如硒代半胱氨酸。
在一些实施方案中,所述DNase I包含氨基酸序列,所述氨基酸序列与RGTRLMGLLLALAGLLQLGLSLKIAAFNIRTFGETKMSNATLASYIVRIVRRYDIVLIQEVRDSHLVAVGKLLDYLNQDDPNTYHYVVSEPLGRNSYKERYLFLFRPNKVSVLDTYQYDDGCESCGNDSFSREPAVVKFSSHSTKVKEFAIVALHSAPSDAVAEINSLYDVYLDVQQKWHLNDVMLMGDFNADCSYVTSSQWSSIRLRTSSTFQWLIPDSADTTATSTNCAYDRIVVAGSLLQSSVVPGSAAPFDFQAAYGLSNEMALAISDHYPVEVTLT(SEQ ID NO:2)具有至少60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列一致性,其中U是非标准氨基酸、例如硒代半胱氨酸。
在一些实施方案中,所述DNase I包含氨基酸序列,所述氨基酸序列与RGTRLMGLLLALAGLLQLGLSLKIAAFNIRTFGETKMSNATLASYIVRIVRRYDIVLIQEVRDSHLVAVGKLLDYLNQDDPNTYHYVVSEPLGRNSYKERYLFLFRPNKVSVLDTYQYDDGCESCGNDSFSREPAVVKFSSHSTKVKEFAIVALHSAPSDAVAEINSLYDVYLDVQQKWHLNDVMLMGDFNADCSYVTSSQWSSIRLRTSSTFQWLIPDSADTTATSTNCAYDRIVVAGSLLQSSVVPGSAAPFDFQAAYGLSNEMALAISDHYPVEVTLT(SEQ ID NO:2)的至少50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275、276、277、278、279、280或281个连续氨基酸具有至少60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列一致性,其中U是非标准氨基酸、例如硒代半胱氨酸。
在一些实施方案中,所述DNase I进一步包含至少一个亲和标签。在一些实施方案中,DNase I的亲和标签是C-末端亲和标签。在一些实施方案中,DNase I的亲和标签是N-末端亲和标签。在一些实施方案中,DNase I的第一亲和标签是N-末端亲和标签,并且DNase I的第二亲和标签是C-末端亲和标签。在一些实施方案中,DNase I的第一亲和标签是第一N-末端亲和标签,并且DNase I的第二亲和标签是第二N-末端亲和标签。在一些实施方案中,DNase I的第一亲和标签是第一C-末端亲和标签并且DNase I的第二亲和标签是第二C-末端亲和标签。
例如,所述DNase I可以包含多聚-组氨酸标签、多聚-组氨酸-甘氨酸标签、多聚-精氨酸标签、多聚-天冬氨酸标签、多聚-半胱氨酸标签、多聚-苯丙氨酸、c-myc标签、单纯疱疹病毒糖蛋白D(gD)标签、FLAG标签、KT3表位标签、微管蛋白表位标签、T7基因10蛋白肽标签、链霉亲和素标签、链霉亲和素结合蛋白(SPB)标签、Strep-标签、Strep-标签II、白蛋白结合蛋白(ABP)标签、碱性磷酸酶(AP)标签、蓝舌病病毒标签(bluetongue virus tag,B-标签)、钙调蛋白结合肽(CBP)标签、氯霉素乙酰转移酶(CAT)标签、胆碱-结合域(CBD)标签、几丁质结合域(CBD)标签、纤维素结合域(CBP)标签、二氢叶酸还原酶(DHFR)标签、半乳糖-结合蛋白(GBP)标签、麦芽糖结合蛋白(MBP)、谷胱甘肽-S-转移酶(GST)、Glu-Glu(EE)标签、人流感血凝素(HA)标签、辣根过氧化物酶(HRP)标签、NE-标签、HSV标签、甾酮异构酶(ketosteroid isomerase,KSI)标签、KT3标签、LacZ标签、萤光素酶标签、NusA标签、PDZ域标签、AviTag、钙调蛋白-标签、E-标签、S-标签、SBP-标签、Softag 1、Softag 3、TC标签、VSV-标签、Xpress标签、Isopeptag、SpyTag、SnoopTag、Profinity eXact标签、蛋白C标签、S1-标签、S-标签、生物素羧基载体蛋白(BCCP)标签、绿色荧光蛋白(GFP)标签、小泛素样修饰剂(SUMO)标签、串联亲和纯化(TAP)标签、HaloTag、Nus-标签、硫氧还蛋白-标签、Fc-标签、CYD标签、HPC标签、TrpE标签、泛素标签、VSV-G表位标签、V5标签,或其组合。
在一些实施方案中,所述DNase I进一步包含至少两个亲和标签。例如,所述DNaseI可以包含至少两个亲和标签,所述亲和标签选自:多聚-组氨酸标签、多聚-组氨酸-甘氨酸标签、多聚-精氨酸标签、多聚-天冬氨酸标签、多聚-半胱氨酸标签、多聚-苯丙氨酸、c-myc标签、单纯疱疹病毒糖蛋白D(gD)标签、FLAG标签、KT3表位标签、微管蛋白表位标签、T7基因10蛋白肽标签、链霉亲和素标签、链霉亲和素结合肽(SPB)标签、Strep-标签、Strep-标签II、白蛋白-结合蛋白(ABP)标签、碱性磷酸酶(AP)标签、蓝舌病病毒标签(B-标签)、钙调蛋白结合肽(CBP)标签、氯霉素乙酰转移酶(CAT)标签、胆碱-结合域(CBD)标签、几丁质结合域(CBD)标签、纤维素结合域(CBP)标签、二氢叶酸还原酶(DHFR)标签、半乳糖-结合蛋白(GBP)标签、麦芽糖结合蛋白(MBP)、谷胱甘肽-S-转移酶(GST)、Glu-Glu(EE)标签、人流感血凝素(HA)标签、辣根过氧化物酶(HRP)标签、NE-标签、HSV标签、甾酮异构酶(KSI)标签、KT3标签、LacZ标签、萤光素酶标签、NusA标签、PDZ结构域标签、AviTag、钙调蛋白-标签、E-标签、S-标签、SBP-标签、Softag 1、Softag 3、TC标签、VSV-标签、Xpress标签、Isopeptag、SpyTag、SnoopTag、Profinity eXact标签、蛋白C标签、S1-标签、S-标签、生物素羧基载体蛋白(BCCP)标签、绿色荧光蛋白(GFP)标签、小泛素样修饰剂(SUMO)标签、串联亲和纯化(TAP)标签、HaloTag、Nus-标签、硫氧还蛋白-标签、Fc-标签、CYD标签、HPC标签、TrpE标签、泛素标签、VSV-G表位标签和V5标签。
在一些实施方案中,所述DNase I包含亲和标签,所述亲和标签是GST。在一些实施方案中,所述DNase I包含亲和标签,所述亲和标签是多聚-组氨酸标签,例如6x-His标签。在一些实施方案中,所述DNase I包含亲和标签,所述亲和标签是MBP。在一些实施方案中,所述DNase I包含亲和标签,所述亲和标签是strep-标签,例如两个strep标签。
在一些实施方案中,所述DNase I包含第一亲和标签和第二亲和标签,所述第一亲和标签是GST,所述第二亲和标签是多聚-组氨酸标签,例如6x-His标签。在一些实施方案中,所述DNase I包含第一亲和标签和第二亲和标签,所述第一亲和标签是GST,所述第二亲和标签是链霉素(strep)标签。在一些实施方案中,所述DNase I包含第一亲和标签和第二亲和标签,所述第一亲和标签是strep标签,例如两个strep标签,所述第二亲和标签是多聚-组氨酸标签,例如6x-His标签。在一些实施方案中,所述DNase I包含第一亲和标签和第二亲和标签,所述第一亲和标签是MBP,所述第二亲和标签是多聚-组氨酸标签,例如6x-His标签。在一些实施方案中,所述DNase I包含第一亲和标签和第二亲和标签,所述第一亲和标签是MBP,所述第二亲和标签是strep标签,例如两个strep标签。
在一些实施方案中,所述DNase I包含第一亲和标签、第二亲和标签和第三亲和标签,所述第一亲和标签是GST,所述第二亲和标签是多聚-组氨酸标签,例如6x-His标签,所述第三亲和标签是strep标签,例如两个strep标签。在一些实施方案中,所述DNase I包含GST标签、His标签和两个strep标签。在一些实施方案中,所述DNase I包含第一亲和标签、第二亲和标签和第三亲和标签,所述第一亲和标签是MBP,所述第二亲和标签是多聚-组氨酸标签,例如6x-His标签,所述第三亲和标签是strep标签,例如两个strep标签。在一些实施方案中,所述DNase I包含MBP标签、His标签和两个strep标签。
在一些实施方案中,所述DNase I包含氨基酸序列,所述氨基酸序列与MSPILGYWKIKGLVQPTRLLLEYLEEKYEEHLYERDEGDKWRNKKFELGLEFPNLPYYIDGDVKLTQSMAIIRYIADKHNMLGGCPKERAEISMLEGAVLDIRYGVSRIAYSKDFETLKVDFLSKLPEMLKMFEDRLCHKTYLNGDHVTHPDFMLYDALDVVLYMDPMCLDAFPKLVCFKKRIEAIPQIDKYLKSSKYIAWPLQGWQATFGGGDHPPKSDGGSGSAALKIAAFNIRTFGETKMSNATLASYIVRIVRRYDIVLIQEVRDSHLVAVGKLLDYLNQDDPNTYHYVVSEPLGRNSYKERYLFLFRPNKVSVLDTYQYDDGUESUGNDSFSREPAVVKFSSHSTKVKEFAIVALHSAPSDAVAEINSLYDVYLDVQQKWHLNDVMLMGDFNADUSYVTSSQWSSIRLRTSSTFQWLIPDSADTTATSTNUAYDRIVVAGSLLQSSVVPGSAAPFDFQAAYGLSNEMALAISDHYPVEVTLT(SEQ ID NO:3)具有至少60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列一致性。
在一些实施方案中,所述DNase I包含氨基酸序列,所述氨基酸序列与ALKIAAFNIRTFGETKMSNATLASYIVRIVRRYDIVLIQEVRDSHLVAVGKLLDYLNQDDPNTYHYVVSEPLGRNSYKERYLFLFRPNKVSVLDTYQYDDGUESUGNDSFSREPAVVKFSSHSTKVKEFAIVALHSAPSDAVAEINSLYDVYLDVQQKWHLNDVMLMGDFNADUSYVTSSQWSSIRLRTSSTFQWLIPDSADTTATSTNUAYDRIVVAGSLLQSSVVPGSAAPFDFQAAYGLSNEMALAISDHYPVEVTLTGSHHHHHHGSGGGSGGSAWSHPQFEKGGGSGGGSGGSAWSHPQFEK(SEQ IDNO:4)具有至少60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列一致性。
在一些实施方案中,所述DNase I包含氨基酸序列,所述氨基酸序列与MSPILGYWKIKGLVQPTRLLLEYLEEKYEEHLYERDEGDKWRNKKFELGLEFPNLPYYIDGDVKLTQSMAIIRYIADKHNMLGGCPKERAEISMLEGAVLDIRYGVSRIAYSKDFETLKVDFLSKLPEMLKMFEDRLCHKTYLNGDHVTHPDFMLYDALDVVLYMDPMCLDAFPKLVCFKKRIEAIPQIDKYLKSSKYIAWPLQGWQATFGGGDHPPKSDGGSGSAALKIAAFNIRTFGETKMSNATLASYIVRIVRRYDIVLIQEVRDSHLVAVGKLLDYLNQDDPNTYHYVVSEPLGRNSYKERYLFLFRPNKVSVLDTYQYDDGUESUGNDSFSREPAVVKFSSHSTKVKEFAIVALHSAPSDAVAEINSLYDVYLDVQQKWHLNDVMLMGDFNADUSYVTSSQWSSIRLRTSSTFQWLIPDSADTTATSTNUAYDRIVVAGSLLQSSVVPGSAAPFDFQAAYGLSNEMALAISDHYPVEVTLTGSHHHHHHGSGGGSGGSAWSHPQFEKGGGSGGGSGGSAWSHPQFEK(SEQ IDNO:5)具有至少60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列一致性。
在一些实施方案中,所述DNase I包含亲和标签,所述亲和标签包含氨基酸序列,所述氨基酸序列与MSPILGYWKIKGLVQPTRLLLEYLEEKYEEHLYERDEGDKWRNKKFELGLEFPNLPYYIDGDVKLTQSMAIIRYIADKHNMLGGCPKERAEISMLEGAVLDIRYGVSRIAYSKDFETLKVDFLSKLPEMLKMFEDRLCHKTYLNGDHVTHPDFMLYDALDVVLYMDPMCLDAFPKLVCFKKRIEAIPQIDKYLKSSKYIAWPLQGWQATFGGGDHPPKSD(SEQ ID NO:6)具有至少60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列一致性。
在一些实施方案中,所述DNase I包含亲和标签,所述亲和标签包含氨基酸序列,所述氨基酸序列与GSHHHHHHGSGGGSGGSAWSHPQFEKGGGSGGGSGGSAWSHPQFE K(SEQ ID NO:7)具有至少60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列一致性。
在一些实施方案中,所述DNase I包含亲和标签,所述亲和标签包含氨基酸序列HHHHHH(SEQ ID NO:8)。在一些实施方案中,所述DNase I包含亲和标签,所述亲和标签包含氨基酸序列AWSHPQFEK(SEQ ID NO 9)。
在一些实施方案中,所述DNase I包含亲和标签,其中所述DNase和所述亲和标签由接头分隔开。在一些实施方案中,所述DNase I包含第一亲和标签和第二亲和标签,其中所述DNase和所述第一亲和标签由接头分隔开,并且所述DNase和所述第二亲和标签由接头分隔开。在一些实施方案中,所述DNase I包含第一亲和标签和第二亲和标签,其中所述第一亲和标签和所述第二亲和标签由接头分隔开。在一些实施方案中,所述DNase I包含第一亲和标签、第二亲和标签和第三亲和标签,其中所述第一亲和标签、所述第二亲和标签和所述第三亲和标签各自由接头分隔开。在一些实施方案中,所述DNase I包含第一亲和标签、第二亲和标签、第三亲和标签和第四亲和标签,其中所述第一亲和标签、所述第二亲和标签、所述第三亲和标签和所述第四亲和标签各自由接头分隔开。在一些实施方案中,接头包含(GS)n、(GGS)n或(GGGS)n或其组合的氨基酸序列,其中n是1-10的整数。在一些实施方案中,接头包含GSGGGSGGS(SEQ ID NO:10)的氨基酸序列。在一些实施方案中,接头包含GGGSGGGSGGS(SEQ ID NO:11)的氨基酸序列。在一些实施方案中,接头包含GS(SEQ ID NO:12)的氨基酸序列。在一些实施方案中,接头包含GGSGSA(SEQ ID NO 13)的氨基酸序列。在一些实施方案中,接头包含GGSGSAA(SEQ ID NO 14)的氨基酸序列。
在一些实施方案中,所述一种或多种非标准氨基酸可以位于SEQ ID NO:1的102位、SEQ ID NO:1的105位、SEQ ID NO:1的174位,或SEQ ID NO:1的210位。在一些实施方案中,所述一种或多种非标准氨基酸可以位于SEQ ID NO:1的102位、SEQ ID NO:1的105位、SEQ ID NO:1的174位,和SEQ ID NO:1的210位。在一些实施方案中,所述一种或多种非标准氨基酸可以位于SEQ ID NO:1的102位和SEQ ID NO:1的105位。在一些实施方案中,所述一种或多种非标准氨基酸可以位于SEQ ID NO:1的102位和SEQ ID NO:1的174位。在一些实施方案中,所述一种或多种非标准氨基酸可以位于SEQ ID NO:1的102位和SEQ ID NO:1的210位。在一些实施方案中,所述一种或多种非标准氨基酸可以位于SEQ ID NO:1的105位和SEQID NO:1的174位。在一些实施方案中,所述一种或多种非标准氨基酸可以位于SEQ ID NO:1的105位和SEQ ID NO:1的210位。在一些实施方案中,所述一种或多种非标准氨基酸可以位于SEQ ID NO:1的174位和SEQ ID NO:1的210位。在一些实施方案中,所述一种或多种非标准氨基酸可以位于SEQ ID NO:1的102位、SEQ ID NO:1的105位和SEQ ID NO:1的174位。在一些实施方案中,所述一种或多种非标准氨基酸可以位于SEQ ID NO:1的102位、SEQ IDNO:1的174位和SEQ ID NO:1的210位。在一些实施方案中,所述一种或多种非标准氨基酸可以位于SEQ ID NO:1的102位、SEQ ID NO:1的105位和SEQ ID NO:1的210位。在一些实施方案中,所述一种或多种非标准氨基酸可以位于SEQ ID NO:1的105位、SEQ ID NO:1的174位和SEQ ID NO:1的210位。
在一些实施方案中,102位处的非标准氨基酸可以由键直接连接到105位处的非标准氨基酸。在一些实施方案中,174位处的非标准氨基酸可以由键直接连接到210位处的非标准氨基酸。在一些实施方案中,102位处的非标准氨基酸可以由键直接连接到174位处的非标准氨基酸。在一些实施方案中,102位处的非标准氨基酸可以由键直接连接到210位处的非标准氨基酸。在一些实施方案中,105位处的非标准氨基酸可以由键直接连接到174位处的非标准氨基酸。在一些实施方案中,105位处的非标准氨基酸可以由键直接连接到210位处的非标准氨基酸。
在一些实施方案中,所述键可以是二硒键。在一些实施方案中,所述二硒键可以处于没有所述一种或多种非标准氨基酸的相应重组酶中的二硫键的位置。
在一些实施方案中,所述相应稳定化的DNase I多肽、其功能片段或其变异体的Tm可以小于37℃。在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的Tm可以大于37℃、40℃、45℃、50℃、55℃、60℃或65℃。在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的Tm可以至少是37℃、40℃、45℃、50℃、55℃、60℃、65℃或更大。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的Tm可以比所述相应重组酶、其功能片段或其变异体的Tm高至少10℃。在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的Tm可以比所述相应重组酶、其功能片段或其变异体的Tm高至少15℃。在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的Tm可以比所述相应重组酶、其功能片段或其变异体的Tm高至少15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃或更大。在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体的Tm可以比所述相应重组酶、其功能片段或其变异体的Tm高小于10℃。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体在环境中的半衰期可以比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体在所述环境中的半衰期大至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍或更多。
在一些实施方案中,所述DNase I多肽、其功能片段或其变异体在所述环境中的半衰期可以大于1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24小时或更长。在一些实施方案中,所述DNase I多肽、其功能片段或其变异体在所述环境中的半衰期可以小于1小时。
在一些实施方案中,所述DNase I多肽、其功能片段或其变异体在所述环境中的半衰期可以大于1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24天或更长。在一些实施方案中,所述DNase I多肽、其功能片段或其变异体在所述环境中的半衰期可以小于1天。
在一些实施方案中,所述稳定化的DNase I多肽在环境中对DNA底物的内切核酸酶活性可以比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体对所述DNA底物的内切核酸酶活性高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、10、20、30、40、50、60、70、80、90或100倍。在一些实施方案中,所述稳定化的DNase I多肽在环境中对DNA底物的内切核酸酶活性可以比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体对所述DNA底物的内切核酸酶活性高小于1.1倍。
在一些实施方案中,所述稳定化的DNase I多肽在存在于环境中至少1、2、3、4、5、6、7、8、9、10、15、20、25、30、40或50分钟之后、对DNA底物的内切核酸酶活性可以比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体在存在于所述环境中至少1、2、3、4、5、6、7、8、9、10、15、20、25、30、40或50分钟之后、对所述DNA底物的内切核酸酶活性高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、10、20、30、40、50、60、70、80、90或100倍。在一些实施方案中,所述稳定化的DNase I多肽在存在于环境中至少1、2、3、4、5、6、7、8、9、10、15、20、25、30、40或50分钟之后、对DNA底物的内切核酸酶活性可以比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体在存在于所述环境中至少1、2、3、4、5、6、7、8、9、10、15、20、25、30、40或50分钟之后、对所述DNA底物的内切核酸酶活性高小于1.1倍。
在一些实施方案中,所述稳定化的DNase I多肽在存在于环境中至少1、2、3、4、5、6、7、8、9、10、12、18或24小时之后、对DNA底物的内切核酸酶活性可以比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体在存在于所述环境中至少1、2、3、4、5、6、7、8、9、10、12、18或24小时之后、对所述DNA底物的内切核酸酶活性高至少1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、10、20、30、40、50、60、70、80、90或100倍。在一些实施方案中,所述稳定化的DNase I多肽在存在于环境中至少1、2、3、4、5、6、7、8、9、10、12、18或24小时之后、对DNA底物的内切核酸酶活性可以比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体在存在于所述环境中至少1、2、3、4、5、6、7、8、9、10、12、18或24小时之后、对所述DNA底物的内切核酸酶活性高小于1.1倍。
在一些实施方案中,所述DNA底物可以是基因组DNA。在一些实施方案中,所述DNA底物可以是单链DNA、双链DNA、环形DNA或无细胞DNA。
在一些实施方案中,所述环境可以是温度为4℃-98℃的环境。在一些实施方案中,所述环境可以是温度为5℃-97℃、6℃-96℃、7℃-95℃、8℃-94℃、9℃-93℃、10℃-92℃、11℃-91℃、12℃-90℃、13℃-89℃、14℃-88℃、15℃-85℃、20℃-75℃、25℃-70℃、30℃-65℃、35℃-60℃、40℃-55℃或45℃-50℃的环境。在一些实施方案中,所述环境可以是温度为至少4℃、5℃、6℃、7℃、8℃、9℃、10℃、11℃、12℃、13℃、14℃、15℃、16℃、17℃、18℃、19℃、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃或更高的环境。在一些实施方案中,所述环境可以是温度小于4℃的环境。
在一些实施方案中,所述环境可以是含有裂解缓冲液的环境。在一些实施方案中,所述裂解缓冲液可以是NP-40裂解缓冲液、RIPA(放射免疫沉淀分析)裂解缓冲液、SDS(十二烷基硫酸钠)裂解缓冲液或ACK(铵-氯化物-钾)裂解缓冲液。
在一些实施方案中,所述环境可以是含有浓度为0.01%至20%的洗涤剂的环境。在一些实施方案中,所述环境可以是含有浓度为0.01%至20%、0.05%至19.5%、0.1%至19%、0.2%至18.5%、0.3%至18%、0.4%至17.5%、0.5%至17%、0.6%至16.5%、0.7%至16%、0.8%至15%、0.8%至14%、0.9%至13%或1%至12%的洗涤剂的环境。在一些实施方案中,所述环境可以是含有浓度小于0.01%的洗涤剂的环境。在一些实施方案中,所述环境可以是含有浓度大于20%的洗涤剂的环境。
在一些实施方案中,所述洗涤剂可以是非离子型洗涤剂。所述非离子型洗涤剂可以包括Triton X-100、Triton X-114、NP-40、Brij-35、Brij-58、吐温(Tween)20、吐温80、辛基葡萄糖苷和辛基硫代葡萄糖苷。在一些实施方案中,所述洗涤剂可以是离子型洗涤剂。所述离子型洗涤剂可以包含十二烷基硫酸钠(SDS)。在一些实施方案中,所述洗涤剂可以是阳离子型洗涤剂。所述阳离子型洗涤剂可以是乙基三甲基溴化铵。在一些实施方案中,所述洗涤剂可以是两性离子型洗涤剂。所述两性离子型洗涤剂可以是CHAPS(3-[(3-胆酰胺基丙基)二甲基铵基]-1-丙烷磺酸盐)。
在一些实施方案中,所述环境可以包含浓度为0.01mM至100mM的二价阳离子。在一些实施方案中,所述环境可以包含浓度为0.01mM至100mM、0.05mM至95mM、0.1mM至90mM、0.5mM至85mM、1mM至80mM、5mM至75mM、10mM至70mM、15mM至65mM、20mM至60mM、25mM至55mM、30mM至50mM或35mM至45mM的二价阳离子。在一些实施方案中,所述环境可以包含浓度小于0.01mM的二价阳离子。在一些实施方案中,所述环境可以包含浓度大于100mM的二价阳离子。在一些实施方案中,所述二价阳离子选自由包含Mg
在一些实施方案中,所述环境可以包含浓度为0.01mM至100mM的还原剂。所述还原剂可以是谷胱甘肽、白蛋白或硫氧还蛋白。在一些实施方案中,所述环境可以包含浓度为0.01mM至100mM、0.05mM至95mM、0.1mM至90mM、0.5mM至85mM、1mM至80mM、5mM至75mM、10mM至70mM、15mM至65mM、20mM至60mM、25mM至55mM、30mM至50mM或35mM至45mM的还原剂。在一些实施方案中,所述环境可以包含浓度小于0.01mM的还原剂。在一些实施方案中,所述环境可以包含浓度大于100mM浓度的还原剂。
在一些实施方案中,所述环境可以具有5-9的pH。在一些实施方案中,所述环境可以具有6-8的pH。在一些实施方案中,所述环境可以具有7-8的pH。在一些实施方案中,所述环境可以具有小于5的pH。在一些实施方案中,所述环境可以具有大于9的pH。
在一些实施方案中,所述环境可以具有10mM至1M的盐浓度。在一些实施方案中,所述环境可以具有15mM至950mM、20mM至900mM、30mM至850mM、40mM至800mM、50mM至750mM、60mM至700mM、70mM至650mM、80mM至600mM、90mM至550mM、100mM至500mM、150mM至450mM或200mM至400mM的盐浓度。在一些实施方案中,所述环境可以具有小于10mM的盐浓度。在一些实施方案中,所述环境可以具有大于1M的盐浓度。
在一些实施方案中,所述环境可以是在液滴内。在一些实施方案中,所述环境可以是血液循环系统。在一些实施方案中,所述环境可以是所述稳定化的DNase I多肽、其功能片段或其变异体可以具有酶活性的任何环境。
在一些实施方案中,所述环境可以具有还原电位,所述还原电位小于-150mV、-160mV、-170mV、-180mV、-190mV、-200mV、-210mV、-220mV、-230mV、-240mV或-250mV、-260mV、-270mV、-280mV、-290mV、-300mV、-310mV、-320mV、-330mV、-340mV或-350mV、-360mV、-370mV、-380mV、-390mV、-400mV、-410mV、-420mV、-430mV、-440mV或-450mV、-460mV、-470mV、-480mV、-490mV、-500mV、-510mV、-520mV、-530mV、-540mV或-550mV、-560mV、-570mV、-580mV、-590mV或-600mV。在一些实施方案中,所述环境可以具有大于-150mV的还原电位。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体可以是重组体。在一些实施方案中,所述重组体可以利用重组DNA技术来产生,例如由噬菌体或酵母表达系统表达的稳定化的DNase I多肽、其功能片段或其变异体。在其他实施方案中,所述重组体可以通过合成编码所述稳定化的DNase I多肽、其功能片段或其变异体的DNA分子而产生。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体可以是牛的DNase I。所述稳定化的DNase I多肽、其功能片段或其变异体可以是任何其他种类的DNases I,包括但不限于大肠杆菌DNase I、嗜碱微胞菌(Microcella alkaliphila)DNaseI、低温乳杆菌(Lactobacillus algidus)DNase I、霍乱弧菌DNase I、长双歧杆菌DNase I、智人DNase I和解鸟氨酸拉乌尔菌(Raoultella ornithinolytica)DNase I。
在一些实施方案中,组合物可以包含编码本文公开的组合物的多核苷酸。在一些实施方案中,所述多核苷酸可以是载体。所述载体可以是核酸分子的片段。所述载体可以取自病毒、质粒或高等生物体的细胞。所述载体可以在生物体中稳定地维持。所述载体可以与外源核酸片段一起被插入以用于克隆目的。所述载体可以包含允许将核酸片段方便地插入载体或从载体移除的特征。所述载体可以是基因工程质粒。
在一些实施方案中,直接连接所述稳定化的DNase I多肽的一种或多种非标准氨基酸中的两个的键在环境中可以不断裂,而直接连接所述相应DNase I多肽的一种或多种标准氨基酸中的两个的键可以在相同的环境中断裂。
在一些实施方案中,制备本文公开的组合物的方法可以包括表达所述稳定化的DNase I多肽的氨基酸序列。在一些实施方案中,表达可以包括在细胞中或在体外的表达。
在一些实施方案中,所述细胞可以是细菌细胞。在一些实施方案中,所述细胞可以是基因组重新编码的细胞。在一些实施方案中,所述细胞可以不是细菌细胞。所述细胞可以从受试者获得或分离。所述细胞可以从组织获得或分离。所述受试者可以是动物,例如人、小鼠、大鼠、猪、狗、兔、羊、马、鸡或其他动物。细胞可以是神经元。所述细胞可以是血-脑屏障系统中的细胞之一。所述细胞可以是细胞系,例如神经元细胞系。所述细胞可以原代细胞,例如从受试者的脑获得的细胞。所述细胞可以是从受试者分离的细胞群,例如组织活检、细胞学样本、血液样品、细针抽取物(FNA)样品或它们的组合。所述细胞可以获自于体液,例如尿液、奶、汗液、淋巴、血液、痰、羊水、房水、玻璃体液、胆汁、脑脊液、乳糜、食糜、渗出物、内淋巴、外淋巴、胃酸、粘液、心包液、腹膜液、胸膜液、脓液、风湿(rheum)、唾液、皮脂、浆液、阴垢、痰、眼泪、呕吐物或其他体液。所述细胞可以包括癌细胞、非癌细胞、肿瘤细胞、非肿瘤细胞、健康细胞或其任何组合。
在一些实施方案中,所述细胞可以包括由稳定化非标准氨基酸tRNA识别的重分配的密码子,所述稳定化非标准氨基酸tRNA包含与所述重分配的密码子对应的反密码子。
在一些实施方案中,所述稳定化的DNase I多肽的氨基酸序列可以由包括天然氨基酸的至少一个密码子的多核苷酸序列编码,该密码子可以被所述重分配的密码子取代。在一些实施方案中,所述稳定化的DNase I多肽的氨基酸序列可以由包括天然氨基酸的至少一个、两个或三个密码子的多核苷酸序列编码,该密码子可被所述重分配的密码子取代。
在一些实施方案中,所述稳定化非标准氨基酸tRNA可以是硒代半胱氨酸tRNA。
在一些实施方案中,所述方法可以包括在所述稳定化的DNase I多肽的氨基酸序列可被表达的条件下、培养所述细胞。在一些实施方案中,所述重分配的密码子可以是UAG、UAA、UGA,或其组合。
在一些方面中,本文中提供一种方法,所述方法包括将可在缓冲液中、反应环境中或固体表面上的DNA底物与包含一种或多种非标准氨基酸的稳定化的脱氧核糖核酸酶I(DNase I)多肽、其功能片段,或其变异体接触;其中所述稳定化的DNase I多肽、其功能片段或其变异体可以相比于不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体以更高的速率催化所述DNA底物的分裂或断裂。在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体可以催化所述DNA底物的分裂或断裂,其速率比不包含所述一种或多种非标准氨基酸的相应DNase I多肽、其功能片段或其变异体高1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300、400、500、600、700、800、900或1000倍或更高。
在一些实施方案中,所述稳定化的DNase I多肽、其功能片段或其变异体可以是本文其他部分公开的稳定化的DNase I多肽、其功能片段或变异体。在一些实施方案中,所述DNA底物可以是基因组DNA。在一些实施方案中,所述DNA底物来自单细胞。所述单细胞(或细胞)在本文中其他部分描述。在一些实施方案中,所述方法可以包括形成多个容器,每个容器都包括多个细胞中的单细胞;所述稳定化的DNase I多肽、其功能片段或其变异体;和裂解缓冲液。在一些实施方案中,所述方法可以进一步包括裂解所述单细胞,由此从所述单细胞释放所述DNA底物。
在一些实施方案中,所述方法可以进一步包括条形码化所述DNA底物或其片段。所述DNA底物上的条形码可以是多核苷酸包含的天然或合成的核酸序列,以明确识别所述多核苷酸以及具有所述条形码序列的多核苷酸包含的其他序列。所述条形码可以唯一地识别受试者、样品(例如无细胞样品)、核酸序列(例如具有一个或多个表观遗传修饰的碱基的序列),或其任意组合。所述条形码可以与DNA底物或互补链相关联。所述DNA底物可以包含单个条形码。所述DNA底物可以包含一个或多个条形码,例如第一条形码和第二条形码。在一些情况中,所述第一条形码可以不同于所述第二条形码。在一些情况中,多个条形码中的每个条形码可以是唯一条形码。在一些情况中,条形码可以包括样品识别条形码。例如,第一条形码可以包括唯一条形码,并且第二条形码可以包括样品识别条形码。
在一些实施方案中,所述方法可以进一步包括扩增所述DNA底物或其片段。所述扩增可以包括聚合酶链反应(PCR)扩增、环介导的等温扩增、基于核酸序列的扩增、链置换扩增、多重置换扩增、滚环扩增、连接酶链式反应、解螺旋酶依赖性扩增、分支扩增法、克隆扩增,或其任何组合。在一些情况中,所述扩增可以包括至少2、3、4、5、6、7、8、9、10、11、12、13或更多次扩增循环。在一些实施方案中,所述扩增可以包括克隆扩增。在一些情况中,单独的DNA底物或片段可以在支持体上原位进行扩增。在一些情况中,所述扩增从单个扩增的模板产生不超过约10
在一些实施方案中,所述方法进一步包括对所述DNA底物或其片段进行测序。所述测序可以包括:无亚硫酸氢盐测序、亚硫酸氢盐测序、TET-辅助亚硫酸氢盐(TAB)测序、ACE-测序、高通量测序、Maxam-Gilbert测序、大规模并行签名测序、Polony测序、454焦磷酸测序、桑格测序、Illumina测序、SOLiD测序、Ion Torrent半导体测序、DNA纳米球测序、Heliscope单分子测序、单分子实时(SMRT)测序、纳米孔DNA测序、鸟枪测序、RNA测序、Enigma测序或其任何组合。在一些实施方案中,所述测序包括全基因组测序。在一些实施方案中,所述测序包括高通量测序、大规模并行测序、桑格测序或下一代测序。
在一些实施方案中,所述多个容器包含固体支持体。在一些实施方案中,DNA底物未附接到容器中的固体支持体。在一些实施方案中,DNA底物可以附接到容器中的固体支持体。所述支持体可以是任何固体或半固体制品,在其上可以固定有试剂例如核酸。核酸可以通过任何方法而固定化固体支持体上,所述方法包括但不限于物理吸附、通过离子键或共价键形成,或其组合。固体支持体可以包括聚合物、玻璃或金属材料。固体支持体的示例包括膜、平面表面、微量滴定板、珠、过滤器、测试条、载玻片、盖玻片和试管,意指在其上合成、附接、连接或以其他方式固定寡聚体的任何固相材料。所述支持体可以由有机聚合物构成,例如聚苯乙烯、聚乙烯、聚丙烯、聚氟乙烯、聚氧乙烯(polyethyleneoxy)和聚丙烯酰胺,以及其共聚物和接枝物。所述支持体还可以是无机的,例如玻璃、二氧化硅、可控孔径玻璃(controlled-pore-glass,CPG)或反相二氧化硅。支持体的构型可以是珠、球体、微粒、颗粒、凝胶或面(surface)的形式。表面可以是平面的、基本上平面的或非平面的。支持体可以是多孔的或无孔的,并且可以具有溶胀或非溶胀的特性。所述支持体可以成形为包括一个或多个孔(well)、凹陷,或其他器皿、容器、特征件或位置。多个支持体可以在不同位置配置成阵列。
在一些实施方案中,缓冲液、反应环境或固体表面可以包括对所述DNA底物或其片段的序列特异性的引物。所述引物可以是具有已知或未知序列的核酸。所述引物可以是单链。在一些情况中,引物可以包括条形码(例如唯一标识符序列)。所述引物可以是扩增引物,该扩增引物与衔接子杂交并在扩增反应中使用靶核酸作为模板而延伸。所述引物可以是测序引物,其与衔接子杂交并在测序反应中使用靶核酸作为模板而延伸。
在一些实施方案中,所述多个细胞可以包括至少2、3、4、5、5.5、6、6.5 7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10,000、15,000、20,000、25,000、30,000、35,000、40,000、45,000、50,000、60,000、70,000、80,000、90,000、100,000、200,000、300,000、400,000、500,000、600,000、700,000、800,000、900,000、1x10
在一些实施方案中,所述多个细胞可以来自一个或多个生物样品。所述生物样品可以来自受试者,例如组织活检、细胞学样本、血液样品、细针抽取物(FNA)样品或其任何组合。所述生物样品可以获自于体液,例如尿液、奶、汗液、淋巴、血液、痰、羊水、房水、玻璃体液、胆汁、脑脊液、乳糜、食糜、渗出物、内淋巴、外淋巴、胃酸、粘液、心包液、腹膜液、胸膜液、脓液、风湿、唾液、皮脂、浆液、阴垢、痰、眼泪、呕吐物或其他体液。
在一些实施方案中,所述一个或多个生物样品包括至少2、3、4、5、10、20、30、40、50、60、70、80、90或100或更多个样品。在一些实施方案中,所述一个或多个生物样品可以包括来自不同受试者的样品。在一些实施方案中,所述一个或多个生物样品可以包括来自同一受试者的样品。
在一些实施方案中,所述一个或多个生物样品来自患有疾病的受试者。所述疾病可以包括癌症、神经病症或自身免疫性疾病。在一些实施方案中,疾病可以包括神经病症。在一些情况中,神经病症可以包括:获得性癫痫性失语、急性播散性脑脊髓炎、肾上腺脑白质营养不良、胼胝体发育不良、失认症、艾氏(Aicardi)综合征、亚历山大病、阿尔珀斯病、交替性瘫痪、阿尔茨海默病、肌萎缩侧索硬化(参见运动神经元病)、无脑畸形、安格尔曼综合征、血管瘤病、缺氧症、失语症、失用症、颅内蛛网膜囊肿、蛛网膜炎、阿诺德-基亚里(Arnold-Chiari)畸形、动静脉畸形、阿斯伯格综合征、共济失调毛细血管扩张症、注意缺陷多动症、自闭症、听觉处理病症、自主神经功能失调、背痛、登氏症、白塞病、贝尔面痪、良性特发性眼睑痉挛、良性局灶性肌萎缩、良性颅内压增高、双侧额顶多小脑回、宾斯旺格病、眼睑痉挛、布洛赫-苏兹伯格(Bloch-Sulzberger)综合征、臂丛神经损伤、脑脓肿、脑损伤、脑创伤、脑瘤、布朗-塞卡尔(Brown-Sequard)综合征、卡纳万病、腕管综合征(CTS)、灼性神经痛、中枢性疼痛综合征、中央脑桥髓鞘溶解症、中央核肌病、头部病症、脑动脉瘤、脑动脉硬化、脑萎缩、脑性巨人症、大脑性瘫痪、夏科-马里-图思(Charcot-Marie-Tooth)病、查理氏(Chiari)畸形、舞蹈症、慢性炎症性脱髓鞘性多发性神经病(CIDP)、慢性疼痛、慢性区域性疼痛综合征、考费-劳里(Coffin Lowry)综合征、包括持续性植物状态的昏迷、先天性双侧面瘫、皮质-基底节变性、颅动脉炎、颅缝早闭、克罗伊茨费尔特-雅各布病、累积性损伤、库兴综合征、巨细胞包涵体病(CIBD)、巨细胞病毒感染、丹迪-沃克综合征、道森(Dawson)病、德莫西(De Morsier)综合征、德杰林-克兰普克(Dejerine-Klumpke)瘫痪、德杰林-索塔斯(Dejerine-Sottas)病、延迟睡眠期综合征、痴呆、皮肌炎、神经性运动障碍、糖尿病性神经病变、弥漫性硬化、自主神经功能异常、计算障碍、书写困难、诵读困难、张力障碍、婴幼儿癫痫性脑病、空蝶鞍综合征、脑炎、脑膨出、脑三叉神经血管瘤病、大便失禁、癫痫、厄尔布瘫痪、红斑性肢痛症、特发性震颤、法布瑞氏(Fabry)病、法布瑞氏综合征、晕厥、家族性痉挛性麻痹、热性癫痫、费希尔综合征、弗里德赖希氏共济失调、FART综合征、戈谢病、格斯特曼综合征、巨细胞动脉炎、巨细胞包涵体病、球形细胞脑白质营养不良、灰质异位症、格林-巴利综合征、HTLV-1相关脊髓病、哈勒沃登-施帕茨病、头部损伤、头痛、半面痉挛、遗传性痉挛性截瘫、遗传共济失调性多发性神经炎、耳带状疱疹、带状疱疹、平山(Hirayama)综合征、前脑无裂畸形、亨廷顿病、积水性无脑畸形、脑积水、皮质醇增多症、缺氧、免疫介导的脑脊髓炎、包涵体肌炎、色素失调症、婴儿植烷酸贮积病、婴儿雷夫叙姆病、婴儿痉挛、炎性肌病、颅内囊肿、颅内压增高、朱伯特(Joubert)综合征、卡恩斯-塞尔综合征、肯尼迪病、金斯伯恩(Kinsbourne)综合征、Klippel Feil综合征、克拉伯病、库格尔贝格-韦兰德病、库鲁病、拉福拉病、兰伯特-伊顿肌无力综合征、克里佩尔-克莱夫纳(Landau-Kleffner)综合征、延髓外侧(Wallenberg)综合征、学习缺陷、利氏病、伦诺斯克-加斯多(Lennox-Gastaut)综合征、莱施-莱(Lesch-Nyhan)综合征、脑白质营养不良、路易体痴呆、无脑回、闭锁综合征、卢格里克(Lou Gehrig)病、腰椎间盘病、莱姆病–神经后遗症、马-约二氏病(脊髓小脑性共济失调3型)、巨脑、枫糖尿病、巨脑、梅尔克松-罗森塔尔综合征、梅尼埃病、脑膜炎、门克斯病、异染性脑白质营养不良、小头畸形、偏头痛、米-费综合征、轻度卒中、线粒体肌病、默比厄斯综合征、单肢肌萎缩、运动神经元病、运动技能障碍、烟雾病、黏多糖沉积病、多发性脑梗死性痴呆、多灶性运动神经病、多发性硬化、多系统萎缩、肌营养不良、肌痛性脑脊髓炎、重症肌无力、脱髓鞘性弥漫性硬化、婴儿肌阵挛脑病、肌阵挛、肌病、肌管性肌病、先天性肌强直、发作性睡病、神经纤维瘤病、抗精神病药恶性综合征、AIDS的神经系统表现、狼疮的神经系统后遗症、神经性肌强直、神经元蜡样脂褐质沉积症、神经元移行障碍、尼曼-皮克病、非24-小时睡眠觉醒综合征、非言语学习障碍、欧莎莉文-麦克劳德(O'Sullivan-McLeod)综合征、枕神经痛、隐性脊管闭合不全序列、大田原综合征、橄榄体脑桥小脑萎缩、斜视眼阵挛肌阵挛综合征、视神经炎、直立性低血压、过用综合征、视象存留、感觉异常、帕金森病、先天性副肌强直、副肿瘤病、阵发性发作、帕里-龙伯格(Parry-Romberg)综合征、龙伯格综合征、佩利措伊斯-梅茨巴赫病、周期性瘫痪、周围神经病变、持续性植物状态、弥漫性神经障碍、光致喷嚏反射、植烷酸贮积病、皮克病、挤压神经、垂体瘤、PMG、脊髓灰质炎、多小脑回、多肌炎、脑穿通畸形、脊髓灰质炎后综合征、疱疹后神经痛(PHN)、感染后脑脊髓炎、体位性低血压、普拉德威利(Prader-Willi)综合征、原发性侧索硬化、朊病毒病、进行性半面萎缩(也称为龙伯格综合征)、进行性多灶性白质脑病、进行性硬化性灰质营养不良、进行性核上性麻痹、假性脑瘤、拉姆塞-安(Ramsay-Hunt)综合征(I型和II型)、拉斯马森(Rasmussen)脑炎、反射交感性营养不良综合征、雷夫叙姆病、重复性运动障碍、重复性应激损伤、不安腿综合征、反转录病毒相关脊髓病、雷特(Rett)综合征、瑞氏综合征、龙伯格综合征、狂犬病、圣威斯特(SaintVitus)舞蹈病、桑德霍夫(Sandhoff)病、精神分裂症(Schytsophrenia)、席尔德(Schilder)病、脑裂、感觉整合功能失调、脑中隔视发育异常、婴儿摇晃综合征、带状疱疹、夏伊-德尔格(Shy-Drager)综合征、肖格伦(Sjogren)综合征、睡眠呼吸暂停、睡眠病、Snatiation、索特(Sotos)综合征、痉挛状态、脊柱裂、脊髓损伤、脊髓肿瘤、脊髓性肌萎缩、椎管狭窄、斯蒂尔-理查森-奥尔谢夫斯基(Steele-Richardson-Olszewski)综合征、参见进行性核上性麻痹、脊髓小脑性共济失调、史提夫-珀森(Stiff-person)综合征、卒中、斯特奇-韦伯(Sturge-Weber)综合征、亚急性硬化性全脑炎、皮质下动脉硬化性脑病、浅表性铁质沉着症、西德纳姆(Sydenham)舞蹈症、晕厥、联觉、脊髓空洞症、迟发性运动障碍、塔尔图-萨克斯(Tay-Sachs)病、颞动脉炎、脊髓拴系综合征、汤姆森(Thomsen)病、胸出口综合征、三叉神经痛、托德瘫痪、妥瑞综合征、短暂性脑缺血发作、可传染性海绵状脑病、横贯性脊髓炎、创伤性脑损伤、震颤、三叉神经痛、热带痉挛性轻截瘫、锥虫病、结节性硬化、血管炎包括颞动脉炎、希佩尔-林道(Von Hippel-Lindau)病(VHL)、Viliuisk脑脊髓炎(VE)、瓦伦贝里(Wallenberg)综合征、霍夫曼病、韦斯特(West)综合征、鞭索、威廉斯(Williams)综合征、威尔逊(Wilson)病、X-连锁脊髓延髓性肌萎缩症,以及泽尔韦格(Zellweger)综合征。
在一些情况中,所述疾病可以包括自身免疫性疾病。在一些情况中,自身免疫性疾病可以包括:急性播散性脑脊髓炎(ADEM)、急性坏死性出血性白质脑炎、艾迪生病、无丙种球蛋白血症、变应性哮喘、变应性鼻炎、斑秃、淀粉样变、强直性脊柱炎、抗-GBM/抗-TBM肾炎、抗磷脂抗体综合征(APS)、自身免疫性再生障碍性贫血、自身免疫性自主神经功能异常、自身免疫性肝炎、自身免疫性高脂血症、自身免疫性免疫缺陷、自身免疫性内耳病(AIED)、自身免疫性心肌炎、自身免疫性胰腺炎、自身免疫性视网膜病变、自身免疫性血小板减少性紫癜(ATP)、自身免疫性甲状腺病、轴突&神经元神经病变、Balo病、白塞病、大疱性类天疱疮、心肌病、喀斯特勒木(Castlemen)病、脂性腹泻(非热带性)、查加斯(Chagas)病、慢性疲劳综合征、慢性炎症性脱髓鞘性多发性神经病(CIDP)、慢性复发性多灶性骨髓炎(CRMO)、许尔-施特劳斯(Churg-Strauss)综合征、瘢痕性类天疱疮/良性粘膜类天疱疮、克罗恩病、科根(Cogan)综合征、冷凝集素病、先天性心脏传导阻滞、柯萨奇心肌炎、克雷(CREST)病、特发性混合性冷球蛋白血症、脱髓鞘性神经病变、皮肌炎、德维克(Devic)病(视神经脊髓炎)、盘状狼疮、德雷斯勒(Dressler)综合征、子宫内膜异位症、嗜酸性筋膜炎、结节性红斑、实验性变应性脑脊髓炎、埃文(Evan)综合征、纤维肌痛、纤维性肺泡炎、巨细胞动脉炎(颞动脉炎)、肾小球肾炎、古德帕斯丘综合征、格拉维(Grave)病、吉兰-巴雷综合征、桥本脑炎、桥本甲状腺炎、溶血性贫血、Henock-Schoniein紫癜、妊娠疱疹、低丙种球蛋白血症、特发性血小板减少性紫癜(ITP)、IgA肾病、免疫调节脂蛋白、包涵体肌炎、胰岛素依赖型糖尿病(1型)、间质性膀胱炎、幼年型关节炎、幼年型糖尿病、川崎综合征、兰伯特-伊顿综合征、白细胞破裂性血管炎、扁平苔藓、硬化苔藓、木样结膜炎、线状IgA病(LAD)、狼疮(SLE)、莱姆病、梅尼埃尔病、显微镜下多血管炎、混合性结缔组织病(MCTD)、Mooren溃疡、穆哈-赫伯曼(Mucha-Habermann)病、多发性硬化、重症肌无力、肌炎、发作性睡病、视神经脊髓炎(Devic)、中性粒细胞减少症、眼瘢痕性类天疱疮、视神经炎、复发性风湿、PANDAS(链球菌相关性儿童自身免疫性神经精神障碍)、副肿瘤性小脑变性、阵发性睡眠性血红蛋白尿症(PNH)、罗二氏(ParryRomberg)综合征、帕松那-特纳(Parsonnage-Turner)综合征、睫状体平坦部炎(parsplantis)(周边葡萄膜炎)、天疱疮、周围神经病变、静脉周围脑脊髓炎、恶性贫血、POEMS综合征、结节性多动脉炎、I、II&III型自身免疫性多腺性综合征、风湿性多肌痛、多肌炎、心肌梗死后综合征、心包切开术后综合征、孕酮皮炎、原发性胆汁性肝硬变、原发性硬化性胆管炎、银屑病、银屑病关节炎、特发性肺纤维化、坏疽性脓皮病、纯红细胞再生障碍、雷诺现象、反射交感性营养不良、瑞特综合征、复发性多软骨炎、不安腿综合征、腹膜后纤维化、风湿热、类风湿关节炎、结节病、施密特(Schmidt)综合征、巩膜炎、硬皮病、Slogren综合征、精子和睾丸自身免疫、僵人综合征、亚急性细菌性心内膜炎(SBE)、交感性眼炎、大动脉炎、颞动脉炎/巨细胞动脉炎、血小板减少性紫癜(TPP)、托洛萨-安(Tolosa-Hunt)综合征、横贯性脊髓炎、溃疡性结肠炎、未分化的结缔组织病(UCTD)、葡萄膜炎、血管炎、大疱性皮肤病、白癜风或韦格内肉芽肿病、慢性活动性肝炎、原发性胆汁性肝硬变、cadilated心肌病、心肌炎、自身免疫性多内分泌腺综合征I型(APS-I)、囊肿性纤维化血管炎、获得性甲状旁腺功能减退症、冠状动脉病、落叶型天疱疮、寻常型天疱疮、拉斯马森(Rasmussen)脑炎、自身免疫性胃炎、胰岛素低血糖综合征(Hirata病)、B型胰岛素抵抗、棘层肥厚、系统性红斑狼疮(SLE)、恶性贫血、治疗抵抗性莱姆关节炎、多神经病、脱髓鞘性病、特应性皮炎、自身免疫性甲状腺功能减退、白癜风、甲状腺相关性眼病、自身免疫性腹泻、ACTH缺陷、皮肌炎、Sjogren综合征、系统性硬化病、进行性系统性硬化病、硬斑病、原发性抗磷脂抗体综合征、慢性特发性荨麻疹、结缔组织综合征、坏死性新月体性肾小球肾炎(NCGN)、系统性血管炎、雷诺综合征、慢性肝病、内脏利什曼病、自身免疫性C1缺陷、膜增生性肾小球肾炎(MPGN)、凝固时间延长、免疫缺陷、动脉粥样硬化、神经元病、副肿瘤性天疱疮、副肿瘤性僵人综合征、副肿瘤性脑脊髓炎、亚急性自主神经病、癌相关性视网膜病变、副肿瘤性斜视眼阵挛肌阵挛共济失调、下运动神经元综合征和兰伯特-伊顿肌无力综合征。
在一些情况中,疾病可以包括:AIDS、炭疽、肉毒中毒、布鲁菌病、软下疳、衣原体感染、霍乱、球孢子菌病、隐孢子虫病、环孢菌病、白喉、埃利希体病(ehrlichiosis)、虫媒病毒性脑炎、肠出血性大肠杆菌、贾第虫病、淋病、登革热、嗜血杆菌流感、汉森病(麻风)、汉坦病毒肺综合征、溶血性尿毒症综合征、甲型肝炎、乙型肝炎、丙型肝炎、人免疫缺陷病毒、军团菌病、李斯特菌病、莱姆病、疟疾、麻疹、脑膜炎球菌病、腮腺炎、百日咳(百日咳)、鼠疫、麻痹性脊髓灰质炎、鹦鹉热、Q热、狂犬病、落矶山斑疹热、风疹、先天性风疹综合征(SARS)、志贺菌病、天花、链球菌病(侵袭性A组)、链球菌性中毒性休克综合征、链球菌性肺炎、梅毒、破伤风、中毒性休克综合征、旋毛虫病、结核、土拉菌病、伤寒、万古霉素中间体抗性金黄色葡萄球菌、水痘、黄热病、变异型克雅氏病(vCJD)、埃博拉出血热、包虫病、亨德拉病毒感染、人类猴痘、甲型流感、H5N1、拉沙热、马尔堡出血热、尼帕病毒、阿尼昂尼昂热、裂谷热、委内瑞拉马脑炎和西尼罗河病毒。
在一些情况中,疾病可以包括癌症。在一些情况中,癌症可以包括甲状腺癌、肾上腺皮质癌、肛门癌、再生障碍性贫血、胆管癌、膀胱癌、骨癌、骨转移、中枢神经系统(CNS)癌、周围神经系统(PNS)癌、乳癌、卡斯尔曼病、子宫颈癌、儿童非霍奇金淋巴瘤、淋巴瘤、结肠直肠癌、子宫内膜癌、食道癌、尤因肿瘤家族(例如尤因肉瘤)、眼癌、胆囊癌、胃肠类癌瘤、胃肠道间质瘤、妊娠滋养层病、毛细胞白血病、霍奇金病、卡波西肉瘤、肾癌、喉咽下癌、急性淋巴细胞白血病、急性髓系白血病、儿童白血病、慢性淋巴细胞白血病、慢性髓系白血病、肝癌、肺癌类癌瘤、非霍奇金淋巴瘤、男性乳癌、恶性间皮瘤、多发性骨髓瘤、骨髓增生异常综合征、骨髓增生性疾病、鼻腔和鼻旁癌、鼻咽癌、神经母细胞瘤、口腔和口咽癌、骨肉瘤、卵巢癌、胰腺癌、阴茎癌、垂体瘤、前列腺癌、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤(成人软组织癌)、黑素瘤皮肤癌、非黑素瘤皮肤癌、胃癌、睾丸癌、胸腺癌、子宫癌(例如子宫肉瘤)、阴道癌、外阴癌或登斯透姆(Waldenstrom)巨球蛋白血症。
在一些情况中,疾病可以包括过度增生性病症。恶性过度增生性病症可以分成风险组,例如低风险组和中高风险组。过度增生性疾病可以包括但不限于癌症、增生或瘤形成。在一些情况中,过度增生性癌症可以是乳癌,例如乳腺中导管组织的导管癌、髓样癌、胶样癌、管癌和炎性乳癌;卵巢癌,包括卵巢上皮性肿瘤,例如卵巢中的腺癌以及已从卵巢转移到腹腔中的腺癌;子宫癌;子宫颈癌例如子宫颈上皮中的腺癌(包括鳞状细胞癌和腺癌);前列腺癌,例如选自以下的前列腺癌:腺癌,或已转移到骨的腺癌;胰腺癌例如胰腺导管组织中的上皮样癌以及胰腺导管中的腺癌;膀胱癌例如膀胱中的移行细胞癌、尿路上皮癌(移行细胞癌)、膀胱中的尿路上皮细胞肿瘤、鳞状细胞癌、腺癌和小细胞癌;白血病例如急性髓系白血病(AML)、急性淋巴细胞白血病、慢性淋巴细胞白血病、慢性髓系白血病、毛细胞白血病、骨髓增生异常、骨髓增生性疾病、急性髓系白血病(AML)、慢性髓系白血病(CML)、肥大细胞增多症、慢性淋巴细胞白血病(CLL)、多发性骨髓瘤(MM)和骨髓增生异常综合征(MDS);骨癌;肺癌例如非小细胞肺癌((NSCLC),其可以分为鳞状细胞癌、腺癌和大细胞未分化癌),以及小细胞肺癌;皮肤癌例如基底细胞癌、黑素瘤、鳞状细胞癌和光化性角化病(其可以是有时发展成鳞状细胞癌的皮肤病况);眼视网膜母细胞瘤;皮肤或眼内(眼)黑素瘤;原发性肝癌(肝中的良性癌);肾癌;自身免疫性缺陷综合征(AIDS)-相关性淋巴瘤例如弥漫性大B-细胞淋巴瘤、B-细胞免疫母细胞性淋巴瘤和小非裂解细胞淋巴瘤;卡波西肉瘤;病毒诱导的癌症包括乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)和肝细胞癌;人类嗜淋巴细胞病毒1型(HTLV-1)和成人T-细胞白血病/淋巴瘤;和人类乳头瘤病毒(HPV)和子宫颈癌;中枢神经系统(CNS)癌例如原发性脑瘤,其包括神经胶质瘤(星形细胞瘤、间变型星形细胞瘤或多形性胶质母细胞瘤)、少突神经胶质瘤、室管膜瘤、脑膜瘤、淋巴瘤、神经鞘瘤和髓母细胞瘤;周围神经系统(PNS)癌例如听神经瘤和恶性周围神经鞘肿瘤(MPNST),包括神经纤维瘤和神经鞘瘤、恶性纤维细胞瘤、恶性纤维组织细胞瘤、恶性脑膜瘤、恶性间皮瘤和恶性混合型米勒管瘤;口腔和口咽癌例如咽下癌、喉癌、鼻咽癌和口咽癌;胃癌例如淋巴瘤、胃间质瘤和类癌瘤;睾丸癌例如生殖细胞瘤(GCT),其包括精原细胞瘤和非精原细胞瘤,以及性腺基质细胞瘤,其包括莱迪希细胞瘤和睾丸支持细胞瘤;胸腺癌例如胸腺瘤、胸腺癌、霍奇金病、非霍奇金淋巴瘤类癌或类癌瘤;直肠癌;和结肠癌。在一些情况中,根据本公开的方法进行分级、分类、表征或诊断的疾病包括但不限于甲状腺症,例如良性甲状腺症,包括但不限于,滤泡性腺瘤、许特莱(Hurthle)细胞腺瘤、淋巴细胞性甲状腺炎和甲状腺增生。在一些情况中,根据本公开的方法进行分级、分类、表征或诊断的疾病包括但不限于恶性甲状腺症,例如滤泡性癌、乳头状甲状腺癌的滤泡性变异体、髓样癌和乳头状癌。
所述疾病可以包括遗传性疾病。遗传性疾病可以是由基因或染色体中的异常所致的病症。遗传性疾病可以被分成两类:单基因病,以及多因子病和多基因(复杂)病。单基因病可以是单突变基因所致。遗传性单基因病可以包括但不限于常染色体显性遗传、常染色体隐性遗传、X-连锁显性遗传、X-连锁隐性遗传、Y-连锁线粒体遗传。对于患有常染色体显性病的人来说,仅需要一个基因的突变拷贝。常染色体显性类型的病症的示例可以包括但不限于亨廷顿病、神经纤维瘤1、马方综合征、遗传性非息肉病结肠直肠癌或遗传性多发性外生骨疣。在常染色体隐性病中,对患有常染色体隐性病的受试者而言,必须突变基因的两个拷贝。此类型的病的示例可以包括但不限于囊性纤维化、镰状细胞病(部分性镰状细胞病)、家族黑蒙性白痴病、尼曼-匹克氏病或脊髓性肌萎缩。X-连锁显性病是因X染色体上的基因突变所致,例如X-连锁低磷血症性佝偻病。一些X-连锁显性病例如雷特综合征、色素失调症2型和艾氏(Aicardi)综合征可能是致命的。X-连锁隐性病还因X染色体上的基因突变所致。此类型的病的示例可以包括但不限于血友病A、杜氏肌营养不良、红绿色盲、肌营养不良和雄激素性秃发。Y-连锁病是因Y染色体上的突变所致。示例可以包括但不限于男性不育症和耳郭多毛症。线粒体遗传的遗传性病,也称为母系遗传,可以适用于线粒体DNA中的基因,例如在莱贝尔(Leber)遗传性视神经病中。
在一些实施方案中,所述多个细胞可以包括多个细菌细胞或真菌细胞。在一些实施方案中,多个细菌细胞或真菌细胞可以包括至少2、3、4、5、5.5 6、6.5 7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10,000、15,000、20,000、25,000、30,000、35,000、40,000、45,000、50,000、60,000、70,000、80,000、90,000、100,000、200,000、300,000、400,000、500,000、600,000、700,000、800,000、900,000、1x10
在一些实施方案中,多个细胞包括多个免疫细胞。在一些实施方案中,所述多个免疫细胞可以包括至少2、3、4、5、5.5 6、6.5 7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10,000、15,000、20,000、25,000、30,000、35,000、40,000、45,000、50,000、60,000、70,000、80,000、90,000、100,000、200,000、300,000、400,000、500,000、600,000、700,000、800,000、900,000、1x10
在一些实施方案中,多个细胞包括多个患病细胞。在一些实施方案中,所述多个患病细胞可以包括至少2、3、4、5、5.5 6、6.5 7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10,000、15,000、20,000、25,000、30,000、35,000、40,000、45,000、50,000、60,000、70,000、80,000、90,000、100,000、200,000、300,000、400,000、500,000、600,000、700,000、800,000、900,000、1x10
在一些实施方案中,多个细胞包括多个癌细胞。在一些实施方案中,所述多个癌细胞可以包括至少2、3、4、5、5.5 6、6.5 7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10,000、15,000、20,000、25,000、30,000、35,000、40,000、45,000、50,000、60,000、70,000、80,000、90,000、100,000、200,000、300,000、400,000、500,000、600,000、700,000、800,000、900,000、1x10
本文中所述的酶可以在宿主细胞中,或在体外,在无细胞合成系统中进行制备。宿主细胞可以是可被稳健地重新编码的任何宿主细胞。这些宿主细胞可以是具有发育良好的遗传系统的细菌细胞,其中大肠杆菌是示例。其他细菌种类也可以使用。用于产生蛋白质的无细胞系统可以是偶联的转录/翻译系统或仅翻译系统。本发明的方法的显著方面是使用生物合成而非化学合成方法。
可以通过本领域中已知的任何方法来培养具有构建的核酸序列的重新编码的细胞。所述培养可以分批或连续地在振荡器烧瓶中或在发酵器中或固定在固体表面上(例如较大容器中包含的小颗粒)进行。典型地,培养基增补有硒源,例如Na
以上公开内容概括地描述了本发明。本文公开的所有文献都通过援引而明确地并入本文中。更全面的理解可以通过参考以下具体实施例而实现,这些实施例在本文中仅仅出于示例说明目的而提供,并非意在限制本发明的范围。
实施例
将载有编码DNase I的基因(UAG密码子引导硒代半胱氨酸掺入取代所有半胱氨酸密码子)的质粒pUC-TetO-GST-DNase_Sec-HisAltStrep转化的RTΔA 2X310K细胞在1L高浓度肉汤(terrific broth)中稀释1/250,该高浓度肉汤中补充有1000μg/mL羧苄青霉素、12.5μg/mL四环素和25μM Na
将载有编码DNase I的基因(UAG密码子引导硒代半胱氨酸掺入取代所有半胱氨酸密码子)的质粒pUC-TetO-GST-DNase_Sec-HisAltStrep转化的RTΔA 2X310K-T7细胞在1L高浓度肉汤中稀释1/250,该高浓度肉汤中补充有1000μg/mL羧苄青霉素、33μg/mL氯霉素和25μM Na
完整的蛋白样品是通过利用前述方法来分析。利用分子量为10kDa的截止过滤器,硒蛋白样品被缓冲液交换到LC-MS级水中。一旦缓冲液交换完成,样品将在甲醇/水/甲酸(50/49/1)溶液中稀释至20μM。在稀释之后,将蛋白溶液以3μL/min的速率经由电喷射离子化而注入Orbitrap Elite质谱仪(赛默飞世尔科技公司(Thermo Fisher ScientificInstruments),不来梅,德国)中。为了确认硒代半胱氨酸的掺入,完整的质量分析在240k分辨率和平均20次扫描下进行。蛋白序列的表征是通过使用193nm受激准分子激光器(Coherent,Inc.)的紫外光解离(UVPD)来进行,该193nm受激准分子激光器连接至前述Orbitrap质谱仪。对于每个UVPD光谱,使用两个2.5mJ的激光脉冲,并且对250次扫描进行平均。MS1光谱通过利用Xtract反卷积算法(赛默飞世尔科技)进行反卷积。UVPD质谱通过利用Xtract进行反卷积,而后利用ProsightPC 3.0进行分析。通过在掺入位点的丝氨酸残基(包括由于形成二硒键而减去一个氢原子)上添加61.9146Da的修饰,对包含硒代半胱氨酸的蛋白质进行搜索。掺入效率是通过用修饰的蛋白质峰的面积、除以未修饰的蛋白质峰和修饰的蛋白质峰的总面积来计算的。每种蛋白质的峰面积是来自每个同位素簇的丰度最大的五个峰的积分面积的总和。
UAG密码子翻译功能被完全消除的基因组重新编码的生物体(GRO)将用于明确地在UAG处掺入非标准氨基酸(NSAA)。基因组重新编码的生物体可以包含一个或多个重分配的三联体密码子以促进掺入非标准氨基酸(NSAA)例如硒代半胱氨酸。通过利用本领域技术人员已知的方法,三联体密码子可以被重分配以便掺入非标准氨基酸例如硒代半胱氨酸。可替代地,通过利用本领域技术人员已知的方法,四联体密码子可以用于掺入非标准氨基酸。开发出了正交氨酰基-tRNA合成酶(aaRS)/tRNA对,其基于非功能性UAG三联体,特异性地且有效地解码四联体UAGA密码子,从而非标准氨基酸、例如硒代半胱氨酸明确地掺入UAGA密码子,获得高蛋白质产量。这种四联体密码子可以用于本方法中。
开发出了一种基因选择方法,该方法能够区别不同水平的硒代半胱氨酸掺入。为了使报道蛋白特异性地‘依赖’于硒代半胱氨酸而非丝氨酸,使用来自阴沟肠杆菌的NMC-Af3-内酰胺酶。此酶与粘质沙雷氏菌的SME-1f3-内酰胺酶具有高度序列相似性,先前已表明,为了发挥活性,该SME-1f3-内酰胺酶需要邻近活性位点丝氨酸残基的二硫键,但是这给大肠杆菌带来了显著的适应成本(fitness cost)。首先,由NMC-A构建了C69S突变体,其无法赋予对氨苄青霉素的抗性(MIC<50μg/mL),表明二硫键对活性而言是必需的。然后,用琥珀终止密码子(X69)取代半胱氨酸69,用于文库选择,假定硒代半胱氨酸的掺入和硒基(selenyl)-巯基键的形成可能恢复活性。
为了消除tRNASec文库与内源性硒代半胱氨酸掺入机制之间的任何干扰,从大肠杆菌DH10B删除selA、selB和selC基因(分别编码SelA、SelB和tRNASec)(制定为DHΔabc)。将包含报告质粒(reporter plasmid)pNMC-A C69X和辅助质粒pRSF-eSelA(表达SelA)的细胞用包含tRNASec反决定子(antideterminant)文库的质粒pMB1-ZU进行转化。将转化体接种(plate)在包含氨苄青霉素浓度梯度的培养基上,以便对能够进行硒代半胱氨酸特异性抑制的突变体进行选择。产生的单菌落覆盖一系列氨苄青霉素浓度。对来自每个板的约12个菌落进行测序,并且发现三种不同的tRNASec突变体:G7-C66:U49-G65:C50-U64(GGAAGAT
AGCGGTCCCGG
将包含G7-C66:U49-G65:C50-U64反决定子序列的tRNASec变异体表示为tRNASecUx,并且与先前设计的嵌合体(tRNAUTu)和tRNASec衍生物(其设计成具有与EF-Tu紧密结合(tRNAUG)的反决定子区域)进行对比。包含CUA反密码子和tRNAUG的亲代tRNASec无法产生活性β-内酰胺酶。杂交体tRNAUTu掺入了硒代半胱氨酸并且可以在75μg/mL上增长。相比之下,tRNASecUx的表达导致了显著更高的β-内酰胺酶活性(高达400μg/mL),但是仅当与SelA共表达时,证实了活性是硒代半胱氨酸依赖性的。为了进一步确认掺入硒代半胱氨酸的tRNASecUx对琥珀终止密码子的反应,基于内源性大肠杆菌含硒蛋白甲酸脱氢酶H(FdhH)的活性,采用了标准的比色测定法。FdhH在无氧条件下被表达,并且催化甲酸盐氧化产生CO
选定的tRNA在通常与EF-Tu相互作用的连接处包含非标准序列。鉴于接纳茎的碱基和邻接的T-臂碱基对都不被认为在tRNASec和SelA之间的相互作用中发挥作用,结果表明,与野生型tRNASec序列相比,选定的U:C使得与EF-Tu的更强结合。基于对标准(canonical)的tRNA开发的模型,没有预测到不寻常(unusual)的C50-U64碱基对强烈地结合至EF-Tu,并且来自主要大肠杆菌tRNAGly的、含有强EF-Tu结合区域的杂交体tRNAUG的表达没有导致活性β-内酰胺酶的产生,表明非标准序列在功能上是重要的。因此,可能该工程化的tRNASec的部分与EF-Tu的结合可能不同于标准的tRNA,鉴于tRNASec通常与SelB相互作用,这不一定是令人吃惊。
缺少编码释放因子1(RF1)的prfA基因的工程化大肠杆菌菌株的开发已经允许有效掺入一系列非天然氨基酸,并且基因组工程化的无琥珀大肠杆菌C321.ΔA的开发提供了良机来确定有效掺入硒代半胱氨酸的蛋白质是否可以被表达。在C321.ΔA中缺失selA、selB和selC基因(表示为菌株RTΔA),并且将细胞用包含琥珀的NMC-A报告质粒和辅助质粒进行转化。与仍然包含RF1的prfA+DHΔabc细胞相比,在RF1-缺乏的细胞中β-内酰胺酶活性大幅增高。此外,在RF1-缺乏的背景中,tRNASecUx可以支持功能性二硒键(经由琥珀介导的掺入两个硒代半胱氨酸残基U69和U238)的形成。
为了进一步提高硒代半胱氨酸的掺入效率,采取了许多措施来改进Sec-tRNASec相对于Ser-tRNASec的水平,包括:增高SelA的水平,降低tRNASecUx的基因剂量,以及共表达磷酸丝氨酰基-tRNASec激酶。为了监测硒代半胱氨酸掺入的效率并且证明蛋白质工程化的可能性,制备了包含工程化的非必要性硒基-巯基键的大肠杆菌二氢叶酸还原酶(DHFR)。自上而下质谱显示了接近100%的硒代半胱氨酸掺入,而没有与包含丝氨酸的DHFR对应的可检测背景。还观察到,理性设计的tRNAUTu嵌合体将硒代半胱氨酸掺入到包含P39X取代的DHFR中,但是导致硒代半胱氨酸掺入水平低得多(38%)和显著的丝氨酸掺入(62%)。在质谱中没有观察到与掺入其他标准氨基酸对应的质量。为了进一步验证硒代半胱氨酸掺入,还表达了铜绿假单胞菌金属蛋白天青蛋白,其必需的半胱氨酸(C112)被硒代半胱氨酸和人硒蛋白细胞谷胱甘肽过氧化物酶(GPx-1)取代。对于天青蛋白,此化学变化先前已被证明只有通过表达的蛋白连接才有可能,必需的半胱氨酸可以用硒代半胱氨酸以良好的效率而生物学取代,如通过完整蛋白质的质谱所测定的。
菌株构建
利用Datsenko和Wanner(2000)改编的λ-Red系统,从大肠杆菌DH10B缺失selAB和selC基因。利用FLP重组酶,将抗生素抗性盒(cassette)切除,从而产生菌株DHAabc。整个fdhF开放阅读框的缺失产生菌株DHAabcF。
大肠杆菌C321.ΔA是从Addgene获得。将包含λ-噬菌体基因以及在菌株开发期间插入的TEM-1 3-内酰胺酶的~12kb基因组区域除去,以促进在37℃下稳定生长并且恢复对3-内酰胺抗生素的敏感性。selAB和selC基因的后续缺失以及抗生素抗性盒的切除产生了菌株RTΔA。为了提高重组蛋白质产量,使编码Lon蛋白酶的lon基因缺失,并且将rne基因截短以从RNase E的C-末端除去477个氨基酸,得到RTΔA.2。
报告质粒
所有报告质粒来自pcat-pheS。将含有15A复制起点和赋予四环素抗性的tetA基因的pcat-pheS的3281bp片段连接到1158bp合成DNA片段,该片段包含来自粘质沙雷氏菌的blaSME-1基因,该基因编码SME-1 3-内酰胺酶,侧缘(flank)有内源性启动子和终止子序列。观察到,此质粒(pSME-1)对大肠杆菌宿主细胞毒性高并且培养得不良。用来自阴沟肠杆菌的编码NMC-Aβ-内酰胺酶的blaNMC-A取代blaSME-1开放阅读框,NMC-Aβ-内酰胺酶与SME-1产生的质粒pNMC-A具有接近70%的序列一致性,该质粒没有表现出任何毒性。在残基69和238处具有丝氨酸或琥珀密码子的pNMC-A变异体通过QuikChange定点诱变而产生。
p15A-fdhF是通过将pcat-pheS所得的片段与从大肠杆菌DH10B基因组DNA扩增的2886bp片段连接而构建,该大肠杆菌DH10B基因组DNA包含fdhF基因、内源性启动子和终止子序列以及上游甲酸盐应答元件(upstream formate response element)。U140S和U140TAG变异体通过QuikChange定点诱变而产生。
辅助质粒
RSF1030复制起点和kan盒通过PCR而扩增为来自pRSFDuet-1(Novagen)的1563bp片段。从大肠杆菌DH10B基因组DNA扩增包含大肠杆菌selA基因和覆盖内源性启动子的5′区域的1562bp片段。将这两个片段组装而产生质粒pRSF-SelA。用强组成型活性EM7启动子和标准的Shine-Dalgarno序列取代内源性弱活性启动子而得到质粒pRSF-eSelA。通过苄基紫精分析测定,通过补充缺失selA的大肠杆菌DH10B(DHΔa)来验证SelA表达质粒。与pRSF-SelA相比,pRSF-eSelA诱导了强颜色变化,并且此变异体用于所有进一步的实验。
pRSF-U-eSelA是通过在RSF1030起点和selA启动子之间添加NotI和NcoI限制位点,并亚克隆NotI/NcoI片段来构建,该片段包含来自pMB1-ZU的selC基因。包含突变体tRNASec基因的pRSF-U-eSelA变异体是通过酶的反向PCR来构建。包含截短的selA基因的质粒pRSF-U-ΔSelA是通过QuikChange定点诱变而产生,在167位和168位分别引入TGA和TAA终止密码子。
变异体tRNA序列
tRNASecCUA-GGAAGATCGTCGTCTCCGGTGAGGCGGCTGGACTCTAAATCCAGTTGG
GGCCGCCAGCGGTCCCGGGCAGGTTCGACTCCTGTGATCTTCCGCCA(SEQ ID NO:17)。
tRNASecUx–GGAAGATGGTCGTCTCCGGTGAGGCGGCTGGACTCTAAATCCAGTTGGGGCCGCCAGCGGTCCCGGTCAGGTTCGACTCCTTGCATCTTCCGCCA(SEQ ID NO:18)。
tRNASecUG–GGAAGATGGTCGTCTCCGGTGAGGCGGCTGGACTCTAAATCCAGTTGGGGCCGCCAGCGGTCCCGGCGAGGTTCGACTCCTCGTATCTTCCGCCA(SEQ ID NO:19)。
tRNAUTu–GGAAGATGTGGCCGAGCGGTTGAAGGCACCGGTCTCTAAAACCGGCGACCCGAAAGGGTTCCAGAGTTCGAATCTCTGCATCTTCCGCCA(SEQ ID NO:20)。
用于组成型表达SelA和PSTK的质粒pRSF-eSelAK是通过将合成DNA片段插入在selA基因和kan盒之间,增加selA的luxI终止子3′以及詹氏甲烷球菌pstK基因来构建,该pstK基因编码O-磷酸丝氨酰-tRNASec激酶(PSTK)密码子,被优化用于在大肠杆菌中表达,并且侧缘有EM7启动子和luxI终止子。
表达质粒
一些表达质粒来自pRST.11。对于pDHFR-P39X-AU,wrs1基因被取代为由组成型EM7启动子控制的操纵子,该启动子包含编码二氢叶酸还原酶的大肠杆菌folA基因(扩增自DH10B基因组DNA),其中C-末端Strep II标签由丝氨酸/丙氨酸接头连接,并且selA基因被序列TAGGAGGCAGATC(SEQ ID NO:21)分隔开,从而提供标准Shine-Dalgarno序列。Sc-tRNATrpAmb被取代为tRNASecUx和tRNAUTu以表达来自强leuP启动子的tRNASec变异体。TAG和AGC密码子通过QuikChange定点诱变而引入在39位。pAz-C112X-AU的构建类似为将folA基因取代为合成DNA片段,该合成DNA片段包含来自铜绿假单胞菌的azu基因,该azu基因编码天青蛋白密码子,被优化用于在大肠杆菌中表达,具有C-末端His6-标签。TAG和AGC密码子通过QuikChange定点诱变而引入在112位。pGPx-U49-AU是通过将folA基因取代为包含人gpx1基因的合成DNA片段来构建,该人gpx1基因编码细胞谷胱甘肽过氧化物酶(GPx-1)密码子,优化用于在大肠杆菌中表达,具有N-末端His6-标签。
文库构建和选择
从pETDuet-1(Novagen)扩增包含MB1复制起点和rop基因的1518bp片段。将其与包含密码子优化的ble基因的合成DNA片段和包括NotI和NcoI位点的MCS组装,从而产生质粒pMB1-Z,该ble基因来自印度斯坦链孢霉(Streptoalloteichus hindustan),赋予博莱霉素(Zeocin)抗性,侧缘有EM7启动子和内源性终止子序列。从大肠杆菌DH10B基因组DNA扩增包含selC基因及其启动子的410bp片段,该大肠杆菌DH10B基因组DNA侧缘有NotI和NcoI位点,并且连接到pMB1-Z中以构建pMB1-ZU。通过苄基紫精分析测定,通过补充缺失selC的大肠杆菌DH10B(DHAc)来验证selC基因的功能性。
tRNASec反决定子文库是利用寡核苷酸引物通过酶的反向PCR而产生,以便将识别为与EF-Tu结合的主要反决定子的六个位置随机化。在自身连接16小时之后,将DNA用GlycoBlue(Ambion)进行乙醇沉淀,并且通过电穿孔转化到包含质粒pNMC-A C69X和质粒pRSF-eSelA的大肠杆菌DHAabc中。将转化体在200ml LB培养基中稀释,并且孵育过夜,该培养基包含12.5μg/mL博莱霉素、6.25μg/mL四环素和25μg/mL卡那霉素。在过夜生长之后,将细胞在LB培养基中稀释1/50,并且孵育1小时,该培养基包含6.25μg/mL博莱霉素、3.75μg/mL四环素、12.5μg/mL卡那霉素、1μM Na
引物序列-用于文库构建的寡核苷酸引物。
selClibfwd–TGGACTGGTCTCCCAGTTGGGGCCGCCAGCGGTCCCGGNNAGGTTCGACTCCTNNNATCTTCCGCCAAAATGC(SEQ ID NO:22)。
selClibrev–GCTGGCGGTCTCaACTGGATTTAGAGTCCAGCCGCCTCACCGGAGACGACNATCTTCCGCGCCTCG(SEQ ID NO:23)。
重新表型
将包含tRNASecUx的NotI/NcoI片段亚克隆到pRSF-eSelA中以产生pRSF-UX-eSelA。将pRSF-U-eSelA变异体转化到包含报告质粒pNMC-A C69TAG的大肠杆菌DHAabc中。将包含pNMC-A和pRSFDuet-1的DHAabc细胞用作阳性对照。将包含pNMC-A C69S和pRSF-UX-eSelA和pNMC-A C69TAG和pRSF-UX-ASelA的DHAabc细胞用作硒代半胱氨酸依赖性fl-内酰胺酶活性的对照。将转化体在LB培养基中培养过夜,该培养基包含6.25pg/mL四环素、25pg/mL卡那霉素、1pM Na
苄基紫精分析测定
将包含pRSFDuet-1和pcat-pheS的大肠杆菌DH10B细胞用作阳性对照。将包含p15A-fdhF U140S和pRSF-UX-eSelA和p15A-fdhF U140X和pRSF-UX-ASelA的DHAabcF细胞用作硒代半胱氨酸依赖性甲酸脱氢酶活性的对照。将转化体在37℃下在LB培养基中培养过夜,该培养基补充有12.5pg/mL四环素和50pg/mL卡那霉素。将过夜培养物在2ml的最终体积中稀释1/20,并且孵育3小时。将培养物归一化至OD600=0.5,并且将5pl等分点样(dot)在LB琼脂板上,该琼脂板包含3.75pg/mL四环素、12.5pg/mL卡那霉素、5mM甲酸钠、10pMNa
修饰和蛋白纯化
在大肠杆菌菌株RTΔA.2中产生硒蛋白的初期尝试使用了来自于pRSF-UX-eSelA的辅助质粒与表达质粒的组合,其中内源性selC启动子被取代为高活性大肠杆菌leuP启动子,该表达质粒包含azu基因,该azu基因在强tacI启动子的下游。初期硒蛋白样品的质谱分析揭示了几乎只在琥珀密码子处掺入丝氨酸,并且作出许多优化以增大Sec-tRNASec与Ser-tRNASec之比率,这被认为是掺入效率的主要驱动力。为了增高SelA比tRNASec的比率,通过将leuP盒移至包含MB1复制起点的较低拷贝表达质粒上,并且将第二selA基因添加在靶硒蛋白下游,降低了tRNASec变异体的表达。此外,为了防止诱导后Sec-tRNASec库的快速缺失,驱动硒蛋白表达的tacI启动子被取代为组成型EM7启动子。这些变化产生了表达质粒pDHFR-P39X-AU和pAz-C112X-AU。
为了进一步减少可用于参与标准翻译的Ser-tRNASec库,将编码O-磷酸丝氨酰-tRNASec激酶的pstK基因添加到辅助质粒pRSF-eSelA而得到pRSF-eSelAK。先前已经报道,PSTK通过产生Sep-tRNASec而增高硒代半胱氨酸掺入tRNAUTu,该Sep-tRNASec是SelA的有效底物但是被大肠杆菌EF-Tu识别不良。同时,培养基中的硒浓度增高,且省略L-半胱氨酸以用于硒蛋白制备。
将包含pDHFR-P39X-AU和pRSF-eSelAK的RTΔA.2转化体在LB培养基中培养O/N,该培养基包含100μg/mL氨苄青霉素、50μg/mL卡那霉素和1μM Na
如前所述,培养包含pAz-C112X-AU和pRSF-eSelAK的RTΔA.2转化体,不同之处在于,添加20μM Na
按照上文关于天青蛋白所述,对包含pGPx-U49-AU和pRSF-eSelAK的RTΔA.2转化体进行培养。将细胞通过离心来收集,并且重新混悬在50mL的缓冲液(50mM磷酸钾、150mMNaCl、10%甘油、1mM DTT,pH 8.0)和1mg/mL溶菌酶中。将细胞通过超声波处理进行溶解并澄清,而后通过IMAC来回收GPx-1。将洗脱物浓缩,并用100mM磷酸缓冲液pH 8.0、0.1%Tween 20和1mM DTT进行透析,而后通过阴离子交换色谱(Q HP柱)来分离GPx-1。以500μg/L的产率和接近100%硒代半胱氨酸掺入效率生产GPx-1。
质谱法
通过利用前文所述的方法,对完整蛋白样品进行分析。通过利用10kDa分子量截止过滤器,将天青蛋白、DHFR和GPx-1样品缓冲液交换到LC-MS级水中。一旦缓冲液交换完成,就将样品在甲醇/水/甲酸(50/49/1)溶液中稀释至20μM。在稀释之后,将蛋白质溶液以3μL/min的速率经由电喷射离子化而注入Orbitrap Elite质谱仪(赛默飞世尔科技公司,不来梅,德国)中。为了确认硒代半胱氨酸的掺入,完整质量分析在240k分辨率和平均20次扫描下进行。对蛋白序列的表征是通过使用193nm受激准分子激光器(Coherent,Inc.)的紫外光解离(UVPD)来进行,该193nm受激准分子激光器连接至与前述Orbitrap质谱仪。对于每个UVPD光谱,使用两个2.5mJ的激光脉冲,并且对250次扫描进行平均。对MS1光谱通过利用Xtract反卷积算法(赛默飞世尔)进行反卷积。UVPD质谱通过利用Xtract进行反卷积,而后利用ProsightPC3.0进行分析。对于天青蛋白,通过将62.9216Da的修饰添加到112位的丝氨酸,或者对于DHFR,将61.9146Da的修饰添加到39位置的丝氨酸(因为当硒代半胱氨酸存在时形成了硒-巯基键,所以从DHFR修饰减去一个氢原子),对包含硒代半胱氨酸的蛋白质进行搜索。掺入效率是通过用修饰的蛋白质峰的面积、除以未修饰的蛋白质质峰和修饰的蛋白峰的总面积来计算的。每种蛋白质的峰面积是来自每个同位素簇的丰度最大的五个峰的积分面积的总和。
作为DNase I活性测定的部分的荧光标记的探针是通过扩增进行制备。扩增是在反应混合物中进行,该反应混合物包含质粒DNA、DNA聚合酶、扩增缓冲液、每种类型的脱氧核苷三磷酸(dNTP)和引物。该扩增是在以下条件下进行:在94℃下初始变性5分钟,94℃下1分钟35次循环、55℃下1分钟,以及72℃下1分钟,最终的延伸步骤在72℃下10分钟。将所得的PCR产物通过利用GeneJET PCR纯化盒(赛默飞世尔,沃尔瑟姆,MA)进行纯化。
DNase I的活性是通过将样品与荧光标记的PCR片段一起孵育,而后在应用生物系统(Applied Biosystems)3130基因分析仪(Genetic Analyzer)(应用生物系统公司(Applied Biosystems Corporation,Carlsbad),CA)上、通过毛细管电泳检测荧光标记的产物来测定。该测定是在反应混合物中进行,该反应混合物包含PCR产物和在盐水中10×稀释的样品。阴性对照仅包含标记的片段,而没有DNase I活性的来源。将该反应混合物在室温下孵育2分钟,其后该反应通过在75℃下孵育10分钟而被终止。该反应物是利用GeneJETPCR纯化盒(赛默飞世尔)来纯化。对每个样品进行片段分析。毛细管电泳是用POP-7聚合物(应用生物系统公司),利用G5染料组的默认基因型分型模块进行。利用基因图谱(GeneMapper)软件4.0版(应用生物系统公司)分析结果。样品的DNase活性表示为与不包含DNase的对照材料(其被赋值1(100%))相比信号强度的百分比差值。
将30ng硒基-DNase(GST–硒基-DNase I融合物)和等摩尔二硫键DNase(从牛胰腺纯化的野生型DNase I,西格玛DN25)在反应缓冲液(NEB B0303S)中在37℃下孵育2小时,该反应缓冲液添加有0mM DTT(-DTT)或50mM DTT(+DTT)。将50ng双链DNA加入该混合物,在37℃下酶切30min,随后在75℃下热灭活10min。二种酶都在0mM DTT中酶切该DNA,但是仅硒基-DNase在50mM DTT中酶切该DNA(图1)。
虽然在本文中已示出和描述了本发明的优选实施方案,但是对本领域技术人员而言显然地这种实施方案仅是作为示例而提供。在不脱离本发明的情况下,本领域技术人员将想到许多变型、改变和替代方案。应理解,本文中所述的本发明的实施方案的各种替代方案可以用于实施本发明。以下权利要求旨在界定本发明的范围并且由此覆盖这些权利要求及等同物范围内的方法和结构。
- 包括非标准氨基酸的组合物及其用途
- 含有非天然氨基酸和多肽的组合物、涉及非天然氨基酸和多肽的方法以及非天然氨基酸和多肽的用途
