癌症治疗
文献发布时间:2023-06-19 10:36:57
技术领域
本发明涉及癌症治疗领域。特别地,本发明涉及预防、治疗或抑制难治性(抗性)检查点抑制剂治疗的个体中的肿瘤和/或转移瘤的发展的方法。
背景技术
在患有晚期癌症的人类中,抗肿瘤免疫通常由于促炎和抗炎、免疫刺激和免疫抑制信号的严格调控的相互影响而无效。现在认为免疫系统不断监测和消除新转化的细胞。因此,癌细胞会改变其表型来应对免疫压力,从而逃避攻击(免疫编辑)并上调抑制性信号的表达。原发肿瘤和转移通过免疫编辑及其他破坏性程序维持其自身生存。抗瘤免疫破坏的主要机制之一是“T细胞耗竭”,其这是由于长期暴露于抗原引起的,其特征在于抑制性受体上调。这些抑制性受体起着检查点的作用,以防止不受控制的免疫反应。
PD-1和共抑制受体,例如细胞毒性T-淋巴细胞抗原4(CTLA-4)、B淋巴细胞和T淋巴细胞衰减剂(BTLA;CD272)、T细胞免疫球蛋白和粘蛋白结构域-3(TIM-3)、淋巴细胞激活基因-3(LAG-3;CD223)等等,常被称作检查点调控剂。它们作为分子“收费站”发挥作用,允许胞外信息指示细胞周期进程及其他胞内信号传导过程是否应该进行。
除了通过TCR的特异性抗原识别之外,T细胞激活还通过由共刺激受体所发出正信号与负信号之间的平衡来调节。这些表面蛋白通常是TNF受体或B7超家族的成员。针对激活性共刺激分子的激动性抗体和针对负性共刺激分子的阻抑性抗体会增强T细胞刺激,从而诱发肿瘤消解。
程序性细胞死亡蛋白1(PD-1或CD279),是一种55-kD的1型跨膜蛋白,是T细胞共刺激受体CD28家族中的一员,T细胞共刺激受体包括免疫球蛋白超家族成员CD28、CTLA-4、诱导性共刺激因子(ICOS)和BTLA。PD-1在活化的T细胞和B细胞上高表达。在记忆T细胞亚组上也可检到不同表达水平的PD-1表达。已鉴定了两种PD-1的特异性配体:程序性死亡配体1(PD-L1,亦称B7-H1或CD274)和PD-L2(亦称B7-DC或CD273)。已证明PD-L1和PD-L2在小鼠和人系统中结合PD-1后均下调T细胞激活(Okazaki et al.,Int Immunol.,2007;19:813-824)。PD-1与其在抗原呈递细胞(APC)和树突细胞(DC)上表达的配体PD-L1和PD-L2之间相互作用,传递负性调节刺激,从而下调活化的T细胞免疫应答。阻断PD-1能抑制这种负信号从而增强T细胞应答。
大量研究表明:癌症微环境操控着PD-L1-/PD-1信号传导通路;PD-L1表达的诱导与抗癌免疫应答的抑制相关,并由此容许癌症进展和转移。基于多种原因,PD-L1/PD-1信号传导通路是癌症免疫逃逸的主要机制。首先且最重要的是,该通路参与存在于外周中的活化T效应细胞的免疫应答的负调节。其次,癌症微环境中PD-L1被上调,而活化的肿瘤浸润性T细胞上PD-1也被上调,这因此可能加强了抑制作用的恶性循环。其三,该通路通过双向信号传导复杂地参与先天免疫和获得性免疫调节。这些因素使得PD-1/PD-L1复合物成为一个中心点,癌症可以通过该中心点操控免疫应答并促进其自身进展。
临床试验中被测试的第一个的免疫检查点抑制剂是伊匹单抗(ipilimumab)(Yervoy,Bristol-Myers Squibb),一种CTLA-4单抗(mAb)。抗CTLA-4单抗是强大的检查点抑制剂,其可从初始细胞和接触过抗原的细胞中消除“破坏(break)”。治疗增强了CD8+T细胞的抗肿瘤功能,提高了CD8+T细胞与Foxp3+调节性T细胞之比,抑制了调节性T细胞的抑制功能。抗CTLA-4单抗疗法的主要缺点是自身免疫毒性的产生。
TIM-3被鉴定为另一种由耗竭的CD8+T细胞表达的重要的抑制性受体。在小鼠癌症模型中,已经证明功能最失调的肿瘤浸润性CD8+T细胞实际上共表达PD-1和ΤIΜ-3。
LAG-3是最近鉴定的另一种抑制性受体,其作用是限制效应T细胞功能并增强调节性T细胞的抑制活性。最近发现,在小鼠中由肿瘤浸润性T细胞广泛共表达PD-1和LAG-3,并且,PD-1和LAG-3的联合阻断在小鼠癌症模型中激发强协同抗瘤免疫应答。
目前,针对PD-1及其配体PD-L1的拮抗剂单抗处于用于癌症治疗的研发的不同阶段,近期的人体试验显示在患有晚期疾病的癌症患者中结果喜人。
第一个进入I期临床试验的阻断B7-H1/PD-1通路的药剂是纳武利尤单抗(Nivolumab)(MDX-1106/BMS-936558/ONO-4538),一种由Bristol-Myers Squibb研发的全人lgG4抗PD-1单抗。
II期研究的结果表明,在患有BRAF野生型黑色素瘤的患者中,将纳武利尤单抗和伊匹单抗联合与单用伊匹单抗进行比较,联合治疗的客观缓解率为61%,单一治疗的客观缓解率为11%,完全缓解率分别为22%和0%的患者。在联合组中有54%的患者报告了3级或4级与治疗相关的不良事件,伊匹单抗组中有24%的患者报告了3级或4级与治疗相关的不良事件。在纳武利尤单抗组中有7.7%的患者发生了导致研究药物中止的任何级别的与治疗相关的不良事件,纳武利尤单抗-加-伊匹单抗组有36.4%的这种患者,伊匹单抗组中有14.8%的这种患者。
免疫检查点抑制剂治疗在黑色素瘤中尤其成功,目前对于黑色素瘤已获批准的治疗方法包括抗PD-1(纳武利尤单抗和派姆单抗(pembrolizumab))、抗CTLA-4(依匹单抗)和抗PD-1/CTLA-4联合治疗方案(纳武利尤单抗-伊匹单抗)。使用伊匹单抗(抗CTLA-4)治疗的黑色素瘤患者的长期生存数据表明,开始治疗后5-10年,有20%的患者显示出持续的持久疾病控制或应答的证据。使用派姆单抗(抗PD-1)治疗的黑色素瘤患者在3年时的缓解率为33%,最初有响应的患者中有70%-80%维持临床疗效。
一项III期研究显示,与单独使用伊匹单抗(2.9个月)相比,使用纳武利尤单抗和伊匹单抗(11.5个月;HR,0.42,P<0.001)治疗和单独使用纳武利尤单抗(6.9个月;HR,0.57,P<0.001)治疗的患者的中位PFS升高。在至少28个月的随访中,联合用药组或单独使用纳武利尤单抗组的中位OS尚未达到,而单独使用伊匹单抗则为20个月[HR:联合用药vs.伊匹单抗,0.55(P<0.0001);纳武利尤单抗vs.伊匹单抗,0.63(P<0.0001);参考16]。在联合用药组、纳武利尤单抗组和伊匹单抗组中,两年的OS率分别为64%、59%和45%。
这些临床试验的结果突显了免疫疗法对晚期转移性黑色素瘤患者的临床管理具有的重大影响。然而,尽管大约35%至60%的患者对基于抗PD-1的免疫疗法有RECIST(实体瘤疗效评价标准)疗效(完全缓解为10%–12%),但已显示40%至65%的患者一开始时RECIST疗效很小或没有疗效,并且有43%的响应者在3年内发展为后天性抗性。
通过对临床试验数据的分析,可以确定三大类患者-(1)最初响应并继续响应的患者(响应者)、(2)从未响应的患者(先天性抗性)和(3)最初响应但最终会导致疾病进展的患者(后天性抗性)。
因此,尽管在癌症免疫疗法中观察到了前所未有的持久缓解率,但大多数患者仍未从治疗中受益(原发性抗性),一些响应者在一段应答期后复发(后天性抗性)。几种常见的癌症类型显示出非常低的应答频率(乳腺癌、前列腺癌和结肠癌),甚至在同一患者内的不同肿瘤之间也发现了异质性应答。对检查点抑制剂治疗的先天性和后天性抗性的机制尚未完全了解,部分原因是对与检查点抑制剂治疗的临床疗效和长期获益相关的整套临床、分子和免疫学因素的不完全了解。此外,很少有免疫功能强大的临床前模型可以通过检查点抑制剂诱导肿瘤消退,从而限制了患者体内肿瘤-免疫相互作用多样性的再现能力。
对检查点抑制剂有原发性抗性的患者对初始治疗无响应。正在进行的研究表明,肿瘤细胞内源性因子和肿瘤细胞外源性因子均参与了抗性机制。
导致原发性或适应性抗性的因素包括:缺乏抗原突变、T细胞衰竭、缺乏足够或合适的肿瘤抗原呈递和/或加工、DC成熟受损、HLA表达丧失、几种信号传导通路(MAPK、PI3K、JAK、STAT、WNT、IFN)的改变、IDO诱导、CD73上调、PD-L1组成型表达、肿瘤内免疫细胞浸润(例如T细胞)受损、其他免疫抑制检查点(例如VISTA、LAG、TIM-3)的激活、代谢/炎性介质的激活、VEGF的过表达和免疫抑制细胞(例如肿瘤相关巨噬细胞(TAM)、调节性T细胞(Tregs)、骨髓来源的抑制性细胞(MDSC)等)的激活。
与后天性癌症抗性相关的其他因素包括靶抗原、HLA的丢失和干扰素信号传导的改变、以及T细胞功能的丧失或其上的表观遗传改变。
在临床前模型中已显示会影响检查点抑制剂功效的免疫抑制细胞类型包括Treg、MDSC、Th2 CD4
肿瘤组织中较高的Treg:Teffector细胞(Teff)比例与许多癌症的预后较差有关,包括卵巢癌、胰腺导管腺癌、肺癌、成胶质细胞瘤、非霍奇金淋巴瘤、黑色素瘤和其他恶性肿瘤。因此,对于其治疗不能增加Teff和/或耗尽Treg以增加Teff与Treg的比率的肿瘤,可能在治疗初期或在疾病复发背景期间(during the relapsed disease setting)对治疗有抗性。
因此,本发明的目的是提供一种用于在被鉴定为对检查点抑制剂治疗有抗性的患者中治疗癌症的联合疗法。该联合疗法包括无活性全细胞分枝杆菌和对检查点抑制剂的阻断,其中该疗法具有克服这种对检查点抑制剂治疗的先天性或后天性抗性的潜力。
发明内容
本发明提供了一种通过施用与无活性全细胞分枝杆菌协同作用的检查点抑制剂,在检查点抑制剂难治性患者中治疗和/或预防癌症和/或转移瘤的建立的有效方法。
在本发明的第一方面,提供了一种用于治疗、减少、抑制或控制检查点抑制剂难治性患者中一种或多种肿瘤的无活性全细胞分枝杆菌(Mycobacterium),其中所述检查点抑制剂难治性患者旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗。
在本发明的第二方面,提供了一种用于治疗、减少、抑制或控制检查点抑制剂难治性患者中一种或多种肿瘤的无活性全细胞分枝杆菌,其中所述检查点抑制剂难治性患者旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗,其中所述检查点抑制治疗包括施用一种或多种阻断剂,所述阻断剂选自针对CTLA-4、PD-1、PD-L1、PD-L2、B7-H3、B7-H4、B7-H6、A2AR、IDO、TIM-3、BTLA、VISTA、TIGIT、LAG-3、CD40、KIR、CEACAM1、GARP、PS、CSF1R、CD94/NKG2A、TDO、TNFR、DcR3及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体(probody)、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他的其抗原结合片段。
在本发明的第三方面,提供了一种用于治疗、减少、抑制或控制检查点抑制剂难治性患者中一种或多种肿瘤的无活性全细胞分枝杆菌,其中所述检查点抑制剂难治性患者旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗,并且进一步包括与分枝杆菌的施用同时、分别或顺序进行共刺激检查点治疗,其中所述共刺激检查点治疗包括施用一种或多种结合剂,所述结合剂选自针对CD27、CD28、CD40、CD122、CD137、OX40、GITR、ICOS及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他的其抗原结合片段。
在本发明的第四方面,提供了一种用于治疗、减少、抑制或控制检查点抑制剂难治性患者中一种或多种肿瘤的无活性全细胞分枝杆菌,其中所述检查点抑制剂难治性患者旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗,任选地进一步包括共刺激检查点治疗,并且进一步包括与分枝杆菌的施用和/或检查点抑制治疗和/或共刺激检查点治疗同时、分别或顺序施用一种或多种其他抗癌治疗或药剂,其中一种或多种其他抗癌治疗或药剂选自:过继细胞疗法、外科手术疗法、化学疗法、放射疗法、激素疗法、小分子疗法,例如二甲双胍,受体激酶抑制剂疗法、热疗、光疗、放射消融疗法、抗血管生成疗法、细胞因子疗法、冷冻疗法、生物疗法、HDAC抑制剂,例如OKI-179,BRAF抑制剂、MEK抑制剂、EGFR抑制剂、VEGF抑制剂、P13Kδ抑制剂、PARP抑制剂、mTOR抑制剂、低甲基化剂、溶瘤病毒、包括TLR2、TLR4、TLR7、TLR8或TLR9激动剂在内的TLR激动剂、或诸如MRx0518(4D Pharma)的TLR5激动剂、STING激动剂(包括MIW815和SYNB1891)和癌症疫苗,例如GVAX或CIMAvax。
在本发明的第五方面,提供了一种治疗、减少、抑制或控制检查点抑制剂难治性个体中的瘤形成、肿瘤或癌症的方法,其中所述方法包括同时、分别或顺序向个体施用:(i)一种或多种检查点抑制剂,其选自针对CTLA-4、PD-1、PD-L1、PD-L2、B7-H3、B7-H4、B7-H6、A2AR、IDO、TIM-3、BTLA、VISTA、TIGIT、LAG-3、CD40、KIR、CEACAM1、GARP、PS、CSF1R、CD94/NKG2A、TDO、TNFR、DcR3及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他的其抗原结合片段;和(ii)无活性全细胞分枝杆菌,其中相对于单独施用一种或多种检查点抑制剂或无活性全细胞分枝杆菌,所述方法导致增强的治疗效果,并且任选地其中所述方法包括施用亚治疗量的所述检查点抑制剂。
在本发明的第六方面,提供了一种治疗、减少、抑制或控制检查点抑制剂难治性个体中的瘤形成、肿瘤或癌症的方法,其中所述方法包括同时、分别或顺序向个体施用:(i)一种或多种检查点抑制剂,其选自针对CTLA-4、PD-1、PD-L1、PD-L2、B7-H3、B7-H4、B7-H6、A2AR、IDO、TIM-3、BTLA、VISTA、TIGIT、LAG-3、CD40、KIR、CEACAM1、GARP、PS、CSF1R、CD94/NKG2A、TDO、TNFR、DcR3及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他的其抗原结合片段;(ii)无活性全细胞分枝杆菌,和(iii)共刺激检查点治疗,其中所述共刺激检查点治疗包括施用一种或多种结合剂,所述结合剂选自针对CD27、CD28、CD40、CD122、CD137、OX40、GITR、ICOS及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他的其抗原结合片段,其中相对于单独施用一种或多种检查点抑制剂、共刺激检查点治疗或无活性全细胞分枝杆菌,所述方法导致增强的治疗效果。
在本发明的第七方面,提供了一种治疗、减少、抑制或控制检查点抑制剂难治性个体中的瘤形成、肿瘤或癌症的方法,其中所述方法包括同时、分别或顺序向个体施用:(i)一种或多种检查点抑制剂,其选自针对CTLA-4、PD-1、PD-L1、PD-L2、B7-H3、B7-H4、B7-H6、A2AR、IDO、TIM-3、BTLA、VISTA、TIGIT、LAG-3、CD40、KIR、CEACAM1、GARP、PS、CSF1R、CD94/NKG2A、TDO、TNFR、DcR3及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他的其抗原结合片段;(ii)无活性全细胞分枝杆菌,和(iii)施用一种或多种其他抗癌治疗或药剂,其选自:过继细胞疗法、外科手术疗法、化学疗法、放射疗法、激素疗法、小分子疗法,例如二甲双胍,受体激酶抑制剂疗法、热疗、光疗、放射消融疗法、抗血管生成疗法、细胞因子疗法、冷冻疗法、生物疗法、HDAC抑制剂,例如OKI-179,BRAF抑制剂、MEK抑制剂、EGFR抑制剂、VEGF抑制剂、P13Kδ抑制剂、PARP抑制剂、mTOR抑制剂、低甲基化剂、溶瘤病毒、包括TLR2、TLR4、TLR7、TLR8或TLR9激动剂在内的TLR激动剂、或诸如MRx0518(4D Pharma)的TLR5激动剂、STING激动剂(包括MIW815和SYNB1891)和癌症疫苗,例如GVAX或CIMAvax,其中相对于单独施用一种或多种检查点抑制剂、共刺激检查点治疗、一种或多种其他抗癌治疗或药物、或无活性全细胞分枝杆菌,所述方法导致增强的治疗效果。
附图说明
参考以下附图描述本发明,其中:
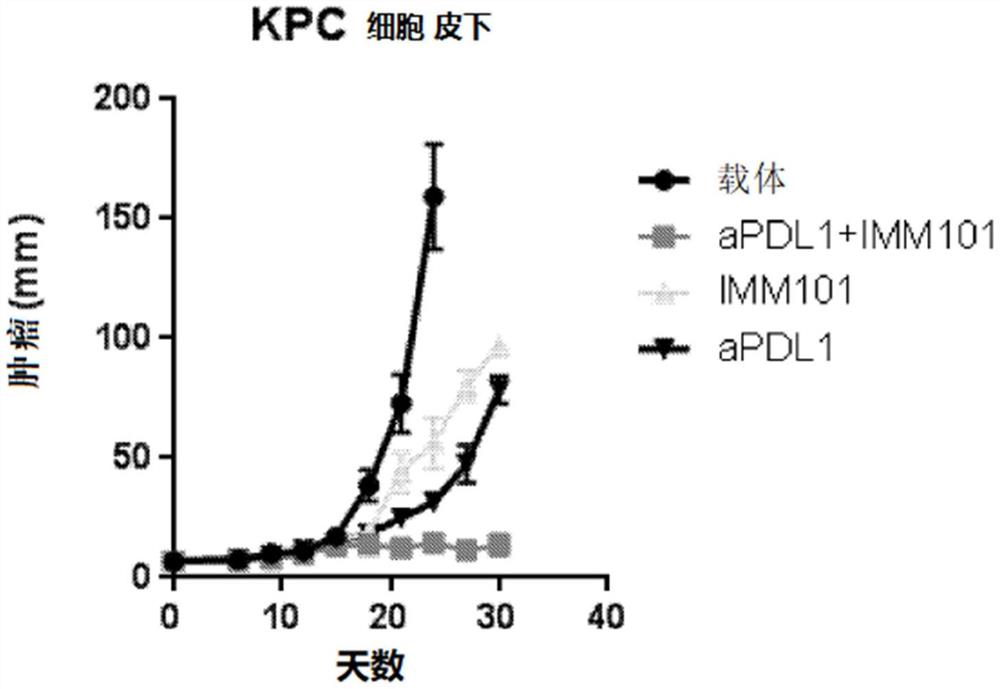
图1显示在胰腺癌异种移植模型(皮下注射KPC细胞)中,伴有或不伴有检查点抑制剂(抗-PD-L1单抗)共施用的热灭活的奥布分枝杆菌(Mycobacterium obuense)(NCTC13365)(IMM-101)制剂的效果。
图2显示如实施例3中详述的在同基因乳腺癌小鼠模型(皮下注射EMT-6细胞)中,伴有或不伴有检查点抑制剂(抗-PD-1单抗)共施用的热灭活的奥布分枝杆菌(NCTC 13365)(IMM-101)制剂的效果,其中该图展示了随时间的平均肿瘤体积+/-SE。
图3显示如实施例2中详述的在对照小鼠、仅接受抗CTLA-4治疗的小鼠或接受由IMM-101和抗CTLA-4组成的联合治疗的小鼠中,浸润B16F10肿瘤的CD3+CD8+细胞和FoxP3Treg细胞的比例。我们发现该组中的显著增加(Anova p<0.05)。下图显示在对照小鼠、仅接受抗PD-1治疗的小鼠或接受由IMM-101和抗PD-1组成的联合治疗的小鼠中,浸润肿瘤的CD3+CD8+细胞和FoxP3 Treg细胞的比例。
图4显示如实施例3中详述的研究了在使用EMT-6细胞系的乳腺癌小鼠模型中抗PD-1抗体或抗PD-1抗体与IMM-101的作用研究示意图。
图5显示如实施例3中详述的在使用EMT-6细胞系的乳腺癌小鼠模型中,载体、抗PD-1抗体或抗PD-1抗体与IMM-101的组合对肿瘤体积变化的影响。
图6显示如实施例3中详述的在使用EMT-6细胞系的乳腺癌小鼠模型中,施用载体、抗PD-1抗体或抗PD-1抗体与IMM-101后对CD8/Treg比例的影响。
图7显示如实施例3中详述的在使用EMT-6细胞系的乳腺癌小鼠模型中,施用载体、抗PD-1抗体或抗PD-1抗体与IMM-101后对INF-γ/IL-10比例的影响。
图8显示使用野生型(WT)和Batf-/-小鼠的研究示意图,以及在皮下注射IMM-101后,CD103+DC对WT和Batf-/-小鼠中INF-γ释放的影响的图形数据。
图9显示在检查点抗性的黑色素瘤(B16F10)的小鼠模型中,伴有或不伴有检查点抑制剂(抗PD-1单抗)共施用的肿瘤附近皮下施用热灭活的奥布分枝杆菌(NCTC 13365)(IMM-101)的制剂的效果,该图显示随时间推移对平均肿瘤体积+/-SE的影响。
图10与图9相同,但是其中该图显示对没有SE的平均肿瘤体积的影响(无误差线)。
图11与图9相同,但是其中该图显示直至研究第16天对平均肿瘤体积+/-SE的影响。
图12与图9相同,但是其中该图显示对中位肿瘤体积的影响。
图13与图9相同,但是其中该图显示直至研究第16天对中位肿瘤体积的影响。
图14与图9相同,但是其中该图为卡普兰-梅尔分析(Kaplan-Meier)生存图。
图15显示在检查点抗性的胰腺癌(Pan02)的小鼠模型中,伴有或不伴有检查点抑制剂(抗PD-1单抗)共施用的肿瘤附近皮下施用热灭活的奥布分枝杆菌(NCTC 13365)(IMM-101)的制剂的效果,其中该图显示随时间推移对平均肿瘤体积+/-SE的影响。
图16与图15相同,但是其中该图显示对没有SE的平均肿瘤体积的影响(无误差线)。
图17与图15相同,但是其中该图显示直至研究第37天对平均肿瘤体积+/-SE的影响。
图18与图15相同,但是其中该图显示对中位肿瘤体积的影响。
图19与图15相同,但是其中该图显示直到研究第37天对中位肿瘤体积的影响。
发明详述
本发明提供了一种治疗、减少、抑制或控制检查点难治性个体中瘤形成、肿瘤或癌症的方法,该方法包括施用无活性全细胞分枝杆菌和一种或多种检查点抑制剂。基于令人惊讶的发现,在检查点抑制剂抗性的动物模型中,全细胞热灭活的分枝杆菌与抗PD-L1抗体(检查点抑制剂)的联合施用可产生协同的抗肿瘤活性和/或比单独使用分枝杆菌或抗PD-L1抗体更有效的抗肿瘤活性。此外,在许多具有不同癌细胞系的动物模型中,分枝杆菌的治疗已显示可改善细胞毒性T淋巴细胞的活性。据信这种改善的活性有助于减少对检查点抑制剂治疗的先天性和/或原发性或适应性抗性。
因此,尽管本领域已知一些组合疗法可逆转或降低先天性和/或原发性或适应性抗性,但是本文公开的本发明提供了组合疗法,其被优化以改善治疗效果,并因此在更大比例的检查点难治性患者中发生应答。
为了可以更容易地理解本发明,首先定义某些术语。在整个详细描述中阐述了附加定义。
“检查点抑制剂”是一种作用于作为TNF受体或B7超家族成员的表面蛋白的试剂,包括与负共刺激(共抑制)分子结合的试剂,负共刺激(共抑制)分子选自CTLA-4、PD-1、PD-L1、PD-L2、B7-H3、B7-H4、B7-H6、A2AR、IDO、TIM-3、BTLA、VISTA、TIGIT、LAG-3、CD40、KIR、CEACAM1、GARP、PS、CSF1R、CD94/NKG2A、TDO、TNFR、DcR3和/或它们各自的配体,包括PD-L1。“阻断剂”是与上述负共刺激分子和/或它们各自的配体结合的试剂。“检查点抑制剂”和“阻断剂”在全文中可互换使用。
根据本发明定义的无活性全细胞分枝杆菌是一种刺激先天免疫和1型免疫的成分,先天免疫和1型免疫包括Th1和巨噬细胞激活/极化和细胞毒性细胞活性,以及通过免疫调节机制独立下调不适当的抗Th2应答。
术语“肿瘤”、“癌症”和“瘤形成(neoplasia)”可互换使用,是指其生长、增殖或存活大于正常对应细胞的生长、增殖或存活的细胞或细胞群,例如细胞增殖性或分化性疾病。通常,增长不受控制。术语“恶性”是指侵袭附近组织。术语“转移”是指肿瘤、癌症或瘤形成向个体内其他部位、位置或区域的扩散或散布,其中所述部位、位置或区域与原发性肿瘤或癌症不同。
术语“程序性死亡1”、“程序性细胞死亡1”、“蛋白质PD-1”、“PD-1”和“PD1”可互换使用,并且包括人PD-1的变体、同工型、物种同源物以及与PD-1具有至少一个共同表位的类似物。
术语“OX40”、“CD137”和“OX-40”可互换使用,并且包括人OX40的变体、同工型、物种同源物、以及与OX40具有至少一个共同表位的类似物。
术语“GITR”和“糖皮质激素诱导的TNFR家族相关基因”可互换使用,并且包括人GITR的变体、同工型、物种同源物以及与GITR具有至少一个共同表位的类似物。
术语“CD137”和“4-1BB”可互换使用,并且包括人CD137的变体、同工型、物种同源物以及与CD137具有至少一个共同表位的类似物。
术语“B7-H3”和“CD276”可互换使用,并且包括人B7-H3的变体、同工型、物种同源物以及与B7-H3具有至少一个共同表位的类似物。
术语“B7-H4”和“VTCN1”可互换使用,并且包括人B7-H4的变体、同工型、物种同源物以及与B7-H4具有至少一个共同表位的类似物。
术语“A2AR”和“腺苷A2A受体”可互换使用,并且包括人A2AR的变体、同工型、物种同源物以及与A2AR具有至少一个共同表位的类似物。
术语“IDO”和“吲哚胺2,3-双加氧酶”可互换使用,并且包括人IDO的变体、同工型、物种同源物以及与IDO具有至少一个共同表位的类似物。
术语“细胞毒性T淋巴细胞相关抗原-4”、“CTLA-4”、“CTLA4”和“CTLA-4抗原”可互换使用,并且包括人CTLA-4的变体、同工型、物种同源物以及与CTLA-4具有至少一个共同表位的类似物。
如本文所用,“亚治疗量”是指当单独施用用于治疗癌症时,比治疗性化合物的常规或典型剂量更低或治疗持续时间更短的治疗性化合物(例如抗体)的剂量或治疗持续时间。已知的治疗性合物的典型剂量是本领域技术人员已知的,或者可以通过常规实验工作确定。
术语“治疗有效量”定义为检查点抑制剂与无活性全细胞分枝杆菌组合的量,其优选带来癌症疾病症状的严重程度降低、无癌症疾病症状期的频率和持续时间增加、或预防疾病折磨造成的损害或残疾。术语“有效量”或“药学上有效量”是指足以提供所期望的生物学或治疗结果的药剂的量。该结果可以是癌症的征象、症状或原因中的一种或多种的减少、改善、缓解、减轻、延迟和/或缓和,或生物系统的任何其他所期望的改变。就癌症而言,有效量可以包含足以引起肿瘤缩小和/或降低肿瘤生长速率(例如抑制肿瘤生长)或预防或延缓其它不想要的细胞增殖的量。在一些实施方案中,有效量是足以延迟癌症或肿瘤的发展、或延长存活或诱导癌症或肿瘤稳定的量。优选地,如RECIST 1.1所定义,通过一种或多种所述肿瘤的肿瘤尺寸的减小或稳定来测量治疗效果,包括目标肿瘤的疾病稳定(SD)、完全缓解(CR)或部分缓解(PR);和/或一种或多种非目标肿瘤的疾病稳定(SD)或完全缓解(CR)。
在一些实施方案中,治疗有效量是足以预防或延迟复发的量。治疗有效量可以在一次或多次施用中给予。治疗有效量的药物或组合可带来以下的一种或多种:(i)减少癌细胞的数量;(ii)减小肿瘤尺寸;(iii)在一定程度上抑制、延迟、减慢并优选阻止癌细胞浸润到外周器官中;(iv)抑制(即减慢至一定程度并且优选阻止)肿瘤转移;(v)抑制肿瘤生长;(vi)预防或延迟肿瘤的发生和/或复发;和/或(vii)在一定程度上减轻与癌症相关的一种或多种症状。例如,为了治疗肿瘤,“治疗有效量”可相对于基线测量结果诱导肿瘤缩小至少约5%,例如至少约10%、或约20%、或约60%或更多。基线测量结果可来自未经治疗的个体。
治疗有效量的治疗性化合物可以在个体中减小肿瘤尺寸、或者减轻症状。本领域普通技术人员将能够基于例如个体的身体尺寸、个体症状的严重程度以及所选择的特定组合物或施用途径等因素来确定这样的量。
术语“免疫应答”是指例如淋巴细胞、抗原呈递细胞、吞噬细胞、粒细胞和由上述细胞或肝脏产生的可溶性大分子(包括抗体、细胞因子和补体)的作用,所述作用导致癌细胞的选择性损伤、破坏或从人体清除。
本文使用的术语“抗体”包括完整抗体及其任何抗原结合片段(即“抗原结合部分”)或单链。
本文使用的术语抗体的“抗原结合部分”(或简称为“抗体部分”)是指保留特异性结合至受体及其配体(例如PD-1)的能力的抗体的一个或多个片段,其包括:(i)Fab片段、(ii)F(ab')2片段、(iii)由VH和CHI结构域组成的Fd片段、(iv)Fv片段、(v)由VH结构域组成的dAb片段、和(vi)分离的互补决定区(CDR)。单链抗体也意图包括在术语抗体的“抗原结合部分”内。使用本领域技术人员已知的常规技术获得这些抗体片段,并且以与完整抗体相同的方式进行片段的实用性筛选。
本文使用的术语“单克隆抗体”或“单克隆抗体组合物”是指单分子组合物的抗体分子的制品。单克隆抗体组合物对特定表位呈现出单一的结合特异性和亲和力。
本文使用的术语“人抗体”旨在包括具有可变区的抗体,其中框架区和CDR区均源自人种系免疫球蛋白序列。
术语“人源化抗体”旨在指其中来源于另一种哺乳动物物种(例如小鼠)的种系的CDR序列已被移植到人框架序列上的抗体。可在人框架序列内进行另外的框架区修饰。
除了抗体之外,其他生物分子也可用作检查点抑制剂,包括对适当靶标具有结合亲和力的肽。
术语“治疗(treatment)”或“治疗(therapy)”是指以治愈、痊愈、减轻、缓解、改变、补救、缓和、改善或影响病症(例如疾病)、病症的症状,或预防或延迟疾病的症状、并发症、生化征象的发作,或者以统计学上显著的方式阻止或抑制疾病、病症或障碍的进一步发展为目的施用活性剂。
本文使用的术语“个体”旨在包括人类和非人类动物。优选的个体包括需要增强免疫应答的人类患者。所述方法特别适用于治疗具有可通过增强T细胞介导的免疫应答来治疗的障碍的人类患者。在一个具体的实施方案中,所述方法特别适合于在体内治疗癌细胞。
如本文所用,术语“检查点抑制剂难治性患者”是指被鉴定为对检查点抑制剂治疗无应答的患者。难治性患者可能表现出对检查点抑制剂治疗的先天性(原发性)抗性。自第一剂起持续至少约8周或12周,对所述检查点抑制剂治疗无应答或应答不足可证明先天性抗性。难治性患者可能表现出对检查点抑制剂治疗的后天性(继发性)抗性。后天性抗性可以通过对所述检查点治疗的初始应答但是一种或多种肿瘤随后复发和发展来证明。检查点抑制剂难治性患者可以对任何检查点抑制剂无应答,非限制性实例包括CTLA-4、PD-1、PD-L1、PD-L2、B7-H3、B7-H4、B7-H6、A2AR、IDO、TIM-3、BTLA、VISTA、LAG-3抑制剂或它们的组合。
如本文所用,术语“并行施用”或“并行”或“同时”是指施用在同一天进行。术语“顺序施用”或“顺序”或“分别”是指施用在不同的日子进行。
如本文所定义,“同时”施用包括彼此之间的间隔约为2小时或1小时以下施用无活性全细胞分枝杆菌和包括检查点抑制剂治疗和/或共刺激检查点治疗和/或一种或多种其他抗癌治疗或药剂的药剂或程序。优选地,“同时”施用是指其中同时施用无活性全细胞分枝杆菌和包括检查点抑制剂治疗和/或共刺激检查点治疗和/或一种或多种其他抗癌治疗或药剂的药剂或程序。
如本文所定义,“分别”施用包括施用无活性全细胞分枝杆菌和包括检查点抑制剂治疗和/或共刺激检查点治疗和/或一种或多种其他抗癌治疗或药剂的药剂或程序相隔超过约12小时、或约8小时、或约6小时或约4小时或约2小时。
如本文所定义,“顺序”施用包括施用无活性全细胞分枝杆菌和包括检查点抑制剂治疗和/或共刺激检查点治疗和/或一种或多种其他抗癌治疗或药剂的药剂或程序,每种多份和/或多剂次和/或非同一场合。无活性全细胞分枝杆菌可以在施用检查点抑制剂和/或共刺激检查点治疗和/或一种或多种其他抗癌治疗或药剂之前和/或之后施用至患者。或者,在检查点抑制剂治疗和/或共刺激检查点治疗和/或一种或多种其他抗癌治疗或药剂治疗之后,将无活性全细胞分枝杆菌继续施用于患者。
替代方案(例如“或”)的使用应理解为意指这些替代方案中的任一个、两个或它们的任何组合。本文使用的不定冠词“一种”或“一个”应理解为是指任何记载或列举的组分中的“一个或多个”。
如本文所使用的,“约”意指在由本领域普通技术人员确定的特定值的可接受误差范围内,其将部分取决于如何测量或确定该值,即测量系统的限制。例如,“约”可意指本领域的每次操作在1个或多于1个标准偏差内。或者,“约”可意指最高达20%的范围。当在本申请和权利要求中提供特定值时,除非另有说明,“约”的含义应被假定为在该特定值的可接受误差范围内。
牝牛分枝杆菌(M.vaccae)和奥布分枝杆菌已显示在宿主中诱导复杂的免疫应答。用这些制剂治疗将刺激先天免疫和1型免疫,包括Th1和巨噬细胞活化以及细胞毒性细胞活性。它们还通过免疫调节机制独立下调不合适的Th2应答。在小鼠和人免疫细胞的实验中已经表明,IMM-101(无活性全细胞奥布分枝杆菌)是呈递抗原巨噬细胞和树突状细胞(DC)的强激活剂,并且DC激活会导致典型的1型免疫应答,伴随着其中存在IMM-101激活的DC的淋巴结中,CD4+T-helper 1淋巴细胞(Th1)和CD8+细胞毒性T淋巴细胞(CTL)的形成和激活、以及细胞因子干扰素-γ(IFN-γ)的产生增加。
此外,其他实验表明,IMM-101还增加了自然杀伤细胞(NK)和表达γ/δ受体的T细胞(γδ-T细胞)的数量和激活。Th1和CTL需要肿瘤细胞表达特定的肿瘤相关抗原(TAA)以进行攻击,而NK细胞和γδ-T细胞不需要这种TAA即可杀死肿瘤细胞。这四种不同的免疫细胞协同工作,以形成有效的抗肿瘤应答。关于癌症,产生IFN-γ的CTL的形成很可能是IMM-101治疗的最重要结果,因为在胰腺癌模型中观察到的IMM-101的抗肿瘤作用可以由于CD8+T细胞的耗尽而完全消除。
IMM-101激活巨噬细胞的能力不仅可以通过释放促炎性巨噬细胞衍生的细胞因子(例如将DC扭转(skew)为1型免疫应答所需的IL-12)来协助DC的激活,而且对于将肿瘤相关的免疫抑制2型巨噬细胞改变为侵袭性的肿瘤1型巨噬细胞可能也很重要。对于类似的热灭活分枝杆菌M.indicus pranii,显示了后者的特征。
IMM-101的一个重要特征是其能够激活DC并使之成熟为树突状细胞亚类,即cDC1(即1型免疫应答所需的DC)。已经显示,激活足够数量的cDC1是CPI生效的先决条件。
人们普遍认为,导致产生INF-γ的特异性攻击表达TAA的肿瘤细胞的Th1和CTL以及通过其他机制攻击肿瘤的激活的NK细胞和γδ-T细胞的1型免疫应答是人体的有效的抗癌应答的主要机制和先决条件,因此应该是任何免疫介导的癌症治疗的核心-临床前数据表明,IMM-101能够刺激此类所需的1型免疫应答。
已经在体外研究了IMM-101对DC启动的影响,并且发现IMM-101表现出剂量依赖性的能力来诱导人和鼠DC的表型活化和细胞因子产生。例如,GM-CSF衍生的鼠DC对IMM-101表现出剂量依赖性,CD80、CD86、CD40和MHC II的膜表达升高,而IL-6、IL-12p40和一氧化氮的产生均增加,这些都是对T细胞有效的抗原依赖性激活必不可少的分子。此外,人单核细胞衍生的DC对IMM-101表现出相似的反应,其中CD80、CD86和MHC II上调,并分泌多种相关的细胞因子,表明DC的激活明显。体外暴露于IMM-101还表明,IMM-101通过增强其DC加工和呈递抗原的能力在功能上影响DC。
体内实验表明,IMM-101(体外)激活的GM-CSF衍生的鼠DC皮下过继转移至幼稚的受体小鼠7天后,IMM-101激活的DC能够激活CD8+和CD4+T细胞并促进IFN-γ的分泌,这是通过再刺激引流的淋巴结细胞制剂进行的。
本文公开,已在动物模型中使用三种不同的癌细胞系(乳腺癌、胰腺癌和检查点抗性型黑色素瘤B16F10)研究了几种不同检查点抑制剂(CPI)与无活性全细胞分枝杆菌(IMM-101)的组合。在这些实验中,仅CPI(或IMM-101)治疗在控制原发性肿瘤生长方面的有效性仅中等至差,但是CPI与IMM-101的组合在乳腺癌中显示出阳性趋势,并且在减少胰腺癌的肿瘤体积方面非常有效。在乳腺肿瘤和黑色素瘤中发现CD8+/Treg比率增加。在乳腺癌模型的脾脏中还发现IFN-γ/IL-10(IL-10是由Treg产生的细胞因子)比率增加。这些增加的比率高度暗示了CTL活性的改善和免疫抑制活性的降低,这有望导致减少或抑制对人或动物个体中的检查点抑制剂治疗的原发性和/或继发性抗性。
在本发明的一方面,所述无活性全细胞分枝杆菌包括全细胞的非致病性的热灭活的分枝杆菌。用于本发明的分枝杆菌物种的实例包括牝牛分枝杆菌(M.vaccae)、抗热分枝杆菌(M.thermoresistibile)、微黄分枝杆菌(M.flavescens)、杜氏分枝杆菌(M.duvalii)、草分枝杆菌(M.phlei)、奥布分枝杆菌(M.obuense)、副偶然分枝杆菌(M.parafortuitum)、泥炭藓分枝杆菌(M.sphagni)、爱知分枝杆菌(M.aichiense)、罗得西亚分枝杆菌(M.rhodesiae)、新金色分枝杆菌(M.neoaurum)、楚布分枝杆菌(M.chubuense)、东海分枝杆菌(M.tokaiense)、科莫斯分枝杆菌(M.komossense)、金色分枝杆菌(M.aurum)、M.w、结核分枝杆菌(M.tuberculosis)、田鼠分枝杆菌(M.microti)、非洲分枝杆菌(M.africanum)、堪萨斯分枝杆菌(M.kansasii)、海分枝杆菌(M.marinum)、猿分枝杆菌(M.simiae)、胃分枝杆菌(M.gastri)、无色分枝杆菌(M.nonchromogenicum)、土分枝杆菌(M.terrae)、次要分枝杆菌(M.triviale)、戈登分枝杆菌(M.gordonae)、瘰疬分枝杆菌(M.scrofulaceum)、石蜡分枝杆菌(M.paraffinicum)、胞内分枝杆菌(M.intracellulare)、鸟型分枝杆菌(M.avium)、蟾分枝杆菌(M.xenopi)、溃疡分枝杆菌(M.ulcerans)、迪氏分枝杆菌(M.diernhoferi)、耻垢分枝杆菌(M.smegmatis)、蛇分枝杆菌(M.thamnopheos)、微黄分枝杆菌、偶发分枝杆菌(M.fortuitum)、外来分枝杆菌(M.peregrinum)、龟分枝杆菌(M.chelonei)、副结核分枝杆菌(M.paratuberculosis)、麻风分枝杆菌(M.leprae)、鼠麻风分枝杆菌(M.lepraemurium)及它们的组合。
无活性全细胞分枝杆菌优选地选自:牝牛分枝杆菌,奥布分枝杆菌,副偶然分枝杆菌,金色分枝杆菌,M.indicus pranii、草分枝杆菌及它们的组合。更优选地,无活性全细胞分枝杆菌是未经加工(rough)的变体。
施用至患者的分枝杆菌的量足以在患者中引起保护性免疫应答,使得患者的免疫系统能够对癌症或肿瘤产生有效的免疫应答。在本发明的某些实施方案中,提供了一种容纳装置,其包含用于本发明的有效量的分枝杆菌,其通常可以是10
特别优选M.indicus pranii、牝牛分枝杆菌和奥布分枝杆菌。
本发明可用于治疗瘤性疾病,例如实体或非实体癌症。本文使用的“治疗”包括预防、减少、控制和/或抑制瘤性疾病。这些疾病包括肉瘤、恶性上皮肿瘤(carcinoma)、腺癌、黑色素瘤、骨髓瘤、胚细胞瘤、神经胶质瘤、淋巴瘤或白血病。示例性的癌症包括例如恶性上皮肿瘤、肉瘤、腺癌、黑色素瘤、神经(胚细胞瘤、神经胶质瘤)、间皮瘤和网状内皮、淋巴或造血系统瘤性疾病(例如骨髓瘤、淋巴瘤或白血病)。在特定方面,瘤形成、肿瘤或癌症包括肺腺癌、肺癌、弥漫性或间质性胃癌、结肠腺癌、前列腺腺癌、食管癌、乳腺癌、胰腺癌、卵巢腺癌、肾上腺腺癌、子宫内膜腺癌或子宫腺癌。
瘤形成、肿瘤和癌症包括良性、恶性、转移性和非转移性类型,包括瘤形成、肿瘤或癌症的任何阶段(I、II、III、IV或V)或等级(G1、G2、G3等),或正在进展、恶化、稳定或缓解中的瘤形成、肿瘤、癌症或转移灶。可根据本发明治疗的癌症包括但不限于:膀胱癌、血液癌、骨骼癌、骨髓癌、脑癌、乳腺癌、结肠癌、食道癌、胃肠道癌、齿龈癌、头癌、肾癌、肝癌、肺癌、鼻咽癌、颈癌、卵巢癌、前列腺癌、皮肤癌、胃癌、睾丸癌、舌癌或子宫癌。另外,所述癌症可以具体地为以下组织学类型,尽管不限于以下类型:瘤、恶性肿瘤、未分化癌、巨细胞和梭形细胞癌、小细胞癌、乳头状癌、鳞状细胞癌、淋巴上皮癌、基底细胞癌、毛母质癌(pilomatrixcarcinoma)、移行细胞癌、乳头状移行细胞癌、腺癌、胃泌素瘤、恶性胆管癌、肝细胞癌、合并肝细胞癌和胆管癌、小梁腺癌、腺样囊性癌、腺瘤息肉中的腺癌、腺癌、家族性息肉病、实体癌、类癌、恶性细支气管肺泡腺癌(malignant bronchiolo-alveolar adenocarcinoma)、乳头状腺癌、嫌色细胞癌(chromophobe carcinoma)、嗜酸细胞癌、嗜氧腺癌、嗜碱细胞癌、透明细胞腺癌、颗粒细胞癌、滤泡腺癌、乳头状和滤泡腺癌、非包膜硬化性癌(nonencapsulating sclerosing carcinoma)、肾上腺皮质癌、子宫内膜样癌(endometroidcarcinoma)、皮肤附件癌、大汗腺癌(apocrine adenocarcinoma)、皮脂腺癌、耵聍腺腺癌(ceruminous adenocarcinoma)、粘液表皮样癌、囊腺癌(cystadenocarcinoma)、乳头状囊腺癌、乳头状浆液性囊腺癌、粘液性囊腺癌、粘液腺癌、印戒细胞癌、浸润性导管癌、髓样癌、小叶癌、炎性癌、佩吉特氏病、乳腺、腺泡细胞癌、腺鳞癌、adenocarcinoma with squamousmetaplasia、胸腺瘤、恶性卵巢间质瘤、恶性卵泡膜瘤、恶性颗粒细胞瘤、恶性男性细胞瘤、恶性支持细胞癌、睾丸间质细胞瘤、恶性脂质细胞瘤、恶性副神经节瘤、恶性乳腺外副神经节瘤(malignant extra-mammary paraganglioma)、恶性嗜铬细胞瘤、血管球肉瘤、恶性黑色素瘤、无黑素性黑素瘤、浅表扩散性黑色素瘤、色素沉着痣中的恶性黑色素瘤、转移性黑色素瘤、恶性雀斑样痣、恶性雀斑样痣黑色素瘤、结节性黑色素瘤、肢端雀斑样黑色素瘤、结缔组织增生性黑色素瘤、上皮样细胞黑色素瘤、蓝色痣、恶性肉瘤、纤维肉瘤、纤维组织细胞瘤、恶性粘液肉瘤、脂肪肉瘤、平滑肌肉瘤、横纹肌肉瘤、胚胎性横纹肌肉瘤、肺泡横纹肌肉瘤、基质肉瘤、混合肿瘤、苗勒管混合瘤、肾母细胞瘤、肝母细胞瘤、癌肉瘤、间质瘤、恶性布伦纳瘤(malignant Brenner tumour)、恶性叶状肿瘤、恶性滑膜肉瘤、间皮瘤、恶性无性细胞瘤、胚胎性癌、畸胎瘤、恶性卵巢甲状腺瘤、恶性绒毛膜癌、中肾瘤、恶性血管肉瘤、血管内皮细胞瘤、恶性卡波西肉瘤、血管外皮细胞瘤、恶性淋巴管肉瘤、骨肉瘤、皮质旁成骨肉瘤、软骨肉瘤、软骨母细胞瘤、恶性间质软骨肉瘤、骨巨细胞瘤、尤因氏肉瘤、牙源性纤维瘤、恶性成釉细胞牙肉瘤、成釉细胞瘤、恶性成釉细胞纤维肉瘤、松果体瘤、恶性脊索瘤、胶质瘤、恶性室管膜瘤、星形细胞瘤、原浆性星形细胞瘤、纤维性星形细胞瘤、星形母细胞瘤、胶质母细胞瘤、少突胶质细胞瘤、成少突神经胶质细胞瘤、原始神经外胚层、小脑肉瘤、节细胞神经母细胞瘤、成神经细胞瘤、视网膜母细胞瘤、嗅觉神经源性肿瘤、脑膜瘤、恶性神经纤维肉瘤、神经鞘瘤、恶性颗粒细胞瘤、恶性淋巴瘤、霍奇金淋巴瘤、霍奇金副肉芽肿、恶性淋巴瘤、小淋巴细胞恶性淋巴瘤、大细胞弥漫性淋巴瘤、恶性淋巴瘤、滤泡、蕈样真菌病、其他指定的非霍奇金淋巴瘤、恶性组织细胞增生症、多发性骨髓瘤、肥大细胞肉瘤、免疫增生性小肠疾病、白血病、淋巴性白血病、浆细胞白血病、红白血病、淋巴肉瘤细胞白血病、髓细胞性白血病、嗜碱性粒细胞白血病、嗜酸性粒细胞白血病、单核细胞性白血病、肥大细胞白血病、巨核细胞白血病、髓样肉瘤和毛细胞白血病。优选地,所述癌症选自前列腺癌、肝癌、肾癌、肺癌、乳腺癌、结直肠癌、胰腺癌、脑癌、肝细胞癌、淋巴瘤、白血病、胃癌、宫颈癌、卵巢癌、甲状腺癌、黑色素瘤、头颈癌、皮肤癌和软组织肉瘤和/或其他形式的癌症。肿瘤可以是转移性或恶性肿瘤。
更优选地,癌症是胰腺癌、结直肠癌、前列腺癌、皮肤癌、卵巢癌或肺癌。
在本发明的一个实施方案中,提供了一种用于治疗、减少、抑制或控制检查点抑制剂难治性患者中一种或多种肿瘤的无活性全细胞分枝杆菌,其中所述检查点抑制剂难治性患者旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗。
在本发明的一个实施方案中,提供了一种用于治疗、减少、抑制或控制检查点抑制剂难治性患者中一种或多种肿瘤的无活性全细胞分枝杆菌,其中所述检查点抑制剂难治性患者旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗,其中所述检查点抑制治疗包括施用一种或多种阻断剂,所述阻断剂选自针对CTLA-4、PD-1、PD-L1、PD-L2、B7-H3、B7-H4、B7-H6、A2AR、IDO、TIM-3、BTLA、VISTA、TIGIT、LAG-3、CD40、KIR、CEACAM1、GARP、PS、CSF1R、CD94/NKG2A、TDO、TNFR、DcR3及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他的其抗原结合片段。
在本发明的一个实施方案中,检查点抑制治疗包括施用亚治疗量和/或持续时间的所述一种或多种阻断剂。
在本发明的一个实施方案中,一种或多种阻断剂选自伊匹单抗(ipilimumab),纳武利尤单抗(nivolumab),派姆单抗(pembrolizumab),azetolizumab,度伐利尤单抗(durvalumab),曲美木单抗(tremelimumab),斯巴达珠单抗(spartalizumab),阿维鲁单抗(avelumab),信迪利单抗(sintilimab),特瑞普利单抗(toripalimab)、MGA012、MGD013、MGD019、恩比利珠单抗(enoblituzumab)、MGD009、MGC018、MEDI0680、PDR001、FAZ053、TSR022、MBG453、relatlinab(BMS986016)、LAG525、IMP321、REGN2810(西米普利单抗(cemiplimab))、REGN3767、培西达替尼(pexidartinib)、LY3022855、FPA008、BLZ945、GDC0919、艾帕斯塔(epacadostat)、indoximid、BMS986205、CPI-444、MEDI9447、PBF509、利瑞路单抗(lirilumab)及它们的组合。
在本发明的一个实施方案中,一种或多种阻断剂优选为伊匹单抗和/或纳武利尤单抗。
在本发明的一个实施方案中,检查点抑制剂治疗包括与无活性全细胞分枝杆菌联合施用一种或多种阻断剂,该阻断剂选自针对CTLA-4、PD-1、PD-L1、PD-L2、B7-H3、B7-H4、B7-H6、A2AR、IDO、TIM-3、BTLA、VISTA、TIGIT、LAG-3、CD40、KIR、CEACAM1、GARP、PS、CSF1R、CD94/NKG2A、TDO、TNFR、DcR3及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他抗原结合片段,以减少或抑制原发性肿瘤或癌症转移至其他部位、或在远离原发性肿瘤或癌症的其他部位形成或建立转移性肿瘤或癌症,从而抑制或减少肿瘤或癌症的复发或肿瘤或癌症的进展,优选在检查点抑制剂难治性患者中施用。
在本发明的一个实施方案中,提供了一种用于治疗、减少、抑制或控制检查点抑制剂难治性患者中一种或多种肿瘤的无活性全细胞分枝杆菌,其中所述检查点抑制剂难治性患者旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗,其中所述检查点抑制治疗包括施用一种或多种阻断剂,所述阻断剂选自针对CTLA-4、PD-1、PD-L1、PD-L2、B7-H3、B7-H4、B7-H6、A2AR、IDO、TIM-3、BTLA、VISTA、TIGIT、LAG-3、CD40、KIR、CEACAM1、GARP、PS、CSF1R、CD94/NKG2A、TDO、TNFR、DcR3及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他抗原结合片段,与单独的任何一种疗法相比,具有引发强效和持久性免疫应答的潜力,具有增强的治疗益处,优选通过减少或稳定一种或多种所述肿瘤(如RECIST 1.1所定义)的肿瘤尺寸来测量,包括目标肿瘤的完全缓解(CR)或部分缓解(PR);和/或一种或多种非目标肿瘤的疾病稳定(SD)或完全缓解(CR)。
在本发明的一个实施方案中,提供了一种无活性全细胞分枝杆菌,其用于制造用于治疗检查点抑制剂难治性患者的癌症的药物,其中所述检查点抑制剂难治性患者旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗。
在本发明的另一个实施方案中,提供了一种用于在检查点抑制剂难治性患者中治疗癌症的联合疗法,其包括无活性全细胞分枝杆菌,所述分枝杆菌:(i)刺激先天性免疫和1型免疫,包括Th1和巨噬细胞活化以及细胞毒性细胞活性,并且(ii)通过免疫调节机制独立下调不适当的Th2应答;以及检查点抑制剂,任选地,其中分枝杆菌选自牝牛分枝杆菌,奥布分枝杆菌或M.indicus pranii。
在本发明的另一个实施方案中,提供了一种用于在检查点抑制剂难治性患者中治疗癌症的联合疗法,其包含无活性全细胞分枝杆菌,所述分枝杆菌介导以下对免疫的免疫刺激作用中的至少一种的任何组合:(i)增加免疫应答、(ii)增加T细胞活化、(iii)增加细胞毒性T细胞活性、(iv)增加NK细胞活性、(v)增加Th17活性、(vi)减轻T细胞抑制、(vii)增加促炎细胞因子的分泌、(viii)增加IL-2的分泌;(ix)增加T细胞产生的干扰素-y、(x)增加Th1应答、(xi)降低Th2应答、(xii)减少或消除至少一种调节性T细胞(Treg)、骨髓来源的抑制细胞(MDSC)、iMC、间充质基质细胞、表达TIE2的单核细胞、(xiii)降低调节性细胞活性和/或一种或多种髓样来源的抑制细胞(MDSC)、iMC、间充质基质细胞、表达TIE2的单核细胞的活性、(xiv)降低或消除M2巨噬细胞、(xv)消除M2巨噬细胞的促肿瘤活性、(xvi)降低或消除N2中性粒细胞、(xvii)降低N2中性粒细胞的促肿瘤活性、(xviii)减少对T细胞活化的抑制作用、(xix)减少对CTL激活的抑制、(xx)减少对NK细胞激活的抑制、(xxi)逆转T细胞衰竭、(xxii)增加T细胞应答、(xxiii)增加细胞毒性细胞的活性、(xxiv)刺激抗原特异性记忆应答、(xxv)诱发癌细胞凋亡或裂解、(xxvi)刺激对癌细胞的细胞毒性或静胞效应(cytostatic effect)、(xxvii)诱导直接杀死癌细胞、和/或(xxviii)诱导补体依赖性细胞毒性和/或(xxix)诱导抗体依赖性细胞介导的细胞毒性。
在本发明的另一个实施方案中,提供了一种用于在检查点抑制剂难治性患者中治疗癌症的联合疗法,其包括促进CTL活性的无活性全细胞分枝杆菌,其中CTL活性包括一种或多种促炎细胞因子的分泌和/或CTL介导的靶细胞杀伤;和/或促进CD4+T细胞活化和/或CD4+T细胞增殖和/或CD4+T细胞介导的细胞耗竭;和/或促进CD8+T细胞活化和/或CD8+T细胞增殖和/或CD8+T细胞介导的细胞耗竭;和/或增强NK细胞活性和/或NK细胞增殖和/或NK细胞介导的细胞耗竭,其中增强的NK细胞活性包括靶细胞耗竭增加和/或促炎性细胞因子释放;和/或CD103+CD141+DC的上调或刺激;和/或降低或消除调节细胞(Treg)的分化、增殖和/或活性、和/或骨髓来源的抑制细胞(MDSC)的分化、增殖、浸润和/或活性;和/或减少或消除诱导型Treg(iTreg)渗入靶位。
在本发明的一个实施方案中,提供了一种用于治疗、减少、抑制或控制检查点抑制剂难治性患者中一种或多种肿瘤的无活性全细胞分枝杆菌,其中所述检查点抑制剂难治性患者旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗,进一步包括与分枝杆菌的施用同时、分别或顺序进行共刺激检查点治疗,其中所述共刺激检查点治疗包括施用一种或多种结合剂,所述结合剂选自针对CD27、CD28、CD40、CD122、CD137、OX40、GITR、ICOS及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他抗原结合片段。
在本发明的一个实施方案中,共刺激检查点治疗包括施用一种或多种结合剂,所述结合剂选自utomilumab、urelumab、MOXR0916、PF04518600、MEDI0562、GSK3174988、MEDI6469.RO7009789、CP870893、BMS986156、GWN323、JTX-2011、varlilumab、MK-4166、NKT-214及它们的组合。
在本发明的一个实施方案中,在检查点抑制治疗和/或共刺激检查点治疗之前和/或之后施用所述无活性全细胞分枝杆菌。
在本发明的另一个实施方案中,提供了一种用于治疗、减少、抑制或控制检查点抑制剂难治性患者中一种或多种肿瘤的无活性全细胞分枝杆菌,其中所述检查点抑制剂难治性患者为旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗,进一步包括与分枝杆菌的施用和/或检查点抑制治疗和/或共刺激检查点治疗同时、分别或顺序施用一种或多种其他抗癌治疗或药剂。
在本发明的另一个实施方案中,一种或多种其他抗癌治疗或药剂选自:过继细胞疗法、外科手术疗法、化学疗法、放射疗法、激素疗法、小分子疗法,例如二甲双胍,受体激酶抑制剂疗法、热疗、光疗、放射消融疗法、抗血管生成疗法、细胞因子疗法、冷冻疗法、生物疗法、HDAC抑制剂,例如OKI-179,BRAF抑制剂、MEK抑制剂、EGFR抑制剂、VEGF抑制剂、P13Kδ抑制剂、PARP抑制剂、mTOR抑制剂、低甲基化剂、溶瘤病毒、包括TLR2、TLR3、TLR4、TLR7、TLR8或TLR9激动剂在内的TLR激动剂、或诸如MRx0518(4D Pharma)的TLR5激动剂、STING激动剂(包括MIW815和SYNB1891)和癌症疫苗,例如GVAX或CIMAvax。
在本发明的另一个实施方案中,一种或多种其他抗癌治疗导致免疫原性细胞死亡治疗,如WO2013/07998中所述。该治疗可诱导肿瘤免疫原性细胞死亡,包括细胞凋亡(1型)、自噬(2型)和坏死(3型),随后释放出肿瘤抗原,其能够诱导免疫应答(包括激活细胞毒性CD8+T细胞和NK细胞),又可充当靶标,包括使树突状细胞可接近抗原。免疫原性细胞死亡治疗可以以次优水平进行,即非治愈性治疗,以致于它不打算完全去除或根除肿瘤,但是导致某些肿瘤细胞或组织坏死。技术人员将理解,为了达到此目的,需要的治疗程度取决于所使用的技术、患者的年龄、疾病的状况以及特别是肿瘤或转移的尺寸和位置。特别优选的治疗包括:微波辐射、靶向放射治疗例如立体定向消融辐射(SABR)、栓塞(embolisation)、冷冻疗法、超声、高强度聚焦超声、射波刀、热疗、射频消融、冷冻消融、电刀加热、热水注射、酒精注射、栓塞(embolization)、放射线照射、光动力疗法、激光束照射及它们的组合。
在本发明的另一个实施方案中,TLR激动剂包括MRx0518(4D Pharma)、米法莫肽(mifamurtide)(Mepact)、Krestin(PSK)、IMO-2125(tilsotolimod)、CMP-001、MGN-1703(lefitolimod)、entolimod、SD-101、GS-9620、咪喹莫特(imiquimod)、瑞喹莫德(resiquimod)、MEDI4736、poly I:C、CPG7909、DSP-0509、VTX-2337(motolimod)、MEDI9197、NKTR-262、G100或PF-3512676及它们的组合。
在本发明的另一个实施方案中,化学疗法包括施用一种或多种选自以下的药剂:环磷酰胺(cyclophosphamide)、甲氨蝶呤(methotrexate)、5-氟尿嘧啶(5-fluorouracil)、阿霉素(doxorubicin)、氮芥(mustine)、长春新碱(vincristine)、丙卡巴肼(procarbazine)、泼尼松龙(prednisolone)、博来霉素(bleomycin)、长春碱(vinblastine)、达卡巴嗪(dacarbazine)、依托泊苷(etoposide)、顺铂(cisplatin)、表柔比星(epirubicin)、卡培他滨(capecitabine)、甲酰四氢叶酸(leucovorin)、亚叶酸(folinic acid)、卡铂(carboplatin)、奥沙利铂(oxaliplatin)、吉西他滨(gemcitabine)、FOLFINROX、紫杉醇(paclitaxel)、培美曲塞(pemetrexed)、伊立替康(irinotecan)及它们的组合。
在本发明的另一个实施方案中,一种或多种其他抗癌治疗或药剂通过瘤内、动脉内、静脉内、血管内、胸膜内、腹膜内、气管内、鼻内、肺内、鞘内、肌内、内镜、病变内、经皮、皮下、局部、立体定位、口服或直接注射或灌注施用。
在本发明的优选实施方案中,检查点抑制剂难治性患者表现出对检查点抑制剂治疗的先天性(原发性)抗性或对检查点抑制剂治疗的后天性(继发性)抗性。
在本发明的一个优选实施方案中,检查点抑制剂难治性患者表现出对检查点抑制剂治疗的先天性(原发性)抗性,表现为从第一剂开始持续至少约8周或12周对所述检查点抑制剂治疗的应答缺乏或应答不足。
在本发明的一个优选实施方案中,检查点抑制剂难治性患者表现出对检查点抑制剂治疗的后天性(继发性)抗性,表现为对所述检查点治疗有初始应答,但一种或多种肿瘤随后复发和发展。
在本发明的又一个优选实施方案中,检查点抑制剂难治性患者对一种或多种的CTLA-4、PD-1、PD-L1、PD-L2、B7-H3、B7-H4、B7-H6、A2AR、IDO、TIM-3、BTLA、VISTA、LAG-3抑制剂的治疗表现出先天性(原发性)抗性或后天性(继发性)抗性。
在本发明的一个实施方案中,检查点抑制治疗和/或共刺激检查点治疗与分枝杆菌协同作用。
在本发明的一个实施方案中,提供了一种治疗、减少、抑制或控制检查点抑制剂难治性个体中的瘤形成、肿瘤或癌症的方法,其中所述方法包括同时、分别或顺序向个体施用:(i)一种或多种选自以下的检查点抑制剂:针对CTLA-4、PD-1、PD-L1、PD-L2、B7-H3、B7-H4、B7-H6、A2AR、IDO、TIM-3、BTLA、VISTA、TIGIT、LAG-3、CD40、KIR、CEACAM1、GARP、PS、CSF1R、CD94/NKG2A、TDO、TNFR、DcR3及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他的其抗原结合片段;和(ii)无活性全细胞分枝杆菌,其中相对于单独施用一种或多种检查点抑制剂或无活性全细胞分枝杆菌,所述方法导致增强的治疗效果,任选地其中检查点抑制治疗包括施用亚治疗量和/或持续时间的所述一种或多种阻断剂。
在本发明的一个实施方案中,提供了一种治疗、减少、抑制或控制检查点抑制剂难治性个体中的瘤形成、肿瘤或癌症的方法,其中所述方法包括同时、分别或顺序向个体施用:(i)一种或多种选自以下的检查点抑制剂:针对CTLA-4、PD-1或PD-L1的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他的其抗原结合片段及它们的组合;和(ii)无活性全细胞分枝杆菌。
在本发明的一个实施方案中,提供了一种治疗、减少、抑制或控制检查点抑制剂难治性个体中的瘤形成、肿瘤或癌症的方法,其中所述方法包括同时、分别或顺序向个体施用:(i)一种或多种选自以下的检查点抑制剂:伊匹单抗,纳武利尤单抗,派姆单抗,azetolizumab,度伐利尤单抗,曲美木单抗,斯巴达珠单抗,阿维鲁单抗,信迪利单抗,特瑞普利单抗、MGA012、MGD013、MGD019、恩比利珠单抗、MGD009、MGC018、MEDI0680、PDR001、FAZ053、TSR022、MBG453、relatlinab(BMS986016)、LAG525、IMP321、REGN2810(西米普利单抗)、REGN3767、培西达替尼、LY3022855、FPA008、BLZ945、GDC0919、艾帕斯塔、indoximid、BMS986205、CPI-444、MEDI9447、PBF509、利瑞路单抗及它们的组合,和(ii)无活性全细胞分枝杆菌。
在本发明的一个优选的实施方案中,一种或多种检查点抑制剂选自伊匹单抗和/或纳武利尤单抗。
在本发明的一个实施方案中,提供了一种治疗、减少、抑制或控制检查点抑制剂难治性个体中的瘤形成、肿瘤或癌症的方法,其中所述一种或多种肿瘤与选自前列腺癌、肝癌、肾癌、肺癌、乳腺癌、结直肠癌、乳腺癌、胰腺癌、脑癌、肝细胞癌、淋巴瘤、白血病、胃癌、子宫颈癌、卵巢癌、甲状腺癌、黑色素瘤、恶性上皮肿瘤、头颈癌、皮肤癌和软组织肉瘤的癌症相关,优选其中所述一种或多种肿瘤与胰腺癌、结直肠癌、前列腺癌、皮肤癌或卵巢癌相关。
在本发明的另一个实施方案中,提供了一种在检查点抑制剂难治性个体中治疗、减少、抑制或控制瘤形成、肿瘤或癌症的方法,其中该方法包括同时、分别或顺序向个体施用:(i)一种或多种检查点抑制剂,(ii)无活性全细胞分枝杆菌,和(iii)与分枝杆菌的施用同时、分别或顺序进行的共同刺激检查点治疗,其中所述共同刺激检查点治疗包括施用一种或多种结合剂,所述结合剂选自针对CD27、CD28、CD40、CD122、CD137、OX40、GITR、ICOS及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他的其抗原结合片段;其中相对于单独施用一种或多种检查点抑制剂、共刺激检查点治疗或无活性全细胞分枝杆菌,所述方法导致增强的治疗效果,并且任选地,所述共刺激检查点治疗包括施用亚治疗量和/或持续时间的所述结合剂。
在本发明的另一个实施方案中,共刺激检查点治疗包括施用一种或多种结合剂,所述结合剂选自utomilumab、urelumab、MOXR0916、PF04518600、MEDI0562、GSK3174988、MEDI6469、RO7009789、CP870893、BMS986156、GWN323、JTX-2011、varlilumab、MK-4166、NKT-214及它们的组合。
在本发明的另一个实施方案中,提供了一种治疗、减少、抑制或控制检查点抑制剂难治性个体中的瘤形成、肿瘤或癌症的方法,其中该方法包括同时、分别或顺序向个体施用:(i)一种或多种检查点抑制剂,(ii),无活性全细胞分枝杆菌,和(iii)与分枝杆菌的施用同时、分别或顺序进行的共同刺激检查点治疗,其中所述共同刺激检查点治疗包括施用一种或多种结合剂,其中所述结合剂为激动性抗体,任选地,其中所述方法包括施用亚治疗量和/或持续时间的所述共刺激检查点结合剂。
在本发明的又一个实施方案中,提供了一种用于治疗、减少、抑制或控制检查点抑制剂难治性患者中一种或多种肿瘤的无活性全细胞分枝杆菌,其中所述检查点抑制剂难治性患者旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗,其中所述检查点抑制治疗包括施用两种或更多种阻断剂,所述阻断剂选自针对CTLA-4、PD-1、PD-L1、PD-L2、B7-H3、B7-H4、B7-H6、A2AR、IDO、TIM-3、BTLA、VISTA、TIGIT、LAG-3、CD40、KIR、CEACAM1、GARP、PS、CSF1R、CD94/NKG2A、TDO、TNFR、DcR3及它们的组合的细胞、蛋白质、肽、抗体、ADC(抗体-药物偶联物)、Fab片段(Fab)、F(ab')2片段、双抗体、三抗体、四抗体、前体、单链可变区片段(scFv)、二硫键稳定的可变区片段(dsFv)或其他的其抗原结合片段,以及任选地其中所述检查点抑制治疗包括施用亚治疗量和/或持续时间的所述阻断剂。
在本发明的又一个实施方案中,提供了一种用于治疗、减少、抑制或控制检查点抑制剂难治性患者中一种或多种肿瘤的无活性全细胞分枝杆菌,其中所述检查点抑制剂难治性患者旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗,其中所述检查点抑制治疗包括施用两种或更多种阻断剂,其中所述两种或更多种阻断剂针对以下组合中的任一种:CTLA-4和PD-1、CTLA-4和PD-L1、PD-1和LAG-3、或PD-1和PD-L1。
合适的特定组合包括:度伐利尤单抗+曲美木单抗、纳武利尤单抗+伊匹单抗、派姆单抗+伊匹单抗、MEDI0680+度伐利尤单抗、PDR001+FAZ053、纳武利尤单抗+TSR022、PDR001+MBG453、纳武利尤单抗+BMS 986016、PDR001+LAG525b、派姆单抗+IMP321、REGN2810(西米普利单抗)+REGN3767以及其他合适的组合。
在本发明的一个实施方案中,提供了一种用于治疗、减少、抑制或控制检查点抑制剂难治性患者中一种或多种肿瘤的无活性全细胞分枝杆菌,其中所述检查点抑制剂难治性患者旨在与分枝杆菌的施用同时、分别或顺序进行检查点抑制治疗,其进一步包括与分枝杆菌的施用同时、分别或顺序进行共刺激检查点治疗,其直接针对以下组合中的任一种:CTLA-4和CD40、CTLA-4和OX40、CTLA-4和IDO、OX-40和PD-L1、PD-1和OX-40、CD27和PD-L1、PD-1和CD137、PD-L1和CD137、OX-40和CD137、CTLA-4和IDO、PD-1和IDO、PD-L1和IDO、PD!和A2AR、PD-L1和A2AR、PD1和GITR、PD-L1和GITR、PD1和ICOS、PD-L1和ICOS、PD1和CD27、PD-L1和CD27、PD1和CD122、PD-L1和CD122、PD1和CSF1R、PD-L1和CSF1R以及其他此类合适的组合。
合适的特定组合包括:阿维鲁单抗+utomilumab、纳武利尤单抗+urelumab、派姆单抗+utomilumab、Atezolimumab+MOXR0916±贝伐单抗(bevacizumab)、阿维鲁单抗+PF-04518600、度伐利尤单抗+MEDI0562、派姆单抗+GSK3174998、曲美木单抗+度伐利尤单抗+MEDI6469、曲美木单抗+MEDI0562、Utomilumab+PF-04518600、Atezolimumab+RO7009789、曲美木单抗+CP870893、纳武利尤单抗+BMS986156、PDR001+GWN323、纳武利尤单抗+JTX-2011、Atezolizumab+GDC0919、伊匹单抗+epacadostat、伊匹单抗+indoximid、纳武利尤单抗+BMS986205、派姆单抗+epacadostat、阿特朱单抗(Atezolizumab)+CPI-444、度伐利尤单抗+MEDI9447、PDR001+PBF509、纳武利尤单抗+varlilumab、阿特朱单抗+varlilumab、纳武利尤单抗+NKTR-214、度伐利尤单抗+Pexidartinib(PLX3397)、度伐利尤单抗+LY3022855、纳武利尤单抗+FPA008、派姆单抗+Pexidartinib、PDR001+BLZ945、曲美木单抗+LY3022855。
在本发明的另一个实施方案中,提供了一种治疗、减少、抑制或控制检查点抑制剂难治性个体中的瘤形成、肿瘤或癌症的方法,其中该方法包括同时、分别或顺序向个体施用:(i)一种或多种检查点抑制剂,(ii)无活性全细胞分枝杆菌,和(iii)与分枝杆菌的施用同时、分别或顺序进行的共刺激检查点治疗,其还包括施用一种或多种其他抗癌治疗或药剂,其中相对于单独施用一种或多种检查点抑制剂、共刺激检查点治疗、一种或多种其他抗癌治疗或药剂、或无活性全细胞分枝杆菌,所述方法导致增强的治疗效果。
在本发明的一个实施方案或方法中,一种或多种其他抗癌治疗或药剂选自:过继细胞疗法、外科手术疗法、化学疗法、放射疗法、激素疗法、小分子疗法,例如二甲双胍,受体激酶抑制剂疗法、热疗、光疗、放射消融疗法、抗血管生成疗法、细胞因子疗法、冷冻疗法、生物疗法、HDAC抑制剂,例如OKI-179,BRAF抑制剂、MEK抑制剂、EGFR抑制剂、VEGF抑制剂、P13Kδ抑制剂、PARP抑制剂、mTOR抑制剂、低甲基化剂、溶瘤病毒、包括TLR2、TLR3、TLR4、TLR5、TLR7、TLR8或TLR9激动剂在内的TLR激动剂,例如MRx0518(4D Pharma)、STING激动剂(包括MIW815和SYNB1891)和癌症疫苗,例如GVAX或CIMAvax。
在本发明的另一种方法中、抗癌治疗选自:微波辐射、射频消融、靶向放射疗法如立体定向消融辐射疗法(SABR)、栓塞、冷冻疗法、超声、高强度聚焦超声、射波刀、热疗、冷冻消融、电刀加热、热水注射、酒精注射、栓塞、放射线照射、光动力疗法、激光束照射及它们的组合。
在本发明的一个实施方案或方法中,TLR激动剂包括米法莫肽(Mepact)、Krestin(PSK)、MRx0518(4D Pharma)、IMO-2125(tilsotolimod)、CMP-001、MGN-1703(lefitolimod)、entolimod、SD-101、GS-9620、咪喹莫特、瑞喹莫德、MEDI4736、poly I:C、CPG7909、DSP-0509、VTX-2337(motolimod)、MEDI9197、NKTR-262、G100或PF-3512676及它们的组合。
合适的具体组合包括:伊匹单抗+MGN1703、派姆单抗+CMP001、派姆单抗+SD101、曲美木单抗+PF-3512676、瑞喹莫德+派姆单抗(pembolizumab)。
在本发明的一个实施方案或方法中,化学疗法包括施用一种或多种选自以下的药剂:环磷酰胺、甲氨蝶呤、5-氟尿嘧啶、阿霉素、氮芥、长春新碱、丙卡巴肼、泼尼松龙、博来霉素、长春碱、达卡巴嗪、依托泊苷、顺铂、表柔比星、卡培他滨、甲酰四氢叶酸、亚叶酸、卡铂、奥沙利铂、吉西他滨、FOLFINROX、紫杉醇、培美曲塞、伊立替康及它们的组合。
在本发明的一个实施方案或方法中,一种或多种其他抗癌治疗或药剂通过瘤内、动脉内、静脉内、血管内、胸膜内、腹膜内、气管内、鼻内、肺内、鞘内、肌内、内镜、病变内、经皮、皮下、局部、立体定位、口服或直接注射或灌注施用。
在本发明的一个实施方案或方法中,所述瘤形成、肿瘤或癌症与选自前列腺癌、肝癌、肾癌、肺癌、乳腺癌、结直肠癌、乳腺癌、胰腺癌、脑癌、肝细胞癌、淋巴瘤、白血病、胃癌、子宫颈癌、卵巢癌、甲状腺癌、黑色素瘤、恶性上皮肿瘤、头颈癌、皮肤癌和软组织肉瘤的癌症相关,优选其中所述瘤形成、肿瘤或癌与胰腺腺、结直肠癌、前列腺癌、皮肤癌或卵巢癌相关,任选地其中瘤形成、肿瘤或癌是转移性的。
在本发明的另一个优选实施方案或方法中,所述瘤形成、肿瘤或癌症与肉瘤,优选与软组织肉瘤或非软组织肉瘤相关。特别优选的非软组织肉瘤包括骨肉瘤(骨肉瘤(osteosarcoma),尤因肉瘤(Ewing’s sarcoma))和软骨肉瘤。特别优选的肉瘤包括多形性未分化肉瘤(UPS)、血管肉瘤、平滑肌肉肉瘤、去分化性脂肪肉瘤(DDL)、滑膜肉瘤、横纹肌肉瘤、上皮样肉瘤、粘液样肌肉瘤、腺泡状软组织肉瘤、副脊索瘤/肌上皮瘤(parachordoma/myoepithelioma)、多形性脂肪肉瘤、骨外黏液样软骨肉瘤、恶性神经鞘类肿瘤(malignantperipheral nerve sheath tumors)。患者可能小于50岁、或小于20至30岁,或者是青少年(teenager)或青少年(adolescent)(<16岁)或儿童(0-14岁)。可选地,一种或多种肉瘤肿瘤表现出PD-L1或PD-1的染色/表达增加。任选地,无活性的全细胞分枝杆菌和/或检查点抑制剂和/或共刺激性结合剂通过瘤内、瘤周、病灶周围或病灶内施用来施用。
在本发明的一个实施方案或方法中,所述无活性全细胞分枝杆菌选自:牝牛分枝杆菌、奥布分枝杆菌、副偶然分枝杆菌、金色分枝杆菌、M.indicus pranii、草分枝杆菌及它们的组合,任选地为未经加工的形式。优选地,无活性全细胞分枝杆菌为奥布分枝杆菌。
在本发明的一个实施方案或方法中,无活性的全细胞分枝杆菌和/或检查点抑制剂和/或共刺激性结合剂通过肠胃外、口服、舌下、鼻或肺途径施用,优选地,所述肠胃外途径选自皮下(subcutaneous)、皮内、真皮下(subdermal)、腹膜内或静脉内、肿瘤内、瘤周、病灶周围或病灶内施用。
在本发明的一个实施方案或方法中,无活性全细胞分枝杆菌以约10
在进一步的实施方案中,本发明的方法包括以下一项或多项:1)减少或抑制可能或确实发生转移的肿瘤或癌细胞的生长、增殖、迁移或侵袭,2)减少或抑制由原发性肿瘤或癌症引起的向与原发性肿瘤或癌症不同的一个或多个其他部位、位置或区域转移的形成或建立,3)在转移已经形成或已经建立之后,减少或抑制在与原发肿瘤或癌症不同的一个或多个其他部位、位置或区域的转移的生长或增殖,4)在转移已经形成或已经建立之后,减少或抑制其他转移的形成或建立,5)延长总体生存期,6)延长无进展生存期,7)疾病稳定,8)提高生活质量。
在进一步的实施方案中,本发明的方法导致增强的治疗效果,任选地如RECIST1.1所定义,通过减少或稳定一种或多种所述肿瘤的肿瘤尺寸所测得的,包括疾病稳定(SD)、目标肿瘤的完全缓解(CR)或部分缓解(PR);和/或一种或多种非目标肿瘤的疾病稳定(SD)或完全缓解(CR)。
在本发明的一个实施方案或方法中,检查点抑制剂难治性患者表现出对检查点抑制剂治疗的先天性(原发性)抗性或获得的对检查点抑制剂治疗的后天性(继发性)抗性,其中(i)患者表现出对检查点抑制剂治疗的先天性(原发性)抗性,表现为从第一剂开始持续至少约8周或12周对检查点抑制剂治疗的应答缺乏或应答不足,或(ii)患者表现出对检查点抑制剂治疗的后天性(继发性)抗性,表现为对检查点治疗有初始应答,但一种或多种肿瘤随后复发和发展。
然而,治疗的益处或改善不一定是治愈或完全破坏所有靶增殖细胞(例如瘤形成、肿瘤或癌症或转移),也不是消融与细胞增殖有关或由其引起的所有病理、不良症状或并发症或细胞过度增殖性疾病,例如瘤形成、肿瘤或癌症或转移。例如,通过抑制肿瘤或癌症的进展或恶化,肿瘤或癌细胞团的部分破坏、或肿瘤或癌细胞质量、尺寸或细胞数量的稳定,即使仅保留几天、几周或几个月,即使部分或大部分肿瘤或癌块、尺寸或细胞仍然存在,也可以降低死亡率并延长寿命。
治疗益处的具体非限制性实例包括瘤形成、肿瘤或癌症或转移体积(尺寸或细胞质量)或细胞数量减少,抑制或防止瘤形成、肿瘤或癌体积增加(例如,稳定化),减慢或抑制瘤形成、肿瘤或癌症的进展、恶化或转移,或抑制瘤形成、肿瘤或癌症的增殖、生长或转移。
在本发明的一个实施方案中,本文公开的组合和方法根据irRC(源自时间点疗效评估并基于肿瘤负荷)提供了可检测或可测量的改善或总体反应,包括以下一项或多项:(i)irCR-所有病变的完全消失,无论是否可测量,并且没有新病变(通过重复记录、连续评估,应自首次记录之日起不少于4周);(ii)irPR-减轻肿瘤负荷≥相对于基线为50%(在首次记录后至少4周通过连续评估确认)。
发明方法可能不会立即生效。例如,可以在治疗后进行瘤形成、肿瘤或癌细胞数量或质量的增加,但是随着时间的流逝,最终在给定个体中随后发生肿瘤细胞质量、尺寸或细胞数量的稳定或减少。
在本发明的一个实施方案中,本文公开的组合和方法导致选自以下一种或多种的疾病状态和进展的一种或多种标志物的临床相关改善:(i):总体存活,(ii):无进展生存期,(iii):总体缓解率,(iv):转移性疾病减少,(v):肿瘤抗原的循环水平,例如碳水化合物抗原19.9(CA19.9)和癌胚抗原(CEA)或其他取决于肿瘤的抗原,(vii)营养状况(体重、食欲、血清白蛋白),(viii):控制疼痛或止痛药使用,(ix):CRP/白蛋白比率。
在另一个实施方案中,检查点抑制治疗包括施用阻断剂,其中所述阻断剂是选自以下的抗体:AMP-224(Amplimmune,Inc)、BMS-986016或MGA-271及它们的组合。AMP-224,也称为B7-DCIg,是在WO2010/027827和WO2011/066342中描述的PD-L2-Fc融合可溶性受体。
BMS-986016是从表达人免疫球蛋白基因的免疫转基因小鼠中分离出的人LAG-3特异性全人抗体。它被表达为IgG4同种型抗体,其包括减弱Fc受体结合的稳定化铰链突变(S228P),以降低或消除抗体或补体介导的靶细胞杀死的可能性。BMS-986016的重链和轻链氨基酸序列在WO2015/042246的SEQIDNO:17和18中提供。
在另一个实施方案中,所述检查点抑制疗法包括施用BMS-986016,其以约20mg至约8000mg的剂量每两周静脉内施用一次,任选地最多四十八次输注。
在另一个实施方案中,检查点抑制治疗包括施用阻断剂,其中所述阻断剂是特异性结合B7-H3的抗体,例如恩比利珠单抗,一种针对B7-H3的工程化Fc人源化IgG1单克隆抗体,具有强大的抗肿瘤活性(Macrogenics,Inc.);或MGD009,一种B7-H3双亲和力重新定向(DART)蛋白,可与T细胞上的CD3和靶细胞上的B7-H3结合,并已发现将T细胞募集到肿瘤部位并促进肿瘤根除,或MGD009是人源化DART蛋白。MGC018是具有Duocarmycin负载和可裂解肽接头的抗B7-H3抗体药物偶联物(ADC)。
在一些实施方案中,检查点抑制治疗包括施用选自以下的抗B7-H3结合蛋白:DS-5573(Daiichi Sankyo,Inc.)、恩比利珠单抗(MacroGenics,Inc.)和omburtamab[8H9](Y-mabs Therapeutics,Inc)(一种用放射性碘(I-131)标记的B7-H3抗体)。
在一些实施方案中,检查点抑制治疗包括施用吲哚胺-2,3-双加氧酶(IDO)抑制剂,例如D1-甲基-色氨酸(Lunate)和美国专利号7,799,776中记载的其他化合物,其内容通过引用的方式并入本文。
在某些实施方案中,共刺激检查点治疗上调细胞免疫系统,其中所述共刺激检查点治疗包括施用结合剂,所述结合剂选自:针对CD27、OX40、GITR或CD137的细胞、蛋白质、肽、抗体或其抗原结合片段及它们的组合,例如CD137激动剂,包括但不限于BMS-663513(urelumab,抗CD137人源化单克隆抗体激动剂,Bristol-Myers Squibb);CD40的激动剂,例如CP-870,893(α-CD40人源化单克隆抗体,Pfizer);OX40(CD134)激动剂(例如抗OX40人源化单克隆抗体,AgonOx和美国专利号7,959,925中记载的那些)和Astra Zeneca’sMEDI0562,一种人源化OX40激动剂;MEDI6469,鼠OX4激动剂;以及MEDI6383,一种OX40激动剂;或CD27的激动剂,例如CDX-1127(α-CD27人源化单克隆抗体,Celldex)。合适的抗GITR抗体包括TRX518(Tolerx)、MK-1248(Merck)、CK-302,并且用于本发明的合适的抗4-1BB抗体包括PF-5082566(Pfizer)。
TIGIT是一种检查点受体,被认为与介导肿瘤T细胞衰竭有关。已经显示,TIGIT与其他检查点分子CTLA-4和PD-1无关,与荷瘤小鼠和结肠癌患者的NK细胞衰竭有关。在多种荷瘤小鼠模型中,TIGIT的阻断可防止NK细胞衰竭,并增强NK细胞依赖性肿瘤免疫力。此外,TIGIT的阻滞以NK细胞依赖性方式产生有效的肿瘤特异性T细胞免疫、用PD-1配体PD-L1抗体增强的治疗效果,以及在肿瘤再攻击模型中持续的免疫记忆。
有证据表明,包括CD68+或CD163+特异性肿瘤相关巨噬细胞(TAM)在内的MDSC的更大浸润与检查点抑制剂抗性相关。体内研究还表明,β-连环蛋白信号传导抑制CD103+DC募集会导致原发性抗性。
β2微球蛋白(B2M)的丧失是免疫治疗后天性抗性的一种机制,该机制是由抗原呈递不足引起的。B2M丧失会干扰I类MHC重链折叠,导致其受体定位丢失并中断下游信号传导,否则会传播T细胞活化和募集。MHC I类分子的肿瘤下调是肿瘤免疫逃逸的另一种机制,使抗肿瘤T细胞响应无效。
APC在抗肿瘤免疫中的功能是将肿瘤抗原转移至引流肿瘤的淋巴结,以进行肿瘤特异性CD8+T细胞引发。在黑色素瘤中,CD103+DC是唯一具有这种功能的APC。在黑色素瘤小鼠模型中,生长因子FLT3L和多聚I:C的施用已扩大并激活了肿瘤中CD103+DC祖细胞,从而逆转了对PD-L1的抗性。此外,研究表明,在未发炎的肿瘤中,CD103+树突状细胞(这种细胞类型是招募T细胞的趋化因子CXCL9/10的主要来源)的蓄积失败会导致治疗激活的T细胞进入不足和免疫治疗抗性。因此,肿瘤微环境中CD103+DC的缺乏可能是对多种免疫疗法产生抗性的主要机制。
常规树突细胞(cDC)是控制T细胞免疫力的专门抗原呈递细胞。小鼠的谱系追踪实验已经绘制了两个发育和功能上不同的种群cDC1和cDC2,它们位于外周组织中,它们分别由CD103和CD11b的表达来定义。这些谱系及其功能在人类中是保守的。其中,cDC1在将抗原交叉呈递给细胞毒性T细胞方面非常高效,并且是肿瘤内主要的刺激性cDC群体,既可以在引流淋巴结(LN)中产生抗肿瘤免疫力,又可以在肿瘤微环境中与效应T细胞直接相互作用。此外,cDC1对于检查点封锁的治疗反应至关重要。
TIM-3在肿瘤内CD103+树突状细胞中高度表达,TIM-3抗体的施用间接增强了化疗期间的CD8+T细胞应答。
TLR3激动剂多核糖肌酸:多核糖酸(poly I:C)诱导I型IFN产生以及DC成熟。CD141+DC是鼠CD8+/CD103+DC的人等价物,TLR3和TLR8由CD141+DC表达。向小鼠注射TLR3和TLR7激动剂(瑞喹莫德)会导致CD141+和CD1c+DC共同上调共刺激分子CD80、CD83和CD86。
在整个说明书中使用的术语“组合”是指包括与分枝杆菌的施用同时、分别或顺序施用检查点抑制剂和/或共刺激检查点结合剂。因此,检查点抑制剂和/或共刺激检查点结合剂和分枝杆菌可以存在于相同或分开的药物制剂中,并且可以同时或在不同时间施用。
因此,可以将无活性全细胞分枝杆菌和检查点抑制剂和/或共刺激检查点结合剂作为单独的药物提供,以同时或在不同时间施用。
优选地,将无活性全细胞分枝杆菌和检查点抑制剂和/或共刺激检查点结合剂作为单独的药物提供,以在不同时间施用。当分别并在不同时间施用时,可以首先施用无活性全细胞分枝杆菌或检查点抑制剂和/或共刺激性检查点结合剂;然而,适合的是先施用检查点抑制剂和/或共刺激检查点结合剂,再施用无活性全细胞分枝杆菌。此外,两者可以在同一天或不同的日子施用,并且可以在治疗周期中以相同的时间表或以不同的时间表施用。
在本发明的一个实施方案中,治疗周期由每天、每周、每两周或每月施用一次无活性全细胞分枝杆菌,同时每周一次或每两周一次、每三周一次或每四周或更长时间一次,同时施用检查点抑制剂和/或共刺激检查点结合剂。或者,在施用检查点抑制剂和/或共刺激性检查点结合剂之前和/或之后,施用无活性全细胞分枝杆菌。
在本发明的另一个实施方案中,在施用检查点抑制剂和/或共刺激性检查点结合剂之前和之后向患者施用无活性全细胞分枝杆菌。即,在一个实施方案中,在所述检查点抑制剂和/或共刺激检查点结合剂之前和之后向患者施用全细胞非致病性的热灭活分枝杆菌。
在本发明的另一个实施方案中,在施用检查点抑制剂和/或共刺激性检查点结合剂和/或一种或多种其他抗癌治疗或药剂之前和之后,向患者施用无活性全细胞分枝杆菌,其他抗癌治疗或药剂包括:过继细胞疗法、外科手术疗法、化学疗法、放射疗法、激素疗法、小分子疗法,例如二甲双胍,受体激酶抑制剂疗法、热疗、光疗、放射消融疗法、抗血管生成疗法、细胞因子疗法、冷冻疗法、生物疗法、HDAC抑制剂,例如OKI-179,BRAF抑制剂、MEK抑制剂、EGFR抑制剂、VEGF抑制剂、P13Kδ抑制剂、PARP抑制剂、mTOR抑制剂、低甲基化剂、溶瘤病毒、包括TLR2、TLR3、TLR4、TLR5、TLR7、TLR8或TLR9激动剂在内的TLR激动剂,例如MRx0518(4D Pharma)、STING激动剂(包括MIW815和SYNB1891)和癌症疫苗,例如GVAX或CIMAvax。
根据个体患者对治疗的耐受性,根据需要执行剂量延迟和/或剂量减少以及时间表调整。
或者,可以与有效量的无活性全细胞分枝杆菌的施用同时进行检查点抑制剂和/或共刺激性检查点结合剂的施用。
接受根据本发明的检查点抑制治疗和/或共刺激检查点治疗的个体可以与无活性全细胞分枝杆菌的施用同时、分别或顺序进行。
在本发明的一个方面,有效量的无活性全细胞分枝杆菌可以作为单剂量施用。或者,有效量的无活性全细胞分枝杆菌可以多次(重复)剂量施用,例如两次以上、三次以上、四次以上、五次以上、十次以上或二十次以上重复剂量。在施用的分枝杆菌的多剂量中,可能存在1周、2周、3周、4周的时间段或上述剂量之间的组合。
无活性全细胞分枝杆菌可以在检查点抑制治疗之前约8周、6周或4周和/或约1天之间施用,例如约4周和1周之间、或约3周和1周之间、或约3周和2周之间。施用可以以单剂量或更优选以多剂量存在。
在本发明的一个实施方案中,所述无活性全细胞分枝杆菌可以是剂型施用至患者的药物的形式。
在某些情况下,根据本发明的容器可以是小瓶、安瓿、注射器、胶囊、片剂或管。在一些情况下,可以将分枝杆菌冻干并配制用于在施用之前重新悬浮。然而,在其他情况下,将分枝杆菌悬浮于一定体积的药学上可接受的液体中。在一些最优选的实施方案中,提供了一种容器,其包含悬浮于药学上可接受的载体中的单一单位剂量的分枝杆菌,其中所述单位剂量包含约1×10
在本发明的方法和/或组合物的上下文中讨论的实施方案可以相对于本文描述的任何其他方法或组合物使用。因此,涉及一种方法或组合物的实施方案也可以应用于本发明的其他方法和组合物。
在一些情况下,将无活性全细胞分枝杆菌施用至个体上或个体中的特定部位。例如,本发明的分枝杆菌组合物(例如特别是包含奥布分枝杆菌的那些)可以邻近肿瘤或邻近淋巴结(例如引流肿瘤周围组织的那些)施用。因此,在某些情况下,分枝杆菌组合物的部位施用可以在后颈部、扁桃体、腋窝、腹股沟、前颈部、下颌下部、颏下或锁骨上的淋巴结附近。
无活性全细胞分枝杆菌可以在患者中存在癌症或肿瘤的持续时间内施用,或直到癌症已经消退或稳定为止。如果癌症或肿瘤已经消退或稳定,也可将全细胞非致病性的热灭活分枝杆菌继续施用至患者。
本发明的分枝杆菌组合物将包含有效量的通常分散于药学上可接受的载体中的分枝杆菌。短语“药学上或药理学上可接受的”是指当施用至动物(例如人,如果合适)时不产生不良反应、过敏反应或其他不利反应的分子实体和组合物。鉴于本发明内容,含有分枝杆菌的药物组合物的制品将是本领域技术人员已知的,如由Remington's PharmaceuticalSciences,18th Ed.Mack Printing Company,1990所示例的。此外,对于动物(例如人类)施用,应理解的是制品应符合无菌性、产热原性、一般安全性和纯度标准。如本文所述的药理学上可接受的载体的具体实例是硼酸盐缓冲液或无菌盐水溶液(0.9%NaCl)。
本文使用的“药学上可接受的载体”包括任何和所有溶剂、分散介质、包衣、表面活性剂、抗氧化剂、防腐剂(例如抗细菌剂、抗真菌剂)、等渗剂、吸收延迟剂、盐、防腐剂、药物、药物稳定剂、凝胶剂、粘合剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、染料等诸如此类的材料及其组合,如本领域普通技术人员已知的(参见例如Remington's PharmaceuticalSciences,18th Ed.Mack Printing Company,1990,pp.1289-1329)。
在一个优选的实施方案中,经选自以下的肠胃外途径施用全细胞非致病性的热灭活分枝杆菌:皮下、皮内、真皮下、腹膜内、静脉内和囊内注射。真皮内注射能够将完整部分的分枝杆菌组合物递送至免疫监视可接近的真皮层,并因此能够在局部淋巴结处选择抗癌免疫应答并促进免疫细胞增殖。
尽管在本发明的高度优选的实施方案中,通过直接真皮内注射施用分枝杆菌组合物,但是也考虑在一些情况下可以使用其它施用方法。
在某些情况下,可以通过注射、输注、连续输注、静脉内、皮内、动脉内、腹膜内、病灶内、玻璃体内、阴道内、直肠内、局部、瘤内、肌内、腹膜内、皮下、结膜下、囊内、粘膜、心包内、眶内、眼内、口内、颅内、关节内、前列腺内、胸膜内、气管内、鼻内、局部(topically)、局部(locally)、吸入(例如气雾剂吸入)、经导管、经灌洗或经其他方法或前述的任何组合施用本发明的全细胞非致病性的热灭活分枝杆菌,如本领域普通技术人员已知的(参见,例如Remington's Pharmaceutical Sciences,18th Ed.Mack Printing Company,1990)。
在另一个实施方案中,将免疫调节剂通过包括多个微针的微针装置施用于检查点抑制剂难治性患者的皮肤中。
下表1给出了用于制造根据本发明的固体微针的各种方法和配制方法。
下表2给出了根据本发明使用的微针装置技术的选择,所述专利和专利申请通过引用并入本文。
根据本发明使用的其他优选的微针装置包括:北卡罗莱纳州立大学(NorthCarolina State University)(如WO2017/151727中所述)、Debioject微针(Debiotech,瑞士)、Micronject600(NaoPass,以色列,如WO2008/047359中所述)、Nanopatch(Vaxxas,USA)、SOFUSA(Kimberly-Clark,USA,如WO2017/189259和WO2017/189258中所述)、MicronBiomedical的溶解微阵列和MIMIX溶解、控释微阵列(Vaxess,USA)。
在一个实施方案中,本发明提供了用于治疗、减少、抑制或控制个体癌症的免疫调节剂,其中该免疫调节剂包括全细胞无活性分枝杆菌,并且其中所述免疫调节剂将通过包括多个微针的微针装置施用于所述个体的皮肤中。
在一个实施方案中,微针是空心的。在一个单独的实施方案中,微针是固体。
在另一个实施方案中,多个微针以线、正方形、圆形、网格或阵列布置。
在另一个实施方案中,微针装置包括每平方厘米2-2000个微针,例如每平方厘米4-1500个微针,或每平方厘米10-1000个微针。
在另一个实施方案中,微针的长度为2-2000微米,例如20-1000微米、或50-500微米、或100-400微米。
在另一个实施方案中,微针被配置为皮内递送免疫调节剂,任选地其中所述免疫调节剂被递送至淋巴管。
在另一个实施方案中,将所述免疫调节剂包被在微针的至少一部分上或包埋在其中,任选地,其中将微针植入皮肤或从皮肤中去除。优选地,所述包被或微针在与皮肤接触时可溶解。
在另一个实施方案中,其中所述微针是空心的,并且所述免疫调节剂以悬浮液的形式通过所述微针皮内递送,任选地,其中所述微针被植入皮肤或从皮肤中去除。
在另一个实施方案中,提供了一种治疗、减少、抑制或控制检查点抑制剂难治性患者的瘤形成、肿瘤或癌症的方法,其中所述方法包括:
(i)提供一种包括多个微针的微针装置,
(ii)使微针刺入个体的皮肤并呈现锚定状态,在锚定状态下微针锚定在皮肤中并从微针装置伸出,
(iii)通过微针将一定量的免疫调节剂递送到皮肤中,其中所述免疫调节剂包括全细胞无活性分枝杆菌。
在另一个实施方案中,提供了一种用于将至少一种免疫调节剂递送至检查点抑制剂难治性患者的皮肤中的部件的试剂盒(kit of parts),其包括:
包括多个微针的微针装置,以及
一种或多种选自以下的免疫调节剂:
全细胞无活性分枝杆菌,例如牝牛分枝杆菌,例如NCTC 11569、奥布分枝杆菌,例如NCTC 13365、副偶然分枝杆菌、金色分枝杆菌、M.indicus pranii、草分枝杆菌及它们的组合,以及;
检查点抑制剂,选自针对CTLA-4、PD-1、PD-L1、PD-L2、LAG-3、B7-H3、B7-H4、B7-H6、A2AR或IDO的细胞、蛋白质、肽、抗体或其抗原结合片段及它们的组合。
在另一个实施方案中,提供了一种微针装置,其包括多个微针,并且在其上或其中包含一种组合物,该组合物包括全细胞无活性分枝杆菌。
通过引用的方式将上述说明书中提到的所有出版物纳入本文。在不脱离本发明的范围和精神的情况下,本发明的所描述的方法和系统的各种修饰和变化对于本领域技术人员将是显而易见的。尽管已经结合具体的优选实施方案描述了本发明,但是应理解,所要求保护的本发明不应该不适当地限于这些具体实施方案。实际上,对于生物化学和免疫学或相关领域的技术人员来说显而易见的用于实施本发明的所述模式的各种修饰意欲在以下权利要求的范围内。
参考以下非限制性实施例进一步描述本发明。
实施例1
用从KPC小鼠获得的来自胰腺癌细胞系的10
当注射的肿瘤细胞已经成长为可触及的肿瘤(第0天)时,使小鼠不经治疗或接受以下治疗:
1)0.1mg热灭活的全细胞奥布分枝杆菌NTCT 13365/只小鼠,在5天的时间内在交替的日子在颈背部和尾部基部交替地进行皮下注射,在研究长度上间歇2天;
2)每周一次腹膜内注射10mg/kg抗PDL-1单抗;
3)以上述用于单独使用的两种化合物的剂量和时间表,组合抗PDL-1和奥布分枝杆菌NTCT 13365。
在整个研究过程中监测肿瘤生长,以确定所施用的治疗是否具有减小肿瘤尺寸和改善存活前景的作用。
图1中显示的数据证明,接受抗-PDL-1和奥布分枝杆菌NTCT 13365的治疗组合的小鼠表现出肿瘤尺寸的持续减小并且似乎控制了肿瘤。与接受任一单独治疗的小鼠相比,该肿瘤尺寸的减小更为显著。未经治疗的小鼠的肿瘤生长不受控制,并很快死于疾病。
实施例2
在携带皮下检查点抗性B16-F10肿瘤的C57BL/6小鼠中研究了使用IMM-101(热灭活的全细胞奥布分枝杆菌NTCT 13365)和检查点抑制剂的组合治疗的效果。将小鼠在D0移植。将小鼠在D1随机分组,单独地在D1、D3、D5、D7、D9、D11、D13和D15(存活小鼠的一半)或D16(存活小鼠的一半)(Q2Dx8)以0.1mg/只小鼠总共接受8次IMM-101的皮下注射或单独地以10mg/kg总共接受4次抗PD1或抗CTLA4的腹膜内注射(每周两次,连续两周,在D1、D5、D8和D12:TWx2)或两者组合。在第15和16天,将所有存活小鼠的一半在最后一次治疗后杀死(terminated),然后通过FACS分析对肿瘤免疫浸润细胞和脾脏免疫细胞(CD8+细胞与FoxP3Treg细胞的比率)表征进行定量(图3)。可以看出,CD8+与Treg的比率增加,这将转化为增强的人检查点难治性患者中的肿瘤消退效果。
实施例3
将1x10
实施例4
将IMM-101(300μg)在足底皮下注射至C57BL/6WT或Batf3-/-小鼠。7天后收获引流的LN,并单独使用IMM-101或培养基重新刺激72小时。A)实验步骤示意图,B)再刺激后,通过ELISA测量上清液中的IFN-g水平。Baft3-/-小鼠失去了IMM-101体内诱导IFN-γ分泌的能力,表明在该通路中需要CD103+树突状细胞(图8)。
实施例5
已经开展了一项研究,与IMM 101联合检查点抑制剂治疗在患有晚期黑色素瘤放射诱发的免疫原性肿瘤坏死的患者中的安全性和有效性研究组合,以在患有先前治疗过的结直肠癌的患者中研究热灭活的全细胞奥布分枝杆菌(IMM-101)的制剂的效果。
接受治疗的患者表现出不可切除的III期或IV期转移性黑色素瘤,这些患者先前未接受过治疗(A组),或者在PD-1阻断期间疾病已发展(B组)。
这项研究旨在研究IMM-101与纳武利尤单抗的组合是否具有良好的耐受性,并研究该组合在未接受治疗的患者(A组)和在PD-1阻断期间疾病已发展的患者(B组-检查点难治性/抗性患者)中的疗效信号。
IMM-101以单次0.1mL皮内注射IMM 101(10mg/mL)的方式注射到位于三角肌上方的皮肤中,手臂在每次剂量之间交替使用。研究人员将事先接受皮内注射技术的适当培训。
先前使用IMM-101的临床经验表明,该剂量安全且耐受性良好。在注射部位发生的皮肤反应的特征是红斑、局部肿胀和偶发的轻度溃疡。考虑到产品的已知药理作用和先前的临床经验,所有症状均应预料到。此外,使用IMM 101进行的安全性和耐受性研究得出的数据表明,随着时间的推移,皮肤反应会令人满意地解决,并且不会损害日常活动。
在研究中,对每位患者首次施用IMM-101,然后在医疗监督下至少2小时内监测生命体征,并使用复苏设备作为预防措施。
治疗方案是前3剂每2周给予1剂IMM 101,然后休息4周,然后对于接下来的3剂,每2周给予1剂。此后将每隔4周施用一次,并允许+/-2天的窗口。
纳武利尤单抗和伊匹单抗根据处方信息施用。根据评估表,在与IMM-101于同一天同时施用纳武利尤单抗或伊匹单抗时,患者将首先接受IMM-101。在第一剂IMM-101后至少2小时向研究中的每位患者施用第一剂纳武利尤单抗。
对于B组的患者,伊匹单抗可以代替纳武利尤单抗与IMM-101一起用作后续治疗,因为他们继续根据RECIST 1.1进行研究和/或研究者认为由于临床进展原因,继续接受纳武利尤单抗不再合适。
两个组中的患者均继续治疗,直至疾病进展(通过实体瘤疗效评估标准[RECIST]1.1评估)符合以下条件:不可接受的副作用,研究者中止治疗的决定,撤回患者的同意书、或18个月的IMM-101治疗,以较早者为准。两次扫描检查后保持完全缓解的患者应继续治疗,除非研究者认为这与患者的最大利益无关。A组和B组中有疾病进展的患者,如果他们具有临床获益且性能没有下降,并且研究者确定该研究治疗没有临床相关不良反应,或不被视为需要替代治疗,则可以在研究中继续使用纳武利尤单抗+IMM-101进行治疗。
B组患者对IMM-101+纳武利尤单抗的治疗无响应,即,他们已有RECIST 1.1记录的进展或临床进展(但不符合针对进展性疾病的RECIST1.1规则),并且在两种情况下均无先前记录的响应,如果研究者认为这符合患者的最大利益,并且患者先前没有接受过伊匹单抗的非研究性研究(单一疗法或联合治疗),则可以选择在研究中更改治疗方案为伊匹单抗+IMM-101。由于,这种治疗可以一直持续到接受最大4剂的伊匹单抗或因不可接受的副作用、研究者决定终止治疗、撤消患者的同意书或18个月的IMM-101治疗(以较早者为准)而提前终止。B组中接受所有4剂量的伊匹单抗的患者在此时间之后应继续研究并遵循方案评估。他们可以在此期间继续接受IMM 101,直到出现不可接受的副作用、研究者决定终止治疗、撤消患者的同意书或18个月的IMM-101治疗(以较早者为准)。在基线评估之后,将根据研究评估时间表对所有患者进行安全性、对治疗的反应(通过计划扫描)和生存率的评估,并让所有患者有机会接受18个月的IMM-101治疗研究。首次基线后计划扫描,对于A组的患者在第12周,对于B组的患者在第6周。随后的扫描是每8周一次,如果临床上有指征,则可以进行非计划扫描,例如,以确认进展。根据研究者的判断,对于继续研究超过52周的患者,扫描频率可以增加到每12周一次。
根据处方信息,每两周以3mg/kg的静脉输注方式施用纳武利尤单抗。在同一天施用纳武利尤单抗和IMM 101的情况下,将首先施用IMM 101。在第一剂IMM-101后至少2小时向研究中的每位患者施用第1剂纳武利尤单抗。如果发生毒性反应,可以延迟剂量。
如果用于B组患者的研究,依处方信息,伊匹单抗每3周以超过90分钟的3mg/kg静脉输注施用最多4剂。伊匹单抗的首剂可以在研究期间的任何时间开始,但必须在纳武利尤单抗的最后一剂后至少2周。在同一天施用伊匹单抗和IMM 101的情况下,将先施用IMM101。如果发生毒性反应,可以延迟剂量,但是所有伊匹单抗剂量必须在首剂施用的16周内施用。
B组中接受所有4剂伊匹单抗的患者在此时间之后应继续研究并遵循方案评估。他们可能会在此期间继续接受IMM 101,直到出现不可接受的副作用、研究者决定终止治疗、撤消患者的同意书或18个月的IMM-101治疗(以较早者为准)为止。
实施例6
如实施例2中所用,在携带皮下检查点抗性B16-F10(黑色素瘤)肿瘤的C57BL/6j小鼠中研究了使用IMM-101(热灭活的全细胞奥布分枝杆菌NTCT 13365)和检查点抑制剂的组合治疗的效果。给小鼠接种50,000个肿瘤细胞,然后当肿瘤体积达到54-125mm
结果显示在图9-14中,显示了平均TV+/-SE(图9)、没有SE的平均TV(图10)、直到研究第16天的没有SE的平均TV(图11)、中位TV(图12)、直到研究第16天的中位TV(图13)、以及卡普兰-梅尔分析生存图(图14)。
每组和研究日的肿瘤生长抑制率(%)的计算表明,第3组(仅抗PD1)在研究第16天的%TGI为29.07%,而第4组(IMM-101加抗PD-1)在研究第16天时显示的%TGI为52.90%。
从图9-14可以看出,根据%TGI值,与单独的抗PD1相比,在该检查点难治性小鼠模型中,IMM-101和抗PD1的组合功效显著提高,特别是当IMM-101在肿瘤附近皮下施用。此外,与单独的抗PD1相比,所述组合还导致更大的存活百分比。
实施例7
在携带皮下检查点抗性Pan02(胰腺)肿瘤的C57BL/6j小鼠中研究了使用IMM-101(热灭活的全细胞奥布分枝杆菌NTCT 13365)和检查点抑制剂的组合治疗的效果。给小鼠接种3,000,000个肿瘤细胞,然后当肿瘤体积达到63-124mm
结果显示在图15-19中,显示了平均TV+/-SE(图15)、没有SE的平均TV(图16)、直到研究第37天的没有SE的平均TV(图17)、中位TV(图18)、以及直到研究第37天的中位TV(图19)。
每组和研究日的肿瘤生长抑制率(%)的计算表明,第3组(仅抗PD1)在研究第30天(当该组中的所有小鼠均终止时)表现出最大%TGI为-9.24%,而第4组(癌周IMM-101加抗PD-1)在研究第41天显示%TGI为56.22%,第2组(仅癌周IMM-101)在研究第41天显示%TGI为46.93%。
从图15-19可以看出,根据%TGI值,与单独的抗PD1相比,在该检查点难治性小鼠模型中,IMM-101和抗PD1的组合功效显著提高,特别是当IMM-101单独或与抗D1组合在肿瘤附近皮下施用时。此外,与单独的抗PD1相比,所述组合或IMM-101单一疗法还导致更大的存活率。
- IRE1α抑制剂与癌症治疗剂联合用于癌症治疗
- 利用介电加热的癌症治疗方法中所使用的辅助剂以及癌症治疗方法
