细胞分离装置、系统和方法
文献发布时间:2023-06-19 10:40:10
本申请是申请号为201680037336.2、发明名称为细胞分离装置、系统和方法的中国专利申请的分案申请,原申请是申请日为2016年12月29日的国际申请PCT/US2016/069115的中国国家阶段申请。
相关申请
本申请要求于2015年12月29日提交的美国临时申请号62/272,533的优先权,其通过引用以其整体并入本文。
技术领域
本申请涉及细胞分离装置、系统和方法。
背景技术
最近的临床试验证实某些罕见的干细胞、祖细胞或免疫细胞群在再生医学和免疫疗法中具有临床效用(参考文献)。这样的稀有靶细胞可能比血液或骨髓中其它细胞的数量少差不多五个数量级(10
其余大约<0.6%的正常血容量由WBC和血小板(PLT)组成。PLT是小而形状不规则的无核细胞,其数量上超过WBC~30倍的倍数。PLT通过止血和释放多种生长因子修复和再生损伤组织而在止血和愈合中起根本性作用。然而,它们的粘附性质干扰了所述稀有的临床重要靶细胞的有效富集和纯化。最不普遍的血细胞是WBC,在典型血样中仅占总细胞的千分之一。WBC对身体的免疫系统是关键性的,并参与身体对抗感染性疾病、外来物质以及血液及实体肿瘤癌症的防御。几乎所有在临床上用于免疫疗法或再生医学的细胞都存在于WBC部分内,WBC可以进一步分成亚群。最大和最致密的亚群是粒细胞(GRN),其占所有WBC的约60%。较小且密度较低的亚群是单核细胞(MNC),其占剩余约40%。MNC可以进一步分成淋巴细胞和单核白细胞,但是由于在每个细胞中存在单个圆核,所以它们统称为MNC。MNC是免疫系统的关键性成分,包括T细胞、B细胞和NK细胞,其迁移到身体组织中的感染部位,然后分裂并分化为巨噬细胞和树突状细胞以引发免疫应答。目前正在临床试验中研究的许多细胞疗法都利用了存在于MNC部分内的细胞。
因此,为了从血液、骨髓或单采白细胞(leukapheresis)中纯化稀有的细胞群,需要初始的本体贫化步骤(bulk depletion step)以基本上除去所有数量上多得多的RBC、GRN和PLT以产生富集的MNC部分。如前面提到,这可以利用离心来实现。离心是由FDA分类为“最低限度操纵”的细胞处理方法,最低限度操纵为FDA批准提供了较简单的法规途径。单独对血液进行这种初始本体贫化过程可以将存在于MNC部分中的稀有细胞群富集三个数量级(10
目前用于分离靶细胞的方法从手工分离MNC的方法开始,需要高度熟练的操作者用密度梯度介质例如Ficoll来工作。密度梯度介质是介于例如粒细胞和MNC的密度中间的精确密度的小粒子,以致当合并和离心时,所述粒子分层并在粒细胞层和MNC层之间插入其层,使得更易达到随后在不存在粒细胞下移液管收取MNC。随后对MNC内最终靶细胞的纯化需要昂贵且复杂的仪器和昂贵的试剂。这些现行方法也具有低通量率,不适合纯化与大量不需要的细胞混合的稀有细胞,或者靶细胞分离和收获的效率低。这些方法也可能使细胞暴露于可能对该细胞有不利影响的化学剂,或者需要使用存在微生物污染细胞风险的功能开放系统。因此,需要新的技术来实现高效、高通量、甚少或无需人工干预地分离、离析、纯化或交换悬浮有稀有细胞的介质,同时采用简单的设备、细胞相容的试剂、以及功能封闭的无菌系统。
发明内容
本发明提供了一种装置和方法,其用于富集和/或纯化主液中基本上任何或所有的所需细胞,包括稀有的所需细胞例如干细胞、祖细胞或免疫细胞,同时在无菌条件下维持细胞活力。在各种体积的以含有临床相关数量的干细胞、祖细胞或免疫细胞的血液、骨髓或单采白细胞为例的细胞类型上实践本发明,可以提供在回收率、活力和纯度上显著高于可通过所有其它已知装置所获得的靶细胞组成。
因此,第一方面,本发明提供了一种细胞分离系统,其包含:
(a)套筒(cartridge),其包含
(i)包含至少一个输入口、第一出口和第二出口的处理容器;
(ii)包含输入口的第二容器;
(iii)包含输入口和第一出口的第三容器;
(iv)连接处理容器的第一出口和第二容器的输入口的第一导管,其中第一导管包含第一可逆关闭装置,其中第二容器与处理容器瞬时流体连接,使得当第一可逆关闭装置打开时,只可发生从处理容器向第二容器的流体流动;
(v)连接处理容器的第二出口和第三容器的输入口的第二导管,其中第二导管包含第二可逆关闭装置,其中第三容器与处理容器瞬时流体连接,使得当第二可逆关闭装置打开时,只可发生从处理容器向第三容器的流体流动;
(b)包含至少一个端口的转移容器;
(c)至少第三导管,其连接
(i)第三容器的第一出口与转移容器的所述至少一个端口,和
(ii)转移容器的所述至少一个端口与处理容器的所述至少一个输入口;
其中所述至少第三导管包含至少第三可逆关闭装置,使得(A)第三容器与转移容器瞬时流体连接,和(B)转移容器与处理容器瞬时流体连接,其中所述至少第三导管配置成使得下列中仅一项可以成立
(I)当所述至少第三可逆关闭装置打开时,只可发生从第三容器向转移容器的流体流动;或
(II)当所述至少第三可逆关闭装置打开时,只可发生从转移容器向处理容器的流体流动;以及
(d)控制模块,其配置成控制在至少套筒、以及第一和第二导管中的活动。
在一种实施方式中,转移容器在套筒的内部。在另一种实施方式中,所述至少第三导管包含单个导管。在另一种实施方式中,所述至少第三导管包含设置在第三容器和转移容器之间以及转移容器和处理容器之间的T或Y型连接器。
在一种实施方式中,转移容器的所述至少一个端口包含第一输入口和出口。在这样的实施方式中,所述至少第三导管包含:
(i)连接第三容器的出口和转移容器的输入口的第三导管,其中第三导管包含第三可逆关闭装置,使得第三容器与转移容器瞬时流体连接,使得当第三可逆关闭装置打开时,只可发生从第三容器向转移容器的流体流动;以及
(ii)连接转移容器的出口和处理容器的所述至少一个输入口的第四导管,其中第四导管包含第四可逆关闭装置,使得转移容器与处理容器瞬时流体连接,使得当第四可逆关闭装置打开时,只可发生从转移容器向处理容器的流体流动。
在又一种实施方式中,处理容器的所述至少一个输入口包含第一输入口和第二输入口,其中所述至少第三导管或第四导管(当存在时)将转移容器的出口与处理容器的第一输入口连接。在这样的实施方式中,细胞分离系统可以还包含将处理容器的第二输入口与至少一个介质储器连接的第一介质输入导管,其中第一介质输入导管包含至少第五可逆关闭装置,其中所述至少一个介质储器与处理容器瞬时流体连接,使得当所述至少第五可逆关闭装置打开时,只可发生从所述至少一个介质储器向处理容器的流体流动。
在一种实施方式中,转移容器的所述至少一个端口包含第二输入口。在这样的实施方式中,细胞分离系统还可以包含将转移容器的第二输入口与至少一个介质储器连接的第二介质输入导管,其中第二介质输入导管包含至少第六可逆关闭装置,其中所述至少一个介质储器与处理容器瞬时流体连接,使得当所述至少第六可逆关闭装置打开时,只可发生从所述至少一个介质储器向转移容器的流体流动。
在一种实施方式中,细胞分离系统还包含混合器。在一个具体示例中,混合器包含静态混合器。在又一种实施方式中,混合器包含设置在套筒顶壁的内表面上的叶轮。在另一种实施方式中,混合器包含与套筒顶壁的内表面间隔开的叶轮。在另一种实施方式中,混合器包含蠕动泵,蠕动泵包含具有第一端和第二端的泵导管,其中泵导管的第一端定位在处理室中,并且其中泵导管的第二端定位在处理室的外部并与处理室的至少一个输入口连接。在再另一种实施方式中,混合器包括混合模块,混合模块包含底部部分和顶部部分,其中套筒配置成定位在底部部分中,并且其中顶部部分配置成与底部部分可卸式联接。在这样的实施方式中,混合模块可以包括与底部部分联接的可旋转组件,使得可旋转组件配置成在其立轴上将套筒旋转180度或360度。在另一种实施方式中,混合模块可以配置成当套筒定位在混合模块的底部部分中时增加套筒的温度。
在一种实施方式中,第一介质输入导管和/或第二介质输入导管还包含过滤器。在另一种实施方式中,第二容器包含与第一废物导管联接的出口。在又一种实施方式中,处理容器还包含与第二废物导管联接的无菌排出口。
在另一个方面,本发明提供了一种细胞分离方法,所述方法包含:
(a)在功能封闭系统中处理体积为至少10mL(或者,可选地,至少25mL,至少50mL,至少75mL,至少100mL,至少200mL)的主液,其中所述主液包含(i)靶细胞,和(ii)浮力试剂,其中所述处理包含使靶细胞和浮力试剂在适于促进所述细胞附着于一种或多种所述浮力试剂的条件下接触一定时间以生成附着的靶细胞;
(b)向功能封闭系统内的主液施加矢量力例如离心,以引起附着的靶细胞在主液内分层;以及
(c)将附着的靶细胞隔离到功能封闭系统内的区域。
在一种实施方式中,浮力试剂包含制造的浮力试剂,其中各种制造的浮力试剂包含这样的浮力试剂,其中浮力标签(buoyant label)和结合剂在与主液中的靶细胞接触之前彼此附着以形成制造的浮力试剂。在另一种实施方式中,浮力试剂包含在主液内组装的二级浮力试剂,其中方法还包含在步骤(a)之前的预处理步骤,其中预处理步骤包含使主液与浮力标签和结合剂在适于促进结合剂与浮力标签附着的条件下接触一定时间以产生浮力试剂。
在一种实施方式中,各浮力标签包含
(i)各结合剂包含(A)包含能够与靶细胞上的至少一个细胞表位结合的作用剂的初级结合剂,(B)与初级结合剂结合的第一连接子,其中第一连接子包含具有第一互补区的第一寡核苷酸;
(ii)各浮力标签包含与浮力标签结合的第二连接子;
其中第二连接子包含具有第二互补区的第二寡核苷酸,其中第二互补区与第一互补区完全互补,并且其中第一和第二互补区的杂交体具有至少40℃的计算Tm;
其中预处理步骤包含使主液与浮力标签和结合剂在适于促进第一和第二互补区杂交的条件下接触一定时间以产生浮力试剂;
其中所述处理包含使靶细胞和浮力试剂在适于生成附着的靶细胞的条件下在主液中接触;并且其中所述方法还包含
(d)在步骤(c)之后,在功能封闭系统内使附着的靶细胞经受37℃或更低的温度达足以使第一互补区和第二互补区去杂交的一定时间以从靶细胞释放浮力试剂。
在另一个方面,本发明提供了一种细胞分离方法,所述方法包含:
(a)提供主液,其中主液包含附着的靶细胞,其中每个附着的靶细胞包含
(i)与靶细胞上的至少一个细胞表位结合的结合剂,
(ii)与结合剂结合的第一连接子,其中第一连接子包含具有第一互补区的第一寡核苷酸;
(iii)浮力标签,其包含与所述浮力标签结合的第二连接子,其中第二连接子包含具有第二互补区的第二寡核苷酸,其中第二互补区与所述第一互补区完全互补,其中第二互补区与第一互补区杂交以形成杂交体,并且其中第一和第二互补区的杂交体具有至少40℃的计算Tm;
(b)向主液施加矢量力例如离心,以引起附着的靶细胞在主液内分层;
(c)将附着的靶细胞隔离;以及
(d)在步骤(c)之后,使附着的靶细胞经受37℃或更低的温度达足以使第一互补区和第二互补区去杂交的一定时间以从靶细胞释放浮力标签。
在一种实施方式中,在步骤(a)之前通过处理步骤生成附着的靶细胞,所述处理步骤包含使主液中的靶细胞与所制造的包含结合剂、第一连接子和第二连接子的浮力试剂接触,其中第二互补区与第一互补区杂交以形成杂交体;其中所述接触在适于促进所述细胞与一种或多种所制造的浮力试剂附着的条件下进行一定时间以生成附着的靶细胞。在另一种实施方式中,在步骤(a)之前通过处理步骤生成附着的靶细胞,所述处理步骤包含:(A)使主液与浮力标签和结合有第一连接子的结合剂在适于促进第一和第二互补区杂交的条件下接触一定时间以产生浮力试剂;和(B)使靶细胞和浮力试剂在适于生成附着的靶细胞的条件下在主液中接触一定时间。
在这些方面中的任一个中,计算Tm可以是利用最近邻二态模型(nearest-neighbor two-state model)计算的Tm:
其中ΔΗ°(焓)和ΔS°(熵)是在所使用的离子条件下从序列和所公布的最近邻热力学参数计算的熔融参数,R是理想气体常数(1.987calK
在本发明任何方法的另一种实施方式中,结合剂与靶细胞上的细胞表位结合。在另一种实施方式中,各浮力试剂包含一个或多个第二连接子,其中所述一个或多个第二连接子与附着至少一种结合剂的一个或多个第一连接子结合,其中所述至少一种结合剂能够与靶细胞上的细胞表位结合;并且其中所述接触包含使靶细胞和浮力试剂在适于促进靶细胞与浮力试剂中的一种或多种附着的条件下接触一定时间以生成附着的靶细胞。在另一种实施方式中,所述处理可以包含:(i)使主液与初级结合剂接触,其中各初级结合剂包含(A)能够与靶细胞上的至少一个细胞表位结合的作用剂,和(B)与所述作用剂结合的第一连接子;其中所述接触在适于促进靶细胞与初级结合剂附着的条件下发生以产生靶细胞-结合剂复合物;以及(ii)将靶细胞-结合剂复合物与浮力标签一起温育,其中各浮力标签包含第二连接子,其中第二连接子能够与第一连接子结合,其中所述温育在适于促进第一连接子与第二连接子结合的条件下发生以生成附着的靶细胞。在一种实施方式中,步骤(i)和(ii)之间不存在除去未结合的初级结合剂的中间步骤。
在又一种实施方式中,本发明的方法还可以包含在功能封闭系统内将浮力标签与靶细胞分离以产生分离的靶细胞。在本发明方法的一种实施方式中,靶细胞是所需细胞,并且所述方法可以包含在隔离后浓缩所需细胞和产生分离的靶细胞的进一步步骤。
在本发明方法的另一种实施方式中,靶细胞和/或所需细胞可以选自由以下组成的组:肿瘤细胞,癌干细胞,在正常血液、胎盘/脐带血、骨髓中发现的造血干细胞和祖细胞、间充质干细胞和祖细胞、脂肪源性干细胞和祖细胞、内皮祖细胞,白细胞,粒细胞,单核细胞,淋巴细胞,单核白细胞,T细胞,B细胞,NK细胞,驻留在脂肪组织中的基质血管部分细胞,培养细胞,基因修饰细胞,以及这样的靶细胞的亚群。在具体实施方式中,靶细胞和/或所需细胞可以选自由以下组成的组:CD3+细胞,CD4+细胞,CD235a,CD14+,CD19+,CD56+,CD34+,CD117
在本发明方法的各种其它实施方式中,靶细胞和/或所需细胞占未贫化的主液中细胞的少于10%、5%、4%、3%、2%或1%。在各种其它实施方式中,所需细胞的回收效率大于68%、或大于75%、或大于80%、或大于85%、或大于90%、或大于95%。在其它实施方式中,分离的所需细胞的存活率大于90%、或大于95%、或大于97%、或大于99%。在其它实施方式中,靶细胞和/或所需细胞占主液中总细胞的少于20%、10%、5%、4%、3%、2%或1%。
在本发明方法的一种实施方式中,结合剂可以选自由抗体、寡核苷酸、适配体、分子印记聚合物、碳水化合物、蛋白质、肽、酶、小分子、脂质、脂肪酸、金属原子、金属离子或合成聚合物组成的组。在一种具体实施方式中,结合剂包含抗体。在其它实施方式中,第一连接子和第二连接子可包含生物素、亲和素、链霉亲和素、寡核苷酸、抗体结合蛋白、和/或被抗体结合蛋白或任何第二相连结合剂结合的部分。在具体实施方式中,第一连接子和第二连接子包含单独或与寡核苷酸组合的生物素和/或链霉亲和素。
在本发明方法的另一种实施方式中,浮力标签可以选自由充气泡、中空聚合物、玻璃珠、夹带气体的微孔珠、不混溶液体的液滴、金纳米粒子和银纳米粒子组成的组。在一种具体实施方式中,浮力标签包含充气泡。在另一种具体实施方式中,充气泡包含被脂质、磷脂、碳水化合物或蛋白质壳包围的全氟化碳气体芯。在另一种具体实施方式中,充气泡包含被磷脂壳包围的全氟化碳气体芯。在另一种实施方式中,充气泡的直径可以在约1μm和约6.5μm之间。在另一种具体实施方式中,主液可以是外周血、脐带血或单采白细胞。
在一种实施方式中,用于本发明方法中的功能封闭系统包含细胞分离系统,后者包含
(a)套筒,其包含
(i)包含至少一个输入口、第一出口和第二出口的处理容器;
(ii)两个或更多个另外的容器,其至少包括包含输入口的第二容器;以及包含输入口和第一出口的第三容器;
(ii)连接处理容器的第一出口和第二容器的输入口的第一导管,其中第一导管包含第一可逆关闭装置,其中第二容器与处理容器瞬时流体连接,使得当第一可逆关闭装置打开时,只可发生从处理容器向第二容器的流体流动;
(v)连接处理容器的第二出口和第三容器的输入口的第二导管,其中第二导管包含第二可逆关闭装置,其中第三容器与处理容器瞬时流体连接,使得当第二可逆关闭装置打开时,只可发生从处理容器向第三容器的流体流动;
(b)包含至少一个端口的转移容器;
(c)至少第三导管,其连接
(i)第三容器的第一出口与转移容器的所述至少一个端口,和
(ii)转移容器的所述至少一个端口与处理容器的所述至少一个输入口
其中所述至少第三导管包含至少第三可逆关闭装置,使得(A)第三容器与转移容器瞬时流体连接,和(B)转移容器与处理容器瞬时流体连接;其中所述至少第三导管配置成使得下列中仅一项可以成立
(I)当所述至少第三可逆关闭装置打开时,只可发生从第三容器向转移容器的流体流动;或
(II)当所述至少第三可逆关闭装置打开时,只可发生从转移容器向处理容器的流体流动。
在本发明方法的另一种实施方式中,待处理的主液是贫化的主液,并且在所述处理或预处理步骤之前,所述方法包含向功能封闭系统内、例如处理容器内未贫化的主液施加矢量力例如离心,以清除非所需细胞,例如通过将非所需细胞通入第二容器中,从而产生待处理的贫化的主液。在又一种实施方式中,贫化的主液从处理容器传送到转移容器并与浮力试剂混合以开始处理主液。在一种实施方式中,靶细胞是所需细胞,并且其中隔离包含将分离的靶细胞传送到第三容器。在另一种实施方式中,靶细胞不是所需细胞,并且隔离包含将分离的靶细胞在功能封闭系统内浓缩。在又一种实施方式中,细胞分离系统还包含控制模块,用于控制在至少套筒以及第一和第二导管中的活动。在本发明任何方法的一种实施方式中,功能封闭系统可以包含本发明的任何实施方式或实施方式组合的细胞分离系统。
在另一个方面,本发明提供了一种细胞悬液,其包含:
(a)体积为至少1mL(或者,可选地,至少2ml、5ml、10ml、15ml、30ml、25mL、至少50mL、至少75mL、至少100mL、至少200mL)的液体介质;和
(b)悬浮在液体介质中的所需细胞,其中所需细胞选自以下细胞组成的组:在正常血液、胎盘/脐带血、骨髓中发现的造血干细胞和祖细胞、间充质干细胞和祖细胞、内皮祖细胞,白细胞,粒细胞,单核细胞,淋巴细胞,单核白细胞,T细胞,B细胞,NK细胞,驻留在脂肪组织中的基质血管部分细胞,培养细胞,基因修饰细胞,以及这样的所需细胞的亚群;其中所需细胞存在于液体介质中并且其中所需细胞占细胞悬液中细胞的至少80%;
其中所需细胞存活率大于90%、或大于95%、或大于97%、或大于99%;并且
其中细胞悬液存在于功能封闭的细胞分离系统内,或者直接从所述功能封闭的细胞分离系统获得,无需进一步处理。
在一种具体实施方式中,所需细胞可以选自由以下细胞组成的组:CD3+细胞,CD4+细胞,CD235a,CD14+,CD19+,CD56+,CD34+,CD117
在各种实施方式中,存活的所需细胞的数量是至少1x 10
另一个方面,本发明提供了一种组合物,其包含:
(a)至少一种与至少一个第一连接子共价或非共价连接的结合剂,所述至少一种结合剂能够结合细胞悬液中细胞上的至少一个分子靶标;以及
(b)至少一种与至少一个第二互补连接子共价或非共价连接的浮力标签,所述至少一种浮力标签表现出密度显著不同于待分离的细胞悬浮于其中的液体介质的密度。
另一个方面,本发明提供了一种试剂盒,其包含:
(i)初级结合剂,其包含能够与靶细胞上的至少一个细胞表位结合的作用剂;
(ii)与所述作用剂结合的第一连接子,其中第一连接子包含具有第一互补区的第一寡核苷酸;
(iii)浮力标签;
(iv)与浮力标签结合的第二连接子,其中第二连接子包含具有第二互补区的第二寡核苷酸,其中第二互补区与第一互补区完全互补,并且其中第一和第二互补区的杂交体具有至少40℃的计算Tm。
另一个方面,本发明提供了一种组合物,其包含:
(i)初级结合剂,其包含能够与靶细胞上的至少一个细胞表位结合的作用剂;
(ii)与所述作用剂结合的第一连接子,其中第一连接子包含具有第一互补区的第一寡核苷酸;
(iii)浮力标签;
(iv)与浮力标签结合的第二连接子,其中第二连接子包含具有与第一互补区完全互补的第二互补区的第二寡核苷酸,其中第一和第二连接子的互补区的杂交体具有至少40℃的计算Tm。
其中第一连接子和第二连接子彼此杂交。在一种实施方式中,组合物还包含与初级结合剂结合的靶细胞。
在本发明的组合物和试剂盒的一种实施方式中,所述计算Tm可以是利用最近邻二态模型计算的Tm:
其中ΔΗ°(焓)和ΔS°(熵)是从序列和所公布的最近邻热力学参数计算的熔融参数,R是理想气体常数(1.987calK
在本发明的组合物和试剂盒的各种实施方式中,初级结合剂可以选自由抗体、寡核苷酸、适配体、分子印记聚合物、碳水化合物、蛋白质、肽、酶、小分子、脂质、脂肪酸、金属原子、金属离子或合成聚合物组成的组。在一种具体实施方式中,初级结合剂包含抗体。在另一种具体实施方式中,第一连接子和第二连接子之一还包含生物素(任选与寡核苷酸杂交对的第一成员联接),并且另一个还包含链霉亲和素(任选与寡核苷酸杂交对的第二成员联接)。在各种其它实施方式中,浮力标签可以选自由充气泡、中空聚合物、玻璃珠、夹带气体的微孔珠(microporous based with entrained gas)、不混溶液体的液滴、金纳米粒子和银纳米粒子组成的组。在一种具体实施方式中,浮力标签包含充气泡。在各种实施方式中,充气泡可以包含被脂质、磷脂、碳水化合物或蛋白质壳包围的全氟化碳气体芯。在另一种具体实施方式中,充气泡包含被磷脂壳包围的全氟化碳气体芯。在另一种具体实施方式中,充气泡的直径在约1μm和约6.5μm之间。
另一个方面,本发明提供了一种组合物,其包含经由浮力活化的细胞分选而从至少一种分子类型的所需细胞和至少一种分子类型的非所需细胞的起始混合物中纯化的所需细胞,其中所述起始混合物含有非所需细胞数量的至少1倍的所需细胞,或者非所需细胞数量的至少5倍的所需细胞,或者非所需细胞数量的至少10倍的所需细胞,或者非所需细胞数量的至少50倍的所需细胞,或者非所需细胞数量的至少100倍的所需细胞,或者非所需细胞数量的至少500倍的所需细胞,或者非所需细胞数量的至少1000倍的所需细胞,其中:
所述至少一种类型的所需细胞的回收效率大于80%、或大于85%、或大于90%、或大于95%;
所述至少一种类型的所需细胞的纯度大于80%、或大于85%、或大于90%、或大于95%;
所述至少一种类型的所需细胞的存活率大于90%、或大于95%、或大于97%、或大于99%;以及
经受浮力活化细胞分选的所述至少一种分子类型的所需细胞和至少一种分子类型的非所需细胞的混合物的体积大于10mL、或大于50mL、或大于100mL、或大于150mL、或大于200mL、或大于400mL、或大于800mL。
附图说明
图1是根据示例性实施方式,细胞分离系统的分解图。
图2是根据示例性实施方式,细胞分离系统的套筒的横截面图。
图3是根据示例性实施方式,细胞分离系统的侧视图。
图4A是根据示例性实施方式,套筒顶壁上的示例性静态混合器的透视图。
图4B是根据示例性实施方式,图4A的示例性静态混合器的底视图。
图5A是根据示例性实施方式,套筒顶壁上的另一种示例性静态混合器的透视图。
图5B是根据示例性实施方式,图5A的示例性静态混合器的底视图。
图6是根据示例性实施方式,在套筒的斗中的示例性混合器的横截面图。
图7是根据示例性实施方式,套筒的示例性蠕动泵的横截面图。
图8是根据示例性实施方式,示例性混合模块的分解图。
图9显示了本发明实施方式的示例性流程图,其中所需细胞是CD3+细胞,并且方法包含使用本文所述的细胞分离系统。
图10显示了本发明实施方式的示例性流程图,其中进行两个或更多个差速离心步骤以依次除去非所需细胞。
图11总结了利用本发明方法的示例性实施方式生成的实验数据。
图12总结了利用本发明的方法和系统的示例性实施方式生成的实验数据。
具体实施方式
在本文中使用时,除非上下文另有明确规定,否则不带数量指示的指称物包括复数指示物。“和”在本文中使用时与“或”可互换使用,除非另有明确说明。
在本文中使用时,术语“约”意指所列举的参数的+/-5%。
除非上下文另有明确规定,否则本发明的任何方面的所有实施方式均可组合使用。
除非上下文另有明确要求,否则在整个说明和权利要求书中,单词‘包含’等应以包括性意义而不是排它或穷举的意义解释;就是说,以“包括但不限于”的意义。采用单数或复数的单词也分别包括复数和单数。另外,当在本申请中使用时,单词“在本文中”、“上文”和“下文”以及类似含义的单词应该是指作为整体的本申请而不是本申请的任何特定部分。
本公开实施方式的描述不旨在穷举或将本公开限制到所公开的精确形式。虽然本文中出于说明目的描述了本公开的具体实施方式和实施例,但是如相关领域的技术人员将认识到的,在本公开的范围内可能有各种等效修改。
参考附图,图1示出了示例性细胞分离系统100。如图1所示,细胞分离系统100可以包括套筒102、控制模块104和对接站(docking station)106。在本文中使用时,“套筒”是封闭的外壳(具有顶壁),其允许细胞在封闭外壳内的容器之间无菌转移以及细胞、结合剂、浮力标签和浮力试剂的混合以实现连键,其包含三个或更多个瞬时流体连接的机械接合容器。套筒102可容纳最多250mL的液体,可以是圆柱形的,可以是一次性使用的,并且可以优选由硬塑料、并更优选光学透明的聚碳酸酯构成。在某些其它实施方式中,套筒102是可重复使用的。控制模块104可以与套筒102可卸式联接。控制模块104是具有光学和重力传感的机电装置。特别是,控制模块104提供套筒102底部中细胞界面的光学传感,并且可以配置成控制一个或多个可逆关闭装置以控制套筒102的各种容器之间的活动,如下文另外详细论述的。对接站106可以与控制模块104可卸式联接,并且可以用于对控制模块104再充电。另外,对接站106可以无线地或通过有线连接接收一个或多个协议,并且可以进一步配置成下载并处理由控制模块104接收的数据。对接站106优选使用可再充电的电池系统给控制模块104供电,控制模块104监测和控制重力和光学传感设备并指导在套筒102中的活动。用于确定G力的手段可以是本领域中任何公知的,例如通过测量离心机RPM、或通过直接测量加速度或力来计算所述力。
当套筒102可卸地附接于控制模块104时,可使用控制模块104的一个或多个检测器例如光学传感器或其它传感器来检测流过套筒102的细胞的类型。此外,控制模块104也可以包括至少一个但优选两个或更多个光学或其它发射器。在示例性实施方式中,四个红外发射器/检测器对竖直布置在控制模块104中。在一种优选实施方式中,红外传感器直接位于成对红外发射器的对面。在第二种优选实施方式中,提供优先被红细胞吸收的波长的发射器直接位于对该频率敏感的成对传感器的对面。在第三种优选实施方式中,使用的传感器识别具有吸收的荧光染料的细胞。在第一种优选实施方式中,细胞的存在干扰发射的红外光,并且红外光检测器将穿透流体的信号的振幅量化。在一种优选实施方式中,传感器可以赋予传输水平0-1000的值。纯血浆与水相似,全然不阻挡红外光,将记录下大约1000的值。密实的RBC在传感器/发射器对之间通过时,基本上所有的红外光都被阻挡,检测器记录的值为0。
图2示出了套筒102的横截面视图。如图2所示,套筒102包括处理容器108,其包含至少一个输入口110、第一出口112和第二出口114。套筒102还包括包含输入口118的第二容器116、以及包含输入口122和第一出口124的第三容器120。如在下面的过程中所述,含有细胞的生物流体,例如正常血液、脐带血或骨髓,通过至少一个输入口110输送到处理容器108。套筒102的第二容器116包含较大的第一刚性储存隔室或RBC清除隔室,而第三容器120包含较小的第二刚性储存隔室或SC隔室,WBC和基本上所有的SPC被输送到其中。第二容器116显著大于第三容器120,因为从血样清除的RBC的体积总是远大于收集的WBC的体积。所有隔室在套筒102内彼此完全分开,但是相对于气流而言是毗连的。第二隔室116和第三隔室120可以通过小型过滤或足够窄的通气孔与处理容器108连接,从而在细胞溶液从处理室108移入第二和第三容器116、120中时允许排走空气,但不允许容器之间的流体转移。在一种实施方式中,处理容器108是近似圆锥形的中央容器,而第二和第三容器116、120是较小的位于周边的容器。为了给定的目的,所述容器可以具有任何合适的容量。在一种实施方式中,第三和第二容器116、120各自还可以包含附加的常闭口,其提供任选的与套筒102外部的任何合适的接收容器的连接点,用于重力排放或者由于通过空气过滤器192增加气压而排放。在又一种实施方式中,处理容器108中的流体可通过经空气过滤器192施加气压而经由内部输入管110移除,而这当所述容器中的流体水平下降到内部刚性输入管110上的最低点以下时停止。
如图2所示,套筒102还包括连接处理容器108的第一出口112和第二容器116的输入口118的第一导管126。第一导管126包含第一可逆关闭装置128。第二容器116与处理容器108瞬时流体连接,使得当第一可逆关闭装置128打开时,只可发生从处理容器108向第二容器116的流体流动。套筒102还包括连接处理容器108的第二出口114和第三容器120的输入口122的第二导管130。第二导管130包含第二可逆关闭装置132。第三容器120与处理容器108瞬时流体连接,使得当第二可逆关闭装置132打开时,只可发生从处理容器108向第三容器120的流体流动。
在本文中使用时,“可逆关闭装置”是可被关闭(例如通过控制器)以禁止流体流动的任何装置。示例性的这种装置包括但不限于阀、夹具和旋塞阀。在本文中使用时,“瞬时流体连接”是指除了通过打开装置的常闭阀瞬时连接以实现流体或细胞悬液从一个容器到另一个容器的无菌转移之外,容器是流体不连续的(即各自功能封闭)。“导管”可以是允许容器之间流体转移的任何合适的装置,包括但不限于管道。所有的导管成为“常闭的”,使得一旦操作者移除在套筒组装期间安装的防止导管关闭的销,容器就不流体连接。导管可以由任何合适的可逆关闭装置例如阀、夹具或旋塞阀关闭。在一种实施方式中,套筒内的导管随时可以通过弹簧加载的管夹紧机构关闭,除了当流体应该通过时,这时夹紧机构可以旋转(例如,通过自动控制导管的可逆打开的控制模块)以让流体通过,然后可再次旋转以让弹簧加载的管夹紧机构通过重新夹紧导管来关闭该通路。在这样的示例中,可逆关闭装置包含具有大约0.088英寸宽的夹紧表面的两个相对夹具,并且当管中的液压在325PSI时,阻止所有流体通过内径为0.062英寸和外径为0.088英寸的聚氨酯管需要大约1.6磅的夹紧力。在更高的压力下可能需要超过1.6磅的夹紧力,而在较低的压力下减小的夹紧力可能就足够。在这样的示例中,可以使用悬臂系统来达到这些要求的夹紧压力。悬臂系统可根据需要打开和关闭导管(夹紧和松开导管)。弹簧可以设置在每个悬臂上,并且优选位于悬臂的最末端。传动器克服弹簧的阻力来移动杠杆。一旦传动器停止施加力,弹簧的偏置将杠杆推回到它的第一位置。
如上所述,处理容器108或其它容器可以任选由至少一个检测器来查询,以检测细胞的存在或不存在。在这样的实施方式中,控制模块104基于从至少一个检测器传达的信息来控制第一可逆关闭装置128和/或第二可逆关闭装置132的打开和关闭。可以使用任何合适的检测器,包括但不限于光学检测器,如上文关于图1所讨论的。
如将在下文详细描述的,在操作中,RBC首先向处理容器108的底部迁移,径向向外移动离开离心机的旋转轴,直到到达处理容器108的底部,这里存在第一可逆关闭装置128和第二可逆关闭装置132。在此,处理容器108的底部上方的流体的压头推动流体进入两个隔室中的一个:第二容器116或第三容器120。流体被引导进入哪个隔室取决于第一可逆关闭装置128和第二可逆关闭装置132的状态(打开,关闭)。在任一种情况下,在通过第一可逆关闭装置128和/或第二可逆关闭装置132之后,流体通常朝着旋转轴流动,由保留在处理容器108中的流体(主要是血浆)的压力推动。已通过第一可逆关闭装置128和/或第二可逆关闭装置132的流体然后被保留在第二容器116或第三容器120中。通过细调第一可逆关闭装置128和/或第二可逆关闭装置132,非所需细胞溶液可以被清除,并且可以收集所需的细胞溶液。
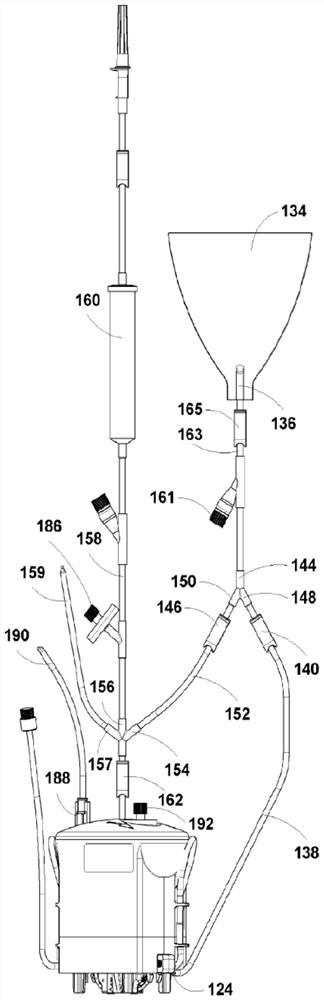
如图3所示,细胞分离系统100可以进一步包括转移容器134,其包含至少一个端口136。转移容器134可以与套筒102机械联接,或者可以仅通过连接转移容器134与套筒102内的容器的的相关导管而物理连接以保持系统为功能封闭系统。因此,在一种实施方式中,转移容器134在套筒102的内部;在另一种实施方式中,转移容器134在套筒102的外部。所述各种容器可以包含任何合适的材料,例如刚性结构、袋子、瓶子或任何其它合适的结构。在一种实施方式中,各容器是刚性容器,例如硬塑料容器(包括但不限于聚碳酸酯)。在另一种实施方式中,转移容器134是柔性容器,包括但不限于袋子。转移容器134可以是刚性容器,因为在溶液中收获的靶细胞开始转移时容器中的空气可以沿着将它与处理容器连接的相关管道排走。转移容器134也可以是柔性容器,其具有可折叠成小形状的优点,使其更容易储存,例如离心期间离心机的转子隔室中。
此外,如图3所示,细胞分离系统100还包括至少第三导管138,其连接第三容器120的第一出口124与转移容器134的所述至少一个端口136、以及转移容器134的所述至少一个端口136与处理容器108的所述至少一个输入口110。所述至少第三导管138包含至少第三可逆关闭装置140,使得第三容器120与转移容器134瞬时流体连接,以及转移容器134与处理容器108瞬时流体连接。所述至少第三导管138配置成使得以下只有一项可以成立:(I)当所述至少第三可逆关闭装置140打开时,只可发生从第三容器120向转移容器134的流体流动,或者(II)当所述至少第三可逆关闭装置140打开时,只可发生从转移容器134向处理容器108的流体流动。
在第三容器120的第一出口124到转移容器134之间以及从转移容器134到处理容器108的所述至少一个入口110的第三导管138也通过任何合适的可逆关闭装置是常闭的。在一种实施方式中,第三导管138可以通过第三可逆关闭装置140(恰好与第三容器120的第一出口124相邻)在套筒102的外部夹紧,并且在隔离的附着细胞从第三容器120转移到转移容器134时可以不夹紧(例如,将隔离的附着细胞从第三容器120通过重力排放到转移容器134)。在传送到转移容器134之后,与第三容器口124相邻的第三导管138上的第三可逆关闭装置140可以被重新夹紧。此时,例如,隔离的附着细胞可以经由第三导管138被转移到处理容器108(例如,将隔离的附着细胞通过重力排放回到处理室108中,用于进一步处理例如分离/富集所述隔离的附着细胞的亚群,包括但不限于单核细胞,以加入来自主液的无细胞和无血小板血浆)。因为套筒102可以被重复使用,因此转移容器134提供了经济优势。另外,转移容器134允许改善靶细胞悬液和BAGS试剂的混合。
细胞分离系统100可以进一步包括控制模块104,如上文关于图1所讨论的。控制模块104可以配置成控制在至少套筒102以及第一和第二导管126、130中的活动。在一些实施方式中,控制模块104也可控制转移容器134内和/或第三导管138内的活动。例如,在转移容器134存在于套筒102内的实施方式中,控制模块104可控制转移容器134内和/或第三导管138内的活动。控制模块104可以控制引导流体在套筒容器108、116、120之间的流动的可逆关闭装置128、132、140,例如当被放置在离心机中时。在一种非限制性实施方式中,将含有靶细胞/浮力标签混合物的套筒102离心,使得结合浮力标签的靶细胞与未结合浮力标签的细胞分离。控制模块104可以被编程以经由第一可逆关闭装置128将无浮力的沉淀细胞输送到套筒102的第二容器116,在套筒102的处理容器108中留下大部分上清液和基本上所有结合到浮力试剂的靶细胞。
在一种实施方式中,所述至少第三导管138包含单个导管。在这种实施方式中,仅有单个导管与转移容器134流体联接,并且所述导管可以流体分离,使得从第三容器120流向转移容器134的流体与从转移容器134流向处理容器108的流体分离。在这种实施方式中可以使用任何合适的可逆关闭手段。图3中显示了一个非限制性示例,其中所述至少第三导管138包含设置在第三容器120和转移容器134之间以及转移容器134和处理容器108之间的T或Y型连接器144,其带有可逆关闭装置140、146来调节期望的流体流动。
在又一种实施方式中,转移容器的所述至少一个端口包含第一输入口148和出口150。在这种实施方式中,所述至少第三导管138可以包含(i)连接第三容器120的出口124与转移容器134的输入口136的第三导管138,其中第三导管138包含第三可逆关闭装置140,使得第三容器120与转移容器134瞬时流体连接,使得当第三可逆关闭装置140打开时只可发生从第三容器120向转移容器134的流体流动,以及(ii)连接转移容器134的出口136与处理容器108的至少一个输入口110的第四导管152,其中第四导管152包含第四可逆关闭装置146,使得转移容器134与处理容器108瞬时流体连接,使得当第四可逆关闭装置140打开时只可发生从转移容器134向处理容器108的流体流动。在这种实施方式中,通过使用完全分离的导管138、152,使得将从第三容器120向转移容器134的流体流动与从转移容器134向处理容器108的流体流动分离成为可能。
在又一种实施方式中,处理容器108的所述至少一个输入口110包含第一输入口154和第二输入口156,其中所述至少第三导管138或第四导管152(当存在时)将转移容器134的出口136与处理容器108的第一输入口154连接。在这样的示例中,细胞分离系统100还可以包含将处理容器108的第二输入口156与至少一个介质储器160连接的第一介质输入导管158,其中第一介质输入导管158包含至少第五可逆关闭装置162,其中所述至少一个介质储存器160与处理容器108瞬时流体连接,使得当所述至少第五可逆关闭装置162打开时,只可发生从所述至少一个介质储器160向处理容器108的流体流动。
介质输入储器160可用于经由第二输入口156向处理容器108供应主液、结合剂、浮力标签和/或浮力试剂。
在再另一种实施方式中,处理容器108的所述至少一个输入口110包含第三输入口157。第三输入口157可以与第五导管159联接。在这样的示例中,可以通过在过滤器186处提供正压而从处理室108中移除液体。
在一种实施方式中,转移容器134的所述至少一个端口还包含第二输入口161。例如,细胞分离系统100还可以包含将转移容器134的第二输入口161与至少一个介质储器(未显示)连接的第二介质输入导管163,其中第二介质输入导管163包含至少第六可逆关闭装置165,其中所述至少一个介质储器与处理容器108瞬时流体连接,使得当所述至少第六可逆关闭装置165打开时,只可发生从所述至少一个介质储器向转移容器134的流体流动。
介质输入储器可用于经由第二输入口161向转移容器134供应主液、结合剂、浮力标签和/或浮力试剂。在至少一个介质储器与处理容器108和转移容器134两者瞬时流体连接的实施方式中,所述介质储器可以是同一储器,或者每个容器可以有它自己专用的储器。
在又一种实施方式中,细胞分离系统100还包含混合器。混合器可以用于,例如,促进/改善以下物质的混合:(a)浮力试剂和主液,和/或(b)浮力标签、结合剂和连接子(当存在时),和/或(c)浮力标签、结合剂、连接子(当存在时)和主液。在一种实施方式中,混合器是静态混合器。静态混合器包含具有输入端和出口的容器,其保持静止,同时提供两种同时通过所述容器的流体的连续混合,其构造例如但不限于包含混合元件的圆柱形管,所述混合元件在整个圆柱形管的内部长度上定向。
图4A-5B中显示了在本发明的装置中适合用于混合(例如混合靶细胞悬液(主要组分)和BACS试剂(添加剂))的示例性静态混合器。上述介质储器可以经由第五和第六可逆关闭装置与静态混合器瞬时流体连接。在一种非限制性实施方式中,如图4A和4B所示,静态混合器164通过包括固定在套筒顶壁170的内表面168上的叶轮166作用于使套筒102在其轴上旋转,引起例如溶液中的BAGS试剂和靶细胞在处理容器内混合。图4A-4B中设计的优点在于,将筒内部的混合附加件胶合在适当的位置,因此仅通过将装载好的套筒放置在辊道装置上一段可编程的时间即可发生溶液中细胞和BACS试剂的混合。
在另一种非限制性实施方式中,如图5A和5B所示,静态混合器164通过包括与套筒顶壁170的内表面168间隔开的叶轮166作用于使套筒102在其轴上旋转,引起例如溶液中的BAGS试剂和靶细胞在处理容器内混合。图5A-5B中的设计的优点在于,通过电动机装置驱动套筒内部的混合附加件在其轴上旋转,使得套筒保持直立并且不必从离心机中移除。
在另一种非限制性实施方式中,如图6所示,混合器作用于为套筒102的处理容器108内溶液中的BACS试剂和靶细胞的混合物赋予循环运动,同时套筒102保持不动。这样的实施方式可以包括定位在圆柱形管174内的叶轮172,其中电动机176配置成驱动叶轮172从而引起处理容器108中的混合。
在另一种非限制性实施方式中,如图7所示,混合器包含蠕动泵178,所述蠕动泵包含具有第一端182和第二端184的泵导管180,其中泵导管180的第一端182定位在处理室108中,并且其中泵导管180的第二端184定位在处理室108的外部并与处理室108的至少一个输入口110连接。
在又一种非限制性实施方式中,如图8所示,混合器包含混合模块194。混合模块可以包括底部部分195和顶部部分196。如图8所示,套筒102可以配置成定位在顶部部分195中,并且顶部部分196可以配置成与底部部分195可卸式联接。照这样,套筒102可以定位在由底部部分195和顶部部分196产生的腔室中。在一种非限制性实施方式中,混合模块194可以包括与底部部分195联接的可旋转组件197。可旋转组件197可以配置成使套筒102在其垂直轴上旋转。可旋转组件197可以与电动机联接,电动机进而引起混合模块194的底部部分195旋转。在一个具体示例中,可旋转组件197配置成使套筒102在其垂直轴上旋转180度,因此套筒102的底部处于竖直位置,然后可旋转组件197使套筒102转回180度到原来的直立位置。在另一个示例中,可旋转组件197配置成以不同的旋转速率经360度地连续颠倒旋转套筒102一段时间。在另一种非限制性实施方式中,混合模块194的底部部分195可配置成振动以协助混合。在另一种非限制性实施方式中,混合模块194可以配置成当套筒102被定位在混合模块194的底部部分195中时增加套筒102的温度。这样的温度增加可以通过混合模块194的底部部分195中的传导、对流或辐射加热而发生。
如图8所示,混合模块194可以包括混合控制模块198,所述混合控制模块可以包括控制面板199和显示器200。控制面板199可以用于选择用于混合的时间段以及一个或多个混合参数。例如,用户可以选择180度混合一段时间、360度混合一段时间、在特定温度下加热一段时间、和/或振动一段时间。其它示例也是可能的。
在各种实施方式中,第一介质输入导管158和/或第二介质输入导管还包含过滤器186。任何合适的过滤器(包括但不限于0.2微米的过滤器,或其它适当尺寸的过滤器以除去大粒子)都可以结合介质输入导管使用以促进介质无菌引入到处理容器和/或目标容器中。这样的过滤器的示例性位置可以在例如图3中看到。
在另一种实施方式中,第二容器116包含与第一废物导管190联接的出口188。这种实施方式允许从第二容器116移除废产物。在又一种实施方式中,处理容器108还包含与第二废物导管(未显示)联接的无菌排出口192。这种实施方式允许从处理容器108中移除废产物。这样的无菌排出口192的示例性放置可在例如图1和2中看到。
另一方面,本发明提供了一种细胞分离方法,其包含:
(a)在功能封闭系统中处理体积为至少10mL(或者,可选地,至少25mL,至少50mL,至少75mL,至少100mL,至少200mL等)的主液,其中所述主液包含(i)靶细胞,和(ii)浮力试剂,其中所述处理包含使靶细胞和浮力试剂在适于促进所述细胞附着于一种或多种所述浮力试剂的条件下接触一定时间以生成附着的靶细胞;
(b)向功能封闭系统内的主液施加矢量力例如离心,以引起附着的靶细胞在主液内分层;以及
(c)将附着的靶细胞隔离到功能封闭系统内的区域。
本发明这个方面的方法中的所有步骤都在功能封闭系统中进行以保持无菌性,并且对于以更高效率和存活率以及在高于以前细胞分离方法可能使用的浓度下分离所需细胞而言,允许处理体积大得多的主液。所有的流体转移和处理步骤均在无菌条件下发生,并且环境保持封闭和无菌。
在本文中使用时,“功能封闭系统”是容器或容器的集合,其在内部保持无菌同时允许在无菌容器之间的间歇性流体传递和/或与其周围大气的气体交换。
如下面的表1所总结,脐带血和外周血(示例性主液)的处理能够清除99.6%的红细胞(RBC)、80%的粒细胞、84%的血小板,产生单核细胞(MNC)富集部分(表中称为“BACSMNC制备物”,在贯穿表中的粗垂直线的左侧)。在这种初始的MNC富集之后,RBC和血小板仍然为主,使得MNC仍然仅占富集的细胞群的一小部分,而表达细胞外分子靶标的特定细胞例如CD34+和CD3+细胞仅占富集的MNC细胞制备物的非常低的百分比。本发明通过进一步清除RBC至最终清除99.999%、粒细胞99.9999%(脐带血)或99.96%(外周血)、和血小板98.2(在表中称为“BAGS最终”和“BACS细胞选择效率”,在贯穿表中的粗垂直线的右侧),提供了携带感兴趣的分子标记的靶细胞的分离能力急剧增加。本发明的方法能够清除非目标MNC至99.993%(脐带血)或98.788%(外周血),同时以79%(脐带血)或80%(外周血)的选择效率回收靶细胞。因此,本发明的方法提供了从临床应用所必需的起始主液体积中分离细胞群内感兴趣的靶细胞的能力的指数式增加。本发明在初步MNC制备步骤中非常高的靶细胞持留与在BACS细胞分离步骤中靶细胞高回收率相结合导致总体效率高,说明了在经常遇到的通过使用尽可能多的靶细胞来优化细胞制造成本或治疗结果的情况中,本发明的商业和治疗利益。
表1
如后述的实施例所示,本发明的方法在从仅5x 10
在本文中使用时,“主液”是所需细胞的原始来源(包括但不限于全血,胎盘/脐带血,骨髓,单采白细胞,血沉棕黄层,培养细胞、或基因修饰细胞或其它制造细胞等的悬液),混有非所需细胞,其可以是稀释或未稀释的(例如,用缓冲液或可用于分离所需细胞的任何其它液体例如盐水、磷酸盐缓冲盐水、细胞培养基、蛋白酶溶液等稀释)。在一种实施方式中,主液是外周血、脐带血或单采白细胞,或其稀释形式。
在一种实施方式中,主液可以是“未贫化的”主液,因为正常存在于相关主液中的所有细胞都保持存在。在另一种实施方式中,主液可以包含贫化的主液。“贫化的”主液是已经从中清除了一种或多种类型非所需细胞的相当部分(例如,至少50%;在其它实施方式中,至少60%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多)的主液。作为非限制性示例,贫化的主液可以包含通过密度离心、差速离心或裂解从全血清除红细胞、或已从中清除红细胞和粒细胞、或已从中清除血小板之后所需细胞的悬液,或者可以包含已从中清除未修饰细胞的基因修饰细胞悬液,或者可以包含已从中清除非干细胞的消化的组织样品,或者可以包含已从中清除非肿瘤细胞的消化的肿瘤样品。在贫化的主液的所有实施方式中,所需细胞可以悬浮于任何合适的液体中,包括但不限于盐水、磷酸盐缓冲盐水、细胞培养基、稀释或未稀释的原始主液(即全血等)。
在本文中使用时,“所需细胞”是在本发明方法的中间输出或最终输出中富集或分离的细胞。
在本文中使用时,“靶细胞”是通过本发明的方法浮力试剂与之附着以便将它们与其它细胞分开的细胞。在一种实施方式中,靶细胞就是所需细胞(即正选择)。在另一种实施方式中,靶细胞构成全部或部分非所需细胞(即负选择)。本发明的方法和系统可以用于任何合适的靶细胞。在各种非限制性实施方式中,靶细胞可以选自由以下组成的组:肿瘤细胞,癌干细胞,在正常血液、胎盘/脐带血、骨髓中发现的造血干细胞和祖细胞、间充质干细胞和祖细胞、脂肪源性干细胞和祖细胞、内皮祖细胞,白细胞,粒细胞,单核细胞,淋巴细胞,单核白细胞,T细胞,B细胞,NK细胞,驻留在脂肪组织中的基质血管部分细胞,培养细胞,基因修饰细胞,以及这样的靶细胞的亚群。在各种具体实施方式中,靶细胞可以是CD3+细胞、CD4+细胞、CD235a、CD14+、CD19+、CD56+、CD34+、CD117
在一种实施方式中,主液包含所需细胞的初始细胞悬液的稀释液。在这种实施方式中,主液在即将通过本发明的方法处理可以针对给定的细胞分离程序酌情稀释最多50倍、40X、30X、20X、10X、4X(即4倍)、最多3X、最多2X、最多1X、最多0.5X、最多0.25X、最多0.1X或更少。可以使用任何合适的稀释剂。在一种非限制性实施方式中,所需细胞是CD3+细胞,主液可以包含初始未稀释主液的2X-4X之间的稀释液。
在本文中使用时,“浮力标签”是(在细胞附着后)导致细胞和浮力标签的复合物的密度与单独靶细胞的密度和/或主液密度显著不同的材料。合适的这样的浮力标签可以包括但不限于:具有蛋白质或脂质壳的气体囊封泡,中空聚合物,玻璃珠(空心或固体),夹带气体的微孔珠,不混溶液体的液滴,金纳米粒子,和银纳米粒子。在一种具体实施方式中,浮力标签包含气体囊封泡,例如由蛋白质、脂质、磷脂或碳水化合物壳包围的气体囊封泡。在一种实施方式中,充气气泡包含被磷脂壳包围的全氟化碳气体芯。在任何这些实施方式中,充气泡可具有任何合适的直径。在一种非限制性实施方式中,充气泡的直径在约1μm和约6.5μm之间。
在一种实施方式中,浮力标签包含至少一种与其共价或非共价附连的结合剂;所述附连可以任选经由连接子。这种实施方式在本文中被称为“浮力试剂”。在本文中使用时,“结合剂”是能够以足够高的亲和力和特异性与至少一个靶细胞上的至少一个细胞表位结合的结构,例如分子。合适的结合剂可以包括但不限于:抗体,寡核苷酸,适配体,分子印迹聚合物,碳水化合物,蛋白质,肽,酶,小分子,脂质,脂肪酸,金属原子,金属离子和合成聚合物。在一种实施方式中,结合剂包含选择性结合靶细胞上的细胞表位的抗体。在本文中使用时,“初级结合剂”是没有附着浮力标签的结合剂。在本文中使用时,“连接子”(或单独的“连接子”)包含一对化学部分(第一连接子和第二连接子),它们一个与结合剂另一个与浮力标签共价或非共价附连,它们在合适的条件下在合适的介质中能够以足够高的亲和力自发地彼此(共价或非共价)相连,以实现结合剂与浮力标签经由连接子间接连接而形成浮力试剂。在某些实施方式中,所述至少一个第一连接子部分是功能暴露的亲和素或链霉亲和素,并且第二连接子部分是生物素或生物素衍生物,单独或与如本文所述的寡核苷酸结合对连接。
在其它实施方式中,第一连接子是第一寡核苷酸,第二连接子是第二寡核苷酸,在其长度的至少一部分上与第一寡核苷酸互补(例如完全互补)并且能够经由碱基配对与第一寡核苷酸结合。
在某些实施方式中,使用两种或更多种不同浮力标签的组合,其中一种或多种的密度明显高于液体介质的密度而一种或多种的密度明显低于液体介质。附着于所述一种或多种不同浮力标签的所述一种或多种结合剂可以靶向一种或多种不同的分子靶标,或者可以全部靶向相同的分子靶标,并且所述一种或多种分子靶标可以在所需细胞上或非所需细胞上。
在某些实施方式中,在结合剂第一顺序(binding agent-first order)中向主液添加的所述一种或多种结合剂的量足以基本饱和细胞悬液的靶细胞上所述结合剂的结合位点,而留在混合物中的未结合的结合剂的量不足以显著干扰浮力标签与结合到细胞的结合剂的结合,因此避免了需要在添加浮力标签之前除去未结合的结合剂。
在其它实施方式中,通过使用本领域技术人员已知的任何合适的手段,例如但不限于血液分析仪、流式细胞术、显微镜检查、沉降、酶分析、ELISA等,预先计数主液中存在的靶细胞的数量,来确定添加到主液中的所述一种或多种结合剂的量。在某些实施方式中,添加到主液中的所述一种或多种结合剂的量通过测试结合剂针对等份主液的两个或更多个量的范围来确定。在其它实施方式中,所使用的所述一种或多种结合剂的量是靶细胞上存在的结合剂结合位点数量的最多40倍。
各种结合剂、连接子和浮力标签可统称为“浮力活化的细胞分选试剂”(BACS试剂)。
浮力试剂可以通过浮力标签和结合剂/任选连接子的任何适当组合来生产,其包括但不限于制造的浮力试剂、次级浮力试剂、结合剂第一顺序的浮力试剂、浮力第一顺序的浮力试剂、和同时浮力试剂。在本文中使用时,“制造的浮力试剂”是其中浮力标签和结合剂在接触主液之前彼此附连而形成浮力试剂的浮力试剂。
在本文中使用时,“次级浮力试剂”是当主液与浮力标签和单独的结合剂接触时自发组装的浮力试剂。因此,在一些实施方式中,浮力试剂包含在主液内组装的次级浮力试剂,其中在处理主液以产生附着的靶细胞之前,所述方法还包含预处理步骤,包括使主液与浮力标签和结合剂在适于促进结合剂附着到浮力标签的条件下接触一定时间以产生浮力试剂。可以使用适合于预期目的的任何合适的顺序向主液添加浮力标签和单独的结合剂。在本文中使用时,“结合剂第一顺序”是通过使主液首先与结合剂接触、然后使所述细胞悬液与浮力标签接触而形成次级浮力试剂的顺序。在本文中使用时,“浮力第一顺序”是通过使主液首先与浮力标签接触、然后使主液与结合剂接触而形成次级浮力试剂的顺序。在本文中使用时,“同时顺序”是通过使主液与浮力标签和结合剂二者基本同时接触而形成第二浮力试剂的顺序。
在一种非限制性实施方式中,
(i)各结合剂包含(A)包含能够与靶细胞上的至少一个细胞表位结合的作用剂的初级结合剂,(B)与初级结合剂结合的第一连接子,其中第一连接子包含具有第一互补区的第一寡核苷酸;和
(ii)各浮力标签包含与所述浮力标签结合的第二连接子;
其中第二连接子包含具有第二互补区的第二寡核苷酸,其中第二互补区与第一互补区完全互补,并且其中第一和第二互补区的杂交体具有至少40℃的计算Tm;
其中预处理步骤包含使主液与浮力标签和结合剂在适于促进第一和第二互补区杂交的条件下接触一定时间以产生浮力试剂;
其中所述处理包含使靶细胞和浮力试剂在适于生成附着的靶细胞的条件下在主液中接触;并且其中所述方法还包含:
(d)在步骤(c)之后,在功能封闭系统内使附着的靶细胞经受37℃或更低的温度达足以使第一互补区和第二互补区去杂交的一定时间以从靶细胞释放浮力试剂。
在另一个方面,本发明提供了一种细胞分离方法,所述方法包含:
(a)提供主液,其中主液包含附着的靶细胞,其中每个附着的靶细胞包含
(i)与靶细胞上的至少一个细胞表位结合的结合剂,
(ii)与结合剂结合的第一连接子,其中第一连接子包含具有第一互补区的第一寡核苷酸;
(iii)浮力标签,其包含与所述浮力标签结合的第二连接子,其中第二连接子包含具有第二互补区的第二寡核苷酸,其中第二互补区与第一互补区完全互补,其中第二互补区与第一互补区杂交以形成杂交体,并且其中
第一和第二互补区的杂交体具有至少40℃的计算Tm;
(b)向主液施加矢量力例如离心,以引起附着的靶细胞在主液内分层;
(c)将附着的靶细胞隔离;以及
(d)在步骤(c)之后,使附着的靶细胞经受37℃或更低的温度达足以使第一互补区和第二互补区去杂交的一定时间以从靶细胞释放浮力标签。
在这方面,所述方法可以在功能封闭系统中进行,或者可以在开放系统中进行。所述方法可以按任何合适的体积进行。在这方面的一种实施方式中,所述方法在至少1ml、2ml、5ml、10ml、25ml、50ml、100ml、或至少200ml的体积中进行。
在一种实施方式中,在步骤(a)之前通过处理步骤生成附着的靶细胞,所述处理步骤包含使主液中的靶细胞与所制造的包含结合剂、第一连接子和第二连接子的浮力试剂接触,其中第二互补区与第一互补区杂交以形成杂交体;
其中所述接触在适于促进所述细胞与一种或多种所制造的浮力试剂附着的条件下进行一定时间以生成附着的靶细胞。在另一种实施方式中,在步骤(a)之前通过处理步骤生成附着的靶细胞,所述处理步骤包含:
(A)使主液与浮力标签和结合有第一连接子的结合剂在适于促进第一和第二互补区杂交的条件下接触一定时间以产生浮力试剂;和
(B)使靶细胞和浮力试剂在适于生成附着的靶细胞的条件下在主液中接触一定时间。
在这些不同的实施方式/方面中,第一寡核苷酸包含与第二寡核苷酸中的第二互补区完全互补的第一互补区。如本领域技术人员将理解的,第一和第二寡核苷酸可以包含适合于预期目的(例如,为了将所述寡核苷酸与所述连接子的另一个组分生物素生物素或链霉亲和素结合)的另外的核苷酸。在这种实施方式中,杂交的互补寡核苷酸以可逆的方式将结合剂(例如抗体)与浮力标签(例如充气泡)连接,使得能够通过充分升高细胞悬液的温度使第一和第二互补区之间形成的杂交体去杂交,将靶细胞从其结合的泡中释放出来。本发明人意外地发现,理论Tm为40℃或更高的杂交体可用于本发明的方法中,虽然这样的高温,如果需要它们来实现泡与分离的靶细胞分离的话,预期将危害大多数哺乳动物细胞类型的存活率(其偏好最高37℃)。意外地,本发明人发现,理论Tm为40℃或更高的杂交体在远低于计算Tm下,即约37℃下,有效地从细胞释放泡。虽然不受任何机制约束,但是本发明人认为远低于理论Tm时的释放是由于通过细胞和泡在它们系在一起时的微米直径施加在这些杂交体上的大布朗(Brownian)力、向心力和/或摩擦力,其可以在低于杂交体的理论Tm下将其削弱。结果是,本发明人在这些实施方式中常规地达到了97%至99%的靶细胞存活率,回收效率高达90%。
在一种实施方式中,杂交步骤可以在范围从4℃至约30℃的温度下进行。在各种其它实施方式中,杂交步骤可以在范围从10℃至约30℃、15℃至约30℃、20℃至约30℃、21℃至约30℃、22℃至约30℃、23℃至约30℃、24℃至约30℃、25℃至约30℃、10℃至约25℃、15℃至约25℃、20℃至约25℃、21℃至约25℃、22℃至约25℃、23℃至约25℃、或24℃至约25℃的温度下进行。
在这些实施方式中,计算Tm是利用最近邻二态模型计算的Tm:
其中ΔΗ°(焓)和ΔS°(熵)是在所使用的离子条件下从序列和所公布的最近邻热力学参数计算的熔融参数,R是理想气体常数(1.987calK
在各种实施方式中,第一互补区和第二互补区之间的杂交体的计算Tm在40℃和约60℃之间,在40℃和约58℃、40℃和约56℃、40℃和约55℃、40℃和约54℃、40℃和约53℃、40℃和约52℃、40℃和约51℃、40℃和约50℃、41℃和约60℃之间,在41℃和约58℃、41℃和约56℃、41℃和约55℃、41℃和约54℃、41℃和约53℃、41℃和约52℃、41℃和约51℃、41℃和约50℃、42℃和约60℃之间、42℃和约58℃、42℃和约56℃、42℃和约55℃、44℃和约54℃、42℃和约53℃、42℃和约52℃、42℃和约51℃、或42℃和约50℃之间。
如本领域技术人员将理解的,第一和第二互补区的特定核苷酸序列可以是在第一和第二互补区的长度上形成完全互补、从而导致杂交体具有如所列举的计算Tm的任何核苷酸序列。
“矢量力”是具有方向和大小的力,包括但不限于重力、向心力和离心力。
本领域技术人员非常清楚血液主要细胞组分的相对密度、特定细胞类型的分化簇(CD)表面标记以及这些细胞类型与各种医学治疗适应症的关系。
本发明的方法可以在任何合适的功能封闭的细胞分离系统中进行。在一种非限制性实施方式中,细胞分离系统可以包含美国专利号8747289中描述的系统。在改进的实施方式中,细胞分离装置包含本文中所公开的系统的任何实施方式或实施方式组合的功能封闭细胞分离系统。在一个这样的实施方式中,功能封闭系统包含细胞分离系统,所述细胞分离系统包含
(a)套筒,其包含
(i)包含至少一个输入口、第一出口和第二出口的处理容器;
(ii)两个或更多个另外的容器,其至少包括包含输入口的第二容器;以及包含输入口和第一出口的第三容器;
(ii)连接处理容器的第一出口和第二容器的输入口的第一导管,其中第一导管包含第一可逆关闭装置,其中第二容器与处理容器瞬时流体连接,使得当第一可逆关闭装置打开时,只可发生从处理容器向第二容器的流体流动;
(v)连接处理容器的第二出口和第三容器的输入口的第二导管,其中第二导管包含第二可逆关闭装置,其中第三容器与处理容器瞬时流体连接,使得当第二可逆关闭装置打开时,只可发生从处理容器向第三容器的流体流动;
(b)包含至少一个端口的转移容器;
(c)至少第三导管,其连接
(i)第三容器的第一出口与转移容器的所述至少一个端口,和
(ii)转移容器的所述至少一个端口与处理容器的所述至少一个输入口
其中所述至少第三导管包含至少第三可逆关闭装置,使得(A)第三容器与转移容器瞬时流体连接,和(B)转移容器与处理容器瞬时流体连接;其中所述至少第三导管配置成使得下列中仅一项可以成立
(I)当所述至少第三可逆关闭装置打开时,只可发生从第三容器向转移容器的流体流动;或
(II)当所述至少第三可逆关闭装置打开时,只可发生从转移容器向处理容器的流体流动。
在本文中使用时,“可逆关闭装置”是可被关闭(例如通过控制器)以禁止流体流动的任何装置。示例性的这种装置包括但不限于阀、夹具和旋塞阀。
在本文中使用时,“套筒”是封闭的外壳(具有顶壁),其允许细胞在封闭外壳内的容器之间无菌转移以及细胞、结合剂、浮力标签和浮力试剂的混合以实现连键,其包含三个或更多个瞬时流体连接的机械接合容器。在本文中使用时,“瞬时流体连接”是指除了通过打开装置的常闭阀瞬时连接以实现流体或细胞悬液从一个容器到另一个容器的无菌转移之外,容器是流体不连续的(即各自功能上封闭)。“转移容器”经由第二导管与第三容器瞬时流体联接,并与处理容器瞬时流体联接,但是除了经由相关导管之外,不要求转移容器与套筒机械联接。
“导管”可以是允许容器之间流体转移的任何合适的装置,包括但不限于管道。所有的导管是“常闭的”,使得容器不流体连接。导管可以由任何合适的可逆关闭装置例如阀、夹具或旋塞阀关闭。在一种实施方式中,套筒内的导管随时可以通过弹簧加载的管夹紧机构关闭,除了当流体应该通过时,这时夹紧机构可以旋转(例如,通过自动控制导管的可逆打开的控制模块)以让流体通过,然后可再次旋转通过重新夹紧导管来关闭该通路。
在第三容器的出口到转移容器和从转移容器到处理容器的输入之间的第三导管也通过任何合适的可逆关闭装置常闭。在一种实施方式中,第三导管可以在套筒的外部被夹紧(恰好与第三容器的第一出口相邻),并且在隔离的附着细胞从第三容器转移到转移容器时可以不夹紧(例如,将隔离的附着细胞从第三容器通过重力排放到转移容器)。在转送到转移容器之后,可以恢复与第三容器口相邻的第三导管上的夹具。此时,例如,隔离的附着细胞可以经由第三导管被转移到处理容器(例如,通过将隔离的附着细胞重力排放回到处理室中,用于进一步处理例如分离/富集所述隔离的附着细胞的亚群,包括但不限于单核细胞,以加入来自主液的无细胞和无血小板血浆)。
转移容器可以与套筒机械联接,或者可以仅经由连接转移容器与套筒内容器的相关管道物理连接,以将所述系统保持为功能封闭系统。
所述各种容器可以包含任何合适的材料,例如刚性结构、袋子、瓶子或任何其它合适的结构。在一种实施方式中,各容器是刚性容器,例如硬塑料容器(包括但不限于聚碳酸酯)。在另一种实施方式中,转移容器是柔性容器,包括但不限于袋子。转移容器可以是刚性容器,因为在溶液中收获的靶细胞开始转移时容器中的空气可以沿着将它与处理容器连接的相关管道排走。转移容器也可以是柔性容器,其具有可折叠成小形状的优点,使其更容易储存,例如离心期间离心机的转子隔室中。
在一种实施方式中,处理容器是大致圆锥形的中央容器,而第二和第三容器是较小的、位于周边的容器。为了给定的目的,所述容器可以具有任何合适的容量。
在一种实施方式中,第三和第二容器各自还可以包含附加的常闭口,其提供任选的与套筒外部的任何合适接收容器的连接点。在另一种实施方式中,处理容器、第二和第三容器可以共用共同的过滤通气孔,以在流体流入和流出套筒的所有容器和转移容器时提供排气。在套筒的正常运转中,该过滤通气口不允许容器之间的流体转移。图9显示了本发明实施方式的示例性流程图,其中所需细胞是CD3+细胞,并且方法包含使用本文所述的细胞分离系统。
在另一种实施方式中,所述方法包含使靶细胞和浮力标签在适于促进靶细胞附着于一种或多种所述浮力标签以生成附着的靶细胞的条件下接触一定时间。在一种实施方式中,各浮力试剂包含一个或多个第二连接子,其中所述一个或多个第二连接子与附连至少一种结合剂的一个或多个第一连接子结合,其中所述至少一种结合剂能够与靶细胞上的细胞表位结合;并且其中所述接触包含使靶细胞和浮力试剂在适于促进靶细胞与一种或多种所述浮力试剂附着的条件下接触一定时间以生成附着的靶细胞。
在这种实施方式中,所述处理包含在功能封闭系统内生成浮力试剂;这可以在存在或不存在靶细胞下完成。在非限制性实施方式中,浮力试剂的生成可以通过以下混合进行:
(A)(i)首先是至少一种能够结合至少一种分子靶标并带有至少一个第一连接子的结合剂,(ii)其次是至少一种带有至少一个互补连接子的浮力标签,或
(B)(i)首先是至少一种带有至少一个连接子的浮力标签,(ii)其次是至少一种能够结合至少一种分子靶标并带有至少一个互补连接子的结合剂,或
(C)至少一种浮力标签,其带有至少一个连接子和至少一种能够结合至少一种分子靶标的结合剂并基本上同时带有至少一个互补连接子。
在另一种实施方式中,所述方法包括首先产生靶细胞-结合剂复合物,如下:
(i)使主液与初级结合剂接触,其中各初级结合剂包含(A)能够与靶细胞上的至少一个细胞表位结合的作用剂,和(B)与所述作用剂结合的第一连接子;其中所述接触在适于促进靶细胞与初级结合剂附着的条件下发生以产生靶细胞-结合剂复合物;以及
(ii)将靶细胞-结合剂复合物与浮力标签一起温育,其中各浮力标签包含第二连接子,其中第二连接子能够与第一连接子结合,其中所述温育在适于促进第一连接子与第二连接子结合的条件下发生以生成附着的靶细胞。
在这种实施方式中,所述方法可以不包含在步骤(i)和(ii)之间发生除去未结合的初级结合剂的中间步骤。这种实施方式可以被称为“免洗涤”方案。如后述的实施例所示,免洗涤方案通常在多种各样的源材料、细胞浓度、处理体积、目标、手动或自动方案、和浮力试剂(例如充气泡)直径中均产生优异的靶细胞回收率(从70+%至90+%)。免洗涤方案在许多源材料和工艺条件下的成功应用是令人惊讶的结果。利用结合剂(例如抗体)和颗粒(例如微珠、纳米粒子或微泡)物理捕获靶细胞的本领域普通技术工作人员知道,没有详细的初步抗体滴定研究(对每种独立的生物样本),不可能在没有这样的滴定研究(其耗时且消耗源材料)的情况下预测给定靶细胞悬液中抗体结合位点的总数,添加标准量的抗体可以预期有时导致显著过量的未结合细胞的抗体残留在细胞悬液中,其将预期在所述第二步骤中与结合细胞的抗体竞争与粒子的结合,从而导致靶细胞回收效率低。免洗涤方案赋予有价值的效益。通常,为了免除最终用户的洗涤步骤要求,制造商会在制造期间用结合剂例如抗体预先标记粒子。这将通常必要的洗涤步骤从最终用户转移给了制造商,增加了制造成本(并因此增加试剂价格)。采用这种策略的制造商也被提出了组装和储存大量不同的抗体标记微泡产品(针对消费者感兴趣的每种不同目标分子各一种)的要求。这导致复杂的制造过程和许多不同产品的库存,再次增加了制造商的成本并因此增加产品价格。而且,在标记的浮力试剂产品的浮力试剂组分的固有储存期限比结合剂组分短的常见情况下,随着库存过期,这也导致昂贵的结合剂的浪费,再次增加了成本。
在另一种实施方式中,可以使用能够结合至少一种分子标记的制造的浮力试剂。在这些实施方式的每一个中,浮力试剂和靶细胞的混合可以在转移容器、处理容器或两者中进行。
在一种实施方式中,浮力试剂在转移容器中产生。在其它实施方式中,浮力试剂可以在处理室中或在外部混合装置中产生。
在又一种实施方式中,在转移容器中进行使浮力试剂与靶细胞接触以产生附着的靶细胞。
溶液中BACS试剂和靶细胞的混合可以经由任何合适的手段来实现,这些手段考虑了在主液中浮力标签上升而靶细胞将下落的事实。在一种实施方式中,进行混合使得所有的靶细胞上基本上所有的结合位点都与浮力标签结合,以提高效率。在一种非限制性实施方式中,通过向套筒的处理容器中的BACS试剂和靶细胞溶液提供旋转运动(nutatingmotion),例如通过将本发明的装置放置在旋转或振动平台上,来进行混合。在又一种实施方式中,所述混合包含将套筒定期重新定向180度以反转浮力标签的固有上升运动和靶细胞的下降运动而向处理容器的相反内表面移动。
在另一种非限制性实施方式中,通过向转移容器内溶液中的BACS试剂和靶细胞提供旋转运动来进行混合。在又一种实施方式中,所述混合包含将转移容器定期重新定向180度以引起浮力标签的固有上升运动和靶细胞的下降运动而向转移容器的相反内表面移动。
在另一种非限制性实施方式中,通过使用包含机载混合器的细胞分离系统进行混合。这样的机载混合器的实施方式下面在涉及细胞分离系统的进一步公开中描述。
在另一种实施方式中,待处理的主液是贫化的主液,并且在所述处理或预处理步骤之前,所述方法包含向功能封闭系统内、例如处理容器内未贫化的主液施加矢量力例如离心,以清除非所需细胞,例如通过将非所需细胞通入第二容器中,从而产生待处理的贫化的主液。这种实施方式容许非所需细胞清除步骤以及随后的目标/所需细胞纯化在同一功能封闭系统中进行,这是使用现有技术方法不可能的。在所述两步过程中,初始的富集步骤将感兴趣的细胞相对于不感兴趣的细胞的相对丰度增加到足够大于起始材料的水平以容许后续处理有效进行。在具体实施方式中,该富集步骤在本文所述的系统的任何实施方式或实施方式组合中经由差速离心进行。在第二步中,初始(富集)步骤的输出细胞悬液受到利用浮力试剂的处理步骤以达到尽可能多的靶细胞回收、足够纯度以供它们的预期应用(即被按照要求的极少不感兴趣的细胞污染)。在所述两步过程中,经常有一些感兴趣的细胞在初始富集步骤期间丢失的情况。因此,这里还有一个总回收量度:起始材料中存在的靶细胞在BACS步骤的输出中回收的百分比。
如本领域技术人员将理解的,可以进行单次施加矢量力以从主液中去除非所需细胞,或者可以进行两个或更多个差速离心步骤以依次去除非所需细胞。这个过程的示例可以在图10中看到。
如本领域技术人员将理解的,产生贫化的主液可以包含对功能封闭系统内、例如处理容器内未贫化的主液施加单轮施加矢量力例如离心,以清除非所需细胞。
或者,贫化主液可以包含两轮或更多轮施加矢量力(例如离心)以去除不同类型的非所需细胞,从而产生贫化的主液以进一步处理来分离所需的靶细胞(图10)。例如,当主液是全血时,第一轮离心可以用来清除例如仅红细胞、或红血细胞和粒细胞,而第二轮离心将单核细胞和血小板分层以形成贫化的主液。
在一种非限制性实施方式中,功能封闭系统可以将包含所需细胞来源的主液(例如正常血液)接收到处理容器中,并且当放置在离心机中时将在离心期间进行初始所需细胞富集步骤,包括将非所需细胞(例如RBC、GRN和PLT)转移到套筒内的第二容器,并提供包含稀有所需细胞的富集的所需细胞制备物(例如MNC)从第三容器的无菌转移并然后返回到处理容器中用于随后经由如上所述与浮力标签结合和分离来进一步纯化。非所需细胞,例如RBC、GRN、PLT和过量流体(例如血浆)可以在不干扰富集的靶细胞下从功能封闭系统中去除,全部在所述系统保持功能封闭的同时。
在一种实施方式中,贫化的主液从处理容器传送到转移容器并与浮力试剂混合以启动处理步骤(a)宿主液体来产生附着的靶细胞。在又一种实施方式中,所述方法还包含在功能封闭系统内将浮力标签从靶细胞上分离,以产生分离的靶细胞。可以使用将靶细胞与浮力标签分离的任何合适的方法,包括但不限于:破坏浮力试剂(例如,经由施加正或负压或者不会损伤该细胞的超声波能量),或通过破坏与靶细胞结合的结合剂和那些结合剂所连接的浮力标签之间的连键(例如经由寡核苷酸连接子的去杂交或大分子连接子的酶促裂解或小分子连接子的化学裂解),从而释放靶细胞以例如在离心期间沿套筒的圆锥形处理容器向下迁移(现在基本上没有非靶细胞)以被定位供收集到套筒的第三容器中。在某些实施方式中,用于施加所述能量或压力的装置(例如超声波仪)与功能封闭的细胞分离系统整合。在某些其它实施方式中,用于施加所述能量或压力的装置是与所述系统的容器之一整合。在某些实施方式中,所述能量或压力与所述系统的任何容器分开。利用超声处理将靶细胞与浮力试剂分离,本发明人意外地常规获得高靶细胞存活率(90%至100%),联同高靶细胞回收效率。
在某些实施方式中,所述方法在这种实施方式中被用于实现正选择,靶细胞是所需细胞,并且所述方法还包含将分离的靶细胞在功能封闭系统内浓缩,其中隔离包含使浓缩的分离靶细胞传送到第三容器。在其它实施方式中,所述方法用于实现负选择(即靶细胞不是所需细胞)。在这种实施方式中,隔离包含将分离的靶细胞在功能封闭系统内浓缩。在某些其它实施方式中,相继使用两轮或更多轮的负和/或正选择。在某些实施方式中,使用两轮或更多轮相继的选择,将细胞从第二或第三容器引导回到处理容器,伴有或不伴有被引导的细胞与附加的BACS试剂的混合。
在另一种实施方式中,细胞分离系统还包含控制模块,用于控制在至少套筒以及第一和第二导管中的活动。
在一些实施方式中,所述控制器也可以控制转移容器内和/或第三导管内的活动。例如,在转移容器存在于套筒内的实施方式中,控制器可以控制转移容器内和/或第三导管内的活动。控制器可以控制可逆关闭装置引导套筒容器之间的流体流动,例如在离心期间。在一种非限制性实施方式中,将含有靶细胞/浮力标签混合物的套筒离心,使得结合到浮力标签的靶细胞与未结合浮力标签的细胞分离。控制模块可以被编程以经由第一可逆关闭装置将无浮力的沉淀细胞输送到套筒的第二容器,在套筒的处理容器中留下大部分上清液和基本上所有结合到浮力试剂的靶细胞。
在又一种实施方式中,处理容器或其它容器可以任选由至少一个检测器查询以检测细胞的存在或不存在。在这种实施方式中,控制模块基于从至少一个检测器传达的信息来控制至少在第一和/或第二管道内的可逆关闭装置的打开和关闭。可以使用任何合适的检测器,包括但不限于光学检测器。
在本文中描述的所有实施方式中,所需细胞可以是任何感兴趣的细胞,包括但不限于:在正常血液、胎盘/脐带血、骨髓中发现的造血干细胞和祖细胞、间充质干细胞和祖细胞、脂肪源性干细胞和祖细胞、内皮祖细胞,白细胞,粒细胞,单核细胞,淋巴细胞,单核白细胞,T细胞,B细胞,NK细胞,驻留在脂肪组织中的基质血管部分细胞,培养细胞,基因修饰细胞,以及这样的靶细胞的亚群。在各种非限制性实施方式中,所需细胞可以是CD3+细胞、CD4+细胞、CD235a、CD14+、CD19+、CD56+、CD34+、CD117
在各种实施方式中,主液具有至少10mL(或者,可选地,至少25mL,至少50mL,至少75mL,至少100mL,至少200mL等)的体积。
在其它实施方式中,所需细胞占未贫化的主液的小于(或者,可选地,小于5%、1%、0.5%、0.1%、0.05%等)。在一种非限制性实施方式中,CD3+、CD4+、CD14+、CD19+、CD56+或CD34+细胞是所需的细胞并在未贫化的主液(全血)中占小于约0.2%,并且占贫化的主液(例如红细胞和/或血小板清除后的全血)中细胞的小于约20%、18%、12%、10%、5%、2.5%、1%或0.5%。
在又一种实施方式中,所需细胞的回收率大于68%、或大于75%、或大于80%、或大于85%、或大于90%或大于95%。在一种非限制性实施方式中,CD3+细胞、CD4+细胞、CD235a、CD14+、CD19+、CD56+、CD34+、CD117
在其它实施方式中,所需细胞的存活率大于90%、或大于95%、或大于97%、或大于99%。在一种非限制性实施方式中,CD3+细胞、CD4+细胞、CD235a、CD14+、CD19+、CD56+、CD34+、CD117
在其它实施方式中,所需细胞在未处理的主液中存在约5x 10
例如,当CD34+细胞是所需细胞并且脐带血是主液时,所需细胞可以在未处理的脐带血中存在约5x 10
在另一个非限制性示例中,CD3+细胞是所需细胞并且单采白细胞产物是主液,所需细胞可以存在约2.5x 10
在某些实施方式中,采用本发明方法的总细胞处理时间小于1小时,小于45分钟,小于30分钟,小于25分钟,小于20分钟,小于15分钟,小于10分钟,或小于5分钟。
在某些实施方式中,功能封闭系统的合适容器(例如处理容器、第二容器和/或转移容器)用含有充足的O
在某些实施方式中,悬浮有靶细胞的主液用含有充足的O
另一方面,本发明提供了细胞悬液,其包含:
(a)体积为至少10mL(或者,可选地,至少25mL,至少50mL,至少75mL,至少100mL,至少200mL,至少400mL,至少800mL等)的液体介质;和
(b)所需细胞悬浮在液体介质中,其中所需细胞选自以下细胞组成的组:在正常血液、胎盘/脐带血、骨髓中发现的造血干细胞和祖细胞、间充质干细胞和祖细胞、内皮祖细胞,白细胞,粒细胞,单个核细胞,淋巴细胞,单核细胞,T细胞,B细胞,NK细胞,驻留在脂肪组织中的基质血管部分细胞,以及这样的所需细胞的亚群;其中所需细胞存在于液体介质中并且其中所需细胞占细胞悬液中细胞的至少80%(或者,至少85%、90%、95%、98%、99%或更多);
其中所需细胞存活率大于90%、或大于95%、或大于97%、或大于99%;并且
其中细胞悬液存在于封闭的细胞分离系统内。
本发明的细胞悬液是在隔离(并且任选地在细胞分离之后)之后获得的那些所需细胞,但在任何可能进行的下游处理之前仍然(a)包含在功能封闭系统(例如细胞分离系统)内,或(b)直接从功能封闭系统获得。液体介质是在隔离/细胞分离之后细胞悬浮于其中的液体介质,因此可以是适合于特定预期用途的任何这样的液体介质。在各种实施方式中,液体介质可以包含盐水、细胞培养基、或适合于特定用途的任何其它液体介质。在一种实施方式中,细胞悬液直接从封闭的细胞分离系统获得。在另一个种实施方式中,细胞分离系统包含本发明的任何实施方式或实施方式组合的细胞分离系统/设备。在又一种实施方式中,细胞悬液存在于经由封闭细胞分离系统的转移容器的细胞悬液移除流中。在一种实施方式中,组合物中的所需细胞包含附着于细胞的浮力标签。
在一种实施方式中,存活的所需细胞的数量是至少1x 10
另一方面,提供了试剂盒,其包含一种或多种结合剂、和/或一种或多种浮力标签、和/或一种或多种浮力试剂,以及一个或多个套筒和/或一个或多个系统和/或一种或多种缓冲剂。
另一方面,本发明提供了一种组合物,其包含:
(a)至少一种与至少一个第一连接子共价或非共价连接的结合剂,所述至少一种结合剂能够结合细胞悬液中细胞上的至少一个分子靶标;以及
(b)至少一种与至少一个第二互补连接子共价或非共价连接的浮力标签,所述至少一种浮力标签表现出密度显著不同于待分离的细胞悬浮于其中的液体介质的密度。
在另一种实施方式中,其中所述至少一种浮力标签包括但不限于充气泡、中空聚合物、玻璃珠、夹带气体的微孔珠、不混溶液体的液滴、任何形状的固体、任何形状的液体、金纳米粒子或银纳米粒子。在又一种实施方式中,所需细胞包含各种细胞类型,包括但不限于在正常血液、胎盘/脐带血、骨髓中发现的造血干细胞和祖细胞、间充质干细胞和祖细胞以及内皮祖细胞,或驻留在脂肪组织中的基质血管部分细胞,培养细胞或基因修饰细胞。
在一种实施方式中,所述组合物包含
(a)至少一种与至少一个第一连接子共价或非共价连接的结合剂,所述至少一种结合剂能够结合细胞悬液中细胞上的至少一个分子靶标;以及
(b)至少一种与至少一个第二互补连接子共价或非共价连接的浮力标签,所述至少一种浮力标签表现出密度显著不同于待分离的细胞悬浮于其中的液体介质的密度。
在另一种实施方式中,所述组合物包含:
(i)包含能够与靶细胞上的至少一个细胞表位结合的作用剂的初级结合剂;
(ii)与所述作用剂结合的第一连接子,其中第一连接子包含具有第一互补区的第一寡核苷酸;
(iii)浮力标签;
(iv)与浮力标签结合的第二连接子,其中第二连接子包含具有与第一互补区完全互补的第二互补区的第二寡核苷酸,其中第一和第二连接子的互补区的杂交体具有至少40℃的计算Tm。
其中第一连接子和第二连接子彼此杂交。在一种实施方式中,组合物还包含与初级结合剂结合的靶细胞。
另一个方面,本发明提供了一种试剂盒,其包含
(i)包含能够与靶细胞上的至少一个细胞表位结合的作用剂的初级结合剂;
(ii)与所述作用剂结合的第一连接子,其中第一连接子包含具有第一互补区的第一寡核苷酸;
(iii)浮力标签;
(iv)与浮力标签结合的第二连接子,其中第二连接子包含具有第二互补区的第二寡核苷酸,其中第二互补区与第一互补区完全互补,并且其中第一和第二互补区的杂交体具有至少40℃的计算Tm。
这些组合物和试剂盒可用于,例如,上述方法的具体实施方式中,其中通过去杂交进行靶细胞分离。在一种实施方式中,第一和第二互补区的杂交体的计算Tm在40℃和约60℃之间。在另一种实施方式中,计算Tm是利用最近邻二态模型计算的:
其中ΔΗ°(焓)和ΔS°(熵)是在所使用的离子条件下从序列和所公布的最近邻热力学参数计算的熔融参数,R是理想气体常数(1.987calK
在一种实施方式中,所述至少一种结合剂包括但不限于:抗体,寡核苷酸,适配体,分子印迹聚合物,碳水化合物,蛋白质,肽,酶,小分子,脂质,脂肪酸,金属原子,金属离子或合成聚合物。在另一种实施方式中,所述至少一个第一连接子和/或第二连接子包括但不限于:生物素,亲和素,链霉亲和素,寡核苷酸,抗体结合蛋白,被抗体结合蛋白结合的部分,其组合,或任何第二附着的结合剂。在一种具体实施方式中,初级结合剂包含抗体。
另一个方面,本发明提供了组合物,其包含经由浮力活化的细胞分选而从至少一种分子类型的所需细胞和至少一种分子类型的非所需细胞的起始混合物中纯化的所需细胞,其中所述起始混合物含有非所需细胞数量的至少1倍的所需细胞,或者非所需细胞数量的至少5倍的所需细胞,或者非所需细胞数量的至少10倍的所需细胞,或者非所需细胞数量的至少50倍的所需细胞,或者非所需细胞数量的至少100倍的所需细胞,或者非所需细胞数量的至少500倍的所需细胞,或者非所需细胞数量的至少1000倍的所需细胞,其中:
所述至少一种类型的所需细胞的回收效率大于80%、或大于85%、或大于90%、或大于95%;所述至少一种类型的所需细胞的纯度大于80%、或大于85%、或大于90%、或大于95%;
所述至少一种类型的所需细胞的存活率大于90%、或大于95%、或大于97%、或大于99%;以及
经受浮力活化细胞分选的所述至少一种分子类型的所需细胞和至少一种分子类型的非所需细胞的混合物的体积大于2mL、或大于10mL、或大于50mL、或大于100mL、或大于150mL、或大于200mL、或大于400mL、或大于800mL。
在各种实施方式中,将纯化的所需细胞或从纯化的所需细胞扩增的细胞用于细胞疗法、研究、或药物开发。在另一种实施方式中,在经由浮力活化的细胞分选进行纯化之前,经由离心富集所需细胞。在又一种实施方式中,浮力活化的细胞分选步骤在进行前述所需细胞富集的同一容器中进行。
在各种实施方式中,所需细胞在纯化之前或纯化之后扩增。在其它实施方式中,细胞用于细胞疗法,并且细胞疗法是自体或同种异体的。在其它实施方式中,所需细胞是干细胞或前体细胞、免疫细胞、从干细胞分化的细胞、从诱导性多能干细胞分化的细胞、基因工程细胞、和/或准备基因工程的细胞。
在各种其它实施方式中,所需细胞经由浮力活化的细胞分选进行负选择、经由浮力活化的细胞分选进行正选择、或其组合。例如,可以通过浮力活化的细胞分选经由相继的负选择和正选择的组合来选择所需细胞,其中相继的负选择和正选择在同一容器中进行。
实施例1
利用寡核苷酸杂交连接子分离靶细胞
为了制备富集的细胞悬液-结合剂-浮力标签复合物供本发明方法使用,可以使用以下方案:通过处理200ml新鲜的人外周血和胎盘脐带血收集单位来制备单核细胞(PBMC)制备物。PBMC制备物用PBSHE稀释到1x 10
对于从外周血PBMC分离CD3细胞:如下制备CD3抗体和寡核苷酸杂交体:在每1mL细胞悬液中,将预先在5'端缀合了20-Mer寡核苷酸5'-GGAAGC GGT GCT ATC CTACT-3'(序列号1)的CD3抗体以0.3mg/mL(2μM)浓度与1/10体积的预先与生物素缀合的8-Mer、10-Mer、12-Mer或14-Mer互补寡核苷酸(A')(4μm浓度)一起温育。所述互补寡核苷酸序列是所述20-Mer寡核苷酸的最3'碱基。将寡核苷酸在室温下温育1小时以发生杂交。
向所述稀释的PBMC制备物中添加12.5μg CD3抗体-寡核苷酸杂交体/mL细胞悬液(事先通过实验确定对CD3+细胞选择是最佳的),并在旋转混合器中在室温下温育20分钟。
对于从脐带血PBMC中分离CD34细胞:如下制备CD34抗体和寡核苷酸杂交体:在每1mL细胞悬液中,将预先在5'端缀合了20-Mer寡核苷酸5'-GGA AGC GGT GCT ATC CTA CT-3'(序列号1)的CD34抗体以0.1mg/mL(2μM)浓度与1/10体积的预先与生物素缀合的8-Mer、10-Mer、12-Mer或14-Mer互补寡核苷酸(A')(4μm浓度)一起温育。所述互补寡核苷酸序列是所述20-Mer寡核苷酸的最3'碱基。将寡核苷酸在室温下温育1小时以发生杂交。
向所述稀释的PBMC制备物中,添加15μg CD34抗体-寡核苷酸杂交体/mL细胞悬液(事先通过实验确定对CD34+细胞选择是最佳的),并在旋转混合器中在室温下温育20分钟。
另外,通过短暂涡旋Advanced Microbubbles SIMB
温育后,将细胞悬液以400x g离心5分钟。微泡(和结合微泡的细胞)漂浮在弯液面上形成结块(正性部分),而未结合的细胞在容器的底部形成沉淀团(负性部分),在所述细胞沉淀团和细胞结块之间观察到澄清的溶液。
将正性部分转移到单独的容器中,向其中添加30倍过量的寡核苷酸A',并在37℃的水浴中温育20分钟,然后在37℃培养箱中的旋转混合器中30分钟以将所述寡核苷酸去杂交。将微泡-正性细胞部分以400x g离心5分钟。现在无结合的靶细胞群在容器的底部形成沉淀团,而微泡形成漂浮在弯液面上的结块。从容器中除去微泡。
稀释的PBMC、负性部分、正性部分和微泡样品进行流式细胞术分析。使用抗体主混合物,其含有FITC标记的抗人CD45、7-氨基放线菌素染料(7-AAD)、以及用于CD3分离的APC标记的抗人CD3或用于CD34分离的PE标记的抗人CD34,将每种细胞悬液的50μl等份添加到含有预先确定合适的主混合物体积的流式管中。50μl稀释的PBMC悬液添加到阳性对照和阴性对照流式管中。阳性对照用主混合物标记,阴性对照管用FITC标记的抗人CD45、7-AAD、以及PE或APC标记的小鼠IgG(同种型)标记。然后涡旋所有管并在室温下在暗处温育20分钟。这次温育后,所有管容纳0.5ml的1x裂解缓冲液,然后将管涡旋并在室温下在暗处再温育10分钟。在马上要流式细胞术分析之前,各管容纳50μl流式计数珠悬液。然后使用之前确定的CD45/7-AAD/CD3门控策略(gating strategy)分析所述管,以获得合理的结果,其中PBMC用于CD3分离或ISHAGE门控策略用于CD34分离。
图11显示了试验结果。计算Tm为16.3℃、27.9℃和41.6℃的8-Mer(n=1)和10-Mer(n=1)和12-Mer(n=1)寡核苷酸连接子分别产生分别为12.5%和21.7%和68.4%的靶细胞回收率。计算Tm为50.2℃的14-Mer(n=3)寡核苷酸连接子产生在76.7%和94.5%之间的靶细胞回收率。这些结果证明,靶细胞回收率是寡核苷酸连接子长度的敏感函数,并且提供了意外的发现,即计算Tm(在所用的离子条件下)明显高于在此使用的37℃去杂交温度(这对人类细胞存活是理想的)的寡核苷酸连接子杂交体达到的回收最高率。在最佳条件下,观察到高达95%的靶细胞回收效率,本领域技术人员将认识到超过常规靶细胞分离方法的回收效率。
实施例2
在功能封闭系统中从人血分离靶细胞
为了制备用于本发明方法中的富集的细胞悬液-结合剂-浮力标签复合物,使用以下方案:在本发明中通过处理200ml新鲜人外周血用于CD3+或CD4+分离和100mL单采白细胞用于CD3+分离来制备外周血和单采白细胞的单核细胞(PBMC)制备物,并设定为收获40-45ml进入PBSHE中。在排空套筒内的非靶细胞部分之后,通过转移容器将靶细胞富集的细胞悬液转移到处理容器中以保持无菌性。
对于从外周血分离CD3+细胞:PBMC或单采白细胞的PBMC,1mL生物素化的CD3抗体(原液浓度0.5mg蛋白/mL)用PBSHE稀释至5mL的体积,并通过整合的0.2μm过滤器加入,并在室温下伴恒温混合温育20分钟。
对于从外周血分离CD4+细胞:1mL生物素化的CD3抗体(原液浓度0.5mg蛋白/mL)用PBSHE稀释至5mL的体积,并通过整合的0.2μm过滤器加入,并在室温下伴恒温混合温育20分钟。
CD4+细胞
0.5mL生物素化的CD3抗体(原液浓度0.5mg蛋白/mL)用PBSHE稀释至5mL的体积,并通过整合的0.2μm过滤器加入,并在室温下伴恒温混合温育20分钟。
另外,通过短暂涡旋2x 1.4mL用于CD3+或CD4+的Advanced MicrobubblesSIMBTM4-5微泡的小瓶来制备浮力试剂并无菌分配到具有PVC输出管的5mL注射器中。5mL的其余部分由PBSHE补足。在完成20分钟抗体温育之后,将微泡注射器无菌接入系统的第三导管并添加微泡。将PBMC-抗体-微泡悬液在室温下伴恒定混合温育30分钟。
温育后,所述系统以400x g离心5分钟。微泡(和结合微泡的细胞)漂浮在弯液面上形成结块,而未结合的细胞在容器的底部形成沉淀团,在所述细胞沉淀团和细胞结块之间观察到澄清的溶液。然后将系统以50x g离心1分钟以将负性部分转移到所述第二容器中,在这种情况下充当清除容器。取一小份负性部分用于细胞计数。
将泡的结块加上清液转移到转移容器中,然后经受超声波能量2秒,直到泡被破坏。将超声处理过的正性细胞部分转移回处理容器中,并以400x g离心5分钟,然后转移至第三容器,在这种情况下充当收获容器至限定的最终体积。取一小份正性部分用于细胞计数。
稀释的PBMC、负性部分、正性部分样品进行流式细胞术分析。使用抗体主混合物,其含有FITC标记的抗人CD45、7-氨基放线菌素染料(7-AAD)、PE标记的抗人CD4和APC标记的抗人CD3。将每种细胞悬液的50μl等份添加到含有预先确定合适的主混合物体积的流式管中。50μl稀释的PBMC悬液添加到阳性对照和阴性对照流式管中。阳性对照用主混合物标记,阴性对照管用FITC标记的抗人CD45、7-AAD、以及PE或APC标记的小鼠IgG(同种型)标记。然后涡旋所有管并在室温下在暗处温育20分钟。这次温育后,所有管容纳0.5ml的1x裂解缓冲液,然后将管涡旋并在室温下在暗处再温育10分钟。在马上要流式细胞术分析之前,各管容纳50μl流式计数珠悬液。然后使用之前确定的CD45/CD4/7-AAD/CD3门控策略来分析管,以用PBMC获得充分的结果。
实验结果显示在图12中。从外周血中分离细胞产生80.9%和88.1%之间的CD3+(n=4)回收率、94.8%和99.6%之间的纯度以及90.7%和95.8%之间的存活率。对于CD4+细胞(n=1),回收率是81.7%,纯度96.6%,和存活率95.3%。从单采白细胞(n=1)分离CD3+细胞产生了83.0%的回收率、纯度98.6%和存活率96.1%。在每种情况下,这些组合的回收率、纯度和存活率度量超过了以前在文献中由工作人员采用完全人工处理和开放式容器所报道的,证明了本发明的未经证实的性能。
实施例3
使用寡核苷酸连接子在功能封闭系统中从人血分离CD3+细胞
为了制备用于本发明方法中的富集的细胞悬浮液-结合剂-浮力标签复合物,可以使用以下方案:在本发明中通过处理200ml新鲜人外周血来制备外周血单核细胞(PBMC)制备物,并设定为收获40-45ml进入PBSHE中。在排空套筒内的非靶细胞血液部分之后,经由转移容器将收获的富集靶细胞悬液转移到处理容器中以保持无菌性。
如下制备CD3抗体和寡核苷酸杂交体:将540μg预先在5'端缀合了20-Mer寡核苷酸5'-GGA AGC GGT GCT ATC CTA CT-3'(序列号1)的CD3抗体与1/10体积的预先与生物素缀合的14-Mer互补寡核苷酸(A')(4μm浓度)一起温育。所述互补寡核苷酸序列是所述20-Mer寡核苷酸的最3'碱基。将寡核苷酸在室温下温育1小时以发生杂交。杂交后,通过整合的0.2μm过滤器将抗体-寡核苷酸杂交体添加到PBMC中,并在室温下伴恒温混合温育20分钟。
另外,通过短暂涡旋2x 1.4mL Advanced Microbubbles SIMBTM4-5微泡的小瓶来制备浮力试剂并无菌分配到具有PVC输出管的5mL注射器中。5mL的其余部分由PBSHE补足。在完成20分钟抗体温育之后,将微泡注射器无菌接入系统的第三导管并添加微泡。将PBMC-抗体-微泡悬液在室温下伴恒定混合温育30分钟。
温育后,所述系统以400x g离心5分钟。微泡(和结合微泡的细胞)漂浮在弯液面上形成结块,而未结合的细胞在容器的底部形成沉淀团,在所述细胞沉淀团和细胞结块之间观察到澄清的溶液。然后将系统以50x g离心1分钟以将负性部分转移到第二容器、即清除容器中。取一小份负性部分用于细胞计数。另外将600μM浓度的竞争性寡核苷酸A'与PBSHE在5mL注射器中合并。
将泡的结块加上清液转移到转移容器中,然后添加竞争性寡核苷酸A'。将PBMC-抗体-微泡悬液与竞争性寡核苷酸A'在37℃水浴中伴恒定混合温育40分钟。
将正性细胞部分转移回处理容器中,并以400x g离心5分钟,然后转移至第三容器,在这种情况下充当收获容器,至限定的最终体积。未结合的微泡留在处理容器中。取一小份正性部分和微泡部分用于细胞计数。
稀释的PBMC、负性部分、正性部分样品进行流式细胞术分析。使用抗体主混合物,其含有FITC标记的抗人CD45、7-氨基放线菌素染料(7-AAD)、和APC标记的抗人CD3。将每种细胞悬液的50μl等份添加到含有预先确定合适的主混合物体积的流式管中。50μl稀释的PBMC悬液添加到阳性对照和阴性对照流式管中。阳性对照用主混合物标记,阴性对照管用FITC标记的抗人CD45、7-AAD、以及APC标记的小鼠IgG(同种型)标记。然后涡旋所有管并在室温下在暗处温育20分钟。这次温育后,所有管容纳0.5ml的1x裂解缓冲液,然后将管涡旋并在室温下在暗处再温育10分钟。在马上要流式细胞术分析之前,各管容纳50μl流式计数珠悬液。然后使用之前确定的CD45/7-AAD/CD3门控策略来分析管,以用PBMC获得充分的结果。
实验结果显示在图11中。使用计算Tm为50.2℃的14-Mer寡核苷酸连接子(n=1)从外周血(n=1)分离CD3+细胞产生76.7%的回收率、纯度97.3%、和存活率96.8%。这些结果证明,寡核苷酸连接子方法在自动化的大容量系统中产生优异的纯度、回收率和存活率,同时避免了需要物理破坏微泡(例如经由超声处理)以收集靶细胞,这在诸如此处使用的大容量系统中可能难以精确地控制。
以下内容对应于母案申请中的原始权利要求书,现作为说明书的一部分并入此处:
1、一种细胞分离系统,其包含:
(a)套筒,其包含
(i)包含至少一个输入口、第一出口和第二出口的处理容器;
(ii)包含输入口的第二容器;
(iii)包含输入口和第一出口的第三容器;
(iv)连接所述处理容器的第一出口和所述第二容器的输入口的第一导管,其中所述第一导管包含第一可逆关闭装置,其中所述第二容器与所述处理容器瞬时流体连接,使得当所述第一可逆关闭装置打开时,只可发生从所述处理容器向所述第二容器的流体流动;
(v)连接所述处理容器的第二出口和所述第三容器的输入口的第二导管,其中所述第二导管包含第二可逆关闭装置,其中所述第三容器与所述处理容器瞬时流体连接,使得当所述第二可逆关闭装置打开时,只可发生从所述处理容器向所述第三容器的流体流动;
(b)包含至少一个端口的转移容器;
(c)至少第三导管,其连接:
(i)所述第三容器的第一出口与所述转移容器的所述至少一个端口,和
(ii)所述转移容器的所述至少一个端口与所述处理容器的所述至少一个输入口,
其中所述至少第三导管包含至少第三可逆关闭装置,使得(A)所述第三容器与所述转移容器瞬时流体连接,和(B)所述转移容器与所述处理容器瞬时流体连接,其中所述至少第三导管配置成使得下列中仅一项可以成立:
(I)当所述至少第三可逆关闭装置打开时,只可发生从所述第三容器向所述转移容器的流体流动;或
(II)当所述至少第三可逆关闭装置打开时,只可发生从所述转移容器向所述处理容器的流体流动;以及
(d)控制模块,其配置成控制在至少所述套筒、以及所述第一导管和第二导管中的活动。
2、根据项1所述的细胞分离系统,其中所述转移容器在所述套筒的内部。
3、根据项1或2所述的细胞分离系统,其中所述至少第三导管包含单个导管。
4、根据项3所述的细胞分离系统,其中所述至少第三导管包含设置在所述第三容器和所述转移容器之间以及所述转移容器和所述处理容器之间的T或Y型连接器。
5、根据项1-2中任一项所述的细胞分离系统,其中所述转移容器的所述至少一个端口包含第一输入口和出口。
6、根据项5所述的细胞分离系统,其中所述至少第三导管包含:
(i)连接所述第三容器的出口和所述转移容器的输入口的第三导管,其中所述第三导管包含第三可逆关闭装置,使得所述第三容器与所述转移容器瞬时流体连接,使得当所述第三可逆关闭装置打开时,只可发生从所述第三容器向所述转移容器的流体流动;以及
(ii)连接所述转移容器的出口和所述处理容器的所述至少一个输入口的第四导管,其中所述第四导管包含第四可逆关闭装置,使得所述转移容器与所述处理容器瞬时流体连接,使得当所述第四可逆关闭装置打开时,只可发生从所述转移容器向所述处理容器的流体流动。
7、根据项1-6中任一项所述的细胞分离系统,其中所述处理容器的所述至少一个输入口包含第一输入口和第二输入口,其中所述至少第三导管或所述第四导管(当存在时)将所述转移容器的出口与所述处理容器的第一输入口连接。
8、根据项7所述的细胞分离系统,其还包含将所述处理容器的第二输入口与至少一个介质储器连接的第一介质输入导管,其中所述第一介质输入导管包含至少第五可逆关闭装置,其中所述至少一个介质储器与处理容器瞬时流体连接,使得当所述至少第五可逆关闭装置打开时,只可发生从所述至少一个介质储器向所述处理容器的流体流动。
9、根据项5-8中任一项所述的细胞分离系统,其中所述转移容器的所述至少一个端口还包含第二输入口。
10、根据项9所述的细胞分离系统,其还包含将所述转移容器的第二输入口与至少一个介质储器连接的第二介质输入导管,其中所述第二介质输入导管包含至少第六可逆关闭装置,其中所述至少一个介质储器与所述处理容器瞬时流体连接,使得当所述至少第六可逆关闭装置打开时,只可发生从所述至少一个介质储器向所述转移容器的流体流动。
11、根据项1-10中任一项所述的细胞分离系统,其中所述细胞分离系统还包含混合器。
12、根据项11所述的细胞分离系统,其中所述混合器包含静态混合器。
13、根据项11或12所述的细胞分离系统,其中所述混合器包含设置在所述套筒的顶壁内表面上的叶轮。
14、根据项11或12所述的细胞分离系统,其中所述混合器包含与所述套筒的顶壁内表面间隔开的叶轮。
15、根据项11所述的细胞分离系统,其中所述混合器包含蠕动泵,所述蠕动泵包含具有第一端和第二端的泵导管,其中所述泵导管的第一端定位在所述处理室中,并且其中所述泵导管的第二端定位在所述处理室的外部并与所述处理室的至少一个输入口连接。
16、根据项11所述的细胞分离系统,其中所述混合器包括混合模块,所述混合模块包含底部部分和顶部部分,其中所述套筒配置成定位在所述底部部分中,并且其中所述顶部部分配置成与所述底部部分可卸式联接。
17、根据项16所述的细胞分离系统,其中所述混合模块包括与所述底部部分联接的可旋转组件,并且其中所述可旋转组件配置成在其立轴上将所述套筒旋转180度或360度。
18、根据项16或17所述的细胞分离系统,其中所述混合模块配置成当所述套筒定位在所述混合模块的底部部分中时增加所述套筒的温度。
19、根据项8-18中任一项所述的细胞分离系统,其中所述第一介质输入导管和/或所述第二介质输入导管还包含过滤器。
20、根据项1-19中任一项所述的细胞分离系统,其中所述第二容器包含与第一废物导管联接的出口。
21、根据项1-20中任一项所述的细胞分离系统,其中所述处理容器还包含与第二废物导管联接的无菌排出口。
22、一种细胞分离方法,其包含:
(a)在功能封闭系统中处理体积为至少10mL(或者,可选地,至少25mL,至少50mL,至少75mL,至少100mL,至少200mL)的主液,其中所述主液包含(i)靶细胞,和(ii)浮力试剂,其中所述处理包含使所述靶细胞和所述浮力试剂在适于促进所述细胞附着于一种或多种所述浮力试剂的条件下接触一定时间以生成附着的靶细胞;
(b)向所述功能封闭系统内的所述主液施加矢量力例如离心,以引起所述附着的靶细胞在所述主液内分层;以及
(c)将所述附着的靶细胞隔离到所述功能封闭系统内的区域。
23、根据项22所述的细胞分离方法,其中所述浮力试剂包含制造的浮力试剂,其中各种制造的浮力试剂包含如下所述的浮力试剂:其中浮力标签和结合剂在与所述主液中的靶细胞接触之前彼此附着以形成所述制造的浮力试剂。
24、根据项22所述的细胞分离方法,其中所述浮力试剂包含在所述主液内组装的二级浮力试剂,其中方法还包含在步骤(a)之前的预处理步骤,其中所述预处理步骤包含使所述主液与浮力标签和结合剂在适于促进所述结合剂与所述浮力标签附着的条件下接触一定时间以产生所述浮力试剂。
25、根据项24所述的方法,其中
(i)各结合剂包含(A)包含能够与所述靶细胞上的至少一个细胞表位结合的作用剂的初级结合剂,(B)与所述初级结合剂结合的第一连接子,其中所述第一连接子包含具有第一互补区的第一寡核苷酸;
(ii)各浮力标签包含与所述浮力标签结合的第二连接子;
其中所述第二连接子包含具有第二互补区的第二寡核苷酸,其中所述第二互补区与所述第一互补区完全互补,并且其中所述第一和第二互补区的杂交体具有至少40℃的计算Tm;
其中所述预处理步骤包含使所述主液与所述浮力标签和所述结合剂在适于促进所述第一和第二互补区杂交的条件下接触一定时间以产生所述浮力试剂;
其中所述处理包含使所述靶细胞和所述浮力试剂在适于生成所述附着的靶细胞的条件下在所述主液中接触;并且其中所述方法还包含
(d)在步骤(c)之后,在所述功能封闭系统内使所述附着的靶细胞经受37℃或更低的温度达足以使所述第一互补区和所述第二互补区去杂交的一定时间以从所述靶细胞释放所述浮力试剂。
26、一种细胞分离方法,其包含:
(a)提供主液,其中所述主液包含附着的靶细胞,其中每个附着的靶细胞包含
(i)与靶细胞上的至少一个细胞表位结合的结合剂,
(ii)与所述结合剂结合的第一连接子,其中所述第一连接子包含具有第一互补区的第一寡核苷酸;
(iii)浮力标签,其包含与所述浮力标签结合的第二连接子,其中所述第二连接子包含具有第二互补区的第二寡核苷酸,其中所述第二互补区与所述第一互补区完全互补,其中所述第二互补区与所述第一互补区杂交以形成杂交体,并且其中所述第一和第二互补区的杂交体具有至少40℃的计算Tm;
(b)向所述主液施加矢量力例如离心,以引起所述附着的靶细胞在所述主液内分层;
(c)将所述附着的靶细胞隔离;以及
(d)在步骤(c)之后,使所述附着的靶细胞经受37℃或更低的温度达足以使所述第一互补区和所述第二互补区去杂交的一定时间以从所述靶细胞释放所述浮力标签。
27、根据项26所述的方法,其中在步骤(a)之前通过处理步骤生成所述附着的靶细胞,所述处理步骤包含使所述主液中的靶细胞与所制造的包含所述结合剂、所述第一连接子和所述第二连接子的浮力试剂接触,其中所述第二互补区与所述第一互补区杂交以形成所述杂交体;
其中所述接触在适于促进所述细胞与一种或多种所制造的浮力试剂附着的条件下进行一定时间以生成所述附着的靶细胞。
28、根据项26所述的方法,其中在步骤(a)之前通过处理步骤生成附着的靶细胞,所述处理步骤包含:
(A)使所述主液与所述浮力标签和结合有所述第一连接子的结合剂在适于促进所述第一和第二互补区杂交以产生浮力试剂的条件下接触一定时间;和
(B)使所述靶细胞和所述浮力试剂在适于生成所述附着的靶细胞的条件下在所述主液中接触一定时间。
29、根据项25-28中任一项所述的方法,其中所述计算Tm是利用最近邻二态模型计算的Tm:
其中ΔΗ°(焓)和ΔS°(熵)是在所使用的离子条件下从序列和所公布的最近邻热力学参数计算的熔融参数,R是理想气体常数(1.987calK
30、根据项25-29中任一项所述的方法,其中所述第一互补区和所述第二互补区之间杂交体的计算Tm在40℃和约60℃之间。
31、根据项22-30中任一项所述的方法,其中所述结合剂与所述靶细胞上的细胞表位结合。
32、根据项22-31中任一项所述的方法,其中各浮力试剂包含一个或多个第二连接子,其中所述一个或多个第二连接子与一个或多个附连于至少一种结合剂的第一连接子结合,其中所述至少一种结合剂能够与所述靶细胞上的细胞表位结合;并且其中所述接触包含使所述靶细胞和所述浮力试剂在适于促进所述靶细胞与一种或多种所述浮力试剂附着的条件下接触一定时间以生成所述附着的靶细胞。
33、根据项22-32中任一项所述的方法,其中所述处理包含:
(i)使所述主液与所述初级结合剂接触,其中各初级结合剂包含(A)能够与所述靶细胞上的至少一个细胞表位结合的作用剂,和(B)与所述作用剂结合的第一连接子;其中所述接触在适于促进所述靶细胞与所述初级结合剂附着的条件下发生以产生靶细胞-结合剂复合物;以及
(ii)将所述靶细胞-结合剂复合物与所述浮力标签一起温育,其中各浮力标签包含第二连接子,其中所述第二连接子能够与所述第一连接子结合,其中所述温育在适于促进所述第一连接子与所述第二连接子结合的条件下发生以生成所述附着的靶细胞。
34、根据项33所述的方法,其中步骤(i)和(ii)之间不存在除去未结合的初级结合剂的中间步骤。
35、根据项22-24和31-34中任一项所述的方法,其中所述方法还包含在所述功能封闭系统内将所述浮力标签与所述靶细胞分离以产生分离的靶细胞。
36、根据项22-35中任一项所述的方法,其中所述靶细胞和/或所需细胞选自由以下组成的组:肿瘤细胞,癌干细胞,在正常血液、胎盘/脐带血、骨髓中发现的造血干细胞和祖细胞、间充质干细胞和祖细胞、脂肪源性干细胞和祖细胞、内皮祖细胞,白细胞,粒细胞,单核细胞,淋巴细胞,单核白细胞,T细胞,B细胞,NK细胞,驻留在脂肪组织中的基质血管部分细胞,培养细胞,基因修饰细胞,以及这样的靶细胞的亚群。
37、根据项22-36中任一项所述的方法,其中所述靶细胞和/或所需细胞选自由以下组成的组:CD3+细胞,CD4+细胞,CD235a,CD14+,CD19+,CD56+,CD34+,CD117
38、根据项22-37中任一项所述的方法,其中所述靶细胞和/或所需细胞占未贫化的主液中细胞的少于10%。
39、根据项22-38中任一项所述的方法,其中所述靶细胞和/或所需细胞占未贫化的主液中细胞的少于5%。
40、根据项22-39中任一项所述的方法,其中所述所需细胞的回收效率大于68%、或大于75%、或大于80%、或大于85%、或大于90%、或大于95%。
41、根据项22-40中任一项所述的方法,其中所需细胞的存活率大于90%、或大于95%、或大于97%、或大于99%。
42、根据项22-41中任一项所述的方法,其中所述靶细胞和/或所需细胞占所述主液中总细胞的少于20%。
43、根据项22-42中任一项所述的方法,其中所述靶细胞和/或所需细胞占所述主液中总细胞的少于5%、或所述主液中总细胞的少于2%、或所述主液中总细胞的少于1%。
44、根据项22-43中任一项所述的方法,其中所述结合剂选自由抗体、寡核苷酸、适配体、分子印记聚合物、碳水化合物、蛋白质、肽、酶、小分子、脂质、脂肪酸、金属原子、金属离子或合成聚合物组成的组。
45、根据项23-44中任一项所述的方法,其中所述结合剂包含抗体。
46、根据项22-45中任一项所述的方法,其中所述第一连接子和第二连接子包含生物素、亲和素、链霉亲和素、寡核苷酸、抗体结合蛋白、其组合、和/或被抗体结合蛋白或任何第二相连结合剂结合的部分。
47、根据项22-45中任一项所述的方法,其中所述第一连接子和第二连接子包含单独或与寡核苷酸连接的生物素和/或链霉亲和素。
48、根据项22-47中任一项所述的方法,其中所述浮力标签选自由充气泡、中空聚合物、玻璃珠、夹带气体的微孔珠、不混溶液体的液滴、金纳米粒子和银纳米粒子组成的组。
49、根据项22-48中任一项所述的方法,其中所述浮力标签包含充气泡。
50、根据项49所述的方法,其中所述充气泡包含被脂质、磷脂、碳水化合物或蛋白质壳包围的全氟化碳气体芯。
51、根据项50所述的方法,其中所述充气泡包含被磷脂壳包围的全氟化碳气体芯。
52、根据项50-51中任一项所述的方法,其中所述充气泡的直径在约1μm和约6.5μm之间。
53、根据项22-52中任一项所述的方法,其中所述主液是外周血、脐带血或单采白细胞。
54、根据项22-25和29-53中任一项所述的方法,其中所述功能封闭系统包含细胞分离系统,所述细胞分离系统包含
(a)套筒,其包含
(i)包含至少一个输入口、第一出口和第二出口的处理容器;
(ii)两个或更多个另外的容器,其至少包括包含输入口的第二容器;以及包含输入口和第一出口的第三容器;
(ii)连接所述处理容器的第一出口所述和第二容器的输入口的第一导管,其中所述第一导管包含第一可逆关闭装置,其中所述第二容器与所述处理容器瞬时流体连接,使得当所述第一可逆关闭装置打开时,只可发生从所述处理容器向所述第二容器的流体流动;
(v)连接所述处理容器的第二出口和所述第三容器的输入口的第二导管,其中所述第二导管包含第二可逆关闭装置,其中所述第三容器与所述处理容器瞬时流体连接,使得当所述第二可逆关闭装置打开时,只可发生从所述处理容器向所述第三容器的流体流动;
(b)包含至少一个端口的转移容器;
(c)至少第三导管,其连接
(i)所述第三容器的第一出口与所述转移容器的所述至少一个端口,和
(ii)所述转移容器的所述至少一个端口与所述处理容器的所述至少一个输入口
其中所述至少第三导管包含至少第三可逆关闭装置,使得(A)所述第三容器与所述转移容器瞬时流体连接,和(B)所述转移容器与所述处理容器瞬时流体连接;其中所述至少第三导管配置成使得下列中仅一项可以成立
(I)当所述至少第三可逆关闭装置打开时,只可发生从所述第三容器向所述转移容器的流体流动;或
(II)当所述至少第三可逆关闭装置打开时,只可发生从所述转移容器向所述处理容器的流体流动。
55、根据项22-25和29-50中任一项所述的方法,其中所述待处理的主液是贫化的主液,并且在所述处理或预处理步骤之前,所述方法包含向所述功能封闭系统内、例如所述处理容器内的未贫化的主液施加矢量力例如离心,以清除非所需细胞,例如通过将所述非所需细胞通入第二容器中,从而产生待处理的贫化的主液。
56、根据项55所述的方法,其中所述贫化的主液从所述处理容器传送到所述转移容器并与所述浮力试剂混合以开始处理所述主液。
57、根据项55-56中任一项所述的方法,其中所述靶细胞是所述所需细胞,并且其中所述隔离包含将所述分离的靶细胞传送到所述第三容器。
58、根据项55-56中任一项所述的方法,其中所述靶细胞不是所述所需细胞,并且所述隔离包含将所述分离的靶细胞在所述功能封闭系统内浓缩。
59、根据项55-58中任一项所述的方法,其中所述细胞分离系统还包含控制模块,用于控制在至少所述套筒以及所述第一和第二导管中的活动。
60、根据项22-25和29-59中任一项所述的方法,其中所述功能封闭系统包含项1-21中任一项所述的细胞分离系统。
61、一种细胞悬液,其包含:
(a)体积为至少1mL(或者,可选地,至少2ml、5ml、10ml、15ml、30ml、25mL、至少50mL、至少75mL、至少100mL、至少200mL)的液体介质;和
(b)悬浮在所述液体介质中的所需细胞,其中所述所需细胞选自由以下组成的组:在正常血液、胎盘/脐带血、骨髓中发现的造血干细胞和祖细胞、间充质干细胞和祖细胞、内皮祖细胞,白细胞,粒细胞,单核细胞,淋巴细胞,单核白细胞,T细胞,B细胞,NK细胞,驻留在脂肪组织中的基质血管部分细胞,培养细胞,基因修饰细胞,以及这样的所需细胞的亚群;其中所述所需细胞存在于液体介质中并且其中所述所需细胞占所述细胞悬液中细胞的至少80%(或者,至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多);
其中所述所需细胞的存活率大于90%、或大于95%、或大于97%、或大于99%;并且
其中所述细胞悬液存在于所述功能封闭的细胞分离系统内,或者直接从所述功能封闭的细胞分离系统获得,无需进一步处理。
62、根据项61所述的组合物,其中所述所需细胞选自由以下组成的组:CD3+细胞,CD4+细胞,CD235a,CD14+,CD19+,CD56+,CD34+,CD117
63、根据项61-62中任一项所述的细胞悬液,其中所述功能封闭系统包含项1-21中任一项所述的细胞分离系统。
64、根据项63所述的细胞悬液,其中所述细胞悬液存在于所述转移容器、所述处理容器和/或所述第三容器内。
65、根据项61-64中任一项所述的细胞悬液,其中所述细胞悬液存在于经过所述功能封闭的细胞分离系统的转移容器的细胞悬液移除流中。
66、根据项61-65中任一项所述的细胞悬液,其中存活的所需细胞的数量是至少1x10
67、根据项61-66中任一项所述的细胞悬液,其中所述所需细胞包含与所述细胞附着的浮力标签。
68、一种组合物,其包含:
(a)至少一种与至少一个第一连接子共价或非共价连接的结合剂,所述至少一种结合剂能够结合细胞悬液中所述细胞上的至少一个分子靶标;以及
(b)至少一种与至少一个第二互补连接子共价或非共价连接的浮力标签,所述至少一种浮力标签表现出密度显著不同于所述待分离的细胞悬浮于其中的液体介质的密度。
69、一种试剂盒,其包含:
(i)初级结合剂,其包含能够与靶细胞上的至少一个细胞表位结合的作用剂;
(ii)与所述作用剂结合的第一连接子,其中所述第一连接子包含具有第一互补区的第一寡核苷酸;
(iii)浮力标签;
(iv)与所述浮力标签结合的第二连接子,其中所述第二连接子包含具有第二互补区的第二寡核苷酸,其中所述第二互补区与所述第一互补区完全互补,并且其中所述第一和第二互补区的杂交体具有至少40℃的计算Tm。
70、一种组合物,其包含:
(i)初级结合剂,其包含能够与靶细胞上的至少一个细胞表位结合的作用剂;
(ii)与所述作用剂结合的第一连接子,其中所述第一连接子包含具有第一互补区的第一寡核苷酸;
(iii)浮力标签;
(iv)与所述浮力标签结合的第二连接子,其中所述第二连接子包含具有与所述第一互补区完全互补的第二互补区的第二寡核苷酸,其中所述第一和第二连接子的互补区的杂交体具有至少40℃的计算Tm;
其中所述第一连接子和所述第二连接子彼此杂交。
71、根据项70所述的组合物,其中所述组合物还包含与所述初级结合剂结合的靶细胞。
72、根据项69-71中任一项所述的试剂盒或组合物,其中所述第一互补区和第二互补区的杂交体的所述计算Tm在40℃和约60℃之间。
73、根据项69-72中任一项所述的试剂盒或组合物,其中所述计算Tm大于或等于40℃,其利用所述最近邻二态模型计算:
其中ΔΗ°(焓)和ΔS°(熵)是在所使用的离子条件下从序列和所公布的最近邻热力学参数计算的熔融参数,R是理想气体常数(1.987calK
74、根据项69-73中任一项所述的试剂盒或组合物,其中所述初级结合剂选自由抗体、寡核苷酸、适配体、分子印记聚合物、碳水化合物、蛋白质、肽、酶、小分子、脂质、脂肪酸、金属原子、金属离子或合成聚合物组成的组。
75、根据项69-74中任一项所述的试剂盒或组合物,其中所述初级结合剂包含抗体。
76、根据项69-75中任一项所述的试剂盒或组合物,其中所述第一连接子和所述第二连接子之一还包含生物素并且另一个还包含链霉亲和素。
77、根据项69-76中任一项所述的试剂盒或组合物,其中所述浮力标签选自由充气泡、中空聚合物、玻璃珠、夹带气体的微孔珠、不混溶液体的液滴、金纳米粒子和银纳米粒子组成的组。
78、根据项69-76中任一项所述的试剂盒或组合物,其中所述浮力标签包含充气泡。
79、根据项78所述的试剂盒或组合物,其中所述充气泡包含被脂质、磷脂、蛋白质或碳水化合物壳包围的全氟化碳气体芯。
80、根据项78所述的试剂盒或组合物,其中所述充气泡包含被磷脂壳包围的全氟化碳气体芯。
81、根据项78-80中任一项所述的试剂盒或组合物,其中所述充气泡的直径在约1μm和约6.5μm之间。
82、一种组合物,其包含经由浮力活化的细胞分选而从至少一种分子类型的所需细胞和至少一种分子类型的非所需细胞的起始混合物中纯化的所需细胞,其中所述起始混合物含有非所需细胞数量的至少1倍的所需细胞,或者非所需细胞数量的至少5倍的所需细胞,或者非所需细胞数量的至少10倍的所需细胞,或者非所需细胞数量的至少50倍的所需细胞,或者非所需细胞数量的至少100倍的所需细胞,或者非所需细胞数量的至少500倍的所需细胞,或者非所需细胞数量的至少1000倍的所需细胞,其中:
所述至少一种类型的所需细胞的回收效率大于80%、或大于85%、或大于90%、或大于95%;
所述至少一种类型的所需细胞的纯度大于80%、或大于85%、或大于90%、或大于95%;
所述至少一种类型的所需细胞的存活率大于90%、或大于95%、或大于97%、或大于99%;以及
经受所述浮力活化细胞分选的所述至少一种分子类型的所需细胞和至少一种分子类型的非所需细胞的混合物的体积大于2mL、或大于10mL、或大于50mL、或大于100mL、或大于150mL、或大于200mL、或大于400mL、或大于800mL。
83、根据项82所述的组合物,其中所述纯化的所需细胞或从所述纯化的所需细胞扩增的细胞用于细胞疗法、研究、或药物开发。
84、根据项82或83所述的组合物,其中在经由浮力活化的细胞分选进行纯化之前,经由离心富集所述所需细胞。
85、根据项84所述的组合物,其中所述浮力活化的细胞分选步骤在进行先前所述富集所需细胞的同一容器中进行。
86、根据项82-85中任一项所述的组合物,其中将所述所需细胞在纯化之前或纯化之后扩增。
87、根据项82-85中任一项所述的组合物,其中所述细胞用于细胞疗法,并且所述细胞疗法是自体或同种异体的。
88、根据项82-87中任一项所述的组合物,其中所述所需细胞是干细胞或前体细胞、免疫细胞、从干细胞分化的细胞、从诱导性多能干细胞分化的细胞、基因工程细胞、和/或准备基因工程的细胞。
89、根据项82-88中任一项所述的组合物,其中所述所需细胞经由浮力活化的细胞分选进行负选择、经由浮力活化的细胞分选进行正选择、或其组合。
90、根据项82-88中任一项所述的组合物,其中所述所需细胞通过浮力活化的细胞分选经由相继的负选择和正选择的组合来选择,其中所述相继的负选择和正选择在同一容器中进行。
序列表
<110> 热起源公司
<120> 细胞分离装置、方法和系统
<130> 15-2074-PCT
<150> 62/272533
<151> 2015-12-29
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 合成的
<400> 1
ggaagcggtg ctatccatc 19
- 密闭式系统的细胞分离方法、其细胞培养袋及其细胞分离装置
- 基于细胞形变量和声表面波的癌细胞分离装置及控制系统
