神经调节技术
文献发布时间:2023-06-19 10:48:02
背景技术
本文所公开的主题涉及神经调节,并且更具体地涉及使用从能源应用的能量调节生理响应(应答,反应,response)的技术。
神经调节已用于治疗多种临床病况。例如,在沿脊髓的多个位置处的电刺激已用于治疗慢性背痛。可植入装置可以周期性产生电能,该电能应用至组织以激活某些神经纤维,其可以导致疼痛感降低。对于脊髓刺激,刺激电极通常位于硬膜外腔中,尽管脉冲发生器可以稍微远离电极定位,例如,在腹部或臀部区域,但是需要通过导线连接至电极。在其它实施中,深部脑刺激可以用于刺激脑的特定区域以治疗运动障碍,并且刺激位置可以通过神经成像来引导。这种中枢神经系统刺激通常靶向局部神经或脑细胞功能,并且通过递送电脉冲并位于靶神经处或附近的电极介导。然而,将电极定位在靶神经处或附近是困难的。例如,这些技术可以涉及手术放置递送能量的电极。此外,通过神经调节的特定组织靶向是困难的。位于某些靶神经处或附近的电极通过触发神经纤维中的动作电位来介导神经调节,这进而导致神经突触处神经递质的释放和与下一神经的突触通信。由于植入电极的当前实施一次刺激多个神经或轴突,因此这种传播可以导致比期望相对更大或更扩散的生理学效果。由于神经通路是复杂且相互连接的,因此靶向性更强的调节效果可以在临床上更有用。
发明内容
以下概述了与最初所主张的主题的范围相匹配的某些实施方式。这些实施方式不意欲限制所主张的主题的范围,而是这些实施方式仅旨在提供可能实施方式的简要概述。实际上,本发明公开可以涵盖可以与以下所述的实施方式类似或不同的多种形式。
在一个实施方式中,一种方法可以包括进行具有一个或多个治疗参数的治疗规程以引起远端位点(distal site)处所关心的一种或多种分子的浓度变化。治疗规程可以包括对所关心的区域的一种或多种超声波能(ultrasound energy)治疗。该方法可以包括在完成治疗规程后,评价所关心的区域中基因的表达水平和远端位点处一种或多种所关心的分子的浓度,并且基于基因的表达水平、一种或多种所关心的分子的浓度或者两者改变一种或多种治疗参数。
在另一个实施方式中,一种方法可以包括进行具有一个或多个治疗参数的治疗规程以引起远端位点处的目标生理学结果。治疗规程可以包括对所关心的区域的一种或多种超声波能治疗。该方法可以包括在完成治疗规程之后评价所关心的区域中基因的表达水平,并且基于基因的表达水平改变一个或多个治疗参数。
在另一个实施方式中,一种方法可以包括进行具有一个或多个治疗参数的治疗规程以引起远端位点处一种或多种所关心的分子的浓度变化。治疗规程可以包括对所关心的区域的一种或多种超声波能治疗。该方法可以包括评价所关心的区域中基因的RNA转录,并且基于所关心的区域中基因的RNA转录改变一个或多个治疗参数。
附图说明
当参考附图阅读以下详细描述时,将更好地理解本发明的这些和其它特征、方面和优势,附图中类似的符号在整个附图中表示类似的部分,其中:
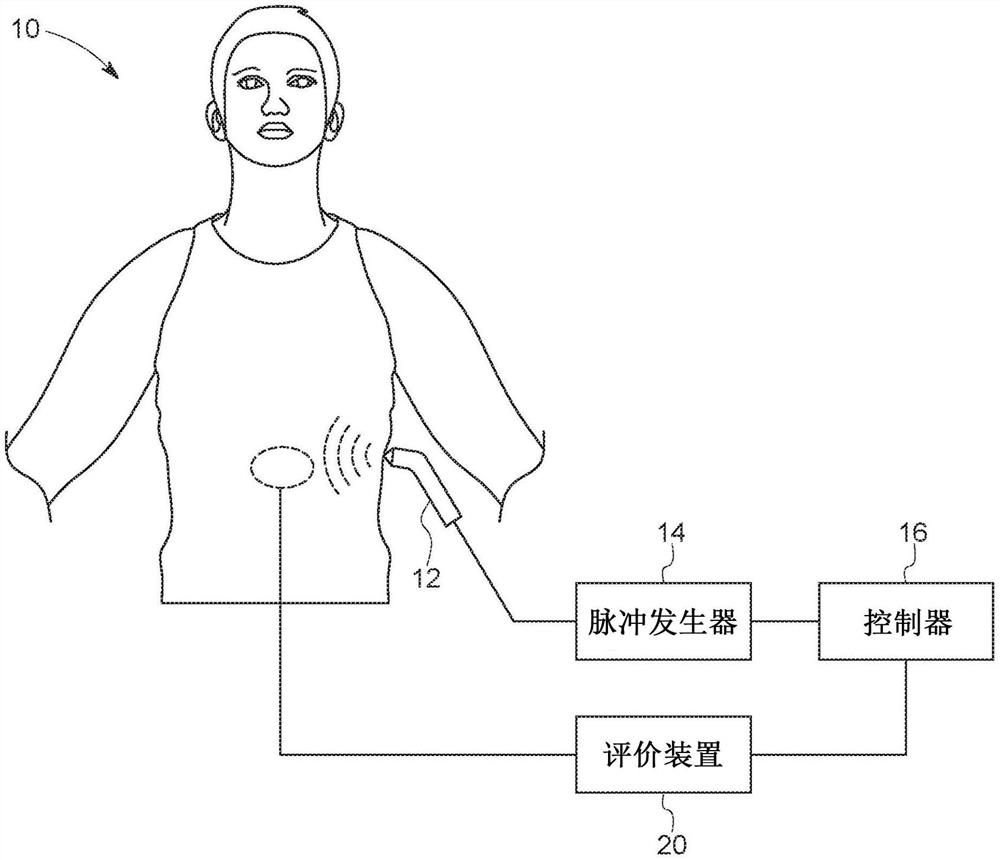
图1是根据本发明公开的实施方式,使用脉冲发生器的神经调节系统的示意图;
图2是根据本发明公开的实施方式的神经调节系统的框图;
图3是根据本发明公开的实施方式的操作中的超声波能应用装置的示意图;
图4是根据本发明公开的实施方式可以结合图1的神经调节系统使用的能量应用装置的实例;
图5是根据本发明公开的实施方式用于超声波能应用以实现目标生理学结果的实验设备的示意图;
图6是根据本发明公开的实施方式用于优化随时间的治疗的神经调节技术的流程图;
图7A是根据本发明公开的实施方式在两周的时间段内超声波能应用的实验时间线;
图7B是根据本发明公开的实施方式在一周的时间段内超声波能应用的实验时间线;
图7C是根据本发明公开的实施方式在两周的时间段内假对照应用的实验时间线;
图7D是根据本发明公开的实施方式未治疗过的对照的实验时间线;
图8显示了根据本发明公开的实施方式与细胞因子活性有关的基因的转录组数据(基因本体GO:0005125);
图9A显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中肿瘤坏死因子(TNF)的RNA浓度;
图9B显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中白介素1α的RNA浓度;
图9C显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中白介素6的RNA浓度;
图9D显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中C-C基序趋化因子配体4的RNA浓度;
图9E显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中白介素1β的RNA浓度;
图9F显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中C-C基序趋化因子配体20的RNA浓度;
图10A显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中有丝分裂原-激活的蛋白激酶14(p38)的RNA和蛋白浓度;
图10B显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中核糖体蛋白S6激酶B1(p70S6K)的RNA和蛋白浓度;
图10C显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中v-akt鼠胸腺瘤病毒致癌基因同系物(Akt)的RNA和蛋白浓度;
图10D显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中糖原合酶激酶3β(GSK3B)的RNA和蛋白浓度;
图10E显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中SRC原癌基因,非受体酪氨酸激酶(c-Src)的RNA和蛋白浓度;
图10F显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中的B细胞中κ轻链多肽基因增强子(NF-κβ)的RNA和蛋白浓度;
图10G显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中的细胞因子信号转导抑制因子3(SOCS3)的RNA和蛋白浓度;
图11显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中的烟碱型胆碱能受体α4亚基(CHRNA4)的RNA浓度;
图12A显示了根据本发明公开的实施方式与激活的T细胞增殖的正调控有关的基因的转录组数据(基因本体:GO:0042104);
图12B显示了根据本发明公开的实施方式与B细胞激活调控有关的基因的转录组数据(基因本体:GO:0050864);
图13A显示了根据本发明公开的实施方式与葡聚糖生物合成过程有关的基因的转录组数据(基因本体:GO:0009250);
图13B显示了根据本发明公开的实施方式编码认为是转录因子的蛋白的基因的转录组数据;
图14显示了根据本发明公开的实施方式与检测LPS的能力有关的基因的转录组数据;
图15显示了根据本发明公开的实施方式与检测LPS和关键细胞因子响应基因的能力有关的基因的转录组数据;
图16A显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中的烟碱型胆碱能受体α4亚基(CHRNA4)的RNA浓度;
图16B显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中的胆碱O-转乙酰酶(CHAT)的RNA浓度;
图16C显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中溶质载体家族5成员7(SLC5A7)的RNA浓度;
图16D显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中乙酰胆碱酯酶(卡特赖特(Cartwright)血型)(ACHE)的RNA浓度;
图16E显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中丁酰胆碱酯酶(BCHE)的RNA浓度;
图16F显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中溶质载体家族18成员A3(SLC18A3)的RNA浓度;
图17A显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中水通道蛋白1(科尔顿(Colton)血型)的RNA浓度;
图17B显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中水通道蛋白3(吉尔(Gill)血型)的RNA浓度;
图18A显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中跨膜蛋白176A(TMEM176A)的RNA浓度;
图18B显示了根据本发明公开的实施方式在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中跨膜蛋白176B(TMEM176B)的RNA浓度;
图18C显示了根据本发明公开的实施方式与TMEM176A和TMEM176B有关的基因的转录组数据;和
图19显示了根据本发明公开的实施方式在向脂多糖-引起的高血糖动物模型的脾脏、右肾上腺、骶神经节、结状神经节和孤束核应用超声波能之后血液中的去甲肾上腺素、乙酰胆碱和肿瘤坏死因子的浓度。
具体实施方式
以下将描述一个或多个具体实施方式。为了提供这些实施方式的简明描述,并未在说明书中描述实际实施的所有特征。应理解在任何这种实际实施的开发中,如在任何工程或设计项目中,必须做出多种实施特异的决策以实现开发者的特定目标,如遵守系统相关和商业相关约束,其可能因实施而异。此外,应理解这种开发工作可能是复杂且耗时的,但是尽管如此,对于受益于本发明公开的常规技术人员来说,仍是设计、加工和制造的例行工作。
本文所提供的任何实例或说明不以任何方式被视为对他们所使用的任何一个或多个术语的限定、限制或表达定义。相反,这些实例或说明应被视为关于多种具体实施方式进行描述并且仅是说明性的。本领域那些普通技术人员将理解这些实例或说明所使用的任何一个或多个术语将涵盖可以或可以不随之给出或在说明书中的其它处给出的其它实施方式,并且所有这些实施方式旨在包括在该术语的范围内。指定这些非限制性实例和说明的语言包括但不限于:“例如”、“比如”、“如”、“像”、“包括”、“在某些实施方式中”、“在一些实施方式中”和“在一个实施方式中”。
当介绍本发明公开的多个实施方式的要素时,冠词“一”、“一种”和“该”旨在表示存在一个或多个要素。术语“包含”、“包括”和“具有”旨在是包括在内的并且表示除所列要素外可能存在其它要素。此外,以下讨论中的任何数值实例旨在是非限制性的,并因此其它数值、范围和百分比在所公开的实施方式的范围内。
本文提供了通过向神经末端位点处的组织或其它解剖结构区域应用能量来用于治疗受试者的神经调节技术。所应用的能量可以靶向组织或结构的子区域,从而所应用的总能量相对较低。此外,通过靶向特定所关心的区域,可以选择性调节特定神经通路,同时所关心的区域外的其它非靶向神经通路保持未调节。以这种方式,器官的一个子区域的神经调节可以获得与器官的不同子区域的神经调节不同的目标生理学结果。在具体实例中,用神经调节能量靶向肝脏的肝门(porta hepatic)区域可以因此引起循环葡萄糖浓度变化。靶向肝脏的其它区域可以不获得相同的循环葡萄糖浓度的变化。在另一个实例中,用神经调节能量靶向脾脏区域可以引起去甲肾上腺素和乙酰胆碱浓度变化。此外,周围神经神经节的神经调节可以调节胆碱能抗炎通路、多巴胺产生通路以及葡萄糖调控和/或胰岛素产生通路。因此,基于神经调节能量直接靶向的神经,器官内神经末梢(例如,轴突末端)的分布可以进而允许选择性神经调节以实现目标生理学结果。周围神经中的这些技术实现了在周围神经通路末梢处传播的目标效果。然而,目标生理学结果可以包括多个和重叠通路中的活性变化。
如本文所讨论的,可以实施神经调节以引起目标生理学结果,例如,用于某些病症的治疗。患者可以受益于在一段时间内(例如,数周)内定期(例如,每天)的神经调节治疗方案以实现所期望的目标生理学结果。然而,多个和重叠通路中的活性变化可以随时间导致补偿生理效果,这使得神经调节治疗随时间而变得不太有效。因此,本发明的技术提供了多个通路的标志物的评价,从而可以评价神经调节的有效性。在收益递减的情况下,治疗方案可以引入恢复期以允许补偿途径回到正常,然后重新开始神经调节。在一个实施方式中,评价是多种标志物的基因表达特征谱,其中某些谱与降低神经调节有效性的生理变化有关,而其它谱与对于有效神经调节有利的基因表达环境有关。特征性基因表达或标志物表达谱指示了在本文所提供的神经调节实施中通过向神经轴突末端的能量应用所传播的复杂生理变化。在另一个实施方式中,特征谱涉及一种或多种所关心的分子(例如,循环分子、生物标志物)的浓度变化或修饰。
人的神经系统是神经细胞或神经元的复杂网络,其中枢存在于脑和脊髓中并且外周存在于身体的多种神经中。神经元具有细胞体、树突和轴突。神经是服务特定身体部分的一组神经元。神经可以含有几百个神经元至几十万个神经元。神经通常含有传入和传出神经元两者。传入神经元将信号携带至中枢神经系统而传出神经元将信号携带至外周。一个位置中的一组神经元细胞体被称为神经节。通过神经元和神经传导神经中产生的电信号(例如,通过内部或外部刺激)。神经元在邻近于接收细胞的突触(连接)处释放神经递质以使得电信号继续和调节。
神经元的电信号被称为动作电位。当跨过细胞膜的电压电位大于特定阈值时,开始(起始,引发)动作电位。然后,该动作电位沿神经元长度传播。神经的动作电位是复杂的并且代表了其中单个神经元的动作电位之和。神经元的轴突末端和接收细胞之间的接合被称为突触。动作电位沿神经元的轴突移动至其轴突末端,它是形成神经纤维的突触前末梢或突触末端的轴突神经分枝的远端末端。动作电位的电脉冲引发包含神经递质的囊泡向突触前轴突末端的突触前膜迁移,并最终向突触间隙(例如,在突触前和突触后细胞之间所形成的空间)或轴突细胞外间隙(axoextracellular space)中释放神经递质。化学性突触通过释放神经递质将动作电位的电信号转化为化学信号。与化学性突触相反,电学性突触允许离子电流流入突触前轴突末端并跨过细胞膜进入突触后细胞。
通过跨过细胞膜的离子运动介导动作电位的生理学效果。神经元通过有利于离子,如Na
突触可以位于两个神经元之间的接合点,其允许动作电位沿着神经纤维传播。然而,轴突末端还可以在神经元和非神经元细胞之间的接合点处形成突触并且可以在间质液或体液处终止。例如,突触的类型包括具有神经免疫连接处的免疫细胞的突触,具有器官内的驻留感觉细胞的突触,或具有腺细胞的突触。神经递质向突触间隙的释放和神经递质与突触后细胞的突触后膜中的受体的结合导致下游效应,其依赖于突触前神经元的性质、所释放的特定神经递质以及突触后细胞(例如,突触后细胞的可用受体类型)的性质。另外,动作电位可以是刺激性或抑制性的。刺激性突触后动作电位提高了突触后神经元发射或释放后续动作电位的可能性。相反,抑制性突触后动作电位降低了突触后神经元发射或释放后续动作电位的可能性。一些神经元可以一起工作以释放引发下游动作电位或抑制下游动作电位的神经递质。
神经调节从外部能源向神经系统的特定区域应用能量以激活和/或阻断一种或多种神经或者升高和/或降低神经功能。电学神经调节在靶神经处或附近应用一个或多个电极,并且通过神经(例如,作为动作电位)实施能量应用以在能量应用位点下游的区域中引起生理响应。然而,由于神经系统的复杂性,难以预测给定能量应用位点的生理响应的范围和最终终点。尽管用于中枢神经系统(即,脑组织)的超声波调节的策略已证明对神经活性成功调节,但是调节周围神经的尝试已经滞后。例如,对中枢神经系统(CNS)的超声波调节涉及大脑皮质区域的刺激,该区域具有丰富的突触结构,而超声波刺激周围神经的尝试靶向神经干,其不富含或缺乏突触结构。
本文提供了基于所关心的目标区的直接和聚焦调节的神经调节和由于神经调节引起目标生理学结果的技术。所关心的目标区的神经调节允许能量仅向所关心的目标区有限且非剥脱(非消融,nonablative)的应用,而不将能量应用至所关心的目标区以外。通过将能量应用至包括突触的一定体积的组织,可以通过优先激活突触以引起神经递质或神经肽的释放来实现所期望的结果。以这种方式,将所关心的区域内的突触激活,同时所关心的区域以外的突触未激活。靶向的突触前神经元细胞可以释放神经递质或神经肽,或者在邻近的非神经元细胞或神经元细胞附近引起神经递质或神经肽释放的改变以调节细胞活性。这进而可以导致所关心的区域(例如,含有所关心的目标区的组织或结构中或者不含所关心的目标区的器官、组织或结构中)以外的局部作用和/或非局部(例如,全身性)作用,而不会直接刺激富含突触的区域。
神经调节可以用于治疗葡萄糖代谢和相关病症,改变疾病进展和控制全身性炎症。例如,一个或多个所关心的区域处的肝脏调节可以用于治疗糖尿病(即,1型或2型糖尿病)、高血糖、败血病、创伤、感染、糖尿病-相关痴呆病、肥胖症或其它饮食或代谢病症。神经调节还可以用于促进减重、控制食欲、治疗恶病质或者增强食欲。例如,直接胰腺刺激可以导致食欲增强,直接肝脏刺激可以引起神经肽Y(NPY)减少,其进而促进饱腹感信号,并且直接脾脏刺激可以导致全身性炎症降低。此外,周围神经神经节的神经调节可以调节胆碱能抗炎通路(CAP)、多巴胺产生通路以及葡萄糖调控和/或胰岛素产生通路。
所关心的目标区的神经调节可以获得在治疗时间以外持续的治疗结果。例如,在预定时间段内对所关心的目标区反复能量应用的治疗可以获得疾病症状的持续改善。预定时间段可以是其间发生神经调节治疗的数小时、数日、数周或数月的时窗。另外,神经调节治疗可以包括预定时间段内的一个或多个单独的能量应用事件。可以将单独的能量应用事件在预定时间段内反复施用于相同所关心的区域。例如,可以根据预置调节参数,在预定时间段内,在所关心的区域每天、每隔一天、每两天、每三天发生一次、每周发生一次或者以任何其它适合的治疗速率发生神经调节治疗。
例如,调节参数可以包括从连续至间断的多种刺激时间模式。调节参数还可以包括刺激应用的频率和持续时间。应用频率可以是连续的或者以多种时间段递送,例如,在一天或一周内。治疗持续时间可以持续多种时间段,其包括但不限于几分钟至几小时。另外,调节参数可以包括超声波能治疗之间的恢复期的持续时间。恢复期的持续时间可以允许在重新开始神经调节治疗之前,所关心的区域的补偿通路恢复正常。
然而,所关心的区域内突触的连续刺激可以随时间在受试者中产生不期望的生理学结果。例如,在一段时间内(作为神经调节治疗规程的一部分)对受试者应用的释放所关心的特定分子(例如,神经递质或神经肽)的一系列能量应用事件还可以在一段时间内,在受试者中引起所关心的分子的细胞受体和/或通道的基因表达变化(例如,相对于能量应用事件之前的基线表达水平降低)。当通过特定分子对细胞过度激活延长的一段时间时,可以发生基因表达的下调,并且对于该分子细胞受体的相应产生可以降低以补偿通过所述分子对细胞的过度刺激。照此,在所关心的区域内,在延长的一段时间中对突触反复刺激以释放所关心的分子可以引起相应细胞受体和/或通道的基因表达的下调,借此降低延长的一段时间内,后续能量应用事件的有效性。作为另外一种选择,组织区域内突触的反复刺激可以通过将它们代谢、降解或抑制来引起参与神经递质或神经肽的半衰期的基因的上调。例如,丁酰胆碱酯酶(BCHE)是可以上调的基因,然后蛋白翻译、糖基化和分泌。BCHE可以水解神经递质乙酰胆碱,已提议将其作为多种疾病(例如,肥胖症、代谢综合征、炎性疾病、恶性肿瘤)的预后标志物,并且它是神经毒剂和杀虫剂的预防措施。BCHE在大部分组织,包括脑、肝脏和淋巴组织中表达。
因此,本文提供了用于确定和/或改变对于受试者的神经调节治疗的一个或多个治疗参数,从而使得可以保持对每个能量应用事件的急性响应(例如,神经递质或者神经肽的释放),同时可以使不希望的慢性作用最小化的技术。治疗参数可以包括其中将神经调节治疗(例如,单独的能量应用事件)应用于受试者的治疗期,治疗期内单独的能量应用事件的治疗频率和/或恢复期(例如,后续神经调节治疗或治疗期之间的时间段)的持续时间。例如,恢复期可以有利于由神经调节治疗所引起的任何不希望的生理学效果的逆转,如基因表达水平的不希望的变化。在恢复期的持续时间过去并且基因表达水平的任何变化已基本逆转(例如,朝神经调节治疗之前的基线阈值方向)后,可以开始后续神经调节治疗。在一些实施方式中,基因表达水平变化可以是所期望的受试者的神经调节治疗效果。在这些实施方式中,如果先前的神经调节治疗将基因表达水平在适当方向上改变(例如,升高或降低),则可以省略恢复期并且可以开始后续神经调节治疗。
可以在对受试者的第一神经调节治疗之前确定治疗参数(例如,治疗期、治疗频率和恢复期的持续时间)。在一些实施方式中,由于神经调节治疗或者历史或实验数据,可以基于受试者中所期望的生理学结果确定治疗参数。在完成第一神经调节治疗之后,可以评价受试者中某些基因的表达水平并且可以确定基因的表达水平是否是所期望的。如果基因的表达水平是所期望的,则可以基于先前确定的治疗参数进行后续神经调节治疗。如果基因的表达水平不是所期望的,则可以基于以下因素改变后续神经调节的治疗参数,该因素包括但不限于受试者中所评价的基因表达水平、受试者中所期望的生理学结果、历史数据或实验数据。照此,本文所提供的神经调节技术可以优化延长的一段时间内对受试者的神经调节治疗的治疗参数,从而可以维持对神经调节治疗所期望的急性响应,同时可以使神经调节治疗的任何不希望的慢性作用最小化。
为此,所公开的神经调节技术可以结合神经调节系统使用。图1是用于神经调节以对能量应用产生响应而实现神经递质释放和/或激活突触组分(例如,突触前细胞、突触后细胞)的系统10的示意图。所示系统包括与能量应用装置12(例如,超声波换能器)偶联的脉冲发生器14。能量应用装置12配置以接受能量脉冲(例如,通过一根或多根导线或无线连接)并将能量脉冲导向至所关心的区域(例如,周围神经神经节或其部分),这进而导致产生了目标生理学结果。在某些实施方式中,脉冲发生器14和/或能量应用装置12可以植入到生物相容位点(例如,腹部)并且导线内部偶联能量应用装置12和脉冲发生器14。例如,能量应用装置12可以是MEMS换能器,如电容式微机械超声波换能器。
在某些实施方式中,能量应用装置12和/或脉冲发生器14可以无线通信,例如,通过进而可以向脉冲发生器14提供指令的控制器16。在其它实施方式中,脉冲发生器14可以是体外装置(例如,可以运行以从受试者体外位置经皮或以无创方式应用能量)并且在某些实施方式中可以整合(integrate,集成)到控制器16内。在其中脉冲发生器14位于体外的实施方式中,护理人员可以操作能量应用装置12并将其定位在受试者皮肤上或上方的点,从而将能量脉冲经皮递送至所期望的内部组织。一旦定位以将能量脉冲应用至所期望的位点,则系统10可以开始神经调节以实现目标生理学结果或临床效果。
在某些实施方式中,系统10可以包括与控制器16偶联并且配置以评价指示是否已实现调节的目标生理学结果的特征的评价装置20。在一个实施方式中,目标生理学结果可以是局部的。例如,调节可以导致向局部组织的改变或功能的变化,如组织结构变化、某些分子浓度的局部变化、组织移位、流体运动提高等。
在某些实施方式中,调节可以导致全身性和/或非局部变化。目标生理学结果可以涉及循环分子浓度变化或者不包括直接对其应用能量的所关心的区域的组织特征的变化。在一个实例中,移位可以是所期望的调节的代表性测量,并且低于预期移位值的移位测量可以导致调节参数的改变,直至引起预期移位值。因此,在一些实施方式中,评价装置20可以配置以评价浓度变化。在一些实施方式中,评价装置20可以是配置以评价组织大小和/或位置变化的成像装置。尽管单独显示了系统10的显示元件,但是应理解该元件中的一些或全部可以彼此组合。此外,元件中的一些或全部可以彼此以有线或无线方式通信。
基于评价,可以改变控制器16的调节参数。例如,如果所期望的调节与限定时窗(例如,能量应用程序开始之后5分钟或30分钟)内或者相对于程序开始时的基线的浓度(一种或多种分子的循环浓度或组织浓度)变化有关,则可能期望调节参数(例如,脉冲频率)的改变,其进而可以通过操作人员或通过自动反馈环提供至控制器16以用于限定或调整脉冲发生器14的能量应用参数或调节参数。
如本文所提供的系统10可以根据多种调节参数提供能量脉冲。例如,调节参数可以包括从连续至间断的多种刺激时间模式。通过间歇刺激,在信号开启时间(signal-ontime)期间,以特定频率递送一段时间的能量。信号开启时间之后是一段无能量递送的时间,其称为信号关闭时间。调节参数还可以包括刺激应用的频率和持续时间。应用频率可以是连续的或者以多种时间段递送,例如,在一天或一周内。治疗持续时间可以持续多种时间段,其包括但不限于几分钟至几小时。在某些实施方式中,具有指明刺激模式的治疗持续时间可以持续1小时,例如,其以72小时的间隔重复。在某些实施方式中,可以以更高的频率(如3小时)递送更短持续时间(例如,30分钟)的治疗。因此,根据调节参数,如治疗持续时间和频率,可以可调节地控制能量应用以实现所期望的结果。
在某些实施方式中,可以基于受试者的疾病的一个或多个特征改变控制器16的调节参数以实现所期望的结果。可以基于疾病随时间的发展来升高或降低治疗持续时间和/或能量应用的应用频率以实现所期望的治疗结果。例如,如果患者的疾病状态恶化,则治疗持续时间和/或应用频率可以随时间升高以实现所期望的结果。在另一个实例中,如果患者的疾病状态改善,则可以随时间维持或降低治疗持续时间和/或应用频率。
图2是系统10的某些组件的框图。如本文所提供的,用于神经调节的系统10可以包括适合于产生用于应用至受试者组织的多种能量脉冲的脉冲发生器14。脉冲发生器14可以是单独的或者可以集成到外部装置,如控制器16中。控制器16包括用于控制该装置的处理器30。软件代码或指令储存在控制器16的存储器32中以用于通过处理器30执行,从而控制该装置的多种组件。控制器16和/或脉冲发生器14可以通过一根或多根导线33或无线连接至能量应用装置12。
控制器16还包括具有输入/输出电路34和显示器36的用户界面,其适合于允许临床医师提供选择输入或调节参数以调节程序。每个调节程序可以包括一组或多组调节参数,其包括脉冲振幅、脉冲宽度、脉冲频率等。脉冲发生器14对来自控制器16的控制信号发生响应以改变其内部参数,从而改变通过导线33传输至能量应用装置12所应用至的受试者的能量脉冲的刺激特征。可以使用任何适合类型的脉冲发生电路,其包括但不限于恒定电流、恒定电压、多个单独电流或电压源等。所应用的能量是电流幅度和脉冲宽度持续时间的函数。控制器16允许通过在特定时间改变调节参数和/或开始能量应用,在特定时间取消能量应用或者在特定时间抑制能量应用来可调节地控制能量。在一个实施方式中,能量应用装置的可调节控制基于与受试者中一种或多种分子(例如,循环分子)的浓度有关的信息。如果该信息来自评价装置20,则反馈环可以驱动可调节控制。例如,如果通过评价装置20所测量的循环葡萄糖浓度高于预定阈值或范围,则控制器16可以开始向所关心的区域(例如,周围神经神经节)并且使用与循环葡萄糖降低有关的调节参数的能量应用。可以通过葡萄糖浓度漂移至高于预定(例如,所期望的)阈值或预定范围以外来引发能量应用的开始。在另一个实施方式中,当初始能量应用在预定时间范围(例如,1小时、2小时、4小时、1天)内不导致产生目标生理学结果(例如,所关心的分子的浓度)的预期变化时,可调节控制可以处于改变调节参数的形式。在某些实施方式中,评价装置20可以是测量基因表达的装置。
在一个实施方式中,存储器32存储由操作人员可选择的不同操作方式。例如,所存储的操作方式可以包括用于执行与特定治疗位点(例如,肝脏、脾脏、周围神经节或胰脏)有关的一组调节参数的指令。不同的位点可以具有不同的相关调节参数。可以配置控制器16以基于选择执行适当指令,而不是使操作人员手动输入模式。在另一个实施方式中,存储器32存储不同治疗类型的操作模式。例如,激活可以与相对于与抑制或阻断组织功能有关的那些不同的刺激压力或频率范围有关。在具体实例中,当能量应用装置是超声波换能器时,时均功率(瞬时平均强度)和峰值正压在1mW/cm
在另一个实施方式中,存储器32存储允许调整或改变调节参数以实现所期望的结果的校准或设置模式。在一个实例中,自动或通过接收操作人员的输入,以较低的能量参数开始并逐渐提高刺激。以这种方式,操作人员可以随调节参数的改变而实现所引起的效果的调节。
该系统还可以包括有利于聚焦能量应用装置12的成像装置。在某些实施方式中,成像装置可以集成到能量应用装置12中或者成像装置可以是与能量应用装置12相同的装置,从而应用不同的超声波参数(频率、孔径或能量)以用于选择(例如,空间选择)所关心的区域和用于将能量聚焦至所选择的所关心的区域以用于靶向和后续神经调节。在另一个实施方式中,存储器32存储一种或多种用于空间选择器官或组织结构内的所关心的区域的靶向或聚焦模式。空间选择可以依赖于如本文所提供的成像数据。基于空间选择,能量应用装置12可以聚焦至对应于所关心的区域的患者中的所选择的体积。例如,能量应用装置12可以配置以首先以靶向模式操作,从而应用用于捕获用于识别所关心的区域的图像数据的靶向模式能量。靶向模式能量不处于适合于优先激活的水平和/或不以适合于优先激活的调节参数应用。然而,一旦识别所关心的区域,则根据与优先激活有关的调节参数,控制器16可以然后以治疗模式操作。
还可以配置控制器16以作为调节参数选择的输入接收与目标生理学结果有关的输入。例如,当成像方式用于评价作为向所关心的区域的能量应用的结果的组织特征时,控制器16可以配置以接收该特征的计算指数或参数。基于该指数或参数是否高于或低于预定阈值,可以改变调节参数。在一个实施方式中,该参数可以是受影响的组织的组织移位的测量或者是受影响的组织的深度的测量。其它参数可以包括评价一种或多种所关心的分子的浓度(例如,评价相对于阈值或基线/对照的浓度变化、变化率中的一种或多种,确定浓度是否在所期望的范围内)。此外,能量应用装置12(例如,超声波换能器)可以在控制器16的控制下操作以(1)获取可以用于空间选择体内所关心的区域的图像数据,(2)向所关心的区域应用调节能量,和(3)获取图像数据以确定已发生目标生理学结果(例如,通过移位测量)。在这种实施方式中,成像装置、评价装置20和能量应用装置12可以是同一装置。
在另一种实施中,还可以通过控制器16存储所期望的调节参数设置。以这种方式,可以确定受试者特异的参数。此外,可以随时间评价这些参数的有效性。如果特定参数组随时间不太有效,则受试者可以对激活通路或治疗参数发展出了不敏感性/耐受性。如果系统10包括评价装置20,则评价装置20可以为控制器16提供反馈。在某些实施方式中,该反馈可以来源于用户或者指示目标生理学结果的特征的评价装置20。控制器16可以配置以使能量应用装置根据调节参数应用能量并基于反馈动态调整调节参数。例如,基于反馈,处理器16可以自动实时且对来自评价装置20的反馈产生响应而改变调节参数(例如,超声波束或机械振动的频率、幅度或脉冲宽度)。
例如,根据所公开的技术向所关心的区域的能量应用可以用作具有所期望的结果的治疗规程的一部分以将循环葡萄糖浓度维持在预定浓度,如低于约200mg/dL和/或高于约70mg/dL。该技术可以用于将葡萄糖维持在约4mmol/L至8mmol/L或者约70至150mg/dL的范围内。该技术可以用于维持受试者(例如,患者)的正常血糖范围,其中正常血糖范围可以是基于患者个体因素,如体重、年龄和/或病历的个体化范围。因此,可以基于所关心的分子所期望的最终浓度来实时调整并且可以在基于来自评价装置20的输入的反馈环中调整能量向一个或多个所关心的区域的应用。例如,如果评价装置20是循环葡萄糖监测器或血糖监测器,则实时葡萄糖测量可以用作控制器16的输入。如本文所提供的,可以实施治疗规程(一系列规则或不规则间隔的能量应用事件),并且可以在治疗过程中评价循环葡萄糖浓度。在一个实施方式中,该患者在治疗开始时是高血糖的,但是治疗规程的实施降低循环葡萄糖的浓度并将浓度在所期望的范围内维持一段时间(例如,一个月)。在一段时间后,循环葡萄糖浓度可以开始逐渐升高,即使根据治疗规程应用定期能量应用事件。当循环葡萄糖浓度不再处于所期望的范围内时,可以实施治疗恢复期直至患者再次对治疗规程产生响应的这一时间。
在另一个实施方式中,本发明的技术可以用于引起特征生理变化谱。例如,特征谱可以包括由于能量应用而使得组织和/或血液中的浓度升高的一组所关心的分子,和由于能量应用而使得组织和/或血液中的浓度降低的另一组所关心的分子。特征谱还可以包括不会由于能量应用而变化的一组分子。特征谱可以限于所期望的生理学结果有关的同时变化。例如,该谱可以包括与循环胰岛素升高一起观察到的循环葡萄糖的降低。
图3是其中能量应用装置12包括能够向靶组织43(通过非限制性实例作为脾脏显示)应用能量的超声波换能器42的具体实例。能量应用装置12可以包括用于控制超声波换能器42的控制回路。处理器30的控制回路可以集成到能量应用装置12(例如,通过集成控制器16)中或者可以是单独的组件。超声波换能器42还可以配置为获取图像数据,从而帮助空间选择所期望或靶向的所关心的区域44并且将所应用的能量聚焦至组织43或结构的所关心的区域44。
所期望的靶组织43可以是内部组织或器官,其包括具有与突触后细胞48(例如,脾脏T细胞)形成突触47的轴突末端46的突触前神经元细胞。可以在聚焦在靶组织43的所关心的区域44上的超声波换能器42的聚焦场内,通过将能量直接应用至轴突末端46来刺激突触以引起分子向突触间隙47中的释放。在所示的实施方式中,轴突末端46与脾脏T细胞形成突触,并且神经递质在突触间隙47中的释放和/或离子通道活性的变化进而导致下游效应,如胆碱能抗炎通路(CAP)的激活。可以选择所关心的区域以包括特定类型的轴突末端46,如特定神经元类型的轴突末端46和/或与特定类型的非神经元细胞形成突触的轴突末端46。因此,可以选择所关心的区域44以对应于具有所期望的轴突末端46(和相关非神经元细胞48)的靶组织43的部分。在某些实施方式中,可以选择能量应用以优先引发一个或多个分子(例如,神经递质或神经肽)从突触内的神经中的释放。在某些实施方式中,可以选择能量应用以通过直接能量转导(即,非神经元细胞内的力传导或电压激活的蛋白)直接激活所关心的区域44中的神经元细胞,从而优先引发一个或多个分子(例如,神经递质或神经肽)的释放。在某些实施方式中,可以选择能量应用以通过在所关心的区域44内的神经元细胞内引起激活,从而优先引发一个或多个分子(例如,神经递质或神经肽)的释放,该激活引起所期望的生理学效果。
在某些实施方式中,能量可以聚焦或集中在小于约25mm
可以参考解剖学标志等,通过成像识别出含有轴突46的所关心的区域44以实施空间选择。可以基于以下因素选择靶组织43中的所关心的区域44,该因素包括但不限于历史或实验数据(例如,显示特定位置与所期望或目标生理学结果的结合的数据)。作为另外一种选择或者另外,系统10可以向个体轴突末端46应用能量直至实现所期望的目标生理学效果。应理解脾脏43仅是举例来说的。可以结合其它器官或结构(例如,肝脏、胰脏、胃肠组织或周围神经神经节)使用对于通过使用所显像的神经的空间信息对所关心的区域44的直接能源应用的优先激活的所公开的轴突末端46的选择。
在其它实施方式中,可以通过一种或多种生物标志物的存在或不存在来识别所关心的区域。可以通过对组织染色并且获得指示染色的图像以识别包括生物标志物的组织区域来评价这些标志物。在一些实施方式中,可以通过体内染色技术获得生物标志物信息,从而实时获得受试者内的生物标志物的位置数据。在其它实施方式中,可以通过体外染色技术获得生物标志物信息以获得用于预测受试者内的生物标志物位置的一幅或多幅代表性图像的位置数据。在一些实施方式中,选择所关心的区域以对应于富含特定生物标志物或缺乏特定生物标志物的组织。例如,一种或多种生物标志物可以包括神经元结构标志物(例如,髓鞘标志物)。
可以基于操作人员的输入空间选择器官或组织中所关心的区域。例如,操作人员可以通过直接操纵图像(例如,在图像上画出或写出所关心的区域)或者通过提供对应于所关心的区域的图像坐标信息,在所获得的图像上指出所关心的区域。在另一个实施方式中,可以基于图像数据自动选择所关心的区域以实现空间选择。在一些实施方式中,空间选择包括在存储器中存储与所关心的区域有关的数据并存取该数据。
神经调节作用的评价可以用作选择或改变神经调节参数的输入或反馈。评价技术可以使用作为目标生理学结果的组织状况或功能的直接评价。该评价可以发生在神经调节之前(即基线评价)、期间和/或之后。该评价技术可以包括以下中的至少一种:功能性磁共振成像、扩散张量磁共振成像、正电子放射断层扫描术或者声监测、热监测。该评价技术还可以包括核酸、蛋白和/或标志物浓度评价。可以通过系统接收来自评价技术的图像以用于自动或手动评价。基于图像数据,可以改变调节参数。例如,可以使用组织大小变化或移位作为局部神经递质浓度的标志物,并且用作局部细胞对表型调节神经递质的暴露的替代标志物,并且有效地用作对葡萄糖代谢通路或全身性炎症通路的预测作用的标志物。局部浓度可以表示能量应用的聚焦场内的浓度。
另外或者作为另外一种选择,系统可以评价组织区域中或者血液中一种或多种分子的存在或浓度。可以通过细针穿刺获得组织,并且可以通过任一本领域技术人员已知的任何适合的技术进行所关心的分子(例如,代谢分子、代谢途径标志物、肽递质、儿茶酚胺、胆碱酯酶)的存在或水平的评价。
在其它实施方式中,目标生理学结果可以包括但不限于组织移位、组织大小变化、一种或多种分子浓度(例如,局部、非局部或循环浓度)的变化、基因或标志物表达的变化、传入活性和细胞迁移等。例如,组织移位可以作为向组织的能量应用的结果发生。通过评价组织移位(例如,通过成像),可以估计其它影响。例如,某种移位的特征可以在于分子浓度的特定变化。在一个实例中,基于经验数据,5%的组织移位(例如,肝脏移位)可以指示循环葡萄糖浓度所期望的降低,或者与之有关。在另一个实例中,可以通过将参考图像数据(向组织应用能量之前的组织图像)与处理后的图像数据(向组织应用能量之后采集的组织图像)相比较来评价组织移位以确定最大或平均组织移位值。如果移位大于阈值移位,则可以将能量应用评价为可能已引起了所期望的目标生理学结果。
图4是可以结合图1所示的系统10使用的能量应用装置12的实例,系统10包括布置在如本文所提供的可以(例如,通过控制器16)控制以应用能量和对靶组织成像的单个能量应用装置12中的高强度聚焦超声波(HIFU)换能器74A和成像超声波换能器74B。
图5显示了如本文所提供的用于实施聚焦在靶组织43(例如,脾脏、肝脏、胰脏、胃肠组织或周围神经神经节)上的某些神经调节实验的实验设备。可以根据参数设置,通过控制器16操作能量应用装置12以向靶组织43中的所关心的区域应用能量。尽管以40W RF放大器显示了所示实验设备,但是这仅是举例说明的,并且可以使用其它放大器(例如,线性放大器)。在某些设备中,将大鼠头部插入鸟笼线圈中。
图6是用于评价神经调节治疗在一段时间内的作用的方法80的流程图,该作用进而可以用作用于选择或改变治疗参数的输入或反馈。尽管相对于神经调节治疗对受试者中基因表达的作用的评价描述了图6,但是应理解所评价的神经调节治疗的作用可以包括神经调节治疗在受试者中的其它所期望的生理学作用或者神经调节治疗在受试者中不期望的生理学作用。在一些实施方式中,可以在图6中评价通过神经调节治疗引起的生理变化的特征谱。
如本文所提供的,患者是否对治疗规程产生响应的评价可以基于特征谱。特征谱可以限定相对于实施治疗规程之前所评价的基线谱的同时变化,该变化与所期望的生理学结果相关。例如,特征谱可以包括由于神经调节治疗而使得组织和/或血液中的浓度升高的一组所关心的分子,和由于神经调节治疗而使得组织和/或血液中的浓度降低的另一组所关心的分子,和/或由于神经调节治疗不改变的一组分子的浓度信息。特征谱可以包括由于神经调节治疗表达升高的一组基因,由于神经调节治疗表达降低的另一组基因,和/或由于神经调节治疗表达不变的一组基因的表达信息。作为另外一种选择或者另外,特征谱可以反映相对于基线,某些蛋白的激活或修饰状态,例如,磷酸化、乙酰化的变化。
在方法80中,可以在步骤82中选择或确定治疗规程中的一种或多种神经调节治疗参数。在某些实施方式中,可以基于受试者中所期望的生理学结果选择或确定治疗参数。治疗参数可以包括其中将神经调节治疗(例如,单独的能量应用事件)应用于受试者的治疗期。例如,受试者的治疗期可以发生3天、5天、一周、一周半、两周或任何其它适合的时间段以在受试者中实现所期望的生理学结果。治疗参数还可以包括治疗期内单独能量应用事件对受试者的治疗频率。例如,治疗频率可以为每天两次、每天一次、每周四次、每周三次、每周两次、每周一次或任何其它适合的能量应用事件频率以在受试者中实现所期望的生理学结果。此外,治疗参数可以包括治疗恢复期(例如,连续神经调节治疗或治疗期之间的时间段)。恢复期的持续时间可以有利于神经调节治疗所引起的任何不希望的生理学效果的逆转。例如,恢复期的持续时间可以允许特定基因的表达水平回到类似于神经调节治疗之前的基线阈值的表达水平。在一些实施方式中,恢复期的持续时间可以为1天、2天、3天、4天、5天、6天、一周、两周或第一治疗期和第二治疗期之间的任何其它适合的时间段以在受试者中实现所期望的生理学结果。在某些实施方式中,可以不确定恢复期的持续时间直至方法80的步骤88。在一些实施方式中,可以基于以下因素确定治疗参数,该因素包括但不限于历史或实验数据(例如,显示特定治疗参数与所期望或目标生理学结果的结合的数据)。在一些实施方式中,可以基于受试者当前的生理状态、病历、体重或年龄确定治疗参数。
在步骤84中,基于步骤82中所确定的治疗参数(例如,治疗期、频率和/或剩余期),向受试者应用神经调节治疗以实现所期望的生理学结果。例如,对受试者的神经调节治疗可以包括向受试者身体的靶组织每天应用一次能量,应用一周。在另一个实例中,对受试者的神经调节治疗可以包括向受试者身体的靶组织每天应用一次能量,应用两周。在单一神经调节治疗或一系列治疗完成后,可以在步骤86中评价神经调节治疗对受试者中特定基因的表达水平的作用。
例如,可以使用用于确定受试者的特定基因的表达水平的一种或多种评价技术。该评价技术可以通过RNA测序、定量聚合酶链反应(qPCR)、微阵列或其它适合的技术从靶组织中的细胞亚型产生RNA或mRNA转录组数据。在一些实施方式中,可以基于基因与所期望的生理学结果的关系来选择或确定用于评价的特定基因。例如,所评价的基因可以产生与通过神经调节治疗激活的所期望的通路(例如,胆碱能抗炎通路)有关的分子(例如,蛋白)。在某些实施方式中,可以在受试者的神经调节治疗开始采集特定基因的基因表达基线水平之前进行特定基因的基因表达水平的评价。评价数据还可以通过多个基因的组-水平分析,如聚类(clustering)来评价基因表达数据。聚类技术可以用于类的发现或归类。患者的特征基因表达谱可以用于识别已归类的基因表达谱中的最近匹配。例如,有响应的患者可以具有其特征在于与治疗响应性有关的基因表达的基因表达谱,而治疗不敏感患者可以具有其特征在于与治疗无响应有关的基因表达的基因表达谱。聚类分析可以用于确定患者未归类的特征基因表达谱应被归类为对治疗有响应还是无响应。
在某些实施方式中,还可以在步骤86中进行一种或多种所关心的分子(例如,葡萄糖、神经递质、神经肽、胆碱酯酶或细胞因子)的浓度变化的一种或多种评价。所关心的分子的浓度变化的评价可以用于确定如本文所述的治疗参数和/或调节参数是否需要改变以实现所期望的生理学结果。一旦确定治疗参数和/或调节参数需要改变以从神经调节治疗实现所期望的生理学结果,则可以如本文所述改变治疗参数和/或调节参数。
基于如步骤86中所评价的基因表达水平,在步骤88中进行神经调节治疗对受试者特定基因的表达水平是否有影响的确定。一旦确定对基因表达水平的作用是所期望的,则方法80可以继续至步骤90,并且可以根据步骤82中确定的治疗参数应用后续神经调节治疗。例如,在某些实施方式中,特定基因由于神经调节治疗的表达水平变化可能不是所期望的。如果在步骤86中将特定基因的表达水平评价为无显著变化(例如,与神经调节治疗之前的基线阈值相比),则可以在对受试者的进一步神经调节治疗中使用步骤82中确定的神经调节治疗参数。在另一个实例中,在某些实施方式中,特定基因由于神经调节治疗的表达水平变化(例如,升高或降低)可以是所期望的。如果在步骤86中将特定基因的表达水平评价为显著变化(例如,与神经调节治疗之前的基线阈值相比),则可以在对受试者的进一步神经调节治疗中使用步骤82中确定的神经调节治疗参数。
在步骤88中,一旦确定对基因表达水平的作用不是所期望的,则方法80可以继续至步骤92,并且可以基于对受试者中基因表达水平所评价的作用来改变神经调节治疗的治疗参数。例如,特定基因由于神经调节治疗的表达水平变化(例如,升高或降低)可以不是所期望的。如果确定特定基因的表达水平显著变化(例如,与神经调节治疗之前的基线阈值相比),则可以改变(例如,动态或可调节地控制)神经调节治疗参数以实现所期望的生理学结果,同时使对受试者中基因表达的影响最小。在另一个实例中,特定基因由于神经调节治疗的表达水平变化(例如,升高或降低)可以是所期望的。如果确定特定基因的表达水平未显著变化(例如,与神经调节治疗之前的基线阈值相比),则可以改变(例如,动态或可调节地控制)神经调节治疗参数以实现所期望的生理学结果和所期望的基因表达变化。在一些实施方式中,可以基于以下因素改变治疗参数,该因素包括但不限于历史数据、实验数据、受试者当前的生理状态、病历、体重或年龄、对受试者中基因表达所评价的影响或者受试者中所期望的生理学结果。
在一个实施方式中,如果基因表达水平中的升高或减少是该基因表达水平的基线阈值中的至少10%、20%、30%、50%或75%的升高或降低,则将基因表达水平评价为与神经调节治疗之前的基线阈值相比显著变化。在另一个实施方式中,如果基因表达水平是该基因表达水平的基线阈值中的至多10%、5%、3%、2%、1%或0%的升高或降低,则将基因表达水平评价为与神经调节治疗之前的基线阈值相比未显著变化。
可以在步骤92中改变应用于受试者的任何后续神经调节治疗(例如,单独的能量应用事件)的治疗期。在一些实施方式中,可以相对于之前的神经调节治疗的治疗期来增加或减少受试者的治疗期。在一些实施方式中,可以不根据之前的神经调节治疗的治疗期改变受试者的治疗期。对于任何后续神经调节治疗,可以在步骤92中改变治疗期内对受试者单独的能量应用事件的治疗频率。在一些实施方式中,可以相对于之前神经调节治疗中的能量应用事件的治疗频率来提高或降低治疗频率。在一些实施方式中,可以不根据之前神经调节治疗中的能量应用事件的治疗频率来改变治疗频率。
可以改变(或者确定,如果在步骤82中未确定)后续治疗期或神经调节治疗之间的恢复期的持续时间。在一些实施方式中,可以基于神经调节治疗对特定基因表达水平所评价的影响来确定恢复期的持续时间。例如,可以基于相对于神经调节治疗之前的基线表达水平,一组基因的表达水平升高和/或一组基因的表达水平降低的程度,将恢复期的持续时间确定为特定时间段。在一些实施方式中,如果特定基因的表达水平变化(例如,升高或降低)是所期望的但未评价,则可以立即开始受试者的后续神经调节治疗而无恢复期。在一些实施方式中,如果评价了特定基因的表达水平变化但不是所期望的,则可以基于基因表达水平的变化程度,在受试者后续神经调节治疗开始之前发生确定或改变的恢复期。另外或者作为另外一种选择,可以基于以下因素确定恢复期的持续时间,该因素包括但不限于历史或实验数据(例如,显示特定恢复期与所期望或目标基因表达变化的逆转的关系的数据)。在一些实施方式中,可以通过在之前的神经调节治疗之后在分散的时间点评价受试者中的基因表达水平来确定恢复期的持续时间,直至确定基因表达水平已恢复正常(例如,神经调节治疗之前的基线基因表达水平)。
在步骤94中,基于步骤92中所改变的治疗参数(例如,治疗期、治疗频率和/或恢复期的持续时间),向受试者应用神经调节治疗以在受试者中实现所期望的生理学结果和所期望的基因表达水平。在实施神经调节治疗之后,可以重复步骤86、88、92和94直至在步骤88中确定神经调节治疗对基因表达所评价的作用是所期望的。一旦确定神经调节治疗对基因表达所评价的作用是所期望的,则可以在应用于受试者的任何后续神经调节治疗中使用改变的神经调节治疗参数(例如,治疗期、治疗频率和/或恢复期的持续时间)。照此,可以优化对受试者的神经调节治疗的治疗参数以在受试者中实现所期望的生理学结果,同时实现所期望的基因表达水平。
实施例
神经调节治疗随时间的生理学效果的确定
图7A至7D显示了用于实施如本文所提供的某些调节实验的神经调节治疗的实验时间线。在图7A中,将超声波能应用于雌性Sprague Dawley(SD)大鼠的脾脏,在调节实验开始时,大鼠约300g和11周龄。超声波能应用事件的治疗期为以每天一次的治疗频率进行两周。在图7B中,也将超声波能应用于雌性SD大鼠的脾脏,在调节实验开始时,大鼠约300g和11周龄。超声波能应用事件的治疗期为以每天一次的治疗频率进行一周。在图7C和7D中,通过将超声波换能器放置在雌性SD大鼠脾脏上但不应用超声波刺激来进行假对照。在图7C中,假对照的治疗期为以每天一次的治疗频率进行两周。在图7D中,假对照的治疗期为以每天一次的治疗频率进行一周。
在图7A和7B所示的实施方式中,将每个超声波能应用事件100在30秒的停止期前后进行1分钟。在每个超声波能应用治疗之前使用标准麻醉(例如,2%至4%的异氟烷)。如图7A和7B所示,在治疗期中,在上次超声波能应用后4小时,将脂多糖(LPS)通过腹膜内(IP)注射施用于雌性SD大鼠。LPS是引起强免疫或炎症响应的细菌分子。在LPS注射后的时间段内处死雌性SD大鼠以用于器官收获和处理。尽管举例来说,所示时间段为LPS注射后1小时,但是应理解在其它实施方式中,评价所引起的变化的时间段可以是可改变的。
在图7C和7D所示的实施方式中,通过将超声波换能器放置在雌性SD大鼠脾脏上但不应用超声波刺激来进行每个假对照应用事件102。如图7C所示,在治疗期中,在上次假对照应用事件后4小时,将LPS通过IP注射施用于雌性SD大鼠。在LPS注射后的时间段内处死雌性SD大鼠以用于器官收获和处理。尽管举例来说,所示时间段为LPS注射后1小时,但是应理解在其它实施方式中,评价所引起的变化的时间段可以是可改变的。如图7D所示,未将LPS通过IP注射施用于雌性SD大鼠,并且在时间段中,在上次假对照应用事件后的时间段处死雌性SD大鼠。尽管举例来说,所示时间段为上次假对照应用事件后5小时,但是应理解在其它实施方式中,评价所引起的变化的时间段可以是可改变的。从处死的雌性SD大鼠收获脾脏样品。
检查了延长的一段时间(例如,1周时间段内每天一次,2周时间段内每天一次)内的超声波刺激作用。获得了脾门部分以测量特定基因的表达水平。将脾门部分在RNAlater中处理24小时,并在-80℃,在无RNA的管中保存。从脾门部分提取RNA,使用TruSeqStranded mRNA文库制备来制备RNA以用于测序,并且对RNA测序以用于评价基因表达水平。
本发明的实施例表明无创方法刺激靶组织中神经元的轴突末端的实现所期望的生理学结果(例如,一种或多种所关心的分子,如神经递质或神经肽的释放)并且评价与所期望的生理学结果直接或间接相关的特定基因随时间的表达水平。通过受刺激脾脏和假对照脾脏的RNA转录组测序来监测与全身性炎症有关的特定细胞因子活性基因的表达水平。另外,测量了多种全身性炎症相关细胞因子和蛋白的血液浓度。在对脾脏的单一超声波能应用事件(例如,单一剂量)后,发现超声波神经调节治疗影响(例如,升高或降低)血液和/或脾脏中特定蛋白的浓度。在对脾脏的超声波能应用事件一周之后,发现超声波神经调节治疗影响(例如,升高或降低)血液和/或脾脏中特定蛋白的浓度,但是脾脏中基因表达水平未显著改变(例如,与神经调节治疗之前的基线水平相比)。在对脾脏超声波能应用事件两周后,发现超声波神经调节治疗影响脾脏中特定基因的表达水平。总的来说,该数据表明可以优化靶组织或结构内超声波神经调节治疗的治疗参数,从而超声波神经调节治疗可以实现所期望的生理学结果,同时基于一个或多个可调节治疗参数(例如,治疗期、治疗频率或后续治疗期之间的恢复期的持续时间)在受试者内引起特定基因所期望的表达水平。
图8显示了在未治疗过的大鼠、假对照(即,接受LPS,但未接受超声波刺激的大鼠)和接受LPS以及超声波刺激的大鼠中,在一周时间段和两周时间段内,与细胞因子活性有关的特定基因的转录组数据。发现在超声波刺激两周时间段后,特定细胞因子活性基因的表达水平(基因本体GO:0005125)与细胞因子活性基因的未治疗过的表达水平相关。也就是说,超声波治疗规程能够逆转LPS引起的免疫应答的作用。在一个实施方式中,本发明的技术可以追踪组织或采集自循环流体的样品中的细胞因子活性基因的表达,并且可以作为治疗规程的一部分,将一种或多种细胞因子活性基因的表达用作脾脏有效神经调节的代表性标志物以降低炎症或治疗免疫相关病症。
图9A至9F显示了在未治疗过的大鼠、假对照(即,接受LPS,但未接受超声波刺激的大鼠)和接受LPS以及超声波刺激的大鼠中,在一周时间段和两周时间段内,多种细胞因子的RNA浓度。图9A显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,肿瘤坏死因子(TNF)的浓度。图9B显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,白介素1α的浓度。图9C显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,白介素6的浓度。图9D显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,C-C基序趋化因子配体4的浓度。图9E显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,白介素1β的浓度。图9F显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,C-C基序趋化因子配体20的浓度。如图9A至9F所示,与一周时间段的超声波刺激之后多种细胞因子的浓度相比,两周时间段内的超声波刺激显示出多种细胞因子较低的RNA浓度。照此,与一周时间段的超声波刺激相反,两周时间段的超声波刺激可以改变基因表达水平。
图10A至10G显示了在未治疗过的大鼠、假对照(即,接受LPS,但未接受超声波刺激的大鼠)和接受LPS以及超声波刺激的大鼠中,在一周时间段和两周时间段内,多种基因的RNA浓度。图10A至10G还显示了在不同的超声波压力下多种蛋白的超声波激活水平。图10A显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,有丝分裂原激活的蛋白激酶14(p38)的RNA浓度,以及随着超声波压力的量的增加,相应基因蛋白p38的超声波激活水平。图10B显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,核糖体蛋白S6激酶B1(p70S6K)的RNA浓度,以及随着超声波压力的量的增加,相应基因蛋白p70S6K的超声波激活水平。图10C显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,v-akt鼠胸腺瘤病毒致癌基因同系物1(Akt)的RNA浓度,以及随着超声波压力的量的增加,相应基因蛋白Akt的超声波激活水平。图10D显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,糖原合酶激酶3β(GSK3B)的RNA浓度,以及随着超声波压力的量的增加,相应基因蛋白GSK3B的超声波激活水平。图10E显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,SRC原癌基因非受体酪氨酸激酶(c-Src)的RNA浓度,以及随着超声波压力的量的增加,相应基因蛋白c-Src的超声波激活水平。图10F显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,B细胞中的κ轻链多肽基因增强子的核因子(NF-κβ)的RNA浓度,以及随着超声波压力的量的增加,相应基因蛋白NF-κβ的超声波激活水平。图10G显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,细胞因子信号转导抑制因子3(SOCS3)的RNA浓度,以及随着超声波压力的量的增加,相应基因蛋白SOCS3的超声波激活水平。如图10A至10G所示,第二信使分子的超声波激活水平(例如,磷酸化)对于实现超声波神经调节的所期望的生理学结果是重要的。然而,基于治疗期(例如,与两周时间段相比的一周时间段),多种蛋白的RNA表达水平似乎不会变化。
图11显示了未治疗过的大鼠、假对照和接受LPS以及超声波刺激的大鼠在一周时间段和两周时间段内的烟碱型胆碱能受体α4亚基(CHRNA4)的RNA浓度。如图11所示,发现在接受LPS以及超声波刺激的大鼠中,在一周时间段内,CHRNA4的浓度指示了胆碱能抗炎通路(CAP)响应的降低(例如,全身性炎症降低)。然而,发现在接受LPS以及超声波刺激的大鼠中,在两周时间段内,CHRNA4的浓度与假对照中存在的CHRNA4的浓度相关。因此,发现在两周时间段内的超声波刺激引起CHRNA4基因表达升高。
图12A和12B显示了在未治疗过的大鼠、假对照和接受LPS以及超声波刺激的大鼠中,在一周时间段和两周时间段内,与激活的T细胞增殖的正调控有关的基因(基因本体:GO:0042104)以及与B细胞激活的调控有关的基因(基因本体:GO:0050864)的转录组数据。如图12A和12B所示,发现在一周时间段内的超声波刺激不足以抑制对LPS的增殖响应,但是发现在两周时间段内的超声波刺激足以抑制对LPS的增殖响应。
图13A和13B显示了在未治疗过的大鼠、假对照和接受LPS以及超声波刺激的大鼠中,在一周时间段和两周时间段内,与葡聚糖生物合成过程(例如,葡聚糖和仅由葡萄糖残基组成的多糖的形成(基因本体:GO:0009250))有关的基因以及编码转录因子蛋白的基因的转录组数据。如图13A和13B所示,发现在一周时间段内的超声波刺激不足以抑制多个系统和/或分子通路之间对LPS的响应,但是发现在两周时间段内的超声波刺激足以抑制多个系统和/或分子通路之间对LPS的响应。
图14显示了在未治疗过的大鼠、假对照和接受LPS以及超声波刺激的大鼠中,在一周时间段和两周时间段内,与检测LPS的能力有关的基因的转录组数据。如图14所示,发现在一周时间段内的超声波刺激不足以改变与检测LPS的能力有关的基因(例如,CEBPA、CEBPB、TLR4、CD14和LBP)的表达,但是发现在两周时间段内的超声波刺激足以改变与检测LPS的能力有关的基因的表达。
图15显示了在未治疗过的大鼠、假对照和接受LPS以及超声波刺激的大鼠中,在一周时间段和两周时间段内,与天然免疫系统,具体地检测LPS并对其响应的能力有关的基因的转录组数据。如图15所示,发现在一周时间段内的超声波刺激不足以改变与天然免疫系统有关的促炎基因(例如,TNF、IL-1A、IL-1B)的表达,但是发现在两周时间段内的超声波刺激足以改变与天然免疫系统有关的基因的表达。
图16A至16G显示了未治疗过的大鼠、假对照和接受LPS以及超声波刺激的大鼠在一周时间段和两周时间段内的乙酰胆碱相关基因的RNA浓度。图16A显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,烟碱型胆碱能受体α4亚基(CHRNA4)的RNA浓度。图16B显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,胆碱O-转乙酰酶(CHAT)的浓度。图16C显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,溶质载体家族5成员7(SLC5A7)的浓度。图16D显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,乙酰胆碱酯酶(卡特赖特血型)(ACHE)的浓度。图16E显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,丁酰胆碱酯酶(BCHE)的浓度。图16F显示了在未治疗过的脾脏、假对照脾脏和超声波刺激的脾脏中,在一周时间段和两周时间段内,溶质载体家族18成员A3(SLC18A3)的浓度。如图16A所示,发现乙酰胆碱受体亚基CHRNA4的表达水平一开始在超声波刺激一周后降低,但是然后意外地在超声波刺激两周时间段后开始升高。有趣地,图16E中所示的胆碱酯酶BCHE水解乙酰胆碱,并且在刺激一周后升高,并在两周保持升高。照此,发现在相对于一周时间段的刺激的两周时间段的刺激之间,包括CHRNA4和BCHE的神经信号转导,如胆碱能抗炎通路(CAP)受超声波刺激的影响和调节存在差异。
图17A显示了未治疗过的大鼠、假对照和接受LPS以及超声波刺激的大鼠在一周时间段和两周时间段内的水通道蛋白1(科尔顿血型)的RNA浓度。图17B显示了未治疗过的大鼠、假对照和接受LPS以及超声波刺激的大鼠在一周时间段和两周时间段内的水通道蛋白3(吉尔血型)的浓度。图18A显示了未治疗过的大鼠、假对照和接受LPS以及超声波刺激的大鼠在一周时间段和两周时间段内的跨膜蛋白176A(TMEM176A)的浓度。图18B显示了未治疗过的大鼠、假对照和接受LPS以及超声波刺激的大鼠在一周时间段和两周时间段内的跨膜蛋白176B(TMEM176B)的浓度。TMEM176A和TMEM176B与树突状细胞的未成熟状态有关。图18C显示了在未治疗过的大鼠、假对照和接受LPS以及超声波刺激的大鼠中,在一周时间段和两周时间段内,根据聚类分析分组的与TMEM176A和TMEM176B有关的基因的转录组数据。如所示的,两周组与对照/未治疗过的组聚类,而一周组与对照/假组聚类。因此,基于最近匹配,聚类分析(例如,层序、k均值)可以用于识别一周响应、两周响应、未治疗过的响应和/或无响应(类似于对照/假组)的基因表达谱特征。
图19显示了在脾脏、右肾上腺、骶神经节、结状神经节或孤束核的超声波刺激之后,相对于对照,循环瞬时分子(例如,去甲肾上腺素、乙酰胆碱和肿瘤坏死因子)的平均浓度。如图19所示,由于脾脏超声波刺激,去甲肾上腺素的浓度的升高在血液中产生了乙酰胆碱浓度的升高。
调节血液中的乙酰胆碱水平可以影响多个生理学过程。乙酰胆碱的静脉注射已显示会降低心率和心输出量。乙酰胆碱注射可以通过衬垫血管的内皮细胞和平滑肌细胞上的毒蕈碱型乙酰胆碱M3受体的刺激来引起血管舒张并降低血压。在肠内,乙酰胆碱水平的升高可以刺激肠运动和分泌。通过CHAT基因编码的胆碱o-转乙酰酶,从胆碱合成内源乙酰胆碱。胃肠道中的CHAT表达是适当地高的,并且归因于通过交感神经的高神经支配。在脾脏内,CHAT基因的RNA表达低于检测限并且实际上为零,如图17B所示。血浆中乙酰胆碱的来源主要归因于循环单核白细胞(Fujii et al.,Expression and Function of theCholinergic System in Immune Cells,Frontiers in Immunology 8(2017))。这些循环单核白细胞处于与脾脏的恒定交换(Adams et al.,Exercise and LeukocyteInterchange Among Central Circulation,Lung,Spleen,and Muscle,Brain,Behavior,and Immunity 25:658-666(2011))并且其结果是通过短期和长期超声波脾脏刺激而暴露、运输并调节。例如,通过主要在T细胞、巨噬细胞和树突状细胞上表达的C-C趋化因子受体类型5(CCR5),将脾脏中的蛋白C-C基序趋化因子配体4(CCL4)的分泌用于运输T细胞(一类单核白细胞)。图9D表明在一周和两周超声波之间,C-C基序趋化因子配体4(CCL4)的RNA表达存在差异,从而推断在脾脏和循环中的单核白细胞之间的运输和交换中存在相应变化。这些运输调节将对血浆中的乙酰胆碱浓度具有相应调节,其归因于这些循环单核白细胞和由于血浆乙酰胆碱水平变化所造成的最终下游生理学变化。
在另一个实施方式中,与神经调节所引起的特征谱有关的基因表达的变化可以用于改变患者对一种或多种其它疗法的响应性。例如:特征谱可以与一个或多个细胞表面受体的表达的升高或降低有关。
本发明的技术效果包括在延长的一段时间内向受试者提供神经调节治疗,从而可以维持对神经调节治疗所期望的急性响应(例如,神经递质或神经肽的释放),同时可以使神经调节治疗的任何不希望的慢性作用最小化。可以基于第一系列的能量应用事件之后对受试者的任何所期望的效果,确定和/或改变受试者的神经调节治疗的一个或多个治疗参数。例如,可以基于神经调节治疗的第一系列的能量应用事件所评价的作用,确定或改变能量应用事件的治疗期、治疗期内能量应用事件的治疗频率或者后续神经调节治疗期之间的恢复期的持续时间。在某些实施方式中,所期望的效果是受试者中某些基因的表达水平的变化。在某些实施方式中,所期望的效果是受试者中某些基因的表达水平不变化或最小变化。照此,本文所提供的神经调节技术可以优化延长的一段时间内对受试者的神经调节治疗的治疗参数,从而可以维持对神经调节治疗所期望的急性响应,同时可以使神经调节治疗的任何不希望的慢性作用最小化。
本领域技术人员认识到可以进行RNA测序以评价所有转录本的RNA表达、信使RNA的转录本或靶RNA转录本。此外,可以通过RNA测序,通过反转录聚合酶链反应(rt-PCR)并且甚至通过微阵列技术测量RNA表达。此外,可以使用或不使用荧光激活细胞分选术,对分离自组织样品的单一个体细胞进行RNA测序。
可以在多个时间并且在由个体生物循环和节律,如昼夜节律所限定的不同时间进行RNA表达测量。然而,RNA表达测量可以是有限的并且可以实施以确认指明组织特征变化的间接测量。
本书面说明使用实施例来公开本发明,包括最佳方式,并且还使得本领域的任何技术人员能够实践本发明,包括制备和使用任何装置或系统以及实施任何所引入的方法。通过权利要求限定了本发明的可取得专利的范围,并且所述范围可以包括本领域技术人员想到的其它实施例。如果它们具有不与权利要求的文字语言不同的结构成分,或者如果它们包括与权利要求的文字语言具有非实质性差异的等价结构成分,则这些其它实例旨在处于权利要求的范围内。
- 用于生理系统干扰的神经调节技术
- 神经调节技术
