一种新型冠状病毒主蛋白酶的亲和肽M1及其应用
文献发布时间:2023-06-19 11:09:54
技术领域
本发明属于生物医药技术领域,具体而言,涉及一种新型冠状病毒主蛋白酶的亲和肽M1及其应用。
背景技术
冠状病毒(Coronaviruses,CoVs)是一种有包膜的非节段的单股正链RNA病毒,属于巢病毒目(Nidovirales)冠状病毒科(Coronaviridae)正冠状病毒亚科(Orthocoronavirinae),在自然界中广泛存在,人和多种动物易感,其自然宿主包括人类和其他哺乳动物,如牛、猪、犬、猫、鼠和蝙蝠等,冠状病毒是导致呼吸道感染的主要致病性病原体之一,根据遗传和抗原的标准,冠状病毒可以分为4类,即α、β、γ和δ冠状病毒(Fehr AR,Perlman S.Coronaviruses:an overview of their replication and pathogenesis[J].Coronaviruses,2015:1-23.),其中,α-冠状病毒和β-冠状病毒仅感染哺乳动物,通常引起人类的呼吸系统疾病和动物胃肠炎,γ-冠状病毒和δ-冠状病毒可感染鸟类,但其中一些也可感染哺乳动物。目前,已经鉴定出6种人类冠状病毒,其中包括α属的HCoV-29E和HCoV-NL63,β属的HCoVOC43、HCoV-HKU1、严重急性呼吸综合征相关冠状病毒(SARS-CoV)和中东呼吸综合征相关冠状病毒(MERS-CoV)。
由冠状病毒感染引起的疾病严重威胁人类的生命与健康,随着全球人口流动性的增加,加之病毒自身的强致病性和易发生遗传变异等特点,冠状病毒已经成为全球范围内的健康威胁。冠状病毒感染宿主细胞后,一般经历吸附、穿入、脱壳、核酸复制、转录翻译及包装等多个阶段,阻止任何一个过程均可以导致冠状病毒复制受影响或抑制,最高效的抑制冠状病毒的药物是通过作用于病毒吸附宿主细胞或核酸复制这两个阶段,其中,冠状病毒的主蛋白酶(Main protease,M
本发明通过噬菌体展示技术筛选出冠状病毒的亲和肽M1,该亲和肽与冠状病毒SARS-CoV-2的主蛋白酶M
发明内容
本发明的目的在于提供一种新型冠状病毒主蛋白酶的亲和肽M1及其应用,所述亲和肽与冠状病毒具有较好的亲和性,该亲和肽为本发明首次发现,为研究和开发新型有效的抗冠状病毒的疫苗和药物提供了参考。
本发明的上述目的通过以下技术方案得以实现:
本发明的第一方面提供了一种特异性结合冠状病毒的亲和肽。
进一步,所述亲和肽的序列如SEQ ID NO.1所示;
优选地,所述的亲和肽特异性结合冠状病毒的主蛋白酶M
优选地,所述的冠状病毒为SARS-CoV-2。
本发明中所述的冠状病毒包括(但不限于):人类冠状病毒229E(HCoV-229E)、人类冠状病毒OC43(HCoV-OC43)、严重急性呼吸系统综合症冠状病毒(SARS-CoV)、人类冠状病毒NL63(HCoV-NL63)、人类冠状病毒HKU1(HCoV-HKU1)、中东呼吸综合征冠状病毒(MERS-CoV)、犬冠状病毒(CCoV)、猫冠状病毒(FeCoV)、大鼠冠状病毒(RCV)、猪流行性腹泻病毒(PEDV)、可传染的胃肠炎病毒(TGEV)。
本发明的第二方面提供了一种亲和肽衍生物。
进一步,所述亲和肽衍生物包括本发明第一方面所述的亲和肽的修饰产物、本发明第一方面所述的亲和肽经一个或多个氨基酸添加和/或替换后获得的变体、本发明第一方面所述的亲和肽与其他物质的偶联物。
进一步,所述修饰产物包括本发明第一方面所述的亲和肽经甲基化修饰、豆蔻酰化修饰、PEG修饰、氟元素修饰、生物素修饰、荧光标记修饰、环化修饰、羧化修饰、脂肪酸修饰、乙酰化修饰、磷酸化修饰、糖基化修饰、酰胺化修饰或其他已知的多肽修饰后的修饰产物;
进一步,所述氨基酸添加和/或替换后获得的变体包括在本发明第一方面所述的亲和肽的氨基端、羧基端或内部任意位置进行添加和/或替换氨基酸后获得的变体;
优选地,所述变体是本发明第一方面所述的亲和肽的氨基端、和/或羧基端、和/或内部任意位置添加和/或替换1个或多个无关氨基酸获得的。
进一步,所述无关氨基酸包括(但不限于):酪氨酸、甘氨酸、半胱氨酸、色氨酸、谷氨酰胺、蛋氨酸和苏氨酸。
进一步,所述添加和/或替换的氨基酸包括天然氨基酸、非天然氨基酸。
进一步,所述本发明第一方面的亲和肽与其他物质的偶联物包括本发明第一方面所述的亲和肽与载体蛋白、外源性多肽、药物进行偶联获得的偶联物;
优选地,所述载体蛋白包括(但不限于):血清白蛋白、血蓝蛋白、鸡卵白蛋白;
优选地,所述外源性多肽包括(但不限于):Fc区、信号肽、多肽标记;
更优选地,所述Fc区选自以下组:IgA Fc区、IgD Fc区、IgG Fc区、IgE Fc区、IgMFc区;
更优选地,所述多肽标记选自以下组:Flag标记、strep标记、聚组氨酸标记、VSV-G标记、流感病毒血凝素标记、c-Myc标记;
优选地,所述药物包括(但不限于):双膦酸盐类药物、环烯醚萜化合物;
更优选地,所述双膦酸盐类药物包括(但不限于):阿仑膦酸、伊班膦酸盐、唑来膦酸;
更优选地,所述环烯醚萜化合物包括(但不限于):京尼平尼酸、京尼平-龙胆双糖苷、京尼平苷、京尼平苷酸。
本发明的第三方面提供了一种核酸分子。
进一步,所述核酸分子编码本发明第一方面所述的亲和肽或编码本发明第二方面所述的亲和肽衍生物。
本发明的第四方面提供了一种表达载体。
进一步,所述表达载体含有本发明第三方面所述的核酸分子。
进一步,所述载体是指可以携带插入的多核苷酸进入宿主细胞的分子。
进一步,所述载体包括(但不限于):脂质体、生物相容性聚体胶束、包括天然聚体和合成聚体;脂蛋白;多肽;多糖;脂多糖;人工病毒包膜;金属颗粒;以及细菌、病毒,如杆状病毒、腺病毒和逆转录病毒、噬菌体、粘粒、质粒、真菌载体和其它通常用在本领域的各种真核和原核宿主表达、可能被用于基因治疗、以及用于简单的蛋白表达的重组载体。
本发明的第五方面提供了一种宿主细胞。
进一步,所述宿主细胞含有本发明第三方面所述的核酸分子或含有本发明第四方面所述的表达载体。
本发明的第六方面提供了一种药物组合物。
进一步,所述药物组合物包括本发明第一方面所述的亲和肽、本发明第二方面所述的亲和肽衍生物、本发明第三方面所述的核酸分子、本发明第四方面所述的表达载体;
进一步,所述药物组合物还可包括药学上可接受的载体和/或辅料。
本发明的药物组合物中所包含的药学上可接受的载体和/或辅料是作为制剂时通常利用的载体和/或辅料,所述的载体和/或辅料包括药学上可接受的载体、稀释剂、填充剂、结合剂及其它赋形剂,这依赖于给药方式及所设计的剂量形式。适合的药学上可接受的载体和/或辅料在Remington's Pharmaceutical Sciences(19th ed.,1995)中有详细的记载。
进一步,所述药物组合物的给药方式包括口服、非口服。
进一步,所述以非口服的方式给药包括(但不限于):静脉内注射、皮下注射、肌肉注射、腹腔注射、局部给药、经皮给药。
进一步,所述药物组合物的适当的给药剂量根据制剂化方法、给药方式、患者的年龄、体重、性别、病态、饮食、给药时间、给药途径、排泄速度及反应灵敏度等的因素而多样,熟练的医生一般可容易确定得到希望的治疗效果或有效的预防效果所需使用的给药剂量。
进一步,所述药物组合物根据本发明所属技术领域的普通技术人员可容易实施的方法,利用药学上可接受的载体和/或辅料来进行制剂化,从而可制备成单位容量形态或装入多容量容器内来制备。剂型可为油性或水性介质中的溶液、悬浮液或乳化液形态或浸膏剂、粉剂、颗粒剂、片剂、胶囊剂或凝胶(例如,水凝胶)形态,还可包含分散剂或稳定剂。
本发明的第七方面提供了一种用于检测冠状病毒的产品。
进一步,所述产品含有本发明第一方面所述的亲和肽、本发明第二方面所述的亲和肽衍生物、本发明第三方面所述的核酸分子、本发明第四方面所述的表达载体、本发明第五方面所述的宿主细胞;
优选地,所述产品包括试剂盒、试纸条、芯片。
进一步,所述试剂盒还包括容器、使用说明书、阳性对照物、阴性对照物、缓冲剂、助剂或溶剂,其中使用说明书记载了如何使用所述试剂盒进行冠状病毒的检测,以及如何利用检测结果进行判断等。
本发明的第八方面提供了一种非诊断和治疗目的地检测冠状病毒的方法。
进一步,所述方法包括采用本发明第一方面所述的亲和肽、本发明第二方面所述的亲和肽衍生物、本发明第三方面所述的核酸分子、本发明第四方面所述的表达载体、本发明第五方面所述的宿主细胞、本发明第七方面所述的产品进行检测。
进一步,所述冠状病毒优选为SARS-CoV-2。
进一步,所述检测的方法包括(但不限于):等离激元共振试验、酶联免疫吸附试验、放射免疫检测、荧光免疫检测、发光免疫检测。
在本发明的实施例中,所述检测的方法为等离激元共振试验。
作为非诊断和治疗目的的实例,本发明所述的方法可用于体外冠状病毒的感染机制和发病机制的研究中。
本发明的第九方面提供了本发明第一方面所述的亲和肽的应用。
进一步,所述应用包括如下任一方面的应用:
(1)在制备本发明第二方面所述的亲和肽衍生物中的应用;
(2)在制备本发明第六方面所述的药物组合物中的应用;
(3)在制备本发明第七方面所述的产品中的应用。
进一步,所述在制备本发明第六方面所述的药物组合物中的应用包括在制备抗冠状病毒的药物组合物中的应用、在制备抗冠状病毒相关疾病的药物组合物中的应用。
进一步,所述冠状病毒相关疾病包括(但不限于):慢性支气管炎、中耳炎、肺炎、心肌炎、额窦炎、急性呼吸窘迫综合征、腹泻、胸腔积液、代谢性酸中毒、凝血功能障碍、脓毒性休克。
进一步,所述冠状病毒优选为SARS-CoV-2。
本发明的第十方面提供了本发明第二方面所述的亲和肽衍生物的应用或本发明第三方面所述的核酸分子或本发明第四方面所述的表达载体或本发明第五方面所述的宿主细胞的应用。
进一步,所述应用包括如下任一方面的应用:
(1)在制备本发明第六方面所述的药物组合物中的应用;
(2)在制备本发明第七方面所述的产品中的应用。
本发明的第十一方面提供了一种制备抗冠状病毒疫苗的方法。
进一步,所述方法包括使用本发明第一方面所述的亲和肽纯化冠状病毒M
进一步,所述冠状病毒优选为SARS-CoV-2。
除非另有定义,本发明上下文中的所使用的所有的技术和科学术语具有本领域普通技术人员所理解的相同含义。本发明的说明书中所使用的术语只是为了描述具体的实施例,不是旨在于限制本发明,此外,对部分术语解释如下。
本文中使用的术语“修饰”,是指对亲和肽作出的任何改变,例如肽长度的改变、氨基酸序列的改变、化学结构的改变、肽的共翻译修饰或翻译后修饰。在一些情况下,本发明的肽包含一个或多个经修饰的氨基酸残基。修饰的类型在本领域中是公知的。
本文中使用的术语“治疗”,是指通常涉及治疗人类或动物(例如,被兽医所应用),其中可达到某些预期的治疗效果,例如,抑制病症的发展(包括降低发展速度、使发展停止)、改善病症和治愈病症。还包括作为预防措施(例如预防)的治疗。对还没有发展为病症但有发展为该病症危险的患者的用途,也包括在术语“治疗”中。
本文中使用的术语“受试者”和“患者”,通常是指人类受试者并且可互换使用。受试者可以是男性或女性,可以是任何人种或种族,包括但不限于白种人、非裔美国人、非洲人、亚洲人、西班牙人、印度人等。受试者可以是任何年龄,包括新生儿、婴儿、幼儿、儿童、青少年、成人和老年人。受试者还可包括动物受试者,特别是哺乳动物受试者,例如犬科动物、猫科动物、牛科动物、山羊科动物、马科动物、绵羊科动物、猪科动物、啮齿动物(例如大鼠和小鼠)、兔类动物、灵长类动物(包括非人灵长类动物)等,以用于兽医药物或医疗药物的开发的目的。
本发明使用的术语“天然氨基酸”,是指那些由遗传密码编码的氨基酸,以及那些后来被修饰的氨基酸,例如羟脯氨酸、γ-羧基谷氨酸和O-磷酸丝氨酸。天然产生的α-氨基酸包括(但不限于):丙氨酸(Ala)、半胱氨酸(Cys)、天冬氨酸(Asp)、谷氨酸(Glu)、苯丙氨酸(Phe)、甘氨酸(Gly)、组氨酸(His)、异亮氨酸(Ile)、精氨酸(Arg)、赖氨酸(Lys)、亮氨酸(Leu)、蛋氨酸(Met)、天冬酰胺(Asn)、脯氨酸(Pro)、谷氨酰胺(Gln)、丝氨酸(Ser)、苏氨酸(Thr)、缬氨酸(Val)、色氨酸(Trp)、酪氨酸(Tyr)及其组合。天然氨基酸的立体异构体包括(但不限于):D-丙氨酸(D-Ala)、D-半胱氨酸(D-Cys)、D-天冬氨酸(D-Asp)、D-谷氨酸(D-Glu)、D-苯丙氨酸(D-Phe)、D-组氨酸(D-His)、二亮氨酸(D-Ile)、D-精氨酸(D-Arg)、D-赖氨酸(D-Lys)、D-亮氨酸(D-Leu)、D-蛋氨酸(D-Met)、D-天冬酰胺(D-Asn)。
本发明使用的术语“非天然氨基酸”,包括(但不限于):氨基酸类似物、氨基酸模拟物、合成氨基酸、M’-修饰赖氨酸和以类似于天然氨基酸的方式起作用的L-构型或D-构型的甲基氨基酸。非天然氨基酸不是由遗传密码编码的,可以但不一定具有与天然氨基酸相同的基本结构。所述非天然氨基酸包括(但不限于):2-氨基脂肪酸、3-氨基脂肪酸、β-丙氨酸、β-氨基丙酸、2-氨基丁酸、4-氨基丁酸、哌啶羧酸、6-氨基己酸、2-氨基庚酸、2-氨基异丁酸、3-氨基异丁酸、2-氨基庚二酸、2,4-二氨基丁酸、锁链素、2,2'-二氨基庚二酸、2,3-二氨基丙酸、N-乙基甘氨酸、N-乙基天冬酰胺、羟赖氨酸、异羟赖氨酸、3-羟脯氨酸、4-羟基脯氨酸、异锁链素、异-异亮氨酸、N-甲基甘氨酸、N-甲基异亮氨酸、6-N-甲基赖氨酸、N-甲基缬氨酸、正缬氨酸、正亮氨酸或鸟氨酸。
本发明的优点和有益效果:
(1)本发明首次报道了一种亲和肽M1,所述亲和肽M1能够特异性地结合冠状病毒,可用于冠状病毒的辅助检测中。
(2)本发明提供的亲和肽为进一步研究和开发相关抗冠状病毒的新型疫苗、抗冠状病毒药物提供了参考,对于预防和控制冠状病毒的大流行具有重要的意义。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
图1显示的是筛选过程简要示意图、筛选得到的噬菌体蓝色斑点结果图和部分测序相关结果展示图;
图2显示的是M1多肽与靶蛋白M
图3显示的是M3和M4多肽与靶蛋白M
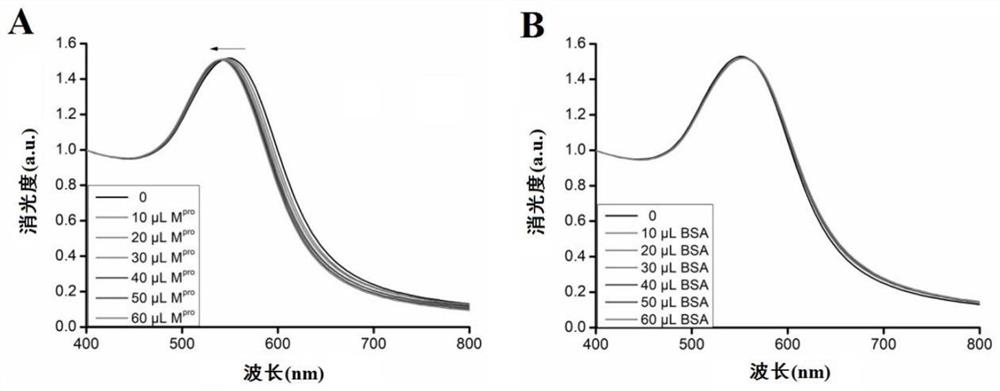
图4显示的是M1多肽修饰的金纳米颗粒对M
图5显示的是M3和M4多肽修饰的金纳米颗粒对M
具体实施方式
下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解为:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。
实施例1 SARS-CoV-2的病毒主蛋白酶M
1、实验材料
Ph.D.-12噬菌体展示肽库试剂盒购自New England Biolabs,Inc.。相互作用动力学分析和亲合力测定使用ForteBio Octet仪器。实验试剂和实验操作方法均按照产品的使用说明进行。
2、实验方法
通过噬菌体展示技术获得SARS-CoV-2的病毒主蛋白酶M
噬菌体展示实验
第一天
(1)用0.1M NaHCO
(2)在平皿中加入1.5mL的上述步骤(1)制备得到的溶液,并反复旋转直至表面完全湿润;
(3)在湿盒中,4℃温和振荡孵育过夜或4℃保存于湿盒中备用;
第二天
(4)将ER2738接种至10mL LB+Tet(四环素)的培养基中,该培养物将在步骤(11)中用于滴定,可在5-10小时内使用,如果要在同一天扩增洗脱的噬菌体(请参阅步骤(12)),还应在装有ER2738的25mL锥形瓶中接种20mL LB培养基,在37℃剧烈振摇下孵育两种培养物,孵育滴定培养直至达到所需要求;仔细监测20mL培养物,以使其不会超出对数早阶段(OD600=0.01-0.05),以用于步骤(12);
(5)封闭:将平皿反扣在洁净的纸巾上,去除包被液,加满封闭液(BSA)(封闭液配制:取7mL 0.1M NaHCO
(6)封闭完成后,丢弃封闭液。用TBST(TBS+0.1%[v/v]Tween-20)将每块板快速洗涤6次,反复旋转,以确保孔底及孔侧面均被洗涤,洗涤要迅速,避免平皿干燥;
(7)用1mL TBST稀释1×10
(8)将其正面朝下拍在干净的纸巾上,倒掉无结合的噬菌体;
(9)按照步骤(6)用TBST将板清洗10次,每次使用一块干净的纸巾,以防止交叉污染;
(10)洗脱已结合的噬菌体:1mL洗脱缓冲液(0.2M甘氨酸-盐酸(pH=2.2))洗脱结合的噬菌体,轻缓地摇动不超过10min,将洗脱液转入微量离心管中,用150μL 1M的Tris-HCl(pH=9.1)溶液中和;
(11)取少量洗脱液(20μL)测定滴度;
(12)通过将洗脱液添加到步骤(4)中的20mL ER2738培养物中来扩增其余的洗脱液,37℃剧烈振摇孵育4.5h;
(13)将培养物转移到离心管中,4℃,12000g离心10min后,将上清液转移至新的试管中,然后相同条件下再离心;
(14)将80%的上层清液转移至新管中,并向其中加入1/6体积的20%PEG/2.5MNaCl溶液,4℃条件下沉淀噬菌体,至少2小时或过夜;
第三天
(15)4℃14000rpm离心15min,弃掉上清液,短暂地重新旋转试管,并用移液管除去残留的上清液;
(16)用1mL TBS悬浮沉淀物并转入微量离心管中,4℃14000rpm离心5min使残留的细胞沉淀;
(17)将上清液转移至新的微量离心管中,并通过加入1/6体积的20%PEG/2.5MNaCl溶液进行沉淀,在冰上孵育15-60min,4℃,14000rpm离心10min,弃去上清液,再次离心,并用微量移液器除去残留的上清液;
(18)用200μL TBS悬浮沉淀物,微量离心1min,以沉淀任何残留的不溶物,将上清液转移到新管中,即为扩增的洗脱液;
(19)测量噬菌体的滴度;
(20)包被平皿进行第二轮筛选;
第四天和第五天
(21)在步骤(19)中,从滴定板中计数蓝色噬菌斑,并确定噬菌体滴度,滴度应在10
(22)进行第二轮淘选:使用计算量的第一轮扩增洗脱液作为输入噬菌体,并将洗涤步骤中的Tween 20浓度提高到0.5%(v/v);
(23)测定第二轮筛选扩增洗脱液的滴度;
(24)包被平皿进行第三轮筛选;
第六天
(25)进行第三轮淘选:使用与第一轮(步骤(7))相同的输入滴度,使用第二轮扩增的洗脱液,重复步骤(4)-(10),在洗涤步骤中再次使用0.5%Tween;
(26)按照步骤(11)在LB/IPTG/Xgal板上滴定未扩增的第三轮洗脱液(无须扩增第三轮洗脱液,测定未扩增的第三轮洗脱液的滴度。如果不进行第四轮筛选则不必扩增第三轮的筛选洗脱物。滴度测定时的蓝色噬斑可用于测序:平板的孵育时间不得长于18h。将剩余的洗脱物保存于4℃的条件下,可至少保存一周。
噬菌体滴度测定
(1)5-10mL LB培养基中接种ER2738克隆,并摇动孵育4-8h(对数中期,OD600约为0.5);
(2)在细胞生长时,将顶层琼脂放入微波炉中融化,分装至无菌培养管中,每管3mL,在45℃的条件下保存备用;
(3)在37℃的条件下,按预期稀释度预热一块LB/IPTG/Xgal板至少1h,直至准备使用;
(4)在LB中制备10至10
(5)当步骤(1)中的培养物达到对数中期时,分装至微量离心管中,每管200μL;
(6)将10μL每种噬菌体稀释液添加至每个试管中,每管仅加入一种稀释液,迅速涡旋,室温条件下孵育1-5min;
(7)一次将一种感染的感染细胞转移至含有45℃顶层琼脂的培养管中,短暂涡旋;
(8)立即将步骤(7)的培养物倒入预热的LB/IPTG/Xgal板上,轻轻倾斜并旋转平板,以均匀铺展顶部琼脂;
(9)冷却平板5min,37℃倒置培养过夜;
(10)在大约有100个噬菌斑的板上计数噬菌斑,将每个数字乘以该板的稀释因子,以每10μL噬菌斑形成单位(pfu)的噬菌体滴度。
提取DNA测序
(1)LB培养ER2738过夜,1:100稀释,1mL/管,每管接种一个噬菌斑;
(2)枪头穿刺蓝色噬菌斑,至以上培养管中;
(3)37℃振摇孵育4.5-5h;
(4)将培养物转移至1.5mL的离心管中,14000rpm离心30s;
(5)吸取上清至新的离心管中,14000rpm离心30s;
(6)吸取80%的上清至新的离心管中,4℃的条件下保存;
(7)取500μL,加入200μL PEG/NaCl,混匀,室温下静置10-20min。
(8)4℃,14000rpm离心10min,弃上清,再次离心,弃上清;
(9)用100μL碘化物重悬,剧烈震荡,加入250μL的无水乙醇,室温下静置10-20min;
(10)4℃,14000rpm离心10min,弃上清,加入500μL 70%的乙醇,再次离心,4℃,14000rpm离心10min;
(11)弃上清,晒干;
(12)用30μL TE Buffer重悬后,-20℃的条件下冻存,送测序。
3、实验结果
通过噬菌体展示技术筛选得到的M
表1通过噬菌体展示技术筛选得到的M
实施例2亲和肽与靶标蛋白的亲和力和相互作用动力学检测
1、实验方法
通过生物膜干涉技术(Bio-layer Interferometry,BLI)检测亲和肽M1、M3、M4与靶标蛋白M
(1)将表面修饰有链霉亲和素(Streptavidin,SA)的生物传感器浸入PBS缓冲液中进行平衡,至少10min;
(2)将传感器浸入PBS缓冲液中得到基线;
(3)将传感器浸入已知浓度的固化溶液(M1/M3/M4多肽溶液)中,溶液中生物素化的多肽结合到生物传感器表面,使其表面膜层发生变化。该步骤使得多肽结合到SA生物传感器上。
(4)将固化后的传感器浸入PBS缓冲液中再做基线。
(5)将固化后的生物传感器浸入含有M
(6)将已结合待测抗体的传感器浸入缓冲液中进行解离,M
(7)通过对实验过程中生物传感器生物膜层厚度的实时监控,拟合得到亲和肽M1、M3、M4与M
2、实验结果
M1多肽与靶蛋白M
表2亲和肽与靶蛋白相互作用的结合解离动力学和亲和力分析
实施例3亲和肽M1对靶标蛋白的响应能力的验证
1、实验方法
在亲和肽的C端引入一个半胱氨酸,使多肽通过Au-S键结合在金纳米颗粒表面。在体系中加入一系列浓度梯度的靶标蛋白,当蛋白与金纳米颗粒表面的亲和肽结合时,检测金纳米颗粒的SPR峰位。详细实验步骤如下:
(1)金纳米颗粒的制备
将150mL柠檬酸钠溶液(2.2mM)加入到250mL圆底烧瓶中,置于90℃的水浴中,400rpm磁力搅拌,加入1mL氯金酸溶液(25mM),反应30min后再加入1mL 60mM的柠檬酸钠溶液和1mL 25mM的氯金酸溶液,反应30min后再加入1mL 60mM的柠檬酸钠溶液和1mL 25mM的氯金酸溶液,反应30min后冷却至室温,即为金纳米颗粒溶液;
(2)多肽识别M
取上述金纳米颗粒溶液200μL,分别加入20μL的M1、M3、M4多肽(0.5mg/mL),混匀后置于30℃的水浴中30min,然后,12000rpm离心5min,弃去上清,并加入200μL水重悬沉淀。取200μL上述溶液,加入不同浓度的M
2、实验结果
实验结果显示,表面修饰了M1多肽的金纳米颗粒加入M
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
- 一种新型冠状病毒主蛋白酶的亲和肽M1及其应用
- 一种新型冠状病毒主蛋白酶的亲和肽M1及其应用
