一种新冠病毒S1-RBD蛋白羊驼纳米抗体及其制备方法和应用
文献发布时间:2023-06-19 11:16:08
技术领域
本发明涉及抗体制备技术领域,尤其是涉及一种新冠病毒S1-RBD蛋白羊驼纳米抗体及其制备方法和应用。
背景技术
羊驼的免疫系统在检测到细菌和病毒等外来入侵者时会产生两种类型的抗体:一种类似于人抗体IgG,另一种只有四分之一大小,这些较小的抗体称为单域抗体或纳米抗体(即缺失轻链的“重链抗体”),这种缺失轻链的重链抗体只有很小的片段也能和正常的IgG等抗体一样去结合抗原,直接利用大肠杆菌培养噬菌体就可以获得大量的纳米抗体。
新型冠状病毒蛋白分为刺突糖蛋白(S蛋白,spike protein)、包膜糖蛋白(E蛋白)、膜糖蛋白(M蛋白)和核衣壳蛋白(N蛋白)。在冠状病毒中起关键作用的S蛋白包含2个亚单位,即S1和S2。S1蛋白能够促进病毒与宿主细胞受体的结合,其含有一个重要的C端RBD结构域,正是这个区域负责和受体结合。
目前,市场上的新冠检测试剂盒只有新冠病毒核酸检测试剂盒和新冠病毒抗体检测试剂盒两大类,既没有应用于该领域的新冠病毒羊驼抗体,也没有应用新冠病毒羊驼抗体检测新冠病毒蛋白的检测试剂盒,更没有极具临床应用价值、可开发为治疗新冠病毒肺炎临床药物的具有中和病毒能力的羊驼纳米抗体。
鉴于此,特提出本发明。
发明内容
本发明的目的在于提供一种新冠病毒S1-RBD蛋白羊驼纳米抗体及其制备方法和应用,该新冠病毒S1-RBD蛋白羊驼纳米抗体在用于新冠病毒检测时大大提高了检测诊断的特异性和准确性,同时该抗体还具有中和新冠病毒的中和活性,在作为新冠病毒肺炎治疗的纳米抗体药物上具有良好的应用前景。
本发明提供一种新冠病毒S1-RBD蛋白羊驼纳米抗体的制备方法,包括:
A)从免疫羊驼的外周血淋巴细胞中提取总RNA,并反转录扩增cDNA;
B)以cDNA为模板扩增羊驼抗体VHH基因,将其与载体连接构建噬菌体文库;
C)从噬菌体文库中筛选阳性克隆;
D)利用阳性克隆构建羊驼纳米抗体表达载体,经诱导表达和纯化,获得新冠病毒S1-RBD蛋白羊驼纳米抗体。
在本发明中,所述免疫羊驼是经重组新冠病毒S1蛋白免疫的羊驼;具体地,免疫时重组新冠病毒S1蛋白的剂量可以为0.4mg/只;每隔2周进行一次免疫,在第6次免疫2周后获得免疫羊驼。
在本发明中,反转录扩增cDNA包括:
向RNase free离心管中加入5×gDNA digester Mix 6μL和总RNA 2μg,加RNasefree超纯水至总体积为30μL,混匀,于42℃孵育2分钟,得到反应液;
向所述反应液中加入
在本发明中,采用巢式PCR扩增羊驼抗体VHH基因,包括:
以cDNA为模板进行第一轮PCR扩增,得到第一轮扩增产物;第一轮PCR扩增体系为:2×phanta mix 25μL,Primer F 0.5μL,Primer R 0.5μL,模板cDNA 2μL,ddH
利用第一轮扩增产物进行第二轮PCR扩增,得到第二轮扩增产物;第二轮PCR扩增体系为:2×phanta mix 25μL,Primer F 0.5μL,Primer R 0.5μL,第一轮扩增产物50ng,ddH
在本发明中,构建噬菌体文库包括:
采用Sfi I对第二轮PCR扩增产物和载体pHEN1进行酶切,酶切后回收载体和羊驼抗体VHH基因并进行连接反应,得到连接产物;
将连接产物转化至TG-1感受态细胞中,培养至OD600达到0.7后,加入辅助噬菌体继续培养,收细菌培养上清,获得噬菌体文库。
在本发明中,可以采用包被有重组新冠病毒S1蛋白的酶联板对噬菌体文库进行筛选,得到阳性克隆。
进一步地,本发明的制备方法还包括:
对噬菌体文库进行放大培养、分离、亲和筛选、鉴定、测序,得到羊驼抗体VHH基因序列。
在本发明中,可以将阳性克隆中富集度较高的序列亚克隆到pET22b载体上,获得羊驼纳米抗体表达载体。
本发明还提供一种新冠病毒S1-RBD蛋白羊驼纳米抗体,按照上述制备方法制得。
本发明还提供新冠病毒S1-RBD蛋白羊驼纳米抗体在检测新冠病毒蛋白或作为新冠病毒抗体药物的应用。
本发明的实施,至少具有以下优势:
1、本发明制备的新冠病毒S1-RBD蛋白羊驼纳米抗体,填补了新冠病毒血清学检测市场中ELISA检测试剂盒中没有羊驼抗体的空白,该羊驼抗体可用于研发检测新冠病毒蛋白的诊断试剂盒,大大提高了检测诊断的特异性和准确性;
2、本发明的抗新冠病毒S1-RBD蛋白的羊驼抗体具有中和新冠病毒的能力,其有望作为中和抗体用于新冠病毒肺炎抗体药物的研发,从而为新冠病毒的研发打下坚实的基础。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明构建噬菌体文库载体pHEN1的质粒图谱;
图2为本发明新冠病毒S1-RBD蛋白羊驼纳米抗体中和新冠病毒试验的结果。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
本实施例提供一种新冠病毒S1-RBD蛋白羊驼纳米抗体的制备方法,步骤如下:
一、对羊驼进行重组新冠病毒S1蛋白的免疫
将利用基因工程技术表达的新型冠状病毒S1-RBD蛋白(重组新冠病毒S1-RBD蛋白)纯化后,对羊驼进行免疫,免疫方法如下:
在不同的时间点(每隔2周进行一次免疫),按照0.4mg/只的剂量,使用福氏佐剂乳化重组新型冠状病毒S1-RBD蛋白抗原后,对羊驼进行颈肩部皮下多点注射;在第6次免疫2周后,由羊驼颈静脉抽血100mL至抗凝采血管中,完成对羊驼的免疫过程。
二、获取羊驼血清及外周血淋巴细胞
对上述免疫后抗体滴度达标的羊驼进行外周血的采集,对所采血液进行再分配,分出1/2血量直接进行离心以分离出血清(自其中纯化出的抗体可用于诊断试剂盒的研发)。
剩余的外周血用生理盐水进行1:1稀释,将稀释后的血液和白细胞分离液按1:1比例混合后,在室温下于2500rpm离心25分钟。
离心后,用1mL微量移液器小心地将淋巴细胞分离液与上层稀释血浆之间的一薄层白色外周血淋巴细胞(PBMC)吸出,汇集在15mL离心管后,在2000rpm下离心15分钟;弃上清,底层沉淀即为从淋巴细胞分离液分离出的、用于构建噬菌体文库的羊驼外周血淋巴细胞。
三、构建羊驼的新冠病毒S1-RBD蛋白抗体的cDNA噬菌体文库
1、RNA提取
向上述沉淀的羊驼外周血淋巴细胞中加入1mL TRIzol,用移液器打匀后加入0.2mL氯仿,加盖好后用手剧烈摇晃15秒,在室温放置2-3分钟,然后在12,000×g下离心15分钟。
离心后分成三层,下面的红色层为酚-氯仿相,中间是中间层,上面是无色的水相;RNA仅存在于水相中,水相占总TRIzol的60%。
2、RNA沉淀
将上层水相转移到另一干净的EP管中,加入0.5mL异丙醇,室温静置10分钟,然后在12000×g下离心10分钟;离心后管底部收集到絮状胶样的RNA沉淀。
3、RNA洗涤
去上清,加入1mL 75%乙醇洗涤RNA沉淀,振荡器混匀,在7500×g下离心5分钟。
4、RNA再溶解
用无RNase水重悬RNA沉淀,用枪头反复吹打几次至沉淀完全溶解。
5、测浓度
取2μL储存液加入另一个EP管中,再加入98μL无RNase水,离心混匀,以无RNase水作空白对照,测OD260/280值。
6、RNA鉴定
采用甲醛变性琼脂糖电泳进行鉴定,确定抽提RNA的完整性和DNA污染情况。
7、反转录为cDNA
在完成RNA提取后,使用反转录试剂盒,将提取到的外周血淋巴细胞的RNA反转录为cDNA。
第一链cDNA合成操作步骤如下:
1)残留基因组DNA去除
在RNase free离心管中配制如下混合液,用移液器轻轻吹打混匀后,在42℃孵育2分钟。
混合液体系如下:
5×gDNA digester Mix 6μL
模板RNA Total RNA 2μg
RNase free超纯水 至30μL。
2)逆转录反应
在上述第1)步的反应管中直接加入
逆转录反应体系如下(20μL体系):
第1)步的反应液 15μL
逆转录程序如下:
25℃ 5分钟
55℃ 15分钟
85℃ 5分钟。
8、巢式PCR扩增羊驼抗体VHH基因
1)第一轮PCR(1st PCR)测试:
第一轮(1st PCR)PCR体系及条件如下:
共计进行32个循环。
2)1st PCR大量扩增:
按照测试确定的PCR条件大量扩增PCR用于制备第二轮PCR(2nd PCR)模板,一般扩增10个反应体系。
3)1st PCR片段纯化:
使用琼脂糖凝胶纯化(gel-purification)方式进行片段纯化。
电泳后,割胶纯化VHH片段(约700bp),使用gel-extraction纯化试剂盒进行纯化;操作步骤按纯化试剂盒说明书进行,纯化后跑胶检测,条带唯一(约700bp)且清晰。
4)第二轮PCR(2nd PCR)测试:
第二轮(2nd PCR)PCR体系及条件如下:
共计进行32个循环。
通过琼脂糖凝胶电泳检测片段扩增情况。
5)2nd PCR大量扩增:
按照测试确定的PCR条件大量扩增PCR,一般每组引物扩增4-8个反应体系。
6)2nd PCR片段纯化:
使用过柱纯化(PCR-clean up)方式进行片段纯化;操作步骤按纯化试剂盒说明书进行,纯化后跑胶检测,条带唯一(约450bp)且清晰。
9、将扩增出的羊驼纳米抗体VHH基因与载体连接构建噬菌体文库
构建噬菌体文库的载体pHEN1的质粒图谱见图1。
1)酶切、连接:将第二轮PCR扩增产物与载体pHEN1共同使用Sfi I进行酶切;酶切体系为:Sfi I 2uL,扩增基因12ug、pHEN1载体3ug,10×Sfi I Buffer 3μL补足水到30μL;酶切反应条件为:在37℃下反应12小时(或过夜)。
酶切后使用DNA纯化回收试剂盒回收酶切完成的载体和扩增抗体基因,对回收后的载体和扩增抗体基因进行连接反应;连接反应体系为:pHEN1载体200ng,扩增抗体基因80ng,T4连接酶2μL,10×连接缓冲液5μL,加水直至50μL,4℃过夜。
回收连接产物,使用超纯水进行溶解。
2)电转:将电转杯置于冰上预冷,待TG-1感受态细胞融化后加入1μL上述获得的连接产物,将混合后的感受态细胞和连接产物转移到预冷好的电转杯中,使用电转仪预设的转化程序电击转化。
电转后立即往电转杯中加入1mL SOC培养基,将细胞在37℃复苏60分钟,随后涂在含有氨苄抗性的LB培养板上过夜生长。
3)冻存:将在上述培养板上生长的细胞用LB培养基和涂布棒冲洗刮下,加入20%的甘油后,置于-80℃进行冻存。
4)转化:将约为10
5)加入辅助噬菌体:按照细菌细胞数:辅助噬菌体为20:1的比例加入辅助噬菌体后,继续于37℃、220rpm条件下培养30分钟。
加入终浓度为100ug/ml的氨苄青霉素和0.2mM的IPTG,在30℃下过夜培养。
6)收细菌培养上清:将过夜培养的细菌在4℃、13000rpm下离心5分钟,收集上清。将上清转移到新的离心管后,加入1/4体积预冷的5×PEG8000/NaCl并在冰上孵育30分钟。
孵育后,在13000rpm、4℃条件下离心10分钟。离心后弃上清,加入1mL PBS缓冲液溶解沉淀,即制备获得噬菌体文库。
10、筛选与扩大噬菌体文库
1)使用包被有真核表达的新冠病毒S1-RBD蛋白的酶联板进行噬菌体文库的筛选。向孔中加入定量的抗体,按照常规ELISA法进行反应和测试。经过3轮测试,获得阳性克隆。
2)噬菌体的放大培养与分离:从构建的抗新冠病毒S1-RBD蛋白纳米抗体库(约2.6×10
培养后,转移菌液至50mL离心管,于4℃、2000×g下离心10min,弃去上清,然后用新鲜的2×YT-AK(50μg/mL Amp)培养基重新悬浮沉淀,在30℃、250r/min条件下过夜培养。
将过夜的菌液转移到50mL的离心管中,在2000×g、4℃下离心10min。离心后,吸取上清转移至新的50mL高速离心管中,加入适量的5×PEG8000/NaCl(20%PEG/2.5M NaCl)后,冰浴30min以上。随后,在4℃、12000×g下离心15min,除去上清,完全晾干后用PBS重新悬浮沉淀,转移到1.5mL的EP管中,在4℃、12000×g下离心2min,将上清转移新的1.5mL的EP管中,再次加入5×PEG8000/NaCl进行沉降,在4℃、12000×g下离心15min。吸取上清,用PBS重新悬浮沉淀,于4℃、12000×g下离心1min,将上清转移到新的1.5mL EP管中,4℃保存。
3)抗新冠病毒S1-RBD蛋白羊驼纳米抗体的进一步亲和筛选
将定量后的重组新冠病毒S1-RBD蛋白用包被缓冲液(0.05M碳酸盐缓冲液,pH9.6)稀释至10μg/mL,100μL/well加入到96孔酶标板,4℃孵育过夜。
次日,每孔加200μL 3%BSA-PBS进行封闭,37℃孵育1h。随后,用PBST(0.5%Tween-20)洗涤三次后每孔加入100μL扩增分离得到的噬菌体,37℃、2h。再分别用PBST洗6次,PBS洗2次,洗涤后完全拍干液体,100μL/well加Glycine-HCl洗脱缓冲液,37℃温育10min,收集洗脱液,加入适量Tris-HCl,使pH=7.0左右。
取洗脱下来的噬菌体,按10
另取1mL洗脱液感染10mL生长处于对数期的TG1菌液,离心后重悬浮沉淀,涂大板,次日刮取大板上的菌体,甘油保存用于下一轮筛选。亲和筛选共进行三轮。包被的抗原量每轮依次递减,二轮为5μg/mL,三轮为1μg/mL。
4)可溶性单克隆ELISA鉴定阳性克隆
①在96孔深孔板中加入300μL 2×YT-AG(50μg/mL Amp,2%Glucose),分别挑取第二、三轮筛选后输出平板上的单克隆接种到孔中,在30℃、220r/min下过夜培养作为母板。
另取一个96孔深孔板,加入500μL 2×YT-AG,每孔接种20μL母板菌液,对应加入各孔中,在37℃、220rpm下摇菌4h。随后,加入终浓度为0.01mmol/L的IPTG,在28℃、220rpm下诱导过夜。
②分别稀释重组新冠病毒S1蛋白抗原和BSA至终浓度为2μg/mL,分别包被96孔ELISA板,4℃孵育过夜。
次日取出,PBST洗3次,然后每孔加入200μL 3%BSA-PBS,在37℃下封闭2h,封闭期间1000×g,4℃,10min离心过夜诱导的菌液,作为一抗备用。
封闭结束后,PBST洗4次,每孔各加入30μL 1%BSA-PBS和90μL离心后的菌液上清作为一抗,37℃孵育2h。二抗采用HRP-Anti-M13酶标二抗,以TMB作为底物,在450nm处测吸光值。
最后,选取吸光值读数最高的TG-1菌落作为样本进行DNA测序,鉴定获得重组新冠病毒S1-RBD蛋白羊驼纳米抗体VHH的基因序列。
四、新冠病毒S1-RBD蛋白纳米抗体的诱导表达与纯化
1、纳米抗体原核表达菌株的构建
选取可溶性单克隆ELISA鉴定为阳性、且OD450>1.0的克隆送去测序公司测序。根据序列测定结果,选取序列富集度较高的序列,将其从pHEN1载体上亚克隆到pET22b载体上。
亚克隆步骤如下:
1)使用小提质粒试剂盒提取重组质粒和pET22b的质粒;
2)使用Pst I和NotⅠ进行双酶切;
3)分别切取凝胶,回收相应的基因和载体;
4)将基因和空载再连接;
5)转化连接产物至BL21(DE3)感受态;
6)将转化子涂布LB-A平板,在37℃下倒置过夜培养。
2、使用质粒小提试剂盒提取重组质粒。
3、使用Pst I和NotⅠ进行双酶切,送样到测序公司测序。
4、在37℃下酶切2h,向酶切产物中加入5×DNA Loading buffer后,采用1.5%琼脂糖凝胶电泳跑胶,30min后使用凝胶成像系统对条带进行分析鉴定。
5、重组抗新冠病毒S1-RBD蛋白纳米抗体的诱导表达。
6、采用常规基因工程技术对抗新冠病毒S1-RBD蛋白纳米抗体的菌株进行诱导和纳米抗体的表达。
7、抗新冠病毒S1-RBD蛋白纳米抗体的表达纯化。
8、按照常规方法对表达的抗体进行纯化,采用15%SDS-PAGE检测目的抗体纯度;结果表明,抗体纯度≥95%。
实施例2
本实施例提供一种新冠病毒S1-RBD蛋白羊驼纳米抗体,其是按照实施例1的制备方法制备得到的。
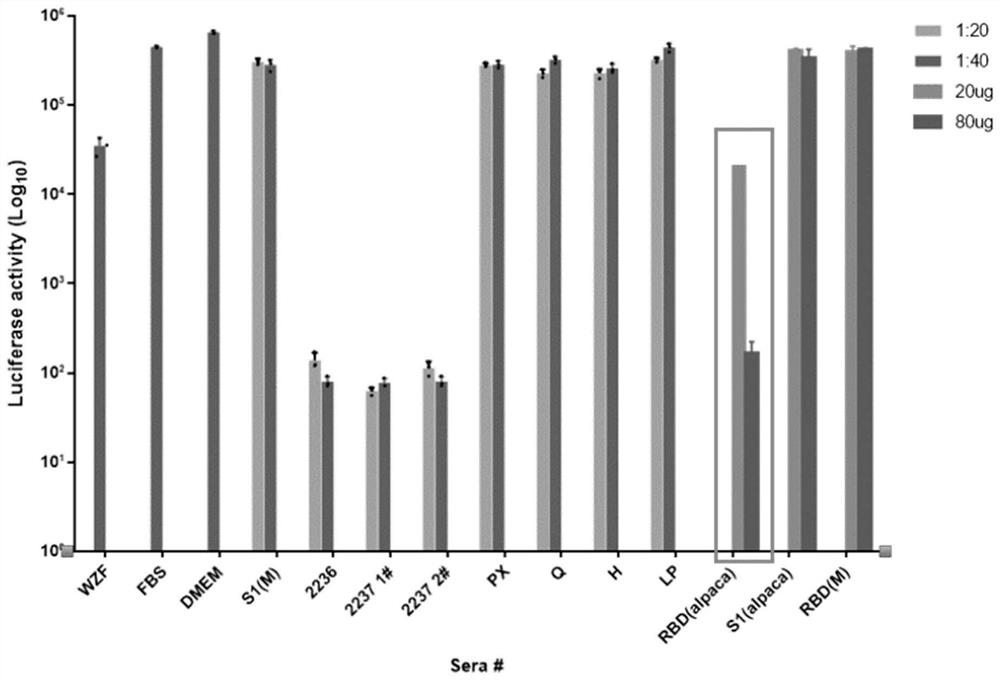
对上述新冠病毒S1-RBD蛋白羊驼纳米抗体进行中和新冠病毒试验,结果见图2;图2中的横坐标为所有待检抗体样本,纵坐标luciferase activity为荧光素酶吸收值,其可显示抗体中和病毒的活性。
图2结果表明:本发明制备的抗新冠病毒S1-RBD蛋白的羊驼抗体具有中和新冠病毒的能力,除了用于诊断试剂盒的开发外,更有望用作COVID-19治疗性抗体药物的研发。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 一种新冠病毒S1-RBD蛋白羊驼纳米抗体及其制备方法和应用
- 一种靶向新冠病毒N蛋白的鲨鱼单域抗体及其制备方法和应用
