装载了肿瘤裂解物的微粒
文献发布时间:2023-06-19 11:17:41
本申请是2013年10月02日提交的申请号为201380057518.2、发明名称为“装载了肿瘤裂解物的微粒”的发明专利申请的分案申请。
发明背景
肿瘤细胞存在在某种程度上是因为其选择了一种或多种突变使得其部分或全部逃离体内的免疫监控。
在引发对肿瘤细胞的免疫应答的尝试中,之前的研究者已使用树突状细胞,其为专业的抗原呈递细胞,对免疫系统递呈肿瘤抗原。举例来说,用肽或肿瘤裂解物脉冲的树突状细胞已被用于为黑色素瘤患者接种疫苗。
然而,由于这些抗原仅由树突状细胞内吞且通常通过只诱导辅助T细胞而并不提供强免疫应答的主要组织相容性复合体(MHC)II类途径呈递,因此以之前的方式简单地向免疫系统提供肿瘤抗原并不有效。
相反地,经由MHC I类途径递呈肿瘤抗原可通过激活CD8+T细胞促成更强的抗肿瘤免疫力。之前的研究者已尝试通过使用基因转移方法由MHC I类途径递呈肿瘤抗原。然而,这些方法具有劣势,包括(1)局限的识别全部重要的肿瘤特异性抗原的能力,(2)局限的对特异性肿瘤抗原基因定位的能力,(3)只有一种或少数的已知肿瘤抗原基因可以被引入树突状细胞以及(4)所述方法费时且繁琐。
发明概述
一些实施方案涉及分离的树突状细胞,其包含基本上由(i)微粒和(ii)微粒内装载的肿瘤裂解物所组成的吞噬组分。在特定的实施方案中,所述肿瘤裂解物以约200μg至约500μg的量存在。在特定的实施方案中,所述肿瘤裂解物以约200μg的量存在。
在一些实施方案中,所述肿瘤裂解物是选自癌症的裂解物,所述癌症选自下组:乳腺癌、小细胞肺癌、非小细胞肺癌、神经胶质瘤、髓母细胞瘤、神经母细胞瘤、肾母细胞瘤、横纹肌肉瘤、骨肉瘤、肝癌、胰腺癌、黑色素瘤、前列腺癌和眼黑色素瘤。
在一些实施方案中,所述微粒是酵母细胞壁微粒。在一些实施方案中,所述树突状细胞是已分离不超过8天的未成熟细胞。
另一实施方案涉及疫苗,其包含前文所述的分离的树突状细胞。
一些实施方案涉及用于产生分离的包含装载了肿瘤裂解物的微粒的树突状细胞的方法,其包括:(i)将所述肿瘤裂解物装载入微粒来产生装载了肿瘤裂解物的微粒;(ii)冻干所述装载了肿瘤裂解物的微粒;以及(iii)将所述装载了肿瘤裂解物的微粒与树突状细胞共同孵育,其中所述孵育引起所述树突状细胞吞噬所述装载了肿瘤裂解物的微粒。
在特定的实施方案中,前文所述方法进一步包括(a)在溶液中重悬所述装载了肿瘤裂解物的微粒以及(b)在步骤(iii)之前冻干所述重悬溶液。在特定的实施方案中,所述肿瘤裂解物通过冷冻和融化所述肿瘤生成。在特定的实施方案中,前文所述方法进一步包括重复所述冷冻和融化步骤。在特定的实施方案中,前文所述方法进一步包括在-150℃冷冻保存所述肿瘤裂解物。
在特定的实施方案中,步骤(iii)包括:(a)将肿瘤裂解物加入酵母细胞壁微粒,(b)孵育所述酵母细胞壁微粒,(c)冻干所述酵母细胞壁微粒以及(d)洗涤所述酵母细胞壁,其中重复步骤(b)-(c)至少一次且在重复步骤(b)之前伴随将水加入所述酵母细胞微粒的步骤。
在特定的实施方案中,步骤(iii)包括:(a)将装载了肿瘤裂解物的微粒与树突状细胞以约100:1的比例接触,(b)将所述装载了肿瘤裂解物的微粒与所述树突状细胞孵育1至2小时以及(c)收集所述树突状细胞并洗涤所述细胞。
在优选的实施方案中,将少量的一种或多种增强免疫应答的佐剂添加至肿瘤裂解缓冲液中,然后与树突状细胞孵育。一种或多种佐剂的添加增加了肿瘤裂解物对树突状细胞的作用同时显著减少任何来自这类佐剂的全身作用。通常使用的佐剂包括但不限于蛋白质、肽、核酸和碳水化合物。
示例性佐剂包括但不限于单磷酰脂质A、GpC寡核苷酸(如GpC DNA)、Poly I:C、Poly ICLC、有效的MHC II表位肽、β葡聚糖,和树突状细胞刺激细胞因子如IL-12。合适的佐剂是那些已知与树突状细胞上的受体相互作用由此激活树突状细胞并进一步刺激T细胞(如CD4+和CD8+T细胞)更强的生成的分子。
在一些实施方案中,一种或多种增强免疫应答的佐剂的量是至少约5μg、至少约10μg、至少约15μg、至少约20μg、至少约25μg、至少约30μg、至少约35μg、至少约40μg、至少约45μg、至少约50μg、至少约60μg、至少约70μg、至少约80μg、至少约80μg、至少约90μg,或至少约100μg。在一个实施方案中,佐剂的量占总裂解物的量的1-10%之间。佐剂的量足以刺激树突细胞上的受体,如toll-样受体。
一些实施方案涉及用于治疗癌症的方法,其包括施用包含前文所述的分离的树突状细胞的疫苗。在特定的实施方案中,所述癌症选自下组:乳腺癌、小细胞肺癌、非小细胞肺癌、神经胶质瘤、髓母细胞瘤、神经母细胞瘤、肾母细胞瘤、横纹肌肉瘤、骨肉瘤、肝癌、胰腺癌、黑色素瘤、前列腺癌和眼黑色素瘤。
附图简述
图1描述了用于产生树突状细胞的方法。
图2描述了用于产生肿瘤裂解物的方法。
图3描述了用于产生酵母细胞壁微粒的方法。
图4描述了用于将肿瘤裂解物装载入酵母细胞壁微粒的方法。
图5描述了用于产生装载了肿瘤裂解物微粒的树突状细胞的方法。
图6是装载了肿瘤裂解物微粒的树突状细胞与抗原脉冲的树突状细胞对B3Z细胞作用的比较图。
图7A展示了受B16F0小鼠黑色素瘤困扰的对照小鼠的肺。图7B展示了受B16F0小鼠黑色素瘤困扰但用肿瘤裂解物微粒装载的树突状细胞治疗的小鼠的肺。
优选实施方案的详述
本领域的普通技术人员已知的多种方法学作为本文的参考文献。作为参考文献的描述这些已知的方法学的发表物和其他材料在本文如阐述全文般通过提述以其全文并入。
除非明确表明仅指代单数,否则本文所用单数形式“一个”、“一种”以及“所述”指单数以及复数两者。同样的,除非明确表明仅指代单数,术语的单数形式指单数和复数两者。举例来说,“疫苗”意为“一种疫苗”或“多种疫苗”。
术语“约”与数值和范围有关时意为包括的数字不限于本文阐述的精确数字,且意在指基本上在引用范围内但不脱离本发明的保护范围的范围。本文所用术语“约”可被本领域的普通技术人员理解且将在其使用的语境中有一定程度的变化。
本文所用“受试者”或“患者”指任何需要用疫苗治疗的动物。举例来说,受试者可能承受或有风险发展出可被疫苗治疗或预防的病症。本文使用的“受试者”或“患者”包括人。
本文所用术语“治疗有效量”和“治疗水平”分别意为在需要治疗的受试者中针对施用疫苗提供了特异性应答的疫苗的剂量或受试者的血浆浓度。为方便起见,下文提供了关于成人受试者的示例性剂量、疫苗递送量、治疗有效量和治疗水平。当需要治疗特定的受试者和/或病症/疾病时,本领域的技术人员可根据标准实践调整此类量。
本文所述的“肿瘤裂解物”指被裂解的肿瘤。肿瘤裂解可在多个条件下发生,包括肿瘤的重复冷冻和融化,通过均质化物理裂解肿瘤,与高渗或低渗溶液接触和与一种或多种非离子去污剂接触。肿瘤裂解物在裂解过程中未交联。在另一实施方案中,所述肿瘤裂解物使用本领域任何已知的技术通过切碎、研磨或捣碎肿瘤,或以别的方式粉碎肿瘤来产生。在另一实施方案中,所述肿瘤裂解物通过在磷酸盐缓冲液(PBS)如1X PBS存在下,切碎、研磨、捣碎或粉碎肿瘤来产生。
在特定的实施方案中,所述肿瘤裂解物从称量为至少200至500μg的实体肿瘤产生。
在另一实施方案中,所述肿瘤裂解物通过切碎、研磨或捣碎或粉碎肿瘤随后重复冷冻和融化来产生。在特定的实施方案中,将所述切碎的肿瘤冷冻和融化多次。在特定的实施方案中,将所述切碎的肿瘤冷冻和融化至少1、2、3或4次。在一些实施方案中,所述冷冻在液氮中实施,且可实施20分钟。在特定的实施方案中,所述融化在室温实施。在另一实施方案中,所述肿瘤裂解物在冷冻和融化流程后于约-135℃或更低的温度保存。在特定的实施方案中,所述肿瘤裂解物在冷冻和融化流程后于约-150℃或更低的温度保存。
所述肿瘤裂解物可从任何实体肿瘤制备,包括但不限于癌和肉瘤。在一些实施方案中,所述实体肿瘤来自与乳腺癌、小细胞肺癌、非小细胞肺癌、神经胶质瘤、髓母细胞瘤、神经母细胞瘤、肾母细胞瘤、横纹肌肉瘤、骨肉瘤、肝癌、胰腺癌、黑色素瘤、前列腺癌和眼黑色素瘤相关的肿瘤。
多个免疫应答增强剂可作为佐剂添加至肿瘤裂解缓冲液来加强免疫应答,从而使得当肿瘤裂解物与树突状细胞共同孵育时,所述佐剂展示对树突状细胞作用增强同时显著降低任何来自这种佐剂的全身作用。
选择一种或多种用于本发明的合适的佐剂在本领域的技术人员的已知范围内。举例来说,单磷酰脂质A、GpC寡核苷酸、Poly I:C、Poly ICLC、有效的MHC II表位肽,以及树突状细胞刺激细胞因子如IL-12、IL-2和GM-CSF都是用于本发明的良好的佐剂候选。
本文描述的“微粒”指任何在其中能包含肿瘤裂解物且也使得裂解物能够离开该结构的中空和多孔结构。在一些实施方案中,微粒的大小约0.5至约5μm,其大致为细菌的大小以使得微粒可被单核细胞如树突状细胞摄取。在特定的实施方案中,所述微粒的大小为约0.5至约1μm。在特定的实施方案中,所述微粒的大小为约0.5至约2.5μm。在一些实施方案中,所述微粒可以是具有葡聚糖网络的任何微粒,只要所述微粒在大小上为约0.5至约5μm。
在一些实施方案中,所述微粒是珠载体。所述珠载体不受形状或材料的限制,而可以是任何使得珠载体被单核细胞包括树突状细胞吞噬的形状、大小或材料。
在另一实施方案中,所述微粒是酵母细胞壁微粒(“YCWP”)。所述YCWP由酵母细胞壁制备从而使得所述微粒是多孔的并能在其中包含裂解物。在一个实施方案中,所述YCWP由酿酒酵母(Saccharomyces cerevisiae)制备。在另一实施方案中,所述YCWP是酵母聚糖微粒。在另一实施方案中,所述YCWP大约是单核吞噬细胞系统的细胞和其他吞噬细胞通常摄取的微生物结构的大小。在特定的实施方案中,所述YCWP为约1-5μm。
在一个实施方案中,所述YCWP通过下列步骤进行制备:(a)悬浮酵母来产生悬浮液,(b)孵育所述悬浮液,(c)离心所述悬浮液并去除上清以及(d)回收获得的YCWP。在另一实施方案中,步骤(a)-(d)重复至少1、2、3或4次。
在另一实施方案中,所述YCWP通过下列步骤进行制备:(a)在溶液中悬浮酵母来产生第一悬浮液,(b)孵育所述第一悬浮液,(c)离心所述第一悬浮液并去除上清,(d)悬浮所得沉淀来产生第二悬浮液,(e)孵育所述第二悬浮液,(f)离心所述第二悬浮液并去除上清以及(g)洗涤所得沉淀来回收所述YCWP。在另一实施方案中,对所述YCWP进行灭菌。
在特定的实施方案中,所述酵母在NaOH包括1M NaOH中悬浮。在特定的实施方案中,所述第一悬浮液在约80℃孵育约1小时或1小时。在特定的实施方案中,所述离心在约2000倍重力实施约10分钟,或在2000倍重力实施10分钟。在特定的实施方案中,所述沉淀在水包括pH为约4.5或pH为4.5的水中悬浮。在特定的实施方案中,所述第二悬浮液在约55℃孵育约1小时或在55℃孵育1小时。在特定的实施方案中,将所述沉淀在水中洗涤至少1、2、3或4次。在特定的实施方案中,将所述沉淀洗涤一次。
在另一实施方案中,所述YCWP使用异丙醇和/或丙酮进行灭菌随后洗涤沉淀。在特定的实施方案中,其他已知的醇类是合适的。在特定的实施方案中,所述YCWP在灭菌后可完全干燥。在另一实施方案中,所述YCWP在干燥后进行重悬。在特定的实施方案中,所述YCWP在PBS如1XPBS中重悬。在另一实施方案中,使所述YCWP干燥且随后在肿瘤裂解物装载入YCWP中之前冷冻,从而在使用前将其放置保存。在特定的实施方案中,冻干所述YCWP并在约4℃或更低保存。在特定的实施方案中,冻干所述YCWP并在4℃保存。
用肿瘤裂解物装载微粒。在一个实施方案中,通过将所述裂解物与微粒悬浮液共同孵育并使得所述裂解物穿入所述微粒的空心内部来将所述肿瘤裂解物装载入所述微粒。
在另一实施方案中,用肿瘤裂解物装载所述微粒后,冻干该组合来在所述微粒内产生无水肿瘤裂解物。通过冻干所述用肿瘤裂解物装载的微粒,所述裂解物被捕获在所述微粒内并准备就绪以被单核细胞如树突状细胞吞噬。在特定的实施方案中,所述冻干是仅有的用于将所述裂解物捕获在所述微粒内的机制。在特定的实施方案中,所述捕获并非是由分离的组分阻断所述裂解物离开所述微粒引起的,举例来说,是通过物理捕获、疏水结合、任何其他结合引起的。在特定的实施方案中,所述捕获并非是由交联或以其它的方式将裂解物附着于冻干时可能发生的任何附着物外的微粒上引起的。
在另一实施方案中,所述微粒在冻干后于溶液中重悬。在特定的实施方案中,所述溶液是水。在特定的实施方案中,重悬所述微粒来使得额外的肿瘤裂解物穿透所述微粒并随后再次冻干该组合。在其它实施方案中,所述组合承受多次冻干和重悬。在其它实施方案中,所述装载了肿瘤裂解物的微粒在冻干后使用前于乙醇中灭菌。
在特定的实施方案中,通过如下将所述肿瘤裂解物装载入所述微粒:(a)孵育所述裂解物和所述微粒的悬浮液,使得所述裂解物穿入所述微粒的空心内部并冻干装载了所述裂解物的微粒的悬浮液以及(b)任选地重悬所述微粒,孵育重悬的微粒并冻干重悬的微粒和任何尚未在微粒内的肿瘤裂解物。
在使用YCWP的具体实施方案中,YCWP的数目为约1x10
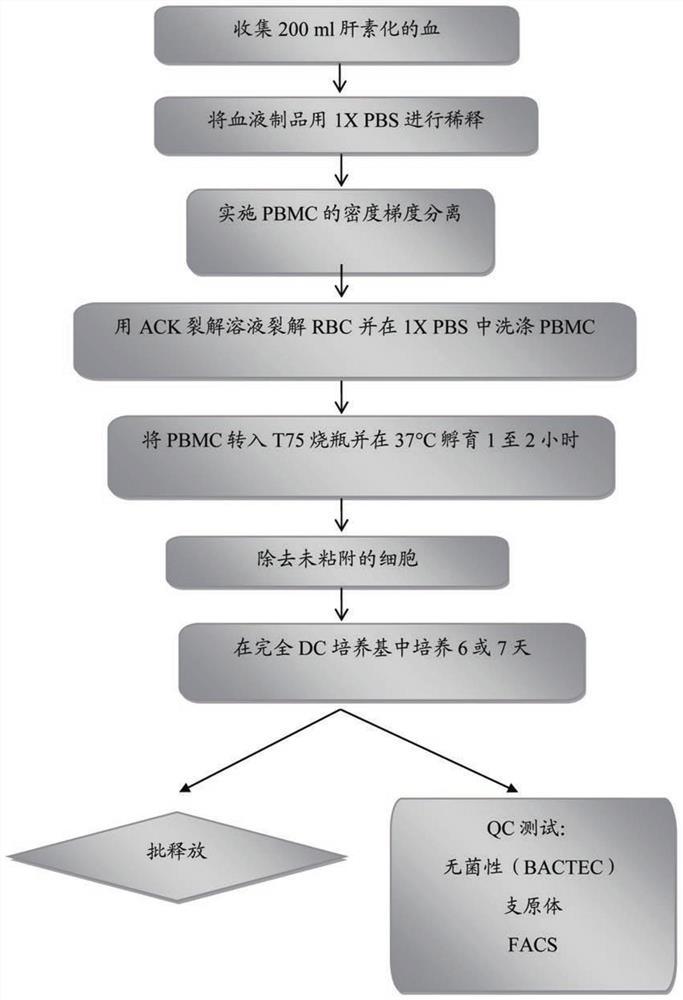
本文所述的“树突状细胞”指从外周血单核细胞(“PBMC”)生成的细胞。在一个实施方案中,树突状细胞通过下列步骤制备:(a)收集血液,(b)稀释所述血液,(c)对PBMC实施密度梯度分离,(d)裂解红细胞并洗涤所述PBMC,(e)孵育所述PBMC,(f)去除未粘附的细胞以及(g)在培养基中培养粘附的细胞。
在一些实施方案中,所述树突状细胞是培养不超过5天的未成熟的树突状细胞。在其他实施方案中,所述树突状细胞已培养6-8天。
在特定的实施方案中,所述血液是肝素化的。在特定的实施方案中,步骤(c)的密度梯度分离包括将血液放置在淋巴细胞分离培养基中且随后离心所述血液。在特定的实施方案中,所述离心在约1000倍重力实施约20分钟或在1000倍重力实施20分钟。在特定的实施方案中,第二次离心在步骤(d)之前实施且在约500g实施约5分钟或在500g实施5分钟。在特定的实施方案中,第三次离心在步骤(d)之前实施且在约500g实施约10分钟或在500g实施10分钟。在特定的实施方案中,所述裂解使用ACK裂解溶液实施,随后进行孵育,优选地在室温持续约5分钟,且接下来是随后的离心。在特定的实施方案中,将PBMC在RPMI-1640培养基中洗涤。在特定的实施方案中,所述PBMC在步骤(e)于约37℃在烧瓶中孵育约1-2小时或在37℃孵育1-2小时。在特定的实施方案中,将无血清DC培养基添加至烧瓶中。
在一些实施方案中,一种或多种细胞因子存在于培养基中,包括,但不限于,粒细胞巨噬细胞集落刺激因子(800单位/ml)以及IL-4(500单位/ml)。
装载了肿瘤裂解物的微粒被吞噬于单核细胞中,优选地,于树突状细胞中。在一个实施方案中,所述装载了肿瘤裂解物的微粒与树突状细胞共同孵育从而使得所述细胞吞噬装载了肿瘤裂解物的微粒。
在特定的实施方案中,所述微粒与所述树突状细胞以约100:1的比例或以100:1的比例孵育。所述孵育可实施约1小时、1小时或优选地少于1小时。
在特定的实施方案中,收集包含所述肿瘤裂解物微粒的树突状细胞并洗涤,举例来说,至少1、2、3或4次。在其他实施方案中,所述树突细胞在洗涤后孵育并在冷冻培养基中重悬。在特定的实施方案中,所述重悬浮液产生约10 x 10
在一个实施方案中,所述包含装载了肿瘤裂解物的微粒的树突状细胞被用作疫苗来预防和/或治疗疾病,包括癌症。待治疗的疾病不特别限制,但取决于装载入微粒中的特定的肿瘤裂解物。举例来说,将使用来自乳腺癌肿瘤的肿瘤裂解物的疫苗用于治疗乳腺癌。在另一实施方案中,将患者自身的肿瘤细胞用于产生疫苗。举例来说,所述疫苗可使用来自于乳腺癌相关的肿瘤的肿瘤裂解物生产且随后施用于提取所述肿瘤的乳腺癌患者。在另一实施方案中,约200μL 10x10
在另一实施方案中,在将剂量施用于患者前所述剂量通过将200μL等分试样稀释至1ml终体积进行施用。在特定的实施方案中,所述等分试样用包含5%人血清白蛋白的无菌生理盐水稀释。在特定的实施方案中,稀释前需要将所述200μL等分试样融化。在这样的方案中,融化和将所述剂量施用于患者之间的时间长度应不多于2小时。在一些实施方案中,所述稀释的等分试样在3cc注射器中施用。在一些实施方案中,使用不小于23Ga.的注射器针头。
在另一实施方案中,对患者施用至少1、2、3或4个剂量。在特定的实施方案中,每四周对患者进行再次接种疫苗。在特定的实施方案中,每次接种施用约1-2百万的包含装载了肿瘤裂解物的微粒的树突状细胞。在另一实施方案中,所述包含装载了肿瘤裂解物的微粒的树突状细胞通过注射施用于患者。在特定的实施方案中,所述装载了肿瘤裂解物的微粒注射入患者位于或接近(1)肿瘤或(2)淋巴结处。
在一些实施方案中,疫苗不与任何其他免疫抑制治疗如类固醇或化疗共同施用。疫苗可使用任何技术包括静脉注射和吸入来施用。
疫苗还可包含生物佐剂,包括但不限于核酸如GpC寡核苷酸、蛋白质或肽表位如破伤风类毒素MHC II类-结合p30肽。
实施例1:制备树突状细胞
树突状细胞从患者的PBMC生成。PBMC通过抽血200ml之后进行标准操作流程自患者收集。随后将血液转移至250ml离心管并用1 X PBS以1:1稀释。随后,35ml稀释的血液在50ml管中层铺于15ml室温的淋巴细胞分离培养基(LSM;Mediatech)上并于室温在1000g离心20分钟。PBMC层通过从LSM梯度吸取移出并置于干净的50ml离心管中。加入四体积的1 XPBS且随后将离心管倒置来混合内容物。PBMC随后在室温以500g离心5分钟。将10ml的1 XPBS加入至每管且重悬细胞并汇集于1管中。PBMC再次以500g在室温离心10分钟,在20至40ml的ACK裂解溶液(Cambrex)中重悬且在室温孵育5分钟。所述细胞在1500rpm再次离心5分钟。PBMC在30ml RPMI-1640培养基(Mediatech)中重悬。随后将细胞转入2-4个T75烧瓶中。所述烧瓶在37℃孵育1至2小时。未粘附细胞随后通过漂洗去除。随后,将10ml的1 X PBS加入每个烧瓶中,涡旋摇动(swirl)烧瓶,并去除PBS。随后,将10ml的完全DC培养基(无血清DC培养基+800U/ml GM-CSF+1000U/ml IL-4)添加至每个烧瓶。烧瓶随后在37℃,5%CO
图1提供了树突状细胞生成的概要。
实施例2:制备肿瘤裂解物
肿瘤样品从患者获得。将脂肪和坏死组织与肿瘤组织分开后,对所述组织称重并加入1 X PBS(每200μg组织50μL PBS)且将所述肿瘤用外科手术刀在1 X PBS中彻底切碎。肿瘤细胞随后经历4轮冷冻和融化。在液氮中实施冷冻20分钟并在室温实施融化。制备的肿瘤裂解物通过分光光度计定量。取一等分试样用于质量控制测试。其余以配制物保存在≤-135℃用于疫苗的制备。冷冻融化循环后可任选地添加少量的佐剂。
图2提供了肿瘤细胞裂解物加工的概要。
实施例3:制备YCWP
YCWP从Fleishmans面包酵母或等效物制备。简而言之,10g Fleishmans面包酵母在100ml的1M NaOH中悬浮并加热至80℃持续1小时。未溶解的酵母细胞壁通过在2000x g离心10分钟回收。回收的酵母细胞壁随后在用HCl将pH调整至4.5的100ml水中重悬并在55℃孵育另外一小时,且随后通过离心回收。回收的YCWP随后用水洗涤一次,异丙醇洗涤4次且最后用丙酮洗涤两次。一旦YCWP彻底干燥,将其在PBS中重悬,计数,等分成1X10
图3提供了酵母细胞壁微粒加工的概要
实施例4:制备YCWP
通过以下过程将三克活性干燥酵母(Fleischmann’s或等价物)在水中洗涤三次:将所述酵母在30ml的无菌水中悬浮,涡旋振荡(vortex),并在室温于800-1000x g离心5分钟。倾倒上清后,将酵母沉淀在50ml的1M NaOH中重悬并在90℃水浴中加热1小时。
酵母悬浮液随后在800-1000x g离心5分钟,且沉淀在25-30mL酸性水中(pH用HCl调整至4.5)重悬。重复酸性水洗涤步骤直至悬浮液的pH<7.0。随后将沉淀在30mL酸性水中重悬并在75℃水浴中孵育1小时。酵母沉淀通过1000x g离心5分钟回收,且随后用10mL无菌水洗涤3次,10mL异丙醇洗涤4次且最终10mL丙酮洗涤两次。将丙酮小心除去,且将沉淀均匀展开在烧杯的玻璃表面上,使其空气干燥过夜。
收集干燥的YWCP并在真空罐中于4℃保存且随后在10-15mL过滤的70%乙醇中洗涤3次。在最后的洗涤中对YWCP进行短暂超声处理,且若需要重复所述超声处理至将各团块(clump)分散。一旦去除乙醇,在无菌水中洗涤YWCP。将100μl的YWCP等分试样分散入2.0mL圆底折顶离心管(rounded-bottom snap top centrifuge tube)中,置于冰箱1小时,冻干,并在真空罐中于4℃保存供将来使用。
实施例5:将肿瘤裂解物装载入YCWP
将完全无水的YCWP悬浮液(1 X 10
图4提供了YCWP装载流程的概要。
实施例6:用肿瘤裂解物装载YCWP
患者的肿瘤活检样品与50-100μl的裂解缓冲液(PBS)(取决于肿瘤样品的量)小心混合,混合过程中避免气泡,且随后在4℃孵育30分钟。混合物在丙酮-干冰浴和37℃水浴经历冷冻-融化3次,并随后在4℃以最大的速度离心10分钟。将50μl制备的肿瘤裂解物加入包含10mg干燥的YCWP的2mL无菌离心管使得液体肿瘤裂解物覆盖YCWP。混合物在4℃孵育2小时直至液体肿瘤裂解物浸入YCWP。
随后将所述管放置于-85℃冰箱30分钟来快速冷冻沉淀。将所述管放置在冻干机过夜。将50μl无菌水添加至干燥的酵母沉淀上并在4℃孵育2小时来使得液体浸入沉淀。
将所述管放置于-85℃冰箱30分钟来快速冷冻沉淀。将所述管放置在冻干机过夜。干燥的微粒随后在1mL 70%的乙醇中重悬并在4℃保存供将来使用。
实施例8:制备包含装载了肿瘤裂解物的微粒的树突状细胞
离心装载了肿瘤裂解物的YCWP在70%乙醇中的悬浮液。将乙醇小心除去并替换为1mL PBS。对装载的YWCP进行超声处理。用无菌1 X PBS洗涤装载的YCWP。最终洗涤后,在PBS中重悬装载的YCWP至约1 X 10
以1:100的比例将装载的YCWP添加至树突状细胞培养物中,并将所述培养物放回37℃孵育箱中。随后,将下列因子添加至培养物:以1:5000的体积比将在无菌水中的50μg/mL的TNF-α添加至培养物(每10mL培养物2μL);以1:1000的体积比将在无菌水中的10μg/mL的IL-1β添加至培养物;以1:1000的体积比将在无菌水中的10μg/mL的IL-6添加至培养物;以及以1:1000的体积比将在100%乙醇中的1mg/mL的PGE2添加至培养物。添加所有的因子并混合入培养物后,将所述培养物过夜孵育。
实施例9:树突状细胞的收获,疫苗的制备和冷冻保存
从孵育箱中取出实施例9制备的树突状细胞培养物。在无菌条件下的护罩中实施下列步骤。从培养烧瓶中取出10mL培养基。用4.0-4.5mL的1 X PBS冲洗培养烧瓶并添加至培养基中。
将1.5-2.0mL的CellStripper
随后,细胞在CryoStor
实施例10:用于患者施用的实体肿瘤疫苗的制备
一冷冻管的患者细胞从冷冻保存中移出并在37℃的水浴中小心融化。在无菌条件下,将用于注射的具有5%人血清白蛋白的1mL无菌生理盐水(或1mL无菌1X PBS)轻轻加至包含细胞的冷冻管中。小心重悬细胞后,从冷冻管取出全部体积且将包含肿瘤细胞的注射器用于对患者施用疫苗。
实施例11:包含装载了肿瘤裂解物的微粒的树突状细胞V.S.抗原脉冲的树突状细胞(DC)
B3Z细胞是表达T-细胞受体的T-细胞杂交瘤,所述T细胞受体特异性地识别在H-2K
在通过与递呈卵清蛋白表位的树突状细胞上的MHC I类分子相互作用进行激活后,对B3Z细胞进行工程化来通过表达β-半乳糖苷酶应答。β-半乳糖苷酶催化X-gal(5-溴-4-氯-吲哚基β-D-吡喃半乳糖苷)的分解来生成5-溴-4-氯-3-羟基吲哚,一种蓝色产物。对这种蓝色的分光光度测量提供了对卵清蛋白表位的有效MHC I类递呈的测量。该实验的结果,示于图6中,证明了通过装载了卵清蛋白的YCWP装载树突状细胞提供了与卵清蛋白脉冲的树突状细胞相比增加了超过100倍的CD8+T细胞应答。
实施例12:体外数据
树突状细胞从由雌性C57BL/6J小鼠两条后腿的股骨和胫骨的骨髓获得的细胞来制备。获得B16F0鼠科黑色素瘤细胞(ATCC(CRL-6322))并使用标准组织培养技术培养。在树突状细胞培养第7天以100:1(微粒:DC)的比例通过将微粒加入,用包含B16F0肿瘤裂解物(约2x10-15g/YCWP)的YCWP来装载树突状细胞,持续2小时。在制备包含装载了肿瘤裂解物的微粒的树突状细胞的三天前,通过静脉注射在0.4ml 1X PBS中的0.75x10
在第四周末(当对照小鼠中的一只死亡时),处死小鼠并对任何发生的转移进行计数。未用含装载了肿瘤裂解物的微粒的树突状细胞治疗的全部四只对照动物具有多于50个肿瘤。然而,治疗的小鼠无一具有可测量的转移。该数据表明含装载了肿瘤裂解物的微粒的树突状细胞在经过验证的动物模型系统中在治疗癌症上是有效的。该数据列于表1中。
表1.对照和治疗小鼠的转移数目
此外,图7A表明在本实验中的三只对照小鼠的肺(一只在于实验终点前死亡且不能对其肺进行拍照),而图7B表明四只治疗的小鼠的肺。
实施例13:体内操作
为接种受试者,可将一剂1.25百万剂量的包含装载了肿瘤裂解物的微粒的树突状细胞在0.2mL的无血清、10%二甲基亚砜的冷冻培养基(CryoStorTM CS-10,BioLifeSolutinos,Inc.)中冷冻保存。注射前,融化树突状细胞并将其用包含5%人血清白蛋白(Albuminar-25,Aventis Behring)的注射用无菌生理盐水稀释至1mL。随后可将稀释转移至3.0cc注射器用于注射并使用不小于23Ga.的针头,其应在融化的2小时内施用。注射可皮下施用至淋巴结区域。
实施例14:使用SepMate-50系统自全外周血分离单核细胞
操作:
实施例15:与装载的YCWP组合的树突状细胞的生成
在实施例14中的步骤后,实施下列方法:
I.YCWP的添加:
II.细胞因子的制备和添加:
实施例16:细胞的收获,疫苗的制备和冷冻保存
在实施例15中的步骤后,实施下列方法:
I.细胞的收获:
II.疫苗的制备和冷冻保存:
