红细胞的等容球化
文献发布时间:2023-06-19 11:17:41
技术领域
本发明属于自动分析仪领域,并且涉及一种用于分析样本中细胞的血液分析仪。在此,在分析之前,借助于压电加热器对细胞进行加热和等容球化。
背景技术
为了自动分析细胞,自动细胞计数设备获得了越来越多的成功。对此的实例是设备Advia 2120、Sysmex XE-2100、CellaVision DM96和CellaVision DM1200。这些自动化设备除了其高的通量之外还提供一些优点,像例如,高度客观性(没有与观察者相关的可变性)、消除了通常与人工计数(对高细胞数进行计数)相关的统计变化,以及确定在人工计数情况下无法提供的大量参数,并且如上所述,更有效率和成本更低的操作。这些设备中的一些能够每小时处理120到150个患者样本。
自动单细胞计数的技术原理通常或基于阻抗(电阻)测量或基于光学系统(散射光或吸收测量)。此外,建立成像系统,成像系统例如对血液涂片的细胞进行自动成像和评估。
在阻抗方法中,基于检测和测量由于粒子移动通过小开口而引起的导电性(电阻)的变化对细胞进行计数以及其尺寸的确定。粒子,像例如血细胞本身是不导电的,然而悬浮在导电的稀释剂中。当这种细胞的悬浮液被引导穿过开口时,在单个细胞穿过时两个电极之间的电路径的阻抗(电阻)暂时增加,其中,电极处于开口的两侧上。
与阻抗方法相反,光学方法包括将激光束或LED光束引导穿过稀释的血液样本,稀释的血液样本的连续的流股被激光束或LED光束检测。在此,例如能够借助于光波导将相应的光束引导至流通单元。穿过流通单元的检测区的每个细胞都散射聚焦光。然后,通过光电探测器检测散射光并且将其转换为电脉冲。在此产生的脉冲数量直接与在具体时间段内穿过检测区的细胞数量成比例。
在光学方法中,以不同角度测量穿过检测区的各个细胞的光散射。由此,检测相应的细胞对于光辐射的散射行为,这可以推算出例如细胞结构、形状和反射能力。该散射行为能够用于区分血细胞的不同类型,并且能够使用推导出的参数来诊断该样本的血细胞与例如从大量分类为正常的参考样本中获取标准的偏差。
在自动评估例如血液涂片中的细胞时,如今的分析仪借助具有高数值孔径并且具有浸没在载玻片与物镜之间的显微镜来工作,以便能够实现高分辨率。然而,由此得到相对小的景深,该景深明显小于细胞垂直于具有血液涂片的载玻片的表面厚度。相应地,利用仅在调焦中的二维成像不能够清晰地对细胞的整个深度信息清晰成像。因此,这通常造成血细胞分类不明确,专业人员,例如实验室医师必须人工进行重新分类。
关于光学系统,在血液学中当前使用的测量设备包括显微镜,显微镜具有大约100倍的放大率,具有在物体平面上的传感器元件为100nm=0.1μm的有效横向分辨率。常用的相机具有最大为0.3至100万像素的像素数。由此,物体中的视场仅为几百微米大。为了能够拍摄和分析血液样本的染色的涂片,则必须利用位移单元以迂回扫描方法对涂片的待分析区域的面积进行扫描,其中,涂片的宽度可以为几毫米而长度为几十毫米。为了稍微加速该过程,以低放大率,例如以相应的10倍大视场的10倍放大率执行第一次平面扫描,并且在用于找出待测量的细胞的第一次图像评估之后,然后有针对性地以更高的放大率仅移近含有细胞的关注区域(RoI)。这表示,不以高的放大率对样本进行完全的平面分析。为了使细胞足够良好可见以便能够利用高分辨率光学显微镜对其进行分析,在先前的步骤中将血液涂片染色。在世界范围内已经建立了多种染色方案,染色方案从全球角度来看部分因地区不同而异。因此,血液涂片分析的可比性受区域限制,因为只能将根据相同方案染色的细胞的图像进行有效的相互比较。
对于红细胞(RBC)的分析,将红细胞尤其在流通系统中被圆化,该过程也称作为球化。
天然双凹红细胞的圆化或球化能够实现借助于几何公式对其体积和其他参数的精确分析,对此,例如参见Y.C.B.Fung和P.Tong的“红细胞的球化理论(Theory of thesphering of red blood cells)”,Biophysical Journal,第8卷(1968)。
在此,在实践中,球化过程易于集成到复杂的样本准备过程中,如其典型地存在于自动血液机中,以实现快速的工作流并同时实现高的样本通量。
通过在样本中添加低渗缓冲液,将等容球化应用于已知的血液分析仪中,其中缓冲液通常另外包括使细胞膜失稳的试剂,像例如十二烷基硫酸钠(SDS)。在此,使用低渗液体进行球化引起样本的高度稀释,例如稀释系数为630。此外,用于等容球化的这种处理方式导致红细胞处于与初始状态高度不同的状态。为此,低渗流体和使细胞膜失稳的试剂的结合也会尤其有助于此。
这些球化细胞的分析例如包括测定其体积或血红蛋白,并且在血液分析仪中例如通过使用由激光或LED产生的单色光以及利用米氏理论(Mie-Theorie)来光学上评估球形物体。可替代地,也能够例如通过测量限定体积的包括离子的液体的导电性来阻抗滴定地分析球化细胞(库尔特原理)。
还已知以下方法,在这些方法中利用以相应的调温水浴形式的热量来球化红细胞,为此,参见例如N.Matsumoto、Y.Ya-wata和H.S.Jocob的“降低的膜蛋白磷酸化与红细胞球形红细胞症的相关性(Association of Decreased Membrane ProteinPhosphorylation With Red Blood Cell Spherocytosis)”,Blood,第49卷,第2期(1977年2月)。在此,能够部分免除样本的高稀释度。但是,由于加热非常容易造成红细胞的进一步变化,像例如蛋白质凝集在血细胞中或其上,由此,红细胞的形态由于过热而极其强烈变化,并且使得细胞的相应的精确分析不可行。
此外,对于成像分析需要将球化的红细胞置于显微镜的光学焦点内,以便随后能够实现精确的图像分析。
发明内容
因此,本发明所基于的目的是提供一种用于分析医学样本的自动分析仪以及一种用于对医学样本的细胞进行球化的方法,其中能够在不对样本进行非常高度稀释的情况下实现细胞的球化,并且同时除了球化之外,还能够对细胞在尽可能原始且少量或完全没有变化的状态下进行分析,像例如应尽可能避免对细胞进行化学预处理,并且理想地能够完全省略对细胞进行标记。此外,还可以避免在已知方法中利用热量来进行球化所产生的缺点。因此,例如可避免蛋白质由于过热而凝集在细胞中和细胞上以及由此引起的形态变化。本发明另外的目的是,将相应完好且无标记的球化细胞引入到显微镜的光学焦点内,以使随后实现精确的图像分析。
该目的由根据独立权利要求的根据本发明的分析仪和根据本发明的方法来实现。本发明的有利改进尤其通过从属权利要求提供。
本发明的主题尤其包括一种用于分析医学样本的分析仪,该分析仪包括:用于样本的分析单元、压电元件和分析设备,其中压电元件能够通过施加电压和频率来运行,并且在此生成声波场。其中,在压电元件运行过程中,处于分析单元中的样本处于声波场中。
根据本发明的分析仪具有的优点是,能够免去使用至今为止必须用于球化细胞的低渗缓冲液以及使细胞膜失稳的试剂。此外,不再需要对样本进行非常高度的稀释,并且同时也尽可能避免了在借助于水浴进行常规加热时产生的缺点。此外,球化的细胞能够借助于所产生的声波场和相应的声力同时也引入到显微镜的光学焦点内和/或保持在其中,以便随后能够实现精确的图像分析。此外,能够完全或部分免除用于随后的显微镜检查的样本着色或其他标记。
根据本发明的分析仪优选为自动分析仪,特别优选为半自动分析仪或全自动分析仪。此外,分析仪优选是血液分析仪,特别优选是自动血液分析仪。
在分析仪的一个优选实施方式中,位于分析单元中的样本在压电元件运行过程中通过波场被加热,优选加热到至少48摄氏度,特别优选加热到至少50摄氏度。这具有的优点是,能够可靠实现红细胞的完全球化。
在分析仪的一个优选实施方式中,通过施加35伏至100伏,优选40至80伏,特别优选75伏的电压以及大约1MHz的频率,优选1.113MHz的频率或大约5MHz的频率,优选5.397MHz的频率来运行压电元件。这具有的优点是,能够特别安全、快速且有效地将位于分析单元中的医学样本的细胞加热到48或50摄氏度的温度。
在分析仪的另一个优选实施方式中,分析单元是流通单元,优选是微流体流通单元。这具有的优点是:能够实现优化的工作流和高的样本通量。此外,这具有如下优点,能够在液体环境中进而在更自然的条件下分析细胞。优选地,样本以每秒在0.002至5mm之间,特别优选以每秒0.002至0.1mm之间的流速在分析单元内移动。在此,流动条件有利地是层流的。
在分析仪的另一个优选实施方式中,分析设备包括光学显微镜,优选为用于分析位于分析单元中的样本的数字全息显微镜(DHM)。显微镜优选包括20至60倍的物镜。这具有的优点是,能够将放大率适配成,使得能够利用调焦充分清晰地将球化的红细胞成像。
在分析仪的另一个优选实施方式中,位于分析单元中的医学样本细胞借助于声力被置于和/或保持在显微镜的焦点区域中,其中借助于压电元件产生声力。优选地,为此施加的电压优选为8至12伏,并且频率为大约1MHz,优选为1.113MHz,或者为大约5MHz,优选为5.397MHz。这具有的优点是,能够无接触地将细胞置于或保持在焦点区域中。同时,不造成如在较高电压情况下出现的细胞加热,并且相应地不造成细胞中由热学引发的形态变化。因此,细胞不成为球形,而是保持双凹形。
本发明的另一个目的是一种借助于加热将医学样本的细胞球化的方法,其中该细胞位于分析单元中,并且其中借助于以电压和频率运行的压电元件产生声波场,并且其中细胞处于波场中并通过波场被加热且由此被球化。
在该方法的一个优选实施方式中,球化等容地进行。这具有的优点是,通过球化使例如红细胞的细胞体积保持不变。这对于细胞体积的相应定量的精确分析会是非常重要的。
在该方法的另一个优选实施方式中,将细胞加热到至少48摄氏度,特别优选地加热到至少50摄氏度。这具有的优点是,能够可靠地实现红细胞的完全球化。
在该方法的另一个优选实施方式中,细胞在分析单元中以每秒0.002至5mm之间,特别优选以每秒0.002至0.01mm之间的流速移动。
在该方法的另一个优选实施方式中,细胞在球化之后,借助于包括光学显微镜,优选包括数字全息显微镜(DHM)的分析设备而被分析和/或成像,其中细胞在分析和/或成像期间优选位于显微镜的焦点区域中。这具有的优点是,能够高质量地实现细胞成像,进而能够对例如细胞体积或其他细胞参数实现精确的、定量的分析。
在该方法的另一个优选实施方式中,将细胞通过声力置于和/或保持在显微镜的焦点区域中,其中这优选与将细胞球化同时进行。
在该方法的另一个优选实施方式中,通过同时利用声力和微流体力将细胞置于和/或保持在显微镜的焦点区域中,其中,这优选与将细胞球化同时进行。
优选地,为了将细胞引入和/或保持在显微镜的焦点区域中而借助于压电元件产生声力。优选地,为此施加的电压为8至12伏,并且频率为大约1MHz,优选为1.113MHz,或者大约为5MHz,优选为5.397MHz。
在该方法的另一个优选实施方式中,在流通单元的第一区域中,优选借助于施加到压电元件的1MHz,特别优选1.113MHz的频率在流通单元内进行细胞的球化。优选地,流通单元的第一区域位于显微镜的焦点区域上游。显微镜的焦点区域处于流通单元的第二个区域中,其中,第一区域优选布置在第二区域的上游。优选地,于是在下游、在流通单元的第二区域中,优选借助于施加到压电元件的5MHz的频率,特别优选的是5.397MHz的频率将细胞提升到显微镜的焦点区域中。这具有的优点是,即使同时球化和聚焦会导致这种不希望的变化和/或无法排除这种变化,也能够实现在不对细胞进行进一步不希望的热引起另外变化的情况下将细胞球化。
在该方法的另一个优选实施方式中,在球化之后立即,优选在球化之后0.05至1秒内对细胞进行分析和/或成像。这具有的优点是,在细胞的分析和/或成像已经结束的时间点才出现由于细胞的加热或过热而引起的、可能出现的不期望的细胞变化。
在该方法的另一个优选实施方式中,细胞是人或动物细胞,优选为血细胞,特别优选为红细胞。
在该方法的另一个优选实施方式中,细胞是红细胞,并且其中对细胞的分析包括体积测定和/或单细胞血红蛋白(MCH)测定和/或疟疾寄生虫检测。
本发明的另一个主题是根据本发明的方法在自动分析仪中的应用,优选在根据本发明的自动分析仪中的应用。
医学样本优选包括细胞制剂和/或医学制品。医学制品优选是组织切片、来自人体分泌物和/或体液和/或微晶的沉积物。这具有的优点是,能够测试和表征不同的样本类型,包括不同的细胞类型。
附图说明
根据附图再次通过具体的实施例来更详细地阐述本发明。所示的实施例是本发明的优选实施方式。附图中示出:
图1示出分析单元(9),红细胞(7)在没有声发射加热(akustophoretischesHeizen)的情况下位于分析单元中,其中压电元件(1)以23伏运行,
图2示出分析单元(9),球化的红细胞(7)在具有声发射加热的情况下位于分析单元中,其中压电元件(1)以75伏运行,
图3示出分析单元(9),红细胞(7)位于分析单元中,其中压电元件(1)以23伏运行,
图4示出分析单元(9),球化的红细胞(7)位于分析单元中,其中压电元件(1)以75伏运行。
具体实施方式
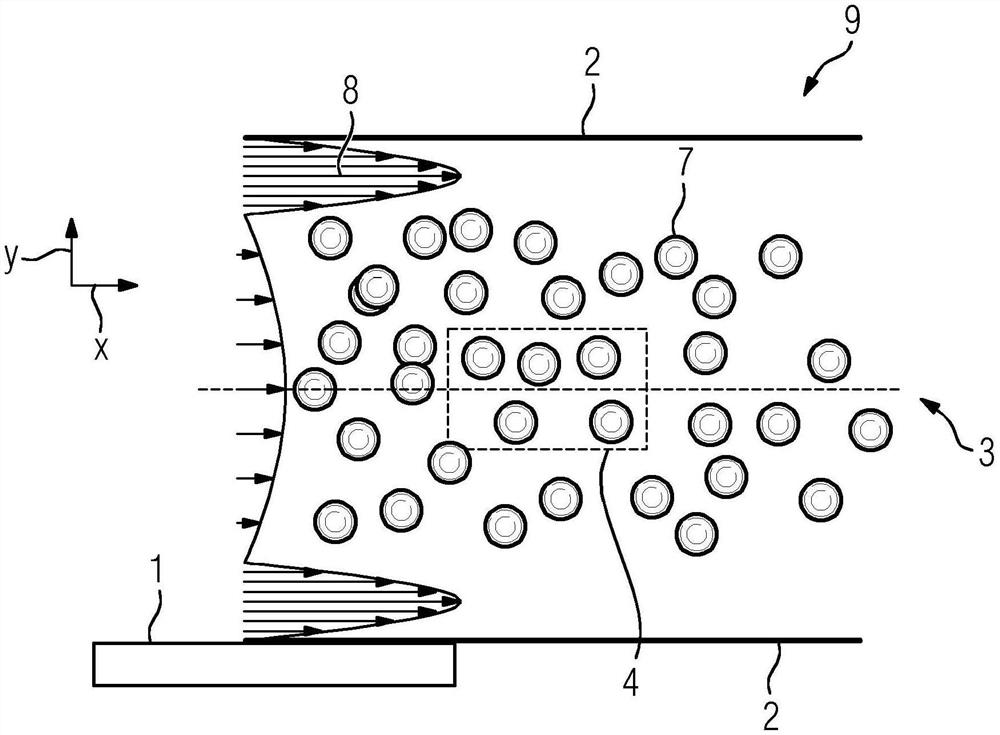
图1中示出的分析单元(9)包括通道壁(2)和压电元件(1),并且分析单元是用于分析样本中的细胞的自动分析仪的一部分。该分析仪包括设计为光学显微镜的分析设备(10)和用于照亮分析单元(9)中的样本的光源以及用于会聚和聚焦由被照明的样本发出的光束的会聚透镜。样本是包括红细胞(7)的血液样本。样本位于设计为微流体流通单元的分析单元(9)中。此外,显微镜包括相机,该相机包括用于记录在显微镜中成像的光场的数字记录设备,该记录设备包括CCD芯片或CMOS芯片。分析单元(9)和显微镜设计成,使得能够对位于光学窗口(4)中的红细胞(7)进行成像和分析。压电元件(1)在通道壁(2)处的外部区域中、在红细胞(7)的流动方向x上直接布置在光学窗口(4)之前。与红细胞在y方向上的位置相关地以矢量方式示出在流通单元内沿x方向移动的红细胞(7)的速度分布曲线(8)。
压电元件(1)以25伏的电压和约为1MHz,优选为1.113MHz的频率运行,或者以25伏的电压和约为5MHz,优选为5.397MHz的频率运行。红细胞(7)的温度低于48摄氏度,并且红细胞(7)处于其初始状态并且未被球化。
在图2中示出与图1所示相同的分析单元(9)。压电元件(1)现在以75伏的电压和约1MHz,优选1.113MHz的频率运行,或者以75伏的电压和约5MHz,优选5.397MHz的频率运行。红细胞(7)的温度至少为48摄氏度,并且红细胞(7)被球化。
在图3中示出另一个分析单元(9),红细胞(7)位于分析单元中。与红细胞在z方向上的位置相关地以矢量方式示出在流通单元内沿x方向移动的红细胞(7)的速度分布图(8)。未示出的压电元件(1)布置在通道壁的外侧区域中,并以23伏的电压和约1MHz,优选1.113MHz的频率运行,或者以23伏的电压和约5MHz,优选5.397MHz的频率运行。红细胞(7)的温度为36摄氏度,并且红细胞(7)处于其初始状态并且未被球化。示出的是通过压电元件(1)产生的声波(5)的走向。声波节(6)位于通道半高(3)和红细胞(7)的区域中。红细胞(7)由于声力被吸入声波节的区域中,并且被保持在那里。
在图4中示出与图3相同的分析单元(9)。压电元件(1)以75伏的电压和约1MHz,优选1.113MHz的频率运行,或者以75伏的电压和约5MHz,优选5.397MHz的频率运行。红细胞(7)的温度为48摄氏度,并且红细胞(7)完全球化。示出的是通过压电元件(1)产生的声波(5)的走向。声波节(6)位于通道半高(3)和红细胞(7)的区域中。红细胞(7)由于声力被吸入声波节的区域中,并被保持在那里。
附图标记列表
1 压电元件
2 通道壁
3 通道半宽
4 光学窗口
5 声波
6 声波节
7 红细胞(RBC)
8 速度分布曲线
9 分析单元。
- 红细胞的等容球化
- 含有促红细胞生成素衍生的分子的用于局部应用的美容制剂
