生物传感器及其制备方法
文献发布时间:2023-06-19 11:21:00
技术领域
本申请要求基于于2018年11月26日提交的韩国专利申请第10-2018-0147292号的优先权的权益,其公开内容通过引用整体并入本文。
本申请涉及生物传感器以及用于制备其的方法。
背景技术
免疫分析方法是基于抗原-抗体结合反应的分析方法。免疫分析方法的代表形式是酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA),其是最常用的免疫诊断方法。
酶联免疫吸附测定通常通过将抗体固定在经表面处理的基底中来检测目标物质。另一方面,作为基底的表面处理方法,使用这样的液相法:其中将基底浸入包含要对表面进行处理的物质的溶液中。然而,液相法具有易于进行的优点,然而其具有基底的表面处理有些不均匀以及所处理的物质具有低密度的缺点。因此,存在固定在基底中的抗体的密度低且不均匀,从而使生物传感器的目标物质的检测灵敏度降低的问题。
因此,需要具有改善的目标物质检测灵敏度的生物传感器。
发明内容
技术问题
本申请的一个目的是提供具有改善的目标物质检测灵敏度的生物传感器。本申请的另一个目的是提供用于制备具有改善的检测灵敏度的生物传感器的方法。
技术方案
在本说明书中提及的物理特性中,当测量温度影响结果时,除非另有说明,否则相关的物理特性为在室温下测量的物理特性。术语室温是未经加热或冷却的自然温度,其可以为例如在10℃至30℃范围内的任何温度、或者为约23℃或约25℃左右。此外,除非本文另有说明,否则温度的单位为℃。
在本说明书中提及的物理特性中,当测量压力影响结果时,除非另有说明,否则相关的物理特性为在常压下测量的物理特性。术语常压是未经加压或减压的自然压力,其中通常将约1大气压左右称为常压。
在本申请的一个实例中,本申请涉及用于检测目标物质的生物传感器。
本申请的生物传感器包括:基础材料;形成在基础材料的一侧上的支撑层;和固定在支撑层中的第一抗体,其中形成在基础材料的一侧上的支撑层为通过气相沉积法形成的自组装单层。
作为一个实例,基础材料没有特别限制,其可以为例如聚合物基底、金属基底、金属氧化物基底或玻璃基底。
作为聚合物基底,例如,可以使用聚碳酸酯、聚甲基丙烯酸甲酯(PMMA)、或聚丙烯基底,但不限于此。作为金属基底,例如,可以使用铝、铁或金基底,但不限于此。作为金属氧化物基底,可以使用Al
作为一个实例,可以在基础材料的一侧上形成支撑层。
在基础材料的一侧上形成支撑层的方法可以是通过气相沉积法来进行,并且具体地,可以通过以下待描述的分子层沉积(Molecular layer Deposition,MLD)法来实现。
作为一个实例,固定在支撑层中的第一抗体没有特别限制,其中可以考虑待检测的目标物质来选择合适的抗体。
具体地,可以选择具有能够与目标物质结合的结合位点的抗体作为第一抗体。因此,第一抗体可以根据待检测的目标物质而变化。另一方面,第一抗体的类型没有特别限制,其可以为例如IgE、IgD或IgG。
术语目标物质可以意指作为能够与抗体的结合位点结合的物质的抗原。
作为一个实例,形成在基础材料的一侧上的支撑层可以为通过气相沉积法形成的自组装单层。通常,自组装单层意指在不借助于特定酶或因素的情况下通过吸附而在表面上自发地形成的分子组装体。因此,在本申请中,自组装单层可以意指通过吸附而在基础材料的一侧上自发地形成的分子组装体。当生物传感器的支撑层为自组装单层(self-assembled monolayer,SAM)时,有利于使第一抗体均匀地附接至支撑层。
作为一个实例,本申请的生物传感器的吸光度可以满足以下公式1。
[公式1]
Ab≥0.15
在以上公式1中,Ab为在使100μL的包含20ng/mL至40ng/mL目标物质的溶液与其中固定有第一抗体的支撑层接触,然后使第二抗体和TMB(3,3’,5,5’-四甲基联苯胺)与所述支撑层接触之后,使用UV-Vis分光光度计测量的在最大吸收波长处的吸光度,所述第二抗体能够与目标物质结合并且结合有与TMB(3,3’,5,5’-四甲基联苯胺)反应的酶。
在以上公式1中,支撑层的其中固定有第一抗体的区域可以为约8cm宽且约2cm长。
在以上公式1中,20ng/mL至40ng/mL可以意指例如约20ng/mL、22ng/mL、24ng/mL、26ng/mL、28ng/mL、30ng/mL、32ng/mL、34ng/mL、36ng/mL、38ng/mL或约40ng/mL。
在以上公式1中,作为包含目标物质的溶液,可以使用磷酸盐缓冲盐水(PBS)。
在以上公式1中,在从接触目标物质时的时间到经过约50分钟至约70分钟时的任一时间,例如,从接触测试物质时的时间到经过约55分钟、约60分钟或约65分钟时的时间的反应之后,可以接触能够与目标物质结合并且结合有与TMB(3,3’,5,5’-四甲基联苯胺)反应的酶的第二抗体。
另一方面,为了除去包含未结合至第一抗体的目标物质的溶液,可以在接触第二抗体之前进行洗涤过程。洗涤过程没有特别限制,其中可以使用已知的洗涤溶液来洗涤。例如,作为洗涤溶液,可以使用PBS(磷酸盐缓冲盐水)-吐温。
在以上公式1中,能够与目标物质结合并且结合有与TMB(3,3’,5,5’-四甲基联苯胺)反应的酶的第二抗体没有特别限制,其中可以考虑待检测的目标物质来选择合适的抗体。具体地,可以选择具有能够与结合至第一抗体的目标物质结合的结合位点的抗体作为第二抗体。因此,第二抗体的结合位点可以通过与结合至第一抗体的目标物质反应来结合。另一方面,第二抗体可以以能够与结合至第一抗体的目标物质充分反应的量接触。例如,可以接触约100μL的包含1μg/mL的第二抗体的溶液。第二抗体的类型没有特别限制,其可以为例如IgE、IgD或IgG。
另一方面,作为结合至第二抗体的酶,可以使用已知的能够与TMB(3,3’,5,5’-四甲基联苯胺)反应的酶。例如,酶可以为辣根过氧化物酶(HRP)。
在以上公式1中,在从接触第二抗体时的时间到经过约50分钟至约70分钟时的任一时间,例如,从接触第二抗体时的时间到经过约55分钟、约60分钟或约65分钟时的时间的反应之后,可以接触TMB(3,3’,5,5’-四甲基联苯胺)。另一方面,TMB(3,3’,5,5’-四甲基联苯胺)可以以约100μL(0.1mg/mL)的量接触。
在以上公式1中,在吸光度的测量中,可以在从接触TMB(3,3’,5,5’-四甲基联苯胺)时的时间到经过10分钟至20分钟时的任一时间,例如,从接触TMB(3,3’,5,5’-四甲基联苯胺)时的时间到经过约12分钟、13分钟、14分钟、15分钟、16分钟、17分钟或18分钟时的时间的反应之后使用UV-Vis分光光度计来测量吸光度。
在以上公式1中,在另一个实例中,吸光度(Ab)可以为约0.16或更大、0.17或更大、或者约0.18或更大,并且上限没有特别限制,但可以为约0.3或更小、0.29或更小、0.28或更小、或者约0.27或更小。
在这样的范围内的吸光度意味着固定在第二抗体中的与TMB反应的酶的量高,这意味着结合至第一抗体的目标物质的量高。此外,这可以意味着固定在支撑层中的第一抗体具有高密度。因此,具有以上范围内的吸光度的生物传感器具有高的目标物质检测灵敏度。
作为一个实例,生物传感器的吸光度可以与在0.6ng/mL至1.0ng/mL范围内的目标物质浓度相关。具体地,当目标物质的浓度在0.6ng/mL至1.0ng/mL的范围内增加时,吸光度也增加。因此,本申请的生物传感器还可以定量地检测在这样的非常低的浓度范围内的目标物质。
作为一个实例,形成形成在基础材料的一侧上的支撑层的支撑层形成材料可以包括由下式1表示的化合物。
[式1]
A(R
在上式1中,在另一个实例中,R
在上式1中,在另一个实例中,R
在上式1中,p可以为0、1或2的整数。
在上式1中,r和q可以各自独立地为1、2或3的自然数。
在上式1中,p、q和r的总和满足4。即,满足p+q+r=4。
作为一个实例,由上式1表示的化合物的种类没有特别限制,但其可以为例如(4-氨基丁基)三乙氧基硅烷、(4-氨基丁基)三甲氧基硅烷、氨基苯基三乙氧基硅烷、氨基苯基三甲氧基硅烷、(3-氨基丙基)三甲氧基硅烷、(3-氨基丙基)三乙氧基硅烷或(3-氨基丙基)二甲基乙氧基硅烷。
当使用由上式1表示的化合物形成支撑层时,有利于在支撑层的一侧上形成自组装单层。
作为一个实例,形成在基础材料的一侧上的支撑层的密度可以为800个/μm
测量形成在基础材料的一侧上的支撑层的密度的方法没有特别限制,例如,可以通过利用EDC偶联使生物素结合至支撑层,并且利用其上结合有20nm金纳米颗粒的链霉亲和素和生物素的选择性吸附特性使用SEM来测量支撑层的吸附密度。
本申请还涉及用于制备生物传感器的方法。此外,作为用于本申请的用于制备生物传感器的方法的基础材料、用于形成支撑层的支撑层形成材料和固定在支撑层中的第一抗体,可以使用如上所述的基础材料、支撑层形成材料和第一抗体。
本申请的生物传感器制备方法包括:通过气相沉积法在基础材料的一侧上形成作为自组装单层的支撑层的第一步;以及在支撑层中固定第一抗体的第二步。
作为一个实例,在第一步中,在基础材料的一侧上形成作为自组装单层的支撑层的方法可以通过气相沉积法来进行。具体地,可以通过分子层沉积(MLD)在基础材料的一侧上形成支撑层。
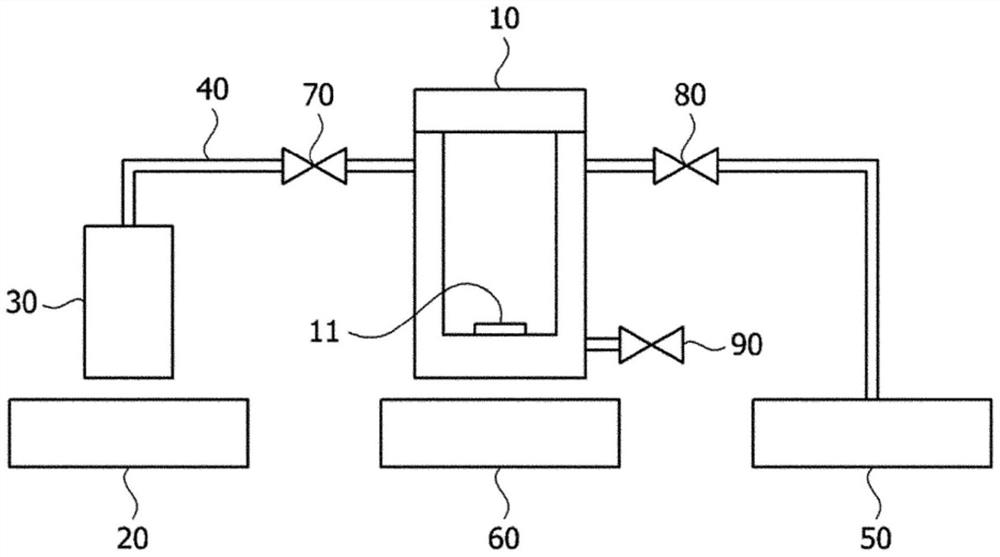
分子层沉积可以使用如图1中的分子层沉积设备1来进行。如图1中所示,分子层沉积设备1可以包括反应室10、反应槽30、用于连接反应室和反应槽的气体连接管道40、用于调节反应室压力的真空泵50、用于调节反应槽温度的第一热源20、用于调节反应室温度的第二热源60、设置在气体连接管道40中用于调节流入反应室10的蒸发的支撑层形成材料的流量的第一阀门70、设置在真空泵50中用于调节反应室10的压力的第二阀门80、以及用于将反应室10的压力调节至常压的第三阀门90。
首先,可以将基础材料安全地放置在分子层沉积设备1的反应室中,并且可以将支撑层形成材料装入反应槽中。
其后,可以通过设置在反应槽30中的第一热源20将反应槽30的温度调节至高于支撑层形成材料的沸点的温度,例如,可以将反应槽30的温度调节至50℃至500℃的温度范围。第一热源20没有特别限制,但作为一个实例可以为电加热器。第一热源20可以通过将反应槽30的温度调节至高于装入反应槽30中的支撑层形成材料的沸点的温度来使支撑层形成材料蒸发。可以通过气体连接管道40将蒸发的支撑层形成材料引入反应室10中。此时,第一阀门70可以调节该阀门的打开和关闭时间以调节蒸发的支撑层形成材料的流量。例如,可以通过将第一阀门打开约40秒至约80秒使得反应槽中的蒸发的支撑层形成材料通过气体连接管道被引入反应室中来调节蒸发的支撑层形成材料的流量。如果第一阀门的打开时间短,则可能不能在基础材料上沉积具有足够密度的支撑层,而如果打开时间长,则由于流入反应室中的蒸发的支撑层形成材料增多,可能浪费支撑层形成材料。
另一方面,可以通过设置在反应室中的第二热源60将反应室的温度调节至约40℃至约200℃的范围。第二热源60可以为与上述电加热器相同类型的电加热器。第二热源60用于在蒸发的支撑层形成材料在反应室10中沉积的同时为反应室10提供高温,其中考虑到支撑层形成材料的类型和支撑层的期望的吸附密度,可以在以上温度范围内适当地选择高温。另一方面,支撑层形成材料的沉积可以进行约10分钟至约60分钟。当沉积在以上范围内进行时,可以在基础材料上在不浪费时间同时具有高密度的情况下使支撑层有效地沉积为自组装单层。
反应室10的压力可以通过真空泵50和设置在真空泵中的第二阀门80来调节。当打开第二阀门时,可以向反应室10的内部施加负压。可以打开第二阀门80使得在基础材料11上沉积支撑层形成材料之前使反应室10的内部变为真空气氛。此外,可以在打开第一阀门并使蒸发的支撑层形成材料流入反应室10中的同时关闭第二阀门80。
此外,还可以通过第三阀门90来调节反应室10的压力。例如,可以关闭第三阀门90以将反应室10的内部保持在真空气氛。另一方面,当打开第三阀门90时,可以将反应室10的压力调节至常压。具体地,当将其上形成有支撑层的基础材料11从反应室10取出时,可以打开第三阀门90以将反应室10的压力调节至常压。如上所述,通过打开第三阀门90以将反应室10的压力调节至常压,可以将未沉积在基础材料11上而残留的支撑层形成材料从反应室10中有效地除去。
当通过如上的分子层沉积在基础材料的一侧上沉积支撑层时,可以沉积作为具有高密度的自组装单层的支撑层。因此,包括该支撑层的生物传感器可以改善目标物质的检测灵敏度。
在一个实例中,在第二步中在支撑层中固定第一抗体的方法中,可以经由连接中间物在支撑层中固定第一抗体。具体地,可以通过使连接中间物结合至支撑层,然后使第一抗体结合至所述连接中间物来在支撑层中固定第一抗体。
连接中间物没有特别限制,但作为一个实例可以为戊二醛1,4-丁二醇二缩水甘油醚、N,N’-二琥珀酰亚胺基碳酸酯或对亚苯基二异氰酸酯。
使连接中间物结合至支撑层的方法没有特别限制,其中可以通过已知的方法来使连接中间物结合。在一个实施方案中,可以通过与包含对亚苯基二异氰酸酯的溶液反应来使连接中间物结合至支撑层。
另一方面,使第一抗体结合至连接中间物的方法没有特别限制,其中可以通过已知的方法来附接第一抗体。在一个实施方案中,可以通过使包含第一抗体的溶液与其上形成有连接中间物的基础材料接触使得连接中间物与第一抗体反应来使第一抗体附接至连接中间物。
本申请还涉及用于检测目标物质的方法。本申请的用于检测目标物质的方法包括:使包含目标物质的测试对象物质、其中固定有与底物反应的酶的第二抗体和底物与生物传感器接触的第一步;以及测量与生物传感器接触的底物的变化的第二步。在一个实例中,作为生物传感器,可以使用上述生物传感器。因此,可以改善目标物质的检测灵敏度。即,还可以以高灵敏度检测痕量的目标物质。
作为一个实例,第一步中的包含目标物质的测试对象物质没有特别限制,其可以例如来源于人体。在一个实施方案中,测试对象物质可以为汗、血液、血清、血浆、脑脊液、唾液、泪、鼻腔排出物或尿等。这样的测试对象物质可以考虑测试对象物质中包含的目标物质的浓度来适当地选择。另一方面,目标物质可以意指作为能够结合至抗体的结合位点的材料的抗原。
作为一个实例,第一步中的其中固定有与底物反应的酶的第二抗体和底物可以与如上所述的第二抗体和底物相同。
作为一个实例,在第一步中,可以使包含目标物质的测试对象物质、其中固定有与底物反应的酶的第二抗体、和底物与生物传感器顺序地接触。具体地,可以使包含目标物质的测试对象物质与生物传感器接触,然后可以使其中固定有与底物反应的酶的第二抗体与该生物传感器接触,最后可以使底物与该生物传感器接触。
另一方面,在第一步中使包含目标物质的测试对象物质与生物传感器接触之后,可以包括洗涤生物传感器的洗涤过程。此外,在使其中固定有与底物反应的酶的第二抗体与该生物传感器接触之后,可以包括用于洗涤生物传感器的洗涤过程。通过这样的一系列洗涤过程,可以改善目标物质的检测准确度。
在第二步中测量底物的变化的方法没有特别限制,但是例如,可以通过光学方法来测量底物的变化。具体地,在使用与结合至第二抗体的酶反应以显色的色原作为底物的情况下,可以通过测量色原的吸光度来测量由固定在第二抗体中的酶引起的底物的变化。此外,吸光度的测量没有特别限制,但其可以使用已知的分光光度计来测量。
通过测量底物的变化,可以定量分析目标物质。具体地,可以通过测量根据目标物质的含量的吸光度(在下文中,可以称为“标准吸光度”)来构建数据。通过对所构建数据的标准吸光度与测试对象物质的吸光度进行比较,可以确定测试对象物质中包含的目标物质的含量。
有益效果
根据本申请的一个实例,提供了具有改善的目标物质检测灵敏度的生物传感器。此外,提供了用于制备具有改善的目标物质检测灵敏度的生物传感器的方法。此外,提供了用于使用该生物传感器检测目标物质的方法。
附图说明
图1是示出可以在用于制备生物传感器的方法中使用的示例性气相沉积设备的概念图。
图2是示出用于制造实施例的生物传感器的一系列过程的示例性概念图。
图3是示出使用通过实施例制备的生物传感器根据目标物质的浓度利用UV-Vis分光光度计测量的在最大吸收波长(约450nm的波长)处的吸光度的图。
图4是示出使用通过比较例制备的生物传感器根据目标物质的浓度利用UV-Vis分光光度计测量的在最大吸收波长(约450nm的波长)处的吸光度的图。
发明实施方式
在下文中,将参照实施例详细地描述本申请,但本申请的范围不受以下实施例限制。
将通过实施例和比较例制备的生物传感器用1%PBS和0.05%吐温20洗涤四次,用1%BSA(牛血清白蛋白)封闭1小时,然后洗涤四次。
其后,向其中添加约100μL的作为目标物质的IgE(NIBSC,11/234)(20ng/mL),反应1小时,然后洗涤四次,并向其中添加约100μL的作为第二抗体的其中固定有HRP(辣根过氧化物酶)的抗人IgE抗体(制造商:Goma Biotech,产品名:IgE,Anti-Human,HRP)(1μg/mL),反应1小时,然后洗涤四次。然后,向其中添加约100μL的作为底物的TMB(3,3’,5,5’-四甲基联苯胺)(0.1mg/mL),反应15分钟,然后向其中添加约100μL的2M H
其后,使用UV-Vis分光光度计(Agilent,Cary 8454)测量吸光度。
实施例
基础材料:使用玻璃基底(8cm×2cm)(Sewon Tech,钠钙玻璃)作为基础材料。
支撑层形成材料:使用(3-氨基丙基)三甲氧基硅烷(APTMS)(Sigma-Aldrich,281778)。
连接中间物:使用对亚苯基二异氰酸酯(Sigma-Aldrich,258555)。
第一抗体:使用抗人IgE抗体(ThermoFisher Scientific,A18797)。
在基础材料上形成支撑层:
将玻璃基底安全地放置在如图1中所示配置的气相沉积设备的反应室中,打开第二阀门以形成处于真空气氛的反应室,并使用第二热源使反应室的温度保持在约100℃。此外,将作为支撑层形成材料的(3-氨基丙基)三甲氧基硅烷(APTMS)装入反应槽中,然后通过使用第一热源将反应槽的温度加热至100℃来使APTMS蒸发。将第一阀门打开约60秒使得蒸发的APTMS流入反应室中,并再次关闭第一阀门,然后保持10分钟以在玻璃基底上沉积APTMS,从而形成作为自组装单层的支撑层。
打开第二阀门并使反应室的温度降低至室温。其后,关闭第二阀门并打开第三阀门以将反应室的压力转换为常压,然后从反应室中收集其上形成有支撑层的基础材料。
在支撑层中固定第一抗体:
将其上形成有支撑层的玻璃基底浸入0.2%对亚苯基二异氰酸酯溶液(在DMF/吡啶9:1中)中2小时。
其后,使约100μL的第一抗体(1μg/mL)反应1小时以将该抗体固定在支撑层中。
图2是示出用于制造实施例的生物传感器的一系列过程的示例性概念图。使用通过与以上相同的方法制备的实施例的生物传感器来测量吸光度。
比较例
使用与实施例1的那些相同的基础材料、支撑层形成材料和第一抗体。
在基础材料上形成支撑层:
使用玻璃基底的液相沉积法在玻璃基底上形成支撑层。具体地,将玻璃基底浸入包含1%的作为支撑层形成材料的(3-氨基丙基)三乙氧基硅烷(APTMS)的乙醇中约2小时以在基础材料上形成支撑层。其后,通过将其上形成有支撑层的基础材料用乙醇洗涤约10秒来收集其上形成有支撑层的基础材料。
在支撑层中固定第一抗体:
以与实施例中相同的方式将第一抗体固定在支撑层中。
使用以与以上相同的方法制备的比较例的生物传感器来测量吸光度。
图3是示出使用通过实施例制备的生物传感器根据目标物质的浓度利用UV-Vis分光光度计(路径长度:1cm)测量的在最大吸收波长(约450nm的波长)处的吸光度的图,图4是示出使用通过比较例制备的生物传感器根据目标物质的浓度利用UV-Vis分光光度计(路径长度:1cm)测量的在最大吸收波长(约450nm的波长)处的吸光度的图。
如图3和图4中所示,作为对实施例中制备的生物传感器的吸光度进行分析的结果,发现吸光度在20ng/mL的目标物质下高至约0.175。然而,作为对比较例中制备的生物传感器的吸光度进行分析的结果,发现吸光度在20ng/mL的目标物质下低至约0.08。由此可以确定,实施例中制备的生物传感器的检测灵敏度显著高于比较例中制备的生物传感器的检测灵敏度。
- 电化学生物传感器用修饰电极及其制备方法、电化学生物传感器及其制备方法和应用
- 利用自发光操纵子合成微生物自发光生物传感器的制备方法及其相应生物传感器和应用
