用于确定突触形成的方法和系统
文献发布时间:2023-06-19 11:21:00
相关专利申请的交叉引用
本申请要求于2018年10月9日提交的美国临时专利申请序列号62/743,153的优先权,该美国临时专利申请的内容全文以引用方式合并于本文。
技术领域
本公开的主题涉及用于确定突触形成,例如,与多特异性抗体诸如T细胞依赖性双特异性抗体的活性相关的突触形成的方法和系统。
背景技术
多特异性抗体(如双特异性抗体)是重要的研究工具、诊断工具以及作为疗法。这在很大程度上归因于这样一个事实:可以选择此类抗体从而以高特异性和亲和力与两种或更多种抗原或抗原上存在的两个或更多个表位结合。例如,对于癌症治疗剂而言,多特异性抗体可以用于靶向癌细胞,例如通过将癌细胞上存在的抗原与免疫细胞结合以触发免疫应答。另外,多特异性抗体可用作异二聚体受体的配体,当异二聚体受体的同源配体与之结合并促进受体组分之间的相互作用时,异二聚体受体通常由它们的同源配体活化。
用治疗性单克隆抗体(mAb)或抗体-药物偶联物(ADC)靶向肿瘤相关细胞表面抗原已被证明对血液学和实体瘤恶性肿瘤的治疗非常有效。这些分子通常依赖以下作用机制(MOA)中的一种或其组合来杀死肿瘤细胞:抗体依赖性细胞介导的细胞毒性(ADCC)、补体依赖性细胞毒性(CDC)、受体阻滞、或缀合细胞毒性药物的内化和细胞内释放。尽管MOA有所差异,但最大化/优化靶标参与以及考虑治疗分子的药代动力学特性已成为决定剂量/方案的重要驱动力。因此,需要用于最大化/优化用于治疗癌症的mAb和ADC的方法和系统。
作为多特异性抗体的子集,T细胞依赖性双特异性分子(例如,双特异性T细胞衔接剂(bispecific T cell engager,BiTE)和T细胞依赖性双特异性抗体(TDB))代表一类新兴且颇具前景的用于治疗癌症的治疗分子。博纳吐单抗(Blinatumomab,一种CD3xCD19BiTE),已被证明可有效治疗一种罕见形式的急性淋巴细胞白血病,并且最近获得了FDA的加速批准(Bargou,R.,E.Leo等人(2008)“Tumor regression in cancer patients byvery low doses of a T cell-engaging antibody.”Science 321:974-977)。多种新型的T细胞依赖性双特异性药物也处于临床开发阶段,并且已显示出颇具前景的初步结果。因此,需要用于开发和筛选用于治疗用途的新型多特异性分子的方法和系统。多种新型的T细胞依赖性双特异性药物也处于临床开发阶段,并且已显示出颇具前景的初步结果。(Budde,L E等人(2018)“Mosunetuzumab,a Full-Length Bispecific CD20/CD3 Antibody,Displays Clinical Activity in Relapsed/Refractory B-Cell Non-Hodgkin Lymphoma(NHL):Interim Safety and Efficacy Results from a Phase 1Study”,Blood 132:399)。
发明内容
本公开的主题提供了用于确定突触形成的方法和系统,例如,通过筛选多特异性抗体(诸如T细胞依赖性双特异性(TDB)抗体)。在某些实施例中,该方法涉及筛选能够诱导细胞突触形成的多特异性抗体,例如T细胞依赖性双特异性抗体。在某些实施例中,该方法包括(a)使与第一抗原和第二抗原结合的多特异性抗体与表达所述第一抗原的第一细胞和表达所述第二抗原的第二细胞接触,其中所述多特异性抗体与所述第一抗原和第二抗原一经结合,所述第一细胞与所述第二细胞之间即形成细胞突触;以及(b)测量细胞突触对所述第一细胞的活化,并且第一细胞的可检测活化指示所述多特异性抗体能够诱导细胞突触形成。
本公开的主题进一步提供检测细胞突触形成的方法。在某些实施例中,该方法包括(a)使与第一抗原和第二抗原结合的多特异性抗体与表达所述第一抗原的第一细胞和表达所述第二抗原的第二细胞接触,其中所述多特异性抗体与所述第一抗原和第二抗原一经结合,所述第一细胞与所述第二细胞之间即形成细胞突触;以及(b)测量细胞突触对所述第一细胞的活化,并且其中所述第一细胞的可检测活化指示细胞突触形成。
在某些实施例中,多特异性抗体为双特异性抗体。在某些实施例中,测量第一细胞的活化包括测量指示活化的生物标志物。在某些实施例中,生物标志物为细胞表面分子。在某些实施例中,生物标志物选自由CD62L、CD69、CD154及其组合组成的组。在某些实施例中,生物标志物为CD62L的表达。在某些实施例中,第一细胞为T细胞或T细胞衍生的细胞。在某些实施例中,第一细胞一经活化即具有不足的细胞溶解能力。在某些实施例中,第一细胞为Jurkat细胞。在某些实施例中,第一抗原为CD3。
在某些实施例中,第二抗原为肿瘤抗原。在某些实施例中,肿瘤抗原选自由以下项组成的组:HER2、LYPD1、LY6G6D、PMEL17、LY6E、EDAR、GFRA1、MRP4、RET、Steap1、TenB2、CD20、FcRH5、CD19、CD33、CD22、CD79A和CD79B。在某些实施例中,第二细胞为B细胞。在某些实施例中,肿瘤抗原选自由以下项组成的组:CD20、FcRH5、CD19、CD33、CD22、CD79A和CD79B。
在某些实施例中,测量第一细胞的活化包括检测报告子,第一细胞一经活化,所述报告子即被诱导。在某些实施例中,报告子为荧光分子或发光分子。
在某些实施例中,第一细胞与第二细胞的比率介于约1:10与约50:1之间。在某些实施例中,第一细胞与第二细胞的比率介于约1:10与约10:1之间。在某些实施例中,第二抗原在第二细胞上的平均表达为每个细胞至少约1,000个分子。在某些实施例中,第二抗原在第二细胞上的平均表达为每个细胞至少约100,000个分子。在某些实施例中,第一细胞与第二细胞之间的平均距离不大于约0.3mm。在某些实施例中,第一细胞与第二细胞之间的平均距离不大于约0.1mm。
本公开的主题还涉及用于确定细胞突触形成,例如,由与第一抗原和第二抗原结合的多特异性抗体诱导的细胞突触形成的试剂盒,其中第一抗原由第一细胞表达且第二抗原由第二细胞表达。在某些实施例中,本公开的试剂盒包括(a)表达第一抗原的第一细胞;(b)表达第二抗原的第二细胞;以及(c)用于测量第一细胞的活化的工具。在某些实施例中,多特异性抗体与第一抗原和第二抗原一经结合,第一细胞与第二细胞之间即形成细胞突触。在某些实施例中,细胞突触形成活化第一细胞。
本公开的主题进一步提供用于确定细胞突触形成的系统,其中该系统包括:(a)表达第一抗原的第一细胞;(b)表达第二抗原的第二细胞;以及(c)用于测量第一细胞的活化的工具。
附图说明
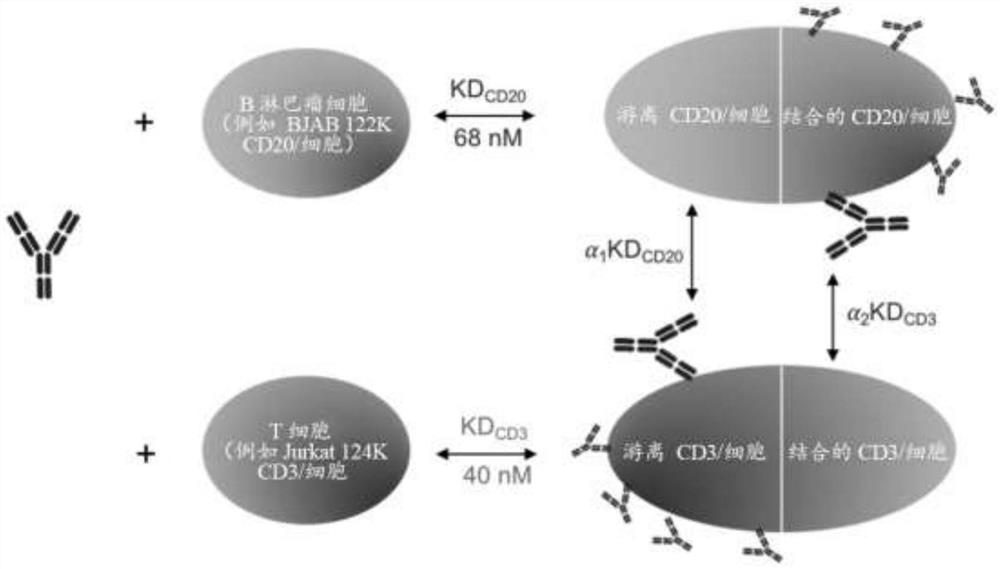
图1描绘了细胞突触模型的结构,其描述T细胞依赖性双特异性抗体(TDB)与B淋巴瘤细胞和T细胞的结合,以及细胞突触的形成。
图2A至图2B描绘了CD69和CD62L作为T细胞活化的生物标志物的用途。图2A描绘了与BJAB B细胞孵育的Jurkat T细胞和针对CD69和CD62L表达染色的CD20/CD3 TDB。图2B描绘了具有增加的CD69或减少的CD62L的T细胞的百分比用于计算与TDB浓度相反的T细胞活化%。误差线表示SEM。
图3A至图3B描绘了T细胞活化的检测。图3A描绘了将Jurkat T细胞与BJAB B细胞和CD20/CD3 TDB在24小时的时程中孵育。计算并标绘通过CD69增加或C62L减少标记的活化百分比。图3B描绘了将Jurkat T细胞用BJAB B细胞和CD20/CD3 TDB浓度滴定在4小时的时程中孵育。CD62L表达的减少用于计算T细胞活化的百分比。将T细胞活化与TDB浓度相对绘制。误差线表示SEM。
图4描绘了CD4和CD8 T细胞活化的检测。将人PMBC用CD20/CD3 TDB孵育4小时。计算并标绘通过C62L降低测量的CD4和CD8 T细胞活化的百分比。误差线表示SEM。
图5描绘了预测的细胞突触与观察到的细胞突触。黑色圆圈代表在各种效应细胞:靶(E:T)细胞比率和CD20/CD3 TDB浓度下观察到的细胞突触百分比(具有CD62L T细胞活化标志物的T细胞数目标准化为T细胞总数)。灰色圆圈代表模型预测的细胞突触百分比。
图6描绘了当B细胞具有较高的抗原CD20表达水平时,T细胞更可能被活化。B细胞R为CD20,在测试样品中,表达水平为每个细胞1,200、每个细胞1,400或每个细胞122,000。
图7描绘了1μL中500个T细胞和500个B细胞的模拟。
图8描绘了T细胞与B细胞之间的细胞内距离的模拟。
图9描绘了在B细胞抗原表达(每个细胞1,200个、每个细胞1,400个或每个细胞122,000个)以及T细胞与B细胞之间的细胞内距离(距离(Dx)为从0.04mm至0.30mm)不同的条件下的T细胞活化。
具体实施方式
1.定义
本文的术语“抗体”以最广泛的含义使用,并且包含各种抗体结构,其包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体和TDB抗体)以及抗体片段,只要它们表现出所需的抗原结合活性。
“抗体片段”是指除了完整抗体以外的分子,其包含完整抗体的一部分且结合完整抗体结合的抗原。抗体片段的示例包括但不限于Fv、Fab、Fab'、Fab'-SH、F(ab')
术语“全长抗体”、“完整抗体”及“全抗体”在本文中可互换地用于指代具有基本上类似于天然抗体结构的结构或具有含有如本文所定义的Fc区的重链的抗体。
“天然抗体”是指具有不同结构的天然存在的免疫球蛋白分子。例如,天然IgG抗体是约150,000道尔顿的异四聚体糖蛋白,由经二硫键合的两条相同轻链和两条相同重链组成。从N末端到C末端,每条重链具有可变区(VH)(也称为可变重结构域或重链可变结构域),后接三个恒定结构域(C
抗体的“类别”是指抗体的重链所具有的恒定结构域或恒定区的类型。存在五大类抗体:IgA、IgD、IgE、IgG和IgM,及它们中的一些可以进一步分为亚类(同种型),例如,IgG
“分离的”抗体或抗体片段为已从其自然环境的组分中分离的抗体或抗体片段。通过例如,电泳(例如,SDS-PAGE、等电点聚焦(isoelectric focusing,IEF)、毛细管电泳)或色谱(例如,离子交换或反相HPLC)测定,可将抗体或抗体片段可纯化至大于95%或99%的纯度。关于评定抗体纯度的方法的综述,请参见例如Flatman等人,J.Chromatogr.B 848:79-87(2007)。
如本文所用,术语“表位”是指能够与抗体特异性结合的蛋白质决定簇。表位通常由分子的化学活性表面聚组(grouping)组成,诸如氨基酸或糖侧链,并且通常具有特定的三维结构特征以及特定的电荷特征。构象性和非构象性表位的区别在于,在存在变性溶剂的情况下丧失与前者的结合而不是与后者的结合。
“分离的”核酸是指已从其天然环境的组分中分开的核酸分子。分离的核酸包括这样的核酸分子,其包含在通常含有所述核酸分子的细胞中,但所述核酸分子存在于染色体外或与其天然染色体位置不同的染色体位置处。
如本文所用,术语“载体”(vector)是指能够载运与其相连接的另一核酸的核酸分子。该术语包括作为自我复制核酸结构的载体,以及整合入其已被引入的宿主细胞的基因组中的载体。某些载体能够指导与其可操作链接的核酸的表达。此类载体在本文中称为“表达载体”。
术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用,并且是指已引入外源核酸的细胞,其包括此类细胞的子代。宿主细胞包括“转化体”和“转化细胞”,其包括原代转化细胞和来源于所述原代转化细胞的子代,不考虑传代次数。子代可能与亲本细胞的核酸内容物完全一致,或者可能含有突变。本文包括如在原始转化细胞中筛选或选择的具有相同功能或生物活性的突变子代。
“个体”或“受试者”是哺乳动物。哺乳动物包括但不限于驯养的动物(例如,牛、绵羊、猫、犬和马)、灵长类动物(例如,人和非人灵长类动物,诸如猴)、兔以及啮齿类动物(例如,小鼠和大鼠)。在某些实施例中,该个体或受试者为人。
如本文所用,术语“约”或“大致”是指在如本领域普通技术人员所确定的特定值的可接受误差范围内,所述可接受误差范围将部分地取决于如何测量或确定该值,即测量系统的局限性。例如,按照本领域中的实践,“约”可以意指3个之内或多于3个标准偏差。可替代地,“约”可以意指给定值的至多20%,优选地至多10%,更优选地至多5%,并且更优选地还是至多1%的范围。可替代地,特别是关于生物学系统或过程,该术语可以意指在某一值的某一数量级内,优选地在5倍以内,更优选地在2倍以内。
如本文所述,任何浓度范围、百分比范围、比率范围或整数范围应理解为包括所述范围内的任何整数的值,以及适当情况下,包括其分数(诸如整数的十分之一和百分之一),除非另有说明。
2.抗体
本公开的主题提供可以通过本文公开的筛选方法评估的多特异性抗体,例如双特异性抗体和TDB抗体。本公开的多特异性抗体,例如双特异性抗体,具有至少两种不同的结合特异性。参见,例如,美国专利号5,922,845和5,837,243;Zeilder(1999)J.Immunol.163:1246-1252;Somasundaram(1999)Hum.Antibodies 9:47-54;Keler(1997)Cancer Res.57:4008-4014。在某些实施例中,本公开涵盖的多特异性抗体可以与单一抗原上的至少两个不同表位结合或与抗原上重叠的至少两个表位结合,例如双表位抗体。可替代地,在某些实施例中,本公开的多特异性抗体可以与至少两种不同的抗原结合。本公开的多特异性抗体可以为激动性抗体或拮抗性抗体。
在某些实施例中,本文公开的多特异性抗体的至少一个抗原结合结构域与一个或多个肿瘤抗原结合。任何肿瘤抗原均可以用于本文所述的肿瘤相关的实施例中。抗原可以,例如表达为肽或表达为完整蛋白质或其部分。完整蛋白质或其一部分可以是天然的或诱变的。肿瘤抗原的非限制性示例包括HER2、LYPD1、LY6G6D、PMEL17、LY6E、EDAR、GFRA1、MRP4、RET、Steap1、TenB2、CD20、FcRH5、CD19、CD33、CD22、CD79A和CD79B。在某些实施例中,肿瘤抗原包含在B细胞淋巴瘤中。在某些实施例中,肿瘤抗原为CD20、FcRH5、CD19、CD33、CD22、CD79A和CD79B。
在某些实施例中,多特异性抗体的至少一个抗原结合结构域与细胞上表达的一种或多种蛋白质结合,其中该结合活化所述细胞。在某些实施例中,细胞为T细胞或T细胞衍生的细胞。在某些实施例中,多特异性抗体与T细胞或T细胞衍生的细胞的受体结合,其中该结合可以活化所述细胞。在某些实施例中,多特异性抗体与CD3结合。
在某些实施例中,多特异性抗体与第一抗原和第二抗原结合,其中多特异性抗体与第一抗原和第二抗原的结合活化所述细胞。在某些实施例中,第一抗原为肿瘤抗原。在某些实施例中,第一抗原为CD3并且第二抗原为CD20。在某些实施例中,多特异性抗体为国际公开号WO2015/095392中公开的双特异性抗体,该文献通过引用整体并入本文。
在某些实施例中,本公开的多特异性抗体,例如双特异性抗体和/或TDB抗体,包含一种或多种抗原结合多肽。例如但不作为限制,本公开的多特异性抗体可以包括第一抗原结合多肽和第二抗原结合多肽。在某些实施例中,第一抗原结合多肽和第二抗原结合多肽具有不同的结合特异性。在某些实施例中,第一抗原结合多肽可以与第一抗原结合,并且第二抗原结合多肽可以与第二抗原结合。
在某些实施例中,例如,在本公开的多特异性抗体包含第一抗原结合多肽和第二抗原结合多肽的情况下,第一抗原结合多肽和第二抗原结合多肽可以通过一个或多个二硫键相互作用。例如但不作为限制,在某些实施例中,第一抗原结合多肽和第二抗原结合多肽的铰链区可以通过一个或多个二硫键相互作用,例如通过两个二硫键。
在某些实施例中,如本文所公开的,多特异性(例如双特异性)抗体在抗体的每个抗原结合多肽内包括异源二聚化结构域。在某些实施例中,可以改变公开的多特异性抗体的第一抗原结合多肽和第二抗原结合多肽的CH3结构域以促进第一抗原结合多肽和第二抗原结合多肽的异源二聚化。例如但不作为限制,第一抗原结合多肽和/或第二抗原结合多肽可使用杵臼结构(knob-in-hole)技术包括一个或多个异源二聚化结构域(参见,例如,美国专利号5,731,168和8,216,805,其通过引用整体并入本文)以促进第一抗原结合多肽和第二抗原结合多肽之间的缔合和/或相互作用。
在某些实施例中,本公开的多特异性抗体不包括轻链恒定结构域(CL)。可替代地,本文公开的多特异性抗体可包括一个或多个CL结构域。本公开的主题进一步提供拮抗性抗体和激动性抗体。
在某些实施例中,本文提供的抗体为抗体片段。抗体片段包括但不限于F(ab')
双抗体是具有两个抗原结合位点的抗体片段,其可以是二价或双特异性的。参见例如,EP专利申请号404,097;PCT申请号WO 1993/01161;Hudson等人,Nat.Med.9:129-134(2003);以及Hollinger等人,Proc.Natl.Acad.Sci.USA 90:6444-6448(1993)。三抗体和四抗体也在Hudson等人,Nat.Med.9:129-134(2003)中进行了描述。
抗体片段的其他非限制性示例包括Fab、Fab'、Fab'-SH、Fv和scFv片段。单结构域抗体是包含抗体的全部或部分重链可变结构域或全部或部分轻链可变结构域的抗体片段。在某些实施例中,单结构域抗体为人单结构域抗体(Domantis,Inc.,Waltham,MA;参见例如美国专利号6,248,516B1)。
关于对包含补救受体结合表位残基并具有增加的体内半衰期的Fab和F(ab')
在某些实施例中,本文提供的多特异性抗体和双特异性抗体为嵌合抗体。某些嵌合抗体在例如美国专利号4,816,567;以及Morrison等人,Proc.Natl.Acad.Sci.USA,81:6851-6855(1984))中描述。在一个实例中,嵌合抗体包含非人可变区(例如,来源于小鼠、大鼠、仓鼠、兔或非人灵长类动物,例如猴的可变区)和人恒定区。在某些实施例中,嵌合抗体可以是“类别转换”抗体,其中类别或亚类已经从亲本抗体的类别或亚类改变。嵌合抗体包括其抗原结合片段。
在某些实施例中,嵌合抗体为人源化抗体。可以将非人抗体进行人源化以减少对人类的免疫原性,同时保留亲本非人抗体的特异性和亲和力。人源化抗体可包括一个或多个可变结构域,其中高变区(HVR)例如CDR或其部分来源于非人抗体;并且FR或其部分来源于人抗体序列。人源化抗体还可以任选地包括人恒定区的至少一部分。在某些实施例中,人源化抗体中的一些FR残基被来自非人抗体(例如,作为HVR残基来源的抗体)的相应残基取代,例如以恢复或改善抗体特异性或亲和力。
人源化抗体及其制备方法在例如Almagro和Fransson,Front.Biosci.13:1619-1633(2008)中综述,并且进一步描述于例如Riechmann等人,Nature 332:323-329(1988);Queen等人,Proc.Nat’l Acad.Sci.USA86:10029-10033(1989);美国专利号5,821,337、7,527,791、6,982,321和7,087,409;Kashmiri等人,Methods 36:25-34(2005)(描述了特异性决定区(SDR)移植);Padlan,Mol.Immunol.28:489-498(1991)(描述了“表面再塑”);Dall'Acqua等人,Methods 36:43-60(2005)(描述了“FR改组”);以及Osbourn等人,Methods 36:61-68(2005)以及Klimka等人,Br.J.Cancer,83:252-260(2000)(描述了用于FR改组的“指导选择”方法)中。
可以用于人源化的人框架区包括但不限于:使用“最佳配合”方法选择的框架区(参见例如Sims等人J.Immunol.151:2296(1993));来源于具有轻链或重链可变区的特定子组的人抗体的共有序列的框架区(参见例如Carter等人,Proc.Natl.Acad.Sci.USA,89:4285(1992);以及Presta等人J.Immunol.,151:2623(1993));人成熟(体细胞突变)框架区或人种系框架区(参见例如Almagro和Fransson,Front.Biosci.13:1619-1633(2008));以及来源于筛选FR文库的框架区(参见例如Baca等人,J.Biol.Chem.272:10678-10684(1997)及Rosok等人,J.Biol.Chem.271:22611-22618(1996))。
在某些实施例中,本文提供的多特异性抗体为人抗体。可以使用本领域已知的各种技术来产生人抗体。人抗体一般描述于van Dijk和van de Winkel,Curr.Opin.Pharmacol.5:368-74(2001)及Lonberg,Curr.Opin.Immunol.20:450-459(2008)中。
可以通过以下方式来制备人抗体:将免疫原施用于转基因动物,所述转基因动物已被改进以应答于抗原激发而产生具有人可变区的完整人抗体或完整抗体。此类动物通常含有全部或部分人免疫球蛋白基因座,所述全部或部分人免疫球蛋白基因座替代内源性免疫球蛋白基因座,或者在动物的染色体外存在或随机整合至动物的染色体中。在此类转基因小鼠中,内源性免疫球蛋白基因座通常已被灭活。关于从转基因动物获得人抗体的方法的综述,参见Lonberg,Nat.Biotech.23:1117-1125(2005)。另参见例如描述XENOMOUSE
在某些实施例中,人抗体也可以通过基于杂交瘤的方法制备。已经描述了用于产生人单克隆抗体的人骨髓瘤和小鼠-人杂交骨髓瘤细胞系。(参见例如Kozbor J.Immunol.,133:3001(1984);Brodeur等人,Monoclonal Antibody Production Techniques andApplications,第51-63页(Marcel Dekker,Inc.,New York,1987);以及Boerner等人,J.Immunol.,147:86(1991)。)经由人B细胞杂交瘤技术产生的人抗体也描述于Li等人,Proc.Natl.Acad.Sci.USA,103:3557-3562(2006)中。另外的方法包括例如在美国专利号7,189,826(描述了从杂交瘤细胞系产生单克隆人IgM抗体)和Ni,Xiandai Mianyixue,26(4):265-268(2006)(描述了人-人杂交瘤)中描述的那些方法。人类杂交瘤技术(Trioma技术)也描述于Vollmers和Brandlein,Histology and Histopathology,20(3):927-937(2005)和Vollmers和Brandlein,Methods and Findings in Experimental and ClinicalPharmacology,27(3):185-91(2005)中。
在某些实施例中,人抗体还可通过分离选自人源噬菌体展示文库的Fv克隆可变域序列来产生。然后可以将此类可变域序列与所需的人恒定结构域结合。下文描述了从抗体文库选择人抗体的技术。
本公开的主题还提供免疫缀合物,其包括与一种或多种细胞毒性剂缀合的本文公开的多特异性抗体(例如,双特异性抗体),所述一种或多种细胞毒性剂为诸如化学治疗剂或药物、生长抑制剂、蛋白质、肽、毒素(例如细菌、真菌、植物或动物来源的蛋白质毒素、酶促活性毒素,或它们的片段),或放射性同位素。例如,所公开主题的抗体或抗原结合部分可以功能性地连接(例如,通过化学偶联、基因融合、非共价缔合或其他方式)至一个或多个其他结合分子,诸如另一种抗体、抗体片段、肽或结合模拟物。
3.用于筛选抗体的方法和系统
可以鉴定、筛选本公开主题的多特异性抗体,或者通过本文提供的方法和系统表征其物理/化学性质和/或生物学活性。
例如,T细胞依赖性多特异性抗体可以活化效应T细胞并靶向其针对靶肿瘤细胞的细胞溶解活性。T细胞依赖性多特异性抗体(例如TDB抗体)的作用机制取决于细胞突触的形成。因此,在某些实施例中,可以基于检测抗体诱导细胞突触形成的能力的系统和/或方法来选择此类多特异性抗体。
在某些实施例中,筛选方法包括:(a)使与第一抗原和第二抗原结合的多特异性抗体与表达所述第一抗原的第一细胞(例如,效应细胞)和表达所述第二抗原的第二细胞(例如,靶细胞)接触,其中所述多特异性抗体与所述第一抗原和第二抗原一经结合,所述第一细胞和所述第二细胞之间即形成细胞突触;以及(b)测量细胞突触对所述第一细胞的活化,其中第一细胞的可检测活化指示所述多特异性抗体能够诱导细胞突触形成。在某些实施例中,多特异性抗体为双特异性抗体。
在某些实施例中,第一细胞(例如,效应细胞)为T细胞或T细胞衍生的细胞。T细胞的非限制性示例包括辅助T细胞、细胞毒性T细胞、记忆T细胞(包括中枢记忆T细胞、干细胞样记忆T细胞(或类干记忆T细胞)以及两种类型的效应记忆T细胞:例如T
在某些实施例中,对第一细胞进行改造,以使其一经活化即存在细胞溶解不足。此类工程改造的非限制性示例包括但不限于缺失或破坏涉及细胞溶解活性的一种或多种基因,例如穿孔素和颗粒酶、任何抗肿瘤细胞因子(例如IL-2、IFNγ和TNFα)及/或用于表达这些基因所需的一种或多种基因。在某些实施例中,第一细胞为永生化细胞。在某些实施例中,第一细胞为Jurkat细胞。
在某些实施例中,第一细胞表达第一抗原。在某些实施例中,多特异性抗体与第一抗原的结合能够活化第一细胞。在某些实施例中,抗原为受体。在某些实施例中,抗原在生物复合物中。例如但不作为限制,受体存在于生物复合物内,例如,在与一种或多种共受体(co-receptor)和/或蛋白质的复合物中。在某些实施例中,第一抗原为CD3受体的组分。
在某些实施例中,测量第一细胞的活化包括测量指示活化的生物标志物。在某些实施例中,生物标志物为细胞表面分子,第一细胞一经活化,该生物标志物的数量即会改变。细胞表面分子的变化可以通过本领域已知的和本文公开的任何测定法来确定。例如但不作为限制,可以通过酶联免疫吸附测定(ELISA)或通过流式细胞术,例如使用靶向细胞表面分子的抗体的荧光活化细胞分选(FACS),来测量细胞表面分子。在某些实施例中,生物标志物选自由CD62L、CD69及其组合组成的组。在某些实施例中,生物标志物为CD62L的表达。
在某些实施例中,第二细胞(例如靶细胞)为肿瘤细胞或表达肿瘤抗原的细胞。在某些实施例中,第二抗原为肿瘤抗原。在某些实施例中,肿瘤抗原选自由以下项组成的组:HER2、LYPD1、LY6G6D、PMEL17、LY6E、EDAR、GFRA1、MRP4、RET、Steap1、TenB2、CD20、FcRH5、CD19、CD33、CD22、CD79A和CD79B。在某些实施例中,第二抗原对第二细胞具有内源性。在某些实施例中,第二细胞为B细胞。在某些实施例中,肿瘤抗原选自由以下项组成的组:CD20、FcRH5、CD19、CD33、CD22、CD79A和CD79B。
细胞的遗传修饰(例如,第一细胞和/或第二细胞的修饰)可以通过用重组DNA构建体转导基本同质的细胞组分来完成。在某些实施例中,逆转录病毒载体(γ逆转录病毒或慢病毒)用于将DNA构建体引入细胞中。例如,可以将编码抗原识别受体的多核苷酸克隆到逆转录病毒载体中,并且可以从其内源启动子、从逆转录病毒长末端重复序列或从对受关注靶细胞类型具有特异性的启动子驱动表达。也可以使用非病毒载体。
在某些实施例中,可以通过分析信号传导途径是否与第一细胞的活化相关来确定第一细胞的活化。在某些实施例中,测量第一细胞的活化包括检测报告子,第一细胞一经活化,所述报告子即被诱导。例如但不作为限制,可以通过使用基于体外报告子的测定法(例如荧光素酶测定法)来确定所述活化,其中第一抗原(例如受体)的活化导致报告子(例如荧光素酶)或荧光蛋白(例如GFP或RFP)的表达。在某些实施例中,报告子由包含启动子的构建体表达,第一细胞一经活化即会活化该启动子。启动子的非限制性示例包括CD69启动子和IL-2启动子。
在某些实施例中,细胞突触的形成和/或第一细胞的活化受第一细胞与第二细胞之间的比率影响。在某些实施例中,第一细胞与第二细胞的比率介于约1:1000与约1000:1之间、介于约1:500与约500:1之间、介于约1:200与约200:1之间、介于约1:100与约100:1之间、介于约1:50与约50:1之间、介于约1:40与约40:1之间、介于约1:30与约30:1之间、介于约1:20与约20:1之间、介于约1:10与约10:1之间、介于约1:5与约5:1之间、介于约1:4与约4:1之间、介于约1:3与约3:1之间、或介于约1:2与约2:1之间。在某些实施例中,第一细胞与第二细胞的比率介于约1:10与约50:1之间。在某些实施例中,第一细胞与第二细胞的比率介于约1:10与约10:1之间。在某些实施例中,第一细胞与第二细胞的比率为约1:1000、约1:500、约1:400、约1:300、约1:200、约1:100、约1:50、约1:40、约1:30、约1:20、约1:10、约1:9、约1:8、约1:7、约1:6、约1:5、约1:3、约1:2、约1:1、约2:1、约3:1、约4:1、约5:1、约6:1、约7:1、约8:1、约9:1、约10:1、约20:1、约30:1、约40:1、约50:1、约100:1、约200:1、约300:1、约400:1、约500:1、或约1000:1。
在某些实施例中,细胞突触的形成和/或第一细胞的活化受第二抗原在第二细胞上的表达影响。在某些实施例中,第二抗原在第二细胞上的平均表达为每个细胞至少约10个分子、每个细胞至少约100个分子、每个细胞至少约1,000个分子、每个细胞至少约2,000个分子、每个细胞至少约3,000个分子、每个细胞至少约4,000个分子、每个细胞至少约5,000个分子、每个细胞至少约6,000个分子、每个细胞至少约7,000个分子、每个细胞至少约8,000个分子、每个细胞至少约9,000个分子、每个细胞至少约10,000个分子、每个细胞至少约15,000个分子、每个细胞至少约20,000个分子、每个细胞至少约30,000个分子、每个细胞至少约40,000个分子、每个细胞至少约50,000个分子、每个细胞至少约60,000个分子、每个细胞至少约70,000个分子、每个细胞至少约80,000个分子、每个细胞至少约90,000个分子、每个细胞至少约100,000个分子、每个细胞至少约110,000个分子、每个细胞至少约120,000个分子、每个细胞至少约130,000个分子、每个细胞至少约140,000个分子、每个细胞至少约150,000个分子、每个细胞至少约160,000个分子、每个细胞至少约170,000个分子、每个细胞至少约180,000个分子、每个细胞至少约190,000个分子、每个细胞至少约200,000个分子、每个细胞至少约300,000个分子、每个细胞至少约400,000个分子、每个细胞至少约30,000个分子、每个细胞至少约500,000个分子、或者每个细胞至少约1000,000个分子。在某些实施例中,第二抗原在第二细胞上的平均表达为每个细胞介于约10个至约100个分子之间、每个细胞介于约100个至约1,000个分子之间、每个细胞介于约100个至约10,000个分子之间、每个细胞介于约1,000个至约100,000个分子之间、每个细胞介于约1,000个至约200,000个分子之间、每个细胞介于约1000个至约300,00个分子之间、每个细胞介于约10,000个至约100,000个分子之间、每个细胞介于约10,000个至约200,000个分子之间、或每个细胞介于约10,000个至约500,000个分子之间。
在某些实施例中,细胞突触的形成和/或第一细胞的活化受第一细胞与第二细胞的密度或它们之间的平均距离影响。
细胞内距离可以通过本领域已知的任何方法来确定。例如,计算第一细胞与第二细胞之间的距离的方法可以包括:使用软件以随机x、y、z坐标模拟大小为例如1μL(1mm
4.系统和试剂盒。
本公开的主题进一步涉及系统和试剂盒。在某些实施例中,本文公开的系统/试剂盒可用于确定与第一抗原和第二抗原结合的多特异性抗体的细胞突触形成。在某些实施例中,系统/试剂盒包括(a)表达第一抗原的第一细胞;(b)表达第二抗原的第二细胞;以及(c)用于测量第一细胞的活化的工具。在某些实施例中,多特异性抗体与第一抗原和第二抗原一经结合,第一细胞与第二细胞之间即形成细胞突触。在某些实施例中,细胞突触形成活化第一细胞。
在某些实施例中,系统/试剂盒包括容器以及在容器上或与容器相关的标签或包装插页。容器可以由多种材料形成,诸如玻璃或塑料。容器可以容纳组合物本身或与其他组合物组合。
如果需要,可以将系统/试剂盒与本文公开的任何方法的说明书一起提供。所述说明书通常可以包括关于组合物用于执行所述方法的用途的信息。所述说明书可以直接打印在容器上(如果有的话),或者作为粘贴在容器上的标签,或者作为单独的纸页、小册子、卡片或在容器中或与容器一起提供的文件夹。
以下实例仅是对当前公开的主题的说明,而不应以任何方式视为限制。
5.示例性非限制性实施例。
A.一种检测细胞突触形成的方法,其包括:使能够与第一抗原和第二抗原结合的多特异性抗体与表达第一抗原的第一细胞和表达第二抗原的第二细胞接触,其中多特异性抗体与第一抗原和第二抗原一经结合,第一细胞与第二细胞之间即形成细胞突触;以及测量第一细胞的活化,其中第一细胞的活化指示细胞突触形成。
A1.一种确定能够诱导细胞突触形成的多特异性抗体的活性的方法,该方法包括:使与第一抗原和第二抗原结合的多特异性抗体与表达第一抗原的第一细胞和表达第二抗原的第二细胞接触,其中多特异性抗体与第一抗原和第二抗原一经结合,第一细胞和第二细胞之间即形成细胞突触;以及测量细胞突触对第一细胞的活化,其中第一细胞的可检测活化指示多特异性抗体能够诱导细胞突触形成。
A2.根据A或A1所述的方法,其中测量所述第一细胞的活化包括测量指示活化的至少一种生物标志物。
A3.根据A2所述的方法,其中所述至少一种生物标志物为细胞表面分子。
A4.根据A3所述的方法,其中所述至少一种生物标志物选自由CD62L、CD69及其组合组成的组。
A5.根据A4所述的方法,其中所述至少一种生物标志物为CD62L的表达。
A6.根据A至A5中任一项所述的方法,其中所述第一抗原为CD3。
A7.根据A至A6中任一项所述的方法,其中所述第一细胞为T细胞或T细胞衍生的细胞。
A8.根据A7所述的方法,其中所述第一细胞一经活化即存在细胞溶解不足。
A9.根据A8所述的方法,其中所述第一细胞为Jurkat细胞。
A10.根据A-A9中任一项所述的方法,其中所述第二抗原为肿瘤抗原。
A11.根据A10所述的方法,其中所述肿瘤抗原选自由以下项组成的组:HER2、LYPD1、LY6G6D、PMEL17、LY6E、EDAR、GFRA1、MRP4、RET、Steap1、TenB2、CD20、FcRH5、CD19、CD33、CD22、CD79A和CD79B。
A12.根据A-A11中任一项所述的方法,其中所述第二细胞为B细胞。
A13.根据A12所述的方法,其中所述肿瘤抗原选自由以下项组成的组:CD20、FcRH5、CD19、CD33、CD22、CD79A和CD79B。
A14.根据A、A1和A6至A13中任一项所述的方法,其中测量所述第一细胞的活化包括检测报告子,第一细胞一经活化,所述报告子即被诱导。
A15.根据A14所述的方法,其中所述报告子为荧光分子或发光分子。
A16.根据A至A15中任一项所述的方法,其中所述第一细胞与所述第二细胞的比率介于约1:10与约50:1之间。
A17.根据A16所述的方法,其中所述第一细胞与所述第二细胞的比率介于约1:10与约10:1之间。
A18.根据A至A17中任一项所述的方法,其中所述第二抗原在所述第二细胞上的平均表达为每个细胞至少约1,000个分子。
A19.根据A18所述的方法,其中所述第二抗原在所述第二细胞上的平均表达为每个细胞至少约10,000个分子。
A20.根据A至A19中任一项所述的方法,其中所述第一细胞与所述第二细胞之间的平均距离不大于约0.3mm。
A21.根据A20所述的方法,其中所述第一细胞与所述第二细胞之间的平均距离不大于约0.1mm。
A22.根据A至A21中任一项所述的方法,其中所述多特异性抗体为双特异性抗体。
B.一种用于确定与第一抗原和第二抗原结合的多特异性抗体的细胞突触形成的试剂盒,其包括:表达第一抗原的第一细胞;表达第二抗原的第二细胞;以及用于测量第一细胞的活化的工具。
B1.根据B所述的试剂盒,其中所述双特异性抗体与所述第一抗原和所述第二抗原一经结合,所述第一细胞与所述第二细胞之间即形成细胞突触。
B2.根据B1所述的试剂盒,其中所述细胞突触形成活化所述第一细胞。
B3.根据B至B2中任一项所述的试剂盒,其中所述用于测量第一细胞的活化的工具包括测量指示活化的至少一种生物标志物。
B4.根据B3所述的试剂盒,其中所述至少一种生物标志物为细胞表面分子。
B5.根据B4所述的试剂盒,其中所述至少一种生物标志物选自由CD62L、CD69及其组合的表达所组成的组。
B6.根据B5所述的试剂盒,其中所述至少一种生物标志物包括CD62L的表达。
B7.根据B至B5中任一项所述的试剂盒,其中所述第一抗原为CD3。
B8.根据B至B5中任一项所述的试剂盒,其中所述第一细胞为T细胞或T细胞衍生的细胞。
B9.根据B8所述的试剂盒,其中所述第一细胞一经活化即存在细胞溶解不足。
B10.根据B9所述的试剂盒,其中所述第一细胞为Jurkat细胞。
B11.根据B至B9中任一项所述的试剂盒,其中所述第二抗原为肿瘤抗原。
B12.根据B11所述的试剂盒,其中所述肿瘤抗原选自由以下项组成的组:HER2、LYPD1、LY6G6D、PMEL17、LY6E、EDAR、GFRA1、MRP4、RET、Steap1、TenB2、CD20、FcRH5、CD19、CD33、CD22、CD79A和CD79B。
B13.根据B至B12中任一项所述的试剂盒,其中所述第二细胞为B细胞。
B14.根据B13所述的试剂盒,其中所述肿瘤抗原选自由以下项组成的组:CD20、FcRH5、CD19、CD33、CD22、CD79A和CD79B。
B15.根据B至B2和B7至B14中任一项所述的试剂盒,其中所述用于测量第一细胞的活化的工具包括所述第一细胞中的报告基因,其中所述第一细胞一经活化,即诱导所述报告基因的表达。
B16.根据B15所述的试剂盒,其中所述报告基因表达荧光分子或发光分子。
B17.根据权利要求B至B16中任一项所述的试剂盒,其中所述第一细胞与所述第二细胞的比率介于约1:10与约50:1之间。
B18.根据B17所述的试剂盒,其中所述第一细胞与所述第二细胞的比率介于约1:10与约10:1之间。
B19.根据B至B18中任一项所述的试剂盒,其中所述第二抗原在所述第二细胞上的平均表达为每个细胞至少约1,000个分子。
B20.根据B19所述的试剂盒,其中所述第二抗原在所述第二细胞上的平均表达为每个细胞至少约10,000个分子。
B21.根据B至B20中任一项所述的试剂盒,其中所述第一细胞与所述第二细胞之间的平均距离不大于约0.3mm。
B22.根据B21所述的试剂盒,其中所述第一细胞与所述第二细胞之间的平均距离不大于约0.1mm。
B23.根据B至B22中任一项所述的试剂盒,其中所述多特异性抗体为双特异性抗体。
C.一种用于确定与第一抗原和第二抗原结合的多特异性抗体的细胞突触形成的系统,其包括:表达第一抗原的第一细胞;表达第二抗原的第二细胞;以及用于测量第一细胞的活化的工具。
C1.根据C所述的系统,其中所述多特异性抗体与所述第一抗原和所述第二抗原一经结合,所述第一细胞与所述第二细胞之间即形成细胞突触。
C2.根据C1所述的系统,其中所述细胞突触形成活化所述第一细胞。
C3.根据C至C2中任一项所述的系统,其中所述用于测量第一细胞的活化的工具包括指示活化的至少一种生物标志物。
C4.根据C3所述的系统,其中所述至少一种生物标志物为细胞表面分子。
C5.根据C4所述的系统,其中所述至少一种生物标志物选自由CD62L、CD69及其组合的表达所组成的组。
C6.根据C5所述的系统,其中所述至少一种生物标志物包括CD62L的表达。
C7.根据C至C6中任一项所述的系统,其中第一抗原为CD3。
C8.根据C至C7中任一项所述的系统,其中第一细胞为T细胞或T细胞衍生的细胞。
C9.根据C8所述的系统,其中第一细胞一经活化即存在细胞溶解不足。
C10.根据C9所述的系统,其中第一细胞为Jurkat细胞。
C11.根据C至C10中任一项所述的系统,其中第二抗原为肿瘤抗原。
C12.根据C11所述的系统,其中肿瘤抗原选自由以下项组成的组:HER2、LYPD1、LY6G6D、PMEL17、LY6E、EDAR、GFRA1、MRP4、RET、Steap1、TenB2、CD20、FcRH5、CD19、CD33、CD22、CD79A和CD79B。
C13.根据C至C12中任一项所述的系统,其中第二细胞为B细胞。
C14.根据C13所述的系统,其中肿瘤抗原选自由以下项组成的组:CD20、FcRH5、CD19、CD33、CD22、CD79A和CD79B。
C15.根据C至C2和C13至C14中任一项所述的系统,其中所述用于测量第一细胞的活化的工具包括所述第一细胞中的报告基因,其中所述第一细胞一经活化,即诱导所述报告基因的表达。
C16.根据C15所述的系统,其中报告基因表达荧光分子或发光分子。
C17.根据C至C16中任一项所述的系统,其中第一细胞与第二细胞的比率介于约1:10与约50:1之间。
C18.根据C17所述的系统,其中第一细胞与第二细胞的比率介于约1:10与约10:1之间。
C19.根据C至C18中任一项所述的系统,其中第二抗原在第二细胞上的平均表达为每个细胞至少约1,000个分子。
C20.根据C19所述的系统,其中第二抗原在第二细胞上的平均表达为每个细胞至少约10,000个分子。
C21.根据C至C20中任一项所述的系统,其中第一细胞与第二细胞之间的平均距离不大于约0.3mm。
C22.根据C21所述的系统,其中第一细胞与第二细胞之间的平均距离不大于约0.1mm。
C23.根据C至C22中任一项所述的系统,其中多特异性抗体为双特异性抗体。
以下是本公开的方法和组合物的实例。应当理解,在给出上文提供的一般描述的情况下,可以实践各种其他实施例。
与典型的治疗性mAb或ADC的MOA不同,T细胞依赖性双特异性分子通过活化效应T细胞以及靶向其针对靶肿瘤细胞的细胞溶解活性而起作用(Staerz,UD,O.Kanagawa和MJBevan.(1985)“Hybrid antibodies can target sites for attach by T cells.”
在该实例中,使用T细胞活化的早期标志物作为细胞突触形成的替代物确立了体外测定法。来自体外测定法的数据用于建立基于机制的模型,以同时评估各种因素对细胞突触形成的影响。建模框架可以指导T细胞依赖性双特异性分子以及更普遍的其他多特异性抗体的合理设计和开发。
试剂:细胞和测试抗体
B淋巴瘤细胞系包括BJAB、Pfeiffer和SUDHL-8,以及Jurkat(一种来源于急性淋巴细胞白血病的人淋巴母细胞系),其是从美国典型培养物保藏中心(American TypeCulture Collection,Manassas,VA)获得。这些细胞系保存于罗斯威尔公园纪念研究所(Roswell Park Memorial Institute,RPMI)培养基1640(Corning,Tewksbury,MA)中,该培养基补充有10%胎牛血清(FBS:Hyclone,Logan,UT)、25mM HEPES(Corning,Tewksbury,MA)、1%Glutamax(Gibco,Carlsbad,CA)和1%青霉素/链霉素(Gibco,Carlsbad,CA)。
抗CD20/CD3 TDB为人源化全长IgG1杵臼结构双特异性抗体(Speiss,2013)。所有抗体均由基因泰克公司的经改造的中国仓鼠卵巢(CHO)细胞系生产而成。
利用Jurkat效应细胞的细胞突触测定法
将效应T细胞(Jurkat)与表达CD20的靶细胞(BJAB/Pfeiffer/SUDHL8)以50:1、10:1、1:1或1:10的效靶比率进行孵育。将效应细胞和靶细胞在测定培养基(RPMI-1640、10%FBS、25mM HEPES、1%谷氨酰胺、1%青霉素/链霉素)中稀释。将50uL每种类型的细胞以测试浓度接种到96孔U型底板(Falcon,Corning,NY)中。将TDB测试抗体在测定培养基中稀释,从1mg/mL开始,然后进行10个梯度的7.5倍连续稀释,并且添加到细胞中。将反应在37℃、5%CO2下孵育0-24hr。孵育后,将板转移至冰中以终止反应。将细胞在4℃以1200RPM离心5分钟,以便用200uL FACs缓冲液(PBS、2%FBS、0.02%叠氮化物)洗涤3次,以去除未结合的抗体。
针对B细胞上的CD19的表达(APC抗人CD19,BioLegend,San Diego,CA)以及T细胞活化标志物CD62L和CD69(PE抗人CD62L、FITC抗人CD69,BD Biosciences,San Jose,CA)将细胞在冰上染色30分钟。染色后,将细胞用200uL FACs缓冲液洗涤3次,并固定在
用Flow Jo软件(Treestar,Ashland,OR)分析荧光CD62L或CD69效应细胞的平均数目。使用对照(无TDB抗体)条件确定基线百分比。将CD62L或CD69阳性T细胞百分比的变化与TDB测试抗体浓度(GrapPad Prism,La Jolla,CA)相对绘制。
利用外周血单核细胞(PBMC)的细胞突触测定法
按照制造商的说明,使用Uni-Sep血液分离管(Accurate Chemical&Scientific,Westbury,NY),通过密度梯度离心从健康供体的新鲜血液中分离出PBMC。从界面收集单核细胞,用测定培养基(RPMI-1640、10%FBS、25mM HEPES、1%谷氨酰胺、1%青霉素/链霉素)洗涤两次。PBMC在测定培养基中稀释,测定培养基的体积与从中分离出PBMC的血液体积相同,以维持细胞的生理计数。将100uL PBMC接种在96孔U型底板(Falcon,Corning,NY)中的每个孔中。将TDB测试抗体在测定培养基中稀释,从1mg/mL开始,然后进行10个梯度的5倍连续稀释,并且添加到细胞中。将带有抗体的PBMC在37℃、5%CO2下孵育4hr。孵育后,将板转移至冰中以终止反应。将细胞在4℃以1200RPM离心5分钟,以便用200uL FACS缓冲液(PBS、2%FBS、0.02%叠氮化物)洗涤3次,以去除未结合的抗体。使用以下抗体针对B细胞表面抗原(CD19、CD40)、T细胞表面抗原(CD4、CD8)和T细胞活化标志物(CD62L)将细胞在冰上染色30分钟:PECy7抗人CD19(BioLegend)、Brilliant Violet510抗人CD4(BioLegend)、APC/Cy7抗人CD8(BioLegend)和PE抗人CD62L抗体(BD Biosciences)。染色后,将细胞用200uL FACS缓冲液(PBS、2%FBS、0.02%叠氮化物)洗涤3次,并固定在
在流式细胞仪(BD Biosciences FACSCanto IVD 10,San Jose,CA)上分析细胞。将CD19阳性细胞选为B细胞,并且将CD4阳性和CD8阳性细胞选为T细胞。T细胞的活化引起L-选择蛋白(CD62L)的脱落。使用Flow Jo计算T细胞上的CD62L荧光。通过对对照(无抗体)群体进行门控来确定基线荧光,并在多轮运行中将其标准化。在GraphPad Prism(LaJolla,CA)中绘制剂量应答曲线。
模型开发
建立了基于一系列常微分方程的数学模型来描述TDB突触的形成(图1),该模型描述了T细胞中CD20/CD3 TDB、肿瘤抗原CD20和CD3受体之间的顺序结合。CD20/CD3 TDB与CD20和CD3的结合亲和力(KD)值分别为68nM和40nM。在当前的建模练习中,在假设kon值为0.001 1/(nM x second)的前提下,使用公式koff=KD*kon推导CD20/CD3TDB与CD20或CD3的Koff值,以确保在实验条件下实现结合平衡。
突触形成是以下列假设和逐步逼近法提出的:1)细胞结合的CD20和CD3的总量均匀分布在搅拌良好的系统中;2)TDB首先以1:1的比率与CD20或CD3结合,并且所述结合是独立事件(公式1-5);3)然后将TDB结合的CD20和CD3分别与未结合的CD3和CD20结合,以形成三分子突触(公式6至10);4)用Emax模型描述了三分子突触和细胞突触之间的关系(公式11);5)推算出六个最接近的靶细胞(即B淋巴瘤细胞)与每个T细胞的平均距离,以说明靶细胞至T细胞之间的细胞密度和相对细胞密度对细胞突触形成的影响(参见下一节)。
d(游离药物)/dt=-konCD20*游离CD20*游离药物-konCD3*游离CD3*
游离药物+koffCD20*药物CD20+koffCD3*药物CD3(1)
d(游离CD20)/dt=-konCD20*游离CD20*游离药物+koffCD20*药物CD20(2)
d(游离CD3)/dt=-konCD3*游离CD3*游离药物+koffCD3*药物CD3(3)
d(药物CD20)/dt=konCD20*游离CD20*游离药物-koffCD20*药物CD20(4)
d(药物CD3)/dt=konCD3*游离CD3*游离药物-koffCD3*药物CD3(5)
游离药物、游离CD20和游离CD3分别代表未结合的(或游离的)CD20/CD3 TDB、CD20和CD3。药物CD20和药物CD3分别代表TDB结合的CD20和TDB结合的CD3。
CD20_FPC = (CD20_free/CD20B0)*CD20_KCell (6)
CD20_BPC = (DCD20/CD20B0)*CD20_KCell (7)
CD3_FPC = (CD3F/CD3T0)*CD3_KCell (8)
CD3_BPC = (DCD3/CD3T0)*CD3_KCell (9)
突触M=CD20_FPC*CD3_BPC/(α1*KDCD20)+CD20_BPC*CD3_FPC/(α2*KDCD3)(10)
CD20_FPC和CD20_BPC分别代表游离的和TDB结合的CD20受体/B细胞。CD3_FPC和CD3_BPC分别代表游离的和TDB结合的CD3受体/T细胞。突触M代表三分子突触。α代表KD的比例因子。
突触C=E最大*突触M/(EC50+突触M)(11)突触C代表细胞突触。
T细胞与B淋巴瘤细胞之间细胞间距离的计算
根据实验条件(表1),使用随机的X、Y和Z坐标模拟了T细胞和B淋巴瘤细胞在1mm
表1.用于模拟T细胞和B淋巴瘤细胞位置的实验条件
表2B淋巴瘤细胞到T细胞的平均距离
然后将该总平均距离(DX;mm)合并到公式11中,以说明细胞浓度以及靶细胞与T细胞的比率对细胞突触形成的影响(公式12至15)。表3列出了最终模型的参数估计值。
突触
E最大=E最大
E最大
EC50 = E最大
E最大
CD20_K细胞代表每个细胞的CD20表达水平(每个细胞的受体)。
表3.通过拟合体外细胞突触数据估算模型的参数。
T细胞依赖性双特异性分子的作用机制已得到明确定义(Sun,2015)。对靶抗原具有特异性的臂与癌细胞接合,并且另一臂同时与T细胞接合,以诱导多克隆T细胞活化。T细胞的活化导致穿孔素和颗粒酶的释放,从而裂解癌细胞。因此,TDB作用机制(MOA)的驱动步骤是TDB分子与靶标T细胞和效应T细胞两者的结合,形成细胞突触(Staerz,1985)。T细胞活化是细胞突触形成后最接近的事件,因此T细胞活化标志物可用于粗略估计突触形成。
为了开发一种体外测定法来检测TDB依赖性突触形成,保持靶细胞和效应细胞恒量的平衡可能是有用的。因此,采用了活化但不裂解靶细胞的效应细胞。将Jurkat T细胞用于开发体外系统作为替代性T细胞来源。Jurkat T细胞活化(与原代T细胞相似)但不释放穿孔素和颗粒酶。将表达CD20的BJAB B淋巴瘤细胞用作靶细胞。为了初始测定法的开发,将细胞以1:1的效靶比率组合,并在CD20/CD3 TDB存在下于37℃一起孵育四小时。
孵育后,针对CD19、CD69和CD62L表达将所述细胞染色。CD19表达用于鉴别靶标T细胞和CD3 T细胞。从T细胞表面的CD62L脱落和CD69上调是已知的T细胞活化标志物(Chao,C.,R.Jensen等人(1997)“Mechanisms of L-Selectin Regulation by Activated Tcells.”J Immunol159:1686-1694;以及Shipkova,M.,E.Wieland.(2012)“Surfacemarkers of lymphocyte activation and markers of cell proliferation.”ClinicChimica Acta413:1338-1349)。因此,将活化的T细胞测量为CD69阳性或CD62L阴性(图2A)。计算活化的T细胞的百分比,并且针对TDB浓度进行标绘(图2B)。CD62L和CD69两者都显示出相似的活化模式(图2B)。TDB依赖性CD69活化的EC50为1.22ng/mL,而TDB依赖性CD62L降低过程的EC50为4.95ng/mL。
为了准确地将初始突触形成建模,找到最早的T细胞活化标志物可能是有用的。为了检查最早的T细胞活化读数,将Jurkat T细胞与BJAB靶细胞以及CD20/CD3 TDB孵育24小时的时间段。在各个时间点测量通过CD69和CD62L表达检测到的细胞活化(图3A)。在一小时之时可检测到由CD69表达标记的T细胞活化,并且所述活化在添加CD3/CD20 TDB后持续增加直至24小时。相反,与TDB和靶细胞孵育1小时后,CD62L脱落达到最大程度的降低(图3A)。CD62L早在添加TDB后5分钟就显示出表达变化(图3B)。因此,选择CD62L脱落作为用于对T细胞突触形成建模的早期T细胞活化标志物。
为了确认利用细胞系的体外系统能精准测量T细胞与靶细胞之间的生理细胞突触形成,从人供体中分离了PBMC,并在突触测定法中测试。将CD20/CD3 TDB添加到PBMC,并孵育四小时。使用CD62L表达作为标志物,分析了CD4和CD8 T细胞两者的T细胞活化。
与通过Jurkat T细胞、CD8 T细胞的活化相似,并且在较小程度上,CD4 T细胞表现出TDB依赖性活化,这表明利用Jurkat T细胞的体外测定系统反映了原代人CD4和CD8 T细胞的体内环境。
建立使用CD62L表达作为细胞突触形成的替代标志物的体外测定系统后,评估潜在影响细胞突触的因子。使用了三种表达不同CD20量的B淋巴瘤细胞系,其中BJAB细胞表达最高水平的CD20(每个细胞122K拷贝),Pfeiffer细胞表达中等量的CD20(每个细胞14K拷贝),而SUDHL-8表达最低量的CD20(每个细胞1.2K拷贝)。另外,评估了范围广泛的效应细胞与靶细胞比率(E:T比率),范围为从(1:10至50:1)。如图5所示,以靶标表达依赖性方式形成细胞突触。表达最高水平CD20的BJAB细胞显示出最高量的细胞突触,而分别表达少大概10倍和100倍CD20的Pfeiffer和SUDHL8细胞的细胞突触形成则减少。无论E:T比率如何,均证明了靶标表达水平依赖性细胞突触形成。
细胞突触的形成还取决于效应细胞和靶细胞的相对细胞密度(E:T比率)。当效应细胞的细胞密度是靶细胞50倍高时,观察到最小的细胞突触形成。通过增加靶细胞的细胞密度,提高了细胞突触量(图5)。
细胞突触模型的开发
提出的细胞突触模型的示意图如图1所示。基于已知的TDB结合动力学,开发了细胞突触模型,即在靶标和T细胞表面形成三分子突触复合物(即CD20/CD3 TDB-CD20-CD3)是形成细胞突触所需的,其通过T细胞活化标志物粗略估计。将靶标(即,CD20)和CD3作为游离和可溶性抗原处理,与TDB的结合作为独立事件,并通过结合亲和力(即,KD)确定。已经证明,结合臂之一一经结合,mAb的结合亲和力即可能受到影响,因此引入探索性术语α以说明结合亲和力的变化。然后,细胞突触的形成受三分子突触复合物的量、靶标与T细胞之间的距离以及每个细胞的靶标表达水平支配。
使用Jurkat T细胞的体外T细胞活化数据评估了模型表征和预测细胞突触形成的能力。该细胞系是用于评估细胞突触形成的理想选择,因为Jurkat T细胞的细胞杀伤功能即使在活化后也会受到损害。因此,靶细胞量是固定的,以允许定量细胞突触。该数据集中包括各种TDB浓度、效应细胞:靶细胞(E:T)比率以及每个细胞的靶标表达水平,以允许评估模型参数。
如图5所示,该模型可以定量捕获正在形成的细胞突触的量。基于TDB的作用机制,仅细胞突触的形成可以触发所需的下游活性(例如细胞杀伤),而无法单独触发TDB与靶细胞或效应细胞其中之一的结合。因此,通过提供可能影响细胞突触形成的关键因子的综合分析,该模型可用于辅助TDB的设计。
T细胞依赖性双特异性分子已成为用于癌症治疗的一类新的且颇具前景的分子。该分子具有独特的MOA,将肿瘤靶标识别与CD3介导的T细胞募集组合一起。已经作出巨大努力来探索分子特性和靶标表达对抗肿瘤活性的影响(例如2:1靶标:CD3结合双特异性分子,与针对同一靶标以及用于先前治疗的药物的靶标结合竞争)。然而,由于缺乏对细胞突触形成、下游药理作用的驱动力的定量了解,因此合理的分子设计、靶标选择和剂量/方案选择一直具有挑战性。
一个主要的挑战是测量细胞突触本身的形成。一种对突触形成建模的方法是对T细胞/肿瘤细胞复合物成像。然而,由于该测定法是在细胞培养皿中进行的,T细胞和肿瘤细胞仅由于它们的紧密接近性而可以出现在彼此的复合物中。一种替代方法是在流式细胞仪上测量细胞复合物,使用FSC和SSC测量来测量复合物的增加。然而,与细胞成像仪一样,检测到的T细胞/肿瘤细胞复合物与TDB浓度无关(数据未示出)。
除了直接测量T细胞/肿瘤细胞复合物,还可以通过测量TDB与T细胞和肿瘤细胞靶标结合后的近端事件来测量细胞突触形成。传统的体外测定法已测量了通过CD69、CD25和其他细胞表面活化标志物测量的T细胞活化(Sun,L.L.,D.Ellerman等人(2015)“Anti-CD20/CD3 T cell-dependent bispecific antibody for the treatment of B cellmalignancies.”Science Translation Medicine 7(287):287ra70;Junttila,T.T.,J.Li等人(2014)“Antitumor efficacy of a bispecific antibody that targets HER2 andactivates T cells.”Cancer Research 74(19):5561-71;以及Brischwein,K.,B.Schlereth等人(2006)“MT110:A novel bispecific single-chain antibodyconstruct with high efficacy in eradicating established tumors.”MolecularImmunology 43:1129-1143)。暴露于TDB后,CD69和CD62L两者在T细胞上的表达均呈剂量依赖性变化(图2)。然而,CD62L在添加TDB的5分钟内从T细胞的表面丢失,并且最大程度的脱落发生在2小时内。这与CD69相反,CD69的表达在加入TDB后长达24小时持续增加(图3)。虽然两种标志物都显示出与TDB相似的敏感性(图2),但CD62L表达的变化更接近TDB添加,并因此是细胞突触形成的更直接读数。
在先前的研究中已经探讨了突触的形成以及与下游药理作用的联系(Brischwein,K.,B.Schlereth等人(2006)“MT110:A novel bispecific single-chainantibody construct with high efficacy in eradicating established tumors.”Molecular Immunology 43:1129-1143;Speiss,C.,M.Merchant等人(2013)“Bispecificantibodies with natural architecture produced by co-culture of bacteriaexpressing two distinct half-antibodies.”Nature Biotechnology 31:753-758;以及Chen,X.等人(2016)Mechanistic Projection of First-in-Human Dose for BispecificImmunomodulatory P-Cadherin LP-DART:An Integrated PK/PD ModelingApproach.Clin Pharmacol Ther.100(3):232-41)。在这些研究中,突触的形成无法定量,并利用以下几个假设在分子水平建模:1)固定的靶标表达水平;2)固定的CD3表达水平;3)细胞结合的靶标和CD3的计算总量作为游离可溶性分子均匀地分布在充分搅拌的系统中。然后将模型预测的分子突触用于驱动下游药理作用(例如细胞杀伤和T细胞动力学)。尽管这种建模策略已证明其在支持MABEL剂量选择和描述体外和体内PK-PD关系方面的价值,但也注意到了若干局限性。
首先,模型预测的分子突触与药理作用之间的关系可能不同,其取决于每个细胞的靶标或CD3表达水平。例如,在i)低细胞密度的表达高靶标的细胞与ii)高细胞密度的表达低靶标的细胞的条件下,靶标的总量可以相同。在特定浓度的双特异性分子下,模型预测的分子突触的量将相同,而观察到的药理作用可能因细胞密度的不同而有所不同。第二,用于预测分子突触形成的模型假定靶标和CD3为游离可溶性分子。然而,可以预料,与游离可溶性分子相比,双特异性分子与细胞结合分子的可及性不同,并因此需要考虑细胞密度。此外,考虑到T细胞依赖性双特异性分子的药理作用是由T细胞活化触发的,还需要考虑靶细胞与效应细胞之间的相对细胞密度。第三,触发下游药理活性的是细胞突触结构(即双特异性分子-靶细胞-T细胞)的形成,而不是分子突触。虽然在细胞表面形成分子突触(即双特异性分子-细胞结合的靶分子-细胞结合的CD3分子)是先决条件,但细胞突触结构所需的最小分子突触量仍不清楚。
当前建模工作的目的是开发一种描述细胞突触形成的综合模型,所述细胞突触形成可通过如上所述的体外测定法来粗略估计。生成的数据集涵盖了潜在影响细胞突触形成的多种因素,其包括1)靶标表达水平(每个细胞1,200个拷贝至每个细胞122,000个拷贝);2)效应细胞与靶细胞比率(1:10至1:0.01);3)总细胞密度(1至11x10
该实例公开测量和预测体外T细胞活化的方法学。据推测,体外T细胞活化是以下功能之一:B细胞和T细胞密度(即细胞内距离)、每个细胞的B细胞靶标受体(CD20)表达水平以及对于靶抗原的双特异性抗体亲和力(KD)。
图6示出当B细胞具有较高的抗原CD20表达水平时,T细胞更可能被活化。
细胞内距离对于建模很有用,因为在双特异性Ab的存在下,更接近B细胞的T细胞更可能被“活化”。通过模拟计算细胞内距离。计算B细胞与T细胞之间距离的方法包括:使用R软件以随机x、y、z坐标模拟大小为1μL(1mm
总之,T细胞与B细胞之间的较高的B细胞靶标表达水平和较短的细胞内距离两者均导致增强的T细胞活化。
除了所描绘和要求保护的各种实施例之外,所公开的主题还涉及具有本文所公开和要求保护的特征的其他组合的其他实施例。这样,本文所呈现的特定特征可以在所公开的主题的范围内以其他方式彼此组合,使得所公开的主题包括本文所公开的特征的任何合适的组合。为了说明和描述的目的,已经呈现了所公开的主题的特定实施例的前述描述。并不旨在穷举或将所公开的主题限制为所公开的那些实施例。
对于本领域技术人员显而易见的是,在不脱离所公开主题的精神或范围的情况下,可以对所公开主题的组合物和方法进行各种修改和变化。因此,旨在所公开的主题包括在所附权利要求及其等同物的范围内的修改和变化。本文引用了各种出版物、专利和专利申请,其内容通过引用以其全文并入本文。
- 用于确定突触形成的方法和系统
- 一种用于神经突触形成分析中的细胞共培养方法
