海藻酸基注射型凝胶体系
文献发布时间:2023-06-19 11:26:00
技术领域
本发明涉及一种海藻酸基注射型凝胶体系(Alginic acid based injectablehydrogel system),具体地,涉及一种海藻酸基注射型凝胶体系,其有助于海藻酸中所含的造影剂不会扩散到周围环境中,并在注射部位停留一定时间,从而可以通过成像准确地确定靶部位的位置,或者有助于海藻酸中所含的药物在靶部位缓慢释放,从而可以治疗或缓解靶部位的症状。
背景技术
腹腔镜手术(Laparoscopic surgery)是减少对患者身体的损伤或影响的“微创手术”方法之一,不是切开腹部或胸部,而是钻开一个0.5~1.5cm的小孔,并插入安装了专用摄像头的内窥镜(腹腔镜)并在观察腹腔内的同时用手术工具(镊子、电刀、止血缝合单元等)进行手术的方法。
与开腹手术相比,由于腹腔镜手术的优势(如手术后疼痛少,切口少而恢复速度快和住院时间短)已得到了数十年的发展。近年来,随着采用这种腹腔镜手术的机器人手术等的引入,腹腔镜手术已被视为是手术技术的基础。对于大肠癌、胃癌等的手术治疗,在通过腹腔镜手术切开并去除体内癌发生部位之前,需要通过向胃或大肠的内部插入内窥镜来用肉眼确认手术部位(例如癌发生部位)的过程。但是,由于在常规手术方法中通过内窥镜获得的视角和范围与通过腹腔镜获得的视角和范围完全不同,难以准确地找到要切割的目标位置,因此根据手术医生的熟练程度,切割的准确度和切割范围不可避免地会有所不同,且切割范围也将不可避免地增加。因此,近期还有人采用如下手术方法,即为了标记要通过手术去除的部位,将诸如印度墨水之类的药物借助内窥镜注射针注射到通过内窥镜确认的病变中以标记病变区域,然后借助腹腔镜通过肉眼确认标记有印度墨水的部位并进行手术的方法。然而,这种标记方法的缺点在于,由于不正确地注射到肌肉层中的墨水而可能导致并发症,并且随着墨水或染料在注入区域周围扩散,因此通过手术去除的部位会变宽。因此,为了使在腹腔镜手术期间被去除的正常组织的区域最小化,需要能标记适当的病变部位的“标记用”或“标志用”造影剂。
在对于癌症或炎症性疾病区域难以进行手术治疗的情况下,则可以通过局部注射药物来实现治疗和症状缓解,但就疏水性药物而言,由于不易溶于水,因此局部注射药物并不容易,而就亲水性药物而言,会在注射部位迅速扩散,且药物的持续时间非常短。因此,需要一种“局部注射型”的药物制剂,其能够将药物均匀地注射到目标病变,并能使药物以期望的速率缓慢释放,从而最大化在靶部位的治疗效果或症状缓解效果。
发明内容
发明要解决的问题
能够标记病变的成像造影剂或成像法有很多,近来,使用近红外荧光染料的病变标记技术正在迅速发展。使用近红外荧光染料的荧光成像技术的优点在于,不仅能够从荧光成像检测出位于组织深处的标记区域,而且即使使用少量的荧光染料也能够灵敏地检测荧光信号。就当前使用的荧光成像造影剂而言,一种已被FDA批准的近红外荧光染料,即吲哚菁绿,已用于成像诊断和手术期间的血管成像等,但是在临床应用中存在一些局限性。吲哚菁绿由于浓度依赖性聚集现象而导致荧光亮度降低,在体内水溶液中具有化学不稳定性,并迅速扩散到周围组织,从而导致成像判别精度差且成像信号强度迅速减弱的缺点,因此难以用于造影剂。由于这些原因,需要开发一种可以增加对病变的标记效率并增加造影剂在体内的半衰期的方法。
其次,当将药物注射到生物体内时,由于在药物注射部位迅速吸收和扩散,可能对周围的正常组织产生副作用,并且药物在生物体内因酶的作用而分解,因此存在药物持久效果降低的问题。因此,为获得期望的药效,存在需要大量给药或反复给药的难处。由于这些原因,需要开发一种能够通过防止药物在体内扩散来改善对靶部位的药效的持续时间的方法。
本发明是为解决如上所述的现有技术的问题而提出的,并且本发明人基于海藻酸开发了使用多价离子作为离子交联剂的海藻酸基注射型凝胶体系,从而完成了本发明。因此,本发明提供一种用于制备注射型水凝胶的组合物,包含:第一剂,含海藻酸和离子交联剂;以及第二剂,含海藻酸和交联速率调节剂。另外,本发明提供用于标记病变的组合物以及包括将上述组合物注入个体的步骤的病变的标记方法,其中,上述组合物包含:第一剂,含海藻酸和离子交联剂,以及第二剂,含海藻酸和交联速率调节剂。
本发明的海藻酸基注射型凝胶体系,帮助包含在海藻酸中的造影剂在注射部位保留一定时间而不会扩散到周围,从而使得可以利用成像准确地确定靶部位的位置。
另外,本发明的海藻酸基注射型凝胶体系可以将药物以及造影剂掺入海藻酸中并将其注射至靶部位,尤其,在本发明的海藻酸水凝胶中添加如抗癌剂之类的药物并进行注射的情况下,可以防止药物扩散到周围,同时使该药物在海藻酸中缓慢释放很长一段时间,从而能使药效能够持续很久。
用于解决问题的手段
除非另有定义,否则本说明书中使用的所有技术和科学术语均具有与本发明所属技术领域的技术人员通常所理解的含义相同的含义。通常,在本说明书中使用的命名法是本领域众所周知的并且是常用的。
为实现如上所述的技术问题,本发明涉及海藻酸基注射型凝胶体系,具体地,本发明提供用于制备注射型水凝胶的组合物形式的海藻酸基注射型凝胶体系,包含:第一剂,含海藻酸和离子交联剂;以及第二剂,含海藻酸和交联速率调节剂。另外,本发明提供用于标记病变的组合物以及包括将上述组合物注入个体的步骤的病变的标记方法,上述组合物包含:第一剂,含海藻酸和离子交联剂,以及第二剂,含海藻酸和交联速率调节剂。
在本发明中,上述第一剂或第二剂可掺入有成像造影剂或药物。
即本发明的注射型水凝胶制备用组合物,将成像造影剂或药物掺入海藻酸或海藻酸/透明质酸混合物中,并将离子交联剂和交联速率调节剂包含于其中的第一剂和第二剂混合并一起注射,以制成注射型的水凝胶形式。
因此,本发明涉及将上述第一剂和第二剂一起进行混合的注射型水凝胶组合物。
当使用这种海藻酸基注射型凝胶体系将成像造影剂或药物局部注射到目标病变区域时,注射溶液在标记区域中变成凝胶(gel),以防止造影剂或药物扩散,从而能够增加持续时间。通过这种方式,不仅可以通过成像相对准确地确定靶部位的位置,而就药物而言,由于药效可以持续很久,可以减少由药物扩散引起的副作用,并且可以实现靶部位所需要的药效。
在本发明中,上述“离子交联剂”包含在第一剂中,并且用作提供用于海藻酸交联的多价离子的离子提供源,通过与海藻酸结合形成离子交联的水凝胶。这种离子交联剂可选自由碳酸钙(Calcium carbonate)、碳酸锶(Strontium carbonate)、EDTA钙(Calciumdisodium edetate)、柠檬酸钙(Calcium citrate)、硫酸钙(Calcium sulfate)、海藻酸钙(Calcium alginate)、葡萄糖酸钙(Calcium gluconate)、磷酸氢钙(Calcium phosphatedibasic(CaHPO
在本发明中,上述“交联速率调节剂”包含在第二剂中,并起到调节海藻酸交联形成速率的作用。这种交联速率调节剂可包含在由如葡萄糖酸、乙酸、苹果酸、乳酸、抗坏血酸的有机酸或其盐或其的混合物以及光致酸产生剂(photoacid generator,PAG)构成的组中选择的一个以上。更具体地,上述交联速率调节剂可以为D-葡萄糖酸,但不限于此。
在本发明中,上述离子交联剂与交联速率调节剂的比率没有限制,但基于存在于海藻酸中的羧酸基(carboxylic acid group)的摩尔数(X),优选离子交联剂的摩尔比为0.1X至0.4X。就交联速率调节剂而言,其用量能够使溶液的pH为中性即可。
在本发明中,上述海藻酸可以与透明质酸混合。由于即使在海藻酸和透明质酸的混合比为100:0至1:99的各种混合条件下也能良好地形成水凝胶,因此对上述海藻酸和透明质酸的混合比没有明显的限制。透明质酸被人体中存在的酶即透明质酸酶(hyaluronidase)分解,因此透明质酸的混合比例越高,水凝胶的分解速度越快,药物的释放速度越快,因此,可根据掺入到水凝胶中的造影剂或药物的释放速率来调节海藻酸和透明质酸混合比。
在本发明中,上述“成像造影剂”可以为磁共振成像造影剂、计算机断层扫描(computed tomography,CT)造影剂或荧光染料。
当将上述磁共振成像造影剂(MRI造影剂)注射至人体时,它会改变组织的弛豫率,从而扩大组织之间的弛豫程度差异,并引起MRI信号的变化,从而使组织之间的对比度更清晰。MRI造影剂包括离子化钆(Gd)(Ⅲ)配合物和中性钆(Gd)(Ⅲ)配合物。更具体地,上述MRI造影剂可以为钆络合物、锰络合物、铜(Copper)(II)络合物、氧化铁纳米颗粒和氧化锰纳米颗粒,在本发明的一实施例中使用了作为氧化铁纳米颗粒造影剂的菲立磁
在本发明中,上述CT造影剂是用于在X射线拍摄时增强阴影的物质,并且,例如可以由金属或包含碘(iodine)的化合物或纳米颗粒制成,且在本发明的一个实施例中,使用了孟加拉红,但不限于此。
在本发明中,上述“荧光染料”可以为荧光素(Fluorescein)、CR110:羧基罗丹明110:罗丹明绿(商标名)、TAMRA:羧四甲基罗丹明:TMR、羧基罗丹明6G:CR6G、BODIPY FL(商标名):4,4-二氟-5,7-二甲基-4-硼杂-3a,4a-二氮杂-s-引达省-3-丙酸、BODIPY 493/503(商标名):4,4-二氟-1,3,5,7-四甲基-4-硼杂-3a,4a-二氮杂-s-引达省-8-丙酸、BODIPYR6G(商标名):4,4-二氟-5-(4-苯基-1,3-丁二烯基)-4-硼杂-3a,4a-二氮杂-s-引达省-3-丙酸、BODIPY 558/568(商标名):4,4-二氟-5-(2-噻吩基)-4-硼杂-3a,4a-二氮杂-s-引达省-3-丙酸、BODIPY 564/570(商标名):4,4-二氟-5-苯乙烯基-4-硼杂-3a,4a-二氮杂-s-引达省-3-丙酸、BODIPY 576/589(商标名):4,4-二氟-5-(2-吡咯基)-4-硼杂-3a,4a-二氮杂-s-引达省-3-丙酸、BODIPY 581/591(商标名):4,4-二氟-5-(4-苯基-1,3-丁二烯基)-4-硼杂-3a,4a-二氮杂-s-引达省-3-丙酸、EvoBlue10(商标名)、EvoBlue30(商标名)、MR121、ATTO 655(商标名)、ATTO 680(商标名)、ATTO 700(商标名)、ATTO MB2(商标名)、AlexaFluor 350(商标名)、Alexa Fluor 405(商标名)、Alexa Fluor 430(商标名)、Alexa Fluor488(商标名)、Alexa Fluor 532(商标名)、Alexa Fluor 546(商标名)、Alexa Fluor 555(商标名)、Alexa Fluor 568(商标名)、Alexa Fluor 594(商标名)、Alexa Fluor 633(商标名)、Alexa Fluor 680(商标名)、Alexa Fluor 700(商标名)、Alexa Fluor 750(商标名)、Alexa Fluor 790(商标名)、Flamma 496(商标名)、Flamma 507(商标名)、Flamma 530(商标名)、Flamma 552(商标名)、Flamma 560(商标名)、Flamma 575(商标名)、Flamma 581(商标名)、Flamma 648(商标名)、Flamma 675(商标名)、Flamma 749(商标名)、Flamma 774(商标名)、Flamma 775(商标名)、Rhodamine Red-X(商标名)、Texas Red-X(商标名)、5(6)-TAMRA-X(商标名)、5TAMRA(商标名)、花菁(Cyanine)系列染料(Cy5、Cy5.5、Cy7,IR820)、吲哚菁绿(Indocyanine green,ICG)或ZW800等,但不限于此。具体地,上述荧光染料可以是荧光染料和人血清白蛋白结合的复合物。上述结合可以是离子结合、疏水性结合或共价结合,更具体地,可以为共价结合,但不限于此。代表性地,BODIPY染料可以与人血清白蛋白形成疏水性结合,为了提高亲水性而添加磺酰基(sulfonyl group)的花青系列染料、Alexa系列染料等可以形成离子结合。
在本发明中,上述“药物”的种类没有特别的限制,可以为目标疾病选择合适的药物,例如,抗癌药、抗炎症药、麻醉剂、抗病毒剂、抗菌剂、治疗性抗体、抗生素或免疫治疗剂等。
在本发明中,抗癌剂可使用选自由阿霉素、棉籽酚、氮芥、伊马替尼、奥沙利铂、利妥昔单抗、厄洛替尼、诺拉替尼、拉帕替尼、吉非替尼、凡德他尼、尼洛替尼、司马沙尼、波舒替尼、阿昔替尼、西地尼布、来舒替尼、曲妥珠单抗、易瑞沙、硼替佐米、舒尼替尼、卡铂、贝伐单抗、顺铂、西妥昔单抗、白果槲寄生、天冬酰胺酶、维甲酸、羟基脲、达沙替尼、雌莫司汀、吉妥珠单抗、替伊莫单抗、依铂、甲基氨基乙酰丙酸、安吖啶、阿仑单抗、丙卡巴肼、前列地尔、硝酸钬壳聚糖、吉西他滨、多西氟尿啶、培美曲塞、替加氟、卡培他滨、吉美拉西、奥替拉西、阿扎胞苷、甲氨蝶呤、尿嘧啶、阿糖胞苷、氟尿嘧啶、氟达拉滨、依诺他滨、氟他胺、地西他滨、巯基嘌呤、硫鸟嘌呤、克拉屈滨、卡莫氟、雷替曲塞、多西他赛、紫杉醇、伊立替康、贝洛替康、拓扑替康,长春瑞滨、依托泊苷、长春新碱、长春碱、替尼泊苷、多柔比星、伊达比星、表柔比星、米托蒽醌、丝裂霉素、博来霉素、柔红霉素、放线菌素D、吡柔比星、阿柔比星、培洛霉素、替西罗莫司、替莫唑胺、白消安、异环磷酰胺、环磷酰胺、美法仑、六甲蜜胺、达卡巴嗪、塞替派、尼莫司汀、苯丁酸氮芥、二溴卫矛醇、立可林、特雷托宁(tretonin)、依斯美坦、氨鲁米特、阿那格雷、诺维本、法倔唑、他莫昔芬、托瑞米芬、睾内酯、阿那曲唑、来曲唑、伏罗唑、比卡鲁胺、洛莫司汀和卡莫斯汀构成的组中的一种以上,但不限于此。
在本发明中,抗炎症药可以为水杨酸(salicylates)、布洛芬(ibuprofen)、萘普生(naproxen)、非诺洛芬(fenoprofen)、吲哚美辛(indomethacin)、苯基丁氮酮(phenyltazone)、甲氨蝶呤(methotrexate)、环磷酰胺(cyclophosphamide)、二氯甲基二乙胺(mechlorethamine)、地塞米松(dexamethasone)、泼尼松龙(prednisolone)、塞来昔布(celecoxib)、伐地昔布(valdecoxib)、尼美舒利(nimesulide)、可的松(cortisone)或皮质类固醇(corticoste roid)等。
另一方面,当将海藻酸基水凝胶注射到粘膜下层以进行成像标记时,患者的免疫系统会识别为异物已侵入生物体内,并可能引起炎症反应以将其清除。此时,包括各种酶的蛋白质、补体(complement system)、抗体和免疫细胞进入到注射部位,起到去除存在于注射部位的海藻酸和荧光染料的作用。因此,由于在注射部位发生的炎症反应,有可能导致除去水凝胶中所含的荧光染料的速度加快。作为减少炎症反应和副作用的方法,可在注射水凝胶时,单独口服抗炎症药,或与水凝胶一起混合并注射到目标部位。对于疏水性(hydrophobic)抗炎症药,由于难以在水中溶解,因此为使其更好的在水溶液中分散,将其装载(loading)在微球(microspheres)、纳米颗粒(nanoparticles)、脂质体(liposome)或胶束(micelle)等上,并与水凝胶一起注射。
本发明的注射型水凝胶制备用组合物,在需要的情况下,可适当地包含悬浮剂、增溶剂、稳定剂、等渗化剂、保存剂、抗吸附剂、表面活性剂、稀释剂、赋形剂、pH调节剂、止痛剂、缓冲剂、含硫还原剂、抗氧化剂等。例如,可包含灭菌水、生理盐水、惯用的缓冲剂(磷酸、柠檬酸、其他的有机酸等)、稳定剂、盐、抗氧化剂(抗坏血酸等)、表面活性剂、悬浮剂、等渗化剂或保存剂等。注射用的水溶液的例子包括:生理盐水;葡萄糖;或其他包含辅助剂的等渗溶液,例如,包含D-山梨糖醇、D-甘露糖、D-甘露糖醇、氯化钠。并且,能够与缓冲剂,例如磷酸盐缓冲液、乙酸钠缓冲液;止痛剂,例如盐酸普鲁卡因;稳定剂,例如苯甲醇、苯酚;抗氧化剂进行组合使用。适用于本发明的药学上可接受的载体和制剂在[雷明顿药学(Remington's Pharmaceutical Sciences),19th ed.,1995]中有详细描述。
在本发明中,上述“个体”可以为包括人类、狗、猫、牛、马、猪、鼠等的哺乳动物,但不限于此。
发明效果
如果需要预先标记了要通过手术切除的区域,或者在一定时间内需要标记病变部位时,则会将成像造影剂局部注入至病变部位中,通常情况下,注射到局部的成像造影剂快速地扩散到周围组织中,导致图像识别的准确性降低,并且图像信号强度迅速减弱。
本发明的包含成像造影剂的海藻酸基注射型水凝胶制备用组合物,使掺入在凝胶内部的造影剂不会扩散到周围,而是使其在病变部位停留一定时间,从而可以通过成像准确地判别靶部位的位置,并在需要时能通过手术进行去除。
另外,静脉内注射药物时,在大多数情况下会对非目标细胞或器官产生影响,会引起严重的副作用。即使当药物在靶部位局部注射时,药物也会在注射部位迅速吸收并扩散,因此不能完全避免对周围正常细胞的副作用,并且药物在注射部位的持续时间也短。
本发明的包含药物的海藻酸基注射型水凝胶制备用组合物,在注射的病变部位,使掺入至凝胶内部的药物不会扩散到周围并缓慢释放一定时间,从而能够使药效持续很久。因此,能够减少对周围组织的药物副作用,同时即使注射少量药物,也能够在靶部位实现期望的药效。
附图说明
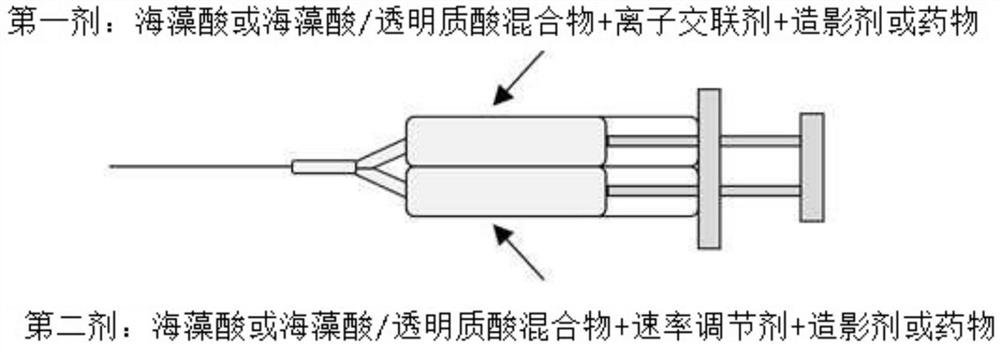
图1是海藻酸基注射型凝胶体系的结构图。
图2a是根据吲哚菁绿浓度的荧光图表。
图2b是示出根据吲哚菁绿浓度的最大荧光强度的图表。
图2c是根据吲哚菁绿浓度的吸光度图表。
图3a是示出根据以1:1结合的吲哚菁绿-人血清白蛋白浓度的荧光图表。
图3b是示出根据以1:1结合的吲哚菁绿-人血清白蛋白浓度的最大荧光强度的图表。
图3c是根据以1:1结合的吲哚菁绿-人血清白蛋白浓度的吸光度图表。
图4a是当吲哚菁绿的浓度固定为30μM时根据人血清白蛋白的比率的荧光图表。
图4b是示出当吲哚菁绿的浓度固定为30μM时根据人血清白蛋白的比率的最大荧光强度的图表。
图4c是当吲哚菁绿的浓度固定为6μM时根据人血清白蛋白的比率的荧光图表。
图5是示出根据进入海藻酸水凝胶中的钙离子和D-葡萄糖酸的浓度的凝胶化时间的图片和图表。
图6a是观察在96孔板中按30μM的吲哚菁绿溶液、30μM的吲哚菁绿-人血清白蛋白溶液、添加吲哚菁绿-人血清白蛋白30μM的海藻酸水凝胶的3种条件注射后的直至第三天的荧光强度的变化的图表。
图6b是刚在96孔板中按30μM的吲哚菁绿溶液、30μM的吲哚菁绿-人血清白蛋白溶液、添加吲哚菁绿-人血清白蛋白30μM的海藻酸水凝胶的3种条件注射后拍摄的荧光成像。
图7是用双注射器向裸鼠的皮下进行注射的示意图,上述双注射器的一侧装有作为第一剂的混合吲哚菁绿-人血清白蛋白和碳酸钙的海藻酸溶液,另一侧装有作为第二剂的混合有D-葡萄糖酸的海藻酸溶液。
图8是对于裸鼠皮下注射吲哚菁绿溶、吲哚菁绿-人血清白蛋白溶液和含吲哚菁绿-人血清白蛋白的海藻酸水凝胶的三种条件的随时间获得的荧光成像。
图9是对于裸鼠皮下注射吲哚菁绿溶液、吲哚菁绿-人血清白蛋白溶液和掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶的三种条件观察随时间的注射部位的样子的图片。
图10a示出了对于裸鼠皮下注射吲哚菁绿溶液、吲哚菁绿-人血清白蛋白溶液和掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶的三种条件的随时间的ROI值(Region ofinterest)的图表。
图10b是示出对于裸鼠皮下注射吲哚菁绿溶液、吲哚菁绿-人血清白蛋白溶液、掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶的三种条件的随时间的标记部位和周边组织的TBR(靶本底比值(Target-to-background ratio)=标记部位中的荧光ROI值÷周边组织的荧光ROI值)的图表。
图10c是示出对于裸鼠皮下注射的吲哚菁绿溶液、吲哚菁绿-人血清白蛋白溶液、掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶的三种条件的随时间的标记部位中的荧光扩散面积的图表。
图11a是ZW800-1C NHS酯(ester)的结构。
图11b是共价结合的人血清白蛋白-ZW800-1C结合体的吸光度和荧光图表。
图11c是对注射到裸鼠皮下的海藻酸水凝胶的随时间而获得的荧光成像,该海藻酸水凝胶掺入有人血清白蛋白-ZW 800-1C的共价结合形式的荧光染料。
图12是示出在海藻酸水凝胶中掺入作为一种药物的阿霉素并注射到ep管(ep-tube)中的样子。
图13是对于蒸馏水、海藻酸水凝胶和掺入有阿霉素的海藻酸水凝胶获得的荧光成像。
图14是示出在海藻酸水凝胶中掺入作为一种MRI造影剂的氯化锰和菲立磁并注射到ep管(ep-tube)中的样子。
图15是对于蒸馏水、海藻酸水凝胶和掺入有氯化锰(0.05、0.1、0.2mM)的海藻酸水凝胶获得的MRI T1加权图像。
图16是对于蒸馏水、海藻酸水凝胶和掺入有菲立磁(25、50、100μM)的海藻酸水凝胶获得的MRI T2加权图像。
图17是示出在海藻酸水凝胶中掺入作为一种CT造影剂的孟加拉红并注射到ep管(ep-tube)中的样子。
图18是对于蒸馏水、海藻酸水凝胶和掺入有孟加拉红的海藻酸水凝胶获得的CT成像。
图19是对于蒸馏水、海藻酸水凝胶和掺入有孟加拉红的海藻酸水凝胶获得的CT成像。
图20是将混合海藻酸和透明质酸制成的水凝胶注射到ep管(ep-tube)中的样子。
图21是在试验组1(猪#1)的胃内粘膜下层注射掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶,并在3天后通过荧光腹腔镜确认注射有水凝胶的位置的荧光检测成像。虚线圈内所示的荧光信号是在注射水凝胶的位置产生的荧光信号。
图22是在试验组2(猪#2)的胃内粘膜下层注射掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶,并在30分钟后通过荧光腹腔镜确认注射有水凝胶的位置的荧光检测成像。虚线圈内所示的荧光信号是在注射水凝胶的位置产生的荧光信号。
图23是切开猪胃后使用荧光腹腔镜所获得的荧光成像(上:猪#1,下:猪#2)。
图24是载有塞来昔布的PLGA微球的显微镜观察图片。
图25a是通过将塞来昔布以各种浓度溶解在乙腈溶液中而获得的吸收光谱。
图25b是在251nm波长下按各浓度测量塞来昔布(乙腈)溶液的吸光度而获得的标准曲线(Standard curve)。
图25c是将载有塞来昔布的PLGA微球溶液以0.04mg/mL的浓度溶于乙腈溶液中并测量的吸收光谱。
图26a是将包含载有塞来昔布的PLGA微球的海藻酸水凝胶注射到小鼠皮下后在第24小时、第48小时和第72小时后获得的荧光成像。
图26b是随时间定量分析不含塞来昔布的海藻酸水凝胶(Alg Gel)和含载有塞来昔布的PLGA微球的海藻酸水凝胶(microsphere/Alg Gel)注射的部位(region ofinterest,ROI)中发生的荧光信号的结果。
具体实施方式
在下文中,将参考附图更详细地说明本发明的优选实施例,以便更具体地说明本发明。然而,本发明不限于在此描述的实施例,并且可以以其他形式实施。除非另有定义,否则本说明书中使用的所有技术和科学术语具有与本发明所属领域的技术人员通常理解的相同含义。通常,在本说明书中使用的术语是本领域众所周知的、并且是常用的。
1-1:吲哚菁绿和吲哚菁绿-人血清白蛋白复合物的荧光和吸光度测量
在开发利用吲哚菁绿和人血清白蛋白结合物的手术标记物之前,为了解吲哚菁绿和人血清白蛋白结合物的适当的浓度,按不同浓度混合两个物质并观察荧光(λ
<制备例1>
在1.5mg的吲哚菁绿(Indocyanine green,ICG,购自西格玛-奥德里奇公司)中添加3mL蒸馏水,并通过搅拌(stirring)使其溶解以制备高浓度的吲哚菁绿溶液。将蒸馏水添加至上述高浓度的吲哚菁绿溶液中,并通过搅拌(stirring)混合来制备2-100μM的溶液。
<制备例2>
取1mL的上述高浓度的吲哚菁绿溶液并添加至42.89mg的人血清白蛋白(Humanserum albumin,HSA,购自西格玛-奥德里奇公司)中后,通过移液(pipetting)完全混合,制成高浓度的吲哚菁绿-人血清白蛋白复合物。将上述高浓度的吲哚菁绿-人血清白蛋白溶液添加至蒸馏水,并通过搅拌(stirring)混合来制备2-100μM的溶液。
<评价1-荧光特性评价>
在仅存在2-100μM吲哚菁绿的情况下,直至约20μM的浓度,最大荧光强度增加,然后出现荧光染料聚集,并且荧光从其以上的高浓度开始降低(图2a和图2b)。相反,确认了与在2-100μM的浓度范围仅使用吲哚菁绿的情况相比,以1比1结合的吲哚菁绿-人血清白蛋白复合物具有更高的荧光,并且直至两种物质的浓度约为30μM,最大荧光强度持续增加,并且从其以上的浓度开始保持不变(图3a和图3b)。
<评价2-吸光度特性评价>
在2-10μM的浓度范围观察吲哚菁绿以及1比1结合的吲哚菁绿-人血清白蛋白复合物的吸光度的结果,确认了,均显示随着浓度的增加吸光度增加的趋势,但吲哚菁绿-人血清白蛋白复合物表现出更强的吸光度(图2c和图3c)。
1-2:根据吲哚菁绿-人血清白蛋白复合物的混合比的荧光和吸光度测量
在开发利用吲哚菁绿-人血清白蛋白结合物的手术标记物之前,为了解吲哚菁绿-人血清白蛋白结合物的适当的混合比,按不同浓度混合两个物质并观察荧光(λ
<制备例3>
以与制备例1相同的方法,制备了高浓度的吲哚菁绿溶液。在42.89mg的人血清白蛋白中添加1mL蒸馏水后,然后通过移液(pipetting)完全混合,制成高浓度的人血清白蛋白溶液。通过取0.125mL的上述高浓度的吲哚菁绿溶液而将其最终浓度固定为30μM,并在其中仅添加人血清白蛋白溶液,人血清白蛋白溶液的添加量为以使其与吲哚花青绿的摩尔比为0至2的量,然后用蒸馏水制成总体积1mL的溶液并搅拌(stirring)以完全混合。
<评价3-荧光和吸光度特性评价>
使用上述制备例3的溶液观察了荧光和吸光度的变化(图4a至4c)。在吲哚菁绿-人血清白蛋白结合物中,荧光倾向于随着人血清白蛋白量的增加而增加。尤其,直到两种物质以1比1的比例混合时,发生荧光的增加,之后,人血清白蛋白的比例增加至其以上时,荧光几乎没有变化。当观察根据吲哚菁绿-人血清白蛋白结合物的摩尔比的吸光度时,吸光度倾向于随着人血清白蛋白摩尔数的增加而增加。
1-3:观察添加钙后随时间的海藻酸溶液的凝胶化
为了制备可以用作手术标记物的具有适当的凝胶化时间的海藻酸水凝胶,通过双注射器将表1所示浓度不同的钙离子添加到海藻酸溶液中,然后观察海藻酸溶液随时间的变化(图5)。
钙离子通过与海藻酸交联形成水凝胶。就碳酸钙(Calcium carbonate,购自西格玛-奥德里奇公司)而言,溶解度低,因此通过双注射器混合酸性条件的D-葡萄糖酸(D-gluconic acid solution,购自西格玛-奥德里奇公司),以调节碳酸钙的溶解速度,从而使其快速与海藻酸实现交联。通过该过程,海藻酸可以整体上均匀地凝胶化。通过添加相对于碳酸钙的两倍摩尔数的D-葡萄糖酸,将整体溶液的pH调节至中性。
[表1]
(通过双注射器的海藻酸水凝胶的混合条件,X表示包含在海藻酸1.0w/v%中的羧酸基摩尔数。)
<制备例4>
将0.036g的海藻酸钠(Sodium alginate,购自喜美克(KIMICA)公司)溶于3mL蒸馏水中,制成海藻酸1.2wt%溶液。在1.25mL的上述海藻酸1.2wt%溶液中添加0.25mL的蒸馏水,以制备海藻酸1.0wt%溶液。将1mL的海藻酸1.0wt%溶液添加到1.14mg的碳酸钙中,通过移液(pipetting)或旋涡(vortexing)混合来制备第一剂溶液。在0.833mL的上述海藻酸1.2wt%溶液中添加0.007mL的D-葡萄糖酸溶液,并用蒸馏水调节至总体积1mL,随后通过涡旋(vortexing)和搅拌(stirring)以完全混合并制备第二剂溶液。基于1.0w/v%的海藻酸中所含的羧基的摩尔数,碳酸钙和D-葡萄糖酸分别使用了0.1倍和0.2倍。
<制备例5>
除第一剂的碳酸钙为2.29mg,第二剂的D-葡萄糖酸溶液为0.015mL的条件之外,使用与制备例4相同的方法制备了溶液。基于1.0w/v%的海藻酸中所含的羧基的摩尔数,碳酸钙和D-葡萄糖酸分别使用了0.2倍和0.4倍。
<制备例6>
除第一剂的碳酸钙为3.43mg,第二剂的D-葡萄糖酸溶液为0.022mL的条件之外,使用与制备例4相同的方法制备了溶液。基于1.0w/v%的海藻酸中所含的羧基的摩尔数,碳酸钙和D-葡萄糖酸分别使用了0.3倍和0.6倍。
<评价4-根据钙离子量的海藻酸水溶液的凝胶化评价>
通过双注射器将制备例4至6的第一剂和第二剂的溶液注射到玻璃瓶中,至总体积为0.5mL之后,通过倒置玻璃瓶观察是否随时间形成了凝胶。如上述表1和图5所示,对于0.1X-0.3X的钙条件,将海藻酸溶液用双注射器注入玻璃瓶中,以观察溶液随时间的变化。
在0.1X钙条件下,溶液在刚注射后呈流动的液态(溶胶),然后在约46分钟后变为固态(凝胶)。在0.2X钙条件下,溶液在刚注射后呈稍微流动的液态(溶胶),然后在约2分钟后变为固态(凝胶)。最后,在0.3X钙条件下,溶液在刚注射后呈几乎不流动的状态,然后在约1分钟后变为固态(凝胶)。在图5中,根据使用的钙离子的浓度将这种凝胶化时间绘制成了图表。
观察到随着通过0.1-0.3X的钙条件添加至海藻酸的中的钙离子的浓度的增加,海藻酸的凝胶化时间缩短。尤其,在钙离子状态为0.3X的情况下,其在刚注射后便以几乎不流动固态(凝胶)存在。在本实验中,为了有效地防止吲哚菁绿-人血清白蛋白复合物的扩散,选择了在刚注射后变成凝胶的0.3X的钙条件进行后续实验。
1-4:掺入吲哚菁绿-人血清白蛋白复合物的海藻酸水凝胶的荧光测量
为了防止吲哚菁绿-人血清白蛋白复合物轻易在生物体内扩散,将吲哚菁绿-人血清白蛋白复合物掺入海藻酸中,然后通过双注射器与钙离子交联形成可注射的水凝胶形状后,在体外(in vitro)条件下确认荧光(λ
<制备例7>
以与制备例1相同的方法,制备了高浓度的吲哚菁绿溶液。在0.139mL的上述高浓度的吲哚菁绿溶液中添加蒸馏水,使得总量为1.5mL后,并通过搅拌(stirring)混合以制备第一剂溶液。第二剂溶液使用了蒸馏水。以使混合第一剂和第二剂的最终溶液的吲哚菁绿的浓度为30μM的方式进行制备。
<制备例8>
以与制备例2相同的方法,制备了高浓度的吲哚菁绿-人血清白蛋白溶液。在0.139mL的上述高浓度的吲哚菁绿-人血清白蛋白溶液中添加蒸馏水,使得总量为1.5mL后,并通过搅拌(stirring)混合以制备第一剂溶液。第二剂溶液使用了蒸馏水。以使混合第一剂和第二剂的最终溶液的吲哚菁绿-人血清白蛋白复合物的浓度为30μM的方式进行制备。
<制备例9>
以与制备例2相同的方法制备了高浓度的吲哚菁绿-人血清白蛋白溶液。除使用在1.25mL的海藻酸1.2wt%溶液中添加0.139mL的上述高浓度的吲哚菁绿-人血清白蛋白溶液后用蒸馏水将总体积设为1.5mL的溶液之外,以与制备例6相同的方法,制备了第一剂和第二剂溶液。
<评价5-荧光评价>
使用双注射器将制备施例7至9的溶液分别注射到96孔板(well)中,以使总体积为200μL。确认了注入的凝胶的随着时间的荧光图表和荧光成像。
如图6a所示,在刚注射各溶液后,吲哚菁绿-人血清白蛋白溶液条件的荧光最高,且荧光按吲哚菁绿溶液、掺入了吲哚菁绿-人血清白蛋白的海藻酸水凝胶的顺序减少。注射后3小时,掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶的荧光相对增加,且荧光按吲哚菁绿-人血清白蛋白溶液、掺入了吲哚菁绿-人血清白蛋白的海藻酸水凝胶、吲哚菁绿顺序降低。这些条件观察至3天时,也观察到了相同的结果。
通过图6b的荧光成像确认,当用双注射器注射海藻酸水凝胶时,溶液已充分混合的状态进入。
1-5:在动物模型中掺入吲哚菁绿-人血清白蛋白的海藻酸水凝胶的荧光测量
为了观察掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶在裸鼠中的荧光持久性,将其以凝胶形式通过双注射器注射到裸鼠皮下,并使用荧光成像设备(IVIS LuminaXR,Xenogen Corporation-Caliper,CA,USA)拍摄随时间的标记性能。以与制备例7至9相同的方法制备将要注射到动物模型的三种溶液。图7是使用双注射器在裸鼠的皮肤下注射含有吲哚菁绿-人血清白蛋白的海藻酸水凝胶的示意图。图7是利用双注射器在裸鼠的皮下注射掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶的示意图。
<评价6-在动物模型中的凝胶的荧光持续性评价>
使用双注射器将制备例7至9的溶液以总体积为100μL的方式分别注射至裸鼠的皮下。
图8是在裸鼠的皮下注射吲哚菁绿溶液、吲哚菁绿-人血清白蛋白溶液和掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶的三种条件下随时间获得的荧光成像(λ
图9是观察在裸鼠皮下注射吲哚菁绿溶液、吲哚菁绿-人血清白蛋白溶液和掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶的注射部位的结果。具体地,确认了在吲哚菁绿、吲哚菁绿-人血清白蛋白溶液的条件下,在刚注射后注射部位略微凸出,且在约24小时后溶液扩散并消失。相反,在注射海藻酸水凝胶的裸鼠,在刚注射后即可用肉眼观察到突出区域,且就凝胶而言,确认了尽管一部分会被分解但仍能维持约一个月左右。
在图10a中,以标记区域的ROI值对裸鼠中的各条件的荧光持续多长时间进行了比较。当确认ROI值时,吲哚菁绿和吲哚菁绿-人血清白蛋白溶液显示出几乎相似的状态。随着时间的流逝,注射的溶液扩散并且荧光在第6小时时最大,并且在经过一天时,与刚注入后的荧光相比,可以确认分别剩余16%和12%的荧光。相反,就海藻酸水凝胶而言,注射后的溶液同样稍微扩散且荧光在第6小时时最大,但与刚注入后的荧光相比,在两天后仍确认到剩余61%的荧光信号。
在图10b中,通过将目标区域(Target)的荧光ROI值除以周围组织(Background)的荧光ROI值,观察靶本底比值(Target-to-background ratio,TBR)。结果,证实吲哚菁绿、吲哚菁绿-人血清白蛋白溶液条件的TBR增加5倍大约需要4-5天,而海藻酸水凝胶的TBR增加5倍大约需要8天。
在图10c中,确认了在裸鼠中出现荧光的面积。当比较在吲哚菁绿、吲哚菁绿-人血清白蛋白溶液条件下荧光扩散到最大的面积与在海藻酸水凝胶条件下荧光扩散到最大的面积时,发现海藻酸水凝胶的荧光比其他条件的扩散少大约两倍。另外,在其他两种条件中,荧光信号在48小时时几乎消失,而海藻酸水凝胶条件下,直至第5天也显示荧光信号。
综合这些结果,证实了在体内(in vivo)条件下海藻酸水凝胶覆盖荧光染料并防止其在靶部位扩散,从而有效地增加了荧光持续时间。
1-6:海藻酸水凝胶的人血清白蛋白-ZW800-1C掺入实验
将一种作为共价结合复合物的人血清白蛋白-ZW800-1C荧光染料掺入至海藻酸水凝胶中,以确认在体内(in vivo)条件下荧光的持久性。
<制备例10>
将人血清白蛋白(10mg/mL)溶解在磷酸缓冲液中,然后在室温下与ZW800-1C NHS酯(ester)(图11a)以1:2的摩尔比在1mL磷酸缓冲液中反应1小时。反应完成后,使用PD-10色谱柱(GE Healthcare)除去未结合的荧光染料和反应副产物。纯化后获得的人血清白蛋白-ZW-800-1C结合体使用Amicon Ultra-0.5mL(截留(cut off):30kDa)离心过滤器浓缩,并在4℃的冰箱中储存。
为了分析结合至人血清白蛋白的荧光染料的比率,将人血清白蛋白-ZW800-1C结合物溶解在变性的磷酸缓冲液(含1%SDS/1mM NaOH)中,并测量吸光度。使用在280nm的人血清白蛋白摩尔消光系数(34,445M
人血清白蛋白-荧光染料结合物的吸光度和荧光度是通过在磷酸缓冲液中以5μM的浓度(基于荧光染料浓度)稀释来进行测量(图11b)。
<制备例11>
除在第一剂中使用30μM的人血清白蛋白-ZW800-1C共价结合形式的荧光染料代替吲哚菁绿-人血清白蛋白复合物之外,以与制备例9相同的方法制备了第一剂和第二剂试剂。
<评价7-在动物模型中的凝胶的荧光持续性评价>
使用双注射器将制备例11的溶液注射到裸鼠的皮下,使得总体积为100μL。证实了在体内(in vivo)条件下,海藻酸水凝胶也能够防止作为共价结合形式的荧光染料的人血清白蛋白-ZW800-1C在靶部位扩散,从而有效地增加了荧光持续时间(图11c)。
作为要掺入海藻酸水凝胶中的药物,准备了作为抗癌药的阿霉素(Doxorubicin,购自西格玛-奥德里奇公司)。
<制备例12>
将1.5mg的阿霉素溶于0.5mL的蒸馏水中,以制备高浓度的阿霉素溶液。除使用1.25mL的海藻酸1.2wt%溶液中添加0.125mL的上述高浓度的阿霉素后用蒸馏水将总体积设为1.5mL的溶液之外,以与制备例6相同的方法制备第一剂和第二剂溶液。
<评价8-海藻酸水凝胶中的阿霉素掺入和荧光成像确认>
使用双注射器将制备例12的溶液注射到ep管(ep-tube)中,以使总体积为0.5mL。此后,如图12所示,通过颠倒ep管(ep-tube)确认了所形成的海藻酸水凝胶有效地掺入有阿霉素。
如图13所示,使用荧光成像装置(IVIS)观察了掺入有阿霉素的水凝胶的荧光成像(λ
作为磁共振成像造影剂的氯化锰溶液(Manganese chloride,购自西格玛-奥德里奇公司,1M)和菲立磁I.V.(Feridex,购自泰俊制药,11.2mg Fe/mL)本身就是分散在水溶液中的商品,因此直接使用。
<制备例13>
在10μL的氯化锰溶液中添加990μL的蒸馏水,将氯化锰溶液稀释成1/100。除使用在1.25mL的海藻酸1.2wt%溶液中分别添加10、20、40μL的上述稀释的氯化锰溶液后再用蒸馏水调节至总体积1.5mL的3种浓度(最终浓度0.05、0.1、0.2mM)的溶液之外,以与制备例6相同的方法制备了第一剂和第二剂溶液。
<制备例14>
在50μL的菲立磁溶液中添加950μL的蒸馏水,将菲立磁溶液稀释成1/20。除使用在1.25mL的海藻酸1.2wt%溶液中分别添加5、10、20μL的上述稀释的菲立磁溶液后再用蒸馏水调节至总体积1.5mL的3种浓度(最终浓度20、50、100μM)的溶液之外,以与制备例6相同的方法制备了第一剂和第二剂溶液。
<评价9-海藻酸水凝胶中的磁共振成像造影剂掺入和磁共振成像确认>
使用双注射器将制备例13、14溶液中的0.2mM氯化锰和100μM菲立磁溶液注射到ep管(ep-tube)中,以使总体积为0.5mL。此后,如图14所示,通过颠倒ep管(ep-tube)确认了所形成的海藻酸水凝胶有效地掺入有作为磁共振成像造影剂的氯化锰和菲立磁。
使用双注射器将制备例13的3种浓度的氯化锰溶液分别注射到微管(micro-tube)中,以使总体积为0.25mL。此后,如图15所示,确认蒸馏水、海藻酸水凝胶和氯化锰(0.05、0.1、0.2mM)的MRI T1加权成像。可以确认,随着海藻酸水凝胶中氯化锰的添加量增加,MRI信号越亮。
使用双注射器将制备例14的3种浓度的菲立磁溶液分别注射到微管(micro-tube)中,以使总体积为0.25mL。此后,如图16所示,确认蒸馏水、海藻酸水凝胶和菲立磁(25、50、100μM)的MRI T2加权成像。可以确认,随着海藻酸水凝胶中菲立磁的添加量增加,MRI信号越暗。
利用作为CT造影剂的孟加拉红(Rose bengal,购自西格玛-奥德里奇公司),确认了是否能够在海藻酸水凝胶中掺入CT造影剂来使用。
<制备例15>
将100mg孟加拉红溶于1mL蒸馏水中,制备了高浓度的孟加拉红溶液。除使用0.015g的海藻酸钠中添加0.729mL的上述高浓度的孟加拉红和0.771mL的蒸馏水并通过搅拌(srirring)进行溶解的溶液之外,以与上述制备例6相同的方法,制备了第一剂和第二剂溶液。
<评价10-海藻酸水凝胶中的孟加拉红掺入和CT成像确认>
使用双注射器将制备例15的溶液中的溶液注射到ep管(ep-tube)中,以使总体积为0.5mL。此后,如图17所示,通过颠倒ep管(ep-tube)确认了所形成的海藻酸水凝胶有效地掺入有孟加拉红。
如图18、图19所示,确认了蒸馏水、海藻酸水凝胶、掺入有孟加拉红的水凝胶的CT成像。由此,确认了在整个海藻酸水凝胶内孟加拉红扩散良好。
在海藻酸和透明质酸以50:50和1:99混合的条件确认了是否形成水凝胶。
<制备例16>
将0.06g的透明质酸钠(Sodium hyaluronate,购自Lifecore生物医学公司)溶于2mL蒸馏水中,以制备3wt%的透明质酸溶液。
将0.036g的海藻酸钠溶于3mL的蒸馏水中,制备了海藻酸1.2wt%溶液。以制备例1的方法,制备了高浓度的吲哚菁绿溶液。
0.417mL的海藻酸1.2wt%溶液中添加0.334mL的透明质酸3wt%溶液和0.093mL的高浓度的吲哚菁绿溶液后,用蒸馏水调节至总体积1mL。
将1mL的混合有上述海藻酸和透明质酸的溶液添加至3.43mg的碳酸钙中,通过涡旋(vortexing)制备了第一剂溶液。0.417mL的海藻酸1.2wt%溶液中添加0.334mL的透明质酸3wt%溶液和0.022mL的D-葡萄糖酸后,用蒸馏水调节至总体积1mL,随后通过涡旋(vortexing)和搅拌(stirring)混合并制备第二剂溶液。
<制备例17>
以与制备例16相同的方法,制备了透明质酸3wt%溶液、海藻酸1.2wt%溶液、高浓度的吲哚菁绿溶液。
在0.005mL的海藻酸1.2wt%溶液中添加0.66mL的透明质酸3wt%溶液和0.093mL的高浓度的吲哚菁绿溶液后,用蒸馏水调节至总体积1mL。将1mL的混合有上述海藻酸和透明质酸的溶液添加至3.43mg的碳酸钙中,通过涡旋(vortexing)制备了第一剂溶液。
在0.005mL的海藻酸1.2wt%溶液中添加0.66mL的透明质酸3wt%溶液和0.022mL的D-葡萄糖酸后,用蒸馏水调节至总体积1mL,随后通过涡旋(vortexing)和搅拌(stirring)混合并制备第二剂溶液。
[表2]
<评价11-海藻酸和透明质酸混合水凝胶评价>
使用双注射器将上述制备例16、17的溶液注射到ep管(ep-tube)中,以使总体积为0.5mL。此后,如图20所示,通过颠倒ep管(ep-tube)确认了在所形成的海藻酸和透明质酸混合的条件下也能够形成水凝胶。
猪(小型猪)的代谢过程、器官结构和大小与人体相似,因此易于通过内窥镜进行实验性治疗和追踪观察。利用猪确认掺入有作为荧光手术标记物的吲哚菁绿-人血清白蛋白的海藻酸水凝胶的荧光标记性能,在两头猪的胃内粘膜下层注射掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶,在注射当天和注射第3天的时间点,评价是否能够通过荧光腹腔镜将注射到胃内的荧光染料产生的荧光信号作为成像进行检测并由此识别出标记的位置。
<制备例18>
以与制备例2相同的方法制备了高浓度的吲哚菁绿-人血清白蛋白溶液。在8.4mL的海藻酸1wt%溶液中添加0.558mL的上述高浓度的吲哚菁绿-人血清白蛋白溶液后,进一步添加蒸馏水,使得总体积为12mL,从而制备了荧光手术标记物溶液。在本试验中,以未添加离子交联剂的方式进行了实验。
<评价12-在猪胃中使用荧光腹腔镜进行荧光标记性能确认>
在注射制备的海藻酸水凝胶之前,将两只猪(猪#1、猪#2)禁食48小时,并在全身麻醉后进行实验。
在试验的第一天,将内窥镜和导管(Clear-Jet注射器(injector),23G,范麦迪斯)通过试验组1(猪#1)的嘴部插入,将制备例18的掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶向猪的胃内粘膜下层的三处各注射1mL。为了确定注射位置,将止血夹夹在水凝胶注射位置旁边。注射后三天,将荧光腹腔镜系统安装在猪的腹腔中,并通过位于胃外的荧光腹腔镜检测由位于胃内侧的荧光手术标记物产生的荧光信号,从而评价是否能实时确认标记有手术标记物的位置。
在实施试验组1的荧光腹腔镜评价的当天,以与试验组1相同的实施方法,对试验组2(猪#2)的胃内粘膜下层的三处注射了荧光手术标记物。为了确定注射位置,将止血夹夹在水凝胶注射位置旁边。注射水凝胶后,将荧光腹腔镜系统安装在猪的腹腔中,并通过位于胃外的荧光腹腔镜检测由位于胃内侧的荧光手术标记物产生的荧光信号,从而评价是否能实时确认标记有手术标记物的位置。
使用荧光腹腔镜系统,通过成像观察注射掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶的位置的结果,确认了在3天前注射荧光标记物的试验组1(图21)和当日注射并观察的试验组2(图22)中,均可以从荧光成像中确认注射水凝胶的位置。
随后,对猪实施安乐死并切开猪的胃,以确认从荧光成像确定的位置是否为实际注射水凝胶的位置。确认了在紧挨着夹在的注射水凝胶的位置的止血夹所在的位置附近产生了荧光信号,从该结果可以确认通过猪实验的荧光成像确定的荧光就是实际从水凝胶产生的荧光信号(图23)。
综合这些结果可知,掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶作为手术切除区域的成像标记物具有优异的性能。
当将海藻酸基水凝胶注射到粘膜下层以进行成像标记时,患者的免疫系统会识别为异物已侵入体内,并可能引起炎症反应以将其清除。此时,包括各种酶的蛋白质、补体(complement system)、抗体和免疫细胞会进入到注射部位,从而起到去除存在于注射部位的海藻酸和荧光染料的作用。因此,由于在注射部位发生的炎症反应,有可能导致除去水凝胶中所含的荧光染料的速度加快。
因此,在本实施例中,制备了载有抗炎症药的可生物降解微球(biodegradablemicrospheres),并将其与水凝胶一起注射到体内以抑制注射部位的炎症反应,并由此评价了在注射部位处的荧光成像信号的强度是否可以保持更高。抗炎症药使用了塞来昔布(Celecoxib),并使用作为可生物降解高分子的聚乳酸-羟基乙酸共聚物(Poly(lactic-co-glycolic acid),PLGA)制备了载药微球。
7-1.载抗炎症药可生物降解微球的制备和分析
<制备例19>
将135mg的PLGA(50:50,Mw 38000-54000,购自西格玛-奥德里奇公司)和13.5mg的塞来昔布(Celecoxib,购自西格玛-奥德里奇公司)溶于4.5mL的二氯甲烷(Dichloromethane)中。将0.5g的聚乙烯醇(Polyvinyl alcohol,PVA,Mw 13000-23000,购自西格玛-奥德里奇公司)添加到50mL的蒸馏水中,并以65℃加热,待完全溶解后,在25℃的温度下使溶液冷却。将装有溶解作为表面活性剂的聚乙烯醇的水溶液的烧杯浸入冰中,并逐滴滴入溶解有塞来昔布和PLGA的二氯甲烷溶液,然后使用均质器(Homogenizer PT3100Polytron,Kinematica AG,Littau-Lucerne,瑞士)以5000rpm剧烈搅拌5分钟,以制备水包油(oil-in-water)乳液(emulsion)溶液。为了除去作为有机溶剂二氯甲烷,将制备的乳液溶液与100mL蒸馏水混合,并在25℃的温度条件下以300rpm搅拌8小时。为了除去存在于所制备的微球表面上的表面活性剂(即PVA),将其以3000rpm的速度离心5分钟并洗涤,并重复3次该过程。之后,将水溶液冷冻干燥,并将获得的微球在4℃下保存。
<评价13-制备的载抗炎症药微球的分析>
将载有塞来昔布的PLGA微球以0.5mg/mL的浓度分散在蒸馏水中后,在载玻片(Slide glass)上滴几滴,然后使用光学显微镜(Axio Imager M2显微镜(microscope),蔡司(Zeiss),德国)观察形状和尺寸(图24)。可确认所制备的微球具有圆形形状,并且当测量100个微球的尺寸时,确认制备出了尺寸为9.4±2.7μm的微球。将载有塞来昔布的PLGA微球以0.5mg/mL的浓度分散在蒸馏水中后,使用激光粒度仪(Zetasizer NanoZS,MalvernInstruments,Worces-tershire,UK)装置测量zeta电位的结果,zeta电位值为-20.7mV。
<评价14-微球中载药量分析>
将1mg的塞来昔布溶于10mL的乙腈(Acetonitrile)中,并用乙腈稀释,分别制备0.625μg/mL、1.25μg/mL、2.5μg/mL、5μg/mL、10μg/mL、12.5μg/mL、25μg/mL浓度的标准溶液。测量每种溶液在251nm波长下的吸光度以获得塞来昔布的标准曲线(Standard curve)(图25a、图25b)。
将5mg的载有塞来昔布的PLGA微球完全溶于2.5mL的乙腈中,并用乙腈溶液稀释50倍后,在251nm波长下测量吸光度,并与标准曲线进行比较,分析了微球中载药量(图25c)。结果,确认了2mg微球中所含的塞来昔布的量为196.4μg。即微球内载有9.8wt/wt%的药物。
7-2.动物实验评价
通过动物实验对以下事项进行评价,即在掺入有吲哚菁绿-人血清白蛋白的海藻酸水凝胶中一起混合载有塞来昔布的微球并进行注射以抑制炎症反应时,荧光染料在注射部位的维持时间是否会更长,荧光强度是否会更高。
<制备例20>
以与制备例2相同的方法制备了吲哚菁绿-人血清白蛋白溶液。在1.167mL的海藻酸1.2wt%溶液中添加0.093mL的吲哚菁绿-人血清白蛋白溶液后,进一步添加蒸馏水,使得总体积为2mL,并进行搅拌。
<制备例21>
为制备含抗炎症药的海藻酸水凝胶,制备了0.136mL的载有塞来昔布的PLGA微球以9mg/mL浓度分散的蒸馏水溶液。以上述方法制备了2mL的掺入有吲哚菁绿-人血清白蛋白的海藻酸水溶液,并将0.136mL的微球水溶液和2mL的海藻酸溶液混合后进行搅拌。包含在海藻酸水凝胶内的塞来昔布药物的最终浓度为600μg/mL。
<评价15-在动物模型中的凝胶的荧光持久性评价>
利用注射器向白鼠的皮下分别注射100μL的制备例20和21的溶液。图26a是将海藻酸水凝胶注射到小鼠皮下位置(subcutaneous location)后第24小时、第48小时、第72小时获得的荧光成像(λ
如上所述,已经详细描述了本发明的内容的特定部分,对于本领域普通技术人员来说,该特定技术仅仅是优选的实施方式,本发明的范围不限于此是显而易见的。因此,可以说,本发明的实质范围由所附的权利要求书及其等同物定义。
- 海藻酸基注射型凝胶体系
- 用于心衰辅助治疗的可注射型海藻酸基生物材料及其制备方法
