用于眼细胞疗法的方法和组合物
文献发布时间:2023-06-19 11:26:00
I.序列表
本申请包含按ASCII格式以电子方式提交并特此通过引用以其全文并入的序列表。所述ASCII副本创建于2019年9月17日,名称为PAT058298_sequence_listing_2019_ST25.txt并且大小为224KB。
II.技术领域
本发明涉及产生遗传修饰的眼细胞(例如角膜缘干细胞(LSC)或角膜内皮细胞(CEC))的扩增群的方法,其中所述细胞在涉及LATS抑制剂的使用的情况下被扩增并且B2M在细胞中的表达已经降低或消除。本发明还涉及此类修饰的细胞群,包含所述细胞的制剂、用途和治疗方法。
III.背景技术
器官再生和/或愈合是治疗许多严重健康问题的关键问题。
例如在眼睛中,已知角膜失明是全世界失明的第三大主要原因。全世界所有角膜移植物中大约有一半用于角膜内皮功能障碍的治疗。
角膜是透明的组织,包含不同的层:角膜上皮、前弹力膜(Bowman’s membrane)、基质、后弹力膜(Descemet’s Membrane)和内皮。角膜内皮还包括人角膜内皮细胞的单层,并通过其屏障和离子泵功能帮助维持角膜透明性。它在维持角膜基质和房水之间的液体、营养和盐的平衡中起着至关重要的作用。为了保持透明性,必须保持内皮细胞密度,但是由于创伤、疾病或内皮营养不良,内皮细胞密度可以显著降低。细胞的密度也随着老化而降低。人角膜内皮在体内增殖的倾向有限。如果细胞密度降低得太低,则屏障功能可能会受到损害。内皮屏障功能的丧失导致角膜水肿和视力丧失。大疱性角膜病变的临床状况可能是导致的一种并发症。
目前,由角膜内皮功能障碍引起的失明的唯一治疗方法是角膜移植。尽管角膜移植是最常见的器官移植形式之一,但所需供体角膜的可用性却极为有限。2012年至2013年的一项全球调查对角膜移植组织的严重短缺进行了量化,发现每70个需求中只有一个角膜可用(Gain等人,(2016)Global Survey of Corneal Transplantation and Eye Banking[角膜移植和眼库全球调查].JAMA Ophthalmol.[JAMA眼科学]134:167-173)。
因此,非常需要新的治疗方法以提供用于治疗角膜内皮功能障碍的角膜内皮细胞。
角膜上皮也需要在眼中维持。角膜上皮由一层基底细胞和多层非角质化、分层的鳞状上皮构成。这对于维持角膜的清晰度和规则的折射表面至关重要。它充当角膜基质上的透明、可再生的保护层,并由位于角膜缘的干细胞群补充。在角膜缘干细胞缺陷(角膜缘干细胞患病或缺失的病症)中,健康的角膜缘干细胞数量减少会导致角膜上皮更新能力降低。
角膜缘干细胞缺陷可能是由于化学或热灼伤、紫外线和电离辐射造成的伤害的引起的,或者甚至是由于隐形眼镜佩戴引起的;遗传性障碍(如无虹膜)和免疫性障碍(如史蒂文斯-约翰逊综合征和眼部疤痕性类天疱疮)的结果引起的。角膜缘干细胞的损失可以是部分或全部;并且可以是单侧的或双侧的。角膜缘干细胞缺陷的症状包括疼痛、畏光、无法治愈的疼痛性角膜上皮缺陷、角膜新血管形成、结膜上皮置换角膜上皮、最终可能导致失明的角膜透明度丧失和视力降低。
一种用于治疗角膜缘干细胞缺陷的产品(名称为
因此,迫切需要新的治疗方法来供应角膜缘干细胞以治疗角膜缘干细胞缺陷。
IV.发明内容
本文所述的发明涉及用于眼细胞疗法的组合物和方法,例如,在其基因组中的特定靶序列处的修饰的眼细胞,包括如通过引入包括靶向所述靶序列的gRNA分子的CRISPR系统(例如,酿脓链球菌(S.pyogenes)Cas9 CRISPR系统)修饰的。例如,本披露涉及gRNA分子、CRISPR系统、眼细胞以及使用基因组编辑的细胞(例如修饰的角膜缘干细胞)治疗眼疾病的方法。
本发明提供了修饰的角膜缘干细胞,相对于未修饰的角膜缘干细胞,其降低或消除β-2-微球蛋白(B2M)的表达。
本发明进一步提供了修饰的角膜缘干细胞群,其相对于未修饰的角膜缘干细胞具有降低或消除B2M的表达。
在一个方面,修饰的角膜缘干细胞包括相对于未修饰的角膜缘干细胞在B2M处或附近的碱基对的插入或缺失,例如一个以上的碱基对的插入或缺失。在另一个方面,本发明提供了包括修饰的角膜缘干细胞的细胞群,其中在至少约30%的细胞中,至少一个所述插入或缺失是移码突变,例如,如通过下一代测序(NGS)所测量的。
在某些方面,本发明提供了一种修饰的角膜缘干细胞,其相对于未修饰的角膜缘干细胞具有降低或消除的β-2-微球蛋白(B2M)表达,其中所述B2M表达被包含编码gRNA分子的CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)降低或消除,所述gRNA分子包含与B2M基因中的靶序列互补的靶向结构域。
在其他方面,本发明提供了一种修饰的角膜缘干细胞,其相对于未修饰的角膜缘干细胞具有降低或消除的β-2-微球蛋白(B2M)表达,其中所述B2M表达被包含编码gRNA分子的核酸分子的CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)降低或消除,所述gRNA分子包含与B2M基因中的靶序列互补的靶向结构域。
在某些方面,本发明提供了一种修饰的角膜缘干细胞,其相对于未修饰的角膜缘干细胞具有降低或消除的β-2-微球蛋白(B2M)表达,其中所述B2M表达被包含编码gRNA分子的CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)降低或消除,所述gRNA分子包含与B2M基因中的靶序列互补的靶向结构域,其中将修饰的角膜缘干细胞暴露于LATS抑制剂(例如,在包含LATS抑制剂的培养基中培养)。
在其他方面,本发明提供了一种修饰的角膜缘干细胞,其相对于未修饰的角膜缘干细胞具有降低或消除的β-2-微球蛋白(B2M)表达,其中所述B2M表达被包含编码gRNA分子的核酸分子的CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)降低或消除,所述gRNA分子包含与B2M基因中的靶序列互补的靶向结构域,其中将修饰的角膜缘干细胞暴露于LATS抑制剂。
本发明还提供了修饰的角膜内皮细胞,其相对于未修饰的角膜内皮细胞具有降低或消除的B2M表达。
本发明进一步提供了修饰的角膜内皮细胞群,其相对于未修饰的角膜内皮细胞具有降低或消除的B2M表达。
在一个方面,修饰的角膜内皮细胞包括相对于未修饰的角膜内皮细胞在B2M处或附近的碱基对的插入或缺失,例如一个以上的碱基对的插入或缺失。在另一个方面,本发明提供了包括修饰的角膜内皮细胞的细胞群,其中在至少约30%的细胞中,至少一个所述插入或缺失是移码突变,例如,如通过下一代测序(NGS)所测量的。
本发明进一步提供了治疗患有眼疾病的患者的方法,所述方法包括:提供角膜缘干细胞群,其中所述角膜缘干细胞群已在LATS抑制剂存在下培养;将包含gRNA分子的CRISPR系统(例如酿脓链球菌Cas9 CRISPR系统)引入角膜缘干细胞群中,所述gRNA分子包含与B2M基因中的靶序列互补的靶向结构域;并将细胞群施用于有需要的患者。
本发明还提供了制备用于眼细胞疗法的修饰的角膜缘干细胞群的方法,所述方法包括:通过降低或消除B2M的表达来修饰角膜缘干细胞群,包括向角膜缘干细胞中引入具有靶向结构域的gRNA分子,所述靶向结构域包含SEQ ID NO:23-105或SEQ ID NO:108-119或SEQ ID NO:134-140中任一项的序列,其中所述角膜缘干细胞已经任选地在LATS抑制剂存在下培养;并进一步在包含LATS抑制剂的细胞培养基中扩增修饰的角膜缘干细胞。
在某些方面,可用于本发明的方法中的LATS抑制剂是具有式A1的化合物
或其盐。
在以下实施例中描述了本披露的非限制性实施例:
1.一种修饰的角膜缘干细胞,其相对于未修饰的角膜缘干细胞具有降低或消除的β-2-微球蛋白(B2M)表达,其中所述B2M表达被包含gRNA分子的CRISPR系统降低或消除,所述gRNA分子包含与B2M基因中的靶序列互补的靶向结构域。
2.一种修饰的角膜缘干细胞,其相对于未修饰的角膜缘干细胞具有降低或消除的β-2-微球蛋白(B2M)表达,其中所述B2M表达被包含编码gRNA分子的核酸分子的CRISPR系统降低或消除,所述gRNA分子包含与B2M基因中的靶序列互补的靶向结构域。
3.根据实施例1或2所述的修饰的角膜缘干细胞,其中所述修饰的角膜缘干细胞在包含大肿瘤抑制激酶(“LATS”)抑制剂的培养基中培养,任选地其中所述LATS抑制剂是具有式A1的化合物
或其盐,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
4.根据实施例3所述的修饰的角膜缘干细胞,其中所述化合物选自:N-甲基-2-(吡啶-4-基)-N-(1,1,1-三氟丙-2-基)吡啶并[3,4-d]嘧啶-4-胺;2-甲基-1-(2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙氧基)丙-2-醇;2,4-二甲基-4-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}戊-2-醇;N-叔丁基-2-(嘧啶-4-基)-1,7-萘啶-4-胺;2-(吡啶-4-基)-N-[1-(三氟甲基)环丁基]吡啶并[3,4-d]嘧啶-4-胺;N-丙基-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;2-(3-甲基-1H-吡唑-4-基)-N-(1-甲基环丙基)吡啶并[3,4-d]嘧啶-4-胺;2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙-1-醇;2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶;N-环戊基-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-丙基-2-(3-(三氟甲基)-1H-吡唑-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(2-甲基环戊基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;2-(3-氯吡啶-4-基)-N-(1,1,1-三氟-2-甲基丙-2-基)吡啶并[3,4-d]嘧啶-4-胺;2-(2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙氧基)乙-1-醇;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;(1S,2S)-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}环戊-1-醇;N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺;N-甲基-N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺和N-甲基-2-(吡啶-4-基)-N-[(2R)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
5.根据实施例3所述的修饰的角膜缘干细胞,其中所述化合物选自:3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶;N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺;和N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
6.根据实施例3所述的修饰的角膜缘干细胞,其中所述化合物选自:3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;和2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶。
7.根据实施例3所述的修饰的角膜缘干细胞,其中所述化合物选自:N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺;和N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
8.根据实施例3所述的修饰的角膜缘干细胞,其中所述化合物是N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺。
9.根据实施例3至8中任一项所述的修饰的角膜缘干细胞,其中所述化合物以3至10微摩尔的浓度存在。
10.根据实施例1-9中任一项所述的修饰的角膜缘干细胞,其中所述gRNA分子的靶向结构域与选自以下的基因组区域内的序列互补:chr15:44711469-44711494、chr15:44711472-44711497、chr15:44711483-44711508、chr15:44711486-44711511、chr15:44711487-44711512、chr15:44711512-44711537、chr15:44711513-44711538、chr15:44711534-44711559、chr15:44711568-44711593、chr15:44711573-44711598、chr15:44711576-44711601、chr15:44711466-44711491、chr15:44711522-44711547、chr15:44711544-44711569、chr15:44711559-44711584、chr15:44711565-44711590、chr15:44711599-44711624、chr15:44711611-44711636、chr15:44715412-44715437、chr15:44715440-44715465、chr15:44715473-44715498、chr15:44715474-44715499、chr15:44715515-44715540、chr15:44715535-44715560、chr15:44715562-44715587、chr15:44715567-44715592、chr15:44715672-44715697、chr15:44715673-44715698、chr15:44715674-44715699、chr15:44715410-44715435、chr15:44715411-44715436、chr15:44715419-44715444、chr15:44715430-44715455、chr15:44715457-44715482、chr15:44715483-44715508、chr15:44715511-44715536、chr15:44715515-44715540、chr15:44715629-44715654、chr15:44715630-44715655、chr15:44715631-44715656、chr15:44715632-44715657、chr15:44715653-44715678、chr15:44715657-44715682、chr15:44715666-44715691、chr15:44715685-44715710、chr15:44715686-44715711、chr15:44716326-44716351、chr15:44716329-44716354、chr15:44716313-44716338、chr15:44717599-44717624、chr15:44717604-44717629、chr15:44717681-44717706、chr15:44717682-44717707、chr15:44717702-44717727、chr15:44717764-44717789、chr15:44717776-44717801、chr15:44717786-44717811、chr15:44717789-44717814、chr15:44717790-44717815、chr15:44717794-44717819、chr15:44717805-44717830、chr15:44717808-44717833、chr15:44717809-44717834、chr15:44717810-44717835、chr15:44717846-44717871、chr15:44717945-44717970、chr15:44717946-44717971、chr15:44717947-44717972、chr15:44717948-44717973、chr15:44717973-44717998、chr15:44717981-44718006、chr15:44718056-44718081、chr15:44718061-44718086、chr15:44718067-44718092、chr15:44718076-44718101、chr15:44717589-44717614、chr15:44717620-44717645、chr15:44717642-44717667、chr15:44717771-44717796、chr15:44717800-44717825、chr15:44717859-44717884、chr15:44717947-44717972、chr15:44718119-44718144、chr15:44711563-44711585、chr15:44715428-44715450、chr15:44715509-44715531、chr15:44715513-44715535、chr15:44715417-44715439、chr15:44711540-44711562、chr15:44711574-44711596、chr15:44711597-44711619、chr15:44715446-44715468、chr15:44715651-44715673、chr15:44713812-44713834、chr15:44711579-44711601、chr15:44711542-44711564、chr15:44711557-44711579、chr15:44711609-44711631、chr15:44715678-44715700、chr15:44715683-44715705、chr15:44715684-44715706、chr15:44715480-44715502。
11.根据实施例10所述的修饰的角膜缘干细胞,其中所述gRNA分子的靶向结构域与选自以下的基因组区域内的序列互补:chr15:44715513-44715535、chr15:44711542-44711564、chr15:44711563-44711585、chr15:44715683-44715705、chr15:44711597-44711619、或chr15:44715446-44715468。
12.根据实施例10所述的修饰的角膜缘干细胞,其中所述gRNA分子的靶向结构域与基因组区域chr15:44711563-44711585内的序列互补。
13.根据实施例1-9中任一项所述的修饰的角膜缘干细胞,其中针对B2M的所述gRNA分子的靶向结构域包含以下靶向结构域,所述靶向结构域包含SEQ ID NO:23-105或108-119或134-140中任一项的序列。
14.根据实施例13所述的修饰的角膜缘干细胞,其中针对B2M的所述gRNA分子的靶向结构域包含以下靶向结构域,所述靶向结构域包含SEQ ID NO:108、111、115、116、134或138中任一项的序列。
15.根据实施例13所述的修饰的角膜缘干细胞,其中针对B2M的所述gRNA分子的靶向结构域包含以下靶向结构域,所述靶向结构域包含SEQ ID NO:108的序列。
16.根据实施例13所述的修饰的角膜缘干细胞,其中针对B2M的所述gRNA分子的靶向结构域包含以下靶向结构域,所述靶向结构域包含SEQ ID NO:115的序列。
17.根据实施例13所述的修饰的角膜缘干细胞,其中针对B2M的所述gRNA分子的靶向结构域包含以下靶向结构域,所述靶向结构域包含SEQ ID NO:116的序列。
18.根据实施例1-9中任一项所述的修饰的角膜缘干细胞,其中所述gRNA包含SEQID NO:120、160-177中任一项的序列。
19.根据实施例18所述的修饰的角膜缘干细胞,其中所述gRNA包含SEQ ID NO:120、162、166、167、171、和175中任一项的序列。
20.根据实施例18所述的修饰的角膜缘干细胞,其中所述gRNA包含SEQ ID NO:120的序列。
21.根据实施例18所述的修饰的角膜缘干细胞,其中所述gRNA包含SEQ ID NO:166的序列。
22.根据实施例18所述的修饰的角膜缘干细胞,其中所述gRNA包含SEQ ID NO:167的序列。
23.根据实施例1-22所述的修饰的角膜缘干细胞,其中所述CRISPR系统是酿脓链球菌Cas9 CRISPR系统。
24.根据实施例23所述的修饰的角膜缘干细胞,其中所述CRISPR系统包含Cas9分子,所述Cas9分子包含SEQ ID NO:106或107或SEQ ID NO:124至134中任一个。
25.根据实施例23所述的修饰的角膜缘干细胞,其中所述CRISPR系统包含Cas9分子,所述Cas9分子包含SEQ ID NO:106或107。
26.一种修饰的角膜缘干细胞,其包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑
(a)以缺失基因组DNA的包含SEQ ID NO:141至159中任一个的序列的连续延伸段,从而消除细胞中MHC I类分子的表面表达,或
(b)以在与gRNA分子的包含SEQ ID NO:23-105或108-119或134-140中任一项的序列的靶向结构域互补的靶序列处或附近形成插入/缺失,从而消除细胞中MHC I类分子的表面表达。
27.根据实施例26所述的修饰的角膜缘干细胞,其包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑:
(a)以缺失基因组DNA的包含SEQ ID NO:141、148或149中任一个的序列的连续延伸段,从而消除细胞中MHC I类分子的表面表达,或
(b)以在与gRNA分子结构域的包含SEQ ID NO:108、111、115、116、134或138中任一个的序列的靶向结构域互补的靶序列处或附近形成插入/缺失,从而消除细胞中MHC I类分子的表面表达。
28.根据实施例26所述的修饰的角膜缘干细胞,其包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被:
(a)编辑以缺失基因组DNA的包含SEQ ID NO:141的序列的连续延伸段,从而消除细胞中MHC I类分子的表面表达,或
(b)以在与gRNA分子结构域的包含SEQ ID NO:108中任一个的序列的靶向结构域互补的靶序列处或附近形成插入/缺失,从而消除细胞中MHC I类分子的表面表达。
29.一种修饰的角膜缘干细胞,其包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑:
(a)以缺失选自以下任一个的基因组DNA区域的连续延伸段:chr15:44711469-44711494、chr15:44711472-44711497、chr15:44711483-44711508、chr15:44711486-44711511、chr15:44711487-44711512、chr15:44711512-44711537、chr15:44711513-44711538、chr15:44711534-44711559、chr15:44711568-44711593、chr15:44711573-44711598、chr15:44711576-44711601、chr15:44711466-44711491、chr15:44711522-44711547、chr15:44711544-44711569、chr15:44711559-44711584、chr15:44711565-44711590、chr15:44711599-44711624、chr15:44711611-44711636、chr15:44715412-44715437、chr15:44715440-44715465、chr15:44715473-44715498、chr15:44715474-44715499、chr15:44715515-44715540、chr15:44715535-44715560、chr15:44715562-44715587、chr15:44715567-44715592、chr15:44715672-44715697、chr15:44715673-44715698、chr15:44715674-44715699、chr15:44715410-44715435、chr15:44715411-44715436、chr15:44715419-44715444、chr15:44715430-44715455、chr15:44715457-44715482、chr15:44715483-44715508、chr15:44715511-44715536、chr15:44715515-44715540、chr15:44715629-44715654、chr15:44715630-44715655、chr15:44715631-44715656、chr15:44715632-44715657、chr15:44715653-44715678、chr15:44715657-44715682、chr15:44715666-44715691、chr15:44715685-44715710、chr15:44715686-44715711、chr15:44716326-44716351、chr15:44716329-44716354、chr15:44716313-44716338、chr15:44717599-44717624、chr15:44717604-44717629、chr15:44717681-44717706、chr15:44717682-44717707、chr15:44717702-44717727、chr15:44717764-44717789、chr15:44717776-44717801、chr15:44717786-44717811、chr15:44717789-44717814、chr15:44717790-44717815、chr15:44717794-44717819、chr15:44717805-44717830、chr15:44717808-44717833、chr15:44717809-44717834、chr15:44717810-44717835、chr15:44717846-44717871、chr15:44717945-44717970、chr15:44717946-44717971、chr15:44717947-44717972、chr15:44717948-44717973、chr15:44717973-44717998、chr15:44717981-44718006、chr15:44718056-44718081、chr15:44718061-44718086、chr15:44718067-44718092、chr15:44718076-44718101、chr15:44717589-44717614、chr15:44717620-44717645、chr15:44717642-44717667、chr15:44717771-44717796、chr15:44717800-44717825、chr15:44717859-44717884、chr15:44717947-44717972、chr15:44718119-44718144、chr15:44711563-44711585、chr15:44715428-44715450、chr15:44715509-44715531、chr15:44715513-44715535、chr15:44715417-44715439、chr15:44711540-44711562、chr15:44711574-44711596、chr15:44711597-44711619、chr15:44715446-44715468、chr15:44715651-44715673、chr15:44713812-44713834、chr15:44711579-44711601、chr15:44711542-44711564、chr15:44711557-44711579、chr15:44711609-44711631、chr15:44715678-44715700、chr15:44715683-44715705、chr15:44715684-44715706、chr15:44715480-44715502,从而消除细胞中MHC I类分子的表面表达,或
(b)以在选自以下任一个的基因组DNA区域处或附近形成插入/缺失:chr15:44711469-44711494、chr15:44711472-44711497、chr15:44711483-44711508、chr15:44711486-44711511、chr15:44711487-44711512、chr15:44711512-44711537、chr15:44711513-44711538、chr15:44711534-44711559、chr15:44711568-44711593、chr15:44711573-44711598、chr15:44711576-44711601、chr15:44711466-44711491、chr15:44711522-44711547、chr15:44711544-44711569、chr15:44711559-44711584、chr15:44711565-44711590、chr15:44711599-44711624、chr15:44711611-44711636、chr15:44715412-44715437、chr15:44715440-44715465、chr15:44715473-44715498、chr15:44715474-44715499、chr15:44715515-44715540、chr15:44715535-44715560、chr15:44715562-44715587、chr15:44715567-44715592、chr15:44715672-44715697、chr15:44715673-44715698、chr15:44715674-44715699、chr15:44715410-44715435、chr15:44715411-44715436、chr15:44715419-44715444、chr15:44715430-44715455、chr15:44715457-44715482、chr15:44715483-44715508、chr15:44715511-44715536、chr15:44715515-44715540、chr15:44715629-44715654、chr15:44715630-44715655、chr15:44715631-44715656、chr15:44715632-44715657、chr15:44715653-44715678、chr15:44715657-44715682、chr15:44715666-44715691、chr15:44715685-44715710、chr15:44715686-44715711、chr15:44716326-44716351、chr15:44716329-44716354、chr15:44716313-44716338、chr15:44717599-44717624、chr15:44717604-44717629、chr15:44717681-44717706、chr15:44717682-44717707、chr15:44717702-44717727、chr15:44717764-44717789、chr15:44717776-44717801、chr15:44717786-44717811、chr15:44717789-44717814、chr15:44717790-44717815、chr15:44717794-44717819、chr15:44717805-44717830、chr15:44717808-44717833、chr15:44717809-44717834、chr15:44717810-44717835、chr15:44717846-44717871、chr15:44717945-44717970、chr15:44717946-44717971、chr15:44717947-44717972、chr15:44717948-44717973、chr15:44717973-44717998、chr15:44717981-44718006、chr15:44718056-44718081、chr15:44718061-44718086、chr15:44718067-44718092、chr15:44718076-44718101、chr15:44717589-44717614、chr15:44717620-44717645、chr15:44717642-44717667、chr15:44717771-44717796、chr15:44717800-44717825、chr15:44717859-44717884、chr15:44717947-44717972、chr15:44718119-44718144、chr15:44711563-44711585、chr15:44715428-44715450、chr15:44715509-44715531、chr15:44715513-44715535、chr15:44715417-44715439、chr15:44711540-44711562、chr15:44711574-44711596、chr15:44711597-44711619、chr15:44715446-44715468、chr15:44715651-44715673、chr15:44713812-44713834、chr15:44711579-44711601、chr15:44711542-44711564、chr15:44711557-44711579、chr15:44711609-44711631、chr15:44715678-44715700、chr15:44715683-44715705、chr15:44715684-44715706、chr15:44715480-44715502,从而消除细胞中MHC I类分子的表面表达。
30.根据实施例29所述的修饰的角膜缘干细胞,其包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑:
(a)以缺失选自以下的基因组DNA区域的连续延伸段:chr15:44715513-44715535、chr15:44711542-44711564、chr15:44711563-44711585、chr15:44715683-44715705、chr15:44711597-44711619、或chr15:44715446-44715468、或
(b)以在选自以下任一个的基因组DNA区域处或附近形成插入/缺失:chr15:44715513-44715535、chr15:44711542-44711564、chr15:44711563-44711585、chr15:44715683-44715705、chr15:44711597-44711619、或chr15:44715446-44715468。
31.根据实施例28所述的修饰的角膜缘干细胞,其包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑
(a)以缺失基因组DNA区域chr15:44711563-44711585的连续延伸段,从而消除细胞中MHC I类分子的表面表达,或:
(b)以在该基因组DNA区域处或附近形成插入/缺失,从而消除细胞中MHC I类分子的表面表达。
32.根据前述实施例中任一项所述的修饰的角膜缘干细胞,其中所述修饰的角膜缘干细胞包含在与gRNA分子的靶向结构域互补的靶序列处或附近形成的插入/缺失。
33.根据实施例26(b)、27(b)、28(b)、29(b)、30(b)或31(b)或32中任一项所述的修饰的角膜缘干细胞,其中所述插入/缺失包含10个或大于10个核苷酸缺失,任选地11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、或35个核苷酸缺失。
34.根据实施例26至33中任一项所述的修饰的角膜缘干细胞,其中所述修饰的角膜缘干细胞在包含大肿瘤抑制激酶(“LATS”)抑制剂的培养基中培养,任选地其中所述LATS抑制剂是具有式A1的化合物
或其盐,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
35.根据实施例34所述的修饰的角膜缘干细胞,其中所述化合物选自:N-甲基-2-(吡啶-4-基)-N-(1,1,1-三氟丙-2-基)吡啶并[3,4-d]嘧啶-4-胺;2-甲基-1-(2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙氧基)丙-2-醇;2,4-二甲基-4-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}戊-2-醇;N-叔丁基-2-(嘧啶-4-基)-1,7-萘啶-4-胺;2-(吡啶-4-基)-N-[1-(三氟甲基)环丁基]吡啶并[3,4-d]嘧啶-4-胺;N-丙基-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;2-(3-甲基-1H-吡唑-4-基)-N-(1-甲基环丙基)吡啶并[3,4-d]嘧啶-4-胺;2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙-1-醇;2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶;N-环戊基-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-丙基-2-(3-(三氟甲基)-1H-吡唑-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(2-甲基环戊基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;2-(3-氯吡啶-4-基)-N-(1,1,1-三氟-2-甲基丙-2-基)吡啶并[3,4-d]嘧啶-4-胺;2-(2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙氧基)乙-1-醇;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;(1S,2S)-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}环戊-1-醇;N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺;N-甲基-N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺和N-甲基-2-(吡啶-4-基)-N-[(2R)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
36.根据实施例34所述的修饰的角膜缘干细胞,其中所述化合物选自:3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶;N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺;和N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
37.根据实施例34所述的修饰的角膜缘干细胞,其中所述化合物选自:3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;和2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶。
38.根据实施例34所述的修饰的角膜缘干细胞,其中所述化合物选自:N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺;和N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
39.根据实施例34所述的修饰的角膜缘干细胞,其中所述化合物是N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺。
40.根据实施例34至39中任一项所述的修饰的角膜缘干细胞,其中所述化合物以3至10微摩尔的浓度存在。
41.根据实施例1-40中任一项所述的修饰的角膜缘干细胞,其中所述细胞相对于待施用所述细胞的患者是自体的。
42.根据实施例1-40中任一项所述的修饰的角膜缘干细胞,其中所述细胞相对于待施用所述细胞的患者是同种异体的。
43.一种制备用于眼细胞疗法的修饰的角膜缘干细胞或修饰的角膜缘干细胞群的方法,所述方法包括,
a)通过降低或消除B2M的表达来修饰角膜缘干细胞或角膜缘干细胞群,包括将包含具有靶向结构域的gRNA分子的CRISPR系统引入所述角膜缘干细胞或所述角膜缘干细胞群,所述靶向结构域
(i)包含SEQ ID NO:23-105或108-119、或134至140中任一项的序列,或
(ii)与选自以下的基因组区域内的序列互补:chr15:44711469-44711494、chr15:44711472-44711497、chr15:44711483-44711508、chr15:44711486-44711511、chr15:44711487-44711512、chr15:44711512-44711537、chr15:44711513-44711538、chr15:44711534-44711559、chr15:44711568-44711593、chr15:44711573-44711598、chr15:44711576-44711601、chr15:44711466-44711491、chr15:44711522-44711547、chr15:44711544-44711569、chr15:44711559-44711584、chr15:44711565-44711590、chr15:44711599-44711624、chr15:44711611-44711636、chr15:44715412-44715437、chr15:44715440-44715465、chr15:44715473-44715498、chr15:44715474-44715499、chr15:44715515-44715540、chr15:44715535-44715560、chr15:44715562-44715587、chr15:44715567-44715592、chr15:44715672-44715697、chr15:44715673-44715698、chr15:44715674-44715699、chr15:44715410-44715435、chr15:44715411-44715436、chr15:44715419-44715444、chr15:44715430-44715455、chr15:44715457-44715482、chr15:44715483-44715508、chr15:44715511-44715536、chr15:44715515-44715540、chr15:44715629-44715654、chr15:44715630-44715655、chr15:44715631-44715656、chr15:44715632-44715657、chr15:44715653-44715678、chr15:44715657-44715682、chr15:44715666-44715691、chr15:44715685-44715710、chr15:44715686-44715711、chr15:44716326-44716351、chr15:44716329-44716354、chr15:44716313-44716338、chr15:44717599-44717624、chr15:44717604-44717629、chr15:44717681-44717706、chr15:44717682-44717707、chr15:44717702-44717727、chr15:44717764-44717789、chr15:44717776-44717801、chr15:44717786-44717811、chr15:44717789-44717814、chr15:44717790-44717815、chr15:44717794-44717819、chr15:44717805-44717830、chr15:44717808-44717833、chr15:44717809-44717834、chr15:44717810-44717835、chr15:44717846-44717871、chr15:44717945-44717970、chr15:44717946-44717971、chr15:44717947-44717972、chr15:44717948-44717973、chr15:44717973-44717998、chr15:44717981-44718006、chr15:44718056-44718081、chr15:44718061-44718086、chr15:44718067-44718092、chr15:44718076-44718101、chr15:44717589-44717614、chr15:44717620-44717645、chr15:44717642-44717667、chr15:44717771-44717796、chr15:44717800-44717825、chr15:44717859-44717884、chr15:44717947-44717972、chr15:44718119-44718144、chr15:44711563-44711585、chr15:44715428-44715450、chr15:44715509-44715531、chr15:44715513-44715535、chr15:44715417-44715439、chr15:44711540-44711562、chr15:44711574-44711596、chr15:44711597-44711619、chr15:44715446-44715468、chr15:44715651-44715673、chr15:44713812-44713834、chr15:44711579-44711601、chr15:44711542-44711564、chr15:44711557-44711579、chr15:44711609-44711631、chr15:44715678-44715700、chr15:44715683-44715705、chr15:44715684-44715706、chr15:44715480-44715502,
其中所述角膜缘干细胞或所述角膜缘干细胞群任选地已经在LATS抑制剂存在下培养;以及
b)在包含LATS抑制剂的细胞培养基中进一步扩增所述修饰的角膜缘干细胞或所述修饰的角膜缘干细胞群;以及
c)任选地,通过荧光激活细胞分选(FACS)或磁性激活细胞分选(MACS),使所述角膜缘干细胞群富集降低或消除了B2M表达的角膜缘干细胞。
44.根据实施例43所述的方法,其中所述LATS抑制剂是具有式A1的化合物
或其盐,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
45.根据实施例44所述的方法,其中所述化合物选自:N-甲基-2-(吡啶-4-基)-N-(1,1,1-三氟丙-2-基)吡啶并[3,4-d]嘧啶-4-胺;2-甲基-1-(2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙氧基)丙-2-醇;2,4-二甲基-4-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}戊-2-醇;N-叔丁基-2-(嘧啶-4-基)-1,7-萘啶-4-胺;2-(吡啶-4-基)-N-[1-(三氟甲基)环丁基]吡啶并[3,4-d]嘧啶-4-胺;N-丙基-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;2-(3-甲基-1H-吡唑-4-基)-N-(1-甲基环丙基)吡啶并[3,4-d]嘧啶-4-胺;2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙-1-醇;2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶;N-环戊基-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-丙基-2-(3-(三氟甲基)-1H-吡唑-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(2-甲基环戊基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;2-(3-氯吡啶-4-基)-N-(1,1,1-三氟-2-甲基丙-2-基)吡啶并[3,4-d]嘧啶-4-胺;2-(2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙氧基)乙-1-醇;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;(1S,2S)-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}环戊-1-醇;N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺;N-甲基-N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺和N-甲基-2-(吡啶-4-基)-N-[(2R)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
46.根据实施例44所述的方法,其中所述化合物选自3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶;N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺;和N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
47.根据实施例44所述的方法,其中所述化合物选自3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;和2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶。
48.根据实施例44所述的方法,其中所述化合物选自:N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺;和N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
49.根据实施例44所述的方法,其中所述化合物是N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺。
50.根据实施例44至49中任一项所述的方法,其中所述化合物以3至10微摩尔的浓度存在。
51.根据实施例43-50中任一项所述的方法,其中所述CRISPR系统是酿脓链球菌Cas9 CRISPR系统。
52.根据实施例51所述的方法,其中所述CRISPR系统包含Cas9分子,所述Cas9分子包含SEQ ID NO:106或107或SEQ ID NO:124至134中任一个。
53.根据实施例51所述的方法,其中所述CRISPR系统包含Cas9分子,所述Cas9分子包含SEQ ID NO:106或107。
54.包含根据实施例1-42中任一项所述的修饰的角膜缘干细胞或通过根据实施例43-53中任一项所述的方法获得的修饰的角膜缘干细胞的细胞群。
55.根据实施例54所述的细胞群,其中所述修饰的角膜缘干细胞包含在与gRNA分子结构域的靶向结构域互补的靶序列处或附近形成的插入/缺失。
56.根据实施例55所述的细胞群,其中所述插入/缺失包含10个或大于10个核苷酸缺失,任选地11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、或35个核苷酸缺失。
57.根据实施例55或56所述的细胞群,其中所述插入/缺失在所述细胞群的细胞的至少约40%、例如至少约50%、例如至少约60%、例如至少约70%、例如至少约80%、例如至少约90%、例如至少约95%、例如至少约96%、例如至少约97%、例如至少约98%、例如至少约99%中形成,例如,如通过下一代测序和/或核苷酸插入测定法可检测到的。
58.根据实施例55至57中任一项所述的细胞群,其中在所述细胞群的细胞的不超过约5%、例如不超过约1%、例如不超过约0.1%、例如不超过约0.01%中检测到脱靶插入/缺失,例如,如通过下一代测序和/或核苷酸插入测定法可检测到的。
59.一种组合物,其包含根据实施例1至42中任一项所述的修饰的角膜缘干细胞或通过根据实施例43-53中任一项所述的方法获得的修饰的角膜缘干细胞或根据实施例54-58中任一项所述的细胞群或通过根据实施例43-53中任一项所述的方法获得的修饰的角膜缘干细胞群。
60.根据实施例54所述的组合物,其中所述修饰的角膜缘干细胞包含在与gRNA分子结构域的靶向结构域互补的靶序列处或附近形成的插入/缺失。
61.根据实施例55所述的组合物,其中所述插入/缺失包含10个或大于10个核苷酸缺失,任选地11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、或35个核苷酸缺失。
62.根据实施例55或56所述的组合物,其中所述插入/缺失在所述细胞群的细胞的至少约40%、例如至少约50%、例如至少约60%、例如至少约70%、例如至少约80%、例如至少约90%、例如至少约95%、例如至少约96%、例如至少约97%、例如至少约98%、例如至少约99%中形成。
63.根据实施例55至57中任一项所述的组合物,其中在所述细胞群的细胞的不超过约5%、例如不超过约1%、例如不超过约0.1%、例如不超过约0.01%中检测到脱靶插入/缺失,例如,如通过下一代测序和/或核苷酸插入测定法可检测到的。
64.根据实施例1至42中任一项所述的修饰的角膜缘干细胞或根据实施例54至58中任一项所述的细胞群或根据实施例59至63中任一项所述的组合物,用于治疗眼疾病。
65.用于根据实施例64所述使用的修饰的角膜缘干细胞或细胞群或组合物,其中所述眼疾病是角膜缘干细胞缺陷。
66.用于根据实施例65所述使用的修饰的角膜缘干细胞或细胞群或组合物,其中所述眼疾病是单侧角膜缘干细胞缺陷。
67.用于根据实施例65所述使用的修饰的角膜缘干细胞或细胞群或组合物,其中所述眼疾病是双侧角膜缘干细胞缺陷。
68.用于根据实施例59至62中任一项所述使用的修饰的角膜缘干细胞或细胞群或组合物,其中所述细胞相对于待施用所述细胞的患者是自体的。
69.用于根据实施例59至62中任一项所述使用的修饰的角膜缘干细胞或细胞群或组合物,其中所述细胞相对于待施用所述细胞的患者是同种异体的。
70.一种治疗患有眼疾病的患者的方法,所述方法包括以下步骤:向有需要的患者施用根据实施例1-42中任一项所述的修饰的角膜缘干细胞或根据实施例54至58中任一项所述的细胞群或根据实施例59至63中任一项所述的组合物。
71.根据实施例70所述的方法,其中所述眼疾病是角膜缘干细胞缺陷。
72.根据实施例71所述的方法,其中所述眼疾病是单侧角膜缘干细胞缺陷。
73.根据实施例71所述的方法,其中所述眼疾病是双侧角膜缘干细胞缺陷。
74.根据实施例71至73中任一项所述的方法,其中所述细胞相对于待施用所述细胞的患者是自体的。
75.根据实施例71至73中任一项所述的方法,其中所述细胞相对于待施用所述细胞的患者是同种异体的。
76.根据实施例1至42中任一项所述的修饰的角膜缘干细胞或根据实施例54至58中任一项所述的细胞群或根据实施例59至63中任一项所述的组合物在治疗眼疾病中的用途。
77.根据实施例76所述的用途,其中所述眼疾病是角膜缘干细胞缺陷。
本发明的其他特征和优点从以下详细说明和权利要求书将是清楚的。
V.附图说明
图1:如蛋白质印迹所示,LATS抑制剂(化合物实例3和实例4)在处理一小时内诱导LSC中的YAP脱磷酸化。
图2:在角膜缘干细胞培养物中p63-α的免疫标记表明,当LSC群维持在包含LATS抑制剂(化合物实例3和实例4)的培养基中时,它可以被扩增。图2A:在存在生长培养基和DMSO的情况下,只有少数分离的细胞附着在培养皿上,并且最多可以存活6天。大多数细胞表达人核标志物,但很少表达p63α。图2B和2C:相反,在存在LATS抑制剂的情况下:化合物实例编号3和实例编号4,细胞形成集落并表达p63α。所述结果表明,LATS抑制剂促进具有p63α阳性表型的细胞群的扩增。图2D:使细胞传代并在LATS抑制剂化合物的存在下培养它们两周使得细胞群扩增并形成表达p63α的融合培养物。
图3:FACS分析显示CRISPR介导的在sgRNA SEQ ID NO:120情况下的B2M缺失,以及随后在大约70%的LSC中发生的HLA A、B和C消除。
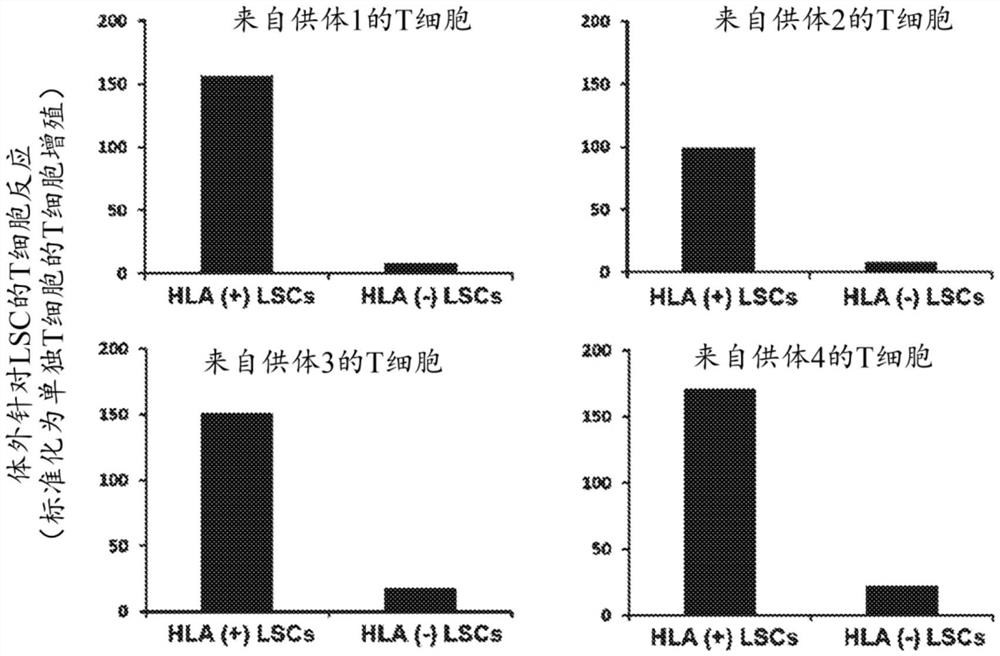
图4:图显示了与来自4个不同供体的CD8+T细胞共培养的基因编辑的LSC(CRISPR介导的用sgRNA SEQ ID NO:120的B2M缺失)的结果。
图5:B2M缺失的功效。图5显示了FACS数据,其检测基因编辑的角膜缘干细胞上的B2M表面蛋白,这些角膜缘干细胞用在表6中表示的sgRNA CR00442、CR000446、CR000455、1-CR004366、4-CR004366、6-HEYJA000001、8-HEYJA000004、和9-HEYJA000005进行了CRISPR编辑。所有sgRNA显示B2M表面蛋白敲除率在27%-62%之间。
图6:HLA A、B、C消除的功效。图6显示了FACS数据,其检测基因编辑的角膜缘干细胞上的HLA-ABC表面蛋白,这些角膜缘干细胞用在表6中表示的sgRNA CR00442、CR000446、CR000455、1-CR004366、4-CR004366、6-HEYJA000001、8-HEYJA000004、和9-HEYJA000005进行了CRISPR编辑。所有sgRNA显示HLA-ABC表面蛋白消除率为28%-60%。
图7:MACS介导的B2M阴性LSC的选择。图7显示了FACS数据,其检测基因编辑的角膜缘干细胞上的B2M表面蛋白,这些角膜缘干细胞在核转染后经MACS处理以获得B2M阴性LSC培养物。测试的所有sgRNA(在表6中表示的CR00442、CR000446、CR000455、1-CR004366、4-CR004366、6-HEYJA000001、8-HEYJA000004、和9-HEYJA000005)显示纯的(约99%至100%)B2M阴性LSC培养物。
图8:MACS介导的HLA A、B、C阴性LSC的选择。图8显示了FACS数据,其检测基因编辑的角膜缘干细胞上的HLA-ABC表面蛋白,这些角膜缘干细胞在核转染后经MACS处理以获得B2M/HLA-ABC阴性LSC培养物。测试的所有sgRNA(在表6中表示的CR00442、CR000446、CR000455、1-CR004366、4-CR004366、6-HEYJA000001、8-HEYJA000004、和9-HEYJA000005)显示纯的(约99%至100%)HLA-ABC阴性LSC培养物。
VI.具体实施方式
LATS是大肿瘤抑制激酶(large tumor suppressor kinase)的缩写。如本文所使用的LATS是指LATS1和/或LATS2。如本文所用的,LATS1是指大肿瘤抑制激酶1,LATS2是指大肿瘤抑制激酶2。LATS1和LATS2都具有丝氨酸/苏氨酸蛋白激酶活性。LATS1和LATS2已获得人类基因组组织(HUGO)基因命名委员会标识符:分别为HGNC ID 6514和HGNC ID 6515。LATS1在本领域中有时也称为WARTS或wts,而LATS2在本领域中有时也称为KPM。代表性的LATS序列包括但不限于可从美国国家生物技术信息中心蛋白质数据库以如下所示登录号NP_004681.1(LATS1)和NP_001257448.1(LATS1)和NP_055387.2(LATS 2)可获得的蛋白序列。
LATS1:NP_004681.1(丝氨酸/苏氨酸-蛋白激酶LATS1同种型1,智人)(SEQ ID NO:1)
1mkrsekpegy rqmrpktfpa snytvssrqm lqeireslrn lskpsdaaka ehnmskmste
61dprqvrnppk fgthhkalqe irnsllpfan etnssrstse vnpqmlqdlq aagfdedmvi
121qalqktnnrs ieaaiefisk msyqdprreq maaaaarpin asmkpgnvqq svnrkqswkg
181skeslvpqrh gpplgesvay hsespnsqtd vgrplsgsgi safvqahpsn gqrvnppppp
241qvrsvtpppp prgqtppprg ttppppswep nsqtkrysgn meyvisrisp vppgawqegy
301pppplntspm nppnqgqrgi ssvpvgrqpi imqssskfnf psgrpgmqng tgqtdfmihq
361nvvpagtvnr qppppyplta angqspsalq tggsaapssy tngsipqsmm vpnrnshnme
421lynisvpglq tnwpqsssap aqsspssghe iptwqpnipv rsnsfnnplg nrashsansq
481psattvtait papiqqpvks mrvlkpelqt alapthpswi pqpiqtvqps pfpegtasnv
541tvmppvaeap nyqgppppyp khllhqnpsv ppyesiskps kedqpslpke deseksyenv
601dsgdkekkqi ttspitvrkn kkdeerresr iqsyspqafk ffmeqhvenv lkshqqrlhr
661kkqlenemmr vglsqdaqdq mrkmlcqkes nyirlkrakm dksmfvkikt lgigafgevc
721larkvdtkal yatktlrkkd vllrnqvahv kaerdilaea dnewvvrlyy sfqdkdnlyf
781vmdyipggdm msllirmgif peslarfyia eltcavesvh kmgfihrdik pdnilidrdg
841hikltdfglc tgfrwthdsk yyqsgdhprq dsmdfsnewg dpsscrcgdr lkplerraar
901qhqrclahsl vgtpnyiape vllrtgytql cdwwsvgvil femlvgqppf laqtpletqm
961kvinwqtslh ippqaklspe asdliiklcr gpedrlgkng adeikahpff ktidfssdlr
1021qqsasyipki thptdtsnfd pvdpdklwsd dneeenvndt lngwykngkh pehafyeftf
1081rrffddngyp ynypkpieye yinsqgseqq sdeddqntgs eiknrdlvyv
LATS1:丝氨酸/苏氨酸-蛋白激酶LATS1同种型2[智人]
NCBI参考序列:NP_001257448.1(SEQ ID NO:2:)
1mkrsekpegy rqmrpktfpa snytvssrqm lqeireslrn lskpsdaaka ehnmskmste
61dprqvrnppk fgthhkalqe irnsllpfan etnssrstse vnpqmlqdlq aagfdedmvi
121qalqktnnrs ieaaiefisk msyqdprreq maaaaarpin asmkpgnvqq svnrkqswkg
181skeslvpqrh gpplgesvay hsespnsqtd vgrplsgsgi safvqahpsn gqrvnppppp
241qvrsvtpppp prgqtppprg ttppppswep nsqtkrysgn meyvisrisp vppgawqegy
301pppplntspm nppnqgqrgi ssvpvgrqpi imqssskfnf psgrpgmqng tgqtdfmihq
361nvvpagtvnr qppppyplta angqspsalq tggsaapssy tngsipqsmm vpnrnshnme
421lynisvpglq tnwpqsssap aqsspssghe iptwqpnipv rsnsfnnplg nrashsansq
481psattvtait papiqqpvks mrvlkpelqt alapthpswi pqpiqtvqps pfpegtasnv
541tvmppvaeap nyqgppppyp khllhqnpsv ppyesiskps kedqpslpke deseksyenv
601dsgdkekkqi ttspitvrkn kkdeerresr iqsyspqafk ffmeqhvenv lkshqqrlhr
661kkqlenemmr vkpfkmsifi lnhlfawclf
LATS 2:NP_055387.2丝氨酸/苏氨酸-蛋白激酶LATS2[智人]。((SEQ ID NO:3:)
1mrpktfpatt ysgnsrqrlq eireglkqps kssvqglpag pnsdtsldak vlgskdatrq
61qqqmratpkf gpyqkalrei rysllpfane sgtsaaaevn rqmlqelvna gcdqemagra
121lkqtgsrsie aaleyiskmg yldprneqiv rvikqtspgk glmptpvtrr psfegtgdsf
181asyhqlsgtp yegpsfgadg ptaleemprp yvdylfpgvg phgpghqhqh ppkgygasve
241aagahfplqg ahygrphllv pgeplgygvq rspsfqsktp petggyaslp tkgqggppga
301glafpppaag lyvphphhkq agpaahqlhv lgsrsqvfas dsppqslltp srnslnvdly
361elgstsvqqw paatlarrds lqkpgleapp rahvafrpdc pvpsrtnsfn shqprpgppg
421kaepslpapn tvtavtaahi lhpvksvrvl rpepqtavgp shpawvpapa papapapapa
481aegldakeeh alalggagaf pldveyggpd rrcppppypk hlllrskseq ydldslcagm
541eqslragpne peggdksrks akgdkggkdk kqiqtspvpv rknsrdeekr esriksyspy
601afkffmeqhv enviktyqqk vnrrlqleqe makaglceae qeqmrkilyq kesnynrlkr
661akmdksmfvk iktlgigafg evclackvdt halyamktlr kkdvlnrnqv ahvkaerdil
721aeadnewvvk lyysfqdkds lyfvmdyipg gdmmsllirm evfpehlarf yiaeltlaie
781svhkmgfihr dikpdnilid ldghikltdf glctgfrwth nskyyqkgsh vrqdsmepsd
841lwddvsncrc gdrlktleqr arkqhqrcla hslvgtpnyi apevllrkgy tqlcdwwsvg
901vilfemlvgq ppflaptpte tqlkvinwen tlhipaqvkl speardlitk lccsadhrlg
961rngaddlkah pffsaidfss dirkqpapyv ptishpmdts nfdpvdeesp wndasegstk
1021awdtltspnn khpehafyef tfrrffddng ypfrcpkpsg aeasqaessd lessdlvdqt
1081egcqpvyv
LATS被认为负向调节YAP1活性。“YAP1”是指是yes相关蛋白1,也称为YAP或YAP65,其是一种蛋白质,可作为参与细胞增殖的基因的转录调节剂。LATS激酶是丝氨酸/苏氨酸蛋白激酶,已显示其可直接磷酸化YAP,这导致YAP胞质保留和失活。在没有被LATS磷酸化的情况下,YAP易位到细胞核中,与DNA结合蛋白TEAD形成复合物,并导致下游基因表达。(BarryER&Camargo FD(2013)The Hippo superhighway:signaling crossroads converging onthe Hippo/Yap pathway in stem cells and development.[Hippo高速公路:在干细胞和发育中趋于汇合在Hippo/Yap途径上的信号传导十字路口]Current opinion in cellbiology[细胞生物学的最新观点]25(2):247-253.;Mo JS,Park HW,&Guan KL(2014)TheHippo signaling pathway in stem cell biology and cancer.[干细胞生物学和癌症中的Hippo信号传导通路]EMBO reports[EMBO报道]15(6):642-656;Pan D(2010)The hipposignaling pathway in development and cancer.[发育与癌症中的hippo信号传导通路]Developmental cell[发育细胞]19(4):491-505.)
Hippo/YAP途径涉及哺乳动物系统中的多种细胞类型和组织,包括各种癌症。特别是,Hippo途径明显涉及肠、胃和食道、胰腺、唾液腺、皮肤、乳腺、卵巢、前列腺、脑和神经系统、骨骼、软骨细胞、脂肪细胞、肌细胞、T淋巴细胞、B淋巴细胞、髓样细胞、肾脏和肺。参见Nishio等人,2017,Genes to Cells[细胞的基因]22:6-31。
游离形式或盐形式的具有式A1或其子式的化合物(例如式A2)是LATS1和/或LATS2的有效抑制剂。
在优选的实施例中,游离形式或盐形式的具有式A2或其子式的化合物是LATS1和LATS2的有效抑制剂。
LATS抑制剂
因此,本发明涉及具有式A2的化合物:
或其盐、或立体异构体,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;以及
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或,条件是当X
R
R
条件是:
(1)当X
(2)当X
除非另有说明,否则术语“本发明的化合物”是指具有式A1和其子式(例如式A2)的化合物、或其盐,以及所有立体异构体(包括非对映立体异构体和对映异构体)、旋转异构体、互变异构体和同位素标记的化合物(包括氘取代),以及固有形成的部分。
本文描述了本发明的各种(列举的)实施例。应认识到,每个实施例中指定的特征可以与其他指定特征组合以提供本发明的另外实施例。当实施例被描述为“根据”先前实施例时,先前实施例包括其子实施例,例如使得当实施例20被描述为“根据”实施例1至19时,实施例1至19包括实施例19和19A。
实施例1.一种细胞群扩增的方法,所述方法包括以下步骤:a)在LATS抑制剂存在下培养包含角膜缘干细胞的细胞群,以产生包含角膜缘干细胞的扩增的细胞群,其中所述角膜缘干细胞具有通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)的B2M的表达降低或消除,所述CRISPR系统是例如包含选自表1或表4或表6中所述的那些的gRNA的CRISPR系统。
实施例2.一种细胞群扩增的方法,该方法包括以下步骤:a)在LATS抑制剂存在下培养包含角膜内皮细胞的细胞群,以产生包含角膜内皮细胞的扩增的细胞群,其中所述角膜内皮细胞具有通过CRISPR系统(例如,包含选自表1或表4或表6中所述的那些的gRNA的CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统))的B2M的表达降低或消除。
实施例3.根据实施例1或实施例2所述的细胞群扩增的方法,其中所述LATS抑制剂是具有式A1的化合物
或其盐,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例4.一种细胞群扩增的方法,其包括以下步骤:a)在具有式A1的化合物的存在下培养包含角膜缘干细胞的接种细胞群,
或其盐以产生包含角膜缘干细胞的扩增的细胞群,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例5.一种细胞群扩增的方法,所述方法包括以下步骤:a)在具有式A1的化合物或其盐的存在下培养包含角膜内皮细胞的接种细胞群,
以产生包含角膜内皮细胞的扩增的细胞群,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例6.根据实施例3至实施例5所述的细胞群扩增的方法,其中所述化合物选自:N-甲基-2-(吡啶-4-基)-N-(1,1,1-三氟丙-2-基)吡啶并[3,4-d]嘧啶-4-胺;2-甲基-1-(2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙氧基)丙-2-醇;2,4-二甲基-4-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}戊-2-醇;N-叔丁基-2-(嘧啶-4-基)-1,7-萘啶-4-胺;2-(吡啶-4-基)-N-[1-(三氟甲基)环丁基]吡啶并[3,4-d]嘧啶-4-胺;N-丙基-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;2-(3-甲基-1H-吡唑-4-基)-N-(1-甲基环丙基)吡啶并[3,4-d]嘧啶-4-胺;2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙-1-醇;2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶;N-环戊基-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-丙基-2-(3-(三氟甲基)-1H-吡唑-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(2-甲基环戊基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;2-(3-氯吡啶-4-基)-N-(1,1,1-三氟-2-甲基丙-2-基)吡啶并[3,4-d]嘧啶-4-胺;2-(2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙氧基)乙-1-醇;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;(1S,2S)-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}环戊-1-醇;N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺;N-甲基-N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺和N-甲基-2-(吡啶-4-基)-N-[(2R)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
实施例7.根据实施例3至实施例5所述的细胞群扩增的方法,其中所述化合物选自3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶;N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺;和N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
实施例8.根据实施例3至实施例5所述的细胞群扩增的方法,其中所述化合物选自3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;和2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶。
实施例9.根据实施例3至实施例5所述的细胞群扩增的方法,其中所述化合物选自:N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺;和N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
实施例10.根据实施例3至实施例5所述的细胞群扩增的方法,其中所述化合物选自N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺。
实施例11.根据实施例3至实施例5所述的细胞群扩增的方法,其中所述化合物以0.5至100微摩尔,优选0.5至25微摩尔,更优选1至20微摩尔,特别优选约3至10微摩尔的浓度存在。
实施例12.根据实施例3至实施例5所述的细胞群扩增的方法,其中在步骤a)中所述化合物存在一至两周,随后进行步骤b),其中所述细胞在不补充所述化合物的情况下在生长培养基中培养一段时间,优选地,所述段时间为一至两周。
实施例13.根据实施例1至实施例5所述的细胞群扩增的方法,其中所述方法产生细胞接种量的大于10倍的扩增。
实施例14.根据实施例1至实施例5所述的细胞群扩增的方法,其中所述方法产生细胞接种量的15倍至600倍,优选地20倍至550倍的扩增。
实施例15.根据实施例1或实施例2所述的细胞群扩增的方法,其中所述LATS抑制剂抑制LATS1和LATS2。
实施例16.根据实施例2至实施例3或实施例5至实施例15中任一项所述的细胞群扩增的方法,其中所述方法进一步包括对所述角膜内皮细胞进行遗传修饰。
实施例17.根据实施例1或实施例4或实施例6至实施例15中任一项所述的细胞群扩增的方法,其中所述方法进一步包括对所述角膜缘干细胞进行遗传修饰。
实施例18.根据实施例16或实施例17所述的细胞群扩增的方法,其中所述遗传修饰包括降低或消除与促进宿主抗移植免疫应答相关的基因的表达和/或功能。
实施例19.根据实施例16至实施例18中任一项所述的细胞群扩增的方法,其中所述遗传修饰包括将基因编辑系统引入所述细胞,所述基因编辑系统特异性靶向与促进宿主抗移植免疫应答有关的基因。
实施例20.根据实施例19所述的细胞群扩增的方法,其中所述基因编辑系统是CRISPR基因编辑系统。
实施例21.根据实施例16至实施例20中任一项所述的细胞群扩增的方法,其中所述基因是B2M。
实施例22.根据实施例1至实施例21中任一项所述的细胞群扩增的方法,该方法包括在产生扩增的细胞群之后漂洗那些细胞以基本上去除所述化合物的进一步步骤。
实施例23.一种通过根据实施例1至实施例22中任一项所述的方法可获得的细胞群。
实施例24.一种通过根据实施例1至实施例22中任一项所述的方法获得的细胞群。
实施例25.一种包含角膜内皮细胞的细胞群或根据实施例23或实施例24所述的细胞群,其中所述细胞中的一个或多个包含与促进宿主抗移植免疫应答相关的基因的一个或多个核酸残基的非天然发生的插入或缺失,其中插入和/或缺失导致所述基因的表达或功能降低或消除。
实施例26.根据实施例25所述的细胞群,其中所述基因是B2M。
实施例27.一种包含根据实施例25或实施例26所述的细胞群的组合物。
实施例28.一种培养细胞的方法,所述方法包括在LATS抑制剂存在下培养包含角膜内皮细胞的细胞群。
实施例29.根据实施例28所述的培养细胞的方法,其中所述LATS抑制剂是具有式A1的化合物,
或其盐,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例30.一种培养细胞的方法,其包括在具有式A1的化合物或其盐的存在下培养包含角膜内皮细胞的细胞群,
其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例31.一种培养细胞的方法,该方法包括在LATS抑制剂的存在下培养包含角膜缘干细胞的细胞群。
实施例32.根据实施例31所述的培养细胞的方法,其中所述LATS抑制剂是具有式A1的化合物,
或其盐,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例33.一种培养细胞的方法,其包括在具有式A1的化合物或其盐的存在下培养包含角膜缘干细胞的细胞群,
其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例34.具有式A1的化合物或其盐
在产生、优选离体产生扩增的角膜缘干细胞群的方法中的用途,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例35.具有式A1的化合物或其盐
在产生、优选离体产生扩增的角膜内皮细胞群的方法中的用途,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例36.根据实施例34或实施例35的具有式A1的化合物或其盐的用途,其中所述化合物是具有选自式I至IV的式的化合物:
实施例37.根据实施例34或实施例35的具有式A1的化合物或其盐的用途,其中所述化合物选自3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;和2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶。
实施例38.根据实施例34或实施例35的具有式A1的化合物或其盐的用途,其中所述化合物选自:N-甲基-2-(吡啶-4-基)-N-(1,1,1-三氟丙-2-基)吡啶并[3,4-d]嘧啶-4-胺;2-甲基-1-(2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙氧基)丙-2-醇;2,4-二甲基-4-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}戊-2-醇;N-叔丁基-2-(嘧啶-4-基)-1,7-萘啶-4-胺;2-(吡啶-4-基)-N-[1-(三氟甲基)环丁基]吡啶并[3,4-d]嘧啶-4-胺;N-丙基-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;2-(3-甲基-1H-吡唑-4-基)-N-(1-甲基环丙基)吡啶并[3,4-d]嘧啶-4-胺;2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙-1-醇;2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶;N-环戊基-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-丙基-2-(3-(三氟甲基)-1H-吡唑-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(2-甲基环戊基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;2-(3-氯吡啶-4-基)-N-(1,1,1-三氟-2-甲基丙-2-基)吡啶并[3,4-d]嘧啶-4-胺;2-(2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙氧基)乙-1-醇;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;(1S,2S)-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}环戊-1-醇;N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺;N-甲基-N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺和N-甲基-2-(吡啶-4-基)-N-[(2R)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
实施例39.根据实施例34或实施例35的具有式A1的化合物或其盐的用途,其中所述化合物选自:N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺;和N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
实施例40.根据实施例34或实施例35的具有式A1的化合物或其盐的用途,其中所述化合物是N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺。
实施例41.一种治疗眼疾病或障碍的方法,该方法包括向有需要的受试者施用修饰的细胞群,其中该细胞群已经在具有式A1的化合物或其盐的存在下生长,
其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例42.一种治疗眼疾病或障碍的方法,所述方法包括向有需要的受试者施用修饰的角膜缘干细胞群,其中所述群已经在具有式A1的化合物或其盐的存在下生长,
其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例43.一种治疗眼疾病或障碍的方法,所述方法包括向有需要的受试者施用修饰的角膜内皮细胞群,其中所述群已经在具有式A1的化合物或其盐的存在下生长,
其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例44.根据实施例41至实施例43所述的治疗眼疾病或障碍的方法,其中所述化合物具有选自式I至IV的式:
实施例45.根据实施例41至实施例43所述的治疗眼疾病或障碍的方法,其中所述化合物选自3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶;N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺;和N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
实施例46.根据实施例41至实施例43所述的治疗眼疾病或障碍的方法,其中所述化合物选自:N-甲基-2-(吡啶-4-基)-N-(1,1,1-三氟丙-2-基)吡啶并[3,4-d]嘧啶-4-胺;2-甲基-1-(2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙氧基)丙-2-醇;2,4-二甲基-4-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}戊-2-醇;N-叔丁基-2-(嘧啶-4-基)-1,7-萘啶-4-胺;2-(吡啶-4-基)-N-[1-(三氟甲基)环丁基]吡啶并[3,4-d]嘧啶-4-胺;N-丙基-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺;2-(3-甲基-1H-吡唑-4-基)-N-(1-甲基环丙基)吡啶并[3,4-d]嘧啶-4-胺;2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙-1-醇;2-(吡啶-4-基)-4-(3-(三氟甲基)哌嗪-1-基)吡啶并[3,4-d]嘧啶;N-环戊基-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-丙基-2-(3-(三氟甲基)-1H-吡唑-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(2-甲基环戊基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;2-(3-氯吡啶-4-基)-N-(1,1,1-三氟-2-甲基丙-2-基)吡啶并[3,4-d]嘧啶-4-胺;2-(2-甲基-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}丙氧基)乙-1-醇;N-(1-甲基环丙基)-7-(吡啶-4-基)异喹啉-5-胺;(1S,2S)-2-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}环戊-1-醇;N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺;N-甲基-N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;N-(丙-2-基)-2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-胺;3-(吡啶-4-基)-N-(1-(三氟甲基)环丙基)-2,6-萘啶-1-胺和N-甲基-2-(吡啶-4-基)-N-[(2R)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
实施例47.根据实施例41至实施例43所述的治疗眼疾病或障碍的方法,其中所述化合物选自:N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺;和N-甲基-2-(吡啶-4-基)-N-[(2S)-1,1,1-三氟丙-2-基]吡啶并[3,4-d]嘧啶-4-胺。
实施例48.根据实施例41至实施例43所述的治疗眼疾病或障碍的方法,其中所述化合物是N-(叔丁基)-2-(吡啶-4-基)-1,7-萘啶-4-胺。
实施例49.一种促进修饰的角膜缘干细胞或修饰的角膜内皮细胞的细胞增殖的方法,所述方法包括在包含具有式A1的化合物或其盐的细胞增殖培养基中培养所述修饰的角膜缘干细胞或所述修饰的角膜内皮细胞,
其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例50.一种包含LATS抑制剂和修饰的角膜内皮细胞的细胞制剂。
实施例51.根据实施例50所述的细胞制剂,其中所述LATS抑制剂是具有式A1的化合物,
其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例52.一种细胞制剂,其包含具有式A1的化合物,
和修饰的角膜内皮细胞,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例53.一种包含LATS抑制剂和修饰的角膜缘干细胞的细胞制剂。
实施例54.根据实施例53所述的细胞制剂,其中所述LATS抑制剂是具有式A1的化合物,
其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例55.一种细胞制剂,其包含具有式A1的化合物,
和修饰的角膜缘干细胞,其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例56.根据实施例50至实施例55中任一项所述的细胞制剂,其进一步包含生长培养基,其中所述生长培养基选自由以下组成的组:补充胎牛血清的杜氏改良伊戈尔培养基、具有人血清的无人内皮血清的培养基、X-VIVO15培养基和间充质干细胞条件培养基;优选地X-VIVO15培养基。
实施例57.一种离体扩增修饰的细胞的群的方法,所述方法包括使所述细胞与具有式A1的化合物接触,
其中
X
环A是
(a)5或6元单环杂芳基,其通过碳环成员与分子的其余部分连接,并包含1至4个独立地选自N、O和S的杂原子作为环成员,条件是所述杂原子环成员中至少一个是在5元杂芳基的相对于连接碳环成员的3位或4位的或在6元杂芳基的对位环位置上的未经取代的氮(-N=);或
(b)选自以下的9元稠合双环杂芳基
其中“*”代表环A与分子其余部分的附接点;
其中环A未经取代或经1至2个独立地选自卤素、氰基、C
R
R
R
(a)未经取代的或经1至3个独立地选自以下的取代基取代的C
(i)卤素;
(ii)氰基;
(iii)氧代;
(iv)C
(v)C
(vi)C
(vii)-OR
(viii)-NR
(ix)-C(O)R
(x)-S(O)
(xi)单环C
(xii)6元杂环烷基,其包含1至2个独立地选自N、O和S的杂原子作为环成员,且其未经取代或经1至2个独立地选自羟基、卤素、C
(xiii)未经取代或经卤素取代的苯基;
(xiv)5或6元单环杂芳基,其包含1至4个独立地选自N和O的杂原子作为环成员;以及
(xv)9或10元稠合双环杂芳基,其包含1至2个独立地选自N和O的杂原子作为环成员;
(b)-S(O)
(c)未经取代的或经1至2个独立地选自卤素、C
(d)未经取代的或经1至2个独立地选自以下的取代基取代的C
(e)4元杂环烷基,其包含1至2个选自N、O和S的杂原子作为环成员,并且未经取代或经1至2个独立地选自以下的取代基取代:C
或R
R
R
实施例58.根据实施例57所述的方法,其中所述修饰的细胞是基因编辑的细胞。
实施例59.通过根据实施例57至58中任一项所述的方法获得的细胞。
在一个实施例中,所述本发明的化合物以约0.5至约100微摩尔,优选为约0.5至约25微摩尔,更优选为约1至约20微摩尔,特别优选为约3至约10微摩尔的浓度存在。在一个实施例中,所述本发明的化合物以0.5至100微摩尔,优选0.5至25微摩尔,更优选1至20微摩尔,特别优选为3至10微摩尔的浓度存在。在一个具体的实施例中,所述本发明的化合物以3至10微摩尔的浓度存在。
在另一个实施例中,本发明涉及一种治疗眼疾病或障碍的方法,所述方法包括向有需要的受试者施用细胞群(例如,包含通过CRISPR系统降低或消除B2M表达的修饰的角膜缘干细胞的细胞群),其中所述群已在能够抑制LATS1和LATS2激酶活性的试剂存在下生长;从而诱导YAP易位并驱动下游基因表达以促进细胞增殖。在另外的实施例中,所述试剂是具有式A1或其子式(例如式A2)的化合物或其药学上可接受的盐。
在另一个实施例中,本发明涉及一种治疗眼疾病或障碍的方法,所述方法包括向有需要的受试者施用角膜缘干细胞群(例如,包含通过CRISPR系统降低或消除B2M表达的修饰的角膜缘干细胞的细胞群),其中所述群已在能够抑制LATS1和LATS2激酶活性的试剂存在下生长;从而诱导YAP易位并驱动下游基因表达以促进细胞增殖。在另外的实施例中,所述试剂是具有式A1或其子式(例如式A2)的化合物或其药学上可接受的盐。
在另一个实施例中,本发明涉及一种治疗眼疾病或障碍的方法,所述方法包括向有需要的受试者施用角膜内皮细胞群(例如,包含通过CRISPR系统降低或消除B2M表达的修饰的角膜内皮细胞的细胞群),其中所述群已在能够抑制LATS1和LATS2激酶活性的试剂存在下生长;从而诱导YAP易位并驱动下游基因表达以促进细胞增殖。在另外的实施例中,所述试剂是具有式A1或其子式(例如式A2)的化合物或其药学上可接受的盐。
在另一个实施例中,本发明涉及促进眼伤口愈合的方法,所述方法包括向受试者的眼施用治疗有效量的细胞群(例如,包含通过CRISPR系统降低或消除B2M表达的修饰的细胞的细胞群),所述细胞群是通过根据本发明的细胞群扩增的方法可获得或获得的。在一个实施例中,眼伤口是角膜伤口。在其他实施例中,眼伤口是损伤或手术伤口。
除非另有说明,否则上文和下文中使用的通用术语优选在本发明的上下文中具有以下含义,其中无论在什么情况下使用的更通用的术语可以彼此独立地由更具体的定义代替或保留,从而定义本发明的更详细实施例。
在本文描述的所有方法能够以任何合适顺序进行,除非本文另外指明或另外与上下文明显相矛盾。本文提供的任何和所有实例或示例性语言(例如“如”)的使用仅旨在更好地说明本发明,而不对另外要求保护的本发明范围做出限制。
如本文所使用的,术语“一个/种(a,an)”,“所述(the)”以及在本发明的上下文中使用的类似术语(特别是在权利要求的上下文中)应被解释为涵盖单数和复数二者,本文中除非另外指示或与上下文明显相矛盾。
如本文所使用的,术语“C
如本文所使用的,术语“C
如本文所使用的,术语“亚烷基”是指二价烷基基团。例如,如本文所使用的,术语“C
如本文所使用的,术语“C
如本文所使用的,术语“C
如本文所使用的,术语“C
如本文所使用的,术语“二-(C
如本文所使用的,术语“氰基”是指基团*-C≡N。
如本文所使用的,术语“环烷基”是指作为完全氢化的环的非芳香族碳环,包括单环-、双环-或多环-系统。“C
如本文所使用的,术语“稠合环”是指多环组件,其中包含所述环组件的环如此连接,使得两个环共有的环原子彼此直接键合。稠合环组件可以是饱和的、部分饱和的、芳香族的、碳环的、杂环的等。常见稠合环的非排他性实例包括十氢化萘、萘、蒽、菲、吲哚、苯并呋喃、嘌呤、喹啉等。
如本文所使用的,术语“卤素”是指溴、氯、氟或碘;优选地氟、氯或溴。
如本文所使用的,术语“卤代烷基”旨在包括具有指定碳原子数的、经一个或多个卤素取代的、如上述定义的支链和直链饱和烷基。例如,“C
如本文所使用的,术语“杂烷基”是指如本文所定义的烷基,其中烷基链内的一个或多个碳原子被独立地选自N、O和S的杂原子替代。在如本文所使用的C
如本文所使用的,术语“杂芳基”是指在5至10元芳香族环系统内含有至少一个杂原子(例如,氧、硫、氮或其组合)的芳香族部分。杂芳基的实例包括但不限于吡咯基、吡啶基、吡唑基、吲哚基、吲唑基、噻吩基、呋喃基、苯并呋喃基、噁唑基、异噁唑基、咪唑基、三唑基、四唑基、三嗪基、嘧啶基、吡嗪基、噻唑基、嘌呤基、苯并咪唑基、喹啉基、异喹啉基、喹喔啉基、苯并吡喃基、苯并噻吩基、苯并咪唑基、苯并噁唑基和1H-苯并[d][1,2,3]三唑基。杂芳香族部分可以由单环或稠合环系统组成。典型的单杂芳基环是含有1至4个独立地选自N,O和S的杂原子的5至6元环,典型的稠合杂芳基环系是9至10元环独立地含有1至4个杂原子的环系统稠合的杂芳基环系统可以由稠合在一起的两个杂芳基环或稠合至芳基(例如苯基)的杂芳基组成。
如本文使用的,术语“杂原子”是指氮(N),氧(O)或硫(S)原子。除非另有说明,否则任何具有不满足的化合价的杂原子均假定具有足以满足化合价的氢原子,并且当杂原子是硫时,其可以被未氧化(S)或被氧化为S(O)或S(O)
如本文使用的,术语“羟基(hydroxyl或hydroxyl)”是指基团-OH。
如本文所使用的,术语“杂环烷基”意指如本申请中所定义的环烷基,条件是所指示的环碳中的一个或多个被选自以下的部分替代:-O-、-N=、-NH-、-S-、-S(O)-和-S(O)
如本文所使用的,术语“氧代”是指二价基团=O。
如本文所使用的,术语“经取代的”是指至少一个氢原子被非氢基团替代,条件是维持正常的化合价并且取代产生稳定的化合物。在取代基是氧代(即,=O)时,那么原子上的两个氢被替代。在本发明的化合物中存在氮原子(例如胺)的情况下,可以通过用氧化剂(例如,mCPBA和/或过氧化氢)处理将其转化为N-氧化物以提供本发明的其他化合物。
如本文使用的术语“未经取代的氮”是指由于其通过双键和单键(-N=)与其相邻的环原子的键合而没有取代能力的氮环原子。例如,在4-吡啶基
如本领域普通技术人员将能够理解,例如,分子中的酮(-CH-C(=O)-)基团可以互变异构成其烯醇形式(-C=C(OH)-)。因此,本发明旨在覆盖所有可能的互变异构体,即使当结构仅描述其中之一时也是如此。
如本文所用,
当任何变量在本发明的化合物的任何成分或化学式中出现不止一次时,则每次出现时其定义独立于其他每次出现时的其定义。因此,例如,如果显示一个基团经0-3个R基团取代,则所述基团可以未经取代或经至多三个R基团取代,并且在每次出现时,R是独立于R的定义选择的。
除非另有说明,否则术语“本发明的化合物(compound of the presentinvention或compounds of the present invention)”是指具有式A1及其子式(例如式A2)的化合物,以及异构体,例如立体异构体(包括非对映异构体、对映异构物和外消旋体)、几何异构体、构象异构体(包括旋转异构体和阻转异构体)、互变异构体、同位素标记的化合物(包括氘取代)、和固有形成的部分(例如,多晶型物、溶剂化物和/或水合物)。当存在能够形成盐的部分时,则也包括盐,特别是药学上可接受的盐。
本领域普通技术人员将认识到,本发明的化合物可以含有手性中心,因此可以不同的异构体形式存在。如本文所使用的,术语“异构体”是指具有相同分子式但原子的排列和构型不同的本发明的不同化合物。
如本文所使用的,术语“对映异构体”是彼此为不能重叠镜像的一对立体异构体。对映异构体对的1:1混合物是“外消旋”混合物。如本文所使用的,所述术语用于在适当的情况下表示外消旋混合物。当指定本发明化合物的立体化学时,使用常规的RS系统指定具有两个手性中心的已知相对和绝对构型的单一立体异构体(例如(1S,2S));具有已知相对构型但绝对构型未知的单一立体异构体用星号表示(例如(1R*,2R*));和具有两个字母的外消旋体(例如(1RS,2RS))是(1R,2R)和(1S,2S)的外消旋混合物;(1RS,2SR)是(1R,2S)和(1S,2R)的外消旋混合物)。如本文所使用的,术语“非对映异构体”是具有至少两个非对称原子,但其彼此非镜像的立体异构体。绝对立体化学是根据Cahn-lngold-Prelog R-S系统规定。当本发明的化合物是纯对映体时,每个手性碳处的立体化学可以通过R或S表示。未知绝对构型的本发明的拆分的化合物可以取决于其使波长为钠D线的平面偏振光旋转的方向(右旋或左旋)来指定(+)或(-)。可替代地,可以通过手性HPLC通过相应的对映异构体/非对映异构体的各自保留时间来定义本发明的拆分的化合物。
本文所述的本发明的某些化合物含有一个或多个不对称中心或不对称轴,并且因此可以生成对映异构体、非对映异构体、以及其他立体异构形式,可以根据绝对立体化学将其定义为(R)-或(S)-。
当本发明的化合物含有双键或其他赋予分子一定量的结构刚性的一些其他特征时,可能会出现几何异构体。如果所述化合物含有双键,取代基可以是E或Z构型。如果所述化合物含有二取代的环烷基,环烷基取代基可以具有顺式-或反式-构型。
如本文所使用的,术语“构象的异构体”或“构象异构体”是可以绕一个或多个键旋转而不同的异构体。旋转异构体是通过仅绕一个键旋转而不同的构象异构体。
如本文所使用的,术语“阻转异构体”是指基于分子中受限制的旋转而产生的轴向或平面手性的结构异构体。
除非另有说明,否则本发明的化合物意指包括所有此类可能的异构体,包括外消旋混合物、光学纯形式以及中间体混合物。光学活性(R)-和(S)-异构体可使用手性合成子或手性试剂制备,或使用常规技术(例如使用适当的溶剂或溶剂混合物在手性SFC或HPLC色谱柱(例如大赛璐公司(DAICEL Corp.)提供的
本发明的化合物可以光学活性或外消旋形式分离。光学活性形式可以通过拆分外消旋形式或由光学活性起始材料合成来制备。用于制备本发明化合物和其中制备的中间体的所有方法均被认为是本发明的一部分。当制备对映异构体或非对映异构体产物时,它们可以通过常规方法分离,例如通过色谱法或分步结晶法。
如本文所使用的,术语“LATS”是大肿瘤抑制蛋白激酶的缩写。如本文所使用的,术语“LATS”是指LATS1和/或LATS2。如本文所使用的,术语“LATS1”是指大肿瘤抑制激酶1,且术语“LATS2”是指大肿瘤抑制激酶2。LATS1和LATS2都具有丝氨酸/苏氨酸蛋白激酶活性。
如本文所使用的,术语“YAP1”是指是yes相关蛋白1,也称为YAP或YAP65,其是一种蛋白质,可作为参与细胞增殖的基因的转录调节剂。
如本文所使用的,术语“MST1/2”是指哺乳动物不育20样激酶-1和-2。
术语“有效量”或“治疗有效量”在本文中可互换使用,并且是指如本文描述的化合物、配制品、材料或组合物的有效于实现特定的生物学结果的量。
如本文所使用的,术语本发明的化合物的“治疗有效量”是指将引起受试者的生物或医学响应(例如,酶或蛋白活性的减小或抑制,或改善症状、缓解病症、减慢或延迟疾病进展或预防疾病等)的本发明的化合物的量。在一个非限制性实施例中,如本文所使用的术语“治疗有效量”是指本发明的LATS化合物在施用至受试者时有效(1)至少部分缓解、抑制、预防和/或改善(i)由LATS活性介导的,或(ii)以LATS的活性(正常或异常)为特征的病症、或障碍或疾病;或(2)降低或抑制LATS的活性;或(3)降低或抑制LATS的表达的量。在另一个非限制性实施例中,如本文所使用的术语“治疗有效量”是指当被施用至细胞、或组织、或非细胞生物材料、或介质时有效地至少部分降低或抑制LATS活性;或至少部分地降低或抑制表达LATS的表达的量。
此外,如本文所使用的,本发明的修饰的角膜缘干细胞的术语“治疗有效量”是指引发受试者的生物学或医学应答,例如改善症状、缓解病症、缓慢或延迟疾病进展、抑制或预防疾病(特别是眼疾病,特别是角膜缘干细胞缺陷)的本发明的细胞的量。
如本文所使用的,术语“受试者”包括人和非人动物。非人动物包括脊椎动物,例如哺乳动物和非哺乳动物,例如非人灵长类、绵羊、猫、马、牛、鸡、狗、小鼠、大鼠、山羊、兔和猪。优选地,受试者是人。除非指出时,否则所述术语“患者”或“受试者”在本文中可互换地使用。
如本文所使用的,术语“IC
如本文所使用的,术语任何疾病或障碍的“治疗(treat、treating或treatment)”是指缓解或改善疾病或障碍(即,减慢或阻止疾病或其至少一种临床症状的发展);或缓解或减轻与所述疾病或障碍相关的至少一种物理参数或生物标记,包括患者可能无法辨别的那些物理参数或生物标记。
如本文所使用的,术语任何疾病或障碍的“预防(prevent、preventing或prevention)”是指疾病或障碍的预防性治疗;或延迟疾病或障碍的发作或进展。
如本文所使用的,如果受试者将在生物学上、在医学上或在生活质量上从治疗中获益,则这类受试者是“需要”这种治疗的。
取决于工艺条件,本发明的化合物以游离(中性)或盐形式获得。这些化合物的游离形式和盐形式,特别是“药学上可接受的盐”均在本发明的范围内。
如本文所使用的,术语“盐(salt或salts)”是指本发明化合物的酸加成盐或碱加成盐。“盐”特别包括“药学上可接受的盐”。如本文所使用的,术语“药学上可接受的盐”是指保留本发明的化合物的生物有效性和特性,并且通常不是生物学上或其他方面不希望的盐。在许多情况下,由于氨基和/或羧基基团或与其类似的基团的存在,本发明的化合物能够形成酸盐和/或碱盐。可以用无机酸和有机酸形成药学上可接受的酸加成盐。
可以衍生出盐的无机酸包括例如盐酸、氢溴酸、硫酸、硝酸、磷酸等。
可以衍生出盐的有机酸包括例如乙酸、丙酸、乙醇酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、扁桃酸、甲磺酸、乙磺酸、甲苯磺酸、磺基水杨酸等。
可以用无机碱和有机碱形成药学上可接受的碱加成盐。
可以衍生出盐的无机碱包括例如铵盐和来自元素周期表第I至XII列的金属。在某些实施例中,盐衍生自钠、钾、铵、钙、镁、铁、银、锌和铜;特别合适的盐包括铵盐、钾盐、钠盐、钙盐和镁盐。
可以衍生出盐的有机碱包括例如伯胺、仲胺和叔胺;取代的胺(包括天然存在的取代的胺);环胺;碱性离子交换树脂等。某些有机胺包括异丙胺、苄星、胆碱盐、二乙醇胺、二乙胺、赖氨酸、葡甲胺、哌嗪和氨丁三醇。
在另一个方面,本发明提供了呈以下形式的具有式A1或其子式(例如式A2)的化合物:乙酸盐、抗坏血酸盐、己二酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、溴化物/氢溴酸盐、碳酸氢盐/碳酸盐、硫酸氢盐/硫酸盐、樟脑磺酸盐、癸酸盐、氯化物/盐酸盐、氯茶碱盐(chlortheophyllonate)、柠檬酸盐、乙二磺酸盐、富马酸盐、葡庚糖酸盐、葡糖酸盐、葡糖醛酸盐、谷氨酸盐、戊二酸盐、乙醇酸盐、马尿酸盐、氢碘酸盐/碘化物、羟乙基磺酸盐、乳酸盐、乳糖醛酸盐、十二烷基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、扁桃酸盐、甲磺酸盐、甲基硫酸盐、粘酸盐、萘甲酸盐、萘磺酸盐、烟酸盐、硝酸盐、十八烷酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、磷酸盐/磷酸氢盐/磷酸二氢盐、聚半乳糖醛酸盐、丙酸盐、癸二酸盐、硬脂酸盐、琥珀酸盐、磺基水杨酸盐、硫酸盐、酒石酸盐、甲苯磺酸盐、三苯乙酸盐(trifenatate)、三氟乙酸盐或昔萘酸盐形式。
本文给出的任何式也旨在表示未标记的形式以及化合物的同位素标记形式。本发明的同位素标记的化合物具有由本文给出的式表示的结构,除了一个或多个原子被具有所选择的原子质量或质量数的原子取代。可以掺入本发明的化合物中的同位素包括例如氢的同位素。
此外,掺入某些同位素,特别是氘(即
可以掺入本发明的化合物的同位素的其他实例包括氢、碳、氮、氧、磷、氟和氯的同位素,如分别是
本发明的一种或多种化合物的任何不对称原子(例如,碳等)可以按外消旋或对映异构体富集的形式(例如,(R)-、(S)-或(R,S)-构型)存在。在某些实施例中,每个不对称的原子在(R)-或(S)-构型中具有至少50%对映异构体过量、至少60%对映异构体过量、至少70%对映异构体过量、至少80%对映异构体过量、至少90%对映异构体过量、至少95%对映异构体过量或至少99%对映异构体过量。如果可能,在具有不饱和双键的原子上的取代可以按顺式-(Z)-或反式-(E)-形式存在。
因此,如本文使用的,本发明的化合物可以呈可能的立体异构体、旋转异构体、阻转异构体、互变异构体或其混合物之一的形式,例如,作为基本上纯的几何(顺式或反式)立体异构体、非对映异构体、光学异构体(对映体)、外消旋体或其混合物。
可以基于组分的物理化学差异,例如通过色谱法和/或分级结晶法将本发明的化合物的任何所得的立体异构体混合物分离成纯的或基本上纯的几何或光学异构体、非对映异构体、外消旋体。
可以通过已知方法将任何所得的本发明的最终化合物或其中间体的外消旋体拆分成旋光对映体,例如通过将用光学活性酸或碱得到的其非对映异构体盐进行分离,并释放出光学活性的酸性或碱性化合物。特别地,因此可以采用碱性部分将本发明的化合物拆分成它们的旋光对映体,例如通过用光学活性酸形成的盐的分级结晶,例如酒石酸、联苯甲酰酒石酸、二乙酰酒石酸、二-O,O'-对甲苯甲酰酒石酸、扁桃酸、苹果酸或樟脑-10-磺酸。外消旋产物也可以通过手性色谱法分离,例如使用手性吸附剂的高压液相色谱法(HPLC)。
如本文所使用的,术语“序列同一性”的百分比通过在比较窗口上比较两个最佳比对的序列来确定,其中所述比较窗口中的多核苷酸序列的部分与用于这两个序列的最佳比对的参考序列(例如本发明的多肽)相比可以包含添加或缺失(即,缺口),所述参考序列不包含添加或缺失。可以通过以下方法计算所述百分比:测定在这两个序列中出现相同核酸碱基或氨基酸残基的位置的数目以产生匹配位置数,将所述匹配位置数除以所述比较窗口中的位置总数,并将结果乘以100,从而得到序列同一性百分比。
如本文所使用的,在两个或更多个核酸或多肽序列的上下文中,术语“相同”或“同一性”百分比是指两个或更多个作为相同序列的序列或子序列。当在比较窗口或指定区域内进行比较和比对以寻求使用以下序列比较算法之一或通过手动比对和目视检查所测量的最大对应时,如果两个序列具有规定百分比的相同的氨基酸残基或核苷酸(即,在规定区域上或当没有规定时则在参考序列的整个序列上,至少75%、80%、85%、90%、95%、96%、97%、98%或99%序列同一性),则两个序列是“基本上相同的”。本发明提供分别与本文举例说明的多肽或多核苷酸基本上相同的多肽或多核苷酸。
如本文所使用的,术语“分离的”意指从天然状态改变的或去除的。例如,天然存在于活体动物中的核酸或肽或细胞不是“分离的”,但是与其天然状态的共存材料部分或完全分开的相同核酸或肽或细胞是“分离的”。
如本文所使用的,术语“核酸”或“多核苷酸”是指单链或双链形式的脱氧核糖核酸(DNA)或核糖核酸(RNA)及其聚合物。除非特别限定,否则所述术语涵盖含有已知的天然核苷酸类似物的核酸,这些核酸具有与参考核酸类似的结合特性并且以与天然存在的核苷酸类似的方式进行代谢。除非另外指出,否则特定的核酸序列还隐含地涵盖其保守修饰的变体(例如,简并密码子取代)、等位基因、直向同源物、SNP和互补序列以及明确指明的序列。具体地,简并密码子取代可以通过产生如下序列而获得,在这些序列中,一个或多个所选的(或全部)密码子的第三位被混合碱基和/或脱氧肌苷残基取代(Batzer等人,Nucleic AcidRes.[核酸研究]19:5081(1991);Ohtsuka等人,J.Biol.Chem.[生物化学杂志]260:2605-2608(1985);和Rossolini等人,Mol.Cell.Probes[分子与细胞探针]8:91-98(1994))。
如本文所使用的,术语“细胞群”或“细胞的群”包括在体内或离体在存在LATS1和/或LATS2抑制剂的情况下增殖的细胞。在此类细胞中,Hippo信号传导通常抑制细胞生长,但是当所述途径被LATS抑制所破坏时会增殖。在某些实施例中,可用于本发明的方法、制剂、培养基、试剂或试剂盒的细胞群包括来自上述组织的细胞或本文所述或提供的细胞。此类细胞包括但不限于眼细胞(例如,角膜缘干细胞,角膜内皮细胞)、上皮细胞(例如,来自皮肤)、神经干细胞、间充质干细胞、肺的基底干细胞、胚胎干细胞、成体干细胞、诱导多能干细胞和肝祖细胞。
在一个实施例中,本发明涉及使用小分子LATS激酶抑制剂的细胞扩增的离体细胞疗法,所述细胞如本文所述进行修饰。
离体细胞疗法通常涉及从患者或健康供体分离的细胞群的扩增,所述细胞群有待移植至患者以建立扩增的细胞的瞬时或稳定移植。离体细胞疗法可用于将基因或生物治疗分子递送给患者,其中在分离的细胞中实现基因转移或生物治疗分子的表达。离体细胞疗法的非限制性实例包括但不限于干细胞移植(例如,造血干细胞移植、自体干细胞移植或脐带血干细胞移植)、组织再生、细胞免疫疗法和基因疗法。例如,参见Naldini,2011,NatureReviews Genetics[自然评论遗传学]第12卷,第301-315页。
离体程序是本领域熟知的,并在下文更全面地讨论。简而言之,从哺乳动物(例如,人)分离细胞,并用本发明的gRNA分子进行遗传修饰(即,体外转导或转染)。可以将修饰的细胞施用于哺乳动物接受者以提供治疗益处。哺乳动物接受者可以是人,并且相对于接受者,细胞可以是自体的。可替代地,相对于接受者,细胞可以是同种异体的。
术语“自体的”是指衍生自与将其引入到其中的同一个体的任何材料。
术语“同种异体的”是指源自与引入材料的个体相同的物种的不同动物的任何材料。当一个或多个基因座处的基因不相同时,称两个或更多个个体彼此是同种异体的。在一些方面,来自相同物种的个体的同种异体材料可以在遗传上充分不同以抗原性地相互作用。
本发明的药物组合物可包含细胞(例如,通过CRISPR系统具有降低或消除的B2M表达的修饰的细胞,例如LSC或CEC)(例如,多个细胞,如本文所述的)与一种或多种药学或生理上可接受的载体、稀释剂或赋形剂组合。此类组合物可以包含缓冲液,如中性缓冲盐水、磷酸盐缓冲盐水等;碳水化合物,如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸如甘氨酸;抗氧化剂;螯合剂,如EDTA或谷胱甘肽;佐剂(例如氢氧化铝);以及防腐剂。
在一个实施例中,本发明的药物组合物是冷冻保存的组合物。冷冻保存的组合物包含细胞(例如,通过CRISPR系统具有降低或消除的B2M表达的修饰的细胞,例如LSC或CEC),例如,多个细胞)和冷冻保护剂。术语“冷冻保护剂”,如本文所使用的,是指为了最小化冷冻保存过程的有害作用而添加到生物样品中的化合物。在一个实施例中,冷冻保存的组合物包含细胞(例如,通过CRISPR系统具有降低或消除的B2M表达的修饰的细胞,例如LSC或CEC),例如,多个细胞)和选自下列的冷冻保护剂:甘油,DMSO(二甲基亚砜)聚乙烯吡咯烷酮、羟乙基淀粉、丙二醇、乙酰胺、单糖、藻类衍生的多糖、和糖醇、或其组合。在一个更具体的实施例中,冷冻保存的组合物包含细胞(例如,通过CRISPR系统具有降低或消除的B2M表达的修饰的细胞,例如LSC或CEC),例如,多个细胞)和浓度为0.5%至10%,例如,1%-10%、2%-7%、3%-6%、4%-5%、优选地5%的DMSO。DMSO可作为防冻剂,防止细胞内外形成水晶体,水晶体可能会导致细胞在冷冻保存步骤中受损。在另外的实施例中,冷冻保存的组合物进一步包含合适的缓冲液,例如CryoStor CS5缓冲液(生物生命溶液公司(BioLifeSolutions))。
在一个方面,本发明的组合物被配制用于静脉内施用。在一个方面,本发明的组合物被配制用于局部施用,特别是局部眼施用。
本发明的药物组合物能以适合于待治疗(或预防)的疾病的方式施用。施用的总量和频率将由如患者的状况以及患者的疾病的类型和严重程度等因素来确定,然而适当的剂量可以通过临床试验来确定。
在一个实施例中,药物组合物基本上不含,例如不存在可检测水平的例如选自下组的污染物,该组由以下组成:内毒素、支原体、复制型慢病毒(RCL)、p24、VSV-G核酸、HIVgag、残留的抗CD3/抗CD28包被的珠、小鼠抗体、合并的人血清、牛血清白蛋白、牛血清、培养基组分、载体包装细胞或质粒组分、细菌和真菌。在一个实施例中,细菌是选自下组的至少一种,该组由以下组成:粪产碱菌、白色念珠菌、大肠杆菌、流感嗜血杆菌、脑膜炎奈瑟氏菌、铜绿假单胞菌、金黄色葡萄球菌、肺炎链球菌、以及酿脓链球菌A组。
在另一个方面,在与体内用途相关的本发明的实施例中,本发明提供了药物组合物,其包含本发明的修饰的角膜缘干细胞,或通过根据本发明的细胞群扩增方法可获得或获得的细胞群,以及药学上可接受的载体。在另外的实施例中,组合物包含至少两种药学上可接受的载体(例如本文描述的那些)。
在某些情况下,施用根据本发明的细胞群扩增的方法获得的或可获得的细胞群(例如,包含通过CRISPR系统(例如,酿脓链球菌Cas9CRISPR系统)具有降低或消除的B2M表达的修饰的细胞(例如LSC或CEC)的细胞群)与至少一种另外的药剂(或治疗剂)(例如免疫抑制剂,例如皮质类固醇、环孢霉素、他克莫司和免疫抑制剂的组合)的组合可能是有利的。具体而言,组合物可以作为组合治疗剂配制在一起或分开施用。
LATS抑制剂化合物的制备
考虑到本文提供的方法、反应方案和实例,可以以有机合成领域的技术人员已知的多种方式制备可用于本发明方法的LATS抑制剂化合物。可以使用2018年4月26日提交的美国专利申请号15/963,816和2018年4月26日提交的国际申请号PCT/IB2018/052919(WO2018/198077)(将其全部内容并入本文)中所述的方法合成本发明的此类化合物。
例如,LATS抑制剂化合物可以使用下文所述的方法、以及合成有机化学领域中已知的合成方法或通过本领域技术人员所理解的其变体来合成。优选的方法包括但不限于下文所述的那些。所述反应在适合于所用试剂和材料并且适于实现转化的溶剂或溶剂混合物中进行。有机合成领域的技术人员将理解,分子上存在的官能团应与所提出的转化一致。这有时将需要判断以修改合成步骤的顺序或选择一种特定的工艺方案而不是另一种,以便获得本发明所希望的化合物。
起始材料通常可从商业来源获得,例如奥尔德里奇化学公司(AldrichChemicals)(威斯康星州密尔沃基(Milwaukee,Wis.))或使用本领域技术人员众所周知的方法容易地制备(例如通过一般描述于以下中的方法制备:Louis F.Fieser和MaryFieser,Reagents for Organic Synthesis[用于有机合成的试剂],第1-19卷,Wiley,纽约(1967-1999编辑),Larock,R.C.,Comprehensive Organic Transformations[有机官能团转换],第2版,Wiley-VCH Weinheim,德国(1999),或Beilsteins Handbuch derorganischen Chemie[贝尔斯坦有机化学手册],4,Aufl.编辑Springer-Verlag[斯普林格出版社],柏林,包括增刊(也可以经由Beilstein在线数据库获得)。
为了说明的目的,下面描述的反应方案提供了合成本发明化合物以及关键中间体的潜在途径。有关各个反应步骤的详细说明,请参见下面的实例部分。本领域技术人员将理解,可以使用其他合成路线来合成本发明的化合物。尽管在方案中描述了具体的原料和试剂,并在下面进行了讨论,但是可以容易地替换其他起始材料和试剂以提供各种衍生物和/或反应条件。另外,根据本披露,可以使用本领域技术人员熟知的常规化学进一步修饰通过下述方法制备的许多化合物。
在本发明的化合物的制备中,可能需要保护中间体的远端官能性。对这种保护的需要将根据远端官能性的性质和制备方法的条件而变化。对这种保护的需要是本领域技术人员容易确定的。有关保护基及其使用的一般说明,参见Greene,T.W.等人,ProtectingGroups in Organic Synthesis[有机合成中的保护基],第4版.,威利出版社(Wiley)(2007)。在本发明化合物的制备中引入的保护基,例如三苯甲基保护基,可以显示为一个区域异构体,但是也可以作为区域异构体的混合物存在。
本文使用的缩写定义如下:“1x”表示一次,“2x”表示两次,“3x”表示三次,“℃”表示摄氏度,“aq”表示水性,“Col”表示柱,“eq”表示当量(equivalent或equivalents),“g”表示克(gram或grams),“mg”表示毫克(milligram或milligrams),“nm”表示纳米(nanometer或nanometers),“L”表示升(liter或liters),“mL”或“ml”表示毫升(milliliter或milliliters),“ul”、“uL”、“μl”、或“μL”表示微升(microliter或microliters),“nL”或“nl”表示纳升(nanoliter或nanoliters),“N”表示正常,“uM”或“μM”表示微摩尔,“nM”表示纳摩尔,“mol”表示摩尔(mole或moles),“mmol”表示毫摩尔(millimole或millimoles),“min”表示分钟(minute或minutes),“h”或“hrs”表示小时(hour或hours),“RT”表示室温,“ON”表示过夜,“atm”表示大气压,“psi”表示每平方英寸磅数,“conc.”表示浓度,“aq”表示水性,“sat”或“sat'd”表示饱和的,“MW”表示分子量,“mw”或“μwave”表示微波,“mp”表示熔点,“Wt”表示重量,“MS”或“Mass Spec”表示质谱分析法,“ESI”表示电喷雾质谱,“HR”表示高分辨率,“HRMS”表示高分辨质谱法,“LCMS”表示液相色谱质谱,“HPLC”表示高效液相色谱,“RP HPLC”表示反相HPLC,“TLC”或“tlc”表示薄层色谱,“NMR”表示核磁共振光谱,“nOe”表示核欧沃豪斯效应谱,“1H”表示质子,“δ”表示δ(delta),“s”表示单峰,“d”表示双重峰,“t”表示三重峰,“q”表示四重峰,“m”表示多重峰,“br”表示宽峰,“Hz”表示赫兹,“ee”表示“对映异构体过量”以及“α”、“β”、“R”、“r”、“S”、“s”、“E”、和“Z”是本领域技术人员熟悉的立体化学指定。
以下本文中使用的下列缩写具有相应的含义:
AC 活性对照
AIBN 偶氮二异丁腈
ATP 三磷酸腺苷
Bn 苄基
Boc 叔丁氧基羰基
Boc
BSA 牛血清白蛋白
Bu 丁基
Cs
CHCl
DAST 二乙基氨基三氟化硫
DBU 2,3,4,6,7,8,9,10-八氢嘧啶并[1,2-a]氮环庚三烯
DCM 二氯甲烷
DMAP 4-二甲基氨基吡啶
DMEM 杜氏改良伊戈尔培养基(Dulbecco’s modified Eagle’s medium)
DMF 二甲基甲酰胺
DMSO 二甲亚砜
DPPA 二苯基磷酰基叠氮化物
DTT 二硫苏糖醇
EA 乙酸乙酯
EDTA 乙二胺四乙酸
Equiv. 等量
Et 乙基
Et
EtOH 乙醇
EtOAc 乙酸乙酯
FBS 胎牛血清
HATU 2-(7-氮杂-1H-苯并三唑-1-基)-1,1,3,3-四甲基脲鎓六氟磷酸盐
HCl 盐酸
HEPES (4-(2-羟基乙基)-1-哌嗪乙磺酸
HPMC (羟丙基)甲基纤维素
HTRF 均匀时间分辨荧光
i-Bu 异丁基
i-Pr 异丙基
KOAc 乙酸钾
LiAlH
LATS 大肿瘤抑制因子
LSC 角膜缘干细胞
LSCD 角膜缘干细胞缺陷
Me 甲基
mCPBA 3-氯过氧苯甲酸
MeCN 乙腈
MnO
N
NaBH
NaHCO
Na
NBS N-溴代琥珀酰亚胺
NC 中性对照
PBS 磷酸盐缓冲盐水
PFA 多聚甲醛
Ph 苯基
PPh
Ph
pYAP 磷酸化YAP
R
RT 室温(℃)
Ser 丝氨酸
t-Bu或Bu
TEA 三乙胺
TFA 三氟乙酸
THF 四氢呋喃
UVA 紫外线A
YAP Yes相关蛋白(NCBI基因ID:10413;官方符号:(YAP1)
具有式I至VI的化合物可以如一般方案I至III中以及更详细地以下方案1至6中所示制备。
用于制备具有式I或II的化合物的一般方案
双环二氯化物GS1b可以商购获得(当X=C时),或者可以通过环化和氯化由氨基异烟酸/酰胺GS1a制备。可以将GS1b的二氯化物胺化并与适当的试剂偶联以形成GS1c,将其通过任何必要的官能化(例如但不限于保护和脱保护步骤、还原、水解、烷基化、胺化、偶联等)进一步官能化以产生式I或式II。
用于制备具有式III的化合物的一般方案II
用于制备具有式IV的化合物的一般方案III
可以如以下方案1中所示制备具有式V的化合物。步骤C可以包括胺化和任何必要的官能化,例如但不限于保护和脱保护步骤、还原、水解、烷基化等。
方案1
可替代地,可以如方案2中所示制备具有式V的化合物。步骤C可以包括胺化和任何必要的官能化,例如但不限于保护和脱保护步骤、还原、水解、烷基化等。通过但不限于金属介导的偶联,胺化,烷基化等以及必要的保护和脱保护步骤,将一氯化物中间体2d进一步官能化,得到具有式V的化合物。
方案2
可以如方案3所示制备其中R
方案3
可以如方案4所示制备其中R
方案4
可以如方案5所示制备其中R
方案5
可以如方案6所示,由市售的二氯化物6a’(2,4-二氯-1,7-萘啶,阿奎拉制药公司(Aquila Pharmatech))制备具有式VI的化合物。步骤A可以包括金属介导的偶联和任何必要的官能化,例如但不限于保护和脱保护步骤、环化、还原、水解、烷基化等。步骤B可以包括胺化和任何必要的官能化,例如但不限于保护和脱保护步骤、还原、水解、烷基化等。
方案6
已经使用本文披露的方法制备、分离和表征了以下实例。下列实例说明了本发明的部分范围,并不意味着限制本发明的范围。
除非另有说明,否则起始材料通常可从非排他性商业来源获得,例如TCI精细化学品公司(TCI Fine Chemicals)(日本)、上海凯米有限公司(Shanghai Chemhere Co.,Ltd.)(上海,中国)、奥罗拉精细化学品公司(Aurora Fine Chemicals LLC(圣地亚哥,加利福尼亚州)、FCH集团(FCH Group)(乌克兰)、奥尔德里奇化学公司(Aldrich Chemicals Co.)(密尔沃基,威斯康星州)、兰斯特合成公司(Lancaster Synthesis,Inc.)(温厄姆,新罕布什尔州)、阿克洛斯有机公司(Acros Organics)(费尔劳恩,新泽西州)、美桥化工有限公司(Maybridge Chemical Company,Ltd.)(康沃尔,英格兰)、泰格科学公司(TygerScientific)(普林斯顿,新泽西州)、阿斯利康制药公司(AstraZeneca Pharmaceuticals)(伦敦,英国)、康侨公司(Chembridge Corporation)(美国)、美奇丝科学公司(MatrixScientific)(美国)、卡耐儿化学制药公司(Conier Chem&Pharm Co.,Ltd)(中国)、安娜敏公司(Enamine Ltd)(乌克兰)、Combi-Blocks公司(Combi-Blocks,Inc.)(圣地亚哥,美国)、奥克伍德公司(Oakwood Products,Inc.)(美国)、阿波罗科学公司(Apollo ScientificLtd.)(英国)、艾莉化学公司(Allichem LLC.)(美国)和乌克罗公司(Ukrorgsyntez Ltd)(拉脱维亚)。
实例的表征中使用的LCMS方法
使用化学工作站(ChemStation)软件在安捷伦(Agilent)系统上进行分析型LC/MS。所述系统由以下组成:
·安捷伦G1312二元泵
·安捷伦G1367孔板自动进样器
·安捷伦G1316柱温箱
·安捷伦G1315二极管阵列检测器
·安捷伦6140/6150质谱仪
·SOFTA蒸发光散射检测器
典型的方法条件如下:
·流速:0.9mL/min
·柱:1.8微米2.1x50mm沃特斯(Waters)Acquity HSS T3 C18柱
·流动相A:水+0.05%TFA
·流动相B:乙腈+0.035%TFA
·运行时间:2.25分钟
·系统在1.35分钟内运行从10%B到90%B的梯度。所述梯度后,在100%B下进行0.6分钟的洗涤。所述方法的剩余持续时间将系统恢复到初始条件。
·典型的质谱仪扫描范围是100amu到1000amu。
实例的表征中使用的NMR
除非另有说明,否则质子光谱是在带有5mm QNP低温探头的Bruker AVANCE II400MHz或带有5mm QNP探头的Bruker AVANCE III 500MHz上记录的。相对于二甲亚砜(δ2.50)、氯仿(δ7.26)、甲醇(δ3.34)或二氯甲烷(δ5.32),化学位移以ppm报告。将少量干燥样品(2mg至5mg)溶于适当的氘代溶剂(1mL)中。
溶剂和试剂购自供应商,无需进一步纯化即可使用。碱性离子交换树脂柱PoraPakTM Rxn CX 20cc(2g)从沃特斯公司购买。相分离器盒(Isolute相分离器)购自拜泰齐公司(Biotage)。Isolute吸收剂(Isolute HM-N)购自拜泰齐公司。
实例的纯化中使用的ISCO方法
ISCO快速色谱是在装有预填的二氧化硅
实例的纯化中使用的制备型HPLC方法
制备型HPLC在沃特斯公司Autoprep系统上使用MassLynx和FractionLynx软件进行。所述系统由以下组成:
·沃特斯2767自动进样器/分部收集器
·沃特斯2525二元泵
·沃特斯515补流泵
·沃特斯2487双波长UV检测器
·沃特斯ZQ质谱仪
典型的方法条件如下:
·流速:100mL/min
·柱:10微米19x50mm沃特斯Atlantis T3 C18柱
·注射体积:0-1000微升
·流动相A:水+0.05%TFA
·流动相B:乙腈+0.035%TFA
·运行时间:4.25分钟
在初始条件下保持0.25分钟后,系统在3分钟内运行针对实例适当的从x%B到y%B的梯度。所述梯度后,在100%B下进行0.5分钟的洗涤。所述方法的剩余持续时间将系统恢复到初始条件。
通过FractionLynx软件的质量检测触发级分收集。
实例的纯化中使用的手性制备型HPLC方法
SFC手性筛选在与沃特斯ZQ质谱仪连接的泰尔仪器公司制备型观察仪(TharInstruments Prep Investigator)系统上进行。泰尔仪器公司制备型观察仪系统由以下组成:
·Leap HTC PAL自动进样器
·泰尔仪器公司流体递送模块(0mL/min至10mL/min)
·泰尔仪器公司SFC 10位柱箱
·沃特斯2996PDA
·分光公司(Jasco)CD-2095手性检测器
·泰尔仪器公司自动背压调节器。
泰尔仪器公司的所有组件都是SuperPure Discovery系列产品线的一部分。
所述系统以2mL/min(WhelkO-1柱为4mL/min)流动,并保持在30摄氏度。系统背压设置为125巴。通过具有六个3微米柱的组对每个样品进行筛选:
·3微米4.6x50 mm ChiralPak AD
·3微米4.6x50 mm ChiralCel OD
·3微米4.6x50 mm ChiralCel OJ
·3微米4.6x250 mm Whelk O-1
·3微米4.6x50 mm ChiralPak AS
·3微米4.6x50 mm Lux-纤维素-2
系统在5分钟内运行从5%助溶剂到50%助溶剂的梯度,然后在50%助溶剂下保持0.5分钟,切换回5%助溶剂并在初始条件下保持0.25分钟。在每个梯度之间有4分钟的平衡方法,使5%助溶剂流过下一个有待筛选的柱。筛选的典型溶剂为MeOH、MeOH+20mM NH
一旦使用这些梯度方法之一检测到分离,就会开发出等度方法,并在必要时扩大规模,以在泰尔仪器公司Prep80系统上进行纯化。
步骤1:将尿素(40.00g,666.00mmol)和3-氨基异烟酸(2a,18.40g,133.20mmol)的混合物在210℃下加热1小时(注意:不使用溶剂)。添加NaOH(2N,320mL),并将所述混合物在90℃搅拌1h。通过过滤收集固体,并用水洗涤。将如此获得的粗产物悬浮于HOAc(400mL)中,并在100℃下搅拌1h。将混合物冷却至室温,过滤,并将固体用大量水洗涤,然后在真空下干燥,以给出吡啶并[3,4-d]嘧啶-2,4(1H,3H)-二酮(2b,17.00g,78%产率),其无需进一步纯化。LCMS(m/z[M+H]
步骤2:向吡啶并[3,4-d]嘧啶-2,4(1H,3H)-二酮(2b,20.00g,122.60mmol)和POCl
真空除去溶剂和POCl
步骤3:在室温下,在20mL小瓶中,在DMSO(0.7mL)中搅拌2,4-二氯吡啶并[3,4-d]嘧啶(600mg,3.0mmol),并用N
步骤4:在20mL微波反应器中添加在乙腈(8mL)中的钯四(99mg,0.086mmol)、碳酸钾(2.15mL,4.3mmol)和2氯-N-甲基-N-(1,1,1-三氟丙-2-基)吡啶并[3,4-d]嘧啶-4-胺(500mg,1.72mmol)和吡啶-4-基硼酸(233mg,1.89mmol),得到黄色悬浮液。将反应混合物在微波下于130℃搅拌30分钟。将粗混合物用DCM、H
1H NMR(500MHz,DMSO-d6)δ9.33(d,J=0.8Hz,1H),8.86-8.75(m,2H),8.63(d,J=5.9Hz,1H),8.38-8.30(m,2H),8.20(dd,J=6.0,0.9Hz,1H),6.11(qt,J=8.5,7.4Hz,1H),3.50(d,J=1.1Hz,3H),1.61(d,J=7.0Hz,3H)。LCMS(m/z[M+H]
1H NMR(500MHz,DMSO-d6)δ9.33(d,J=0.8Hz,1H),8.86-8.75(m,2H),8.63(d,J=5.9Hz,1H),8.38-8.30(m,2H),8.20(dd,J=6.0,0.9Hz,1H),6.11(qt,J=8.5,7.4Hz,1H),3.50(d,J=1.1Hz,3H),1.61(d,J=7.0Hz,3H)。LCMS(m/z[M+H]
步骤1:在20mL微波反应器中添加在乙腈(体积:2mL)中的钯四(58.1mg,0.050mmol)、碳酸钾(1.256mL,2.51mmol)和2,4-二氯-1,7-萘啶(200mg,1.005mmol)和吡啶-4-基硼酸(130mg,1.055mmol),得到橙色悬浮液。将反应混合物在微波下于120℃搅拌60分钟。将粗混合物用DCM、H
步骤2:在40ml小瓶中,添加在DMSO(体积:2mL)中的氟化钾(11.54mg,0.199mmol)、4-氯-2-(吡啶-4-基)-1,7-萘啶(40mg,0.166mmol)和2-甲基丙-2-胺(0.035mL,0.331mmol),得到黄色悬浮液。将反应混合物在130℃下搅拌24小时。在空气流下蒸发溶剂。将残余物通过在
1H NMR(400MHz,丙酮-d6)δ9.57(s,1H),9.15(d,J=0.9Hz,1H),8.82-8.72(m,2H),8.56(d,J=5.6Hz,1H),8.44-8.37(m,2H),7.69(dd,J=5.6,0.9Hz,1H),2.08(s,2H),1.87(s,6H),1.48(d,J=0.8Hz,6H)。LCMS(m/z[M+H]
1H NMR(500MHz,甲醇-d4)δ9.01(s,1H),8.41(d,J=5.7Hz,1H),8.26(s,1H),7.91(dd,J=5.7,0.9Hz,1H),2.83(s,3H),1.60(s,3H),1.05-0.94(m,2H),0.91-0.82(m,2H)。LCMS(m/z[M+H]+):281.1.
可以从接受者本人获得用于细胞群扩增方法以获得扩增的细胞群的细胞的接种群。在部分存在组织、器官或细胞缺陷(例如存在健康细胞)的患者中,可以从未受影响的组织或器官或细胞来源获得细胞的接种群。例如,在单侧眼细胞缺陷的情况下,可以从未受影响的眼的活检中获得接种群。它也可以从部分受损的器官中剩余的健康组织中获得。
在优选的实施例中,用于细胞群扩增方法以获得扩增的细胞群的细胞的接种群可以从最初衍生自供体组织(例如人、兔、猴等,优选人)的细胞获得。例如,人组织的来源是尸体供体或来自活体供体(包括活体亲属)的组织。
在自体和同种异体方法下从已从体内移出的如上所述衍生的自体或同种异体组织,可按以下来提取和制备细胞:例如,可以使用手术刀解剖所需区域,然后将细胞解离(例如,使用胶原酶、分散酶、胰蛋白酶、accutase或TripLE;例如在37℃下1mg/ml的胶原酶),直到45分钟至3小时通过显微镜观察(例如使用Zeiss Axiovert倒置显微镜)细胞明显分离为止。
适合地,可以合并从若干个角膜或从不同供体分离的细胞,例如LSC或CEC,以进行进一步处理,例如细胞群扩增和B2M基因编辑。
为了用于根据本发明的细胞群扩增方法中,然后例如通过移液将分离的细胞添加到培养基中,如下文“细胞群扩增”部分所述。
在根据本发明的优选实施例中,对从供体收获的细胞材料的质量进行评估。例如,在收获细胞并开始在培养基(如下所述的生长或细胞增殖培养基)中培养后约24小时,在明场显微镜下进行目测评估以寻找存在的漂浮细胞(作为死细胞的指示)。理想地,所述评估是要表明,对于适于用于产生根据本发明的扩增的细胞群的材料而言,漂浮细胞约少于10%。
不限制适用于根据本发明的细胞群扩增方法的细胞数量,但是作为出于说明目的的实例,适合用于根据本发明的细胞群扩增方法的接种细胞群可以包含约1000个细胞。
如果需要测量接种细胞群中的细胞数,这可以例如根据本领域众所周知的标准方案通过使用光学显微镜、免疫组织化学或FACS的手动或自动细胞计数来完成。
以下更详细地描述与应用于眼细胞的眼细胞群扩增有关的方法(起始材料的制备,随后是细胞群扩增阶段,细胞的储存),其中以角膜缘干细胞和角膜内皮细胞为具体实例。
可以从接受者本人获得用于细胞群扩增方法以获得扩增的角膜缘干细胞群的细胞的接种群。在角膜缘干细胞部分缺陷的患者中,可以从角膜缘的未受影响部分获得接种细胞群。例如,在单侧角膜缘干细胞缺陷的情况下,可以从未受影响的眼的活检中获得接种群。它也可以从部分受损的角膜缘中剩余的健康组织中获得。
在优选的实施例中,用于细胞群扩增方法以获得扩增的角膜缘干细胞群的细胞的接种群可以从最初衍生自供体哺乳动物角膜组织(例如人、兔、猴等,优选人)的细胞获得。
例如,人角膜组织的来源是尸体供体(例如,通过眼库来源)或来自活体供体(包括活体亲属)的组织。一定范围的供体角膜缘组织适合于根据本发明的用途。在一个优选的实施例中,角膜组织获自具有相容的HLA谱的活着的亲属或供体。
用于获得LSC的组织可以是例如宽度约4mm,高度约1mm的角膜缘组织的环。
在自体和同种异体方法下从已从体内移出的如上所述的角膜组织,可按以下来提取和制备LSC:例如,可以使用手术刀解剖角膜缘上皮区域,然后将细胞解离(例如,使用胶原酶、分散酶、胰蛋白酶、accutase或TripLE;例如在37℃下1mg/ml的胶原酶),直到45分钟至3小时通过显微镜观察(例如使用Zeiss Axiovert倒置显微镜)细胞明显分离为止。
适合地,可以合并从若干个角膜或从不同供体分离的细胞,例如LSC或CEC,以进行进一步处理,例如细胞群扩增和B2M基因编辑。
为了用于根据本发明的细胞群扩增方法中,然后例如通过移液将分离的细胞添加到培养基中,如下文“细胞群扩增”部分所述。
在根据本发明的优选实施例中,对从供体角膜收获的细胞材料的质量进行评估。例如,在收获细胞并开始在培养基(如下所述的生长或细胞增殖培养基)中培养后约24小时,在明场显微镜下进行目测评估以寻找存在的漂浮细胞(作为死细胞的指示)。理想地,所述评估是要表明,对于适于用于产生根据本发明的扩增的细胞群的材料而言,漂浮细胞约少于10%。
不限制适用于根据本发明的细胞群扩增方法的细胞数量,但是作为出于说明目的的实例,适合用于根据本发明的细胞群扩增方法的接种细胞群可以包含约1,000个角膜缘干细胞。
如果需要测量接种细胞群中的细胞数,这可以例如根据本领域众所周知的标准方案通过使用光学显微镜、免疫组织化学或FACS的手动或自动细胞计数来完成。
用于细胞群扩增方法的角膜内皮细胞(CEC)的接种群可以获得自最初衍生自哺乳动物角膜组织(例如人、兔、猴等,优选人)的细胞。例如,人角膜组织的来源是尸体人供体(可能通过眼库来源的)。
供体的年龄范围可以是例如从婴儿期到70岁。优选地还合适的供体是那些没有角膜疾病或外伤史的供体。在根据本发明的一个实施例中,优选的供体角膜是那些角膜内皮细胞计数高于2000个细胞/mm
用于获得CEC的角膜表面不受限制,但是可以是例如大约8mm-10mm直径的面积。
例如,可以从供体角膜组织中提取和制备CEC,如下所示:例如使用手术级反向Sinsky内皮剥离器,对角膜内皮细胞层和后弹力膜和(DM)评分。将DM内皮细胞层从角膜基质上剥离,并将细胞从DM解离(例如在37℃下使用1mg/ml胶原酶)直到通过显微镜观察(例如使用Zeiss Axiovert倒置显微镜)观察到细胞脱离变得明显(从45分钟到3小时)。由于在角膜中DM仅携带角膜内皮细胞,因此以这种方式分离的细胞群是CEC群,其适合用作根据本发明的接种细胞群。
为了在根据本发明的细胞群扩增方法中使用,可以如下文“细胞群扩增”部分中所述将分离的角膜内皮细胞添加到培养基中。
在根据本发明的优选实施例中,对从供体角膜收获的细胞材料的质量进行评估。例如,在收获细胞并开始在培养基(如下所述的生长或细胞增殖培养基)中培养后约24小时,在明场显微镜下进行目测评估以寻找存在的漂浮细胞(作为死细胞的指示)。理想地,所述评估是要表明,对于适于用于产生根据本发明的扩增的细胞群的材料而言,漂浮细胞约少于10%。
不限制适用于根据本发明的细胞群扩增方法的细胞起始数量,但是作为出于说明目的的实例,适合用于根据本发明的细胞群扩增方法的角膜内皮细胞接种细胞群可以是100 000至275 000个细胞。
如果需要测量接种细胞群中的细胞数,这可以例如通过取等分样品并进行免疫细胞化学(例如,计数被Sytox Orange染色的细胞核)或通过在明场显微镜下进行活细胞成像来计数细胞数来进行。
Sytox Orange测定可根据本领域已知的标准方案进行。简而言之,在细胞附着于细胞培养皿后(通常在细胞铺板后24小时),将细胞固定在多聚甲醛中。然后使细胞透化(例如,使用0.3%Triton X-100的溶液),然后将其在Sytox Orange的溶液中标记(例如,使用在PBS的中的0.5微摩尔Sytox Orange)。然后在Zeiss落射荧光显微镜下计数每表面面积被Sytox Orange染色的核的数目。
在本发明的一个实施例中,包含来自患者或供体的细胞的细胞群可以在本领域已知的培养容器中的培养基中生长,所述培养容器例如板、多孔板和细胞培养瓶。例如,可以使用未涂覆或涂覆胶原、synthemax、明胶或纤连蛋白的培养皿。合适的培养容器的优选实例是无涂覆的板。也可以使用本领域已知的用于工业用途的标准培养容器和设备,例如生物反应器。
术语“培养基(culture medium)”、“细胞培养基(cell culture medium)”、“细胞培养基(cell medium)”或“培养基(medium)”用于描述(i)其中细胞(例如干细胞、祖细胞或分化的细胞)生长的细胞生长培养基,或(ii)其中细胞(例如干细胞、祖细胞或分化细胞)增殖的细胞增殖培养基。
使用的培养基可以是生长培养基或细胞增殖培养基。通常,生长培养基是支持细胞群生长和维持的培养基。本领域技术人员可以容易地为特定类型的细胞群确定合适的生长培养基。用于干细胞培养或上皮细胞培养的合适的生长培养基是本领域已知的,例如:补充了FBS(胎牛血清)的DMEM(杜氏改良伊戈尔培养基)(英杰公司(Invitrogen))、补充了人血清的人内皮SF(无血清)培养基(英杰公司(Invitrogen))、X-VIVO15培养基(龙沙集团(Lonza))、或DMEM/F12(赛默飞世尔科学公司(Thermo Fischer Scientific)(任选地补充氯化钙)。这些可以另外补充有生长因子(例如bFGF)和/或抗生素如青霉素和链霉素。
可替代地,可以首先将分离的细胞添加到根据本发明的细胞增殖培养基中。本文所定义的细胞增殖培养基包含生长培养基和根据本发明的LATS抑制剂。
在某些实施例中,本发明的细胞增殖培养基包含生长培养基和根据本发明的LATS抑制剂。LATS抑制剂优选选自包含根据式A1或其子式(例如式A2)并且如在“LATS抑制剂”部分下进一步描述的化合物的组。
在一个优选的实施例中,以约0.5至100微摩尔,优选约0.5至25微摩尔,更优选约1至20微摩尔的浓度添加根据式A1或其子式(例如式A2)的LATS抑制剂。在进一步的实施例中,以0.5至100微摩尔,优选0.5至25微摩尔,更优选1至20微摩尔的浓度添加根据式A1或其子式(例如式A2)的LATS抑制剂。在一个具体的实施例中,以约3至10微摩尔的浓度添加根据式A1或其子式(例如式A2)的LATS抑制剂。在一个更具体的实施例中,以约3至10微摩尔的浓度添加根据式A1或其子式(例如式A2)的LATS抑制剂。
在一个实施例中,可以通过将化合物粉末在DMSO中溶解至储备浓度为1mM至100mM(例如1mM至50mM、5mM至20mM、10mM至20mM,特别地10mM)来制备根据式A1或其子式(例如式A2)的化合物的储备溶液。在一个实施例中,可以通过将化合物粉末在DMSO中溶解至储备浓度为10mM来制备根据式A1或其子式(例如式A2)的化合物的储备溶液。
在本发明的一个方面,根据本发明的LATS抑制剂抑制细胞群中LATS1和/或LATS2活性。在一个优选的实施例中,所述LATS抑制剂抑制LATS1和LATS2。
在一个实施例中,本发明的细胞增殖培养基任选地进一步包含rho相关蛋白激酶(ROCK)抑制剂。发现添加ROCK抑制剂可防止细胞死亡并促进悬浮液中的细胞附着,特别是在培养干细胞时。所述ROCK抑制剂是本领域已知的,并且在一个实例中选自(R)-(+)-反式-4-(1-氨乙基)-N-(4-吡啶基)环己烷甲酰胺二盐酸盐一水合物((1R,4r)-4-((R)-1-氨乙基)-N-(吡啶-4-基)环己烷甲酰胺;Y-27632;西格玛-奥德里奇公司(Sigma-Aldrich))、5-(1,4-二氮杂-1-基磺酰基)异喹啉(法舒地尔(fasudil)或HA 1077;开曼化学公司(CaymanChemical))、H-1152、H-1152P、(S)-(+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]高哌嗪、2HCl、ROCK抑制剂、二甲基法舒地尔(diMF,H-1152P)、N-(4-吡啶基)-N'-(2,4,6-三氯苯基)尿素、Y-39983、Wf-536、SNJ-1656、和(S)-+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]-六氢-1H-1,4-二氮环庚三烯二盐酸盐(H-1152;托克里斯生物科学(Tocris Bioscience)),及其衍生物和类似物。另外的ROCK抑制剂包括含咪唑的苯并二氮杂
在一个优选的实施例中,本发明的细胞增殖培养基中使用的ROCK抑制剂是(R)-(+)-反式-4-(1-氨乙基)-N-(4-吡啶基)环己烷甲酰胺二盐酸盐一水合物((1R,4r)-4-((R)-1-氨乙基)-N-(吡啶-4-基)环己烷甲酰胺;Y-27632;西格玛-奥德里奇公司(Sigma-Aldrich);描述于Nature[自然]1997,第389卷,第990-994页;JP4851003,JP11130751;JP2770497;US5478838;US6218410,其所有通过引用以其整体并入本文中)。
在一个实施例中,所述ROCK抑制剂,特别地Y-27632,以约0.5至约100微摩尔,优选为约0.5至约25微摩尔,更优选为约1至约20微摩尔,特别优选为约10微摩尔的浓度存在。在一个实施例中,所述本发明的化合物以0.5至100微摩尔,优选0.5至25微摩尔,更优选1至20微摩尔,特别优选10微摩尔的浓度存在。在一个具体的实施例中,所述ROCK抑制剂,特别地Y-27632,以10微摩尔的浓度存在。
在一个具体的实施例中,本发明的细胞增殖培养基包含DMEM/F12(1:1)、5%-20%的人血清或胎牛血清或血清替代物、1mM-2mM氯化钙、1微摩尔至20微摩尔的LATS抑制剂、以及任选的1微摩尔至20微摩尔ROCK抑制剂。在一个更具体的实施例中,本发明的细胞增殖培养基包含DMEM/F12(1:1)、10%-20%的人血清或胎牛血清或血清替代物(例如10%的人血清或胎牛血清或血清替代物)、1mM-2mM氯化钙、3微摩尔至10微摩尔的LATS抑制剂、以及任选的10微摩尔ROCK抑制剂。
细胞可以经历一轮或多轮新鲜生长培养基和/或细胞增殖培养基的添加。无需传代细胞即可添加新鲜培养基,但传代细胞也是添加新鲜培养基的一种方式。
也可以使用一系列培养基,以各种顺序组合:例如,细胞增殖培养基,然后添加生长培养基(其未补充有根据本发明的LATS抑制剂,并且可以不同于用作细胞增殖培养基基础的生长培养基)。
根据本发明的细胞群扩增阶段发生在细胞暴露于细胞增殖培养基的时期。
可以使用本领域已知的用于培养细胞的标准温度条件,例如优选地约30℃至40℃。特别优选地,细胞生长以及细胞群扩增阶段在约37℃下进行。可以使用具有5%-10%CO
在培养期间,根据需要可以在生长或细胞增殖培养基中传代细胞。细胞在亚汇合或汇合时可以传代。优选地,当细胞达到约90%-100%汇合时使细胞传代,尽管也可以在较低的汇合百分比水平进行。细胞的传代是根据本领域已知的标准方案进行的。例如,简而言之,通过以下来传代细胞:用Accutase处理培养物(例如10分钟),通过离心漂洗细胞悬浮液,并根据需要将细胞铺板在新鲜的生长培养基或细胞增殖培养基中。细胞分裂比的范围例如为1:2至1:5。
对于根据本发明的细胞群扩增方法的细胞群扩增阶段,可以进行接种细胞群在细胞增殖培养基中的扩增,直到获得所需量的细胞材料。
可将细胞暴露于细胞增殖培养基一段时间,以扩增细胞群。
在一个优选的实施例中,在从患者或供体组织中分离细胞后,将接种细胞群直接暴露于根据本发明的LATS抑制剂(例如根据式A1或其子式(例如,式A2)的那些化合物)并维持细胞增殖所需的整个时间,例如12至16天。
在根据本发明的一个实施例中,可以任选地执行基因编辑技术以遗传修饰细胞和/或表达生物治疗化合物。例如,可以修饰细胞以降低或消除介导免疫应答的基因的表达和/或功能,否则当将细胞群递送给患者时,其可能有助于免疫排斥。基因编辑技术在根据本发明的细胞群扩增方法中的应用是任选的,并且如果希望减轻患者体内被移植材料的免疫排斥问题,可以替代的向患者施用局部免疫抑制剂和/或抗炎剂(如在免疫抑制剂和抗炎剂部分下进一步描述)。
根据本发明的一方面,遗传修饰包括降低或消除与促进宿主抗移植免疫应答有关的基因的表达和/或功能。在一个优选的实施例中,遗传修饰包括将基因编辑系统引入分离的干细胞或干细胞群中,所述基因编辑系统特异性靶向与促进宿主抗移植免疫应答相关的基因。在一个具体的实施例中,所述基因编辑系统是CRISPR(CRISPR:成簇规律间隔短回文重复序列,也称为CRISPR/Cas系统)。
基因编辑技术可以在不同的点进行,例如(1)在组织上,细胞分离之前或(2)在细胞分离时或(3)在体外细胞群扩增阶段(在细胞在体外暴露于本发明的LATS抑制剂时)或(4)在体外在细胞群扩增阶段结束时(在细胞体外暴露于本发明的LATS抑制剂之后)。在一个实施例中,在根据本发明的LATS抑制剂存在下细胞体外扩增两周后使用CRISPR。
在“降低免疫排斥”部分中进一步描述了适用于细胞群扩增方法的基因编辑技术。
在根据本发明的细胞群扩增方法中,优选为化合物的LATS抑制剂产生接种细胞群的大于2倍的扩增。
在根据本发明的细胞群扩增方法的一个方面,根据式A1或其子式(例如,式A2)的化合物产生分离细胞(即,从患者或供体获得的细胞)的接种群的大于30倍扩增。在根据本发明的细胞群扩增方法的一个具体的实施例中,根据式A1或其子式的LATS抑制剂产生分离细胞的接种群的100倍至2200倍扩增。在根据本发明的细胞群扩增方法的一个更具体的实施例中,根据式A1或其子式(例如,式A2)的LATS抑制剂产生分离细胞的接种群的600倍至2200倍扩增。通过根据本发明的细胞群扩增方法获得的倍数扩增系数可以在细胞的一次或多次传代中实现。在本发明的另一个方面,通过根据本发明的细胞群扩增方法获得的倍数扩增系数可以在暴露于根据式A1或其子式(例如,式A2)的化合物约12至16天、优选地约14天后实现。在一个实施例中,根据本发明的分离的LSC的扩增接种群包含至少40%的未分化的LSC,例如,至少45%,、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%的未分化LSC。在一个具体的实施例中,根据本发明的分离的LSC的扩增的接种群包含至少60%的未分化的LSC。在一个更具体的实施例中,根据本发明的分离的LSC的扩增的接种群包含至少80%的未分化的LSC。在一个优选的实施例中,根据本发明的分离的LSC的扩增的接种群包含至少90%的未分化的LSC。
如果需要测量细胞数或细胞群的扩增,可以例如通过取等分样品并进行免疫细胞化学(例如,计数被Sytox Orange染色的细胞核)或通过在明场显微镜下进行活细胞成像来计数细胞数来完成或通过在根据本发明的方法的细胞群扩增阶段的各个时间点对细胞融合进行实时定量活细胞分析来完成。
Sytox Orange测定可根据本领域已知的标准方案进行。简而言之,在细胞附着于细胞培养皿后(通常在细胞铺板后24小时),将细胞固定在多聚甲醛中。然后使细胞透化(例如,使用0.3%Triton X-100的溶液),然后将其在Sytox Orange的溶液中标记(例如,使用在PBS的中的0.5微摩尔Sytox Orange)。然后在Zeiss落射荧光显微镜下计数每表面面积被Sytox Orange染色的核的数目。可以将通过根据本发明的细胞群扩增方法扩增的细胞群添加至溶液中,然后例如在保存溶液或冷冻保存溶液(例如下文所述的那些)中进行存储,或直接添加至适合于递送至患者的组合物中。适用于眼递送的保存溶液、冷冻保存溶液或组合物可以任选地包含根据本发明的LATS抑制剂。
在根据本发明的更优选的实施例中,递送给患者的细胞群制剂包含非常低至可忽略的水平的LATS抑制剂化合物。因此,在一个具体的实施例中,根据本发明的细胞群扩增的方法包括进一步漂洗的步骤,以基本上除去本发明的化合物(例如根据式A1或其子式(例如,式A2)的化合物)。这可以包括在根据本发明的细胞群扩增阶段之后漂洗细胞。为了漂洗细胞,将细胞与培养皿中脱离(例如,通过用Accutase处理),然后离心脱离的细胞,并在PBS或根据本发明的生长培养基中制备细胞悬浮液。所述步骤可以进行多次,例如1至10次,以漂洗出细胞。最后,可以根据需要将细胞重悬于保存溶液、冷冻保存溶液、适合于眼递送的组合物、生长培养基或其组合中。
通过细胞群扩增方法和漂洗包含根据本发明的LATS抑制剂的细胞增殖培养基制备的扩增的细胞群可以被转移到适于递送给患者的组合物中,例如定位剂。任选地,将细胞群在添加到适于递送给患者的定位剂之前存储一段时间。在一个优选的实施例中,可以首先将扩增的细胞群添加至适合于保存或冷冻保存的溶液中,所述溶液优选不包含LATS抑制剂,并且在添加至适合于递送给患者的定位剂之前存储(任选地冷冻)的细胞群优选也不含LATS抑制剂。
适用于冷冻保存的典型溶液、甘油、二甲基亚砜、丙二醇或乙酰胺可用于本发明的冷冻保存溶液。冷冻保存的细胞制剂通常保持在-20℃或-80℃。在一个实施例中,冷冻保存的组合物包含细胞(例如,通过CRISPR系统具有降低或消除的B2M表达的修饰的细胞,例如LSC或CEC),例如,多个细胞)和选自下列的冷冻保护剂:甘油,DMSO(二甲基亚砜)聚乙烯吡咯烷酮、羟乙基淀粉、丙二醇、乙酰胺、单糖、藻类衍生的多糖、和糖醇、或其组合。在一个更具体的实施例中,冷冻保存的组合物包含细胞(例如,通过CRISPR系统具有降低或消除的B2M表达的修饰的细胞,例如LSC或CEC),例如,多个细胞)和浓度为0.5%至10%,例如,1%-10%、2%-7%、3%-6%、4%-5%、优选地5%的DMSO。DMSO可作为防冻剂,防止细胞内外形成水晶体,水晶体可能会导致细胞在冷冻保存步骤中受损。在另外的实施例中,冷冻保存的组合物进一步包含合适的缓冲液,例如CryoStor CS5缓冲液(生物生命溶液公司(BioLifeSolutions))。
细胞群扩增:以制备扩增的角膜缘干细胞群
在本发明的一个实施例中,包括例如角膜上皮细胞和角膜缘细胞(包括角膜缘干细胞)的细胞群(例如如在“用于制备扩增的角膜缘干细胞群的起始材料:角膜上皮细胞和角膜缘细胞”部分中所述获得的)可以在本领域已知的培养容器(例如板、多孔板和细胞培养瓶)中的培养基中生长。例如,可以使用未涂覆或涂覆胶原、synthemax、明胶或纤连蛋白的培养皿。合适的培养容器的优选实例是无涂覆的板。也可以使用本领域已知的用于工业用途的标准培养容器和设备,例如生物反应器。
使用的培养基可以是生长培养基或细胞增殖培养基。本文将生长培养基定义为支持细胞群生长和维持的培养基。用于干细胞培养或上皮细胞培养的合适的生长培养基是本领域已知的,例如:补充了FBS(胎牛血清)的DMEM(杜氏改良伊戈尔培养基)(英杰公司(Invitrogen))、补充了人血清的人内皮SF(无血清)培养基(英杰公司(Invitrogen))、X-VIVO15培养基(龙沙集团(Lonza))、或DMEM/F12(赛默飞世尔科学公司(Thermo FischerScientific)(任选地补充氯化钙)。这些可以另外补充有生长因子(例如bFGF)和/或抗生素如青霉素和链霉素。根据本发明的优选的生长培养基是X-VIVO15培养基(其没有另外补充生长因子)。
可替代地,可以首先将分离的细胞添加到根据本发明的细胞增殖培养基中。本文所定义的细胞增殖培养基包含生长培养基和根据本发明的LATS抑制剂。在根据本发明的细胞增殖培养基中,生长培养基组分选自下组,该组由以下组成:补充了FBS(胎牛血清)的DMEM(杜氏改良伊戈尔培养基)(英杰公司(Invitrogen))、补充了人血清的人内皮SF(无血清)培养基(英杰公司(Invitrogen))、X-VIVO15培养基(龙沙集团(Lonza))、或DMEM/F12(赛默飞世尔科学公司(Thermo Fischer Scientific)(任选地补充氯化钙)。这些可以另外补充有生长因子(例如bFGF)和/或抗生素如青霉素和链霉素。
根据本发明的优选的细胞增殖培养基是具有根据本发明的LATS抑制剂的X-VIVO15培养基(龙沙集团)。这种细胞增殖培养基的优点是不需要另外的生长因子或饲养细胞来促进LSC的增殖。X-VIVO培养基尤其包括药物级人白蛋白、重组人胰岛素和巴氏灭菌的人转铁蛋白。任选地,可以将抗生素添加到X-VIVO15培养基中。在一个优选的实施例中,使用X-VIVO15培养基而不添加抗生素。
适合地,在一个具体的实施例中,根据本发明的细胞增殖培养基是补充有血清白蛋白例如人血清或胎牛血清或血清替代物并且进一步包含根据本发明的LATS抑制剂的DMEM/F12培养基。任选地,可以将抗生素添加到DMEM/F12培养基中。在一个优选的实施例中,使用DMEM/F12培养基而不添加抗生素。
细胞增殖培养基包含生长培养基和根据本发明的LATS抑制剂。LATS抑制剂优选选自包含根据式A1或其子式(例如式A2)并且如在“LATS抑制剂”部分下进一步描述的化合物的组。
在一个优选的实施例中,以约0.5至100微摩尔,优选约0.5至25微摩尔,更优选约1至20微摩尔的浓度添加根据式A1或其子式(例如式A2)的LATS抑制剂。在一个优选的实施例中,以0.5至100微摩尔,优选0.5至25微摩尔,更优选1至20微摩尔的浓度添加根据式A1或其子式(例如式A2)的LATS抑制剂。在一个具体的实施例中,以约3至10微摩尔的浓度添加根据式A1或其子式(例如式A2)的LATS抑制剂。在一个更具体的实施例中,以约3至10微摩尔的浓度添加根据式A1或其子式(例如式A2)的LATS抑制剂。
在一个实施例中,可以通过将化合物粉末在DMSO中溶解至储备浓度为10mM来制备根据式A1或其子式(例如式A2)的化合物的储备溶液。在一个实施例中,可以通过将化合物粉末在DMSO中溶解至储备浓度为1mM至100mM(例如1mM至50mM、5mM至20mM、10mM至20mM,特别地10mM)来制备根据式A1或其子式(例如式A2)的化合物的储备溶液。
在本发明的一个方面,根据本发明的LATS抑制剂抑制角膜缘细胞中LATS1和/或LATS2活性。在一个优选的实施例中,所述LATS抑制剂抑制LATS1和LATS2。
在一个实施例中,本发明的细胞增殖培养基任选地进一步包含rho相关蛋白激酶(ROCK)抑制剂。发现添加ROCK抑制剂可防止细胞死亡并促进悬浮液中的细胞附着,特别是在培养干细胞时。所述ROCK抑制剂是本领域已知的,并且在一个实例中选自(R)-(+)-反式-4-(1-氨乙基)-N-(4-吡啶基)环己烷甲酰胺二盐酸盐一水合物((1R,4r)-4-((R)-1-氨乙基)-N-(吡啶-4-基)环己烷甲酰胺;Y-27632;西格玛-奥德里奇公司(Sigma-Aldrich))、5-(1,4-二氮杂-1-基磺酰基)异喹啉(法舒地尔(fasudil)或HA 1077;开曼化学公司(CaymanChemical))、H-1152、H-1152P、(S)-(+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]高哌嗪、2HCl、ROCK抑制剂、二甲基法舒地尔(diMF,H-1152P)、N-(4-吡啶基)-N'-(2,4,6-三氯苯基)尿素、Y-39983、Wf-536、SNJ-1656、和(S)-+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]-六氢-1H-1,4-二氮环庚三烯二盐酸盐(H-1152;托克里斯生物科学(Tocris Bioscience)),及其衍生物和类似物。另外的ROCK抑制剂包括含咪唑的苯并二氮杂
在一个优选的实施例中,本发明的细胞增殖培养基中使用的ROCK抑制剂是(R)-(+)-反式-4-(1-氨乙基)-N-(4-吡啶基)环己烷甲酰胺二盐酸盐一水合物((1R,4r)-4-((R)-1-氨乙基)-N-(吡啶-4-基)环己烷甲酰胺;Y-27632;西格玛-奥德里奇公司(Sigma-Aldrich);描述于Nature[自然]1997,第389卷,第990-994页;JP4851003,JP11130751;JP2770497;US5478838;US6218410,其所有通过引用以其整体并入本文中)。
在一个实施例中,所述ROCK抑制剂,特别地Y-27632,以约0.5至约100微摩尔,优选为约0.5至约25微摩尔,更优选为约1至约20微摩尔,特别优选为约10微摩尔的浓度存在。在一个实施例中,所述本发明的化合物以0.5至100微摩尔,优选0.5至25微摩尔,更优选1至20微摩尔,特别优选10微摩尔的浓度存在。在一个具体的实施例中,所述ROCK抑制剂,特别地Y-27632,以10微摩尔的浓度存在。
在一个具体的实施例中,本发明的细胞增殖培养基包含DMEM/F12(1:1)、5%-20%的人血清或胎牛血清或血清替代物、1mM-2mM氯化钙、1微摩尔至20微摩尔的LATS抑制剂、以及任选的1微摩尔至20微摩尔ROCK抑制剂。在一个更具体的实施例中,本发明的细胞增殖培养基包含DMEM/F12(1:1)、10%-20%的人血清或胎牛血清或血清替代物(例如10%的人血清或胎牛血清或血清替代物)、1mM-2mM氯化钙、3微摩尔至10微摩尔的LATS抑制剂、以及任选的10微摩尔ROCK抑制剂。
细胞可以经历一轮或多轮新鲜生长培养基和/或细胞增殖培养基的添加。无需传代细胞即可添加新鲜培养基,但传代细胞也是添加新鲜培养基的一种方式。
也可以使用一系列培养基,以各种顺序组合:例如,细胞增殖培养基,然后添加生长培养基(其未补充有根据本发明的LATS抑制剂,并且可以不同于用作细胞增殖培养基基础的生长培养基)。
根据本发明的细胞群扩增阶段发生在细胞暴露于细胞增殖培养基的时期。
可以使用本领域已知的用于培养细胞的标准温度条件,例如优选地约30℃至40℃。特别优选地,细胞生长以及细胞群扩增阶段在约37℃下进行。可以使用具有5%-10%CO
在培养期间,根据需要可以在生长或细胞增殖培养基中传代细胞。细胞在亚汇合或汇合时可以传代。优选地,当细胞达到约90%-100%汇合时使细胞传代,尽管也可以在较低的汇合百分比水平进行。细胞的传代是根据本领域已知的标准方案进行的。例如,简而言之,通过以下来传代细胞:用Accutase处理培养物(例如10分钟),通过离心漂洗细胞悬浮液,并根据需要将细胞铺板在新鲜的生长培养基或细胞增殖培养基中。细胞分裂比的范围例如为1:2至1:5。
对于根据本发明的细胞群扩增方法的细胞群扩增阶段,可以进行接种细胞群在细胞增殖培养基中的扩增,直到获得所需量的细胞材料。
可将细胞暴露于细胞增殖培养基一段时间,以扩增细胞群。例如,这可以包括在培养基中培养LSC的全部时间,或者LSC分离后的第一周,或者从角膜分离角膜缘后的24小时。
在一个优选的实施例中,在从角膜中分离细胞后,将接种细胞群直接暴露于根据本发明的LATS抑制剂(例如根据式A1或其子式(例如,式A2)的那些化合物)并维持LSC增殖所需的整个时间,例如12至16天。
在根据本发明的一个实施例中,可以任选地执行基因编辑技术以遗传修饰细胞,以降低或消除介导免疫应答的基因的表达和/或功能,否则当将细胞群递送给患者时,其可能有助于免疫排斥。基因编辑技术在根据本发明的细胞群扩增方法中的应用是任选的,并且如果希望减轻患者体内被移植材料的免疫排斥问题,可以替代的向患者施用局部免疫抑制剂和/或抗炎剂(如在免疫抑制剂和抗炎剂部分下进一步描述)。
根据本发明的一方面,遗传修饰包括降低或消除与促进宿主抗移植免疫应答有关的基因的表达和/或功能。在一个优选的实施例中,遗传修饰包括将基因编辑系统引入角膜缘干细胞中,所述基因编辑系统特异性靶向与促进宿主抗移植免疫应答相关的基因。在一个具体的实施例中,所述基因编辑系统是CRISPR(CRISPR:成簇规律间隔短回文重复序列,也称为CRISPR/Cas系统)。
基因编辑技术可以在不同的点进行,例如(1)在角膜缘上皮组织上,LSC分离之前或(2)在细胞分离时或(3)在体外细胞群扩增阶段(在细胞在体外暴露于本发明的LATS抑制剂时)或(4)在体外在细胞群扩增阶段结束时(在细胞体外暴露于本发明的LATS抑制剂之后)。在一个实施例中,在根据本发明的LATS抑制剂存在下细胞体外扩增两周后使用CRISPR。
在“降低免疫排斥”部分中进一步描述了适用于细胞群扩增方法的基因编辑技术。
在根据本发明的细胞群扩增方法中,优选为化合物的LATS抑制剂产生接种细胞群的大于2倍的扩增。
在根据本发明的细胞群扩增方法的一个方面,根据式A1或其子式(例如,式A2)的化合物产生角膜缘细胞的接种群的大于30倍扩增。在根据本发明的细胞群扩增方法的一个具体的实施例中,根据式A1或其子式(例如,式A2)的LATS抑制剂产生角膜缘细胞的接种群的100倍至2200倍扩增。在根据本发明的细胞群扩增方法的一个更具体的实施例中,根据式A1或其子式(例如,式A2)的LATS抑制剂产生角膜缘细胞的接种群的600倍至2200倍扩增。通过根据本发明的细胞群扩增方法获得的倍数扩增系数可以在细胞的一次或多次传代中实现。在本发明的另一个方面,通过根据本发明的细胞群扩增方法获得的倍数扩增系数可以在暴露于根据式A1或其子式(例如,式A2)的化合物约12至16天、优选地约14天后实现。
在根据本发明的细胞群扩增方法的一个方面,根据式A1或其子式(例如,式A2)的LATS抑制剂产生相较于细胞总数,其中p63α阳性细胞多于6%的细胞群。在根据本发明的细胞群扩增方法的一个具体的实施例中,根据式A1或其子式(例如,式A2)的LATS抑制剂产生相较于细胞总数,其中p63α阳性细胞多于20%的细胞群。在根据本发明的细胞群扩增方法的另一个具体的实施例中,根据式A1或其子式(例如,式A2)的LATS抑制剂产生相较于细胞总数,其中p63α阳性细胞多于70%的细胞群。在根据本发明的细胞群扩增方法的又另一个具体的实施例中,根据式A1或其子式(例如,式A2)的LATS抑制剂产生相较于细胞总数,其中p63α阳性细胞多于95%的细胞群。通过根据本发明的细胞群扩增方法获得的p63α阳性细胞的百分比的增加可以在细胞的一次或多次传代中实现。在本发明的另一个方面,通过根据本发明的细胞群扩增方法获得的p63α阳性细胞的百分比的增加可以在暴露于根据式A1或其子式(例如,式A2)的化合物约12至16天、优选地约14天后实现。
如果需要测量细胞数或细胞群的扩增,可以例如通过取等分样品并进行免疫细胞化学(例如,计数被Sytox Orange染色的细胞核)或通过在明场显微镜下进行活细胞成像来计数细胞数来完成或通过在根据本发明的方法的细胞群扩增阶段的各个时间点对细胞融合进行实时定量活细胞分析来完成。
Sytox Orange测定可根据本领域已知的标准方案进行。简而言之,在细胞附着于细胞培养皿后(通常在细胞铺板后24小时),将细胞固定在多聚甲醛中。然后使细胞透化(例如,使用0.3%Triton X-100的溶液),然后将其在Sytox Orange的溶液中标记(例如,使用在PBS的中的0.5微摩尔Sytox Orange)。然后在Zeiss落射荧光显微镜下计数每表面面积被Sytox Orange染色的核的数目。
适合地,根据本发明,可以使用本领域技术人员已知的多种方法,例如免疫标记和荧光分选,例如固相吸附、荧光活化的细胞分选(FACS)、磁亲和细胞分选(MACS)等将通过细胞群扩增的方法可获得的或获得的LSC与培养物中的其他细胞中分离。在某些实施例中,通过分选,例如某些细胞表面标志物的免疫荧光分选,分离LSC。本领域技术人员熟知的两种优选的分选方法是MACS和FACS。适用于所述细胞分选的LSC标志物是p63α、ABCB5、ABCG2和C/EBPδ。
因此,在一个方面,本发明涉及一种制备用于眼细胞疗法的修饰的角膜缘干细胞或修饰的角膜缘干细胞群的方法,所述方法包括,
a)通过降低或消除B2M的表达来修饰角膜缘干细胞或角膜缘干细胞群,包括将包含具有靶向结构域的gRNA分子的CRISPR系统引入所述角膜缘干细胞或所述角膜缘干细胞群,所述靶向结构域
(i)包含SEQ ID NO:23-105或108-119、或134至140中任一项的序列,或
(ii)与选自以下的基因组区域内的序列互补:
chr15:44711469-44711494、chr15:44711472-44711497、chr15:44711483-44711508、chr15:44711486-44711511、chr15:44711487-44711512、chr15:44711512-44711537、chr15:44711513-44711538、chr15:44711534-44711559、chr15:44711568-44711593、chr15:44711573-44711598、chr15:44711576-44711601、chr15:44711466-44711491、chr15:44711522-44711547、chr15:44711544-44711569、chr15:44711559-44711584、chr15:44711565-44711590、chr15:44711599-44711624、chr15:44711611-44711636、chr15:44715412-44715437、chr15:44715440-44715465、chr15:44715473-44715498、chr15:44715474-44715499、chr15:44715515-44715540、chr15:44715535-44715560、chr15:44715562-44715587、chr15:44715567-44715592、chr15:44715672-44715697、chr15:44715673-44715698、chr15:44715674-44715699、chr15:44715410-44715435、chr15:44715411-44715436、chr15:44715419-44715444、chr15:44715430-44715455、chr15:44715457-44715482、chr15:44715483-44715508、chr15:44715511-44715536、chr15:44715515-44715540、chr15:44715629-44715654、chr15:44715630-44715655、chr15:44715631-44715656、chr15:44715632-44715657、chr15:44715653-44715678、chr15:44715657-44715682、chr15:44715666-44715691、chr15:44715685-44715710、chr15:44715686-44715711、chr15:44716326-44716351、chr15:44716329-44716354、chr15:44716313-44716338、chr15:44717599-44717624、chr15:44717604-44717629、chr15:44717681-44717706、chr15:44717682-44717707、chr15:44717702-44717727、chr15:44717764-44717789、chr15:44717776-44717801、chr15:44717786-44717811、chr15:44717789-44717814、chr15:44717790-44717815、chr15:44717794-44717819、chr15:44717805-44717830、chr15:44717808-44717833、chr15:44717809-44717834、chr15:44717810-44717835、chr15:44717846-44717871、chr15:44717945-44717970、chr15:44717946-44717971、chr15:44717947-44717972、chr15:44717948-44717973、chr15:44717973-44717998、chr15:44717981-44718006、chr15:44718056-44718081、chr15:44718061-44718086、chr15:44718067-44718092、chr15:44718076-44718101、chr15:44717589-44717614、chr15:44717620-44717645、chr15:44717642-44717667、chr15:44717771-44717796、chr15:44717800-44717825、chr15:44717859-44717884、chr15:44717947-44717972、chr15:44718119-44718144、chr15:44711563-44711585、chr15:44715428-44715450、chr15:44715509-44715531、chr15:44715513-44715535、chr15:44715417-44715439、chr15:44711540-44711562、chr15:44711574-44711596、chr15:44711597-44711619、chr15:44715446-44715468、chr15:44715651-44715673、chr15:44713812-44713834、chr15:44711579-44711601、chr15:44711542-44711564、chr15:44711557-44711579、chr15:44711609-44711631、chr15:44715678-44715700、chr15:44715683-44715705、chr15:44715684-44715706、chr15:44715480-44715502,
其中所述角膜缘干细胞或所述角膜缘干细胞群任选地已经在LATS抑制剂存在下培养;以及
b)在包含LATS抑制剂以及任选地ROCK抑制剂的细胞培养基中进一步扩增所述修饰的角膜缘干细胞或角膜缘干细胞群;以及
c)任选地,通过荧光激活细胞分选(FACS)或磁性激活细胞分选(MACS),使所述角膜缘干细胞群富集具有LSC生物标志物例如p63α、ABCB5、ABCG2和C/EBPδ的表达的未分化的角膜缘干细胞,以及
d)任选地,通过荧光激活细胞分选(FACS)或磁性激活细胞分选(MACS),使所述角膜缘干细胞群富集降低或消除了B2M表达的角膜缘干细胞。
在根据本发明的一个方面,通过根据本发明的细胞群扩增方法可获得的或获得的LSC群优选显示以下特征中的至少一个。更优选地,其显示以下特征中的两个或更多个,更优选地,其显示以下特征中的全部。
(1)所述细胞制剂对p63α细胞呈阳性。p63α的表达可以通过本领域已知的标准技术来估计,例如免疫组织化学和定量RT-PCR。
(2)所述细胞制剂包含超过6%的p63α阳性细胞。优选地,所述细胞制剂包含超过10%、20%、30%、40%、50%、60%、70%、80%或90%的p63α阳性细胞。在一个优选的实施例中,所述细胞制剂包含超过95%的p63α阳性细胞。p63α细胞的百分比可以通过免疫组织化学或FACS测量。
(3)所述细胞表达ABCB5、ABCG2和C/EBPδ中的一种或多种。ABCB5、ABCG2、和C/EBPδ的表达可以通过本领域已知的标准技术来估计,例如免疫组织化学和定量RT-PCR。
(4)通过角蛋白-12表达观察到,所述细胞可以分化为角膜上皮细胞。这些特征可以通过免疫组织化学或FACS观察到。
(5)所述细胞制剂包含超过50%的B2M和/或HLA-ABC阴性细胞。优选地,所述细胞制剂包含超过50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%的B2M和/或HLA-ABC阴性细胞。在一个优选的实施例中,所述细胞制剂包含超过95%的B2M和/或HLA-ABC阴性细胞。B2M和/或HLA-ABC阴性细胞的百分比可以通过免疫组织化学或FACS或MACS测量。
在一个优选的实施例中,所述细胞制剂包含超过95%的p63α阳性细胞和超过95%的B2M和/或HLA-ABC阴性细胞。
可以将通过根据本发明的细胞群扩增方法扩增的细胞群添加至溶液中,然后例如在保存溶液或冷冻保存溶液(例如下文所述的那些)中进行存储,或直接添加至适合于眼递送的组合物中。适用于眼递送的保存溶液、冷冻保存溶液或组合物可以任选地包含根据本发明的LATS抑制剂。
在根据本发明的更优选的实施例中,递送至眼的细胞群制剂包含非常低(例如,低痕量水平)至可忽略的水平的LATS抑制剂化合物。因此,在一个具体的实施例中,根据本发明的细胞群扩增的方法包括进一步漂洗的步骤,以基本上除去本发明的化合物(例如根据式A1或其子式的化合物)。这可以包括在根据本发明的细胞群扩增阶段之后漂洗细胞。为了漂洗细胞,将细胞与培养皿中脱离(例如,通过用Accutase处理),然后离心脱离的细胞,并在PBS或根据本发明的生长培养基中制备细胞悬浮液。所述步骤可以进行多次,例如1至10次,以漂洗出细胞。最后,可以根据需要将细胞重悬于保存溶液、冷冻保存溶液、适合于眼递送的组合物、生长培养基或其组合中。
通过细胞群扩增方法和漂洗包含根据本发明的LATS抑制剂的细胞增殖培养基制备的扩增的细胞群可以被转移到适于眼递送的组合物中,例如定位剂。任选地,将细胞群在添加到适于眼递送的定位剂之前存储一段时间。在一个优选的实施例中,可以首先将扩增的细胞群添加至适合于保存或冷冻保存的溶液中,所述溶液优选不包含LATS抑制剂,并且在添加至适合于眼递送的定位剂之前存储(任选地冷冻)的细胞群优选也不含LATS抑制剂。
适用于LSC保存的典型溶液是Optisol或PBS或CryoStor CS5缓冲液(生物生命溶液公司(BioLife Solutions)),优选是Optisol。Optisol是包含硫酸软骨素和葡聚糖的角膜存储介质,以增强存储过程中的角膜脱水(参见例如Kaufman等人,(1991)Optisolcorneal storage medium[Optisol角膜存储介质];Arch Ophthalmol[眼科学文献]6月;109(6):864-8)。为了冷冻保存,在本发明的冷冻保存溶液中可以使用甘油、二甲基亚砜、丙二醇或乙酰胺。冷冻保存的细胞制剂通常保持在-20℃或-80℃。在一个实施例中,冷冻保存的组合物包含细胞(例如,通过CRISPR系统具有降低或消除的B2M表达的修饰的细胞,例如LSC或CEC),例如,多个细胞)和选自下列的冷冻保护剂:甘油,DMSO(二甲基亚砜)聚乙烯吡咯烷酮、羟乙基淀粉、丙二醇、乙酰胺、单糖、藻类衍生的多糖、和糖醇、或其组合。在一个更具体的实施例中,冷冻保存的组合物包含细胞(例如,通过CRISPR系统具有降低或消除的B2M表达的修饰的细胞,例如LSC或CEC),例如,多个细胞)和浓度为0.5%至10%,例如,1%-10%、2%-7%、3%-6%、4%-5%、优选地5%的DMSO。DMSO可作为防冻剂,防止细胞内外形成水晶体,水晶体可能会导致细胞在冷冻保存步骤中受损。在另外的实施例中,冷冻保存的组合物进一步包含合适的缓冲液,例如CryoStor CS5缓冲液(生物生命溶液公司(BioLifeSolutions))。
在一个方面,本发明涉及通过根据本发明的细胞群扩增方法可获得的角膜缘干细胞的保存的或冷冻保存的制剂。在一个可替代的方面,本发明涉及一种新鲜细胞制剂,其中通过本发明的细胞群扩增方法可获得的角膜缘干细胞悬浮在PBS和/或生长培养基中或与定位剂组合。新鲜细胞制剂通常保持在约15℃至37℃。本领域已知的标准细胞培养容器例如小瓶或烧瓶可用于储存细胞。
在根据本发明的优选实施例中,在用于眼之前,将冷冻保存的细胞制剂解冻(例如,通过在培养箱或水浴中在约37℃的温度下培养)。优选地,可以添加10体积的PBS或生长培养基以从冷冻保存液中漂洗掉细胞。然后可以在与用于眼递送的定位剂组合之前将细胞通过离心漂洗,并且可以在PBS和/或生长培养基中制成细胞悬浮液,所述定位剂还优选地不包含LATS抑制剂。
在本发明的一个方面,将通过细胞群扩增方法制备的扩增的细胞群制备为悬浮液(例如在PBS和/或生长培养基,例如X-VIVO培养基或DMEM/F12中)并与适合眼递送的定位剂(例如生物基质,如GelMA或纤维蛋白胶)组合使用。在根据本发明的治疗方法的一个具体的实施例中,细胞、PBS和/或生长培养基以及生物基质的这种组合经由载体(例如接触透镜)被递送至眼。在又另一个具体的实施例中,细胞、PBS和/或生长培养基以及生物基质的这种组合最多仅包含痕量水平的LATS抑制剂。
如本文所使用的术语“痕量水平”意指少于5%w/v(例如,不超过5%w/v、4%w/v、3%w/v、2%w/v、或1%w/v)、和优选地少于0.01%w/v(例如,不超过0.01%w/v、0.009%w/v、0.008%w/v、0.007%w/v、0.006%w/v、0.005%w/v、0.004%w/v、0.003%w/v、0.002%w/v、或0.001%w/v),其可以被测量,例如使用如在本文实例中所述的高分辨率色谱。在某些实施例中,本发明的LATS抑制剂化合物的痕量水平是在一个或多个洗涤步骤之后存在的残余化合物的水平,其总地低于此类化合物的细胞效力,因此它们在体内不诱导生物学作用。因此,化合物的残余水平低于预期对细胞培养物中或受试者中的细胞群扩增具有生物学作用的量(例如,在将扩增的细胞群移植至受试者之后)。可以例如作为洗涤效率来测量痕量水平,其可以如下计算:洗涤效率=100-(洗涤后沉淀的平均浓度x沉淀体积x分子量)/(化合物浓度x培养基体积x分子量)。如本文所使用的,“漂洗以基本上从细胞中去除”本发明的LATS抑制剂化合物是指用于建立痕量水平的LATS抑制剂化合物的步骤。
可替代地,可以培养细胞并且细胞群增殖阶段可以在适合于细胞递送至眼表面的定位剂(例如纤维蛋白、胶原蛋白)上的细胞增殖培养基中发生。
在一个方面,本发明涉及一种组合物,其包含本发明的修饰的角膜缘干细胞或通过本发明的方法获得的修饰的角膜缘干细胞或本发明的细胞群或通过本发明的方法获得的修饰的角膜缘干细胞群。适合地,所述组合物的修饰的角膜缘干细胞包含在与gRNA分子结构域的靶向结构域互补的靶序列处或附近形成的插入/缺失。适合地,所述插入/缺失包含10个或大于10个核苷酸缺失,任选地11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、或35个核苷酸缺失。适合地,所述插入/缺失在所述细胞群的细胞的至少约40%、例如至少约50%、例如至少约60%、例如至少约70%、例如至少约80%、例如至少约90%、例如至少约95%、例如至少约96%、例如至少约97%、例如至少约98%、例如至少约99%中形成。在一个实施例中,在所述细胞群的细胞的不超过约5%、例如不超过约1%、例如不超过约0.1%、例如不超过约0.01%中检测到脱靶插入/缺失,例如,如通过下一代测序和/或核苷酸插入测定法可检测到的。
细胞群扩增:制备扩增的角膜内皮细胞群:
在本发明的一个优选的实施例中,角膜内皮细胞(例如如在“
使用的培养基可以是生长培养基或细胞增殖培养基。本文将生长培养基定义为支持细胞群生长和维持的培养基。用于角膜内皮细胞培养的合适的生长培养基是本领域已知的,例如:补充了FBS(胎牛血清)的DMEM(杜氏改良伊戈尔培养基)(英杰公司(Invitrogen))、补充了人血清的人内皮SF(无血清)培养基(英杰公司(Invitrogen))、X-VIVO15培养基(龙沙集团(Lonza))或间充质干细胞条件培养基。这些可以另外补充有生长因子(例如bFGF)和/或抗生素如青霉素和链霉素。根据本发明的优选的生长培养基是X-VIVO15培养基(其没有另外补充生长因子)。
可替代地,可以首先将分离的细胞添加到根据本发明的细胞增殖培养基中。本文所定义的细胞增殖培养基包含生长培养基和根据本发明的LATS抑制剂。在根据本发明的细胞增殖培养基中,生长培养基组分选自下组,该组由以下组成:补充了FBS(胎牛血清)的DMEM(杜氏改良伊戈尔培养基)(英杰公司(Invitrogen))、补充了人血清的人内皮SF(无血清)培养基(英杰公司(Invitrogen))、X-VIVO15培养基(龙沙集团(Lonza))或间充质干细胞条件培养基。这些可以另外补充有生长因子(例如bFGF)和/或抗生素如青霉素和链霉素。
根据本发明的优选的细胞增殖培养基是具有根据本发明的LATS抑制剂的X-VIVO15培养基(龙沙集团)。这种细胞增殖培养基的优点是不需要另外的生长因子或饲养细胞来促进CEC的增殖。X-VIVO培养基尤其包括药物级人白蛋白、重组人胰岛素和巴氏灭菌的人转铁蛋白。任选地,可以将抗生素添加到X-VIVO15培养基中。在一个优选的实施例中,使用X-VIVO15培养基而不添加抗生素。
细胞增殖培养基包含生长培养基和根据本发明的LATS抑制剂。LATS抑制剂优选选自包含根据式A1或其子式(例如式A2)并且如在“LATS抑制剂”部分下进一步描述的化合物的组。
在一个优选的实施例中,以约0.5至100微摩尔,优选约0.5至25微摩尔,更优选约1至20微摩尔的浓度添加根据式A1或其子式(例如式A2)的LATS抑制剂。在一个优选的实施例中,以0.5至100微摩尔,优选0.5至25微摩尔,更优选1至20微摩尔的浓度添加根据式A1或其子式(例如式A2)的LATS抑制剂。在一个具体的实施例中,以约3至10微摩尔的浓度添加根据式A1或其子式(例如式A2)的LATS抑制剂。在一个更具体的实施例中,以约3至10微摩尔的浓度添加根据式A1或其子式(例如式A2)的LATS抑制剂。
在一个实施例中,可以通过将化合物粉末在DMSO中溶解至储备浓度为10mM来制备根据式A1或其子式(例如式A2)的化合物的储备溶液。在一个实施例中,可以通过将化合物粉末在DMSO中溶解至储备浓度为1mM至100mM(例如1mM至50mM、5mM至20mM、10mM至20mM,特别地10mM)来制备根据式A1或其子式(例如式A2)的化合物的储备溶液。
在本发明的一个方面,根据本发明的LATS抑制剂抑制角膜内皮细胞中LATS1和/或LATS2活性。在一个优选的实施例中,所述LATS抑制剂抑制LATS1和LATS2。
在一个实施例中,本发明的细胞增殖培养基任选地进一步包含rho相关蛋白激酶(ROCK)抑制剂。发现添加ROCK抑制剂可防止细胞死亡并促进悬浮液中的细胞附着,特别是在培养干细胞时。在一个优选的实施例中,本发明的细胞增殖培养基中使用的ROCK抑制剂是(R)-(+)-反式-4-(1-氨乙基)-N-(4-吡啶基)环己烷甲酰胺二盐酸盐一水合物((1R,4r)-4-((R)-1-氨乙基)-N-(吡啶-4-基)环己烷甲酰胺;Y-27632;西格玛-奥德里奇公司(Sigma-Aldrich);描述于Nature[自然]1997,第389卷,第990-994页;JP4851003,JP11130751;JP2770497;US5478838;US6218410,其所有通过引用以其整体并入本文中)。
在一个实施例中,所述ROCK抑制剂,特别地Y-27632,以约0.5至约100微摩尔,优选为约0.5至约25微摩尔,更优选为约1至约20微摩尔,特别优选为约10微摩尔的浓度存在。在一个实施例中,所述本发明的化合物以0.5至100微摩尔,优选0.5至25微摩尔,更优选1至20微摩尔,特别优选10微摩尔的浓度存在。在一个具体的实施例中,所述ROCK抑制剂,特别地Y-27632,以10微摩尔的浓度存在。
在一个具体的实施例中,本发明的细胞增殖培养基包含DMEM/F12(1:1)、5%-20%的人血清或胎牛血清或血清替代物、1mM-2mM氯化钙、1微摩尔至20微摩尔的LATS抑制剂、以及任选的1微摩尔至20微摩尔ROCK抑制剂。在一个更具体的实施例中,本发明的细胞增殖培养基包含DMEM/F12(1:1)、10%-20%的人血清或胎牛血清或血清替代物(例如10%的人血清或胎牛血清或血清替代物)、1mM-2mM氯化钙、3微摩尔至10微摩尔的LATS抑制剂、以及任选的10微摩尔ROCK抑制剂。
细胞可以经历一轮或多轮新鲜生长培养基和/或细胞增殖培养基的添加。无需传代细胞即可添加新鲜培养基,但传代细胞也是添加新鲜培养基的一种方式。
也可以使用一系列培养基,以各种顺序组合:例如,细胞增殖培养基,然后添加生长培养基(其未补充有根据本发明的LATS抑制剂,并且可以不同于用作细胞增殖培养基基础的生长培养基)。
根据本发明的细胞群扩增阶段发生在细胞暴露于细胞增殖培养基的时期。
可以使用本领域已知的用于培养细胞的标准温度条件,例如优选地约30℃至40℃。特别优选地,细胞生长以及细胞群扩增阶段在约37℃下进行。可以使用具有5%-10%CO
在培养期间,根据需要可以在生长或细胞增殖培养基中传代细胞。细胞在亚汇合或汇合时可以传代。优选地,当细胞达到约90%-100%汇合时使细胞传代,尽管也可以在较低的汇合百分比水平进行。细胞的传代是根据本领域已知的标准方案进行的。例如,简而言之,例如使用胶原酶将细胞从培养容器中脱离。然后将细胞离心并在PBS或根据本发明的细胞生长培养基中漂洗,并根据需要以例如1:2至1:4的稀释度接种在新鲜的生长或细胞增殖培养基中。
对于根据本发明的细胞群扩增方法的细胞群扩增阶段,可以进行接种细胞群在细胞增殖培养基中的扩增,直到获得所需量的细胞材料。
可将细胞暴露于细胞增殖培养基一段时间,以扩增细胞群。例如,这可能包括在培养基中培养CEC的全部时间,或者仅CEC分离后的第一至两周,或者仅从角膜分离后的24小时。
在一个优选的实施例中,在从角膜中分离细胞后,将角膜内皮细胞直接暴露于根据本发明的LATS抑制剂(例如根据式A1或其子式(例如,式A2)的那些化合物)并维持CEC增殖所需的整个时间,例如一至两周。
在本发明的一个更优选的实施例中,在体外细胞群扩增阶段之后(即,在将细胞暴露于根据本发明的LATS抑制剂一段时间以扩增细胞群之后),根据本发明的细胞群扩增方法包括另外的步骤,其中可以在不补充LATS抑制剂的情况下使细胞在生长培养基中生长一段时间(例如两周),以使得能够形成成熟的角膜内皮。成熟的角膜内皮在本文中被定义为具有六边形形态、ZO-1阳性紧密连接和Na/K ATP酶表达的CEC的单层。在一个优选的实施例中,当形成成熟的角膜内皮时,细胞不传代。
在根据本发明的一个实施例中,可以任选地执行基因编辑技术以遗传修饰细胞,以降低或消除介导免疫应答的基因的表达和/或功能,否则当将细胞群递送给患者时,其可能有助于免疫排斥。基因编辑技术在根据本发明的细胞群扩增方法中的应用是任选的,并且如果希望减轻患者体内被移植材料的免疫排斥问题,可以替代的向患者施用局部免疫抑制剂和/或抗炎剂(如在免疫抑制剂和抗炎剂部分下进一步描述)。
根据本发明的一个方面,对于使用基因编辑技术的情形,遗传修饰包括降低或消除与促进宿主抗移植免疫应答有关的基因的表达和/或功能。在一个优选的实施例中,遗传修饰包括将基因编辑系统引入角膜内皮细胞中,所述基因编辑系统特异性靶向与促进宿主抗移植免疫应答相关的基因。在一个具体的实施例中,所述基因编辑系统是CRISPR(CRISPR:成簇规律间隔短回文重复序列,也称为CRISPR/Cas系统)。
基因编辑技术(如果使用)可以在不同的点进行,例如(1)在角膜组织上,CEC分离之前或(2)在细胞分离时或(3)在体外细胞群扩增阶段(在细胞在体外暴露于本发明的LATS抑制剂时)或(4)在体外在细胞群扩增阶段结束时(在细胞体外暴露于本发明的LATS抑制剂之后)。
在“降低免疫排斥”部分中进一步描述了适用于细胞群扩增方法的基因编辑技术。
在根据本发明的细胞群扩增方法中,优选为化合物的LATS抑制剂产生接种细胞群的大于2倍的扩增。
在根据本发明的细胞群扩增方法的一个方面,根据式A1或其子式(例如,式A2)的化合物产生角膜内皮细胞的接种群的大于10倍扩增。在根据本发明的细胞群扩增方法的一个具体的实施例中,根据式A1或其子式(例如,式A2)的LATS抑制剂产生角膜内皮细胞的接种群的15倍至600倍扩增。在根据本发明的细胞群扩增方法的一个更具体的实施例中,根据式A1或其子式(例如,式A2)的LATS抑制剂产生角膜内皮细胞的接种群的扩增为20倍至550倍。通过根据本发明的细胞群扩增方法获得的倍数扩增系数可以在细胞的一次或多次传代中实现。在本发明的另一个方面,通过根据本发明的细胞群扩增方法获得的倍数扩增系数可以在暴露于根据式A1或其子式(例如,式A2)的化合物一至两周后实现,优选地约10天后。
如果需要测量细胞数或细胞群的扩增,可以例如通过取等分样品并进行免疫细胞化学(例如,计数被Sytox Orange染色的细胞核)或通过在明场显微镜下进行活细胞成像来计数细胞数来完成或通过在根据本发明的方法的细胞群扩增阶段的各个时间点对细胞融合进行实时定量活细胞分析来完成。
适合地,根据本发明,可以使用本领域技术人员已知的多种方法,例如免疫标记和荧光分选,例如固相吸附、荧光活化的细胞分选(FACS)、磁亲和细胞分选(MACS)等将通过细胞群扩增的方法可获得的或获得的CEC与培养物中的其他细胞中分离。在某些实施例中,通过分选,例如某些细胞表面标志物的免疫荧光分选,分离CEC。本领域技术人员熟知的两种优选的分选方法是MACS和FACS。适用于所述细胞分选的CEC标志物是Na/K ATP酶、8a2、AQP1和SLC4A11。
因此,在一个方面,本发明涉及一种制备用于眼细胞疗法的修饰的CEC或修饰的CEC群的方法,所述方法包括,
a)通过降低或消除B2M的表达来修饰CEC或CEC群,包括将包含具有靶向结构域的gRNA分子的CRISPR系统引入所述CEC或所述CEC群,所述靶向结构域
(i)包含SEQ ID NO:23-105或108-119、或134至140中任一项的序列,或
(ii)与选自以下的基因组区域内的序列互补:
chr15:44711469-44711494、chr15:44711472-44711497、chr15:44711483-44711508、chr15:44711486-44711511、chr15:44711487-44711512、chr15:44711512-44711537、chr15:44711513-44711538、chr15:44711534-44711559、chr15:44711568-44711593、chr15:44711573-44711598、chr15:44711576-44711601、chr15:44711466-44711491、chr15:44711522-44711547、chr15:44711544-44711569、chr15:44711559-44711584、chr15:44711565-44711590、chr15:44711599-44711624、chr15:44711611-44711636、chr15:44715412-44715437、chr15:44715440-44715465、chr15:44715473-44715498、chr15:44715474-44715499、chr15:44715515-44715540、chr15:44715535-44715560、chr15:44715562-44715587、chr15:44715567-44715592、chr15:44715672-44715697、chr15:44715673-44715698、chr15:44715674-44715699、chr15:44715410-44715435、chr15:44715411-44715436、chr15:44715419-44715444、chr15:44715430-44715455、chr15:44715457-44715482、chr15:44715483-44715508、chr15:44715511-44715536、chr15:44715515-44715540、chr15:44715629-44715654、chr15:44715630-44715655、chr15:44715631-44715656、chr15:44715632-44715657、chr15:44715653-44715678、chr15:44715657-44715682、chr15:44715666-44715691、chr15:44715685-44715710、chr15:44715686-44715711、chr15:44716326-44716351、chr15:44716329-44716354、chr15:44716313-44716338、chr15:44717599-44717624、chr15:44717604-44717629、chr15:44717681-44717706、chr15:44717682-44717707、chr15:44717702-44717727、chr15:44717764-44717789、chr15:44717776-44717801、chr15:44717786-44717811、chr15:44717789-44717814、chr15:44717790-44717815、chr15:44717794-44717819、chr15:44717805-44717830、chr15:44717808-44717833、chr15:44717809-44717834、chr15:44717810-44717835、chr15:44717846-44717871、chr15:44717945-44717970、chr15:44717946-44717971、chr15:44717947-44717972、chr15:44717948-44717973、chr15:44717973-44717998、chr15:44717981-44718006、chr15:44718056-44718081、chr15:44718061-44718086、chr15:44718067-44718092、chr15:44718076-44718101、chr15:44717589-44717614、chr15:44717620-44717645、chr15:44717642-44717667、chr15:44717771-44717796、chr15:44717800-44717825、chr15:44717859-44717884、chr15:44717947-44717972、chr15:44718119-44718144、chr15:44711563-44711585、chr15:44715428-44715450、chr15:44715509-44715531、chr15:44715513-44715535、chr15:44715417-44715439、chr15:44711540-44711562、chr15:44711574-44711596、chr15:44711597-44711619、chr15:44715446-44715468、chr15:44715651-44715673、chr15:44713812-44713834、chr15:44711579-44711601、chr15:44711542-44711564、chr15:44711557-44711579、chr15:44711609-44711631、chr15:44715678-44715700、chr15:44715683-44715705、chr15:44715684-44715706、chr15:44715480-44715502,
其中所述CEC或CEC群任选地在LATS抑制剂存在下培养;以及
b)在包含LATS抑制剂以及任选地ROCK抑制剂的细胞培养基中进一步扩增修饰的CEC或CEC群;以及
c)任选地,通过荧光激活细胞分选(FACS)或磁性激活细胞分选(MACS),使CEC群富集具有CEC生物标志物(例如Na/K ATP酶、8a2、AQP1和SLC4A11)的表达的未分化的CEC,以及
d)任选地,通过荧光激活细胞分选(FACS)或磁性激活细胞分选(MACS),使CEC群富集降低或消除了B2M表达的CEC。
在根据本发明的一个方面,通过根据本发明的细胞群扩增方法可获得的或获得的CEC群优选显示以下特征中的至少一个。更优选地,其显示以下特征中的两个或更多个,特别优选地,其显示以下特征中的全部。
(1)所述细胞表达Na/K ATP酶。Na/K ATP酶的表达可以通过本领域已知的标准技术来估计,例如免疫组织化学、定量RT-PCR或通过FACS分析。
(2)所述细胞表达胶原8a2、AQP1(水通道1)和SLC4A11(溶质载体家族4成员11)中的一个或多个。优选地,相对表达水平高于通常不表达胶原蛋白8a2、AQP1和SLC4A11的细胞,例如在皮肤成纤维细胞中。胶原蛋白8a2、AQP1或SLC4A11的表达可以通过本领域已知的标准技术来估计,例如免疫组织化学、定量RT-PCR或通过FACS分析。
(3)所述细胞不表达(或至多表达相对低水平的)RPE65(视网膜色素上皮的标志物)和/或CD31(血管内皮的标志物)。相对表达水平类似于通常不表达RPE65、CD31的细胞,例如在真皮成纤维细胞中。RPE65和CD31的表达可以通过本领域已知的标准技术来估计,例如定量RT-PCR、免疫组织化学或FACS分析。
(4)所述细胞表达相对较低水平的CD73。相对表达水平低于经历了内皮向间质转化的细胞。CD73的表达可以通过本领域已知的标准技术来估计,例如FACS分析或免疫组织化学。
(5)所述细胞制剂包含超过50%的B2M和/或HLA-ABC阴性细胞。优选地,所述细胞制剂包含超过50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%的B2M和/或HLA-ABC阴性细胞。在一个优选的实施例中,所述细胞制剂包含超过95%的B2M和/或HLA-ABC阴性细胞。B2M和/或HLA-ABC阴性细胞的百分比可以通过免疫组织化学或FACS或MACS测量。
在一个优选的实施例中,所述细胞制剂包含超过95%的Na/K ATP酶、8a2、AQP1或SLC4A11阳性细胞和超过95%的B2M和/或HLA-ABC阴性细胞。
在根据本发明的另一个方面,当在层中时,例如当在板上培养时,通过根据本发明的细胞群扩增方法可获得的CEC群优选显示以下特征中的至少一个。更优选地,其显示以下特征中的两个或更多个,特别优选地,其显示以下特征中的全部:
(1)所述细胞能够形成单层结构。这是体内角膜内皮细胞层的特征之一。这可以通过核染色(例如,用核染料如Sytox、Hoechst)然后显微镜检查来观察。
(2)所述细胞能够形成紧密连接。这可以通过本领域已知的标准技术紧密连接标志物封闭小带-1(ZO-1)的免疫荧光染色进行检查。
(3)所述细胞能够规则地布置在细胞层中。这可以通过本领域已知的标准技术紧密连接标志物封闭小带-1(ZO-1)的免疫荧光染色进行检查。在体内健康的角膜内皮细胞层中,构成所述层的细胞规则地排列,因此认为角膜内皮细胞维持正常功能和高透明度,并且角膜被认为适当地表现出水控制功能。
可以将通过根据本发明的细胞群扩增方法扩增的细胞群添加至溶液中,然后例如在保存溶液或冷冻保存溶液(例如下文所述的那些)中进行存储,或直接添加至适合于眼递送的组合物中。适用于眼递送的保存溶液、冷冻保存溶液或组合物可以任选地包含根据本发明的LATS抑制剂。
在根据本发明的更优选的实施例中,递送给眼的细胞群制剂包含非常低至可忽略的水平的LATS抑制剂化合物。因此,在一个具体的实施例中,根据本发明的细胞群扩增的方法包括进一步漂洗的步骤,以基本上除去本发明的化合物(例如根据式A1或其子式(例如,式A2)的化合物)。这可以包括在根据本发明的细胞群扩增阶段之后(直接在细胞群扩增阶段之后和/或在已经培养细胞以在未补充LATS抑制剂的生长培养基中形成成熟的角膜内皮之后)漂洗细胞。为了漂洗细胞,将细胞离心,并在PBS或根据本发明的生长培养基中制备细胞悬浮液。所述步骤可以进行多次,例如1至10次,以漂洗出细胞。最后,可以根据需要将细胞重悬于保存溶液、冷冻保存溶液、适合于眼递送的组合物、生长培养基或其组合中。
通过细胞群扩增方法和漂洗包含根据本发明的LATS抑制剂的细胞增殖培养基制备的扩增的细胞群可以被转移到适于眼递送的组合物中,例如定位剂。任选地,将细胞群在添加到适于眼递送的定位剂之前存储一段时间。在一个优选的实施例中,可以首先将扩增的细胞群添加至适合于保存或冷冻保存的溶液中,所述溶液优选不包含LATS抑制剂,并且在添加至适合于眼递送的定位剂之前存储(任选地冷冻)的细胞群优选也不含LATS抑制剂。
适用于保存CEC的典型溶液是Optisol或PBS,优选是Optisol。Optisol是包含硫酸软骨素和葡聚糖的角膜存储介质,以增强存储过程中的角膜脱水(参见例如Kaufman等人,(1991)Optisol corneal storage medium[Optisol角膜存储介质];Arch Ophthalmol[眼科学文献]6月;109(6):864-8)。为了冷冻保存,在本发明的冷冻保存溶液中可以使用甘油、二甲基亚砜、丙二醇或乙酰胺。冷冻保存的细胞制剂通常保持在-20℃或-80℃。
在一个方面,本发明涉及通过根据本发明的细胞群扩增方法可获得的角膜内皮细胞的保存的或冷冻保存的制剂。在一个可替代的方面,本发明涉及一种新鲜细胞制剂,其中通过本发明的细胞群扩增方法可获得的角膜内皮细胞悬浮在PBS和/或生长培养基中或与定位剂组合。新鲜细胞制剂通常保持在约37℃。本领域已知的标准细胞培养容器例如小瓶或烧瓶可用于储存细胞。
在根据本发明的优选实施例中,在用于眼之前,将冷冻保存的细胞制剂解冻(例如,通过在培养箱或水浴中在约37℃的温度下培养)。优选地,可以添加10体积的PBS或生长培养基以从冷冻保存液中漂洗掉细胞。然后可以在与用于眼递送的定位剂组合之前将细胞通过离心漂洗,并且可以在PBS和/或生长培养基中制成细胞悬浮液,所述定位剂还优选地不包含LATS抑制剂。
在本发明的一个方面,将通过细胞群扩增方法(优选还包括在不补充LATS抑制剂的情况下在培养基中生长以形成成熟角膜内皮的步骤)制备的扩增的细胞群制备为悬浮液(例如在PBS和/或生长培养基,例如X-VIVO培养基中)并与适合眼递送的定位剂(例如生物基质,如GelMA或纤维蛋白胶)组合使用。在根据本发明的治疗方法的具体的实施例中,细胞、PBS和/或生长培养基以及生物基质的这种组合作为悬浮液被递送至眼。在又另一个具体的实施例中,细胞、PBS和/或生长培养基以及生物基质的这种组合最多仅包含痕量水平的LATS抑制剂。
可替代地,可以培养细胞并且细胞群增殖阶段可以在适合于细胞递送至眼表面的定位剂上的细胞增殖培养基中发生。
在本发明的一个实施例中,可以使用本领域已知的方法(例如,参见Kim等人,JSMBiotechnol.Bioeng.[JSM生物技术与生物工程],2016,第1047页)将根据本发明扩增的细胞群分离为连续的细胞片,以递送至角膜。细胞片可以机械地支撑在一种或多种材料上以递送至角膜。
在一个方面,本发明涉及一种组合物,其包含本发明的修饰的CEC或通过本发明的方法获得的修饰的CEC或本发明的细胞群或通过本发明的方法获得的修饰的CEC群。适合地,所述组合物的修饰的CEC包含在与gRNA分子结构域的靶向结构域互补的靶序列处或附近形成的插入/缺失。适合地,所述插入/缺失包含10个或大于10个核苷酸缺失,任选地11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、或35个核苷酸缺失。适合地,所述插入/缺失在所述细胞群的细胞的至少约40%、例如至少约50%、例如至少约60%、例如至少约70%、例如至少约80%、例如至少约90%、例如至少约95%、例如至少约96%、例如至少约97%、例如至少约98%、例如至少约99%中形成。在一个实施例中,在所述细胞群的细胞的不超过约5%、例如不超过约1%、例如不超过约0.1%、例如不超过约0.01%中检测到脱靶插入/缺失,例如,如通过下一代测序和/或核苷酸插入测定法可检测到的。
移植后,同种异体角膜缘干细胞或角膜内皮细胞有被接受者免疫系统排斥的风险。免疫抑制方案可用于降低移植细胞如LSC或CEC的免疫排斥风险。
用于同种异体LSC或CEC接受者的合适的全身性免疫抑制剂包括他克莫司、霉酚酸酯、泼尼松和预防性缬更昔洛韦和甲氧苄啶/磺胺甲噁唑。(参见:Holland EJ、Mogilishetty G、Skeens HM、Hair DB、Neff KD、Biber JM、Chan CC(2012)Systemicimmunosuppression in ocular surface stem cell transplantation:results of a10-year experience.[眼表干细胞移植的全身免疫抑制:10年经验的结果。]Cornea.[角膜]2012年6月;31(6):655-61)。
由于根据本发明的细胞群扩增方法提供了细胞群的高扩增能力,因此任选地,基因编辑技术可以用于去除免疫排斥的驱动因子或添加降低接受者免疫应答的基因。
在本发明的一方面,对细胞群“离体”进行基因编辑。在本发明的另一个方面,基因编辑技术可以任选地用于降低或消除与促进宿主抗移植免疫应答有关的基因的表达。在优选的实施例中,所述基因选自由以下组成的组:B2M、HLA-A、HLA-B和HLA-C。在一个具体的实施例中,所述基因是B2M。B2M是β2微球蛋白,是I类主要组织相容性复合物(MHC)的组分。它具有HUGO基因命名委员会(HGNC)标识符914。HLA-A是主要的组织相容性复合物,I级,A(HGNC ID 4931)。HLA-B是主要的组织相容性复合物,I级,B(HGNC ID 4932)。HLA-C是主要的组织相容性复合物,I级,C(HGNC ID 4933)。
在一个优选的实施例中,本发明的方法中使用的的基因编辑方法是CRISPR(CRISPR:成簇规律间隔短回文重复序列,也称为CRISPR/Cas系统)。在本发明的一方面,对细胞群“离体”进行基因编辑。
如本文所用的“CRISPR”是指一组规律间隔成簇短回文重复、或包含一组这种重复的系统。如本文所使用的,“Cas”是指CRISPR相关蛋白。多种CRISPR-Cas系统可以根据其效应模块的配置分为两类:1类CRISPR系统利用若干种Cas蛋白和crRNA以形成效应复合物,而2类CRISPR系统使用与crRNA结合的大的单组分Cas蛋白介导干扰。2类CRISPR-Cas系统的一个实例使用Cpf1(来自普氏菌属和弗朗西斯氏菌属的CRISPR 1)。参见例如,Zetsche等人,Cell[细胞]163:759-771(2015),将其内容通过引用以其全文并入本文。如本文所使用的,术语“Cpf1”包括可用于CRISPR系统的所有直向同源物、和变体。
术语“CRISPR系统”、“Cas系统”或“CRISPR/Cas系统”是指包含RNA指导的核酸酶或其他效应分子和gRNA分子的一组分子,它们一起对于指导和实现由RNA指导的核酸酶或其他效应分子在靶序列处对核酸的修饰是必需且足够的。在一个实施例中,CRISPR系统包含gRNA和Cas蛋白(例如Cas9蛋白)。包含Cas9或经修饰的Cas9分子的此类系统在本文中称为“Cas9系统”或“CRISPR/Cas9系统”。在一个实例中,gRNA分子和Cas分子可以复合,以形成核糖核蛋白(RNP)复合物。
在大约40%的测序的真细菌基因组和90%的测序的古细菌中发现了天然存在的CRISPR系统。Grissa等人(2007)BMC Bioinformatics[BMC生物信息学]8:172。此系统是赋予对外来遗传元件(如质粒和噬菌体)的抗性并提供获得性免疫的形式的原核免疫系统。Barrangou等人(2007)Science[科学]315:1709-1712;Marragini等人(2008)Science[科学]322:1843-1845。
已经修饰CRISPR系统用于真核生物(如小鼠、灵长类动物和人类)的基因编辑(沉默、增强或改变特定基因)。Wiedenheft等人(2012)Nature[自然]482:331-8。这通过例如向真核细胞中引入一种或多种编码特异性工程化的指导RNA(gRNA)(例如,包含与真核基因组的序列互补的序列的gRNA)的载体和一种或多种适当的RNA指导的核酸酶(例如,Cas蛋白)来实现。RNA引导的核酸酶与gRNA形成复合物,所述复合物然后通过gRNA的序列与真核基因组的互补序列的杂交定向至靶DNA位点,其中所述RNA引导的核酸酶随后诱导DNA中的双链或单链断裂。在链断裂处或附近插入或缺失核苷酸产生修饰的基因组。
由于这些天然存在于许多不同类型的细菌中,因此CRISPR的确切排列,和Cas基因的结构、功能和数量及其产物在物种之间略有不同。Haft等人(2005)PLoS Comput.Biol.[公共科学图书馆医学杂志第一版]1:e60;Kunin等人(2007)Genome Biol.[基因组生物学]8:R61;Mojica等人(2005)J.Mol.Evol.[分子进化杂志]60:174-182;Bolotin等人(2005)Microbiol.[微生物学]151:2551-2561;Pourcel等人(2005)Microbiol.[微生物学]151:653-663;和Stern等人(2010)Trends.Genet.[遗传学趋势]28:335-340。例如,Cse(Cas亚型,大肠杆菌)蛋白质(例如,CasA)形成功能性复合物Cascade,其将CRISPR RNA转录物处理成保留Cascade的间隔子重复单元。Brouns等人(2008)Science[科学]321:960-964。在其他原核生物中,Cas6加工CRISPR转录物。大肠杆菌中基于CRISPR的噬菌体失活需要Cascade和Cas3,但不需要Cas1或Cas2。强烈火球菌(Pyrococcus furiosus)和其他原核生物中的Cmr(Cas RAMP模块)蛋白形成具有小CRISPR RNA的功能性复合物,其识别和切割互补的靶RNA。
更简单的CRISPR系统依赖于蛋白质Cas9,其是具有两个活性切割位点的核酸酶,各自对应用于双螺旋的每条链。将Cas9和修饰的CRISPR基因座RNA组合可用于基因编辑系统。Pennisi(2013)Science[科学]341:833-836。
在一些实施例中,RNA指导的核酸酶是Cas分子,例如,Cas9分子。
术语“Cas9”或“Cas9分子”是指来自细菌II型CRISPR/Cas系统的负责DNA切割的酶。Cas9还包括野生型蛋白质及其功能性和非功能性突变体。“Cas9分子”可以与gRNA分子(例如tracr的结构域序列,也称为tracrRNA或反式激活CRISPR RNA)相互作用,并与gRNA分子协同定位(例如,靶向或归巢)在含有靶序列和PAM(原型间隔子相邻基序)序列的位点。根据本发明,在本文所述的方法和组合物中使用的Cas9分子可以来自、衍生自或以其他方式基于多种物种的Cas9蛋白。例如,例如酿脓链球菌、嗜热链球菌、金黄色葡萄球菌和/或脑膜炎奈瑟氏菌的Cas9分子、衍生自其的Cas9分子或基于其的Cas9分子可用于本文所述的系统、方法和组合物中。另外的Cas9物种包括:燕麦食酸菌(Acidovorax avenae)、胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae)、产琥珀酸放线杆菌(Actinobacillussuccinogenes)、猪放线杆菌(Actinobacillus suis)、放线菌属物种、cycliphilusdenitrificans、少食氨基酸单胞菌(Aminomonas paucivorans)、蜡样芽饱杆菌(Bacilluscereus)、史密斯氏芽孢杆菌(Bacillus smithii)、苏云金芽孢杆菌、拟杆菌属物种、Blastopirellula marina、慢生根瘤菌属物种、侧孢短芽孢杆菌(Brevibacilluslatemsporus)、结肠弯曲菌(Campylobacter coli)、空肠弯曲菌(Campylobacter jejuni)、拉德弯曲菌(Campylobacter lad)、Candidatus Puniceispirillum、解纤维梭菌(Clostridiu cellulolyticum)、产气荚膜梭菌(Clostridium perfringens)、拥挤棒杆菌(Corynebacterium accolens)、白喉棒杆菌(Corynebacterium diphtheria)、马氏棒杆菌(Corynebacterium matruchotii)、Dinoroseobacter sliibae、细长真杆菌(Eubacteriumdolichum)、γ变形杆菌、固氮葡糖醋杆菌(Gluconacetobacler diazotrophicus)、副流感嗜血杆菌(Haemophilus parainfluenzae)、生痰嗜血杆菌(Haemophilus sputorum)、加拿大螺杆菌(Helicobacter canadensis)、同性恋螺杆菌(Helicobacter cinaedi)、鼬鼠螺杆菌(Helicobacter mustelae)、多营养泥杆菌(Ilyobacter polytropus)、金氏金氏菌(Kingella kingae)、卷曲乳杆菌(Lactobacillus crispatus)、伊氏李斯特菌(Listeriaivanovii)、单核细胞增生李斯特菌(Listeria monocytogenes)、李斯特氏菌科细菌、甲基孢囊菌属物种、甲基弯菌(Methylosinus trichosporium)、羞怯动弯杆菌(Mobiluncusmulieris)、杆菌状奈瑟氏菌(Neisseria bacilliformis)、灰色奈瑟氏菌(Neisseriacinerea)、浅黄奈瑟氏菌(Neisseria flavescens)、乳糖奈瑟氏菌(Neisserialactamica)、奈瑟氏菌属物种、瓦茨瓦尔西奈瑟氏菌(Neisseria wadsworthii)、亚硝化单胞菌属物种、Parvibaculum lavamentivorans、多杀巴斯德菌(Pasteurella multocida)、琥珀酸考拉杆菌(Phascolarctobacterium succinatutens)、丁香罗尔斯通菌(Ralstoniasyzygii)、沼泽红假单胞菌(Rhodopseudomonas palustris)、小红卵菌属物种、穆氏西蒙斯氏菌(Simonsiella muelleri)、鞘氨醇单胞菌属物种、维尼芽孢乳杆菌(Sporolactobacillus vineae)、路邓葡萄球菌(Staphylococcus lugdunensis)、链球菌属物种、罕见小球菌属物种(Subdoligranulum sp.)、Tislrella mobilis、密螺旋体属物种、或Verminephrobacter eiseniae。
在一些实施例中,活性Cas9分子与靶核酸相互作用并切割靶核酸的能力是PAM序列依赖性的。PAM(原型间隔子相邻基序)序列是靶核酸中的序列。它通常很短,例如2至7个碱基对长。在一个实施例中,靶核酸的切割发生在PAM序列的上游。来自不同细菌物种的活性Cas9分子可以识别不同的序列基序(例如PAM序列)。在一个实施例中,酿脓链球菌的活性Cas9分子识别序列基序NGG并指导靶核酸序列的在所述序列上游1至10个(例如3至5个)碱基对的切割。参见例如,Mali等人,SCIENCE[科学]2013;339(6121):823-826。在一个实施例中,嗜热链球菌的活性Cas9分子识别序列基序NGGNG(SEQ ID NO:4)和NNAG AAW(SEQ IDNO:5)(W=A或T并且N是任何核碱基)并指导核心靶核酸序列的在这些序列上游1至10个(例如3至5个)碱基对的切割。参见例如,Horvath等人,SCIENCE[科学]2010;327(5962):167-170;以及Deveau等人,J BACTERIOL[细菌学杂志]2008;190(4):1390-1400。在一个实施例中,变形链球菌的活性Cas9分子识别序列基序NGG或NAAR(R-A或G)并指导核心靶核酸序列的在所述序列上游1至10个(例如3至5个)碱基对的切割。参见例如,Deveau等人,JBACTERIOL[细菌学杂志]2008;190(4):1390-1400。
在一个实施例中,金黄色葡萄球菌的活性Cas9分子识别序列基序NNGRR(SEQ IDNO:6)(R=A或G)并指导靶核酸序列的在所述序列上游1至10个(例如3至5个)碱基对的切割。参见例如,Ran F.等人,NATURE[自然],第520卷,2015,第186-191页。在一个实施例中,脑膜炎奈瑟氏菌的活性Cas9分子识别序列基序NNNNGATT(SEQ ID NO:7)并指导靶核酸序列的在所述序列上游1至10个(例如3至5个)碱基对的切割。参见例如,Hou等人,PNAS EARLYEDITION[美国国家科学院院刊早期版本]2013,1-6。可以例如使用Jinek等人,SCIENCE[科学]2012,337:816中描述的转化测定来确定Cas9分子识别PAM序列的能力。
示例性天然存在的Cas9分子描述于Chylinski等人,RNA Biology[RNA生物学]2013;10:5,727-737中。此类Cas9分子包括簇1细菌家族、簇2细菌家族、簇3细菌家族、簇4细菌家族、簇5细菌家族、簇6细菌家族、簇7细菌家族、簇8细菌家族、簇9细菌家族、簇10细菌家族、簇11细菌家族、簇12细菌家族、簇13细菌家族、簇14细菌家族、簇15细菌家族、簇16细菌家族、簇17细菌家族、簇18细菌家族、簇19细菌家族、簇20细菌家族、簇21细菌家族、簇22细菌家族、簇23细菌家族、簇24细菌家族、簇25细菌家族、簇26细菌家族、簇27细菌家族、簇28细菌家族、簇29细菌家族、簇30细菌家族、簇31细菌家族、簇32细菌家族、簇33细菌家族、簇34细菌家族、簇35细菌家族、簇36细菌家族、簇37细菌家族、簇38细菌家族、簇39细菌家族、簇40细菌家族、簇41细菌家族、簇42细菌家族、簇43细菌家族、簇44细菌家族、簇45细菌家族、簇46细菌家族、簇47细菌家族、簇48细菌家族、簇49细菌家族、簇50细菌家族、簇51细菌家族、簇52细菌家族、簇53细菌家族、簇54细菌家族、簇55细菌家族、簇56细菌家族、簇57细菌家族、簇58细菌家族、簇59细菌家族、簇60细菌家族、簇61细菌家族、簇62细菌家族、簇63细菌家族、簇64细菌家族、簇65细菌家族、簇66细菌家族、簇67细菌家族、簇68细菌家族、簇69细菌家族、簇70细菌家族、簇71细菌家族、簇72细菌家族、簇73细菌家族、簇74细菌家族、簇75细菌家族、簇76细菌家族、簇77细菌家族、或簇78细菌家族的Cas9分子。
示例性天然存在的Cas9分子包括簇1细菌家族的Cas9分子。实例包括以下的Cas9分子:酿脓链球菌(例如,菌株SF370、MGAS 10270、MGAS 10750、MGAS2096、MGAS315、MGAS5005、MGAS6180、MGAS9429、NZ131和SSI-1)、嗜热链球菌(例如,菌株LMD-9)、假豕链球菌(S.pseudoporcinus)(例如,菌株SPIN 20026)、变形链球菌(例如,菌株UA 159、NN2025)、猴链球菌(S.macacae)(例如,菌株NCTC1 1558)、解没食子酸链球菌(S.gallolylicus)(例如,菌株UCN34、ATCC BAA-2069)、马链球菌(S.equines)(例如,菌株ATCC9812、MGCS 124)、停乳链球菌(S.dysgalactiae)(例如,菌株GGS 124)、牛链球菌(S.bovis)(例如,菌株ATCC700338)、S.cmginosus(例如,菌株F021 1)、无乳链球菌(S.agalactia*)(例如,菌株NEM316、A909)、单核细胞增多性李斯特菌(例如,菌株F6854)、无害李斯特菌(L.innocua,例如,菌株Clip l1262)、意大利肠球菌(Enterococcus italicus)(例如,菌株DSM 15952)、或屎肠球菌(Enterococcus faecium)(例如,菌株1、23、408)。另外的示例性Cas9分子是脑膜炎奈瑟氏菌的Cas9分子(Hou等人PNAS Early Edition[美国国家科学院院刊早期版本]2013,1-6)和金黄色葡萄球菌Cas9分子。
在一个实施例中,Cas9分子(例如活性Cas9分子)包含与以下具有至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性的氨基酸序列;当与以下相比时,相差不超过1%、2%、5%、10%、15%、20%、30%或40%的氨基酸残基的氨基酸序列;与以下相差至少1、2、5、10或20个氨基酸但相差不超过100、80、70、60、50、40或30个氨基酸的氨基酸序列;或与以下相同的氨基酸序列:本文描述的任何Cas9分子序列或天然存在的Cas9分子序列,例如来自本文所列物种的或描述于Chylinski等人,RNA Biology[RNA生物学]2013,10:5,′I2′I-Τ,1;Hou等人PNAS Early Edition[美国国家科学院院刊早期版本]2013,1-6中的Cas9分子。
在一个实施例中,Cas9分子包含与以下具有至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性的氨基酸序列;当与以下相比时,相差不超过1%、2%、5%、10%、15%、20%、30%或40%的氨基酸残基的氨基酸序列;与以下相差至少1、2、5、10或20个氨基酸但相差不超过100、80、70、60、50、40或30个氨基酸的氨基酸序列;或与以下相同的氨基酸序列:酿脓链球菌Cas9(UniProt Q99ZW2)。在一个实施例中,Cas9分子包含与以下具有60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性的氨基酸序列;当与以下相比时,相差不超过1%、2%、5%、10%、15%、20%、30%或40%的氨基酸残基的氨基酸序列;与以下相差至少1、2、5、10或20个氨基酸但相差不超过100、80、70、60、50、40或30个氨基酸的氨基酸序列;或与以下相同的氨基酸序列:酿脓链球菌Cas9:
(SEQ ID NO:123)。
在某些实施例中,Cas9分子是酿脓链球菌Cas9变体,如在以下文献中描述的变体:Slaymaker等人,Science Express[科学快讯]中,可于2015年12月1日在Science DOI:10.1126/science.aad5227在线获得;Kleinstiver等人,Nature[自然],529,2016,第490-495页,可于2016年1月6日在doi:10.1038/nature16526在线获得;或US2016/0102324,这些文献的内容以其全文并入本文。
在一些实施例中,Cas9分子是SEQ ID NO:123的酿脓链球菌Cas9变体,其包含对带正电荷的氨基酸(例如赖氨酸、精氨酸或组氨酸)的一个或多个突变,这些突变在所述位置引入不带电荷或非极性氨基酸(例如丙氨酸)。在实施例中,突变是对于Cas9的nt沟中的一个或多个带正电荷的氨基酸而言的。在实施例中,Cas9分子是SEQ ID NO:123的酿脓链球菌Cas9变体,其包含在SEQ ID NO:123的位置855处的突变,例如在SEQ ID NO:123的位置855处突变为不带电荷的氨基酸,例如丙氨酸。在实施例中,Cas9分子仅在SEQ ID NO:123的位置855处相对于SEQ ID NO:123具有突变,例如突变为不带电荷的氨基酸,例如丙氨酸。在实施例中,Cas9分子是SEQ ID NO:123的酿脓链球菌Cas9变体,其包含在SEQ ID NO:123的位置810处的突变、位置1003处的突变、和/或位置1060处的突变,例如在SEQ ID NO:123的位置810、位置1003、和/或位置1060处突变为丙氨酸。在实施例中,Cas9分子仅在SEQ ID NO:123的位置810、位置1003、和位置1060处相对于SEQ ID NO:123具有突变,例如,其中每个突变是突变为不带电荷的氨基酸,例如丙氨酸。在实施例中,Cas9分子是SEQ ID NO:123的酿脓链球菌Cas9变体,其包含在SEQ ID NO:123的位置848处的突变、位置1003处的突变、和/或位置1060处的突变,例如在SEQ ID NO:123的位置848、位置1003、和/或位置1060处突变为丙氨酸。在实施例中,Cas9分子仅在SEQ ID NO:123的位置848、位置1003、和位置1060处相对于SEQ ID NO:123具有突变,例如,其中每个突变是突变为不带电荷的氨基酸,例如丙氨酸。在实施例中,Cas9分子是如在Slaymaker等人,Science Express[科学快讯]中描述的Cas9分子,所述文献可于2015年12月1日在Science DOI:10.1126/science.aad5227。
在实施例中,Cas9分子是SEQ ID NO:123的酿脓链球菌Cas9变体,其包含一个或多个突变。在实施例中,Cas9变体包含在SEQ ID NO:123的位置80处的突变,例如,包含SEQ IDNO:123的位置80处的亮氨酸(即,包含具有C80L突变的SEQ ID NO:123,或由其组成)。在实施例中,Cas9变体包含在SEQ ID NO:123的位置574处的突变,例如,包含SEQ ID NO:123的位置574处的谷氨酸(即,包含具有C574E突变的SEQ ID NO:123,或由其组成)。在实施例中,Cas9变体包含在SEQ ID NO:123的位置80处的突变和位置574处的突变,例如,包含SEQ IDNO:123的位置80处的亮氨酸和SEQ ID NO:123的位置574处的谷氨酸(即,包含具有C80L突变和C574E突变的SEQ ID NO:123,或由其组成)。不受理论束缚,据信此类突变改善了Cas9分子的溶解特性。
在实施例中,Cas9分子是SEQ ID NO:123的酿脓链球菌Cas9变体,其包含一个或多个突变。在实施例中,Cas9变体包含在SEQ ID NO:123的位置147处的突变,例如,包含SEQID NO:123的位置147处的酪氨酸(即,包含具有D147Y突变的SEQ ID NO:123,或由其组成)。在实施例中,Cas9变体包含在SEQ ID NO:123的位置411处的突变,例如,包含SEQ ID NO:123的位置411处的苏氨酸(即,包含具有P411T突变的SEQ ID NO:123,或由其组成)。在实施例中,Cas9变体包含在SEQ ID NO:123的位置147处的突变和位置411处的突变,例如,包含SEQ ID NO:123的位置147处的酪氨酸和SEQ ID NO:123的位置411处的苏氨酸(即,包含具有D147Y突变和P411T突变的SEQ ID NO:123,或由其组成)。不受理论束缚,据信此类突变改善了Cas9分子例如在酵母中的靶向效率。
在实施例中,Cas9分子是SEQ ID NO:123的酿脓链球菌Cas9变体,其包含一个或多个突变。在实施例中,Cas9变体包含在SEQ ID NO:123的位置1135处的突变,例如,包含SEQID NO:123的位置1135处的谷氨酸(即,包含具有D1135E突变的SEQ ID NO:123,或由其组成)。不受理论束缚,据信此类突变改善了Cas9分子对NGG PAM序列相对于NAG PAM序列的选择性。
在实施例中,Cas9分子是SEQ ID NO:123的酿脓链球菌Cas9变体,其包含一个或多个突变,这些突变在某些位置引入不带电荷或非极性氨基酸(例如丙氨酸)。在实施例中,Cas9分子是SEQ ID NO:123的酿脓链球菌Cas9变体,其包含在SEQ ID NO:123的位置497处的突变、位置661处的突变、位置695处的突变和/或位置926处的突变,例如在SEQ ID NO:123的位置497、位置661、位置695和/或位置926处突变为丙氨酸。在实施例中,Cas9分子仅在SEQ ID NO:123的位置497、位置661、位置695和位置926处相对于SEQ ID NO:123具有突变,例如,其中每个突变是突变为不带电荷的氨基酸,例如丙氨酸。不受理论束缚,据信此类突变减少了Cas9分子在脱靶位点的切割。
应当理解,本文所述的对于Cas9分子而言的突变可以组合,并且可以与本文所述的任何融合或其他修饰组合,并且可以在本文所述的任何测定中测试Cas9分子。
各种类型的Cas分子可用于本文。在一些实施例中,使用II型Cas系统的Cas分子。在其他实施例中,使用其他Cas系统的Cas分子。例如,可以使用I型或III型Cas分子。示例性Cas分子(和Cas系统)例如描述于Haft等人,PLoS COMPUTATIONAL BIOLOGY[科学公共图书馆计算生物学]2005,1(6):e60以及Makarova等人,NATURE REVIEW MICROBIOLOGY[自然微生物学评论]2011,9:467-477中,将这两篇参考文献的内容通过引用以其全文并入本文。
在一个实施例中,本文披露的方法中使用的Cas或Cas9分子包含一种或多种以下活性:切口酶活性;双链切割活性(例如,内切核酸酶和/或外切核酸酶活性);解旋酶活性;或与gRNA分子一起定位至靶核酸的能力。
在一些实施例中,Cas9分子(例如,酿脓链球菌的Cas9)可以另外包含一个或多个赋予额外活性的氨基酸序列。在一些方面,Cas9分子可以包含一个或多个核定位序列(NLS),如至少1、2、3、4、5、6、7、8、9、10个或更多个NLS。通常,NLS由暴露于蛋白质表面上的带正电荷的赖氨酸或精氨酸的一个或多个短序列组成,但其他类型的NLS是已知的。NLS的非限制性实例包括NLS序列,所述NLS序列包含或衍生自:SV40病毒大T抗原的NLS,其具有氨基酸序列PKKKRKV(SEQ ID NO:8)。其他合适的NLS序列在本领域中是已知的(例如,Sorokin,Biochemistry[生物化学](莫斯科)(2007)72:13,1439-1457;Lange J BiolChem.[生物化学杂志](2007)282:8,5101-5)。在任何上述实施例中,Cas9分子可以另外(或可替代地)包含标签,例如His标签,例如His(6)标签(His His His His His His,SEQ IDNO:121)或His(8)标签(His His His His His His His His,SEQ ID NO:122),例如在N末端或C末端。
在具体的方面,本文提供了通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达的修饰的人细胞,例如LSC或CEC,其中修饰的细胞已被转导以表达适合用于基因编辑的Cas9。在特定的方面,本文提供了通过CRISPR系统具有降低或消除的B2M表达的修饰的人细胞,例如LSC或CEC,其中修饰的细胞表达适合用于基因编辑的Cas9。
在一些实施例中,Cas9分子包含与以下具有至少约60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性的氨基序列;当与以下相比时,相差不超过1%、2%、5%、10%、15%、20%、30%或40%的氨基酸残基的氨基酸序列;与以下相差至少1、2、5、10或20个氨基酸但相差不超过100、80、70、60、50、40或30个氨基酸的氨基酸序列;或与以下相同:本文提供的Cas9序列,例如,SEQ ID NO:123、SEQ ID NO:106、SEQ ID NO:107、SEQ ID NO:124、SEQ ID NO:125、SEQ ID NO:126、SEQ ID NO:127、SEQ ID NO:128、SEQ IDNO:129、SEQ ID NO:130、SEQ ID NO:131、SEQ ID NO:132、或SEQ ID NO:133。在具体的实施例中,Cas9分子包含选自以下的氨基序列:SEQ ID NO:123、SEQ ID NO:106、SEQ ID NO:107、SEQ ID NO:124、SEQ ID NO:125、SEQ ID NO:126、SEQ ID NO:127、SEQ ID NO:128、SEQID NO:129、SEQ ID NO:130、SEQ ID NO:131、SEQ ID NO:132、和SEQ ID NO:133。
在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有iProt 20109496(SEQ ID NO:106)的序列:
MAPKKKRKVDKKYSIGLDIGTNSVGWAVITDEYKVPSKKFKVLGNTDRHSIKKNLIGALLFDSGETAEATRLKRTARRRYTRRKNRILYLQEIFSNEMAKVDDSFFHRLEESFLVEEDKKHERHPIFGNIVDEVAYHEKYPTIYHLRKKLVDSTDKADLRLIYLALAHMIKFRGHFLIEGDLNPDNSDVDKLFIQLVQTYNQLFEENPINASGVDAKAILSARLSKSRRLENLIAQLPGEKKNGLFGNLIALSLGLTPNFKSNFDLAEDAKLQLSKDTYDDDLDNLLAQIGDQYADLFLAAKNLSDAILLSDILRVNTEITKAPLSASMIKRYDEHHQDLTLLKALVRQQLPEKYKEIFFDQSKNGYAGYIDGGASQEEFYKFIKPILEKMDGTEELLVKLNREDLLRKQRTFDNGSIPHQIHLGELHAILRRQEDFYPFLKDNREKIEKILTFRIPYYVGPLARGNSRFAWMTRKSEETITPWNFEEVVDKGASAQSFIERMTNFDKNLPNEKVLPKHSLLYEYFTVYNELTKVKYVTEGMRKPAFLSGEQKKAIVDLLFKTNRKVTVKQLKEDYFKKIEEFDSVEISGVEDRFNASLGTYHDLLKIIKDKDFLDNEENEDILEDIVLTLTLFEDREMIEERLKTYAHLFDDKVMKQLKRRRYTGWGRLSRKLINGIRDKQSGKTILDFLKSDGFANRNFMQLIHDDSLTFKEDIQKAQVSGQGDSLHEHIANLAGSPAIKKGILQTVKVVDELVKVMGRHKPENIVIEMARENQTTQKGQKNSRERMKRIEEGIKELGSQILKEHPVENTQLQNEKLYLYYLQNGRDMYVDQELDINRLSDYDVDHIVPQSFLKDDSIDNKVLTRSDKNRGKSDNVPSEEVVKKMKNYWRQLLNAKLITQRKFDNLTKAERGGLSELDKAGFIKRQLVETRQITKHVAQILDSRMNTKYDENDKLIREVKVITLKSKLVSDFRKDFQFYKVREINNYHHAHDAYLNAVVGTALIKKYPKLESEFVYGDYKVYDVRKMIAKSEQEIGKATAKYFFYSNIMNFFKTEITLANGEIRKRPLIETNGETGEIVWDKGRDFATVRKVLSMPQVNIVKKTEVQTGGFSKESILPKRNSDKLIARKKDWDPKKYGGFDSPTVAYSVLVVAKVEKGKSKKLKSVKELLGITIMERSSFEKNPIDFLEAKGYKEVKKDLIIKLPKYSLFELENGRKRMLASAGELQKGNELALPSKYVNFLYLASHYEKLKGSPEDNEQKQLFVEQHKHYLDEIIEQISEFSKRVILADANLDKVLSAYNKHRDKPIREQAENIIHLFTLTNLGAPAAFKYFDTTIDRKRYTSTKEVLDATLIHQSITGLYETRIDLSQLGGDSRADHHHHHH
在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有如本文实例中所示的SEQ ID NO:107的序列。在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有iProt105026(也称为iProt106154、iProt106331、iProt106545和PID426303,这取决于蛋白质的制备)(SEQ ID NO:107)的序列:
在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有iProt106518(SEQ ID NO:124)的序列:
在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有iProt106519(SEQ ID NO:125)的序列:
在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有iProt106520(SEQ ID NO:126)的序列:
在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有iProt106521(SEQ ID NO:127)的序列:
在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有iProt106522(SEQ ID NO:128)的序列:
在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有iProt106658(SEQ ID NO:129)的序列:
在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有iProt106745(SEQ ID NO:130)的序列:
在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有iProt106746(SEQ ID NO:131)的序列:
在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有iProt106747(SEQ ID NO:132)的序列:
在某些实施例中,用于本发明的方法或组合物中的Cas9蛋白具有iProt106884(SEQ ID NO:133)的序列:
在优选的实施例中,用于本发明的CRISPR系统包含Cas9分子,其包含SEQ ID NO:106或107。
因此,例如用于真核细胞中的基因编辑的工程化的CRISPR基因编辑系统典型地涉及(1)包含靶向结构域(其能够与基因组DNA靶序列杂交)和能够结合至Cas(例如,Cas9酶)的序列的指导RNA分子(gRNA),以及(2)Cas(例如Cas9)蛋白。能够结合Cas蛋白的序列可以包含称为tracr结构域或tracrRNA的结构域。靶向结构域和能够结合至Cas(例如Cas9酶)的序列可以置于同一分子上(有时称为单个gRNA、嵌合gRNA或sgRNA)或不同的分子上(有时称为双重gRNA或dgRNA)。如果置于不同的分子上,则每个分子包含允许这些分子例如通过杂交缔合的杂交结构域。
术语“指导RNA”、“指导RNA分子”、“gRNA分子”或“gRNA”可互换使用,并且是指促进将RNA指导的核酸酶或其他效应分子(通常与gRNA分子复合)特异性指导到靶序列上的一组核酸分子。在一些实施例中,通过将gRNA的部分与DNA杂交(例如通过gRNA靶向结构域)以及通过将gRNA分子的部分与RNA指导的核酸酶或其他效应分子结合(例如,至少通过gRNAtracr)来实现所述指导。在实施例中,gRNA分子由单个连续的多核苷酸分子组成,在本文中称为“单指导RNA”或“sgRNA”等。在其他实施例中,gRNA分子由多个,通常是两个多核苷酸分子组成,这些多核苷酸分子本身能够缔合,通常通过杂交,在本文中称为“双指导RNA”或“dgRNA”等。gRNA分子在下面更详细地描述,但通常包含靶向结构域和tracr。在实施例中,靶向结构域和tracr被布置于单个多核苷酸上。在其他实施例中,靶向结构域和tracr被布置于分开的多核苷酸上。
术语“靶向结构域”(当所述术语与gRNA结合使用时)是gRNA分子的部分,其识别靶序列(例如细胞核酸内的靶序列,例如在基因内),例如与其互补。
术语“crRNA”(当所述术语与gRNA分子结合使用时)是gRNA分子的部分,其包含靶向结构域和与tracr相互作用以形成标志杆区域的区域。
如在本文中与gRNA分子结合使用的术语“标志杆(flagpole)”是指gRNA的部分,其中crRNA和tracr彼此结合或杂交。
如在本文中与gRNA分子结合使用的术语“tracr”是指gRNA的与核酸酶或其他效应分子结合的部分。在实施例中,tracr包含与Cas9特异性结合的核酸序列。在实施例中,tracr包含形成标志杆的部分的核酸序列。
术语“靶序列”是指与gRNA靶向结构域互补,例如完全互补的核酸序列。在实施例中,靶序列被布置于基因组DNA上。在一个实施例中,靶序列与由具有核酸酶或其他效应子活性的蛋白质识别的前间区邻近基序(PAM)序列(例如由Cas9识别的PAM序列)相邻(在DNA的相同链上或在DNA的互补链上)。靶序列在本文中是指β-2-微球蛋白或B2M的靶序列。
如与核酸结合使用的术语“互补”是指碱基A与T或U和G与C的配对。术语互补是指完全互补的核酸分子,即整个参考序列中的形式A与T或U对和G与C对,以及至少80%、85%、90%、95%、99%互补的分子。
“β-2-微球蛋白”或“B2M”,也称为IMD43,是MHC I类分子的组分。B2M是一种血清蛋白,发现其与几乎所有有核细胞表面上的主要组织相容性复合物(MHC)I类重链相关。所述蛋白质主要具有β折叠的片状结构,在某些病理条件下可形成淀粉样蛋白原纤维。编码的抗微生物蛋白在羊水中显示抗细菌活性。已经表明所述基因的突变导致高分解代谢性低蛋白血症(NCBI:基因ID:567)。
术语“B2M基因中的靶序列”或“B2M基因中的靶多核苷酸序列”是指B2M多核苷酸序列内的连续序列(NCBI:基因ID:567)。B2M多核苷酸序列编码B2M蛋白,这是一种与几乎所有有核细胞表面上的主要组织相容性复合物(MHC)I类重链相关的血清蛋白。B2M基因有4个外显子,跨度约为8kb。
在一些实施例中,所述靶多核苷酸序列是B2M的变体。在一些实施例中,所述靶多核苷酸序列是B2M的同源物。在一些实施例中,所述靶多核苷酸序列是B2M的直向同源物。
术语“B2M的基因组DNA”是指B2M多核苷酸序列(NCBI:基因ID:567)。
gRNA分子形式是本领域中已知的。如本文所披露的示例性gRNA分子(例如dgRNA分子)包含以下,例如由以下组成:具有以下序列的第一核酸:
5’nnnnnnnnnnnnnnnnnnnnGUUUUAGAGCUAUGCUGUUUUG 3’(SEQ ID NO:9),
其中“n”是指靶向结构域(例如如本文描述)的残基,并且可以由15-25个核苷酸组成,例如由20个核苷酸组成;
和具有以下示例性序列的第二核酸序列:
5’AACUUACCAAGGAACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC 3’,任选地在3’末端具有1、2、3、4、5、6或7(例如4或7,例如7)个另外的U核苷酸(SEQ ID NO:10)。
第二核酸分子可以可替代地由上述序列的片段组成,其中这种片段能够与所述第一核酸杂交。这种第二核酸分子的一个实例是:
5’AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC3’,任选地在3’末端具有1、2、3、4、5、6或7(例如4或7,例如7)个另外的U核苷酸(SEQ ID NO:11)。
如本文所披露的另一种示例性gRNA分子(例如sgRNA分子)包含以下,例如由以下组成:具有以下序列的第一核酸:
5’nnnnnnnnnnnnnnnnnnnGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC 3’(SEQ ID NO:12),其中“n”是指靶向结构域(例如如本文描述)的残基,并且可以由15-25个核苷酸组成,例如由20个核苷酸组成,任选地在3’末端具有1、2、3、4、5、6、或7个(例如,4或7个,例如4个)另外的U核苷酸。
本领域中已知的CRISPR基因编辑系统的另外组分和/或元件例如描述于美国公开号2014/0068797、WO2015/048577和Cong(2013)Science[科学]339:819-823中,这些文献的内容特此通过引用以其全文并入。可以产生例如通过工程化CRISPR基因编辑系统以包含gRNA分子来抑制靶基因的此类系统,所述gRNA分子包含与所述靶基因的序列杂交的靶向结构域。在实施例中,所述gRNA包含靶向结构域,所述靶向结构域与靶基因的15-25个核苷酸(例如,20个核苷酸)完全互补。在实施例中,所述靶基因的15-25个核苷酸(例如,20个核苷酸)紧邻由CRISPR基因编辑系统的RNA引导的核酸酶(例如Cas蛋白)识别的前间区邻近基序(PAM)序列的5'布置(例如,当所述系统包含酿脓链球菌Cas9蛋白时,所述PAM序列包含NGG,其中N可以是A、T、G或C中的任一者)。
在一些实施例中,可以将gRNA分子和CRISPR基因编辑系统的RNA指导的核酸酶(例如,Cas蛋白)复合以形成RNP(核糖核蛋白)复合物。可以将这样的RNP复合物用于本文所述的方法。在其他实施例中,可以将编码CRISPR基因编辑系统的一个或多个组分的核酸用于本文所述的方法。
在一些实施例中,可以将外源DNA连同CRISPR基因编辑系统一起引入细胞,例如,编码所需转基因的DNA,所述DNA具有或不具有在靶细胞类型中有活性的启动子的。取决于外来DNA的序列和基因组的靶序列,这一过程可以用于在由CRISPR基因编辑系统靶向的位点处或附近将外来DNA整合到基因组中。例如,在转基因侧翼的3'和5'序列可以包含于外来DNA中,这些3'和5'序列与通过基因编辑系统切割的基因组中的位点的(分别)3'和5'的基因序列同源。这种外来DNA分子可以被称为“模板DNA”。
在一个实施例中,本发明的CRISPR基因编辑系统包含Cas9(例如,酿脓链球菌Cas9)和包含与目的基因的序列杂交的靶向结构域的gRNA。在一个实施例中,所述gRNA和Cas9复合以形成RNP(核糖核蛋白)。在一个实施例中,CRISPR基因编辑系统包含编码gRNA的核酸和编码Cas蛋白(例如Cas9,例如酿脓链球菌Cas9)的核酸。在一个实施例中,CRISPR基因编辑系统包含gRNA和编码Cas蛋白(例如Cas9,例如酿脓链球菌Cas9)的核酸。
在一些实施例中,可以利用对Cas9、sgRNA表达的诱导性控制来优化效率,同时降低脱靶效应的频率,从而提高安全性。实例包括但不限于如下所列的转录和转录后开关;强力霉素诱导的转录Loew等人(2010)BMC Biotechnol.[BMC生物科技]10:81,Shield1诱导的蛋白质稳定作用Banaszynski等人(2016)Cell[细胞]126:995-1004,他莫昔芬诱导蛋白质激活Davis等人(2015)Nat.Chem.Biol.[自然化学生物学]11:316-318,雷帕霉素或光遗传诱导的分裂Cas9的活化或二聚化Zetsche(2015)Nature Biotechnol.[自然生物技术]33(2):139-142,Nihongaki等人(2015)Nature Biotechnol.[自然生物技术]33(7):755-760,Polstein和Gersbach(2015)Nat.Chem.Biol.[自然化学生物学]11:198-200,和SMASh标签药物诱导的降解Chung等人(2015)Nat.Chem.Biol.[自然化学生物学]11:713-720。
通常,CRISPR-Cas或CRISPR系统统指涉及CRISPR相关(“Cas”)基因的表达或指导其活性的转录物和其他元件,包括编码Cas基因的序列、tracr(反式激活CRISPR)序列(例如tracrRNA或活性部分tracrRNA)、tracr-配对序列(在内源CRISPR系统的上下文中包含“直接重复”和tracrRNA处理的部分直接重复)、指导序列(在内源CRISPR系统的上下文中也称为“间隔子”)、或一种或多种如本文中使用的术语“RNA”(例如,用于指导Cas9的一种或多种RNA,例如CRISPR RNA和反式激活(tracr)RNA或单指导RNA(sgRNA)(嵌合RNA))或来自CRISPR基因座的其他序列和转录物。总的来说,CRISPR系统特征在于在靶序列的位点处促进CRISPR复合物形成的元件(也称之为内源性CRISPR系统情况下的原型间隔区)。在形成CRISPR复合物的情况下,“靶序列”是指指导序列被设计为与其具有互补性的序列,其中靶序列与指导序列之间的杂交促进CRISPR复合物的形成。靶序列可以包含任何多核苷酸,例如DNA或RNA多核苷酸。在一些实施例中,靶序列位于细胞核或细胞质中。在一些实施例中,在CRISPR复合物中优选的是:tracr序列具有一个或多个发夹并且具有30个或更多个核苷酸的长度,40或更多个核苷酸的长度,或50个或更多个核苷酸的长度;指导序列的长度在10到30个核苷酸之间,CRISPR/Cas酶是II型Cas9酶。在本发明的实施例中,术语指导序列和指导RNA(“gRNA”)可互换使用。总的来说,指导序列是与靶多核苷酸序列具有足够互补性以与靶序列杂交并指导CRISPR复合物与靶序列的序列特异性结合的任何多核苷酸序列。在一些实施例中,当使用适合比对算法进行最佳比对时,指导序列与其相应靶序列之间的互补程度是约或超过约50%、60%、75%、80%、85%、90%、95%、97.5%、99%、或更大。最佳比对可以通过使用用于比对序列的任何适合的算法来确定,这些算法的非限制性实例包括史密斯-沃特曼(Smith-Waterman)算法、尼德曼-温施算法(Needleman-Wunsch algorithm)、基于巴罗斯-惠勒(Burrows-Wheeler)转换的算法(例如,巴罗斯-惠勒比对仪)、ClustalW、Clustal X、BLAT、诺沃比对(Novoalign)(诺沃克拉夫特技术公司(NovocraftTechnologies));ELAND(依诺米那公司(Illumina),圣地亚哥,加利福尼亚州),和SOAP。在一些实施例中,指导序列的长度是约或超过约5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、75、或更多个核苷酸。在一些实施例中,指导序列的长度是小于约75、50、45、40、35、30、25、20、15、12、或更少个核苷酸。优选指导序列是10-30个核苷酸长。指导序列指导CRISPR复合物与靶序列的序列特异性结合的能力可以通过任何合适的测定法来评估。例如,足以形成CRISPR复合物的CRISPR系统的组分(包括有待测试的指导序列)可以诸如通过用编码CRISPR序列组分的载体进行转染来提供给具有相应靶序列的宿主细胞,随后诸如通过Surveyor测定评估靶序列内的优先切割。类似地,靶多核苷酸序列的切割可以在试管中通过以下方式进行评估:通过提供靶序列、CRISPR复合物的组分(包括有待测试的指导序列)和不同于测试指导序列的对照指导序列并且在测试指导序列反应与对照指导序列反应之间比较靶序列处的结合或切割速率。其他测定是可能的,并且是本领域技术人员能够想到的。指导序列可以被选择为靶向任何靶序列。在一些实施例中,靶序列是细胞基因组中的序列。示例性靶序列包括靶基因组中独特的那些。例如,对于酿脓链球菌Cas9,基因组中的独特靶序列可以包括MM M MMMNNNNNNNNNNNNXGG(SEQ IDNO:13)形式的Cas9靶位点,其中NNN NNN NN XGG(SEQ ID NO:179)(N是A、G、T、或C;并且X可以是任何)在基因组中只出现一次。基因组中独特靶序列可以包括形式MMMMMMMMNNNNNNNNNNNXGG(SEQID NO:14)的酿脓链球菌Cas9靶位点,其中N N N N XGG(N是A、G、T、或C;且X可以是任何)在基因组中只出现一次。对于嗜热链球菌CRISPRl Cas9,基因组中的独特靶序列可以包括形式MMMMMMMMNN N N NN XXAGAAW(SEQ ID NO:15)的Cas9靶位点,其中NNN NN N XXAGAAW(SEQ ID NO:180)(N是A、G、T、或C;且X可以是任何;且W是A或T)在基因组中只出现一次。基因组中的独特靶序列可以包括形式MMMMMM MN N NNNNNXXAGAAW(SEQ ID NO:16)的嗜热链球菌CRISPRl Cas9靶位点,其中NNNNNNNNNNNXXAGAAW(SEQ ID NO:181)(N是A、G、T、或C;且X可以是任何;且W是A或T)在基因组中只出现一次。对于酿脓链球菌Cas9,基因组中的独特靶序列可以包括形式MMMMMMMMNNNN NNNNNNXGGXG(SEQID NO:17)的Cas9靶位点,其中NNNNNNNNNNNNXGGXG(SEQ ID NO:182)(N是A、G、T、或C;且X可以是任何)在基因组中只出现一次。基因组中的独特靶序列可以包括形式MMMMMMMMMNNNNNNNNNNNXGGXG(SEQ ID NO:183)的酿脓链球菌Cas9靶位点,其中NNNNNNNNNNNXGGXG(SEQ ID NO:18),(N是A、G、T、或C;且X可以是任何)在基因组中只出现一次。在这些序列的每一个中,N是任何核碱基,并且“M”可以是A、G、T或C并且在将序列鉴定为独特序列时无需考虑。在一些实施例中,选择指导序列以减少指导序列内的二级结构的程度。在一些实施例中,当进行最佳折叠时,指导序列的约或小于约75%、50%、40%、30%、25%、20%、15%、10%、5%、1%,或更少的核苷酸参与自互补碱基配对。最佳折叠可以是通过任何适合的多核苷酸折叠算法来确定。一些程序是基于计算最小吉布斯自由能。一种这样的算法的实例是mFold,如通过Zuker和Stiegler(Nucleic Acids Res.[核酸研究]9(1981),133-148)所描述。另一个示例性折叠算法是使用质心结构预测算法的在线网站服务器RNAfold,它是维也纳大学的理论化学研究所(Institute for TheoreticalChemistry at the University of Vienna)开发的(例如,参见A.R.Gruber等人,2008,Cell[细胞]106(1):23-24;以及PA Carr和GM Church,2009,Nature Biotechnology[自然生物技术]27(12):1 151-62)。
提供了选择、设计和验证用于在本文所述gRNA中使用的靶向结构域的方法。本文还提供了用于掺入gRNA的示例性靶向结构域。
已经描述了用于选择和验证靶序列以及脱靶分析的方法(参见,例如,Mali 2013;Hsu 2013;Fu 2014;Heigwer 2014;Bae 2014;和Xiao 2014)。例如,可以通过鉴定针对Cas9分子的PAM序列(例如相关的PAM,例如酿脓链球菌的NGG PAM,脑膜炎奈瑟氏菌的NNNNGATT(SEQ ID NO:19)或NNNNGCTT PAM(SEQ ID NO:20),以及金黄色葡萄球菌的NNGRRT(SEQ IDNO:21)或NNGRRV PAM(SEQ ID NO:22)),并将相邻序列鉴定为使用所述Cas9分子的CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)的靶序列来选择靶序列。软件工具可用于进一步优化与用户的靶序列相对应的潜在靶向结构域的选择,例如以最小化整个基因组中的总脱靶活性。候选靶向结构域和包含那些靶向结构域的gRNA可以通过使用本领域已知的和/或本文所述的方法进行功能评估。
作为非限制性实例,使用DNA序列搜索算法鉴定用于与酿脓链球菌、脑膜炎奈瑟氏菌和金黄色葡萄球菌的Cas9一起使用的gRNA中使用的靶向结构域。针对每个Cas9设计17-mer、18-mer、19-mer、20-mer、21-mer、22-mer、23-mer和/或24-mer靶向结构域。关于酿脓链球菌Cas9,优选地,靶向结构域是20-mer。使用基于公共工具cas-offinder(Bae 2014)的定制gRNA设计软件进行gRNA设计。所述软件可在计算指导RNA的全基因组脱靶倾向后对指导RNA进行评分。
下表(即表1,表4)提供了用于gRNA分子的靶向结构域,用于在本发明的组合物和方法中改变B2M基因的表达或改变B2M基因。
在特定实施例中,本文所述的细胞(例如LSC和CEC),通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达,所述CRISPR系统包含选自表1或表2或表4或表6中所述的gRNA。靶向B2M基因的CRISPR和gRNA分子的用途还描述于例如Mandal等人2014,Cell Stem Cell[干细胞],15:643-652;国际专利申请公开号WO16073955、WO17093969、WO16011080、WO16183041、WO17106537、WO 2017143210、WO 2017212072、和WO2018064594。
表1:示例性的同种异体眼细胞靶标的gRNA靶向结构域
在特定实施例中,本文所述的修饰的细胞(例如LSC或CEC)通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达,所述CRISPR系统包含选自实例中表1或表4或表6中所述的gRNA,其中此类修饰的细胞包含外显子1内B2M的基因编辑。
在特定实施例中,本文所述的修饰的细胞(例如LSC或CEC)通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达,所述CRISPR系统包含选自表1或表4或表6中所述的gRNA,其中此类修饰的细胞包含外显子2内B2M的基因编辑。
在特定实施例中,本文所述的修饰的细胞(例如LSC或CEC)通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达,所述CRISPR系统包含选自表1或表4或表6中所述的gRNA,其中此类修饰的细胞包含外显子3内B2M的基因编辑。
在特定实施例中,本文所述的修饰的细胞(例如LSC或CEC)通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达,所述CRISPR系统包含选自表1或表4或表6中所述的gRNA,其中此类修饰的细胞包含外显子4内B2M的基因编辑。
在特定实施例中,本文所述的修饰的细胞(例如LSC或CEC)通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达,所述CRISPR系统包含选自表1或表4中所述的gRNA,其中此类修饰的细胞包含选自表1或表4中所述的基因组位置(例如,chr15:44711469-44711494)内的B2M的基因编辑。在一些实施例中,用于本发明的gRNA分子的靶向结构域与选自以下的基因组区域内的序列互补:chr15:44711469-44711494、chr15:44711472-44711497、chr15:44711483-44711508、chr15:44711486-44711511、chr15:44711487-44711512、chr15:44711512-44711537、chr15:44711513-44711538、chr15:44711534-4471 1559、chr15:44711568-44711593、chr15:44711573-44711598、chr15:44711576-44711601、chr15:44711466-44711491、chr15:44711522-44711547、chr15:44711544-44711569、chr15:44711559-44711584、chr15:44711565-44711590、chr15:44711599-44711624、chr15:44711611-44711636、chr15:44715412-44715437、chr15:44715440-44715465、chr15:44715473-44715498、chr15:44715474-44715499、chr15:44715515-44715540、chr15:44715535-44715560、chr15:44715562-44715587、chr15:44715567-44715592、chr15:44715672-44715697、chr15:44715673-44715698、chr15:44715674-44715699、chr15:44715410-44715435、chr15:44715411-44715436、chr15:44715419-44715444、chr15:44715430-44715455、chr15:44715457-44715482、chr15:44715483-44715508、chr15:44715511-44715536、chr15:44715515-44715540、chr15:44715629-44715654、chr15:44715630-44715655、chr15:44715631-44715656、chr15:44715632-44715657、chr15:44715653-44715678、chr15:44715657-44715682、chr15:44715666-44715691、chr15:44715685-44715710、chr15:44715686-44715711、chr15:44716326-44716351、chr15:44716329-44716354、chr15:44716313-44716338、chr15:44717599-44717624、chr15:44717604-44717629、chr15:44717681-44717706、chr15:44717682-44717707、chr15:44717702-44717727、chr15:44717764-44717789、chr15:44717776-44717801、chr15:44717786-44717811、chr15:44717789-44717814、chr15:44717790-44717815、chr15:44717794-44717819、chr15:44717805-44717830、chr15:44717808-44717833、chr15:44717809-44717834、chr15:44717810-44717835、chr15:44717846-44717871、chr15:44717945-44717970、chr15:44717946-44717971、chr15:44717947-44717972、chr15:44717948-44717973、chr15:44717973-44717998、chr15:44717981-44718006、chr15:44718056-44718081、chr15:44718061-44718086、chr15:44718067-44718092、chr15:44718076-44718101、chr15:44717589-44717614、chr15:44717620-44717645、chr15:44717642-44717667、chr15:44717771-44717796、chr15:44717800-44717825、chr15:44717859-44717884、chr15:44717947-44717972、chr15:44718119-44718144、chr15:44711563-44711585、chr15:44715428-44715450、chr15:44715509-44715531、chr15:44715513-44715535、chr15:44715417-44715439、chr15:44711540-44711562、chr15:44711574-44711596、chr15:44711597-44711619、chr15:44715446-44715468、chr15:44715651-44715673、chr15:44713812-44713834、chr15:44711579-44711601、chr15:44711542-44711564、chr15:44711557-44711579、chr15:44711609-44711631、chr15:44715678-44715700、chr15:44715683-44715705、chr15:44715684-44715706、chr15:44715480-44715502。在一个具体的实施例中,所述gRNA分子的靶向结构域与选自以下的基因组区域内的序列互补:chr15:44715513-44715535、chr15:44711542-44711564、chr15:44711563-44711585、chr15:44715683-44715705、chr15:44711597-44711619、或chr15:44715446-44715468。在一个实施例中,所述gRNA分子的靶向结构域与基因组区域chr15:44711597-44711619内的序列互补。在另一个实施例中,所述gRNA分子的靶向结构域与基因组区域chr15:44715446-44715468内的序列互补。在一个优选的实施例中,所述gRNA分子的靶向结构域与基因组区域chr15:44711563-44711585内的序列互补。
在具体的实施例中,本文所述的修饰的细胞(例如LSC或CEC)通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达,所述CRISPR系统包含选自表1或表4中所述的gRNA靶向结构域序列。在一个实施例中,针对B2M的该gRNA分子的靶向结构域包含以下靶向结构域,所述靶向结构域包含SEQ ID NO:23-105或108-119或134-140中任一项的序列。在一个具体的实施例中,针对B2M的所述gRNA分子的靶向结构域包含以下靶向结构域,所述靶向结构域包含SEQ ID NO:108、111、115、116、134或138中任一项的序列。在一个优选的实施例中,针对B2M的所述gRNA分子的靶向结构域包含以下靶向结构域,所述靶向结构域包含SEQ ID NO:108的序列。在另一个实施例中,针对B2M的所述gRNA分子的靶向结构域包含以下靶向结构域,所述靶向结构域包含SEQ ID NO:115的序列。在另一个实施例中,针对B2M的所述gRNA分子的靶向结构域包含以下靶向结构域,所述靶向结构域包含SEQID NO:116的序列。
在一些实施例中,本文所述的修饰的细胞(例如LSC或CEC)通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达,所述CRISPR系统包含靶向与选自表5中所述的任何序列互补的序列的gRNA。在一些实施例中,本文所述的修饰的细胞(例如LSC或CEC)通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达,所述CRISPR系统包含靶向与选自SEQ ID NO:141至159的任何序列互补的序列的gRNA。
在具体实施例中,本文所述的修饰的细胞(例如LSC或CEC)通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达,所述CRISPR系统包含gRNA,其中所述gRNA包含SEQ ID NO:120、160-177中任一项的序列。在具体实施例中,本文所述的修饰的细胞(例如LSC或CEC)通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达,所述CRISPR系统包含gRNA,其中所述gRNA包含SEQ ID NO:120、162、166、167、171、和175中任一项的序列。在一个优选的实施例中,所述gRNA包含SEQ ID NO:120的序列。在另一个实施例中,所述gRNA包含SEQ ID NO:166或167的序列。
在具体的实施例中,本文所述的修饰的细胞(例如LSC或CEC)通过CRISPR系统(例如,酿脓链球菌Cas9 CRISPR系统)具有降低或消除的B2M表达,所述CRISPR系统包含gRNA,所述gRNA包含相对于表1或表4或表6中所述的gRNA序列的一个、两个、三个、四个、五个、六个、七个或八个核苷酸修饰(例如,添加、取代或缺失)。
在一个方面,本发明涉及一种修饰的LSC或CEC,其包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以缺失基因组DNA的包含SEQ ID NO:141至159中任一个序列的连续延伸段,从而消除细胞中MHC I类分子的表面表达。在一个实施例中,本发明的修饰的LSC或CEC包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以缺失基因组DNA的包含SEQ ID NO:141、144、148、149、153或157中任一个序列的连续延伸段,从而消除细胞中MHC I类分子的表面表达。在一个更具体的实施例中,本发明的修饰的LSC或CEC包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以缺失基因组DNA的包含SEQ ID NO:141、148、或149中任一个序列的连续延伸段,从而消除细胞中MHC I类分子的表面表达。在一个优选的实施例中,修饰的LSC或CEC包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以缺失基因组DNA的包含SEQ ID NO:141的序列的连续延伸段,从而消除细胞中MHC I类分子的表面表达。
在一个方面,本发明涉及一种修饰的LSC或CEC,其包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以缺失选自以下任一个序列的基因组DNA区域的连续延伸段:chr15:44711469-44711494、chr15:44711472-44711497、chr15:44711483-44711508、chr15:44711486-44711511、chr15:44711487-44711512、chr15:44711512-44711537、chr15:44711513-44711538、chr15:44711534-44711559、chr15:44711568-44711593、chr15:44711573-44711598、chr15:44711576-44711601、chr15:44711466-44711491、chr15:44711522-44711547、chr15:44711544-44711569、chr15:44711559-44711584、chr15:44711565-44711590、chr15:44711599-44711624、chr15:44711611-44711636、chr15:44715412-44715437、chr15:44715440-44715465、chr15:44715473-44715498、chr15:44715474-44715499、chr15:44715515-44715540、chr15:44715535-44715560、chr15:44715562-44715587、chr15:44715567-44715592、chr15:44715672-44715697、chr15:44715673-44715698、chr15:44715674-44715699、chr15:44715410-44715435、chr15:44715411-44715436、chr15:44715419-44715444、chr15:44715430-44715455、chr15:44715457-44715482、chr15:44715483-44715508、chr15:44715511-44715536、chr15:44715515-44715540、chr15:44715629-44715654、chr15:44715630-44715655、chr15:44715631-44715656、chr15:44715632-44715657、chr15:44715653-44715678、chr15:44715657-44715682、chr15:44715666-44715691、chr15:44715685-44715710、chr15:44715686-44715711、chr15:44716326-44716351、chr15:44716329-44716354、chr15:44716313-44716338、chr15:44717599-44717624、chr15:44717604-44717629、chr15:44717681-44717706、chr15:44717682-44717707、chr15:44717702-44717727、chr15:44717764-44717789、chr15:44717776-44717801、chr15:44717786-44717811、chr15:44717789-44717814、chr15:44717790-44717815、chr15:44717794-44717819、chr15:44717805-44717830、chr15:44717808-44717833、chr15:44717809-44717834、chr15:44717810-44717835、chr15:44717846-44717871、chr15:44717945-44717970、chr15:44717946-44717971、chr15:44717947-44717972、chr15:44717948-44717973、chr15:44717973-44717998、chr15:44717981-44718006、chr15:44718056-44718081、chr15:44718061-44718086、chr15:44718067-44718092、chr15:44718076-44718101、chr15:44717589-44717614、chr15:44717620-44717645、chr15:44717642-44717667、chr15:44717771-44717796、chr15:44717800-44717825、chr15:44717859-44717884、chr15:44717947-44717972、chr15:44718119-44718144、chr15:44711563-44711585、chr15:44715428-44715450、chr15:44715509-44715531、chr15:44715513-44715535、chr15:44715417-44715439、chr15:44711540-44711562、chr15:44711574-44711596、chr15:44711597-44711619、chr15:44715446-44715468、chr15:44715651-44715673、chr15:44713812-44713834、chr15:44711579-44711601、chr15:44711542-44711564、chr15:44711557-44711579、chr15:44711609-44711631、chr15:44715678-44715700、chr15:44715683-44715705、chr15:44715684-44715706、chr15:44715480-44715502,从而消除细胞中MHC I类分子的表面表达。在一个实施例中,本发明的修饰的LSC或CEC包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以缺失选自以下的基因组DNA区域的连续延伸段:chr15:44715513-44715535、chr15:44711542-44711564、chr15:44711563-44711585、chr15:44715683-44715705、chr15:44711597-44711619、或chr15:44715446-44715468。在一个具体实施例中,本发明的修饰的LSC或CEC包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以缺失选自以下的基因组DNA区域的连续延伸段:chr15:44711563-44711585、chr15:44711597-44711619、or chr15:44715446-44715468,从而消除细胞中MHC I类分子的表面表达。在一个优选的实施例中,本发明的修饰的LSC或CEC包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以缺失基因组DNA区域chr15:44711563-44711585的连续延伸段,从而消除细胞中MHC I类分子的表面表达。
在一个方面,本发明涉及一种修饰的LSC或CEC,其包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以在与gRNA分子的靶向结构域互补的靶序列处或附近形成插入/缺失。
“插入/缺失(indel)”(当所述术语在本文中使用时)是指相对于参考核酸包含一个或多个核苷酸插入、一个或多个核苷酸缺失、或核苷酸插入和缺失的组合的核酸,其在暴露于包含gRNA分子的组合物(例如CRISPR系统)之后产生。插入/缺失可以通过在暴露于包含gRNA分子的组合物之后对核酸进行测序来确定,例如通过NGS。关于插入/缺失的位点,如果插入/缺失包含参考位点的约10、9、8、7、6、5、4、3、2或1个核苷酸内的至少一个插入或缺失,或者插入/缺失与所述参考位点的部分或全部重叠(例如,包含至少一个与gRNA分子例如本文所述的gRNA分子的靶向结构域互补的位点的10、9、8、7、6、5、4、3、2或1个核苷酸重叠的插入或缺失,或至少一个在gRNA分子例如本文所述的gRNA分子的靶向结构域互补的位点的10、9、8、7、6、5、4、3、2或1个核苷酸内的插入或缺失),则称插入/缺失位于参考位点(例如,与gRNA分子的靶向结构域互补的位点)“处或附近”。
“插入/缺失模式(indel pattern)”(当所述术语在本文中使用时)是指在暴露于包含gRNA分子的组合物之后产生的一组插入/缺失。在一个实施例中,依据出现频率,插入/缺失模式由前三个插入/缺失组成。在一个实施例中,依据出现频率,插入/缺失模式由前五个插入/缺失组成。在一个实施例中,插入/缺失模式由相对于所有测序读数以大于约5%的频率存在的插入/缺失组成。在一个实施例中,插入/缺失模式由相对于插入/缺失测序读数(即,不是由未经修饰的参考核酸序列组成的那些读数)的总数以大于约10%的频率存在的插入/缺失组成。在一个实施例中,插入/缺失模式包含前五个最常观察到的插入/缺失中的任何3个。插入/缺失模式可以例如通过对暴露于gRNA分子的细胞群中的细胞进行测序来确定。
在一个方面,本发明提供了一种修饰的LSC或CEC,包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以在与gRNA分子的包含SEQ ID NO:23-105或108-119或134-140中任一个的序列的靶向结构域互补的靶序列处或附近形成插入/缺失,从而消除细胞中MHC I类分子的表面表达。在一个实施例中,本发明的修饰的LSC或CEC包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以在与gRNA分子的包含SEQ ID NO:108、111、115、116、134或138中任一个的序列的靶向结构域互补的靶序列处或附近形成插入/缺失,从而消除细胞中MHC I类分子的表面表达。在一个更具体的实施例中,本发明的修饰的LSC或CEC包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以在与gRNA分子的包含SEQ ID NO:108、115、或116中任一个的序列的靶向结构域互补的靶序列处或附近形成插入/缺失,从而消除细胞中MHCI类分子的表面表达。在一个优选的实施例中,修饰的LSC或CEC包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以在与包含序列SEQ ID NO:108的gRNA分子的靶向结构域互补的靶序列处或附近形成插入/缺失,从而消除细胞中MHC I类分子的表面表达。
在一个方面,本发明提供一种修饰的LSC或CEC,其包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以在选自以下的基因组DNA区域处或附近形成插入/缺失:chr15:44711469-44711494、chr15:44711472-44711497、chr15:44711483-44711508、chr15:44711486-44711511、chr15:44711487-44711512、chr15:44711512-44711537、chr15:44711513-44711538、chr15:44711534-44711559、chr15:44711568-44711593、chr15:44711573-44711598、chr15:44711576-44711601、chr15:44711466-44711491、chr15:44711522-44711547、chr15:44711544-44711569、chr15:44711559-44711584、chr15:44711565-44711590、chr15:44711599-44711624、chr15:44711611-44711636、chr15:44715412-44715437、chr15:44715440-44715465、chr15:44715473-44715498、chr15:44715474-44715499、chr15:44715515-44715540、chr15:44715535-44715560、chr15:44715562-44715587、chr15:44715567-44715592、chr15:44715672-44715697、chr15:44715673-44715698、chr15:44715674-44715699、chr15:44715410-44715435、chr15:44715411-44715436、chr15:44715419-44715444、chr15:44715430-44715455、chr15:44715457-44715482、chr15:44715483-44715508、chr15:44715511-44715536、chr15:44715515-44715540、chr15:44715629-44715654、chr15:44715630-44715655、chr15:44715631-44715656、chr15:44715632-44715657、chr15:44715653-44715678、chr15:44715657-44715682、chr15:44715666-44715691、chr15:44715685-44715710、chr15:44715686-44715711、chr15:44716326-44716351、chr15:44716329-44716354、chr15:44716313-44716338、chr15:44717599-44717624、chr15:44717604-44717629、chr15:44717681-44717706、chr15:44717682-44717707、chr15:44717702-44717727、chr15:44717764-44717789、chr15:44717776-44717801、chr15:44717786-44717811、chr15:44717789-44717814、chr15:44717790-44717815、chr15:44717794-44717819、chr15:44717805-44717830、chr15:44717808-44717833、chr15:44717809-44717834、chr15:44717810-44717835、chr15:44717846-44717871、chr15:44717945-44717970、chr15:44717946-44717971、chr15:44717947-44717972、chr15:44717948-44717973、chr15:44717973-44717998、chr15:44717981-44718006、chr15:44718056-44718081、chr15:44718061-44718086、chr15:44718067-44718092、chr15:44718076-44718101、chr15:44717589-44717614、chr15:44717620-44717645、chr15:44717642-44717667、chr15:44717771-44717796、chr15:44717800-44717825、chr15:44717859-44717884、chr15:44717947-44717972、chr15:44718119-44718144、chr15:44711563-44711585、chr15:44715428-44715450、chr15:44715509-44715531、chr15:44715513-44715535、chr15:44715417-44715439、chr15:44711540-44711562、chr15:44711574-44711596、chr15:44711597-44711619、chr15:44715446-44715468、chr15:44715651-44715673、chr15:44713812-44713834、chr15:44711579-44711601、chr15:44711542-44711564、chr15:44711557-44711579、chr15:44711609-44711631、chr15:44715678-44715700、chr15:44715683-44715705、chr15:44715684-44715706、chr15:44715480-44715502,从而消除细胞中MHC I类分子的表面表达。在一个实施例中,本发明的修饰的LSC或CEC包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以在选自以下的基因组DNA区域处或附近形成插入/缺失:chr15:44715513-44715535、chr15:44711542-44711564、chr15:44711563-44711585、chr15:44715683-44715705、chr15:44711597-44711619、或chr15:44715446-44715468。在一个具体的实施例中,本发明的修饰的LSC或CEC包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以在选自以下的基因组DNA区域处或附近形成插入/缺失:chr15:44711563-44711585、chr15:44711597-44711619、or chr15:44715446-44715468,从而消除细胞中MHC I类分子的表面表达。在一个优选的实施例中,本发明的修饰的LSC或CEC包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以在基因组DNA区域chr15:44711563-44711585处或附近形成插入/缺失,从而消除细胞中MHC I类分子的表面表达。
在一些实施例中,形成的插入/缺失包含10个或大于10个核苷酸缺失,任选地11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、或35个核苷酸缺失。
在一些实施例中,所述插入/缺失在细胞群的细胞的至少约40%、例如至少约50%、例如至少约60%、例如至少约70%、例如至少约80%、例如至少约90%、例如至少约95%、例如至少约96%、例如至少约97%、例如至少约98%、例如至少约99%中在与gRNA分子的靶向结构域互补的靶序列处或附近形成。
在一些实施例中,在细胞群的细胞的至少约5%,任选地至少约10%、15%、20%、25%、30%或更多中检测到包含缺失10个或大于10个核苷酸的插入缺失。
在一些实施例中,插入/缺失通过下一代测序(NGS)测量。
在一个实施例中,本发明提供了一种修饰的LSC或CEC,包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以在靶序列处或附近形成插入/缺失,并且其中在所述经修饰的LSC或CEC中没有形成脱靶插入/缺失,例如如通过下一代测序和/或核苷酸插入测定法可检测的。在一个实施例中,本发明提供了一种修饰的LSC或CEC群,包含以下基因组,在所述基因组中15号染色体上的b2微球蛋白(B2M)基因已被编辑以在靶序列处或附近形成插入/缺失,并且其中在修饰的LSC或CEC群的细胞的不超过约5%,例如不超过约1%,例如不超过约0.1%,例如不超过约0.01%中检测到脱靶插入/缺失,例如,如通过下一代测序和/或核苷酸插入测定法可检测的。
“脱靶插入/缺失”(当所述术语在本文中使用时)是指在除了gRNA分子的靶向结构域的靶序列以外的位点处或附近的插入/缺失。相对于gRNA的靶向结构域的序列,此类位点可以包含例如1、2、3、4、5个或更多个错配核苷酸。在示例性实施例中,使用经由计算机模拟预测的脱靶位点的靶向测序或通过本领域已知的插入方法来检测此类位点。
在一些实施例中,本发明的修饰的LSC或CEC相对于待施用所述细胞的患者是自体的。在其他实施例中,本发明的修饰的LSC或CEC相对于待施用所述细胞的患者是同种异体的。
候选Cas9分子、候选gRNA分子、候选Cas9分子/gRNA分子复合物可以通过本领域已知的方法或如本文所述的进行评估。例如,先前已经描述了用于评估Cas9分子的核酸内切酶活性的示例性方法(Jinek 2012)。本文所述的每种技术可以单独使用或与一种或多种技术组合使用以评估候选分子。本文披露的技术可以用于多种方法,包括但不限于确定Cas9分子/gRNA分子复合物的稳定性的方法,确定促进稳定的Cas9分子/gRNA分子复合物的条件的方法,筛选对于稳定的Cas9分子/gRNA分子复合物的方法,鉴定形成稳定的Cas9分子/gRNA分子复合物的最佳gRNA的方法,以及选择用于施用于受试者的Cas9/gRNA复合物的方法。
结合和切割测定:测试Cas9分子的核酸内切酶活性。可以在质粒切割试验中评估Cas9分子/gRNA分子复合物结合和切割靶核酸的能力。在所述测定中,通过加热至95℃并缓慢冷却至室温,将合成的或体外转录的gRNA分子在反应前进行预退火。将天然或限制性消化线性化的质粒DNA(300ng(约8nM))与纯化的Cas9蛋白分子(50nM-500nM)和gRNA(50nM-500nM,1:1)在含或不含10mM MgCl2的Cas9质粒切割缓冲液(20mM HEPES pH 7.5、150mMKC1、0.5mM DTT,0.1mM EDTA)中在37℃孵育60分钟。将反应用5X DNA上样缓冲液(30%甘油、1.2%SDS、250mM EDTA)终止,通过0.8%或1%琼脂糖凝胶电泳分离,并通过溴化乙锭染色观察。所得的切割产物表明Cas9分子切割两条DNA链,或仅切割两条链之一。例如,线性DNA产物指示两条DNA链的切割。带切口的开环产物表示两条链中只有一条被切割。
可替代地,可以在寡核苷酸DNA切割试验中评估Cas9分子/gRNA分子复合物结合和切割靶核酸的能力。在所述测定中,通过与5个单位的T4多核苷酸激酶和-3-6pmol(-20-40mCi)[γ-32Ρ]-ΑΤΡ在IX T4多核苷酸激酶反应缓冲液中以在50微升反应于37℃孵育30分钟来对DNA寡核苷酸(10pmol)进行放射性标记。热灭活后(65℃加热20分钟),将反应物通过柱纯化以去除未结合的标记。通过在95℃下将标记的寡核苷酸与等摩尔量的未标记的互补寡核苷酸退火3分钟,然后缓慢冷却至室温,生成双链体定位剂(100nM)。对于切割测定,通过加热至95℃持续30s,然后缓慢冷却至室温,使gRNA分子退火。将Cas9(终浓度为500nM)与退火的gRNA分子(500nM)在切割测定缓冲液(20mM HEPES pH 7.5、100mM KCl,5mMMgC12、1mM DTT,5%甘油)中以9微升的总体积进行预孵育。通过添加1微升靶DNA(10nM)引发反应,并在37℃下孵育1小时。通过添加20微升上样染料(5mM EDTA、0.025%SDS、甲酰胺中的5%甘油)并加热至95℃5分钟猝灭反应。切割产物在含有7M尿素的12%变性聚丙烯酰胺凝胶上分离,并通过磷光成像观察。产生的切割产物表明互补链、非互补链或两者是否被切割。
这些测定中的一种或两种均可用于评估候选gRNA分子或候选Cas9分子的适用性。
插入/缺失检测和鉴定。靶向的基因组修饰也可以通过桑格测序或深度测序来检测。对于前者,可以用位于gRNA靶序列侧翼的任一引物扩增来自修饰区的基因组DNA。可以将扩增子亚克隆到用于转化的质粒(如pUC19)中,并且应所述对单个菌落进行测序以揭示克隆的基因型。
可替代地,深度测序适用于对大量样品或靶位点进行采样。NGS引物设计用于较短的扩增子,通常在100bp-200bp大小范围内。对于插入/缺失的检测,重要的是设计距离Cas9靶位点至少50bp的引物,以允许检测更长的插入/缺失。可以使用市售仪器,例如依诺米那系统来评估扩增子。NGS优化和故障排除的详细说明可以在依诺米那用户手册中找到。
在本发明的一方面,通过如上所述的根据本发明的方法可获得的扩增的细胞群被递送至眼。递送在无菌条件下进行。
在涉及在360°角膜缘周膜切开术之后用于角膜缘干细胞疗法的一个实施例中,可以将纤维血管角膜血管翳从表面小心地去除。
在本发明的一方面,将细胞群与适合于眼递送的定位剂组合(如下文进一步描述)并递送至眼。在一个优选的实施例中,将适于眼递送的细胞和定位剂组合并经由载体例如治疗性接触透镜或羊膜向眼施用。在另一个实施例中,将适合在眼中使用的细胞和定位剂,例如可光固化的生物基质例如GelMA,经由生物印刷递送到眼。
在一个实施例中,本发明提供了一种将包含角膜缘干细胞或角膜内皮细胞的细胞群移植到受试者的角膜上的方法,所述方法包括通过用包含根据本发明的LATS抑制剂的细胞增殖培养基培养包含角膜缘干细胞或角膜内皮细胞的细胞群来扩增所述细胞群,漂洗扩增的细胞群以基本上除去LATS抑制剂,并将所述细胞施用到所述受试者的角膜上。优选地,在所述给予之前,所述细胞与生物基质组合。在具体的实施例中,在所述给予之前,将所述细胞与生物作为GelMA的基质组合。在更具体的实施例中,所述角膜内皮细胞与生物基质组合,所述生物基质被生物印刷在眼表面上。特别优选地,所述角膜缘干细胞或角膜内皮细胞与作为GelMA的生物基质组合,并通过光触发反应使GelMA聚合而生物印刷在眼表面上。在另一个实施例中,在所述施用之前,将所述细胞与(1)凝血酶和纤维蛋白原或(2)纤维蛋白胶组合。
在另一个实施例中,本发明提供了一种将细胞群移植到受试者的眼中的方法,所述方法包括将细胞与生物基质组合以形成细胞/生物基质混合物,将混合物注射到受试者的眼中或将混合物施加到受试者眼表面上,并通过使用诸如紫外线A或白光光源的光源引导和固定细胞(例如在角膜上)将细胞生物印刷在眼中或眼上。在某些实施例中,光源产生波长为至少350nm的光。在某些实施例中,光源产生在350nm至420nm范围内的光。例如,LED光源可用于产生波长为365nm或405nm或350nm以上的任何其他波长的光,或者具有带通滤波器的水银灯可用于产生波长为365nm的光。在另一个实施例中,光源产生可见的白光,所述白光具有例如在400nm至700nm范围内的波长。在某些实施例中,所述细胞是眼细胞,例如角膜细胞(例如角膜内皮细胞)、晶状体细胞、小梁网状细胞或在前房中发现的细胞。在具体的实施例中,所述细胞是角膜内皮细胞。此类方法的某些实施例包括:
实施例x1.一种将分离的细胞群移植到受试者眼中的方法,所述方法包括将细胞与生物基质组合以形成细胞/生物基质混合物,将混合物注射到受试者眼中(例如,前房中),并通过使用光源在眼中引导和固定细胞将细胞生物印刷在眼中。
实施例x2.如实施例x1所述的方法,其中将分离的细胞与作为GelMA的生物基质组合,并通过光触发反应使GelMA聚合而生物印刷在角膜上。
实施例x3.如实施例x1或实施例x2所述的方法,其中光源产生波长在350nm至700nm范围内的光。
实施例x4.如实施例x1至x3中任一项所述的方法,其中波长是350nm至420nm。
实施例x5.如实施例x1至x4中任一项所述的方法,其中波长是365nm。
实施例x6.如实施例x1至x5中任一项所述的方法,其中所述分离的细胞是角膜内皮细胞。
实施例x7.一种将分离的细胞群移植到受试者眼中的方法,所述方法包括将细胞与生物基质组合以形成细胞/生物基质混合物,将混合物施用到受试者眼上,并通过使用光源在眼上引导和固定细胞将细胞生物印刷在眼上。
实施例x8.如实施例x7所述的方法,其中将分离的细胞与作为GelMA的生物基质组合,并通过光触发反应使GelMA聚合而生物印刷在眼表面上。
实施例x9.如实施例x7或实施例x8所述的方法,其中光源产生波长在350nm至700nm范围内的光。
实施例x10.如实施例x7至x9中任一项所述的方法,其中波长是350nm至420nm。
实施例x11.如实施例x7至x10中任一项所述的方法,其中波长是365nm。
实施例x12.如实施例x7至x11中任一项所述的方法,其中所述分离的细胞是角膜缘干细胞。
在一个可替代实施例中,经由治疗性接触透镜将通过如上所述的根据本发明的方法可获得的扩增的细胞群直接递送至眼,而无需使用适用于眼递送的定位剂(例如GelMA或纤维蛋白胶)。
在本发明的一个实施例中,可以将细胞制剂经由适合眼用的定位剂递送至眼。细胞可以包埋在定位剂内或粘附到定位剂的表面,或两者。
定位剂的类型不受限制,只要它能够携带LSC或CEC并适合在眼中使用即可。在一个优选的实施例中,定位剂是可降解的并且是生物相容的。在递送CEC的情况下,优选地,定位剂可以在手术递送至眼表面之后促进CEC附着于角膜。
在一个优选的实施例中,细胞仅在细胞群扩增后与定位剂组合。在一个特别优选的实施例中,在漂洗细胞群以基本上除去本发明的LATS抑制剂的存在后,将扩增的细胞群与适合于眼递送的定位剂组合。在一个实施例中,将LSC或CEC与定位剂组合并以适合眼用的形式储存。在另一个实施例中,将LSC或CEC和定位剂分开储存并在眼用前立即组合。
定位剂优选选自由以下组成的列表:纤维蛋白、胶原、明胶、纤维素、羊膜、纤维蛋白胶、凝血酶和纤维蛋白原的组合、聚乙烯(乙二醇)二丙烯酸酯(PEGDA)、GelMA、(其为甲基丙烯酰胺改性的明胶,也称为甲基丙烯酸明胶)、包含以下的定位剂:聚合物、交联聚合物、或包含以下中的一种或多种的水凝胶:透明质酸、聚乙二醇、聚丙二醇、聚环氧乙烷、聚环氧丙烷、泊洛沙姆、聚乙烯醇、聚丙烯酸、聚甲基丙烯酸、聚乙烯吡咯烷酮、聚(丙交酯-共-乙交酯)、海藻酸盐、明胶、胶原、纤维蛋白原、纤维素、甲基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、羟丙基瓜儿胶、吉兰糖胶、瓜尔胶、黄原胶和羧甲基纤维素、以及其衍生物、其共聚物、及其组合。
在一个更优选的实施例中,定位剂选自由以下组成的列表:纤维蛋白、胶原、明胶、羊膜、纤维蛋白胶、凝血酶和纤维蛋白原的组合、聚乙烯(乙二醇)二丙烯酸酯(PEGDA)、GelMA、包含以下的定位剂:聚合物、交联聚合物、或包含以下中的一种或多种的水凝胶:透明质酸、聚乙二醇、聚丙二醇、聚环氧乙烷、聚环氧丙烷、泊洛沙姆、聚丙烯酸、聚(丙交酯-共-乙交酯)、海藻酸盐、明胶、胶原、纤维蛋白原、羟丙基甲基纤维素和羟丙基瓜儿胶、以及其衍生物、其共聚物、及其组合。
在一个优选的实施例中,可以经由作为生物基质的定位剂将根据本发明的扩增的细胞群递送至接受者。在更优选的实施例中,定位剂是可光固化的,可降解的生物基质。优选地,它能够被注射至眼。生物基质的具体实例是GelMA,它是甲基丙烯酰胺修饰的明胶,也称为甲基丙烯酸明胶。
GelMA可以根据本领域已知的标准方案来制备(Van Den Bulcke等人,Biomacromolecules[生物大分子],2000,第31-38页;Yue等人,Biomaterials[生物材料],2015,第254-271页)。例如,将来自猪皮肤的明胶(凝胶强度为300g Bloom,A型)溶解在不含钙和镁的PBS中(杜氏PBS),然后在强烈搅拌下将甲基丙烯酸酐添加到明胶溶液中以达到所需浓度(例如,8%(体积/体积)。可以在添加另外的DPBS之前和之后搅拌混合物。可以使用透析管经由Milli-Q水透析纯化稀释混合物,以除去甲基丙烯酸。纯化的样品可以任选地冻干,并将固体储存在-80℃、-20℃或4℃下直至进一步使用。
通过将冻干的GelMA溶解在包含药学上可接受的赋形剂的适合眼用的配制品中来制备GelMA储备溶液。为了制备GelMA储备溶液,可以将冻干的GelMA溶解在DPBS中。GelMA完全溶解后,可以将光引发剂(例如,苯基-2,4,6-三甲基苯甲酰基次膦酸锂)引入GelMA溶液中。为了将pH值调节至中性,可以在使用0.22微米无菌膜过滤之前,向溶液中添加NaOH。可以将最终滤液分成等分试样,并保存在4℃下直至进一步使用。
在根据本发明的一个方面,使用光引发剂聚合生物基质(优选为GelMa)将细胞包囊在生物基质内。合适的光引发剂是Irgacure 2959、苯基-2,4,6-三甲基甲酰基次膦酸锂、苯基-2,4,6-三甲基甲酰基次膦酸钠、双(2,4,6-三甲基甲酰基)次膦酸锂、双(2,4,6-三甲基甲酰基)次膦酸钠、二苯基(2,4,6-三甲基甲酰基)氧化膦、伊红Y、磷酸核黄素、樟脑醌、Quantacure BPQ、Irgacure 819、Irgacure 1850、和Darocure 1173。在一个优选的实施例中,光引发剂是苯基-2,4,6-三甲基苯甲酰基次膦酸锂、苯基-2,4,6-三甲基苯甲酰基次膦酸钠、磷酸核黄素。在另一个实施例中,光引发剂是苯基-2,4,6-三甲基苯甲酰基次膦酸锂。
在聚合之前,将可光固化的生物基质与合适的光引发剂在适合眼用的包含药学上可接受的赋形剂的配制品中在本领域已知的合适容器中例如小瓶中混合。在与细胞混合之前,可以将光引发剂与生物基质组合;可替代地,在与细胞混合之后,可以将光引发剂与生物基质组合;可替代地,可以先将光引发剂添加到细胞,然后与生物基质组合。生物基质和光引发剂的浓度取决于所用的特定生物基质和特定光引发剂,但是选择其以在方便的光暴露时间内提供聚合,所述时间通常少于约5分钟;优选地少于约2分钟;更优选地少于约1分钟。在一个实施例中,光引发剂是苯基-2,4,6-三甲基苯甲酰基次膦酸锂,其在用于细胞递送至眼的配制品中的浓度为约0.01%w/v至约0.15%w/v。在另一个方面,苯基-2,4,6-三甲基苯甲酰基次膦酸锂在用于细胞递送至眼的配制品中的浓度为约0.05%w/v或约0.075%w/v。可以使用公开的程序(Biomaterials[生物材料]2009,30,6702-6707)合成LAP,也可以从TCI(产品号L0290)和Biobots(BioKey)获得。
可以在本领域已知的合适容器例如小瓶或试管中将细胞添加到GelMA中。例如,可以通过移液到GelMA中并通过上下轻轻移液混合来添加细胞。在一个实施例中,适合于眼递送的组合物中的GelMA浓度为约10至约200mg/mL、或约25至约150mg/mL、或约25至约75mg/mL。在一个优选的实施例中,适合于眼递送的组合物中的GelMA浓度为约25mg/mL、约50mg/mL或约75mg/mL。
为了聚合可光固化的生物基质,如上所述,将生物基质、光引发剂和细胞暴露于光源持续优选的持续时间。用于聚合的光的波长将取决于所使用的特定光引发剂的光化学性质。例如,Irgacure 2959的光引发聚合反应将发生在波长为300nm-370nm的光下;苯基-2,4,6-三甲基苯甲酰基次膦酸锂的光引发聚合反应将发生在波长为300nm-420nm的光下;核黄素-5'-磷酸的光引发聚合反应将发生在300nm-500nm波长的光下。所使用的光源可能会发出一定范围的波长,例如白炽灯、气体放电灯或金属蒸气灯所能达到的波长;可替代地,所使用的光源可以发射窄范围的波长,如通过滤光器或通过发光二极管(LED)实现的那样。优选地,所使用的光源不发射波长小于315nm的光,以避免UV辐射对细胞的破坏作用。在一个实施例中,光源是光谱范围为415nm-700nm的白光源。在另一个实施例中,光源是具有约365±5nm、约375±5nm、约385±5nm、约395±5nm、约405±5nm、约415±5nm、约425±5nm、约435±5nm、约445±5nm、约455±5nm、或约465±5nm的光谱范围的LED光源。选择光的强度以使光毒性最小化并在方便的光暴露时间内提供聚合,所述时间通常少于约5分钟;优选地少于约2分钟;更优选地少于约1分钟。聚合反应的一种指示是溶液粘度的增加。聚合反应的另一种指示是开始胶凝。
生物基质的聚合可以经由生物印刷技术在眼表面上发生,或者可替代地在随后移植到眼表面上的载体上发生。任选地,生物基质的聚合可以发生在前房的角膜表面上,或者可替代地发生在随后被移植到前房的角膜表面的载体上。
适用于眼递送的细胞(例如,修饰的LSC)和定位剂优选地经由例如接触透镜或羊膜的载体来递送。
适合根据本发明使用的接触透镜(例如,与修饰的LSC一起使用)优选是那些符合患者角膜曲率并且能够在临床实践中被患者很好地耐受以作为条带接触透镜连续使用若干天的接触透镜。
根据本发明的合适类型的接触透镜的实例与已经针对与1型波士顿人工角膜一起使用的长期条带接触透镜(也可以用于患有角膜缘干细胞缺陷的患者)在临床使用上广泛验证的一致并描述于:Thomas、Merina M.D.;Shorter、Ellen O.D.;Joslin、CharlotteE.O.D.、Ph.D.;McMahon、Timothy J.O.D.;Cortina、M.Soledad M.D.Contact Lens Use inPatients With Boston Keratoprosthesis Type 1:Fitting,Management,andComplications.[带有1型波士顿人工角膜的患者的接触透镜使用:贴合、处理和并发症。]Eye Contact Lens.[接触透镜]2015年11月;41(6):334-40。
接触透镜可以具有本领域中已知的或后来开发的任何适当材料,并且可以是软性透镜、硬性透镜或混合透镜,优选为软性透镜,更优选为常规水凝胶透镜或硅酮水凝胶(SiHy)透镜。
“常规水凝胶接触透镜”是指包含水凝胶块状(芯)材料的接触透镜,所述水凝胶块状(芯)材料是水不溶的、交联的聚合物材料,理论上不含硅酮,并且在完全水合后在其聚合物基质内可包含至少10重量%的水。常规的水凝胶接触透镜通常是通过将本领域技术人员已知的常规的水凝胶透镜配制品(即,可聚合的组合物)共聚合而获得的,所述配制品包含无硅酮的亲水性的可聚合组分。
用于制备商业水凝胶接触透镜的常规水凝胶眼镜配制品的实例包括但不限于,alfafilcon A、acofilcon A、deltafilcon A、etafilcon A、focofilcon A、helfilcon A、helfilcon B、hilafilcon B、hioxifilcon A、hioxifilcon B、hioxifilcon D、methafilcon A、methafilcon B、nelfilcon A、nesofilcon A、ocufilcon A、ocufilcon B、ocufilcon C、ocufilcon D、omafilcon A、phemfilcon A、polymacon、samfilcon A、telfilcon A、tetrafilcon A、和vifilcon A。
“SiHy接触透镜”是指包含硅酮水凝胶块状(芯)材料的接触透镜,所述材料是水不溶的、交联的聚合物材料,含有硅酮,并且在完全水合后在其聚合物基质内可包含至少10重量%的水。硅氧烷水凝胶接触透镜通常是通过硅酮水凝胶透镜配制品的共聚合而获得的,所述配制品至少包含本领域技术人员已知的含硅酮的可聚合组分和亲水性可聚合组分。
用于制造商业SiHy接触透镜的SiHy透镜配制品的实例包括但不限于asmofilconA、balafilcon A、comfilcon A、delefilcon A、efrofilcon A、enfilcon A、fanfilcon A、galyfilcon A、lotrafilcon A、lotrafilcon B、narafilcon A、narafilcon B、senofilconA、senofilcon B、senofilcon C、smafilcon A、somofilcon A、和stenfilcon A。
在一个优选的实施例中,载体是选自下组的接触透镜,该组由以下组成:Balafilcon A、Lotrafilcon A、Lotrafilcon B、Senofilcon A和methafilcon A。
在特别优选的实施例中,载体是接触透镜,其为Lotrafilcon B。
可以使用纤维蛋白胶或缝合线将载体固定在眼表面上的适当位置,以防止眼球运动使结构体移位。
与生物基质和细胞组合的载体可以在眼睛上停留一段时间以递送细胞,例如几天至一周,优选一周。
在一个可替代的实施例中,LSC可以作为细胞悬浮液递送至眼表面(没有定位剂例如生物基质有或没有载体例如接触透镜)。配制品中可包括本领域已知的改善组织粘附性的化合物和赋形剂,例如粘膜粘附剂、粘度增强剂或反向热凝胶剂。
可以将按照根据本发明的细胞群扩增方法可获得的眼细胞(例如角膜内皮细胞)群移植到受试者的眼,例如受试者的角膜上。
根据本发明的细胞群可以经由适合眼用的定位剂递送,所述定位剂是可光固化的、可降解的生物基质,例如GelMA。以下方法描述了用于控制向角膜内壁的递送的过程。
方法1.气泡压抑法
功能障碍的内皮细胞可首先通过剥离/刮擦或以受控方式使用飞秒激光进行光致破裂而从角膜内壁脱离。然后将一小团载有细胞的生物基质注入角膜的内表面附近。这可以使用标准注射器或定制涂药器手动完成。也可以通过外科手术系统(例如constellation仪器)或注射泵进行控制。然后将气泡注入到团的下方。气泡将团压向后角膜,形成薄涂层。然后,使用UV或近UV光源或固化生物基质所需的任何其他光谱带固化整个凝胶。可替代地,可以保留功能障碍的组织,并在其上方固化生物基质。可以使用其他光学聚焦方法将光源聚焦为不同大小,以控制固化区域。剩余的未固化区域可以使用冲洗/抽吸套管冲洗掉。
方法2.使用飞秒激光的消减法
功能障碍的内皮细胞可首先通过剥离/刮擦或以受控方式使用飞秒激光进行光致破裂而从角膜内壁脱离。可替代地,它们可以留在原地。然后将载有细胞的生物基质注射到角膜的内表面上,覆盖去除组织的空隙或覆盖在功能障碍组织上。这可以使用标准注射器或定制涂药器手动完成。也可以通过外科手术系统(例如constellation仪器)或注射泵进行控制。然后,使用UV或近UV光源或固化生物基质所需的任何其他光谱带固化生物基质。飞秒激光然后用于脱离多余的材料,将厚度和面积控制为所需的分布。然后用镊子通过角膜切口去除多余的材料。
方法3.染色遮蔽和基于吸收的厚度控制
首先使用生物相容性染料(台盼蓝,亮蓝等)对角膜的内表面进行染色。然后通过剥离/刮擦将功能障碍的内皮细胞从角膜的内壁上脱离。然后将载有细胞的含有细胞相容性染料的生物基质注射到角膜的内表面上,覆盖去除组织的空隙。然后,使用UV或近UV光源或固化生物基质所需的任何其他光谱带固化生物基质。角膜组织中的染料增加了光吸收(起遮蔽的作用),以控制固化的生物基质的面积。类似地,生物基质中的染色增加了光的吸收,从而控制固化的材料的深度/厚度。然后使用冲洗/抽吸套管从前房冲洗未固化的凝胶材料。
方法4.干前房施用
功能障碍的内皮细胞可首先通过剥离/刮擦或以受控方式使用飞秒激光进行光致破裂而从角膜内壁脱离。可替代地,其可以留在原地。然后将前节的前房的水排干,并用气体(例如空气)代替。然后将载有细胞的生物基质以受控的小液滴形式施用到角膜的内表面(允许表面张力以分散液滴),或使用刷子或柔软的尖端套管进行涂布。可以将透明质酸施用于生物基质以改变其粘性性质,并能够更好地控制分配/施用。然后,使用UV或近UV光源或固化生物基质所需的任何其他光谱带固化整个生物基质。最后,然后用平衡的盐溶液再次填充前房。
方法5.天然浮力配制品
功能障碍的内皮细胞可首先通过剥离/刮擦或以受控方式使用飞秒激光进行光致破裂而从角膜内壁脱离。然后将一小团载有细胞的生物基质注入角膜的内表面附近。生物基质被配制为相对于房水是天然浮力的,或者被充气以达到相同的效果。这导致生物基质自然升至角膜后部,形成薄涂层。然后,使用UV或近UV光源或固化生物基质所需的任何其他光谱带固化整个生物基质。可替代地,可以保留功能障碍的组织,并在其上方固化生物基质。可以使用光学聚焦方法将UV光源聚焦为不同大小,以控制固化区域。剩余的未固化区域可以使用抽吸套管冲洗掉。
在一个可替代实施例中,可以将扩增的细胞群(例如本文所述的CEC)作为细胞悬浮液(不包含定位剂,例如可光固化、可降解的生物基质)递送,并通过使患者向下看3小时而通过重力使其附着。配制品中可包括本领域已知的改善组织粘附性的化合物和赋形剂,例如粘附剂、粘度增强剂或反向热凝胶剂。
在又另一个替代实施例中,还可通过使用磁珠递送扩增的细胞群,例如本文所述的CEC。制备CEC/珠粒在适合于眼递送的介质中的悬浮液,然后将其注射到眼睛中。通过施用于眼上的磁铁促进细胞附着。(Magnetic field-guided cell delivery withnanoparticle-loaded human corneal endothelial cells.[纳米载人角膜内皮细胞的磁场引导细胞递送。]Moysidis SN,Alvarez-Delfin K,Peschansky VJ,Salero E,WeismanAD,Bartakova A,Raffa GA,Merkhofer RM Jr,Kador KE,Kunzevitzky NJ,GoldbergJL.Nanomedicine.[纳米医学]2015年4月;11(3):499-509.doi:10.1016/j.nano.2014.12.002。)
根据本披露的修饰的眼细胞或眼细胞群(例如,LSC、CEC、LSC群或CEC群)可以用于治疗或预防眼疾病或障碍的方法,所述方法包括向有需要的受试者治疗施用治疗有效量的包含眼细胞(例如,LSC或CEC)的细胞群。
根据本发明的角膜缘干细胞群(例如,具有通过CRISPR系统(例如酿脓链球菌Cas9CRISPR系统)降低或消除了B2M表达的LSC)可以用于治疗或预防眼疾病或障碍的方法,所述方法包括向有需要的受试者施用治疗有效量的包含角膜缘干细胞的细胞群。优选地,眼疾病或障碍与角膜缘干细胞缺陷有关。
角膜缘干细胞缺陷可能是由多种多样的情况引起的,包括但不限于:
-化学或热灼伤或辐射损伤造成的直接干细胞损伤;
-先天性疾病,如无虹膜、硬化性角膜、多发性内分泌肿瘤;
-自身免疫性障碍,例如史蒂文斯约翰逊综合征或眼部瘢痕性天疱疮或胶原血管病;
-慢性非自身免疫性炎性障碍,例如接触透镜使用、干眼疾病、酒渣鼻、葡萄球菌边缘、角膜炎(细菌性、真菌性和病毒性)、翼状胬肉或肿瘤;
-医源性,例如经过多次眼科手术、翼状胬肉或肿瘤切除、冷冻疗法;
-药物毒性的结果,例如防腐剂(硫柳汞、苯甲烃铵)、局部麻醉药、毛果芸香碱、β受体阻滞剂、丝裂霉素、5-氟脲嘧啶、硝酸银和引起史蒂文斯约翰逊综合征的口服药物。
(参见:Dry Eye:a practical guide to ocular surface disorders and stemcell surgery.[干眼症:有关眼表面障碍和干细胞手术的实用指南。]SLACK 2006-RzanyB,Mockenhaupt M,Baur S等人J.Clin.Epidemiol.[临床流行病学杂志]49,769-773(1996))。
在临床实践中,最常见的角膜缘干细胞缺陷的原因是化学烧伤、无虹膜、史蒂文斯约翰逊综合征和接触透镜使用。
眼疾病或障碍更优选为角膜缘干细胞缺陷,其是由选自下组的损伤或疾病或障碍引起的,该组由以下组成:化学灼伤、热灼伤、放射损伤、无虹膜、硬化性角膜、多发性内分泌肿瘤、史蒂文斯约翰逊综合征、眼部疤痕性类天疱疮、胶原血管病、接触透镜使用引起的慢性非自身免疫性炎性障碍、干眼疾病、酒渣鼻、葡萄球菌边缘、角膜炎(包括细菌性、真菌性和病毒性角膜炎)、翼状胬肉或肿瘤、多次眼科手术或翼状胬肉或肿瘤切除或冷冻疗法引起的角膜缘干细胞缺陷;以及药物引起的药物毒性导致的角膜缘干细胞缺陷,所述药物例如选自由以下组成的组的药物:防腐剂(硫柳汞、苯甲烃铵)、局部麻醉药、毛果芸香碱、β受体阻滞剂、丝裂霉素、5-氟脲嘧啶、硝酸银和引起史蒂文斯约翰逊综合征的口服药物。
在一个具体的实施例中,本发明提供了通过向有需要的受试者施用有效量的根据本发明的细胞群扩增方法可获得的角膜缘干细胞群(例如,通过CRISPR系统(例如酿脓链球菌Cas9 CRISPR系统)降低或消除B2M表达的角膜缘干细胞群)来治疗角膜缘干细胞缺陷的方法。
在一个更具体的实施例中,本发明提供了一种治疗由损伤或障碍引起的角膜缘干细胞缺陷的方法,所述损伤或障碍选自下组,该组由以下组成:化学灼伤、热灼伤、放射损伤、无虹膜、硬化性角膜、多发性内分泌肿瘤、史蒂文斯约翰逊综合征、眼部疤痕性类天疱疮、胶原血管病、接触透镜使用引起的慢性非自身免疫性炎性障碍、干眼疾病、酒渣鼻、葡萄球菌边缘、角膜炎(包括细菌性、真菌性和病毒性角膜炎)、翼状胬肉或肿瘤、多次眼科手术或翼状胬肉或肿瘤切除或冷冻疗法引起的角膜缘干细胞缺陷;以及药物引起的药物毒性导致的角膜缘干细胞缺陷,所述药物例如选自由以下组成的组:防腐剂(硫柳汞、苯甲烃铵)、局部麻醉药、毛果芸香碱、β受体阻滞剂、丝裂霉素、5-氟脲嘧啶、硝酸银和引起史蒂文斯约翰逊综合征的口服药物,所述治疗是通过向有需要的受试者施用治疗有效量的通过根据本发明的细胞群扩增方法可获得的角膜缘干细胞群(例如,通过CRISPR系统(例如酿脓链球菌Cas9 CRISPR系统)降低或消除B2M表达的角膜缘干细胞群)。
在又一个更具体的实施例中,本发明提供了通过向有需要的受试者施用治疗有效量的根据本发明的细胞群扩增方法可获得的角膜缘干细胞群(例如,通过CRISPR系统(例如酿脓链球菌Cas9 CRISPR系统)降低或消除B2M表达的角膜缘干细胞群)来治疗角膜缘干细胞缺陷的方法,所述角膜缘干细胞缺陷由选自下组的损伤、疾病或障碍引起:化学灼伤、无虹膜、史蒂文斯约翰逊综合征和接触透镜使用。
当成人是接受者(移植接受者)时,在具体的实施例中,可以用根据本发明的处理方法将大于1,000个表达p63α的细胞施用于患者。在具体的实施例中,可以用根据本发明的处理方法将1,000至100,000个表达p63α的细胞施用于患者。
根据本发明的角膜内皮细胞群(例如,具有通过CRISPR系统(例如酿脓链球菌Cas9CRISPR系统)降低或消除了B2M表达的角膜内皮细胞群)可以用于治疗或预防眼疾病或障碍的方法,所述方法包括向有需要的受试者施用治疗有效量的包含角膜内皮细胞的细胞群。优选地,眼疾病或障碍与角膜内皮细胞密度降低有关。在优选的实施例中,眼疾病或障碍是角膜内皮功能障碍。
更优选地,眼疾病或障碍是角膜内皮功能障碍,其选自由以下组成的组:Fuchs角膜内皮营养不良、大疱性角膜病变(包括假晶状体大疱性角膜病和无晶状体大疱性角膜病)和角膜移植失败、后部多态性角膜营养不良、先天性遗传性内皮营养不良、X连锁内皮角膜营养不良、无虹膜和角膜内皮炎。在一个具体的实施例中,眼疾病或障碍选自下组,该组由以下组成:Fuchs角膜内皮营养不良、大疱性角膜病变(包括假晶状体大疱性角膜病和无晶状体大疱性角膜病)和角膜移植失败。
在一个具体的实施例中,本发明提供了通过向有需要的受试者施用有效量的根据本发明的细胞群扩增方法可获得的角膜内皮细胞群(例如,通过CRISPR系统(例如酿脓链球菌Cas9 CRISPR系统)降低或消除B2M表达的角膜内皮细胞群)来治疗角膜内皮功能障碍的方法。
在一个更具体的实施例中,本发明提供了通过向有需要的受试者施用有效量的根据本发明的细胞群扩增方法可获得的角膜内皮细胞群(例如,通过CRISPR系统(例如酿脓链球菌Cas9 CRISPR系统)降低或消除B2M表达的角膜内皮细胞群)来治疗角膜内皮功能障碍的方法,所述角膜内皮功能障碍选自由以下组成的组:Fuchs角膜内皮营养不良、大疱性角膜病变(包括假晶状体大疱性角膜病和无晶状体大疱性角膜病)和角膜移植失败、后部多态性角膜营养不良、先天性遗传性内皮营养不良、X连锁内皮角膜营养不良、无虹膜和角膜内皮炎。
在又一个更具体的实施例中,本发明提供了通过向有需要的受试者施用有效量的根据本发明的细胞群扩增方法可获得的角膜内皮细胞群(例如,通过CRISPR系统(例如酿脓链球菌Cas9 CRISPR系统)降低或消除B2M表达的角膜内皮细胞群)来治疗角膜内皮功能障碍的方法,所述角膜内皮功能障碍选自由以下组成的组:Fuchs角膜内皮营养不良、大疱性角膜病变(包括假晶状体大疱性角膜病和无晶状体大疱性角膜病)和角膜移植失败。
当成人是接受者(移植接受者)时,在特定方面,可以在根据本发明的治疗方法中使用的角膜内皮细胞群(例如,具有通过CRISPR系统(例如酿脓链球菌Cas9 CRISPR系统)降低或消除B2M表达的角膜内皮细胞群)在眼中的最终细胞密度优选为约至少500个细胞/mm
在某些实施例中,通过本文提供的治疗方法改善了患者的视力。视觉敏感度测试在本领域中是众所周知的,包括例如Snellen和Sloan敏感度测试以及早期治疗糖尿病视网膜病变研究(ETDRS)敏感度测试。例如,可以使用最佳矫正视觉敏感度(BCVA)测量来测量视力的改善。在某些实施例中,本文所提供的本发明的修饰的细胞或细胞群或组合物治疗后,如通过ETDRS字母所测量的,本文提供的治疗的患者的BCVA提高至少1、2、3、4、5或更多行。
提供以下实例以进一步说明本发明,但不限制其范围。本发明的其他变型对于本领域普通技术人员来说是容易清楚的,并且由所附权利要求涵盖。
除非另外定义,否则本文使用的技术术语和科学术语具有与熟悉本披露所属领域的技术人员通常理解的相同含义。
研究同意的尸体人角膜是从眼库获得的。解剖角膜缘边缘,并在1.2mg/ml的分散酶溶液中于37℃进行2小时的部分解离,然后在TrypLE(生命技术公司(LifeTechnologies))中进行10分钟的解离。然后小心地从部分解离的角膜缘边缘切下角膜隐窝片,并通过离心漂洗)。在以下实例中使用以这种方式获得的细胞。
将按照实例1所述获得的细胞接种在玻璃底黑壁24孔培养皿中的角膜缘上皮细胞培养基(补充有10%人血清和1.3mM氯化钙的DMEM F12)中,所述培养基补充有LATS抑制剂化合物实例编号4或3,浓度为10微摩尔,或补充DMSO作为阴性对照。在这些条件下,将细胞在5%CO2中在37℃下培养24小时。
为了测量LATS抑制剂对下游靶标YAP的作用,通过免疫组织化学分析了细胞内YAP的分布。将细胞培养物用4%PFA固定20分钟,透化并在0.3%Triton X-100(西格玛-奥德里奇公司(Sigma-Aldrich))和3%驴血清于PBS中的封闭溶液中封闭30分钟。然后在封闭溶液中于4℃用第一抗体标记细胞12小时。使用的第一抗体是来自圣克鲁斯生物技术公司(Santa Cruz Biotechnology)的抗YAP。将样品在PBS中洗涤3次,然后在室温下施加1:500稀释度的驴产生的第二抗体Alexa Fluor 488(分子探针公司(Molecular Probes))30分钟。阴性对照省略了第一抗体(数据未显示)。使用Zeiss LSM 880共聚焦显微镜观察荧光。
在没有LATS抑制剂的情况下(DMSO对照)培养的LSC的细胞核中仅观察到了弱的YAP免疫染色。在暴露于LATS抑制剂化合物2-(3-甲基-1H-吡唑-4-基)-N-(1-甲基环丙基)吡啶并[3,4-d]嘧啶-4-胺或2,4-二甲基-4-{[2-(吡啶-4-基)吡啶并[3,4-d]嘧啶-4-基]氨基}戊-2-醇的LSC的细胞核中,YAP免疫染色更强,所述化合物是如美国专利申请号15/963,816和国际专利号PCT/IB2018/052919(WO 2018/198077)(提交于2018年4月26日)中所述制备的(数据未显示)。
如实施例1中所述获得的细胞在37℃下用Accutase与培养皿脱离10分钟,通过离心漂洗细胞悬浮液,并铺板于6孔板(康宁公司(Corning))中的补充有10%人血清和1.3mM氯化钙的DMEM F12中,并在没有LATS抑制剂化合物的情况下培养2-4天。
然后用新鲜角膜缘上皮细胞培养基(补充有10%人血清和1.3mM氯化钙的DMEMF12)更换培养基,所述新鲜培养基补充有LATS抑制剂化合物实例编号4或3,浓度为10微摩尔,或补充DMSO作为阴性对照。在这些条件下,将细胞在5%CO2中在37℃下培养1小时。
为了测量LATS抑制剂对下游靶标YAP的作用,通过蛋白质印迹法如下测量YAP磷酸化水平。通过胰蛋白酶解离和离心获得细胞沉淀,并用PBS洗涤。用含有蛋白酶抑制剂混合物(生命技术公司(Life Technologies))的30微升RIPA裂解缓冲液裂解沉淀30分钟,每10分钟涡旋振荡一次。然后将细胞碎片在4℃下以14k rpm沉淀15分钟,并收集蛋白质裂解物。使用微型BCA试剂盒(皮尔斯公司(Pierce))定量蛋白质浓度。在4%-20%TGX凝胶(伯乐公司(BioRad))的每个孔中填充十五微克总蛋白,并根据制造商的说明进行蛋白质印迹。用磷酸化YAP(ser127)(CST,1:500)或总Yap(Abnova,1:500)抗体探测膜,并用肌动蛋白(艾博抗公司(Abcam))标记作为上样对照。膜用缀合了HRP的第二抗体染色,漂洗并用ChemiDoc系统(伯乐公司(Biorad))按照制造商的说明进行成像。
蛋白质印迹分析(见图1)显示化合物实例编号图4和3均导致人LSC中YAP磷酸化水平的降低。这些结果表明,LATS抑制剂化合物实例编号4和3可以激活人LSC中的YAP信号传导。
将按照实例1所述获得的细胞接种在24孔板(康宁公司(Corning))中的角膜缘上皮细胞培养基(补充有10%人血清和1.3mM氯化钙的DMEM F12)中,所述培养基补充有LATS抑制剂化合物实例编号4或3,浓度为10微摩尔,或补充DMSO作为阴性对照。分离后不传代,首先将细胞在5%CO2中于37℃培养6天(图2A、2B和2C)。
为了评估化合物能够使两次传代后的LSC扩增的能力,在化合物实例3的存在下使LSC传代并培养两周以使其能够扩增(图2D)。通过在37℃下用Accutase处理培养物10分钟来传代角膜缘干细胞(LSC),通过离心漂洗细胞悬浮液并将细胞铺板在补充了LATS抑制剂化合物实例3的新鲜LSC培养基中。
为了观察扩增的细胞群表达p63α,通过免疫组织化学如下测量。将细胞培养物用4%PFA固定20分钟,透化并在0.3%Triton X-100(西格玛-奥德里奇公司(Sigma-Aldrich))和3%驴血清于PBS中的封闭溶液中封闭30分钟。然后在封闭溶液中于4℃用第一抗体标记细胞12小时。使用的第一抗体是来自细胞信号传导公司(Cell Signalling)的p63α。将样品在PBS中洗涤3次,然后在室温下施加1:500稀释度的驴产生的第二抗体AlexaFluor 488(分子探针公司(Molecular Probes))30分钟。用人核抗原抗体(密理博公司(Millipore))以1:500的稀释度对细胞进行复染,以标记培养物中的所有细胞并确认其人身份。阴性对照省略了第一抗体(数据未显示)。使用Zeiss LSM 880共聚焦显微镜观察荧光。
图2A显示在存在生长培养基和DMSO的情况下,只有少数分离的细胞附着在培养皿上,并且最多可以存活6天。大多数细胞表达人核标志物,但很少表达p63α。相反,在存在LATS抑制剂化合物实例编号4(图2B)和化合物实例编号3(图2C)的情况下,细胞形成集落并表达p63α。所述结果表明,LATS抑制剂促进具有p63α阳性表型的细胞群的扩增。图2D:使细胞传代并在LATS抑制剂化合物实例编号3的存在下培养它们两周使得细胞群扩增并形成表达p63α的融合培养物。
将按实例1所述获得的细胞铺板于48孔板(康宁公司(Corning)中的XVIVO15培养基(龙沙集团(Lonza))中,所述培养基补充有浓度为10微摩尔的LATS抑制剂(如在下表2和3中列出的)或补充有DMSO中作为阴性对照。将细胞在37℃在5%CO2中培养。
对于每种化合物,产生了两组培养物。在从角膜分离的细胞已附着于细胞培养皿上后(通常在细胞铺板后24小时),在室温下将第一组培养物在4%PFA中固定20分钟。在培养两次传代后,在室温下将第二组培养物在4%PFA中固定20分钟。当细胞达到90%-100%融合时传代。
为了观察扩增的细胞群表达p63α,通过免疫组织化学如下测量。透化固定的细胞培养物并在0.3%Triton X-100(西格玛-奥德里奇公司(Sigma-Aldrich))和3%驴血清于PBS中的封闭溶液中封闭30分钟。然后在封闭溶液中于4℃用第一抗体标记细胞12小时。使用的第一抗体是来自细胞信号传导公司(Cell Signalling)的p63α。将样品在PBS中洗涤3次,然后在室温下施加1:500稀释度的驴产生的第二抗体Alexa Fluor 488(分子探针公司(Molecular Probes))30分钟。然后在室温下在0.5微摩尔Sytox Orange(赛默飞世尔公司(ThermoFisher))的PBS溶液中标记细胞核5分钟。
为了评估p63α阳性细胞的百分比,计数被抗p63α抗体标记的细胞数目,并通过计数被Sytox Orange染色的细胞核的数目来确定细胞总数。然后通过计算也表达p63α的Sytox-orange阳性核的百分比来确定p63α阳性细胞的比例。
为了评估细胞扩增比率,使用Zeiss LSM 880共聚焦显微镜对细胞核进行计数。然后通过计算细胞的扩增群与接种细胞的群的比率来确定扩增系数。
下表中的结果表明,LATS抑制剂能够实现细胞群扩增。在存在LATS抑制剂的情况下,57%至97%的细胞表达p63α阳性表型。
表2
表3
在以下示例中,通过CRISPR介导的β-2-微球蛋白基因缺失,从HEK293表面消除了HLA I类表达。
靶向B2M的指导RNA(gRNA)从Dharmacon(Lafayette,科罗拉多州)获得(表4中的序列1-5)。还设计了另外的七个gRNA(表4中的6-12)。表5显示了每个gRNA ID的PAM序列、靶序列位置、与gRNA靶向结构域相对应并与B2M基因中靶序列互补的B2M基因序列。表6代表sgRNA的序列。使用脂质转染方法如下测试这些gRNA(SEQ ID NO 108-119)降低或消除HEK293细胞中B2M表达的能力
表4
表5
PAM=原型间隔子邻近基序;gRNAs 1-5来自Dharmacon
表6
脂质转染:
转染前一天,将500'000个HEK293细胞(ATCC,马纳萨斯,弗吉尼亚州)铺板在35mm皿中,并在DMEM/10%FBS中生长。第二天,将细胞用tracrRNA-gRNA-Cas9 mRNA的混合物转染。制备10微摩尔的储备液:将20纳摩尔的gRNA和20纳摩尔的tracrRNA各自重悬于2000微升10毫摩尔Tris缓冲液pH7.4中。此外,将Cas9 mRNA预稀释为1:10:将10微升1微克/微升Cas9 mRNA添加至90微升10毫摩尔Tris缓冲液pH7.4中。
为了获得用于35mm皮氏培养皿(Petri dish)大小的混合物,将12.5微升的10微摩尔tracrRNA(Dharmacon,目录号U-002000-20)、12.5微升的10微摩尔的靶向人B2M的gRNA(表4;SEQ ID NO:108-119)、50微升的0.1微克/微升Cas9 mRNA(Dharmacon,目录号CAS11195)、和15微升DharmaFECT Duo转染试剂(Dharmacon,目录号T-2010-02)组合并在室温下孵育20分钟。将混合物逐滴添加到培养皿中的2.5ml DMEM/10%FBS培养基中。单独的转染试剂代表转染阴性对照。
在37℃下在5%CO
FACS分析:将HEK293细胞用Accutase(赛默飞世尔公司(ThermoFisher),目录号A1110501)在5%CO2中在37℃下处理20分钟。通过使用含有10%血清的细胞培养基终止反应,并转移至falcon管中进行离心步骤(1000rpm,5分钟)。吸出培养基后,将细胞重悬于200微升FACS缓冲液(PBS/10%FBS)中。
为了分析B2M和HLA-ABC的表达,分别将5微升APC小鼠抗人β2-微球蛋白抗体(博奇公司(Biolegend),目录号316312)和20微升PE小鼠抗人类HLA-ABC抗体(BD生物科学公司(BD Biosciences),目录号560168)添加至细胞悬浮液中,并在冰上孵育30分钟。在进行抗体标记后用FACS缓冲液将细胞洗涤3次,并重悬于500微升的FACS缓冲液中。
将每个样品转移至圆底96孔板的一个孔中,并在BD LSRFortessa X-20装置上进行分析。使用BD FACSDiva软件分析FACS数据。
结果示出在下表7中。
表7
在以下示例中,通过CRISPR介导的β-2-微球蛋白基因缺失,从LSC表面消除了HLAI类表达。
使用核转染方法如下测试sgRNA ID SEQ NO 120降低或消除LSC中B2M表达的能力。
核转染:
将第0代的LSC用TryLE
使用手动移液器吸出上清液以避免细胞损失,并将细胞重悬于干细胞核转染溶液II(龙沙集团(Lonza),目录号VPH-5022)中。在添加Cas9蛋白:sgRNA混合物之前,立即将细胞重悬在核转染溶液中。制备了100μM(3.23μg/μl)的储备液:将5.1纳摩尔的单指导RNA(sgRNA)重悬于51μl 10mM Tris缓冲液pH7.4中。为了获得核转染混合物,将8μg高浓度(≥5μg/μl)Cas9蛋白(如下所示)(体积=1.6μl)与16.2μg sgRNA和表4中靶向1-CR004366序列的序列(如下所示,SEQ ID NO:120)(体积=5μl)的组合混合在一起并在室温下孵育20分钟以形成Cas9蛋白-sgRNA复合物。使用1:10的摩尔比(50pmol Cas9蛋白:500pmol sgRNA)。
Cas9蛋白质(SEQ ID NO:107)
sgRNA(SEQ ID NO:120)
GAGUAGCGCGAGCACAGCUAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU
将Cas9蛋白-sgRNA复合物添加到细胞悬浮液中,并立即转移到电穿孔比色杯中。使用核转染装置(龙沙集团(Lonza),Amaxa Nucleofector II)和程序A023转染细胞。核转染后,将细胞从比色皿转移到48孔synthemax包被的板中的一个孔中,所述板包含预热的LSC培养基,所述培养基包括3μM LATS抑制剂和10μM Rock抑制剂Y-27632(Nature[自然]1997,第389卷,第990-994页)。将LSC在5%CO2的培养箱中孵育约5天,直到细胞融合90%。
FACS分析:
将LSC用TryLE
为了分析B2M和HLA-ABC的表达,分别将5μl APC小鼠抗人β2-微球蛋白抗体(博奇公司(Biolegend),目录号316312)和20μl PE小鼠抗人类HLA-ABC抗体(BD生物科学公司(BDBiosciences),目录号560168)添加至细胞悬浮液中,并在冰上孵育30分钟。
每种颜色使用同种型对照的相同量和孵育时间(5μl博奇公司(Biolegend)APC小鼠IgG1,κ同种型对照(FC)抗体#316311和20μl BD生物科学公司(BD Biosciences)PE小鼠IgG1,κ同种型对照#555749)来设置稍后FACS中阴性对照门控。在进行抗体标记后用FACS缓冲液将细胞洗涤3次,并重悬于500μl的FACS缓冲液中(取决于细胞数)。在FACS分选之前,将细胞通过70μm的过滤器过滤,并保存在冰上直至分选。
为了防止细胞粘附在壁上,在分选之前将收集管充满FACS缓冲液30分钟,并在添加收集培养基之前抽出。使用包含化合物的人血清富集的LSC培养基,在BD FACSAria II仪器上将细胞分选到准备好的收集管中。使用BD FACSDiva软件和FlowJo软件分析FACS数据。
结果证实,约有70%的经sgRNA SEQ ID NO:120进行CRISPR编辑的细胞不表达B2M并消除了角膜缘干细胞的细胞表面的HLA I表达(图3)。
LSC/T-细胞反应测定:
在平底96孔synthemax包被的板中一式两份进行LSC/T细胞测定,并在5%CO2中在37℃下孵育10天。将补充有HEPES(100μM)、非必需氨基酸(10x)、丙酮酸钠(10mM)、2-巯基乙醇(10x)、10%FBS和1%青霉素-链霉素((生命技术公司(Life Technologies)Gibco)的RPMI-1640作为培养基用于共培养。可替代地,补充有HEPES(10mM)、非必需氨基酸(1x)、丙酮酸钠(1mM)、2-巯基乙醇(1x)、10%FBS和1%青霉素-链霉素((生命技术公司(LifeTechnologies)Gibco)的RPMI-1640作为培养基用于共培养。
共培养前一天,将LSC(刺激细胞)传代并培养至约70%融合(30'000-50'000细胞),然后用包含化合物的LSC培养基进行培养。在第二天,使用Ficoll-Paque方法(GE医疗集团生命科学部(GE Healthcare Life Sciences),目录号17-1440-03),使用EDTA血液分离外周血单核细胞(PBMC)。PBMC分离后,使用CD8+T细胞分离试剂盒(美天旎公司生物技术公司(Miltenyi Biotec),目录号130-096-495)从所有其他细胞群中分离CD8+细胞。将具有1-10x10^6个CD8+细胞的细胞悬浮液用1μM CellTrace Violet(英杰公司(Invitrogen),目录号C34557)染色,并在黑暗中于37℃孵育20分钟。孵育后,将2ml冰冷的热灭活的FBS添加到每个5ml细胞悬浮液中,并将细胞在37℃另外孵育5分钟。用培养基洗涤3个步骤后,将染色的CD8+细胞稀释至每孔100'000个细胞的终浓度,并在洗去LSC培养基后向每个含有LSC的孔中添加100μl CD8+细胞稀释液。对于阳性对照,将染色的CD8+细胞在预包被10μg/ml抗人CD3+(e生物科学公司(eBioscience),目录号16-0037-85)孔中孵育,孔包括稀释的3μg/ml抗人CD28(e生物科学公司(eBioscience),目录号16-0289-85)。使用仅具有培养基的染色的CD8+细胞的一个单独的重复样品作为阴性对照。
10天后,将CD8+细胞转移至U型底96孔板,并使用包括MACS BSA储备液(美天旎公司生物技术公司(Miltenyi Biotec),目录号130-091-376)的autoMAC漂洗溶液(美天旎公司生物技术公司(Miltenyi Biotec),目录号130-091-222)洗涤3次。在BD LSRFortessa X-20上测量细胞。使用BD FACSDiva软件和FlowJo软件分析FACS数据。
图4显示了与来自4个不同供体的CD8+T-细胞共培养的基因编辑的角膜缘干细胞(LSC)。在所有4个供体中,与B2M/HLA I类阴性LSC(其用sgRNA SEQ ID NO:120进行了CRISPR编辑)共同培养的T细胞免疫应答几乎被完全消除。
实例8:筛选sgRNA降低或消除LSC中B2M表达以及消除角膜缘干细胞的细胞表面的HLA I表达的效率
角膜缘干细胞的分离和培养:
将按实例1所述获得的细胞铺板于10cm synthemax包被的皮氏培养皿(Petridish)中的角膜缘上皮细胞培养基(DMEM F12,补充有10%人血清和1.3mM氯化钙)中,其中补充有3μM LATS抑制剂化合物和10μM Rock抑制剂Y-27632(Nature[自然]1997,第389卷,第990-994页)。在这些条件下,将细胞在5%CO2中于37℃下培养24-48小时。
用选定的gRNA(表6)对LSC进行核转染,然后进行FACS分析/MACS分离。
在LSC中进行sgRNA筛选(SEQ ID NO 120和160-177)的核转染方法如下:将第3代的LSC用TryLETMExpress Enzym(赛默飞世尔公司(ThermoFisher),目录号12605010)在5%CO2中在37℃下胰蛋白酶化15分钟。刮下细胞后,通过使用含有10%血清的细胞培养基终止反应,并转移至falcon管中。使用Vi-cell计数细胞后,通过在单个试管中转移300'000个细胞并以1000rpm离心5分钟来制备每个反应300'000个细胞。使用手动移液器吸出上清液以避免细胞损失,并将细胞重悬于干细胞核转染溶液II(龙沙集团(Lonza),目录号VPH-5022)中。在添加Cas9 RNP:sgRNA混合物之前,立即将细胞重悬在核转染溶液中。为了获得核转染混合物,将5μg的高浓度(≥5μg/μl)具有SEQ ID NO:106的Cas9蛋白(体积=0.78μl)与19.5μg表6的sgRNA(体积=12.2μl)混合,并在室温下孵育20分钟。使用约1:20的摩尔比(31.5pmol Cas9RNP:605pmol sgRNA)。将Cas9蛋白-指导RNA复合物添加到细胞悬浮液中,并立即转移到电穿孔比色杯中。使用核转染装置(龙沙集团(Lonza),Amaxa NucleofectorII)和程序A023转染细胞。核转染后,将细胞从比色皿转移到24孔synthemax包被的板中的一个孔中,所述板包含预热的LSC培养基,所述培养基包括3μM LATS化合物和10μM Rock抑制剂Y-27632(Nature[自然]1997,第389卷,第990-994页)。将LSC在5%CO2的培养箱中孵育约3天,直到细胞融合90%。
FACS分析:
将LSC用TryLE
为了分析B2M和HLA-ABC的表达,分别将5μl APC小鼠抗人β2-微球蛋白抗体(博奇公司(Biolegend),目录号316312)和20μl PE小鼠抗人类HLA-ABC抗体(BD生物科学公司(BDBiosciences),目录号560168)添加至细胞悬浮液中,并在冰上孵育30分钟。
每种颜色使用同种型对照的相同量和孵育时间(5μl博奇公司(Biolegend)APC小鼠IgG1,κ同种型对照(FC)抗体#316311和20μl BD生物科学公司(BD Biosciences)PE小鼠IgG1,κ同种型对照#555749)来设置稍后FACS中阴性对照门控。在进行抗体标记后用FACS缓冲液将细胞洗涤3次,并重悬于200μl的FACS缓冲液中(取决于细胞数)。
使用BD FACSDiva软件和FlowJo软件分析FACS数据。
下表8中显示了核转染后LSC中B2M敲除效率的结果。
表8.
实例9:sgRNA降低或消除LSC中B2M表达以及消除角膜缘干细胞的细胞表面的HLAI表达的效率B2M阴性LSC的FACS和MACS
如实例8中所述进行角膜缘干细胞的分离和培养。
选择用于中靶/脱靶分析的sgRNA的核转染:
将第3代的LSC用TryLE
使用手动移液器吸出上清液以避免细胞损失,并将细胞重悬于干细胞核转染溶液II(龙沙集团(Lonza),目录号VPH-5022)中。在添加Cas9 RNP:sgRNA混合物之前,立即将细胞重悬在核转染溶液中。
为了获得核转染混合物,将10μg高浓度(≥5μg/μl)Cas9蛋白(体积=1.56μl;SEQID NO:106)与40.2μg sgRNA(体积=25μl;sgRNA序列示于表6:SEQ ID NO 120、162、164、166、167、171、173、175)混合,并在室温下孵育20分钟。使用1:20的摩尔比(62.5pmolCas9RNP:1250pmol sgRNA)。
将Cas9蛋白-指导RNA复合物添加到细胞悬浮液中,并立即转移到电穿孔比色杯中。使用核转染装置(龙沙集团(Lonza),Amaxa Nucleofector II)和程序A023转染细胞。核转染后,将细胞从比色皿转移到12孔synthemax包被的板中的一个孔中,所述板包含预热的LSC培养基,所述培养基包括3μM LATS化合物和10μM Rock抑制剂Y-27632(Nature[自然]1997,第389卷,第990-994页)。将LSC在5%CO2的培养箱中孵育约3天,直到细胞融合90%。
FACS:
将LSC用TryLETMExpress Enzym(赛默飞世尔公司(ThermoFisher),目录号12605010)在5%CO2中在37℃下处理15分钟。刮下细胞后,通过使用含有10%血清的细胞培养基终止反应,并转移至falcon管中进行离心步骤(1000rpm,5分钟)。吸出培养基后,将细胞重悬于200μl FACS缓冲液(PBS/10%FBS)中。
为了分析B2M和HLA-ABC的表达,分别将2.5μl APC小鼠抗人β2-微球蛋白抗体(博奇公司(Biolegend),目录号316312)和10μl PE小鼠抗人类HLA-ABC抗体(BD生物科学公司(BD Biosciences),目录号560168)添加至细胞悬浮液中,并在冰上孵育30分钟。
每种颜色使用同种型对照的相同量和孵育时间(2.5μl博奇公司(Biolegend)APC小鼠IgG1,κ同种型对照(FC)抗体#316311和10μl BD生物科学公司(BD Biosciences)PE小鼠IgG1,κ同种型对照#555749)来设置稍后FACS中阴性对照门控。在进行抗体标记后用FACS缓冲液将细胞洗涤3次,并重悬于300μl的FACS缓冲液中。通过FACS分析了标记的LSC(约15'000LSC)的小等份样品,以确认核转染后B2M敲除。使用BD FACSDiva软件和FlowJo软件分析FACS数据。
为了获得纯化的B2M阴性LSC培养物,使用MACS对抗体标记的LSC的第二且更大的部分进行分选,以将B2M阴性与B2M阳性分离。
核转染后LSC中B2M敲除效率的结果如图5所示。核转染后消除角膜缘干细胞的细胞表面的HLA I表达的效率如图6所示。
MACS:
为了获得纯化的B2M阴性LSC培养物,使用MACS对抗体标记的LSC的第二且更大的部分进行分选,以将B2M阴性与B2M阳性分离。
如上所述用B2M和HLA-ABC抗体标记LSC后,通过添加2ml MACS缓冲液(美天旎公司生物技术公司(Miltenyi Biotec),目录号130-091-222)终止反应,并以1000rpm离心5分钟。对于每一步,MACS缓冲液始终补充3μM LATS抑制剂化合物、10μM Rock抑制剂Y-27632(Nature[自然]1997,第389卷,第990-994页)和BSA(美天旎公司生物技术公司(MiltenyiBiotec),目录号130-091-376)。
吸出上清液后,将细胞重悬于80μl MACS缓冲液中,并向细胞悬浮液中添加10μl抗APC微珠(美天旎公司生物技术公司(Miltenyi Biotec),目录号130-090-855)和10μl抗PE微珠(美天旎公司生物技术公司(Miltenyi Biotec),目录号130-048-801)。在黑暗中在冰箱中将包含抗体标记的LSC的磁珠孵育15分钟。孵育后,通过添加2ml MACS缓冲液洗涤细胞,并以1000rpm离心5分钟。吸出上清液后,添加500μl MACS缓冲液。
为了准备用于将B2M阳性阴性LSC与B2M阳性LSC分离的LS柱(美天旎公司生物技术公司(Miltenyi Biotec),目录号130-042-401),将LS柱放在磁体装置(美天旎公司生物技术公司(Miltenyi Biotec),Quadro磁体)上,并用3ml MACS缓冲液洗涤。流过液被丢弃。
将细胞悬浮液施用于柱顶,并在单独的15ml falcon管中收集流过液以收集B2M阴性LSC。一旦所有细胞悬浮液都在流过液级分中,将3ml MACS缓冲液应用的柱上。当柱储存器为空时,通过添加新的MACS缓冲液将所述步骤重复3次。将B2M阴性LSC级分以1000rpm离心5分钟。吸出上清液后,将B2M阴性LSC重悬于LSC培养基中,所述培养基包括3μM LATS抑制剂化合物和3μM Rock抑制剂Y-27632(Nature[自然]1997,第389卷,第990-994页),并铺板于48synthemax包被平板的1个孔中。在8-21天后(取决于细胞扩增),在5%CO2中在37℃下用TryLE
图7和8显示了FACS数据,其检测基因编辑的角膜缘干细胞上的B2M和HLA-ABC表面蛋白,这些角膜缘干细胞在核转染后经MACS处理以获得B2M/HLA-ABC阴性LSC培养物。所有测试的sgRNA均显示纯的(约99%-100%)B2M/HLA-ABC阴性LSC培养物。
实例10:gRNA特异性的表征和CRISPR/Cas9介导的脱靶编辑事件的分析
使用生化方法(例如,Cameron等人,Nature Methods.6,600-606;2017)确定由Cas9和选定的B2M指导物切割的潜在脱靶基因组位点。使用所述测定法测试显示B2M插入/缺失活性的指导物的潜在脱靶基因组切割位点。在所述实验中,使用从男性人外周血单核细胞(PBMC)纯化的基因组DNA以及具有已知脱靶谱的对照指导,筛选了11种靶向人B2M的sgRNA。表10显示了在生化测定中使用64nM指导物浓度检测到的潜在脱靶位点的数量。分析的结果是,选择了若干种gRNA来分析角膜缘干细胞中潜在的脱靶活性。
角膜缘干细胞中脱靶活性检测:
在基因组编辑的扩增的LSC中,使用靶向PCR和NGS对上述鉴定的潜在CRISPR/Cas9介导的切割位点进行了评估。
在编辑和未编辑的细胞中通过扩增子测序进一步分析选择的sgRNA(SEQ ID NO:120、162、166、167、171和175)。每个指导物的潜在脱靶位点侧翼的引物用于通过NGS分析在编辑的LSC和未编辑的外周血单核细胞中检测插入/缺失。进一步分析具有(1)已编辑和未编辑细胞之间的平均插入/缺失百分比差异大于0.5%;或(2)已编辑和未编辑的插入/缺失之间小于0.05的p值的位点。针对假定的Cas9切割位点附近的特征插入/缺失模式,评估了此类位点的NGS序列读数。
根据结果,我们可以评估gRNA的特异性及其在治疗应用中的适用性。
结果:
gRNA的中靶和脱靶结果如下所示。表10的所有sgRNA通过生化测定进行了分析,选择的结果进一步通过扩增子测序进行了分析。NGS结果显示,B2M sgRNA(SEQ ID NO:120、162、166、167、171、和175)在纯化的LSC群中可实现约99%的插入/缺失。在NGS结果中,在任何sgRNA(SEQ ID NO:120、162、166、167、171和175)情况下,没有预测位点对于脱靶活性被测试为阳性。对于SEQ ID NO:120,对69个脱靶基因座中的64个进行了测序,并在LSC中鉴定到零个对于脱靶活性经验证的插入缺失。对于SEQ ID NO:162,对92个脱靶基因座中的88个进行了测序,并在LSC中鉴定到零个对于脱靶活性经验证的插入缺失。对于SEQ ID NO:166,对62个脱靶基因座中的60个进行了测序,并在LSC中鉴定到零个对于脱靶活性经验证的插入缺失。对于SEQ ID NO:167,对35个脱靶基因座中的35个进行了测序,并在LSC中鉴定到零个对于脱靶活性经验证的插入缺失。对于SEQ ID NO:171,对29个脱靶基因座中的28个进行了测序,并在LSC中鉴定到零个对于脱靶活性经验证的插入缺失。对于SEQ ID NO:175,对48个脱靶基因座中的46个进行了测序,并在LSC中鉴定到零个对于脱靶活性经验证的插入缺失。
表10.脱靶分析
ND:无数据
除非另外指明,否则没有详细地具体描述的所有方法、步骤、技术和操作可以并且已经按照本身已知的方式进行,这应是技术人员所清楚的。再次对例如本文提及的标准手册和普通背景技术和其中引用的另外的参考文献进行引用。除非另外指明,否则本文引用的每个参考文献都通过引用以其全文而并入。
本发明的权利要求是非限制性的并且提供于下文中。尽管在此已经详细披露了具体实施例和权利要求,但是这仅是出于说明的目的以举例方式来进行的,并且这并不旨在对所附权利要求的范围或任何相应的未来申请的权利要求主题的范围加以限制。具体而言,本发明人考虑到,在不脱离如由权利要求定义的本披露的精神和范围的情况下,可以对本披露进行多种替代、改变和修饰。核酸起始材料、感兴趣的克隆或文库类型的选择被认为对于具有在此所述的实施例的知识的本领域普通技术人员而言是常规的。其他实施例、优点和修饰被认为落入下列权利要求的范围内。本领域的技术人员仅使用常规实验就将认识到或能够确定本文所述的本发明这些具体实施例的许多等效形式。
- 用于眼细胞疗法的方法和组合物
- 用于癌症的过继性细胞疗法的组合物和方法
