一种类在体心脏器官芯片及方法
文献发布时间:2023-06-19 11:40:48
技术领域
本发明属于微机电工程和生物医学技术领域,具体涉及一种类在体心脏器官芯片及方法。
背景技术
这里的陈述仅提供与本发明相关的背景技术,而不必然地构成现有技术。
在全球范围内,心脏机能障碍诱发的心血管病死亡占总死亡人数的33%,占居全球死亡人数的首位。
目前,现有的心肌收缩力(或应力)检测微纳传感器件有以下几种:
电阻抗法(Electrical impedance)是由Gievar等提出,该方法将心肌细胞种植在叉指微电极阵列芯片,细胞在跳动过程中引起细胞底部与电极上表面之间的距离变化,从而获得阻抗(电阻与电容)的变化,但该方法忽略了心肌细胞收缩力的产生不仅仅与收缩位移相关。
微悬臂梁法(Micro-cantilever)可通过激光束探测心肌收缩引起的挠度变化,实现以力或应力为直接物理量测定心肌细胞的收缩。这种装置需要集成激光束在悬臂梁的背侧,由于热量累积可能会对细胞正常代谢过程造成潜在影响。
细胞鼓(Cell drum)也是一类用于检测心肌收缩行为的微纳器件。它是基于MEMS工艺制备硅基柔性薄膜,同时集成封装激光和压力传感器。这种方法的一种缺陷是,腔体内部难以封装成密闭空间,导致获得信号的信噪比小于3。
微柱阵列(Micropost array)和牵引力显微镜(Traction force microscopy)技术都是通过图像算法分离位移的变化,实现收缩应力的检测。这两种技术通常用于单个心肌细胞的测试。然而,心脏内部心肌细胞之间不是孤立的,其内部的细胞通讯机制来协调心脏的同一跳动。这两种方法在多个细胞同时检测方面需要提升。
基于以上分析,迫切需要构造一种集成多类细胞培养、贴近在体心肌功能、具备动作电位与收缩同时监测的心脏器官芯片。
发明内容
针对现有技术存在的不足,本发明的目的是提供一种类在体心脏器官芯片及方法,该器官芯片可贴近在体心肌生存微环境,并可同时监测收缩行为、电生理行为,并集成电刺激与机械刺激一体。
为了实现上述目的,本发明是通过如下的技术方案来实现:
第一方面,本发明的实施例提供了一种类在体心脏器官芯片,包括基底装置、培养液灌流装置,基底装置表面设置PDMS薄膜,PDMS薄膜顶部设置培养液灌流装置以模拟血液流动的情况;
所述基底装置包括基底,基底表面设置PDMS模具,PDMS模具具有微气通道;
所述PDMS薄膜包括悬空薄膜,悬空薄膜设置应变传感部件、感应电极与刺激电极。
作为进一步的技术方案,所述微气通道包括多个管状通道和多个柱状通道,管状通道和柱状通道依次交替设置,且相邻管状通道、柱状通道之间连通。
作为进一步的技术方案,所述微气通道一端设置进气口,微气通道设置进气口的一端插入软管。
作为进一步的技术方案,所述悬空薄膜贴附于基底装置表面设置。
作为进一步的技术方案,所述应变传感部件采用压阻传感器,压阻传感器由CNT与PDMS形成。
作为进一步的技术方案,所述感应电极与刺激电极均间隔设定距离设置于悬空薄膜两侧,感应电极、刺激电极均成对对称设置。
作为进一步的技术方案,所述培养液灌流装置包括运输营养液的沟道与柱形细胞培养装置,柱形细胞培养装置设置多个,多个柱形细胞培养装置均与沟道连通,沟道具有进液口和出液口。
第二方面,本发明实施例还提供了一种如上所述的类在体心脏器官芯片的制备方法,包括以下步骤:
含微气通道的基底装置制备:在氧等离子处理过的硅片上旋涂一层SU-8负性光刻胶,真空干燥冷却至室温;将含有沟道且等间隔设有圆孔的掩模版与涂覆硅片接触并紫外曝光;通过加热曝光晶片进行热处理;将曝光后的硅片在显影液中浸渍,用水漂洗和空中干燥而显影出微沟道与圆柱;将PDMS涂覆在显影后的硅片上,在固化后剥离,获得PDMS模具;通过等离子键合技术,将PDMS模具与基底石英玻璃封接;
PDMS薄膜制备:在亚克力板上旋涂一层PDMS薄膜,在固化后剥离,并贴附于含微气通道的基底装置表面,形成悬空薄膜;将CNT与PDMS充分搅拌,用丝网印方法将未固化的CNT-PDMS共混物涂在悬空薄膜表面,烘烤设定时间,形成感应形变的压阻传感器;
培养液灌流装置制备:运输营养液的沟道与柱形细胞培养装置是由PDMS灌入铝模具后固化而来。
作为进一步的技术方案,在沟道一端打孔,插入软管。
作为进一步的技术方案,通过丝网印在距离悬空薄膜设定距离处,对称制备感应电极与刺激电极;并对类在体心脏器官芯片进行机械刺激并联合脉冲矩形电刺激的周期性刺激。
上述本发明的实施例的有益效果如下:
本发明的器官芯片,基底装置的PDMS模具设置的微气通道可贯通气体,从而实现机械刺激;培养液灌流装置可实现多类细胞共培养,PDMS薄膜可实现心肌收缩应力与电生理同测,并通过刺激电极的设置可以进行电刺激;本发明的芯片可贴近在体心肌生存微环境,并可同时监测收缩行为、电生理行为,并集成电刺激与机械刺激一体,实现对心脏器官芯片的研究。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
图1是本发明根据一个或多个实施方式的器官芯片示意图;
图2是本发明根据一个或多个实施方式的基底装置的制备流程图;
图中:为显示各部位位置而夸大了互相间间距或尺寸,示意图仅作示意使用;
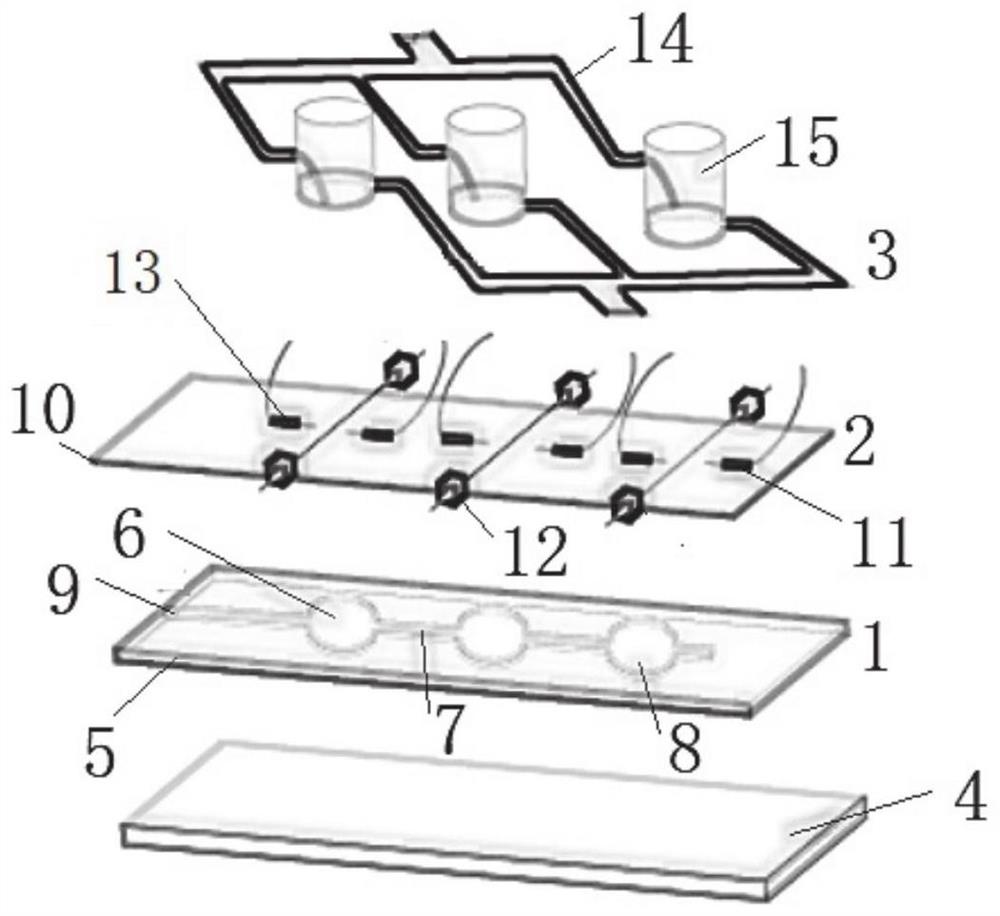
其中,1基底装置,2 PDMS薄膜,3培养液灌流装置,4基底,5 PDMS模具,6微气通道,7管状通道,8柱状通道,9进气口,10悬空薄膜,11感应电极,12应变传感部件,13刺激电极,14沟道,15柱形细胞培养装置。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本发明使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非本发明另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合;
为了方便叙述,本发明中如果出现“上”、“下”、“左”、“右”字样,仅表示与附图本身的上、下、左、右方向一致,并不对结构起限定作用,仅仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的设备或元件必须具有特定的方位,以特定的方位构造和操作,因此不能理解为对本发明的限制。
术语解释部分:本发明中如出现术语“安装”、“相连”、“连接”、“固定”等,应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或为一体;可以是机械连接,也可以是电连接,可以是直接连接,也可以是通过中间媒介间接相连,可以是两个元件内部连接,或者两个元件的相互作用关系,对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明的具体含义。
正如背景技术所介绍的,现有技术中存在不足,为了解决如上的技术问题,本发明提出了一种类在体心脏器官芯片及方法。
本发明的一种典型的实施方式中,如图1所示,提出一种类在体心脏器官芯片,其可贴近在体心肌生存微环境,可同时监测收缩行为、电生理行为、集成电刺激与机械刺激一体。
本发明的器官芯片主要基于柔性透明的PDMS材料制备,其主要分为三个部分:含微气通道的基底装置1、可嵌入CNT的PDMS薄膜2、培养液灌流装置3。
基底装置1集成机械刺激,培养液灌流装置3可实现多类细胞共培养,PDMS薄膜2可实现心肌收缩应力与电生理同测及其电刺激。
其中,基底装置1表面设置PDMS薄膜2,PDMS薄膜2顶部设置培养液灌流装置3以模拟血液流动的情况。
具体的,基底装置1包括基底4,基底4表面设置PDMS模具5,PDMS模具5内部设置微气通道6,用于贯通气体,实现机械刺激。
本实施例中,基底4可以采用石英玻璃。
微气通道6包括多个管状通道7和多个柱状通道8,管状通道7和柱状通道8依次交替设置,且相邻管状通道、柱状通道之间连通,微气通道一端设置进气口9,微气通道的进气口与气源连通,向微气通道内注入气体进行机械刺激。
进一步的方案中,微气通道一端可插入对应尺寸的特氟龙软管,由特氟龙软管向内输入气体。
具体的,PDMS薄膜2包括悬空薄膜10,悬空薄膜10设置应变传感部件12、感应电极11与刺激电极13;
其中,悬空薄膜10贴附于基底装置表面设置。
应变传感部件12采用压阻传感器,压阻传感器由CNT与PDMS形成。
感应电极11与刺激电极13均间隔设定距离设置于悬空薄膜两侧,感应电极、刺激电极均成对对称设置。
在本实施例中,感应电极、刺激电极设置在距离悬空薄膜2mm处,感应电极设置4个,刺激电极设置2个。其中,感应电极为条形,宽度为100μm、长度为1mm;刺激电极为圆形,直径为500μm。
具体的,培养液灌流装置3包括运输营养液的沟道14与柱形细胞培养装置15两部分组成。
其中,柱形细胞培养装置15设置多个,其为圆柱形,多个柱形细胞培养装置均与沟道14连通,沟道具有进液口和出液口;由沟道的进液口向柱形细胞培养装置内提供细胞培养液,进行细胞培养液灌流;多个沟道的出液口与输液管汇合相连,用于排出代谢产物。
沟道14与柱形细胞培养装置15两部分都是由PDMS灌入铝模具后固化而来,其铝模具用铣削工艺制备。
类在体心脏器官芯片的制备流程主要包括基底装置制备、PDMS薄膜制备、培养液灌流装置制备、机械与电耦合刺激实现四个部分。
具体包括:
(1)含微气通道的基底装置制备:
首先,在氧等离子处理过的硅片上以1500r/min旋涂一层70μm厚的SU-8(3005)负性光刻胶,在140℃下真空干燥30分钟并随后冷却至室温;
然后,将含有宽度为100μm、长度76mm沟道,且等间隔设有直径为5mm圆孔的掩模版与涂覆硅片接触并紫外曝光;
再后,通过在140℃下加热曝光晶片10分钟而进行热处理;将曝光后的硅片在显影液中浸渍10分钟,用水漂洗和空中干燥而显影出微沟道与圆柱;
将PDMS(质量比10:1)涂覆在显影后的硅片上,在60℃烘箱固化后,将其小心剥离,获得PDMS模具;
随后,通过等离子键合技术,将PDMS模具与基底石英玻璃封接。
为实现微通道的气压式机械刺激,可在沟道一端打孔,插入对应尺寸的特氟龙软管。
具体制备流程如图2所示,分为:
A.在硅片表面旋涂一层70μm SU-8负性光刻胶;
B.紫外曝光处理;
C.显影操作;
D.铸模和固化;
E.涂覆PDMS并脱模;
F.等离子键合,将PDMS模具与基底封接;
G.在沟道一端打孔,插入特氟龙软管。
(2)可嵌入CNT的PDMS薄膜制备:主要由应变传感部件、感应电极与刺激电极三部分组成。
首先,以2000r/min的速度在亚克力板上旋涂一层厚度为25μm的PDMS薄膜,在60℃烘箱固化后,小心剥离,并贴附于含微气通道的基底装置表面,形成悬空薄膜;
将重量比为8%的CNT(直径:20-30nm,长度:10-30μm)与PDMS充分搅拌,其中PDMS的固化剂与预聚物的重量比为10%;用丝网印方法将未固化的CNT-PDMS共混物涂在薄膜表面,然后在65℃下烘烤4h,形成感应形变的厚度20μm,宽300μm压阻传感器。
通过前期仿真,确定了当薄膜受到气压时,会在悬空膜区域及薄膜边缘处形成较大形变,为此,检测动作电位的电极与刺激电极应避免放置上述区域。
通过丝网印在距离悬空薄膜2mm处,对称制备4个感应电极与2个电刺激电极。其中,感应电极为条形,宽度为100μm、长度为1mm;刺激电极为圆形,直径为500μm。
(3)培养液灌流装置制备:
培养液灌流装置包括运输营养液沟道与柱形细胞培养装置两部分组成。两部分都是由PDMS(质量比10:1)灌入铝模具后固化而来。铝模具用铣削工艺制备,带有长方体状凸起(高度150μm,宽度为1000μm)与圆柱形凸起(高度150μm,直径为10mm),其中长方体状凸起用以形成运输营养液沟道,圆柱形凸起用以形成柱形细胞培养装置。
(4)机械与电耦合刺激实现:
进行为期7天拉伸形变为10%、频率1Hz的机械刺激,机械刺激通过微气通道施加在PDMS薄膜;并联合频率2.5Hz、场强5V/cm、周期10ms的脉冲矩形电刺激的周期性刺激,电刺激施加在刺激电极。通过耦合刺激可以用于探索机械与电刺激耦合对细胞功能的影响。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种类在体心脏器官芯片及方法
- 一种类器官芯片及其制备方法
