免疫消融疗法
文献发布时间:2023-06-19 11:57:35
技术领域
本发明涉及用于通过免疫消融治疗疾病的组合物。特别地,本发明的组合物可用于治疗由免疫细胞如淋巴细胞介导的疾病。
背景技术
本发明人先前已发现,高浓度的糖皮质激素可用于调节患者以增强细胞免疫疗法如过继性T细胞疗法的功效;在国际专利申请PCT/US2018/025517(作为WO2018/183927公开)中描述。在该申请中,本发明人注意到了与化疗和放疗介导的预调节相关的毒性,所述预调节被认为非选择性地破坏脾的细胞结构。本发明人已经提供了急性剂量的糖皮质激素(类固醇的亚类)和其他无毒淋巴细胞耗竭剂(lymphodepleting agent),以有益于接受细胞免疫疗法的癌症患者。
WO2018/183927指出,高剂量糖皮质激素可引起淋巴组织的消融,以减少细胞免疫疗法与淋巴组织的结合,特别是与淋巴结中生发中心和边缘区以及脾中生发中心和边缘区的结合。WO2018/183927进一步指出,高剂量糖皮质激素也通过生物机制(与支持以化疗剂或放疗进行预调节的细胞毒性机制相反)对外周血淋巴细胞进行淋巴细胞耗竭。
先前对使用类固醇在ACT之前对患者进行预调节的研究表明这种方法无效。Hinrichs(J Immunother.2005年11月-12月;28(6):517-24.)评价了地塞米松作为ACT之前的预调节处理。与全身照射(TBI)相比,Hinrichs证明在第-6天、第-4天和第-2天施用0.8mg/kg的HED淋巴细胞耗竭等同于5Gy TBI。Hinrichs证明在ACT之前第-6天、第-4天和第-2天用10mg/kg(HED 0.81mg/kg)全身腹膜内地塞米松预处理诱导与放射相当的淋巴细胞耗竭,但该预处理没有增强ACT肿瘤杀伤。相反,Hinrichs公开了用放射预处理确实增强ACT肿瘤杀伤。在Hinrichs论文中,据报道地塞米松引起脾淋巴细胞耗竭,如脾细胞减少99%所证明。然而,尽管Hinrichs报道了99%的淋巴细胞耗竭,但没有观察到ACT肿瘤杀伤的增强。相反,Hinrichs观察到放射确实增强ACT肿瘤杀伤。然而,重复Hinrichs报道的淋巴细胞耗竭的实验表明,在第-6天、第-4天和第-2天10mg/kg(HED 0.81mg/kg)腹膜内地塞米松的Hinrichs剂量不能有效对外周血淋巴细胞进行淋巴细胞耗竭。使用Hinrichs剂量,外周血中仅B淋巴细胞受到显著淋巴细胞耗竭,从10680(媒介物对照)到3733活事件(通过CD3-CD19+细胞的流式细胞术测量),减少65%。相反,CD3+T淋巴细胞从3370个减少到2441个活事件,仅非显著减少33%。CD3+CD4+T淋巴细胞从1779个减少到902个活事件,仅非显著减少50%。CD3+CD8_T淋巴细胞从1318个减少到1277个活事件,仅非显著减少3%。CD3+CD4+CD25+FoxP3+Treg从198个减少到70个活事件,仅非显著减少65%。自然杀伤(NK)细胞从1153个减少到958个活事件,仅非显著减少17%。
***
自身免疫是免疫系统异常地对受试者自身成分进行攻击的现象。(在健康受试者中,免疫系统通过建立对受试者自身成分的耐受性来避免破坏性自身免疫反应)。由破坏性自身免疫反应引起的疾病称为自身免疫疾病。不同的自身免疫疾病影响身体的不同部位;这些可以是使人衰弱的(例如在类风湿性关节炎的情况下,其影响关节)神经退行性/神经破坏性的(例如在多发性硬化的情况下),并且在一些情况下(例如糖尿病),与高死亡率相关(Thomas等人,2010)。
自身免疫疾病的发病机理广泛归因于T和B淋巴细胞不适当地识别自身抗原和引发细胞介导的或体液反应,或两者,从而导致炎性组织和血管损伤的关键作用(Sullivan等人,2010;Shlomchik等人,2001)。
自身免疫疾病通常通过长期施用免疫抑制剂如类固醇来治疗。例如,天疱疮患者已经通过每天2小时IV输注100mg地塞米松来治疗3天(Pasricha等人,2008)。该剂量不是淋巴细胞消融性的(lymphoablating)。以这种方式每28天对天疱疮患者进行治疗直至治愈。治愈需要3至12个月。复发率为15%,所有患者均用另一种Dexa治疗缓解。Dexa的剂量为约1-2mg/kg。虽然有助于控制自身免疫疾病和减轻症状,但此类治疗方案不是治愈性的,涉及若干长期副作用和增加的感染风险(Patt等人,2013)。
越来越多地测试淋巴细胞耗竭疗法用于控制免疫损伤。这种疗法的一个吸引人的前提是它可以“重新启动”免疫系统并恢复免疫耐受性(Lu等人,2011)。然而,淋巴细胞耗竭疗法的致耐受性潜力仍然存在争议。通过来自抗胸腺细胞球蛋白(ATG)(一种免疫耗竭药物的原型)研究的冲突证据,特别是关于其是否诱导CD4+CD25+Foxp3+调节性T(Treg)细胞的研究(Lu等人,2011)举例说明了该争论。为了理解ATG在体内克隆水平对T细胞的影响,Lu等人在简化模型中研究了抗小鼠胸腺细胞球蛋白(mATG)的作用,其中T-淋巴细胞库由对生理自身抗原特异的致病性T效应(Teff)细胞的单个克隆组成。mATG处理导致来自其他单克隆Teff库的抗原特异性Treg细胞的外周诱导,而与胸腺参与无关。Treg细胞的从头诱导始终在局部引流淋巴结中发生,并且诱导的Treg细胞在血液中的持久性与长期保护免于自身免疫破坏相关。(Lu等人,2011)因此提供了在免疫耗竭疗法中从致病性自身抗原特异性Teff细胞克隆转化为Treg细胞的体内证据。
***
1型糖尿病(T1D)是一种自身免疫疾病,其逐渐导致分泌胰岛素的β-细胞耗竭,最终导致临床上显著的高血糖症和代谢不稳定性(Atkinson等人,2014)。总体上,T1D占糖尿病的约5%并且影响全世界约2千万个体(Menke等人,2013)。约125万美国人患有T1D,并且估计每年将在美国新诊断出40,000人(American Diabetes Association,Diabetes Care37,2014)。考虑到医疗费用和间接成本(例如收入损失),TD1每年给美国带来144亿美元的经济负担。
治疗性胰岛素和其他基于外部降血糖药的治疗不能治愈T1D,而只是提供控制血液中葡萄糖水平的解决方案。患者仍易受到不稳定的血糖水平以及微血管和大血管糖尿病并发症的发展的影响(Peng等人,2018)。
缺少从糖尿病患者中去除自身免疫底物的安全干预。TD1中的自身免疫包括免疫反应的许多方面(Snarski等人2016;Cantu-Rodriguez等人,2016)。因此,基于使用抗体、融合蛋白、细胞因子、调节性T细胞和小分子抑制剂的抗原特异性免疫疗法仅导致T1D患者一定程度的β细胞保存和血糖水平降低(Kim等人,2013年)。即使组合使用,靶向自身免疫库中特定成分的免疫疗法也不能保证恢复胰岛素不依赖性(Bone等人,2017)。
迄今为止,自体造血干细胞移植(HSCT)是唯一经证实的T1D治愈策略(Voltarelli等人,2007)。自体HSCT作为自身免疫疾病(AD)如多发性硬化、系统性硬化、类风湿性关节炎、系统性红斑狼疮、克罗恩病等的治疗选择已经进行了12年(Swart等人,2017)。这种更强烈和更广泛的免疫方法包括用高剂量免疫抑制进行的“免疫复位”,其包括非特异性消除自身反应性T和B细胞反应,随后进行造血干细胞移植以重建耐受性免疫系统。值得注意的是,在临床试验中,该方法使得高达80%的T1D患者在混合膳食耐受性测试期间经历胰岛素不依赖期,同时具有C肽水平的相关增加(Couri等人,2018)。然而,严重的担忧阻止了采用免疫复位作为T1D的治疗方法。
与HSCT手术相关的风险超过了为T1D提供的积极效果:HSCT仍然与显著毒性和高达3%的死亡率相关(Alexander等人,2018;Pallera等人,2004;Henig等人,2014)。此外,当前的免疫复位方案基于细胞毒性免疫抑制方案(例如化疗、放疗),其将患者暴露于一系列安全问题,包括短期感染风险、急性器官功能障碍和死亡,以及恶性肿瘤和继发性自身免疫疾病的长期风险(Daikeler等人,2012)。
几乎所有用HSCT治疗的T1D患者都恢复使用外源性胰岛素,随后C肽水平降低(Magdalena等人,2018),这是由于预调节(PC)后自身免疫病理生理底物的不完全消融所致(Loh等人,2007)。增加移植调节方案的强度或重复该手术以改善治疗结果将使患者暴露于过度的风险和毒性(Couri等人,2018)。
HSCT与高费用相关,范围从大约80,000美元至300,000美元,这取决于HSCT前给予的调节方案、移植类型和与住院相关的住院费用(Broder等人,2017)。
***
需要对淋巴细胞介导的自身免疫疾病和其他疾病的进一步治疗。需要比HSCT更简单且成本更低的进一步治疗。
发明内容
本发明基于惊人的发现,即高剂量的糖皮质激素可引起外周血淋巴细胞的淋巴细胞耗竭而基本上不影响其他细胞的细胞计数。诸如生发中心消融的其他作用也支持本发明的某些方面。本发明提供了高剂量糖皮质激素激动剂的这些作用的医学应用;用于治疗淋巴细胞介导的疾病。
因此,在第一方面,本发明提供了用于治疗受试者中淋巴细胞介导的疾病的包含糖皮质激素的药物组合物,其中所述治疗包括向患者施用一定剂量的药物组合物,以递送相当于约3-26mg/kg人等效剂量(HED)地塞米松碱的剂量的糖皮质激素。糖皮质激素的剂量可称为‘急性高剂量’。在一些实施方案中,向患者的药物组合物的剂量递送相当于约10-26或约12-26mg/kg人等效剂量(HED)地塞米松碱的剂量的糖皮质激素。药物组合物可(或可不)包含如本文所定义的药学上可接受的载体。药物组合物可(或可不)包含如本文所定义的药学上可接受的防腐剂。药物组合物可(或可不)包含如本文所定义的药学上可接受的螯合剂。然而,在该方面的所有实施方案中,药物组合物确实包含一种或多种选自由以下组成的组的成分:药学上可接受的载体、防腐剂和/或螯合剂。在一些实施方案中,药物组合物还可包含赋形剂。在一些实施方案中,药物组合物包含多于一种药学上可接受的载体。在一些实施方案中,药物组合物包含多于一种药学上可接受的防腐剂。在一些实施方案中,药物组合物包含多于一种药学上可接受的螯合剂。本发明的实施方案可以定义为实现受试者中的全身性淋巴细胞耗竭。
在一些实施方案中,淋巴细胞介导的疾病是自身免疫疾病,例如选自由1型糖尿病、多发性硬化、肌萎缩性侧索硬化、硬皮病、天疱疮和狼疮组成的组的自身免疫疾病。本发明的淋巴细胞耗竭作用支持了这些实施方案的功效。
尽管糖皮质激素在许多自身免疫病症中具有公认的用途(Flammer等人,2011),但它们从未被考虑用于免疫复位。此外,基于在自体细胞移植之前使用药物低剂量以预调节患者的研究显示该方法无效(Medicines Agency;2017)。基于本发明的药物组合物的多种体内作用的复杂作用模式提供了化疗的首次有效替代,其可用作治疗自身免疫病症如糖尿病的安全免疫复位方案。
与本发明相关的几个优点涉及药物组合物的作用,包括(i)非骨髓消融性免疫复位:该药物组合物可以耗竭所有外周血淋巴细胞类型,例如包括负责糖尿病自身免疫的胰岛特异性自身反应性T细胞,但基于特异性受体介导的作用模式而保留中性粒细胞、血小板、RBC和干细胞(HSC和MSC)。因此,本发明降低了感染风险并消除了在免疫复位后对恢复血细胞的HSCT的需要。结果是一种非骨髓消融性方案,其可以进行功效与化疗相当的安全免疫复位。(ii)次级淋巴管中生发中心(GC)和边缘区的减少。药物组合物短暂地消融次级淋巴器官中的生发中心,从而产生高亲和力抗体和长寿命的浆细胞(DeFranco等人,2016)以增加对自身免疫病理生理学底物的功效。(iii)简单的施用模式。药物组合物可以被配制用于口服或静脉内施用途径,使其在数小时内有效,淋巴细胞和GC在7-14天内恢复。首次,完全淋巴细胞耗竭无需住院。(iv)减少复发的机会。与化疗或放疗不同,本发明的药物组合物可以以完全淋巴细胞消融的剂量安全施用,以清除负责复发的记忆T和B细胞。(v)可接受的再施用。在自身免疫病理生理学底物复发的情况下,高剂量糖皮质激素的安全概况将允许重复给药本发明的药物组合物。
本文公开的与本发明相关的这些作用和优点意味着技术人员将理解本发明提供了治疗自身免疫疾病以及本文讨论的其他淋巴细胞介导的疾病的有效策略。
在一些实施方案中,淋巴细胞介导的疾病是残留HIV疾病。在这些实施方案中,如本文所述,受试者淋巴器官中减少数量的生发中心可迫使与这些中心中的龛(nich)结合的残留HIV感染T细胞进入循环,在循环中它们可通过免疫系统或标准疗法被消除。在本公开的背景下,本领域技术人员将理解HIV在病毒感染T淋巴细胞的意义上是淋巴细胞介导的疾病。本发明的淋巴细胞耗竭作用也有助于这些实施方案的功效。
在其他实施方案中,淋巴细胞介导的疾病是淋巴瘤,例如生发中心淋巴瘤(GC淋巴瘤)或边缘区淋巴瘤。在这些实施方案中,如本文所述,受试者淋巴器官中减少数量的生发中心可迫使结合这些中心中的龛的癌细胞(例如生发中心淋巴瘤)进入循环,在循环中它们可通过免疫系统或标准疗法被消除。技术人员将意识到标准癌症疗法包括例如化疗。因此,本文所述的基于糖皮质激素的疗法可与化疗组合使用,优选与强度降低的细胞毒性化疗组合使用(其中当与本文所述的基于高剂量糖皮质激素的疗法组合使用时,化疗的有效剂量小于不使用本文所述的高剂量糖皮质激素的相同化疗的有效剂量)。本发明的淋巴细胞耗竭作用也有助于这些实施方案的功效。在特定的实施方案中,特别设想了伯基特淋巴瘤(BL)的治疗。在非洲,BL治疗围绕三种化疗药物环磷酰胺、长春新碱和甲氨蝶呤(全身和鞘内)的组合。该组合以2周的间隔重复进行,共6个周期,12周(Burkitt’s LymphomaNational Treatment Guidelines.2009)。较低剂量的地塞米松目前在WHO基本药物列表中,然而,现有的WHO列出的地塞米松产品不适合于BL治疗,因为本发明的较高剂量将需要复配小瓶,其可导致污染和患者的严重或致命感染,以及伴随复配达到毒性水平的赋形剂如苯甲醇或对羟基苯甲酸酯。
在其他实施方案中,淋巴细胞介导的疾病是移植物抗宿主疾病(GvHD)。GvHD是接受来自遗传上不同的人的移植组织后的医学并发症。GvHD甚至会在自体移植的情况下发生,最有可能由自体细胞的加工和储存引起,使得移植的细胞随后将身体识别为异物。在GvHD中,保留在供体组织(移植物)中的供体免疫系统的白细胞将受体(宿主)识别为异物(非自身的)。存在于移植组织中的白细胞然后攻击受体的体细胞,这导致此病症。GvHD通常与干细胞移植如骨髓移植时发生的那些相关。GvHD也适用于其他形式的移植组织,如实体器官移植。本发明的淋巴细胞耗竭作用也有助于这些实施方案的功效。
在其他实施方案中,淋巴细胞介导的疾病是过敏性疾病。这包括慢性和急性过敏。例如,本发明的药物组合物可用于治疗哮喘。本发明的淋巴细胞耗竭作用也有助于这些实施方案的功效。
在一些实施方案中,药物组合物包含药学上可接受的载体。在一些实施方案中,药物组合物包含防腐剂和/或螯合剂。在一些实施方案中,药物组合物包含防腐剂。优选地,防腐剂是亚硫酸盐。在一些实施方案中,药物组合物包含螯合剂,其可以是EDTA。
在优选的实施方案中,药物组合物的糖皮质激素包括地塞米松。这可以是地塞米松碱、地塞米松磷酸钠或醋酸地塞米松的形式。最优选地,糖皮质激素是地塞米松磷酸钠。
如上所述和如权利要求所定义,本发明的药物组合物用于治疗淋巴细胞介导的疾病。治疗可包括将药物组合物的剂量作为单一急性剂量施用。或者,治疗包括将药物组合物的剂量作为在约72小时内给予的总剂量施用。
淋巴细胞介导的疾病的治疗包括向需要抗炎、免疫抑制、淋巴细胞消融、生发中心消除、IL-2IL-7IL-12和/或IL-15升高、间充质干细胞升高、G-CSF增加或中性粒细胞增加的患者施用所述组合物。此外,淋巴细胞介导的疾病的治疗可导致PD-1或PD-L1或CTLA-4表达的可检测的变化。
如上所述和如权利要求所定义,本发明的药物组合物用于治疗淋巴细胞介导的疾病,其中所述治疗包括向患者施用一定剂量的药物组合物。药物组合物可以静脉内(IV)或口服施用。当进行静脉内施用时,优选地,该剂量在0.25-2小时内作为单次IV输注施用。输注的组合物可以在生理或半生理盐水或乳酸林格氏液或5%葡萄糖或另一种标准IV流体溶液中。对于口服施用,组合物可以作为与少量果汁或甜味剂混合的单次口服剂量给予。
在优选的实施方案中,药物组合物以糖皮质激素水溶液的形式提供。技术人员将理解,这意味着水用作这些实施方案的药物组合物中的溶剂。
施用根据本发明使用的药物组合物以递送糖皮质激素,其剂量相当于至少约3mg/kg、至少约4mg/kg、至少约5mg/kg、至少约6mg/kg、至少约7mg/kg、至少约8mg/kg、至少约9mg/kg、至少约10mg/kg、至少约11mg/kg、至少约12mg/kg或至少约13mg/kg、或至少约14mg/kg、或至少约15mg/kg、或至少约16mg/kg、或至少约17mg/kg、或至少约18mg/kg、或至少约19mg/kg、或至少约20mg/kg、或至少约21mg/kg、或至少约22mg/kg、或至少约23mg/kg、或至少约24mg/kg、或至少约25mg/kg、或至少约26mg/kg的人等效剂量(HED)的地塞米松碱。药物组合物的剂量可以定义为以相当于从相当于HED的地塞米松碱的剂量范围取得的值的剂量递送糖皮质激素,其中该范围由选自上述值列表的端点定义,例如约10mg/kg-26mg/kg、或约15mg/kg-25mg/kg(或来自上述列表的任两个值)。在优选的实施方案中,受试者是人,糖皮质激素含有地塞米松碱,并且药物组合物以约3.0至约18.0mg/kg地塞米松碱的剂量施用于人受试者。
本领域技术人员将理解,可以使用常规方法来测量本发明实现的淋巴细胞耗竭。例如,CD4+、CD8+、Treg和/或B细胞群体可以在施用药物组合物后测量,例如在其施用后48小时。流式细胞术是可用于进行细胞计数的一种示例性方法。
技术人员将理解,本发明可与本文所述的其他治疗方法、例如化疗和/或基于细胞的疗法联合使用。在这些实施方案中,可以对受试者施用化疗。在这些实施方案中,可以对受试者施用基于细胞的疗法。然而,本发明的大多数实施方案不涉及化疗或基于细胞的疗法。因此,在一些实施方案中,不向受试者施用化疗。在一些实施方案中,不向受试者施用基于细胞的疗法。
本文详细讨论了本发明的作用机制,并且在一些情况下,这些机制可以形成本发明的独特特征的一部分,特别是在所述机制开辟了新的临床状况的情况下(例如,通过允许选择患者亚组作为受试者)。
附图说明
现在将参考附图讨论说明本发明原理的实施方案和实验,其中:
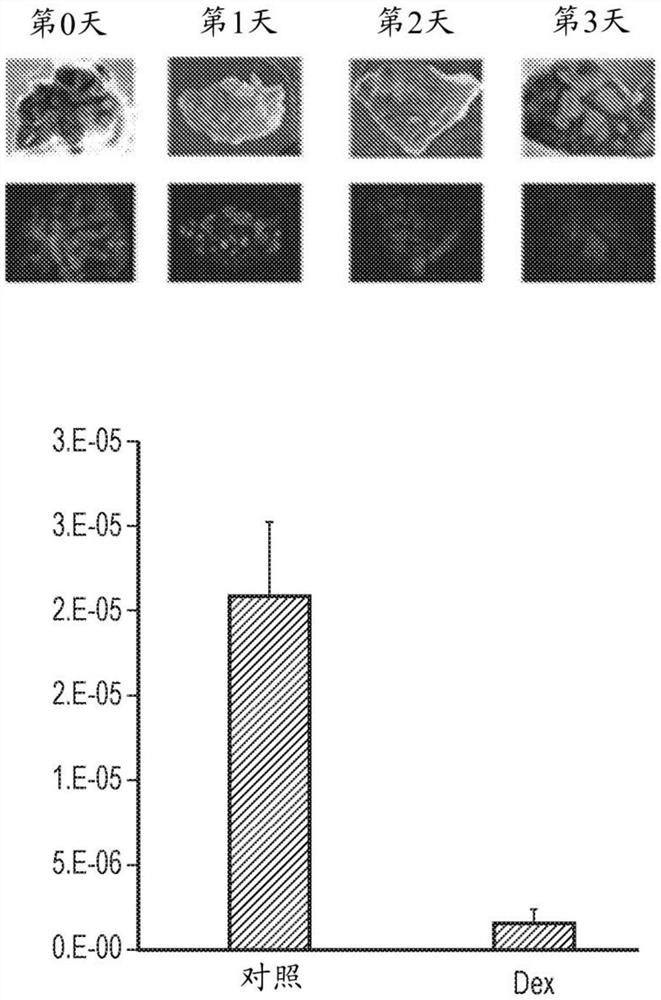
图1.急性高剂量地塞米松消除了小鼠脾和次级淋巴管中的结合龛。显示了用FITC-PNA染色的新鲜厚脾切片的黑白标度明场(顶部)和免疫荧光(底部)图像,以定量来自脾收获前96小时IP施用人等效剂量(HED)9.3mg/kg地塞米松碱的小鼠的生发中心。该图显示了在脾收获前96小时施用IP安慰剂对照和IP HED 9.3mg/kg地塞米松碱的小鼠的每脾面积平均生发细胞计数加平均值标准面积(SEM)的柱形图。对照小鼠具有显著的FITC-PNA免疫荧光,而注射地塞米松的小鼠几乎没有免疫荧光信号。
图2.急性高剂量地塞米松剂量依赖性地消除小鼠脾中的结合龛。显示了用FITC-PNA染色的新鲜厚脾切片的免疫荧光染色测量的平均生发中心染色强度的柱形图。使用阈值和MetaMorph图像分析计算免疫荧光强度。柱为平均值加SEM。在脾收获前48小时向小鼠施用安慰剂、3mg/kg HED、6mg/kg HED、9mg/kg HED或12mg/kg HED地塞米松碱。生发中心减少在HED 6mg/kg下是明显的,并且在9和12mg/kg剂量的HED下显著减少。
图3.急性高剂量地塞米松消除了大鼠脾中的结合龛(MZ:边缘区)。显示了在脾收获前48小时用安慰剂、20mg/kg(HED 3.23mg/kg)、40mg/kg(HED 6.45mg/kg)或80mg/kg(HED12.9 mg/kg)地塞米松碱IV或PO治疗的大鼠的5微米脾切片上测得的边缘区宽度的柱形图。在所有地塞米松剂量下,边缘区面积减少,并且在12.9mg/kg HED下被最大抑制。每组n=5。*p<0.05ANOVA(Dunnett事后分析)相对于媒介物IV;
图4.急性高剂量地塞米松消除了大鼠脾中的结合龛。显示了5微米固定脾切片的BCL-6染色的每个脾的面积作为以每个切片的平均值给出的生发中心数的量度的柱形图。在脾收获前48小时用安慰剂、20mg/kg(HED 3.23mg/kg)、40mg/kg(HED 6.45)或80mg/kg(HED 12.9mg/kg)地塞米松碱IV或PO治疗大鼠。在所有地塞米松剂量下,生发中心面积减少,并且在12.9mg/kg HED下被最大抑制。组1-4IV:1=20mg/kg(HED 3.23mg/kg),2=40mg/kg(HED 6.45mg/kg),3=80mg/kg(HED 12.9mg/kg),4=安慰剂。组5-9PO:5=20mg/kg(HED3.23mg/kg),6=40mg/kg(HED 6.45mg/kg),7=80mg/kg(HED 12.9mg/kg),8=安慰剂。
图5.急性高剂量地塞米松降低胸腺质量。照片显示了安慰剂治疗的鼠受试者的胸腺大小(上图)和用6mg/kg HED剂量的本发明药物组合物治疗的鼠受试者的胸腺大小(下图)。下图显示了安慰剂治疗的受试者(对照)和用3mg/kg HED、6mg/kg HED、9mg/kg HED和12mg/kg HED的本发明药物组合物治疗的受试者的胸腺重量与体重的百分比。
图6.急性高剂量地塞米松减少大鼠淋巴细胞数。显示了用安慰剂、20mg/kg(HED3.23mg/kg)、40mg/kg(HED6.45)或80mg/kg(HED 12.9mg/kg)地塞米松碱IV(右)或PO(左)治疗大鼠后48小时,通过全血计数测量的个体绝对淋巴细胞数和平均值的图。在抽血前48小时施用地塞米松。无论IV给药(右)还是口服给药(左),在所有剂量下与对照相比在大鼠中观察到显著的淋巴细胞耗竭。剂量显示为HED(人等效剂量)。
图7.急性高剂量地塞米松不减少大鼠中性粒细胞数。显示了用安慰剂、20mg/kg(HED 3.23mg/kg)、40mg/kg(HED6.45)或80mg/kg(HED 12.9mg/kg)地塞米松碱IV(右)或PO(左)治疗大鼠后48小时,通过全血计数测量的个体绝对中性粒细胞数和平均值的图。图3、图4和图6中的数据来自相同的大鼠。急性高剂量地塞米松具有中性粒细胞保留的淋巴细胞耗竭概况。在抽血前1×48小时施用口服(左)和IV(右)剂量。剂量显示为HED(人等效剂量)。
图8.CD3和CD4阳性淋巴细胞。用安慰剂、HED 3mg/kg、HED 6mg/kg、HED 9mg/kg或HED 12.mg/kg地塞米松碱PO治疗小鼠后48小时,作为相对计数通过流式细胞术测量的个体CD3+(左)和CD4+(右)淋巴细胞和平均值并使用全血计数归一化为相对绝对计数的图。相对计数/ul=流式细胞术和全血细胞计数的组合。与对照相比,在12mg/kg组中:CD3+细胞减少65%;CD4+细胞减少75%。剂量显示为HED(人等效剂量)。合并单向ANOVA和之后Tukey检验以确定治疗组之间的统计显著性;*p<0.05,**p<0.01,***p<0.001。
图9.急性高剂量地塞米松减少小鼠CD8阳性淋巴细胞和Treg。显示了用安慰剂、HED 3mg/kg、HED 6mg/kg、HED 9mg/kg或HED 12.mg/kg地塞米松碱PO治疗小鼠后48小时,作为相对计数通过流式细胞术测量的个体CD8+(左)和Treg(右)淋巴细胞和平均值并使用全血计数归一化为相对绝对计数的图。Treg淋巴细胞被鉴定为CD3+CD4+CD25+FoxP3+。相对计数/ul=流式细胞术和全血计数的组合。与对照相比,在12mg/kg组中:CD8+细胞减少56%;小鼠Treg减少78%。剂量显示为HED(人等效剂量)。合并单向ANOVA和之后事后Tukey检验以确定治疗组之间的统计显著性;*p<0.05,**p<0.01。
图10.急性高剂量地塞米松减少小鼠NK细胞和B淋巴细胞。显示了用安慰剂、HED3mg/kg、HED 6mg/kg、HED 9mg/kg或HED 12.mg/kg地塞米松碱PO治疗小鼠后48小时,作为相对计数通过流式细胞术测量的个体自然杀伤(NK)细胞(左)和B淋巴细胞(右)和平均值并使用全血计数归一化为相对绝对计数的图。NK细胞被鉴定为CD3-CD49b+。B淋巴细胞被鉴定为CD3-B220+。相对计数/ul=流式细胞术和全血计数的组合。与对照相比,在12mg/kg组中:NK细胞减少87%;B细胞减少83%。剂量显示为HED(人等效剂量)。合并单向ANOVA和之后事后Tukey检验以确定治疗组之间的统计显著性;*p<0.05,**p<0.01;***p<0.001。
图11.急性高剂量地塞米松减少小鼠绝对淋巴细胞数,同时保留中性粒细胞。显示了用安慰剂、HED 3mg/kg、HED 6mg/kg、HED 9mg/kg、HED 12.mg/kg或HED 17.5mg/kg地塞米松碱PO治疗小鼠后24-48小时,通过全血计数测量的个体绝对中性粒细胞(左)和总淋巴细胞(右)和平均值的图。细胞/μl=从全血计数(CBC)获得的绝对数。急性高剂量地塞米松在大于12mg/kg的HED剂量下引起几乎完全的淋巴细胞消融,但不影响中性粒细胞。因此,急性高剂量地塞米松消除了对输血的需要,并且提供了化疗方案的更安全、无毒的替代方案。剂量显示为HED(人等效剂量)。
图12.急性高剂量地塞米松保留小鼠RBC和血小板。显示了用安慰剂、HED 3mg/kg、HED 6mg/kg、HED 9mg/kg、HED 12.mg/kg或17.5mg/kg地塞米松碱PO治疗小鼠后48小时,通过全血计数测量的个体绝对RBC(左)和血小板(右)和平均值的图。细胞/μl=从CBC获得的绝对数。急性高剂量地塞米松不影响RBC或血小板,消除了对输血的需要,并且因此提供了化疗方案的更安全、无毒的替代方案。剂量显示为HED(人等效剂量)。
图13.显示了用安慰剂(媒介物)或低或高剂量的急性高剂量地塞米松治疗幼稚
图14.用3mg/kg地塞米松碱治疗的50%(2/4)的人类患者耗竭了CD3、CD4和CD8阳性淋巴细胞。显示了对四名人类患者口服施用3mg/kg地塞米松碱后48小时,个体治疗前和治疗后通过流式细胞术测量的CD3+、CD4+和CD8+淋巴细胞的值和线图。每个患者的治疗前值通过连接线与治疗后值相连。CD4+细胞也是CD3+。CD8+细胞也是CD3+。
图15.用3mg/kg地塞米松碱治疗的25%(1/4)的人类患者耗竭Treg和B淋巴细胞。线是对四名人类患者口服施用3mg/kg地塞米松碱后48小时,个体治疗前后通过流式细胞术测量的Treg和B淋巴细胞的值和线图。每个患者的治疗前值通过连接线与治疗后值相连。Treg被鉴定为CD3+CD4+CD25+FoxP3+。B淋巴细胞被鉴定为CD3-CD19+。
图16.用3mg/kg地塞米松基治疗的75%(3/4)的人类患者耗竭NK细胞,同时保留造血干细胞。线是对四名人类患者口服施用3mg/kg地塞米松碱后48小时,个体治疗前和治疗后通过流式细胞术测量的NK细胞和造血干细胞(HSC)的值和线图。每个患者的治疗前值通过连接线与治疗后值相连。NK细胞被鉴定为CD3-CD16/56+。HSC被鉴定为CD34+CD38-。
图17.用3mg/kg地塞米松碱治疗的100%的人类患者显示血清IL-2和/或IL-15水平升高,但IL-6没有升高。对四名人类患者口服施用3mg/kg地塞米松碱后48小时,每个患者治疗前和治疗后的通过ProCartaPlex-9plx Luminex测定测量的白介素2和白介素15的血浆水平的柱状图。图14、图15、图16和图17示出了来自相同的四个人类患者的数据。
图18.口服施用3mg/kg地塞米松碱48小时后骨髓MSC数量增加。来自31名历史幼稚对照人的数据加标准偏差的柱形图,以及2名人类患者在使用MarrowCellution
图19.第-2天12mg/kg和17-18mg/kg地塞米松碱口服剂量与第-5天单剂量环磷酰胺166mg/kg(HED 500mg/m2)和氟达拉滨10mg/kg联合第-2天12mg/kg或17-18mg/kg地塞米松碱的比较,以及与第-5天和第-4天的2天重复环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天氟达拉滨10mg/kg(HED 30mg/m2)的比较。显示了用PBS(媒介物),或用第-5天和第-4天的重复IP环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天IP氟达拉滨10mg/kg(HED 30mg/m2)(Flu+Cy),或用都在第-5天的单IP剂量环磷酰胺166mg/kg(HED500mg/m2)和IP氟达拉滨10mg/kg,然后在第-2天用口服12mg/kg或17-18mg/kg地塞米松碱(Flu+Cy+AVM0703(12mg/kg);Flu+Cy+AVM0703(17mg/kg)),或用口服12mg/kg或17-18mg/kg地塞米松碱(AVM0703(12mg/kg);AVM0703(17mg/kg))治疗小鼠后48小时,通过全血计数测量的个体绝对淋巴细胞和平均值(左)的图。还显示了(右)这些方案的小鼠给药方案的代表。
图20.与第-5天和第-4天的2天重复环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天氟达拉滨10mg/kg(HED 30mg/m2)相比,第-5天单剂量环磷酰胺166mg/kg(HED500mg/m2)和氟达拉滨10mg/kg联合第-2天12mg/kg或17-18mg/kg地塞米松碱等效地淋巴细胞耗竭CD3+和CD4+淋巴细胞。显示了用PBS(媒介物),或用第-5天和第-4天的重复IP环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天IP氟达拉滨10mg/kg(HED 30mg/m2)(Flu+Cy),或用都在第-5天的单IP剂量环磷酰胺166mg/kg(HED 500mg/m2)和IP氟达拉滨10mg/kg,然后在第-2天用口服12mg/kg或17-18mg/kg地塞米松碱(Flu+Cy+AVM0703(12mg/kg);Flu+Cy+AVM0703(17mg/kg)),或用口服12mg/kg或17-18mg/kg地塞米松碱(AVM0703(12mg/kg);AVM0703(17mg/kg))IP治疗小鼠后48小时,作为相对计数通过流式细胞术测量的个体CD3+(左)和CD4+(右)淋巴细胞和平均值并使用全血计数归一化为相对绝对计数的图。在CD3+图(左)和CD4+图(右)中,12mg/kg或17-18mg/kg地塞米松碱数据分别显示在右侧栏中(相对计数为‘92’、‘71’、‘37’和‘25’)。
图21.与第-5天和第-4天的2天重复环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天氟达拉滨10mg/kg(HED 30mg/m2)相比,第-5天单剂量环磷酰胺166mg/kg(HED500mg/m2)和氟达拉滨10mg/kg联合第-2天12mg/kg或17-18mg/kg地塞米松碱等效地淋巴细胞耗竭CD8+淋巴细胞和Treg。显示了用PBS(媒介物),或用第-5天和第-4天的重复IP环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天IP氟达拉滨10mg/kg(HED 30mg/m2)(Flu+Cy),或用都在第-5天的单IP剂量环磷酰胺166mg/kg(HED 500mg/m2)和IP氟达拉滨10mg/kg,然后在第-2天用口服12mg/kg或17-18mg/kg地塞米松碱(Flu+Cy+AVM0703(12mg/kg);Flu+Cy+AVM0703(17mg/kg)),或用口服12mg/kg或17-18mg/kg地塞米松碱(AVM0703(12mg/kg);AVM0703(17mg/kg))IP治疗小鼠后48小时,作为相对计数通过流式细胞术测量的个体Treg(右)和CD8+淋巴细胞(左)和平均值并使用全血计数归一化为相对绝对计数的图。在CD8+图(左)和CD4+图(右)中,12mg/kg或17-18mg/kg地塞米松碱数据分别显示在右侧列(相对计数为‘33’、‘1.4’、‘0.2’和‘0.5’)。
图22.与第-5天和第-4天的2天重复环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天氟达拉滨10mg/kg(HED 30mg/m2)相比,第-5天单剂量环磷酰胺166mg/kg(HED500mg/m2)和氟达拉滨10mg/kg联合第-2天12mg/kg或17-18mg/kg地塞米松碱等效地淋巴细胞耗竭NK细胞和B淋巴细胞。显示了用PBS(媒介物),或用第-5天和第-4天的重复IP环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天IP氟达拉滨10mg/kg(HED 30mg/m2)(Flu+Cy),或用都在第-5天的单IP剂量环磷酰胺166mg/kg(HED 500mg/m2)和IP氟达拉滨10mg/kg,然后在第-2天用口服12mg/kg或17-18mg/kg地塞米松碱(Flu+Cy+AVM0703(12mg/kg);Flu+Cy+AVM0703(17mg/kg)),或用口服12mg/kg或17-18mg/kg地塞米松碱(AVM0703(12mg/kg);AVM0703(17mg/kg))IP治疗小鼠后48小时,作为相对计数通过流式细胞术测量的个体B淋巴细胞(左)和NK细胞淋巴细胞(右)和平均值并使用全血计数归一化为相对绝对计数的图。在B细胞图(左)和NK细胞图(右)中,12mg/kg或17-18mg/kg地塞米松碱数据分别显示在右侧列(对于B细胞,相对计数为‘111’和‘58’;未显示NK细胞)。
图23.与第-5天和第-4天的2天重复环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天氟达拉滨10mg/kg(HED 30mg/m2)相比,第-5天单剂量环磷酰胺166mg/kg(HED500mg/m2)和氟达拉滨10mg/kg联合第-2天12mg/kg或17-18mg/kg地塞米松碱等效地淋巴细胞耗竭绝对淋巴细胞,但保留了中性粒细胞。显示了用PBS(媒介物),或用第-5天和第-4天的重复IP环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天IP氟达拉滨10mg/kg(HED 30mg/m2)(Flu+Cy),或用都在第-5天的单IP剂量环磷酰胺166mg/kg(HED 500mg/m2)和IP氟达拉滨10mg/kg,然后在第-2天用口服12mg/kg或17-18mg/kg地塞米松碱(Flu+Cy+AVM0703(12mg/kg);Flu+Cy+AVM0703(17mg/kg)),或用口服12mg/kg或17-18mg/kg地塞米松碱(AVM0703(12mg/kg);AVM0703(17mg/kg))IP治疗小鼠后48小时,通过全血计数测量的个体绝对中性粒细胞(左)和绝对淋巴细胞(右)和平均值的图。在中性粒细胞图(左)和淋巴细胞图(右)中,12mg/kg或17-18mg/kg地塞米松碱数据分别显示在右侧列(相对计数为‘321’、‘605’、‘521’和‘88’)。
图24.第-5天单剂量环磷酰胺166mg/kg(500mg/m2)和氟达拉滨10mg/kg(HED30mg/m2)联合第-2天12mg/kg或17-18mg/kg地塞米松碱保留红细胞(RBC)和血小板。显示了用PBS(媒介物),或用第-5天和第-4天的重复IP环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天IP氟达拉滨10mg/kg(HED 30mg/m2)(Flu+Cy),或用都在第-5天的单IP剂量环磷酰胺166mg/kg(HED 500mg/m2)和IP氟达拉滨10mg/kg,然后在第-2天用口服12mg/kg或17-18mg/kg地塞米松碱(Flu+Cy+AVM0703(12mg/kg);Flu+Cy+AVM0703(17mg/kg)),或用口服12mg/kg或17-18mg/kg地塞米松碱(AVM0703(12mg/kg);AVM0703(17mg/kg))IP治疗小鼠后48小时,通过全血计数测量的个体绝对血小板和绝对RBC和平均值的图。在RBC图(左)和血小板图(右)中,12mg/kg或17-18mg/kg地塞米松碱数据分别显示在右侧列(相对计数为‘10’、‘10’、‘348’和‘373’)。
图25.与第-5天和第-4天的2天重复环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天氟达拉滨10mg/kg相比,第-5天单剂量环磷酰胺166mg/kg(HED 500mg/m2)和氟达拉滨10mg/kg联合第-2天12mg/kg或17-18mg/kg地塞米松碱保留体重(毒性的量度)。显示了(左)通过从治疗前体重减去用PBS(媒介物),或用第-5天和第-4天的重复IP环磷酰胺166mg/kg和第-5天、第-4天、第-3天、第-2天的4天IP氟达拉滨10mg/kg(HED 30mg/m2)(Flu+Cy),或用都在第-5天的单IP剂量环磷酰胺166mg/kg(HED 500mg/m2)和IP氟达拉滨10mg/kg,然后在第-2天用口服12mg/kg或17-18mg/kg地塞米松碱(Flu+Cy+AVM0703(12mg/kg);Flu+Cy+AVM0703(17mg/kg)),或用口服12mg/kg或17-18mg/kg地塞米松碱(AVM0703(12mg/kg);AVM0703(17mg/kg))IP治疗小鼠后48小时的体重计算的个体体重差异和平均值的图。与化疗组不同,急性高剂量地塞米松组与体重减轻无关。因此,急性高剂量地塞米松提供了与化疗类似的淋巴细胞耗竭作用,但没有相关的毒性。还显示了(右)这些方案中给药时间表的代表。
图26.15mg/kg地塞米松碱HED(AVM0703)与标准化疗方案的比较:抗肿瘤功效。用PBS(对照)、15mg/kg地塞米松碱HED(AVM0703),或环磷酰胺100mg/kg i.p、多柔比星6mg/kgi.p、长春新碱0.1mg/kg i.p和地塞米松0.2mg/kg i.p(CHOP)的1个周期或2个周期治疗A20B细胞淋巴瘤小鼠(8-10周龄)。在第0天给药1个周期的CHOP,在第0天和第10天给药小鼠2个周期的CHOP,在第7天、第10天、第18天、第23天、第24天、第28天、第35天和第42天给药地塞米松(用箭头表示)。跟踪小鼠的肿瘤生长,每2-3天测量肿瘤体积(mm
图27.15mg/kg地塞米松碱HED(AVM0703)与标准化疗方案的比较:毒性。图A显示与PBS对照相比,15mg/kg地塞米松碱HED(AVM0703)的体重变化百分比。图B显示与PBS对照相比,1个周期或2个周期的环磷酰胺100mg/kg i.p、多柔比星6mg/kg i.p、长春新碱0.1mg/kgi.p和地塞米松0.2mg/kg i.p(CHOP)的体重变化百分比。在用2个周期的CHOP(B)治疗的小鼠中观察到的体重降低比用15mg/kg地塞米松碱HED(A)治疗的小鼠中观察到的大得多。另外,用2个周期的CHOP治疗的18%小鼠死于CHOP治疗,而没有小鼠死于地塞米松治疗。
图28.15mg/kg地塞米松碱HED(AVM0703)与PBS对照的统计比较。用PBS(对照)或15mg/kg地塞米松碱HED(AVM0703)治疗A20B细胞淋巴瘤小鼠(8-10周龄)。在第7天、第10天、第18天、第23天和第24天给药地塞米松(由箭头指示)。跟踪小鼠的肿瘤生长,每2-3天测量肿瘤体积(mm
图29.糖皮质激素疗法降低了有效化疗所需的剂量:仅用PBS(‘对照’)或用地塞米松碱(‘AVM0703’)治疗的荷瘤受试者表现出持续的肿瘤生长,通常在20天后具有高生长速率。以与在第11天和第14天用两个剂量的Cy/Flu化疗(‘Cy/Flu’)治疗的受试者的肿瘤相似的方式,在第11天用AVM0703治疗然后在第14天用一个剂量的Cy/Flu化疗(‘Combo’)治疗的荷瘤受试者表现出肿瘤体积的稳定且持续的减小。
图30.高剂量糖皮质激素疗法降低肿瘤密度,而不显著影响体重。在肿瘤建立后,在施用每周6mg/Kg HED、每周15mg/Kg HED或每周21mg/Kg HED的每周剂量的糖皮质激素AVM0703后测量受试者的肿瘤密度(左图)。还示出了研究过程中小鼠的体重(右图);虚线代表在研究开始时小鼠平均重量减轻20%。没有显示由于毒性引起的显著体重减轻,并且没有小鼠被取下。
具体实施方式
细胞毒性化疗剂通过非受体介导的机制或方式引发细胞死亡。细胞毒性化疗剂通过干扰细胞分裂、代谢或细胞生存所必需的功能来引发细胞死亡。由于这种作用机制,快速生长(意指增殖或分裂)或具有代谢活性的细胞将优先于并非这样的细胞而被杀死。体内不同细胞的分裂状态或使用能量状态(其为代谢活性以支持细胞功能)决定引发细胞死亡的化疗剂的剂量。本领域技术人员将理解,用于本发明的糖皮质激素不是细胞毒性化疗剂。细胞毒性化疗剂非排他性地涉及烷化剂、抗代谢物、植物生物碱、拓扑异构酶抑制剂、抗肿瘤药和三氧化二砷、卡莫司汀、氟达拉滨、IDA ara-C、myalotang、GO、氮芥、环磷酰胺、吉西他滨、苯达莫司汀、全身照射、阿糖胞苷、依托泊苷、美法仑、喷司他丁和放射。
本发明涉及用于通过免疫消融治疗疾病的包含糖皮质激素的药物组合物。特别地,本发明的组合物可用于治疗由免疫细胞如淋巴细胞介导的疾病。治疗包括向患者施用一定剂量的药物组合物以递送相当于约3-26mg/kg人等效剂量(HED)地塞米松碱的剂量的糖皮质激素。
如本文所用,术语糖皮质激素包括糖皮质激素受体激动剂和与糖皮质激素受体结合的任何化合物。此类化合物涉及但不限于地塞米松、含地塞米松的药剂、氢化可的松、甲基泼尼松、泼尼松、皮质酮、布地奈德、倍他米松和倍氯米松。其他糖皮质激素包括泼尼松龙、糠酸莫米松、曲安奈德和甲泼尼龙。糖皮质激素还包括糖皮质激素受体调节激动剂。另外,选择性糖皮质激素受体激动剂可用于本文公开的药物组合物中。此类激动剂或调节剂包括例如选择性糖皮质激素受体调节剂(SEGRM)和选择性糖皮质激素受体激动剂(SEGRA)。可用于本文公开的方法和组合物中的糖皮质激素、糖皮质激素受体调节剂和选择性糖皮质激素受体激动剂(SEGRA)是本领域技术人员熟知的。
糖皮质激素和糖皮质激素受体(GR)调节剂通过激活或抑制基因表达的膜糖皮质激素受体和细胞质GR发挥其作用。糖皮质激素和GR调节剂的一些期望的淋巴细胞耗竭作用似乎是通过膜GR或除了它们的基因组作用之外的其他非基因组作用介导的。有趣的是,与地塞米松共同治疗已经显示能够降低糖皮质激素抗性(Serafin等人,2017)。
糖皮质激素的作用是复杂的并且取决于每种特定的糖皮质激素对GR和盐皮质激素受体(MR)的亲和力。另外,现在已经鉴定出9种已知的胞质GR同工型和其他膜表达的GR受体,但尚未完全表征。据报道,糖皮质激素对淋巴细胞水平具有不同的作用,这取决于施用的糖皮质激素的浓度和治疗的持续时间。一般而言,在通常用于慢性治疗的低剂量下,据报道糖皮质激素使淋巴细胞从外周血重新分布到骨髓中,在中等剂量下,据报道糖皮质激素引起白细胞增多,其被认为白细胞从骨髓、脾和胸腺重新分布到外周血中,而在高剂量下,糖皮质激素通过引发细胞凋亡和坏死性凋亡而对淋巴细胞具有淋巴毒性作用。作用的持续时间也取决于剂量水平,例如Fauci等人(1976)报道了单次口服0.24mg/kg地塞米松剂量抑制外周血T和B淋巴细胞80%,在12小时开始恢复,到24小时达到正常水平。然而,本发明证明,3mg/kg或更大的急性口服剂量对于在施用后24-48小时减少外周血T和B细胞是必需的,在给药后约5-14天恢复到基线水平。
示例性糖皮质激素的期望的体内作用将包括次级淋巴管中生发中心和边缘区的减少,一些癌症的直接肿瘤杀伤;特别是多发性骨髓瘤、肾细胞癌、白血病和淋巴瘤、非小细胞肺癌(NSCLC)、前列腺癌和乳腺癌;所有外周血淋巴细胞类型的耗竭,缺乏淋巴细胞向BM或其他器官的再分布,以及血浆细胞因子包括IL-2和/或IL-7和/或IL-12和/或IL-15升高至优选20pg/ml或更高的水平,等等。示例性糖皮质激素不升高IL-6的血浆水平,IL-6是ACT诱导的细胞因子释放综合征(CRS)的主要贡献者之一。示例性糖皮质激素不升高GM-CSF的血浆水平,GM-CSF是ACT诱导的神经水肿的主要贡献者之一。约HED6mg/kg及以上的地塞米松的急性剂量减少次级淋巴管中的生发中心和边缘区;约1.6mg/kg HED的地塞米松的急性剂量在48小时内对多发性骨髓瘤和其他癌细胞系具有约50%直接肿瘤杀伤,其随着剂量高达约12mg/kg HED而维持但不增加;如用3mg/kg HED治疗的50%患者显示出淋巴细胞增多的观察结果所表明,淋巴细胞耗竭需要大于约3mg/kg HED的地塞米松的急性剂量(图14);在约HED 3mg/kg或更高的地塞米松碱剂量下观察到血浆IL-2和IL-15细胞因子升高(图17)。基于本申请公开的适应症中期望的体内作用,最优选的急性地塞米松碱剂量(其可基于已知的计算器或如本说明书中公开的那样转化为等效剂量的其他糖皮质激素)最可能为约HED 9mg/kg及以上。
单次高剂量的糖皮质激素可作为口服施用或约1小时IV输注给予。总剂量可作为重复IV或口服剂量以任何量给予,使得例如地塞米松的总剂量在约24至约72小时内为约3mg/kg至约26mg/kg。
另一种糖皮质激素或糖皮质激素受体调节剂的等效剂量可以使用公众可获得的皮质激素转化算法,优选http://www.medcalc.com轻易地和容易地计算。例如,3-12mg/kg地塞米松转化为19-75mg/kg泼尼松。因为泼尼松的生物半衰期为约20小时,而地塞米松的生物半衰期为约36至54小时。因此,每24小时给药19-75mg/kg泼尼松,以进行等效生物给药。更具体地,12mg/kg剂量的地塞米松对应于1)75mg/kg剂量的泼尼松龙,其需要每24小时重复给药约2至约3个剂量。10mg/kg剂量的倍他米松是约12mg/kg地塞米松并且具有与地塞米松相似的药效学(生物)半衰期。然而,倍他米松在约24mg/50kg的剂量下减少RBC(Gaur2017)。
本申请实施例中的DEX(地塞米松碱)剂量以人等效剂量(HED)给出。在给出的实施例中,AVM0703(也称为AugmenStem
计算人等效剂量(HED)的方法是本领域已知的。例如,FDA的药物评价和研究中心(CDER)在2005年发布高度引用的指导文件(美国卫生部CDER,2005),其在该文件第7页的表1中列出了基于体表面积将动物剂量转化为HED的既定算法(用于在物种之间外推剂量的普遍接受的方法)。为了参考,下面复制了表1。技术人员理解,对于下文解释的以mg/kg计的动物剂量,容易使用表1右手列中的标准转化因子计算HED:
HED=动物剂量(mg/kg)×(动物体重(kg)/人体重(kg))
本文所述的剂量可表示为“基于体重的剂量”或“基于体表面积(BSA)的剂量”。基于体重的剂量是基于患者体重计算的施用于患者的剂量,例如mg/kg。基于BSA的剂量是基于患者的表面积计算的施用于患者的剂量,例如mg/m2。两种形式的剂量测量可在人类给药的情况下通过将基于重量的剂量乘以37或将基于BSA的剂量除以37来转换,如上表1中所示。
术语“受试者”和“患者”在本文中可互换使用,并且是指人或动物。
与等效剂量的其他糖皮质激素类固醇一样,地塞米松抑制淋巴组织中生发中心的形成和增殖并且淋巴细胞耗竭外周血。糖皮质激素,特别是地塞米松的剂量优选达到大于75%的淋巴细胞耗竭。更优选地,糖皮质激素,特别是地塞米松的剂量达到大于80%的淋巴细胞耗竭。最优选地,糖皮质激素,特别是地塞米松的剂量达到大于95%的淋巴细胞耗竭。本领域技术人员将理解,可以通过测量全血计数(CBC)容易地测量淋巴细胞耗竭。
地塞米松和其他优选的糖皮质激素保留中性粒细胞并且不抑制中性粒细胞功能(Schleimer RP,J Pharmacol Exp Ther1989;250:598–605),以及保留红细胞(RBC)、血小板、间充质干细胞(MSC)和造血干细胞(HSC)。人体内的中性粒细胞保留是指绝对中性粒细胞计数(ANC)大于500/mm
地塞米松被批准与地塞米松磷酸钠注射液的初始剂量一起使用,根据所治疗的疾病,所述剂量为每天0.5-9mg,基于50kg BW,日剂量为0.01-0.18mg/kg。在较不严重的疾病中,低于0.5mg的剂量可能就足够了,而在严重疾病中,可能需要高于9mg的剂量。目前的医学实践倾向于使用高(药理学)剂量的皮质类固醇来治疗无反应性休克。对于脑水肿,地塞米松磷酸钠注射液通常最初以10mg的剂量静脉内施用,然后每6小时肌内施用4mg,直到脑水肿症状消退。此总剂量对应于约0.34至0.48mg/kg的总24小时剂量和在72小时内0.8至1.12mg/kg的总72小时剂量,这不是根据本发明的有效剂量,其使用约3mg/kg至约26mg/kg的剂量。
对于急性过敏性疾病,地塞米松磷酸钠注射液,USP 4mg/mL,推荐:第一天,1或2mL(4或8mg),肌内注射,然后施用地塞米松磷酸钠片,0.75mg;第二和第三天,每天分两次服用4片;第四天,分两次服用2片;第5天和第6天,每天1片;第七天,无治疗;第8天,随访访视。地塞米松以2mg/kg用于重症急性儿科哮喘的急诊室,该剂量低于本发明定义的糖皮质激素剂量。
糖皮质激素如地塞米松的常规制剂可能不适合用于本发明的治疗应用。例如,地塞米松磷酸钠(DSP)目前以低剂量(2-4mg/ml)和低体积制剂(例如APP Pharmaceuticals,Mylan)出售,其含有抗微生物防腐剂,如苯甲醇(BA)和对羟基苯甲酸丙酯(PP)。进行完全淋巴细胞消融所需的DSP的目标剂量需要使用多个小瓶,导致赋形剂过量。超过WHO可接受的苯甲醇和对羟基苯甲酸丙酯的日摄入量(ADI)与遗传毒性和增加的癌症风险(Darbre等人,2014)、生殖毒性(Aker等人,2016)、增加的过敏性疾病风险(Savage等人,2012;Spanier等人,2014)和新生儿CNS功能障碍(Medicines Agency,2017)有关。此外,使用市售DSP包装说明书,约6%的接受类固醇的患者会出现严重的神经精神效应(Malmegrim等人,2017)。由于本发明涉及施用高剂量的糖皮质激素,因此应使用具有低水平潜在毒性防腐剂的制剂或不含毒性防腐剂的制剂。优选地,防腐剂是抗氧化剂。
本发明的药物组合物可包含防腐剂(例如抗氧化剂)添加剂如亚硫酸钠以维持组合物的稳定性。亚硫酸盐也广泛用作制药工业中的防腐剂和抗氧化剂添加剂。据报道,暴露于此类亚硫酸盐中会在敏感个体中诱发从皮炎、荨麻疹、潮红、低血压和腹痛到危及生命的过敏和哮喘反应的一系列不良临床效应。亚硫酸盐诱发的症状在一些个体中是轻度的,在另一些个体中是严重的,在一些个体中反应可能危及生命。在优选的实施方案中,当包含亚硫酸钠作为抗氧化剂时,浓度为0-70ppm亚硫酸钠(无水)。
抗氧化剂的加入量可以从含糖皮质激素的组合物中通常使用的水平降低,从而降低与使用这些抗氧化剂相关的毒性和不良副作用。在一些情况下,本发明的制剂可以不添加抗氧化剂。
如本文所用,抗氧化剂是延迟或抑制分子氧化过程从而增加组合物稳定性的那些赋形剂。可以使用的抗氧化剂包括例如抗坏血酸、乙酰半胱氨酸、丁基羟基苯甲醚、半胱氨酸盐酸盐、连二亚硫酸钠、龙胆酸、谷氨酸单钠、谷胱甘肽、甲醛次硫酸氢钠、甲硫氨酸、单硫代甘油、没食子酸丙酯、亚硫酸盐、硫代乙醇酸钠、α-硫代甘油、生育酚α、α生育酚琥珀酸氢酯和硫代乙醇酸钠。
除了活性糖皮质激素和抗氧化剂之外,本领域技术人员熟知的其他组分可以包括在本文公开的药物组合物中。药物组合物可以使用由被认为安全和有效的材料组成的药学上可接受的“载体”来制备。“药学上可接受的”是指这样的分子实体和组合物,所述分子实体和组合物“一般被认为是安全的”,例如,当施用于人时,所述分子实体和组合物在生理上是可耐受的,并且通常不会产生过敏或类似的不良反应,诸如胃部不适等。在一些实施方案中,该术语是指这样的分子实体和组合物,所述分子实体和组合物被美国联邦或州政府的监管机构批准在《联邦食品、药物和化妆品法》第204(s)和409条下的GRAS清单(其须经FDA上市前审查和批准)或类似清单、美国药典或另外普遍认可的用于动物,尤其是用于人的药典中列出。
术语“载体”是指稀释剂、粘合剂、润滑剂和崩解剂。本领域技术人员熟悉这些药物载体和使用这些载体配制药物组合物的方法。
本文提供的药物组合物可包含一种或多种赋形剂,例如溶剂、增溶剂、悬浮剂、缓冲剂、等渗剂、抗氧化剂或抗微生物防腐剂。当使用时,组合物的赋形剂不会对组合物中使用的活性成分(即,糖皮质激素)的稳定性、生物利用度、安全性和/或功效产生不利影响。因此,本领域技术人员将理解,提供了其中在剂型的任何组分之间没有不相容性的组合物。赋形剂可选自由以下组成的组:缓冲剂、增溶剂、张度剂、螯合剂、抗氧化剂、抗微生物剂和防腐剂。
本发明的药物组合物可以包括用于螯合和降低组合物中可能存在的金属离子的反应性的螯合剂。可能的螯合剂为EDTA二钠钙0.01-0.1%(EDTA=乙二胺四乙酸或依地酸)、EDTA二钠0.01-0.11%、EDTA钠0.20%、维塞胺钙钠2.84%、钙立醇0.023%、DTPA0.04-1.2%(二亚乙基三胺五乙酸)。在优选的实施方案中,EDTA二钠(依地酸)的浓度为0-500ppm。
***
如WO2018/183927中所述,糖皮质激素也可与过继性细胞疗法(ACT)联合用作预调节剂。糖皮质激素,特别是地塞米松的剂量为细胞免疫疗法施用前约12至约72小时的约3mg/kg至约26mg/kg单次急性剂量,或在细胞疗法施用的约12至约72小时给予的约3mg/kg至约26mg/kg的总剂量时,增加血浆IL-2和IL-15水平。
糖皮质激素,特别是地塞米松的剂量为约3mg/kg至约26mg/kg单次急性剂量或在约72小时内给予约3mg/kg至约26mg/kg的总剂量,单独施用或与降低强度的细胞毒性预调节组合时,可用于治疗自身免疫疾病。为了治疗自身免疫疾病,可以将ACT靶向于驱动疾病的免疫细胞以努力根除自身免疫识别细胞。另外,对于自身免疫疾病,ACT可以是由CAR或TCR靶向的Treg或由自身免疫攻击发生的身体区域或器官特异性或选择性表达的针对抗原的表达抗体。Treg可以非排他地涉及CD4+Treg、CD4+CD45RA+Treg、CD4+CD25+CD45RA+Treg、FoxP3+Treg、CD4+CD25+FoxP3+CD152+Treg、CD4+CD25+CD152+Treg、CD8+Treg、CD8+CD28-Treg、CD4+CD25int/高、CD127低、CTLA4+、GITR+、FoxP3+、CD127低、CD4+CD25-
最初通过对CD4和CD25的组成型表达而被识别的“天然”调节性T细胞可以通过转录因子foxP3和表面CD152的表达来进一步定义。它们的产生和它们的一些抑制活性依赖于TGF-β,并且已经显示它们可以通过CD152介导的CD80/86的连接在合适的DC中诱导IDO。在没有共刺激的情况下通过抗原刺激产生的无能CD4+T细胞的特征似乎在于其抗原刺激阈值的内在升高,其可以通过E3泛素连接酶如GRAIL、c-cbl和Itch的表达来维持。无能细胞可通过在抗原呈递位点竞争并吸附出刺激性细胞因子如IL-2而充当调节性T细胞。Tr1细胞代表诱导的CD4辅助T细胞亚组,其分化和一些调节特性依赖于IL-10。它们不表达foxP3,但可以表达与Th2细胞和GATA阻遏物(ROG)相关的标记物。与天然Treg一样,它们表达高水平的表面CD152并且可以在合适的DC中诱导IDO和色氨酸分解代谢。CD8+CD28-抑制T(Ts)细胞首先在人中表征,但最近也在啮齿动物中得到证实。与Tr1细胞一样,它们在IL-10存在下被诱导,并且IL-10可能参与树突细胞共刺激的下调与ILT-3和ILT-4(在人DC中)的上调,其似乎在呈递抗原以耐受其他T细胞队列中起重要作用。
调节性T细胞(Treg)在维持免疫稳态中起重要作用1。Treg抑制其他T细胞的功能以限制免疫反应。Treg的数量和功能的改变涉及几种自身免疫疾病,包括多发性硬化、活动性类风湿性关节炎和1型糖尿病。在包括肺癌、胰腺癌和乳腺癌的许多恶性疾病中都发现了高水平的Treg。Treg还可以阻止抗肿瘤免疫反应,导致死亡率增加。
迄今已经鉴定了两大类Treg:CD4和CD8 Treg。CD4 Treg由两种类型组成,组成型表达CD25和FoxP3的“天然”Treg(nTreg)和所谓的适应性或诱导型Treg(iTreg)。
天然Treg(nTreg)作为表达高水平CD25以及转录因子(和谱系标记物)FoxP3的CD4
发育成Treg细胞的信号被认为来自T细胞受体和MHC II与胸腺基质上表达的自身肽的复合物之间的相互作用。nTreg基本上不依赖于细胞因子。
适应性或诱导型Treg作为单阳性CD4细胞源自胸腺。在同源抗原和特异性免疫调节细胞因子如TGF-β、IL-10和IL-4存在下,它们在充分抗原刺激后分化成表达CD25和FoxP3的Treg(iTreg)。(Chatenoud L,Bach JF.Adaptive human regulatory T cells:myth orreality?J Clin Invest.2006;116:2325-2327.)
FoxP3是目前最被接受的Treg标记物,尽管已经报道了FoxP3
糖皮质激素,特别是地塞米松的剂量为约3mg/kg至约26mg/kg单次急性剂量或在约72小时内给予约3mg/kg至约26mg/kg的总剂量,单独施用或与降低强度的细胞毒性化疗或放疗组合,可用于治疗残留HIV疾病,以及用于治疗生发中心淋巴瘤如伯基特淋巴瘤。
位于次级淋巴组织内的B细胞滤泡中的滤泡辅助CD4 T细胞T
高活性抗逆转录病毒疗法(HAART)能够长期抑制感染者的血浆HIV-1负荷,但低水平的病毒持续并在疗法停止后反弹。在HAART过程中,此病毒存在于潜伏感染的细胞(例如静息CD4 T细胞)中,和可能支持残留病毒复制的其他细胞类型中。根除治疗需要从所有贮库中清除病毒。
伯基特淋巴瘤是起源于次级淋巴系统并在其中生长的生发中心淋巴瘤,通常与活化c-Myc的染色体易位相关。它是生长最快的癌症之一,每14-18小时大小可以加倍。BL是在脾和次级淋巴管的生发中心中发现的侵袭性B细胞淋巴瘤。BL以医生Denis ParsonsBurkitt的名字命名,该医生于1958年在赤道非洲工作时首次描述该疾病(Burket,D.,1958)。BL最常见于生活在撒哈拉以南非洲的儿童中,在东非的发病率和死亡率最高(Orem,J.,等人,)。男孩比女孩更易患BL。在非洲以外,BL最有可能发生在免疫系统受损的人中。
在B细胞恶性肿瘤中,CLL对依鲁替尼反应最强,因此不幸的是,依鲁替尼不可能显著有益于患有伯基特淋巴瘤和其他生发中心淋巴瘤的人。然而,对于生发中心淋巴瘤如伯基特淋巴瘤,使用消融次级淋巴生发中心的药剂,可以获得将B-细胞癌再分布到更易受化疗影响且增殖较少的循环中的相同结果。因此,在一些实施方案中,本发明增加淋巴瘤对化疗的敏感性和/或提供联合疗法,所述联合疗法除了糖皮质激素,例如地塞米松之外,还包括强度降低的细胞毒性化疗。本文公开了各种合适的化疗。
对布鲁顿酪氨酸激酶抑制剂依鲁替尼治疗慢性淋巴细胞性白血病的能力的临床观察已经证明,CLL细胞从淋巴管再分布到血流中是其有益于CLL的作用机制。循环的CLL细胞不增殖,克隆的增殖限于淋巴微环境。因此,再分布到血流中减少了癌性增殖。类似地,也报道了ALL从骨髓再分布到血流中增强对标准化疗的敏感性(Chang BY,Blood 2013 122:2412-24;)。
据报道,糖皮质激素对淋巴细胞具有多重且矛盾的作用,这取决于剂量、给药持续时间和所研究的物种。自1943年(综述参见Burger等人,2013)以来,糖皮质激素已作为淋巴细胞增多诱导剂(即增加循环淋巴细胞数目的药剂)进行了研究,通常使用0.5至1mg/kg的泼尼松,其将相当于0.1-0.2mg/kg地塞米松剂量。相反,用于难治性CLL的高剂量甲基泼尼松(HDMP)在相当于泼尼松0.5-1.0mg/kg剂量的甲基泼尼松剂量下似乎不会诱导淋巴细胞增多。淋巴毒性高剂量类固醇通常被认为是每天约100mg的泼尼松等效物,其将是16mg的地塞米松等效剂量,为约0.23至0.32mg/kg,且我们已证明其不是有效的预调节剂量。地塞米松直到施用约3mg/kg或更高的HED才减少小鼠的生发中心。泼尼松不显著影响脾重量或生发中心,直到以超过2.5mg/kg的剂量在小鼠中每天口服,持续13周(Yan等人,2015),每天30mg的剂量(约0.48-0.72mg/kg)将具有不可接受的盐皮质激素活性的人类剂量被认为是人狼疮患者中的高剂量。
对于使用标准化疗方案如COPADM的伯基特淋巴瘤(BL)治疗,泼尼松通常以60mg/m
爱泼斯坦-巴尔病毒(EBV)感染在几乎所有非洲BL患者中发现,并且认为慢性疟疾降低了对EBV的抗性,使其得以保持。该疾病特征性地涉及颌骨或其他面骨、回肠远端、盲肠、卵巢、肾或乳房。此外,BL攻击免疫受损的人,如患有HIV的人。
BL分为三种主要的临床变体:地方性、散发性和免疫缺陷相关的变体,其中地方性变体(也称为“非洲变体”)最常见于生活在世界疟疾流行地区的儿童中。
本发明的一个效果可以是消融生发中心和/或边缘区,以选择性地使BL和其他生发中心癌细胞或边缘区癌细胞从生发中心或边缘区进入循环,在循环中它们可以更容易地用化疗或其他药剂杀死。这可以大幅地、安全地和成本有效地提高BL治疗结果。
哮喘是一种慢性炎症,其特征在于肺组织中CD8+1型T淋巴细胞和巨噬细胞以及气道腔中中性粒细胞的数量增加。在两种炎性病症中显著不同的淋巴细胞在哮喘和COPD的发病机理中起关键作用。现在有大量证据支持T细胞在哮喘中的主要作用,特别是T辅助2型(Th2)细胞参与特应性过敏性哮喘以及非特应性和职业性哮喘。T细胞毒性2型CD8+T细胞也有较小的贡献。几种Th2细胞因子具有调节气道炎症的潜力,特别是白介素-13,其在动物模型中独立于IgE和嗜酸性粒细胞增多症诱导气道高反应性。哮喘和慢性阻塞性肺病(COPD)是两种不同的肺部炎性疾病,它们具有共同的功能异常,即气流限制(Baraldo等人,2007)。
在哮喘中,气流限制在很大程度上是可逆的,无论自发地还是通过治疗,并且在大多数病例中不进展。另一方面,COPD中的气流限制通常是进行性的且可逆性差。在哮喘中,慢性炎症引起气道对多种刺激的反应性的相关增加,导致喘鸣、呼吸困难、胸闷和咳嗽的反复发作,特别是在晚上和清晨。许多细胞参与哮喘的炎症反应,其中CD4+2型淋巴细胞、肥大细胞和嗜酸性粒细胞被认为起关键作用。在COPD中,可逆性差的气流限制与肺对有害颗粒或气体的异常炎症反应有关。这种慢性炎症的特征在于肺组织中CD8+1型T淋巴细胞和巨噬细胞以及气道腔中中性粒细胞的数量增加。在两种炎性病症中显著不同的淋巴细胞在哮喘和COPD的发病机理中起关键作用(Baraldo等人,2007)。
用于描述本发明实施方案的定义:
淋巴细胞耗竭的生物学机制意指通过细胞凋亡或坏死性凋亡或焦亡或自噬或肿瘤病诱导程序性细胞死亡。各种刺激可以参与称为坏死性凋亡的细胞死亡的非凋亡形式,这在细胞凋亡所需的半胱天蛋白酶被抑制时发生。焦亡是程序性细胞死亡的半胱天冬酶依赖性形式,其在许多方面不同于细胞凋亡。与细胞凋亡不同,它依赖于半胱天冬酶-1或半胱天冬酶-11(人类半胱天冬酶-5)的活化。自噬是溶酶体依赖性过程。
细胞凋亡:一种细胞死亡形式,其中程序性事件序列导致细胞消除而不将有害物质释放到周围区域中。细胞凋亡通过消除旧细胞、不必要的细胞和不健康细胞在身体发育和维持身体健康中起关键作用。
本文使用的术语“和/或”将被视为两个指定的特征或组分中的每一个在另一个存在或不存情况下的具体公开。因此,如本文中在诸如“A和/或B”这样的短语中使用的术语“和/或”旨在包括“A和B”、“A或B”、“A”(单独的)和“B”(单独的)。类似地,如在诸如“A、B和/或C”的短语中使用的术语“和/或”旨在涵盖以下每一个方面:A、B和C;A、B或C;A或C;A或B;B或C;A和C;A和B和C;A(单独的);B(单独的)和C(单独的)。
当提及诸如量或时间持续时间等的可测量值时,术语“约”是指+/-20%或+/-10%的变化。
“施用”是指使用本领域技术人员已知的各种方法和递送系统中的任一种将剂物理地引入到受试者中。本文公开的制剂的示例性施用途径包括静脉内、肌内、皮下、腹膜内、脊髓或其他肠胃外施用途径,例如通过注射或输注。如本文使用的短语“肠胃外施用”是指除经肠施用和局部施用以外的通常通过注射进行的施用方式,包括但不限于静脉内、肌内、动脉内、鞘内、淋巴管内、病灶内、囊内、眶内、心内、真皮内、腹膜内、经气管、皮下、角质层下、关节内、囊下、蛛网膜下、椎管内、硬膜外和胸骨内注射和输注,以及体内电穿孔。在一些实施方案中,所述制剂通过非肠胃外途径(例如口服)施用。其他非肠胃外途径包括局部、表皮或粘膜施用途径,例如鼻内、阴道、直肠、舌下或局部施用。
药理学剂量是远超过体内正常水平的剂量。
本文所用的“抗肿瘤效应”是指可表现为肿瘤体积减小、肿瘤细胞数目减少、肿瘤细胞增殖减少、转移瘤数目减少、总生存期或无进展生存期增加、预期寿命增加或与肿瘤相关的各种生理症状改善的生物效应。抗肿瘤效应还可以指预防肿瘤的发生,例如疫苗。
治疗剂是与不使用所述治疗剂的细胞免疫疗法相比增强细胞免疫疗法的功效的药剂。
术语“自体的”是指源自随后将被再次引入的相同个体的任何材料,无论个体是人还是其他动物。
术语“同种异体的”是指源自一个个体然后被引入相同物种的另一个个体的任何材料,无论个体是人还是其他动物。
术语地塞米松(也称为Dex)非排他性地涉及任何制剂,无论是液体溶液、液体悬浮液、口服溶液、片剂形式、溶解于含有地塞米松活性成分的液体中的片剂形式、可注射形式、凝胶制剂、贴片制剂或含有地塞米松活性成分的任何制剂。
术语糖皮质激素受体调节剂非排他性地涉及糖皮质激素受体激动剂或糖皮质激素受体调节剂,包括但不限于:化合物A[CpdA;(2-((4-乙酰苯基)-2-氯-N-甲基)乙基氯化铵)]和N-(4-甲基-1-氧代-1H-2,3-苯并噁嗪-6-基)-4-(2,3-二氢苯并呋喃-7-基)-2-羟基-2(三氟甲基)-4-甲基戊酰胺(ZK216348)、AL-438、Mapracorat、LGD-5552、RU-24858、Fosdagrocorat、PF-802、化合物10、MK5932、C108297、LGD5552和ORG 214007-0。
免疫毒素是含有毒素以及特异性结合靶细胞的抗体或生长因子的蛋白质。免疫毒素是通过将抗体与不含天然结合结构域的完整蛋白毒素化学缀合而产生的。比单克隆抗体(MoAb)更小的免疫蛋白(如生长因子和细胞因子)也已经与蛋白毒素化学缀合和遗传融合。用于免疫毒素构建体的毒素来源于细菌、真菌和植物,并且大多数通过抑制蛋白质合成而发挥功能。通常用于免疫毒素的细菌毒素包括白喉毒素(DT)和来自假单胞菌外毒素(PE)的毒素。免疫毒素中使用的植物毒素包括蓖麻毒素A链(RTA)和核糖体失活蛋白(RIP)白树毒素(gelonin)、美洲商陆抗病毒蛋白(pokeweed antiviral protein)和商陆毒蛋白(dodecandron)。因为它是酶,所以一种毒素分子可以作用于许多底物分子,对细胞具有破坏性作用。毒素如白喉毒素(DT)和假单胞菌外毒素(PE)通过对延伸因子2(EF-2)的作用阻止蛋白质合成。
本文所用的术语全身注射非排他性地涉及在数秒或数小时内迅速导致细胞免疫疗法的循环水平的施用途径,并且非排他性地涉及静脉内、腹膜内、皮下、经由鼻粘膜下层、舌、经由支气管镜检查、静脉内、动脉内、肌内、眼内、纹状体内、皮下、真皮内、通过真皮贴剂、通过皮肤贴剂、通过贴剂、进入脑脊液、进入门静脉、进入脑、进入淋巴系统、胸膜内、眼眶后、真皮内、进入脾、淋巴内等。
如本文使用的术语“注射部位”非排他性地涉及肿瘤内或器官内(诸如肾或肝脏或胰腺或心脏或肺或脑或脾或眼)、肌内、眼内、纹状体内、真皮内、通过真皮贴剂、通过皮肤贴剂、通过贴剂、进入脑脊液、进入大脑等等。
本文所用的术语淋巴细胞耗竭非排他性地涉及外周血中淋巴细胞数量的减少,而不引起淋巴细胞再分布到另一器官如骨髓、胸腺、淋巴结、肺或脾或另一器官中。
本文所用的术语淋巴细胞消融非排他性地涉及将外周血中的淋巴细胞数降低至低于200/微升,优选低于100/微升,而不引起淋巴细胞再分布到另一器官如骨髓、胸腺、淋巴结、肺或脾或另一器官中。
本文所用的术语细胞毒性淋巴细胞耗竭涉及通过ADCC、细胞介导的细胞毒性或淋巴细胞的直接裂解或细胞毒性消除、化疗或放疗的机制减少外周血中的淋巴细胞数。
抗体依赖性细胞介导的细胞毒性(ADCC),也称为抗体依赖性细胞毒性,是细胞介导的免疫防御的机制,由此免疫系统的效应细胞主动裂解靶细胞,所述靶细胞的膜表面抗原已被特异性抗体结合。
本文所用的术语“细胞免疫疗法”,“过继性细胞免疫疗法”,“过继性细胞疗法”(ACT)或细胞免疫疗法或细胞疗法非排他性地涉及含有用于帮助免疫系统对抗疾病的细胞或来自免疫谱系的直接对抗疾病如癌症、自身免疫疾病和某些病毒感染的细胞的治疗。细胞免疫疗法可以来自自体或同种异体来源。在优选的实施方案中,本文公开的方法中使用的过继性免疫疗法可以是过继性T细胞免疫疗法,即‘T细胞疗法’。
本文所用的术语预调节涉及在ACT之前用细胞毒性淋巴细胞耗竭剂或无毒性淋巴细胞耗竭剂给患者作准备。
本文所用的术语免疫疗法(也称为生物疗法)非排他性地涉及用于癌症、自身免疫疾病或感染治疗的一种类型的治疗,其被设计为增强身体的天然防御以对抗癌症、自身免疫疾病或感染。它使用由身体或实验室制备的物质来改善或恢复免疫系统功能。术语“免疫疗法”是指通过包括诱导、增强、抑制或以其他方式改变免疫反应的方法治疗患有疾病或处于感染疾病或遭受疾病复发的风险中的受试者。免疫疗法的实例包括但不限于T细胞疗法。T细胞疗法可包括过继性T细胞疗法、肿瘤浸润淋巴细胞(TIL)免疫疗法、自体细胞疗法、工程化自体细胞疗法(eACT)和同种异体T细胞移植。然而,本领域技术人员将认识到本文公开的调节方法将增强任何移植的T细胞疗法的有效性。T细胞疗法的实例描述于美国专利公开号2014/0154228和2002/0006409、美国专利号5,728,388和国际公开号WO 2008/081035中。
本文所用的术语“免疫调节”在癌症、自身免疫疾病或感染中非排他性地涉及旨在利用患者的免疫系统以实现肿瘤、引起自身免疫的细胞或病毒控制、稳定和潜在根除疾病的一系列治疗。
本文所用的术语免疫调节剂非排他性地涉及改变免疫反应或免疫系统功能(如通过刺激抗体形成或抑制白细胞活性)的化学剂(如地塞米松)或生物剂(如
免疫抑制剂(也称为免疫抑制剂)可以是可抑制或防止免疫反应的化学或生物剂。例如,CD26的拮抗剂和地塞米松是免疫抑制剂。用于本发明的NTLA可以是NTLA免疫抑制剂。
术语“调节”和“预调节”在本文中可互换使用,并且表示为需要T细胞疗法用于合适的病症的患者或动物作准备。本文所用的调节包括但不限于在T细胞疗法之前减少生发中心和边缘区的数目,减少内源性淋巴细胞的数目,去除细胞因子吸收(sink),增加一种或多种稳态细胞因子或促炎因子的血清水平,增强调节后施用的T细胞的效应子功能,增强抗原呈递细胞活化和/或可用性,或其任何组合。
本文所用的术语‘过继性免疫疗法’或‘细胞过继性免疫疗法’非排他性地
本文所用的术语激动剂非排他性地
本文中使用的术语拮抗剂非排他性地
本文所用的术语抑制剂非排他性地
本文所用的术语“淋巴细胞”包括自然杀伤(NK)细胞、T细胞或B细胞。NK细胞是一类细胞毒性(细胞毒性)淋巴细胞,其代表固有免疫系统的主要成分。NK细胞排斥肿瘤和被病毒感染的细胞。它通过细胞凋亡或程序性细胞死亡的过程起作用。它们被称为“天然杀手”,因为它们不需要活化来杀伤细胞。T细胞在细胞介导的免疫中起主要作用(不涉及抗体)。其T细胞受体(TCR)将自身与其他淋巴细胞类型区分开来。胸腺是免疫系统的专门器官,主要负责T细胞的成熟。有六种类型的T细胞,即:辅助T细胞(例如CD4+细胞)、细胞毒性T细胞(也称为TC、细胞毒性T淋巴细胞、CTL、T杀伤细胞、溶细胞T细胞、CDS+T细胞或杀伤T细胞)、记忆T细胞((i)干记忆T scM细胞,如幼稚细胞,是CD45RO-、CCR7+、CD45RA+、CD62L+(L-选择素)、CD27+、CD28+和IL-7Ra+,但它们也表达大量CD95、IL-2R~、CXCR3和LFA-1,并显示记忆细胞所特有的多种功能属性);(ii)中央记忆TcM细胞表达L-选择素和CCR7,它们分泌IL-2,但不分泌IFNy或IL-4,和(iii)效应记忆T EM细胞,然而不表达L-选择素或CCR 7,但产生效应细胞因子如IFNy和IL-4)、调节性T细胞(Treg、抑制性T细胞或CD4+CD25+调节性T细胞)、天然杀伤T细胞(NKT)和γδT细胞。另一方面,B细胞在体液免疫(涉及抗体)中起主要作用。它产生抗体和抗原并发挥抗原呈递细胞(APC)的作用,并在通过抗原相互作用活化后变成记忆B细胞。在哺乳动物中,未成熟的B细胞在骨髓中形成,其名称由此来源。
术语"癌症"是指特征在于异常细胞不受控制生长的疾病。癌细胞可以局部地扩散或通过血流和淋巴系统扩散至身体的其他部分。文中描述了各种癌症的实例并且包括但不限于乳腺癌、前列腺癌、卵巢癌、宫颈癌、皮肤癌、胰腺癌、结肠直肠癌、肾癌、肝癌、脑癌、淋巴瘤、白血病、肺癌等。术语“肿瘤”和“癌症”在本文可互换使用,例如,两个术语均涵盖实体和液体肿瘤,例如弥漫性或循环性肿瘤。如本文所用,术语“癌症”或“肿瘤”包括恶化前的以及恶性的癌症和肿瘤。
特定的癌症可能对化疗或放疗有反应,或者该癌症可能是难治性的。难治性癌症是指无法通过外科手术进行干预的癌症,并且该癌症最初对化疗或放疗无反应,或癌症随时间变得无反应。
本文所用的“抗肿瘤效应”是指可表现为肿瘤体积减小、肿瘤细胞数目减少、肿瘤细胞增殖减少、转移瘤数目减少、总生存期或无进展生存期增加、预期寿命增加或与肿瘤相关的各种生理症状改善的生物效应。抗肿瘤效应还可以指预防肿瘤的发生,例如疫苗。
如本文所用,术语“无进展生存期”可缩写为PFS,是指从治疗日期到根据修订的恶性淋巴瘤IWG反应标准的疾病进展日期或任何原因引起的死亡的时间。
“疾病进展”通过测量射线照片上的恶性病变或其他方法来评估,不应报告为不良事件。无体征和症状的疾病进展导致的死亡应报告为原发性肿瘤类型(例如DLBCL)。
如本文所用,“反应持续时间”可缩写为DOR,是指受试者的首次客观反应到根据修订的恶性淋巴瘤IWG反应标准确认的疾病进展日期或死亡之间的时间段。
术语“总生存期”可缩写为OS,定义为从治疗日期到死亡日期的时间。
术语“减少”和“降低”在本文中可互换使用,并且表示小于原始值的任何变化。“减少”和“降低”是相对术语,需要测量前和测量后之间的比较。“减少”和“降低”包括完全耗竭。
受试者的“治疗(treatment)”或“治疗(treating)”是指以逆转、减轻、改善、抑制、减缓或预防症状、并发症或病症的发作、进展、发展、严重性或复发、或与疾病相关的生物化学标记为目的对受试者进行的任何类型的干预或过程,或向受试者施用活性剂。在一个实施方案中,“治疗(treatment)”或“治疗(treating)”包括部分缓解。在另一个实施方案中,“治疗(treatment)”或“治疗(treating)”包括完全缓解。
可替代物(例如,“或”)的使用应理解为意指可替代物中的一个、两个或其任意组合。如本文中所用,不定冠词“一个/种(a)”或“一个/种(an)”应该被理解为指任何所叙述或列举的组分中的“一种或多种”。
术语“约”或“基本上由...组成”是指是指本领域普通技术人员确定的特定值或组成的可接受的误差范围内的值或组成,其将部分取决于如何测量或测定该值或组成,即测量系统的限制。例如,根据本领域的实践,“约”或“基本上由...组成”可意指在1个或多于1个标准偏差内。或者,“约”或“基本上由...组成”可表示多达20%的范围(即,±20%)。例如,约3mg可包括介于2.3mg与3.6mg之间的任何数值(针对20%而言)。此外,特别是对于生物系统或过程,所述术语可以表示高达一个数量级或高达一个值的5倍。当在本申请和权利要求书中提供特定值或组成时,除非另有说明,否则“约”或“基本上由...组成”的含义应该被假定在该特定值或成分的可接受的误差范围内。
如本文中所述,任何浓度范围、百分比范围、比率范围或整数范围应理解为包括所述范围内的任何整数的值,以及在适当时包括其分数(诸如整数的十分之一和百分之一),除非另有说明。
范围:以范围形式呈现本发明的各方面。呈范围格式的描述是为了方便和简洁起见,并且不应解释为对本发明的范围进行不可改变的限制。因此,对范围的描述应被认为已经确切地公开所有可能的子范围以及所述范围内的单独数值。例如,从3到12的范围包括3.1、3.2、3.3等。
自身免疫疾病和由淋巴细胞介导且需要比HSCT更简单且成本更低的治疗的其他疾病涉及但不限于以下列表;过敏、哮喘、残留HIV、生发中心淋巴瘤如Burkitts淋巴瘤和弥漫性大B细胞淋巴瘤、边缘区淋巴瘤、移植物抗宿主病(GvHD)、类固醇抗性GvHD、失弛缓症、阿狄森氏病、成人斯蒂尔病、无丙种球蛋白血症、斑秃、淀粉样变性病、强直性脊柱炎、抗GBM/抗TBM肾炎、抗磷脂综合征、自身免疫性血管性水肿自身免疫性,自主神经功能障碍,自身免疫性脑脊髓炎、自身免疫肝炎、自身免疫内耳病(AIED)、自身免疫性心肌炎、自身免疫性卵巢炎、自身免疫性睾丸炎、自身免疫性胰腺炎、自身免疫性视网膜病、自身免疫性荨麻疹、轴索性和神经元神经病(AMAN)、贝罗病、白塞氏病、良性黏膜类天疱疮、大疱性类天疱疮、卡斯尔门病(CD)、乳糜泻、南美洲锥虫病、慢性炎症性脱髓鞘性多发性神经病(CIDP)、慢性复发性多病灶性骨髓炎(CRMO)、Churg-Strauss综合征(CSS)或嗜酸粒细胞性肉芽肿病(EGPA)、瘢痕性类天疱疮、耳蜗前庭综合征、冷凝集素病、先天性心脏阻滞、柯萨奇病毒性心肌炎、CREST综合征、克罗恩氏病、疱疹样皮炎、皮肌炎、德维克氏病(视神经脊髓炎)、盘状狼疮、德雷斯勒氏综合征、子宫内膜异位、嗜酸细胞食管炎(EoE)、嗜酸细胞性筋膜炎、结节性红斑、原发性混合型冷球蛋白血症、伊文氏综合征、纤维肌痛、纤维化肺泡炎、巨细胞动脉炎(颞动脉炎)、巨细胞性心肌炎、肾小球肾炎、古德帕斯丘氏综合征、肉芽肿性多血管炎、格雷夫斯氏病、吉兰-巴雷综合征、桥本氏甲状腺炎、溶血性贫血、亨-舒紫癜(HSP)、妊娠疱疹或妊娠性类天疱疮(PG)、化脓性汗腺炎(HS)(痤疮)、低丙种球蛋白血症、IgA肾病、IgG4相关硬化病、免疫性血小板减少性紫癜(ITP)、包涵体肌炎(IBM)、间质性膀胱炎(IC)、幼年型关节炎、幼年型糖尿病(1型糖尿病)、幼年型肌炎(JM)、川崎病、兰伯特-伊顿综合征、白细胞碎裂性血管炎、扁平苔藓、硬化性苔藓、木样结膜炎、线状IgA病(LAD)、狼疮、慢性莱姆病、梅尼耳氏病、显微镜下多动脉炎(MPA)、混合型结缔组织病(MCTD)、莫伦氏溃疡、穆-哈二氏病、多灶性运动神经病(MMN)或MMNCB、多发性硬化、重症肌无力、肌炎、嗜眠发作、视神经脊髓炎、嗜中性白血球减少症、眼瘢痕性类天疱疮、视神经炎、复发性风湿病(PR)、PANDAS、副肿瘤性小脑变性(PCD)、阵发性睡眠性血红蛋白尿症(PNH)、帕罗综合征、睫状体平坦部炎(周边葡萄膜炎)、Parsonnage-Turner综合征、天疱疮、周围神经病、静脉周围脑脊髓炎、恶性贫血(PA)、POEMS综合征、结节性多动脉炎、多腺体综合征I、II、III型、风湿性多肌痛、结节性多动脉炎、多肌炎、心肌梗死后综合征、心包切开术后综合征、原发性胆汁性肝硬化、原发性硬化性胆管炎、孕酮性皮炎、牛皮癣、牛皮癣性关节炎、单纯红细胞再生障碍性贫血(PRCA)、坏疽性脓皮病、雷诺氏现象、反应性关节炎、反射性交感神经营养不良、复发性多软骨炎、不宁腿综合征(RLS)、腹膜后纤维化、风湿热、类风湿性关节炎、肉状瘤病、施密特综合征、巩膜炎、硬皮病、休格连氏综合征、精子和睾丸自身免疫性、僵人综合征(SPS)、亚急性细菌性心内膜炎(SBE)、苏萨克氏综合征、交感性眼炎(SO)、高安氏动脉炎、颞动脉炎/巨细胞动脉炎、血小板减少性紫癜(TTP)、Tolosa-Hunt综合征(THS)、横贯性脊髓炎、1型糖尿病、溃疡性结肠炎(UC)、未分化型结缔组织病(UCTD)、葡萄膜炎、血管炎、白癜风、原田病。
在本发明的某些实施方案中,人们可能希望排除诸如以下的疾病:过敏、哮喘、残留HIV、生发中心淋巴瘤如Burkitts淋巴瘤和弥漫性大B细胞淋巴瘤、边缘区淋巴瘤、移植物抗宿主病(GvHD)、类固醇抗性GvHD、失弛缓症、阿狄森氏病、成人斯蒂尔病、无丙种球蛋白血症、斑秃、淀粉样变性病、强直性脊柱炎、抗GBM/抗TBM肾炎、抗磷脂综合征、自身免疫性血管性水肿自身免疫性,自主神经功能障碍,自身免疫性脑脊髓炎、自身免疫肝炎、自身免疫内耳病(AIED)、自身免疫性心肌炎、自身免疫性卵巢炎、自身免疫性睾丸炎、自身免疫性胰腺炎、自身免疫性视网膜病、自身免疫性荨麻疹、轴索性和神经元神经病(AMAN)、贝罗病、白塞氏病、良性黏膜类天疱疮、大疱性类天疱疮、卡斯尔门病(CD)、乳糜泻、南美洲锥虫病、慢性炎症性脱髓鞘性多发性神经病(CIDP)、慢性复发性多病灶性骨髓炎(CRMO)、Churg-Strauss综合征(CSS)或嗜酸粒细胞性肉芽肿病(EGPA)、瘢痕性类天疱疮、耳蜗前庭综合征、冷凝集素病、先天性心脏阻滞、柯萨奇病毒性心肌炎、CREST综合征、克罗恩氏病、疱疹样皮炎、皮肌炎、德维克氏病(视神经脊髓炎)、盘状狼疮、德雷斯勒氏综合征、子宫内膜异位、嗜酸细胞食管炎(EoE)、嗜酸细胞性筋膜炎、结节性红斑、原发性混合型冷球蛋白血症、伊文氏综合征、纤维肌痛、纤维化肺泡炎、巨细胞动脉炎(颞动脉炎)、巨细胞性心肌炎、肾小球肾炎、古德帕斯丘氏综合征、肉芽肿性多血管炎、格雷夫斯氏病、吉兰-巴雷综合征、桥本氏甲状腺炎、溶血性贫血、亨-舒紫癜(HSP)、妊娠疱疹或妊娠性类天疱疮(PG)、化脓性汗腺炎(HS)(痤疮)、低丙种球蛋白血症、IgA肾病、IgG4相关硬化病、免疫性血小板减少性紫癜(ITP)、包涵体肌炎(IBM)、间质性膀胱炎(IC)、幼年型关节炎、幼年型糖尿病(1型糖尿病)、幼年型肌炎(JM)、川崎病、兰伯特-伊顿综合征、白细胞碎裂性血管炎、扁平苔藓、硬化性苔藓、木样结膜炎、线状IgA病(LAD)、狼疮、慢性莱姆病、梅尼耳氏病、显微镜下多动脉炎(MPA)、混合型结缔组织病(MCTD)、莫伦氏溃疡、穆-哈二氏病、多灶性运动神经病(MMN)或MMNCB、多发性硬化、重症肌无力、肌炎、嗜眠发作、视神经脊髓炎、嗜中性白血球减少症、眼瘢痕性类天疱疮、视神经炎、复发性风湿病(PR)、PANDAS、副肿瘤性小脑变性(PCD)、阵发性睡眠性血红蛋白尿症(PNH)、帕罗综合征、睫状体平坦部炎(周边葡萄膜炎)、Parsonnage-Turner综合征、天疱疮、周围神经病、静脉周围脑脊髓炎、恶性贫血(PA)、POEMS综合征、结节性多动脉炎、多腺体综合征I、II、III型、风湿性多肌痛、结节性多动脉炎、多肌炎、心肌梗死后综合征、心包切开术后综合征、原发性胆汁性肝硬化、原发性硬化性胆管炎、孕酮性皮炎、牛皮癣、牛皮癣性关节炎、单纯红细胞再生障碍性贫血(PRCA)、坏疽性脓皮病、雷诺氏现象、反应性关节炎、反射性交感神经营养不良、复发性多软骨炎、不宁腿综合征(RLS)、腹膜后纤维化、风湿热、类风湿性关节炎、肉状瘤病、施密特综合征、巩膜炎、硬皮病、休格连氏综合征、精子和睾丸自身免疫性、僵人综合征(SPS)、亚急性细菌性心内膜炎(SBE)、苏萨克氏综合征、交感性眼炎(SO)、高安氏动脉炎、颞动脉炎/巨细胞动脉炎、血小板减少性紫癜(TTP))、Tolosa-Hunt综合征(THS)、横贯性脊髓炎、1型糖尿病、溃疡性结肠炎(UC)、未分化型结缔组织病(UCTD)、葡萄膜炎、血管炎、白癜风、原田病。
本发明免疫设置的进一步讨论
脾脏含有白髓与红髓。脾脏的红髓持有正常地从循环中过滤并去除衰老或缺陷红细胞(RBC)和包被抗体的细菌或红细胞的巨噬细胞。脾脏的白髓含有淋巴样区室(lymphoidcompartments)并且对免疫监视和反应是关键的:它合成针对入侵病原体的抗体并且响应于流血或感染而释放血小板和中性粒细胞。认为脾脏在发育期间具有多种作用,包括作为造血
脾脏白髓的动脉周淋巴样鞘(PALS)主要由T细胞群居,而淋巴部分主要由B细胞群居。生发中心(GC)是在外周淋巴组织中的淋巴结或淋巴小结内和在脾脏的白髓中的部位,其中密集的成熟B淋巴细胞(或者称为中心细胞)快速地增殖、分化、通过体细胞超突变进行突变并且在抗体反应期间进行类别转换(class switch)。生发中心是B细胞体液免疫反应的重要部分。它们在B细胞被T依赖性抗原活化之后动态发育。在组织学上,GC描述了淋巴组织中的显微镜下可分辨的部分。活化的B细胞从初级聚集中心迁移到初级滤泡滤泡系统(primary follicles follicular system)中并且在滤泡树突细胞(FDC)的环境中开始单克隆扩增。
扩增几天之后,B细胞使它们的编码抗体的DNA突变,并且因此在生发中心中产生多种克隆。这涉及由体细胞超突变引起的随机取代、缺失以及插入。在一些来自FDC的未鉴别出的刺激下,成熟B细胞(中心母细胞)从暗区迁移至亮区并且开始将它们的抗体暴露至它们的表面,并且在这个阶段被称为中心细胞。中心细胞处于活化的细胞凋亡状态并且从呈递抗原的FDC竞争生存信号。这个拯救过程被认为是取决于抗体对抗原的亲和力。功能性B细胞然后与辅助性T细胞相互作用以得到最后的分化信号。这也涉及例如从IgM至IgG的同种型转换。与T细胞的相互作用被认为是防止自反应性抗体的产生。B细胞成为传播抗体的浆细胞或在随后与相同抗原接触中被活化的记忆B细胞。根据再循环假设,它们还可以重新开始增殖、突变以及选择的整个过程。
可以将脾脏白髓区内含有的B细胞进一步划分到特定的区域中,这通过用特定的分子标记物染色加以鉴别。脾脏的边缘区含有非循环成熟B细胞,所述细胞与白髓结界,从而在白髓和红髓之间形成间隔,并且表达高水平的CD21和IgM和CD24以及CD79a,和可测量水平的CD9和CD22。外套区围绕正常的生发中心滤泡并且表达CD21、CD23以及CD38。滤泡区包含在生发中心内并且表达高水平的IgD和CD23、中等水平的CD21和CD24,并且也可以通过PNA染色来鉴别。生发中心通过PNA结合加以最好的辨别并且表达比滤泡区更高水平的CD54。生发中心具有特别的辅助性T细胞群体,它们似乎在所有生发中心中均匀分布。生发中心在传统上与需要T辅助性细胞的免疫反应相关,尽管这不是绝对的。生发中心是高变基因突变发生和产生高亲和力IgG的B细胞产生之处。活跃的生发中心具有有形(tangible)巨噬细胞和表达CD21的树突细胞。滤泡中心也可以通过CD45R(B220)的表达来鉴别(Cytotoxicologic Pathology,35:366-375,2007)。发现CD45R滤泡中心包围表达Bcl6和Bcl2的生发中心。BioEssays 29:166–177,2007;Cytotoxicol Pathol 34(5):648–655,(2006)]
对病原体或癌细胞的反应由参与免疫反应的大量不同细胞类型的复杂相互作用和活性来协调。先天免疫反应是第一道防线并且在病原体暴露后不久发生。其通过吞噬细胞如中性粒细胞和巨噬细胞、细胞毒性天然杀伤(NK)细胞和粒细胞进行。随后的适应性免疫反应引发抗原特异性防御机制并且可能需要数天才能发展。在适应性免疫中具有关键作用的细胞类型是抗原呈递细胞,包括巨噬细胞和树突状细胞。包括T细胞亚群、B细胞和巨噬细胞的各种细胞类型的抗原依赖性刺激都在宿主防御中发挥关键作用。免疫细胞非排他性地涉及:B细胞、树突状细胞、粒细胞、先天性淋巴细胞(ILC)、巨核细胞、单核细胞/巨噬细胞、髓源抑制性细胞(MDSC)、天然杀伤(NK)细胞、血小板、红细胞(RBC)、T细胞、胸腺细胞。
Zwang等人(2014)已经表明,在淋巴细胞耗竭后,淋巴细胞通过增强的胸腺生成和残留未耗竭的外周淋巴细胞的增殖来重新填充免疫空间。术语稳态增殖(或者稳态扩增或淋巴细胞减少诱导的增殖)是指后一种过程。稳态增殖与移植中免疫耗竭疗法后淋巴细胞区室的重建特别相关。重新填充淋巴细胞可偏向于能够诱导移植物排斥、自身免疫或在同种异体骨髓移植的情况下诱导移植物抗宿主疾病的效应记忆类型。
两种免疫耗竭剂,阿仑单抗和兔抗胸腺细胞球蛋白,已经在它们在重建淋巴细胞中诱导效应记忆表型的能力方面得到充分表征。
稳态增殖的早期研究显示,在淋巴细胞耗竭中幸存的T细胞分裂、发育出记忆表型和功能,然后以显性方式起作用,通过共刺激阻断使动物对心脏或肾同种异体移植物耐受具有抗性。1,2与这些发现一致,最近的研究显示淋巴细胞减少本身足以破坏稳定的基于共刺激阻断的外周耐受。3在MHC不匹配(mimatched)的心脏移植的小鼠模型中,淋巴细胞减少(通过照射或抗CD4+/CD8+单克隆抗体实现)诱导急性T和B细胞介导的排斥,伴随T细胞向CD44hi效应记忆(EM)表型转变和供体特异性抗体的出现。稳态增殖过程可分为“缓慢”(每24-36小时一次细胞分裂)或“快速”(每6-8小时一次分裂)动力学。虽然缓慢增殖响应于“空白空间的感知”而发生,但快速增殖主要是肠道抗原驱动的过程。4缓慢的稳态增殖在小鼠模型中淋巴细胞耗竭后的稳态增殖中占优势。此外,T和B细胞都可以经历稳态增殖。
阿仑单抗(抗CD52)是有效的淋巴细胞耗竭剂,其已经用作移植和治疗多发性硬化的诱导疗法。CD4+细胞和在较小程度上幼稚CD8+细胞对阿仑单抗诱导的淋巴细胞耗竭最敏感。5,6,7,8然而,较大群体的幼稚T细胞可以保持无缺失,因为外周淋巴结可以是阿仑单抗诱导后这些细胞的贮库。9阿仑单抗疗法在肾移植受体中导致向记忆CD4+和CD8+表型的偏斜;在阿仑单抗疗法后具有排斥证据(通过活检,新的或供体特异性抗体)的患者具有增加比例的CD8+效应记忆细胞(CD45RO-CD62L-)。10这些相同患者的CD4+细胞中调节性T细胞(Treg)的频率进一步降低。相反,其他工作表明在阿仑单抗诱导后Foxp3+细胞的频率增加。11在这种情况下,Foxp3表达可能仅是T细胞活化的瞬时标记物。12,13,14在多发性硬化患者中,阿仑单抗疗法后的稳态增殖导致CD4+和CD8+细胞的高度活化的、增殖性的、寡克隆的和记忆样的群体的恢复。15特别地,CD8库由表达穿孔素和粒酶B的末端分化的效应记忆CD28-CD57+CD8群体支配。这种群体被认为与自身免疫相关,并且实际上在87名患者的此研究中,三分之二发展出(主要是甲状腺)自身免疫。
最近对肾移植中作为诱导疗法给予的rATG后淋巴细胞耗竭动力学的检查发现,与巴利昔单抗或无诱导疗法后的最小T细胞耗竭相比,rATG在6个月时将T细胞区室持久耗竭至计数低于250CD3+细胞/μL。19与先前研究相反,此最近研究发现rATG诱导后1个月胸腺生成(即CD4+或CD8+细胞中的CD31+细胞)没有增加。相反,IL-7和IL-15通过Stat5的外周细胞因子介导的信号传导在rATG疗法后的第一个月增加,特别是在记忆T细胞亚群中。这些研究表明ATG后的T细胞恢复来自外周T细胞库而不是胸腺生成增加。
在人类中,与小鼠不同,大多数增殖T细胞来源于外周而不是胸腺。20因此,外周细胞因子信号传导对于维持淋巴细胞充足(lymphoreplete)状态和在淋巴细胞减少症中重新填充T细胞区室是必需的。IL-7是负责T细胞稳态增殖的主要细胞因子。在经胸腺切除术的年轻人和老年人中,循环IL-7水平高于健康对照的水平。21胸腺功能低或无胸腺功能的这些患者中的IL-7似乎通过STAT5信号传导刺激T细胞增殖。IL-7本身已被描述为维持T细胞区室的“变阻器”。22在淋巴细胞减少症中,过量的IL-7刺激T细胞增殖。增殖的T细胞消耗IL-7,并且当T细胞区室重新填充时水平下降到基础状态。此机制防止过度增殖并保持T细胞稳态。最近的研究发现IL-7诱导的增殖需要间断的(而不是连续的)信号传导,并且TCR接合提供了这种中断。23对外周(自身)TCR配体具有不充分亲和力的T细胞在延长的IL-7信号传导后死亡;这种机制维持了对自身配体具有适当亲和力的T细胞群体。除了IL-7之外,IL-15信号传导对于CD8+T细胞生存和增殖是重要的。24,25,26虽然IL-15增强记忆CD8+细胞的稳态增殖,但单独的IL-15不足以用于幼稚CD8 T细胞的稳态增殖。27在幼稚CD8+细胞中,MHC I接合对于稳态增殖也是必需的。28新出现的数据显示记忆CD4+也可能对IL-15有反应。29,30,31最后,TGB-β可能减弱IL-15信号传导并对稳态增殖驱动的自身免疫起制动作用。32,33,34,35,36,37
抑制CD4+和CD8+细胞中TCR信号传导的蛋白酪氨酸磷酸酶基因产物PTPN2涉及人自身免疫。38,39与对照动物相比,在小鼠模型中T细胞的PTPN2敲除导致更快速的淋巴细胞减少诱导的CD8+增殖。与对照CD8+细胞的过继转移相比,将PTPN2缺失的CD8+细胞过继转移到同类宿主中导致效应/记忆分化和自身免疫。40此反应是IL-7非依赖性的。miRNA-181a部分通过抑制其他蛋白磷酸酶的表达来增强TCR信号传导。41因此,miRNA-181或另一种miRNA可能抑制PTPN2表达,从而抑制淋巴细胞减少诱导的增殖。已经表明转录因子可以调节造血干细胞重新填充淋巴细胞区室的能力。例如,HoxB4信号传导可促进响应于淋巴细胞减少的造血干细胞CD4+中央记忆(CD44hiCD62L+)表型。42在竞争性过继转移实验中,Hoxb4-过表达的中央记忆细胞比野生型中央记忆细胞对淋巴器官重建的贡献小。最后,整联蛋白CD18(淋巴细胞功能相关抗原-1或LFA-1)在肠道和次级淋巴器官之间的幼稚T细胞运输中起作用43,44,并与肠道自身免疫有关。45CD4+CD18-/-细胞向Rag-/-宿主中的过继转移表明快速和缓慢淋巴细胞减少诱导的增殖对CD18的需求。46上述研究说明了,稳态增殖的非细胞因子调节剂在稳态增殖中偏向效应记忆表型的重要性。
克服作为移植屏障的稳态增殖的另一种潜在方法是删除移植受体中特异性的潜在病理性CD8+细胞。Yamada等人采用此方法,在非人灵长类的MHC不匹配的肾移植的混合嵌合模型中,在淋巴细胞耗竭时使用抗-CD8 mAb;54他们在CD8耗竭的动物中Tmem反应降低的发现是令人鼓舞的。同一组随后研究了阿来法塞(alefacept),一种人白细胞功能抗原-3(LFA-3)粘附分子的细胞外CD2结合部分的融合蛋白。55此剂被认为通过阻断效应记忆CD2+细胞和LFA-3之间的相互作用来中断细胞毒性效应记忆T细胞增殖。用于银屑病的阿来法塞疗法优先耗竭CD4+CD45RO+效应记忆细胞,其与皮肤病变中的临床改善相关。56在非人灵长类动物移植模型中阿来法塞优先和可逆地耗竭CD8+效应记忆(CD28-CD95+)细胞57;此模型中的CD28-细胞是CD2hi,有助于解释阿来法塞优先消耗CD8+细胞的能力。
移植后环磷酰胺施用是通过耗竭否则可能在诱导疗法中幸存的同种异体反应性CD8+细胞来预防GVHD的有吸引力的方法。58,59最近的数据表明,移植后环磷酰胺施用主要靶向快速分裂的同种异体特异性细胞,相对地保留HSCT后维持免疫活性所必需的幼稚细胞。60CD4+Foxp3+Treg似乎对环磷酰胺具有抗性并且在环磷酰胺诱导用于同种异体骨髓移植后迅速恢复。61Treg的保留可能部分地构成环磷酰胺预防GVHD的机制的基础。
Thangavelu等人(2005)证明了类风湿性关节炎(RA)患者在淋巴细胞耗竭疗法后长期的深刻的CD4+T淋巴细胞减少。重建不良可由通过胸腺的从头T细胞产生减少或由残留T细胞的外周扩增不良引起。已知白介素-7(IL-7)刺激胸腺产生新的T细胞并允许循环的成熟T细胞扩增,从而在T细胞稳态中起关键作用。在本研究中,我们证明RA患者的横截面中循环IL-7水平降低。骨髓基质细胞培养物的IL-7产生在RA中也受到损害。为了研究这种IL-7缺陷是否可以解释在治疗性淋巴细胞耗竭后在RA中观察到的长期的淋巴细胞减少,我们比较了RA患者与用高剂量化疗和自体祖细胞拯救治疗的实体癌患者。化疗使所有患者具有类似的淋巴细胞减少,但与癌症患者3-4个月时发生的重建相比,这在RA患者中在12个月时持续。两个队列均产生含有T细胞受体切除环的幼稚T细胞。各组之间的主要区别特征是在治疗后前3个月内不能扩增RA中的外周T细胞,特别是记忆细胞。最重要的是,与淋巴细胞减少时非RA对照个体中增加4倍相比,RA中血清IL-7水平没有增加。因此,我们的数据表明RA患者是相对IL-7缺陷的,并且这种缺陷可能是治疗性淋巴细胞耗竭后RA中早期T细胞重建不良的重要导致因素。此外,在具有稳定的、良好控制的疾病的RA患者中,IL-7水平与CD4+T细胞的T细胞受体切除环含量正相关,这表明IL-7在这队列中对胸腺活动的直接作用。
实施例
以下实施例证明高剂量糖皮质激素受体激动剂可引起外周血淋巴细胞的接近完全的淋巴细胞耗竭,以及减少淋巴器官中生发中心的数量和耗竭胸腺淋巴细胞。实现这些效果而基本上不影响中性粒细胞、血小板、RBC和干细胞(HSC和MSC)的细胞计数。
这些实施例还表明,高剂量糖皮质激素激动剂的这种淋巴细胞耗竭概况类似于标准化疗方案(基于环磷酰胺(Cy)和氟达拉滨(Flu)),但不引起相关的体重减轻(此类化疗方案的毒性的一般量度)。
因此,高剂量的糖皮质激素激动剂代表非骨髓消融性方案,其可产生具有与化疗相当的功效但无相关毒性的“免疫复位”。因此,高剂量糖皮质激素受体激动剂代表了用于治疗由免疫细胞如淋巴细胞介导的疾病的有希望的疗法。
急性高剂量地塞米松在本文中也可称为Dex、AugmenStem
对于小鼠,在第0天给雄性小鼠腹膜内注射114.6mg/kg地塞米松碱(HED 9.32mg/kg)的地塞米松磷酸钠,并在地塞米松注射后96小时处死。通过放血处死小鼠,然后用5U肝素/mlPBS通过逆行冲洗将残留血细胞冲洗到胸颈静脉中。取出脾脏,称湿重,然后在10%福尔马林中固定。随后通过专有方法将脾切片,然后与FITC-PNA在4℃孵育24小时,洗涤,置于载玻片上并捕获免疫荧光图像。使用MetaMorph软件来定量免疫荧光信号。样品图像和对脾面积归一化的结果示于图1中。
对照小鼠具有显著的FITC-PNA免疫荧光,而注射地塞米松磷酸钠的小鼠几乎没有免疫荧光信号。FITC-PNA标记生发中心,其非排他性地涉及脾和淋巴结。此实施例证明了高剂量地塞米松减少淋巴器官中生发中心(GC)数量的能力,其可以消除自身反应性免疫记忆。减少淋巴器官中生发中心的数量也可以迫使癌细胞(例如生发中心淋巴瘤)或与这些中心中的龛结合的残留HIV感染T细胞进入循环,在循环中它们可以通过免疫系统或标准疗法被消除。
图2显示了急性高剂量地塞米松(以HED计)对小鼠脾脏中生发中心数量影响的剂量反应。生发中心减少在HED 6mg/kg下是明显的,但直到9和12mg/kg剂量的HED才显著减少。
对于大鼠,施用(IV或PO)3.23、6.45和12.9mg/kg之间的地塞米松HED(大鼠剂量20、40和80mg/kg)以在48小时后测定GC和边缘区抑制。在大鼠中,12.9mg/kg的HED Dex剂量最大地抑制GC和边缘区数目和面积,如图3和图4所示。将福尔马林固定的脾脏切成5片、修剪并包埋在石蜡中,切片并用苏木精和曙红(H&E)染色。使用目镜测微计测量动脉周围淋巴鞘(PAL)直径和具有最大直径PAL的白髓区域中边缘区(MZ)的宽度。使用自动图像分析方法评估大鼠脾脏中的BCL-6免疫组织化学染色以确定GC面积。
急性高剂量地塞米松也降低胸腺质量和体积(图5)。对于小鼠,在第0天对雄性小鼠口服施用媒介物或3、6、9和12mg/kgHED地塞米松碱的地塞米松磷酸钠,并在地塞米松治疗后48小时处死。通过放血处死小鼠,然后用5U肝素/mlPBS通过逆行冲洗将残留血细胞冲洗到胸颈静脉中。取出每只小鼠的胸腺,称湿重,以胸腺重量/体重作图。
在幼稚小鼠和大鼠模型中进行的初步剂量递增研究表明,施用高剂量地塞米松导致完全淋巴细胞耗竭(图11,右侧)。高剂量地塞米松能够诱导施用后48小时测量的CD4+、CD8+、Treg和B细胞群体的约98%的减少,这支持自身免疫病理生理学底物的快速消融。早期验证显示,急性高剂量地塞米松具有2-3小时的药代动力学半衰期和4-5天的药效学半衰期,这排除了长期的免疫抑制。此外,急性高剂量地塞米松的口服给药具有与IV给药相当的效果,这支持使用急性高剂量地塞米松作为单一口服治疗。
如图6所示,与施用后48小时的安慰剂相比,向体重250-300克的雄性Lewis大鼠IV或PO施用20(3.2HED)、40(6.5HED)或80(12.9HED)mg/kg的地塞米松在所有剂量下显著减少了淋巴细胞计数。相反,如图7所示,急性高剂量地塞米松没有减少中性粒细胞。实际上,所有剂量的地塞米松都增加了中性粒细胞的数量,可能是通过去边界(demargination)作用。RBC、血小板、Hct、HgB不受地塞米松治疗的影响。
与安慰剂(n=7)相比,以HED 3mg/kg(n=4)、HED 6mg/kg(n=6)、HED 9mg/kg(n=4)、12mg/kg(n=4)、15mg/kg(n=4)或17.5mg/kg(n=4)向C57Bl雄性小鼠口服急性施用地塞米松使CD3+T淋巴细胞减少65%并且使CD4+T淋巴细胞减少75%(图8),使CD8+T淋巴细胞减少56%并且使Treg减少78%(图9),使自然杀伤细胞(NK)减少87%并且使B淋巴细胞减少83%(图10),使绝对淋巴细胞计数减少84%,但保留中性粒细胞(图11)、RBC(图12)和血小板(图13)。在通过经口灌胃法施用地塞米松后24至48小时抽取血液用于全血化学(CBC)和流式细胞术。在HED剂量大于12mg/kg下,在正常小鼠中观察到几乎完全的淋巴细胞消融。在荷瘤小鼠中,接近完全的淋巴细胞消融剂量将是HED大于6mg/kg。
急性高剂量地塞米松通过半胱天冬酶途径活化受体介导的细胞凋亡,并根据所用剂量使所有淋巴细胞经受淋巴细胞耗竭或淋巴细胞消融。如从其受体介导的作用模式所预期的,地塞米松由于缺乏或由于在这些细胞上的不同糖皮质激素受体而诱导淋巴细胞耗竭,从而保留中性粒细胞、血小板和红细胞(RBC)。使用高剂量的地塞米松观察到在外周血和骨髓两者中的中性粒细胞计数高于安慰剂的趋势,这支持了在淋巴细胞耗竭治疗期间对感染的可能抵抗。
明显地,高剂量的地塞米松不显著改变小鼠中造血干细胞的量(图13)。因此,以急性高剂量地塞米松为代表的非骨髓消融性方案可以消除在免疫复位后对干细胞输血用于造血恢复的需要。
将3mg/kg地塞米松碱等效量(在这些实施例中给出的所有剂量均为地塞米松碱等效量)口服急性施用给4名人类患者,3名患有膝骨关节炎,1名患有主动脉瘤。在药物治疗前和治疗后48小时抽取血液用于CBC分析和流式细胞术以测定淋巴细胞和其他血细胞群体。分析血清的细胞因子水平。对于一名患者,未得到治疗前CBC,因此仅显示3名患者的归一化流式细胞术数据。根据未归一化的流式细胞术数据,对于此剂量的地塞米松,4名患者中仅有2名对地塞米松有淋巴细胞耗竭反应(图14、图15和图16),而4名患者中有2名在CD3和CD4淋巴细胞中显示淋巴细胞增多反应,4名患者中有1名在CD8、B淋巴细胞和NK细胞中显示淋巴细胞增多反应。急性口服地塞米松碱(3mg/kg)后48小时,4名患者中有3名显示IL-2水平升高,并且4名患者中有4名显示IL-15水平升高(图17)。IL-6(一种已知是潜在致命细胞因子释放综合征(CRS)的主要驱动因素的细胞因子)在任何患者中都不升高。基于在3mg/kg剂量下在4名非癌症患者中的2名中观察到的淋巴细胞增多反应,基于荷瘤小鼠对地塞米松增加的敏感性(其中与健康小鼠中的HED 114mg/kg相比,荷瘤小鼠中的最低致死剂量是HED43mg/kg),优选的淋巴细胞耗竭剂量将是3mg/kg或更高(Scorza Barcellona,1984)。
施用地塞米松后48小时抽取骨髓,并且通过集落形成测定成纤维细胞(CFU-F)确定间充质干细胞(MSC)数量。口服施用地塞米松碱3mg/kg增加髂嵴骨髓(BM)MSC几乎两倍(图18)。在对马的研究中还测定了BM MSC的三系分化能力。在对马进行1小时IV输注施用后48小时,6mg/kg HED使胸骨BM MSC干细胞数量加倍,但不改变MSC向骨细胞、软骨细胞或脂肪细胞的三系分化能力。
在第-2天以12mg/kg或17.5mg/kg HED通过经口灌胃法向成年雄性小鼠施用地塞米松碱。在第-5天和第-4天向另一组小鼠IP施用166mg/kg(HED 500mg/m2)的Cy,以及在第-5天、第-4天、第-3天、第-2天施用10mg/kg(HED 30mg/m2)的氟达拉滨。在第-5天向第三组小鼠IP施用166mg/kg(HED 500mg/m2)的Cy,以及在第-5天施用10mg/kg(HED 30mg/m2)的氟达拉滨,然后在第-2天口服施用12mg/kg或17.5mg/kg HED地塞米松碱。CBC和流式细胞术结果如图19-24所示,体重如图25所示。
在抽血前12-72小时之间给予的地塞米松碱12mg/kg或17.5mg/kg HED导致与标准2天Cy和4天Flu相当的淋巴细胞耗竭概况,与第-5天单次Cy和第-5天单次Flu与第-2天12mg/kg地塞米松HED的组合一样(图23)。单次Cy和单次Flu剂量可以在第-6天、第-4天或第-3天施用,具有相同的效果。单独地塞米松的淋巴细胞耗竭概况可能是优选的,因为绝对淋巴细胞不像CyFlu那样被大幅耗竭,并且当在CyFlu后进行过继性细胞疗法时,淋巴细胞耗竭的程度可能与神经水肿有关。
作为毒性的一般量度,标准重复CyFlu方案显著降低体重,而12mg/kg或17.5mg/kg地塞米松碱HED不影响体重。在第-5天一次Cy和一次Flu剂量与12mg/kg地塞米松HED的组合对体重的影响显著低于标准CyFlu方案,而在第-5天一次Cy和一次Flu剂量与17.5mg/kg地塞米松HED的组合对体重没有影响(图25)。这表明急性高剂量地塞米松具有与基于环磷酰胺(Cy)和氟达拉滨(Flu)的标准化疗相当的淋巴细胞耗竭概况,但没有相关的体重减轻,这证实了地塞米松制剂与化疗相比的安全性。
另外,在用急性高剂量地塞米松的双盲对照马试验中,在长达70天内没有观察到不良副作用。
迄今为止收集的数据表明,急性高剂量地塞米松的安全概况与批准的DSP产品一致。对于各种病症,急性高剂量地塞米松的建议剂量(HED 3-18mg/kg)等于或小于每天安全且有效地用于脉冲疗法长达5天的DSP的累积剂量,并且DSP在医师发起的高剂量脉冲疗法临床使用中具有良好的耐受性(Han等人,2014;Annane等人,2004;Ayache等人,2014)。对少数人骨关节炎患者进行的初步研究揭示,急性高剂量地塞米松提高血浆IL-2和IL-15细胞因子的水平,而不影响促炎性细胞因子(例如,IL-6)的浓度,如化疗方案后所见(US9855298B2)。在用增加HED剂量(6-12mg/kg)的急性高剂量地塞米松治疗的小鼠中的临床化学的全面分析显示,急性口服剂量是安全的并且不会将临床化学水平升高到正常范围之外,包括胆固醇和总蛋白。此外,虽然已显示慢性低剂量的DSP引起不期望的副作用,包括体重增加和葡萄糖增加(Ferris&Kahn,2012),但是已发现急性高剂量地塞米松后的葡萄糖水平并未升高到超出正常范围。总之,急性高剂量地塞米松的淋巴细胞耗竭活性和其安全概况强烈支持其用作自身免疫疾病的免疫复位治疗,其功效与化疗相当。
可以在第-1天或第-2天或第-3天或第-4天或第-5天作为单一剂量给予并且在第-2天与约3至约12mg/kg的地塞米松组合的其他标准化疗方案包括:Cy 120mg/kg和Flu75mg/m2;30mg/m2 flu和50mg/kg Cy和200cGy TBI;Cy 1500mg/m2和苯达莫司汀120mg/m2;约300mg/m2至约2300mg/m2的Cy;约10mg/m2至约900mg/m2的Flu;Cy 600mg/m2和Flu 30mg/m2;白消安和美法仑和Flu;白消安(根据体重调整剂量)和噻替哌(10mg/kg)和氟达拉滨(160mg/m2);Flu 30mg/m2和Cy 300mg/m2和Mensa 300mg/m2;Flu 30mg/m2和Cy 60mg/m2和阿仑单抗0.2mg/kg。
可以用糖皮质激素免疫抑制剂或用地塞米松剂量治疗患有自身免疫疾病的患者,所述自身免疫疾病例如但不限于:SLE、银屑病、类风湿性关节炎、银屑病关节炎、I型糖尿病、多发性硬化、干燥综合征、硬皮病、格雷夫斯病、桥本甲状腺炎、乳糜泻、艾迪生病、重症肌无力、自身免疫性肝炎、抗磷脂综合征、胆道胆管炎。急性高剂量地塞米松(作为碱)的剂量范围为约3mg/kg至约24mg/kg,优选约9mg/kg至约18mg/kg的剂量。
急性高剂量地塞米松剂量使B淋巴细胞数减少大于90%,并且当记忆B细胞在20岁以上人中占B细胞区室的大约50%时,记忆B细胞群体也减少大于90%。患者的自身免疫攻击B细胞已经凋亡并且患者停止以具有主动自身免疫攻击。患者的身体症状得到改善或消除。在大多数患者中从自身免疫疾病的缓解无限期地持续,然而,如果患者复发,则可施用重复剂量的糖皮质激素免疫抑制剂,地塞米松剂量或CD26拮抗剂。如果需要,重复治疗可以每月进行一次,但优选不超过一年一次,最优选不超过每5年一次。
用糖皮质激素免疫抑制剂或用地塞米松治疗具有残留HIV的患者。急性高剂量地塞米松(作为碱)的剂量范围为约3mg/kg至约24mg/kg,优选约9mg/kg至约18mg/kg的剂量。该治疗消除了脾中HIV隐藏的龛,并将感染的T细胞送入循环中,在循环中它们可被标准HIV疗法杀死,所述标准HIV疗法包括抗逆转录病毒药物,包括但不限于核苷逆转录酶抑制剂(NTRI)、非核苷逆转录酶抑制剂(NNRTI)、蛋白酶抑制剂(PI)、融合和进入抑制剂、药代动力学增强剂和整合酶链转移抑制剂(INSTI)。
用糖皮质激素免疫抑制剂或用地塞米松治疗患有生发中心淋巴瘤,诸如但不限于伯基特淋巴瘤或弥漫性大B细胞淋巴瘤(DLBCL)的患者。急性高剂量地塞米松(作为碱)的剂量范围为约3mg/kg至约24mg/kg,优选约9mg/kg至约18mg/kg的剂量。该治疗消除了脾中生发中心淋巴瘤结合的龛,并将细胞递送到循环中,在循环中它们可被更完全地消除,该消除或用更低剂量的标准化疗如R-CHOP,或通过抗CD20的抗体如Rituxan、Bexxar或Zevalin,或通过抗CD22或CD70的抗体如Lymphocide或玛汀-沃瑟妥珠单抗(Vorsetuzumabmafodotin),或通过Bcl-2抑制剂如奥利默森钠(Oblimersen sodium)、ABT-737(口服形式维奈托克(navitoclax)、ABT-263)、或芬维A胺(Fenretinide),或通过Syk抑制剂如福坦替尼(Fostamatinib)或塔玛替尼(Tamatinib),或通过蛋白酶体抑制剂如硼替佐米(Bortezomib)(Velcade)、或COMPADME、CODOX-M/IVAC。复发率降低,无病生存率增加。
为了计算另一种糖皮质激素的等效剂量,将地塞米松的剂量输入公众可获得的糖皮质激素转换计算器中,优选http://www.medcalc.com。然后基于糖皮质激素的半衰期确定总给药。例如,3-12mg/kg地塞米松转化为19-75mg/kg泼尼松。因为泼尼松的生物半衰期为约20小时,而地塞米松的生物半衰期为约36至54小时。因此,每24小时给药19-75mg/kg泼尼松,以进行等效生物给药。
可以用急性高剂量泼尼松治疗患有自身免疫疾病的患者,所述自身免疫疾病例如但不限于:SLE、银屑病、类风湿性关节炎、银屑病关节炎、I型糖尿病、多发性硬化、干燥综合征、硬皮病、格雷夫斯病、桥本甲状腺炎、乳糜泻、艾迪生病、重症肌无力、自身免疫性肝炎、抗磷脂综合征、胆道胆管炎。急性高剂量泼尼松的剂量范围为约19mg/kg至约150mg/kg,优选剂量为约56mg/kg至约112mg/kg,24小时后重复(第二次)施用此剂量,并且在初次剂量后48-72小时任选重复(第三次)施用此剂量。
急性高剂量泼尼松剂量使B淋巴细胞数减少大于90%,并且当记忆B细胞在20岁以上人中占B细胞区室的大约50%时,记忆B细胞群体也减少大于90%。患者的自身免疫攻击B细胞已经凋亡并且患者停止以具有主动自身免疫攻击。患者的身体症状得到改善或消除。在大多数患者中从自身免疫疾病的缓解无限期地持续,然而,如果患者复发,则可施用重复剂量的泼尼松。如果需要,重复治疗可以每月进行一次,但优选不超过一年一次,最优选不超过每5年一次。
实施例10–15mg/kg地塞米松碱HED与标准化疗方案的比较
以前的研究表明,侵袭性非霍奇金淋巴瘤的标准化疗方案在A20B细胞淋巴瘤小鼠模型中具有显著的毒性(Bascus等人,2016)。
患者中用于侵袭性NHL的标准化疗方案以及用于惰性NHL的最常用方案是环磷酰胺、多柔比星、长春新碱和泼尼松/类固醇(CHOP)的组合,每21天给予一次,持续6-8个周期。Bascus等人(2016)在A20 B细胞淋巴瘤小鼠模型中评估了CHOP的功效和毒性。
在Bascus等人(2016)研究中,8-10周龄雌性BALB/c小鼠用于体内实验。将动物以12:12h光/暗循环圈养在具有过滤空气的架子上,随意给予食物和水。A20细胞系来源于老龄BALB/cAnN小鼠的天然网状细胞肉瘤的B淋巴细胞,并获自美国典型培养物保藏中心(美国弗吉尼亚州马纳萨斯)。在每个化疗周期中,使用以下剂量:环磷酰胺100mg/kg i.p,多柔比星6mg/kg i.p,长春新碱0.1mg/kg i.p和地塞米松0.2mg/kg i.p。在肿瘤植入后(P.T.I.)第25天,将接种A20细胞系的小鼠组(n=9)用一个周期的化疗(CHOP×1)、两个周期的化疗(CHOP×2)或PBS作为对照进行治疗,并跟踪肿瘤生长。每2-3天测量肿瘤体积(mm
在本研究中,以与Bascus等人(2016)研究报道的相同方式圈养、接种和治疗小鼠。用15mg/kg地塞米松碱HED或PBS作为对照治疗小鼠并跟踪肿瘤生长。在A20 2M肿瘤细胞接种后第7天、第10天、第18天、第23天、第24天、第28天、第35天和第42天以15mg/kg HED进行地塞米松给药。每2-3天测量肿瘤体积(mm
与CHOP和PBS对照相比,15mg/kg地塞米松碱HED的功效示于图26中。如图26可见,就肿瘤体积控制而言,15mg/kg地塞米松碱HED的功效大于1个周期的CHOP,但不如2个周期的CHOP有效。
然而,图27表明15mg/kg地塞米松碱HED与2个周期的CHOP相比具有有利的毒性概况,在用2个周期的CHOP治疗的小鼠中观察到的体重降低(图27B)远大于用15mg/kg地塞米松碱HED治疗的小鼠中观察到的体重降低(图27A)。另外,用2个周期的CHOP治疗的18%小鼠死于CHOP治疗,而没有小鼠死于地塞米松治疗。因此,可以得出结论,地塞米松可以与传统化疗一样有效,且没有相关的毒性。
15mg/kg地塞米松碱HED与PBS对照相比的统计分析结果如图28A所示。这表明在研究期间的多个时间点肿瘤体积的显著差异,地塞米松治疗的小鼠具有显著降低的肿瘤体积。
此实施例表明糖皮质激素治疗降低了有效化疗所需的剂量。
基本上如实施例10所述使用A20 B细胞淋巴瘤小鼠模型,但使用雄性小鼠而不是雌性小鼠。在第0天接种小鼠。仅用PBS('对照')或在第11天和第14天用HED 15mg/kg地塞米松碱('AVM0703')治疗的小鼠表现出持续的肿瘤生长,在20天后具有高生长速率(参见图29)。‘联合疗法’是在第11天施用HED 15mg/kg地塞米松碱,随后在第14天施用Cy/Flu疗法(13.5mg/kg HED环磷酰胺和0.8mg/kg HED氟达拉滨),显示肿瘤体积的稳定减小,其在24和26天后减小到与用在第11天和第14天两次施用Cy/Flu化疗(13.5mg/kg HED环磷酰胺和0.8mg/kg HED氟达拉滨)治疗的小鼠中的肿瘤大小(图29)相似的程度。用联合疗法或双剂量Cy/Flu治疗的受试者在第14天后表现出减小的肿瘤体积。
此实施例表明,施用高剂量地塞米松优先影响癌细胞。
基本上如实施例10所述使用A20 B细胞淋巴瘤小鼠模型,但使用雄性小鼠而不是雌性小鼠。在第0天接种小鼠并在第28天用PBS(安慰剂)或15mg/kg HED地塞米松治疗。使用全血细胞计数分析仪(CBC分析仪)测量细胞计数,结果示于下表2中。
表2
表2中给出的数据支持荷瘤小鼠对地塞米松敏感性增加的发现(本文讨论;参见例如实施例3)。在荷瘤小鼠中没有观察到外周淋巴细胞耗竭,因为地塞米松似乎被肿瘤吸收。相反,健康小鼠表现出淋巴细胞耗竭。这表明地塞米松对肿瘤具有直接作用,提高了肿瘤中深度淋巴细胞耗竭的可能性,并因此得到本文所述的高剂量糖皮质激素疗法的更好的肿瘤靶向概况。当在荷瘤小鼠中测试时,地塞米松对肿瘤浸润淋巴细胞(TIL)相比于对外周淋巴细胞更具特异性。
此研究的目的是评价不同剂量地塞米松对肿瘤的作用。在10周龄BALB/c小鼠中建立肿瘤后,通过Excel将小鼠随机分成具有大约相等的平均肿瘤体积的四组。以每周6mg/KgHED地塞米松,每周15mg/Kg HED地塞米松或每周21mg/Kg HED地塞米松对小鼠给药4个周期(每个剂量组中5只小鼠)。使用公开的公式V=L x W
参考文献
以上引用了许多出版物,以便更全面地描述和公开本发明以及本发明所属的现有技术水平。这些参考文献的全文引用如下:
Aker,A.M.et al.Phenols and parabens in relation to reproductive andthyroid hormones in pregnant women.Environ.Res.151,3037(2016)
Alexander,T.et al.Hematopoietic stem cell therapy for autoimmunediseases-Clinical experience and mechanisms.J.Autoimmun.92,35-46(2018).
American Diabetes Association.Diagnosis and classification ofdiabetes mellitus.Diabetes Care 37Suppl 1,S81-90(2014)
American Diabetes Association.Type 1 Diabetes(2018)
Atkinson,M.A.,Eisenbarth,G.S.&Michels,A.W.Type 1 diabetes.Lancet(London,England)383,69-82(2014)autoimmune disease.Nat Rev Immunol;1:147-153(2001)
Autoimmune disease:Updates from Europe and the United States.BiolBlood Marrow Transplant;16(1Supp1):S48-S56.doi:10.1016/j.bbmt.2009.10.034(2010)
Baraldo,S.,Kim Lokar Oliani,Graziella Turato,Renzo Zuin and MarinaSaetta,“The Role of Lymphocytes in the Pathogenesis of Asthma and COPD”,Cutrent Medicinal Chemistry 14:2250.(2007)
Bascus T.,Moreno M.,Mónaco A.,Reyes L,Paolino A.,Oliver P.,KramerM.G.,Engler H.,Pacheco J.P.,Grille S.,Chabalgoity J.A novel non-Hodgkinlymphoma murine model closer to the standard clinical scenario.J TranslMed.2016 Nov 22;14(1):323.
Bone,R.N.&Evans-Molina,C.Combination Immunotherapy for Type1Diabetes.Curr.Diab.Rep.17,50(2017)
Broder,M.S.et al.The Cost of Hematopoietic Stem-Cell Transplantationin the United States.Am.Heal.drug benefits 10,366-374(2017).
Burger,J.A.&Montserrat,E.,Coming full circle:70 years of chroniclymphocytic leukemia cell redistribution,from glucocorticoids to inhibitorsof B-cell receptor signaling;Blood 2013 vol121 no.9 1501-1509,doi:https://doi.org/10.1182/blood-2012-08-452607(2013).
Burkitt’s Lymphoma National Treatment Guidelines.Health,IMAWorld.2009
Burkit,D.A sarcoma involving the jaws in African children.The BritishJournal of Surgery.,Vols.46(197):21823(1958)
Cantu-Rodriguez,O.G.et al.Long-Term Insulin Independence in Type 1Diabetes Mellitus Using a Simplified Autologous Stem Cell Transplant.J.Clin.Endocrinol.Metab.101,2141-2148(2016)
Couri,C.E.B.,Malmegrim,K.C.R.&Oliveira,M.C.New Horizons in theTreatment of Type 1 Diabetes:More Intense Immunosuppression and Beta CellReplacement.Front.Immunol.9,1086(2018.
Daikeler,T.,Tichelli,A.&Passweg,J.Complications of autologoushematopoietic stem cell transplantation for patients with autoimmunediseases.Pediatr.Res.71,439-444(2012).
Darbre,P.D.&Harvey,P.W.Parabens can enable hallmarks andcharacteristics of cancer in human breast epithelial cells:a review of theliterature with reference to new exposure data and regulatorystatus.J.Appl.Toxicol.34,925-938(2014)
DeFranco,A.L.Germinal centers and autoimmune disease in humans andmice.Immunol.Cell Biol.94,918-924(2016)
Fauci AS.Mechanisms of corticosteroid action on lymphocytesubpopulations.II.Differential effects of in vivo hydrocortisone,prednisoneand dexamethasone on in vitro expression of lymphocyte function.Clinical andExperimental Immunology;24(1):54-62(1976)
Flammer,J.R.&Rogatsky,I.Minireview:Glucocorticoids in autoimmunity:unexpected targets and mechanisms.Mol.Endocrinol.25,1075-1086(2011)
Henig,I.&Zuckerman,T.Hematopoietic stem cell transplantation-50 yearsof evolution and future perspectives.Rambam Maimonides Med.J.5,e0028(2014).
Kim,J.H.,Jin,S.-M.,Kim,H.S.,Kim,K.-A.&Lee,M.-S.Immunotherapeutictreatment of autoimmune diabetes.Crit.Rev.Immunol.33,245-281(2013)
Loh,Y.et al.Development of a secondary autoimmune disorder afterhematopoietic stem cell transplantation for autoimmune diseases:role ofconditioning regimen used.Blood 109,2548-2643(2007).
Lu,Y.,Suzuki,J.,Guillioli,M.,Umland,O.,&Chen,Z.Induction of self-antigen-specific Foxp3+regulatory T cells in the periphery by lymphodepletiontreatment with anti-mouse thymocyte globulin in mice.Immunology 134,50-59(2011)
Magdalena,W.et al.Lack of persistent remission following initialrecovery in patients with type 1 diabetes treated with autologous peripheralblood stem cell transplantation.Diabetes Res.Clin.Pract.(2018).doi:10.1016/j.diabres.2018.07.020
Malmegrim,K.C.R.et al.Immunological Balance Is Associated withClinical Outcome after Autologous Hematopoietic Stem Cell Transplantation inType 1 Diabetes.Front.Immunol.8,167(2017)
Medicines Agency,E.Benzyl alcohol and benzoic acid group used asexcipients.(2017)
Menke,A.et al.The prevalence of type 1 diabetes in the UnitedStates.Epidemiology(Cambridge,Mass.)24,773-774(2013)
Orem,J.,et al.Burkitt’s Lymphoma in Africa,a Review of theEpidemiology and Etiology.s.l.:African Health Sciences,Vols.7.3:166-175(2007)
Pallera,A.M.&Schwartzberg,L.S.Managing the toxicity of hematopoieticstem cell transplant.J.Support.Oncol.2,223-228-247(2004).
Pasricha,J.Current regimen of pulse therapy fbr pemphigus:Minormodifications,improved results.Indian J Dermatol Venereol Leprol 74;3,pp217-221(2008)
Patt H,Bandgar T,Lila A,Shah N.Management issues with exogenoussteroid therapy.Indian Journal of Endocrinology and Metabolism.17(Suppl 3):S612-S617.doi:10.4103/2230-8210.123548(2013)
Peng,B.-Y.et al.Addressing Stem Cell Therapeutic Approaches inPathobiology of Diabetes and Its Complications.J.Diabetes Res.2018,7806435(2018)
Ponchel et al.,Interleukin-7 deficiency in rheumatoid arthritis:consequences for therapy-induced lymphopeniaArthritis Res Ther,7:R80-R92(DOI10.1186/ar1452)(2005)
Savage,J.H.,Matsui,E.C.,Wood,R.A.&Keet,C.A.Urinary levels oftriclosan and parabens are associated with aeroallergen and foodsensitization.J.Allergy Clin.Immunol.130,453-60.e7(2012)
Serafin,V.,CapuZZo,G.,Milani,G.,Minuzzo,S.A.,Pinazza,M.,BortoloZZi,R.,Bresolin,S.,Porcù,E.,Frasson,C.,Indraccolo,S.,Basso,G.,&Accordi,B.Glucocorticoid resistance is reverted by LCK inhibition in pediatric T-cellacutelymphoblastic leukemia.Blood,130(25),2750-2761(2017)
Shlomchik MJ,Craft JE,Mamula MJ.From T to B and back again:positivefeedback in systemic
Snarski,Eet al.Immunoablation and autologous hematopoietic stem celltransplantation in the treatment of new-onset type 1 diabetes mellitus:long-term observations.Bone Marrow Transplant.51,398-402(2016)
Spanier,A.J.,Fausnight,T.,Camacho,T.F.&Braun,J.M.The associations oftriclosan and paraben exposure with allergen sensitization and wheeze inchildrenAllergy asthma Proc.35,475-481(2014)
Sullivan,K.,Muraro,P.,&Tyndall,A.Hematopoietic cell transplantationfor
Swart,J.F.et al.Haematopoietic stem cell transplantation forautoimmune diseases.Nat.Rev.Rheumatol.13,244-256(2017).
Thomas SL,Griffiths C,Smeeth L,Rooney C,Hall AJ.Burden of MortalityAssociated With Autoimmune Diseases Among Females in the UnitedKingdom.American Journal of Public Health.100(11):2279-2287.doi:10.2105/AJPH.2009.180273(2010)
Thangavelu G1,Parkman JC,Ewen CL,Uwiera RR,Baldwin TA,AndersonCC.Programmed death-1 is required for systemic self-tolerance in newlygenerated T cells during the establishment of immune homeostasis.ArthritisRes Ther.7(1):R80-92.(2005)
U.S Department of Health and Human Services Food and DrugAdministration Center for Drug Evaluation and Research(CDER)Guidance forIndustry:Estimating the Maximum Safe Starting Dose in Initial Clinical Trialsfor Therapeutics in Adult Healthy Volunteers.Pharmacology and Toxicology July(2005)
Voltarelli,J.C.et al.,Autologous nonmyeloablative hematopoietic stemcell transplantation in newly diagnosed type 1 diabetes mellitus.JAMA 297,1568-1576(2007).
Yan,SX et al.,Prednisone treatment inhibits the differentiation ofBlymphocytes into plasma cells in MRL/MpSlac-1pr mice,Acta PharmacologicaSinica volume 36,pages 1367-1376(2015).
Zwang Homeostatic expansion as a barrier to lymphocyte depletionstrategies Curr Opin Organ Transplant.August;19(4):357-362(2014)
编号的段落
以下带编号的段落描述了我们提案的各个方面,作为说明书的一部分
1.一种用于治疗受试者中淋巴细胞介导的疾病的包含糖皮质激素的药物组合物,其中所述治疗包括向患者施用一定剂量的药物组合物以递送相当于约3-26mg/kg人等效剂量(HED)的地塞米松碱的剂量的糖皮质激素,
其中所述药物组合物包含一种或多种药学上可接受的载体、防腐剂和/或螯合剂。
2.根据段落1所述使用的药物组合物,其中所述淋巴细胞介导的疾病是自身免疫疾病。
3.根据段落1所述使用的药物组合物,其中所述淋巴细胞介导的疾病是残留HIV疾病。
4.根据段落1所述使用的药物组合物,其中所述淋巴细胞介导的疾病是生发中心淋巴瘤。
5.根据段落1所述使用的药物组合物,其中所述淋巴细胞介导的疾病是移植物抗宿主疾病。
6.根据段落1所述使用的药物组合物,其中所述淋巴细胞介导的疾病是过敏性疾病,任选地其中所述过敏性疾病是哮喘。
7.根据段落2所述使用的药物组合物,其中所述自身免疫疾病选自由1型糖尿病、多发性硬化、肌萎缩性侧索硬化、硬皮病、天疱疮和狼疮组成的组。
8.根据前述段落中任一项所述使用的药物组合物,其中所述药物组合物包含防腐剂,其中所述防腐剂是亚硫酸盐。
9.根据前述段落中任一项所述使用的药物组合物,其中所述药物组合物包含螯合剂,其中所述螯合剂是EDTA。
10.根据前述段落中任一项所述使用的药物组合物,其中所述糖皮质激素包含地塞米松,任选地其中所述地塞米松选自由地塞米松碱、地塞米松磷酸钠和醋酸地塞米松组成的组。
11.根据段落10所述使用的药物组合物,其中所述地塞米松是地塞米松磷酸钠。
12.根据前述段落中任一项所述使用的药物组合物,其中所述药物组合物的剂量是单次急性剂量或在约72小时内给予的总剂量。
13.根据前述段落中任一项所述使用的药物组合物,其中所述药物组合物以静脉内(IV)或口服剂量施用,任选地其中所述IV或口服剂量以单次IV或口服剂量施用。
14.根据前述段落中任一项所述使用的药物组合物,其中所述药物组合物是糖皮质激素水溶液。
15.根据前述段落中任一项所述使用的药物组合物,其中所述药物组合物以相当于至少约4mg/kg、至少约5mg/kg、至少约6mg/kg、至少约7mg/kg、至少约8mg/kg、至少约9mg/kg、至少约10mg/kg、至少约11mg/kg、至少约12mg/kg、至少约15mg/kg、至少约18mg/kg或至少约24mg/kg的人等效剂量(HED)的地塞米松碱的剂量施用。
本发明将通过参考附随的权利要求书来解释。
- 免疫消融疗法
- 用于X射线诱导的光动力学疗法、放射疗法、放射动力学疗法、化学疗法、免疫疗法以及它们的任何组合的纳米级金属有机层和金属有机纳米片
