用于通过上调JAG-1来生成毛细胞的组合物和方法
文献发布时间:2023-06-19 12:02:28
本申请要求于2018年8月17日提交的美国专利申请第62/719,218号的优先权,所述美国专利申请的内容通过全文引用的方式并入本文。
创建于2019年8月17日的大小为1KB的命名为“FREQ-025_01WO SeqList_ST25.txt”的文本文件的内容通过全文引用的方式特此并入。
技术领域
本公开涉及包括Jag-1激动剂和Jag-1增效剂的用于增加耳蜗支持细胞或前庭支持细胞的增殖、耳蜗或前庭细胞,特别是Lgr5+细胞的扩增群体的产生的组合物和方法以及治疗听力或平衡障碍的相关方法。另外,本发明涉及此类患者的听力功能可以改善的程度。
背景技术
感音神经性听力损失(SNHL)占所有听力损失的约90%(Li等人,《先进药物输送评论(Adv.Drug Deliv.Rev.)》108,2–12,2017),其中SNHL的主要原因是高龄、耳毒性药物和噪声暴露(Liberman&Kujawa,《听力研究(Hear.Res.)》349,138–147,2017)。SNHL通常是由于内耳中耳蜗的感觉上皮内的感觉转换细胞(毛细胞)的损坏和丧失引起的。毛细胞容易受到损害,并且尽管如鸟类、鱼类和两栖动物等其它物种可以在一生中再生毛细胞,但哺乳动物缺乏这种再生能力(Fujioka等人,《神经科学趋势(Trends Neurosci.)》38,139–44,2015)。
当前尚无治疗选项来恢复受损的哺乳动物内耳的功能,并且人耳蜗无法替换丧失或受损的毛细胞意味着大多数患有SNHL的患者是通过助听器或耳蜗植入物来应对的(参见例如Ramakers等人,《喉镜(Laryngoscope)》125,2584–92,2015;Raman等人,“耳蜗植入物在患有感音神经性听力损失的成人中的有效性(Effectiveness of Cochlear Implants inAdults with Sensorineural Hearing Loss)”.美国医疗保健研究与质量局(Agency forHealthcare Research and Quality(US)),2011;以及Roche&Hansen,《北美耳鼻喉科诊所(Otolaryngol.Clin.North Am.)》48,1097–116,2015)。然而,由于不适、羞耻和对声音质量的不满,只有不到25%的候选者使用听力装置(Lerner,2019;Pratt,2018;Sawyer等人,2019;Willink等人,2019)。尽管植入技术有所改进,但是一些用户仍然会感觉到语音识别不良或下降、声音质量差以及高达15%-20%的错杂度(安大略省健康质量局(HealthQuality Ontario),2018)。
SNHL通常导致患者的听力水平阈值(当通过测听法测量时)增加。然而,有些患者在通过测听法评估时听力阈值正常,但是在嘈杂环境中感觉到语音识别不良。这种情况被称为隐性听力损失,并且尽管这种情况使这些患者感到虚弱,但可能不必要用助听器来进行干预并且当然也可能不必要用耳蜗植入物(所述耳蜗植入物用于患有更严重听力损失的患者)来进行干预。
因此,例如通过降低听力水平阈值和/或通过改善语音识别来改善听力功能的再生治疗方法为患有感音神经性听力损失或隐性听力损失的患者提供了重大突破。此类再生治疗方法与使用基本上应对所述病状的听力装置而不是通过恢复耳蜗功能来治疗所述病状的现有方法形成鲜明对比。
正在研究若干种用于再生哺乳动物内耳感觉上皮中的受损或缺失的毛细胞的方法(在Mittal等人,《分子神经科学前沿(Front Mol Neurosci.)》(2017);10:236中进行了综述)。这些方法包含基于细胞的方法(其旨在将外源性细胞递送到内耳以恢复感觉上皮)和基于基因的方法(其旨在将外源性基因递送到感觉上皮并重新编程内源性细胞以生成毛细胞)。例如,腺病毒介导的基因递送已经在动物模型中显示出一定的前景,其中外源性Atoh1能够刺激感觉上皮内的细胞分化为毛细胞。这些方法的一个缺点是需要将细胞或载体递送到患者体内,这在复杂的内耳系统中可能是有挑战性的。因此,其中通过外源性药剂来调节内耳细胞的内源性信号传导通路的分子方法是有吸引力的,因为此类药剂的递送可能比基于细胞或基于基因的方法更为直接。
使用分子药剂来引发转分化是一个所关注的方面,其中耳蜗的现有支持细胞被刺激以分化为替换毛细胞。另一个所关注的方面是支持细胞中增殖反应的激活,以便提供可以分化为毛细胞的新细胞群体,从而替换丧失或受损的毛细胞。
Wnt通路激动剂(GSK抑制剂)与组蛋白脱乙酰酶复合物(HDAC)抑制剂的组合已经在刺激体外和体内动物模型中支持细胞的扩增以及在动物模型中提供听力功能的改善方面显示出有希望的结果(参见McLean等人,《细胞报告(Cell Rep.)》2017年2月21日;18(8):1917–1929;WO 2017/151907)。
仍需要开发在体内和体外有效的毛细胞再生策略,其可以包含促进内耳的感觉上皮的支持细胞的增殖超出先前已达到的水平。
发明内容
在各个方面,本公开提供了一种用于增加耳蜗支持细胞或前庭支持细胞的增殖的方法,所述方法包括使所述支持细胞与Jagged-1(Jag-1)激动剂接触,从而与媒剂对照相比,增加耳蜗支持细胞或前庭支持细胞增殖,其中所述Jag-1激动剂不是WNT激动剂或GSK3抑制剂。
在本公开的方法的一些实施例中,所述方法进一步包括使Lgr5+耳蜗细胞与Jag-1增效剂或Deltex-1增效剂接触,其中所述Lgr5+耳蜗细胞与所述Jag-1激动剂、Jag-1增效剂和/或所述Deltex-1增效剂以任何顺序或同时接触。
在本公开的方法的一些实施例中,所述Jag-1增效剂或所述Deltex-1增效剂不是HDAC抑制剂。在本公开的方法的一些实施例中,所述Jag-1增效剂或所述Deltex-1增效剂不是丙戊酸(VPA)。
在本公开的方法的一些实施例中,所述Jag-1激动剂增加Deltex-1或Hif-1的表达或活性;所述Jag-1激动剂在不增加Deltex-1或Hif-1的表达的情况下增加除Deltex-1或Hif-1以外的非经典Notch信号传导基因;所述Jag-1激动剂与所述Jag-1增效剂的组合增加Deltex-1或Hif-1的表达或活性;或者所述Jag-1激动剂与所述Jag-1增效剂的组合在不增加Deltex-1或Hif-1的表达的情况下增加非经典Notch信号传导基因。
本公开提供了一种用于增加耳蜗支持细胞或前庭支持细胞的增殖的方法,所述方法包括使所述支持细胞与Deltex-1激动剂接触,从而与媒剂对照相比,增加耳蜗支持细胞或前庭支持细胞增殖,其中所述Deltex-1激动剂不是WNT激动剂或GSK3抑制剂。在一些实施例中,所述方法进一步包括使Lgr5+耳蜗细胞与Jag-1增效剂或Deltex-1增效剂接触,其中所述Lgr5+耳蜗细胞与所述Jag-1激动剂、Jag-1增效剂和/或所述Deltex-1增效剂以任何顺序或同时接触。
在本公开的方法的一些实施例中,不是HDAC抑制剂的所述Jag-1增效剂或所述Deltex-1增效剂。
在本公开的方法的一些实施例中,不是VPA相关的所述Jag-1增效剂或所述Deltex-1增效剂。在本公开的方法的一些实施例中,所述Deltex-1激动剂独立于Jag-1增加非经典Notch信号传导;或者所述Deltex-1激动剂至少部分地通过增加HIF-1来增加非经典Notch信号传导。
在本公开的方法的一些实施例中,所述Deltex-1增效剂与所述Wnt激动剂或GSK3抑制剂组合独立于Jag-1增加非经典Notch信号传导;或者所述Deltex-1增效剂与所述Wnt激动剂或GSK3抑制剂的组合通过增加Hif-1来增加非经典Notch信号传导。
本公开提供了一种用于增加耳蜗支持细胞或前庭支持细胞的增殖的方法,所述方法包括使所述支持细胞与非经典Notch信号传导激动剂接触,从而与媒剂对照相比,增加耳蜗支持细胞或前庭支持细胞增殖。
在本公开的方法的一些实施例中,所述非经典Notch信号传导激动剂不是Wnt激动剂或GSK3抑制剂。在本公开的方法的一些实施例中,所述方法进一步包括使Lgr5+耳蜗细胞与Jag-1增效剂或Deltex-1激动剂接触,其中所述Lgr5+耳蜗细胞与所述非经典Notch信号传导激动剂、Jag-1增效剂和/或所述Deltex-1增效剂以任何顺序或同时接触。
在本公开的方法的一些实施例中,非经典Notch信号传导激动剂的特征在于以下中的一个或多个:与媒剂对照相比,使Lgr5+耳蜗细胞中的Jag-1和/或Deltex-1的表达和/或活性增加至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%或200%;与媒剂对照相比,使Lgr5+耳蜗细胞增殖增加至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%或200%,与单独的Wnt激动剂相比,所述非经典Notch信号传导激动剂与所述Wnt激动剂的组合使Lgr5+耳蜗细胞中的Jag-1和/或Deltex-1的表达和/或活性增加至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%或200%;与单独的Wnt激动剂相比,所述非经典Notch信号传导激动剂与所述Wnt激动剂的组合使Lgr5+耳蜗细胞增殖增加至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%或200%。
本公开提供了一种用于产生扩增的耳蜗或前庭细胞群体的方法,所述方法包括使耳蜗支持细胞或前庭支持细胞群体与Jagged-1(Jag-1)激动剂接触,从而与媒剂对照相比,产生扩增的耳蜗或前庭细胞群体,其中所述Jag-1激动剂不是WNT激动剂或GSK3抑制剂。
本公开提供了一种用于产生扩增的耳蜗或前庭细胞群体的方法,所述方法包括使耳蜗支持细胞或前庭支持细胞群体与Deltex-1激动剂接触,从而与媒剂对照相比,产生扩增的耳蜗或前庭细胞群体,其中Jag-1激动剂不是WNT激动剂或GSK3。
本公开提供了一种用于产生扩增的耳蜗或前庭细胞群体的方法,所述方法包括使耳蜗支持细胞或前庭支持细胞群体与非经典Notch信号传导激动剂接触,从而与媒剂对照相比,产生扩增的耳蜗或前庭细胞群体。
在本公开的方法的一些实施例中,一种或多种所述耳蜗支持细胞或一种或多种所述前庭支持细胞表达含富含亮氨酸重复序列的G蛋白偶联受体5(Lgr5)。
在本公开的方法的一些实施例中,一种或多种所述耳蜗支持细胞或一种或多种所述前庭支持细胞是一种或多种成熟细胞。在本公开的方法的一些实施例中,所述扩增的耳蜗或前庭细胞群体表达含富含亮氨酸重复序列的G蛋白偶联受体5(Lgr5)。在本公开的方法的一些实施例中,一种或多种所述耳蜗支持细胞或一种或多种所述前庭支持细胞是一种或多种耳蜗支持细胞。
在本公开的方法的一些实施例中,所述扩增的耳蜗或前庭细胞群体是耳蜗细胞。
本公开提供了一种治疗患有内耳听力或平衡障碍或有罹患内耳听力或平衡障碍的风险的受试者的方法,所述方法包括向所述受试者施用:Jagged-1(Jag-1)激动剂,其中所述Jag-1激动剂不是Wnt激动剂或GSK3抑制剂;Deltex-1激动剂,其中所述Deltex-1激动剂不是Wnt激动剂或GSK3抑制剂;或非经典Notch信号传导激动剂。
在本公开的方法的一些实施例中,所述受试者患有内耳听力或平衡障碍。在本公开的方法的一些实施例中,所述障碍是内耳听力障碍。在本公开的方法的一些实施例中,所述障碍是平衡障碍。在本公开的方法的一些实施例中,所述内耳听力或平衡障碍是感音神经性听力损失。
在本公开的方法的一些实施例中,当通过行为测听法或听觉脑干反应(ABR)测试评估时,治疗使听觉功能改善。
在本公开的方法的一些实施例中,所述方法进一步包括向所述受试者施用Jag-1增效剂或Deltex-1增效剂,其中所述Jag-1激动剂、所述Deltex-1激动剂或所述非经典Notch信号传导激动剂以及所述Jag-1增效剂和/或所述Deltex-1增效剂的施用以任何顺序或同时进行。
在本公开的方法的一些实施例中,所述Jag-1增效剂或所述Deltex-1增效剂不是HDAC抑制剂。
在本公开的方法的一些实施例中,所述Jag-1增效剂或所述Deltex-1增效剂不是丙戊酸(VPA)。在本公开的方法的一些实施例中,所述Jag-1激动剂和/或所述Deltex-1激动剂是可溶性Jag-1蛋白、磷脂酰肌醇3-激酶(PI3K)激动剂或HIF1-α激活剂。
在本公开的方法的一些实施例中,所述PI3K激动剂是叉头框-O转录因子(FOXO)抑制剂。在本公开的方法的一些实施例中,所述FOXO抑制剂是AS1842856。
在本公开的方法的一些实施例中,HIF1-α激活剂是4,4α-二氢-4-氧代-1,10-菲咯啉-3-羧酸(1,4-DPCA)、N-[(1-氯-4-羟基-3-异喹啉基)羰基]-甘氨酸(FG-2216)、或N-[(1,3-二环己基六氢-2,4,6-三氧代-5-嘧啶基)羰基]-甘氨酸(达普司他(daprodusat))。
在本公开的方法的一些实施例中,所述Jag-1增效剂和/或所述Deltex-1增效剂是PI3K增效剂。
在本公开的方法的一些实施例中,所述PI3K增效剂是磷酸酶和张力蛋白同源物(PTEN)抑制剂。
在本公开的方法的一些实施例中,所述PTEN抑制剂是SF1670、VO-Ohpic、bpV(phen)或bpV(pic)。
在本公开的方法的一些实施例中,所述Jag-1增效剂是可溶性Jag-1肽。在本公开的方法的一些实施例中,所述可溶性Jag-1肽包括氨基酸序列CDDYYYGFGCNKFCRPR(SEQ IDNO:1)或其与SEQ ID NO:1至少90%相同的变体。
在本公开的方法的一些实施例中,所述Wnt激动剂或所述GSK3抑制剂是CHIR99021、AZD1080、LY2090314、经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮、或GSK3抑制剂XXII。
在本公开的方法的一些实施例中,所述HIF1-α激活剂是1,4-DPCA。在本公开的方法的一些实施例中,所述HIF1-α激活剂是FG-2216。在本公开的方法的一些实施例中,所述HIF1-α激活剂是达普司他。
在本公开的方法的一些实施例中,所述PTEN抑制剂是SF1670。在本公开的方法的一些实施例中,所述PTEN抑制剂是VO-Ohpic。在本公开的方法的一些实施例中,所述PTEN抑制剂是bpV(phen)。在本公开的方法的一些实施例中,所述PTEN抑制剂是bpV(pic)。
在本公开的方法的一些实施例中,所述AS1842856的浓度约介于0.1nM与100μM之间。
在本公开的方法的一些实施例中,所述1,4-DPCA的浓度约介于1nM与100mM之间。
在本公开的方法的一些实施例中,所述FG-2216的浓度约介于1nM与1000mM之间。
在本公开的方法的一些实施例中,所述达普司他的浓度约介于1nM与1000mM之间。
在本公开的方法的一些实施例中,所述SF1670的浓度约介于1nM与100mM之间。
在本公开的方法的一些实施例中,所述VO-Ohpic的浓度约介于1nM与100mM之间。
在本公开的方法的一些实施例中,所述bpV(phen)的浓度约介于1nM与100mM之间。
在本公开的方法的一些实施例中,所述bpV(pic)的浓度约介于1nM与100mM之间。
在本公开的方法的一些实施例中,所述可溶性Jag-1肽的浓度约介于1μM与10μM之间。
在本公开的方法的一些实施例中,所述GSK3抑制剂是AZD1080。
在本公开的方法的一些实施例中,所述GSK3抑制剂是LY2090314。
在本公开的方法的一些实施例中,所述GSK3抑制剂是经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮。
在本公开的方法的一些实施例中,所述GSK3抑制剂是GSK3抑制剂XXII。
在本公开的方法的一些实施例中,所述GSK3抑制剂是CHIR99021。
在本公开的方法的一些实施例中,AZD1080的浓度约介于0.5μM与5μM之间。
在本公开的方法的一些实施例中,LY2090314的浓度约介于4nM与40nM之间。
在本公开的方法的一些实施例中,经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮的浓度约介于5nM与500nM之间。
在本公开的方法的一些实施例中,GSK3抑制剂XXII的浓度约介于0.1μM与1μM之间。
在本公开的方法的一些实施例中,CHIR99021的浓度约介于1μM与10μM之间。
在本公开的方法的一些实施例中,所述Jag-1激动剂是局部和/或全身施用的。在本公开的方法的一些实施例中,所述Jag-1激动剂是局部施用的。在本公开的方法的一些实施例中,所述Jag-1激动剂是全身施用的。在本公开的方法的一些实施例中,所述Jag-1激动剂是局部和全身施用的。在本公开的方法的一些实施例中,所述Deltex-1激动剂是局部和/或全身施用的。在本公开的方法的一些实施例中,所述Deltex-1激动剂是局部施用的。在本公开的方法的一些实施例中,所述Deltex-1激动剂是全身施用的。
在本公开的方法的一些实施例中,所述非经典Notch信号传导激动剂是局部和全身施用的。在本公开的方法的一些实施例中,所述非经典Notch信号传导激动剂是局部和/或全身施用的。在本公开的方法的一些实施例中,所述非经典Notch信号传导激动剂是局部施用的。在本公开的方法的一些实施例中,所述非经典Notch信号传导激动剂是全身施用的。在本公开的方法的一些实施例中,所述非经典Notch信号传导激动剂是局部和全身施用的。
在本公开的方法的一些实施例中,所述Wnt激动剂或所述GSK3抑制剂是局部和/或全身施用的。在本公开的方法的一些实施例中,所述Wnt激动剂或所述GSK3抑制剂是局部施用的。在本公开的方法的一些实施例中,所述Wnt激动剂或所述GSK3抑制剂是全身施用的。在本公开的方法的一些实施例中,所述Wnt激动剂或所述GSK3抑制剂是局部和全身施用的。
在本公开的方法的一些实施例中,所述局部施用是对鼓膜、中耳或内耳的。在本公开的方法的一些实施例中,所述局部施用是对中耳的。在本公开的方法的一些实施例中,所述全身施用是口服或肠胃外的。在本公开的方法的一些实施例中,所述全身施用是口服的。
本公开提供了一种药物组合物,所述药物组合物包括Jag-1激动剂和/或Deltex-1激动剂以及药学上可接受的载体。
在本公开的组合物的一些实施例中,所述Jag-1激动剂和/或所述Deltex-1激动剂是可溶性Jag-1蛋白、磷脂酰肌醇3-激酶(PI3K)激动剂或HIF1-α激活剂。
在本公开的组合物的一些实施例中,所述PI3K激动剂是叉头框-O转录因子(FOXO)抑制剂。
在本公开的组合物的一些实施例中,所述FOXO抑制剂是AS1842856。
在本公开的组合物的一些实施例中,HIF1-α激活剂是4,4α-二氢-4-氧代-1,10-菲咯啉-3-羧酸(1,4-DPCA)、N-[(1-氯-4-羟基-3-异喹啉基)羰基]-甘氨酸(FG-2216)、或N-[(1,3-二环己基六氢-2,4,6-三氧代-5-嘧啶基)羰基]-甘氨酸(达普司他)。
本公开提供了一种药物组合物,所述药物组合物包括Jag-1增效剂和/或Deltex-1增效剂是PI3K增效剂。
在本公开的组合物的一些实施例中,所述Jag-1增效剂和/或所述Deltex-1增效剂是PI3K增效剂。
在本公开的组合物的一些实施例中,所述PI3K增效剂是磷酸酶和张力蛋白同源物(PTEN)抑制剂。
在本公开的组合物的一些实施例中,所述PTEN抑制剂是SF1670、VO-Ohpic、bpV(phen)或bpV(pic)。
在本公开的组合物的一些实施例中,所述Jag-1增效剂是可溶性Jag-1肽。
在本公开的组合物的一些实施例中,所述可溶性Jag-1肽包括氨基酸序列CDDYYYGFGCNKFCRPR(SEQ ID NO:1)或其与SEQ ID NO:1至少90%相同的变体。
在本公开的组合物的一些实施例中,所述HIF1-α激活剂是1,4-DPCA。
在本公开的组合物的一些实施例中,所述HIF1-α激活剂是FG-2216。
在本公开的组合物的一些实施例中,所述HIF1-α激活剂是达普司他。
在本公开的组合物的一些实施例中,所述PTEN抑制剂是SF1670。
在本公开的组合物的一些实施例中,所述PTEN抑制剂是VO-Ohpic。
在本公开的组合物的一些实施例中,所述PTEN抑制剂是bpV(phen)。
在本公开的组合物的一些实施例中,所述PTEN抑制剂是bpV(pic)。
在本公开的组合物的一些实施例中,所述AS1842856的浓度约介于10μM与1,000,000mM之间。
在本公开的组合物的一些实施例中,所述1,4,DPCA的浓度约介于10μM与1,000,000mM之间。
在本公开的组合物的一些实施例中,所述FG-2216的浓度约介于10μM与1,000,000mM之间。
在本公开的组合物的一些实施例中,所述达普司他的浓度约介于10μM与1,000,000mM之间。
在本公开的组合物的一些实施例中,所述SF1670的浓度约介于10μM与1,000,000mM之间。
在本公开的组合物的一些实施例中,所述VO-Ohpic的浓度约介于10μM与1,000,000mM之间。
在本公开的组合物的一些实施例中,所述bpV(phen)的浓度约介于10μM与1,000,000mM之间。
在本公开的组合物的一些实施例中,所述bpV(pic)的浓度约介于10μM与1,000,000mM之间。
在本公开的组合物的一些实施例中,所述可溶性Jag-1肽的浓度约介于1μM与10μM之间。
在本公开的组合物的一些实施例中,所述药物组合物处于生物相容性基质中。在本公开的组合物的一些实施例中,所述生物相容性基质包括透明质酸、透明质酸盐、卵磷脂凝胶、普朗尼克(pluronics)、聚(乙二醇)、泊洛沙姆、壳聚糖、木葡聚糖、胶原蛋白、纤维蛋白、聚酯、聚(丙交酯)、聚(乙交酯)、聚(乳酸-共-乙醇酸)(PLGA)、乙酸异丁酸蔗糖酯、单油酸甘油酯、聚酸酐、聚己内酯蔗糖、单油酸甘油酯、丝材料或其组合。在本公开的组合物的一些实施例中,所述药物组合物被调配用于施用。
在本公开的组合物的一些实施例中,所述组合物用于治疗或预防内耳听力或平衡障碍。
在所使用的药物组合物的一些实施例中,所述内耳听力或平衡障碍是感音神经性听力损失。
在一些实施例中,所述药物组合物用于制造用于治疗或预防内耳听力或平衡障碍的药物。
在所使用的药物组合物的一些实施例中,所述内耳听力或平衡障碍是感音神经性听力损失。
本公开提供了一种容器,所述容器包括Jag-1激动剂、Deltex-1激动剂或非经典notch信号传导激动剂和说明书,其中那些说明书描述了Jag-1激动剂、Deltex-1激动剂或非经典notch信号传导激动剂针对治疗或预防受试者的内耳听力或平衡障碍的使用。在一些实施例中,所述内耳听力或平衡障碍是感音神经性听力损失。
除非另外定义,否则本文所使用的所有技术术语和科学术语具有与本公开所属领域的普通技术人员通常所理解的含义相同的含义。在本说明书中,除非上下文另外明确规定,否则单数形式也包含复数形式。尽管类似于或等效于本文所描述的那些方法和材料的方法和材料可以用于本发明的实践或测试中,但是下面描述了合适的方法和材料。在冲突的情况下,将以本说明书(包含定义)为准。另外,材料、方法和实例仅是说明性的并且不旨在是限制性的。
根据以下详细描述和权利要求书,本发明的其它特征和优点将显而易见。
附图说明
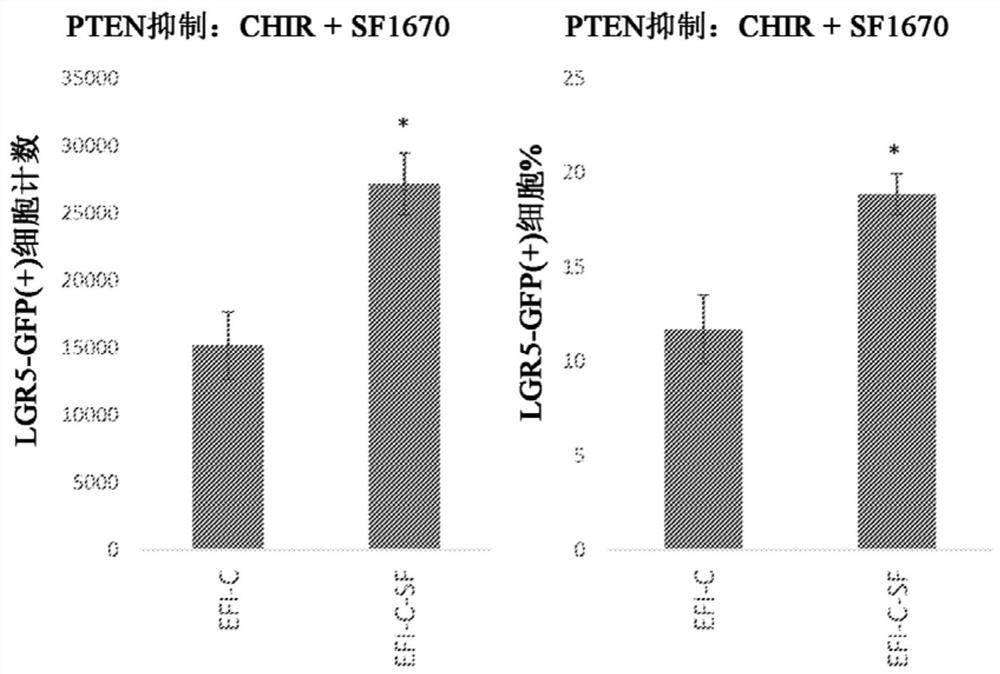
图1A是展示了CHIR(C)引发了培养的耳蜗Lgr5祖细胞的扩增(LGR5-GFP(+)细胞计数)和富集(LGR5-GFP(+)细胞百分比)的一系列图表,所述扩增和富集通过在生长因子的背景中添加PTEN抑制剂/PI3K激动剂SF1670(0.1μM)而增强,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图1B示出了Lgr5细胞培养物的图像,其描绘了Lgr5-GFP细胞集落。在生长因子的背景中,EFI-C-SF增强了Lgr5-GFP集落形成,所述生长因子包含:50ng/mL EGF(E)、50ng/mLbFGF(F)和50ng/mL IGF1(I)。
图2A是展示了CHIR引发了培养的耳蜗Lgr5祖细胞的扩增(LGR5-GFP(+)细胞计数)和富集(LGR5-GFP(+)细胞百分比)的图表,所述扩增和富集通过在生长因子的背景中添加3μM的PTEN抑制剂/PI3K增效剂VO-Ohpic(VO)而增强,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图2B示出了Lgr5细胞培养物的图像,其描绘了Lgr5-GFP细胞集落。在生长因子的背景中,EFI-C-VO-Ohpic增强了Lgr5-GFP集落形成,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图3是展示了CHIR上调Jag-1而VO不上调Jag-1的图表。在生长因子的背景中,Jag-1上调通过向CHIR中添加3μM的PTEN抑制剂/PI3K增效剂VO-Ohpic而增强,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图4是显示了VO-OHpic(3μM)和CHIR(4μM)在单独和组合的情况下对Lgr5+细胞中Jag-1表达的影响(如通过蛋白质印迹带强度所测量的)的图表。使用GelQuant软件将计算的Jag-1相对于GAPDH进行归一化,并且对带进行定量。将Jag-1带的净体积除以匹配的GAPDH带的净体积值。在生长因子的背景中,将这些值相对于媒剂进行归一化,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图5是展示了在生长因子的背景(具有或不具有CHIR)中,VO-Ohpic未引发HDAC抑制的可检测到的增加,而VPA引发HDAC抑制的浓度依赖性增加,所述生长因子包含:50ng/mLEGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图6A是示出了在生长因子的背景中,向4μM CHIR中添加0.25μM Jag-1肽(J)(当与CHIR组合(EFICJ)时)能够重现Lgr5+细胞增殖的增强的图表,所述生长因子包含:50ng/mLEGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图6B是示出了在生长因子的背景中,向4μM CHIR中添加0.25μM Jag-1肽(J)(当与CHIR组合(EFICJ)时)能够重现Lgr5+细胞增殖的增强的一些列图像,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。比例尺400μm。*=p<0.05、**=p<0.01、***=p<0.001。
图7是显示了在生长因子的背景中,FOXO1抑制剂AS1842856对LGR5+细胞生长(Lgr5 GFP(+)细胞计数)和富集(Lgr5 GFP(%))的浓度依赖性作用的图表,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图8A是显示了FOXO1抑制剂AS1842856(425nM)引发培养的耳蜗Lgr5+祖细胞扩增的一系列图表。在生长因子的背景中,当AS1842856与VPA(1mM)组合时,根据百分比,Lgr5细胞富集,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图8B是Lgr5+细胞培养物的一系列图像,其描绘了Lgr5-GFP细胞集落。在生长因子的背景中,EFI-AS1842856(425nM)促进Lgr5-GFP集落形成,当添加VPA时其被富集(如培养物中的Lgr5-阴性细胞较少所示),所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图9是展示了在生长因子的背景中,425nM AS21842856(EFI-A)上调了Jag-1表达的图表,如通过qPCR检测到的,所述表达通过添加VPA(EFI-A-V)而增强,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图10A是展示了如通过蛋白质印记带强度测量的,单独的4μM CHIR(EFI-C)或425nM AS21842856(EFI-A)或与1mM VPA一起(EFI-C-V)(EFI-A-V)对培养的Lgr5+细胞中Jag-1表达的影响的一系列图像。培养物含有生长因子的背景,所述生长因子包含:50ng/mLEGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图10B是展示了1mM VPA增强了425nM AS1842856对Jag-1上调的作用的图表。使用GelQuant软件将计算的Jag-1相对于GAPDH进行归一化,并且对带进行定量。将Jag-1带的净体积除以匹配的GAPDH带的净体积值。将这些值相对于媒剂进行归一化。
图11A是展示了在生长因子的背景中,HIF1-α激活剂/脯氨酰4-羟基化抑制剂1,4-DPCA(DPCA)不使Lgr5 GFP+耳蜗祖细胞增殖的图表,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。对照化合物CHIR99021(4μM;C)和丙戊酸(1mM;V)使Lgr5 GFP+耳蜗祖细胞富集。
图11B是展示了在生长因子的背景中,HIF1-α激活剂/HIF-PH抑制剂1,4-DPCA(DPCA)不使Lgr5 GFP+耳蜗祖细胞富集的图表,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。对照化合物CHIR99021(4μM;C)和丙戊酸(1mM;V)使Lgr5GFP+耳蜗祖细胞富集。
图12A是展示了在生长因子的背景中,HIF1-α激活剂/脯氨酰4-羟基化抑制剂1,4-DPCA(370nM DPCA)当与CHIR(4μM)+VPA(1mM)组合时通过CHIR(4μM)+VPA(1mM)增强了Lgr5GFP+祖细胞增殖的图表,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mLIGF1(I)。
图12B是描绘了以下展示的图表:在生长因子的背景中,HIF1-α激活剂/脯氨酰4-羟基化抑制剂1,4-DPCA(370nM DPCA)当与CHIR(4μM)+VPA(1mM)组合时通过CHIR(4μM)+VPA(1mM)示出了使Lgr5 GFP+祖细胞增殖富集的趋势,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图12C是描绘了在生长因子的背景中,用CHIR(4μM)、CHIR(4μM)+VPA(1mM)或CHIR(4μM)+VPA(1mM)+1,4-DPCA(370nM)处理的Lgr5 GFP+细胞的培养物的一系列图像,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图13A是展示了在生长因子的背景中,HIF1-α激活剂/HIF-PH抑制剂FG-2216(FG)不使Lgr5 GFP+耳蜗祖细胞增殖的图表,所述生长因子包含:50ng/mL EGF(E)、50ng/mLbFGF(F)和50ng/mL IGF1(I)。对照化合物CHIR99021(4μM;C)和丙戊酸钠盐(1mM;V)使Lgr5GFP+耳蜗祖细胞富集。
图13B是展示了在生长因子的背景中,HIF1-α激活剂/HIF-PH抑制剂FG-2216(FG)不使Lgr5 GFP+耳蜗祖细胞富集的图表,所述生长因子包含:50ng/mL EGF(E)、50ng/mLbFGF(F)和50ng/mL IGF1(I)。对照化合物CHIR99021(4μM;C)和丙戊酸钠盐(1mM;V)使Lgr5GFP+耳蜗祖细胞富集。
图14A是展示了在生长因子的背景中,HIF1-α激活剂/HIF-PH抑制剂FG-2216(30μM;FG)当与CHIR(4μM)组合时通过CHIR(4μM)和CHIR(4μM)+VPA(1mM)增强了Lgr5 GFP+祖细胞增殖的图表,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图14B是描绘了以下展示的图表:在生长因子的背景中,HIF1-α激活剂/HIF-PH抑制剂FG-2216(30μM;FG)当与CHIR(4μM)组合时通过CHIR(4μM)+VPA(1mM)增强了Lgr5 GFP+祖细胞增殖的富集,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mLIGF1(I)。
图14C是描绘了在生长因子的背景中,用CHIR(4μM)、CHIR(4μM)+VPA(1mM)或CHIR(4μM)+FG-2216(30μM;FG)处理的Lgr5 GFP+细胞的培养物的一系列图像,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图15A是展示了在生长因子的背景中,HIF1-α激活剂/HIF-PH抑制剂FG-2216(30μM;FG)当与CHIR(4μM)+VPA(1mM)组合时与CHIR(4μM)和CHIR(4μM)+VPA(1mM)类似地使Lgr5GFP+祖细胞增殖的图表,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mLIGF1(I)。
图15B是描绘了以下展示的图表:在生长因子的背景中,HIF1-α激活剂/HIF-PH抑制剂FG-2216(30μM;FG)示出了当与CHIR(4μM)+VPA(1mM)组合时增强Lgr5GFP+祖细胞增殖富集的趋势超过了CHIR(4μM)+VPA(1mM),所述生长因子包含:50ng/mL EGF(E)、50ng/mLbFGF(F)和50ng/mL IGF1(I)。
图15C是描绘了在生长因子的背景中,用CHIR(4μM)、CHIR(4μM)+VPA(1mM)或CHIR(4μM)+VPA(1mM)+FG-2216(30μM;FG)处理的Lgr5 GFP+细胞的培养物的一系列图像,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图16A是展示了在生长因子的背景中,HIF1-α激活剂/HIF-PH抑制剂达普司他(DAP)不使Lgr5 GFP+耳蜗祖细胞增殖的图表,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。对照化合物CHIR99021(4μM;C)和丙戊酸钠盐(1mM;V)使Lgr5 GFP+耳蜗祖细胞富集。
图16B是展示了在生长因子的背景中,HIF1-α激活剂/HIF-PH抑制剂达普司他(DAP)不使Lgr5 GFP+耳蜗祖细胞富集的图表,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。对照化合物CHIR99021(4μM;C)和丙戊酸钠盐(1mM;V)使Lgr5 GFP+耳蜗祖细胞富集。
图17A是展示了在生长因子的背景中,HIF1-α激活剂/HIF-PH抑制剂达普司他(1.11μM;DAP)当与CHIR(4μM)+VPA(1mM)组合时与CHIR(4μM)和CHIR(4μM)+VPA(1mM)相比不增强Lgr5 GFP+祖细胞增殖的图表,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图17B是描绘了以下展示的图表:在生长因子的背景中,HIF1-α激活剂/HIF-PH抑制剂达普司他(1.11μM;DAP)当与CHIR(4μM)+VPA(1mM)组合时对Lgr5 GFP+祖细胞增殖的富集的增强超过了CHIR(4μM)和CHIR(4μM)+VPA(1mM),所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
图17C是描绘了在生长因子的背景中,用CHIR(4μM)、CHIR(4μM)+VPA(1mM)或CHIR(4μM)+VPA(1mM)+达普司他(1.11μM;DAP)处理的Lgr5 GFP+细胞的培养物的一系列图像,所述生长因子包含:50ng/mL EGF(E)、50ng/mL bFGF(F)和50ng/mL IGF1(I)。
具体实施方式
本发明基于以下发现:通过增加例如Jag-1、Deltex-1表达来增加非经典notch信号传导会引起耳蜗支持细胞或前庭支持细胞的增殖,同时在子代细胞中维持分化为耳蜗毛细胞或前庭毛细胞的能力。
本文所述的方法增加了耳蜗支持细胞或前庭支持细胞的增殖。通常,耳蜗支持细胞或前庭支持细胞(在其中刺激增殖)表达Lgr5(含富含亮氨酸重复序列的G蛋白偶联受体5)。然而,本文描述的方法也可以刺激具有很少或没有Lgr5表达的支持细胞的增殖。
本文所述的方法产生了扩增的耳蜗或前庭细胞群体。在一些实施例中,富集表达Lgr5的扩增的细胞(即,与起始细胞群体相比,更大百分比的扩增的细胞群体表达Lgr5)。
Lgr5是GPCR A类受体蛋白的成员,其在各种组织中表达,如在肌肉、胎盘、脊髓和脑中表达,并且特别是在某些组织中作为成体干细胞的生物标记。Lgr5+干细胞是内耳的耳蜗和前庭器官中存在的感觉毛细胞的前体。因此,增加Lgr5+耳蜗或前庭细胞群体是有益的,因为它会增加可以分化为感觉毛细胞的前体细胞的群体。
本发明提供了用于通过增加Jag-1表达、Deltex-1表达或非经典Notch信号传导来诱导耳蜗支持细胞和前庭支持细胞的自我更新的组合物和方法。
因此,在各个方面,本发明提供了用于以下的组合物和方法:增加耳蜗支持细胞或前庭支持细胞的增殖;产生扩增的耳蜗或前庭细胞群体;以及通过使耳蜗支持细胞或前庭支持细胞与Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂接触或向受试者施用Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂来治疗受试者的内耳听力或平衡障碍。
在本发明的另一方面,耳蜗支持细胞或前庭支持细胞进一步与另外的药剂接触或向受试者进一步施用另外的药剂。向Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂中添加另一种药剂是有利的,因为与单独或组合的Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂相比,支持细胞群体的增殖增加。
在一些实施例中,与Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂的组合相比,在用Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂和另外的药剂治疗后产生的扩增的细胞群体大于所产生的扩增的细胞群体。
与Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂相比,当使用另外的药剂时,更多地富集了Lgr5+细胞群体。
在一些实施例中,另外的药剂是Jag-1增效剂或Deltex-1增效剂。
可替代地,另外的药剂可以是表观遗传药剂。表观遗传药剂包含表观遗传修饰剂、介体和调节剂。表观遗传修饰剂是其产物直接通过DNA甲基化、染色质的翻译后修饰或染色质的结构改变来修饰表观基因组的基因。表观遗传介体通常是表观遗传修饰的靶标,尽管它们自身很少突变。表观遗传介体与干细胞重编程所涉及的基因在很大程度上重叠,并且其在癌症中的作用直接来自于其重编程作用的发现。表观遗传介体是那些其产物是表观遗传修饰剂的靶标的基因。表观遗传调节剂是位于信号传导和代谢通路中修饰剂和介体上游的as基因。
毛细胞再生剂
如本文所使用的,术语毛细胞再生剂是指Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂以及本文所述的促进毛细胞再生的任何添加剂。
毛细胞再生剂刺激耳蜗支持细胞(在所述耳蜗支持细胞中刺激增殖)的增殖,所述耳蜗支持细胞表达Lgr5(含富含亮氨酸重复序列的G蛋白偶联受体5)。然而,毛细胞再生剂还可以刺激具有很少或没有Lgr5表达的支持细胞的增殖。在一些实施例中,毛细胞再生剂产生扩增的耳蜗细胞群体。在一些实施例中,富集表达Lgr5的扩增的细胞(即,与起始细胞群体相比,更大百分比的扩增的细胞群体表达Lgr5)。
在一些实施例中,毛细胞再生剂可以通过刺激耳蜗的感觉上皮内的支持细胞向替换毛细胞的转分化来促进毛细胞的再生。可替代地或另外,毛细胞再生剂可以激活耳蜗的感觉上皮中的增殖反应,从而提供可以随后分化成支持细胞的新的细胞群体。
单一药剂可以用作毛细胞再生剂,或者药剂的组合可以提供毛细胞再生功能。因此,在一些实施例中,毛细胞再生剂是单一药剂。在其它实施例中,毛细胞再生剂是药剂的组合。在某些此类实施例中,药剂的组合可以一起调配在单一组合物中。在其它实施例中,药剂的组合可以单独调配并分别提供给患者。
毛发再生剂包含Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂。其它另外的药剂包含例如Wnt激动剂或HDAC抑制剂。
J
Jagged-1(Jag-1)是Notch受体的配体,所述配体触发Notch信号传导通路,所述Notch信号传导通路是调节多种组织类型中的细胞命运决定的高度保守的通路。Jag-1-Notch相互作用通过从膜上释放Notch受体的细胞内单位,从而引起激活下游靶基因的转录的蛋白水解裂解级联来触发Notch信号通路。
Jag-1激动剂是使Jag-1基因、蛋白和/或通路的表达、水平和/或活性增加的化合物。在一些实施例中,Jag-1激动剂结合并激活Jag-1和/或增加Jag-1细胞内结构域(JICD)的活性。可替代地,Jag-1激动剂可以结合并调节一种或多种Jag-1通路组分的活性,如通过抑制通路的负调节剂的活性,或通过激活通路的上游或下游调节剂。
在一些实施例中,Jag-1激动剂充当非经典Notch信号传导激动剂。在一些实施例中,Jag-1激动剂基本上不激活经典Notch信号传导基因。在一些实施例中,Jag-1激动剂基本上不激活足以激活Wnt信号传导的量的经典Notch信号传导基因。在一些实施例中,Jag-1激动剂直接作用于Jag-1,并且基本上不上调HES或HEY基因或促进其活性。在一些实施例中,Jag-1激动剂不是Wnt激动剂。在一些实施例中,Jag-1激动剂不是GSK3抑制剂。在一些实施例中,Jag-1激动剂增加非经典Notch信号传导。在一些实施例中,Jag-1激动剂通过增加Deltex-1或Hif-1的表达或活性来增加非经典Notch信号传导。
在一些实施例中,Jag-1激动剂直接结合Jag-1。在其它实施例中,Jag-1激动剂调节一种或多种Jag-1通路下游组分,如Deltex-1或Hif-1。在其它实施例中,Jag-1激动剂调节除Hes或Hey之外的一种或多种Jag-1通路下游组分。在一些实施例中,相对于经典notch通路基因,Jag-1激动剂优先激活非经典notch通路基因。在一些实施例中,与Jag-1激动剂上调Hes或Hey相比,Jag-1激动剂优先上调Deltex-1或Hif-1。在一些实施例中,Jag-1激动剂使Deltex-1和/或Hif-1的表达与其增加Hes和Hey的表达或活性相比增加5%、10%、25%、50%、75%、100%或更多。
在一些实施例中,Jag-1激动剂使Deltex-1的表达与其增加Hes的表达或活性相比增加5%、10%、25%、50%、75%、100%或更多。
在一些实施例中,Jag-1激动剂使Deltex-1的表达与其增加Hey的表达或活性相比增加5%、10%、25%、50%、75%、100%或更多。
在一些实施例中,Jag-1激动剂使Hif-1的表达与其增加Hes的表达或活性相比增加5%、10%、25%、50%、75%、100%或更多。
在一些实施例中,Jag-1激动剂使Hif-1的表达与其增加He7的表达或活性相比增加5%、10%、25%、50%、75%、100%或更多。
在一些实施例中,Jag-1激动剂是蛋白质或肽、P13K激动剂或FOXO抑制剂。
在下表1中提供了作为Jag-1激动剂的具有活性的示例性药剂,包含其药学上可接受的盐。
表1:Jag-1激动剂
在特定实施例中,Jag-1激动剂是任选地包括CDDYYYGFGCNKFCRPR(SEQ ID NO:1)、由其组成或基本上由其组成的可溶性Jag-1肽(残基188-204)。还包含与SEQ ID NO:1至少90%、95%、96%、97%、98%或99%相同的Jag-1肽变体和其片段。Jag-1肽变体和其片段介导Notch信号传导。
因此,“Jag-1激动剂”是指例如在Lgr5+耳蜗细胞中使Jag-1的表达、水平和/或活性增加的药剂。相对于对照,例如相对于基线活性水平,某些Jag-1激动剂使Lgr5+耳蜗细胞中的Jag-1的表达和/或水平增加约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
相对于对照,例如相对于基线活性水平,某些Jag-1激动剂使Lgr5+耳蜗细胞中的Jag-1的表达和/或水平增加约或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍。
在一些实施例中,相对于单独的Jag-1激动剂,Jag-1激动剂与Jag-1增效剂和/或Deltex-1增效剂的组合使Lgr5+耳蜗细胞中的Jag-1表达、水平和/或活性增加至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在其它实施例中,相对于单独的Jag-1激动剂,Jag-1激动剂与Jag-1增效剂和/或Deltex-1增效剂的组合使Lgr5+耳蜗细胞中的Jag-1表达、水平和/或活性增加约或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍。
可替代地,相对于对照,例如相对于基线活性水平,Jag-1激动剂使Lgr5+耳蜗细胞增殖增加至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在其它实施例中,相对于对照,例如相对于基线活性水平,Jag-1激动剂使Lgr5+耳蜗细胞增殖增加约或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍。
Lgr5+耳蜗细胞增殖可以例如在干细胞增殖测定中测量。
非经典Notch信号传导激动剂的特征在于以下中的一个或多个:1)与媒剂对照相比,使Lgr5+耳蜗细胞中的Jag-1和/或Deltex-1的表达和/或活性增加至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、250%、300%、350%、400%、450%或500%;或者2)相对于毛发和分裂增强剂(Hair and Enhancer of Split,Hes)或与YRPW相关的毛发/分裂增强剂(Hairy/enhancer-of-split related with YRPW,Hey),使Lgr5+耳蜗细胞中的Jag-1和/或Deltex-1的表达和/或活性增加1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍。
在一些实施例中,Jag-1激动剂是HIF1-α激活剂。HIF1-α激活剂包含在例如耳蜗细胞中抑制脯氨酰4-羟基化(P4H)的药剂。α-脯氨酰4-羟化酶(一种氧敏感酶)的抑制靶向促血管生成因子HIF-1α,以在特定脯氨酸残基羟基化后破坏。
可替代地,HIF1-α激活剂是指例如在耳蜗细胞中抑制缺氧诱导因子(HIF)脯氨酰羟化酶(PHD)酶的药剂(HIF-PH抑制剂)。抑制缺氧诱导因子(HIF)脯氨酰羟化酶增加HIF稳定性和作用。
示例性HIF1-α激活剂包含4,4α-二氢-4-氧代-1,10-菲咯啉-3-羧酸(1,4-DPCA)、N-[(1-氯-4-羟基-3-异喹啉基)羰基]-甘氨酸(FG-2216)、和N-[(1,3-二环己基六氢-2,4,6-三氧代-5-嘧啶基)羰基]-甘氨酸(达普司他)。
在一些实施例中,Jag-1激动剂是磷脂酰肌醇3-激酶(PI3K、PI3-激酶;也称为磷酸肌醇3-激酶)激动剂。因此,在某些实施例中,“PI3K激动剂”是指使例如耳蜗细胞中的至少一种PI3K基因、蛋白和/或通路的表达、水平和/或活性(如成纤维细胞生长因子(FGF)上调或AKT磷酸化)增加的药剂。在一些情况下,PI3K激动剂是“直接PI3K激动剂”,其直接结合至少一种PI3K蛋白,并且任选地增加或以其它方式激活PI3K蛋白被或与PI3K通路中的其它分子结合。在一些实施例中,PI3K激动剂是“下游PI3K靶标”,其结合和/或调节PI3K下游的基因或蛋白质,包含直接或紧邻PI3K下游的基因或蛋白质,如AKT或FOXO。如本文所描述的,“下游PI3K激动剂”的实例包含FOXO抑制剂。在一些实施例中,与P13K激动剂上调Hes或Hey相比,Jag-1激动剂优先上调Deltex-1或Hif-1。在一些实施例中,PI3K激动剂使Deltex-1和/或Hif-1的表达与其增加Hes和Hey的表达或活性相比增加10%、25%、50%、75%。
PI3-激酶是能够磷酸化磷脂酰肌醇的肌醇环的3位羟基的相关细胞内信号转换酶家族。PI3-激酶具有多种细胞功能,包含细胞生长、增殖、分化、运动、存活和细胞内运输。这些功能中的许多功能与I类PI3-激酶激活PI3K/AKT/mTOR通路中的蛋白激酶B(PKB或Akt)的能力有关。PI3K活性还与Jag-1通路具有正相互作用。
PI3-激酶的示例性类别包含I、II、III和IV类PI3K。I类PI3K激酶产生磷脂酰肌醇3-磷酸酯(PI(3)P)、磷脂酰肌醇(3,4)-双磷酸酯(PI(3,4)P2)和磷脂酰肌醇(3,4,5)-三磷酸酯(PI(3,4,5)P3),并且由G蛋白偶联受体和酪氨酸激酶受体激活。I类PI3K的实例包含:催化激酶,如PIK3CA、PIK3CB、PIK3CG和PIK3CD;以及调节激酶,如PIK3R1、PIK3R2、PIK3R3、PIK3R4、PIK3R5和PIK3R6。
II类和III类PI3K在结构和功能上与I类不同。II类PI3K在C末端C2结构域中有所不同,其缺少关键的Asp残基来协调Ca2+的结合,这表明II类PI3K以不依赖Ca2+的方式结合脂质。II类包含至少三种催化亚型(C2α、C2β和C2γ),无调节亚型。II类PI3K催化从PI产生PI(3)P和从PI产生PI(3,4)P2。III类在结构上更类似于I类(即,它们以催化(Vps34)和调节(Vps15/p150)亚基的异二聚体形式存在),但仅从PI产生PI(3)P。II类PI3K的实例包含PIK3C2A、PIK3C2B和PIK3C2G,并且III类PI3K的实例包含PIK3C3。
在一些实施例中,相对于对照,例如相对于基线活性水平,PI3K激动剂使耳蜗细胞或耳蜗细胞群体中的至少一种PI3K基因或蛋白的表达、水平和/或活性(如成纤维细胞生长因子(FGF)上调或AKT磷酸化)增加约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%或更多(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
在一些实施例中,相对于对照,例如相对于基线活性水平,PI3K激动剂使耳蜗细胞中的PI3K/AKT通路中PI3K(例如,I类PI3K)激活AKT(即,增加AKT蛋白表达)的能力增加约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、200%、300%、400%或500%或更多(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
PI3K激动剂的一般实例包含叉头框-O转录因子(FOXO)抑制剂。
在某些实施例中,Jag-1/PI3K激动剂是FOXO抑制剂。叉头框-O转录因子(FOXO)是指调节涉及细胞生长、增殖、分化和其它过程的基因的表达的转录因子家族。FOX蛋白的特征是叉头框,所述叉头框是形成与DNA结合的基序的80到100个氨基酸的序列。由于蛋白质结构域结构中环的蝴蝶状外观,此叉头基序也被称为有翼螺旋。叉头蛋白是螺旋-旋转-螺旋(helix-turn-helix)类蛋白的亚组。
示例性FOXO转录因子包含FOXO1、FOXO3(或FOXO3a)、FOXO4和FOXO6。因此,“FOXO抑制剂”是指使例如耳蜗细胞中的至少一种FOXO基因、转录因子蛋白和/或通路的表达、水平和/或活性降低的药剂。“FOXO拮抗剂”是指与至少一种FOXO蛋白结合并且任选地降低、减少或以其它方式消除FOXO蛋白被或与其它分子的结合的药剂。FOXO抑制剂的特定实例包含AS1842856。
在某些实施例中,相对于对照,例如相对于基线活性水平,FOXO抑制剂使耳蜗细胞中的FOXO转录因子的表达或活性降低约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%。
这些和相关的FOXO抑制剂的实例包含针对FOXO基因/蛋白并降低其表达的抑制性核酸(例如,反义、siRNA)药剂。
在一些情况下,相对于对照,例如相对于基线活性水平,FOXO抑制剂使耳蜗细胞中FOXO转录因子与DNA的结合降低约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、200%、300%、400%或500%或更多(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
在一些实施例中,相对于对照,例如相对于基线活性水平,FOXO抑制剂使耳蜗细胞中的FOXO转录因子的核定位降低约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在一些实施例中,相对于对照,例如相对于基线活性水平,FOXO抑制剂使耳蜗细胞中的FOXO转录因子的磷酸化和任选的泛素化/降解增加约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在一些实施例中,相对于对照,例如相对于基线活性水平,FOXO抑制剂使耳蜗细胞中的FOXO转录因子的乙酰化增加约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%或更多(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
DELTEX-1激动剂
Deltex-1E3泛素连接酶1(Deltex-1)是Notch受体的配体,所述配体触发非经典Notch信号传导通路,所述非经典Notch信号传导通路是调节多种组织类型中的细胞命运决定的高度保守的通路。Deltex-1在Jag-1的下游进行调节。
Deltex-1激动剂是使Deltex-1基因的表达、水平和/或活性和/或蛋白质表达或活性增加的化合物。例如,相对于对照,例如相对于基线活性水平,Deltex-1激动剂使Deltex-1基因的表达或活性和/或蛋白质表达或活性增加约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
在一些实施例中,Deltex-1激动剂直接结合并激活Deltex-1。可替代地,Deltex-1激动剂可以结合并调节一种或多种Jag-1通路组分的活性,如通过抑制通路的负调节剂的活性,或通过激活通路的上游或下游调节剂。
在一些实施例中,Deltex-1激动剂直接作用于Deltex-1(即,与Deltex-1结合)。在其它实施例中,Deltex-1激动剂调节一种或多种Deltex-1通路下游组分,如Hif-1。在一些实施例中,Deltex-1激动剂独立于Jag-1增加非经典Notch信号传导。独立于Jag-1意指激动剂不激活Jag-1,从而激活了经典Notch通路的组分,例如Wnt、Hes或Hey。在一些实施例中,Deltex-1激动剂通过增加Hif-1来增加非经典Notch信号传导。Deltex-1激动剂是使Hif-1基因的表达、水平和/或活性和/或蛋白质表达或活性增加的化合物。例如,相对于对照,例如相对于基线活性水平,Deltex-1激动剂使Hif-1基因的表达或活性和/或蛋白质表达或活性增加约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
在一些实施例中,与Deltex-1激动剂上调Hes或Hey相比,Deltex-1激动剂优先上调Deltex-1或Hif-1。在一些实施例中,Deltex-1激动剂使Deltex-1和/或Hif-1的表达与其增加Hes和Hey的表达或活性相比增加10%、25%、50%、75%或100%。
JAG-1增效剂、DELTEX-1增效剂和PI3K增效剂
Jag-1激动剂或Deltex-1激动剂可以与一种或多种另外的药剂如本文定义的Jag-1增效剂、Deltex-1增效剂或PI3K增效剂组合使用。
在某些实施例中,Jag-1增效剂充当非经典Notch信号传导增效剂。在干细胞增殖测定中,与Jag-1增效剂组合使用的Jag-1激动剂至少部分地通过与单独的Jag-1激动剂相比使Deltex-1或Hif-1的表达或活性增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%来增加非经典Notch信号传导。可替代地,Jag-1激动剂与Jag-1增效剂的组合独立于Deltex-1或Hif-1使非经典Notch信号传导增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在一些实施例中,与Jag-1增效剂上调Hes或Hey相比,Jag-1增效剂优先上调Jag-1、Deltex-1或Hif-1。在一些实施例中,Jag-1增效剂使Jag-1、Deltex-1和/或Hif-1的表达与其增加Hes和Hey的表达或活性相比增加10%、25%、50%、75%或100%。
相对于对照,例如相对于基线活性水平,Deltex-1增效剂与Wnt激动剂或GSK3抑制剂的组合独立于Jag-1使非经典Notch信号传导增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
可替代地,相对于对照,例如相对于基线活性水平,Deltex-1增效剂与Wnt激动剂或GSK3抑制剂的组合通过增加Hif-1使非经典Notch信号传导增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在一些实施例中,与Deltex-1增效剂上调Hes或Hey相比,Deltex-1增效剂优先上调Jag-1、Deltex-1或Hif-1。在一些实施例中,Deltex-1增效剂使Jag-1、Deltex-1和/或Hif-1的表达与其增加Hes和Hey的表达或活性相比增加10%、25%、50%、75%或100。
在一些实施例中,Jag-1增效剂或Deltex-1增效剂是PI3K增效剂。
在一些实施例中,PI3K增效剂是“上游PI3K靶标”,其例如通过减少负调节PI3K的基因或蛋白质的表达、水平和/或活性或通过增加正调节PI3K的基因或蛋白质的表达、水平和/或活性(如FGF上调或AKT磷酸化)而结合和/或调节PI3K上游的基因或蛋白质。
在一些实施例中,Jag-1/PI3K增效剂是PTEN抑制剂。PTEN是磷脂酰肌醇-3,4,5-三磷酸酯3-磷酸酶。其含有张力蛋白样结构域和催化结构域并优先使磷酸肌醇底物脱磷酸。其负调节细胞中磷脂酰肌醇-3,4,5-三磷酸酯的细胞内水平。PTEN特异性催化PIP3中肌醇环的3'磷酸酯的去磷酸化,从而生成双磷酸酯产物PIP2(PtdIns(4,5)P2)。这种去磷酸化产生对AKT信号传导通路的抑制。因此,PTEN负调节或抑制PI3K/Akt和任选的PKB信号传导通路。
因此,“PTEN抑制剂”是指使例如耳蜗细胞中的PTEN基因的表达、水平和/或活性和/或蛋白质表达或活性降低的药剂。“PTEN拮抗剂”是指与至少一种PTEN蛋白结合并且任选地降低、减少或以其它方式消除PTEN蛋白被或与其它分子的结合的药剂。示例性PTEN抑制剂包含双过氧钒化合物。PTEN抑制剂的具体实例包含SF1670、VO-Ohpic、bpV(phen)和bpV(pic)。
在某些实施例中,相对于对照,例如相对于基线活性水平,PTEN抑制剂使耳蜗细胞中的PTEN的表达降低约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%、500%或更多(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍或更多倍)。
这些和相关的PTEN抑制剂的实例包含针对PTEN基因/蛋白并降低其表达的抑制性核酸(例如,反义、siRNA)药剂。相对于对照,例如相对于基线活性水平,某些PTEN抑制剂使耳蜗细胞中PTEN催化PIP3中肌醇环的3'磷酸酯去磷酸化的能力降低约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍或更多倍)。
一些PTEN抑制剂直接结合到PTEN的活性位点。相对于对照,例如相对于基线活性水平,一些PTEN抑制剂使耳蜗细胞PIP3水平和/或Akt磷酸化增加约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍或更多倍)。
表2:Jag-1增效剂、Deltex-1增效剂或PI3K增效剂
WNT激动剂
Wnt激动剂是指增加细胞(例如,耳蜗细胞)中的Wnt基因、蛋白或信号传导通路(例如,TCF/LEF、卷曲蛋白受体家族、Wif1、Lef1、轴蛋白(Axin)2、β-连环蛋白)的表达、水平和/或活性的药剂。Wnt激动剂包含GSK3抑制剂,如GSK3-α或GSK3-β抑制剂。在优选实施例中,GSK3抑制剂是GSK3-β抑制剂。
TCF/LEF家族是通过高迁移率族结构域与DNA结合并且参与Wnt信号传导通路的一类转录因子,在Wnt信号传导通路中,所述转录因子将共激活剂β-连环蛋白募集到靶基因的增强子元件。卷曲蛋白是在Wnt信号传导通路中用作受体的G蛋白偶联受体蛋白家族。卷曲蛋白受体抑制细胞内β-连环蛋白降解并激活TCF/LEF介导的转录。
在一些实施例中,相对于对照,例如相对于基线活性水平,Wnt激动剂使耳蜗或前庭细胞中的Wnt信号传导增加约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、200%、300%、400%或500%或更多(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
在一些实施例中,相对于对照,例如相对于基线活性水平,Wnt激动剂使耳蜗或前庭细胞中的TCF/LEF介导的转录增加例如约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、200%、300%、400%或500%或更多(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
在一些实施例中,相对于对照,例如相对于基线活性水平,Wnt激动剂对卷曲蛋白受体家族成员的结合和激活增加例如约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、200%、300%、400%或500%或更多(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
在一些实施例中,相对于对照,例如相对于基线活性水平,Wnt激动剂对GSK3的抑制增加例如约或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
在一些实施例中,与Wnt激动剂上调Hes或Hey相比,Wnt激动剂更多地优先上调Jag-1、Deltex-1或Hif-1。在一些实施例中,Wnt激动剂使Jag-1、Deltex-1和/或Hif-1的表达与其增加Hes和Hey的表达或活性相比增加10%、25%、50%、75%、100%、125%、150%、175%、200%、250%或更多。
在下表3和4中提供了作为Wnt激动剂的具有活性的示例性药剂,包含其药学上可接受的盐。
表3示例性Wnt激动剂
表4Wnt激动剂
在一些实施例中,作为Wnt激动剂的具有活性的药剂是GSK3抑制剂。优选地,GSK3抑制剂是AZD1080、GSK3抑制剂XXII、CHIR99021或LY2090314。在优选实施例中,Wnt激动剂是CHIR99021。在其它优选实施例中,Wnt激动剂和/或GSK3抑制剂是经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮。(式A。)
Wnt激动剂可以是选自WO 2018/125746的任何Wnt激动剂,所述文献特此通过引用并入。在一些实施例中,Wnt激动剂可以是如WO 2018/125746的权利要求1中所定义的化合物。在一些实施例中,Wnt激动剂可以是如WO 2018/125746的权利要求12中所定义的化合物。
示例性经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮包含:3-(咪唑并[1,2-a]吡啶-3-基)-4-(2-(哌啶-1-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-1H-吡咯-2,5-二酮;7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-9-腈;3-(9-乙炔基-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氨基-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;1-(9-氟-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-2-羰基)哌啶-4-甲醛;3-(9-氟-2-(4-(羟甲基)哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4,4-二氟哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(8-氧杂-3-氮杂双环[3.2.1]辛烷-3-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(苯并[d]异噁唑-3-基)-4-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-1H-吡咯-2,5-二酮;N-(7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-9-基)乙酰胺;3-(9-(二氟甲基)-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(3,3-二氟哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-((1R,4R)-2,5-二氮杂双环[2.2.1]庚烷-2-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;2-(8-氧杂-3-氮杂双环[3.2.1]辛烷-3-羰基)-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-9-腈;2-(3,3-二氟哌啶-1-羰基)-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-9-腈;2-(4,4-二氟哌啶-1-羰基)-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-9-腈;3-(2-(4,4-二氟哌啶-1-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(8-氧杂-3-氮杂双环[3.2.1]辛烷-3-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4-(氨基甲基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4-(羟甲基)哌啶-1-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;2-(4-(羟甲基)哌啶-1-羰基)-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-9-腈;3-(9-氟-2-(3,3,4,4,5,5-六氟哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(3,3,5,5-四氟哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(2,2,6,6-四氟吗啉-4-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4,4-二氟-3-羟基哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4-(二氟(羟基)甲基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(6,6-二氟-1,4-氧代氮杂环庚烷-4-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-([1,2,4]三唑并[4,3-a]吡啶-3-基)-4-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(哌啶-1-羰基-d10)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基-3,3,4,4-d4)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(4-(2,2,2-三氟-1-羟乙基)哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(4-((甲氨基)甲基)哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4-((二甲氨基)甲基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4-氨基哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(4-(甲氨基)哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4-(二甲氨基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;9-氟-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-N-(哌啶-4-基甲基)-3,4-二氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-2(1H)-羧酰胺;9-氟-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-N-甲基-N-(哌啶-4-基甲基)-3,4-二氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-2(1H)-羧酰胺;9-氟-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-N-甲基-N-((1-甲基哌啶-4-基)甲基)-3,4-二氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-2(1H)-羧酰胺;3-(9-氟-2-((1R,4R)-5-甲基-2,5-二氮杂双环[2.2.1]庚烷-2-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(2-甲基-2,8-二氮杂螺[4.5]癸烷-8-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(8-甲基-2,8-二氮杂螺[4.5]癸烷-2-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(咪唑并[1,2-a]吡啶-3-基)-4-(2-(2,2,6,6-四氟吗啉-4-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-1H-吡咯-2,5-二酮;3-(2-(6,6-二氟-1,4-氧代氮杂环庚烷-4-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;2-(4-(二甲氨基)哌啶-1-羰基)-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-9-腈;9-氰基-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-N-甲基-N-((1-甲基哌啶-4-基)甲基)-3,4-二氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-2(1H)-羧酰胺;7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-2-(8-甲基-2,8-二氮杂螺[4.5]癸烷-2-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-9-腈;3-(8,9-二氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;或3-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮(LY20900314)。
优选地,经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮是:3-(咪唑并[1,2-a]吡啶-3-基)-4-(2-(哌啶-1-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-1H-吡咯-2,5-二酮;7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-9-腈;3-(9-乙炔基-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(4-(羟甲基)哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4,4-二氟哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(8-氧杂-3-氮杂双环[3.2.1]辛烷-3-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-(二氟甲基)-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(3,3-二氟哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;2-(4,4-二氟哌啶-1-羰基)-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-9-腈;3-(2-(8-氧杂-3-氮杂双环[3.2.1]辛烷-3-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4-(羟甲基)哌啶-1-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(3,3,4,4,5,5-六氟哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(3,3,5,5-四氟哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(2,2,6,6-四氟吗啉-4-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4,4-二氟-3-羟基哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4-(二氟(羟基)甲基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(6,6-二氟-1,4-氧代氮杂环庚烷-4-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(哌啶-1-羰基-d10)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基-3,3,4,4-d4)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(9-氟-2-(4-(2,2,2-三氟-1-羟乙基)哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4-((二甲氨基)甲基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(2-(4-(二甲氨基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;9-氟-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1H-吡咯-3-基)-N-甲基-N-((1-甲基哌啶-4-基)甲基)-3,4-二氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-2(1H)-羧酰胺;3-(咪唑并[1,2-a]吡啶-3-基)-4-(2-(2,2,6,6-四氟吗啉-4-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-1H-吡咯-2,5-二酮;3-(2-(6,6-二氟-1,4-氧代氮杂环庚烷-4-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;3-(8,9-二氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮;或3-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮。(LY2090314)。
最优选地,经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮是3-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂卓并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1H-吡咯-2,5-二酮。(LY2090314)。
经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮的结构在下表5中示出。
表5
在其它实施例中,如WO 2018/125746、US 20180214458和USSN 62/608,663中所述的Wnt激动剂和/或GSK3抑制剂,所述文献的内容各自通过全文引用的方式并入。
HDAC抑制剂
组蛋白脱乙酰酶(HDAC)是从组蛋白上的ε-N-乙酰赖氨酸氨基酸中去除乙酰基(O=C-CH3),从而允许组蛋白更紧密地缠绕DNA的一类酶。这很重要,因为DNA缠绕在组蛋白周围,并且DNA表达受乙酰化和脱乙酰化的调节。
HDAC根据与酵母原始酶的序列同源性和结构域组织而分类为四种类别。HDAC类别包含HDACI、HDAC IIA、HDAC IIB、HDAC III和HDAC IV。
组蛋白脱乙酰酶(HDAC)抑制剂(HDACi、HDI)是抑制组蛋白脱乙酰酶的化合物。
因此,“HDAC抑制剂”是指能够降低HDAC的表达或酶活性的药剂。例如,HDAC抑制剂导致细胞中靶基因的组蛋白脱乙酰化降低。
在某些实施例中,相对于对照,例如相对于基线活性水平,HDAC抑制剂使HDAC的表达或酶活性降低至少5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在某些实施例中,相对于对照,例如相对于基线活性水平,HDAC抑制剂使靶基因的组蛋白脱乙酰化降低至少5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在一些实施例中,相对于对照,例如相对于基线活性水平,HDAC抑制剂使靶基因的表达或活性增加至少5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在一些实施例中,相对于对照,例如相对于基线活性水平,HDAC抑制剂使HDAC的表达或酶活性降低至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍。
在一些实施例中,相对于对照,例如相对于基线活性水平,HDAC抑制剂使靶基因的组蛋白脱乙酰化降低至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍。
在一些实施例中,相对于对照,例如相对于基线活性水平,HDAC抑制剂使靶基因的表达或活性增加至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍。在各个实施例中,本发明的方法和组合物包含使用HDAC抑制剂。下表6和7提供了示例性HDAC抑制剂。
表6示例性HDAC抑制剂
表7另外的示例性HDAC抑制剂
在一些实施例中,HDAC抑制剂是I类HDAC抑制剂。在这些实施例中,I类HDAC抑制剂可以是短链羧酸。在优选实施例中,HDAC抑制剂是丙戊酸(VPA)、2-己基-4-戊炔酸或苯丁酸钠。更优选地,HDAC抑制剂是丙戊酸(VPA)。
如本文所使用的,术语“丙戊酸”、“VPA”和“丙戊酸钠”可互换地用于指代相同的化合物。
使用方法
在某些实施例中,本公开涉及诱导、促进或增强内耳组织,具体地内耳支持细胞和毛细胞的生长、增殖或再生。一些实施例涉及用于干细胞的受控增殖的方法,所述方法包括在抑制分化的同时诱导干细胞性的初始阶段和随后的使干细胞向组织细胞分化的阶段。
当根据本发明的方法用毛细胞再生剂处理耳蜗支持细胞或前庭支持细胞群体时,无论所述群体是在体内还是体外,经处理的支持细胞均表现出干细胞样行为,因为经处理的支持细胞具有增殖和分化的能力,更具体地分化为耳蜗毛细胞或前庭毛细胞的能力。在一些情况下,药剂诱导并维持支持细胞产生子代干细胞,所述子代干细胞可以分裂许多代并维持使高比例的所得细胞分化为毛细胞的能力。在某些实施例中,增殖干细胞表达选自以下中的一个或多个的一个或多个干细胞标记:Lgr5、Sox2、Opeml、Phex、lin28、Lgr6、细胞周期素D1、Msx1、Myb、Kit、Gdnf3、Zic3、Dppa3、Dppa4、Dppa5、Nanog、Esrrb、Rex1、Dnmt3a、Dnmt3b、Dnmt3l、Utf1、Tcl1、Oct4、Klf4、Pax6、Six2、Zic1、Zic2、Otx2、Bmi1、CDX2、STAT3、Smad1、Smad2、smad2/3、smad4、smad5和smad7。优选地,增殖干细胞表达选自以下中的一个或多个的一个或多个干细胞标记:Lgr5。
在一些实施例中,所述方法可以用于在大量毛细胞形成之前维持或甚至暂时增加预先存在的支持细胞群体的干细胞性(即,自我更新)。在一些实施例中,预先存在的支持细胞群体包括内柱细胞、外柱细胞、内指状细胞、Deiter细胞、Hensen细胞、Boettcher细胞和/或Claudius细胞。可以使用在代表性显微分析样品上的利用免疫染色(包含细胞计数)和谱系追踪的形态学分析来确认这些细胞类型中的一种或多种细胞类型的扩增。在一些实施例中,预先存在的支持细胞包括Lgr5+细胞。利用免疫染色(包含细胞计数)和qPCR和RNA杂交的形态学分析可以用于确认细胞群体中的Lgr5上调。
有利地,本文描述的方法可以在不使用基因操纵的情况下实现这些目标。在许多学术研究中使用的种系操纵并不是治疗听力损失的理想治疗方法。通常,所述疗法优选地涉及不伴有基因疗法的小分子、肽、抗体或其它非核酸分子或核酸递送载体的施用。在某些实施例中,所述疗法涉及小有机分子的施用。在一些情况下,听力保护或恢复是通过使用被注射到中耳并扩散到耳蜗中的(非遗传性)治疗剂来实现的。
耳蜗严重依赖于所有存在的细胞类型,并且这些细胞的组织对其功能很重要。作为支持细胞,其在神经递质循环和耳蜗力学中起着重要作用。因此,在柯蒂氏器内维持玫瑰花式图案化可能对功能很重要。基底膜的耳蜗力学激活了毛细胞转导。由于耳蜗力学的高灵敏度,还期望避免细胞团块。总而言之,即使在增殖后,沿基底膜维持毛细胞和支持细胞的正确分布和关系也可能是听力的期望特征,因为支持细胞功能和适当的力学对于正常听力是必须的。
在一些实施例中,以维持或甚至建立耳蜗上皮细胞的玫瑰花式图案特性的方式扩增耳蜗细胞群体中毛细胞的细胞密度。
在某些实施例中,增加了包括毛细胞和支持细胞两者的耳蜗细胞群体中的毛细胞的细胞密度。耳蜗细胞群体可以是体内群体(即,由受试者的耳蜗上皮所包括),或者耳蜗细胞群体可以是体外(离体)群体。如果所述群体是体外群体,则可以参考任何治疗之前和之后采集的所述群体的代表性显微分析样品来确定细胞密度的增加。如果所述群体是体内群体,则可以通过确定对受试者的听力的影响来间接确定细胞密度的增加,其中毛细胞密度的增加与听力的改善相关。
在一些实施例中,在不存在神经元细胞的情况下置于干细胞增殖测定中的支持细胞形成带状突触。
在原生耳蜗中,毛细胞和支持细胞的图案化以平行于基底膜的方式发生。在一些实施例中,以耳蜗上皮的基底膜特性的方式扩增耳蜗细胞群体中的支持细胞的增殖。
在一些实施例中,通过用本公开的组合物处理初始耳蜗细胞群体以形成中间耳蜗细胞群体来选择性地扩增初始耳蜗细胞群体中的支持细胞的数量,其中中间耳蜗细胞群体中的支持细胞与毛细胞的比率超过初始耳蜗细胞群体中的支持细胞与毛细胞的比率。扩增的耳蜗细胞群体可以是例如体内群体、体外群体或甚至体外外植体。在一些实施例中,中间耳蜗细胞群体中的支持细胞与毛细胞的比率超过初始耳蜗细胞群体中的支持细胞与毛细胞的比率。例如,在一些实施例中,中间耳蜗细胞群体中的支持细胞与毛细胞的比率超过初始耳蜗细胞群体中的支持细胞与毛细胞的比率1.1倍、1.5倍、2倍、3倍、4倍、5倍或更多倍。在一些情况下,通过干细胞增殖测定来确定组合物扩增耳蜗细胞群体的能力。
在一些实施例中,通过用本公开的组合物处理耳蜗细胞群体来扩增耳蜗细胞群体中的干细胞的数量以形成中间耳蜗细胞群体,其中中间耳蜗细胞群体中的干细胞的细胞密度超过初始耳蜗细胞群体中的干细胞的细胞密度。经处理的耳蜗细胞群体可以是例如体内群体、体外群体或甚至体外外植体。在一个此类实施例中,经处理的耳蜗细胞群体中的干细胞的细胞密度超过初始耳蜗细胞群体中的干细胞的细胞密度至少1.1倍、1.25倍、1.5倍、2倍、3倍、4倍、5倍或更多倍。体外耳蜗细胞群体的扩增可能比体内群体的扩增更显著;例如,在某些实施例中,扩增的体外干细胞群体中的干细胞的细胞密度可以比初始耳蜗细胞群体中的干细胞的细胞密度大至少4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、75倍、100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍、1000倍、2000倍或甚至3000倍。在一些情况下,通过干细胞增殖测定来确定组合物扩增耳蜗细胞群体的能力。
在一些实施例中,用本公开的毛细胞再生剂处理耳蜗支持细胞群体或前庭支持细胞群体以增加所述群体的Lgr5活性。例如,在一些情况下,Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂。
具有使体外耳蜗支持细胞或前庭支持细胞群体的Lgr5活性增加至少1.2倍、1.5倍、2倍、3倍、4倍、5倍或更多倍并维持所述活性的能力。在一些实施例中,Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂。
具有使体外耳蜗支持细胞或前庭支持细胞群体的Lgr5活性增加2倍、3倍、5倍、10倍、100倍、500倍、1000倍、2000倍或甚至3000倍的能力。在体内群体中也可以观察到Lgr5活性的增加,但是观察到的增加可能小于体外群体。在一些情况下,Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂和Wnt激动剂抑制剂具有使体内耳蜗支持细胞或前庭支持细胞群体的Lgr5活性增加约或至少约5%、10%、20%、30%或更多的能力。在一些情况下,例如在体外Lgr5+活性测定中证明了Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂的用于Lgr5活性的这种增加的能力,并且例如在体内Lgr5+活性测定中证明了在体内群体中的所述能力,如通过分离器官并使用免疫染色、Lgr5的内源性荧光蛋白表达和用于Lgr5的qPCR执行形态学分析所测量的。
在一些实施例中,如例如在体外Lgr5+活性测定中测量的,与单独的Wnt激动剂相比,组合的Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂具有使体外耳蜗支持细胞或前庭支持细胞群体的Lgr5活性增加10%、20%、30%、40%、50%、75%、100%或200%的能力。
在一些实施例中,如例如在干细胞增殖测定中测量的,与单独的Wnt激动剂相比,Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂具有使体外耳蜗支持细胞或前庭支持细胞群体的Lgr5增殖增加10%、20%、30%、40%、50%、75%或100%的能力。
在一些实施例中,如例如在干细胞增殖测定中测量的,与Wnt激动剂结合VPA相比,Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂具有使体外耳蜗支持细胞或前庭支持细胞群体的Lgr5增殖增加10%、20%、30%、40%、50%、75%或100%的能力。
除了增加群体的Lgr5活性外,还可以通过用本公开的毛细胞再生剂处理含有Lgr5+支持细胞的耳蜗或前庭细胞群体(无论是体内还是体外)来增加耳蜗或前庭细胞群体中的Lgr5+支持细胞的数量。通常,干细胞/祖细胞支持细胞的细胞密度可以通过若干种机制中的一种或多种机制相对于初始细胞群体扩增。例如,在一些实施例中,可以产生具有增加的干细胞倾向性(即,更大的分化为毛细胞的能力)的新产生的Lgr5+支持细胞。作为另外的实例,在一些实施例中,通过细胞分裂不产生子代Lgr5+细胞,但是诱导预先存在的Lgr5+支持细胞分化为毛细胞。作为另外的实例,在一些实施例中,通过细胞分裂不产生子代细胞,但是Lgr5支持细胞被激活到更高水平的Lgr5活性,并且然后激活的支持细胞能够分化为毛细胞。不管机制如何,在一些实施例中,本公开的毛细胞再生剂具有使体外分离的耳蜗支持细胞或前庭支持细胞的细胞群体中的Lgr5+支持细胞的细胞密度增加至少5倍、10倍、50倍、100倍、500倍、1000倍或2000倍的能力。在体内群体中也可以观察到Lgr5+支持细胞的细胞密度的增加,但是观察到的增加可能稍微较小。例如,在一些实施例中,所述组合物具有使体内耳蜗支持细胞或前庭支持细胞群体中的Lgr5+支持细胞的细胞密度增加约或至少约5%、10%、20%、30%或更多的能力。组合物在体外群体中的能力(用于Lgr5+支持细胞的这种增加)可以例如在干细胞增殖测定或适当的体内测定中证明。在一些实施例中,本公开的组合物具有通过在不存在蛋白质的情况下或在低检测水平的蛋白质的情况下诱导细胞中Lgr5的表达来增加耳蜗中Lgr5+细胞的数量,同时维持原生形态的能力。在一些实施例中,组合物具有通过在不存在蛋白质的情况下或在低检测水平的蛋白质的情况下诱导细胞中Lgr5的表达来增加耳蜗或前庭器官中Lgr5
本发明包含通过使耳蜗支持细胞与Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂接触来增加Lgr5+耳蜗支持细胞的增殖的方法。在一些实施例中,细胞进一步与Jag-1增效剂或Deltex增效剂和/或Wnt激动剂接触。任选地,细胞进一步与表观遗传药剂如HDAC抑制剂接触。优选地,HDAC抑制剂是VPA。
本发明包含通过使前庭支持细胞与Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂接触来增加前庭支持细胞的增殖的方法。在一些实施例中,细胞进一步与Jag-1增效剂或Deltex增效剂和/或Wnt激动剂接触。任选地,细胞进一步与表观遗传药剂如HDAC抑制剂接触。优选地,HDAC抑制剂是VPA。
在各种方法中,与媒剂对照相比,Lgr5+耳蜗细胞或前庭细胞增殖增加。
在一些实施例中,相对于媒剂对照,Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂使Lgr5+耳蜗支持细胞或前庭支持细胞增殖增加至少10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、250%、300%、350%、400%、450%或500%或更多(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
在一些实施例中,在干细胞增殖测定中,相对于单独的Wnt激动剂,Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂结合本文所述的另外的药剂使Lgr5+耳蜗支持细胞或前庭支持细胞增殖增加至少10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、250%、300%、350%、400%、450%或500%(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
在一些实施例中,在干细胞增殖测定中,相对于Wnt激动剂结合VPA,Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂结合本文所述的另外的药剂使Lgr5+耳蜗支持细胞或前庭支持细胞增殖增加至少10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、250%、300%、350%、400%、450%或500%(或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍)。
还包含用于通过使包括亲本细胞群体的耳蜗组织与Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂接触以在耳蜗组织中形成扩增的细胞群体来扩增所述耳蜗组织中的耳蜗细胞群体的方法。在一些实施例中,细胞进一步与Jag-1增效剂或Deltex增效剂和/或Wnt激动剂接触。任选地,细胞进一步与表观遗传药剂如HDAC抑制剂如I类HDAC抑制剂接触。在一些实施例中,I类HDAC抑制剂是短链羧酸,例如丙戊酸(VPA)。
本发明还包含通过使细胞群体与Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂接触以在耳蜗组织中形成扩增的细胞群体来产生扩增的Lgr5+耳蜗细胞群体的方法。在一些实施例中,细胞进一步与Jag-1增效剂或Deltex增效剂和/或Wnt激动剂接触。Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂。如在干细胞分化测定中所测量的,扩增的群体能够分化为毛细胞。
Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂(任选地结合另外的)能够(i)在干细胞增殖测定中经历增殖测定时间段从增殖测定初始细胞群体形成增殖测定最终细胞群体,和/或(ii)在干细胞分化测定中经历分化测定时间段从分化测定初始细胞群体形成分化测定最终细胞群体,其中:(a)增殖测定初始细胞群体具有(i)增殖测定初始总细胞数量,(ii)增殖测定初始Lgr5+细胞数量,(iii)增殖测定初始毛细胞数量,(iv)等于增殖测定初始Lgr5+细胞数量与增殖测定初始总细胞数量的比率的增殖测定初始Lgr5+细胞分数,和(v)等于增殖测定初始毛细胞数量与增殖测定初始总细胞数量的比率的增殖测定初始毛细胞分数;(b)增殖测定最终细胞群体具有(i)增殖测定最终总细胞数量,(ii)增殖测定最终Lgr5+细胞数量,(iii)增殖测定最终毛细胞数量,(iv)等于增殖测定最终Lgr5+细胞数量与增殖测定最终总细胞数量的比率的增殖测定最终Lgr5+细胞分数,和(v)等于增殖测定最终毛细胞数量与增殖测定最终总细胞数量的比率的增殖测定最终毛细胞分数;(c)分化测定初始细胞群体具有(i)分化测定初始总细胞数量,(ii)分化测定初始Lgr5+细胞数量,(iii)分化测定初始毛细胞数量,(iv)等于分化测定初始Lgr5+细胞数量与分化测定初始总细胞数量的比率的分化测定初始Lgr5+细胞分数,和(v)等于分化测定初始毛细胞数量与分化测定初始总细胞数量的比率的分化测定初始毛细胞分数;(d)分化测定最终细胞群体具有(i)分化测定最终总细胞数量,(ii)分化测定最终Lgr5+细胞数量,(iii)分化测定最终毛细胞数量,(iv)等于分化测定最终Lgr5+细胞数量与分化测定最终总细胞数量的比率的分化测定最终Lgr5+细胞分数,和(v)等于分化测定最终毛细胞数量与分化测定最终总细胞数量的比率的分化测定最终毛细胞分数;(e)增殖测定最终Lgr5+细胞数量超过增殖测定初始Lgr5+细胞数量至少10倍;和/或(f)分化测定最终毛细胞数量为非零数量。
如在干细胞分化测定中所测量的,扩增的群体能够分化成毛细胞。
在一些实施例中,耳蜗细胞在耳蜗组织中。在一些实施例中,耳蜗组织在受试者中。
一些实施例涉及治疗患有听力损失或听觉功能下降或有罹患听力损失或听觉功能下降的风险的受试者的方法。预防和/或治疗急性和慢性耳部疾病以及听力损失、头晕和平衡问题,尤其是突发性听力损失、声创伤、由于长期暴露于噪声引起的听力损失、老年性耳聋、内耳假体植入期间的创伤(插入创伤)、由于内耳区域疾病引起的头晕、与头晕有关和/或作为梅尼埃病(Meniere's disease)的症状、与眩晕有关和/或作为梅尼埃病的症状、耳鸣、听觉过敏以及由于抗生素和细胞抑制剂以及其它药物引起的听力损失。
在一些实施例中,听力损失是感音神经性听力损失或隐性听力损失。
感音神经性听力损失约占听力损失的90%,并且其通常是由于耳蜗中毛细胞的损坏或丧失而引起的。毛细胞损坏和丧失的原因很多,并且本文所述的药剂和治疗可以在因毛细胞损坏或丧失的任何原因引起的感音神经性听力损失的上下文中使用。例如,毛细胞可能受到损坏,并且噪声暴露可能诱导损失,从而导致噪声诱导的感音神经性听力损失。因此,在一些实施例中,感音神经性听力损失是噪声诱导的感音神经性听力损失。噪声诱导的感音神经性听力损失可能是长期噪声暴露或严重噪声暴露的结果。耳毒性药物(例如顺铂和其类似物、氨基糖苷抗生素、水杨酸盐和其类似物或髓袢利尿剂)也可能引起感音神经性听力损失。在一些实施例中,感音神经性听力损失是药物诱导的感音神经性听力损失。感染可能会损坏耳蜗毛细胞,并且可能是突发性感音神经性听力损失的原因。在一些实施例中,感音神经性听力损失是突发性感音神经性听力损失(SSNHL)。突发性感音神经性听力也可能是特发性的。作为人类衰老过程的一部分,随着时间的流逝,毛细胞也可能会丧失或损坏。在一些实施例中,感音神经性听力损失是年龄相关感音神经性听力损失(也称为老年性耳聋)。
患有隐性听力损失的患者在嘈杂的环境中听力困难,但在标准测听频率下评估时不具有感音神经性听力损失(并且因此听力图正常)。因此,患有隐性听力损失的患者在可听性方面具有正常的听力功能,但可懂度功能降低。当向患者呈现背景噪声时,可懂度功能降低可能变得明显。
一些实施例包含用于预防、降低或治疗涉及内耳组织,特别是内耳毛细胞、其祖细胞以及任选的血管纹和相关的听觉神经的内耳病症和听力损伤的发生率和/或严重性的方法。特别令人感兴趣的是那些导致永久性听力损失(其中毛细胞数量减少可能是其起因)和/或毛细胞功能下降的病状。
通过使Lgr5+耳蜗细胞与Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂接触或向受试者施用Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂以在耳蜗组织中形成扩增的细胞群体来治疗或预防受试者的听力损失或听觉功能下降。在一些实施例中,细胞进一步与Jag-1增效剂或Deltex增效剂和/或Wnt激动剂接触。任选地,细胞进一步与表观遗传药剂如HDAC抑制剂如I类HDAC抑制剂接触。在一些实施例中,I类HDAC抑制剂是短链羧酸,例如丙戊酸(VPA)。
可以使用不同的标准来确定听力损失的有效治疗。这些标准可以归类为声音可听性的改善或声音可懂度的改善或两者。可听性功能的改善意味着患者检测声音存在或不存在的能力得到改善。换句话说,可听性的改善意味着患者能够检测到更安静的声音的存在。声音可懂度的改善意味着患者正确识别声音的能力得到改善。在一些实施例中,治疗为患者提供了改善的可听性功能。在一些实施例中,治疗为患者提供了改善的可懂度功能。在一些实施例中,治疗为患者提供了改善的可听性功能和改善的可懂度功能。
可听性功能的改善可以与可懂度功能的改善相关。例如,在这些情况下,患者可能能够更容易地检测单词的声音并正确识别单词。然而,在其它情况下,可听性的改善可能不与可懂度的改善相关。在这些情况下,患者现在可能能够听到单词,但无法正确识别所述单词。然而,可听性的改善是有利的,因为其可以允许患者听到患者以前听不见的声音。
在其它情况下,如通过标准测听法测试所测量的,患者可能感觉可听性功能的变化很小或没有变化,但是在治疗后仍可以感觉到可懂度功能得到改善。例如,在这些情况下,患者可能能够以与治疗之前的声音水平相同的声音水平检测单词刺激的存在,但是现在能够正确识别所述单词,而在治疗之前所述单词被错误地识别。可懂度的改善是重要的治疗益处,因为结果是患者可能能够在现实世界情形中理解更多的声音。因此,在优选实施例中,治疗为患者提供了改善的可懂度功能。在一些情况下,如通过标准测听法测试所测量的,患者可能感觉到可听性功能的变化很小或没有变化,但是在超高频下,可听性功能却有所改善。
可以使用本文所述的纯音测听法来测量可听性的改善。然而,为了通过治疗提供改善,不一定需要测量可听性的改善。类似地,可以使用本文所述的单词识别测试来测量可懂度的改善。然而,为了通过治疗提供改善,不一定需要测量可懂度的改善。本文所述的治疗可以用于提供听力功能的改善,而无需测量治疗之前和之后的听力功能。
本文所述的治疗在改善高频率下的可听性功能方面可能特别有效。因此,在一些实施例中,治疗提供了在4kHz、6kHz和/或8kHz下的改善的听力阈值。当通过纯音测听法测量时,此改善可以以在4kHz、6kHz和/或8kHz下纯音阈值降低的形式被观察到。在一些实施例中,相对于治疗前患者的纯音阈值,患者在治疗后在4kHz下的纯音阈值降低。在一些实施例中,相对于治疗前患者的纯音阈值,患者在治疗后在6kHz下的纯音阈值降低。在一些实施例中,相对于治疗前患者的纯音阈值,患者在治疗后在8kHz下的纯音阈值降低。
在一些实施例中,相对于在治疗前患者在4kHz、6kHz和/或8kHz下的听力阈值,在4kHz、6kHz和/或8kHz下的改善的听力阈值为至少5dB。在一些实施例中,相对于在治疗前患者在4kHz、6kHz和/或8kHz下的听力阈值,在4kHz、6kHz和/或8kHz下的改善的听力阈值为至少10dB。在一些实施例中,相对于在治疗前患者在4kHz、6kHz和/或8kHz下的听力阈值,在4kHz、6kHz和/或8kHz下的改善的听力阈值为至少20dB。在一些实施例中,相对于在治疗前患者在4kHz、6kHz和/或8kHz下的听力阈值,在4kHz、6kHz和/或8kHz下的改善的听力阈值为至少30dB。
在优选实施例中,当通过纯音测听法测量时,相对于在治疗前患者在8kHz下的听力阈值,治疗提供了在8kHz下至少5dB的改善的听力阈值。
在优选实施例中,当通过纯音测听法测量时,相对于在治疗前患者在6kHz下的听力阈值,治疗提供了在6kHz下至少5dB的改善的听力阈值。
在特别优选的实施例中,当通过纯音测听法测量时,相对于在治疗前患者在6kHz和8kHz下的听力阈值,治疗提供了在6kHz和8kHz下至少5dB的改善的听力阈值。
在一些实施例中,当在4kHz、6kHz和8kHz上测量时,使用患者的纯音阈值的平均值来评估可听性的改善。在某些实施例中,当通过纯音测听法测量时,治疗提供了对在4kHz、6kHz和8kHz上的患者听力阈值的平均值的改善,其中相对于在治疗前通过纯音测听法测量时在4kHz、6kHz和8kHz上的患者听力阈值的平均值,所述改善为至少1dB、2dB、3dB、4dB、5dB、6dB、7dB、8dB、9B、10dB、12dB、15dB、20dB、25dB、30dB。
可听性功能的改善可以在单个患者中或以在整个患者群体中的平均值的形式被观察到。
可以使用本文所述的单词识别测试来测量可懂度的改善。
在一些实施例中,使用如本文所述的标准单词识别评分来测量可懂度的改善。可替代地或另外,可以使用如本文所述的噪声中单词测试(words-in-noise test)来测量可懂度的改善。
当使用标准单词识别测试评估时,本文所述的治疗可以有效地改善单词的可懂度。因此,在一些实施例中,治疗提供了改善的标准单词识别评分,其中所述改善为至少10%、至少20%、至少30%、至少50%、至少70%、至少100%,其中所述改善百分比是使用以下公式计算的:
在优选实施例中,改善的单词识别评分为至少10%,其中所述改善百分比是使用以下公式计算的:
可以使用50个单词的标准单词识别测试来评估听力功能。在一些实施例中,治疗为患者提供了改善的标准单词识别,其中如果测试,则相对于在治疗前患者在50个单词的标准单词识别测试中识别的单词数量,所述改善将为至少5个、至少10个、至少15个单词。
在优选实施例中,治疗为患者提供了改善的标准单词识别,其中如果测试,则相对于在治疗前患者在50个单词的标准单词识别测试中识别的单词数量,所述改善将为至少5个单词。
本文所述的治疗在改善背景噪声中声音的可懂度方面特别有效。因此,在一些实施例中,治疗为患者提供了改善的噪声中单词评分,其中所述改善为至少10%、至少20%、至少30%、至少50%、至少70%、至少100%,其中所述改善百分比是使用以下公式计算的:
在优选实施例中,改善的噪声中单词评分为至少10%,其中所述改善百分比是使用以下公式计算的:
可以使用70个单词的噪声中单词测试来评估听力功能。因此,在一些实施例中,治疗为患者提供了改善的噪声中单词识别,其中如果测试,则相对于在治疗前患者在70个单词的噪声中单词测试中识别的单词数量,所述改善将为至少5个、至少7个、至少10个单词。
在优选实施例中,治疗为患者提供了改善的噪声中单词识别,其中如果测试,则相对于在治疗前患者在70个单词的噪声中单词测试中识别的单词数量,所述改善将为至少5个单词。
可以使用35个单词的噪声中单词测试来评估听力功能。因此,在一些实施例中,治疗为患者提供了改善的噪声中单词识别,其中如果测试,则相对于在治疗前患者在35个单词的噪声中单词测试中识别的单词数量,所述改善将为至少2个、至少3个、至少5个单词。
在优选实施例中,治疗为患者提供了改善的噪声中单词识别,其中如果测试,则相对于在治疗前患者在35个单词的噪声中单词测试中识别的单词数量,所述改善将为至少2个单词。
可以看到噪声中单词评分改善,而可听性功能未对应地改善。因此,在一些实施例中,当通过纯音测听法测量时,治疗提供了改善的噪声中单词评分,而可听性功能没有变化。在某些此类实施例中,在治疗后患者在0.5kHz、1kHz、2kHz和4kHz上的听力阈值的平均值与在治疗前患者在0.5kHz、1kHz、2kHz和4kHz上的听力阈值的平均值相比增加或降低不超过5dB,其中所述听力阈值是通过纯音测听法测量的。
在优选实施例中,治疗:(i)提供在8kHz下的改善的听力阈值,其中如果测试,则相对于在治疗前患者在8kHz下的听力阈值,所述改善将为至少5dB,其中所述听力阈值是通过纯音测听法测量的,并且(ii)为患者提供改善的标准单词识别评分或为患者提供改善的噪声中单词评分,其中如果测试,则标准单词识别评分的所述改善将为至少10%,其中所述改善百分比是使用以下公式计算的:
其中如果测试,则噪声中单词评分的所述改善将为至少10%,其中所述改善百分比是使用以下公式计算的:
在某些此类实施例中,治疗还提供了在6kHz下的改善的听力阈值,其中如果测试,则相对于在治疗前患者在6kHz下的听力阈值,所述改善将为至少5dB。
声音可懂度的改善可能在治疗具有正常可听性功能但可懂度功能降低的两个患者组的上下文中尤其有意义。这两个组是(i)患有隐性听力损失的患者,以及(ii)在标准测听频率(0.25kHz–8kHz)下听力阈值处于正常范围内(即,至多25dB)但仍难以正确感知声音的患者。这些患者通常在噪声中单词测试中表现出功能降低。因此,对于这些患者组中的任一个患者组中的患者,有效治疗表现为改善的可懂度功能。还可以观察到可听性功能的改善。在不希望受理论所束缚的情况下,噪声中单词评分的改善可能是由于治疗在超高频范围内提供了改善引起的。
本发明人发现,在治疗后不久可以观察到可听性功能和/或可懂度功能的改善。在一些实施例中,治疗在15天、30天、60天或90天内提供了可听性功能和/或可懂度功能的改善。在优选实施例中,在90天内提供了可听性功能和/或可懂度功能的改善。
在治疗之后,可以维持可听性功能和/或可懂度功能的改善。在一些实施例中,改善一直维持到至少90天、120天、180天或365天。在某些实施例中,改善一直维持到至少90天。在某些实施例中,改善一直维持到至少120天。在某些实施例中,改善一直维持到至少180天。在某些实施例中,改善一直维持到至少365天。
在各个实施例中,将Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂和任选的本文所述的一种或多种另外的药剂全身或局部施用于受试者。
全身施用包含但不限于口服或肠胃外施用。肠胃外途径包含例如肌内(IM)、皮下(SC)和静脉内(IV)。局部施用是例如用于内耳和/或中耳的施用。更具体地,用于圆窗膜的局部施用或例如用于耳蜗组织的鼓膜内或经鼓膜施用。本文描述了更具体的局部递送方法。
利用本文所述的用于增加Lgr5+耳蜗细胞增殖的各种方法来治疗或预防听力损失或听觉功能下降。耳蜗细胞与“细胞有效浓度”的Jag-1激动剂、Deltex-1激动剂和/或非经典Notch信号传导激动剂接触,以在耳蜗组织中形成扩增的细胞群体。任选地,细胞进一步与如本文所述的一种或多种另外的药剂接触。
“细胞有效浓度”是在干细胞增殖测定中,与媒剂对照相比,诱导至少1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍的基因表达和/或诱导Lgr5+细胞数量增加约1.5倍的化合物的最小浓度。
在一些实施例中,Lgr5+耳蜗细胞与“细胞有效浓度”的一种或多种化合物在体外(例如,在细胞培养中)接触(并且然后植入到耳蜗中)。在其它实施例中,Lgr5+耳蜗细胞与“细胞有效浓度”的一种或多种化合物原位(即,在耳蜗内)接触。在一些实施例中,递送足够的化合物以在人耳蜗的整个语音区域中达到“细胞有效浓度”。为了达到此目标浓度,可以将较高浓度的药物滴注到耳蜗中并扩散到整个语音区域。在其它实施例中,Lgr5+耳蜗细胞与比“细胞有效浓度”高2倍、3倍、4倍、5倍、10倍、20倍、50倍、100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍、1000倍的一种或多种化合物原位(即,在耳蜗内)接触。
可替代地,通过施用“调配物有效浓度”的一种或多种化合物来治疗听力损失或听觉功能下降。“调配物有效浓度”是比“细胞有效调配物”高的浓度。例如,“调配物有效浓度”比“细胞有效浓度”高至少约100倍到5000倍,或者比“细胞有效浓度”高约100倍、250倍、500倍、750倍、1000倍、1250倍、1500倍、1750倍、2000倍,或者比“细胞有效浓度”高约100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍或1000倍。通常,“调配物有效浓度”比“细胞有效浓度”高至少约1000倍。
可替代地,通过以设定的每日剂量施用一种或多种化合物来治疗听力损失或听觉功能下降。
以如上所述的“细胞有效浓度”和“调配物有效浓度”调配一种或多种化合物。
在一些实施例中,一种或多种化合物的“细胞有效浓度”为约0.01pM到1000nM、约1pM到100nM、约10pM到10nM、1nM到1000μM、约10nM到100μM、约0.1μM到10μM、约1μΜ到1mM、约1pM到10pM、约10pM到100pM、约100pM到1nM、约1nM到10nM、约10nM到100nM、约100nM到1000nM、约1μM到10μM、约10μM到100μM、约100μM到1mM、1mM到10mM、或约10mM到100mM。
在一些实施例中,将化合物以以下的每日剂量全身施用于受试者:约0.01毫克到1000毫克/天;约0.01毫克到500毫克/天;约0.01毫克到250毫克/天;约0.01毫克到100毫克/天;约0.01毫克到50毫克/天;约0.01毫克到25毫克/天;约0.01毫克到10毫克/天;约0.01毫克到5毫克/天;0.1毫克到100毫克/天;约0.1毫克到50毫克/天;约0.1毫克到25毫克/天;约0.1毫克到10毫克/天;约0.1毫克到5毫克/天;约0.1毫克到2.5毫克/天;约0.1毫克到10毫克/天;约0.1毫克到5毫克/天;约0.1毫克到4毫克/天;约0.1毫克到3毫克/天;约0.1毫克到2毫克/天;约0.1毫克到2毫克/天或约1毫克到5毫克/天。
在一些实施例中,将化合物以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。在一些实施例中,将化合物以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,将JAG-1激动剂例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到1000mM、10nM到1000mM、约100nM到100mM、约1uM到10mM、约10uM到1mM、约1nM到10nM、约10nM到100nM、约0.1uM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,JAG-1激动剂以足以在内耳中的外淋巴液中达到以下浓度的量施用:约0.01uM到1000mM、约0.1uM到100mM、约1uM到10mM、约10uM到1mM、约0.001uM到0.01uM、约0.01uM到0.1uM、约0.1uM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM、约1μM、约2μM、约3μM、约4μM、约5μM、约6μM、约7μM、约8μM、约9μM、或约10μM。
在一些实施例中,将Jag-1激动剂以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、10uM到100,000mM、约100uM到10,000mM、约1,000uM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、约10,000mM到100,000mM、或约100,000mM到1,000,000mM。
优选地,将Jag-1激动剂以以下的浓度施用于受试者,例如施用于中耳:约100uM、约1mM、约2mM、约3mM、约4mM、约5mM、约6mM、约7mM、约8mM、约9mM、约10mM、或约100mM。
在一些实施例中,将Jag-1激动剂以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,将Jag-1激动剂以相对于FDA批准的浓度的约0.01倍、0.1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,Jag-1激动剂是可溶性Jag-1肽,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,可溶性Jag-1肽以足以在内耳中的外淋巴液中达到以下浓度的量施用:约50nM、约100nM、约200nM、约300nM、约400nM、约500nM、或约1000nM。
在一些实施例中,Jag-1激动剂是可溶性Jag-1肽,并且以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,将Jag-1激动剂以以下的浓度施用于受试者,例如施用于中耳:约50uM、约100uM、约200uM、约300uM、约400uM、约500uM、约1mM、约5mM、约10mM、约20mM、约30mM、约40mM、约50mM、或约100mM。
在一些实施例中,Jag-1激动剂是可溶性Jag-1肽,并且以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,Jag-1激动剂是可溶性Jag-1肽,并且以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,Jag-1激动剂是HIF1-α激活剂,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,HIF1-α激活剂以足以在内耳中的外淋巴液中达到以下浓度的量施用:约100nM、约500nM、约1uM、约5uM、约10uM、约20uM、约30uM、约40uM、约50uM、或约100uM。
在一些实施例中,HIF1-α激活剂是1,4-DPCA,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,HIF1-α激活剂是1,4-DPCA,以足以在内耳中的外淋巴液中达到以下浓度的量施用:约100nM、约500nM、约1uM、约5uM、约10uM、约20uM、约30uM、约40uM、约50uM、或约100uM。
在一些实施例中,HIF1-α激活剂是1,4-DPCA,并且以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,将1,4-DPCA激动剂以在内耳中的外淋巴液中的以下的浓度施用于受试者,例如施用于中耳:约100uM、约500uM、约1mM、约5mM、约10mM、约20mM、约30mM、约40mM、约50mM、或约100mM。
在一些实施例中,HIF1-α激活剂是1,4-DPCA并且以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,HIF1-α激活剂是1,4-DPCA并且以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,HIF1-α激活剂是FG2216,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到1000mM、约10nM到100mM、约100nM到10mM、约1uM到1mM、约1uM到100uM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、约10mM到100mM、或约100mM到1000mM。
优选地,HIF1-α激活剂是FG2216并且以足以在内耳中的外淋巴液中达到以下浓度的量施用:约1uM、约5uM、约10uM、约15uM、约20uM、约30uM、约40uM、约50uM。
在一些实施例中,HIF1-α激活剂是FG2216,并且以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,HIF1-α激活剂是FG2216,以以下的浓度施用于受试者,例如施用于中耳:约0.5mM、约1mM、约5mM、约10mM、约15mM、约20mM、约30mM、约40mM、或约50mM。
在一些实施例中,HIF1-α激活剂是FG2216并且以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,HIF1-α激活剂是FG2216并且以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,HIF1-α激活剂是达普司他,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到1000mM、约10nM到100mM、约100nM到10mM、约1uM到1mM、约1uM到100uM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、约10mM到100mM、或约100mM到1000mM。
优选地,HIF1-α激活剂是达普司他,以足以在内耳中的外淋巴液中达到以下浓度的量施用:约0.1uM、约0.5uM、约1uM、约5uM、约10uM、约15uM、约20uM、约30uM、约40uM、或约50uM。
在一些实施例中,HIF1-α激活剂是达普司他,并且以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,HIF1-α激活剂是达普司他,其以以下的浓度施用于受试者,例如施用于中耳:约0.5mM、约1mM、约5mM、约10mM、约15mM、约20mM、约30mM、约40mM、或约50mM。
在一些实施例中,HIF1-α激活剂是达普司他并且以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,HIF1-α激活剂是达普司他并且以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,Jag-1激动剂是PI3K激动剂,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,PI3K激动剂以足以在内耳中的外淋巴液中达到以下浓度的量施用:约50nM、约100nM、约200nM、约400nM、约600nM、约1200nM、约2500nM、或约10uM。
在一些实施例中,Jag-1激动剂是PI3K激动剂,并且以以下的浓度施用于受试者,例如施用于中耳:约10uM到1,000,000mM、约100uM到100,000mM、约1mM到10,000mM、约10mM到1,000mM、约10uM到100uM、约100uM到1mM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、约10,000mM到100,000mM、或约100,000mM到1,000,000mM。
优选地,将PI3K激动剂以以下的浓度施用于受试者,例如施用于中耳:约100uM、约250uM、约500uM、约750uM、约1mM、约5mM、约10mM、约15mM、约20mM、约30mM、约40mM、或约50mM。
在一些实施例中,Jag-1激动剂是PI3K激动剂并且以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,Jag-1激动剂是PI3K激动剂并且以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,PI3K激动剂是FOXO抑制剂并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,FOXO抑制剂以足以在内耳中的外淋巴液中达到以下浓度的量施用:约50nM、约100nM、约200nM、约400nM、约600nM、约1200nM、约2500nM、或约10uM。
在一些实施例中,PI3K激动剂是FOXO抑制剂,并且以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,将FOXO抑制剂以以下的浓度施用于受试者,例如施用于中耳:约50uM、约100uM、约200uM、约400uM、约600uM、约1200uM、约2500uM、或约10mM。
在一些实施例中,PI3K激动剂是FOXO抑制剂并且以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,PI3K激动剂是FOXO抑制剂并且以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,FOXO抑制剂是AS1842856,并且例如以足以达到以下浓度的量施用于耳蜗细胞:约0.1nM到100uM、约1nM到10uM、约10nM到1uM、约0.1nM到1nM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、和约10uM到100uM。
优选地,AS1842856以足以在内耳中的外淋巴液中达到以下浓度的量施用:约50nM、约100nM、约200nM、约300nM、约400nM、约500nM、约600nM、约700nM、约800nM、约900nM、和约1uM。
在一些实施例中,FOXO抑制剂是AS1842856,并且以以下的浓度施用于受试者,例如施用于中耳:约0.1uM到100mM、约1uM到10mM、约10uM到1mM、约0.1uM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1mM、约1mM到10mM、和约10mM到100mM。
优选地,将AS1842856以以下的浓度施用于受试者,例如施用于中耳:约50uM、约100uM、约200uM、约300uM、约400uM、约500uM、约600uM、约700uM、约800uM、约900uM、和约1mM。
在一些实施例中,FOXO抑制剂是AS1842856并且以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,FOXO抑制剂是AS1842856并且以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,将Deltex-1激动剂例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,Deltex-1激动剂以足以在内耳中的外淋巴液中达到以下浓度的量施用:约50nM、约100nM、约200nM、约400nM、约600nM、约1200nM、约2500nM、或约10uM。
在一些实施例中,将Deltex-1激动剂以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,将Deltex-1激动剂以以下的浓度施用于受试者,例如施用于中耳:约10uM、100uM、1mM、5mM、10mM、或100mM。
在一些实施例中,将Deltex-1激动剂以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,将Deltex-1激动剂以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,将Jag-1增效剂例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,Jag-1增效剂以足以在内耳中的外淋巴液中达到以下浓度的量施用:约50nM、约100nM、约200nM、约400nM、约600nM、约1200nM、约2500nM、或约10uM。
在一些实施例中,将Jag-1增效剂以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,将Jag-1增效剂以以下的浓度施用于受试者,例如施用于中耳:约10uM、约100uM、约1mM、约5mM、约10mM、或约100mM。
在一些实施例中,将Jag-1增效剂以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,将Jag-1增效剂以相对于FDA批准的浓度的约0.01倍、0.1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
PI3k
在一些实施例中,Jag-1增效剂是PI3K增效剂,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,所施用的PI3K增效剂以足以在内耳中的外淋巴液中达到以下浓度的量施用:约50nM、约100nM、约200nM、约400nM、约600nM、约1200nM、约2500nM、或约10uM。
在一些实施例中,将PI3K增效剂以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,将PI3K增效剂以以下的浓度施用于受试者,例如施用于中耳:约10uM、约100uM、约1mM、约5mM、约10mM、或约100mM。
在一些实施例中,将PI3K增效剂以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,将PI3K增效剂以相对于FDA批准的浓度的约0.01倍、0.1倍、2倍、3倍、5倍或10倍施用于受试者。
在一些实施例中,PI3K增效剂是PTEN抑制剂,例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,PTEN抑制剂以足以在内耳中的外淋巴液中达到以下浓度的量施用:约50nM、约100nM、约200nM、约400nM、约600nM、约1200nM、约2500nM、或约10uM。
在一些实施例中,将PTEN抑制剂以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,将PTEN抑制剂以以下的浓度施用于受试者,例如施用于中耳:约10uM、约100uM、约1mM、约5mM、约10mM、或约100mM。
在一些实施例中,将PTEN抑制剂以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,将PTEN抑制剂以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,PTEN抑制剂是SF1670并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,SF1670以足以在内耳中的外淋巴液中达到以下浓度的量施用:约10nM、约25nM、约50nM、约75nM、约100nM、约250nM、约500nM、约750nM、和约1uM。
在一些实施例中,PTEN抑制剂是SF1670并且以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,将SF1670以在内耳中的外淋巴液中的以下的浓度施用于受试者,例如施用于中耳:约10uM、约25uM、约50uM、约75uM、约100uM、约250uM、约500uM、约750uM、和约1mM。
在一些实施例中,将SF1670以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,将SF1670以相对于FDA批准的浓度的约0.01倍、0.1倍、2倍、3倍、5倍或10倍施用于受试者。
在一些实施例中,PTEN抑制剂是VO-Ohpic,例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,VO-Ohpic以足以在内耳中的外淋巴液中达到以下浓度的量施用:约0.5uM、约1uM、约2uM、约4uM、约6uM、约8uM、约10uM、约25uM、或约50uM。
在一些实施例中,将VO-Ohpic以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,将VO-Ohpic以以下的浓度施用于受试者,例如施用于中耳:约0.5mM、约1mM、约2mM、约4mM、约6mM、约8mM、约10mM、约25mM、或约50mM。
在一些实施例中,将VO-Ohpic以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,将VO-Ohpic以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,PTEN抑制剂是bpV(phen),其例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,PTEN抑制剂是bpV(phen),其以足以在内耳中的外淋巴液中达到以下浓度的量施用:约0.5uM、约1uM、约2uM、约4uM、约6uM、约8uM、约10uM、约25uM、或约50uM。
在一些实施例中,将PTEN抑制剂bpV(phen)以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,PTEN抑制剂是bpV(phen),其以以下的浓度施用于受试者,例如施用于中耳:约0.5mM、约1mM、约2mM、约4mM、约6mM、约8mM、约10mM、约25mM、或约50mM。
在一些实施例中,PTEN抑制剂是bpV(phen),以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,PTEN抑制剂是bpV(phen),以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,PTEN抑制剂是bpV(pic),例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,PTEN抑制剂是bpV(pic),其以足以在内耳中的外淋巴液中达到以下浓度的量施用:约0.5uM、约1uM、约2uM、约4uM、约6uM、约8uM、约10uM、约25uM、或约50uM。
在一些实施例中,PTEN抑制剂是bpV(pic),以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,PTEN抑制剂是bpV(pic),以以下的浓度施用于受试者,例如施用于中耳:约0.5mM、约1mM、约2mM、约4mM、约6mM、约8mM、约10mM、约25mM、或约50mM。
在一些实施例中,PTEN抑制剂是bpV(pic),以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,将Jag-1增效剂以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
PI3k
在一些实施例中,Jag-1增效剂是PI3K增效剂,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,PI3K增效剂以足以在内耳中的外淋巴液中达到以下浓度的量施用:约50nM、约100nM、约200nM、约400nM、约600nM、约1200nM、约2500nM、或约10uM。
在一些实施例中,将PI3K增效剂以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,将PI3K增效剂以以下的浓度施用于受试者,例如施用于中耳:约10uM、约100uM、约1mM、约5mM、约10mM、或约100mM。
在一些实施例中,将PI3K增效剂以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,将Deltex-1增效剂例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约1nM到100mM、约10nM到10mM、约100nM到1mM、约1nM到10nM、约10nM到100nM、约100nM到1uM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
优选地,Deltex-1增效剂以足以在内耳中的外淋巴液中达到以下浓度的量施用:约50nM、约100nM、约200nM、约400nM、约600nM、约1200nM、约2500nM、或约10uM。
在一些实施例中,将Deltex-1增效剂以以下的浓度施用于受试者,例如施用于中耳:约1uM到1,000,000mM、约10uM到100,000mM、约100uM到10,000mM、约1mM到1,000mM、约1uM到10uM、约10uM到100uM、约100uM到1,000uM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
优选地,将Deltex-1增效剂以以下的浓度施用于受试者,例如施用于中耳:约10uM、约100uM、约1mM、约5mM、约10mM、或约100mM。
在一些实施例中,将Deltex-1增效剂以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,将Deltex-1增效剂以相对于FDA批准的浓度的约0.01倍、约0.1倍、约1倍、约2倍、约3倍、约5倍或约10倍施用于受试者。
在一些实施例中,GSK3抑制剂是AZD1080,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约0.001μM到10mM、约0.01uM到1mM、约0.1μM到100μM、约0.001μM到0.01μM、约0.01μM到0.1μM、约0.1μM到1μM、约1μM到10μM、约10μM到100μM、约100μM到1,000μM、或约1mM到10mM。
优选地,AZD1080以足以在内耳中的外淋巴液中达到以下浓度的量施用:约1μM、2μM、3μM、4μM、5μM、6μM、7μM、8μM、9μM、或10μM。
在一些实施例中,GSK3抑制剂是AZD1080,并且以以下的浓度施用于受试者,例如施用于中耳:约0.001mM到10,000mM、约0.01mM到1,000mM、约0.1mM到100mM、约0.001mM到0.01mM、约0.01mM到0.1mM、约0.1mM到1mM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、或约1,000mM到10,000mM。
优选地,将AZD1080以以下的浓度施用于受试者,例如施用于中耳:约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM。
在一些实施例中,GSK3抑制剂是AZD1080,并且以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,GSK3抑制剂是AZD1080并且以相对于FDA批准的浓度的约0.01倍、0.1倍、2倍、3倍、5倍或10倍施用于受试者。
在一些实施例中,GSK3抑制剂是LY2090314,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约0.001nM到10mM、约0.01nM到1μM、约0.1nM到100nM、约0.001nM到0.01nM、约0.01nM到0.1nM、约0.1nM到1nM、约1nM到10nM、约10nM到100nM、约100nM到1μM、或约1μM到10μM。
优选地,LY2090314以足以在内耳中的外淋巴液中达到以下浓度的量施用:约1nM、5nM、10nM、15nM、20nM、或40nM。
在一些实施例中,GSK3抑制剂是LY2090314,并且以以下的浓度施用于受试者,例如施用于中耳:约0.001μM到10mM、约0.01μM到1mM、约0.1μM到100uM、约0.001μM到0.01μM、约0.01μM到0.1μM、约0.1μM到1μM、约1μM到10μM、约10μM到100μM、约100μM到1mM、或约1mM到10mM。
优选地,LY2090314以以下的浓度施用于受试者,例如施用于中耳:约1μM、5μM、10μM、15μM、20μM、或40μM。
在一些实施例中,GSK3抑制剂是LY2090314并且以相对于FDA批准的浓度的约0.001倍到10倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,GSK3抑制剂是LY2090314并且以相对于FDA批准的浓度的约0.01倍、0.1倍、2倍、3倍、5倍或10倍施用于受试者。
在一些实施例中,GSK3抑制剂是经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约0.001nM到10mM、约0.01nM到1μM、约0.1nM到100nM、约0.001nM到0.01nM、约0.01nM到0.1nM、约0.1nM到1nM、约1nM到10nM、约10nM到100nM、约100nM到1μM、或约1μM到10μM。
优选地,经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮以足以在内耳中的外淋巴液中达到以下浓度的量施用:约1nM、5nM、10nM、15nM、20nM、50nM、100nM、250nM、或500nM。
在一些实施例中,GSK3抑制剂是经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮,并且以以下的浓度施用于受试者,例如施用于中耳:约0.001μM到10mM、约0.01μM到1mM、约0.1μM到100uM、约0.001μM到0.01μM、约0.01μM到0.1μM、约0.1μM到1μM、约1μM到10μM、约10μM到100μM、约100μM到1mM、或约1mM到10mM。
优选地,将经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮以以下的浓度施用于受试者,例如施用于中耳:约1μM、5μM、10μM、15μM、20μM、50μM、100μM、250μM、或500μM。
在一些实施例中,GSK3抑制剂是经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮,并且以相对于FDA批准的浓度的约0.001倍到10倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,GSK3抑制剂是经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮并且以相对于FDA批准的浓度的0.01倍、0.1倍、2倍、3倍、5倍或10倍施用于受试者。
在一些实施例中,GSK3抑制剂是GSK3抑制剂XXII,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约0.1nM到1mM、约1nM到100μM、约10nM到10μM、约0.1nM到1nM、约1nM到10nM、约10nM到100nM、约100nM到1μM、约1μM到10μM、约10μM到100μM、或约100μM到1000μM。
优选地,GSK3抑制剂XXII以足以在内耳中的外淋巴液中达到以下浓度的量施用:约0.1μM、0.2μM、0.3μM、0.4μM、0.5μM、0.6μM、0.7μM、0.8μM、0.9μM、或1.0μM。
在一些实施例中,GSK3抑制剂是GSK3抑制剂XXII,以以下的浓度施用于受试者,例如施用于中耳:约0.1μM到1,000mM、约1μM到100mM、约10μM到10mM、约0.1μM到1μM、约1μM到10μM、约10μM到100μM、约100μM到1mM、约1mM到10mM、约10mM到100mM、或约100mM到1000mM。优选地,GSK3抑制剂XXII以以下的浓度施用于受试者,例如施用于中耳:约0.1mM、0.2mM、0.3mM、0.4mM、0.5mM、0.6mM、0.7mM、0.8mM、0.9mM、或1.0mM。
在一些实施例中,GSK3抑制剂是GSK3抑制剂XXII并且以相对于FDA批准的浓度的约0.001倍到10倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,GSK3抑制剂是GSK3抑制剂XXII并且以相对于FDA批准的浓度的约0.01倍、0.1倍、2倍、3倍、5倍或10倍施用于受试者。
在一些实施例中,GSK3抑制剂是CHIR99021,并且例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约0.001mM到10mM、约0.01mM到1mM、约0.1μM到100μM、约0.001μM到0.01μM、约0.01μM到0.1μM、约0.1μM到1μM、约1μM到10μM、约10μM到100μM、约100μM到1,000μM、或约1mM到10mM。
优选地,CHIR99021以足以在内耳中的外淋巴液中达到以下浓度的量施用:约1μM、2μM、3μM、4μM、5μM、6μM、7μM、8μM、9μM、或10μM。
在一些实施例中,GSK3抑制剂是CHIR99021,以以下的浓度施用于受试者,例如施用于中耳:约0.001mM到10,000mM、约0.01mM到1,000mM、约0.1mM到100mM、约0.001mM到0.01mM、约0.01mM到0.1mM、约0.1mM到1mM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、或约1,000mM到10,000mM。
优选地,将CHIR99021以以下的浓度施用于受试者,例如施用于中耳:约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM。
在一些实施例中,GSK3抑制剂是CHIR99021并且以相对于FDA批准的浓度的约0.001倍到100倍、或相对于FDA批准的浓度的约0.1倍到50倍、或相对于FDA批准的浓度的约0.1倍到5倍、或相对于FDA批准的浓度的约1倍到5倍的浓度比率施用于受试者。
在一些实施例中,GSK3抑制剂是CHIR99021并且以相对于FDA批准的浓度的约0.01倍、0.1倍、2倍、3倍、5倍或10倍施用于受试者。
在一些实施例中,将HDAC抑制剂例如以足以在内耳中的外淋巴液中达到以下浓度的量施用于耳蜗细胞:约0.01uM到1000mM、约1uM到100mM、约10uM到10mM、约1uM到10uM、约10uM到100uM、约100uM到1000uM、约1mM到10mM、或约10mM到100mM。
在一些实施例中,将HDAC抑制剂以以下的浓度施用于受试者,例如施用于中耳:约10uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,HDAC抑制剂是VPA并且例如以足以在内耳中的外淋巴液中达到约10μM到4mM的浓度的量施用于耳蜗细胞。
在一些实施例中,将VPA以约100mM到4,000mM的浓度施用于受试者,例如施用于中耳。
在一些实施例中,HDAC抑制剂是VPA并且以约50mg、约100mg、约125mg、约250mg、约500mg、1000mg、2000mg、3000mg、4000mg或约5000mg的每日剂量全身施用于受试者。优选地,VPA以约50mg、约100mg、约125mg、约250mg、约500mg、1000mg、2000mg、3000mg、4000mg或约5000mg的口服剂型施用。
在一些实施例中,HDAC抑制剂是2-己基-4-戊炔酸并且例如以足以在内耳中的外淋巴液中达到约10μM到4mM的浓度的量施用于耳蜗细胞。
在一些实施例中,将2-己基-4-戊炔酸以约100mM到4,000mM的浓度施用于受试者,例如施用于中耳。
在一些实施例中,HDAC抑制剂是2-己基-4-戊炔酸并且以约50mg、约100mg、约125mg、约250mg、约500mg、1000mg、2000mg、3000mg、4000mg或约5000mg的每日剂量全身施用于受试者。优选地,VPA以约50mg、约100mg、约125mg、约250mg、约500mg、1000mg、2000mg、3000mg、4000mg或约5000mg的口服剂型施用。
在一些实施例中,HDAC抑制剂是苯丁酸钠并且例如以足以在内耳中的外淋巴液中达到约10μM到4mM的浓度的量施用于耳蜗细胞。
在一些实施例中,将苯丁酸钠以约100mM到4,000mM的浓度施用于受试者,例如施用于中耳。
在一些实施例中,HDAC抑制剂是苯丁酸钠并且以约50mg、约100mg、约125mg、约250mg、约500mg、1000mg、2000mg、3000mg、4000mg或约5000mg的每日剂量全身施用于受试者。优选地,VPA以约50mg、约100mg、约125mg、约250mg、约500mg、1000mg、2000mg、3000mg、4000mg或约5000mg的口服剂型施用。
一些实施例包含组合疗法,所述组合疗法包括使细胞与以下接触或施用以下:(i)Jag-1激动剂与(ii)Jag-1增效剂的组合,其中相对于(i)和(ii)中的单独的每一个,所述组合增加了Lgr5+耳蜗细胞增殖。在一些情况下,所述组合经鼓膜施用于受试者。一些实施例包括一起施用在如本文所述的同一药物组合物中的(i)Jag-1激动剂和(ii)Jag-1增效剂。一些实施例包括分别施用在单独的药物组合物中的(i)Jag-1激动剂和(ii)Jag-1增效剂。在一些实施例中,相对于(i)和(ii)中的单独的每一个,施用(i)和(ii)的组合使受试者的听力改善。
示例性组合疗法包含施用以下化合物中的两种或更多种化合物:CHIR99021、Vo-Ohpic、AZD1080、LY2090314、GSK3抑制剂XXII AS1842856和VPA。
优选组合疗法包含:1)CHIR99021和Vo-Ohpic;2)AZD1080和Vo-Ohpic;3)LY2090314和Vo-Ohpic;4)GSK3抑制剂XXII和Vo-Ohpic;5)AS1842856和VPA;或6)AS842856和Vo-Ohpic。
在一些实施例中,Jag-1增效剂是Vo-Ohpic,并且Jag-1激动剂是CHIR99021。优选地,Vo-Ohpic以足以在内耳中的外淋巴液中达到以下浓度的量施用:约1μM、2μM、3μM、4μM、5μM、6μM、7μM、8μM、9μM、或10μM,并且CHIR99021以足以在内耳中的外淋巴液中达到以下浓度的量施用:约1μM、2μM、3μM、4μM、5μM、6μM、7μM、8μM、9μM、或10μM。
可替代地,将Vo-Ohpic以以下的浓度施用于受试者,例如施用于中耳:1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM,并且将CHIR99021以以下的浓度施用于受试者,例如施用于中耳:约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM。
在一些实施例中,Jag-1增效剂是Vo-Ohpic,并且Jag-1激动剂是AZD1080。优选地,Vo-Ohpic以足以在内耳中的外淋巴液中达到以下浓度的量施用:1μM、2μM、3μM、4μM、5μM、6μM、7μM、8μM、9μM、或10μM,并且AZD1080以足以在内耳中的外淋巴液中达到以下浓度的量施用:约1μM、2μM、3μM、4μM、5μM、6μM、7μM、8μM、9μM、或10μM。
可替代地,将Vo-Ohpic以以下的浓度施用于受试者,例如施用于中耳:约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM,并且将AZD1080以以下的浓度施用于受试者,例如施用于中耳:约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM。
在一些实施例中,Jag-1增效剂是Vo-Ohpic,并且Jag-1激动剂是LY209031。优选地,Vo-Ohpic以足以在内耳中的外淋巴液中达到以下浓度的量施用:约1μM、2μM、3μM、4μM、5μM、6μM、7μM、8μM、9μM、或10μM,并且LY2090314以足以在内耳中的外淋巴液中达到以下浓度的量施用:约1nM、5nM、10nM、15nM、20nM、或40nM。
可替代地,将Vo-Ohpic以以下的浓度施用于受试者,例如施用于中耳:约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM,并且将LY2090314以以下的浓度施用于受试者,例如施用于中耳:约1μM、5μM、10μM、15μM、20μM、或40nM。
在一些实施例中,Jag-1增效剂是Vo-Ohpic,并且Jag-1激动剂是GSK3抑制剂XXII。优选地,Vo-Ohpic以足以在内耳中的外淋巴液中达到以下浓度的量施用:约1μM、2μM、3μM、4μM、5μM、6μM、7μM、8μM、9μM、或10μM,并且GSK3抑制剂XXII以足以在内耳中的外淋巴液中达到以下浓度的量施用:约0.1μM、0.2μM、0.3μM、0.4μM、0.5μM、0.6μM、0.7μM、0.8μM、0.9μM、或1.0μM。
可替代地,将Vo-Ohpic以以下的浓度施用于受试者,例如施用于中耳:约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM、或约30mM,并且将GSK3抑制剂XXII以以下的浓度施用于受试者,例如施用于中耳:约0.1mM、0.2mM、0.3mM、0.4mM、0.5mM、0.6mM、0.7mM、0.8mM、0.9mM、或1.0mM。
在一些实施例中,Jag-1激动剂是AS1843856,并且另外的药剂是VPA。优选地,AS1843856以足以在内耳中的外淋巴液中达到以下浓度的量施用:约0.1μM、0.2μM、0.3μM、0.4μM、0.5μM、0.6μM、0.7μM、0.8μM、0.9uM、或1μM,并且VPA以足以在内耳中的外淋巴液中达到约100μM到4mM的浓度的量施用。
可替代地,将AS1843856以以下的浓度施用于受试者,例如施用于中耳:约0.1mM、0.2mM、0.3mM、0.4mM、0.5mM、0.6mM、0.7mM、0.8mM、0.9mM、或1mM,并且将VPA以约100mM到4,000mM的浓度施用于受试者,例如施用于中耳。
在一些实施例中,Jag-1激动剂是AS1843856,并且另外的药剂是Vo-Ohpic。优选地,AS1843856以足以在内耳中的外淋巴液中达到以下浓度的量施用:约0.1μM、0.2μM、0.3μM、0.4μM、0.5μM、0.6μM、0.7μM、0.8μM、0.9uM、或1μM,并且Vo-Ohpic以足以在内耳中的外淋巴液中达到以下浓度的量施用:约1μM、2μM、3μM、4μM、5μM、6μM、7μM、8μM、9μM、或10μM。
可替代地,将AS1843856以以下的浓度施用于受试者,例如施用于中耳:约0.1mM、0.2mM、0.3mM、0.4mM、0.5mM、0.6mM、0.7mM、0.8mM、0.9mM、或1mM,并且将Vo-Ohpic以以下的浓度施用于受试者,例如施用于中耳:约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM。
药物组合物和施用
某些实施例涉及药物、预防和/或治疗组合物,所述药物、预防和/或治疗组合物包括药学上可接受的载体和Jag-1激动剂、Deltex-1激动剂或非经典Notch信号传导激动剂(和任选的另外的药剂)、其如本文所述的药学上可接受的盐或其组合(在本文中统称为“一种或多种毛细胞再生剂”或“一种或多种化合物”)。
在一些实施例中,本发明的药物组合物中的一种或多种化合物的浓度为如上所述的“调配物有效浓度”。
在一些实施例中,药物组合物包括的Jag-1激动剂的浓度为约10uM到1,000,000mM、约100uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1,000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,药物组合物包括是可溶性Jag-1肽的浓度为以下的Jag-1激动剂:约10uM到1,000,000mM、约100uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1,000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,药物组合物包括是HIF1-α激活剂的浓度为以下的Jag-1激动剂:约10uM到1,000,000mM、约100uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1,000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,药物组合物包括是1,4-DPCA的浓度为以下的HIF1-α激活剂:约10uM到1,000,000mM、约100uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1,000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,药物组合物包括是FG-2216的浓度为以下的HIF1-α激活剂:约10uM到1,000,000mM、约100uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1,000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,药物组合物包括是达普司他的浓度为以下的HIF1-α激活剂:约10uM到1,000,000mM、约100uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1,000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,药物组合物包括的PI3K激动剂的浓度为约10uM到1,000,000mM、约100uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1,000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,药物组合物包括是FOXO抑制剂的浓度为以下的PI3K激动剂:约10uM到1,000,000mM、约100uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1,000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,药物组合物包括是AS1842856的浓度为以下的FOXO抑制剂:约10uM到1,000,000mM、约100uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1,000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1000mM到10,000mM、或约10,000mM到100,000mM。优选地,AS1842856“调配物有效浓度”为约0.1mM、0.2mM、0.3mM、0.4mM、0.5mM、0.6mM、0.7mM、0.8mM、0.9mM、或1mM。
在其它实施例中,药物组合物包括的Deltex-1激动剂的浓度为约10uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
在其它实施例中,药物组合物包括的Jag-1增效剂的浓度为约10uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
在其它实施例中,药物组合物包括是PI3K增效剂的浓度为以下的Jag-1增效剂:约10uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,药物组合物包括是PTEN抑制剂的浓度为以下的PI3K增效剂:约10uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,药物组合物包括是SF1670的浓度为以下的PTEN抑制剂:约10uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,药物组合物包括是VO-Ohpic的浓度为以下的PTEN抑制剂:约10uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1,000mM到10,000mM、或约10,000mM到100,000mM。优选地,药物组合物中的VO-Ohpic浓度为约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM。
在一些实施例中,药物组合物包括是bpV(phen)的浓度为以下的PTEN抑制剂:约10uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1,000mM到10,000mM、或约10,000mM到100,000mM。优选地,药物组合物中的bpV(phen)浓度为约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM。
在一些实施例中,药物组合物包括是bpV(pic)的浓度为以下的PTEN抑制剂:约10uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1,000mM到10,000mM、或约10,000mM到100,000mM。优选地,药物组合物中的bpV(pic)浓度为约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM。
在一些实施例中,药物组合物包括是AZD1080的浓度为以下的GSK3抑制剂:约0.001mM到10,000mM、约0.01mM到1,000mM、约0.1mM到100mM、约0.001mM到0.01mM、约0.01mM到0.1mM、约0.1mM到1mM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、或约1,000mM到10,000mM。优选地,AZD1080的浓度为约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM。
在一些实施例中,药物组合物包括是LY2090314的浓度为以下的GSK3抑制剂:约0.001μM到10mM、约0.01μM到1mM、约0.1μM到100uM、约0.001μM到0.01μM、约0.01μM到0.1μM、约0.1μM到1μM、约1μM到10μM、约10μM到100μM、约100μM到1mM、或约1mM到10mM。优选地,LY2090314的浓度为约1μM、5μM、10μM、15μM、20μM、或40μM。
在一些实施例中,药物组合物包括是经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮的浓度为以下的GSK3抑制剂:约0.001μM到10mM、约0.01μM到1mM、约0.1μM到100uM、约0.001μM到0.01μM、约0.01μM到0.1μM、约0.1μM到1μM、约1μM到10μM、约10μM到100μM、约100μM到1mM、或约1mM到10mM。优选地,经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂卓并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮的浓度为约1μM、5μM、10μM、15μM、20μM、50μM、100μM、250μM、或500μM。
在一些实施例中,药物组合物包括是GSK3抑制剂XXII的浓度为以下的GSK3抑制剂:约0.1μM到1,000mM、约1μM到100mM、约10μM到10mM、约0.1μM到1μM、约1μM到10μM、约10μM到100μM、约100μM到1mM、约1mM到10mM、约10mM到100mM、或约100mM到1000mM。优选地,GSK3抑制剂XXII的浓度为约0.1mM、0.2mM、0.3mM、0.4mM、0.5mM、0.6mM、0.7mM、0.8mM、0.9mM、或1.0mM。
在一些实施例中,药物组合物包括是CHIR99021的浓度为以下的GSK3抑制剂:约0.001mM到10,000mM、约0.01mM到1,000mM、约0.1mM到100mM、约0.001mM到0.01mM、约0.01mM到0.1mM、约0.1mM到1mM、约1mM到10mM、约10mM到100mM、约100mM到1,000mM、或约1,000mM到10,000mM。优选地,CHIR99021的浓度为约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM。
在一些实施例中,药物组合物包括是HDAC抑制剂的浓度为以下的表观遗传药剂:约10uM到1,000,000mM、约1000uM到100,000mM、约10,000uM到10,000mM、约1000uM到10,000uM、约10,000uM到100,000uM、约100,000uM到1,000,000uM、约1,000mM到10,000mM、或约10,000mM到100,000mM。
在一些实施例中,药物组合物包括是VPA的浓度为约100mM到4,000mM的HDAC抑制剂。
在一些实施例中,药物组合物包括约50mg、约100mg、约125mg、约250mg、约500mg、1000mg、2000mg、3000mg、4000mg或约5000mg的单位剂量的VPA。
在一些实施例中,药物组合物包括约50mg、约100mg、约125mg、约250mg、约500mg、1000mg、2000mg、3000mg、4000mg或约5000mg的单位剂量的VPA的口服剂型。
在一些实施例中,药物组合物包括是2-己基-4-戊炔酸的浓度为约100mM到4,000mM的HDAC抑制剂。
在一些实施例中,药物组合物包括50mg、约100mg、约125mg、约250mg、约500mg、1000mg、2000mg、3000mg、4000mg或约5000mg的单位剂量的2-己基-4-戊炔酸。
在一些实施例中,药物组合物包括约50mg、约100mg、约125mg、约250mg、约500mg、1000mg、2000mg、3000mg、4000mg或约5000mg的单位剂量的2-己基-4-戊炔酸的口服剂型。
在一些实施例中,药物组合物包括的苯丁酸钠的浓度为约100mM到4,000mM。
在一些实施例中,药物组合物包括约50mg、约100mg、约125mg、约250mg、约500mg、1000mg、2000mg、3000mg、4000mg或约5000mg的单位剂量的苯丁酸钠。
在一些实施例中,药物组合物包括约50mg、约100mg、约125mg、约250mg、约500mg、1000mg、2000mg、3000mg、4000mg或约5000mg的单位剂量的苯丁酸钠的口服剂型。
在一些实施例中,药物组合物包括是Vo-Ohpic的Jag-1增效剂和是CHIR99021的Jag-1激动剂。Vo-的浓度为1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM或10mM,并且CHIR99021的浓度为约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM或10mM。
在一些实施例中,药物组合物包括是Vo-Ohpic的Jag-1增效剂和是AZD1080的Jag-1激动剂。Vo-Ohpic的浓度约为1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM或10mM,并且AZD1080的浓度为约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM或10mM。
在一些实施例中,药物组合物包括是Vo-Ohpic的Jag-1增效剂和是LY209031的Jag-1激动剂,Vo-Ohpic的浓度约为1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM或10mM,并且LY2090314的浓度为约1μM、5μM、10μM、15μM、20μM或40nM。
在一些实施例中,药物组合物包括是Vo-Ohpic的Jag-1增效剂和是GSK3抑制剂XXII的Jag-1激动剂。Vo-Ohpic的浓度为约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM或10mM或约30mM,并且GSK3抑制剂XXII的浓度为约0.1mM、0.2mM、0.3mM、0.4mM、0.5mM、0.6mM、0.7mM、0.8mM、0.9mM或1.0mM。
可替代地,将Vo-Ohpic以以下的浓度施用于受试者,例如施用于中耳:约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、或10mM、或约30mM,并且将GSK3抑制剂XXII以足以在内耳中的外淋巴液中达到以下浓度的量施用:约0.1mM、0.2mM、0.3mM、0.4mM、0.5mM、0.6mM、0.7mM、0.8mM、0.9mM或1.0mM。
在一些实施例中,药物组合物包括是AS1843856的Jag-1激动剂和是VPA的另外的药剂。AS1843856的浓度为约0.1mM、0.2mM、0.3mM、0.4mM、0.5mM、0.6mM、0.7mM、0.8mM、0.9mM或1mM,并且VPA的浓度为约100mM到4,000mM。
在一些实施例中,药物组合物包括是AS1843856的Jag-1激动剂和是Vo-Ohpic的Jag-1增效剂。AS1843856的浓度为约0.1mM、0.2mM、0.3mM、0.4mM、0.5mM、0.6mM、0.7mM、0.8mM、0.9mM或1mM,并且Vo-的浓度为约1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM或10mM。
在一些实施例中,如上所述,组合物适于施用于内耳和/或中耳,例如局部施用于圆窗膜或鼓膜内或经鼓膜施用于例如耳蜗组织。可替代地,如上所述,组合物适于全身(例如口服或肠胃外)施用。
当局部施用于例如内耳和/或中耳时,一种或多种化合物以约25μl到500μl或约50μl到200μl的单位剂量施用。
短语“药学上可接受的”在本文中用于指在正确医学判断的范围内适合于与人和动物的组织接触使用而不会产生过多毒性、刺激、过敏性应答或其它问题或并发症的、与合理的益处/风险比相称的那些化合物、材料、组合物和/或剂型。
如本文所使用的,“药学上可接受的载体、稀释剂或赋形剂”包含但不限于任何已经被美国食品和药品管理局批准为可用于人类或家畜的佐剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、增味剂、表面活性剂、润湿剂、分散剂、悬浮剂、稳定剂、等渗剂、溶剂、表面活性剂或乳化剂。示例性药学上可接受的载剂包含但不限于:糖,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和马铃薯淀粉;纤维素和它的衍生物,如羧甲基纤维素钠、乙基纤维素和乙酸纤维素;黄芪胶;麦芽;明胶;滑石粉;可可脂、蜡、动植物油脂、石蜡、有机硅、膨润土、硅酸、氧化锌;油,如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油、以及大豆油;二醇,如丙二醇;多元醇,如甘油、山梨醇、甘露醇、以及聚乙二醇;酯,如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,如氢氧化镁和氢氧化铝;海藻酸;无热原水;等渗盐水;林格氏溶液(Ringer's solution);乙醇;磷酸盐缓冲溶液;以及在药物调配物中采用的任何其它相容性物质。
某些组合物包括至少一种生物相容性基质。如本文所使用的,术语“生物相容性基质”是可接受的用于向人施用以释放治疗剂的聚合物载体。在一些情况下,生物相容性基质可以是生物相容性凝胶、泡沫、纤维、膜或垫。在一些实施例中,生物相容性基质衍生自丝。
在一些实施例中,所述生物相容性基质包括透明质酸、透明质酸盐、卵磷脂凝胶、普朗尼克、聚(乙二醇)、聚合物、泊洛沙姆、壳聚糖、木葡聚糖、胶原蛋白、纤维蛋白、聚酯、聚(丙交酯)、聚(乙交酯)、聚(乳酸-共-乙醇酸)(PLGA)、乙酸异丁酸蔗糖酯、单油酸甘油酯、聚酸酐、聚己内酯蔗糖、单油酸甘油酯或其组合。
适用于调配本公开的生物活性组合物的示例性聚合物包含但不限于聚酰胺、聚碳酸酯、聚亚烷基(聚乙二醇(PEG))、丙烯酸和甲基丙烯酸酯的聚合物、聚乙烯聚合物、聚乙交酯、聚硅氧烷、聚氨酯及其共聚物、纤维素、聚丙烯、聚乙烯、聚苯乙烯、乳酸和乙醇酸的聚合物、聚酸酐、聚(原酸)酯、聚(丁酸)、聚(戊酸)、聚(丙交酯-共-己内酯)、多糖、蛋白质、聚透明质酸、聚氰基丙烯酸酯、及其共混物、混合物或共聚物。
在一些实施例中,相对于组合物,聚合物的浓度介于约5wt%与约25wt%之间,或相对于所述组合物为约5wt%、6wt%、7wt%、8wt%、9wt%、10wt%、11wt%、12wt%、13wt%、14wt%、15wt%、16wt%、17wt%、18wt%、19wt%、20wt%、21wt%、22wt%、23wt%、24wt%或25wt%。在某些实施例中,相对于组合物,聚合物的浓度介于约10wt%与约23wt%之间。在一些实施例中,相对于组合物,聚合物的浓度介于约15wt%与约20wt%之间。在特定实施例中,相对于组合物,聚合物的浓度为约17wt%。
在一个实施例中,将本公开的生物活性组合物调配成ABA型或BAB型三嵌段共聚物或其混合物,其中A嵌段是相对疏水性的并且包括可生物降解的聚酯或聚(原酸酯),并且B嵌段是相对亲水性的并且包括聚乙二醇(PEG)。可生物降解的疏水性A聚合物嵌段包括聚酯或聚(原酸酯),其中聚酯由选自由以下组成的组的单体合成:D,L-丙交酯,D-丙交酯、L-丙交酯、D,L-乳酸、D-乳酸、L-乳酸、乙交酯、乙醇酸、ε-己内酯、ε-羟基己酸、γ-丁内酯、γ-羟基丁酸、δ-戊内酯、δ-羟基戊酸、羟基丁酸、苹果酸和其共聚物。
在一些实施例中,相对于组合物,共聚物的浓度介于约5wt%与约25wt%之间,或相对于所述组合物为约5wt%、6wt%、7wt%、8wt%、9wt%、10wt%、11wt%、12wt%、13wt%、14wt%、15wt%、16wt%、17wt%、18wt%、19wt%、20wt%、21wt%、22wt%、23wt%、24wt%或25wt%。在某些实施例中,相对于组合物,共聚物的浓度介于约10wt%与约23wt%之间。在一些实施例中,相对于组合物,共聚物的浓度介于约15wt%与约20wt%之间。在特定实施例中,相对于组合物,共聚物的浓度为约17wt%。
某些组合物包含至少一种泊洛沙姆。泊洛沙姆是三嵌段共聚物,其由被配置为聚(氧乙烯)-聚(氧丙烯)-聚(氧乙烯)的三嵌段的(即,亲水性聚(氧乙烯)嵌段和疏水性聚(氧丙烯)嵌段)形成。泊洛沙姆是一类具有环氧丙烷嵌段疏水基和环氧乙烷亲水基的嵌段共聚物表面活性剂。泊洛沙姆是可商购的(例如,
示例性泊洛沙姆包含泊洛沙姆124、泊洛沙姆188、泊洛沙姆237、泊洛沙姆338和泊洛沙姆407。在一些实施例中,泊洛沙姆包括泊洛沙姆124、泊洛沙姆188、泊洛沙姆237、泊洛沙姆338或泊洛沙姆407中的两种或更多种的混合物。在一些实施例中,两种或更多种泊洛沙姆的混合物包括泊洛沙姆407和泊洛沙姆124。在某些实施例中,泊洛沙姆包括泊洛沙姆188和泊洛沙姆407或其混合物中的至少一种。在一些实施例中,泊洛沙姆是泊洛沙姆407。
在一些实施例中,相对于组合物,泊咯沙姆的浓度介于约5wt%与约25wt%之间,或相对于所述组合物为约5wt%、6wt%、7wt%、8wt%、9wt%、10wt%、11wt%、12wt%、13wt%、14wt%、15wt%、16wt%、17wt%、18wt%、19wt%、20wt%、21wt%、22wt%、23wt%、24wt%或25wt%。在某些实施例中,相对于组合物,泊洛沙姆的浓度介于约10wt%与约23wt%之间。在一些实施例中,相对于组合物,泊洛沙姆的浓度介于约15wt%与约20wt%之间。在特定实施例中,相对于组合物,泊洛沙姆的浓度为约17wt%。
在一些实施例中,润湿剂、乳化剂和润滑剂(如十二烷基硫酸钠和硬脂酸镁)以及着色剂、脱模剂、包衣剂、甜味剂、调味剂和香味剂、防腐剂和抗氧化剂也可以存在于组合物中。
某些组合物包括至少一种抗氧化剂。药学上可接受的抗氧化剂的实例包含:(1)水溶性抗氧化剂,如抗坏血酸、盐酸半胱氨酸、硫酸氢钠、焦亚硫酸钠、亚硫酸钠等;(2)油溶性抗氧化剂,如抗坏血酸棕榈酸酯、丁基羟基茴香醚(BHA)、丁基羟基甲苯(BHT)、卵磷脂、没食子酸丙酯、α-生育酚等;以及(3)金属螯合剂,如柠檬酸、乙二胺四乙酸(EDTA)、山梨醇、酒石酸、磷酸等。
在具体实施例中,组合物在约体温下的粘度与组合物在室温下的粘度明显不同(例如,较小、较大)。
在一些实施例中,组合物包括缓冲剂。例如,在某些情况下,缓冲液是生理盐水或磷酸盐缓冲盐水(PBS)。
在一些实施例中,组合物处于或接近生理pH。例如,在一些实施例中,组合物的pH介于约6与约8之间,包含介于例如约6到约6.5到约7到约7.5到约8之间所有整数、小数和范围。在特定实施例中,组合物的pH为约7.4(±0.2)。
在一些方面,本公开药物组合物被冻干。其包括一种或多种本文所述的药剂和胶凝剂。
在一些实施例中,冻干的药物组合物呈冻干饼的形式。
在一些实施例中,与包括一种或多种溶剂的相当药物组合物相比,冻干的药物组合物对氧气和/或光具有更高的稳定性。
在一些实施例中,本公开提供了冻干的药物组合物的重构溶液。
如本文所使用的,术语“胶凝剂”是指在经受胶凝条件(例如,使胶凝剂经历从低粘度到高粘度或相反的变化或转变的特定温度或温度范围、离子存在、pH值或范围或胶凝剂浓度)后能够赋予本公开的药物组合物或重构溶液凝胶状或增稠品质的药剂。在一些实施例中,胶凝条件是特定温度(例如,约26℃、约27℃、约28℃、约29℃、约30℃、约31℃、约32℃、约33℃、约34℃、约35℃、约36℃、约37℃、约38℃、约39℃或约40℃)。在一些实施例中,胶凝条件是特定温度范围(例如,约26℃或更高、约27℃或更高、约28℃或更高、约29℃或更高、约30℃或更高、约31℃或更高、约32℃或更高、约33℃或更高、约34℃或更高、约35℃或更高、约36℃或更高、约37℃或更高、约38℃或更高、约39℃或更高、或约40℃或更高)。在一些实施例中,胶凝剂向本公开的药物组合物或重构溶液提供介于约1,000与10,000,000厘泊之间、介于约5,000与5,000,000厘泊之间或介于约100,000与4,000,000厘泊之间的粘度。在一些实施例中,胶凝剂向本公开的药物组合物或重构溶液提供介于约50,000与2,000,000厘泊之间的粘度。
在一些实施例中,在胶凝之前(例如,在环境温度下(例如,在介于约20℃与约26℃之间)),胶凝剂向本公开的药物组合物或重构溶液提供的粘度小于约100,000厘泊、小于约50,000厘泊、20,000厘泊、小于约10,000厘泊、小于约8,000厘泊、小于约7,000厘泊、小于约6,000厘泊、小于约5,000厘泊、小于约4,000厘泊、小于约3,000厘泊、小于约2,000厘泊或小于约1,000厘泊。
在一些实施例中,在胶凝时(例如,在人体温度下(例如,介于约35℃与约39℃之间、介于约36℃与约38℃之间或在约37℃下)),胶凝剂提供的粘度大于约1,000厘泊、大于约5,000厘泊、大于约10,000厘泊、大于约20,000厘泊、大于约50,000厘泊、大于约60,000厘泊、大于约70,000厘泊、大于80,000厘泊、大于约90,000厘泊、或大于约100,000厘泊。
在一些实施例中,与在胶凝之前(例如,在环境温度下(例如、在约25℃下))的药物组合物或重构溶液的粘度相比,在胶凝时(例如,在人体温度下(例如,介于约36℃与约39℃之间,或在约37℃下)),本公开的药物组合物或重构溶液的粘度(以厘泊为单位测量)为约2倍或更大、约5倍或更大、约10倍或更大、约20倍或更大、约50倍或更大、约60倍或更大、约7倍或更大、约80倍或更大、约90倍或更大、约100倍或更大。
应当理解,本公开的药物组合物或重构溶液的胶凝条件(例如,胶凝温度)可以通过本领域中的多种技术来测量。在一些实施例中,使用具有平行板几何形状(例如,板距离为0.5mm到1.0mm)的可商购的流变仪来确定胶凝温度。在一些实施例中,以恒定速率(例如2到3℃/min)和0.74Hz到1Hz的变形频率在连续温度范围(例如15℃到40℃)内进行分析。胶凝温度是在剪切存储模量(G')和剪切损耗模量(G”)相等的温度下确定的。
在一些实施例中,胶凝剂包括阿拉伯胶、藻酸、膨润土、聚(丙烯酸)(卡波姆)、羧甲基纤维素、乙基纤维素、明胶、羟乙基纤维素、羟丙基纤维素、硅酸铝镁(Veegum)、甲基纤维素、泊洛沙姆、透明质酸钠、聚乳酸乙醇酸钠、壳聚糖、聚乙烯醇、海藻酸钠、黄原胶或其任何组合。在一些实施例中,胶凝剂包括泊洛沙姆。
在一些实施例中,胶凝剂是热可逆胶凝剂。
如本文所使用的,术语“热可逆”是指通过施加热量可逆的能力。“热可逆胶凝剂”是指在施加热量时能够可逆地赋予本公开的药物组合物或重构溶液凝胶状或增稠品质的药剂。
在一些实施例中,热可逆胶凝剂包括泊洛沙姆。
可以理解的是,胶凝剂(例如,热可逆胶凝剂)也可以是本公开的药物组合物或重构溶液的膨胀剂。在一些实施例中,泊洛沙姆(例如泊洛沙姆407)是本公开的药物组合物或重构溶液的胶凝剂和/或膨胀剂。泊洛沙姆是可商购且药学上可接受的聚环氧乙烷-聚环氧丙烷-聚环氧乙烷的三嵌段共聚物的一般类别,其在低温(例如,室温或更低的温度)下表现出相对低的粘度,但是在升高的温度(例如,约37℃的体温)下表现出很高的粘度,从而使含有此类热可逆胶凝剂的组合物有效地固化在适当位置。其它热可逆胶凝剂如聚环氧乙烷-聚乳酸-聚环氧乙烷聚合物也适用于本发明的各种实施例。
在一些实施例中,泊洛沙姆(例如泊洛沙姆407)是本公开的药物组合物或重构溶液的胶凝剂和膨胀剂。在一些实施例中,在药物组合物(例如,冻干的药物组合物)中泊洛沙姆(例如,泊洛沙姆407)的存在减轻了对任何其它赋形剂(例如,另外的膨胀剂)的需求。此类减轻可以为药物组合物提供一个或多个优点(例如,增强的稳定性和/或减少的重构时间)。
在一些实施例中,泊洛沙姆选自由以下组成的组:泊洛沙姆101、泊洛沙姆105、泊洛沙姆108、泊洛沙姆122、泊洛沙姆123、泊洛沙姆124、泊洛沙姆181、泊洛沙姆182、泊洛沙姆183、泊洛沙姆184、泊洛沙姆185、泊洛沙姆188、泊洛沙姆212、泊洛沙姆215、泊洛沙姆217、泊洛沙姆231、泊洛沙姆234、泊洛沙姆235、泊洛沙姆237、泊洛沙姆238、泊洛沙姆282、泊洛沙姆284、泊洛沙姆288、泊洛沙姆331、泊洛沙姆333、泊洛沙姆334、泊洛沙姆335、泊洛沙姆338、泊洛沙姆401、泊洛沙姆402、泊洛沙姆403和泊洛沙姆407。
在一些实施例中,泊洛沙姆是泊洛沙姆188或泊洛沙姆407。
在一些实施例中,泊洛沙姆是泊洛沙姆407。
在一些实施例中,泊洛沙姆是纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)。
在一些实施例中,纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的平均分子量为约9kDa或更大、约9.2kDa或更大、约9.4kDa或更大、约9.6kDa或更大、约9.8kDa或更大、约10kDa或更大、约10.2kDa或更大、约10.4kDa或更大、约10.6kDa或更大、约10.8kDa或更大、约11kDa或更大、约11.2kDa或更大、约11.4kDa或更大、约11.6kDa或更大、约11.8kDa或更大、约12kDa或更大、或约12.1kDa或更大。
在一些实施例中,与未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)相比,纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)具有降低水平的分子量低于9kDa的聚合物链。
在一些实施例中,未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)相比,纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)具有约99%或更少、约98%或更少、约95%或更少、约90%或更少、约80%或更少、约70%或更少、约60%或更少、约50%或更少、约40%或更少、约30%或更少、约20%或更少或约10%或更少的分子量低于9kDa的聚合物链。
在一些实施例中,通过液-液萃取或尺寸排阻色谱法制备纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)。
在一些实施例中,在纯化期间从泊洛沙姆(例如泊洛沙姆407)中去除约10%或更多、约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约70%或更多、约80%或更多、约90%或更多、约95%或更多、约98%或更多、或约99%或更多的分子量低于9kDa的一种或多种杂质。
在一些实施例中,在纯化期间从泊洛沙姆(例如泊洛沙姆407)中去除约10%或更多、约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约70%或更多、约80%或更多、约90%或更多、约95%或更多、约98%或更多、或约99%或更多的一种或多种二嵌段共聚物(例如,PEO-PPO)、单嵌段聚合物(例如,PEO)和/或醛。
在一些实施例中,本公开的药物组合物、药物组合物、冻干的药物组合物或重构溶液包括缓冲剂。缓冲剂将重构溶液的pH控制在约4到约13、约5到约12、约6到约11、约6.5到约10.5或约7到约10的范围内。
缓冲剂的实例包含但不限于柠檬酸盐缓冲剂、乙酸盐缓冲剂、磷酸盐缓冲剂、氯化铵、碳酸钙、氯化钙、柠檬酸钙、葡乳醛酸钙、葡庚糖酸钙、葡萄糖酸钙、d-葡萄糖酸、甘油磷酸钙、乳酸钙、乳糖醛酸钙、丙酸、戊酮酸钙、戊酸、磷酸氢钙、磷酸、磷酸三钙、磷酸氢氧化钙、乙酸钾、氯化钾、葡萄糖酸钾、钾混合物、磷酸氢二钾、磷酸二氢钾、磷酸钾混合物、乙酸钠、碳酸氢钠、氯化钠、柠檬酸钠、乳酸钠、磷酸氢二钠、磷酸二氢钠、磷酸钠混合物、氨丁三醇、氨基磺酸盐缓冲液(例如HEPES)、氢氧化镁、氢氧化铝、海藻酸、无热原水、等渗盐水、林格氏溶液、乙醇和/或其组合。润滑剂可以选自由以下组成的非限制性组:硬脂酸镁、硬脂酸钙、硬脂酸、二氧化硅、滑石、麦芽、山嵛酸甘油酯、氢化植物油、聚乙二醇、苯甲酸钠、乙酸钠、氯化钠、亮氨酸、月桂基硫酸镁、月桂基硫酸钠和其组合。
在一些实施例中,缓冲剂包括磷酸盐缓冲盐水、TRIS、三乙酸盐、三HCl-65、柠檬酸钠、组氨酸、精氨酸、磷酸钠、三碱65、羟乙基淀粉或其任何组合。
在一些实施例中,本公开的药物组合物、药物组合物、冻干的药物组合物或重构溶液包括膨胀剂。
在一些实施例中,膨胀剂包括泊洛沙姆(例如泊洛沙姆407)、甘露醇、蔗糖、麦芽糖、海藻糖、右旋糖、山梨糖醇、葡萄糖、棉子糖、甘氨酸、组氨酸、聚乙烯吡咯烷酮(例如,聚乙烯吡咯烷酮K12或聚乙烯吡咯烷酮K17)、乳糖或其任何组合。
在一些实施例中,本公开的药物组合物、药物组合物、冻干的药物组合物或重构溶液包括稳定剂。
在一些实施例中,稳定剂包括冷冻保护剂。在一些实施例中,冷冻保护剂是多元醇(例如,二醇或三元醇,如丙二醇(即1,2-丙二醇)、1,3-丙二醇、甘油、(+/-)-2-甲基-2,4-戊二醇、1,6-己二醇、1,2-丁二醇、2,3-丁二醇、乙二醇或二甘醇)、非去污剂磺基甜菜碱(例如,NDSB-201(3-(1-吡啶)-1-丙烷磺酸盐)、渗透液(例如,L-脯氨酸或三甲胺N-氧化物二水合物)、聚合物(例如,聚乙二醇200(PEG 200)、PEG 400、PEG 600、PEG1000、PEG 3350、PEG4000、PEG 8000、PEG 10000、PEG 20000、聚乙二醇单甲醚550(mPEG 550)、mPEG 600、mPEG2000、mPEG 3350、mPEG 4000、mPEG 5000、聚乙烯吡咯烷酮(例如,聚乙烯吡咯烷酮K15)、季戊四醇丙氧基化物或聚丙二醇P 400)、有机溶剂(例如,二甲亚砜(DMSO)或乙醇)、糖(例如D-(+)-蔗糖、D-山梨糖醇、海藻糖、D-(+)-麦芽糖一水合物、中赤藓糖醇、木糖醇、肌醇、D-(+)-棉子糖五水合物、D-(+)-海藻糖二水合物或D-(+)-葡萄糖一水合物)或盐(例如,乙酸锂、氯化锂、甲酸锂、硝酸锂、硫酸锂、乙酸镁、氯化钠、甲酸钠、丙二酸钠、硝酸钠、硫酸钠或其任何水合物)或其任何组合。
在一些实施例中,稳定剂包括盐。在一些实施例中,盐选自由以下组成的组:锂盐(例如,乙酸锂、氯化锂、甲酸锂、硝酸锂、硫酸锂或其任何水合物)、镁盐(例如,乙酸镁或其水合物)和钠盐(例如,氯化钠、甲酸钠、丙二酸钠、硝酸钠、硫酸钠或其任何水合物)。又例如,调配物包括一种或多种钠盐。又例如,调配物包括氯化钠。
在一些实施例中,稳定剂包括表面活性剂。在一些实施例中,表面活性剂包括一种或多种阴离子表面活性剂(例如,2-丙烯酰胺基-2-甲基丙烷磺酸、月桂基硫酸铵、全氟壬酸铵、多库酯、椰油酰基二乙酸二钠、月桂基硫酸镁、全氟丁烷磺酸、全氟壬酸、全氟辛烷磺酸、全氟辛酸、十二烷基硫酸钾、烷基硫酸钠、十二烷基硫酸钠、十二烷基苯磺酸钠、月桂酸钠、月桂基硫酸钠、十二烷基肌氨酸钠、肉豆蔻醇聚醚硫酸酯钠、壬酰氧基苯磺酸钠、对乙酰氨基磺酸钠、硬脂酸钠或硫脂)、一种或多种阳离子表面活性剂(例如,山嵛基三甲基氯化铵、氯化苯扎氯铵、苄索氯铵、溴化十二烷基溴化铵、布洛尼道克斯(bronidox)、碳萘烷溴化十二烷(carbethopendecinium bromide)、西他氯铵、西曲溴铵、西曲氯铵、十六烷基吡啶二氯鎓、二癸基二甲基二甲基十八烷二氯铵、氯化二癸基二甲基辛二铵、氯化二苄基二甲基辛二铵氯化铵、多米芬溴化物、月桂基甲基格洛斯-10羟丙基二氯化铵、辛烯二盐酸盐、奥拉氟醚、正油基-1,3-丙二胺、箱鲀毒素(pahutoxin)、硬脂基氯化铵、氢氧化四甲基铵或通佐溴胺)、一种或多种两性离子表面活性剂(例如,椰油酰胺基丙基甜菜碱、椰油酰胺基丙基羟基磺基甜菜碱、二棕榈酰磷脂酰胆碱、蛋卵磷脂、羟基磺基甜菜碱、卵磷脂、肉豆蔻胺氧化物、肽类杀菌剂或月桂两性乙酸钠)和/或一种或多种非离子表面活性剂(例如,烷基聚糖苷、西土马哥(cetomacrogol)1000、鲸蜡硬脂醇、鲸蜡醇、椰子酰胺、椰油酰胺、癸基葡糖苷、癸基聚葡萄糖、单硬脂酸甘油酯、igepal ca-630、isoceteth-20、月桂基葡糖苷、麦芽糖苷、单月桂酸酯、霉菌枯草杆菌素、窄范围乙氧基化物、nonidet p-40、壬苯醇醚-9、壬苯醇醚、np-40、八乙二醇单十二烷基醚、正辛基β-d-硫代吡喃葡萄糖苷、辛基葡萄糖苷、油醇、peg-10葵花子甘油酯、五乙基乙二醇单十二烷基醚、聚多卡醇、α-生育酚聚乙二醇琥珀酸酯(TPGS)、泊洛沙姆(例如泊洛沙姆407)、聚乙氧基牛脂胺、聚甘油聚蓖麻油酸酯、聚山梨酸酯(例如聚山梨酸酯20、聚山梨酸酯40、聚山梨酸酯60或聚山梨酸酯80)、脱水山梨糖醇、脱水山梨糖醇单月桂酸酯、脱水山梨糖醇单硬脂酸酯、脱水山梨糖醇三硬脂酸酯、硬脂醇、表面活性素、triton x-100)。
在一些实施例中,本公开的药物组合物、药物组合物、冻干的药物组合物或重构溶液包括张度调节剂。
在一些实施例中,张度调节剂包括NaCl、右旋糖、右旋糖酐、聚蔗糖、明胶、甘露醇、蔗糖、甘氨酸、甘油或其任何组合。
在一些实施例中,本公开的药物组合物或重构溶液包括舒缓剂。在一些实施例中,舒缓剂包括利多卡因(lidocaine)。
除了这些组分之外,本公开的药物组合物、药物组合物、冻干的药物组合物或重构溶液包含在药物组合物中有用的任何物质。
在一些实施例中,本公开的药物组合物、药物组合物、冻干的药物组合物或重构溶液包含一种或多种药学上可接受的赋形剂或辅助成分,如但不限于一种或多种溶剂、分散介质、稀释剂、分散助剂、助悬剂、制粒助剂、崩解剂、填料、助流剂、液体媒剂、粘合剂、表面活性剂、等渗剂、增稠剂或乳化剂、缓冲剂、润滑剂、油、防腐剂和其它种类。也可以包含赋形剂,如蜡、黄油、着色剂、涂覆剂、调味剂和加香剂。药学上可接受的赋形剂在本领域中是众所周知的(例如,参见《雷明顿的科学与实践药学(Remington's The Science andPractice of Pharmacy)》,第21版A.R.Gennaro;利平科特·威廉斯和威尔金斯出版公司(Lippincott,Williams&Wilkins),马里兰州巴尔的摩(Baltimore,MD),2006)。
稀释剂的实例可以包含但不限于碳酸钙、碳酸钠、磷酸钙、磷酸二钙、硫酸钙、磷酸氢钙、磷酸钠、乳糖、蔗糖、纤维素、微晶纤维素、高岭土、甘露醇、山梨醇、肌醇、氯化钠、干淀粉、玉米淀粉、糖粉和/或其组合。制粒剂和分散剂可以选自由以下组成的非限制性列表:土豆淀粉、玉米淀粉、木薯淀粉、淀粉羟乙酸钠、粘土、海藻酸、瓜尔胶、柑桔渣、琼脂、膨润土、纤维素和木材产物、天然海绵、阳离子交换树脂、碳酸钙、硅酸盐、碳酸钠、交联聚(乙烯基–吡咯烷酮)(交聚维酮)、羧甲基淀粉钠(淀粉羟乙酸钠)、羧甲基纤维素、交联羧甲基纤维素钠(交联羧甲纤维素)、甲基纤维素、预胶凝淀粉(淀粉1500)、微晶淀粉、水不溶性淀粉、羧甲基纤维素钙、硅酸镁铝(威格姆(
表面活性剂和/或乳化剂可以包含但不限于天然乳化剂(例如,阿拉伯胶、琼脂、海藻酸、海藻酸钠、黄蓍胶、角叉菜胶(chondrux)、胆固醇、黄原胶、果胶、明胶、蛋黄、酪蛋白、羊毛脂、胆固醇、蜡和卵磷脂)、胶质粘土(例如,膨润土[硅酸铝]和
粘合剂可以是淀粉(例如,玉米淀粉和淀粉糊);明胶;糖(例如,蔗糖、葡萄糖、右旋糖、糊精、糖蜜、乳糖、乳糖醇、甘露糖醇);天然和合成树胶(例如,阿拉伯胶、海藻酸钠、爱尔兰苔藓提取物、潘瓦尔胶、加蒂胶、伊萨波尔豆壳的粘液、羧甲基纤维素、甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、微晶纤维素、醋酸纤维素、聚(乙烯基吡咯烷酮)、硅酸铝镁(
防腐剂的实例可以包含但不限于抗氧化剂、螯合剂、抗微生物防腐剂、抗真菌防腐剂、醇防腐剂、酸性防腐剂和/或其它防腐剂。抗氧化剂的实例包含但不限于α生育酚、抗坏血酸、抗坏血酸棕榈酸酯、丁基化羟基苯甲醚、丁基化羟基甲苯、单硫代甘油、焦亚硫酸钾、丙酸、没食子酸丙酯、抗坏血酸钠、亚硫酸氢钠、焦亚硫酸钠以及亚硫酸钠。螯合剂的实例包含乙二胺四乙酸(EDTA)、柠檬酸一水合物、依地酸二钠、依地酸二钾、依地酸、富马酸、苹果酸、磷酸、依地酸钠、酒石酸和/或依地酸三钠。抗微生物防腐剂的实例包含但不限于苯扎氯铵、苄索氯铵、苯甲醇、溴硝丙二醇、溴化十六烷基三甲铵、氯化十六烷基吡啶、氯己定、氯丁醇、氯甲酚、氯二甲酚、甲酚、乙醇、甘油、海克替啶(hexetidine)、咪脲、苯酚、苯氧乙醇、苯乙醇、硝酸苯汞、丙二醇和/或硫柳汞。抗真菌防腐剂的实例包含但不限于对羟基苯甲酸丁酯、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、苯甲酸、羟基苯甲酸、苯甲酸钾、山梨酸钾、苯甲酸钠、丙酸钠和山梨酸。醇防腐剂的实例包含但不限于乙醇、聚乙二醇、苯甲醇、苯酚、酚类化合物、双酚、氯丁醇、羟基苯甲酸酯和/或苯乙醇。酸性防腐剂的实例包含但不限于维生素A、维生素C、维生素E、β-胡萝卜素、柠檬酸、乙酸、脱氢抗坏血酸、抗坏血酸、山梨酸和/或植酸。其它防腐剂包含但不限于生育酚、乙酸生育酚、甲磺酸去氧肟酯、鲸蜡胺、丁基羟基茴香醚(BHA)、丁基羟基甲苯(BHT)、乙二胺、月桂基硫酸钠(SLS)、月桂基醚硫酸钠(SLES)、钠亚硫酸氢盐、焦亚硫酸钠、亚硫酸钾、焦亚硫酸钾、GLYDANT
油的实例包含但不限于巴旦杏油、杏仁油、鳄梨油、巴巴苏油、香柠檬油、黑加仑籽油、琉璃苣油、杜松油、甘菊油、芥菜油、葛缕子油、棕榈蜡油、蓖麻油、肉桂油、可可脂油、椰子油、鱼肝油、咖啡油、玉米油、棉籽油、鸸鹋油、桉树油、月见草油、鱼油、亚麻籽油、香叶醇油、葫芦油、葡萄籽油、榛子油、海索草油、肉豆蔻酸异丙酯油、西蒙德木油、夏威夷果油、杂薰衣草油、薰衣草油、柠檬油、山苍子油、澳洲坚果油、锦葵油、芒果籽油、白芒花籽油、水貂油、肉豆蔻油、橄榄油、橙子油、橙连鳍鲑油、棕榈油、棕仁油、桃仁油、花生油、罂粟籽油、南瓜籽油、油菜籽、米糠、迷迭香、红花、檀木、山茶花油、香草(savoury)油、沙棘油、芝麻油、牛油树脂油、硅油、大豆油、向日葵油、茶树油、蓟油、椿油、香根草油、胡桃油和麦胚芽油、以及硬脂酸丁酯、辛酸甘油三酯、癸酸甘油三酯、环甲硅油、癸二酸二乙酯、二甲硅油360、二甲硅油、肉豆蔻酸异丙酯、矿物油、辛基十二烷醇、油基铝酒精和/或硅油。
本文所述的化合物或组合物可以以适合于期望递送途径(例如,经鼓膜注射、经鼓膜和导管、耳蜗植入物和可注射的贮库)的任何方式调配。在一些情况下,组合物或调配物包含一种或多种生理上可接受的组分,包含其衍生物或前药、溶剂化物、立体异构体、外消旋体或互变异构体以及任何生理上可接受的载体、稀释剂和/或赋形剂。
如上所述,某些组合物适于并且某些方法采用施用于中耳或内耳,例如通过局部施用于圆窗膜。圆窗膜是内耳空间的生物屏障并且是局部治疗听力障碍的主要障碍。所施用的药物必须克服此膜才能到达内耳空间。可以将药物可操作地(例如,通过鼓膜注射)局部地放置在圆窗膜上,并且然后可以穿透圆窗膜。穿透圆窗的物质通常分布在外淋巴中,并且因此到达毛细胞和支持细胞。
药物组合物或调配物还可以含有膜渗透增强剂,其支持本文所述的药剂通过圆窗膜。因此,可以使用液体、凝胶或泡沫调配物。也可以口服施加活性成分或采用递送方法的组合。
某些组合物适于并且某些方法采用例如通过鼓膜内或经鼓膜施用而施用于中耳或内耳。药物向耳朵的鼓膜内(IT)递送越来越多地用于临床和研究目的。一些小组使用微导管和微芯以持续的方式使用药物,而大多数小组则以单次或重复IT注射的形式(最多2周的时间段内最多注射8次)来施加药物。
鼓室内施加的药物被认为主要通过穿过圆窗(RW)膜进入内耳的流体。计算表明,控制进入耳内的药物量以及沿耳的长度分布的药物的主要因素是药物保留在中耳空间的持续时间。水溶液的单一“一次性”施加或数小时施加会导致所施加的物质沿耳蜗长度产生陡峭的药物梯度,并随着药物随后分布在整个耳朵中,在耳蜗基部回旋处浓度迅速下降。
其它注射方法包含通过渗透泵,或与植入的生物材料组合,以及更优选地,通过注射或输注。可以帮助控制药物释放动力学和分布的生物材料包含水凝胶材料、可降解材料。最优选地使用的一类材料包含原位胶凝材料。所有潜在材料和方法在参考文献中提及(Almeida H、Amaral MH、Lobao P、Lobo JM,《最新药物发现(Drug Discov Today))2014;19:400-12;Wise AK、Gillespie LN,《神经工程学期刊(J Neural Eng)》2012;9:065002;Surovtseva EV、Johnston AH、Zhang W等人,《国际制药学杂志(Int JPharmaceut)》2012;424:121-7;Roy S、Glueckert R、Johnston AH等人,《纳米医学(Nanomedicine)》2012;7:55-63;Rivera T、Sanz L、Camarero G、Varela-Nieto I,.《当代药物传输(Curr DrugDeliv)》2012;9:231-42;Pararas EE、Borkholder DA、Borenstein JT,《先进药物输送评论(Adv Drug Deliv Rev)》2012;64:1650-60;Li ML、Lee LC、Cheng YR等人,《IEEE生物医学工程汇刊(IEEE T Bio-Med Eng)》2013;60:2450-60;Lajud SA、Han Z、Chi FL等人,《控制释放期刊(J Control Release)》2013;166:268-76;Kim DK、Park SN、Park KH等人,《药物传输(Drug Deliv)》2014;Engleder E、Honeder C、Klobasa J、Wirth M、Arnoldner C、Gabor F,《国际制药学杂志(Int J Pharmaceut)》2014;471:297-302;Bohl A、Rohm HW、Ceschi P等人,《材料科学杂志:医用材料(J Mater Sci Mater Med)》2012;23:2151-62;Hoskison E、Daniel M、Al-Zahid S、Shakesheff KM、Bayston R、Birchall JP,《治疗输送(Ther Deliv)》2013;4:115-24;Staecker H、RodgersB,《药物传输专家评论(Expert OpinDrug Deliv)》2013;10:639-50;Pritz CO、Dudas J、Rask-Andersen H、Schrott-FischerA、Glueckert R,《纳米医学》2013;8:1155-72),所述文献通过全文引用并入本文。其它材料包含胶原蛋白或其它天然材料,包含纤维蛋白、明胶和脱细胞组织。明胶泡沫也可能是合适的。
还可以通过替代手段来增强递送(所述替代手段包含但不限于添加到所递送的组合物中的药剂,如渗透促进剂)或者可以经由超声、电穿孔或高速射流通过装置。
本文描述的方法也可以用于内耳细胞类型,其可以使用本领域技术人员已知的多种方法产生,包含在PCT申请第WO 2012103012 A1号中描述的那些细胞类型。
关于人和兽医治疗,施用的一种或多种特定药剂的量可以取决于多种因素,包含所治疗的病症和所述病症的严重性;所采用的一种或多种具体药剂的活性;患者的年龄、体重、总体健康、性别和饮食;施用时间、施用途径和所采用的一种或多种特定药剂的排泄率;治疗的持续时间;与所采用的一种或多种特定药剂组合或同时使用的药物;处方医师或兽医的判断;以及医学和兽医学领域中已知的类似因素。
本文所述的药剂可以以治疗有效量施用于需要治疗的受试者。本文所述的组合物的施用可以通过任何合适的施用途径,例如通过鼓膜内施用。其它途径包含摄取或可替代地胃肠外,例如静脉内、动脉内、腹膜内、鞘内、心室内、尿道内、胸骨内、颅内、肌肉内、鼻内、皮下、舌下、经皮,或通过吸入或吹入或通过局部耳内滴注用于通过耳道皮肤和鼓膜吸收。此类施用可以是单次或多次口服剂量、确定数量的滴耳剂或快速浓注、多次注射或短期或长期输注。可植入装置(例如,可植入输液泵)也可以用于在特定调配物的当量或变化剂量下随时间的周期性肠胃外递送。对于此类肠胃外施用,优选将化合物调配成在水或另一种合适的溶剂或溶剂混合物中的无菌溶液。溶液可以含有其它物质,如用于使溶液与血液等渗的盐、糖(特别是葡萄糖或甘露醇)、缓冲剂(如乙酸、柠檬酸和/或磷酸及其钠盐)以及防腐剂。
可以通过足以将组合物递送到内耳的几种方法来施用本文所述的组合物。将组合物递送到内耳包含将组合物施用于中耳,使得组合物可以跨过圆窗扩散到内耳。其还包含通过直接注射通过圆窗膜向内耳施用组合物。此类方法包含但不限于通过鼓膜芯或导管进行耳腔施用,或通过例如耳内、经鼓膜或耳蜗内注射进行肠胃外施用。
在特定实施例中,本公开的化合物、组合物和调配物是局部施用的,这意味着它们不是全身施用的。
在一个实施例中,注射器和针设备用于通过耳廓施用向受试者施用化合物或组合物。使用适当大小的针刺穿鼓膜,并将包括组合物的芯或导管通过刺穿的鼓膜插入受试者的中耳。可以插入所述装置,以使其与圆窗接触或紧邻圆窗。用于耳道施用的示例性装置包含但不限于:经鼓膜芯、经鼓膜导管、圆窗微导管(将药物递送到圆窗的小导管)和Silverstein Microwicks
在一些实施例中,注射器和针设备用于通过经鼓膜注射、在鼓膜后向中耳和/或内耳注射向受试者施用化合物或组合物。调配物可以通过鼓膜内注射直接施用到圆窗膜上,或者可以通过耳蜗内注射直接施用到耳蜗或通过膀胱内注射直接施用到前庭器官。
在一些实施例中,递送装置是被设计用于向中耳和/或内耳施用化合物或组合物的设备。仅作为实例:GYRUS Medical GmbH提供了微型耳镜,其用于可视化圆窗小生境和将药物输送到圆窗小生境;Arenberg在美国专利第5,421,818号;第5,474,529号;和第5,476,446号中描述了一种用于将流体递送到内耳结构的医疗装置,所述美国专利中的每个美国专利的此类公开内容通过引用并入本文。美国专利申请序列号08/874,208(其此类公开内容通过引用并入本文)描述了一种用于植入流体输送导管以将组合物递送到内耳的外科手术方法。美国专利申请公开2007/0167918其此类公开内容通过引用并入本文)进一步描述了用于经鼓膜流体采样和药物施加的组合式耳吸器和药物分配器。
在一些实施例中,将本文公开的化合物或组合物一次施用于有需要的受试者。在一些实施例中,将本文公开的化合物或组合物多于一次施用于有需要的受试者。在一些实施例中,在本文中公开的化合物或组合物的第一次施用之后,进行本文中公开的化合物或组合物的第二次、第三次、第四次或第五次施用。
将化合物或组合物施用于有需要的受试者的次数取决于医学专业人员的判断、病症、病症的严重程度以及受试者对调配物的反应。在一些实施例中,将本文公开的化合物或组合物一次施用于有需要的患有轻度急性病状的受试者。在一些实施例中,将本文公开的化合物或组合物多于一次施用于患有中度或严重急性病状的有需要的受试者。在其中受试者的病状没有改善的情况下,根据医生的判断,化合物或组合物可以长期地施用,即在很长一段时间内,包含在受试者的整个生命的持续时间内,以减轻或以其它方式控制或限制受试者的疾病或病状的症状。
在其中受试者的状况确实有所改善的情况下,根据医生的判断,化合物或组合物可以连续不断地施用;可替代地,可以暂时减少或暂时中止所施用的药物剂量一定时间长度(即,“药物假期”)。药物假期的长度在2天与1年之间变化,仅通过实例的方式包含2天、3天、4天、5天、6天、7天、10天、12天、15天、20天、28天、35天、50天、70天、100天、120天、150天、180天、200天、250天、280天、300天、320天、350天和365天。药物假期期间的剂量减少可以为10%-100%,仅通过实例的方式包含10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%和100%。
一旦受试者的听力和/或平衡得到改善,必要时可以施用维持剂量。随后,根据症状将施用的剂量或频率或两者任选地降低至保留改善的疾病、病症或病状的水平。在某些实施例中,在症状出现任何复发时,受试者需要长期的间歇性治疗。
某些实施例包含药物产品,所述药物产品包括密封包装和在容器中的根据本发明的一种或多种化合物。可以优化容器的尺寸以减少包装后容器中的顶部空间,并且任何顶部空间都可以填充有惰性气体(如氮气)。此外,可以选择构造的容器材料以最小化包装后容器内的水分和氧气进入。
感音神经性听力损失的测量
听力损失可以通过几种不同的测试来评估。此类测试可以确定在治疗之前或之后患者对声音的可听性和/或患者对声音的可懂度。声音的可听性是患者检测声音的能力(即,患者是否可以确定声音的存在或不存在)的量度。声音的可懂度是患者正确识别声音的能力的量度。例如,可以根据患者是否可以正确识别单词来评估听力。因此,听力受损的患者可能既无法检测到声音也无法正确识别声音(即声音听不见且听不清)。然而,可听性并不一定与可懂度相关联,并且患者可能例如能够检测到声音,但不能正确识别它(即,声音是可听但听不懂的)。
纯音测听法
通常,由听力学家在听力测试中使用听力计(称为纯音听力法)对患者的可听性功能进行评估。纯音测听法是用于评估声音可听性的标准测试,并在其它地方进行了详细描述(例如,参见Katz,J.,Medwetsky,L.,Burkard,R.,&Hood,L.(2009)《临床听力学手册(Handbook of Clinical Audiology)》.宾夕法尼亚州费城(Philadelphia,Pennsylvania):利平科特·威廉斯·威尔金斯出版公司)。纯音测听法通常在经过声音处理的小室中进行,这会减少可能会干扰低级声音刺激检测的环境噪声水平。
在纯音测听法中,将患者暴露于特定频率的纯音刺激下以确定患者在每个频率下的听力阈值。标准测听法测量患者在以下频率中的每个频率下的纯音听力阈值:0.25kHz、0.5kHz、1kHz、2kHz、3kHz、4kHz、6kHz和8kHz。然而,无需在所有这些频率下确定患者的听力阈值即可确定患者是否患有感音神经性听力损失。例如,可以测试子频率或单个频率以识别患有感音神经性听力损失的患者。
为了确定听力阈值,改变纯音的音量以确定患者能够检测到的最低水平的刺激。最低水平的刺激(对应于最安静的声音)是给定频率下的纯音听力阈值。纯音阈值通常是在听力计上使用听力水平的相应分贝(dB HL)来测量的。然而,听力阈值也可以使用本领域技术人员已知的其它方法来确定。例如,可以通过听性脑干反应(ABR)测试或听觉稳态反应(ASSR)测试来测量听力功能。其它测试也可以用于确定患者的听力功能。例如,畸变产物耳声发射(DPOAE)可以用于测量外部毛细胞功能和损失,并可以用于对因与更高水平的处理(例如听觉神经病)相关的听力损失引起的毛细胞损失引起的听力损失进行鉴别诊断。
可以将纯音阈值绘制在图上以产生患者的听力图。
跨不同频率测量的纯音阈值也可以被平均以提供纯音平均值。例如,当在0.5kHz、1kHz、2kHz和4kHz上测量时,在0.5Hz下纯音听力阈值为50dB HL、在1kHz下纯音听力阈值为60dB HL、在2kHz下纯音听力阈值为65dB HL并且在4kHz下纯音听力阈值为70dB的患者的纯音平均值将为61.25dB HL。
可以在不同频率上计算纯音平均值。任何频率子集下的纯音阈值都可以用于计算纯音平均值。在一些实施例中,在0.5kHz、1kHz、2kHz和4kHz上测量患者听力阈值的平均值。在一些实施例中,在4kHz、6kHz和8kHz上测量纯音平均值。当试图评估标准听力测验频率内较高频率下的患者的听力功能时,在4kHz、6kHz和8kHz上测量纯音平均值非常有用。
感音神经性听力损失可以根据其严重性进行分类。听力损失的严重性由听力水平确定,在所述听力水平下,通过纯音测听法获得患者的阈值水平。听力损失的严重性根据听力阈值使用以下定义进行分类:
·正常:25dB HL或更小
·轻度:至少25dB HL并且不超过40dB HL
·中度:至少40dB HL并且不超过55dB HL
·中重度:至少55dB HL并且不超过70dB HL
·重度:至少70dB HL并且不超过90dB HL
·深度:至少90dB HL或更高
这些严重性度量是本领域中的标准度量(参见Goodman,A.(1965).纯音听力计的参考零水平(Reference zero levels for pure tone audiometer).ASHA,7,262-263)。在某些实施例中,听力损失的严重性是根据患者在单个频率(例如0.25kHz、0.5kHz、1kHz、2kHz、3kHz、4kHz、6kHz或8kHz)下的听力阈值来分类的。例如,患者可能患有在8kHz下的轻度听力损失,并且在其它标准测听频率下听力正常。在一些实施例中,当在频率的子集上测量时,根据纯音平均值将听力损失的严重性分类。在某些此类实施例中,根据0.5kHz、1kHz、2kHz和4kHz上的纯音平均值来对听力损失的严重性进行分类。例如,根据在0.5kHz、1kHz、2kHz和4kHz上的纯音平均值,患者可能患有中度听力损失,但是在单个频率(例如8kHz)下患有中重度听力损失。在其它实施例中,根据在4kHz、6kHz和8kHz上的纯音平均值来对听力损失的严重性进行分类。
在标准测听频率(即0.25kHz、0.5kHz、1kHz、2kHz、3kHz、4kHz、6kHz和8kHz)下具有25dB HL或更小的听力阈值的患者听力正常。患者的听力图也是正常的听力图。
本发明人发现患有中度或中重度听力损失的患者特别适合本文公开的治疗。因此,在某些优选的实施例中,感音神经性听力损失是中度感音神经性听力损失。在其它优选的实施例中,感音神经性听力损失是中重度感音神经性听力损失。在其它实施例中,可以向患有比中度感音神经性听力损失轻的听力损失的患者提供治疗益处。因此,在一些实施例中,感音神经性听力损失是轻度感音神经性听力损失。在其它实施例中,可以向患有比中重度听力损失严重的感音神经性听力损失的患者提供治疗益处。在其它实施例中,感音神经性听力损失是重度感音神经性听力损失。在其它实施例中,感音神经性听力损失是深度感音神经性听力损失。
在一些实施例中,当通过纯音测听法评估时,根据患者在0.5kHz、1kHz、2kHz和4kHz上的听力阈值的平均值来确定中度或中重度感音神经性听力损失。在这些实施例中,当通过纯音测听法评估时,患者在0.5kHz、1kHz、2kHz和4kHz上的听力阈值的平均值至少为40dB HL并且不超过70dB HL。在某些此类实施例中,当通过纯音测听法评估时,患者在0.5kHz、1kHz、2kHz和4kHz上的听力阈值的平均值至少为40dB HL并且不超过55dB HL。在其它实施例中,当通过纯音测听法评估时,患者在0.5kHz、1kHz、2kHz和4kHz上的听力阈值的平均值至少为55dB HL并且不超过70dB HL。
本发明人已经发现,在较高频率下患有听力损失的患者特别适合于本文公开的治疗。因此,在某些实施例中,当通过纯音测听法测量时,患者在4kHz和/或6kHz和/或8kHz下患有比其它标准测听频率(即0.25kHz、0.5kHz、1kHz、2kHz和3kHz)下更严重的听力损失。例如,在实施例中,患者在4kHz、6kHz和8kHz下患有中度或中重度听力损失,而在其它标准测听频率下患有轻度听力损失。在另一个实施例中,患者在4kHz、6kHz和8kHz下患有中度听力损失,而在其它标准测听频率下患有轻度听力损失。在另一个实施例中,患者在4kHz、6kHz和8kHz下患有轻度听力损失,而在其它标准测听频率下听力正常。
在一些实施例中,当通过纯音测听法测量时,患者在4kHz下具有至少40dB HL的听力阈值。在一些实施例中,当通过纯音测听法测量时,患者在6kHz下具有至少40dB HL的听力阈值。在一些实施例中,当通过纯音测听法测量时,患者在8kHz下具有至少40dB HL的听力阈值。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在以下范围内:
8kHz–40dB HL到95dB HL;和/或
6kHz–40dB HL到85dB HL;和/或
4kHz–40dB HL到80dB HL;和/或
3kHz–40dB HL到70dB HL;和/或
2kHz–40dB HL到70dB HL;和/或
1kHz–40dB HL到70dB HL;和/或
0.5kHz–40dB HL到70dB HL;和/或
0.25Hz–40dB HL到70dB HL。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在8kHz下在40dB HL到95dB HL的范围内。在某些此类实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在8kHz下在40dB HL到70dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在6kHz下在40dB HL到85dB HL的范围内。在某些此类实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在6kHz下在40dB HL到70dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在4kHz下在40dB HL到80dB HL的范围内。在某些此类实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在4kHz下在40dB HL到70dB HL的范围内。
在某些此类实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在3kHz下在40dB HL到70dB HL的范围内。
在某些此类实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在2kHz下在40dB HL到70dB HL的范围内。
在某些此类实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在1kHz下在40dB HL到70dB HL的范围内。
在某些此类实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在0.5kHz下在40dB HL到70dB HL的范围内。
在某些此类实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在0.25kHz下在40dB HL到70dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在以下范围内:
8kHz–40dB HL到95dB HL;以及
6kHz–40dB HL到85dB HL;以及
4kHz–40dB HL到80dB HL;以及
3kHz–40dB HL到70dB HL;以及
2kHz–40dB HL到70dB HL;以及
1kHz–40dB HL到70dB HL;以及
0.5kHz–40dB HL到70dB HL;以及
0.25Hz–40dB HL到70dB HL。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在以下范围内:
8kHz–40dB HL到70dB HL;以及
6kHz–40dB HL到70dB HL;以及
4kHz–40dB HL到70dB HL;以及
3kHz–40dB HL到70dB HL;以及
2kHz–40dB HL到70dB HL;以及
1kHz–40dB HL到70dB HL;以及
0.5kHz–40dB HL到70dB HL;以及
0.25Hz–40dB HL到70dB HL。
在一些实施例中,当通过纯音测听法评估时,根据患者在0.5kHz、1kHz、2kHz和4kHz上的听力阈值的平均值来确定轻度感音神经性听力损失。在这些实施例中,患者的听力阈值的平均值为至少25dB HL并且不超过40dB HL。
在这些实施例中,当通过纯音测听法测量时,患者在4kHz下的听力阈值为至少25dB HL并且不超过40dB HL。在这些实施例中,当通过纯音测听法测量时,患者在6kHz下的听力阈值为至少25dB HL并且不超过40dB HL。在一些实施例中,当通过纯音测听法测量时,患者在8kHz下的听力阈值为至少25dB HL并且不超过40dB HL。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在以下范围内:
8kHz–25dB HL到40dB HL;和/或
6kHz–25dB HL到40dB HL;和/或
4kHz–25dB HL到40dB HL;和/或
3kHz–25dB HL到40dB HL;和/或
2kHz–25dB HL到40dB HL;和/或
1kHz–25dB HL到40dB HL;和/或
0.5kHz–25dB HL到40dB HL;和/或
0.25Hz–25dB HL到40dB HL。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在8kHz下在25dB HL到40dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在6kHz下在25dB Hl到40dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在4kHz下在25dB HL到40dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在3kHz下在25dB HL到40dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在2kHz下在25dB HL到40dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在1kHz下在25dB Hl到40dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在0.5kHz下在25dB Hl到40dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在0.25kHz下在25dB HL到40dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在以下范围内:
8kHz–25dB HL到40dB HL;以及
6kHz–25dB HL到40dB HL;以及
4kHz–25dB HL到40dB HL;以及
3kHz–25dB HL到40dB HL;以及
2kHz–25dB HL到40dB HL;以及
1kHz–25dB HL到40dB HL;以及
0.5kHz–25dB HL到40dB HL;以及
0.25Hz–25dB HL到40dB HL。
本文公开的治疗还适用于对于每个标准测听频率,听力图的听力阈值处于不同严重性水平的患者。例如,患者可能在第一频率下患有中度听力损失,在第二频率下患有轻度听力损失等。因此,这些患者可能具有听力图,其中某些听力阈值处于轻度听力损失范围内(即,至少25dB HL并且不超过40dB HL),并且其它听力阈值在中度听力损失范围内(即至少40dB HL并且不超过55dB HL)。在某些实施例中,患者的听力图在4kHz、6kHz和8kHz下的听力阈值在中度听力损失范围内,并且在0.25kHz、05.kHz、1kHz、2kHz和3kHz下的听力阈值在轻度听力损失范围。
还可以在落入标准测听范围之外的频率下评估患者的听力功能。例如,可以在超高频中评估听力功能。在纯音测听的上下文中,超高频是高于8kHz的频率。可以通过纯音测听法评估超高频范围内的听力功能,所述纯音测听法可以在10kHz、12kHz、14kHz和16kHz下执行。可以根据用于将标准测听频率范围内的听力损失的严重性分类的听力阈值对超高频范围内的听力损失的严重性进行分类。在超高频范围内,听力损失的严重性使用以下范围进行分类:
·正常:25dB HL或更小
·轻度:至少25dB HL并且不超过40dB HL
·中度:至少40dB HL并且不超过55dB HL
·中重度:至少55dB HL并且不超过70dB HL
·重度:至少70dB HL并且不超过90dB HL
·深度:至少90dB HL或更高
在一些实施例中,根据患者在单个超高频(例如10kHz、12kHz、14kHz或16kHz)下的听力阈值,对超高频范围内的听力损失的严重性进行分类。单个超高频听力损失的严重性可以是如上所概述的轻度、中度、中重度、重度或深度。例如,在一些实施例中,患者可能患有在16kHz下的轻度听力损失,并且在其它超高频率下听力正常。在其它实施例中,患者可能患有在16kHz下的中度听力损失,并且可能患有在其它超高频率下的轻度听力损失。在一些实施例中,当在超高频率的子集上测量时,根据纯音平均值将听力损失的严重性分类。超高频率的任何子集均可以用于计算纯音平均值。在某些此类实施例中,根据10kHz、12kHz、14kHz和16kHz上的纯音平均值来对听力损失的严重性进行分类。
当在标准测通频率下评估时患有感音神经性听力损失的患者也可能患有在超高频率中的听力损失。因此,在一些实施例中,当通过纯音测听法测量时,患有感音神经性听力损失的患者在16kHz下的听力阈值也介于40dB HL到70dB HL之间。在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在以下范围内:
16kHz–40dB HL到70dB HL;和/或
14kHz–40dB HL到85dB HL;和/或
12kHz–40dB HL到95dB HL;和/或
10kHz–40dB HL到95dB HL。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在14kHz下在40dB HL到85dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在12kHz下在40dB HL到95dB HL的范围内。
在一些实施例中,当通过纯音测听法测量时,患者的听力图的听力阈值在10kHz下在40dB HL到95dB HL的范围内。
单词识别测试
可替代地或者除了纯音测听法之外,可以使用单词识别测试来评估听力损失。单词识别测试是患者正确识别单词的能力的量度,从而提供纯语音测听法无法提供的声音可懂度(尤其是语音可懂度)的度量。在某些实施例中,单词识别评分用于确定患者在治疗前正确识别单词的能力。
本发明人已经发现,本文公开的治疗在改善声音可懂度方面可以是特别有效的,并且因此具有较差的单词识别评分的患者可能特别适合于所公开的治疗。
安静测试中的标准单词识别(在本文中也称为标准单词识别测试)是由听觉医师管理的测试,其测量患者在安静环境中识别单词时的语音可懂度。安静环境是几乎没有背景噪声的环境。
可以使用标准单词识别测试来确定人识别从单词列表中选择并以给定分贝(dB)水平呈现给患者的单词的能力。在某些实施例中,标准单词识别测试用于确定患者识别一个以上分贝水平的单词的能力。
在一些实施例中,标准单词识别测试评估患者识别50个单词的能力。然而,呈现给患者的单词数量可以大于或小于50。例如,在一些实施例中,标准单词识别测试是针对25个单词的。在其它实施例中,标准单词识别测试是针对10个单词的。
可以使用标准单词识别测试来生成使用以下公式计算的标准单词识别(%)评分:
在一些实施例中,患者在治疗前具有90%或更少、85%或更少、或80%或更少、70%或更少、60%或更少、或50%或更少的标准单词识别评分。在优选实施例中,患者在治疗前的标准单词识别评分为60%或更低。
在一些实施例中,标准单词识别评分表示为在测试中被正确识别的单词的数量。例如,在一些实施例中,患者在50个单词的标准单词识别测试中正确地识别出45个或更少的单词、42个或更少的单词、或40个或更少的单词、35个或更少的单词、30个或更少的单词、或25个或更少的单词。在优选实施例中,患者在50个单词的标准单词识别测试中正确地识别出30个或更少的单词。
在一些实施例中,向每只耳朵管理单词列表,并且为每只耳朵计算标准单词识别评分。在本文中,标准单词识别评分的结果是指已经/将要治疗的耳朵。
可以使用任何单词列表来执行标准单词识别测试。然而,标准单词列表通常用于标准单词识别测试中。在一些实施例中,每个测试单词嵌入在载体短语中。载体短语的实例是:“再次说出单词____”、“您将说__”或“说出单词____”。
在一些实施例中,标准单词识别测试是马里兰辅音-元音核-辅音(CNC)单词测试。例如,在以下中描述了马里兰CNC单词测试:Mendel,L.L.,Mustain,W.D.,&Magro,J.(2014).马里兰CNC测试的经典数据(Normative data for the Maryland CNC Test).《美国听力学学会杂志(Journal of the American Academy of Audiology)》,25,775-781。
马里兰CNC单词测试是一种标准单词识别测试,它使用包括辅音-核-辅音(CNC)单音节的单词的音素平衡的单词列表。这些CNC列表是平衡的,以便每个初始辅音、每个元音和每个最终辅音在每个列表中以相同的频率出现。马里兰CNC测试具有10个包含50个单词的列表。
在一些实施例中,马里兰CNC测试使用来自Lehiste和Peterson的语音平衡单词列表的单词,所有这些都是CNC单音节,例如在Lehiste I,Peterson GE.(1959)语音可懂度研究中的语言学考虑(Linguistic considerations in the study of speechintelligibility).《美国声学学会杂志(Journal of the Acoustical Society ofAmerica)》31(3):280–286中所述的。
在一些实施例中,马里兰CNC测试使用来自修订的CNC列表的单词,其除了罕见的文学单词和专有名称,例如,在Peterson GE,Lehiste I.(1962)用于听觉测试的修订的CNC列表(Revised CNC lists for auditory tests).《言语和听力障碍杂志(Journal ofSpeech and Hearing Disorders)》27:62–70中所述的。
在一些实施例中,马里兰CNC测试使用来自修改的CNC单词列表的单词,其考虑了协同发音的影响,其中音素的声学特性受到紧接在它们之前和之后的那些音素的影响,例如,在Causey GD、Hood LJ、Hermanson CL、Bowling LS.(1984)马里兰CNC测试:经典研究(The Maryland CNC Test:normative studies).《听力学(Audiology)》23(6):552–568中所描述的。在以下载体短语中说马里兰CNC测试的单词:“再次说___,”
在一些实施例中,标准单词识别测试是C.I.D听觉测试W-22(CID W-22)测试。例如在以下中描述了CID W-22测试:Hirsh,I.J.,Davis,H.Silverman,S.R.,Reynolds,E.G.,Eldert,E.,&Benson,R.W.(1952).用于语音测听法的材料的开发(Development ofMaterials for Speech Audiometry).《言语、语言和听力研究杂志(Journal of Speech,Language,and Hearing Research)》,17(3),321-337。
CID W-22测试使用分为四个列表的200个单音节单词,每个列表包含50个单词。每个列表在语音上都是平衡的。列表中的语音声音与英语语音样本中的相对频率相同。在语音平衡的单词列表中,词汇具有三个标准。首先,所有单词必须是一个单音节单词,并且在不同列表中不得重复单词。其次,选择的任何单词都应该是熟悉的单词。此第二标准是用于最小化学科教育背景差异的影响。第三,每个单词列表的语音成分应尽可能与英语整体的语音成分相对应。以以下载体短语说CID W-22测试的单词:“您将说__”。
在一些实施例中,标准单词识别测试是NU No.6测试。例如在以下中描述了NUNo.6:Tillman,T.W.,&Carhart,R.(1966).使用CNC单音节单词的语音识别扩增测试:西北大学听觉测试第6.西北大学埃文斯顿Il听觉研究实验室(Northwestern Univ EvanstonIl Auditory Research Lab)。
在一些实施例中,例如,如在illman,T.W.,&Carhart,R.(1966)的表28-2中所描述的,NU No.6测试使用4个包含50个单词的列表。以以下载体短语说NU No.6测试的单词:“说出单词__”。
在优选实施例中,标准单词识别测试是马里兰CNC测试,其使用以下中定义的单词列表和载体短语:Causey GD,Hood LJ,Hermanson CL,Bowling LS.(1984)马里兰CNC测试:经典研究(The Maryland CNC Test:normative studies).《听力学(Audiology)》23(6):552–568中所描述的。在某些此类优选实施例中,单词信号以高于语音感知水平40dB提供给患者。
噪声中单词(WIN)测试
“噪声中单词(WIN)测试”是由听力学专家施用的测试,其用于在存在背景噪声的情况下测量患者在识别单词时方面的语音可懂度。
WIN测试由以变化的信噪比(SNR)水平将单词施用到耳朵组成。信噪比是承载信息的信号(例如,测试单词信号)的强度相对于干扰信号(例如,噪声)的比率,并且通常以分贝表示。在一些实施例中,背景噪声是固定分贝水平的多讲话者混串音。
在一些实施例中,多讲话者混串音包括六个处于固定水平的讲话者(三个女性、三个男性),例如,如在Wilson,R.H.,Abrams,H.B.,&Pillion,A.L.(2003).使用从24dB到0dB信号到混串音的降级呈现模式的在多讲话者混串音中的单词识别任务.《康复研究与发展杂志(Journal of Rehabilitation Research and Development)》,40(4),321-328中所描述的。
在一些实施例中,背景噪声被维持在固定的分贝电平,并且SNR分贝电平的变化是通过改变测试单词信号的分贝水平来实现的。因此,SNR分贝水平是高于背景噪声的SNR。例如,如果多讲话者混串音的水平固定为70dB SPL,并且测试单词信号的水平从70dB SPL改变为94dB SPL,则SNR的分贝级变化为0dB到24dB。
在一些实施例中,所使用的测试单词可以来自本文描述的用于词识别测试的任何列表。在一些实施例中,噪声中单词测试是针对70个单词的。在其它实施例中,噪声中单词测试是针对35个单词的。
在一些实施例中,测试由管理来自NU No.6单词列表的35个或70个单音节单词组成。可以以以下载体短语说测试单词:“说出单词__”。
在一些实施例中,以降级SNR范例来管理WIN测试。在这些实施例中,首先呈现高SNR分贝水平的测试单词,然后呈现逐渐降低SNR分贝水平的测试单词,最后施用最低SNR分贝水平的单词。高SNR分贝水平是患者识别信号单词的最简单设置。低SNR分贝水平是患者识别信号单词的最困难设置。在其它实施例中,以随机水平的SNR范例来管理WIN测试。在这些实施例中,测试单词以随机顺序在不同的SNR分贝水平下呈现。
在某些实施例中,测试单词的SNR分贝水平以4dB的递减从24dB SNR(最容易条件)到0dB SNR(最困难条件)变化,总共七个SNR水平(即24dB SNR、20dB SNR、16dB SNR、12dBSNR、8dB SNR、4dB SNR和0dB SNR)。
在优选实施例中,WIN测试由管理来自NU No.6单词列表的70个单音节单词组成,其中测试单词的SNR分贝水平以4dB的递减从24dB SNR(最容易条件)到0dB SNR(最困难条件)变化,总共七个SNR水平(即24dB SNR、20dB SNR、16dB SNR、12dB SNR、8dB SNR、4dB SNR和0dB SNR)。在此优选实施例中,多讲话者混串音的水平固定为70dB SPL,并且测试单词信号的水平从70dB SPL改变为94dB SPL。
可以使用“噪声中单词”测试来产生噪声中单词评分。
在一些实施例中,噪声中单词评分以在测试中由患者识别的总正确单词的百分比的形式给出并使用以下公式计算:
在一些实施例中,患者在治疗前的噪声中单词评分为90%或更少,80%或更少、70%或更少、60%或更少、50%或更少、40%或更少、或30%或更少。在优选实施例中、患者在治疗前的噪声中单词评分为50%或更少。
在一些实施例中,噪声中单词评分表示为在测试中被正确识别的单词的数量。例如,在一些实施例中,患者在70个单词的噪声中单词测试中正确地识别出63个或更少、56个或更少、49个或更少、42个或更少、35个或更少、28个或更少、或21个或更少的单词。在优选实施例中,患者在70个单词的噪声中单词测试中正确地识别出35个或更少的单词。在其它实施例中,患者在35个单词的噪声中单词测试中正确地识别出32个或更少、28个或更少、24个或更少、21个或更少、17个或更少、14个或更少、或11个或更少的单词。
在一些实施例中,使用在每个信噪比(SNR)水平下的噪声中单词评分和Spearman-Karber等式计算在噪声中单词测试中50%正确单词的预测均值的患者的SNR。预测的50%正确单词的平均值用于提供平均dB SNR水平,在所述水平下,预期在噪声中单词测试中正确识别出50%的单词。在一些实施例中,在噪声中单词测试中针对50%正确单词的预测平均值的患者的SNR为约25dB、约24dB、约23dB、约22dB、约21dB、约20dB、约19dB,18dB、约17dB、约16dB、约15dB、约14dB、约13dB、约12dB、约11dB、约10dB、约9dB、约8dB、约7dB、约6dB。在优选实施例中,在噪声中单词测试中,对于50%正确单词的预测平均值,患者的信噪比(SNR)为约21dB,例如20.8dB,约20dB,约19dB,例如18.8dB,约18dB,例如17.6dB,约17dB,例如16.8dB,或约16dB,例如16.4dB。
定义
在本申请中,除非另外说明,否则“或者”的使用包含“和/或”。如本说明书中使用的,术语“包括(comprise)”和术语的变化如“包括(comprising/comprises)”不旨在排除其它添加剂、组分、整数或步骤。“由...组成”意指包含并限于短语“由...组成”之后的任何内容。因此,短语“由...组成”表示所列元件是必需的或强制性的,并且可以不存在其它元件。“基本上由...组成”意指包含在所述短语之后所列出的任何要素,并且限于不干扰或促进本公开中针对所列元素指定的活动或行为的其它要素。因此,短语“基本上由...组成”表示所列元件是必需的或强制性的,但是其它元件是任选的并且可以存在或不存在,这取决于其是否实质上影响所列元件的活动或作用。
术语“约”和“大约”用作等同物。本公开中使用的有或无约/大约的任何数值意指涵盖相关领域普通技术人员所了解的任何正常波动。在某些实施例中,术语“大致”或“大约”是指在规定的参考值的任一方向(大于或小于)的25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小的值的范围,除非另行说明或另外从上下文明显可见(除了这些数目将超过可能值的100%的情况)。
“对化合物的任何提及也指对所述化合物的药学上可接受的盐的提及”(无论是否明确提及药学上可接受的盐)。可以以任何药学上可接受的固体形式,例如盐、溶剂化物、水合物、多晶型物、无定形物质形式等提供用于本发明的任何化合物。对化合物的任何提及也包含对所述化合物的人工氘代形式的提及。
“活性”是指通过本领域已知的方法测量的由细胞的蛋白质介导并结合细胞效应如增殖、细胞生长或细胞基因表达的生物学功能,所述方法如免疫染色和蛋白质印迹。
“施用”是指将物质引入受试者中。在一些实施例中,施用是例如通过注射进行的耳廓、耳内、耳蜗内、前庭内或经鼓膜施用。在一些实施例中,直接向内耳施用,例如通过圆窗、耳囊或前庭管进行注射。在一些实施例中,施用通过耳蜗植入物递送系统直接进入内耳。在一些实施例中,所述物质经鼓膜注射到中耳。在某些实施例中,所述物质是全身(例如口服或肠胃外)施用的。在某些实施例中,“使被施用”是指在已经施用第一组分之后(例如,在不同的时间和/或通过不同的参与者)施用第二组分。
“激动剂”是指引起靶基因、蛋白质和/或通路的表达、水平和/或活性增加的药剂。在某些情况下,激动剂直接结合并激活靶蛋白。在一些情况下,激动剂通过结合并调节一种或多种通路组分的活性来增加通路的活性,例如,通过抑制通路的一种或多种负调节剂的活性,或通过激活通路的一种或多种上游或下游调节剂。
“耳腔施用”是指使用导管或芯装置将组合物跨过鼓膜向受试者的内耳施用的方法。为了促进芯或导管的插入,可以使用适当大小的注射器或移液管刺穿鼓膜。还可以使用本领域技术人员已知的任何其它方法来插入装置,例如,通过外科手术植入装置。在特定实施例中,芯或导管装置可以是独立装置,这意味着将其插入受试者的耳朵中,并且然后将组合物可控地释放到内耳。在其它特定实施例中,芯或导管装置可以被附接或联接到允许施用另外的组合物的泵或其它装置。泵可以被自动编程以递送剂量单位,或者可以由受试者或医学专业人员控制。
“经典Notch信号传导”是指Notch介导的通过Mastermind状蛋白(MAML)、CSL/RBPJ(CBF-1,无毛的抑制剂、无毛的Lag-1/重组结合蛋白抑制剂)以及引起Hes和Hey靶基因上调的NICD(Notch细胞内结构域)的复合物介导的转录。例如,通过在干细胞增殖测定中测量Hes和Hey基因表达,在耳蜗Lgr5+细胞中测量经典notch信号传导。使用本领域已知的方法,例如通过PCR、Nanostring或蛋白质印迹分析来测量基因表达。
如本文所使用的,“细胞聚集体”是指柯蒂氏器官中的体细胞,所述体细胞已经增殖形成直径大于40微米的给定细胞类型的簇和/或产生了垂直于基底膜的大于3个细胞层的形态。
“细胞聚集体”还可以指其中细胞分裂产生细胞体的过程,所述细胞体使一种或多种细胞类型突破网状层或内淋巴与周淋巴之间的边界。
如本文所使用的,与特定细胞类型相关的“细胞密度”是代表性显微分析样品中每单位面积所述细胞类型的平均数。细胞类型可以包含但不限于Lgr5+细胞、毛细胞或支持细胞。可以用给定器官或组织(包含但不限于耳蜗或柯蒂氏器官)中给定细胞类型评估细胞密度。例如,柯蒂氏器官中的Lgr5+细胞密度是整个柯蒂氏器官中测得的Lgr5+细胞的细胞密度。通常,支持细胞和Lgr5+细胞将通过截取柯蒂氏器官的横截面进行枚举。通常,通过向下观察柯蒂氏器官的表面来枚举毛细胞,尽管在某些情况下也可以使用横截面,如代表性显微分析样品中所述。通常,如代表性显微分析样品所述,将通过分析柯蒂氏器官的整个固定制剂并计数沿上皮表面在给定距离上的Lgr5细胞数量来测量Lgr5+细胞的细胞密度。毛细胞可以通过它们的形态特征来识别,如束或毛细胞特有的染色剂(例如,肌球蛋白VIIa、快蛋白(Prestin)、vGlut3、Pou4f3、Espin、缀合的鬼笔环肽、PMCA2、Ribeye、Atoh1等)。Lgr5+细胞可以通过特定的染色剂或抗体(例如,Lgr5-GFP转基因报告基因、抗Lgr5抗体等)进行识别。
如本文所使用的,“耳蜗浓度”将是通过采样耳蜗流体或组织而测量的给定药剂的浓度。除非另有说明,否则样品应含有足够量的耳蜗流体或组织,以使其大致上代表耳蜗中药物的平均浓度。例如,可以从前庭管中抽取样本,并且依次抽取一系列液体样品,使得各个样品包括耳蜗特定部分的耳蜗流体。
“互补核酸序列”是指能够与包含互补核苷酸碱基对的另一个核酸序列杂交的核酸序列。
如本文所使用的,与特定细胞类型相关的“交叉细胞密度”是代表性显微分析样品中穿过组织的横截面的每单位面积所述细胞类型的平均数。柯蒂氏器官的横截面也可以用于确定给定平面中的细胞数量。通常,毛细胞横截面细胞密度将通过分析柯蒂氏器官的整个固定制剂并计数沿上皮部分的横截面在给定距离内的毛细胞数来测量,如代表性显微分析样品中所述。通常,Lgr5+细胞的横截面细胞密度将通过分析柯蒂氏器官的整个固定制剂并计数沿上皮部分的横截面在给定距离内的Lgr5+细胞的数量来测量,如代表性显微分析样品中所述。毛细胞可以通过它们的形态特征来识别,如束或毛细胞特有的染色剂(合适的染色剂包含例如,肌球蛋白VIIa、快蛋白(Prestin)、vGlut3、Pou4f3、缀合的鬼笔环肽、PMCA2、Atoh1等)。Lgr5+细胞可以通过特定染色剂或抗体(合适的染色剂和抗体包含Lgr5mRNA的荧光原位杂交、Lgr5-GFP转基因报告系统、抗Lgr5抗体等)进行识别。
“降低”是指例如与参考或对照水平相比降低至少5%,例如,5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或100%。
“降低”还包含例如与参考或对照水平相比降低至少约1.1倍,例如,至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍。
“Deltex-1激动剂”是指使Deltex-1 1gene、蛋白质和/或通路的表达、水平和/或活性增加的药剂。在某些情况下,激动剂直接结合并激活Deltex-1。在一些情况下,激动剂通过结合并调节一种或多种Deltex-1通路组分的活性来增加Deltex-1的活性,例如,通过抑制通路的一种或多种负调节剂的活性,或通过激活通路的一种或多种上游或下游调节剂。
“Deltex-1增效剂”是指结合Jag-1激动剂、Deltex-1激动剂、PI3K激动剂或非经典Notch激动剂时使Deltex-1基因、蛋白质和/或通路的表达、水平和/或活性增加的药剂。
“有效浓度”是在干细胞增殖测定中,与未使用化合物的干细胞增殖测定中Lgr5+细胞的数量相比,诱导至少1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍的基因表达和/或诱导Lgr5+细胞数量增加约1.5倍的化合物的最小浓度。
如本文所使用的,“有效释放速率”(质量/时间)是有效浓度(质量/体积)*30uL/1小时。
“消除”是指降低到不可检测的水平。
“移植”或“植入”是指干细胞或祖细胞通过与组织的现有细胞接触而在体内并入感兴趣的组织中的过程。“上皮祖细胞”是指多能细胞,所述多能细胞具有被限制为产生上皮细胞的细胞谱系的潜力。
“上皮干细胞”是指多能细胞,其有可能变得致力于多种细胞谱系,包含产生上皮细胞的细胞谱系。
“表达”是指通过RNA量测量的基因水平。
“HDAC抑制剂”是指抑制I-IV类组蛋白去乙酰化酶的细胞活性的任何化合物。
“杂交”意指在合适的严格条件下在互补核苷酸碱基之间形成双链分子(例如,腺嘌呤(A)与胸腺嘧啶(T)形成碱基对,鸟嘌呤(G)与胞嘧啶(C)也是如此)的对。(参见例如Wahl,G.M.和S.L.Berger(1987)《酶学方法(Methods Enzymol.》152:399;Kimmel,A.R.(1987)《酶学方法》152:507)。
“抑制剂”是指引起靶基因、蛋白质和/或通路的表达、水平和/或活性减少的药剂。“拮抗剂”是“抑制剂”的一个实例。
如本文所使用的,“抑制性核酸”是双链RNA、RNA干扰、miRNA、siRNA、shRNA或反义分子或其部分或其模拟物,当将其向哺乳动物细胞施用时,导致靶基因表达下降。通常,核酸抑制剂包括靶核酸分子的至少一部分或其直系同源物,或者包括靶核酸分子的互补链的至少一部分。在一些实例中,靶基因的表达减少了10%、25%、50%、75%或甚至90-100%。
“体外Lgr5活性”是指体外细胞群体中Lgr5的表达或活性水平。例如,其可以通过将细胞解离为单细胞、用碘化丙锭(PI)染色并使用流式细胞仪分析细胞的Lgr5-GFP表达,在源自表达Lgr5-GFP的小鼠(如B6.129P2-Lgr5tm1(cre/ERT2)Cle/J小鼠(也称为Lgr5-EGFP-IRES-creERT2或Lgr5-GFP小鼠,Jackson实验四储备编号:008875)的细胞中进行测量。来自野生型(非Lgr5-GFP)小鼠的内耳上皮细胞经过相同的培养和分析程序后,可以用作阴性对照。通常,在双变量图中以GFP/FITC作为一个变量显示了两个细胞群体,其包含GFP阳性和GFP阴性群体。Lgr5+细胞可以通过选通GFP阳性细胞群体来识别。Lgr5+细胞的百分比可以通过将GFP阳性细胞群体与GFP阴性群体和阴性对照进行选通来测量。Lgr5+细胞的数量可以通过将细胞总数乘以Lgr5阳性细胞的百分比来计算。对于源自非Lgr5-GFP小鼠的细胞,可以使用抗Lgr5抗体或对Lgr5基因进行定量PCR来测量Lgr5活性。
如本文所使用的,“体内Lgr5活性”是受试者中Lgr5的表达或活性水平。其例如可以通过去除动物的内耳并测量Lgr5蛋白或Lgr5 mRNA来进行测量。可以使用抗Lgr5抗体测量荧光强度来测量Lgr5蛋白产生,如通过对耳蜗样品进行成像确定的,其中荧光强度用作Lgr5存在的量度。蛋白质印迹可以与抗Lgr5抗体一起使用,其中可以从经处理的器官中收获细胞以确定Lgr5蛋白的增加。定量PCR或RNA原位杂交可以用于测量Lgr5 mRNA产生的相对变化,其中可以从内耳收获细胞以确定Lgr5 mRNA的变化。可替代地,可以使用Lgr5启动子驱动的GFP报告基因转基因系统测量Lgr5表达,其中可以使用流式细胞仪、成像或间接使用抗GFP抗体直接检测GFP荧光的存在或强度。
“增加”是指例如与参考水平相比增加至少5%,例如,5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%、100%、150%、200%、250%、300%、350%、400%、450%或500%或更多。
“增加”还意味着例如与参考标准的水平相比,增加至少约1.1倍,例如至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、500倍、1000倍或更多倍。
“耳内施用”是指通过直接注射组合物而将组合物施用于受试者的中耳或内耳。
“耳蜗内”施用是指将组合物跨过鼓膜和圆窗膜直接注射到耳蜗中。
“前庭内”施用是指将组合物跨过鼓膜和圆窗膜或卵窗膜直接注射到前庭器官中。
“分离的”是指从其天然状态发现的通常与其所伴随的组分不同程度地自由的材料。“分离”表示与原始来源或周围环境的分离程度。
如本文所使用的,“Jagged-1激动剂”或“Jag-1激动剂”是使Jag-1基因、蛋白质和/或通路的表达、水平和/或活性增加的化合物。在某些情况下,激动剂直接结合并激活Jag-1蛋白。在一些情况下,激动剂通过结合并调节一种或多种Jag-1通路组分的活性来增加通路的活性,例如,通过抑制通路的一种或多种负调节剂的活性,或通过激活通路的一种或多种上游或下游调节剂。
如本文所使用的,“Jagged-1增效剂”或“Jag-1增效剂”是结合Jag-1激动剂、Deltex-1激动剂、PI3K激动剂或非经典Notch激动剂时使Jag-1基因、蛋白质和/或通路的表达、水平和/或活性增加的化合物。
“Lgr5”是含富含亮氨酸重复序列的G蛋白偶联受体5(也称为G蛋白偶联受体49(GPR49)或G蛋白偶联受体67(GPR67))的首字母缩写。它是一种在人类中由Lgr5基因编码的蛋白质。
“Lgr5活性”定义为细胞群体中Lgr5的活性水平。在体外细胞群体中,可以在体外Lgr5活性测定中测量Lgr5活性。在体内细胞群体中,可以在体内Lgr5活性测定中测量Lgr5活性。
如本文所使用的,“Lgr5+细胞”或“Lgr5阳性细胞”是表达Lgr5的细胞。如本文所使用的,“Lgr5-细胞”或“Lgr5-阴性”是一种细胞,所述细胞不是Lgr5+。
如本文所使用的,“谱系追踪”使用能够在报道基因诱导时对表达靶基因的任何细胞进行命运追踪的小鼠系。这可以包含毛细胞或支持细胞基因(Sox2、Lgr5、肌球蛋白VIIa、Pou4f3等)。例如,谱系追踪可以使用与报告基因小鼠杂交的Lgr5-EGFP-IRES-creERT2小鼠,其在诱导时允许追踪诱导时表达Lgr5的细胞的命运。再例如,可以将Lgr5细胞分离成单个细胞,并在干细胞增殖测定中培养以产生集落,然后在分化测定中进行分化,并通过对毛细胞和/或支持细胞蛋白染色并确定报告基因与毛细胞或支持细胞染色共定位来分析细胞命运以确定Lgr5细胞的命运。另外,可以在人工耳蜗外植体中进行谱系追踪,以追踪治疗后完整器官内的支持细胞或毛细胞命运。例如,可以通过从与报告基因小鼠杂交的Lgr5-EGFP-IRES-creERT2小鼠中分离耳蜗并在治疗之前或期间诱导Lgr5细胞中的报告基因来确定Lgr5细胞的命运。然后可以通过对毛细胞和/或支持细胞蛋白进行染色,并确定报告基因与毛细胞或支持细胞染色共定位以确定Lgr5细胞的命运,从而对器官的细胞命运进行分析。另外,谱系追踪可以在体内执行,以在治疗后在完整器官内体内追踪支持细胞或毛细胞命运。例如,可以确定Lgr5细胞的命运,从而在与报告基因小鼠杂交的Lgr5-EGFP-IRES-creERT2小鼠中诱导报告基因,治疗动物,然后分离耳蜗。然后可以通过对毛细胞和/或支持细胞蛋白进行染色,并确定报告基因与毛细胞或支持细胞染色共定位以确定Lgr5细胞的命运,从而对器官的细胞命运进行分析。可以使用如本领域中的标准的感兴趣的替代报道基因来进行谱系追踪。
“哺乳动物”是指任何哺乳动物,包含但不限于人、小鼠、大鼠、绵羊、猴子、山羊、兔子、仓鼠、马、牛或猪。
如本文所使用的,“平均释放时间”是在释放测定中一半药剂从载体释放到磷酸盐缓冲盐水中的时间。
如本文所使用的,“原生形态”是指组织组织在很大程度上反映了健康组织中的组织。
“非经典Notch信号传导”是指Notch介导的效应或转录,其主要独立于Mastermind状蛋白(MAML)、CSL/RBPJ(CBF-1、无毛的抑制剂、无毛的Lag-1/重组结合蛋白抑制剂)和引起Hes和Hey靶基因上调的NICD(Notch细胞内结构域)复合物驱动的转录。非经典Notch信号可以包含Jag-1介导的转录、γ-分泌酶活性的增加、Deltex-1介导的效应、Hif-1介导的效应、PI3K介导的效应、mTOR介导的效应、AKT介导的效应、NFκB介导的效应、YY1介导的效应。
“非经典Notch激动剂”是指通过Jag-1上调、γ-分泌酶活性增加、Deltex-1介导的效应、Hif-1介导的效应、PI3K介导的效应、mTOR介导的效应、AKT介导的效应、NFκB介导的效应、YY1介导的效应等机制上调非经典Notch靶标的化合物、蛋白质或分子。
“非经典Notch增效剂”是指与Jag-1激动剂、Deltex-1激动剂、PI3K激动剂或非经典Notch激动剂组合使用时通过Jag-1上调、γ-分泌酶活性增加、Deltex-1介导的效应、Hif-1介导的效应、PI3K介导的效应、mTOR介导的效应、AKT介导的效应、NFκB介导的效应、YY1介导的效应等机制上调非经典Notch靶标的化合物、蛋白质或分子。
如本文所使用的,“非人类哺乳动物”是指非人类的任何哺乳动物。
如在本文的相关上下文中所使用的,术语细胞的“数量”可以是0个、1个或更多个细胞。
如本文所使用的,“柯蒂氏器官”是指感觉细胞(内部和外部毛细胞)和支持细胞所驻留的耳蜗的感觉上皮。
“类器官”或“上皮类器官”是指类似于器官或器官的一部分并具有与所述特定器官相关的细胞类型的细胞簇或聚集体。
“药学上可接受的盐”包含酸加成盐和碱加成盐两者。
“药学上可接受的碱加成盐”是指那些保持游离酸的生物学有效性和性质的那些盐,所述盐不是生物学上或其它方面不希望的。可以通过加成无机碱或有机碱与游离酸来制备这些盐。衍生自无机碱的盐包含但不限于钠盐、钾盐、锂盐、铵盐、钙盐、镁盐、铁盐、锌盐、铜盐、锰盐、铝盐等。例如,无机盐包含但不限于铵盐、钠盐、钾盐、钙盐和镁盐。衍生自有机碱的盐包含但不限于伯胺盐、仲胺盐以及叔胺盐,取代的胺包含天然存在的取代胺、环胺以及碱离子交换树脂、如氨、异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、2-二甲氨基乙醇、2-二乙氨基乙醇、二环己胺、赖氨酸、精氨酸、组氨酸、咖啡碱、普鲁卡因、海巴(hydrabamine)、胆碱、甜菜碱、苯明青霉素(benethamine)、千星青霉素(benzathine)、乙二胺、葡糖胺、甲基葡糖胺、可可碱、三乙醇胺、氨丁三醇、嘌呤、哌嗪、哌啶、N-乙基哌啶、聚胺树脂等。某些实施例中使用的示例有机碱包含异丙胺、二乙胺、乙醇胺、三甲胺、二环己胺、胆碱以及咖啡因。
如本文所使用的,“PI3K激动剂”是引起PI3K、蛋白质和/或通路(如FGF上调和/或AKT磷酸化)的表达、水平和/或活性增加的化合物。在某些情况下,激动剂直接结合并激活PI3K蛋白。在一些情况下,激动剂通过结合并调节一种或多种PI3K通路组分的活性来增加通路的活性,例如,通过抑制通路的一种或多种负调节剂的活性,或通过激活通路的一种或多种上游或下游调节剂。
如本文所使用的,“PI3K增效剂”是当与Jag-1激动剂、Deltex-1激动剂、非经典Notch激动剂或PI3K激动剂组合使用时使PI3K、蛋白和/或通路(如FGF上调和/或AKT磷酸化)表达、水平和/或活性增加的化合物。在某些情况下,激动剂直接结合并激活PI3K蛋白。在一些情况下,激动剂通过结合并调节一种或多种PI3K通路组分的活性来增加通路的活性,例如,通过抑制通路的一种或多种负调节剂的活性,或通过激活通路的一种或多种上游或下游调节剂。
细胞“群体”是指大于1的任何数目的细胞,但优选地为至少1X103个细胞、至少1X104个细胞、至少至少1X105个细胞、至少1X106个细胞、至少1X107个细胞、至少1X108个细胞、至少1X109个细胞、或至少1X1010个细胞。
如本文所使用的,“祖细胞”是指与干细胞一样具有分化成特定类型细胞的趋势,但是已经比干细胞更具特异性并且被推动分化成其“靶”细胞。
如本文所使用的,“增殖期”是组织或细胞暴露于单独的或与Wnt激动剂组合的LSD1抑制剂的持续时间。
在某些实施例中,组合物中的任何给定药剂或化合物的“纯度”可以被具体定义。例如,某些组合物可以包括至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%纯度的药剂,包含所有其间的小数,例如且绝不限制,如通过高效液相色谱法(HPLC)测量的,高效液相色谱法是在生物化学和分析化学中常用的用来分离、鉴定和定量化合物的公知形式柱色谱法。
“参考”是指标准或对照条件(例如,未经测试药剂或测试药剂的组合处理)。
如本文所使用的,“释放测定”是其中药剂从生物相容性基质通过透析膜释放到盐水环境的释放速率的测试。可以通过将30微升组合物置于具有适当截止值的盐水透析袋内的1ml磷酸盐缓冲盐水中,并将透析袋置于37℃下的10mL磷酸盐缓冲盐水中来进行示例性释放测定。可以基于药剂的尺寸来选择透析膜的尺寸,以允许被评估的药剂离开膜。对于小分子释放,可以使用3.5-5kDa截止值。组合物的释放速率可能会随时间变化,并且可能以1小时的增量进行测量。
如本文所使用的,“代表性显微分析样品”描述了测量的平均特征尺寸或数量可以合理地认为代表平均特征尺寸或数量(如果测量了所有相关视野)的细胞培养系统、一部分提取组织或整个提取器官内的足够数量的视野。例如,为了评估柯蒂氏器官上某个频率范围内的毛细胞计数,可以使用ImageJ软件(NIH)来测量耳蜗整个固定架的总长度以及各个计数段的长度。内部毛细胞、外部毛细胞和支持细胞的总数可以在1200-1400μM的四个耳蜗段(顶端、中-顶端、中-基底和基底)的全部或部分中计数,至少有3个100μm场大小的视野被合理地认为是代表性显微分析样品。代表性显微分析样品可以包含视野内的测量值,可以将其作为每个给定距离的细胞进行测量。代表性显微分析样品可以用于评估形态,如细胞-细胞接触、耳蜗结构和细胞组分(例如,束、突触)。
“玫瑰花式图案化”是耳蜗中的特征性细胞布置,其中<5%的毛细胞与其它毛细胞相邻。
术语“样品”是指获得、提供和/或进行分析的体积或质量。在一些实施例中,样品是或包括组织样品、细胞样品、流体样品等。在一些实施例中,样品取自(或是)受试者(例如,人类或动物受试者)。在一些实施例中,组织样品是或包括脑、头发(包含根)、口腔拭子、血液、唾液、精液、肌肉或来自任何内部器官的或与这些中的任何一个相关的癌、癌前或肿瘤细胞。流体可以是但不限于尿液、血液、腹水、胸膜液、脊髓液等。身体组织可以包含但不限于脑、皮肤、肌肉、子宫内膜、子宫和宫颈组织或与这些中的任何一个相关的癌、癌前或肿瘤细胞。在一个实施例中,身体组织是脑组织或脑肿瘤或癌症。本领域普通技术人员应了解,在一些实施例中,“样品”是“原始样本”,因为其从来源(例如,受试者)获得;在一些实施例,“样品”是加工原始样品例如以去除某些潜在地污染的组分、以分离某些组分和/或以纯化所关注的某些组分的结果。
“自我更新”是指干细胞分裂产生一个(非对称分裂)或两个(对称分裂)子细胞的过程,其中子代细胞的发育潜能与母细胞的潜能没有区别。自我更新涉及增殖和维持未分化状态。
“siRNA”是指双链RNA。任选地,siRNA的长度为18、19、20、21、22、23或24个核苷酸,并且在其3'端处具有2个碱基突出端。可以将这些dsRNA引入单个细胞或培养系统。此类siRNA用于下调mRNA水平或启动子活性。
“干细胞”是指具有自我更新和分化成多种细胞谱系能力的多能细胞。
如本文所使用的,“干细胞分化测定”是确定干细胞的分化能力的测定。在示例性干细胞分化测定中,通过分离柯蒂氏器官感觉上皮器官、将上皮解离为单个细胞,从3到7天之间的Atoh1-GFP小鼠中收获初始细胞群体的细胞数,然后将细胞通过40um的细胞过滤器。将大约5000个细胞捕获在40μl培养底物中(例如:Matrigel(科宁(Corning),生长因子降低)),并在24孔板的孔中心放置500μl合适的正在测试的培养基、生长因子和药剂。适当的培养基和生长因子包含带有培养基补充剂的高级DMEM/F12(1X N2、1X B27、2mM Glutamax、10mM HEPES、1mM N-乙酰半胱氨酸和100U/ml青霉素/100μg/ml链霉素)和生长将因子(50ng/ml EGF、50ng/ml bFGF和50ng/ml IGF-1)以及被评估的药剂添加到每个孔中。将细胞在标准细胞培养箱中于37℃和5%CO2下培养10天,每2天更换一次培养基。然后通过去除干细胞增殖检测药剂并用基础培养基和分子驱动分化来培养这些细胞。合适的基础培养基是高级DMEM/F12,其中补充有1X N2、1X B27、2mM Glutamax、10mM HEPES、1mM N-乙酰半胱氨酸和100U/ml青霉素/100μg/ml链霉素,并且用于驱动分化的适当的分子是3μMCHIR99021和5μM DAPT,持续10天,其中每2天更换一次介质。群体中毛细胞的数量可以通过使用GFP的流式细胞术来测量。毛细胞分化水平可以进一步使用qPCR来评估,以测量毛细胞标志物(例如,Myo7a)的表达水平,所述表达水平使用合适且不受监管的参考或管家基因(例如,Hprt)进行归一化。毛细胞分化水平也可以通过对毛细胞标记物(例如肌球蛋白7a、vGlut3、Espin、PMCA、Ribeye、缀合的鬼笔环肽、Atoh1、Pou4f3等)进行免疫染色来评估。毛细胞分化水平也可以通过肌球蛋白7a、vGlut3、Espin、PMCA、Prestin、Ribeye、Atoh1、Pou4f3的蛋白质印记进行评估。
如本文所使用的,“干细胞测定”是其中针对一系列标准测试细胞或细胞群体以确定所述细胞或细胞群体是干细胞还是富含干细胞或干细胞标志物的测定。在干细胞测定中,测试细胞/细胞群体的干细胞特性,例如干细胞标记的表达,并进一步可以选地测试干细胞功能,包含自我更新和分化的能力。使用本领域已知的方法,例如通过PCR、纳米带、免疫染色、RNAseq、RNA杂交或蛋白质印迹分析来测量基因表达。
如本文所使用的,“干细胞增殖测定法”是确定药剂诱导从起始细胞群体产生干细胞的能力的测定法。在示例性干细胞增殖试验中,从Lgr5-GFP小鼠(例如B6.129P2-Lgr5tm1(cre/ERT2)Cle/J小鼠(也称为Lgr5-EGFP-IRES-creERT2或Lgr5-GFP小鼠,Jackson实验室储备编号:008875)通过分离柯蒂氏器官感觉上皮并将上皮解离为单个细胞在0到5天之间来获得初始细胞群体的细胞数量。将大约5000个细胞捕获在40μl培养底物中(例如:Matrigel(科宁(Corning),生长因子降低)),并在24孔板的孔中心放置500μl合适的正在测试的培养基、生长因子和药剂。适当的培养基和生长因子包含带有培养基补充剂的高级DMEM/F12(1X N2、1X B27、2mM Glutamax、10mM HEPES、1mM N-乙酰半胱氨酸和100U/ml青霉素/100μg/ml链霉素)和生长将因子(50ng/ml EGF、50ng/ml bFGF和50ng/ml IGF-1)以及被评估的药剂添加到每个孔中。将细胞在标准细胞培养箱中于37℃和5%CO2下培养10天,每2天更换一次培养基。通过在体外Lgr5活性测定中计数鉴定为Lgr5+的细胞数量来定量Lgr5+细胞的数量。通过用细胞群体中鉴定为Lgr5+的细胞数除以所述细胞群体中存在的细胞总数,可以定量得出Lgr5+的细胞分数。可以通过用毛细胞标记物(例如,MyosinVIIa)染色或使用毛细胞基因的内源报告基因(例如,Pou4f3-GFP、Atoh1-nGFP)并使用流式细胞术进行分析来测量群体中的毛细胞数。通过用细胞群体中鉴定为毛细胞的细胞数除以所述细胞群体中存在的细胞总数,可以定量得出毛细胞的细胞分数。使用本领域已知的方法,例如通过PCR、纳米带、免疫染色、RNAseq、RNA杂交或蛋白质印迹分析,在所述测定中测量基因和/或蛋白质的表达和/或活性。
如本文所使用的,“干细胞标记”可以定义为在干细胞中特异性表达的基因产物(例如蛋白质、RNA等)。一种类型的干细胞标记是直接和特异性支持维持干细胞身份的基因产物。实例包含Lgr5和Sox2。可以使用文献中描述的测定法鉴定其它干细胞标记物。为了确定维持干细胞身份是否需要基因,可以使用功能获得和功能丧失研究。在功能获得研究中,特定基因产物(干细胞标志物)的过度表达将有助于维持干细胞的身份。在功能丧失研究中,干细胞标记的去除会导致干细胞特性的丧失或诱导干细胞的分化。干细胞标记的另一种类型是仅在干细胞中表达但不一定具有维持干细胞身份的特定功能的基因。可以通过比较诸如微阵列和qPCR等检测方法比较分选的干细胞和非干细胞的基因表达特征来鉴定这种类型的标记。这种干细胞标记物可以在文献中找到。(e.g.Liu Q.等人,《国际生物化学、细胞生物学的杂志(Int J Biochem Cell Biol.)》2015Mar;60:99-111.http://www.ncbi.nlm.nih.gov/pubmed/25582750)。潜在的干细胞标记包含Ccdc121、Gdf10、Opcm1、Phex等。可以使用如qPCR、免疫组织化学、蛋白质印迹和RNA杂交等方法测量给定细胞或细胞群体中干细胞标记(例如Lgr5或Sox2)的表达。干细胞标志物的表达也可以使用转基因细胞表达报告基因来测量,所述报告基因可以指示给定的干细胞标志物(例如Lgr5-GFP或Sox2-GFP)的表达。然后可以使用流式细胞仪分析来测量报告基因表达的活性。荧光显微镜也可以用于直接可以视化报告基因的表达。干细胞标志物的表达可以进一步使用用于整体基因表达谱分析的微阵列分析来确定。可以将给定细胞群体或纯化细胞群体的基因表达谱与干细胞的基因表达谱进行比较,以确定2个细胞群体之间的相似性。干细胞功能可以通过菌落形成测定或球形成测定,自我更新测定和分化测定来测量。在集落(或球体)形成测定中,当在适当的培养基中培养时,干细胞应能够在细胞培养表面(例如细胞培养皿)上形成集落,或嵌入细胞培养基质(例如Matrigel)中,或者能够悬浮培养时形成球体。在集落/球形成测定中,将单干细胞以低细胞密度接种在适当的培养基中,并在给定的时间段(7-10天)内增殖。然后对形成的菌落进行计数,并对干细胞标志物的表达进行评分,以作为原始细胞的干性指标。任选地,然后挑出形成的菌落并传代以测试其自我更新和分化潜能。在自我更新测定中,当在适当的培养基中培养时,细胞应在至少一个(例如1、2、3、4、5、10、20等)细胞上保持干细胞标志物(例如Lgr5)的表达。在干细胞分化测定中,当在适当的分化培养基中培养时,细胞应能够产生毛细胞,所述毛细胞可以通过qPCR、免疫染色、蛋白质印迹、RNA杂交或流式细胞仪检测的毛细胞标记表达来鉴定。
“受试者”包含人和哺乳动物(例如,小时、大鼠、猪、猫、狗和马)。在一些实施例中,受试者是哺乳动物,具体地灵长类动物,尤其是人类。在一些实施例中,受试者是家畜,如牛、绵羊、山羊、奶牛、猪等;家禽,如鸡、鸭、鹅、火鸡等;以及家养动物,特别是宠物如狗和猫。在某些实施例中(例如,特别是在研究上下文中),受试者哺乳动物将是例如啮齿动物(例如,小鼠、大鼠、仓鼠)、兔、灵长类动物或如自交系猪等猪。
如本文与耳蜗上皮结合使用的“支持细胞”包含柯蒂氏器官内的不是毛细胞的上皮细胞。这包含内柱细胞、外柱细胞、内指状细胞、Deiter细胞、Hensen细胞、Boettcher细胞和/或Claudius细胞。
“统计学上显著的”意味着结果不太可能偶然发生。统计学显著性可以通过本领域已知的任何方法来测定。常用的显著性度量包含p值,如果零假设为真,则p值是观察到的事件会发生的频率或概率。如果获得的p值小于显著性水平,则拒绝零假设。在简单的情况下,显著性水平限定在0.05或更小的p值。
“基本上”或“实质上”意指几乎完全或彻底,例如,一些给定量的95%或更高。
“增效剂”是指相对于单独使用的每种化合物的增加值,使靶基因表达或蛋白质水平的增加值增加1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍。
“组织”是来自相同来源的相似细胞的集合,它们共同执行特定功能,包含例如耳蜗组织,例如柯蒂氏器官。
“鼓膜”施用是指将组合物跨过鼓膜直接注射到中耳中。
如本文与细胞群体结合使用的“治疗”是指将物质递送到群体以影响结果。在体外群体的情况下,所述物质可以直接(或什到间接)递送给群体。在体内人群的情况下,所述物质可以通过施用传递给宿主受试者。
“媒剂对照”或“对照物”是指用不含药物的载体进行治疗,例如用于体外测定的DMSO,用于中耳递送的泊洛沙姆和/或用于将药物化合物递送到耳蜗的载体或溶液单元格在这里描述。
应当理解,提及的“治疗(treating或treatment)”包括预防以及缓解病症的已确定的症状。状态、障碍、或病症的“治疗(treating或treatment)”包括:(1)预防或延迟在人中发展的状态、病症或病状的临床症状的出现,该人可能患有或易患该状态、病症或病状但是还没有经历或显示该状态、病症或病状的临床或亚临床症状;(2)抑制该状态、病症或病状,即阻止、降低或延迟该疾病的发展或其复发(在维持治疗的情况下)或其至少一种临床或亚临床症状;或(3)减轻或减缓该疾病,即引起该状态、病症或病状或其至少一种临床或亚临床症状的消退。
“治疗有效量”意指当向哺乳动物施用以治疗疾病时,足以实现对该疾病的这种治疗的化合物的量。“治疗有效量”将根据化合物、疾病及其严重程度以及待治疗的哺乳动物的年龄、体重等而变化。
“Wnt激动剂”是指当与另一种化合物组合使用时增加Wnt基因或蛋白质的表达,蛋白质水平和/或活性的药剂。使用本领域已知的方法,例如通过PCR、纳米带、免疫染色、RNAseq、RNA杂交或蛋白质印迹分析来测量基因表达。
如本文所使用的,“Wnt激活”是Wnt信号传导通路的激活。
如本文所使用的,“单独的Wnt”是指当将另一种药剂或药剂的组合的本文所述的活性与“单独的Wnt”的活性进行比较时,是指使用相同浓度的相同Wnt药剂进行共沉淀。
如本文所使用的,术语“烷基”是指直链或支链的饱和烃。例如,烷基可以具有1到8个碳原子(即(C
如本文所使用的,术语“烯基”是指直链或支链的烃基,其包含一个或多个双键并且可以包含具有2到约15个碳原子的二价基团。烯基的实例包含但不限于乙烯基、丙烯基、丁烯基和更高的同系物和异构体。
如本文所使用的,术语“炔基”是指直链或支链的烃基,其包含一个或多个三键并且可以包含具有2到约15个碳原子的二价基团。炔基的实例包含但不限于乙炔基、丙炔基、丁炔基和高级同系物和异构体。
如本文所使用的,术语“卤代”或“卤素”是指氟、氯、溴和碘。
如本文所使用的,术语“芳基”是指单个全碳芳族环或多个稠合全碳环系统,其中至少一个环是芳族的。例如,芳基可以具有6到20个碳原子、6到14个碳原子或6到12个碳原子。芳基包含苯基。芳基还包含具有约9到20个碳原子的多个稠合的环系统(例如,包含2、3或4个环的环系统),其中至少一个环是芳族的并且其中其它环可以是芳族或非芳族的(即碳环)。这样的多个稠环系统可以任选地被在多个稠环系统的任何碳环部分上的一个或多个(例如1、2或3)氧代取代。当价数要求允许时,多个稠环系统的环可以通过稠合,螺环和桥键相互连接。应当理解,如上文所定义的,多个稠密环系统的连接点可以在环系统的任何位置,包含环的芳族部分或碳环部分。
如本文所使用的,术语“杂芳基”是指在环中具有除碳以外的至少一个原子的单个芳族环,其中所述原子选自氧、氮和硫;所述术语还包含具有至少一个这样的芳族环的多个稠环系统,所述多个稠环系统在下面进一步描述。因此,所述术语在环中包含约1到6个碳原子和选自氧、氮和硫的约1-4个杂原子的单个芳族环。如果环是芳族的,则硫和氮原子也可以氧化形式存在。所述术语还包含多个稠合的环系统(例如,包含2、3或4个环的环系统),其中如上定义的杂芳基可以与选自杂芳基的一个或多个环稠合(以形成例如萘啶基,例如1,8-萘啶基)、杂环(形成例如1,2,3,4-四氢萘啶基,例如1,2,3,4-四氢-1,8-萘啶基)、碳环(形成例如5,6,7,8-四氢喹啉基)和芳基(形成例如吲唑基)形成多重稠环系统。因此,杂芳基(单个芳环或多个稠环系统)在杂芳基环内具有约1-20个碳原子和约1-6个杂原子。这样的多个稠环系统可以任选地被稠环的碳环或杂环部分上的一个或多个(例如1、2、3或4)氧代取代。当价数要求允许时,多个稠环系统的环可以通过稠合,螺环和桥键相互连接。应当理解,多个稠环系统的各个环可以相对于彼此以任何顺序连接。还应理解,多个稠合环系统(如上对于杂芳基所定义的)的连接点可以在所述多重稠合环系统的任何位置,包含多个稠合的杂芳基、杂环、芳基或碳环部分环系统以及在多个稠环系统的任何合适原子上,包含碳原子和杂原子(例如氮)。
如本文所使用的,术语“环烷基”是指具有约3到约8个环成员的饱和或部分饱和的环结构,所述环成员仅具有碳原子作为环原子并且可以包含二价基团。环烷基的实例包含但不限于环丙基、环丁基、环戊基、环己基、环己烯、环戊烯基、环己烯基。
术语“杂环基”或“杂环的”是指单环或多环3到24元环,其包含碳和选自氧、磷、氮或硫的杂原子,并且其中不存在离域的π电子(芳族)共享环碳或杂原子。杂环基环的实例包含但不限于氧杂环丁烷基、氮杂环丁烷基、四氢呋喃基、吡咯烷基、恶唑啉基、恶唑烷基、噻唑啉基、噻唑啉基、吡喃基、硫代吡喃基、四氢吡喃基、二氧杂炔基、哌啶基、吗啉基、硫代吡啶基、二氧杂环戊基、哌嗪基、吗啉基、二氧杂环戊基和高甘油基。杂环基或杂环烷基环也可以是稠合或桥接的,例如可以是双环。杂环基的实例还包含但不限于稠环,桥环(例如2,5-二氮杂双环[2,2,1]庚烷)和螺环(例如2,8-二氮杂螺[4,5]癸烷)。
如本文所用,“烷基”、“C
术语“任选取代的烷基”是指未取代的烷基或具有指定取代基置换烃主链的一个或多个碳上的一个或多个氢原子的烷基。此类取代基可以包括例如烷基、烯基、炔基、卤素、羟基、烷基羰氧基、芳基羰氧基、烷氧基羰氧基、芳氧基羰氧基、羧酸酯基、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷基硫代羰基、烷氧基、磷酸酯基、膦酸基、次膦酸基、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰基氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸酯基、硫酸酯基、烷基亚磺酰基、磺酸基、氨磺酰基、磺酰胺基、硝基、三氟甲基、氰基、叠氮基、杂环基、烷基芳基、或者芳香族或杂芳香族部分。
如本文所使用的“烯基”包含长度和可能的取代与上述烷基类似但含有至少一个双键的不饱和脂肪族基团。例如,术语“烯基”包括直链烯基基团(例如,乙烯基、丙烯基、丁烯基、戊烯基、己烯基、庚烯基、辛烯基、壬烯基、癸烯基)和支链烯基基团。在某些实施例中,直链或支链烯基基团在其主链中具有六个或更少碳原子(例如,对于直链为C
术语“任选取代的烯基”是指未取代的烯基或具有置换一个或多个烃主链碳原子上的一个或多个氢原子的指定取代基的烯基。此类取代基可以包括例如烷基、烯基、炔基、卤素、羟基、烷基羰氧基、芳基羰氧基、烷氧基羰氧基、芳氧基羰氧基、羧酸酯基、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷基硫代羰基、烷氧基、磷酸酯基、膦酸基、次膦酸基、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰基氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸酯基、硫酸酯基、烷基亚磺酰基、磺酸基、氨磺酰基、磺酰胺基、硝基、三氟甲基、氰基、杂环基、烷基芳基、或者芳香族或杂芳香族部分。
“炔基”包含长度和可能的取代与上述烷基类似但含有至少一个三键的不饱和脂肪族基团。例如,“炔基”包括直链炔基基团(例如,乙炔基、丙炔基、丁炔基、戊炔基、己炔基、庚炔基、辛炔基、壬炔基、癸炔基)和支链炔基基团。在某些实施例中,直链或支链炔基基团在其主链中具有六个或更少碳原子(例如,对于直链为C
术语“任选取代的炔基”是指未取代的炔基或具有置换一个或多个烃主链碳原子上的一个或多个氢原子的指定取代基的炔基。此类取代基可以包括例如烷基、烯基、炔基、卤素、羟基、烷基羰氧基、芳基羰氧基、烷氧基羰氧基、芳氧基羰氧基、羧酸酯基、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷基硫代羰基、烷氧基、磷酸酯基、膦酸基、次膦酸基、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰基氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸酯基、硫酸酯基、烷基亚磺酰基、磺酸基、氨磺酰基、磺酰胺基、硝基、三氟甲基、氰基、叠氮基、杂环基、烷基芳基、或者芳香族或杂芳香族部分。
其他任选取代的部分(例如任选取代的环烷基、杂环烷基、芳基或杂芳基)包括未取代的部分和具有指定取代基中的一个或多个的部分二者。例如,取代的杂环烷基包括被一个或多个烷基基团取代的那些,如2,2,6,6-四甲基-哌啶基和2,2,6,6-四甲基-1,2,3,6-四氢吡啶基。
如本文所使用的,术语“环烷基”是指具有3到30个碳原子的饱和或部分不饱和的烃单环或多环(例如,稠合,桥接或螺环)系统(例如,C
如本文所用,术语“杂环烷基”是指饱和或部分不饱和的3-8元单环、7-12元双环(稠合,桥接或螺环)或11-14元三环体系(稠合、桥连或具有一个或多个杂原子(例如O、N、S、P或Se)的螺环),例如1或1-2或1-3或1-4或1-5或1-6个独立地选自由氮、氧和硫组成的组的杂原子,例如1、2、3、4、5或6个杂原子或除非另有说明。杂环烷基的实例包含但不限于哌啶基、哌嗪基、吡咯烷基、二恶烷基、四氢呋喃基、异吲哚基、吲哚啉基、咪唑烷基、吡唑烷基、恶唑烷基、异恶唑烷基、三唑烷基、环氧乙烷基、氮杂环丁烷基、噻吩基、噻吩基、1,2,3,6-四氢吡啶基、四氢吡喃基、二氢吡喃基、吡喃基、吗啉基、四氢噻喃基、1,4-二氮杂基、1,4-氧杂基、2-氧杂-5-氮杂双环[2.2.1]庚基、2,5-二氮杂双环[2.2.1]庚基、2-氧杂-6-氮杂螺[3.3]庚基、2,6-二氮杂螺[3.3]庚基、1,4-二氧杂-8-氮杂螺[4.5]癸基、1,4-二氧杂螺[4.5]癸基、1-氧杂螺[4.5]癸基、1-氮杂螺[4.5]癸基、3'H-螺[环己烷-1,1'-异苯并呋喃]-基、7'H-螺[环己烷-1,5'-呋喃[3,4-b]吡啶基]-基、3'H-螺[环己烷-1,1'-呋喃[3,4-c]吡啶基]-基、3-氮杂双环[3.1.0]己基、3-氮杂双环[3.1.0]己-3-基、1,4,5,6-四氢吡咯并[3,4-c]吡唑基、3,4,5,6,7,8-六氢吡啶并[4,3-d]嘧啶基、4,5,6,7-四氢-1H-吡唑并[3,4-c]吡啶茚基、5,6,7,8-四氢吡啶并[4,3-d]嘧啶基、2-氮杂螺[3.3]庚基、2-甲基-2-氮杂螺[3.3]庚基、2-氮杂[3.5]壬基、2-甲基-2-氮杂螺[3.5]壬基、2-氮杂螺[4.5]癸基、2-甲基-2-氮杂螺[4.5]癸基、2-氧杂氮杂螺[3.4]辛基、2-氧杂氮杂螺[3.4]辛基-6-基等。在多环杂环烷基的情况下、杂环烷基中仅一个环需要是非芳族的(例如4,5,6,7-四氢苯并[c]异恶唑基)。
如本文所使用的,术语“芳基”包含具有芳香性的基团,包含“共轭的”或具有一个或多个芳环的多环系统,并且在环结构中不包含任何杂原子。术语芳基包括单价物质和二价物质两者。芳基基团的实例包括但不限于苯基、联苯基、萘基等。方便地,芳基是苯基。
如本文所用,术语“杂芳基”旨在包括由碳原子以及一个或多个杂原子例如1或1-2或1-3或1-4或1-5或1-6个杂原子,或例如1、2、3、4、5或6个杂原子组成的稳定的5元、-6元或7元单环或7元、8元、9元、10元、11元或12元双环芳香族杂环,这些杂原子独立地选自由氮、氧和硫组成的组。氮原子可以是取代的或未取代的(即,N或NR,其中R是H或如所定义的其他取代基)。氮和硫杂原子可以任选地被氧化(即,N→O和S(O)
此外,术语“芳基”和“杂芳基”包括多环芳基和杂芳基基团,例如三环、二环,例如萘、苯并噁唑、苯并二噁唑、苯并噻唑、苯并咪唑、苯并噻吩、亚甲基二氧苯基、喹啉、异喹啉、萘啶、吲哚、苯并呋喃、嘌呤、苯并呋喃、脱氮杂嘌呤、中氮茚。
环烷基、杂环烷基、芳基或杂芳基环可以在一个或多个环位置(例如,成环碳或杂原子,诸如N)被如上所述的取代基取代,这些取代基是例如烷基、烯基、炔基、卤素、羟基、烷氧基、烷基羰氧基、芳基羰氧基、烷氧基羰氧基、芳氧基羰氧基、羧酸酯基、烷基羰基、烷基氨基羰基、芳烷基氨基羰基、烯基氨基羰基、烷基羰基、芳基羰基、芳烷基羰基、烯基羰基、烷氧基羰基、氨基羰基、烷基硫代羰基、磷酸酯基、膦酸基、次膦酸基、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰基氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸酯基、硫酸酯基、烷基亚磺酰基、磺酸基、氨磺酰基、磺酰胺基、硝基、三氟甲基、氰基、叠氮基、杂环基、烷基芳基、或者芳香族或杂芳香族部分。芳基和杂芳基基团也可以与不是芳香族的脂环族环或杂环稠合或桥接,以形成多环体系(例如,四氢萘、亚甲基二氧苯基,如苯并[d][1,3]二恶唑-5-基)。
术语“取代的”意指指定原子上的任何一个或多个氢被一个来自指示组的选择置换,其条件是未超过该指定原子的正常原子价,并且该取代形成稳定的化合物。在取代基是氧代或酮基(即,=O)时,原子上的2个氢原子被置换。酮基取代基不存在于芳香族部分上。如本文所用,环双键是在两个相邻环原子之间形成的双键(例如,C=C、C=N或N=N)。“稳定化合物”和“稳定结构”意在指示足够稳健以便在从反应混合物中分离至可用纯度并且调配为有效治疗剂后继续存在的化合物。
在与取代基的键显示与连接环中两个原子的键交叉时,则此类取代基可以与该环中的任何原子键合。在列出取代基但不指明此类取代基通过哪个原子与具有给定式的化合物的剩余部分键合时,则此类取代基可以经验这个式中的任何原子键合。取代基和/或变量的组合是允许的,但仅在此类组合产生稳定化合物时允许。
在任何变量(例如,R)在化合物的任何成分或式中出现多于一次时,其在每次出现时的定义与其在其它每次出现时的定义无关。因此,例如,如果基团示出为被0-2个R部分取代,则基团可能任选地被多达三个R部分取代并且R在每次出现时独立地选自R的定义。同样,取代基和/或变量的组合是允许的,但是仅当这样的组合产生稳定的化合物时。
如本文所用,术语“羟基”(hydroxy或hydroxyl)包括具有-OH或-O-的基团。
如本文所用,术语“卤基”或“卤素”是指氟、氯、溴和碘。
术语“卤代烷基”或“卤代烷氧基”是指被一个或多个卤素原子取代的烷基或烷氧基。
术语“任选取代的卤代烷基”是指未取代的炔基或具有置换一个或多个烃主链碳原子上的一个或多个氢原子的指定取代基的炔基。此类取代基可以包括例如烷基、烯基、炔基、卤素、羟基、烷基羰氧基、芳基羰氧基、烷氧基羰氧基、芳氧基羰氧基、羧酸酯基、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷基硫代羰基、烷氧基、磷酸酯基、膦酸基、次膦酸基、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰基氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸酯基、硫酸酯基、烷基亚磺酰基、磺酸基、氨磺酰基、磺酰胺基、硝基、三氟甲基、氰基、叠氮基、杂环基、烷基芳基、或者芳香族或杂芳香族部分。
术语“烷氧基(alkoxy或alkoxyl)”包括共价连接到氧原子的取代的和未取代的烷基、烯基和炔基基团。烷氧基基团或烷氧基的实例包括但不限于甲氧基、乙氧基、异丙氧基、丙氧基、丁氧基和戊氧基。取代的烷氧基基团的实例包括卤化烷氧基基团。烷氧基基团可以被诸如以下的基团取代:烯基、炔基、卤素、羟基、烷基羰氧基、芳基羰氧基、烷氧基羰氧基、芳氧基羰氧基、羧酸酯基、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷基硫代羰基、烷氧基、磷酸酯基、膦酸基、次膦酸基、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰基氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸酯基、硫酸酯基、烷基亚磺酰基、磺酸基、氨磺酰基、磺酰胺基、硝基、三氟甲基、氰基、叠氮基、杂环基、烷基芳基、或者芳香族或杂芳香族部分。卤素取代的烷氧基基团的实例包括但不限于氟甲氧基、二氟甲氧基、三氟甲氧基、氯甲氧基、二氯甲氧基和三氯甲氧基。
实例
实例1:材料与方法
新生儿Lgr5-EGFP-IRES-Cre-ER小鼠(Jackson实验室,品种8875)用于分析小分子对耳蜗干细胞扩增的影响(参见Barker等人,《自然(Nature)》449,1003–7(2007))。所述品种允许对EGFP细胞进行可视化和定量。
所有动物研究均根据美国国立卫生研究院指南在批准的机构规程下进行。使用新生动物解剖耳蜗,将柯蒂氏器官(感觉上皮)与血管纹(离子转运上皮)和耳蜗轴(神经组织)分开。然后收集上皮并用TrypLE处理15–20分钟以获得单细胞。然后将细胞过滤(40mm),并悬浮在Matrigel(科宁)圆顶中,以每孔0.5耳蜗接种的3D培养。
Lgr5细胞的扩增:将细胞在3D系统中培养,并浸入DMEM和F12的无血清1:1混合物中7天,所述混合物补充有Glutamax(GIBCO)、N2、B27(Invitrogen)、EGF(50ng/mL;Chemicon)、bFGF(50ng/mL;Chemicon)、IGF-1(50ng/mL;Chemicon)和小分子。培养基每隔一天进行更换。一式三份或一式四份进行治疗。
如上所述,从Lgr5 GFP+小鼠解剖柯蒂氏器官,并作为单个细胞解离。背景培养基包含与上述相同浓度的相同补充剂和生长因子。用于图像定量的测定在96孔黑色平板中进行,所述黑色平板具有清晰的底部,细胞以500k细胞/mL的细胞密度包埋在50%Matrigel中,每个孔中均施加50uL。培养细胞7天,每3-4天更换培养基。暴露于实验条件(例如小分子)7天后,将培养基从培养物中移出,并替换为以1:2000稀释度稀释的含有Hoescht的培养基,最终浓度为5ug/mL(200uL/孔)。然后将板置于37℃的细胞培养箱中1小时。然后除去含有Hoescht的培养基,并加入200uL/孔的细胞恢复溶液。然后将板在冰上的塑料包裹的(例如,Saran wrap)CoolRack TM上温育80分钟。接下来,将板在2300RPMs下离心5分钟(Beckman Coulter Allegra 6R离心机;GH 3.8A板转子;环境温度)。然后使用明场、蓝色(Hoescht)和绿色(Lgr5 GFP)3个通道将细胞在Celigo上成像。增殖的细胞集落在蓝色通道和绿色通道中被捕获为总对象。将绿色Lgr5 GFP+细胞集落量化为总GFP(+)细胞面积,而将蓝色hoescht染色集落量化为总细胞面积。使用总GFP(+)细胞面积除以总细胞面积乘以100来计算%GFP(+)细胞面积。汇总所有结果,并用于确定实验条件(例如小分子)对扩增的影响和富集的Lgr5细胞群体。
首先用100mg/kg硫代丁巴比妥钠(仲丁硫巴比妥,西格马(Sigma),密苏里州圣路易斯(St Louis,MO))麻醉动物,并在氧气中维持0.8到1.2%的异氟烷。通过气管套管对动物进行机械通气。潮气量设定为维持5%潮气量末CO
通过耳后切口和听觉大疱的侧向开口获得进入LSCC的通道。为了准备用于注射和采样的LSCC,用牙钻将运河上的骨头打薄,必要时去除面神经的一个分支,在某些动物中,所述分支平行于LSCC短距离延伸。当通过变薄的骨头可以看到根管时,将一层薄的氰基丙烯酸酯胶涂到干燥的骨头上,然后再涂上两部分的有机硅粘合剂(Kwik-Cast,WorldPrecision Instruments,Sarasota,FL)。将有机硅薄薄地涂在根管上,但在周围形成多层,以形成疏水杯状结构。使用30o House镫骨拾取件(N1705 80,Bausch and Lomb Inc.),通过粘合剂和骨头在运河壁上开孔30–40μM。镐的尖端很锋利,但是迅速变宽,从而使进入运河和对内淋巴系统的潜在损害最小。
在注射结束后的15分钟到4小时内,从LSCC采集了多个淋巴样品。首先将移液管移开,然后用镐头将将其密封在适当位置的氰基丙烯酸酯胶滴打碎,注意不要让硅胶杯完好无损。开窗扩增到50–70μM,以允许周淋巴漏出,并在钝尖的毛细管(#53432–706,5μL,VWRInternational,Radnor,PA)中收集新出现的周淋巴。每个毛细管的标称体积为1μL。在20–30分钟的时间段内,依次收集了十六到二十个1μL外淋巴样本。立即用校准解剖显微镜测量每个样品的长度。将样品排入稀释液(25uL的50:50乙腈)中,合并成对的样品,每次测量8-10次。所有数据均表示为每个实验中8-10个测得的样品。
通过LCMS测定化合物浓度
沿淋巴周间隙的药物梯度是直接从多个样品中测量的,这些样品是通过“顺序采样”技术获得的。当根尖穿孔时,脑脊髓液(CSF)通过耳蜗导水管进入ST的基弯,驱逐外淋巴,沿顶端方向推动外淋巴。收集的第一个样品来自顶点附近的外周淋巴,而随后的每个样品都来自逐渐靠近基部的sc骨位置的周围淋巴。推出所有ST旁淋巴后,随后的样本包含已通过标量的CSF。以这种方式收集的样品可以对沿ST长度的药物梯度进行定量。耳蜗是从耳蜗尖收集的,是在10–20分钟内收集的一系列单个1μL样品。为了制备用于样品采集的耳蜗,首先去除覆盖在耳蜗顶点上的中耳粘膜,并使骨骼干燥。将一层薄薄的氰基丙烯酸酯胶(Permabond 101;Permabond,Pottstown,PA)涂在干燥的骨头上,然后在硅橡胶上建立两层有机硅粘合剂(Kwik-Cast,World Precision Instruments,Sarasota,FL)。边缘形成疏水杯。取样时,使用30°House镫骨拾取件(N1705 80,Bausch and Lomb Inc.)通过胶粘剂在胶粘剂的顶点处开孔30–40μM。开窗处流出的清澈,未被污染的流体积聚在疏水表面上。用手持的钝头尖细的毛细管(VWR 53432–706;VWR Radnor,PA)收集液体,每个标有1μL的标称体积,收集时间为1-2分钟。用校准解剖显微镜测量其毛细管中每个样品的长度,从中确定确切的样品体积。以这种方式收集了十个单独的样本,第一个样本代表顶点,每个随后的样本代表基点,最后到达CSF。将样品排入稀释液(25uL的50:50乙腈)中,并通过LCMS测定化合物浓度。
实例2:PTEN抑制增强耳蜗祖细胞的扩增
利用CHIR的抑制GSK3引起培养的耳蜗Lgr5祖细胞的扩增和富集。如图1A和B所示,通过添加0.1uM的PTEN抑制剂/PI3K激动剂SF1670进一步增强了培养的耳蜗Lgr5祖细胞的扩增和富集。类似地,如图3所示,通过在3uM加入PTEN抑制剂/PI3K增效剂VO-Ohpic(VO),也可以增强CHIR诱导的人工耳蜗Lgr5祖细胞的扩增。
实例3:与JAG1协同上调相关的对祖细胞扩增的PTEN效应
如图3所示,CHIR对GSK3的抑制上调了Jag-1,而VO对PTEN的抑制并未上调Jag-1。然而,如图3所示,在3uM时,VO-Ohpic对PTEN的抑制作用与GSK3抑制作用与CHIR的结合可以协同增强Jag-1的上调作用。因此,增强耳蜗祖细胞扩增的PTEN抑制剂作用与Jag1的协同上调相关。图4显示了通过蛋白质印迹分析分析的这些效应
实例4:通过PTEN抑制来增强耳蜗祖细胞的扩增和JAG1的上调与HDAC的抑制无关
如图5所示,VO-Ohpic对PTEN的抑制作用不会引起HDAC抑制的可以检测的增加。相反,在有和没有GSK3抑制的情况下,HDAC抑制剂VPA引起HDAC抑制的浓度依赖性增加。在一起,这些数据表明可以在没有HDAC抑制的情况下实现耳蜗细胞增殖的增强和Jag1的上调。
实例5:J
如图6所示,与Jag-1肽的Jag-1拮抗作用增强了CHIR诱导的Lgr5+细胞增殖,这进一步表明Jag-1的上调介导了耳蜗祖细胞的扩增。
实例6:FOXO1抑制增强了耳蜗祖细胞的扩增和上调J
如图7所示,用AS1842856(EFI-A)抑制FOXO 1以浓度依赖的方式增强了耳蜗祖细胞的扩增。此外,如图8A和B所示,当AS1842856(425nM)与VPA(1mM)结合时,Lgr5细胞富集。图9和10示出了如通过qPCR和蛋白质印迹测定的,利用AS21842856(EFI-A)的FOXO 1抑制会上调Jag-1表达,这通过添加VPA(EFI-A-V)而增强。
将这些值相对于媒剂进行归一化,然后将媒剂设置为0(即从所有媒剂中减去1)。
实例7:HIF1-α激活增强耳蜗祖细胞的扩增
如图11所示,用1,4-DPCA激活HIF1-α不会增殖或富集Lgr5+耳蜗祖细胞。但是,如图12所示,1,4-DPCA(370nM)与CHIR(4μM)和VPA(1mM)组合可以增强Lgr5 GFP+祖细胞的增殖和富集,超过CHIR和VPA。
实例8:HIF-PH抑制增强了耳蜗祖细胞的扩增
如图13所示,用FG-2216抑制HIF-PH不会增殖或富集Lgr5+耳蜗祖细胞。但是,如图14A所示,与CHIR(4μM)结合使用的FG-2216(30μM)增强了CHr(4μM)或CHIR(4μM)和VPA(1mM)的Lgr5 GFP+祖细胞增殖。另外,FG-2216(30μM)与CHIR(4μM)组合可以富集Lgr5 GFP+祖细胞富集(图14B)。另外,图15表明,与CHIR(4μM)和CHIR(4μM)加VPA(1mM)、(4μM)加VPA(1mM),与CHIR(4μM)加VPA(1mM)结合使用时,HIF1-PH抑制剂FG-2216(30μM;FG)可以增殖Lgr5 GFP+祖细胞显示出Lgr5 GFP+祖细胞增殖的富集趋势超过CHIR(4μM)加VPA(1mM)。
如图16所示,用达普司他抑制HIF-PH不会增殖或富集Lgr5+耳蜗祖细胞。如图17A所示,达普司他(1.11μM)与CHIR(4μM)和VPA(1mM)结合不能比CHIR(4μM)或CHIR(4μM)和VPA(1mM)增强Lgr5 GFP+祖细胞的增殖。但是,如图17B所示,当与CHIR(4μM)加VPA(1mM)结合使用时,达普司他达比CHIR(4μM)和CHIR(4μM)加VPA(1mM)增强Lgr5 GFP+祖细胞增殖的富集。
- 用于通过上调JAG-1来生成毛细胞的组合物和方法
- 用于再生毛细胞和/或支持细胞的方法及组合物
