一种人脐带间充质干细胞制剂及其应用
文献发布时间:2023-06-19 12:05:39
技术领域
本申请属于干细胞应用技术领域,尤其是涉及一种人脐带间充质干细胞制剂及其应用;还涉及一种带有绿色荧光标记的人间充质干细胞及其应用。
背景技术
糖尿病是一种慢性代谢性疾病,其发病率正逐年增加,现阶段影响着全球9.5%的人群,预计到2030年,影响的人数或将突破全球人口的50%。糖尿病足溃疡(Diabetic footulceration,DFU)是糖尿病的主要并发症之一,国际糖尿病足工作组(The InternationalWorking Group on the Diabetes Foot,IWGDF)将其定义为糖尿病患者足踝以下的全层皮肤损伤,这种损伤与糖尿病神经病变和周围动脉疾病相关。
据估计,平均每30s全球就有一个人因为糖尿病足导致截肢(参见Boulton AJ,Vileikyte L,Ragnarson-Tennvall G,&Apelqvist J(2005).Lancet(London,England)366(9498):1719-1724.)。然而,局部的缺血、感染、神经病变和代谢紊乱会延迟足部伤口愈合,这对患者和临床医生来说都是治疗糖尿病足所面临的严峻挑战。糖尿病足不仅仅是医学问题,更是社会问题和经济问题。糖尿病足严重影响患者的生活质量乃至生命,同时治疗费用及相关社会经济问题给个人和国家带来沉重负担。
伤口愈合是一个动态的复杂过程,包括止血、炎症、增生、重塑四个重叠阶段,糖尿病伤口愈合是一个重要的问题,伤口的形成和外周血管疾病、创伤、感染和神经并发症之间互相交叉,所以DFU常发生在缺血、感染、神经病变和代谢紊乱的环境中,导致伤口愈合不良和治疗方案不佳(参见Bakker K,Apelqvist J,Lipsky BA,&Van Netten JJ(2016)Diabetes/metabolism research and reviews 32Suppl 1:2-6.)。目前临床上传统干预糖尿病足的方法包括控制血糖、伤口局部反复清创、抗感染、改善下肢血供、持续负压吸引、高压氧干预等,对于下肢缺血严重的糖尿病足患者则采用下肢动脉腔内介入或下肢动脉旁路移植手术进行下肢血流重建(参见Lipsky BA,et al.(2016).Diabetes/metabolismresearch and reviews 32Suppl 1:45-74.和Lopes L,et al.(2018).Stem Cell ResTher 9(1):188.),但以上各种方法均不能达到彻底治愈这一预期效果。
近年来,干细胞移植治疗糖尿病足的应用越来越广泛,移植后的干细胞能够促进新生血管的形成,改善和恢复肢体血流,改善缺血屏障。可用于移植的干细胞主要来源有骨髓、外周血、脐带血、脐带组织和脂肪,根据来源,可以将干细胞分成单核细胞(mononuclearcells,MNCs)、内皮祖细胞(endothelial progenitor cells,EPCs)或间充质干细胞(mesenchymal stem cells,MSCs)。间充质干细胞作为干细胞的一个重要分支,其来源于发育早期的中胚层和外胚层,于1976年被Friedenstein首次发现,这些细胞有分化成成骨细胞、软骨细胞、脂肪细胞、肌肉细胞和神经细胞的潜力。
MSCs可分为多种类型,包括脐带间充质干细胞(Human Umbilical Cord-DerivedMesenchymal Stem Cells,UC-MSCs)、骨髓间充质干细胞(Bone Marrow Mesenchymal StemCells,BM-MSCs)、脂肪干细胞(Adipose-derived Stem Cells,ADSCs)等等。研究表明,BM-MSCs移植以后慢性缺血肢体的血流量增加,结合纤维蛋白喷剂的自体BM-MSCs加速糖尿病人和糖尿病鼠的伤口愈合。临床上常用的自体BM-MSCs移植虽然不存在免疫排斥和道德冲突,但获得的病人BM-MSCs质量不佳、数量不足,获取BM-MSCs过程存在较高风险,不能完全满足临床治疗的要求。ADSCs是干细胞的丰富来源,且能在较低风险情况下大量获取且免疫原性低,Maharlooei MK等研究表明ADSCs移植有助于糖尿病小鼠皮肤溃疡的愈合(参见Diabetes research and clinical practice 93(2):228-234)。但从慢性缺血性并发症患者的组织分离的ADSCs的分化和增殖能力比来自健康人的细胞更弱,因此糖尿病患者自体的ADSCs可能不是理想的干细胞来源。UC-MSCs含量丰富,安全,易于收集且加倍时间短,且具有较低的免疫原性。
细胞的给药途径和给药方案的可变性也会不同程度的影响糖尿病足的治疗效果。由于细胞治疗的关键限制是植入率低,因此选择最佳的细胞移植方式是未来研究的希望。有几种将细胞输送到伤口部位的方法,包括局部和全身注射、直接局部移植和借助于支架局部移植等。Duscher D等报道全身注射移植细胞具有伤口部位细胞沉积、细胞磨损率高、定位差、组织靶向性差、限制细胞存活等缺点(参见Duscher D,et al.(2016).Gerontology62(2):216-225.);Garg RK等报道局部注射细胞在伤口治疗中应用较多,但是局部注射过程中的剪切损伤同样会降低注射细胞的存活率(参见Garg RK,et al.(2014).Stem CellsTransl Med 3(9):1079-1089.)。
发明内容
本发明的目的在于提供一种hUC-MSCs细胞制剂,对糖尿病足的创面愈合提供新的人间充质干细胞治疗手段。另外,本发明目的还在于还提供带有绿色荧光标记的人间充质干细胞,为移植后干细胞的示踪及机制研究提供有力工具。
首先,第一方面本发明提供了一种用于促进皮肤创面愈合的hUC-MSCs细胞制剂,包含hUC-MSCs细胞和纤维蛋白凝胶;其中,所述纤维蛋白凝胶用作hUC-MSCs细胞移植时的支架。
优选地,所述的细胞制剂,其中每1×10
本发明第二方面还提供了所述的hUC-MSCs细胞制剂在制备哺乳动物皮肤创面愈合药物中的应用,优选地,在制备治疗糖尿病皮肤慢性溃疡药物中的应用。
更进一步的,所述hUC-MSCs细胞制剂在制备哺乳动物皮肤创面愈合药物中的应用,特别是在制备治疗糖尿病皮肤慢性溃疡药物中的应用,包括以下步骤:先用纤维蛋白原溶液重悬hUC-MSCs细胞,然后将其均匀滴加至创面,随后在创面处均匀滴加等体积的凝血酶溶液,待成胶后粘上敷贴用以维持细胞存活所需的湿润无菌环境。
上述应用,其中所述纤维蛋白原溶液的浓度为5~30mg/ml,所述凝血酶溶液浓度为20~50U/ml,更优选地,所述纤维蛋白原溶液的浓度为10mg/ml,所述凝血酶溶液浓度为25U/ml。
本发明第三方面还提供了一种带有绿色荧光标记的人脐带间充质干细胞(EGFP-hUC-MSCs细胞),由人脐带间充质干细胞用EGFP标记得到;其中,所述EGFP为增强绿色荧光蛋白。
进一步的,所述EGFP-hUC-MSCs细胞,通过以下方法制备得到:
S1:从脐带中分离人脐带间充质干细胞进行消化传代;
S2:将人脐带间充质干细胞进行扩增培养及鉴定;
S3:构建EGFP标记的hUC-MSCs细胞,即得EGFP-hUC-MSCs细胞。
进一步的,所述EGFP-hUC-MSCs细胞,其中S1包括以下步骤:
S1-1:将脐带中的血液用生理盐水冲洗干净,剪成小段,完全浸泡于“PBS+双抗”保存液中;
S1-2:用含1%双抗的PBS溶液冲洗脐带表面;
S1-3:分离脐动脉、脐静脉以及脐带表面的外膜,将脐带切成小段,于培养箱中培养,细胞长至80%-90%融合率时,开始消化传代。
进一步的,上所述EGFP-hUC-MSCs细胞,其中S2包括以下步骤:
S2-1:将S1消化传代得到的细胞群体进行扩增,优选地在含有10%胎牛血清的DMEM/F12培养基于37℃含5%CO
S2-2:细胞长至80%~85%融合率时,取出两份分别更换成脂诱导培养基和骨诱导培养基培养,并分别进行油红O染色分析和茜素红S染色分析;优选地,更换成脂诱导培养基,每2天换液,培养14天后进行油红O染色分析;更换成骨诱导培养基,每3天换液,培养2-4周后进行茜素红S染色分析;
S2-3:离心收集细胞,流式检测CD34、CD45、CD90和CD105指标。
进一步的,所述EGFP-hUC-MSCs细胞,其中S3包括以下步骤:
S3-1:取指数生长期的293T细胞传至大皿中,细胞数在70%-80%37℃、5%CO
S3-2:取2个EP管,在一号管中将Lipo 2000加入Opti MEM中混匀后静置,在二号管中将Plvx-EGFP、VSV-G、PMDL、RSV慢病毒质粒加入Opti MEM中混匀后静置,将一号管中液体滴加至二号管,混匀后室温静置;
S3-3:将步骤S3-2静置后的液体滴加至预热的DMEM+10%FBS培养基中,混匀,弃去细胞旧液,将混合物沿壁滴加至大皿中,补充新鲜完全培养基进行培养,然后收集病毒液并离心收集上清液;
S3-4:将Lenti X浓缩液与S3-3收集的上清液混合,放置过夜后离心弃上清,留灰白色沉淀;
S3-5:使用冷PBS重悬灰白色沉淀,直接感染人脐带间充质干细胞,获得EGFP-hUC-MSCs细胞。
进一步,所述EGFP-hUC-MSCs细胞,其中所述流式检测CD34、CD45、CD90和CD105指标包括以下步骤:
S2-31:将S2-3收集的细胞用含0.5%BSA的PBS重悬;
S2-32:向细胞重悬液中加入Fc blocker,冰浴;然后加入0.5%BSA的PBS,分装八管;
S2-33:在每一管中分别加入等体积的CD34 PerCP Cy5、CD45 FITC、CD90 APCCy7、CD105 PE、control PerCP Cy5、control FITC、APC Cy7、control PE,然后置于4℃震荡1~2小时;
S2-34:在每一管加入含0.5%BSA的PBS,瞬离并洗涤;
S2-34:用含0.5%BSA的PBS将细胞重悬,流式细胞法测CD34、CD45、CD90和CD105表达量。
本发明第四方面还提供了一种所述EGFP-hUC-MSCs细胞在移植后干细胞的示踪和机制研究中的应用。
本发明提供的hUC-MSCs细胞制剂,借助纤维蛋白凝胶作为细胞移植时的支架,为hUC-MSCs细胞提供更利于存活的三维环境,有利于其长时间发挥促修复作用,本发明所述的应用中,待成胶后粘上敷贴,有利于维持细胞存活所需的湿润无菌环境,同时能起到一定的抵抗皮肤皱缩作用。
本发明提供的EGFP-hUC-MSCs细胞,通过采用EGFP对hUC-MSCs进行标记,实现了移植细胞在体内的示踪及作用机制的探索。并且采用本发明所述的EGFP-hUC-MSCs细胞验证了本发明提供的hUC-MSCs细胞制剂能够促进VEGFA的表达,促进血管的新生,加速创面愈合,特别是能够显著加速糖尿病创面的愈合,促进再上皮化,为糖尿病足患者提供了新型治疗方案。
附图说明
下面结合附图和实施例对本申请的技术方案进一步说明。
图1是EGFP-hUC-MSCs细胞的体外示踪图。
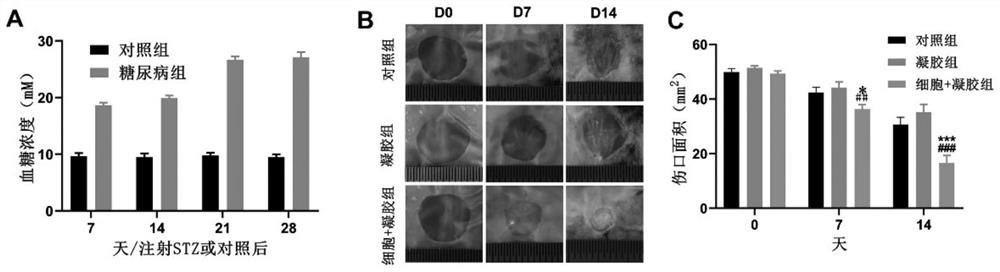
图2是EGFP-hUC-MSCs细胞加速糖尿病创面的愈合效果图;
其中2(A)显示的是糖尿病模型小鼠血糖浮动情况;图2(B)显示的是对照组、凝胶组、细胞组在不同时间点创面的大小宏观图;图2(C)显示的是对照组、凝胶组、细胞组在不同时间点创面的大小统计图。
图3是EGFP-hUC-MSCs细胞在糖尿病皮肤创面的存活的免疫荧光结果;免疫荧光结果显示,hUC-MSCs在纤维蛋白凝胶提供的三维环境下至少可以在糖尿病皮肤创面处存活7天,从而更加有效的发挥促修复作用。
图4是EGFP-hUC-MSCs加速糖尿病创面的愈合效果;
其中,图4(A)显示糖尿病创面修复14天的组织的HE染色结果;
图4(B)显示对照组、凝胶组、细胞组在修复的第14天的表皮间隔的统计结果;
图4(C)显示对照组、凝胶组、细胞组在修复的第14天创面中心区域的K14免疫荧光染色结果。
图5是EGFP-hUC-MSCs促进新生血管的形成效果图;
其中,图5(A)显示对照组、凝胶组、细胞组在修复的第14天的α-SMA免疫荧光染色结果;
图5(B)显示α-SMA+的血管数量统计结果;
图5(C)显示对照组、凝胶组、细胞组创面组织内VEGFA的蛋白质免疫印迹;
图5(D)显示蛋白质免疫印迹灰度统计结果。
具体实施方式
以下结合具体实施例对本发明的技术方案以及有益效果做进一步说明,需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。
制备实施例:
一、人脐带间充质干细胞(human Umbilical Cord Mesenchyreal Stem Cells,hUC-MSCs)的分离
1)将脐带中的血液用生理盐水冲洗干净,然后剪成约两厘米的小段,完全浸泡于“PBS+双抗”保存液中,4℃运输;
2)用PBS(含1%双抗)溶液冲洗脐带表面的消毒液及血液;
3)在冰台上的PBS溶液中分离脐动脉,脐静脉以及脐带表面的外膜;
4)将脐带切成0.5cm小段,并将其均匀的平铺在10cm培养皿中,加入约4ml培养基,封口膜封住培养皿约3/4的周长,置于37℃培养箱中培养,酌情换液;
5)细胞长至80%-90%融合率时,消化传代即可。
二、人脐带间充质干细胞的扩增培养及鉴定
1)将前述步骤一得到的细胞群体进行扩增,在含有10%胎牛血清的DMEM/F12培养基中,37℃含5%CO
2)细胞长至80%融合率时,更换成脂诱导培养基,每2天换液,培养14天后进行油红O染色分析;
3)细胞长至80%融合率时,更换成骨诱导培养基,每3天换液,培养2-4周后进行茜素红S染色分析;
4)离心收集细胞,流式检测CD34、CD45、CD90和CD105指标:
a.用1ml含0.5%BSA的PBS重悬细胞,短暂离心两遍,弃上清;
b.将细胞重悬在95ul含0.5%BSA的PBS中,并加入5ul Fc blocker,冰浴30min;
c.加入800ul 0.5%BSA的PBS,100ul/管,共分装八管;
d.在每一管中分别加入5ul CD34 PerCP Cy5、5ul CD45 FITC、5ul CD90 APCCy7、5ul CD105 PE或5ul control PerCP Cy5、5ul control FITC、5ul APC Cy7、5ulcontrol PE 4℃震荡一小时;
e.在每一管加入1ml含0.5%BSA的PBS,瞬离,洗两次;
f.用1ml 0.5%BSA的PBS将细胞重悬,流式细胞法测CD34、CD45、CD90和CD105表达量。
以上,通过组织贴壁法分离得到人脐带间充质干细胞,并在含有10%FBS的DMEM/F12培养基里培养,通过流式细胞法检测CD34、CD45、CD90、CD105阳性比例分别为0.35%、0.15%、99.9%、99.8%,通过成脂、成骨实验成功得到脂滴和骨结节,因此确定得到高纯度人脐带间充质干细胞。
三、EGFP-hUC-MSCs细胞的构建
1)取指数生长期的293T细胞,将其传至大皿中,细胞数在70%-80%37℃、5%CO
2)取2个1.5ml的EP管,在一号管中将50ul Lipo 2000加入450ul Opti MEM中混匀后静置片刻,在二号管中将Plvx-EGFP、VSV-G、PMDL、RSV慢病毒质粒加入450ul Opti MEM中混匀后静置片刻,将一号管中液体小心轻柔地滴加至二号管,混匀后室温静置10分钟;
3)预热4ml DMEM+10%FBS培养基;
4)将步骤2静置好的液体滴加至步骤3预热的培养基中,混匀;
5)弃去细胞旧液,将混合物沿壁小心滴加至大皿中;
6)6-8h后补充新鲜完全培养基至10ml,37℃、5%CO
7)将培养48h后的病毒液收集入15ml离心管中,500g离心10min收集上清液;
8)将上清液转移至15ml离心管中,并将1体积的Lenti X浓缩液与3体积的上清液混合,4℃过夜;
9)第二天取出,1500x g 4℃离心45min弃上清,留灰白色沉淀;
10)使用75μl冷PBS轻轻地将沉淀重悬;
11)将病毒分装后置于-80℃进行保存或直接感染人脐带间充质干细胞,获得EGFP-hUC-MSCs细胞。
以上通过用高滴度慢病毒感染hUC-MSCs细胞,经荧光显微镜观察鉴定EGFP-hUC-MSCs构建成功,可用于hUC-MSCs的体外及体内示踪(如附图1所示)。
试验方法及结果:
一、EGFP-hUC-MSCs对糖尿病皮肤慢性溃疡的治疗效果
1)取7~8周的雄性C57BL/6J小鼠高脂饲料(60kcal%)喂养一周后,以50mg/kg的剂量连续5天腹腔注射STZ。注射完成5天后,测定小鼠的血糖,随机血糖≥16.7mmol/L即为造模成功。小鼠持续高血糖2周后,在小鼠背部制造两个直径8mm的全皮层缺损创面。
2)选取P3-P5代次EGFP-hUC-MSCs细胞用于创面治疗,选取纤维蛋白凝胶作为细胞移植时的支架,在每个创面施加1×10
3)分别在治疗的第0、7、14天拍照记录创面大小并进行数据统计,留取创面处新生组织经固定、脱水后包埋,进行组织学染色。
如图2,结果显示糖尿病小鼠造模成功,血糖一直维持在高血糖状态。经过制造皮肤全层缺损后,细胞组的治疗显著加速糖尿病小鼠创面的愈合,在第14天,细胞组创面面积减少至16mm
分别收集修复第3天、第7天的创面组织检测hUC-MSCs存活情况,如图3,免疫荧光结果显示hUC-MSCs在纤维蛋白凝胶提供的三维环境下至少可以在糖尿病皮肤创面处存活7天,从而更加有效的发挥促修复作用。
二、EGFP-hUC-MSCs对糖尿病皮肤慢性溃疡的治疗作用的组织学观察
组织固定后,常规石蜡包埋,切片。
1)HE染色
a.切片用二甲苯脱蜡,经各级乙醇水洗:二甲苯(I)5分钟→二甲苯(Ⅱ)5分钟→100%乙醇2分钟→95%乙醇1分钟→80%乙醇1分钟→75%乙醇1分钟→蒸馏水洗2分钟。
b.苏木素染液染色4分钟后用自来水冲洗。
c.分化液分化30s后自来水浸泡15min。
d.伊红染液染色40s后自来水冲洗。
e.常规脱水,透明,封片:95%乙醇(I)1min→95%乙醇(Ⅱ)1min→100%乙醇(I)1min→100%乙醇(Ⅱ)1min→二甲苯石碳酸(3:1)1min→二甲苯(I)1min→二甲苯(Ⅱ)1min→中性树脂封固。
2)K14、α-SMA、GFP免疫荧光染色
a.切片用二甲苯脱蜡,经各级乙醇水洗:二甲苯(I)5分钟→二甲苯(Ⅱ)5分钟→100%乙醇2分钟→95%乙醇1分钟→80%乙醇1分钟→75%乙醇1分钟→蒸馏水洗2分钟。
b.组织切片置于盛满柠檬酸抗原修复液(50X需稀释至1X使用)的修复盒中,于微波炉内进行抗原修复,低火20min,自然冷却后将玻片置于PBST(PBS含0.1%Triton X-100)中,在脱色摇床上轻轻晃动洗涤3次,每次5min。
c.切片稍甩干后用组化笔在组织周围画圈,防止液体流失。在圈内滴加5%的BSA室温孵育封闭1h。
d.轻轻甩掉封闭液,在切片上滴加按比例配好的一抗,将切片平放于湿盒内(内加少量水防止抗体蒸发),4℃过夜孵育。
e.玻片置于PBST中,在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在阻水圈内滴加相应的荧光二抗覆盖组织,室温避光孵育60min。
f.玻片置于PBST中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加DAPI染液,室温避光孵育15min。
g.玻片置于PBST中在脱色摇床上晃动洗涤3次,每次5min。用棉签擦掉阻水圈后滴加10ul抗荧光淬灭封片剂封片。
在创面修复的第14天,收集创面处组织于4%多聚甲醛内固定,常规石蜡包埋,切片。切片用二甲苯脱蜡,经各级乙醇水洗后分别用于HE染色及K14免疫荧光染色。如图4,结果显示同对照组和凝胶组相比,细胞组不存在创面空洞,且创面中心区域出现少量K14阳性细胞,说明EGFP-hUC-MSCs可以显著的促进创面的再上皮化,加速伤口的愈合。
EGFP-hUC-MSCs对糖尿病皮肤慢性溃疡的治疗机制的探索:
通过免疫荧光染色检测创面修复第14天组织中CD31和αSMA的表达,如图5,结果显示与对照组和凝胶组相比,细胞组在迁移修复区有大量αSMA+血管,说明EGFP-hUC-MSCs可以通过促进血管的再生来加速创面的愈合。通过蛋白质免疫印迹检测,与对照组和凝胶组相比,细胞组创面组织内蛋白水平上有较多的VEGFA合成和分泌。
以上述依据本申请的理想实施例为启示,通过上述的说明内容,相关工作人员完全可以在不偏离本项申请技术思想的范围内,进行多样的变更以及修改。本项申请的技术性范围并不局限于说明书上的内容,必须要根据权利要求范围来确定其技术性范围。
- 一种基因修饰的人脐带间充质干细胞制剂在制备治疗糖尿病肾病药物中的应用
- 一种工程化人脐带间充质干细胞外泌体及透皮制剂与应用
