用于细胞疗法之多样化抗原结合域、新颖平台及其他增强子
文献发布时间:2023-06-19 12:16:29
相关申请案之交叉参考
本申请案主张2018年6月1日提交之美国临时申请案第62/679,741号之优先权,其揭示内容出于所有目的并入本文中。
技术领域
本文提供用于构筑用于授受细胞疗法之习知及下一代嵌合抗原受体之多样化抗原结合域及新颖平台,该等授受细胞疗法系针对癌症、感染、过敏、退化性及免疫病症。亦提供用于活化及扩增用于授受细胞疗法之免疫T细胞之新颖方法,该等授受细胞疗法系针对癌症、感染、过敏、退化性及免疫病症。
串行表以引用之方式并入
随附此申请为于2019年6月1日创建、标题为“Sequence_ST25.txt”且具有80,373,218字节之资料、在IBM-PC、MS窗口操作系统上机器格式化的序列表。出于所有目的,该序列表以全文引用之方式并入本文中。
先前技术
CAR为合成免疫受体,其可重新引导T细胞选择性地杀死肿瘤细胞。不同于生理学T细胞受体(TCR)(其接合HLA-肽复合物),CAR接合并不需要肽加工或识别HLA表现之分子。经由将基于scFv(可变单链片段)之抗原结合域与同来源于CD3-ζ或Fc受体γ链之细胞质信号传导域连接之惰性CD8跨膜域融合来构筑初始第一代CAR。为了克服T细胞共刺激之缺乏,藉由并入T细胞共刺激受体之细胞质信号传导域来对第一代CAR进行进一步修饰。
尽管CAR-T细胞成功,但此方法存在若干限制,包括毒性,诸如“细胞介素释放症候群”(CRS)及神经毒性。在CAR构筑体中包括共刺激域引起经由受体之非生理学强直性信号传导,此转而可造成其毒性及持久性缺乏。
为了克服习知第2代CAR之一些设计限制,已描述若干替代性设计,集合地称为下一代CAR,包括Ab-TCR(WO 2017/070608 A1,以引用之方式并入本文中)、TCR受体融合蛋白或TFP(WO 2016/187349 A1,以之方式并入本文中)、合成免疫受体(SIR)(参见WO 2018/102795 A1,以引用之方式并入本文中)、三功能性T细胞抗原偶合剂(Tri-TAC)(参见WO2015/117229 A1,以引用之方式并入本文中)。一般而言,此等替代性CAR设计缺乏共刺激域。
发明内容
联合在范畴中意谓为例示性及说明性、非限制性的系统、组合物及方法,描述以下实施例及其态样。
在某些实施例中,本发明提供组合物,其包含基因工程改造效应细胞(诸如NK细胞及T细胞),该等基因工程改造效应细胞包括编码可用于授受细胞疗法之嵌合抗原受体、合成免疫受体(SIR)及其类似者之聚核苷酸,该授受细胞疗法系用于治疗癌症、感染性、自体免疫及退化性疾病。
在某些实施例中,本发明提供一种合成免疫受体(称为zSIR)之平台,其含有两条CD3z链。可用于构筑zSIR之CD3z链之聚核苷酸序列例如提供于SEQ ID NO:67及71中。对应胺基酸序列分别提供于SEQ ID NO:4066及4070中。本发明提供,抗体之vL片段可与两条CD3z链中之一者接合,且vH片段可与另一条CD3z链接合。当在相同细胞中共表现两条此类链(例如,vL-CD3z及vH-CD3z)时,vL及vH片段可结合其同源抗原且传输T细胞信号。特定言之,当暴露于表现同源目标抗原之细胞株时,表现此类zSIR之T细胞可活化NFAT信号传导,诱导IL2产生,促进T细胞增殖,促进T细胞活化及发挥细胞毒性。zSIR之表现及活性可藉由在vL/vH与CD3z片段之间并入连接子进一步增加。特定言之,来源于抗体之IgCL(SEQ IDNO:28及4027)及IgCH域(SEQ ID NO:29及4028)充当vL/vH与CD3z片段之间的适用连接子。
本发明进一步提供若干新颖抗原结合域,其可用于生成用于授受细胞疗法之习知CAR(例如含有41BB共刺激域之第2代CAR)以及下一代CAR(诸如SIR、zSIR、Ab-TCR、Tri-TAC及TFP)。在一些实施例中,此等抗原结合域来源于在血液科恶性疾病及实体肿瘤两者中表现之抗体及目标抗原。此等抗原结合域之vL、vH及scFv之SEQ ID NO示于表3中。轻链(vL)及重链(vH)的互补决定区(CDR)的SEQ ID NO示于表4中。基于此等抗原结合域之例示性习知CAR(亦即含有41BB共刺激域之第2代CAR)及下一代CAR(例如SIR、zSIR、Ab-TCR及TFP)之核酸及胺基酸SEQ ID提供于表6及表7中。含有此等抗原结合域之CAR显示多样化活体外及活体内特性,诸如与目标抗原之结合亲和力、细胞介素分泌、增殖、细胞毒性、耗尽及长期持久性。因此,含有此等目标抗原之CAR可用于产生多样化免疫反应。聚核苷酸、多肽、表现构筑体、表现包含本发明之抗原结合域之CAR的以重组方式工程化细胞,以及制备及使用此类多肽、聚核苷酸及细胞的方法,描述于此项技术中已知之方法及以下中描述之方法中:PCT/US2017/024843、WO 2014/160030 A2、WO 2016/187349 A1、PCT/US2016/058305、WO 2015/117229 A1及PCT/US17/64379,该等文献以全文引用之方式并入本文中。可产生表现包含此等抗原结合域之CAR(习知CAR及下一代CAR两者)之免疫细胞,且使用此项技术中已知之方法及以下中描述之方法,以用于癌症、感染性及免疫病症之授受细胞疗法:P CT/US2017/024843、WO 2014/160030 A2、WO 2016/187349 A1、PCT/US2016/058305、WO 2015/117229 A1及PCT/US17/64379,该等文献以全文引用之方式并入本文中。
本发明亦提供一种通过共表现Vif蛋白及CAR(例如习知CAR、SIR、Ab-TCR、Tri-TAC或重组TCR及其类似者)或Vif及任何其他治疗基因(例如,用于治疗镰状细胞贫血之β-血球蛋白基因),使用慢病毒载体来改良基因转移之方法。编码CAR且共表现Vif之例示性慢病毒载体(pLenti-EF1a-CD8SP-hu-CD19-USC1-LH4-vH-Gly-Ser-连接子-vL-Myc-CD8TM-BBz-2A-Vif)提供于SEQ ID NO:11268中。在一些实施例中,藉由在封装慢病毒载体时于封装细胞中共表现Vif,以反式形式提供Vif蛋白。在此类实施例中,将Vif蛋白以及编码RNA之慢病毒载体一起封装至病毒颗粒中,且转移至目标细胞中。可藉由此项技术中已知之方法,在封装细胞中表现Vif蛋白。在本发明之一例示性实施例中,藉由共转染编码Vif之哺乳动物表现载体与编码所关注基因(pLenti-EF1α-CD8SP-MYC3-WT1-Ab13-vL-V5-[hTCRb-KACIAH]-F-P2A-SP-W T1-Ab13-vH-Myc4-[hTCRa-CSDVP]-F-F2A-PAC-DWPRE;SEQ ID NO:151)之慢病毒转移载体(例如pCDNA3-Vif;SEQ ID NO:11269)及慢病毒封装载体,在封装细胞中表现Vif蛋白。例示性慢病毒封装载体包括pMDLg/pRRE(Addgene质体12251)(其为编码Gag及Pol之第3代慢病毒封装质体),且亦需要pRSV-Rev(Addgene#12253)及包封表现质体pMD2.G(Addgene#12259)以用于有效封装。另一种慢病毒封装载体为psPAX2(Addgene质体#12260)(其为第2代慢病毒封装质体),且可与包封表现质体pMD2.G(Addgene#12259)一起使用以封装第2代或第3代慢病毒载体。在本发明之一例示性实施例中,编码Vif之质体可与psPAX2及pMD2.G质体一起共转染以封装第2或第3代慢病毒载体。在一替代例示性实施例中,编码Vif之质体可与pMDLg/pRRE、pRSV-Rev及pMD2.G质体一起共转染以封装第3代慢病毒载体。Vif可亦自编码其他慢病毒封装蛋白质(例如gag、Pol及Rev)之相同载体共表现。在本发明之一例示性实施例中,藉由此项技术中已知之方法,封装质体psPAX2经修饰以亦共表现Vif。在一替代例示性实施例中,藉由将编码Vif之核酸序列与编码Pol之核酸序列融合在框中且由P2A可裂解连接序列与其分隔开,封装编码Gag及Pol之第3代慢病毒质体经修饰以亦表现Vif。在一些实施例中,在封装细胞中瞬时表现Vif;而在其他实施例中,在封装细胞中稳定地表现Vif。在一些实施例中,在目标细胞中瞬时表现Vif;而在其他实施例中,在目标细胞中稳定地表现Vif。在一个实施例中,藉由电穿孔编码Vif之哺乳动物表现载体(例如pCDNA3-Vif;SEQ ID NO:11269),或藉由电穿孔Vif多肽,在目标细胞(例如T细胞或干细胞)中瞬时表现Vif。随后,瞬时表现Vif之Targe细胞(例如T细胞或干细胞),用编码CAR或所关注之任何治疗基因(例如β血球蛋白)之慢病毒载体感染。
免疫反应之多株性质为其在控制各种感染上成功的关键。相比之下,目前CAR疗法一般依赖于靶向单一抗原及/或单一抗原之单一抗原决定基。缺失靶向抗原或靶向抗原决定基为目前CAR疗法失败的一个常见原因。为了克服此限制,本发明提供针对多个抗原及针对单一抗原之多个抗原决定基的CAR。此等CAR可以适合的组合使用,以为疾病(诸如癌症、传染性疾病、自体免疫疾病、过敏性疾病及退化性疾病)之预防或治疗提供多株及多样化后天性免疫反应。
本发明亦提供附属模块,该等附属模块可在授受性转移T细胞(例如CAR-T细胞、TCR-T细胞及TIL)中表现,以影响其存活、增殖、活化、效应功能(例如细胞介素分泌、细胞毒性等)、耗尽及活体内持久性。
本发明提供编码至少一种第1代或下一代嵌合抗原受体(CAR)之至少一种重组聚核苷酸,该至少一种重组聚核苷酸包含:(a)第一核酸域,其编码内源蛋白之其中一部分或整个跨膜域及/或细胞质域及视情况胞外域,其中该内源蛋白表现于淋巴球表面上且触发该淋巴球之活化及/或增殖;(b)视情况聚核苷酸连接子;及(c)与该第一核酸域可操作地连接之第二核酸,其中该第二核酸域编码一或多个非天然TCR抗原结合域,其中该结合域系选自表3中阐述之结合域;(d)视情况选用之第三核酸域,其编码共刺激域;及视情况选用之额外核酸域,其编码附属模块。在一个实施例中,第一核酸部分地或完全编码如表13中所阐述之至少一种T细胞受体(TCR)链。在另一或另外实施例中,第一核酸编码表13中与TCR类型之细胞质域可操作地连接之至少一个跨膜域。在另一或另外实施例中,聚核苷酸编码CAR,其中该CAR包含:(i)部分或整个T细胞受体(TCR)恒定链,其具有与选自SEQ ID NO:4038至4063、12602-12638之序列具有至少75%序列一致性之胺基酸序列,且其可包含视情况选用之共刺激模块;(ii)视情况选用之连接子;及(iii)与选自表3中阐述之结合域之(a)连接之一或多个非天然TCR抗原结合域;(iv)视情况选用之附属模块;及(v)包含(i)-(iv)之多肽之二聚体。在另一或另外实施例中,该重组聚核苷酸包含编码表2中之序列中之任一者之序列。在另一或另外实施例中,该附属模组包含选自SEQ ID NO:4103-4117及4090-4096之胺基酸序列。在另一或另外实施例中,经编码CAR包含(1)表1之CAR 1-16中之任一者及/或(2)表2之主链;及(3)表3之结合域。在另一或另外实施例中,(i)为CD3z TCR恒定链。在另一或另外实施例中,该聚核苷酸提供两种第一代或下一代嵌合抗原受体。在另一或另外实施例中,该聚核苷酸编码CD3z恒定链之二聚体。
本发明亦提供至少一种重组聚核苷酸,其编码至少一种下一代嵌合抗原受体(CAR),该至少一种重组聚核苷酸包含:(a)第一核酸域,其编码内源性CD3z蛋白之一部分或整个跨膜域及/或细胞质域及视情况胞外域,该蛋白质具有选自由SEQ ID NO:4064-4066、4070-4072及4075-4078组成之群之序列,其中该内源蛋白表现于淋巴球表面上且触发该淋巴球之活化及/或增殖;(b)视情况聚核苷酸连接子;及(c)与该第一核酸域可操作地连接之第二核酸域,其中该第二核酸域编码一或多个非天然TCR抗原结合域,其中该结合域系选自表3中阐述之结合域;及(d)视情况选用之第三核酸域,其编码共刺激模块;及视情况选用之额外核酸,其编码附属模块。在另一或另外实施例中,编码该内源性CD3z蛋白之该等核酸序列系选自由SEQ ID NO:67及71组成之群。在另一或另外实施例中,该至少一种下一代CAR包含两个CAR,各CAR包含CD3z链。在另一或另外实施例中,抗体之vL片段与两条CD3z链中之一者可操作地连接,且该抗体之vH片段与另一条CD3z链可操作地连接。在另一或另外实施例中,该vL链及该vH链系选自表3及4中针对特定抗原目标之对。在另一或另外实施例中,连接子提供于vL/vH及/或CD3z链之间。在另一或另外实施例中,经编码连接子系选自由以下组成之群:IgCL(SEQ ID NO(DNA):28及SEQ ID NO(PRT):4027)及IgCH域(SEQ ID NO(DNA):29及SEQ ID NO(PRT):4028)。在另一或另外实施例中,该至少一种重组聚核苷酸进一步包含编码共刺激模块之该第三核酸域。在另一或另外实施例中,该共刺激模块包含41BB或CD28蛋白。在另一或另外实施例中,该共刺激模块包含选自由SEQ ID NO:4067及4068组成之群之胺基酸序列。在另一或另外实施例中,该共刺激模块包含来自以下中之任一者或多者之信号传导域:CD134(OX40)、Dap10、CD27、CD2、CD5、ICAM-1、LFA-1、Lck、TNFR-I、TNFR-II、Fas、CD30、CD40及其组合。在另一或另外实施例中,该至少一种重组聚核苷酸进一步包含该附属模组,其中该附属模块包含选自SEQ ID NO:4103-4117及4090-4096之胺基酸序列。
本发明亦提供一种重组细胞,其表现第1代或下一代嵌合抗原受体(CAR)之均或杂二聚体,该均或杂二聚体包含:(a)第一域,其编码内源蛋白之一部分或整个跨膜域及/或细胞质域及视情况胞外域,其中该内源蛋白表现于淋巴球表面上且触发该淋巴球之活化及/或增殖;(b)视情况肽连接子;和该第一域可操作地连接的第二域,其中该第二域包含一或多个非天然TCR抗原结合域,其中该结合域系选自表3中阐述的结合域;及(d)视情况选用之第三域,其编码共刺激模块,且其中该细胞视情况包含附属模块,其中该均或杂二聚体结合于该重组细胞之表面上。在另一或另外实施例中,该细胞用如本文所描述之至少一种重组聚核苷酸转型。在另一或另外实施例中,该细胞为T淋巴球(T细胞)。在另一或另外实施例中,该细胞为原生T细胞、中枢记忆T细胞、效应记忆T细胞、Treg或其组合。在另一或另外实施例中,该细胞为自然杀手(NK)细胞、造血干细胞(HSC)、胚胎干细胞或多能干细胞。在另一或另外实施例中,该附属模组包含选自SEQ ID NO:4103-4117及4090-4096之胺基酸序列。在另一或另外实施例中,该重组细胞表现或经工程改造以表现HIV1-vif。
本发明提供一种嵌合抗原受体(CAR),其包含:(a)第一域,其编码内源蛋白之一部分或整个跨膜域及/或细胞质域及视情况胞外域,其中该内源蛋白表现于淋巴球表面上且触发该淋巴球之活化及/或增殖;(b)视情况肽连接子;及(c)与该第一域可操作地连接之第二域,其中该第二域包含一或多个非天然TCR抗原结合域,其中该结合域系选自表3中阐述之结合域;及(d)视情况选用之第三域,其编码共刺激模块。在另一或另外实施例中,该内源蛋白包含选自由以下组成之群之序列:SEQ ID NO:4064-4066、4070-4072、4075-4078及12637。在另一或另外实施例中,该第一核酸部分或完全编码如表13中所阐述之至少一种T细胞受体(TCR)链。在另一或另外实施例中,该第一核酸包含表13中与对应TCR类型之细胞质域可操作地连接之跨膜域。在另一或另外实施例中,该CAR包含:(i)部分或整个T细胞受体(TCR)恒定链,其具有与选自SEQ ID NO:4038至4063、12602-12638之序列具有至少75%序列一致性之胺基酸序列,且其可包含视情况选用之共刺激模块。
本发明提供一种聚核苷酸,其编码如上文及本文所描述之嵌合抗原受体。
本发明亦提供一种载体,其包含本文所描述之聚核苷酸。
本发明亦提供一种病毒,其包含如本文所描述之聚核苷酸。在另一或另外实施例中,该病毒为反转录病毒、腺病毒、腺相关病毒、慢病毒、痘病毒或疱疹病毒。
本发明亦提供一种医药组合物,其包含:本文所描述之发明中之任一者或多者及医药学上可接受之载剂。
本发明亦提供一种治疗癌症之方法,其包含:提供本发明之组合物、重组细胞,及向个体投与治疗有效量之该组合物或细胞,以便治疗癌症。在另一或另外实施例中,该癌症为血癌。在另一或另外实施例中,该血癌为以下中之任一者或多者:急性骨髓性白血病、慢性骨髓性白血病、骨髓发育不良症候群、淋巴瘤、多发性骨髓瘤及急性淋巴球性白血病。在另一实施例中,该癌症为实体肿瘤。
在一个实施例中,本文提供一种经分离之核酸,其编码SIR(亦即下一代CAR),其中该SIR之抗原特异性域靶向CD19,且该SIR视情况表现K13-vFLIP之经密码子优化的变体(K13-opt)。在例示性实施例中,靶向CD19之经分离之核酸片段之序列阐述于SEQ ID NO:14056-14059及14109-14112中。在例示性实施例中,靶向CD19且视情况共表现K13-vFLIP之经分离多肽之序列阐述于SEQ ID NO:15800-15803及15853-15856中。在一些实施例中,靶向CD19之vL及vH片段描述于表3中且阐述于以下中:SEQ ID NO(DNA):12662、12693及12656及12687以及SEQ ID NO(PRT):14406、14437及14400及14431。本文亦提供由编码SIR及视情况编码K13-vFLIP之核酸编码之多肽,其中该SIR之抗原特异性域靶向CD19。本文进一步提供编码核酸之载体,该等核酸编码SIR及K13-vFLIP,其中该SIR之抗原特异性域靶向CD19。在例示性实施例中,编码靶向CD19之SIR之载体提供于SEQ ID NO:12641中。本文亦提供基因工程改造细胞(诸如T细胞、NKT细胞),其包含编码核酸之载体,该等核酸编码SIR及K13-vFLIP,其中该SIR之抗原特异性域靶向CD19。亦提供用于治疗及预防疾病之方法,其中致病或疾病相关细胞表现CD19。
在一个实施例中,本文提供一种经分离之核酸,其编码SIR,其中该SIR之抗原特异性域靶向MPL,且该SIR视情况表现K13-vFLIP之经密码子优化的变体(K13-opt)。在例示性实施例中,靶向MPL之经分离之核酸片段之序列阐述于SEQ ID NO:13791-13792及13844-13845中。在例示性实施例中,靶向MPL且视情况共表现K13-vFLIP之经分离多肽之序列阐述于SEQ ID NO:15535-15536及15588-15589中。在一些实施例中,靶向MPL之vL及vH片段描述于表3中且阐述于以下中:SEQ ID NO(DNA):12665、12696及12658及12689以及SEQ ID NO(PRT):14409、14440及14402及14433。本文亦提供由编码SIR及视情况编码K13-vFLIP之核酸编码之多肽,其中该SIR之抗原特异性域靶向MPL。本文进一步提供编码核酸之载体,该等核酸编码SIR及K13-vFLIP,其中该SIR之抗原特异性域靶向MPL。在例示性实施例中,编码靶向MPL之SIR之载体提供于SEQ ID NO:14384中。本文亦提供基因工程改造细胞(诸如T细胞、NKT细胞),其包含编码核酸之载体,该等核酸编码SIR及视情况编码K13-vFLIP,其中该SIR之抗原特异性域靶向MPL。亦提供用于治疗及预防疾病之方法,其中致病或疾病相关细胞表现MPL。
在一个实施例中,本文提供一种经分离之核酸,其编码SIR,其中该SIR之抗原特异性域靶向BCMA且该SIR视情况表现K13-vFLIP之经密码子优化的变体(K13-opt)。在例示性实施例中,靶向BCMA之经分离之核酸片段之序列阐述于以下中:SEQ ID NO:12890-12893、12943-12946、12996-12999、13049-13052及12837-12840。在例示性实施例中,靶向BCMA且视情况共表现K13-vFLIP之经分离多肽之序列阐述于以下中:14634-14637、14687-14690、14740-14743、14793-14796及14581-14584。在一些实施例中,靶向BCMA之vL及vH片段描述于表3中且阐述于以下中:SEQ ID NO(DNA):12670及12701、12669及12700、12671-12702、12657及12688、12654及12685,以及SEQ ID NO(PRT):14414及14445、14413及14444、14415及14446、14398及14429及14401及14432。本文亦提供由编码SIR及视情况编码K13-vFLIP之核酸编码之多肽,其中该SIR之抗原特异性域靶向BCMA。本文进一步提供编码核酸之载体,该等核酸编码SIR及K13-vFLIP,其中该SIR之抗原特异性域靶向BCMA。在例示性实施例中,编码靶向BCMA之SIR之载体提供于SEQ ID NO:14378及14385中。本文亦提供基因工程改造细胞(诸如T细胞、NKT细胞),其包含编码核酸之载体,该等核酸编码SIR且视情况编码K13-vFLIP,其中该SIR之抗原特异性域靶向BCMA。亦提供用于治疗及预防疾病之方法,其中致病或疾病相关细胞表现BCMA。
在一个实施例中,本文提供一种经分离之核酸,其编码SIR,其中该SIR之抗原特异性域靶向MSLN且SIR视情况表现K13-vFLIP之经密码子优化的变体(K13-opt)。在例示性实施例中,靶向MSLN之经分离之核酸片段之序列阐述于以下中:SEQ ID NO:14268-14269、14321-14322及14374-14375。在例示性实施例中,靶向MSLN且视情况共表现K13-vFLIP之经分离多肽之序列阐述于SEQ ID NO:16012-16013、16065-16066及16118-16119中。在一些实施例中,靶向MSLN之vL及vH片段描述于表3中且阐述于以下中:SEQ ID NO(DNA):12668及12699、12667及12698及12666-12697,以及SEQ ID NO(PRT):14412及14443、14411及14442及14410及14441。本文亦提供由编码SIR且视情况编码K13-vFLIP之核酸编码之多肽,其中该SIR之抗原特异性域靶向MSLN。本文进一步提供编码核酸之载体,该等核酸编码SIR及K13-vFLIP,其中该SIR之抗原特异性域靶向MSLN。在例示性实施例中,编码靶向MSLN之SIR之载体提供于SEQ ID NO:14381及14383中。本文亦提供基因工程改造细胞(诸如T细胞、NKT细胞),其包含编码核酸之载体,该等核酸编码SIR且视情况编码K13-vFLIP,其中该SIR之抗原特异性域靶向MSLN。亦提供用于治疗及预防疾病之方法,其中致病或疾病相关细胞表现MSLN。
在一个实施例中,本文提供一种经分离之核酸,其编码SIR,其中该SIR之抗原特异性域靶向CD22且该SIR视情况表现K13-vFLIP之经密码子优化的变体(K13-opt)。在例示性实施例中,靶向CD22之经分离之核酸片段之序列阐述于以下中:SEQ ID NO:13314-13317、13420-13423、13473-13476及14215-14218。在例示性实施例中,靶向CD22且视情况共表现K13-vFLIP之经分离多肽之序列阐述于以下中:SEQ ID NO:15058-15061、15164-15167、15217-15220及15959-15962。在一些实施例中,靶向CD22之vL及vH片段描述于表3中,且阐述于以下中:SEQ ID NO(DNA):12663及12694、12655及12686、12643及12674、12652及12683,及SEQ ID NO(PRT):14407及14438、14399及14430、14387及14418、14396及14427。本文亦提供由编码SIR且视情况编码K13-vFLIP之核酸编码之多肽,其中该SIR之抗原特异性域靶向CD22。本文进一步提供编码核酸之载体,该等核酸编码SIR及K13-vFLIP,其中该SIR之抗原特异性域靶向CD22。在例示性实施例中,编码靶向CD22之SIR之载体提供于SEQ IDNO:12640中。本文亦提供基因工程改造细胞(诸如T细胞、NK细胞),其包含编码核酸之载体,该等核酸编码SIR且视情况编码K13-vFLIP,其中该SIR之抗原特异性域靶向CD22。亦提供用于治疗及预防疾病之方法,其中致病或疾病相关细胞表现CD22。
图式简单说明
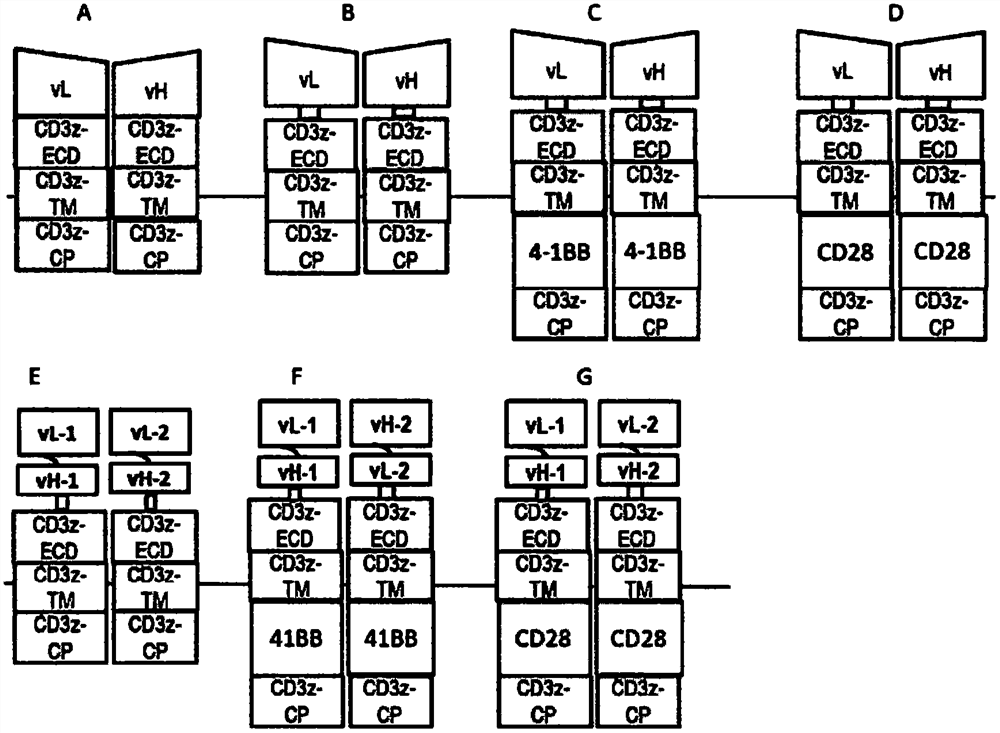
图1描绘不同zSIR之示意性表示。CD3z-ECD、CD3z-TM、CD3z-CP系指CD3z之胞外域、跨膜域及细胞质域。4-1BB及CD28系指4-1BB及CD28之细胞质共刺激域。
图2A至图2B描绘在将本发明之CAR-T细胞与RAJI细胞(图2A)及Nalm6细胞(图2B)一起共培养后,IFNγ之诱导。
图3描绘在RAJI细胞之异种移植模型中,本发明之CAR-T细胞之活体内功效,如使用生物发光成像所量测。
图4描绘在Nalm6细胞之异种移植模型中,本发明之CAR-T细胞之活体内功效,如使用生物发光成像所量测。
实施方式
除非上下文另外明确指示,否则如本文中及所附申请专利范围中所用,单数形式“一(a/an)”及“该”包括复数个指示物。因此,举例而言,提及“一细胞”包括复数个此类细胞,且提及“该聚核苷酸”包括提及一或多个聚核苷酸等。
此外,除非另外陈述,否则使用“或”意谓“及/或”。类似地,包含(comprise/comprises/comprising)及“包括(include/includes/including)”为可互换的且并不意欲为限制性的。
更应理解,在各种实施例之描述使用术语“包含”之情况下,熟习此项技术者应理解,在一些特定情况中,可使用措辞“基本上由......组成”或“由......组成”替代地描述实施例。
除非另外定义,否则本文所用之所有技术及科学术语均具有与本发明所属领域之一般技术者通常所理解相同之含义。
当提及可量测值,诸如量、瞬时持续时间及其类似者时,术语“约”意谓涵盖指定值±20%,或在一些情况下±10%,或在一些情况下±5%,或在一些情况下±1%,或在一些情况下±0.1%之变化,因此变化适合于执行所揭示之方法或描述本文中之组合物。
术语“Ab-TCR”或“AbTCR”系指下一代CAR平台,如WO2017/070608 A1中所描述,其以引用之方式并入本文中。在一实施例中,Ab-TCR包含与目标抗原特异性结合之抗体部分,该目标抗原与能够募集至少一种TCR信号传导模块之TCR模块融合。可用于构筑Ab-TCR之例示性TCR模块提供于WO2019067805之SEQ ID NO:959-964(表6D)中及WO2017/070608 A1中,该等文献以引用之方式并入本文中。靶向BCMA且共表现编码NEMO-K277A之附属模块之例示性Ab-TCR提供于SEQ ID NO:4382-4383(表6)中。然而,编码NEMO-K277A之附属模块为视情况选用的。可构筑不具有NEMO-K277A之本发明中描述之具有抗原结合域(亦即vL及vH片段、配位体及受体等)的Ab-TCR。因此,可自Ab-TCR缺失此附属模块以及上游Furine-SGSG-F2A序列。可替代地,编码NEMO-K277A之附属模块可经编码其他蛋白质之附属模组置换,诸如hNEMO-K277A-deltaV249-K555、mNEMO-K270A、K13-opt、IKK2-S177E-S181E或IKK1-S176E-S180E,和MyD88-L265P、FKBPx2-NEMO、NEMO-L600-FKBPx2等。此外,Ab-TCR中存在之TCR模块可经WO2017/070608 A1中描述之其他TCR模块取代。
术语“附属模块”系指与共表现CAR(包括下一代CAR,诸如SIR、zSIR、Ab-TCR、Tri-TAC、TFP等)及/或rTCR,以增加、降低、调节或修饰表现CAR/rTCR或CAR/rTCR之细胞之表现或活性的组件。例示性附属模块包括以下中之任一者或多者:41BBL、CD40L、HIV1-Vif、vFLIP K13、MC159、cFLIP-L/MRITα、cFLIP-p22、HTLV1 Tax、HTLV2 Tax、HTLV2 Tax-RS突变、FKBPx2-K13、FKBPx2-HTLV2-Tax、FKBPx2-HTLV2-Tax-RS、IL6R-304-vHH-Alb8-vHH、IL12f、PD1-4H1 scFV、PD1-5C4 scFV、PD1-4H1-A1b8-vHH、PD1-5C4-A1b8-vHH、CTLA4-伊派利单抗(Ipilimumab)-scFv、CTLA4-伊派利单抗-Alb8-vHH、IL6-19A-scFV、IL6-19A-scFV-Alb8-vHH、sHVEM、sHVEM-Alb8-vHH、hTERT、Fx06、hNEMO-K277A、靶向Brd4之shRNA及其组合。使用单一载体或使用两个或更多个不同载体,附属模块可与CAR/rTCR及其类似者一起共表现。在一些实施例中,附属模组降低或预防与CAR及/或TCR及其类似者相关之毒性。在一些实施例中,附属模组改良慢病毒介导之基因转移的效率。
如本文所用之术语“抗体系”系指蛋白或来源于与抗原特异性结合之免疫球蛋白分子的多肽序列。抗体可为多株或单株、多链或单链或完整免疫球蛋白,且可来源于天然来源或重组来源。抗体可为免疫球蛋白分子之四聚体。抗体可为“人类化”、“嵌合”或非人类的。
术语“抗体片段”系指保留与抗原之抗原决定基特异性相互作用(例如藉由结合、位阻、稳定化/去稳定化、空间分布)之能力之抗体的至少一部分。抗体片段之实例包括(但不限于)Fab、Fab′、F(ab′)
术语″抗体重链″系指以其天然存在之构形存在于抗体分子中之两种类型多肽链中之较大者,且其通常决定抗体所属类别。
术语″抗体轻链″系指以其天然存在之构形存在于抗体分子中之两种类型多肽链中之较小者。κ(Kappa)及λ(lambda)轻链系指两种主要的抗体轻链同型。
术语“抗癌效果”或“抗肿瘤效果”系指可藉由各种手段体现之生物作用,包括(但不限于)肿瘤体积减小、癌细胞数目降低、癌转移数目降低、预期生命增加、癌细胞增殖降低、癌细胞存活率降低或与癌性病状相关之各种生理学症状之改善。“抗癌效果”亦可藉由CAR、SIR、TFP、Ab-TCR、Tri-Tac、zSIR及其类似者在首先预防癌症之发作中的能力来体现。
“抗癌剂”系指抑制异常细胞分裂及生长、抑制赘生性细胞之迁移、抑制侵袭性或预防癌症生长及癌转移之药剂。
术语“抗原”或“Ag”系指引起免疫反应之分子。
术语“抗原呈递细胞”或“APC”系指在其表面上表现可由免疫细胞或与免疫细胞结合之抗体识别之抗原的任何细胞。举例而言,表现CD19之B淋巴球可充当表现针对CD19之CAR之T细胞的抗原呈递细胞。APC可独立于MHC分子或在MHC分子之情况下呈递抗原。APC可呈递呈与主要组织兼容复合物之复合物(MHC′s)形式之抗原。T细胞可使用其T细胞受体(TCR)识别此等MHC-抗原复合物。在替代性实施例中,APC可独立于MHC,将由在T细胞上表现之天然(例如CD28或41BB)或合成(例如CAR、SIR、zSIR、Ab-TCR、Tri-Tac或TFP等)受体识别之抗原呈递在其表面上。
术语“抗原呈递受质”或“APS”系指诸如珠粒、微珠粒、培养盘之任何受质,或在其表面上展示外来抗原之任何基质。在一个实施例中,APS可将由在T细胞上表现之天然(例如CD28或41BB)或合成(例如习知CAR、SIR、zSIR、Ab-TCR、TFP)受体识别之抗原呈递在其表面上。在本发明之一例示性实施例中,在其表面上涂覆有CD19之胞外域之珠粒可充当表现针对CD19之习知CAR、SIR、zSIR、Ab-TCR或TFP之T细胞的APS。
术语“抗感染效果”系指可藉由各种手段体现之生物作用,包括(但不限于)例如传染剂之效价降低、传染剂之群落计数降低、与感染性病状相关之各种生理学症状之改善。“抗感染性效果”亦可藉由肽、聚核苷酸、细胞及抗体首先预防癌症发作之能力体现。
如本文所用,“亲和力”意谓描述结合强度之量测。在一些情况下,亲和力视结合剂与其目标之间(例如抗体与抗原(包括对结合域具有特异性之抗原决定基)之间)的立体化学拟合之接近性、其间的接触面积之大小、及带电基团及疏水性基团之分布而定。亲和力通常系指结合剂结合其目标之能力。在此项技术中存在多种方式用于量测“亲和力”。举例而言,此项技术中已知用于计算抗体针对抗原之亲和力的方法,包括使用结合实验来计算亲和力。结合亲和力可使用此项技术中已知之各种技术测定,例如表面电浆子共振、生物层干涉法、双重极化干涉法、静态光散射、动态光散射、等温滴定量热法、ELISA、分析型超离心法及流式细胞测量术。用于测定结合亲和力之例示性方法采用表面电浆子共振。表面电浆子共振为一种光学现象,其允许通过例如使用BIAcore系统(Pharmacia Biosensor AB,Uppsala,Sweden and Piscataway,N.J.)侦测生物感测器基质中之蛋白质浓度改变来分析实时生物特异性相互作用。
“抗原结合域”或“抗原结合模块”或“抗原结合区段”系指归因于其一级、二级或三级序列及/或转译后修饰及/或电荷,以较高程度之特异性与抗原结合的多肽或肽。抗原结合域可来源于不同来源,例如抗体、非免疫球蛋白结合蛋白、配位体或受体。
“亲和性”系指结合剂与其目标之间的相互作用的强度(例如抗体与其抗原目标之间、受体与其同源之间的相互作用的强度及其类似者)。抗体及亲和力可使用功能性分析(例如,流式细胞测量术分析及Topanga分析)以表现型表征及比较。
术语“缔合常数(Ka)”定义为受体与配位体或抗体与抗原之缔合的平衡常数。
术语“自体抗原”系指刺激产生自体免疫反应,诸如产生自体抗体之内源性抗原。自体抗原之实例包括(但不限于)桥粒黏蛋白(desmoglein)1、桥粒黏蛋白3及其片段。
如本文所用,术语“主链”系指CAR(表1)及附属模块之特定组合,如表2中所描述。在例示性实施例中,包含各种主链之CAR及附属模块之特定组合描述于表2中。在一个实施例中,CAR及附属模组由单核酸分子编码。在另一实施例中,CAR由第一核酸分子编码,且附属模组由第二核酸分子编码。在一些实施例中,附属模组由多于一个核酸分子编码,视附属模组中之组分数目而定。
如本文所用,有益结果可包括(但不限于)减轻或缓解疾病病状之严重程度、防止疾病病状恶化、治愈疾病病状、防止疾病病状发展、降低患者发展疾病病状之机会及延长患者之生命或预期生命。
如本文所用,术语“结合域”或“抗体分子”系指可以高于非特异性域之亲和力与目标结合之蛋白质,例如免疫球蛋白链或其片段,包含至少一个域,例如免疫球蛋白可变域序列。该术语涵盖抗体及抗体片段。
“结合与...相同的抗原决定基”意谓抗体、scFv或其他抗原结合域与目标抗原结合之能力且具有与例示抗体、scFv或其他抗原结合域相同的抗原决定基。作为一实例,例示抗体、scFv或其他结合剂及其他抗体之抗原决定基可使用标准抗原决定基定位技术来测定。由习知CAR或下一代CAR(例如SIR、zSIR、TFP、Tri-Tac或Ab-TCR)之抗原结合域结合之抗原决定基,亦可藉由抗原决定基分组分析(Epitope Binning assay)来测定。抗原决定基分组为一种用于表征且随后分选针对靶蛋白之单株抗体之文库的竞争性免疫分析。以成对方式测试针对类似目标之抗体针对文库中之所有其他抗体,以查看抗体是否阻断其他抗体与抗原之抗原决定基的结合。在各抗体具有针对文库中之所有其他抗体创建之概况之后,创建各抗体相对于文库中之其他抗体的竞争性阻断概况。紧密相关的分组概况指示,抗体具有相同或紧密相关的抗原决定基,且“分组”在一起。类地似,易藉由诸如利用例如氢/氘交换、x射线结晶学及二维核磁共振判定胺基酸之空间构形来鉴别构形抗原决定基。参见例如Epitope Mapping Protocols,见上文。蛋白质之抗原区亦可使用标准抗原性及亲水性曲线图,诸如使用例如获自Oxford Molecular Group之Omiga 1.0版软件程序计算的曲线图鉴别。为了测定抗原性概况,此计算机程序采用Hopp/Woods方法,Hopp等人,(1981)Proc.Natl.Acad.Sci USA 78:3824-3828;且对于亲水性曲线图,采用Kyte-Doolittle技术,Kyte等人,(1982)J.MoI.Biol.157:1 05-132。为了判定所选择针对目标(例如CD19)之单株抗体是否与独特抗原决定基结合,可使用市售试剂(Pierce,Rockford,Ill.)对各抗体进行生物素标记。使用未标记之单株抗体及经生物素标记之单株抗体的竞争研究可使用CD19-胞外域涂覆之ELISA盘进行。生物素标记之mAb结合可用链霉素-抗生素蛋白-碱性磷酸酶探针侦测。
如本文所用,术语“CDR”或“互补决定区”意欲意谓重链与轻链多肽两者之可变区内发现的非邻接抗原组合位点。此等特定区域已由以下所描述:Kabat等人,J.Bioi.Chern.252:6609-6616(1977);Kabat等人,U.S.Dept.of Health and HumanServices,“Sequences of proteins of immunological interest”(1991);Chothia等人,J.Mol.Bioi.196:901-917(1987);及MacCallum等人,J.Mol.Bioi.25 262:732-745(1996),其中定义包括当彼此对照比较时胺基酸残基之重叠或子集。然而,提及抗体或接枝抗体或其变体之CDR之任一定义的应用意欲处于如本文中所定义及所用之术语的范畴内。如本文所用,抗体之不同CDR亦可由不同定义之组合定义。举例而言,vHCDR1可基于Kabat及VHCDR2(其可基于Chothia定义)定义。涵盖如上文所引用之各参考文献所定义之CDR的胺基酸残基如下:
CDR定义
(残基数目映射于所鉴别参考物)。
术语“构架区”系指存在于更为相异的(亦即高变)CDR之间的此项技术公认之抗体可变区之部分。
涵盖结合本文所描述之分子之胺基酸序列修饰。举例而言,可能需要改良习知CAR或下一代CAR(例如SIR、zSIR及其类似者)之vL及/或vH片段之结合亲和力及/或其他生物特性。此类修饰包括例如缺失结合分子之胺基酸序列内之残基、及/或插入至其中及/或取代该等残基。可产生缺失、插入及取代之任何组合以获得最终构筑体,其限制条件为该最终构筑体拥有所需特征。胺基酸变化亦可改变结合分子之转译后过程,诸如改变糖基化位点之数目或位置。较佳地,CDR中之1、2、3、4、5、6、7、8、9或10个胺基酸可经取代,而构架区(FR)中之1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或25个胺基酸可经取代。取代较佳为如本文所描述之保守取代。另外或替代地,在CDR中之每一者中可插入或缺失1、2、3、4、5或6个胺基酸(当然,视其长度而定),而在FR中之每一者中可插入或缺失1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或25个胺基酸。
较佳地,胺基酸序列插入包括向含有一百或更多残基之多肽中胺基及/或羧基端融合长度范围在1、2、3、4、5、6、7、8、9或10个残基,以及序列内插入单个或多个胺基酸残基。结合分子之插入变体包括抗体之N端或C端与延长抗体之血清半衰期的酶的融合或与多肽的融合。
另一种类型的变体为胺基酸取代变体。此等变体在结合分子中较佳地至少1、2、3、4、5、6、7、8、9或10个胺基酸残基经不同残基置换。取代型突变诱发之最受关注位点包括重链及/或轻链之CDR,特定言之高变区,但亦涵盖重链及/或轻链中之FR改变。
举例而言,若CDR序列涵盖6个胺基酸,则据设想此等胺基酸中之一者、两者或三者经取代。类似地,若CDR序列涵盖15个胺基酸,则据设想此等胺基酸中之一者、两者、三者、四者、五者或六者经取代。
一般而言,若取代重链及/或轻链之CDR中之一或多者或所有的胺基酸,则较佳随后所得之“经取代之”序列与“初始”CDR序列至少60%、更佳65%、甚至更佳70%、尤其较佳75%、更尤其较佳80%一致。此意谓,其取决于CDR之达到与《经取代之》序列一致之程度的长度。举例而言,具有5个胺基酸之CDR与其经取代之序列较佳80%一致以使至少一个胺基酸经取代。因此,结合分子之CDR可与其经取代之序列具有不同程度之一致性,例如CDRL1可具有80%,而CDRL3可具有90%。
较佳取代(或置换)为保守取代。然而,设想任何取代(包括非保守取代,或来自下文所列出之“例示性替换”之一或多者),只要结合分子保留其与目标抗原结合之能力,及/或其CDR与随后经取代之序列具有一致性(与“初始”CDR序列至少60%,大于65%,大于70%,通常大于75%或大于80%一致)即可。
非保守取代将引起一个类别之成员换成另一个类别。不参与维持结合分子之恰当构形之任何半胱胺酸残基一般可经丝胺酸取代,以提高分子之氧化稳定性及防止异常交联。反之,可在抗体中添加半胱胺酸键以改良其稳定性(尤其在抗体为诸如Fv片段之抗体片段的情况下)。
可用于构成靶向不同抗原之本发明之CAR(例如第2代CAR、SIR、zSIR、Ab-TCR、Tri-Tac或TFP)之抗原结合域之例示性vL及vH区段的CDR的SEQ ID提供于表4中。
在一些实施例中,提及与目标抗原特异性结合之抗原结合模块(诸如Fab样或Fv样抗原结合模块)意谓,该抗原结合模块以以下的亲和力或K
“癌症”及“癌性”系指或描述哺乳动物中通常地以不受调控之细胞生长为特征的生理病状。癌症之实例包括(但不限于)B细胞淋巴瘤(霍奇金淋巴瘤(Hodgkin′slymphomas)及/或非霍奇金淋巴瘤)、睪丸癌、肺癌及白血病。其他癌症及细胞增殖性病症将在此项技术中容易地识别。术语“肿瘤”及“癌症”在本文中可互换使用,例如两个术语均涵盖实体及液体,例如良好或是循环肿瘤。如本文所用,术语“癌症”或“肿瘤”包括恶化前以及恶性癌症及肿瘤。
“化学治疗剂”为已知用于癌症之化学疗法之化合物。
“嵌合抗原受体”(CAR)为考虑用作癌症疗法,使用称为授受性细胞转移之技术之人工T细胞受体。构筑特异性刺激T细胞活化且回应于与CAR特异性结合之抗原进行增殖的CAR。术语“嵌合抗原受体”或替代地“CAR”系指一组多肽,通常在最简单实施例中两个,当在免疫效应细胞中表现时,其为细胞提供针对目标细胞,通常癌细胞之特异性及胞内信号产生。在一些实施例中,CAR包含至少一个胞外抗原结合域、跨膜域及细胞质信号传导域(在本文中亦被称作“胞内信号传导域”),其包含来源于刺激分子及/或共刺激分子的功能性信号传导域。在一些态样中,该多肽集合彼此邻接。在一个态样中,刺激分子为与T细胞受体复合物缔合之ξ链。在一个态样中,细胞质信号传导域进一步包含一或多个来源于至少一个如下所定义之共刺激分子的功能性信号传导域。在一个态样中,共刺激分子系选自本文所描述之共刺激分子,例如4-1BB(亦即CD137)、CD27及/或CD28。在一个态样中,CAR包含视情况选用之在CAR融合蛋白之胺基端(N端)的前导序列。在一个态样中,CAR进一步包含在胞外抗原结合域之N端的前导序列,其中该前导序列视情况在细胞加工期间自抗原结合域(例如scFv)裂解且使CAR定位至细胞膜。通常,使用“CAR-T细胞”,其系指已经工程改造以含有嵌合抗原受体之T细胞。因此,携带此类CAR之T淋巴球一般被称作CAR-T淋巴球。靶向CD19且包含CD8信号肽、基于CD19-AM1 scFv之抗原结合域、CD8铰链及跨膜域、4-1BB共刺激域及CD3z刺激域之第二代CAR由SEQ ID NO:799表示。其中4-1BB共刺激域经不同共刺激域(例如CD28或CD27)置换之CAR亦被称作习知CAR。为了克服习知CAR之限制,已描述若干替代性设计或下一代CAR,包括TCR受体融合蛋白或TFP(WO 2016/187349 A1)、抗体TCR或AbTCR(PCT/US2016/058305)。Tri-TAC(WO 2015/117229 A1)及合成免疫受体或SIR(US 62/429,597及PCT/US17/64379)。如本文所用,术语“CAR(CAR/CARs)”亦涵盖将抗原特异性赋予至细胞之较新方法(亦即TFP、AbTCR、Tri-Tac、SIR及zSIR等)。本发明提供可用于产生CAR之若干新颖抗原结合域。尽管未激动地描述,但设想,此等抗原结合域(例如scFv、vL、vH或vHH等)可用于生成习知第一代及第二代CAR以及将抗原特异性赋予至细胞之较新方法(亦即TFP、AbTCR、Tri-Tac、SIR和zSIR等)。因此,当双链SIR、双链Ab-TCR或双链zSIR与包含SIR、Ab-TCR或zSIR之两条恒定链(例如TCRa/b或TCRg/d)融合时,给定抗原结合域之vL及vH片段可用于产生此等片段。相同抗原结合域之vL及vH片段可经由可挠性连接子接合,以生成scFv,使用此项技术中已知之方法,其转而可用于生成习知第一或第二代CAR、TFP或Tri-TAC。
“密码子优化”或“控制物种密码子偏性”系指特定宿主细胞之较佳的密码子使用。
如本文所用,共表现系指表现两个或更多个基因。基因可为编码例如单一蛋白质或呈单一多肽链形式之嵌合蛋白之核酸。举例而言,本文所描述之zSIR可由单一聚核苷酸链编码及合成为单一多肽链,其随后裂解成不同多肽,各自表示不同功能单元。在zSIR由两个或更多个功能性多肽单元组成之一些实施例中,使用一或多个聚核苷酸链来共表现不同功能单元。在另一实施例中,不同聚核苷酸链由编码可裂解连接子(例如,T2A、F2A、P2A、E2A等)之核酸序列连接。在另一实施例中,亦将Ser-Gly-Ser-Gly(SGSG)基元(SEQ ID NO:86-87及4085-86)添加在可裂解连接子序列之上游,以增强裂解效率。可裂解连接子之潜在缺点为,留在N端蛋白质之末端小2A标签可能影响蛋白质功能或造成蛋白质之抗原性的可能性。为了克服此,在一些实施例中,将furine裂解位点(RAKR)(SEQ ID NO:88-90及4087-4089)添加在SGSG基元之上游,以促进在转译之后残余2A肽之裂解。编码zSIR之不同单元之聚核苷酸可由IRES(内部核糖体进入位点)序列连接。替代地,zSIR之不同功能单元由不经由连接子连接但实际上由例如两个不同载体编码之两个不同聚核苷酸编码。可裂解连接子之核酸序列提供于SEQ ID NO:80至SEQ ID NO:85中。
应认识到,蛋白质可彼此具有一致性或同源性且保留相似或相同的功能。举例而言,本发明包括与本文所描述之序列中之任一者具有85%、90%、95%、97%、98%、98.5%、99%或99.9%一致性同时保持生物活性之CD3z链。
术语“共刺激分子”系指T细胞上之同源结合搭配物,其与共刺激配位体特异性结合,从而藉由T细胞(诸如(但不限于))增殖调节共刺激反应。共刺激分子包括(但不限于)MHC I类分子、BTLA及Toll配位体受体以及OX40、CD27、CD28、CD8、ICAM-1、LFA-1(CD11a/CD18)、ICOS(CD278)和4-1BB(CD137)。此类共刺激分子之其他实例包括CD8、ICAM-1、GITR、BAFFR、HVEM(LIGHTR)、SLAMF7、NKp80(KLRF1)、NKp44、NKp30、NKp46、CD160、CD19、CD4、CD8α、CD8β、IL2Rβ、IL2Rγ、IL7Rα、ITGA4、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CDlld、ITGAE、CD103、ITGAL、CDlla、LFA-1、ITGAM、CDllb、ITGAX、CDllc、ITGB1、CD29、ITGB2、CD18、LFA-1、ITGB7、NKG2D、NKG2C、TNFR2、TRANCE/RANKL、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(Tactile)、CEACAM1、CRT AM、Ly9(CD229)、CD160(BY55)、PSGL1、CDlOO(SEMA 4D)、CD69、SLAMF6(NTB-A、Ly108)、SLAM(SLAMF1、CD150、IP0-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、LAT、GADS、SLP-76、PAG/Cbp、CD19a及与CD83特异性结合之配位体。共刺激胞内信号传导域可为共刺激分子之胞内部分。共刺激分子可呈现于以下蛋白质家族中:TNF受体蛋白、免疫球蛋白样蛋白质、细胞介素受体、整合素、信号传导淋巴球性活化分子(SLAM蛋白)及活化NK细胞受体。此类分子之实例包括CD27、CD28、4-1BB(CD137)、OX40、GITR、CD30、CD40、ICOS、BAFFR、HVEM、ICAM-1、淋巴球功能相关抗原-1(LFA-1)、CD2、CD8、CD7、CD287、LIGHT、NKG2C、NKG2D、SLAMF7、NKp80、NKp30、NKp44、NKp46、CD160、B7-H3及与CD83特异性结合之配位体及其类似者。胞内信号传导域可包含衍生其之分子的整个胞内部分或整个原生胞内信号传导域,或其功能片段或衍生物。
术语疾病特异性抗原或疾病相关抗原或致病抗原系指表现在细胞上,有助于疾病之发展的抗原。
术语“致病细胞”或“疾病相关细胞”系指有助于疾病之发展之细胞。例示性致病细胞包括癌细胞及受病毒感染细胞。非癌细胞(诸如B淋巴球及T淋巴球)已与免疫、过敏、退化性及传染性疾病之病原性相关,且亦视为致病细胞。
术语“疾病支持抗原”系指表现于细胞上,支持致病细胞之存活、增殖、生存或活性之抗原。在一些实施例中,疾病支持抗原为存在于基质细胞上之抗原。在一些实施例中,在不希望受理论束缚之情况下,表现CAR之细胞破坏疾病支持细胞,从而间接阻断致病细胞之生长或存活。例示性基质细胞抗原包括骨髓基质细胞抗原2(BST2)、纤维母细胞活化蛋白(FAP)及肌腱蛋白。
术语“退化性病症”系指基于退化性细胞变化之连续过程所致,影响组织或器官(其将随着时间推移越来越恶化),不管是归因于正常身体损耗还是生活方式选择(诸如运动或饮食习惯)的疾病。例示性退化性疾病包括阿兹海默氏症(Alzheimer′s disease)、恰克-马利-杜斯氏症(Charcot-Marie-Tooth disease)、库贾氏病(Creutzfeldt-Jakobdisease)、弗里德赖希共济失调(Friedreich′s ataxia)、糖尿病(II型)及动脉粥样硬化。
“来源于”,当该术语在本文中使用时,指示第一分子与第二分子之间的关系。其一般系指第一分子与第二分子之间的结构相似性,且不涵盖或包括对来源于第二分子之第一分子的方法或来源限制。举例而言,在来源于抗体分子之抗原结合域之情况下,抗原结合域保留足够的抗体结构以使得具有所需功能,即与抗原结合的能力。
词组“与表现目标抗原相关的疾病”或“疾病相关抗原”包括(但不限于)与表现如本文所描述之目标抗原相关的疾病、或与表现如本文所描述之目标抗原之细胞相关的病状,包括例如增生性疾病,诸如癌症或恶性疾病或癌前期病状,诸如脊髓发育不良、骨髓发育不良症候群或白血病前期;或与表现如本文所描述之目标抗原相关之细胞的非癌症相关适应症。在一个态样中,与表现如本文所描述之肿瘤抗原相关之癌症为血液癌。在一个态样中,与表现如本文所描述之肿瘤抗原相关之癌症为实体癌症。与表现如本文所描述之肿瘤抗原相关之其他疾病包括(但不限于)与表现如本文所描述之肿瘤抗原相关之非典型及/或非经典癌症、恶性疾病、癌前期病状或增殖性疾病。与表现如本文所描述之目标抗原相关之非癌症相关适应症包括(但不限于)例如自体免疫疾病(例如狼疮)、发炎性病症(过敏及哮喘)及移植。在一些实施例中,表现目标抗原之细胞表现或在任何时间表现编码目标抗原之mRNA。在另一实施例中,表现目标抗原之细胞产生目标抗原蛋白质(例如野生型或突变型),且目标抗原蛋白质可以正常水平或降低水平存在。在一个实施例中,表现目标抗原之细胞在一个时间点产生可侦测水平之目标抗原蛋白质,且随后产生实质上不可侦测之目标抗原蛋白质。
如本文所用,“由经基因修饰之细胞靶向之疾病”涵盖在任何疾病中涉及以任何方式由经基因修饰之细胞靶向滋生疾病或目标组织或细胞类型之任何细胞,无论经基因修饰之细胞是否靶向患病细胞或健康细胞以实现治疗有益结果。
术语“解离常数(Kd)”定义为受体-配位体相互作用之解离之平衡常数。
术语“编码”系指诸如基因、cDNA或mRNA之聚核苷酸中之核苷酸之特异性序列,在生物过程中充当合成其他聚合物及大分子之模板的固有特性,该等聚合物及大分子具有已确定之核苷酸序列(例如rRNA、tRNA及mRNA)或已确定之胺基酸序列及由其获得之生物特性。因此,若对应于基因之mRNA之转录及转译在细胞或其他生物系统中产生蛋白,则基因、cDNA或RNA编码该蛋白。核苷酸序列与mRNA序列一致且通常提供于序列表中的编码链与用作基因或cDNA转录之模板的非编码链,均可被称作编码蛋白质或其他产物之基因或cDNA。
除非另外规定,否则编码胺基酸序列之核苷酸序列包括彼此互为简并型式且编码相同胺基酸序列之所有核苷酸序列。编码蛋白质或RNA之词语核苷酸序列亦可在一定程度上反式包括,可在一些型式中含有内含子编码蛋白质的核苷酸序列。
术语“有效量”或“治疗有效量”在本文中可互换使用,且系指如本文所描述能有效达成特定生物学结果之化合物、调配物、材料或组合物之量。
术语“内源性”、“原生”或“天然存在”系指来自或在生物体、细胞、组织或系统内部产生之任何物质。其亦系指细胞原生或在细胞中天然表现之基因、蛋白质、核酸(例如DNA、RNA等)或其片段。
术语外源性系指自生物体、细胞、组织或系统外部引入或产生之任何物质。
术语“表现”系指由启动子及/或其他调节元件驱动之特定核苷酸序列之转录及/或转译。
术语“转移载体”系指包含经分离核酸且可用于将经分离核酸传递至细胞内部之物质组合物。因此,术语“转移载体”包括自主复制质体或病毒。该术语亦应解释为进一步包括促进核酸转移至细胞中之非质体及非病毒化合物,诸如聚离胺酸化合物、脂质体及其类似者。病毒转移载体之实例包括(但不限于)腺病毒载体、腺相关病毒载体、反转录病毒载体、慢病毒载体及其类似者。
表现载体包括此项技术中已知之全部,包括并入重组聚核苷酸之黏质体、质体(例如裸露或含于脂质体中)及病毒(例如慢病毒、反转录病毒、腺病毒及腺相关病毒)。
如本文所用,抗原决定基定义为能够引发免疫反应之抗原部分,或与抗体或抗体片段结合之抗原部分。抗原决定基可为蛋白质序列或子序列。
术语“表现载体”系指包含重组聚核苷酸之载体,该重组聚核苷酸包含与待表现核苷酸序列可操作地连接之表现控制序列。表现载体包括此项技术中已知之全部,包括并入重组聚核苷酸之黏质体、质体(例如裸露或含于脂质体中)及病毒(例如慢病毒、反转录病毒、腺病毒及腺相关病毒)。
术语例如zSIR之“功能性多肽单元(FPU)”系指包含功能上与抗原结合域及例如CD3z链连接之胺基端信号序列的多肽。举例而言,抗原结合域位于信号序列与CD3z链之间。
术语“功能部分”当用于提及例如zSIR时,系指多肽(例如zSIR)之任何部分或片段,该部分或片段保留呈其部分(例如母体zSIR)之所需分子(例如zSIR)之生物活性。举例而言,功能部分涵盖在与母体zSIR类似程度、相同程度或较高程度上,保留识别目标细胞或侦测、治疗或预防疾病之能力之zSIR的彼等部分。提及母体zSIR,功能部分可包含例如母体zSIR之约10%、25%、30%、50%、68%、80%、90%、95%或更多。
如本文所用,“经基因修饰之细胞”、“再引导细胞”、“基因工程改造细胞”或“经修饰细胞”系指已经修饰以表现CAR(例如习知第2代CAR、TFP、AbTCR、SIR、Tri-Tac及zSIR)或重组TCR之细胞。举例而言,表现CAR或zSIR之经基因修饰之T淋巴球为经基因修饰之细胞。
术语免疫病症系指特征在于免疫系统之功能障碍的疾病。自体免疫疾病为由针对正常身体部分之异常免疫反应引起的病状。存在至少80种类型的自体免疫疾病。
“免疫效应细胞”在该术语在本文中使用时,系指涉及免疫反应,例如促进免疫效应反应之细胞。免疫效应细胞之实例包括T细胞,例如α/βT细胞及γ/δT细胞、B细胞及自然杀手T(NKT)细胞。
“表现免疫受体之细胞”在该术语在本文中使用时,系指涉及免疫反应,例如促进免疫效应反应且表现一或多个免疫受体(诸如内源性TCR、重组TCR或CAR)之细胞。表现免疫受体之细胞之实例包括T细胞,例如α/βT细胞及γ/δT细胞及NKT细胞。
“免疫效应功能或免疫效应反应”在该术语在本文中使用时,系指例如免疫效应细胞之功能或反应,其增强或促进目标细胞之免疫攻击,例如免疫效应功能或反应系指T细胞或NK细胞促进杀死或抑制目标细胞之生长或增殖的特性。在T细胞之情况下,一级刺激及共刺激为免疫效应功能或反应之实例。
如本文所用之术语“胞内信号传导域”系指分子之胞内信号传导部分。胞内信号传导域产生促进例如含有CAR(例如第2代CAR、TFP、AbTCR、SIR、Tri-TAC及/或zSIR)之细胞之免疫效应功能的信号。免疫效应功能之实例包括细胞溶解活性及辅助活性,包括细胞介素之分泌。TCRα/β/γ/δ链不具有其自身之胞内信号传导域,但借由与拥有信号传导域之TCR信号传导复合物(例如CD3z、CD3e、CD3d及CD3g)之其他链缔合而传输信号。在另一实施例中,胞内信号传导域可包含一级胞内信号传导域。例示性一级胞内信号传导域包括来源于负责一级刺激或抗原依赖性模拟之分子的彼等者。在另一实施例中,胞内信号传导域可包含共刺激胞内域。例示性共刺激胞内信号传导域包括来源于负责共刺激信号或抗原非依赖性刺激之分子的彼等者。举例而言,一级胞内信号传导域可包含CD3z之细胞质序列,且共刺激胞内信号传导域可包含来自辅受体或共刺激分子(诸如CD28或41BB)之细胞质序列。
一级胞内信号传导域可包含已知为基于免疫受体酪胺酸之活化基元或ITAM的信号传导基元。含有ITAM之一级细胞质信号传导序列之实例包括(但不限于)来源于CD3ξ、常见FcRγ(FCER1G)、FcγRIIa、FcRβ(FcεR1b)、CD3γ、CD3δ、CD3ε、CD79a、CD79b、DAPlO及DAP12的彼等者。
如本文所用,术语“连接子”(同样“连接子域”或“连接子区域”)系指本文所揭示之CAR(例如第2代CAR、TFP、AbTCR、SIR及zSIR)之两个或更多个域或区域接合在一起的寡聚肽或多肽。连接子可在任何地方,长度为1至500个胺基酸。在一些实施例中,“连接子”为可裂解或不可裂解的。除非另外规定,否则本文所用之术语“连接子”意谓不可裂解的连接子。不可裂解的连接子可由允许相邻蛋白质域相对于彼此自由活动之可挠性残基构成。此类残基之非限制性实施例包括甘胺酸及丝胺酸。在一些实施例中,连接子包括非可挠性残基。具有非可挠性连接子之连接子之例示性实施例为EAAAK(SEQ ID NO:4011)、E-螺旋(SEQ ID NO:4009)、K-螺旋(SEQ ID NO:4010)或PG4SP(SEQ ID NO:4007)。在其他实施例中,接合zSIR之抗原结合域及CD3z链之连接子共享类似长度。在其他实施例中,接合zSIR之抗原结合域及CD3z链之连接子长度相差不大于20个胺基酸,通常不大于10个胺基酸,较佳地不大于5个胺基酸,更佳地不大于2个胺基酸。在一些实施例中,接合zSIR之抗原结合域及CD3z链之连接子具有相同或类似的胺基酸组成。具有一致组成的例示性连接子为PG4SP(SEQ ID NO:4007)及PG4SP-v2(SEQ ID NO:4008)。在一些实施例中,接合zSIR之抗原结合域及CD3z链之连接子为PG4SP(DNA SEQ ID NO:8;PRT SEQ ID NO:4007)及PG4SP-v2(DNA SEQ ID NO:9;PRT SEQ ID NO:4008)。
在一些实施例中,接合zSIR之抗原结合域及CD3z链之连接子来源于抗体。在一个实施例中,接合zSIR之vL区域及CD3z链之连接子为IgCL(DNA SEQ ID NO:28;PRT SEQ IDNO:4027),且接合zSIR之vH区域及CD3z链之连接子为IgG1-CH1(DNA SEQ ID NO:29及PRTSEQ ID NO:4028)。在一些实施例中,接合zSIR之各别抗原结合域及CD3z链之连接子为IgCL(DNA SEQ ID NO:28;PRT SEQ ID NO:4027)及IgG2-0C-CH1(DNA SEQ ID NO:30;PRT SEQID NO:4029)。在一些实施例中,连接子可包含抗原决定基标签。在一些实施例中,抗原决定基标签系选自由以下组成之群:MYC标签、V5标签、AcV5标签、StreptagII、FLAG标签或HA。在一些实施例中,不可裂解的连接子具有足以确保两个相邻域不在空间上彼此干扰之长度。在本发明之一个实施例中,在位于zSIR之抗原结合域与CD3z链之间的连接子的羧基端添加三个胺基酸残基(Gly-Ser-Gly)(例如Myc标签或V5标签)。在某些实施例中,连接子可携带额外序列,诸如限制酶位点。
如本文所用之术语“可挠性多肽连接子”系指由单独或组合形式之胺基酸(诸如甘胺酸及/或丝胺酸残基)组成,用于将多肽链(例如可变重链及可变轻链区)连接在一起的肽连接子。在一个实施例中,可挠性多肽连接子为Gly/Ser连接子,且包含胺基酸序列(Gly-Gly-Gly-Ser)
术语慢病毒系指反转录病毒科家族之属。HIV、SIV及FIV为慢病毒之所有实例。
术语“慢病毒载体”系指来源于慢病毒基因组之至少一部分的载体,尤其包括如Milone等人,Mol.Ther.17(8):1453-1464(2009)中所提供之自身失活慢病毒载体。临床中可使用之慢病毒载体之其他实例包括(但不限于)例如来自Oxford BioMedica之
如本文所用,非天然存在之TCR抗原结合域″系指与相对于在自然界中存在之TCR为嵌合及非天然存在之TCR恒定区或CD3z链可操作地连接的结合域。换言之,非天然存在之TCR抗原结合域为使用重组分子生物学技术,与TCR恒定链或CD3z链可操作地连接而“的工程改造”的,且此外该抗原结合域系获自或来源于不同于在自然界中发现之TCR的分子。不同于自然界中之TCR之抗原结合域包括抗体vH及vL片段、人类化抗体片段、嵌合抗体片段、受体配位体及其类似者。
术语“可操作地连接”系指第一组分与第二组分之间的功能性连接或缔合,以使得每一组分可为功能性的。举例而言,可操作地连接包括调节序列与异源核酸序列之间的缔合,其使得后者表现。举例而言,当第一核酸序列与第二核酸序列以功能关系置放时,第一核酸序列与第二核酸序列可操作地连接。在两条多肽可操作地连接之情形下,第一多肽以其将独立于任何连接之方式起作用,且第二多肽如同其将不存在两者之间的连接一样起作用。
在两种或更多种核酸或多肽序列之情形下,百分比一致性系指相同的两种或更多种序列。若当在比较窗或指定区域上进行最大对应性比较及比对时,两个序列具有指定百分比之相同(例如在指定区域上,或当未指定时,在完整序列上,60%一致性,视情况70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%一致性)的胺基酸残基或核苷酸,则两个序列为“实质上一致”的,如使用以下序列比较算法中之一者或藉由手动比对及目视检查所量测。视情况而言,一致性存在于至少约50个核苷酸(或10个胺基酸)长度之区域上,或更佳100至500或1000或更多个核苷酸(或20、50、200或更多个胺基酸)长度之区域上。
术语“聚核苷酸”、“核酸”或“重组核酸”系指核苷酸,诸如脱氧核糖核酸(DNA)及(在适当时)核糖核酸(RNA)之聚合物。
“蛋白质”或“多肽”,该等术语在本文中可互换使用,包含称为胺基酸之化学建构嵌段藉由称为肽键之化学键连接在一起形成胺基酸聚合物之一或多条链。
如本文所用,难治性系指对治疗不起反应之疾病,例如癌症。在实施例中,难治性癌症在治疗开始前或开始时可对治疗具有抗性。在其他实施例中,难治性癌症可在治疗期间变得具有抗性。难治性癌症亦称为抗性癌症。
如本文所用,“复发性”系指疾病(例如,癌症)或诸如癌症之疾病之迹象及症状在一段好转的时间之后,例如在疗法,例如癌症疗法之先前治疗之后恢复。
范围:在本发明通篇中,本发明之各种态样可以范围格式呈现。应理解,范围格式中之描述仅为了方便及简洁起见,且不应解释为对本发明范畴的固定限制。
术语“反转录病毒载体(retrovirus vector/retroviral vector)”系指来源于反转录病毒基因组之至少一部分之载体。反转录病毒载体之实例包括如获自Addgene或Clontech之MSCVneo、MSCV-pac(或MSCV-puro)、MSCV-hygro。反转录病毒载体之其他实例为MSCV-Bgl2-AvrII-Bam-EcoR1-Xho-BstB1-Mlu-Sal-ClaI.I03(SEQ ID NO:131)。
术语“睡美人转座子”或“睡美人转座子载体”系指来源于睡美人转座子基因组之至少一部分之载体。睡美人转座子载体之实例为pSBbi-Pur(SEQ ID NO:133)。编码SIR之睡美人转座子载体之其他实例提供于SEQ ID NO:134及SEQ ID NO:135中。
术语“scFv”系指包含含有轻链可变区之至少一个抗体片段及含有重链可变区之至少一个抗体片段的融合蛋白,其中轻链及重链可变区例如经合成连接子(例如较短可挠性多肽连接子)连续连接且能够表现为单链多肽,且其中scFv保留其所来源之完整抗体的特异性。除非指明,否则如本文所用,scFv可例如相对于多肽之N端及C端末端具有任何顺序之vL及vH可变区,scFv可包含vL-连接子-vH或可包含vH-连接子-vL。在本发明中,scFv亦描述为vL-Gly-Ser-连接子-vH。举例而言,FMC63-vL-Gly-Ser-连接子-FMC63-vH系指含有经由由Gly及Ser残基组成的连接子连接之FMC63单株抗体之vL及vH片段的scFv。可替代地,scFv亦描述为(vL+vH)。举例而言,FMC6-(vL+vH)系指含有经由连接子连接之FMC63抗体之vL及vH片段的scFv,其中vL片段位于N端处。
术语“信号传导域”系指在细胞内传输信息以藉由产生第二信使或藉由响应于此类信使充当效应子经限定信号传导路径调节细胞活性的蛋白质的功能区域。
术语合成免疫受体或替代地“SIR”系指多肽,通常两个多肽(例如杂或均二聚体),在一些实施例中,当在效应细胞中表现时,其为细胞提供针对目标细胞,通常癌细胞之特异性,及胞内信号产生。SIR已在PCT/US17/64379中描述。在一典型实施例中,SIR包含一或多个抗原结合域(例如抗体或抗体片段、配位体或受体),该一或多个抗原结合域与如本文所描述之抗原或同源配位体结合,且经由视情况选用之连接子与一或多个T细胞受体恒定链或区域接合。在一些实施例中,该多肽集合彼此邻接。在一些实施例中,SIR包含两个或更多个多肽之两个或更多个集合。每一SIR集合之多肽彼此邻接(功能多肽单元1),但不与其他集合之多肽邻接(功能多肽单元2)。在一些态样中,SIR之T细胞受体恒定链(或区域)系选自以下之恒定链:人类T细胞受体-α(TCR-α或TCRα或TCRa或hTCR-α或hTCRα或hTCRa或Cα)、人类T细胞受体-β1(TCR-β1或TCRβ1或TCRb1或hTCR-β1或hTCRβ1或hTCRb1或Cβ1)、人类T细胞受体-β2(TCR-β2或TCRβ2或TCRb2或hTCR-β2或hTCRβ2或hTCRb2或Cβ2(亦称为TCR-β)、TCRβ或TCRb或Cβ)、人类前T细胞受体α((preTCR-α或preTCRα或preTCRa或preCα)。、人类T细胞受体-γ(TCR-γ或TCRγ或TCRg或hTCR-γ或hTCRγ或hTCRg或hTCRγ1或hTCRγ1或Cγ)或人类T细胞受体-δ(TCR-δ或TCRd或TCRδ或hTCR-δ或hTCRd或hTCRδ或Cδ)。在一些实施例中,SIR之TCR恒定链由其野生型核苷酸序列编码,而在其他态样中,SIR之TCR恒定链由不为野生型之核苷酸序列编码。在一些实施例中,SIR之TCR恒定链由其密码子优化之序列编码。在一些实施例中,SIR之TCR恒定链编码野生型多肽序列,而在其他实施例中,SIR之TCR恒定链编码携带一或多个突变之多肽。在一些实施例中,SIR之TCR恒定链由携带一或多个突变之其密码子优化的序列编码。包含靶向特异性肿瘤制造机″X″之抗原结合域(例如scFv或vHH)之SIR(诸如本文所描述的彼等)亦被称作X-SIR或XSIR。举例而言,包含靶向CD19之抗原结合域之SIR被称作CD19-SIR或CD19SIR。SIR之TCR恒定链/域可来源于其中最终将使用SIR之相同物种。举例而言,对于在人类中使用,可能为有益的是,SIR之TCR恒定链来源于或包含人类TCR恒定链。然而,在一些情况下,有益的是,TCR恒定链来源于其中将最终使用SIR之相同物种,但经修饰以携带增强TCR恒定链之表现的胺基酸取代。举例而言,对于在人类中使用,可能为有益的是,SIR之TCR恒定链来源于或包含人类TCR恒定链,但其中某些胺基酸经来自鼠类TCR恒定链之对应胺基酸置换。此类“鼠化”TCR恒定链提供增加的SIR表现。例示性TCR恒定链之核酸序列提供于SEQ ID NO:39-64(表5)中。例示性TCR恒定链之胺基酸序列提供于SEQ ID NO:4038-4063(表5)中。SIR或其功能部分可在胺基或羧基端处或在两端处包括额外胺基酸,该等额外胺基酸不存在于TCR之胺基酸序列或构成SIR之抗原结合域中。期望额外胺基酸不会干扰SIR或功能部分之生物功能,例如识别目标细胞,侦测癌症,治疗或预防癌症等。更加期望额外胺基酸使生物活性相较于母体SIR之生物活性增强。
术语“刺激”系指由刺激分子(例如TCR/CD3复合物或SIR)与其同源配位体(或在SIR之情况下,目标抗原)之结合诱导的一级反应,从而调节信号转导事件,诸如(但不限于)经由TCR/CD3之信号转导。刺激可介导某些分子之经改变表现。
术语“TCR受体融合蛋白或TFP”系指如WO2016/187349 A1中所描述之下一代CAR平台,该文献以引用之方式并入本文中。在一实施例中,TFP包含与目标抗原特异性结合、与TCR链(诸如CD3ε、CD3γ、CD3δ、TCRα或TCRβ)融合之抗体部分。可用于构筑TFP之例示性TCR链提供于WO2017/070608 A1中,该文献以引用之方式并入本文中。并入CD3ε链之TFP被称作CD3εTFP。并入CD3γ链之TFP被称作CD3γTFP。并插入CD3δ链之TFP被称作CD3δTFP。并插入CD3ε、CD3γ或CD3δ链之TFP统称为CD3ε/γ/δTFP。并入靶向本发明中描述之BCMA之抗原结合域BCMA-Am06-HL且共表现编码NEMO-K277A之附属模块的例示性TFP提供于SEQ ID NO:4384-4387(表6)中。并入本发明中描述之不同抗原结合域且共表现编码NEMO-K277A之附属模块的例示性TFP提供于表7中。此等TFP之SEQ ID NO、抗原结合域及目标抗原可藉由参考表6来判定,此系由于表7中列举之不同构筑体(亦即CAR类别)之次序与表6中列举之构筑体(亦即CAR类别)之次序相同。编码NEMO-K277A之附属模块为视情况选用的。可构筑不具有NEMO-K277A之本发明中描述之具有抗原结合域(亦即vL及vH片段、配位体及受体等)的TFP。因此,可自由SEQ ID NO:1900-3123表示之TFP缺失此附属模块以及上游Furine-SGSG-F2A序列。可替代地,编码NEMO-K277A之附属模块可经编码其他信号传导蛋白质之附属模块置换,诸如hNEMO-K277A-deltaV249-K555、mNEMO-K270A、K13-opt、IKK2-S177E-S181E、或IKK1-S176E-S180E及MyD88-L265P、FKBPx2-NEMO、NEMO-L600-FKBPx2及CMV-141等。
术语“刺激分子”系指由免疫细胞(例如T细胞、NK细胞、B细胞)表现之分子,该分子提供针对免疫细胞信号传导路径之至少一些态样以刺激方式调节免疫细胞活化之细胞质信号传导序列。
术语“个体”意欲包括其中可以引起免疫反应之活生物体(例如任何驯养的哺乳动物或人类)。
术语“T细胞”及“T淋巴球”在本文中可互换及同义地使用。实例包括(但不限于)原生T细胞(“淋巴球先驱细胞”)、中枢记忆T细胞、效应记忆T细胞、干细胞(T
术语“治疗效果”系指可藉由各种手段体现之生物作用,包括(但不限于)例如肿瘤体积减少、癌细胞数目降低、传染剂之群落计数降低、与疾病病状相关之各种生理学症状之改善、首先预防疾病发生或预防疾病复发。
如本文所用,术语“治疗(Treatment/treating)”系指治疗性治疗及预防性或防治性措施两者。需要治疗之个体包括已患有病状之个体以及易于罹患病状之个体,或待预防病状之个体。
术语“泽塔(zeta)”(或由希腊符号“ζ”定义)或替代地“ζ链”、“CD3-ζ”或“TCR-ζ”定义为提供为GenBank寄存编号BAG36664.1之蛋白质,或来自非人类物种(例如小鼠、啮齿动物、猴、猿及其类似者)之等效残基;及“ζ刺激域”或替代地“CD3-ζ刺激域”或“TCR-ζ刺激域”定义为来自ζ链之细胞质域的胺基酸残基,或功能上足以传输T细胞活化必需之初始信号的其功能衍生物。在一个态样中,ζ之细胞质域包含GenBank寄存编号BAG36664.1之残基52至164,或来自非人类物种(例如小鼠、啮齿动物、猴、猿及其类似者)之等效残基,该等等效残基为其功能直系同源物。在一个态样中,“ζ刺激域”或“CD3-ζ刺激域”为提供为DNASEQ IDNO:101及PRT SEQ ID NO:4100之序列。
本文提供组合物,其包含CAR及视情况选用之一或多个附属模块;及使用其来治疗疾病(包括癌症)之方法。如本文所描述,CAR(表1)及如表2中所描述的附属模块之特定组合定义“主链”(表2)。
表1:CAR架构.第一代CAR(习知CAR1或CARI)具有抗原特异性域(ASD)、胞内信号传导域(ISD)(例如,CD3z)及无共刺激域。TCR融合蛋白(TFP)为描述于WO 2016/187349 A1中但类似于习知CAR1具有抗原特异性域(ASD)及胞内信号传导域的下一代CAR。第二代CAR(习知CAR2或CARII)具有抗原特异性域(ASD)、一个共刺激域(例如41BB或CD28)及胞内信号传导(ISD)域(例如CD3z)。第三代CAR(习知CAR3或CARIII)具有抗原特异性域(ASD)、两个共刺激域(例如41BB及CD28)及胞内信号传导(ISD)域(例如CD3z)。AbTCR为双链受体且已描述于PCT/US2016/058305中。cTCR为单链、一条半或双链受体,其由来源于与TCR恒定链融合之vL及vH片段之抗原结合域组成,且引起T细胞信号传导之活化。合成免疫受体为下一代cTCR,且描述于US62/429,597及PCT/US017/064379中。SIR可为单链、一条半或双链受体,其由与一或多个TCR恒定链融合之一或多个抗原结合域组成,且在配位体结合后引起T细胞信号传导之活化。zSIR描述于本申请案中。
zSIR为含有两条CD3-ζ(CD3z)链之合成免疫受体(SIR)之新颖平台。可用于构筑zSIR之CD3z链之核酸及胺基酸序列提供于DNASEQ ID NO:67及71以及PRT SEQ ID NO:4066及4072中。本发明提供,抗体之vL片段可与两条CD3z链中之一者接合,且vH片段可与另一条CD3z链接合。当两条此类链(例如vL-CD3z及vH-CD3z)在相同细胞中共表现时,vL及vH片段可结合在一起,识别其同源抗原或结合搭配物且传输T细胞信号。特定言之,当暴露于表现目标抗原之细胞株时,表现此类zSIR之T细胞可活化NFAT信号传导,诱导IL2产生且发挥细胞毒性。zSIR之表现及活性可藉由在vL/vH与CD3z片段之间并入连接子进一步增加。特定言之,来源于抗体之IgCL及IgCH域充当vL/vH及CD3z片段之间的适用连接子。可用于构筑zSIR之例示性连接子提供于SEQ ID NO:4004至4037(表5)中。图1中提供本发明涵盖之zSIR之示意性实例。
举例而言,zSIR1,scFv之vL片段与一个CD3z-ECD-TM-CP(胞外域、跨膜域及细胞质域)接合,且vH片段与第二CD3zECDTMCP接合。例示性zSIR1提供于SEQ ID NO:425中。在zSIR2中,一个ASD(例如scFV片段)与一个CD3zECDTMCP(胞外域、跨膜域及细胞质域)接合,且第二ASD与第二CD3zECDTMCP接合。例示性zIR2提供于SEQ ID NO:3961中。两个ASD可靶向相同或不同抗原或相同抗原之不同抗原决定基。其中两个ASD靶向两个不同抗原之例示性zSIR2提供于SEQ ID NO:3962中。其中两个ASD靶向相同抗原之两个抗原决定基之例示性zSIR2提供于SEQ ID NO:3961中。在zSIR3中,scFV之vL片段经由来源于免疫球蛋白之cL连接子(SEQ ID NO:28及4027)与一个CD3zECDTMCP(胞外域、跨膜域及细胞质域)接合,且vH片段经由CH1连接子(SEQ ID NO:29及4028)与第二CD3zECDTMCP接合。例示性zSIR3为CD8-hCD19-EUK5-13-vL-IgCL-Bam-CD3zECDTMCP-opt-F-P2A-Spe-SP-Bst-hCD 19-EUK5-13-vH-IgG1-CH1-KPN-CD3zECDTMCP-opt2-F-F2A-Xba-PAC(SEQ ID NO:3955)。可用于构筑zSIR之其他连接子在表5中列出。
在另一实施例中,亦将共刺激域并入zSIR之CD3z链中。例示性共刺激域包括41BB(SEQ ID NO:69及SEQ ID NO:4068)及CD28(SEQ ID NO:69及SEQ ID NO:4067)之共刺激域。含有41BB(BB)(参见上文示意性″C″)及CD28(参见上文示意性″D″)共刺激域之CD3z链展现于SEQ ID NO(DNA):76-79及SEQ ID NO(PRT):4075-4078中。具有含有CD28共刺激域之CD3z之例示性zSIR由CD8SP-BCMA-Am06-HL-vL-[CD3zECDTM-28z-opt]-F-P2A-SP-BCMA-Am06-HL-vH-[CD3zECDTM-28z-opt2](SEQ ID NO(DNA):3971及(SEQ ID NO(PRT):7971)表示。具有含有41BB共刺激域之CD3z之例示性zSIR由CD8SP-BCMA-Am06-HL-vL-[CD3zECDTM-BBz-opt]-F-P2A-SP-BCMA-Am06-HL-vH-[CD3zECDTM-BBz-opt2](SEQ ID NO(DNA):3972及(SEQID NO(PRT):7972)表示。zSIR 4-9类似于zSIR 1-3,不同之处在于CD3zECDTMCP经CD3zECDTM-BBz或经CD3zECDTM-28z域取代。
表1
表2:例示性主链
表3:靶向用于构筑CAR之不同抗原之vL、vH及scFv片段之序列表
表4:属于靶向不同抗原之不同抗原结合域之vL及vH区域之各种CDR的序列表
表5
表6:基于BCMA-Am06-HL抗原结合域之不同CAR类别之序列表亦显示CAR类型及附属模组。CAR类别16及17表示双链SIR之一条链,且仅当与其互补链(亦即分别CAR类别18及19)共表现时显示生物活性。CAR类别13-15(单链SIR)仅显示弱活性。
表7:含有不同抗原结合域之各种CAR构筑体之序列表。针对基于BCMA-Am06-HL之CAR,不同CAR构筑体之次序如表6中所示。
表8.例示性zSIR、SIR及其他构筑体
表9:例示性Vif构筑体
表10.靶向不同抗原之例示性双特异性抗体
表11:
表12:
表13:适用于各种实施例中之TCR链:
在一些实施例中,组合物包含编码CAR 1-15(表1)之核酸,其中CAR之抗原特异性域靶向如PCT/US2017/064379中之表3或表5-6中所描述之一或多个特异性抗原,该等文献以引用之方式并入本文中。在一些实施例中,组合物包含编码主链1-60(表2)中之任一者或多者之核酸,其中经编码CAR之抗原特异性域靶向如本文中及PCT/US2017/064379中之表3或表5-6中所描述之一或多种特异性抗原。在一些实施例中,组合物包含编码主链-1之核酸,其中主链-1中之CAR之抗原特异性域靶向如本文中及PCT/US2017/064379中之表3或表5-6中所描述之一或多种癌症特异性抗原。在一些实施例中,组合物包含编码主链-8之核酸,其中主链-8中之CAR之抗原特异性域靶向如本文中及PCT/US2017/064379中之表3或表5-6中所描述之一或多种癌症特异性抗原。
在各种实施例中,编码本文所描述的主链之CAR组分之经分离的核酸分子编码一个、两个、三个或更多个抗原特异性域(ASD)。
在各种实施例中,编码本文所描述之主链之CAR组分之经分离之核酸分子编码零个、一个、两个、三个或更多个共刺激域。
在各种实施例中,编码本文所描述之主链之CAR组分之经分离之核酸分子编码零个、一个、两个、三个或更多个胞内信号传导域。
在各种实施例中,编码本文所描述之CAR及主链之经分离之核酸分子编码零个、一个、两个、三个或更多个附属模块。
编码本文所描述之CAR及附属模块之所需组分之核酸序列可使用此项技术中已知之重组方法获得。可替代地,所关注核酸可以合成方式而非选殖方式产生。
在一些实施例中,表现本文所描述之CAR及辅助组分之本文所描述之经基因修饰之细胞亦表现降低CAR毒性之药剂。
在一些实施例中,表现本文所描述之CAR及辅助组分之本文所描述之经基因修饰之细胞亦表现增强CAR之活性之药剂。
在一些实施例中,表现本文所描述之CAR及辅助组分之本文所描述之经基因修饰之细胞亦表现增强CAR之持久性之药剂。
在一些实施例中,表现本文所描述之CAR及辅助组分之本文所描述之经基因修饰之细胞亦表现防止CAR耗尽之药剂。
包含如本文所描述之各种主链之组合物包含CAR,该等CAR包含与如本文所描述之癌症相关抗原特异性结合之一或多个ASD。ASD之序列与编码CAR之一或多个链的其余部分之核酸序列邻接且在相同阅读框中。
聚核苷酸、多肽、表现构筑体、表现包含本发明之抗原结合域之CAR的以重组方式工程化细胞,以及制备及使用此类多肽、聚核苷酸及细胞的方法,描述于此项技术中已知之方法及以下中描述之方法中:PCT/US2017/024843、WO 2014/160030 A2、WO 2016/187349A1、PCT/US2016/058305、WO 2015/117229 A1及PCT/US17/64379,该等文献以全文引用之方式并入本文中。
本发明提供若干抗原结合域,其可用于产生用于授受细胞疗法之CAR(例如CAR 1-15及主链1-60)。在一些实施例中,此等抗原结合域源于在癌症、非癌症增殖性病症(例如子宫内膜异位)及/或免疫病症中表现之抗体及目标抗原。目标抗原、此等抗原结合域之vL、vH及scFv片段之SEQ ID(DNA)及SEQ ID(PRT)示于表3中。靶向不同抗原之抗原结合域之vL及vH片段之CDR示于表4中。
在一些实施例中,靶向特定抗原之CAR多肽之经编码抗原结合域包含以下中之任一者或多者:SEQ ID NO:4118至4190、9631至9660及11460至11462、14386至14415之轻链可变域(vL或VL)胺基酸序列,该等序列靶向如表3中列举之抗原,其中至多9个胺基酸残基但不大于10个胺基酸经任何其他胺基酸残基置换;或与如SEQ ID NO:4118至4190、9631至9660、或11460至11462及14386至14415中之任一者中所阐述之胺基酸序列具有80-100%一致性的序列;或与SEQ ID NO:4118至4190、9631至9660、或11460至11462及14386至14415中之任一者之互补决定区(CDR)具有85-100%一致性的序列。具有SEQ ID NO:4118至4190、9631至9660或11460至11462之vL片段之CDR1、CDR2及CDR3分别由SEQ ID NO:11961至12066、12068至12173、12175至12280(表4)表示。
在一些实施例中,CAR(习知CAR及下一代CAR,例如SIR、zSIR、Ab-TCR、Tri-Tac及TFP)多肽之经编码一或多个抗原结合域包含以下中之任一者或多者:SEQ ID NO:4192至4264、9662至9691、11464至11466及14417至14446之重链可变域(vH或VH)胺基酸序列,该等序列靶向如表3中列举之抗原,其中至多9个胺基酸残基但不大于10个胺基酸经任何其他胺基酸残基置换;或与SEQ ID NO:4192至4264、9662至9691、11464至11466及14417至14446之胺基酸序列具有80-100%一致性的序列;或与SEQ ID NO:4192至4264、9662至9691、11464至11466及14417至14446中之任一者之互补决定区(CDR)具有85-100%一致性的序列。具有SEQ ID NO:4192至4264、9662至9691、11464至11466及14417至14446之vH片段之CDR1、CDR2及CDR3分别由SEQ ID NO:12282至12387、12389至12494、12497至12602、16219-16310(表4)表示。
在一些实施例中,CAR 1-15及主链1-60多肽之经编码一或多个抗原结合域包含以下中之任一者或多者:SEQ ID NO:4266至4338、9693至9722、11468至11470及14448-14477之单链可变片段(scFv)胺基酸序列,其中至多9个胺基酸残基但不大于10个胺基酸经任何其他胺基酸残基置换;或与SEQ ID NO:4266至4338、9693至9722、11468至11470及14448-14477之胺基酸序列具有80-100%一致性的序列;或与SEQ ID NO:4266至4338、9693至9722、11468至11470及14448-14477之互补决定区(CDR)具有85-100%一致性的序列。具有SEQ ID NO:4266至4338、9693至9722、11468至11470及14448-14477之scFv片段之vL区之CDR1、CDR2及CDR3分别由SEQ ID NO:11961至12066、12068至12173、12175至12280、16126-16217(表4)表示。具有SEQ ID NO:4266至4338、9693至9722、11468至11470及14448-14477之scFv片段之vH区之CDR1、CDR2及CDR3分别由SEQ ID NO:12282至12387、12389至12494及12497至12602及16219-16310(表4)表示。
应理解,scFv片段中之vL及vH片段之次序可为vL-vH或vH-vL。因此,即使表3中显示之例示性scFv片段表示vL-vH或vH-vL取向,具有互补取向(亦即vH-vL及vL-vH)之scFv片段亦可用于本发明之方法或组合物中。
可用于构筑不同CAR 1-15及主链1-60之例示性组件之DNA及PRT SEQ ID在表5中列出。基于来源于BCMA-AM06-HL scFv之vL及vH片段之例示性习知CAR(例如含有41BB共刺激域之第2代CAR)及下一代CAR(例如SIR、zSIR、Ab-TCR及TFP)之核酸及胺基酸SEQ ID提供于表6中。基于来源于其他scFv片段之vL及vH片段之例示性习知CAR(例如含有41BB共刺激域之第2代CAR)及下一代CAR(例如SIR、zSIR、Ab-TCR及TFP)之核酸及胺基酸SEQ ID,可通过用表3中列举的scFv片段之vL及vH片段置换BCMA-AM06-HL scFv之vL及vH片段来得出。含有不同抗原结合域之例示性CAR构筑体之序列在表7中提及。针对基于BCMA-Am06-HL之CAR,表7中之不同CAR构筑体之次序如表6中所示。因此,由SEQ ID NO:475表示之CAR构筑体类似于由SEQ ID NO:377表示之CAR构筑体,不同之处在于对应于抗原结合域BCMA-Am06-HL之vL及vH片段经对应于抗原结合域BCMA-Am14-HL之vL及vH片段置换。类似地,由SEQ ID NO:476表示之CAR构筑体类似于由SEQ ID NO:378表示之CAR构筑体,不同之处在于对应于抗原结合域BCMA-Am06-HL之vL及vH片段经对应于抗原结合域BCMA-Am14-HL之vL及vH片段置换。
在各种实施例中,当用于构筑CAR(亦即,习知CAR及下一代CAR)时,本发明之抗原结合域显示优良的活体外及活体内特性,诸如针对目标抗原之结合亲和力、细胞介素分泌、增殖、细胞毒性、耗尽及长期持久性。在各种实施例中,当用于构筑CAR(亦即,习知CAR及下一代CAR)时,此等抗原结合域显示多样化活体外及活体内特性,诸如针对目标抗原之结合亲和力、细胞介素分泌、增殖、细胞毒性、耗尽及长期持久性。在各种实施例中,含有此等目标抗原之CAR可用于产生多样化免疫反应。
本发明进一步涵盖CAR,其靶向相同但具有不同抗原结合域之抗原,且部分地视其靶向之抗原之抗原决定基而定,可拥有多样化生物特性。因此,靶向由SEQ ID NO:2435-2483及SEQ ID NO:2386-2434(参见表7之第12-13列)表示之CAR之两组Her2显示不同生物特性,诸如T细胞活化、细胞介素分泌及细胞毒性。
在一些实施例中,经编码CAR分子之抗原特异性域包含抗体、抗体片段、scFv、Fv、Fab、(Fab′)
在一些情况下,scFv可根据此项技术中已知之方法制备(例如Bird等人,(1988)Science 242:423-426及Huston等人,(1988)Proc.Natl.Acad.Sci.USA 85:5879-5883)。可藉由使用可挠性多肽连接子,将V
scFv可在其V
在一个实施例中,靶向特定抗原之CAR之抗原特异性域包含本文中所列出之抗原结合域的一个、两个或全部三个vH(重链)CDR(亦即vH-CDR1、vH-CDR2及vH-CDR3)(表4),及/或本文中所列出之抗原结合域的一个、两个或全部三个vL(轻链)CDR(亦即vL-CDR1、vL-CDR2及vL-CDR3)(表4)。
在另一实施例中,抗原特异性域包含人类化抗体或抗体片段。
在一些实施例中,本文所描述之CAR之抗原特异性域为scFv抗体片段。在其他实施例中,相较于衍生其之抗体,抗体片段针对抗原具有较低结合亲和力,但在其提供本文所描述之生物反应中起作用。在一个实施例中,CAR分子包含针对目标抗原具有以下之结合亲和力KD之抗体片段:10
在一些实施例中,本文所描述之CAR之抗原特异性域与MHC呈递肽结合。已描述在人类白血球抗原(HLA)-A1或HLA-A2之情形下靶向来源于病毒或肿瘤抗原之肽的TCR样抗体。举例而言,TCR样抗体可自筛选文库(诸如人类scFv噬菌体展示文库)鉴别。
在一些实施例中,当如本文所描述,包含抗体之功能片段(包括scFv片段)之CAR结合目标抗原时,诱导出生物反应,诸如免疫反应之活化、细胞介素产量、细胞毒性及其类似者,如熟习此项技术者将理解。
在一些实施例中,如本文所描述,当单独表现或与附属模组一起时,对疾病具有特异性,可由习知CAR(例如第二代CAR)、下一代CAR(例如zSIR、SIR、Ab-TCR、Tri-TAC、TFP等)及rTCR。靶向之抗原,包括(但不限于)以下中之任一者或多者:CD5、CD19;CD123;CD22;CD30;CD171;CS-1(亦被称作CD2子集1、CRACC、SLAMF7、CD319及19A24);BAFF-R、C型凝集素样分子-1(CLL-1或CLECL1);CD33;MPL;表皮生长因子受体变体III(EGFRviii);神经节苷脂G2(GD2);神经节苷脂GD3(aNeu5Ac(2-8)aNeu5Ac(2-3)bDGalp(1-4)bDGlcp(1-1)Cer);TNF受体家族成员B细胞成熟(BCMA);Tn抗原((Tn Ag)或(GalNAcα-Ser/Thr));前列腺特异性膜抗原(PSMA);受体酪胺酸激酶样孤儿受体1(ROR1);Fms樣酪胺酸激酶3(FLT3);肿瘤相关糖蛋白72(TAG72);CD38;CD44v6;表现于急性白血病或淋巴瘤上但不表现於造血先驱细胞上之经糖基化CD43抗原决定基、表现于非造血癌症上之经糖基化CD43抗原决定基、癌胚抗原(CEA);上皮细胞黏附分子(EPCAM);B7H3(CD276);KIT(CD117);介白素-13受体次单元α-2(IL-13Ra2或CD213A2);间皮素;介白素11受体α(IL-llRa);前列腺幹细胞抗原(PSCA);蛋白酶丝胺酸21(睾蛋白(Testisin)或PRSS21);血管内皮生长因子受体2(VEGFR2);Lewis(Y)抗原;CD24;血小板衍生生长因子受体β(PDGFR-β);阶段特异性胚抗原-4(SSEA-4);CD20;叶酸受体α;受体酪胺酸-蛋白激酶ERBB2(Her2/neu);细胞表面相关黏蛋白1(MUC1);表皮生长因子受体(EGFR);神经细胞黏附分子(NCAM);前列腺酶;前列腺酸性磷酸酶(PAP);突变的延长因子2(ELF2M);Ephrin B2;纤维母细胞活化蛋白α(FAP);胰岛素样生长因子1受体(IGF-I受体)、碳酸酐酶IX(CA1X);β型9蛋白酶体(前体,巨蛋白因子)次单元(LMP2);糖蛋白100(gp100);致癌基因融合蛋白,其由断点集群区(BCR)及Abelson。鼠类白血病病毒致癌基因同源物1(Abl)组成(bcr-abl);酪胺酸酶;ephrin A型受体2(EphA2);岩藻糖基GM1;唾液酸基Lewis黏附分子(sLe);神经节苷脂GM3(aNeu5Ac(2-3)bDClalp(1-4)bDGlcp(1-1)Cer);转麸酰胺酸酶5(TGS5);高分子量黑素瘤相关抗原(HMWMAA);o-乙酰基-GD2神经节苷脂(OAcGD2);肿瘤内皮標記1(TEM1/CD248);肿瘤内皮標記7相关的(TEM7R);紧密连接蛋白6(CLDN6);促甲状腺激素受体(TSHR);G蛋白偶联受体C類5组成员D(GPRC5D);X染色体开放阅读框61(CXORF61);CD97;CD179a;多形性淋巴瘤激酶(ALK);聚唾液酸;胎盘特异性1(PLAC1);globoH。糖基神经酰胺之六醣部分(GloboH);乳腺分化抗原(NY-BR-1);尿溶蛋白2(UPK2);A型肝炎病毒细胞受体1(HAVCR1);肾上腺素受体β3(ADRB3);泛连接蛋白3(PANX3);G蛋白偶联受体20(GPR20);淋巴球抗原6複合物基因座K 9(LY6K);嗅觉受体51E2(OR51E2);TCRγ替代物阅读框蛋白质(TARP);威尔姆斯(Wilms)肿瘤蛋白(WT1);癌症/睪丸抗原1(NY-ES0-1);癌症/睪丸抗原2(LAGE-1a);黑素瘤相关抗原1(MAGE-A1);位于染色体12p上之ETS易位-变体基因6(ETV6-AML);精子蛋白17(SPA17);X抗原家族成员1A(XAGE1);结合血管生成素之细胞表面受体2(Tie 2);黑素瘤癌症睪丸抗原-1(MAD-CT-1);黑素瘤癌症睪丸抗原-2(MAD-CT-2);Fos相关抗原1;肿瘤蛋白p53(p53);p53突变;前列腺蛋白;存活素;端粒酶;前列腺癌肿瘤抗原-1(PCT A-1或半乳糖凝集素8)、由T细胞1识别之黑素瘤抗原(MelanA或MARTI);大鼠肉瘤(Ras)突变;人类端粒酶反转录酶(hTERT);肉瘤易位断点;细胞凋亡之黑素瘤抑制劑(ML-IAP);ERG(跨膜蛋白酶,丝胺酸2(TMPRSS2)ETS融合基因);N-乙酰基葡糖胺基-转移酶V(NA17);配对的盒蛋白Pax-3(PAX3);雄激素受体;细胞週期素Bl;v-myc禽类髓细胞瘤病病毒致癌基因神经母细胞瘤衍生同源物(MYCN);Ras同源物家族成员C(RhoC);酪胺酸酶相关蛋白2(TRP-2);细胞色素P450 lB 1(CYPlB 1);CCCTC-结合因子(锌指蛋白)-樣(BORIS。或调节剂oflmprinted位点之兄弟)、T细胞3识别之鳞状细胞癌抗原(SART3);配对的盒蛋白Pax-5(PAX5);前顶体素结合蛋白sp32(OY-TES1);淋巴球特异性蛋白酪胺酸激酶(LCK);A激酶锚蛋白4(AKAP-4);滑膜肉瘤X断点2(SSX2);晚期糖基化终点产物之受体(RAGE-1);肾普遍存在素1(RU1);肾普遍存在素2(RU2);豆荚蛋白;人类状瘤病毒E6(HPVE6);人类状瘤病毒E7(HPV E7);肠羧基酯酶;突变的热休克蛋白70-2(mut hsp70-2);CD79a;CD79b;CD72;白血球相关免疫球蛋白样受体1(LAIR1);IgA受体之Fc片段(FCAR或CD89);白血球免疫球蛋白样受体子族A成员2(LILRA2);CD300分子样家族成员f(CD300LF);C型凝集素域家族12成员A(CLEC12A);骨髓基质细胞抗原2(BST2);含EGF样模块之黏蛋白样激素受体样2(EMR2);淋巴球抗原75(LY75);磷脂肌醇蛋白聚醣-3(GPC3);Fc受体樣5(FCRL5);及免疫球蛋白λ样多肽1(IGLL1)、MPL、生物素、c-MYC抗原决定基標籤、CD34、LAMP1TROP2、GFRα4、CDH17、CDH6、NYBR1、CDH19、CD200R、Slea(CA19.9;唾液酸基Lewis抗原);岩藻糖基-GM1、PTK7、gpNMB、CDH1-CD324、DLL3、CD276/B7H3、IL11Ra、IL13Ra2、CD179b-IGLl1、ALK TCRγ-δ、NKG2D、CD32(FCGR2A)、CSPG4-HMW-MAA、Tim1-/HVCR1、CSF2RA(GM-CSFR-α)、TGFβR2、VEGFR2/KDR、Lews Ag、TCR-β1链、TCR-β2链、TCR-γ链、TCR-δ链、FITC、黄体化激素受体(LHR)、促卵泡激素受体(FSHR)、绒膜促性腺激素激素受体(CGHR)、CCR4、SLAMF6、SLAMF4、HIV1包封糖蛋白、HTLV1-Tax、CMV pp65、EBV-EBNA3c、A型流感血球凝集素(HA)、GAD、PDL1、鸟苷酸环化酶C(GCC)、KSHV-K8.1蛋白、KSHV-gH蛋白、针对桥粒黏蛋白3(Dsg3)之自体抗体、针对桥粒黏蛋白1(Dsg1)之自体抗体、HLA、HLA-A、HLA-A2、HLA-B、HLA-C、HLA-DP、HLA-DM、HLA-DOA、HLA-DOB、HLA-DQ、HLA-DR、HLA-G、IGE、CD99、RAS G12V、组织因子1(TF1)、AFP、GPRC5D、claudin18.2(CLD18A2或CLDN18A.2)、P-醣蛋白、STEAP1、LIV1、黏附分子-4、畸胎瘤衍化生长因子、MPL、GPA33、BST1/CD157、低传导氯通道、整合素B7、Muc17、C16ORF54、VISTA、Muc5Ac、FCRH5、CLDN6、MMP16、UPK1B、BMPR1B、Ly6E、WISP1及SLC34A2。
在一些实施例中,当单独表现或与如本文所描述之附属模块一起表现时,可由CAR靶向、与疾病相关或对疾病具有特异性之抗原包括(但不限于)以下中之任一者或多者:4-1BB、5T4、腺癌抗原、α-胎蛋白、BAFF、B-淋巴瘤细胞、C242抗原、CA-125、碳酸酐酶9(CA-IX)、C-MET、CCR4、CD152、CD19、CD20、CD200、CD22、CD221、CD23(IgE受体)、CD28、CD30(TNFRSF8)、CD33、CD4、CD40、CD44v6、CD51、CD52、CD56、CD74、CD80、。CD123、CEA、CNTO888、CTLA-4、DR5、EGFR、EpCAM、CD3、FAP、纤维结合蛋白外域-B、叶酸受体1、GD2、GD3神经节苷脂、糖蛋白75、GPNMB、HER2/neu、HGF、人类分散因子受体激酶、IGF-1受体、IGF-I、IgG1、L1-CAM、IL-13、IL-6、胰岛素样生长因子I受体、集成素α5β1、集成素αvβ3、LAMP1、MORAb-009、MS4A1、MUC1、黏蛋白CanAg、N-羟乙酰基神经胺糖酸、NPC-1C、PDGF-Rα、PDL192、磷脂酰丝胺酸、前列腺癌瘤细胞、RANKL、RON、ROR1、SCH900105、SDC1、SLAMF7、TAG-72、肌腱蛋白C、TGFβ2、TGF-β、TRAIL-R1、TRAIL-R2、肿瘤抗原CTAA16.88、VEGF-A、VEGFR-1、VEGFR2、波形蛋白及其组合。对癌症具有特异性之其他抗原将对熟习此项技术者而言为显而易见的,且可与本发明替代实施例结合使用。
在一些实施例中,当单独表现或与如本文所描述之附属模块一起表现时,可由CAR靶向、与癌症相关或对癌症具有特异性之抗原包括(但不限于)以下中之任一者或多者:BCMA、FLT3、CD19、CD20(MS4A1)、CD22、STEAP1、CD79b、集成素B7、Her2、Her3、Liv1、TSHR(促甲状腺激素受体)、PSMA、MSLN(间皮素)、EGFRviii、粘附分子4、催乳素受体(PRLR)、Muc17、Muc5Ac、CD70、CD179b、CDH19、CD16ORF54、VISTA(V-set免疫调节受体或VSIR)、GPC3(磷脂肌醇蛋白聚醣3)、DLL3(δ样典型Notch配位体3)、PTK7、FCRH5(Fc受体样5)、LYPD1(含有LY6/PLAUR域之1)、EMR2(粘附G蛋白偶联受体E2或ADGRE2)、gpNMB(糖蛋白nmb)、环指蛋白43(RNF43)、Robo4、CEA、Her3、叶酸受体1(FOLR1)、CLDN6(紧密连接蛋白6)、MMP16(基质金属肽酶16)、尿溶蛋白1B(UPK1B)、骨形态生成蛋白受体1B型(BMPR1B)、Ly6E、WISP1、SLC34A2、畸胎瘤衍化生长因子、gpA33、ROR1、CLL1、IL1RAP、BST1、CD133及其组合。在一些实施例中,CAR之抗原特异性域对以下具有特异性:BCMA、FLT3、CD19、CD20(MS4A1)、CD22、STEAP1、CD79b、集成素B7、Her2、Her3、Liv1、TSHR(促甲状腺激素受体)、PSMA、MSLN(间皮素)、EGFRviii、黏附分子4、催乳素受体(PRLR)、Muc17、Muc5Ac、CD70、CD179b、CDH19、CD16ORF54、VISTA(V-set免疫调节受体或VSIR)、GPC3(磷脂肌醇蛋白聚醣3)、DLL3(δ样典型Notch配位体3)、PTK7、FCRH5(Fc受体样5)、LYPD1(含有LY6/PLAUR域之1)、EMR2(粘附G蛋白偶联受体E2或ADGRE2)、gpNMB(糖蛋白nmb)、环指蛋白43(RNF43)、Robo4、CEA、Her3、叶酸受体1(FOLR1)、CLDN6(紧密连接蛋白6)、MMP16(基质金属肽酶16)、尿溶蛋白1B(UPK1B)、骨形态生成蛋白受体1B型(BMPR1B)、Ly6E、WISP1、SLC34A2、畸胎瘤衍化生长因子、gpA33、ROR1、CLL1、IL1RAP、BST1及CD133。在一些实施例中,CAR之抗原特异性域包含scFv序列,其SEQ ID阐述于表3中。在一些实施例中,CAR之抗原特异性域包含CDR序列,其SEQ ID阐述于表4中。
在各种实施例中,可使用此项技术中已知之方法及PCT/US2017/024843、WO 2014/160030 A2、WO 2016/187349 A1、PCT/US20描述的方法,产生表现包含此等抗原结合域之CAR(习知及下一代CAR(例如SIR、zSIR、Ab-TCR、TFP及其类似者)两者)之免疫细胞,且用于癌症、感染性及免疫病症之授受细胞疗法。
当单独使用或与如本文所描述的附属模块一起时,CAR(例如CAR II、SIR、zSIR、Ab-TCR、Tri-TAC、TFP及其类似者)可包含与疾病支持抗原(例如本文所描述的疾病支持抗原)结合之抗原结合域(例如抗体或抗体片段)。在一些实施例中,疾病支持抗原为存在于支持致病细胞存活及增殖之细胞上的抗原。在一些实施例中,疾病支持抗原为存在于基质细胞或骨髓源性抑制细胞(MDSC)上之抗原。基质细胞可分泌生长因子及细胞介素以促进微环境中之细胞增殖。MDSC细胞可阻断T细胞增殖及活化。在不希望受理论束缚之情况下,在一些实施例中,表现CAR(例如CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之细胞破坏疾病支持细胞,从而间接阻断致病细胞之生长或存活。
在实施例中,基质细胞抗原系选自以下中之一或多者:骨髓基质细胞抗原2(BST2)、纤维母细胞活化蛋白(FAP)及肌腱蛋白。在实施例中,MDSC抗原系选自以下中之一或多者:CD33、CDllb、C14、CD15及CD66b。因此,在一些实施例中,疾病支持抗原系选自以下中之一或多者:骨髓基质细胞抗原2(BST2)、纤维母细胞活化蛋白(FAP)或肌腱蛋白、CD33、CDllb、C14、CD15及CD66b。
在另一实施例中,CAR(例如CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之各抗原特异性区可包含二价(divalent/bivalent)单链可变片段(二-scFv、双-scFv)。在一些实施例中,包含至少两个抗原特异性靶向区域之CAR(例如CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)将表现对两个抗原中之每一者具有特异性之两个scFv。经由铰链区及跨膜域,所得ASD与共刺激域及胞内信号传导域接合。靶向两个抗原之例示性CAR(zSIR)由SEQ ID NO:3962表示,且靶向CD19及CD123。
在另一实施例中,CAR之各ASD包含双功能抗体。
在一些实施例中,CAR(例如CARI、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)的ASD包含V
在一些实施例中,CAR(例如CARI、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)的ASD包含V
在一些实施例中,CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之ASD包含scFv,其SEQ ID及目标抗原在表3中列出。
在一个实施例中,针对目标抗原之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域为靶向此抗原之vL及vH片段之抗原结合部分,例如CDR,其SEQID在表4中列出。
在一个实施例中,针对目标抗原之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域为靶向此抗原之scFv之抗原结合部分,例如CDR,其SEQ ID在表4中列出。
在一些实施例中,CAR(例如CARI、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)的ASD包含V
在一个实施例中,针对目标抗原之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域为靶向此抗原之非免疫球蛋白骨架之抗原结合部分。
在一个实施例中,针对目标抗原之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域为已知与此目标抗原结合之受体之抗原结合部分。
在一个实施例中,针对目标抗原之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域为已知与此目标抗原结合之配位体之抗原结合部分。
本发明表明,视与其结合之抗原之特定抗原决定基而定,靶向相同抗原之CAR可具有不同生物特性。因此,视与其结合之不同CD19-抗原决定基而定,两个靶向CD19之CAR(例如SEQ ID NO:916及818)可具有不同生物特性(例如细胞毒性、增殖或细胞介素分泌等)。在一实施例中,本发明提供CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者),其与表3中列举之不同目标上、与本发明之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)中之任一者相同的抗原决定基结合,其具有与本发明之CAR中之任一者交叉竞争与不同目标结合的能力。在一些实施例中,此等CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域可来源于抗体之vL片段、vH片段或scFv片段。在一些实施例中,用于测定由本发明之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考抗体,为靶向彼抗原且具有如SEQ ID NO:4266-4338、9693-9722及11468-11470(表3)中所示之序列的scFv。在本发明之一例示性实施例中,由SEQ ID NO:4266表示之参考scFv BCMA-Am14-HL可用于交叉竞争研究,以测定由本发明之基于BCMA-Am14-HL之CAR及主链识别的目标-抗原决定基。在一些实施例中,用于针对不同目标之交叉竞争研究之参考CAR为CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者),其SEQ ID在表7中显示。
在本发明之一例示性实施例中,用于测定由本发明之靶向CD19之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为具有如SEQ ID NO:4269-4270、4272、4298、4299、4338、14462(表3)中所示的序列的scFv。
在本发明之一例示性实施例中,用于测定由本发明之靶向CD19之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为具有如SEQ ID NO:4830-4871、4781-4829、4872-4920、4732-4780、4683-4731、4970-5018及4921-4969(表7)中所示的序列的CAR。
在本发明之一例示性实施例中,用于测定由本发明之靶向CD20之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为靶向CD20且具有如表3中行的SEQ ID的scFv。
在一实施例中,用于测定由本发明之靶向CD20之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为靶向CD20且具有如表7中行的SEQID的CAR。
在本发明之一例示性实施例中,用于测定由本发明之靶向CD22之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为靶向CD22且具有如表3中列举的SEQ ID 14449-14458、14460、14469-70的scFv。
在一实施例中,用于测定由本发明之靶向CD22之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为靶向CD22且具有如表7中行的SEQID的CAR。
在本发明之一例示性实施例中,用于测定由本发明之靶向BAFF-R之CAR(例如CARI、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为靶向BAFF-R且具有如表3中列举的SEQ ID:14465-14467的scFv。
在一实施例中,用于测定由本发明之靶向BAFF-R之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为靶向BAFF-R且具有如表7中行的SEQ ID的CAR。
在一实施例中,用于针对本发明的靶向DLL3之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)的交叉竞争研究的参考scFv,为靶向DLL3且具有如表3中列举的SEQ ID的scFv。
在一实施例中,用于针对本发明的靶向DLL3之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之交叉竞争研究的参考CAR,为靶向DLL3且具有如表7中列举的SEQID的CAR。
在一实施例中,用于针对本发明的靶向PTK7之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)的交叉竞争研究的参考scFv,为靶向PTK7且具有如表3中列举的SEQ ID的scFv。
在一实施例中,用于针对本发明的靶向PTK7之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)的交叉竞争研究的参考CAR,为靶向PTK7且具有如表7中列举的SEQID的CAR。
在一实施例中,用于测定由本发明之靶向MSLN(间皮素)之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为靶向MSLN且具有如表3中行的SEQ ID的scFv。
在一个实施例中,用于测定由本发明之靶向MSLN之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQID NO:4284-4285、4293-4295、9715及9716表示。
在另一实施例中,用于测定由本发明之靶向MSLN之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为靶向MSLN且具有如表7中行的SEQID的CAR。
在一实施例中,用于测定由本发明之靶向Her2之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为靶向Her2且具有如表3中行举的SEQ ID的scFv。
在一个实施例中,用于测定由本发明之靶向Her2之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQID NO:4276-4279表示。
在另一实施例中,用于测定由本发明之靶向Her2之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为具有SEQ ID NO:6244-6292、6391-6439、6342-6390及6293-6341(表7)的Her2-CAR。
在一实施例中,用于测定由本发明之靶向TSHR之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为靶向TSHR且具有如表3中行举的SEQ ID:4280的scFv。
在另一实施例中,用于测定由本发明之靶向TSHR之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为具有SEQ ID NO:7567-7615(表7)的TSHR-CAR。
在一实施例中,用于测定由本发明之靶向EGFRviii之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为靶向EGFRviii且具有如表3中行的SEQ ID的scFv。
在另一实施例中,用于测定由本发明之靶向EGFRviii之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为具有SEQ ID NO:5607-5655、5705-5753、5754-5802及5656-5704的EGFRviii-CAR。
在一实施例中,用于测定由本发明之靶向PRLR(催乳素受体)之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为靶向PRLR(催乳素受体)且具有如表3中行举的SEQ ID的scFv。在一个实施例中,用于测定由本发明之靶向PRLR之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:4296及4309表示。
在另一实施例中,用于测定由本发明之靶向PRLR之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为具有如表7中列举的SEQ ID NO:7077-7125及7126-7174的PRLR CAR。
在另一实施例中,用于测定由本发明之靶向PSMA(前列腺特异性膜抗原)之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:7273-7321、7224-7272及7175-7223)标识的目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向PSMA的scFv(例如SEQ ID NO:4281-4283)。在一个实施例中,用于测定由本发明之靶向PSMA之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:4281-4283表示。
在另一实施例中,用于测定由本发明的靶向PSMA之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的PSMA CAR(例如SEQ ID NO:7273-7321、7224-7272及7175-7223)。
在另一实施例中,用于测定由本发明之靶向DLL3之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向DLL3的scFv(例如SEQ ID NO:4290-4291)。
在另一实施例中,用于测定由本发明之靶向FOLR1之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:5999-6047及6048-6096)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向FOLR1的scFv(例如SEQ ID NO:4323-4324)。在一个实施例中,用于测定由本发明之靶向FOLR1之CAR识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:5999-6047及6048-6096表示。
在另一实施例中,用于测定由本发明之靶向GPC3之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:6097-6145及6146-6194)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向GPC3的scFv(例如SEQ ID NO:4307-4308)。在一个实施例中,用于测定由本发明之靶向GPC3之CAR识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:6097-6145及6146-6194表示。
在另一实施例中,用于测定由本发明之靶向WISP1之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:7812-7860及7861-7909)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向WISP1的scFv(例如SEQ ID NO:4335及4336)。在一个实施例中,用于测定由本发明之靶向WISP1之CAR识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:7812-7860及7861-7909表示。
在另一实施例中,用于测定由本发明之靶向EMR2之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:5803-5851、5852-5900及5901-5949)识别的目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向EMR2的scFv(例如SEQID NO:4313、4314及4315)。在一个实施例中,用于测定由本发明之靶向EMR2之CAR识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:4803-5851、585-5900、5901-5949表示。
在另一实施例中,用于测定由本发明之靶向UPK1B之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:7616-7664、7665-7713)识别之目标抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向UPK1B的scFv(例如SEQ ID NO:4328及4329)。在一个实施例中,用于测定由本发明之靶向UPK1B之CAR识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:7616-7664、7665-7713表示。
在另一实施例中,用于测定由本发明之靶向BMPR1B之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:4536-4584、4585-4633)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向BMPR1B的scFv(例如SEQ ID NO:4330及4331)。在一个实施例中,用于测定由本发明之靶向BMPR1B之CAR识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:4536-4584、4585-4633表示。
在另一实施例中,用于测定由本发明之靶向BMPR1B之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的BMPR1B CAR(例如SEQ ID NO:4536-4584、4585-4633)。
在另一实施例中,用于测定由本发明之靶向CDH19之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:5264-5312、5313-5361)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向CDH19的scFv(例如SEQ ID NO:4302及4303)。在一个实施例中,用于测定由本发明之靶向CDH19之CAR识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:5264-5312、5313-5361表示。
在另一实施例中,用于测定由本发明的靶向CDH19之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的CDH19 CAR(例如SEQ ID NO:5264-5312、5313-5361)。
在另一实施例中,用于测定由本发明之靶向VISTA之CAR(例如SEQ ID NO:7763-7811、7714-7762)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向VISTA的scFv(例如SEQ ID NO:4305及4306)。在一个实施例中,用于测定由本发明之靶向VISTA之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:7763-7811、7714-7762表示。
在另一实施例中,用于测定由本发明的靶向VISTA之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的VISTA CAR(例如SEQ ID NO:7763-7811、7714-7762)。
在另一实施例中,用于测定由本发明之靶向IL13Ra2之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争的参考scFv,为表3中列举的IL13Ra2 scFv(例如SEQ ID NO:14448)。
在另一实施例中,用于测定由本发明之靶向IL13Ra2之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的IL13Ra2 CAR(例如SEQ ID NO:15857-15909)。
在另一实施例中,用于测定由本发明之靶向FLT3之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:10606-10654、10557-10605)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向FLT3的scFv(例如SEQ ID NO:9710及9711)。在一个实施例中,用于测定由本发明之靶向FLT3之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:10557-10605、10606-10654表示。
在另一实施例中,用于测定由本发明的靶向FLT3之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的FLT3 CAR(例如SEQ ID NO:10557-10605、10606-10654)。
在另一实施例中,用于测定由本发明之靶向CLDN6之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:5411-5459、5460-5508)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向CLDN6的scFv(例如SEQ ID NO:4325及4326)。在一个实施例中,用于测定由本发明之靶向CLDN6之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:5411-5459、5460-5508表示。
在另一实施例中,用于测定由本发明的靶向CLDN6之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的CLDN6 CAR(例如SEQ ID NO:5411-5459、5460-5508)。
在另一实施例中,用于测定由本发明的靶向ROBO4之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:7420-7468)识别的目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向ROBO4的scFv(例如SEQ ID NO:4320)。在一个实施例中,用于测定由本发明之靶向ROBO4之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:7420-7468表示。
在另一实施例中,用于测定由本发明的靶向ROBO4之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的ROBO4 CAR(例如SEQ ID NO:7420-7468)。
在另一实施例中,用于测定由本发明之靶向IL1RAP之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:10802-10850、10851-10899、10900-10948)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向IL1RAP的scFv(例如SEQ ID NO:9712、9713及9714)。在一个实施例中,用于测定由本发明之靶向IL1RAP之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:10802-10850、10851-10899、10900-10948表示。
在另一实施例中,用于测定由本发明之靶向IL1RAP之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的IL1RAP CAR(例如SEQ ID NO:10802-10850、10851-10899、10900-10948)。
在另一实施例中,用于测定由本发明之靶向CD22之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:5068-5115、10361-10409)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向CD22的scFv(例如SEQ ID NO:4271、9693、12502)。在一个实施例中,用于测定由本发明之靶向CD22之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:5068-5115、10361-10409表示。
在另一实施例中,用于测定由本发明的靶向CD22之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的CD22 CAR(例如SEQ ID NO:5068-5115、10361-10409)。
在另一实施例中,用于测定由本发明之靶向CLL1之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:10459-10507、10410-10458)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向CLL1的scFv(例如SEQ ID NO:9708及9703)。在一个实施例中,用于测定由本发明之靶向CLL1之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:10410-10458、10459-10507表示。
在另一实施例中,用于测定由本发明的靶向CLL1之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的CLL1 CAR(例如SEQ ID NO:10410-10458、10459-10507)。
在另一实施例中,用于测定由本发明之靶向BST1之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:10116-10164、10165-10212、10213-10262)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向BST1的scFv(例如SEQ ID NO:9718、9719及9720)。在一个实施例中,用于测定由本发明之靶向BST1之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:10116-10164、10165-10212、10213-10262表示。
在另一实施例中,用于测定由本发明的靶向BST1之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的BST1 CAR(例如SEQ ID NO:10116-10164、10165-10212、10213-10262)。
在另一实施例中,用于测定由本发明之靶向黏附分子-4之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:7028-7076、11096-11242)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向粘附分子-4的scFv(例如SEQ ID NO:4292、9696)。在一个实施例中,用于测定由本发明之靶向黏附分子-4之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:7028-7076、11096-11242表示。
在另一实施例中,用于测定由本发明之靶向黏附分子-4之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的黏附分子-4CAR(例如SEQ ID NO:7028-7076、11096-11242)。
在另一实施例中,用于测定由本发明之靶向GPA33之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:10655-10703)识别的目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向GPA33的scFv(例如SEQ ID NO:9698)。在一个实施例中,用于测定由本发明之靶向GPA33之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:10655-10703表示。
在另一实施例中,用于测定由本发明的靶向GPA33之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的GPA33 CAR(例如SEQ ID NO:10655-10703)。
在另一实施例中,用于测定由本发明之靶向ROR1之CAR(例如CAR I、CARJI、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:11145-11193)识别的目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向ROR1的scFv(例如SEQ ID NO:9699)。在一个实施例中,用于测定由本发明之靶向ROR1之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:11145-11193表示。
在另一实施例中,用于测定由本发明的靶向ROR1之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别的目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的ROR1 CAR(例如SEQ ID NO:11145-11193)。
在另一实施例中,用于测定由本发明之靶向畸胎瘤衍化生长因子之CAR(例如CARI、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(例如SEQ ID NO:10508-10556)识别之目标-抗原决定基之交叉竞争研究的参考scFv,为表3中列举的靶向畸胎瘤衍化生长因子的scFv(例如SEQ ID NO:9697)。在一个实施例中,用于测定由本发明之靶向畸胎瘤衍化生长因子之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考scFv,由SEQ ID NO:10508-10556表示。
在另一实施例中,用于测定由本发明之靶向畸胎瘤衍化生长因子之CAR(例如CARI、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)识别之目标-抗原决定基之交叉竞争研究的参考CAR,为表7中列举的畸胎瘤衍化生长因子CAR(例如SEQ ID NO:10508-10556)。
在一些实施例中,如本文所描述之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之两个或更多个功能域由一或多个连接子分隔开。连接子为长度在约1至100个胺基酸之寡聚肽或多肽区,其将本发明之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之域/区域中之任一者连接在一起。在一些实施例中,连接子可例如为5-12个胺基酸长、5-15个胺基酸长或5-20个胺基酸长(或其间的任何整数)。连接子可由可挠性残基,如甘胺酸及丝胺酸构成,使得相邻蛋白域相对于彼此自由移动。较长连接子,例如比100个胺基酸长之彼等连接子,可结合本发明之替代实施例使用,且可经选择以例如确保两个相邻域不会在空间上彼此干扰。若干例示性连接子的SEQ ID NO在表5中列出(参见例如SEQID NO:4007至4012)。
在一些实施例中,本文所描述之CAR(其形成主链之一部分)在抗原特异性域与跨膜域之间包含铰链区。在一些实施例中,铰链区包含以下中之任一者或多者:人类CD8α或抗体或功能等效物之Fc片段、其片段或衍生物;人类CD8α之铰链区或抗体或功能等效物、其片段或衍生物;抗体之CH2区;抗体之CH3区;人工间隔序列及其组合。在例示性实施例中,铰链区包含以下中之任一者或多者:(i)IgG4之铰链、CH2及CH3区;(ii)IgG4之铰链区;(iii)IgG4之铰链及CH2区;(iv)CD8α之铰链区;(v)IgG1之铰链、CH2及CH3区;(vi)IgG1之铰链区;(vi)IgG1的铰链及CH2区;或(vii)其组合。
如本文所描述,本文所描述之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)(其形成主链之一部分)包含跨膜域。跨膜域可包含来自具有跨膜域之任何蛋白(包括I型、II型或III型跨膜蛋白中之任一者)之跨膜序列。本发明之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之跨膜域亦可包含人工疏水性序列。本文所描述之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之跨膜域可经选择,以使得跨膜域并不进行二聚。在一些实施例中,包含本文所描述主链中之任一者的编码TMD的CAR(例如CARI、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)包含选自以下的α、β或ζ链的跨膜域的跨膜域:T细胞受体、CD3ε、CD3ζ、CD3γ、CD3δ、CD28、CD45、CD4、CD5、CD8、CD9、CD16、CD22、CD33、CD37、CD64、CD80、CD86、CD134、CD137、CD154、KIRDS2、OX40、CD2、CD27、LFA-1(CD1la、CD18)、ICOS(CD278)、4-1BB(CD137)、GITR、CD40、BAFFR、HVEM(LIGHTR)、SLAMF7、NKp80(KLRFl)、CD160、CD19、IL2Rβ、IL2Rγ、IL7R a、ITGA1、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CD1ld、ITGAE、CD103、ITGAL、CD1la、LFA-1、ITGAM、CD1lb、ITGAX、CD1lc、ITGB1、CD29、ITGB2、CD18、LFA-1、ITGB7、TNFR2、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(Tactile)、CEACAM1、CRT AM、Ly9(CD229)、CD160(BY55)、PSGL1、CDIOO(SEMA4D)、SLAMF6(NTB-A、Ly108)、SLAM(SLAMF1、CD150、IPO-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、PAG/Cbp、NKp44、NKp30、NKp46、NKG2D及/或NKG2C。
跨膜域可包括与跨膜区相邻之一或多个额外胺基酸,例如与衍生跨膜之蛋白质之胞外区相关联的一或多个胺基酸(例如,胞外区之1、2、3、4、5、6、7、8、9、10至15个胺基酸)及/或与衍生跨膜蛋白之蛋白质之胞内区相关联的一或多个额外胺基酸(例如,胞内区之1、2、3、4、5、6、7、8、9、10至15个胺基酸)。在一个态样中,跨膜域与CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之其他域中之一者邻接。在一个实施例中,跨膜域可来自信号传导域、共刺激域或铰链域所来源的相同蛋白质。在另一态样中,跨膜域不来源于CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之其他域所来源相同的蛋白质。
如本文中所描述,本文所描述之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其形成主链之一部分)包含胞内信号传导域。此域可为细胞质的,且可转导效应功能信号且引导细胞执行其特定功能。胞内信号转导域之实例包括(但不限于):T细胞受体之ζ链或其同系物(例如η链、FceRlv及β链、MB1(Iga)链、B29(IgP)链等)中之任一者;CD3多肽(Δ、δ及ε);syk家族酪胺酸激酶(Syk、ZAP70等);src家族酪胺酸激酶(Lck、Fyn、Lyn等);及涉及T细胞转导之其他分子;诸如CD2、CD5及CD28。胞内信号传导域可为人类CD3ζ链、FcyRIII、FcsRI、Fc受体之细胞质尾、携带基于免疫受体酪胺酸之活化基元(ITAM)之细胞质受体,或其组合。额外胞内信号转导域将对于熟习此项技术者而言为显而易见的,且可与本发明之替代实施例结合使用。在一些实施例中,胞内信号传导域包含以下中之一或多者之信号传导域:人类CD3ζ链、FcgRIII、FceRI、Fc受体之细胞质尾、携带基于免疫受体酪胺酸之活化基元(ITAM)之细胞质受体,及其组合。
如本文中所描述,本文所描述之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)(其形成主链之一部分)包含共刺激域。在例示性实施例中,共刺激域包含来自以下中之任一者或多者之信号传导域:CD28、CD137(4-1BB)、CD134(OX40)、Dap10、CD27、CD2、CD5、ICAM-1、LFA-1、Lck、TNFR-I、TNFR-II、Fas、CD30、CD40及其组合。
如本文所描述之可裂解连接子包括2A连接子(例如,T2A)、2A样连接子或其功能等效物及其组合。在一些实施例中,连接子包括:小核糖核酸病毒2A样连接子;猪捷申病毒属(P2A)、明脉扁刺蛾(Thosea asigna)病毒(T2A)之CHYSEL序列或其组合、变体及功能等效物。在其他实施例中,连接序列可包含Asp-Val/Ile-Glu-X-Asn-Pro-Gly
如本文所用,“附属模块”系指增强、降低或调节表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之T细胞之活性,或降低与CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)相关之毒性,以使得CAR治疗反应增强的药剂。附属模组亦可增强至目标细胞(例如免疫效应细胞)中之CAR编码盒中之基因转移及/或该CAR编码盒的表现。
在一些实施例中,包含编码CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之聚核苷酸之载体可进一步包含编码病毒及细胞信号传导蛋白质之聚核苷酸,该等信号传导蛋白质(i)延长表现CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之T细胞的生命期;(ii)刺激T细胞增殖;及/或(iii)保护表现CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)的T细胞免于细胞凋亡;(iv)增强CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)构筑体的封装、基因转移及/或表现。在例示性实施例中,此类蛋白质包括(但不限于)来自卡波西氏肉瘤相关疱疹病毒之vFLIP-K13(SEQ ID NO(DNA):108;SEQ ID NO(PRT):4107)及HIV-1 Vif(SEQ ID NO:118及4117)。
在一个实施例中,编码CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之载体进一步编码vFLIP-K13。在一个实施例中,vFLIP-K13核苷酸序列经密码子优化。共表现经密码子优化的vFLIP K13之例示性CAR(亦即SIR)由SEQ ID NO:14057表示。在一个实施例中,编码CAR之载体进一步编码HIV-1 Vif。在一替代实施例中,编码CAR之载体进一步编码vFLIP K13及HIV-1 Vif两者。
在一些实施例中,附属分子由不同于编码本文所描述之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之载体的载体编码。在一些实施例中,包含编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之载体之效应细胞亦包含编码附属分子的载体。在一些实施例中,附属分子藉由调节编码对应内源蛋白之基因组基因座编码。
在一些实施例中,包含编码CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之聚核苷酸之载体进一步包含编码siRNA或对细胞介素具有特异性之scFv的聚核苷酸。在例示性实施例中,细胞介素为以下中之任一者或多者:IL-10、IL-6、IFN或其组合。在一些实施例中,CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)与分泌性双特异性抗体片段共表现,该分泌性双特异性抗体片段与IL6受体α及人类血清白蛋白结合。在一些实施例中,CAR(例如CARI、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)与分泌性scFv片段共表现,该分泌性scFv片段与IL6结合。在一些实施例中,CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)与肽FX06共表现,以便减轻与CAR疗法相关之毛细管泄漏。
在其他实施例中,包含编码CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之聚核苷酸之载体进一步包含编码siRNA或核酸酶的聚核苷酸,该核酸酶靶向内源性TCR-α、TCR-β、TCR-γ、TCR-δ、CD3γ、CD3ζ、CD3ε、CD3-δ。在其他实施例中,编码siRNA或核酸酶之聚核苷酸(该核酸酶靶向内源性TCR-α、TCR-β、TCR-γ、TCR-δ、CD3γ、CD3q、CD3ε、CD3-δ),由不同于编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之载体编码。
在其他实施例中,包含编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之聚核苷酸之载体进一步包含编码可选标记物之聚核苷酸。在例示性实施例中,可选标记物可编码药物抗性基因,诸如赋予对嘌呤霉素或钙调神经磷酸酶抑制剂(例如CNB30)之抗性的基因。在一些实施例中,可选标记物可编码以下之胞外域及跨膜域:人类CD30、CD20、CD19(SEQ ID NO:96及4095)、BCMA(SEQ ID NO:97及4096)、EGFR(SEQ ID NO:95及4094)、CD34或表现于中细胞表面上且可由可用于消除表现其目标抗原之细胞之抗体识别的任何蛋白质或蛋白质片段。在本发明之一例示性实施例中,西妥昔单抗(cetuximab)(一种抗EGFR单株抗体)用于消除本表现发明之CAR(其与截短EGFR共表现)之细胞。可选标记物可用于富集表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之细胞,选择表现高水准之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之细胞,及/或降低表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之细胞的纯系多样性。在其它实施例中,编码CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之聚核苷酸可编码抗原决定基标签(例如Mvc标签),该等抗原决定基标签表现于CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之胞外域上,且可用于富集表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)的细胞,选择表现高水准之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之细胞;及/或降低表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之细胞之纯系多样性。降低表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之同种异体T细胞之纯系多样性,将转而引起移植体对抗宿主疾病(GVHD)之发生率降低,从而允许使用同种异体T细胞以用于CAR-T细胞疗法。
应注意,对于CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之活性,附属模块为视情况选用的。表6及表7中之多种例示性CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)构筑体(亦即主链)之多肽及聚核苷酸含有附属模组,诸如PAC、K13和/或hNEMO-K277A-Flag。在本发明的替代实施例中,此等CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)构筑体,可在不存在附属模块及间插可裂解连接子(例如P2A或F2A或T2A)的情况下使用。
在某些实施例中,本发明提供一种合成免疫受体(称为zSIR)之新颖平台,其含有两条CD3z链。可用于构筑zSIR之CD3z链之核酸序列提供于SEQ ID NO:67及71中。对应胺基酸序列分别提供于SEQ ID NO:4066及4070中。本发明提供,抗体之vL片段可与两条CD3z链中之一者接合,且vH片段可与另一条CD3z链接合。当在相同细胞中共表现两条此类链(例如,vL-CD3z及vH-CD3z)时,vL及vH片段可结合其同源抗原且传输T细胞信号。特定言之,当暴露于表现同源目标抗原之细胞株时,表现此类zSIR之T细胞可活化NFAT信号传导,诱导IL2产生,促进T细胞增殖,促进T细胞活化及发挥细胞毒性。zSIR之表现及活性可藉由在vL/vH与CD3z片段之间并入连接子进一步增加。特定言之,来源于抗体之IgCL(SEQ ID NO(DNA):28及SEQ ID NO(PRT):4027)及IgCH域(SEQ ID NO(DNA):29及SEQ ID NO(PRT):4028)充当vL/vH与CD3z片段之间的适用连接子。
在另一实施例中,亦将共刺激域并入zSIR之CD3z链中。例示性共刺激域包括41BB及CD28之共刺激域。含有41BB及CD28共刺激域之CD3z链分别呈现于SEQ ID NO:4076、4078及4075、4077(表5)中。总体而言,以上结果提供一种用于授受细胞疗法之新颖平台,其克服SIR之一些设计限制;且亦提供一种SIR之互补方法。
本文所描述之zSIR之两条链可由单一聚核苷酸链编码,且转译成单一多肽链,其随后裂解为不同蛋白质。本文所描述之zSIR之两条链可使用两个不同启动子表现,且由两个单独聚核苷酸链编码。本文所描述之zSIR之两条链可由单一载体编码。本文所描述之zSIR之两条链可由两个不同载体编码。编码zSIR之核酸分子可包含一或多个前导序列(亦称为信号肽)。在一个实施例中,zSIR之每一功能单元(例如与CD3z链接合之抗原结合域加Furine-SGSG-可裂解连接子)之前面可具有前导序列,该前导序列将zSIR作为I型跨膜蛋白引导至细胞表面。在一个实施例中,zSIR之抗原-结合域面向胞外。在一些实施例中,前导序列包含SEQ ID NO:1至4中之任一者之核酸序列及SEQ ID NO:4000至SEQ ID NO:4003之胺基酸序列。在一些实施例中,包含限制酶位点之短核酸序列(3-9个核酸)位于zSIR之不同次单元之间,例如zSIR之信号序列与抗原结合域之间或抗原结合域与CD3z链之间。
本文提供一或多个多肽,其由编码CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)1至15(表1)或本文所描述之主链1-60(表2)中之任一者或多者之一或多个核酸分子编码。
在一些实施例中,CAR(例如CARI、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域,对目标细胞(诸如癌细胞)上之一个、两个、三个或更多个抗原具有特异性。如本文中所描述,在一些实施例中,CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之每一组分彼此邻接,且与CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之组分在相同阅读框中。在一些实施例中,若包含主链之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)包含多于一个抗原特异性域,则抗原特异性域中之每一者邻接,且在与相同CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)中之其他抗原特异性域相同的阅读框中。
本文亦提供一或多个多肽,其由编码包含主链-1之CAR I及如本文所描述之K13-vFLIP的一或多个核酸分子编码。在一些实施例中,包含主链-1之CAR之抗原特异性域,对目标细胞(诸如癌细胞)上之一个、两个、三个或更多个抗原具有特异性。如本文中所描述,在一些实施例中,CAR之每一组分彼此邻接,且与包含主链-1该CAR之组分在相同阅读框中。在一些实施例中,包含主链-1之CAR包含多于一个抗原特异性域,抗原特异性域中之每一者为邻接的,且在与相同CAR中之其他抗原特异性域相同的阅读框中。
本文亦提供一或多个多肽,其由编码主链-8(其包含如本文所描述之CARII(CAR2)及HIV-1 Vif)之一或多个核酸分子编码。在一些实施例中,包含主链-8之CAR之抗原特异性域,对目标细胞(诸如癌细胞)上之一个、两个、三个或更多个抗原具有特异性。如本文中所描述,CAR之每一组分彼此邻接,且在与CAR之组分之相同阅读框中。在一些实施例中,包含主链-8之CAR包含多于一个抗原特异性域,抗原特异性域中之每一者为邻接的,且在与相同CAR中之其他抗原特异性域相同的阅读框中。
在各种实施例中,由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)的一部分或本文所描述的主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,包含两个、三个或更多个抗原特异性域。
在各种实施例中,由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)的一部分或本文所描述的主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,包含两个、三个或更多个共刺激域。
在各种实施例中,由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)的一部分或本文所描述的主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,包含零个、一个、两个、三个或更多个胞内信号传导域。
在各种实施例中,由编码CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)。之一部分)之核酸分子编码的多肽,包含一个、两个、三个或更多个病毒及/或细胞信号传导蛋白质。
可使用此项技术中已知之重组方法,诸如通过自表现核酸分子之细胞筛选文库,藉由自已知包括其之载体导出核酸分子,或藉由自含有其之细胞及组织直接分离,使用标准技术,来获得编码本文所描述之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)的所需组分之核酸序列。可替代地,所关注核酸可以合成方式而非选殖方式产生。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域对如表3中所描述的目标具有特异性。
在一个实施例中,针对目标抗原之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域为靶向此抗原之vL及vH片段之抗原结合部分,例如CDR,其SEQID NO示于表3及4中。
在一个实施例中,针对目标抗原之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域为靶向此抗原之vHH片段之抗原结合部分,例如CDR。
在一个实施例中,针对目标抗原之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域为靶向此抗原之非免疫球蛋白骨架之抗原结合部分。
在一个实施例中,针对目标抗原之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域为已知与此目标抗原结合之受体之抗原结合部分。
在一个实施例中,针对目标抗原之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域为已知与此目标抗原结合之配位体之抗原结合部分。
在一个实施例中,,针对目标抗原之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域为靶向此抗原之scFV之vL及vH片段的抗原结合部分,例如CDR,其SEQ ID NO示于表3中。CDR之SEQ ID NO示于表4中。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对表3中显示之目标具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对CD19具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对CD20具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对CD22具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对BCMA具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对整合素B7具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对Her2具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对TSHR具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对PSMA具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对MSLN具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对EGFR具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对DLL3具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对黏附分子-4具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对催乳素受体(PRLR)具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对Muc17具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对CD70具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对催乳素受体CDH19具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对CD16ORF54具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对VISTA具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对GPC3具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对Muc5Ac具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对FCRH5具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对LYPD1具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对EMR2具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对gpNMB具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对RNF43具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对CD44v6具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对Robo4具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对CEA具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对Her3具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对FOLR1具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对CLDN6具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对MMP16具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对UPK1B具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对BMPR1B具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对Ly6E具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对CD79b具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对WISP1具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对SLC34A2具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对Liv1具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对畸胎瘤衍化生长因子具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对gpA33具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对ROR1具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对CLL1具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对FLT3具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对IL1RAP具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对BST1具有特异性。
在一些实施例中,本文提供由编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)(其为CAR 1至15(参见表1)之一部分或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中CAR之抗原特异性域对CD133具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对CD200R具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对CD276具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对CD324具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对CS1具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对ALK1具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对ROR1具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对CDH6具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对CDH16具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对CDH17具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对叶酸受体β具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对CLEC5A具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对NY-ESO/MHC I类复合物具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对WT1/MHC I类复合物具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对AFP/MHC I类复合物具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对HPV16-E7/MHC I类复合物具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对gp100/MHC I类复合物具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对hTERT/MHC I类复合物具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对MART1/MHC I类复合物具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对HTLV1-Tax/MHC I类复合物具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对PR1/MHC I类复合物具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对HIV1-gag/MHC I类复合物具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对HIV1包封gp120具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对PTK7具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对TROP2具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对BAFF-R具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对LAMP1具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对Tim1具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对TCR γ-δ具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对TCR β1恒定链具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对TCR β2恒定链具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对GCC具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对B7H4具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对LHR具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对Tn-Muc1具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对TSLPR具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对组织因子具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对SSEA-4具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对SLea具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对Muc1/MHC I类复合物具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对Muc16具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对NYBR-1具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对IL13Ra2具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对IL11Ra具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对L1CAM具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对EpCAM1具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对gpNMB具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对GRP78具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对GPC3具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对GRPC5D具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对GFRa4具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对FITC具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对CD79b具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对Lym1具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对Lym2具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对CLD18A2具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对白血病细胞上表现之CD43抗原决定基具有特异性。
在一些实施例中,本文提供由编码zSIR(其为CAR 7-15之一部分(参见例如表1))之核酸分子编码的多肽,其中抗原特异性域对CD179a具有特异性。
在一些实施例中,本文提供由编码CAR 1-6((参见例如表1)或为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子编码的多肽,其中抗原特异性域如表3中所描述。
在一些实施例中,编码本文所描述之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)及/或附属分子之核酸分子,以信使RNA(mRNA)转录物形式提供。在另一实施例中,编码本文所描述之CAR及/或附属分子之核酸分子,以DNA构筑体形式提供。
亦提供载体,其包含本文所描述之聚核苷酸。在一些实施例中,载体为病毒载体。病毒载体之实例包括(但不限于)反转录病毒、腺病毒、腺相关病毒、慢病毒、痘病毒、疱疹病毒载体或睡美人转座子载体。在各种实施例中,本发明包括表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)及附属分子之反转录病毒及慢病毒载体构筑体,该等构筑体可直接转导至细胞中。
本发明亦包括可直接转染至细胞中之RNA构筑体。用于生成用于转染中之mRNA之方法涉及活体外转录(IVT)具有专门设计之引子之模板,继而添加polyA,以生成含有3′及5′未转译序列(“UTR”)(例如本文所描述之3′及/或5′UTR)、5′帽(例如本文所描述之5′帽)及/或内部核糖体入口位点(IRES)(例如本文所描述之IRES)、待表现之核酸及长度通常为50-2000个碱基之polyA尾的构筑体。如此产生之RNA可有效转染不同种类之细胞。在一个实施例中,模板包括CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之序列。在一个实施例中,藉由电穿孔法,将RNA CAR或下一代CAR载体转导至细胞,例如T细胞或NK细胞中。在另一实施例中,藉由使用如专利申请案WO 2013/059343 A1(PCT/US2012/060646)中所描述之微流体装置,而在细胞膜中引起瞬时扰动,将RNA CAR或下一代CAR载体转导至细胞,例如T细胞或NK细胞中。编码所需分子之聚核苷酸序列可使用此项技术中已知之重组方法获得,例如使用标准技术,藉由自表现该基因之细胞筛选文库,藉由自已知包括其之载体导出基因,或藉由自含有其之细胞及组织直接分离。可替代地,所关注之基因可以合成方式而非选殖方式产生。
本发明亦提供其中插入编码本发明之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之DNA的载体。来源于反转录病毒(诸如慢病毒)之载体为达成长期基因转移之适合工具,此系因为其允许长期稳定整合转殖基因及其在子细胞中之传播。慢病毒载体具有优于来源于致癌反转录病毒(诸如鼠类白血病病毒)之载体的额外优势,因为其可转导非增殖性细胞,诸如肝细胞。例示性慢病毒载体提供于SEQ ID NO:129-130及12639中。反转录病毒载体亦可为例如γ反转录病毒载体。γ反转录病毒载体可包括例如启动子、封装信号(ψ)、引子结合位点(PBS)、一或多个(例如两个)长末端重复序列(LTR)及所关注之转殖基因,例如编码CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之基因。例示性γ反转录病毒载体包括鼠类白血病病毒(MLV)、脾病灶形成病毒(SFFV)及骨髓增殖性肉瘤病毒(MPSV)及由其衍生之载体。在另一实施例中,包含编码本发明之所需CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之核酸之载体为腺病毒载体(A5/35)。
编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之天然或合成核酸之表现,通常通过将编码CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)多肽或其部分之核酸与启动子可操作地连接,且将构筑体并入至表现载体中来达成。编码本发明之CAR之例示性慢病毒载体提供于SEQ ID NO:12640-41及14378、14380-85中。载体可适合于在真核生物中复制且整合于真核生物中。典型选殖载体含有转录及转译终止子、起始序列及适用于调节所需核酸序列表现之启动子。载体可含有单个启动子或大于一个启动子。在一些实施例中,CAR之两个或更多个功能单元(例如编码SIR或zSIR或Ab-TCR之两个功能多肽单元之核苷酸)系在单独启动子控制下。使用标准基因递送方案,本发明之表现构筑体亦可用于核酸免疫接种及基因疗法。基因递送之方法为此项技术中已知的。参见例如美国专利第5,399,346号、第5,580,859号、第5,589,466号,该等专利以全文引用之方式并入本文中。
选殖及表现方法将对于熟习此项技术者而言为显而易见的。
用于将聚核苷酸引入至宿主细胞中之物理方法(诸如磷酸钙转染及其类似者)为此项技术中所熟知的,且将对于熟习此项技术者而言为显而易见的。在另一实施例中,藉由使用如专利申请案WO 2013/059343 A1(PCT/US2012/060646)中及Ding X等人,Nat.Biomed.Eng.1,0039(2017)(其中之每一者之内容以全文引用之方式并入本文中,如同本文所阐述一般)中所描述之微流体装置,在细胞膜中引起瞬时扰动,将CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)载体转导至细胞,例如T细胞或NK细胞中。
在各种实施例中,用于用本文所描述之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)进行修饰之细胞(包括T细胞或NK细胞),可获自需要疗法之个体。T细胞可获自许多来源,包括周边血液单核细胞、骨髓、淋巴结组织、脐带血、胎盘、胸腺组织、来自感染位点之组织、腹水、肋膜积液、脾组织及肿瘤。T细胞可为组织驻留γ-δT细胞,其可在表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之前进行活体外培养及扩增。
在一个态样中,本发明提供多种CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者),其包含经工程改造用于与疾病相关抗原(例如本文所描述的肿瘤抗原)特异性结合之抗原结合域(例如抗体或抗体片段、TCR或TCR片段在一个态样中,本发明提供一种经工程改造以表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之免疫效应细胞(例如T细胞、NKT细胞),其中该工程改造免疫效应细胞呈现治疗特性。在一个态样中,本发明提供一种经工程改造以表现CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之免疫效应细胞(例如T细胞、NKT细胞),其中该工程改造免疫效应细胞呈现特性。在一个实施例中,细胞用CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)转型,且CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)在细胞表面上表现。在一些实施例中,细胞(例如T细胞、NKT细胞)用编码CAR(例如SIR、zSIR、Ab-TCR、TFP及其类似者)之病毒载体转导。在一些实施例中,载体为反转录病毒载体。在一些实施例中,病毒载体为慢病毒载体。在一些此等实施例中,细胞可稳定地表现CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)。在另一实施例中,细胞(例如T细胞、NKT细胞)用编码CAR或下一代CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之核酸(例如mRNA、cDNA、DNA)转染。在一些此等实施例中,细胞可瞬时表现CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)。
本发明提供免疫效应细胞(例如T细胞、NKT或NK细胞),其经工程改造以含有引导免疫效应细胞针对患病细胞或疾病相关细胞(诸如癌细胞)之一或多个CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)。此经由CAR(例如SIR、zSIR、Ab-TCR、Tri-Tac、TFP及其类似者)上对癌症相关抗原具有特异性之抗原结合域来达成。存在可由本发明的CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、Tri-Tac、TFP及其类似者)靶向之两种类别之癌症相关抗原(肿瘤抗原):(1)表现于癌细胞表面上之癌症相关抗原;及(2)自身胞内之癌症相关抗原,然而此类抗原(肽)之片段借由MHC(主要组织兼容复合物)呈递于癌细胞表面上。
此外,本发明提供表现CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之细胞及其用途,其用于药剂,或除其他疾病外,治疗涉及表现如本文所描述之肿瘤抗原或疾病相关抗原之细胞或组织之癌症或任何恶性疾病或自体免疫疾病或传染性疾病或退化性疾病或过敏疾病的方法中。
在一个态样中,本发明提供一种免疫效应细胞(例如T细胞、NKT或NK细胞),其经工程改造以表现CAR或下一代CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者),其中该工程改造免疫效应细胞呈现抗疾病特性,诸如抗肿瘤特性。在一个实施例中,抗原为本文所描述之癌症相关抗原(亦即肿瘤抗原)。在一个态样中,CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原结合域包含部分人类化的抗体片段。在一个类型样中,CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原结合域包含部分人类化的scFv。因此,本发明提供CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者),其包含人类化抗原结合域,且经工程改造至细胞(例如T细胞或NK细胞)中;及其用于授受疗法之使用方法。
本文进一步提供基因工程改造细胞,其包含本文所描述之聚核苷酸及/或CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)。在一些实施例中,细胞为T淋巴球(T细胞)。在一些实施例中,细胞为原生T细胞、中枢记忆T细胞、效应记忆T细胞、调节T细胞(Treg)或其组合。在一些实施例中,细胞为自然杀手(NK)细胞、造血干细胞(HSC)、胚胎干细胞或多能干细胞。可包含且表现本发明之CAR之基因工程改造细胞包括(但不限于):T淋巴球(T细胞)、原生T细胞(TN)、记忆T细胞(例如中枢记忆T细胞(TCM)、效应记忆细胞(TEM))、自然杀手细胞、造血干细胞及/或能够产生治疗性相关后代之多能胚胎/诱导干细胞。在一实施例中,基因工程改造细胞为自体细胞。在一实施例中,基因工程改造细胞为同种异体细胞。借助于实例,本发明之个别T细胞可为CD4+/CD8-、CD4-/CD8+、CD4-/CD8-或CD4+/CD8+。T细胞可为CD4+/CD8-及CD4-/CD8+细胞之混合群体或单一纯系群体。当与表现目标抗原之细胞(例如,CD20+及/或CD19+肿瘤细胞)活体外共培养时,本发明之CD4+T细胞可产生IL-2、IFN、TNF及其他T细胞效应细胞介素。当与目标细胞活体外共培养时,本发明之CD8+T细胞可裂解抗原特异性目标细胞。在一些实施例中,T细胞可为以下中之任一者或多者:CD45RA+CD62L+原生细胞、CD45RO+CD62L+中心记忆细胞、CD62L-效应记忆细胞或其组合(Berger等人,Adoptive transfer of virus-specific and tumor-specific T Cell immunity,Curr Opin Immunol,2009,21(2)224-232)。可通过用编码本发明的CAR(例如SIR、zSIR、Ab-TCR、TFP及其类似者)的DNA的细胞稳定转染,来产生经基因修饰的细胞。
基因工程改造细胞可经工程改造以基因剔除内源性TCR链,例如TCRα、TCRβ、TCRγ、TCRδ或前TCRα链之表现。内源性TCRα、TCRβ、TCRγ、TCRδ或前TCRα链之基因剔除可使用此项技术中已知之多种技术,诸如使用CRISP/Cas9及Zn指核酸酶来达成。在本发明之一例示性实施例中,可将靶向TCRα及TCRβ基因座之gRNA以及Cas9 mRNA引入至T细胞或iPSC或干细胞中,以基因敲除内源性TCRα及TCRβ链之表现。此类TCRα/β基因剔除细胞可用于引入本发明之CAR。缺乏功能性内源性TCR的T细胞可经工程改造,以使得其在其表面上不表现任何功能性内源性TCR,例如经工程改造以使得其不表现包含功能性内源性TCR之一或多个次单元(例如内源性TCRα、TCRβ1、TCRβ2、TCRγ、TCRδ或前TCRα的恒定链),或经工程改造以使得其在其表面上生成极少的功能性内源性TCR。可替代地,T细胞可表现实质上受损之内源性TCR,例如藉由表现TCR之一或多个子单元的突变或截断形式。术语实质上受损之TCR意谓此TCR将不会在宿主中引起不良免疫反应。在一个实施例中,同种异体T细胞或同种异体NKT细胞缺乏功能性TCR及/或功能性HLA之表现或具有较低的表现。
多种方法产生表现本发明之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)的稳定转染体。在一个实施例中,稳定转染及细胞之方法系通过电穿孔法使用裸DNA。藉由使用裸DNA,产生再引导细胞所需之时间可显著地减少。用于使用编码本发明之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)的裸DNA的基因工程改造细胞的额外方法包括(但不限于):化学转型方法(例如使用磷酸钙、树状体、脂质体及/或阳离子聚合物)、非化学转型方法(例如电穿孔、光学转型、基因电转移、细胞膜中之瞬时干扰及/或流体动力学递送)及/或基于颗粒之方法(例如刺穿感染,使用基因枪及/或磁转染)。表明存在单一集成的未重排的载体且表现CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)的经转染细胞可进行离体扩增。在一个实施例中,选择用于离体扩增之细胞为CD8+,且表明特异性识别及裂解抗原特异性目标细胞的能力。
病毒转导方法亦可用于产生表现本发明之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之再引导细胞。可用于生成表现发明之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之经基因修饰之细胞的细胞类型包括(但不限于):T淋巴球(T细胞)、自然杀手细胞、造血干细胞及/或能够产生治疗性相关后代的多能胚胎/诱导干细胞。
在适当条件下,藉由抗原刺激T细胞,引起细胞增殖(增强)及/或产生IL-2。包含发明之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之细胞,将响应于一或多个抗原与CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性靶向区之结合而进行数目扩增。本发明亦提供一种制备及增强表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之细胞的方法。该方法包含用表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之载体转染或转导细胞,及用表现目标抗原、重组目标抗原或针对该受体之抗体之细胞刺激细胞,以引起细胞增殖,从而制备且增强T细胞。在一实施例中,细胞可为以下中之任一者或多者:T淋巴球(T细胞)、自然杀手(NK)T细胞、造血干细胞(HSC)或能够产生治疗性相关后代之多能胚胎/诱导干细胞。
在一些实施例中,本文所描述的基因工程改造细胞表现本文所描述的各种主链,其中基于CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之抗原特异性域,主链之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)组分决定目标特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(参见例如表1)(其为本文所描述的主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对表3及/或表7中之抗原目标具有特异性,且包含表3及/或表7中阐述之抗原结合域序列。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对MPL具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对MPL具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CD19具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对CD19具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CD20具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对CD20具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对BCMA具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对BCMA具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CD22具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对CD22具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对BAFF-R具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对BAFF-R具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对整合素B7具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对黏附分子4具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对催乳素受体具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对Muc17具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CD70具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对CD70具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对VISTA具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对GPC3具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对GPC3具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对EMR2具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对EMR2具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对gpNMB具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对RNF43具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对STEAP1具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对Robo4具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CLDN6具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CD44v6具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对MMP16具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对UPK1B具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对BMPR1B具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对Ly6E具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CD79b具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对CD79b具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对WISP1具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对畸胎瘤衍化生长因子具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对gpA33具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对IL1RAP具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对BST1具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对CD133具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CD123具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对CD123具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CD138具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对CD138具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CLL1具有特异性。
在一个实施例中,基因工程改造细胞包含编码CAR 1至15(其为本文所描述之主链(诸如主链-1、主链-2、主链-32或主链-60)之一部分)之核酸分子,其中CAR之抗原特异性域对CLL1具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对TCR-β1恒定链具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对TCR-β2恒定链具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对ALK具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对PTK7具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对DLL3具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对TROP2具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对Tim1具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对LAMP1具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CS1具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对Lym1具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对Lym2具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对TSHR具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对NY-ESO/MHC I类复合物具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对WT1/MHC I类复合物具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对Ras/MHC I类复合物具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CD179a具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对CLD18A2具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对白血病细胞上表现之CD43抗原决定基具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对HIV1包封糖蛋白gp120具有特异性。
在一个实施例中,基因工程改造细胞包含编码zSIR(其为CAR7-15(参见例如表1)之一部分)之核酸分子,其中抗原特异性域对免疫球蛋白之Fc区具有特异性。
在一个实施例中,本文所描述之表现CAR之效应细胞可进一步包含第二CAR,该第二CAR可包括针对相同或不同目标之不同抗原结合域。在一些实施例中,第二CAR可靶向与第一CAR相同或不同的细胞类型。在一些实施例中,第二CAR可具有与第一CAR相同的类别(亦即CAR 1至CAR15)。在一些实施例中,第二CAR具有与第一CAR不同的类别。在一些实施例中,第二CAR具有与第一CAR相同的主链。在一些实施例中,第二CAR具有与第一CAR不同的主链。
在一个实施例中,本文所描述的表现CAR(例如CAR 7-15)的效应细胞,可进一步包含具有相同或不同抗原结合域,视情况相同或不同目标之不同类别的CAR(例如CAR 1或CAR2等)。在一些实施例中,第二CAR(例如CAR 1、CAR 2等)可靶向与第一CAR(例如CAR 7-15)相同或不同的细胞类型。在一个实施例中,CAR包括针对表现于与疾病相关抗原相同的疾病细胞类型(例如癌症)上之目标的抗原结合域。在一个实施例中,表现CAR(例如CAR 7-15,例如zSIR)之细胞包含:CAR,其靶向第一抗原;及第二抗原特异性受体(例如CAR),其靶向第二不同抗原,且包括不具有一级信号传导域但具有共刺激信号传导域之胞内信号传导域。不希望受理论束同时,将共刺激信号传导域,例如4-1BB、CD28、CD27或OX-40置放至抗原特异性受体上,可调节表现两个目标之细胞上之CAR(例如CAR 7-15,例如zSIR)活性。在一个实施例中,表现CAR(例如CAR 7-15,例如zSIR)的细胞包含:i)第一疾病相关抗原CAR,其包括结合本文所描述之目标抗原的一或多个抗原结合域;及ii)CAR,其靶向不同目标抗原(例如表现于与第一目标抗原相同的疾病相关(例如癌症)细胞类型上之抗原)且包括抗原结合域、跨膜域及一级信号传导域以及共刺激域。具有此组态之例示性构筑体之核酸及胺基酸序列分别呈现于SEQ ID NO:14380及SEQ ID NO:16124中。此构筑体中之SIR之抗原结合域包含来源于靶向BCMA之BCMAAm06单株抗体之vL及vH片段,而CAR之抗原结合域包含PD1之胞外域。此构筑体中之CAR之一级信号传导域包含CD3z胞质域,而共刺激域包含4-1BB胞质域。在另一实施例中,表现CAR(例如CAR 7-15,例如zSIR)的细胞包含:i)第一疾病相关抗原CAR,其包括结合本文所描述之目标抗原的一或多个抗原结合域;及ii)CAR,其靶向不同目标抗原(例如表现于与第一目标抗原相同的疾病相关(例如癌症)细胞类型上之抗原)且包括抗原结合域、跨膜域及共刺激域但不具有一级信号传导或活化域。具有此组态之例示性构筑体之核酸及胺基酸序列分别呈现于SEQ ID NO:14379及SEQ ID NO:16123中。此构筑体类似于SEQ ID NO:14380中显示之构筑体,不同之处在于CAR缺乏CD3z域。在又一实施例中,表现CAR(例如CAR 7-15,例如zSIR)的细胞包含:i)第一疾病相关抗原CAR,其包括结合本文所描述的目标抗原的一或多个抗原结合域;及ii)CAR,其靶向不同目标抗原(例如表现于与第一目标抗原相同的疾病相关(癌症)细胞类型上之抗原)且包括抗原结合域、跨膜域及及一级信号传导域但不具有共刺激域。
在一个实施例中,CAR包含抗原结合域、跨膜域及胞内信号传导域(诸如(但不限于)来自以下之一或多个胞内信号传导域:41BB、CD27、OX40、CD28、Dap10、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD28、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD2、CD5、ICAM-1、LFA-1、Lck、TNFR-1、TNFR-II、Fas、CD30、CD40或其组合)及/或一级信号传导域(诸如(但不限于)CD3ζ信号传导域)。共表现CAR之例示性SIR呈现于SEQ ID NO:3217至3219及SEQ ID NO:3221及3222中。
包含如本文所描述之CAR之免疫效应细胞(诸如T细胞及NK细胞)可一般使用如例如以下中所描述之方法进行活化及扩增:美国专利6,352,694、6,534,055、6,905,680、6,692,964、5,858,358、6,887,466、6,905,681、7,144,575、7,067,318、7,172,869、7,232,566、7,175,843、5,883,223、6,905,874、6,797,514、6,867,041,及美国专利申请案公开案第20060121005号。
本文提供用于治疗与表现疾病相关抗原或癌症相关抗原相关之疾病的方法。
在一个实施例中,本文提供用于治疗有需要之个体之疾病之方法,其通过向该个体投与治疗有效量之本文所描述之经基因修饰之细胞(诸如T细胞、NK细胞),该等细胞经工程改造以表现单独抗原特异性CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者),或抗原特异性CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)及辅助分子,其中抗原为如本文中所描述的疾病特异性抗原,且其中致病或疾病相关细胞表现该疾病特异性抗原。
在一个实施例中,本文提供用于治疗有需要之个体之癌症之方法,其通过向该个体投与治疗有效量之本文所描述之经基因修饰之细胞(诸如T细胞、NK细胞),该等细胞经工程改造以表现单独抗原特异性CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者),或抗原特异性CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)及辅助分子,其中抗原为如本文中所描述的疾病特异性抗原,且其中癌细胞表现该肿瘤抗原。
在一个实施例中,癌症特异性抗原表现于在正常细胞及癌细胞两者上,但以较低水平表现于正常细胞上。在一个实施例中,该方法进一步包含选择CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者),该CAR以允许抗原特异性CAR结合且杀死癌细胞之亲和力结合所关注之癌症特异性抗原。在一些实施例中,抗原特异性CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)杀死癌细胞,但杀死小于30%、25%、20%、15%、10%、5%或更少之表现癌症抗原的正常细胞。在例示性实施例中,由抗原特异性CAR杀死之细胞之百分比可使用本文所描述之细胞死亡分析(例如Matador分析)来测定。
在一些实施例中,本发明提供治疗有需要之个体之癌症之方法,其包含向该个体投与治疗有效量之经基因修饰之细胞(例如T细胞、NK细胞),该等细胞经工程改造以表现习知CAR1至15,其中CAR之ASD对表现于癌细胞上的抗原具有特异性(例如,抗原以相对于癌细胞更低之水平表现于正常细胞上),且其SEQ ID NO在表3中列出。
在一些实施例中,本发明提供治疗有需要之个体之癌症之方法,其包含向该个体投与治疗有效量之经基因修饰之细胞(例如T细胞、NK细胞),该等细胞经工程改造以表现包含习知CARI及附属模块K13-vFLIP之主链-1,其中CAR之ASD对表现于癌细胞上的抗原具有特异性(例如,抗原以相对于癌细胞更低之水平表现于正常细胞上),且其SEQ ID NO在表3中列出。
在一些实施例中,本发明提供治疗有需要之个体之癌症之方法,其包含向该个体投与治疗有效量之经基因修饰之细胞(例如T细胞、NK细胞),该等细胞经工程改造以表现包含习知CARII及附属模块HIV1-Vif之主链-12,其中CAR之ASD对表现于致病或疾病相关细胞上的抗原具有特异性(例如,抗原以相对于癌细胞更低之水平表现于正常细胞上)。
在一些实施例中,本发明提供治疗有需要之个体之癌症之方法,其包含向该个体投与治疗有效量之经基因修饰之细胞(例如T细胞、NK细胞),该等细胞经工程改造以表现包含习知CARII及附属模块K13-vFLIP之主链-32,其中CAR之ASD对表现于癌细胞上的抗原具有特异性(例如,抗原以相对于癌细胞更低之水平表现于正常细胞上)。
在例示性实施例中,可靶向本文所描述治疗方法之抗原包括(但不限于)以下中之任一者、两者、三者、四者或更多:CD19;CD5、CD123;CD22;CD30;CD171;CS1(亦被称作CD2子集1、CRACC、SLAMF7、CD319及19A24);C型凝集素样分子-1(CLL-1或CLECL1);BAFF-R;CD33;表皮生长因子受体变体III(EGFRviii);神经节苷脂G2(GD2);神经节苷脂GD3(aNeu5Ac(2-8)aNeu5Ac(2-3)bDGalp(1-4)bDGlcp(1-1)Cer);TNF受体家族成员B细胞成熟(BCMA);Tn抗原((Tn Ag)或(GalNAcα-Ser/Thr));前列腺特异性膜抗原(PSMA);受体酪胺酸激酶样孤儿受体1(ROR1);Fms样酪胺酸激酶3(FLT3);肿瘤相关糖蛋白72(TAG72);CD38;CD44v6;表现于急性白血病或淋巴瘤上但不表现於造血先驱细胞上的经糖基化CD43抗原决定基、表现于非造血癌症上的经糖基化CD43抗原决定基、癌胚抗原(CEA);上皮细胞黏附分子(EPCAM);B7H3(CD276);KIT(CD117);介白素-13受体次单元α-2(IL-13Ra2或CD213A2);间皮素;介白素11受体α(IL-11Ra);前列腺幹细胞抗原(PSCA);蛋白酶丝胺酸21(睾蛋白或PRSS21);血管内皮生长因子受体2(VEGFR2);Lewis(Y)抗原;CD24;血小板衍生生长因子受体β(PDGFR-β);阶段特异性胚抗原-4(SSEA-4);CD20;叶酸受体α(FRa或FR1);叶酸受体β(FRb);受体酪胺酸-蛋白激酶ERBB2(Her2/neu);细胞表面相关黏蛋白1(MUC1);表皮生长因子受体(EGFR);神经细胞黏附分子(NCAM);前列腺酶;前列腺酸性磷酸酶(PAP);突变的延长因子2(ELF2M);EphrinB2;纤维母细胞活化蛋白α(FAP);胰岛素样生长因子1受体(IGF-I受体)、碳酸酐酶IX(CA1X);β型9蛋白酶体(前体,巨蛋白因子)次单元(LMP2);糖蛋白100(gp100);致癌基因融合蛋白,其由断点集群区(BCR)及Abelson鼠类白血病病毒致癌基因同源物1(Abl)组成(bcr-abl);酪胺酸酶;ephrin A。型受体2(EphA2);唾液酸基Lewis黏附分子(sLe);神经节苷脂GM3(aNeu5Ac(2-3)bDClalp(1-4)bDGlcp(1-1)Cer);转麸酰胺酸酶5(TGS5);高分子量黑素瘤相关抗原(HMWMAA);o-乙酰基-GD2神经节苷脂(OAcGD2);肿瘤内皮標記1(TEM1/CD248);肿瘤内皮標記7-相关的(TEM7R);紧密连接蛋白6(CLDN6);促甲状腺激素受体(TSHR);G蛋白偶联受体C類5组成员D(GPRC5D);X染色体开放阅读框61(CXORF61);CD97;CD179a;多形性淋巴瘤激酶(ALK);聚唾液酸;胎盘特异性1(PLAC1);globoH糖基神经酰胺之六醣部分(GloboH);乳腺分化抗原(NY-BR-1);尿溶蛋白2(UPK2);A型肝炎病毒细胞受体1(HAVCR1);肾上腺素受体β3(ADRB3);泛连接蛋白3(PANX3);G蛋白偶联受体20(GPR20);淋巴球抗原6複合物基因座K 9(LY6K);嗅觉受体51E2(OR51E2);TCRγ替代物阅读框蛋白质(TARP);威尔姆斯(Wilms)肿瘤蛋白(WT1);癌症/睪丸抗原1(NY-ES0-1);癌症/睪丸抗原2(LAGE-1a);黑素瘤相关抗原1(MAGE-A1);位于染色体12p上之ETS。易位-变体基因6(ETV6-AML);精子蛋白17(SPA17);X抗原家族成员1A(XAGEl);结合血管生成素之细胞表面受体2(Tie 2);黑素瘤癌症睪丸抗原-1(MAD-CT-1);黑素瘤癌症睪丸抗原-2(MAD-CT-2);Fos。相关抗原1;肿瘤蛋白p53(p53);p53突变;前列腺蛋白;存活素;端粒酶;前列腺癌肿瘤抗原-1(PCT A-1或半乳糖凝集素8)、由T细胞1识别之黑素瘤抗原(MelanA或MARTI);大鼠肉瘤(Ras)突变;人类端粒酶反转录酶(hTERT);肉瘤易位断点;细胞凋亡之黑素瘤抑制劑(ML-IAP);ERG(跨膜蛋白酶,丝胺酸2(TMPRSS2)ETS融合基因);N-乙酰基葡糖胺基-转移酶V(NA17);配对的盒蛋白Pax-3(PAX3);雄激素受体;细胞週期素Bl;v-myc。禽类髓细胞瘤病病毒致癌基因神经母细胞瘤衍生同源物(MYCN);Ras同源物家族成员C(RhoC);酪胺酸酶相关蛋白2(TRP-2);细胞色素P450 lB 1(CγPlB 1);CCCTC-结合因子(锌指蛋白)-樣(BORIS或调节剂oflmprinted位点之兄弟)、T细胞3识别之鳞状细胞癌抗原(SART3);配对的盒蛋白Pax-5(PAX5);前顶体素结合蛋白sp32(OY-TES1);淋巴球特异性蛋白酪胺酸激酶(LCK);A激酶锚蛋白4(AKAP-4);滑膜肉瘤X断点2(SSX2);晚期糖基化终点产物之受体(RAGE-1);肾普遍存在素1(RU1);肾普遍存在素2(RU2);豆荚蛋白;人类状瘤病毒E6(HPV E6);人类状瘤病毒E7(HPV E7);肠羧基酯酶;突变的热休克蛋白70-2(mut hsp70-2);CD79a;CD79b;CD72;白血球相关免疫球蛋白样受体1(LAIR1);IgA受体之Fc片段(FCAR或CD89);白血球免疫球蛋白样受体子族A成员2(LILRA2);CD300分子样家族成员f(CD300LF);C型凝集素域家族12成员A(CLEC12A);骨髓基质细胞抗原2(BST2);含EGF样模块之黏蛋白样激素受体样2(EMR2);淋巴球抗原75(LY75);磷脂肌醇蛋白聚醣-3(GPC3);Fc受体樣5(FCRL5);及免疫球蛋白λ样多肽1(IGLL1)、MPL、生物素、c-MYC抗原决定基標籤、CD34、LAMP1TROP2、GFRα4、CDH17、CDH6、NYBR1、CDH19、CD200R、Slea(CA19.9;唾液酸基Lewis抗原);岩藻糖基-GM1、PTK7、gpNMB、CDH1-CD324、DLL3、CD276/B7H3、IL11Ra、IL13Ra2、CD179b-IGLl1、TCRγ-δ、NKG2D、CD32(FCGR2A)、Tn ag、Tim1-/HVCR1、CSF2RA(GM-CSFR-α)、TGFβR2、Lews Ag、TCR-β1链、TCR-β2链、TCR-γ链、TCR-δ链、FITC、黄体化激素受体(LHR)、促卵泡激素受体(FSHR)、促性腺激素激素受体(CGHR或GR)、CCR4、GD3、SLAMF6、SLAMF4、HIV1包封糖蛋白、HTLV1-Tax、CMV pp65、EBV-EBNA3c、KSHV K8.1、KSHV-gH、A型流感血球凝集素(HA)、GAD、PDL1、鸟苷酸环化酶C(GCC)、针对桥粒黏蛋白3之自体抗体(Dsg3)、针对桥粒黏蛋白1(Dsg1)之自体抗体、HLA、HLA-A、HLA-A2、HLA-B、HLA-C、HLA-DP、HLA-DM、HLA-DOA、HLA-DOB、HLA-DQ、HLA-DR、HLA-G、IgE、CD99、Ras G12V、组织因子1(TF1)、AFP、GPRC5D、Claudin18.2(CLD18A2或CLDN18A.2)、CLDN6、P-醣蛋白、STEAP1、Liv1、黏附分子-4、畸胎瘤衍化生长因子、MPL、gpA33、BST1/CD157、低传导氯通道及由TNT抗体识别之抗原。
在一些实施例中,CAR之抗原特异性域包含scFv序列,其SEQ ID阐述于表3中。
在例示性实施例中,可靶向本文所描述治疗方法之抗原包括(但不限于)表3中描述之目标中之任一者、两者、三者、四者或更多者。
本发明为一种方法,其包含向个体投与:CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)分子;表现CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)分子之细胞;或包含编码CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)分子之核酸之细胞。在一个实施例中,个体患有本文所描述之病症,例如个体患有表现本文所描述之目标抗原之癌症、传染性疾病、过敏疾病、退化性疾病或自体免疫疾病。在又一个实施例中,个体患本文所描述之病症之风险增加,例如个体患表现本文所描述之目标抗原之癌症、传染性疾病、过敏疾病、退化性疾病或自体免疫疾病之风险增加。在一个实施例中,个体为人类。在另一实施例中,个体为动物。在又一实施例中,个体为伴侣动物,诸如狗。
本发明提供用于治疗或预防与表现本文所描述之疾病相关抗原相关之疾病的方法。
在一个实施例中,本发明提供治疗或预防疾病之方法,其借由向有需要之个体提供免疫效应细胞(例如T细胞)或可产生免疫效应细胞之干细胞,该等细胞经工程改造以表现X-CAR,其中X表示如本文中所描述之疾病相关抗原,且其中致病或疾病相关细胞表现该X抗原。表11提供不同抗原及例示性疾病之清单,该等例示性疾病可使用表现靶向此等抗原之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)之免疫效应细胞来预防、抑制或治疗。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其通过向有需要的个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对表3中显示之不同抗原具有特异性的CAR 1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中CAR的ASD包含vL和vH片段,其SEQ ID NO在表3中列出。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对CD19具有特异性的CAR 1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现CD19,且其中CD19-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗之癌症为急性淋巴母细胞白血病、慢性淋巴球性白血病、B细胞恶性疾病、非霍奇金淋巴瘤、给他性大型B细胞淋巴瘤、套细胞淋巴瘤或多发性骨髓瘤。在一个实施例中,待治疗之疾病为免疫(例如狼疮、SLE、ITP等)或过敏疾病。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对CD20具有特异性的CAR 1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现CD20,且其中CD20-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗之癌症为急性淋巴母细胞白血病、慢性淋巴球性白血病、B细胞恶性疾病、非霍奇金淋巴瘤、比上年漫性大型B细胞淋巴瘤或套细胞淋巴瘤。在一个实施例中,待治疗之疾病为免疫(例如狼疮、SLE、ITP等)或过敏疾病。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对CD22具有特异性的CAR 1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现CD22,且其中CD22-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗之癌症为急性淋巴母细胞白血病、慢性淋巴球性白血病、B细胞恶性疾病、非霍奇金淋巴瘤、比上年漫性大型B细胞淋巴瘤或套细胞淋巴瘤。在一个实施例中,待治疗之疾病为免疫(例如狼疮、SLE、ITP等)或过敏疾病。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对BCMA具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现BCMA,且其中BCMA-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症或免疫或过敏疾病。在一个实施例中,待治疗或预防之癌症为浆细胞恶性疾病或多发性骨髓瘤或原发性渗出性淋巴瘤或弥漫性大细胞淋巴瘤。在一个实施例中,待治疗之疾病为免疫(例如狼疮、SLE、ITP等)或过敏疾病。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对MPL具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现MPL,且其中MPL-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗之癌症为急性骨髓性白血病、慢性骨髓性白血病、骨髓发育不良症候群。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对BAFF-R具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现BAFF-R,且其中BAFF-R-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗之癌症为慢性淋巴球性白血病、套细胞淋巴瘤、B细胞淋巴瘤及急性白血病。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其通过向有需要的个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对IL13Ra2具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现IL13Ra2,且其中IL13Ra2-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗之癌症为脑瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对CD79b具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现CD79b,且其中CD79b-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗之癌症为急性淋巴母细胞白血病、慢性淋巴球性白血病、慢性骨髓性白血病、给他漫性大型B细胞淋巴瘤、套细胞淋巴瘤、骨髓发育不良症候群或多发性骨髓瘤。在一个实施例中,待治疗之疾病为免疫(例如狼疮、SLE、ITP等)或过敏疾病。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对Her2具有特异性的CAR 1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现Her2,且其中Her2-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗之癌症为乳癌或胃癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其通过向有需要的个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对间皮素(MSLN)具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现MSLN,且其中MSLN-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗之癌症为间皮瘤、肺癌、胰脏癌、胃肠癌或卵巢癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对TSHR具有特异性的CAR 1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现TSHR,且其中TSHR-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗之癌症为甲状腺癌或T细胞白血病/淋巴瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其通过向有需要的个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对催乳素受体(PRLR)具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现PRLR,且其中PRLR-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗之癌症为乳癌或难染细胞肾细胞癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其通过向有需要的个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对叶酸受体1(FOLR1)具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现FOLR1,且其中FOLR1-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗之癌症为卵巢癌、肺癌、子宫内膜癌或其他实体肿瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对PTK7具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现PTK7,且其中PTK7-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为黑素瘤、肺癌或卵巢癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对DLL3具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现DLL3,且其中DLL3-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为黑素瘤、肺癌或卵巢癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其通过向有需要的个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对EGFRviii具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现EGFRviii,且其中EGFRviii-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为脑癌或肺癌或其他实体肿瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对PSMA具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现PSMA,且其中PSMA-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为前列腺癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对UPK1B具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现UPK1B,且其中UPK1B-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为膀胱癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对WISP1具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现WISP1。在一个实施例中,WISP1-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为神经胶母细胞瘤或乳癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对MMP16具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现MMP16。在一个实施例中,MMP16-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为神经胶母细胞瘤、黑素瘤、小细胞肺癌或神经母细胞瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要的个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对BMPR1B具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现BMPR1B。在一个实施例中,BMPR1B-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为前列腺癌、乳癌或卵巢癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其通过向有需要的个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对SLC34A2具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现SLC34A2。在一个实施例中,SLC34A2-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为肺癌、卵巢癌或子宫内膜癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对gpA33具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现gpA33,且其中gpA33-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为结肠直肠癌、卵巢癌或子宫内膜癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对BST1具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现BST1,且其中BST1-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为血癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对CD133具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现CD133,且其中CD133-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为肺癌或脑癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对EMR2具有特异性的CAR 1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现EMR2,且其中EMR2-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为急性白血病、淋巴瘤、乳癌及结肠癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对GPC3具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现GPC3,且其中GPC3-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为肝癌、乳癌及肺癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对gpNMB具有特异性的CAR 1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现gpNMB,且其中gpNMB-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为黑素瘤、脑癌、乳癌、肺癌及其他实体肿瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对IL1RAP具有特异性的CAR 1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现IL1RAP,且其中IL1RAP-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症或子宫内膜异位。在一个实施例中,待治疗或预防之癌症为肝癌、宫颈癌、结肠癌、卵巢癌及其他实体肿瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其通过向有需要的个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对黏附分子-4具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现黏附分子-4,且其中黏附分子-4-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症或子宫内膜异位。在一个实施例中,待治疗或预防之癌症为膀胱癌、肾癌、头颈癌、卵巢癌、乳癌、肺癌及其他实体肿瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对畸胎瘤衍化生长因子具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现畸胎瘤衍化生长因子,且其中畸胎瘤衍化生长因子-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为结肠直肠癌、卵巢癌、子宫内膜癌及其他实体肿瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对RNF43具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现RNF43,且其中RNF43-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为结肠直肠癌、乳癌、子宫内膜癌及其他实体肿瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对ROR1具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现ROR1,且其中ROR1-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为血癌、CLL及淋巴瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对FLT3具有特异性的CAR 1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现FLT3,且其中FLT3-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为血癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对CLL-1具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现CLL-1,且其中CLL-1-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为血癌。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对Robo4具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现Robo4。在一个实施例中,Robo4-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为肾癌、结肠癌、乳癌或其他实体肿瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对CLDN6具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现CLDN6。在一个实施例中,CLDN6-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为卵巢癌、肝癌或其他实体肿瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对Muc5Ac具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现Muc5Ac。在一个实施例中,Muc5Ac-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为胰脏癌、胃癌、结肠癌或其他实体肿瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要的个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对Muc17具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现Muc17。在一个实施例中,Muc17-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为胰脏癌、胃癌、结肠癌或其他实体肿瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对Ly6E具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现Ly6E。在一个实施例中,Ly6E-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为胰脏癌、乳癌、卵巢癌、胰脏癌或其他实体肿瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要之个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对整合素B7具有特异性的CAR1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现集成素B7。在一个实施例中,整合素B7-CAR的ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为浆细胞赘瘤或原发性渗出性淋巴瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其通过向有需要的个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对STEAP1具有特异性的CAR 1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现STEAP1。在一个实施例中,STEAP1-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为胃癌、前列腺癌或淋巴瘤。
在一个实施例中,本发明提供治疗癌症、自体免疫或过敏疾病之方法,其藉由向有需要的个体提供免疫效应细胞(例如T细胞、NKT细胞),该等细胞经工程改造以表现对Liv1具有特异性的CAR 1至15(参见例如表1)或主链(例如,主链-1、主链-2、主链-32或主链-60)(参见例如表2),其中致病或疾病相关细胞表现Liv1。在一个实施例中,Liv1-CAR之ASD包含vL及vH片段,其SEQ ID NO在表3中列出。在一个实施例中,待治疗或预防之疾病为癌症。在一个实施例中,待治疗或预防之癌症为乳癌、前列腺癌或实体肿瘤。
生长可能受到抑制之例示性癌症包括通常对免疫疗法起反应之癌症。所治疗之癌症之非限制性实例包括黑素瘤(例如转移性恶性黑素瘤)、肾癌(例如透明细胞癌)、前列腺癌(例如激素难治性前列腺腺癌)、乳癌、结肠癌及肺癌(例如非小细胞肺癌)。另外,可使用本文中所描述之分子治疗难治性或复发性恶性疾病。最终,可使用本文所描述之CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)治疗非恶性疾病,诸如子宫内膜异位。
在例示性实施例中,藉由本文所描述之方法治疗之癌症包括各种器官系统之实体肿瘤,诸如肉瘤、腺癌及癌瘤,诸如影响肝脏、肺、乳房、淋巴球性、胃肠道(例如结肠)、泌尿生殖道(例如肾、尿道上皮细胞)、前列腺及咽之彼等。腺癌包括恶性疾病,诸如大部分结肠癌、直肠癌、肾细胞癌、肝癌、非小细胞肺癌、小肠癌及食道癌。在一个实施例中,癌症为黑素瘤,例如晚期黑素瘤。亦可使用本发明之方法及组合物治疗或预防前述癌症之转移性病灶。
可治疗之其他癌症之实例包括:骨癌、胰脏癌、皮肤癌、头或颈部癌症、皮肤或眼内恶性黑素瘤、子宫癌、卵巢癌、直肠癌、肛门区癌、胃癌、睾丸癌、子宫癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金氏病、非霍奇金氏淋巴瘤、食道癌、小肠癌、内分泌系统癌、甲状腺癌、副甲状腺癌、肾上腺癌、软组织肉瘤、尿道癌、癌、慢性或急性白血病(包括急性骨髓性白血病、慢性骨髓性白血病、急性淋巴母细胞白血病、慢性淋巴球性白血病)、儿童实体肿瘤、淋巴球性淋巴瘤、膀胱癌、肾脏或输尿管癌症、肾癌、中枢神经系统(CNS)赘瘤、原发性CNS淋巴瘤、肿瘤血管生成、脊椎轴肿瘤、脑干神经胶瘤、垂体腺瘤、卡波西氏肉瘤、表皮样癌、鳞状细胞癌、T细胞淋巴瘤、环境诱发癌(包括由石棉诱发之彼等癌症)及该等癌症之组合。可使用本文中所描述的CAR分子实现转移性癌症(例如表现PD-L1之转移性癌症)的治疗(Iwai等人(2005)Int.Immunol.17:133-144)。此外,与如本文所描述之癌症相关抗原表现相关之疾病包括(但不限于)例如与如本文所描述之癌症相关抗原表现相关之非典型及/或非经典癌症、恶性疾病、癌前期病状或增殖性疾病。最终,可使用本文所描述之CAR治疗非恶性疾病,诸如子宫内膜异位。在一些实施例中,相对于阴性对照,如本文所描述之表现CAR之T细胞或NKT细胞降低患有血液癌或与表现如本文中所描述之癌症相关抗原之细胞相关之另一癌症的个体的细胞及/或癌细胞的数量、数目、量或百分比至少25%、至少30%、至少40%、至少50%、至少65%、至少75%、至少85%、至少95%或至少99%。在一个实施例中,个体为人类。
在一个态样中,本发明系关于一种抑制疾病(例如癌症、自体免疫疾病、传染性疾病或过敏疾病或退化性疾病)之生长之方法,其包含使致病或疾病相关细胞与本发明之经基因修饰之细胞接触,该等经基因修饰之细胞表现CAR(例如CAR I、CAAII、SIR、zSIR、Ab-TCR、TFP及其类似者)或表现CAR与附属模组(亦即主链1-60;参见表2),使得CAR-T回应于抗原而活化且靶向致病或疾病相关细胞,其中致病或疾病相关细胞的生长受到抑制。在一个态样中,本发明系关于一种预防疾病之方法,其包含向处于患病风险下之患者投与表现CAR或下一代CAR(例如SIR、zSIR、Ab-TCR、TFP及其类似者)之细胞或能够产生本发明之表现CAR之细胞的细胞,使得CAR-T响应于抗原而活化且靶向致病或疾病相关细胞,其中防止致病或疾病相关细胞的生长。在一个态样中,疾病为癌症、传染性疾病、免疫疾病、过敏疾病或退化性疾病。
在一个态样中,疾病为自体免疫疾病。在一个实施例中,自体免疫疾病系选自由以下组成之群:后天免疫缺乏症候群(AIDS)、斑秃、僵直性脊椎炎、抗磷脂症候群、自体免疫艾迪森氏病(Addison′s disease)、自体免疫溶血性贫血、自体免疫肝炎、自体免疫内耳疾病(AIED)、自体免疫淋巴增殖症候群(ALPS)、自体免疫血小板减少性紫癫(ATP)、白塞氏病(Behcet′s disease)、心肌病、脂肪痢-疱疹样皮肤炎;慢性疲劳免疫功能障碍症候群(CFIDS)、慢性发炎性脱髓鞘多发性神经病(CIPD)、瘢痕性类天疱疮、冷凝集素病、脊症候群、克罗恩氏病(Crohn′s disease)、德高氏病(Degos′disease)、幼年型皮肌炎、盘状狼疮、基本混合型冷凝球蛋白血症、肌肉纤维疼痛-纤维肌炎、格雷夫氏病(Graves′disease)、古兰-巴利症候群(Guiiiain-Barre syndrome)、桥本氏甲状腺炎(Hashimoto′sthyroiditis)、特发性肺纤维化、特特发性血小板减少症尿嘧啶(ΓP)、IgA肾病、胰岛素依赖型糖尿病、幼年型慢性关节炎(斯蒂尔氏病(Still′s disease))、幼年型类风湿性关节炎、梅尼尔氏病(Meniere′s disease)、混合型结缔组织疾病、多发性硬化、重症肌无力、恶性贫血、结节性多动脉炎、多软骨炎、多腺症候群、风湿性多肌痛、多发性肌炎及皮肌炎、原发性无γ球蛋白血症、原发性胆汁性肝硬化、牛皮癣、牛皮癣性关节炎、雷诺氏现象(Raynaud′s phenomena)、莱特尔氏症候群(Reiter′s syndrome)、风湿热、类风湿性关节炎、类肉瘤病、硬皮病(进展性全身性硬化症(PSS),亦称为全身性硬化症(SS))、休格连氏症候群(Sjogren′s syndrome)、僵人症候群、全身性红斑性狼疮症(SLE)、高安氏动脉炎(Takayasu arteritis)、颞动脉炎/巨大细胞动脉炎、溃疡性结肠炎、葡萄膜炎、白癜风、韦格纳氏肉芽肿病(Wegener′s granulomatosis)及其任何组合。
本发明之实施例包括一种类型之细胞疗法,其中效应细胞(诸如T细胞及NK细胞)或可产生效应细胞之干细胞经基因修饰以表现如本文所描述之CAR,且向有需要之接受者输注表现CAR或下一代CAR(例如SIR、zSIR、Ab-TCR、TFP及其类似者)的T细胞或NKT细胞。所输注之细胞能够杀死接受者体内之肿瘤细胞。在各个态样中,向患者或其后代投与之免疫效应细胞(例如T细胞、NKT细胞)在向患者投与T细胞或NK细胞之后在患者中生存至少四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月、十二个月、十三个月、十四个月、十五个月、十六个月、十七个月、十八个月、十九个月、二十个月、二十一个月、二十二个月、二十三个月、两年、三年、四年或五年。
本发明亦包括一种类型之细胞疗法,其中免疫效应细胞(例如T细胞、NK细胞)例如通过活体外转录RNA而经修饰,以瞬时表现CAR(例如CAR I、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)或瞬时表现CAR与附属模块(例如主链1-60)。向有需要之接受者输注T细胞或NKT细胞。所输注之细胞能够杀死接受者体内之疾病相关细胞(例如肿瘤细胞或受病毒感染细胞)。因此,在各个态样中,在向患者投与T细胞或NK细胞之后,表现CAR或下一代CAR之免疫效应细胞(例如T细胞、NKT细胞)生存小于一个月,例如三周、两周、一周。
本发明亦包括一种类型之细胞疗法,其中能够产生免疫效应细胞(例如T细胞或NK细胞)之干细胞(例如造血干细胞或淋巴球性干细胞或胚胎干细胞、或经诱导之多能干细胞)经修饰,以表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)或表现CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)与附属模块(例如主链1-60;参见表2),且向有需要之接受者投与该等干细胞。所投与干细胞在移植至接受者中之后产生免疫效应细胞(例如T细胞或NKT细胞),其(亦即,免疫效应细胞)能够杀死接受者体内之疾病相关细胞。因此,在各个态样中,在向患者投与经基因修饰之干细胞之后,在投与表现CAR或下一代CAR之干细胞之后在患者中产生之免疫效应细胞(例如T细胞、NKT细胞)在患者中存留至少一周、2周、3周、一个月、两个月、三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月、十二个月、十三个月、十四个月、十五个月、十六个月、十七个月、十八个月、十九个月、二十个月、二十一个月、二十二个月、二十三个月、两年、三年、四年、五年、十年或二十年。本发明亦包括一种类型之细胞疗法,其中能够产生免疫效应细胞(例如T细胞或NKT细胞)之干细胞经修饰,以表现CAR(例如CARI、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)或表现CAR与附属模块(例如主链1-60;参见表2),且活体外分化以产生向有需要之接受者输注的免疫效应细胞。在输注至接受者中之后,所输注之免疫效应细胞(例如T细胞或NKT细胞)能够杀死接受者体内之疾病相关细胞。因此,在各个态样中,向患者投与之免疫效应细胞(例如T细胞、NK细胞)在患者中生存至少1天、2天、3天、4天、5天、6天、一周、2周、3周、一个月、两个月、三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月、十二个月、十三个月、十四个月、十五个月、十六个月、十七个月、十八个月、十九个月、二十个月、二十一个月、二十二个月、二十三个月、两年、三年、四年、五年、十年或二十年。
本发明亦包括一种类型之细胞疗法,其中调节性免疫效应细胞(例如TREG或CD25+T细胞)经修饰,以表现靶向特异性抗原之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)或表现CAR和附属模块(例如主链1-60)。向患者投与此类CAR-TREG以抑制针对特异性抗原之免疫反应。CAR-TREG可用于预防及治疗自体免疫疾病及增强免疫耐受性。
由经CAR或下一代CAR修饰之免疫效应细胞(例如T细胞、NKT细胞)引起之抗肿瘤免疫反应可为主动或被动免疫反应,或替代地可归因于直接与间接免疫反应。在一个态样中,响应于表现如本文中所描述之疾病相关抗原之人类患病细胞(例如癌症或受感染细胞),CAR或下一代CAR转导的免疫效应细胞(例如T细胞、NK细胞)呈现特异性促炎性细胞介素分泌及强效细胞溶解活性,抵抗如本文中所描述之可溶性疾病相关抗原,介导旁观者杀伤及介导现有人类疾病(包括癌症)的消退。
本发明亦包括一种类型之细胞疗法,其中免疫效应细胞(例如T细胞及NKT细胞)或能够产生免疫效应细胞(例如T细胞或NK细胞)之干细胞经修饰,以表现CAR(例如CARI、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)或表现CAR与附属模块(例如主链1-60),且离体使用该等细胞以净化骨髓或疾病相关细胞(例如癌细胞)之周边血液造血干细胞。作为一实例,将表现CD19特异性CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之T细胞与获自患有急性淋巴球性白血病或非霍奇金淋巴瘤之患者之骨髓或周边血液干细胞样本一起共培养,以便杀死骨髓或周边血液干细胞制剂中存在的任何白血病或淋巴瘤细胞。在活体外(离体)培养适合持续时间(其可在6小时至数天范围内)之后,使用净化的骨髓及周边血液样本来自体移植至患者中。
造血干细胞及先驱细胞之离体扩增已在美国专利第5,199,942号中描述,且以引用之方式并入本文中,且可应用于本发明之细胞。然而,本发明不限于细胞之任何特定离体扩增方法,且可使用此项技术中已知之其他适合的方法。简言之,造血干细胞之离体培养及扩增包含:(1)藉由周边血液采集或骨髓外植体自哺乳动物收集CD34+造血干细胞及先驱细胞;及(2)离体扩增此类细胞。除了美国专利第5,199,942号中描述之细胞生长因子之外,诸如flt3-L、IL-1、IL-3及c-kit配位体之其他因子可用于培养及扩增该等细胞。
除就离体免疫接种而言使用基于细胞之疫苗之外,本发明亦提供用于活体内免疫接种以在患者中引起针对抗原之免疫反应之组合物及方法。
在一些实施例中,本发明之经完全人类CAR或下一代CAR修饰之经基因修饰之细胞(诸如T细胞、NKT细胞),可为一种用于在哺乳动物(例如,人类)中离体免疫接种及/或活体内疗法的疫苗类型。关于离体免疫接种,在向哺乳动物投与细胞之前,活体外进行以下中之至少一者:i)扩增细胞,ii)向细胞中引入编码CAR之核酸或iii)低温保存细胞。离体程序为此项技术中所熟知,例如如美国专利第5,199,942号中所描述,该专利以引用之方式并入本文中。
除就离体免疫接种而言使用基于细胞之疫苗之外,本发明亦提供用于活体内免疫接种以在患者中引起针对抗原之免疫反应之组合物及方法。
本文进一步描述当向患者投与时用于控制CAR-T细胞之活性的方法。在一些实施例中,此等方法可用于控制CAR-T细胞之副作用,诸如细胞介素释放症候群、毛细管泄漏症候群及神经并发症。在一些实施例中,该方法涉及投与酪胺酸激酶(特定言之,Scr家族激酶,且特定言之Lck激酶)之抑制剂。在一个实施例中,该方法涉及投与达沙替尼(Dasatinib)(一种Ab1及Src家族酪胺酸激酶(SFK)之口服小分子抑制剂,包括p56Lck(Lck))(Lee KC等人,Leukemia(2010)24,896-900)。在一个实施例中,在投与表现CAR之细胞之后,向患者投与Src激酶抑制剂来控制或终止表现CAR之细胞之活性。在一个实施例中,在投与表现CAR之细胞之后,向患者投与Lck抑制剂来控制或终止表现CAR之细胞之活性。在一个实施例中,Lck抑制剂为A-770041。
在一个实施例中,在投与表现CAR之细胞之后,向患者投与达沙替尼来控制或终止表现CAR之细胞之活性。在一个实施例中,以以下之剂量经口投与达沙替尼:至少10毫克/天、20毫克/天、40毫克/天、60毫克/天、70毫克/天、90毫克/天、100毫克/天、140毫克/天、180毫克/天、210毫克/天、250毫克/天或280毫克/天。
在一个实施例中,在投与表现CAR之细胞之后,向患者投与普纳替尼(Ponatinib)来控制或终止表现CAR之细胞之活性。在一个实施例中,以以下之剂量经口投与普纳替尼:至少15毫克/天、30毫克/天、45毫克/天、60毫克/天。
T淋巴球具有有限的复制生命期,直至其达到终末分化状态为止,且随后归因于随着年龄增长进展性缺失端粒而进入复制老化期。当活体外培养时,人类T淋巴球呈现约30-50群体倍增数之有限生命期。
出于授受细胞疗法之目的,本文进一步涵盖用于促进周边血液单核细胞及T细胞之存活及增殖以及预防其复制老化以延长免疫细胞(例如淋巴球及NK细胞)之生命期的方法。该方法需要异位表现促进存活及增殖且阻断活化诱导之细胞死亡的病毒及/或细胞蛋白质。适合于此目的的例示性蛋白质包括由卡波西氏肉瘤相关疱疹病毒(亦称为人类疱疹病毒8)编码的病毒FLICE抑制性蛋白质(vFLIP)K13。在一些实施例中,以上病毒及细胞蛋白质以其原生状态或携带小抗原决定基标签形式在免疫细胞(例如T细胞及NK细胞)中表现,且以组成型方式为功能活性的。在其他实施例中,以上病毒及细胞蛋白质以与开关域(或二聚域)(诸如FKBP及FKBPx2)之一或多个复本融合之形式,在免疫细胞(例如T细胞及NK细胞)中表现。在其他实施例中,FKBP或FKBP-x2域可另外携带N端肉豆蔻酰化(Myr)序列以将融合蛋白锚定至细胞膜。携带开关域之融合蛋白在其基础状态中为功能上无活性的,但在添加二聚化药剂(诸如AP20187)后活化,如PCT/US2017/024843中所描述,该文献以全文引用的方式并入本文中。
本文进一步涵盖用于促进慢病毒介导的外源基因及/或cDNA之转导及/或表现的方法。该方法涉及HIV1-Vif蛋白之表现。在一些实施例中,Vif蛋白编码在与外源基因及/或cDNA相同的载体上。在一些实施例中,Vif蛋白编码在与外源基因/cDNA不同的载体上。其转移及/或表现可藉由共表现HIV1 Vif蛋白增强之例示性外源基因/cDNA包括CAR(例如CARI、CARII、SIR、zSIR、Ab-TCR)、重组TCR、血球蛋白及腺苷脱胺酶等。在一些实施例中,共表现HIV1 Vif蛋白可用于促进慢病毒介导的任何经编码基因/cDNA或核酸片段之转导及/或表现。在一些实施例中,HIV1 Vif蛋白编码在与所关注之基因/cDNA相同的载体上。编码CAR且共表现HIV1 Vif蛋白之例示性载体呈现于SEQ ID NO:11268中。编码CAR及HIV Vif之例示性核酸盒呈现于SEQ ID NO:11244-11267中。在一些实施例中,HIV1 Vif蛋白编码在与所关注之基因/cDNA不同的载体上。HIV1 Vif蛋白可用于增强任何哺乳动物细胞中之基因转移/表现。在一些实施例中,HIV1 Vif蛋白用于增强周边血液单核细胞、T细胞、NK细胞、NKT细胞、B细胞、造血干细胞、经诱导之多能干细胞、肝细胞、大脑细胞或皮肤细胞中之基因转移/表现。
在一实施例中,免疫效应细胞(例如T细胞)异位表现选自以下之群组之病毒或细胞信号传导蛋白质中的一或多者:K13-vFLIP(SEQ ID NO:4107)、MC159(SEQ ID NO:4108)、cFLIP-L/MRIT-α(SEQ ID NO:4109)、cFLIP-p22(SEQ ID NO:4110)、HIV1-Vif(SEQ ID NO:4117)、HTLV1-TAX(SEQ ID NO:4113)、HTLV2-TAX(SEQ ID NO:4114)、HTLV2-TAX-RS(SEQ IDNO:4115),或与以上蛋白质之胺基酸序列具有70-99%一致性的蛋白质。
在一实施例中,免疫效应细胞(例如T细胞)异位表现含有一或多个开关域(例如FKBP、FKBPx2或Myr-FKBP)及选自以下之群组之一或多个病毒或细胞信号传导蛋白质的融合蛋白:K13-vFLIP(SEQ ID NO:4107)、MC159(SEQ ID NO:4108)、cFLIP-L/MRIT-α(SEQ IDNO:4109)、cFLIP-p22(SEQ ID NO:4110)、HIV1-Vif(SEQ ID NO:4117)、HTLV1-TAX(SEQ IDNO:4113)、HTLV2-TAX(SEQ ID NO:4114)、HTLV2-TAx-RS(SEQ ID NO:4115)。
在一些态样中,本发明提供一种制造适合于授受细胞疗法之免疫效应细胞之方法,其包含使细胞与部分或完全编码选自以下之群组之病毒或细胞信号传导蛋白质中之一或多者的核酸接触:K13-vFLIP(SEQ ID NO:4107)、MC159(SEQ ID NO:4108)、cFLIP-L/MRIT-α(SEQ ID NO:4109)、cFLIP-p22(SEQ ID NO:4110)、HIV1-Vif(SEQ ID NO:4117)、HTLV1-TAX(SEQ ID NO:4113)、HTLV2-TAX(SEQ ID NO:4114)、HTLV2-TAX-RS(SEQ ID NO:4115),或与以上蛋白质的胺基酸序列具有70-99%一致性的蛋白质。
在一些态样中,本发明提供一种制造适合于授受细胞疗法之免疫效应细胞之方法,其包含使细胞与编码含有一或多个切换域(例如FKBP、FKBPx2或Myr-FKBP)及选自以下之群组之一或多个病毒或细胞信号传导蛋白质之融合蛋白的核酸接触:K13-vFLIP(SEQ IDNO:4107)、MC159(SEQ ID NO:4108)、cFLIP-L/MRIT-α(SEQ ID NO:4109)、cFLIP-p22(SEQID NO:4110)、HIV1-Vif(SEQ ID NO:4117)、HTLV1-TAX(SEQ ID NO:4113)、HTLV2-TAX(SEQID NO:4114)、HTLV2-TAX-RS(SEQ ID NO:4115),或与以上蛋白质的胺基酸序列具有70-99%一致性的蛋白质。
在一实施例中,适合于授受细胞疗法之细胞表现天然或合成免疫受体。例示性此类免疫受体包括嵌合抗原受体(CAR)、T细胞受体(TCR)、嵌合T细胞受体(cTCR)、合成T细胞受体、TCR融合蛋白(TFP)、Ab-TCR及合成notch受体。在一实施例中,可在与编码天然或合成免疫受体之构筑体接触之前、同时或之后,使细胞与编码病毒及细胞信号传导蛋白质之核酸接触。在一实施例中,可在与编码天然或合成免疫受体之构筑体接触之前、同时或之后,使细胞与编码含有开关或二聚域之病毒及细胞信号传导蛋白质的核酸接触。
在一个态样中,本发明提供一种制备免疫效应细胞(例如T细胞、NK细胞)群体之方法。在一实施例中,该方法包含:提供免疫效应细胞(例如T细胞或NK细胞)群体,在允许免疫受体与病毒或细胞信号传导蛋白质共表现之条件下,使免疫效应细胞群体与编码免疫受体(例如CAR、TCR、合成TCR)之核酸接触,及使免疫效应细胞群体与编码病毒或细胞信号传导蛋白质之核酸接触。
在一实施例中,编码病毒或细胞信号传导蛋白质之核酸为DNA。在一实施例中,编码病毒或细胞信号传导蛋白质之核酸含有能够驱动病毒及细胞信号传导蛋白质表现之激活子。在一实施例中,编码病毒或细胞信号传导蛋白质之核酸及编码免疫受体之核酸由相同载体表现。在一实施例中,编码病毒或细胞信号传导蛋白质之核酸及编码免疫受体之核酸由单独载体表现。在一实施例中,编码病毒或细胞信号传导蛋白质(次单元1)之核酸及编码免疫受体(次单元2)之核酸,由含有允许转译第二次单元之内部核糖体进入位点(IRES)之相同聚核苷酸片段表现。在一实施例中,编码病毒或细胞信号传导蛋白质(次单元1)之核酸及编码免疫受体(次单元2)之核酸,由编码可裂解连接子之单一聚核苷酸片段表现,且不同次单元由可裂解连接子隔开。
在一实施例中,编码病毒或细胞信号传导蛋白质之核酸为活体外转录的RNA。在一实施例中,病毒或细胞信号传导蛋白质(次单元1)及免疫受体(次单元2),由含有允许第二次单元之转译之内部核糖体进入位点(IRES)的相同RNA表现。在一实施例中,病毒或细胞信号传导蛋白质(次单元1)及免疫受体(次单元2),由单一RNA表现,且不同次单元由可裂解连接子隔开。
在一实施例中,编码细胞信号传导蛋白质之核酸为该蛋白质之基因组复本,该蛋白质已藉由基因或化学手段利用其激活子之活化而活化。
本文所描述的治疗方法包含使用组合物,该组合物包含经基因修饰之细胞,该等细胞包含编码本文所描述之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)的核酸。在各种实施例中,本文所描述治疗方法可与现有疗法及药剂组合。向个体投与本文所描述之治疗性组合物与至少一种额外已知疗法或治疗剂,该等治疗性组合物包含含有编码本文所描述之CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之核酸的经基因修饰的细胞。在一些实施例中,依序投与本文所描述之组合物及额外疗法或治疗剂。在一些实施例中,同时投与本文所描述之组合物及额外疗法或治疗剂。投与本文所描述之组合物及现有疗法之最佳次序将对于熟习此项技术者(诸如医师)而言为显而易见的。
本文所描述之表现CAR或下一代CAR之细胞及至少一种额外治疗剂可同时(以相同组合物或以单独组合物形式)或依序投与。对于依序投与,本文所描述之表现CAR之细胞可首先投与,且其次可投与额外试剂,或投与次序可颠倒。
在疾病之持续时间内,可向个体投与组合疗法。疾病之持续时间包括自诊断开始直至结束治疗为止,其中该治疗引起症状减少及/或症状消除。在各种实施例中,两种治疗之效果可部分加合,完全加合或大于加合。传递可使得所递送之第一治疗之效果在递送第二治疗时仍可侦测。
可在活动性病症时段期间或在活动性疾病缓解或更少之时段期间,投与CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)疗法及/或其他治疗剂、程序或模式。可在其他治疗之前、与治疗同时、治疗后或在病症缓解期间,投与CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)疗法。
当组合投与时,可以比独立(例如以单药疗法形式)使用每一药剂之量或剂量高、低或相同的量或剂量,投与CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)疗法及额外药剂(例如第二或第三药剂)或所有。在某些实施例中,所投与CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)疗法、额外药剂(例如第二或第三药剂)或所有之量或剂量,比独立(例如以单药疗法形式)使用每一药剂之量或剂量低(例如至少20%、至少30%、至少40%或至少50%)。在其它实施例中,CAR(例如CARI、CAR II、SIR、zSIR、Ab-TCR、TFP及其类似者)疗法、额外药剂(例如第二或第三药剂)或所有生成所需效果(例如治疗癌症)之量或剂量,比达成相同治疗效果所需之独立(例如以单药疗法形式)使用每一药剂之量或剂量低(例如低至少20%、至少30%、至少40%或至少50%)。
其它方法态样涉及视情况与增加免疫细胞之功效及/或安全性之药剂组合,向个体投与有效量之细胞(例如免疫效应细胞)或其群体,各细胞包含CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)分子。在其他态样中,增加免疫细胞之功效及/或安全性之药剂为以下中之一或多者:(i)蛋白质磷酸酶抑制剂;(ii)激酶抑制剂;(iii)细胞介素;(iv)免疫抑制分子的抑制剂;或(v)降低TREG细胞之水平或活性的药剂;vi)增加经CAR修饰之细胞之增殖及/或存留的药剂;vii)趋化细胞素;viii)增加CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)的表现的药剂;ix)允许调节CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)之表现或活性的药剂;x)允许控制经CAR修饰之细胞之存活及/或存留的药剂;xi)控制经CAR修饰之细胞之副作用的药剂;xii)Brd4抑制剂;xiii)将治疗剂(例如sHVEM)或预防剂递送至疾病位点的药剂;xiv)增加引导CAR(例如CAR I、CARII、SIR、zSIR、Ab-TCR、TFP及其类似者)进行针对之目标抗原之表现的药剂;xv)腺苷A2a受体拮抗剂;xvi)消耗单核球及/或巨噬细胞的药剂;xvii)依托泊苷(Etoposide)。
在一些实施例中,本文所描述之经基因修饰之细胞可用于治疗方案以及手术、化学疗法、辐射、免疫抑制剂(诸如环孢素、硫唑嘌呤、甲胺喋呤、霉酚酸酯及FK506)、抗体或其他免疫去除剂(诸如CAMPATH、抗CD3抗体或其他抗体疗法、细胞毒素、氟达拉滨(fludarabine)、环孢素、FK506、雷帕霉素(rapamycin)、霉酚酸、类固醇、FR901228、细胞介素)及照射肽疫苗,诸如Izumoto等人2008 J Neurosurg 108:963-971中所描述之照射肽疫苗。在一个实施例中,本文所描述之表现CAR之细胞可与化学治疗剂组合使用。例示性化学治疗剂包括蒽环霉素(例如,小红莓(doxorubicin)(例如,脂质小红莓))、长春花生物碱(vinca alkaloid)(例如,长春碱(vinblastine)、长春新碱、长春地辛(vindesine)、长春瑞滨(vinorelbine))、烷基化剂(例如,环磷酰胺、达卡巴嗪(decarbazine)、美法仑(melphalan)、异环磷酰胺、替莫唑胺(temozolomide))、免疫细胞抗体(例如,阿仑单抗(alemtuzamab)、吉妥单抗(gemtuzumab)、利妥昔单抗(rituximab)、奥法木单抗(ofatumumab)、托西莫单抗(tositumomab)、贝伦妥单抗(brentuximab))、抗代谢物(包括例如叶酸拮抗剂、嘧啶类似物、嘌呤类似物及腺苷脱胺酶抑制剂(例如,氟达拉滨))、mTOR抑制剂、TNFR糖皮质激素诱导之TNFR相关蛋白质(GITR)促效剂、蛋白酶体抑制剂(例如,阿克拉霉素A(aclacinomycin A)、胶毒素或硼替佐米(bortezomib))、免疫调节剂(诸如沙立度胺(thalidomide)或沙立度胺衍生物(例如,来那度胺(lenalidomide)))。
在一些实施例中,与环磷酰胺及氟达拉滨组合,向个体投与本文所描述之表现CAR之细胞。
在一些实施例中,向先前已投与清髓性及淋巴球耗乏化学疗法两者之个体,投与本文所描述之表现CAR之细胞。例示性清髓性及淋巴球耗乏调节方案包括FCE(氟达拉滨,25毫克/平方公尺/天,第-7至-3天;环磷酰胺200毫克/平方公尺/天,第-7至-3天;及依托泊苷,250毫克/平方公尺/天,第-4至-3天)、FCIE(氟达拉滨,25毫克/平方公尺/天,第-7至-3天;环磷酰胺,200毫克/平方米/天,第-7至-3天;艾达霉素,12毫克/平方公尺/天,第-7至-5天,及依托泊苷,250毫克/平方公尺/天,第-4至-3天)、FluCyE(氟达拉滨,30毫克/平方公尺/天,在投与氟达拉滨之后,阿糖胞苷,1.5公克/平方米/天,及依托泊苷,100毫克/平方公尺/天,其中各药物在第-6至-1天给予)或FE(氟达拉滨,30毫克/平方公尺/天,及依托泊苷,100毫克/平方公尺/天,在第-5天至第-1天)。在一些实施例中,在最后一次化学疗法剂量之后,在第1天至第5天之间,向个体投与表现CAR之细胞。
在一些实施例中,向先前已投与依托泊苷之个体,投与本文所描述之表现CAR之细胞。在一些实施例中,以50毫克/平方米/天至250毫克/平方米/天之剂量,静脉内投与依托泊苷,持续1-5天。在一些实施例中,以5毫克/公斤/剂量,给药依托泊苷,持续1至5次剂量。在一些实施例中,在最后一次依托泊苷剂量之后,在第1天至第5天之间,向个体投与表现CAR之细胞。
在实施例中,与苯达莫司汀(bendamustine)及利妥昔单抗组合,向个体投与表现CAR之细胞。
在一些实施例中,与利妥昔单抗、环磷酰胺、小红莓、长春新碱及/或皮质类固醇(例如泼尼松(prednisone))组合,向个体投与本文所描述之表现CAR之细胞。在实施例中,与利妥昔单抗、环磷酰胺、小红莓、长春新碱及泼尼松(R-CHOP)组合,向个体投与本文所描述之表现CAR或下一代CAR之细胞。在实施例中,个体具有弥漫性大型B细胞淋巴瘤(DLBCL)。
在一些实施例中,与依托泊苷、泼尼松、长春新碱、环磷酰胺、小红莓及/或利妥昔单抗组合,向个体投与本文所描述之表现CAR之细胞。在实施例中,与依托泊苷、泼尼松、长春新碱、环磷酰胺、小红莓及/或利妥昔单抗(EPOCH-R)组合,向个体投与本文所描述之表现CAR或下一代CAR之细胞。在实施例中,与剂量调整的EPOCH-R(DA-EPOCH-R)组合,向个体投与本文所描述之表现CAR之细胞。在实施例中,个体患有B细胞淋巴瘤,例如Myc重排之侵袭性B细胞淋巴瘤。
在一些实施例中,与贝伦妥单抗组合,向个体投与本文所描述之表现CAR之细胞。贝伦妥单抗为一种抗CD30抗体与单甲基奥瑞他汀E(monomethyl auristatin E)之抗体-药物共轭物。在一些实施例中,个体患有霍奇金淋巴瘤(HL),例如复发性或顽抗性HL。在一些实施例中,个体包含CD30+HL。在实施例中,个体已经历自体干细胞移植(ASCT)。
在一些实施例中,与CD20抑制剂,例如抗-CD20抗体(例如抗CD20单特异性抗体或双特异性抗体)或其片段组合,向个体投与本文所描述之表现CAR之细胞。
在一个实施例中,与mTOR抑制剂,例如本文所描述之mTOR抑制剂,例如雷帕霉素类似物(诸如依维莫司(everolimus))组合,向个体投与本文所描述之表现CAR之细胞。在一个实施例中,在投与表现CAR之细胞之前,投与mTOR抑制剂。举例而言,在一个实施例中,可在细胞清除术之前,投与mTOR抑制剂。在一个实施例中,个体患有CLL。
在一个实施例中,本文所描述之表现CAR之细胞可与激酶抑制剂组合使用。在一个实施例中,激酶抑制剂为CDK4抑制剂,例如本文所描述之CDK4抑制剂,例如CD4/6抑制剂,诸如帕博西尼(palbociclib)或PD0332991。在一个实施例中,激酶抑制剂为BTK抑制剂,例如本文所描述之BTK抑制剂,诸如依鲁替尼(ibrutinib)。在一些实施例中,依鲁替尼以约300-600毫克/天(例如约300-350、350-400、400-450、450-500、500-550或550-600毫克/天,例如约420毫克/天或约560毫克/天)之剂量,例如经口投与。在实施例中,依鲁替尼以每天约250mg、300mg、350mg、400mg、420mg、440mg、460mg、480mg、500mg、520mg、540mg、560mg、580mg、600mg(例如250mg、420mg或560mg)之剂量投与一定时间段,例如每天以上述剂量投与21天周期或每天以上述剂量投与28天周期。在一个实施例中,投与1、2、3、4、5、6、7、8、9、10、11、12或更多个周期的依鲁替尼。
在一个实施例中,激酶抑制剂为mTOR抑制剂,例如本文所描述的mTOR抑制剂,诸如雷帕霉素、雷帕霉素类似物、OSI-027。在一个实施例中,激酶抑制剂为本文所描述之双重PI3K/mTOR抑制剂,诸如PF-04695102。
在一个实施例中,激酶抑制剂为Src激酶抑制剂。在一个实施例中,激酶抑制剂为达沙替尼。在一个实施例中,在投与表现CAR之细胞之后,向患者投与Src激酶抑制剂来控制或终止表现CAR之细胞之活性。在一个实施例中,在投与表现CAR之细胞之后,向患者投与达沙替尼来控制或终止表现CAR之细胞之活性。在一个实施例中,以以下之剂量经口投与达沙替尼:至少10毫克/天、20毫克/天、40毫克/天、60毫克/天、70毫克/天、90毫克/天、100毫克/天、140毫克/天、180毫克/天或210毫克/天。
在实施例中,与退行性淋巴瘤激酶(ALK)抑制剂组合,向个体投与本文所描述之表现CAR之细胞。
亦可使用抑制钙依赖性磷酸酯酶钙调神经磷酸酶(环孢灵及FK506)或抑制对生长因子诱导之信号传导重要之p70S6激酶(雷帕霉素)之药物。(Liu等人,Cell 66:807-815,1991;Henderson等人,Immun.73:316-321,1991;Bierer等人,Curr.Opin.Immun.5:763-773,1993)。在另一态样中,可与以下结合,向患者投与(例如之前、同时或之后)本发明之细胞组合物:骨髓移植、使用诸如氟达拉滨之化学疗法剂之T细胞去除疗法、外光束辐射疗法(XRT)、环磷酰胺,及/或诸如OKT3或CAMPATH之抗体。在一个态样中,本发明之细胞组合物在B细胞去除疗法(诸如与CD20反应之试剂,例如美罗华(Rituxan))之后投与。举例而言,在一个实施例中,个体可进行使用高剂量化学疗法,随后周边血液干细胞移植的标准治疗。在某些实施例中,在移植后,个体接受本发明之经扩增免疫细胞输注。在一额外实施例中,在手术之前或之后投与扩增之细胞。
在实施例中,与自体干细胞移植、同种异体干细胞移植、自体骨髓移植或同种异体骨髓移植组合,向个体投与本文所描述之表现CAR之细胞。
在实施例中,与微移植或HLA错配同种异体细胞疗法(Guo M等人,JClinOncol.2012年11月20日;30(33):4084-90)组合,向个体投与本文所描述之表现CAR之细胞。
在实施例中,与吲哚胺2,3-二加氧酶(IDO)抑制剂组合,向个体投与本文所描述之表现CAR之细胞。
在实施例中,与骨髓衍生之抑制细胞(MDSC)之调节剂组合,向个体投与本文所描述之表现CAR之细胞。
在实施例中,与Brd4或BET(溴域及额外末端基元)抑制剂组合,向个体投与本文所描述之表现CAR之细胞。与表现CAR之细胞组合投与之例示性Brd4抑制剂包括(但不限于):如US 20140256706 A1中所描述之JQ1、MS417、OTXO15、LY303511及Brd4抑制剂,及其任何类似物。
在一些实施例中,与介白素-15(IL-15)多肽、介白素-15受体α(IL-15Ra)多肽或IL-15多肽与IL-15Ra多肽两者之组合(例如hetIL-15(Admune Therapeutics,LLC)组合,向个体投与本文所描述之表现CAR之细胞。在一些实施例中,het-IL-15系皮下投与。
在一个实施例中,可向个体投与减轻或改善与投与表现CAR之细胞相关之副作用的药剂。与投与表现CAR之细胞相关之副作用包括(但不限于)CRS及噬血细胞性淋巴组织细胞增生症(HLH),亦称为巨噬细胞活化症候群(MAS)。
因此,本文所描述之方法可包含向个体投与本文所描述之表现CAR之细胞,及进一步投与控制可溶性因子含量升高之一或多种药剂,该含量升高由使用表现CAR之细胞治疗引起。在一个实施例中,个体中升高之可溶性因子为以下中之一或多者:IFN-γ、TNFa、IL-2及IL-6。在一实施例中,个体中升高之因子为以下中之一或多者:IL-1、GM-CSF、IL-10、IL-8、IL-5及fraktalkine。因此,投与以治疗此副作用之药剂可为抵消此等可溶性因子中之一或多者之药剂。在一个实施例中,抵消此等可溶性形式中之一或多者的药剂为抗体或其抗原结合片段。此类药剂之实例包括(但不限于):类固醇(例如皮质类固醇)、Src抑制剂(例如达沙替尼)、TNFa之抑制剂及IL-6之抑制剂。TNFa抑制剂之实例为抗TNFa抗体分子,诸如英利昔单抗(infliximab)、阿达木单抗(adalimumab)、聚乙二醇化赛妥珠单抗(certolizumabpegol)及戈利木单抗(golimumab)。TNFa抑制剂之另一实例为融合蛋白,诸如依那西普(entanercept)。IL-6抑制剂之实例为抗IL-6抗体分子或抗IL-6受体抗体分子,诸如托珠单抗(tocilizumab,toc)、赛瑞单抗(sarilumab)、艾思莫单抗(elsilimomab)、CNTO 328、ALD518/BMS-945429、CNTO 136、CPSI-2364、CDP6038、VX30、ARGX-109、FE301及FM101。在一个实施例中,抗IL-6抗体分子为托西利单抗。在一个实施例中,IL-6抑制剂为与IL6R及人类血清白蛋白(例如IL6R-304-Alb8)(SEQ ID NO:2649)结合之骆驼科双特异性抗体。基于IL-lR的抑制剂之实例为阿那白滞素(anakinra)。在一个实施例中,投与以治疗表现CAR之细胞之副作用之药剂为Src抑制剂(例如达沙替尼)。在一个实施例中,投与以治疗表现CAR之细胞之副作用之药剂为Src抑制剂达沙替尼。在实施例中,达沙替尼以以下之剂量进行投与:约10毫克/天至240毫克/天(例如10毫克/天、20毫克/天、40毫克/天、50毫克/天、70毫克/天、8 00毫克/天、100毫克/天、110毫克/天、120毫克/天、140毫克/天、180毫克/天、210毫克/天、240毫克/天或300毫克/天)。
在一个实施例中,可向个体投与增强表现CAR之细胞之活性的药剂。举例而言,在一个实施例中,药剂可为抑制抑制性分子之药剂。在一些实施例中,抑制性分子(例如,计划性死亡1(PD-1))可降低表现CAR之细胞建立免疫效应反应之能力。抑制性分子之实例包括PD-1、PDLl、CTLA-4、TIM-3、CEACAM(例如CEACAM-1、CEACAM-3及/或CEACAM-5)、LAG-3、VISTA、BTLA、TIGIT、LAIRl、CD160、2B4及TGFR β。抑制分子之抑制,例如在DNA、RNA或蛋白质水平上之抑制,可使CAR表现细胞性能优化。在实施例中,抑制性核酸,例如抑制性核酸,例如dsRNA,例如siRNA或shRNA、成簇规律间隔短回文重复序列(CRISPR)、转录活化因子样效应核酸酶(TALEN)或锌指核酸内切酶(ZFN),例如如本文中所描述,可用于抑制表现CAR之细胞中抑制性分子之表现。在一实施例中,抑制剂为shRNA。在一实施例中,抑制性分子在表现CAR之细胞内受到抑制。在此等实施例中,抑制抑制性分子表现之dsRNA分子与编码CAR之组分(例如,所有组分)的核酸连接。在一个实施例中,抑制性信号之抑制剂可为例如与抑制性分子结合的抗体或抗体片段。举例而言,药剂可为与PD-1、PD-L1、PD-L2或CTLA4结合之抗体或抗体片段。在一实施例中,药剂为与TIM3结合之抗体或抗体片段。在一实施例中,药剂为与CEACAM(CEACAM-1、CEACAM-3及/或CEACAM-5)结合之抗体或抗体片段。在一实施例中,药剂为与LAG3结合之抗体或抗体片段。
PD-1、PD-L1及PD-L2之抗体、抗体片段及其他抑制剂在此项技术中为可获得的,且可与本文所描述之本发明CAR组合使用。帕博利珠单抗(Pembrolizumab)为与PD-1结合之人类化IgG4单株抗体。在其他实施例中,增强表现CAR之细胞之活性的药剂为CEACAM抑制剂(例如CEACAM-1、CEACAM-3及/或CEACAM-5抑制剂)。
在一个实施例中,增强本文所描述之CAR之活性之药剂为增加引导CAR所针对之目标抗原之表现的另一药剂。可向接受本文所描述之表现CAR之细胞之个体投与之药剂包括:三氧化二砷;ATRA(全反式-视黄酸);(Du等人,Blood;2016年10月12日在线出版)之化合物27、40、49;IDH2抑制剂(例如AG-221)或其组合。在一实施例中,在投与表现CAR之细胞之前、同时或之后,投与药剂。在较佳实施例中,在投与表现CAR之细胞之前,投与此等药剂。在较佳实施例中,与以上药剂一起投与之表现CAR之细胞靶向B细胞抗原(例如CD19、CD20或CD22等)。
在一个实施例中,增强本文所描述之CAR或下一代CAR之活性之药剂为可溶性受体。可向接受本文所描述之表现CAR之细胞之个体投与的可溶性受体包括:sHVEM(SEQ IDNO:2664)、sHVEM-Alb8-vHH融合蛋白(SEQ ID NO:2665)或其组合。可溶性受体可一天投与一次或一天投与超过一次,例如一天两次、一天三次或一天四次。可溶性受体可投与多于一天,例如可溶性受体投与2天、3天、4天、5天、6天、1周、2周、3周或4周。举例而言,可溶性受体一天投与一次,持续7天。
在一个实施例中,可向个体投与防止表现CAR之细胞对于正常组织之毒性的药剂。CAR-T细胞疗法之一种限制可为对于正常组织之毒性。举例而言,靶向CD19之CAR或下一代CAR可引起长期消耗正常B细胞,该等正常B细胞亦表现CD19抗原。在一个实施例中,CD19CAR-T细胞疗法可与正常造血干细胞中之内源性CD19之基因剔除或突变组合。在一个实施例中,使用CRIPS/Cas9、Talons或此项技术中已知之其他适合的基因编辑方法,来达成内源性CD19之基因敲除或突变。在目前临床用途中,由CD19 CAR-T细胞结合之CD19之抗原决定基已定位至外显子2-4。在一个实施例中,使用CRISP/Cas9、Zn指核酸酶、Talons或此项技术中已知之其他方法,在自体或同种异体造血干细胞之外显子2(或由靶向CD19之CAR T细胞识别之其他适合的外显子/区域)中产生错义或无义突变。在一个实施例中,向个体给予CD19 CAR-T细胞输注及使用CD19缺失/突变的造血干细胞之自体或同种异体干细胞移植物,来控制他/她的疾病。由于将起源于经修饰干细胞之B细胞将不由CD19-CAR-T细胞靶向,所以患者将逃避B细胞功能障碍,该B细胞功能障碍为CD19 CAR-T细胞的常见副作用。在另一实施例中,MPL CAR-T细胞疗法与正常造血干细胞中之内源性MPL之基因剔除或突变组合。在另一实施例中,CD123 CAR-T细胞疗法与正常造血干细胞中之内源性CD123之基因剔除或突变组合。在另一实施例中,CD33 CAR-T细胞疗法与正常造血干细胞中之内源性CD33之基因剔除或突变组合。在另一实施例中,CD20 CAR-T细胞疗法与正常造血干细胞中之内源性CD20之基因剔除或突变组合。在另一实施例中,CD22 CAR-T细胞疗法与正常造血干细胞中之内源性CD22之基因剔除或突变组合。在另一实施例中,CS1 CAR-T细胞疗法与正常造血干细胞中之内源性CS1之基因剔除或突变组合。在另一实施例中,BCMA CAR-T细胞疗法与正常造血干细胞中之内源性BCMA之基因剔除或突变组合。在另一实施例中,CD45 CAR-T细胞疗法与正常造血干细胞或免疫效应细胞(例如T细胞或NK细胞)中之内源性CD45之基因剔除或突变组合。基本上,类似方法可用以减轻CAR-T细胞针对正常组织之毒性,在该正常组织中,由CAR或下一代CAR靶向之抗原亦表现于正常造血干细胞或其后代中之一者上。
在另一实施例中,CAR-T细胞疗法与免疫效应细胞(例如T细胞或NK细胞)或产生免疫效应细胞之干细胞中之由CAR或下一代CAR靶向之内源基因或蛋白质的基因剔除或突变组合。举例而言,由于CD45在所有造血细胞上表现,所以将难以产生靶向CD45之CAR-T细胞,因为其将被附近CD45-CART细胞杀死。然而,若在T细胞中表现CD45 CAR与在表现CD45 CAR或下一代CAR之T细胞中阻断基因表现或缺失内源性CD45组合,则可产生此类细胞。基本上,类似方法可用于产生靶向表现于免疫效应细胞上之其他抗原的CAR或下一代CAR。例示性此类抗原包括(但不限于):CD5、TCRα、TCRβ1、TCRβ2、TCRγ、TCRδ、preTCRα及表现于NK细胞上之各种受体。
可向接受本文所描述之表现CAR之细胞之个体投与之细胞介素包括:IL-2、IL-4、IL-7、IL-9、IL-15、IL-18、LIGHT及IL-21或其组合。在较佳实施例中,所投与之细胞介素为IL-7、IL-15或IL-21、IL12F或其组合。细胞介素可一天投与一次或一天投与超过一次,例如一天两次、一天三次或一天四次。细胞介素可投与多于一天,例如细胞介素投与2天、3天、4天、5天、6天、1周、2周、3周或4周。举例而言,细胞介素一天投与一次,持续7天。在一个较佳实施例中,在投与表现CAR之细胞之后投与之细胞介素为IL-7。
在一个实施例中,增强本文所描述之表现CAR之细胞之活性之药剂为Brd4抑制剂或靶向BRD4之siRNA或shRNA,如(Tolani,B等人,Oncogene,29;33(22):2928-37.PMID:23792448)(Tolani,Gopalakrishnan,Punj,Matta,&Chaudhary,2014)中所描述。
本文亦提供医药组合物,其包含以下中之任一者或多者:嵌合抗原受体、聚核苷酸、多肽、载体、病毒及/或基因工程改造细胞及/或本文所描述之化学化合物及医药学上可接受之载剂。此类组合物可包含:缓冲液,诸如中性缓冲盐水、磷酸盐缓冲盐水及其类似物;碳水化合物,诸如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或胺基酸,诸如甘胺酸;抗氧化剂;螯合剂,诸如EDTA或麸胱甘肽;佐剂(例如氢氧化铝);及防腐剂。在一个态样中,本发明之组合物经调配用于静脉内投与。
本发明之医药组合物可以适于待治疗之疾病之方式投与。投与之数量及频率将藉由诸如以下之因子来决定:患者之状况及患者之疾病之类型及严重程度,但适当剂量可藉由临床试验来测定。
当指示“治疗有效量”时,待投与之本发明之组合物之精确量可由医师考虑以下来决定:患者(个体)之年龄、体重、肿瘤大小、感染或癌转移程度及状况的个别差异。一般可规定,包含本文所描述之经基因修饰之细胞(T细胞、NK细胞)之医药组合物可以10
在一些实施例中,可能需要向个体投与活化的经基因修饰之细胞(T细胞、NK细胞),且随后自其再抽血(或进行清除术),活化经基因修饰之细胞,且向患者再输注此等活化及扩增之经基因修饰之细胞。此过程可每几周进行多次。在某些态样中,免疫效应细胞(例如T细胞、NK细胞)可自10cc至400cc之抽取血液活化。在某些态样中,免疫效应细胞(例如T细胞、NK细胞)自20cc、30cc、40cc、50cc、60cc、70cc、80cc、90cc或100cc之抽取血液活化。
“医药学上可接受之赋形剂”意谓适用于制备通常安全、无毒且合意的医药组合物之赋形剂,且包括对于兽用以及人类医药用途可接受之赋形剂。此类赋形剂可为固体、液体、半固体,或在气雾剂组合物情况下为气态。
在各种实施例中,根据本发明之医药组合物可经调配用于经由任何投与途径进行递送。“投与途径”可指代此项技术中已知之任何投与路径,包括(但不限于)气雾剂、经鼻、经口、静脉内、肌肉内、腹膜内、吸入、经黏膜、经皮、非经肠、可植入泵、连续输注、局部应用、胶囊及/或注射。
根据本发明之医药组合物亦可含有任何医药学上可接受之载剂。如本文所用,医药学上可接受之载剂系指医药学上可接受之材料、组合物或媒剂,其涉及将所关注化合物自身体之一个组织、器官或部分携带或转运至身体之另一组织、器官或部分。举例而言,载剂可为液体或固体填充剂、稀释剂、赋形剂、溶剂或囊封材料或其组合。载剂之各组分必须为“医药学上可接受的”,此系因为其必须与调配物之其他成分兼容。其亦必须适用于与任何其可接触之组织或器官接触,意谓其不可携有毒性、刺激、过敏反应、免疫原性或过度超过其治疗性益处之任何其他并发症的风险。
根据本发明之医药组合物亦可在用于经口投与之乳液或糖浆中进行囊封、制锭或制备。可添加医药学上可接受之固体或液体载剂以增强组合物或使组合物稳定化,或促进组合物之制备。液体载剂包括糖浆、花生油、橄榄油、甘油、盐水、醇类及水。固体载剂包括淀粉、乳糖、硫酸钙、二水合物、白土、硬脂酸镁或硬脂酸、滑石、果胶、阿拉伯胶(acacia)、琼脂或明胶。载剂亦可包括单独或与蜡一起的持续释放材料,诸如单硬脂酸甘油酯或二硬脂酸甘油酯。
遵循涉及以下之习知药学技术制备医药制剂:对于锭剂形式,涉及研磨、混合、造粒及必要时之压缩;或对于硬明胶胶囊形式,涉及研磨、混合及填充。当使用液体载剂时,制剂将呈糖浆、酏剂、乳液或水性或非水性悬浮液形式。此种液体调配物可直接经口投与或填充至软明胶胶囊中。
可递送治疗有效量之根据本发明之医药组合物。精确治疗有效量为就给定个体中之治疗功效而言将产生最有效结果之组合物的量。此量将视多种因素而变化,包括(但不限于)治疗性化合物之特征(包括活性、药物动力学、药效动力学及生物可用性)、个体之生理状况(包括年龄、性别、疾病类型及阶段、大体身体状况、对给定剂量之反应性及药物类型)、调配物中之一或多种医药学上可接受之载剂之性质及投与途径。熟习临床及药理学技术者将能够借由常规实验判定治疗有效量,例如,藉由监测个体对化合物投与之反应且相应地调节剂量。对于其他指导,参见Remington:The Science and Practice of Pharmacy(Gennaro编第20版,Williams&Wilkins PA,USA)(2000)。
可以任何适宜方式进行主题组合物之投与,包括藉由气雾剂吸入、注射、输注、植入或移植。本文所描述之组合物可以经动脉、皮下、皮内、肿瘤内、结节内、髓内、肌肉内、静脉内(i.v.)注射或腹膜内向患者投与。在一个态样中,藉由皮内或皮下注射向患者投与本发明之T细胞组合物。在一个态样中,借由静脉内注射投与本发明之T细胞组合物。可将免疫效应细胞(例如T细胞、NK细胞)之组合物直接注射至肿瘤、淋巴结或感染部位中。
在一特定例示性态样中,个体可经历白细胞去除术,其中将白细胞收集、富集或离体耗尽以选择及/或分离所关注细胞,例如T细胞。此等T细胞分离株可藉由此项技术中已知之方法进行扩增及处理,使得可引入本发明之一或多种CAR或下一代CAR构筑体,从而产生本发明之CAR-T细胞。有需要之个体可随后经历使用高剂量化学疗法继之以周边血液干细胞移植的标准治疗。在某些态样中,在移植之后或同时,个体接受本发明之经扩增CAR-T细胞输注。在一额外态样中,在手术之前或之后投与扩增之细胞。
在一个实施例中,例如使用活体外转录,将CAR引入至免疫效应细胞(例如T细胞、NKT细胞)中,及个体(例如人类)接受本发明之CAR或下一代CAR免疫效应细胞(例如T细胞、NKT细胞)的初始投与,及本发明之CAR或下一代CAR免疫效应细胞(例如T细胞、NK细胞)的一或多次后续投与,其中在先前投与之后小于15天,例如14、13、12、11、10、9、8、7、6、5、4、3或2天,投与该一或多次后续投与。在一个实施例中,每周向个体(例如人类)投与本发明之CAR或下一代CAR免疫效应细胞(例如T细胞、NK细胞)多于一次,例如每周投与本发明之CAR或下一代CAR免疫效应细胞(例如T细胞、NK细胞)2、3或4次。在一个实施例中,个体(例如人类个体)每周接受多于一次CAR免疫效应细胞(例如T细胞、NK细胞)(例如每周2、3或4次投与)(在本文中亦被称作周期),随后一周不投与CAR或下一代CAR免疫效应细胞(例如T细胞、NK细胞),且随后向个体投与额外一或多次CAR或下一代CAR免疫效应细胞(例如T细胞、NK细胞)(例如每周投与CAR或下一代CAR免疫效应细胞(例如T细胞、NK细胞)多于一次)。在另一实施例中,个体(例如人类个体)接受多于一个周期之CAR或下一代CAR免疫效应细胞(例如T细胞、NK细胞),且各周期之间的时间小于10、9、8、7、6、5、4或3天。在一个实施例中,每隔一天投与CAR或下一代CAR免疫效应细胞(例如T细胞、NK细胞),每周3次投与。在一个实施例中,投与本发明之CAR免疫效应细胞(例如T细胞、NK细胞)至少二、三、四、五、六、七、八周或更多周。
使用瞬时表现CAR或下一代CAR之免疫效应细胞(例如T细胞、NK细胞)(特定言之利用携带鼠scFv之CAR-T)治疗之患者可能出现之潜在问题为多次治疗后之全身性过敏反应。
在不受此理论束缚之情况下,咸信,此类过敏反应可能由发展体液抗CAR反应(亦即具有抗IgE同型之抗CAR抗体)之患者导致。当存在十天至十四天之暴露于抗原中断时,认为患者之抗体生成细胞经历IgG同型(不引起全身性过敏反应)至IgE同型之类别转换。
若患者在CAR或下一代CAR疗法时程期间处于发展针对CAR或下一代CAR疗法之过敏性反应或产生IgE类型CAR抗体反应的高风险下,则可在CAR或下一代CAR疗法之前或期间投与奥马珠单抗(Xolair)。
若患者在短暂CAR或下一代CAR疗法时程中处于产生抗CAR抗体反应(诸如由RNA转导产生之反应)之高风险下,则CAR-T输注中断不应持续大于十天至十四天。
亦提供用于实践本发明之套组。举例而言,本文揭示用于治疗个体之癌症或制备表现CAR或下一代CAR中之一或多者之CAR-T细胞的套组。套组可包括编码CAR或下一代CAR之核酸分子或多肽分子,或编码CAR或下一代CAR之载体,以及将核酸引入至免疫效应细胞中之方法。套组可包括:病毒,其包含编码CAR或下一代CAR之核酸;及用于增强病毒转导之化学物质,诸如凝聚胺。套组可含有用于分离表现CAR或下一代CAR之T细胞之组分。可替代地,套组可含有表现CAR或下一代CAR之免疫效应细胞(例如T细胞或NK细胞)或干细胞。套组中可包括多于一种所揭示之CAR。套组可包括容器及处于容器上或与容器相联之标签或药品说明书。
合适的容器包括例如瓶子、小瓶、注射器等。容器可由多种材料(诸如玻璃或塑料)形成。容器通常容纳包括以下中之一或多者之组合物:核酸分子、病毒、载体、表现CAR或下一代CAR之T细胞。在若干实施例中,容器可具有无菌进入孔(例如,容器可为静脉内溶液袋或具有可藉由皮下注射针刺穿之塞子的小瓶)。标签或药品说明书指示该组合物用于治疗特定病状。标记或药品说明书通常将进一步包括例如在治疗或预防肿瘤或制备CAR-T细胞之方法中,所揭示核酸分子、CAR或下一代CAR、或表现CAR或下一代CAR之T细胞的使用说明书。药品说明书通常包括市售治疗产品封装中惯常所包括之说明书,其含有关于适应症、使用、剂量、投与、与此类治疗产品之使用有关之禁忌及/或警告的信息。命令材料可以电子形式(诸如计算机磁盘或光盘)形式写入,或可为可视的(诸如视频文件)。套组亦可包括促进据以设计套组之特定应用的额外组分。因此,举例而言,套组可另外含有用于量测T细胞上之CAR或下一代CAR之表现、或测定表现CAR之T细胞之数目或百分比或测定CAR-T细胞之功能性的构件。套组可另外包括缓冲液及常用于实践特定方法的其他试剂。此类套组及适当内含物为熟习此项技术者所熟知。
动物模型亦可用于量测CAR活性。举例而言,可使用使用本文所描述之人类癌症相关抗原特异性CAR
可评价剂量依赖性CAR治疗反应。参见例如Milone等人,Molecular Therapy 17(S):1453-1464(2009)。
细胞增殖及细胞介素产量之评定先前已描述于例如Milone等人,MolecularTherapy 17(S):1453-1464(2009)处。
细胞毒性可藉由Matador分析或使用标准
成像技术可用于评价负载肿瘤之动物模型中zSIR之特定运输及增殖。此类分析已描述于例如Barrett等人,HumanGene Therapy 22:1575-1586(2011)中。
其它分析,包括本文实例部分中所描述的彼等分析以及此项技术中已知的彼等分析,亦可用于评价本文所描述的CAR。
实例
可藉由本文及下文所描述之若干活体外及活体内分析来测试CAR之活性。用于生成、选择和使用适合的CAR通用流程提供于下:
用于CAR生成的目标的识别基于文献或基因表现数据库的搜索,选择据以设计CAR之适合的目标。一般而言,相较于正常健康细胞,用于CAR之适合的目标在致病或疾病相关细胞上显示更高表现。
CAR生成一旦鉴别出用于CAR之候选目标抗原,基于在文献中可获得的信息来设计CAR的抗原结合域。一般而言,CAR之抗原结合域通常系基于抗体、抗体片段、scFV或骆驼科vHH域。抗体之重链(vH)及轻链(vL)之可变链之序列、骆驼科vHH域及各种受体及配位体可藉由定序或藉由公开可获得的资料库获得,且可使用本文所描述之方法用于合成CAR,如不同实例中所示。使用公开可获得的软件(例如ThermoFisher或IDT)及市售供应商(例如IDT),包含CAR之抗原结合域之序列经密码子优化且进行人工合成。对所得片段进行PCR扩增,且使用标准分子生物学技术,选殖至含有不同CAR主链之不同载体中。不同CAR主链描述于WO 2016/187349 A1、PCT/US2016/058305、US 62/429,597、PCT/US17/64379及PCT/US2017/024843中,该等文献以全文引用之方式并入本文中。一般而言,通常将CAR构筑体选殖至慢病毒载体中。使用自动化定序,确认构筑体之序列。
编码zSIR之另一例示性构筑体为pLenti-EF1α-CD8SP-BCMA-Am06-HL-vL-IgCL-Bam-CD3zECDTMCP-opt-F-P2A-Spe-SP-Bst-BCMA-Am06-HL-vH-IgG1-CH1-KPN-CD3zECDTMCP-opt2-F-F2A-Xba-PAC-DWPRE(SEQ ID NO:154)。此构筑体具有许多适宜的限制位点,使得抗原结合域片段(例如vL及vH域)可被切断且经靶向其他抗原之抗原结合域片段置换。载体在CD8信号肽(CD8SP)上游携带Nhe I位点,该位点亦可与Xho I位点一起使用以选殖至携带5′信号肽之新的vL片段中。BstB I及Mlu I位点可用于置换vH片段。Xho I及Spe I位点可用于用不同模块交换编码IgCL-[IgCL-Bam-CD3zECDTMCP-opt-F-P2A之模块。类似地,MluI及Xba位点可用于置换含有IgG1-CH1-KPN-CD3zECDTMCP-opt2-F-F2A之模块。编码PAC的附属模块可使用Xba I(或Nde I)及SalI限制位点来置换。因此,一般熟习此项技术者可使用此载体及抗原结合域(例如抗体之vL及vH域)之序列来产生靶向任何其他新颖抗原的zSIR。
分泌性抗原-NLuc融合蛋白及抗原结合域(ABD)-NLuc融合蛋白之产生.(视情况选用之步骤).
产生分泌性抗原-NLuc融合蛋白及抗原结合域(ABD)-NLuc融合蛋白,且如PCT/US2017/025602中所描述使用,该文献以全文引用之方式并入本文中。测试一组细胞株与ABD-NLuc融合蛋白之结合,以鉴别表现高水平之CAR目标之细胞株,且因此可用于测试CAR之活性。表A提供表现可用于分析本发明之CAR之活性之不同抗原目标之细胞株的例示性清单。表现CAR之目标之细胞株亦可使用替代方法,诸如文献搜索、用市售抗体免疫染色或藉由搜索公开可获得的基因表现数据库来鉴别。
在以下中测试表现CAR之免疫效应细胞以识别功能性CAR。
(A)Topanga分析(NLuc结合分析):表现对照载体及表现CAR之Jurkat-NFAT-GFP细胞或T细胞用目标抗原-Nluc融合蛋白(如上文所描述)染色,且藉由量测Nluc活性分析其与目标抗原结合之能力。举例而言,表现基于FMC63之靶向CD19之CAR之Jurkat-NFAT-GFP细胞显示,相较于表现对照载体之Jurkat-NFAT-GFP细胞或亲本Jurkat-NFAT-GFP细胞,与CD19-NLuc融合蛋白的结合增加。
(B)NFAT启动子驱动的GFP表现的诱导将表现对照载体及表现CAR之Jurkat-NFAT-GFP与表现目标抗原之细胞株(上文所描述)一起共培养4-24小时,且藉由使用流式细胞测量术量测GFP表现之诱导来分析其与目标抗原结合的能力。收集细胞上清液且分析细胞介素(例如IL2)之诱导。
(C)细胞介素产量之分析:将表现对照载体及表现CAR之Jurkat-NFAT-GFP细胞或T细胞与目标细胞株一起共培养4-96小时,且使用ELISA检查上清液之细胞介素(例如IL2、IFNγ、TNFα等)表现的诱导。
(D)活体外及活体内细胞毒活性之分析:将未感染T细胞或表现对照载体或CAR之彼等细胞与表现非分泌性形式之荧光素酶(诸如GLuc、NLuc、Turboluc 16等)之目标细胞株一起共培养4-96小时,且藉由量测荧光素酶活性检查细胞裂解之诱导,如PCT/US17/52344中所描述。亦可使用用于量测细胞毒活性的替代方法(例如
基于以上方法,一般熟习此项技术者可容易地设计、构筑、测试及选择针对任何抗原之适当起作用的CAR或CAR库。CAR或CAR库可用于人类临床试验及用于预防及治疗各种疾病病状之临床用途。表9提供可使用本发明之CAR治疗之人类疾病病状的例示性清单。
有可能的是,视各种因子而定,不同CAR或CAR子集最佳地适合于不同疾病病状,该等因子包括(但不限于):致病及疾病相关细胞上之目标抗原之流行性及表现量、疾病负荷及疾病之进展速率。视CAR之功效及毒性概况以及患者之状况而定,不同CAR甚至可最佳地适合于不同患者中之单一疾病病状。本发明提供一种对于产生多样化授受免疫反应之大量技术及逻辑障碍的解决方案。
藉由基因重排,产生正常TCR多样性。胸腺中之严格阳性及阴性选择方法确保,仅限于以低亲和力范围识别自身肽/MHC之表现αβ TCR之T细胞可填入周边。因此,胸腺环境允许产生自身限制性但无自身反应性之一组αβ T细胞。
自不同抗原结合域产生多样化CAR库受到产生及测试多个抗原结合域之技术及财政障碍限制。更重要的是,由于抗原结合域(例如抗体之vL及vH片段)中之每一者具有结合其他抗原且引起脱靶毒性之潜能,所以仅基于复数个抗原结合域之多样化CAR库可能具有增加的毒性风险。因此,此种库之潜在多样性将必须受到限制以降低脱靶毒性。本发明借由自单个或几个抗原结合域,藉由将其与TCR链之不同变体连接,产生多样化CAR库,来克服此问题。CAR库之多样性藉由使用不同连接子而进一步增加。表现该库之T细胞之多样性可藉由使用本发明中描述之不同附属模组及治疗对照来进一步增加。
CAR之此多样化库可用于针对表现该抗原之致病或疾病相关细胞提供多样化免疫反应。可替代地,CAR之多样化库可视情况用此项技术中已知之技术进行DNA条码编码(SEQID NO:123-128),且随后用于选择具有最佳生物学及临床特征之单一CAR或CAR子组。此等特征可包括(但不限于):活体外生物分析(例如细胞毒性、细胞介素分泌、结合亲和力、细胞表面表现、脱靶效果、T细胞增殖、耗尽标记之表现及终末分化等)中之效能、活体内分析(例如存活、肿瘤降低、T细胞留存、T细胞扩增等)中之效能及临床经历(例如疾病缓解、复发率、毒性等)。本发明之CAR可单独使用或与此项技术中已知之其他天然及合成免疫受体组合使用,以产生免疫效应细胞之多样化库,以用于预防及治疗由表现其目标抗原之细胞引起或与其相关之各种疾病病状。
编码不同信号肽、抗体结合域、连接子、TCR恒定链、可裂解连接子及选择标记(例如PAC、EGFP、CNB30等)之基因片段,使用市售供应商(IDT),人工合成在单一或多个片段中,且在用含有适当限制酶之引子之PCR反应中用作模板。扩增片段用适当限制酶消化,且随后使用标准分子生物学技术,选殖至pLENTI-EF1α(SEQ ID NO:129)、pLENTI-EF1α-DWPRE(SEQID NO:130)、pCCLc-MNDU3-W(SEQ ID NO:12639)或MSCV-Bgl2-AvrII-Bam-EcoR1-Xho-BstB1-Mlu-Sal-ClaI.I03(SEQ ID NO:131)载体中。将CAR片段选殖至以下载体中之Nhe I与SalI位点之间:pLENTI-EF1α(SEQ ID NO:129)、pLENTI-EF1α-DWPRE(SEQ ID NO:130)、pCCLc-MNDU3-WPRE(SEQ ID NO:12639)载体。随后,所得片段可在用含有适当限制酶之引子之PCR反应中用作模板。扩增片段可用适当限制酶消化,且随后使用标准分子生物学技术,选殖至适当载体中。
经工程改造以表现用于量测靶向不同细胞表面及胞内抗原之不同构筑体之细胞毒性之荧光素酶(例如GLuc或NLuc)的细胞株提供于表A中。此实验中使用之细胞株、细胞株上之目标抗原及其生长培养基在下表A中显示。在37℃下,在5%CO
表A:
经工程改造具有NFAT依赖性GFP报导基因之Jurkat细胞株(纯系E6-1)为来自UCSF之Arthur Weiss博士的赠礼。将Jurkat细胞维持在补充有10%FBS、青霉素及链霉素之RPMI-1640培养基中。
慢病毒及反转录病毒之产生.藉由基本上如先前(Matta,Hozayev,Tomar,Chugh,&Chaudhary,2003)所描述,在293FT细胞中基于磷酸钙之转染,来产生慢病毒。使293FT细胞在具有10%FCS、4mM L-麸醯胺酸、0.1mM MEM非必需胺基酸及1mM MEM丙酮酸钠(在此被称作DMEM-10)之DMEM中生长。对于慢病毒之产生,将293FT细胞涂铺在于10cm组织培养培养盘中不具有抗生素之10ml DMEM-10培养基中,使得其将在转染当天为大致80%汇合度。第二天,藉由磷酸钙转染方法,使用10μg编码不同基因之慢病毒表现质体、7.5μg PSPAX2质体及2μg PLP/VSVG质体,来转染细胞。在一些实验中,转染混合物亦含有2.5至5μg之间的编码HIV1Vif之质体(SEQ ID NO:11269)。转染后大致15-16小时,移出9ml培养基且用5ml新鲜培养基置换。转染后大致48小时,收集5ml上清液(第一次收集),且用新鲜5ml培养基置换。转染后大致72小时,收集所有培养基(第二次收集,通常约6ml)。合并所收集上清液,且在1000rpm下离心1分钟,以移除任何细胞碎片及非黏附细胞。经由0.45μm针筒过滤器过滤无细胞上清液。在一些情况下,藉由在4℃下于18500rpm下超离心2小时,将上清液进一步浓缩。将病毒集结粒再悬浮于1/10初始体积之XVIVO培养基中。使用新鲜病毒来感染目标细胞或将病毒以等分试样冷冻储存在-80℃下。
T细胞及PBMC之感染.白血球层细胞获自来自洛杉矶儿童医院血库之健康去鉴别成人供体,且用于通过Ficoll-Hypaque梯度离心分离周边血液单核细胞(PBMC)。PBMC按原样使用或使用CD3磁性微珠(Miltenyi Biotech)及按照制造商之说明书用来分离T细胞。将PBMC或所分离之T细胞再悬浮于补充有10ng/ml CD3抗体、10ng/ml CD28抗体及100IU重组人类-IL2之XVIVO培养基(Lonza)中。可替代地,使用CD3/CD28珠粒及100IU重组人类-IL2。在37℃下,在5%CO
基本上,使用如上文针对慢病毒载体产生所描述之类似程序来产生反转录病毒载体,不同之处在于,通常使用10μg反转录病毒构筑体、4μg pKAT及2μg VSVG质体,在10cm组织培养培养盘中在10ml DMEM-10培养基中转染293FT细胞。基本上如上文针对慢病毒载体所描述,进行病毒收集及目标细胞感染。
抗体及药物.毛地黄皂苷(Digitonin)购自Sigma(目录号D141),且在DMSO中制备100mg/ml之储备溶液。在PBS中制备1mg/ml之稀释储备液。除非另外指示,否则用于细胞裂解之毛地黄皂苷之最终浓度为30μg/ml。
临床级CAR-T制造及投与
对于临床级CAR-T制造,使用市售来源(例如Lentigen、Lonza等),生成编码CAR之cGMP级慢病毒。使用白细胞去除术,自供体(自体或同种异体)收集T细胞。使用如(Zhu F,Shah N等人,Cytotherapy,2017)所描述之CLINIMAC Prodigy(Miltenyi Biotech)自动化封闭系统及按照制造商之说明书,制造CAR-T细胞。使用5至10之间的感染倍率(MOI)。用于临床级CAR-T制造之替代方法(诸如Cocoon(Lonza)及手动开放系统)为此项技术中已知的,且可用于本发明之替代性实施例中。在淋巴消耗化学疗法之后,以大致1×10
IL2 ELISA.使用来自R&D systems(Minneapolis,MN)之ELISA套组且按照制造商之建议,在表现CAR之Jurkat-NFAT-GFP效应细胞或T细胞之细胞培养上清液中量测人类IL2、IFNγ、IL6及TNFα,该等细胞已与特异性目标细胞株共培养24至96小时。
FACS分析.小鼠抗人类c-Myc APC-共轭单株抗体(目录号IC3696A)系来自R&DSystems(Minneapolis,MN)。生物素标记蛋白L系购自GeneScript(Piscataway,NJ),以1mg/ml在磷酸盐缓冲盐水(PBS)中复原,且储存在4℃下。抗生蛋白链菌素-APC(SA1005)系购自ThermoFisher Scientific。
对于使用Myc染色进行CAR的检测,采集1×10
对于使用蛋白L染色进行CAR的检测,采集1×10
细胞死亡分析.为了量测细胞死亡,使用基于Gluc或NLuc之异位胞质表现之新颖分析,如PCT/US17/52344“ANon-Radioactive Cytotoxicity Assay”中所描述。
用于检测CAR及其抗原的表现的分析的研发.为了侦测CAR及其目标抗原之表现,使用基于荧光素酶之报导子分析(称为Matador分析),如PCT/US2017/025602“A HighlySensitive And Specific Luciferase Based Reporter Assay For Antigen Detection”中所描述。
CAR之Jurkat NFAT-GFP分析.以使得将携带NFAT结合位点之IL-2启动子选殖至GFP基因上游之方式,来工程改造Jurkat-NFAT-GFP细胞。此等细胞用于研究经由TCR及CAR之信号传导。藉由慢病毒介导的基因转移,在Jurkat NFAT-GFP细胞中稳定地表现不同CAR,随后用嘌呤霉素进行选择。将表现CAR之Jurkat-NFAT-GFP细胞与目标细胞一起,以大致1∶2之E∶T比率,共培养大致4小时至18小时。当CAR与其目标抗原之间的相互作用引起NFAT路径活化时,诱导GFP表现。因此,表现CAR之Jurkat-NFAT-GFP细胞显示,当其与表现CAR之受体之目标细胞株相互作用时,GFP表现之水准增加。
基本上如先前所描述研究,藉由将表现不同CAR构筑体之Jurkat-NFAT-GFP细胞与不同目标细胞共培养的诱导GFP表现(Wu,Roybal,Puchner,Onuffer,&Lim,2015)。藉由FACS分析,监测GFP表现。Jurkat-NFAT-GFP(亲本)细胞用作对照。在下文概述表14中,概述用不同CAR之结果。可藉由参考表14,来判定不同CAR之名称、其SEQ ID NO、组分抗原结合域及TCR链。在当与目标细胞株一起培养时,相较于亲本Jurkat-NFAT-GFP细胞,表现CAR之Jurkat-NFAT-GFP细胞显示更高GFP阳性细胞%之情况下,CAR在分析中视为阳性。因此,当与L363及U266细胞共培养时,相较于亲本Jurkat-NFAT-GFP细胞,表现由SEQ ID NO:495表示之BCMA CAR之Jurkat-NFAT-GFP细胞显示更高的GFP表现诱导。在细胞株名称后之符号+/-、+、2+等指示Jurkat-NFAT-GFP分析上之相对阳性程度,如藉由在将表现CAR之Jurkat-NFAT-GFP细胞与彼细胞株一起培养之后之GFP阳性细胞%所量测。结果亦表明,使用此分析,当暴露于相同细胞株时,视CAR类型而定,含有来源于相同抗体之结合域之不同CAR在其活化NFAT信号传导之能力中显示极大的多样性。另外,即使当CAR共享相同CAR架构(例如BBz CAR或SIR)时,表现含有靶向相同抗原之不同抗原结合域之CAR(例如CAR具有来源于不同BCMA抗体之抗原结合域)之Jurkat细胞,观测到针对相同目标细胞株的反应的极大多样性。最终,当暴露于相同目标细胞株时,表现靶向不同抗原(例如CD19与CD20)之CAR之Jurkat细胞显示反应之多样性。因此,可借由将CAR与不同TCR链、连接子、抗原结合域及目标特异性组合,产生针对单一目标细胞之多样化免疫反应。表14亦概述当暴露于其目标细胞株时,对不同CAR所观测到之基于GLuc之T细胞细胞毒性分析(Matador Asssay)的结果。符号+/-、+及2+等指示当在类似条件下进行分析时,使用Gluc细胞毒性分析,在将目标细胞株与表现CAR之T细胞共培养4-96小时之后,相较于对照T细胞(亦即不表现CAR或表现无关CAR(例如靶向在特定目标细胞株上不表现之抗原的CAR)的T细胞),观测到的细胞毒性程度。同样,类似于Jurkat-NFAT-GFP细胞获得之结果,当暴露于表现其目标抗原之细胞时,视其TCR链、连接子、抗原结合域、目标特异性及目标细胞株而定,表现不同CAR之T细胞在其发挥细胞毒性之能力中显示极大的多样性。在表现不同CAR之T细胞中,视其TCR链、连接子、抗原结合域、目标特异性及目标细胞株而定,当其暴露于在相当条件下之目标细胞株时,观测到在诱导细胞介素产量(例如IL2、TNFα及IFNγ)的能力中的类似多样性。基于此分析之结果,选择在NFAT-GFP及T细胞细胞毒性分析中为阳性之不同抗原结合域(例如scFv)、连接子、CAR类型及类别、及TCR链及其配置,用于进一步研究。
表14
具有不同抗原结合域的CD19 CAR的比较性分析
T细胞用含有不同抗原结合域但具有类似主链之CAR感染。表现CAR(其在第2代CAR主链(例如SEQ ID NO:16317)及双链SIR主链(例如SEQ ID NO:14056及14109)上,且含有分别来源于huCD19-mROO5-1(SEQ ID NO:14406及14437)及huCD19-USC3(SEQ ID NO:14400及14431)之抗原结合域(例如vL及vH片段、vL-CDR1-3及vH-CDR-1-3))之T细胞,相较于表现含有来源于hu-CD19-USC1-LH4(SEQ ID NO:4190及4264)、CD19-9B7(SEQ ID NO:4151及4225)及hu-Bu-13(SEQ ID NO:9655及9686)之抗原结合域(例如vL及vH片段)的对应的CAR的T细胞,显示优良的活体外细胞毒性及细胞介素分泌。因此,不选择来源于hu-CD19-USC1-LH4、CD19-9B7及hu-Bu-13之抗原结合域用于构筑CAR(例如第2代CAR、SIR、Ab-TCR、TFP等)。
CD19 CAR-T细胞之活体外及活体内研究
使用CD3磁珠分离之人类周边血液T细胞,用表现靶向CD19之CAR构筑体(SEQ IDNO:16311、16317及16318)之慢病毒感染。此等CAR之胺基酸序列分别由SEQ ID NO:16335、16341及16342表示。由SEQ ID NO:16311表示之CAR为具有来源于FMC63抗体之抗原结合域且含有41BB共刺激域及CD3z活化域的第二代CAR。由SEQ ID NO:16317表示之CAR为具有来源于低亲和力人类化抗-CD19抗体之抗原结合域且含有41BB共刺激域及CD3z活化域的第二代CAR。相比之下,由SEQ ID NO:16318表示之CAR为含有来源于人类化低亲和力抗-CD19抗体之抗原结合域的双链SIR。此SIR构筑体亦表现编码vFLIP-K13之经密码子优化型式(SEQID NO:12734)之附属模块。将所有CAR构筑体选殖至pCCLc-MNDU3-WPRE载体(SEQ ID NO:12639)中。在补充有重组IL2及CD3/CD28珠粒之XVIVO培养基中,将CAR-T细胞活体外扩增21天。用APC共轭蛋白L染色,随后在感染之后第5天进行流式细胞测量术,显示在细胞表面上强力表现CAR构筑体SEQ ID NO:16311及SEQ ID NO:16317,其中大致45-50%之细胞显示蛋白L染色。相比之下,看见由SEQ ID NO:16318表示之CAR之极少细胞表面表现,其中小于2%之细胞显示用蛋白L表面染色。在培养3周之后,将稳定表现GLuc之RAJI及NALM细胞与表现不同CAR之T细胞一起,以1∶1之效应子:目标(E∶T)比率,共培养48小时。收集上清液且用于通过ELISA量测IFNγ。图2A显示当所有CAR-T细胞与表现高水平之CD19之RAJI细胞共培养时,IFNγ产量显著增加。图2B显示,当与表现中等水平之CD19之Nalm6细胞共培养时,相较于表现构筑体SEQ ID N0:16311之CAR-T,表现构筑体SEQ ID NO:16318之CAR-T显示更高的IFNγ诱导。当重复实验用于量测TNFα产量时,获得基本上类似的结果。为了测试不同CAR-T细胞之活体内功效,经由尾部静脉,NSG小鼠用0.5×10
CD19 CAR-T细胞之活体外及活体内研究
使用CD3磁珠分离之人类周边血液T细胞,用表现靶向CD19之CAR构筑体(SEQ IDNO:16311及14056)之慢病毒感染。已描述由SEQ ID NO:16311表示之CAR。相比之下,由SEQID NO:14056表示之CAR为含有来源于人类化低亲和力抗体之抗原结合域的双链SIR。此构筑体之胺基酸序列由SEQ ID NO:15800表示。将两个CAR构筑体选殖至pCCLc-MNDU3-WPRE载体(SEQ ID NO:12639)中。编码具有SEQ ID NO:14056之CAR之pCCLc-MNDU3-WPRE载体之核酸序列由SEQ ID NO:12641表示。活体外扩增CAR-T细胞。用APC共轭蛋白L染色,随后在感染之后第6天进行流式细胞测量术,显示在细胞表面上强力表现CAR构筑体SEQ ID NO:16311,其中大致71.07%之细胞显示蛋白L染色。相比之下,看见由SEQ ID NO:14056表示之CAR之较少细胞表面表现,其中22.04%之细胞显示用蛋白L表面染色。在大致1周扩增之后,将稳定表现GLuc之RAJI及NALM细胞与表现不同CAR之T细胞一起,以1∶1之E∶T比率,共培养48小时。收集上清液且用于藉由ELISA量测IFNγ、TNFα及IL2。当与RAJI细胞共培养时,表现由SEQ ID NO:14056表示之下一代CAR(亦即双链SIR)之T细胞显示稳固产生IFNγ、TNFα及IL2,而表现FMC63-BBz CAR(SEQ ID NO:16311)之T细胞显示此等细胞介素之弱诱导。在于XVIVO培养基中之培养中,在存在IL2及CD3及CD28抗体下,扩增CAR-T细胞4周之后,重复该实验。观测到,当与RAJI细胞共培养时,表现由SEQ ID NO:14056表示之CAR之T细胞继续显示稳固产生IFNγ、TNFα及IL2,而表现FMC63-BBz CAR(SEQ ID NO:16311)之T细胞显示非常低至可忽略的此等细胞介素诱导,表明功能耗尽的证据。为了测试不同CAR-T细胞之活体内功效,经由尾部静脉,NSG小鼠用0.5×10
藉由靶向CD19之CAR、SIR及TFP之抗原掩蔽之比较
近年来,将习知第2代CD19 CAR偶发插入至单一B细胞急性淋巴球性白血病细胞中显示导致疾病复发,此系归因于白血病细胞上表现之CD19由白血病细胞中表现之CAR多肽掩蔽(Ruella M等人,Nat Med.2018 Oct;24(10):1499-1503)。此防止CAR-T细胞免于识别及杀死表现CAR之白血病细胞,导致纯系增殖、疾病复发及患者死亡。为了测试下一代CAR是否亦易受此问题影响,在表现CD19之RAJI及Nalm6细胞中稳定地表现编码第二代CAR(SEQID NO:16311、16317)、SIR(SEQ ID NO:14035、14056、14065、14109及16330)及TFP(SEQ IDNO:16328及14098)之慢病毒。随后,表现CAR之细胞用PE共轭CD19抗体(例如FMC63-PE)染色。观测到,第二代CAR(SEQ ID NO:16311、16317)及TFP(SEQ ID NO:16328及14098)之表现导致RAJI及Nalm6细胞上之CD19掩蔽,如藉由CD19细胞表面染色降低显示,如藉由与CD19-PE抗体的结合及流式细胞测量术所测定。相比之下,SIR(SEQ ID NO:14035、14056、14065、14109及16330)之表现对于RAJI及Nalm6细胞中之CD19之表现无显著效果。此外,表现第二代CAR(SEQ ID NO:16311、16317)及TFP(SEQ ID NO:16328及14098)之RAJI细胞显示由表现对应CAR及TFP之T细胞的杀伤降低,而表现SIR(SEQ ID NO:14035、14056、14065、14109及16330)之RAJI细胞保留其由表现对应SIR的T细胞杀死的易感性。
使用细胞介素释放症候群(CRS)模型,CAR之比较
使用近来描述之小鼠模型(Giavridis T等人,Nature Medicine,2018),测试不同CD19 CAR构筑体诱导CRS之能力。简言之,在第1天,SCID-Biege小鼠用300万Raji-pLenti-Luc细胞i.p(腹膜内)注射。在第21天,注射(腹膜内)3000万表现CAR(SEQ ID NO:16315及16330)之CAR-T。类似于公开研究(Giavridis T等人,Nature Medicine),在注射CAR-T细胞之后,给予第2代CAR(SEQ ID NO:16315)之动物的三分之一死亡。接受SIR(SEQ ID NO:16330)之动物无死亡。基本上,当使用表现SIR(SEQ ID NO:14056)之T细胞重复实验时,获得类似结果。
具有不同抗原结合域的MPL CAR的比较性分析
T细胞用含有不同抗原结合域但具有类似主链之CAR感染。表现MPL CAR(其在不同CAR主链(例如SEQ ID NO:16315、13761-13770、13780-13794)上,且含有分别来源于hu-161-2(SEQ ID NO:14409及14440)及hu-161-3(SEQ ID NO:14402及14433)之抗原结合域(例如vL及vH片段、vL-CDR1-3及vH-CDR-1-3))之T细胞,相较于表现含有来源于MPL-178、MPL-12E10及MPL-AB317(其描述于WO2019067805中)之抗原结合域(例如vL及vH片段)的对应CAR的T细胞,显示优良的活体外细胞毒性及细胞介素分泌。因此,不选择来源于MPL-178、MPL-12E10及MPL-AB317之抗原结合域用于构筑靶向MPL的CAR(例如第2代CAR、SIR、Ab-TCR、TFP等)。实际上,选择来源于hu-161-2(SEQ ID NO:14409及14440)及hu-161-3(SEQ ID NO:14402及14433)之抗原结合域及含有其对应CDR区之vL及vH,用于靶向MPL的CAR(例如第2代CAR、SIR、Ab-TCR、TFP等)。比较具有SEQ ID NO:13791及13793之CAR,且相较于具有SEQ IDNO:13793之CAR,具有SEQ ID NO:13791之CAR显示呈现优良的活体外细胞毒性及细胞介素产量。亦发现具有SEQ ID NO:13791之CAR优于在相同主链上但含有来源于鼠类MPL-161之抗原结合域的对应CAR,如WO2019067805中所描述。
MPL CAR-T细胞之活体外及活体内研究
使用CD3磁珠分离之人类周边血液T细胞,用表现靶向MPL之CAR构筑体(SEQ IDNO:16315及13791)之慢病毒感染。由SEQ ID NO:16315表示之CAR(CD8SP-MPL-hu-161-2-BBz)为具有来源于人类化MPL抗体之抗原结合域且含有41BB共刺激域及CD3z活化域的第二代CAR。相比之下,由SEQ ID NO:13791表示之CAR为含有来源于人类化MPL抗体之抗原结合域的双链SIR。将两个CAR构筑体选殖至pCCLc-MNDU3-WPRE载体(SEQ ID NO:12639)中。活体外扩增CAR-T细胞长达2-4周。将稳定地表现GLuc之HEL.92.1.7细胞与表现不同CAR之T细胞,以1∶1之E∶T比率,共培养48小时。使用Matador分析来量测细胞死亡。表现由SEQ ID NO:13791表示之下一代CAR(亦即双链SIR)之T细胞显示稳固诱导目标细胞死亡及细胞介素产量,而表现MPL-hu-161-2-BBz CAR(SEQ ID NO:16315)之T细胞显示弱的目标细胞死亡诱导及细胞介素产量。为了测试不同CAR-T细胞之活体内功效,经由尾部静脉,NSG小鼠用0.5×10
藉由靶向MPL之CAR、SIR及TFP之抗原掩蔽之比较
HEL.92.1.7细胞用表现靶向人类MPL之CAR构筑体(SEQ ID NO:16315、13780及13791)的慢病毒感染。CAR表现对于MPL之掩蔽之效果藉由用MPL抗体(1.6.1)进行免疫荧光染色及FACS分析来测定。可替代地,未结合MPL之表现藉由与161-scFv-Nluc融合蛋白(SEQID NO:2245,如WO2017173403中所描述,其以全文引用的方式并入本文中)之结合来测定。161-scFv-Nluc融合蛋白含有与NLuc融合、来源于靶向MPL之抗体(1.6.1)的抗原结合域。发现具有SEQ ID NO:16315及13780之CAR在HEL.92.1.7细胞中之表现导致抗原掩蔽,而具有SEQ ID NO:13791之CAR的表现不导致显著的MPL掩蔽。
具有不同抗原结合域之BCMA CAR的比较性分析
T细胞用含有不同抗原结合域但具有类似主链之CAR感染。表现BCMA CAR(其在不同CAR主链(例如SEQ ID NO:12913、12916-12946)上,且含有分别来源于BCMA-huC13-F12(SEQ ID NO:144114444)、BCMA-huC12A3-L3H3(SEQ ID NO:14414及14445)、BCMA-J6M0(SEQID NO:14415及14446)、BCMA-huJ22-10(SEQ ID NO:14398及14229)及BCMA-hu72(SEQ IDNO:14401 14432)之抗原结合域(例如vL及vH片段、vL-CDR1-3及vH-CDR-1-3))之T细胞,显示优良的活体外细胞毒性及细胞介素分泌。因此,选择来源于以上抗原结合域之抗原结合域及含有其对应CDR区之vL及vH,用于靶向BCMA之CAR(例如第2代CAR、SIR、Ab-TCR、TFP等)。
BCMA CAR-T细胞之活体外及活体内研究
使用CD3磁珠分离之人类周边血液T细胞,用表现靶向人类BCMA之CAR构筑体(SEQID NO(DNA):16316及12890、12943)之慢病毒感染。此等构筑体之对应胺基酸序列由SEQ IDNO:16340、14634及14687表示。由SEQ ID NO:16316表示之CAR为具有来源于人类化BCMA抗体之抗原结合域且含有41BB共刺激域及CD3z活化域的第二代BCMA。相比之下,由SEQ IDNO:12890及12943表示之CAR为双链SIR。将两个CAR构筑体选殖至pCCLc-MNDU3-WPRE载体(SEQ ID NO:12639)中。编码CAR SEQ ID NO:12890及12943之慢病毒载体之完全核酸序列分别由SEQ ID NO:14378-14385表示。活体外扩增CAR-T细胞长达2-4周。将稳定地表现GLuc之L363细胞与表现不同CAR之T细胞,以1∶1之E∶T比率,共培养48小时。使用Matador分析来量测细胞死亡。所有CAR-T细胞显示中等的目标细胞死亡诱导及细胞介素(IFNγ及TNFα)产生。为了测试不同CAR-T细胞之活体内功效,经由尾部静脉,NSG小鼠用0.5×10
藉由在L363及U266细胞株中稳定地表现具有SEQ ID NO(DNA):16316及12890、12943之CAR构筑体,测试不同CAR构筑体掩蔽BCMA抗原的能力。观测到,稳定表现CAR 16316造成BCMA之抗原掩蔽,而在稳定表现具有SEQ ID NO:12890、12943之构筑体后,未观测到显著的抗原掩蔽。类似地,当在表现BCMA之L363或U266细胞中表现时,具有SEQ ID NO:13049、12996及12837之CAR并不造成抗原掩蔽。
具有不同抗原结合域之间皮素(MSLN)CAR的比较性分析
T细胞用含有不同抗原结合域但具有类似主链之CAR感染。表现MSLN CAR(其在不同CAR主链(例如SEQ ID NO:14291-14323)上,且含有分别来源于MSLN-3-HL-AM(SEQ IDNO:4136及42MSLN-5(SEQ ID NO:14412及14443)、MSLN-7D9-HL(SEQ ID NO:14411及14442)及MSLN-hu22A10(SEQ ID NO:14410及14441)之抗原结合域(例如vL及vH片段、vL-CDR1-3及vH-CDR-1-3))之T细胞,相较于来源于MSLN-HuAM15及MSLN76923-HL之抗原结合域,显示优良的活体外细胞毒性及细胞介素分泌。因此,选择来源于MSLN-3-HL-AM(SEQ ID NO:4136及4210)、MSLN-5(SEQ ID NO:14412及14443)、MSLN-7D9-HL(SEQ ID NO:14411及14442)及MSLN-hu22A10(SEQ ID NO:14410及14441)之抗原结合域及含有其对应CDR区之vL和vH,用于靶向MSLN之CAR(例如第2代CAR、SIR、Ab-TCR、TFP等)。
具有不同抗原结合域及主链之间皮素(MSLN)CAR的比较性分析
使用涉及pCCLc-MNDU3-WPRE载体(SEQ ID NO:12639)的基因转移,产生表现含有不同抗原结合域且在不同CAR主链(SEQ ID NO:16312-16314;16361-16363)上之MSLN CAR的T细胞。使用Matador分析测试表现CAR之T细胞针对SKOV3细胞的细胞毒性,且测试该等T细胞的细胞介素产量。所有CAR-T细胞显示在与SKOV3细胞共培养后,轻微至中等的细胞毒性及变化水平的细胞介素产量。接下来,在NSG小鼠中之SKOV3异种移植模型中测试CAR-T细胞。出于此目的,皮下注射1×10
接下来,使用涉及pCCLc-MNDU3-WPRE载体(SEQ ID NO:12639)之基因转移,产生表现含有不同抗原结合域且在不同CAR主链(SEQ ID NO:163 13-16314;16331-16334;14268-14269;14321及14374)上之MSLN CAR的T细胞。此等CAR构筑体之胺基酸序列分别由SEQ IDNO:16337-16338;16354-16357;16012-16013、16065及16118表示。编码CAR SEQ ID NO:14374、14321及14268之慢病毒载体之完全核酸序列分别由SEQ ID NO:14381-14383表示。使用Matador分析测试表现CAR之T细胞针对SKOV3细胞的细胞毒性,且测试该等T细胞的细胞介素产量。在与SKOV3细胞,以1∶1之E∶T比率共培养72小时后,所有CAR-T细胞显示中等的细胞毒性及变化水平的细胞介素产量。表现CAR之T细胞显示高的IFNγ及TNFα基线产量,此在表现CAR16331-16334;14268-14269;14321及14374之T细胞中系不存在的。接下来,在NSG小鼠中之SKOV3异种移植模型中测试CAR-T细胞。出于此目的,皮下注射1×10
具有不同抗原结合域之CD22 CAR的比较性分析
T细胞用含有不同抗原结合域但具有类似主链之CAR感染。表现CD22 CAR(其在第2代CAR主链(例如SEQ ID NO:13443、13390、13284及14185)及双链SIR主链(例如SEQ ID NO:13473、13420、13314及14215)上,且含有分别来源于CD22-INO(SEQ ID NO:14387及14418)、CD22-hu-HA22-2(SEQ ID NO:14399及14430)、CD22-h10F 4v2(SEQ ID NO:14407及14438)及CD22-hu-RFB4(SEQ ID NO:14396及14427)之抗原结合域(例如vL及vH片段、vL-CDR1-3及vH-CDR-1-3))之T细胞,相较于表现含有来源于hu-HA22-1(SEQ ID NO:4123及4197)及CD22-CELL7(SEQ ID NO:14390及14421)之抗原结合域之对应CAR的T细胞,显示优良的活体外细胞毒性及细胞介素分泌。因此,不选择来源于hu-HA22-1及CD22-CELL7之抗原结合域,用于构筑靶向CD22之CAR(例如第2代CAR、SIR、Ab-TCR、TFP等)。实际上,选择来源于CD22-INO(SEQ ID NO:14387及14418)、CD22-hu-HA22-2(SEQ ID NO:14399及14430)、CD22-h10F4v(SEQ ID NO:14407及14438)及CD22-hu-RFB4(SEQ ID NO:14396及14427)之抗原结合域及含有其对应CDR区之vL及vH,用于靶向CD22之CAR。
表现叶酸受体1(FR1或FOLR1)CAR之T细胞在表现FR1之SKOV3细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向FR1之CAR构筑体(SEQ ID NO:2062-2102;2111-2140)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之SKOV3细胞与表现CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现BAFF-R CAR之T细胞在表现BAFF-R之Jeko-1及REC-1细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向BAFF-R之不同CAR构筑体(例如SEQ IDNO:13922-13953;13848-13858、13869-13900、13954-13964;13975-14006)的慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现hGLuc之Jeko-1及REC-1细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。藉由ELISA来测定IFNγ及TNFα之产量。使用NSG小鼠中之Jeko-1异种移植模型,证实CAR之活体内活性。当遭遇BAFF-R阳性细胞时,表现CAR(例如SEQ ID NO:13897、13950、14003等)之T细胞显示活化T细胞信号传导。
表现间皮素(MSLN)CAR之T细胞在表现MSLN之SKOV3细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向MSLN之不同CAR构筑体(SEQ ID NO:2748-2777;2797-2826;2846-2875;2895-2924;2944-2973;9386-9415;9435-9464)的慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现htchLuc之SKOV3细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现Her2 CAR之T细胞在表现Her2之MCF7细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向Her2之CAR构筑体(SEQ ID NO:2346、2356-2385;2395、2405-2434;2444、2454-2483;9092-9121;9141-9170)的慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之MCF7细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现EGFRviii CAR之T细胞在表现EGFRviii之U87MG细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向EGFRviii之CAR构筑体(SEQ ID NO:1660、1670-1699、1709、1719-1748、1758、1768-1797、1807、1817-1846)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之U87MG-EGFRviii细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现EMR2 CAR之T细胞在表现EMR2之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向EMR2之CAR构筑体(SEQ ID NO:1856、1866-1895、1905、1915-1944、1954、1964-1993)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之Molm13细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现DLL3 CAR之T细胞在表现DLL3之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向DLL3之CAR构筑体(SEQ ID NO:1553-1650)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之SK-MEL-37细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现CD19 CAR之T细胞在表现CD19之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向CD19之CAR构筑体(SEQ ID NO:769-817、720-768、867-915、965-1013、818-866、8632-8680)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之RAJI或NALM6细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养4小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现CD20 CAR之T细胞在表现CD20之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向CD20之CAR构筑体(SEQ ID NO:1063-1111、1014-1062)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之RAJI或NALM6细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养4小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现BCMA CAR之T细胞在表现BCMA之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向BCMA之CAR构筑体(SEQ ID NO:377-572、8093-8484)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之U266及L363细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现FLT3 CAR之T细胞在表现FLT3之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向FLT3之CAR构筑体(SEQ ID NO:8926-9023)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之RS4;11及MV4;11细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现CLL1 CAR之T细胞在表现CLL1之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向CLL1之CAR构筑体(SEQ ID NO:8779-8876)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之RAJI及U937细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现BST1 CAR之T细胞在表现BST1之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向BST1之CAR构筑体(SEQ ID NO:8485-8631)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之KG1细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现IL1RAP CAR之T细胞在表现IL1RAP之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向IL1RAP之CAR构筑体(SEQ ID NO:9171-9317)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之THP-1细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现gpA33 CAR之T细胞在表现gpA33之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向gpA33之CAR构筑体(SEQ ID NO:9024-9072)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之Molm-13细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现GPC3 CAR之T细胞在表现GPC3之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向GPC3之CAR构筑体(SEQ ID NO:9024-9072)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之HepG2细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现CLDN6 CAR之T细胞在表现CLDN6之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向CLDN6之CAR构筑体(SEQ ID NO:1455-1552)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之HepG2细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现UPK1B CAR之T细胞在表现UPK1B之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向UPK1B之CAR构筑体(SEQ ID NO:1455-1552)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之OVCAR-3细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现BMPR1B CAR之T细胞在表现BMPR1B之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向BMPR1B之CAR构筑体(SEQ ID NO:573-670)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之LNCaP及COV434细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现WISP1 CAR之T细胞在表现WISP1之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向WISP1之CAR构筑体(SEQ ID NO:3856-3953)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之MDA-MB-453细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现CD133 CAR之T细胞在表现CD133之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向CD133之CAR构筑体(SEQ ID NO:11312-11458)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之Reh及RS4;11细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现催乳素受体(PRLR)CAR之T细胞在表现PRLR之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向PRLR之CAR构筑体(SEQ ID NO:3121-3218)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之MCF7细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现IL13Ra2 CAR之T细胞在表现IL13Ra2之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向IL13Ra2之CAR构筑体(SEQ ID NO:14132-14165)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之U87MG细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现黏附分子-4 CAR之T细胞在表现黏附分子-4之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向黏附分子-4之CAR构筑体(SEQ ID NO:3072-3120、9465-9513)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之MCF7细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现PSMA CAR之T细胞在表现PSMA之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向PSMA之CAR构筑体(SEQ ID NO:3219-3365)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之PC3细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现TSHR(促甲状腺激素受体)CAR之T细胞在表现TSHR之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向TSHR之CAR构筑体(SEQ ID NO:3611-3659)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之TT细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现CDH19 CAR之T细胞在表现CDH19之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向CDH19之CAR构筑体(SEQ ID NO:1308-1405)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之MEL-624细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现VISTA CAR之T细胞在表现VISTA之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向VISTA之CAR构筑体(SEQ ID NO:3758-3855)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之MOLM-13细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养4小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现ROR1 CAR之T细胞在表现ROR1之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向ROR1之CAR构筑体(SEQ ID NO:9514-9562)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之JEKO-1细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养4小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现Liv1 CAR之T细胞在表现Liv1之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向Liv1之CAR构筑体(SEQ ID NO:9514-9562)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之MCF7细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养4小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现整合素B7 CAR之T细胞在表现整合素B7之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向整合素B7之CAR构筑体(SEQ ID NO:2533-2581)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之U266细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养4小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现SLC34A2 CAR之T细胞在表现SLC34A2之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向SLC34A2之CAR构筑体(SEQ ID NO:3562-3610)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之OVCAR-3及OVCAR-4细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现LY6E CAR之T细胞在表现LY6E之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向LY6E之CAR构筑体(SEQ ID NO:2582-2630)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之Molm13细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养4小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现LYPD1 CAR之T细胞在表现LYPD1之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向LYPD1之CAR构筑体(SEQ ID NO:2631-2679)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之OVCAR-3细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现STEAP1 CAR之T细胞在表现STEAP1之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向STEAP1之CAR构筑体(SEQ ID NO:3513-3561、9563-9611)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之PC3及LNCaP细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现Muc5Ac CAR之T细胞在表现Muc5Ac之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向Muc5Ac之CAR构筑体(SEQ ID NO:2974-3022)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之Capan-1(胰脏癌)及NCI-H1437细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现Muc17 CAR之T细胞在表现Muc17之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向Muc17之CAR构筑体(SEQ ID NO:3023-3071)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之SW1463及SW403细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现RNF43 CAR之T细胞在表现RNF43之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向RNF43之CAR构筑体(SEQ ID NO:3366-3463)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之Lovo细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现Robo4 CAR之T细胞在表现Robo4之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向Robo4之CAR构筑体(SEQ ID NO:3464-3512)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之ME-1细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现gPNMB CAR之T细胞在表现gPNMB之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向gPNMB之CAR构筑体(SEQ ID NO:2239-2287)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之U87MG细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
表现FCRH5 CAR之T细胞在表现FCRH5之细胞中诱导细胞毒性。使用CD3磁珠分离之人类周边血液T细胞,用表现靶向FCRH5之CAR构筑体(SEQ ID NO:1994-2042)之慢病毒感染。活体外扩增CAR-T细胞10-14天。将稳定地表现GLuc之REC-1细胞与表现不同CAR之T细胞,以10∶1之E∶T比率,共培养48小时。使用Matador分析,藉由量测GLuc活性,分析CAR-T细胞介导的目标细胞裂解之诱导。使用NSG小鼠中之异种移植模型,证实CAR之活体内活性。
靶向CD19之CAR之活体内功效.使用CD3磁珠分离之人类周边血液T细胞,用表现CD19 CAR构筑体(SEQ ID NO:8633-8680)之慢病毒感染。NSG小鼠(Jackson Lab)以175 cGy之剂量进行亚致死照射。照射后大致24小时(第2天),小鼠用2.5×10
使用CAR-T细胞用于授受细胞疗法.本发明之CAR-T细胞可用于授受细胞疗法。作为一实例,患有复发性急性淋巴球性白血病(ALL)、慢性淋巴球性白血病(CLL)或高风险中级B细胞淋巴瘤之患者,可接受靶向CD19之授受性转移CAR-T细胞的免疫疗法。使用来自Miltenyi Biotec之CliniMACS
使用靶向多种抗原之CAR-T细胞用于授受细胞疗法.许多癌症患者参与用靶向不同致病或疾病相关抗原之授受性转移CAR-T细胞之免疫疗法之IRB批准的I期临床试验。基于其目标抗原在致病或疾病相关细胞中之已知表现,选择针对不同疾病的CAR。在可能的情况下,致病或疾病相关细胞上之CAR目标之表现,藉由与ABD-GGS-NLuc融合蛋白之结合来确认,其中CAR之抗原结合域(ABD)经由可挠性连接子与非分泌性形式之NLuc蛋白融合。可替代地,使用市售抗体之免疫组织化学或流式细胞测量术用于确认致病或疾病相关细胞上之CAR目标之表现。T使用白细胞去除,自个体收集细胞,该等T细胞用编码CAR之适当慢病毒载体转导,且使用CD3/CD28珠粒在封闭系统中离体扩增。在所得细胞产物经受质量控制测试(包括无菌及肿瘤特异性细胞毒性测试)之后,将其低温保存。同时,研究参与者开始淋巴球耗乏化学疗法(30毫克/平方米/天氟达拉滨加500毫克/平方米/天环磷酰胺×3天)。在完成其淋巴球耗乏方案一天之后,研究参与者接受静脉内输注CAR转导的淋巴球,随后每8小时高剂量(720,000IU/kg)IL-2(阿地介白素;Prometheus,San Diego,CA)至耐受。转运先前储存之CAR-T细胞产品,在患者之床边解冻及输注。按照研究方案,CAR-T产品之剂量在1×10
在授受细胞疗法之前,使用清髓性及淋巴球耗乏化学疗法两者
使用与前述实例中所描述基本上类似的方案,不同之处在于研究参与者接受清髓性及淋巴球耗乏化学疗法方案两者。例示性清髓性调节方案包括FCE(氟达拉滨,25毫克/平方公尺/天,第-7至-3天;环磷酰胺200毫克/平方米/天,第-7至-3天;及依托泊苷,250毫克/平方米/天,第-4至-3天)、FCIE(氟达拉滨,25毫克/平方公尺/天,第-7至-3天;环磷酰胺,200毫克/平方米/天,第-7至-3天;艾达霉素,12毫克/平方公尺/天,第-7至-5天,及依托泊苷,250毫克/平方公尺/天,第-4至-3天)、FluCyE(氟达拉滨,30毫克/平方公尺/天,在投与氟达拉滨之后,阿糖胞苷,1.5公克/平方公尺/天,及依托泊苷,100毫克/平方米/天,其中各药物在第-6至-1天给予)或FE(氟达拉滨,30毫克/平方米/天,及依托泊苷,100毫克/平方公尺/天,在第-5天至第-1天)或依托泊苷(50-100毫克/平方公尺/天,在第-5天至第-1天)。在完成化学疗法24-72小时之后,个体接受CAR-T细胞产品。细胞介素释放症候群及神经毒性之发生率及严重程度,在投与CAR-T细胞之前接受清髓性及淋巴球耗乏化学疗法两者之患者中降低。
与CAR-T细胞组合使用mTOR抑制剂RAD001.如前述实例中所描述进行该研究,不同之处在于自输注CAR-T细胞之后第1天开始,以提供目标最低含量0.1至3ng/ml之剂量,向研究参与者投与mTOR抑制剂(例如变构抑制剂,例如RAD001),其中该”最低含量”系指恰好在下一剂量之前血浆中之药物的浓度,或两个剂量之间的最小药物浓度。
与CAR-T细胞组合使用依鲁替尼.如前述实例中所描述进行该研究,不同之处在于自输注CAR-T细胞之后第1天开始,以140mg/d至420mg/d之剂量,向研究参与者投与口服依鲁替尼。应注意,相较于接受CAR-T细胞而无依鲁替尼之参与者,接受依鲁替尼之研究参与者具有较低的严重细胞介素释放症候群发生率。
使用异源CAR-T细胞用于授受细胞疗法.患有复发性骨髓瘤及原发性渗出性淋巴瘤之患者可接受用授受性转移的异源CAR-T细胞的免疫疗法。使用来自Miltenyi Biotec之CliniMACS
CAR-T细胞肝动脉输注.除静脉内输注以外,可动脉内输注CAR-T细胞,以在涉及疾病之局部区域或器官中提供高浓度之CAR-T细胞。在以下实例中,在患者患有自卵巢癌之肝癌转移(其表现间皮素(MSLN))之情况下,使用此方法。基本上类似方法可用于动脉内输注靶向其他肿瘤抗原之CAR-T细胞。
经由右侧公共股动脉方法,在基线处,进行映射血管造影。除肝外灌注之其他潜在来源以外,胃与十二指肠的及右侧胃动脉用微线圈栓塞。进行相同动脉进入程序,以用于投与表现MSLN CAR之T细胞,该等MSLN CAR为单独或组合的(SEQ ID NO:16331-16334;14268-14269;14321或14374)。在第0天,自患者收集T细胞,且用编码CAR(单独或组合)之慢病毒感染,且如先前实例中所描述进行扩增。在第14天(10
CAR-T细胞之腹膜内投与.亦可腹膜内投与CAR-T细胞,基本上如Koneru M等人(Journal of Translational Medicine;2015;13:102)中所描述。在以下实例中,在患者患有涉及腹膜之卵巢癌(其表现叶酸受体α(FR1或FOLR1))之情况下,使用此方法。基本上类似方法可用于腹膜内输注靶向其他肿瘤抗原之CAR-T细胞。
将向患有复发性高级浆液性卵巢癌之患者提供筛选知情同意书,以测试其癌症之FR1(FOLR1)表现。在藉由免疫组织化学确认FR1表现之情况下,随后患者将具有获自周边血液之白血球清除产物。在研究之治疗期中,将对白血球清除产物进行解冻且洗涤。随后,将借由磁力分离,使用CD3/CD28珠粒,自解冻的白血球清除产物分离出CD3+T细胞。活化T细胞将用具有FOLR1 CAR[SEQ ID NO:2120或2121]之慢病毒转导,且使用CD3/CD28珠粒扩增方案进一步扩增。
此等自体T细胞将经基因工程改造,以表现FOLR1 CAR[SEQ ID NO:2120或2121]。显示表现FR1抗原(藉由备用(石蜡包埋)或新鲜活检肿瘤之免疫组织化学分析确认)之患有复发性高级浆液性卵巢癌、原发性腹膜或输卵管癌瘤之患者,将可能符合该研究之条件。
将向3-6名患者之组输注递增剂量之经修饰T细胞,以确立最大耐受剂量(MTD)。存在四个计划剂量水平:3×10
在T细胞输注之前,将定位IP导管。当准备投与经修饰T细胞时,将置放导管。将容许患者在其第一次输注CAR T细胞之前入住医院之住院病人单元,且将仍住院直至在第二次输注CAR T细胞至少3天之后。第一组待治疗的患者及每一后续组中治疗之第一名患者,将容许进入重症监护病房(ICU);后续患者可容许进入医学肿瘤学住院病患服务机构(受治疗医师之临床判断)。
在开始用经CAR修饰之T细胞治疗2至4天之前,患者将接受单次剂量之淋巴球耗乏环磷酰胺(750mg/m2,IV)化学疗法。在输注之前,转导的T细胞将进行数目、纯度、存活力及无菌性质量测试。所有患者将静脉内接受50%之经基因修饰之T细胞剂量。将对患者进行紧密地毒性监测。一至3天后,将以IP输注形式投与其余剂量之T细胞。
在治疗前后,将自所有患者获得血液样本,以评定经基因修饰之T细胞之毒性、治疗效果及存活。
使用CAR-T细胞用于肿瘤内注射.亦可肿瘤内投与CAR-T细胞,基本上如Brown CE等人,Clin Cancer Res.2015年9月15日;21(18):4062-4072中所描述。在以下实例中,在患者患有表现EGFRviii之复发性神经胶母细胞瘤(GBM)之情况下,使用此方法。基本上类似方法可用于肿瘤内注射靶向其他肿瘤抗原之CAR-T细胞。
将进行试点安全性及可行性研究,以在复发性GBM中测试表现CAR(SEQ ID NO:1699或1700)之T细胞。将需要所有参与患者提供书面知情同意书。符合条件的患者将包括患有复发性或难治性单病灶幕上III或IV级神经胶瘤之成人(18-70岁),其肿瘤并不显示与心室/CSF路径连通且适合于切除。在初始诊断高级神经胶瘤(WHO III或IV级)之后,患者将参与,此时其将经历白细胞去除术以用于收集周边血液单核细胞(PBMC)。此等细胞将用于工程改造T细胞,以如先前实例中所描述,在用对应慢病毒载体感染之后表现EGFRviii CAR(SEQ ID NO:1699或1700)。可替代地,可在用反转录病毒载体或使用睡美人转座子感染之后,或藉由IVT mRNA转染,生成CAR-T细胞。随后,测试释放之治疗性CAR-T细胞将进行低温保存且储存以便后续使用。在肿瘤第一次复发时,研究参与者将经历肿瘤切除以及置放Rickham储槽/导管。同时,将对治疗性CAR-T细胞进行解冻,使用基于CD3/CD28珠粒之快速扩增方案进行活体外再扩增。在手术及基线后MR成像恢复之后,将经由留置导管,将CAR-T细胞直接投与至切除凹穴中,基本上如(Brown等人,Clin Cancer Res.2015年9月15日;21(18):4062-4072)所描述。使用21号蝶形针将细胞人工地注射至Rickham储槽中,在5-10分钟内递送2mL体积,随后在5分钟内2mL无防腐剂标准生理盐水之冲洗液。方案治疗计划将规定患者内剂量递增时程,其中在5周时段内颅内投与12次CAR-T细胞剂量之目标包含每周一次治疗周期。在1、2、4及5周期期间,将在周期周之第1、3及5天,进行T细胞输注,且第3周将为其余周期。对于安全性,在第1周期中,吾人将使用患者内剂量递增策略,其中CAR T细胞剂量分别为在第1、3及5天投与10
在移植之前,使用CAR-T细胞用于活体外净化骨髓或周边血液干细胞制剂.在干细胞移植之前,CAR-T细胞可用于净化骨髓或癌细胞之周边血液干细胞制剂。在以下实例中,在自体干细胞(或骨髓)移植之前,表现BCMA之CAR-T细胞用于净化自患有多发性骨髓瘤之患者获得之骨髓或周边血液干细胞。基本上类似方法可用于使用靶向其他适合的抗原之CAR-T细胞来净化骨髓或周边血液干细胞制剂,该等抗原在癌细胞上表现且在正常造血干细胞上不表现或具有可忽略的表现。
患者将经历白细胞去除以收集周边血液单核细胞(PBMC)。将使用CD3珠粒来纯化T细胞。此等细胞将用于工程改造T细胞,以如先前实例中所描述,在用对应慢病毒载体感染之后,表现含有嘌呤霉素抗性基因之BCMA CAR CD8SP-BCMA-BB-CAR02-vL-[hTCRa-CSDVP]-F-F2A-SP-BCMA-BB-CAR02-vH-[hTCRb-KACIAH]-F-P2A-Xba-PAC[SEQ ID NO:546]。此CAR靶向BCMA,一种在骨髓瘤细胞上表现之抗原。表现CAR CD8SP-BCMA-BB-CAR02-vL-[hTCRb-KACIAH]-F-P2A-SP-BCMA-BB-CAR02-vH-[hTCRa-CSDVP]-F-F2A-PAC[SEQ ID NO:552]或CD8SP-BCMA-BB-CAR02-vL-IgCL-Bam-CD 3zECDTMCP-opt-F-P2A-Spe-SP-Bst-BCMA-BB-CAR02-vH-IgG1-CH1-KPN-CD3zECDTMCP-opt2-F-F2A-Xba-PAC[SEQ ID NO:553]之CAR-T,将用作替代物,或与以上靶向CS1之CAR-T细胞组合使用。可替代地,可在用反转录病毒载体或使用睡美人转座子感染之后,或藉由IVT mRNA转染,生成CAR-T细胞。随后,测试释放之治疗性CAR-T细胞将进行低温保存且储存以便后续使用或新鲜使用。将按照标准程序,自患有多发性骨髓瘤之患者收集骨髓细胞及周边血液先驱细胞产物。对于周边血液干细胞之移动,患者将接受3gm/m2环磷酰胺,随后自环磷酰胺24h之后开始,每天接受皮下10μg/kg G-CSF,直至完成提取为止。一旦周边血液CD34+-细胞计数为15个细胞/微升,即收集周边血液干细胞。收集目标将为每天处理三个血液体积,直至在处理之后达到最小10
使用活体外和活体内选择以选择具有所需特性的CAR.使用TRAC gRNA及此项技术中已知之技术,表7中列举之靶向CD19之一组CAR靶向T细胞中之TRAC基因座。靶向载体亦携带位于CAR插入物之终止密码子下游之DNA条码。T细胞可来源于周边血液。在一替代实施例中,使用此项技术中已知之技术,T细胞来源于iPSC之单一纯系或造血干细胞。将表现该组CAR之T细胞与RAJI细胞活体外共培养1至21天。在与目标细胞培养之前,及在共培养之后不同天,收集等分试样之CAR-T细胞库。样本经受下一代定序,以测定在暴露于目标细胞之后,不同CAR之相对频率。生物信息学分析用于测定在与目标细胞共培养之后,与较佳增殖性反应相关的CAR。基本上类似方法用于测定活体内赋予T细胞较高增殖性潜能及/或活体内长期存留及/或以较高频率(当将其在存活动物起始T细胞群体中之频率相较于死于肿瘤挑战之动物进行标准化时)存在的CAR。在本发明之替代实施例中,对于人类临床样本使用基本上类似方法,以鉴别与不同特性及/或结果相关之CAR,该等特性及/或结果包括(但不限于)较佳长期存活、较低的细胞介素释放症候群发生率、较低神经毒性及/或较高长期存留。随后,可使用此类CAR(单独或各种组合形式),来发展不同CAR子库,该等CAR子库含有靶向相同或不同抗原结合域、具有用于治疗不同疾病病状及不同患者之多样化特性的CAR。在其他实施例中,将CAR-T细胞暴露于其目标细胞株,且随后基于如藉由流式细胞测量术所测定之胞内IFNγ之程度,分选至不同组中。低与高IFNγ群体中之不同CAR之频率系藉由下一代定序来测定,且标准化至其在对照CAR-T细胞群体(亦即,尚未暴露于目标细胞株之CAR-T细胞,或暴露于不表现CAR之目标之细胞株的CAR-T细胞)中之频率。根据此分析,可测定与不同水平之IFNγ产量相关之CAR。类似方法用于筛选及选择具有任何所需特性或属性或其组合之CAR,该等所需特性或属性包括(但不限于)较低TNFα产量、较低耗尽标记表现、较低终末分化标记表现及/或较高细胞毒性标记表现。
HIV-1 Vif蛋白增强慢病毒介导的基因转导及表现。
将293FT细胞涂铺在于10cm组织培养培养盘中之不具有抗生素之10ml DMEM-10培养基中,使得其将在转染当天为大致80%汇合度。第二天,细胞藉由磷酸钙转染方法,使用编码SEQ ID NO:11244或靶向CD19之第2代CAR及共表现HIV-1 Vif蛋白(SEQ ID NO:11245)之10μg慢病毒表现质体及封装质体(7.5μg PSPAX2质体及2μg PLP/VSVG)转染。转染后大致15-16小时,移出9ml培养基且用5ml新鲜培养基置换。转染后大致48小时,收集5ml上清液(第一次收集),且用新鲜5ml培养基置换。转染后大致72小时,收集所有培养基(第二次收集,通常约6ml)。合并所收集上清液,且在1000rpm下离心1分钟,以移除任何细胞碎片及非黏附细胞。经由0.45μm针筒过滤器过滤无细胞上清液。使用p24ELISA来量测慢病毒之效价。白血球层细胞获自来自血库之健康去鉴别成人供体,且用于藉由Ficoll-Hypaque梯度离心分离周边血液单核细胞(PBMC)。使用CD3磁性微珠(Miltenyi Biotech)及按照制造商之说明书,PBMC用于分离T细胞。将T细胞再悬浮于补充有10ng/ml CD3抗体、10ng/ml CD28抗体及100IU重组人类-IL2之XVIVO培养基(Lonza)中。已纯化T细胞用等量之慢病毒载体感染,该慢病毒载体编码靶向CD19(SEQ ID NO:11244)之第2代CAR或靶向CD19之第2代CAR且共表现HIV-1 Vif蛋白(SEQ ID NO:11245)。两个CAR构筑体亦携带MYC抗原决定基标签。藉由在感染之后48小时,用APC共轭MYC抗体进行免疫染色及FACS分析,检查T细胞上之CAR的表现。相较于无Vif表现之CAR构筑体,发现显著地更高百分比之T细胞经共表现Vif之CAR构筑体感染。
在感染之后第3天,重复FACS分析。同样,相较于无Vif表现之CAR构筑体,发现显著地更高百分比之T细胞经共表现Vif之CAR构筑体感染。
亦在BC-1细胞株中重复该实验。同样,相较于无Vif表现之CAR构筑体,发现显著地更高百分比之BC-1细胞经共表现Vif之CAR构筑体感染。
- 用于细胞疗法之多样化抗原结合域、新颖平台及其他增强子
- 结合并抑制过氧化氢酶和/或超氧化物歧化酶的抗原结合构建体即单域VHH片段以及用于肿瘤疗法的含有它们的药物组合物
