制备高强度甜味剂的方法
文献发布时间:2023-06-19 12:21:13
相关申请的交叉引用
本申请声明拥有2018年11月11日提交的美国临时申请序列号62/757,156的权益,此项申请以引用方式被完全纳入本文。
背景
技术领域
本公开涉及用于生产甜味化合物的方法、系统和组合物,以及包含该甜味化合物的组合物。
背景技术
味觉系统提供了关于外界化学组成的感官信息。味觉传导是动物的化学诱发感觉的最复杂的形式之一。整个动物界都发现了味觉的信号,从简单的后生动物到最复杂的脊椎动物。哺乳动物被认为具有五种基本的味觉形式:甜、苦、酸、咸和鲜味(谷氨酸单钠的味道,又名鲜美味道)。
几个世纪以来,向可摄入组合物(包括食品和饮料)和/或口服施用的医药组合物中添加了各种天然和非天然成分和/或化合物,以改善它们的味道。虽然很早就了解到仅存在几种基本类型的“味道”,但对于味觉的生物基础和生物化学基础却了解很少,并且大部分味道改善剂或味道改性剂主要通过简单的试错过程来发现。
对于甜味而言,糖尿病和心血管疾病是在全球范围增加的健康问题,但在美国它们正在以令人担忧的速率发展。糖和卡路里是可以被限制以得到对健康具有积极营养作用的关键组分。高强度甜味剂可以提供糖的甜味,并具有各种味道品质。因为它们比糖甜很多倍,所以取代糖所需的甜味剂要少得多。
高强度甜味剂具有多种不同的化学结构,并且因此具有不同的性质,例如但不限于气味、风味、口感和回味。这些性质,尤其是风味和回味,通常被认为是随着品尝的时间而改变的,使得各个时间曲线(temporal profile)是甜味剂特异性的。
最近在鉴定有用的天然调味剂的方面具有显著的进展,所述调味剂如甜味剂,例如蔗糖、果糖、葡萄糖、赤藓糖醇、异麦芽酮糖醇、乳糖醇、甘露糖醇、山梨糖醇、木糖醇、某些已知的天然萜类、类黄酮、或蛋白质甜味剂。参见例如Kinghom等人,“NoncariogenicIntense Natural Sweeteners”,Med.Res.Rev.18(5)347-360(1998)(讨论了相比诸如蔗糖、果糖等的常见天然甜味剂在强度上甜得多的经发现的天然物质)。类似地,最近在新型人造甜味剂的鉴定和商业化方面取得了进展,所述新型人造甜味剂例如阿斯巴甜、糖精、安赛蜜(acesulfame-K)、甜蜜素(cyclamate)、三氯蔗糖等。参见,例如,Ager等人,Angew.Chem.Int.Ed.37,1802-1817(1998)。上述文献的全部公开内容通过引用整体并入本文。
诸如糖精和6-甲基-1,2,3-噁噻嗪-4(3H)-酮-2,2-二氧化物钾盐(乙酰磺胺酸钾)的甜味剂通常特征为具有苦味和/或金属回味。使用2,4-二羟基苯甲酸制备的产品据称表现出减少的与甜味剂有关的不期望的回味,并且在低于它们自身的味道可察觉的那些浓度的浓度下正是如此。并且,诸如三氯蔗糖和阿斯巴甜的高强度甜味剂被报导具有甜味传递问题,即,甜味的延迟起效和残留。参见S.G.Wiet等人,J.Food Sci.,58(3):599-602,666(1993)。
需要具有改善的味道和传递特性的新型增甜化合物、甜味增强剂、以及含有此类化合物和增强剂的组合物。另外,需要含有具有此类期望特性的新型增甜化合物和/或甜味增强剂的食品。
发明内容
本发明提供了一种产生具有以下结构的化合物1的方法:
在一些实施方案中,该方法包括使罗汉果苷IIIE与能够催化从罗汉果苷IIIE产生化合物1的第一酶接触。在某些实施方案中,与第一酶接触的罗汉果苷IIIE包含与重组宿主细胞接触的罗汉果苷IIIE,该重组宿主细胞包含编码第一酶的第一基因。例如,第一基因可以是与重组宿主细胞异源的。
在一些实施方案中,罗汉果苷IIIE在包含编码第一酶的第一多核苷酸的重组宿主细胞中与第一酶接触。罗汉果苷IIIE可以例如提供给重组细胞,存在于重组宿主细胞中,由重组宿主细胞产生,或其任何组合产生。在一些实施方案中,该方法包括在表达第一酶的条件下在培养基中培养重组宿主细胞。第一酶可以是例如UDP糖基转移酶(UDPglycosyltransferases)、环麦芽糊精葡聚糖转移酶(CGTase)、糖基转移酶(glycotransferases)、葡聚糖蔗糖酶(dextransucrases)、纤维素酶(cellulases)、β-葡糖苷酶(β-glucosidases)、淀粉酶(amylases)、转葡糖苷酶(transglucosidases)、果胶酶(pectinases)和葡聚糖酶(dextranases)中的一种或多种。
在一些实施方案中,第一酶是CGTase。在一些实施方案中,CGTase包含一种氨基酸序列,该氨基酸序列与SEQ ID NO:1、3、78-101、148和154中任一个的序列具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,CGTase包含SEQ ID NO:1、3、78-101、148和154中任一个序列。在一些实施方案中,CGTase由SEQ ID NO:1、3、78-101、148和154中的氨基酸序列组成。
在一些实施方案中,第一酶是葡聚糖蔗糖酶。例如,葡聚糖蔗糖酶可包含一种氨基酸序列,该氨基酸序列与SEQ ID NO:2、103、106-110、156、159-162和896中所示的任一序列具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,葡聚糖蔗糖酶由核酸序列编码,该核酸序列与SEQ ID NO:104、105、157、158和895中任何一个具有至少70%的序列同一性。
在一些实施方案中,第一酶是转葡糖苷酶。例如,转葡糖苷酶可包含一种氨基酸序列,该氨基酸序列与SEQ ID NOs:163-291和723中任何一个序列具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,转葡糖苷酶包含SEQ ID NOs:163-291和723中任何一个的氨基酸序列。
在一些实施例中,第一酶是β-葡糖苷酶。例如,β-葡糖苷酶可包含一种氨基酸序列,该氨基酸序列与SEQ ID NOs:102、292、354-374和678-741中任何一个所示的序列具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,该方法包括使罗汉果苷IIA与能够催化罗汉果苷IIA产生罗汉果苷IIIE的酶接触。在一些实施方案中,将罗汉果苷IIA与所述酶接触包括将罗汉果苷IIA与重组宿主细胞接触以产生罗汉果苷IIIE,其中重组宿主细胞包含编码能够催化罗汉果苷IIA产生罗汉果IIIE的酶的基因。罗汉果苷IIA可以例如提供给重组宿主细胞,由重组宿主细胞产生,存在于重组宿主细胞中,或其任何组合。能够催化从罗汉果糖苷IIA产生罗汉果糖苷IIIE的酶可以是例如UDP糖基转移酶、CGTase、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。
在一些实施方案中,第二酶是尿苷二磷酸-葡萄糖基转移酶(UGT)。例如,UGT可以是UGT73C3(SEQ ID NO:4)、UGT73C6(SEQ ID NO:5)、UGT 85C2(SEQ ID NO:6)、UGT73C5(SEQID NO:7)、UGT73E1(SEQ ID NO:8)、UGT98(SEQ ID NO:9或407)、UGT1576(SEQ ID NO:15)、UGT SK98(SEQ ID NO:16)、UGT430(SEQ ID NO:17)、UGT1697(SEQ ID NO:18)、UGT11789(SEQ ID NO:19)。在一些实施方案中,UGT包含一种氨基酸序列,该氨基酸序列与SEQ IDNOs:4-9、15-19、125、126、128、129、293-307、407、409、411、413,439、441和444中任何一个的序列具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。UGT由一种核酸序列编码,该核酸序列与UGT1495(SEQ IDNO:10)、UGT1817(SEQ ID NO:11)、UGT5914(SEQ ID NO:12)、UGT8468(SEQ ID NO:13)、UGT10391(SEQ ID NO:14)、SEQ ID NOs:116-124、127、130、408、410、412、414、440、442、443和445中任何一个中所示的序列具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,该方法包括使罗汉果醇与一种或多种能够催化从罗汉果醇产生罗汉果苷IIIE和/或IIE的酶接触。在一些实施方案中,使罗汉果醇与一种或多种酶接触包括使罗汉果醇与重组宿主细胞接触,以产生罗汉果苷IIIE和/或罗汉果苷IIE,其中重组宿主细胞包含一种或多种编码能够催化其产生罗汉果苷IIIE和/或罗汉果苷IIE的一种或多种酶的基因。例如,罗汉果醇可以提供给重组宿主细胞,由重组宿主细胞产生,存在于重组宿主细胞中,或其任何组合。
在一些实施方案中,能够催化罗汉果醇产生罗汉果苷IIE和/或罗汉果苷IIIE的一种或多种的酶中的至少一种包括一种序列,该序列与SEQ ID NOs:315、316、420、422、424、426、430、431、446、871、845-949和951-1012中任何一个的序列具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的同一性,或由一种序列编码,该序列与SEQ ID NOs:315、316、420、422、424、426、430、431、446、871、845-949和951-1012中任何一个的序列具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的同一性。在一些实施例中,能够催化罗汉果醇产生罗汉果苷IIE和/或罗汉果苷IIIE的酶包括一种或多种UDP糖基转移酶、CGTase、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶。在一些实施方案中,一种或多种酶中的至少一种是尿苷二磷酸-葡萄糖基转移酶(UGT)。例如,UGT可以是UGT73C3、UGT73C6、85C2、UGT73C5、UGT73E1、UGT98、UGT1495、UGT1817、UGT5914、UGT8468、UGT10391、UGT1576、UGT SK98、UGT430、UGT1697或UGT11789,或UGT包含一种氨基酸序列,该序列与SEQ ID NOs:4-9、15-19、125、126、128、129、293-307、405、406、407、409、411、413、439、441和444中任一个具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,该方法包括使罗汉果苷化合物与一种或多种能够催化罗汉果苷化合物产生罗汉果苷IIIE的酶接触以产生罗汉果苷IIIE,其中罗汉果苷化合物是罗汉果苷IA1、罗汉果苷IE1、罗汉果苷IIA1、罗汉果苷IIE、罗汉果苷IIA、罗汉果苷IIIA1、罗汉果苷IIIA2、罗汉果苷III、罗汉果苷IV、罗汉果苷IVA、罗汉果苷V和赛门苷(siamenoside)中的一种或多种。在一些实施方案中,使罗汉果苷化合物与能够催化罗汉果苷IIIE产物的一种或多种酶接触包括使罗汉果苷化合物与重组宿主细胞接触,其中重组宿主细胞包含一种或多种编码所述一种或多种能够催化从罗汉果糖苷化合物产生罗汉果糖苷IIIE的酶的基因。罗汉果苷化合物可以例如提供给重组宿主细胞,由重组宿主细胞产生,存在于重组宿主细胞中,及其任何组合。在一些实施方案中,一种或多种能够催化罗汉果苷产生罗汉果苷化合物的IIIE的酶包括UDP糖基转移酶、CGTase、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。在一些实施方案中,罗汉果苷化合物是罗汉果苷IIE。
在一些实施方案中,一种或多种能够催化罗汉果苷化合物产生罗汉果苷IIIE的酶包含一种氨基酸序列,该序列与SEQ ID NO:1、3、78-101、106-109、147、154、163-303、405、411、354-405、447-723、770、776和782中任一个具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,罗汉果苷化合物是罗汉果苷IIA或罗汉果苷IIE。在一些实施方案中,与一种或多种酶接触产生罗汉果苷IIIA、罗汉果苷IVE和罗汉果苷V中的一种或多种。
在一些实施方案中,一种或多种酶包含一种氨基酸序列,该序列与SEQ ID NO:304、405、411、872、874、978、880、882、884、886、888、890、892、894和896中任何一个具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,所述一种或多种酶由一种序列编码,该序列与SEQ IDNO:305、406、412、873、875、877、879、881、883、885、887、889、891、893和895中的任何一个具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,该方法包括使罗汉果苷IA1与重组宿主细胞接触,其中该重组宿主细胞包含编码UGT98或UGT SK98酶的基因。在一些实施方案中,UGT98或UGT SK98酶包含与SEQ ID NO:9、407、16或306具有至少70%序列同一性的氨基酸序列。在一些实施方案中,UGT98由SEQ ID NO:307所示的序列编码。在一些实施方案中,接触导致细胞中罗汉果苷IIA的产生。
在一些实施方案中,该方法包括使11-羟基-24,25环氧葫芦二烯醇与重组宿主细胞接触,其中所述重组宿主细胞包含编码环氧化物水解酶的基因。在一些实施方案中,将11-羟基-24,25环氧葫芦二烯醇提供给重组宿主细胞、存在于重组宿主细胞中、由重组宿主细胞产生,及其任何组合。
在一些实施方案中,该方法包括使11-羟基葫芦二烯醇与重组宿主细胞接触,其中所述重组宿主细胞包含编码细胞色素P450或环氧化物水解酶的基因。所述11-羟基葫芦二烯醇可以提供给重组宿主细胞,由重组宿主细胞产生,和/或存在于重组宿主细胞中。
在一些实施方案中,该方法包括使3,24,25-三羟基葫芦二烯醇与重组宿主细胞接触,其中所述重组宿主细胞包含编码细胞色素P450的基因。在一些实施方案中,将3,24,25-三羟基葫芦二烯醇提供给重组宿主细胞,存在于重组宿主细胞中,由重组宿主细胞产生,或其任何组合。接触导致重组宿主细胞中产生罗汉果醇。在一些实施方案中,细胞色素P450包含一种氨基酸序列,该序列与SEQ ID NO:20、49、308、315、430、872、874、876、878、880、882、884、886、888、889和892中的任何一个具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性;或细胞色素P450由一种核酸序列编码,该序列与SEQ ID NO:31-48、316、431、871、873、875、877、879、881、883、885、887、890和891中任何一个的序列具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,环氧化物水解酶包含一种氨基酸序列,该序列与SEQ ID NO:21-30和309-314中任何一个的序列具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性;或环氧化物水解酶由一种核酸序列编码,该序列与SEQ ID Nos:114和115中任何一个的序列具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,该方法包括使葫芦二烯醇与重组宿主细胞接触,其中该重组宿主细胞包含编码细胞色素P450的基因。在一些实施方案中,该接触导致产生11-羟基葫芦二烯醇。在一些实施方案中,葫芦二烯醇被提供至重组宿主细胞,由重组宿主细胞产生和/或存在于重组宿主细胞中。在一些实施方案中,细胞色素P450由一种核酸序列编码,该序列与SEQ ID NO:31-48、316、431、871、873、875、877、879、881、883、885、887、889和892中的任何一个具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,细胞色素P450包含一种氨基酸序列,该氨基酸序列与SEQ ID NO:20、31、49、308、315、430、872、874、876、878、880、882、884、886、888、890和891具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,该方法还包括将2,3-氧化角鲨烯、二氧化角鲨烯和二环氧角鲨烯中的一种或多种与重组宿主细胞接触,其中所述重组宿主细胞包含编码具有葫芦二烯醇合酶活性的多肽的基因。
在一些实施方案中,该方法包括使罗汉果苷中间体与重组宿主细胞接触,其中该重组宿主细胞包含编码具有葫芦二烯醇合酶活性的多肽的基因。在一些实施方案中,具有葫芦烯醇合成酶活性的多肽是一种融合蛋白,其包含一个或多个融合到葫芦烯醇合成酶上的融合结构域。在一些实施方案中,所述融合蛋白包含融合至葫芦二烯醇合酶的N-末端、C-末端或两者的融合结构域。在一些实施方案中,融合结构域长约3至约1000个氨基酸。在一些实施方案中,融合结构域长约5至约50个氨基酸。在一些实施方案中,融合结构域是功能蛋白的主要部分或整个序列。
在一些实施方案中,具有葫芦二烯醇合酶活性的融合多肽包含一种氨基酸序列,该序列与SEQ ID NOs:70-73、75-77、319、321、323、325、327-333、417、420、422、424、426、446、902、904或906具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,葫芦二烯醇合酶由一种核酸序列编码,该序列与SEQ ID NOs:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,接触导致葫芦二烯醇的产生。在一些实施方案中,将2,3-氧化角鲨烯和二环氧角鲨烯提供给重组宿主细胞,由重组宿主细胞产生和/或存在于重组宿主细胞中。在一些实施方案中,2,3-氧化角鲨烯和二环氧角鲨烯中的一种或多种是由包含一种序列的酶产生,该序列与SEQ ID NO:898或900具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,2,3-氧化角鲨烯、二环氧角鲨烯和二环氧角鲨烯中的一种或多种由一种酶产生,该酶由一种核酸序列编码,该序列与SEQ ID NO:897或899具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,葫芦二烯醇合酶包含一种氨基酸序列,该序列与SEQ ID NO:70-73、75-77、319、321、323、325、327,329-333、420、422、424、426、446、902、904和906中任何一个具有至少70%的序列同一性。在一些实施方案中,包含葫芦二烯醇合酶活性的多肽由包含核酸序列的基因编码,该序列与SEQ ID NO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905中任一个具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,将11-羟基葫芦二烯醇提供给重组宿主细胞、由重组宿主细胞产生和/或存在于重组宿主细胞中。在一些实施方案中,11-羟基葫芦二烯醇在包含编码CYP87D18和/或SgCPR蛋白的基因的细胞(例如重组宿主细胞)中表达。在一些实施方案中,CYP87D18或SgCPR蛋白包含一种氨基酸序列,该序列与SEQ ID NO:872或874具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,CYP87D18或SgCPR蛋白由一种核酸序列编码,该序列与SEQID NO:871或873具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,该方法包括使角鲨烯与重组宿主细胞接触,其中重组宿主细胞包含编码角鲨烯环氧酶的基因。在一些实施方案中,通过接触产生2,3-氧化角鲨烯。在一些实施方案中,角鲨烯被提供给重组宿主细胞,由重组宿主细胞产生和/或存在于重组宿主细胞中。在一些实施方案中,角鲨烯环氧酶包含一种氨基酸序列,该序列与SEQ ID NO:50-56、60、61、334或335中任一个具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,角鲨烯环氧酶由一种核酸序列编码,该序列与SEQ ID NO:335具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,所述方法包括使法呢基焦磷酸与重组宿主细胞接触,其中所述重组宿主细胞包含编码角鲨烯合酶的基因。在一些实施方案中,通过接触导致角鲨烯的产生。在一些实施方案中,法呢基焦磷酸被提供给重组宿主细胞、由重组宿主细胞产生和/或存在于重组宿主细胞中。在一些实施方案中,角鲨烯合酶包含一种氨基酸序列,该氨基酸序列与SEQ ID NO:69和336中任一个具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,角鲨烯合酶由包含一种核酸序列的序列编码,该核酸序列与SEQ ID NO:337具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,该方法包括使香叶基-PP与重组宿主细胞接触,其中所述重组宿主细胞包含编码法呢基-PP合酶的基因。在一些实施方案中,通过接触导致法呢基-PP的产生。在一些实施方案中,香叶基-PP被提供给重组宿主细胞,由重组宿主细胞产生,和/或存在于重组宿主细胞中。在一些实施方案中,法呢基-PP合酶包含一种氨基酸序列,其与SEQID NO:338具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,法呢基-PP合酶被一种核酸序列编码,该核酸序列与SEQ ID NO:339具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,一种或多种基因可操作地连接至异源启动子,该基因编码(1)能够催化从罗汉果苷IIIE产生化合物I的第一酶,(2)能够催化从罗汉果苷IIA产生罗汉果苷IIIE的酶,(3)环氧化物水解酶,(4)细胞色素P450,(5)具有葫芦二烯醇合酶活性的多肽,(6)角鲨烯环氧化物酶,(7)法呢基-PP合酶。在一些实施方案中,异源启动子是CMV、EF1a、SV40、PGK1、人β-肌动蛋白(human beta actin)、CAG、GAL1、GAL10、TEF1、GDS、ADH1、CaMV35S,Ubi、T7、T7lac、Sp6、araBAD、trp、lac、Ptac、pL启动子或其组合。在一些实施方案中,启动子是诱导型、阻遏型或组成型启动子。在一些实施方案中,在重组宿主细胞中丙酮酸、乙酰辅酶A、柠檬酸盐和TCA循环中间体的一个或多个的产生已被上调。在一些实施方案中,在重组宿主细胞中细胞质定位已被上调。在一些实施方案中,第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个包含编码2A自裂肽的至少一个序列。
在一些实施方案中,重组宿主细胞是植物、双壳类、鱼类、真菌、细菌或哺乳动物的细胞。在一些实施方案中,所述植物选自罗汉果属(Siraitia)、苦瓜属(Momordica)、绞股蓝属(Gynostemma)、南瓜属(Cucurbita)、黄瓜属(Cucumis)、拟南芥属(Arabidopsis)、蒿属(Artemisia)、甜菊属(Stevia)、人参属(Panax)、睡茄属(Withania)、大戟属(Euphorbia)、苜蓿属(Medicago)、吊兰属(Chlorophytum)、五加属(Eleutherococcus)、楤木属(Aralia)、桑属(Morus)、苜蓿属(Medicago)、桦木属(Betula)、黄芪属(Astragalus)、麻疯树属(Jatropha)、山茶属(Camellia)、韧伞属(Hypholoma)、曲霉属(Aspergillus)、茄属(Solanum)、石杉属(Huperzia)、孩儿参属(Pseudostellaria)、黄麻属(Corchorus)、常春藤属(Hedera)、地钱属(Marchantia)和桑属(Morus)。在一些实施方案中,真菌选自毛癣菌属(Trichophyton)、桑黄孔菌属(Sanghuangporus)、樟芝属(Taiwanofungus)、链疫孢属(Moniliophthora)、盘二孢属(Marssonina)、色二孢属(Diplodia)、微香菇属(Lentinula)、法夫酵母属(Xanthophyllomyces)、普可尼亚属(Pochonia)、炭疽菌属(Colletotrichum)、间座壳属(Diaporthe)、组织胞浆菌属(Histoplasma)、球孢子菌属(Coccidioides)、组织胞浆菌属(Histoplasma)、桑黄孔菌属(Sanghuangporus)、短梗霉属(Aureobasidium)、普可尼亚属(Pochonia)、青霉属(Penicillium)、孢子丝菌属(Sporothrix)、黑僵菌属(Metarhizium)、曲霉属(Aspergillus)、耶氏酵母属(Yarrowia)和油脂酵母属(Lipomyces)。在一些实施方案中,真菌为构巢曲霉(Aspergillus nidulans)、解脂耶氏酵母(Yarrowia lipolytica)或圆红冬孢酵母菌(Rhodosporin toruloides)。在一些实施方案中,重组宿主细胞是酵母细胞。在一些实施方案中,酵母选自假丝酵母属(Candida)、酵母属(Sacccharaomyces)、酵母亚门(Saccharomycotina)、外囊菌亚门(Taphrinomycotina)、裂殖酵母纲(Schizosaccharomycetes)、毕赤酵母属(Komagataella)、担子菌门(Basidiomycota)、伞菌亚门(Agaricomycotina)、银耳纲(Tremellomycetes)、柄锈菌亚门(Pucciniomycotina)、短梗霉属(Aureobasidium)、锥毛壳属(Coniochaeta)、红冬孢酵母属(Rhodosporidium)和微球黑粉菌纲(Microboryomycetes)。在一些实施方案中,该细菌选自弗兰克氏菌属(Frankia)、放线菌门(Actinobacteria)、链霉菌属(Streptomyces)和肠球菌属(Enterococcus)。在一些实施方案中,重组宿主细胞是酿酒酵母(Saccharomycescerevisiae)细胞或解脂耶氏酵母(Yarrowia lipolytica)细胞。在一些实施方案中,第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个是用于在细菌、哺乳动物、植物、真菌和/或昆虫细胞中表达的密码子优化的基因。在一些实施方案中,第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个包含对编码的酶的活性增加的功能性突变。在一些实施方案中,培养重组宿主细胞包括监测培养条件的pH、溶解氧水平、氮水平或其组合。
在一些实施方案中,该方法包括分离化合物1。在一些实施方案中,分离化合物1包括裂解重组宿主细胞,和/或从培养基中分离化合物1。在一些实施方案中,该方法包括纯化化合物1。纯化化合物1包括HPLC、固相萃取或其组合。在一些实施方案中,纯化包括获取重组宿主细胞、保存上清液、和裂解重组宿主细胞。在一些实施方案中,裂解包括使细胞经受剪切力或洗涤剂洗涤,从而获得裂解物。剪切力可以例如来自超声处理法、高压细胞裂解(french pressurized cells)、或珠子(beads)。在一些实施方案中,将裂解物进行过滤和纯化步骤。在一些实施方案中,通过固相萃取来过滤和纯化裂解物。
在一些实施方案中,该方法还包括在将第一罗汉果苷IIIE与第一酶接触之前,使第一罗汉果苷与一种或多种水解酶接触以产生罗汉果苷IIIE。例如,该水解酶可以是β-葡聚糖水解酶。在一些实施方案中,水解酶为EXG1或EXG2。在一些实施方案中,水解酶包含氨基酸序列,该氨基酸序列与SEQ ID NO:292、366-368、372、376-398、447-520、524-845、1013、1014和1023中任何一者具有或具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,第一罗汉果苷是罗汉果苷IV、罗汉果苷V、罗汉果苷VI或其组合。在一些实施方案中,第一罗汉果苷是罗汉果苷V、赛门苷I、罗汉果苷IVE、罗汉果苷VI、罗汉果苷IVA或其组合。
在一些实施方案中,使第一罗汉果糖苷与一种或多种水解酶接触包括使第一罗汉果糖苷与包含编码水解酶的基因的宿主细胞接触。在一些实施方案中,第一罗汉果苷接触宿主细胞中的一种或多种水解酶,所述宿主细胞包含编码水解酶的基因和编码能够催化化合物1产生的酶的基因。所述宿主细胞可以是重组宿主细胞,其包含编码第一酶的第一基因,该第一酶能够催化从罗汉果苷IIIE产生化合物1。在一些实施方案中,宿主细胞不是包含编码第一酶的第一基因的重组宿主细胞,该第一酶能够催化从罗汉果苷IIIE产生化合物1。在一些实施方案中,第一罗汉果苷被提供给宿主细胞,由宿主细胞产生和/或存在于宿主细胞中。编码水解酶的基因可以与宿主细胞是异源的或同源的。在一些实施方案中,编码水解酶的基因在宿主细胞中以正常水平表达。在一些实施方案中,编码水解酶的基因在宿主细胞中过表达。
在一些实施方案中,重组宿主细胞包含氧化角鲨烯环化酶例如环阿屯醇合酶(cycloartenol synthase)或β-香树酯醇合酶(beta-amyrin synthase),或编码氧化角鲨烯环化酶例如环阿屯醇合酶或β-香树酯醇合酶的核酸序列,并且其中所述氧化角鲨烯环化酶、环阿屯醇合酶或β-香树酯醇合酶经修饰以产生葫芦二烯醇或环氧葫芦二烯醇。氧化角鲨烯环化酶可以例如包含一种序列或由一种序列组成,该序列与SEQ ID NO:341、343和346-347中任一者具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,重组宿主细胞包含细胞色素P450还原酶或编码细胞色素P450还原酶的基因。在一些实施方案中,细胞色素P450还原酶包含一种序列或由一种序列组成,该序列与SEQ ID NO:318具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
本发明公开包括具有化合物1的结构的化合物,
其中所述化合物由本文公开的任何方法产生。
本发明公开了一种细胞裂解物,其包含具有以下结构的化合物1:
本发明还公开了一种重组细胞,其包含:具有以下结构的化合物1:
以及基因,该基因编码能够催化罗汉果苷IIIE产生化合物1的酶的。在一些实施方案中,该基因是重组细胞的异源基因。
本发明包括一种重组细胞,其包含编码第一酶的第一基因,所述第一酶能够催化由罗汉果苷IIIE产生具有以下结构的化合物1:
第一酶可以是,例如,UDP糖基转移酶、环麦芽糊精葡聚糖转移酶(CGTases)、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。在一些实施方案中,第一酶是CGTase。例如,CGTase可包含一种氨基酸序列,该序列与SEQ ID NOs:1、3、78-101、148和154中的任一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,CGTase包含或由SEQ ID NOs:1、3、78-101、148和154中任何一个的氨基酸序列组成。在一些实施方案中,第一酶是葡聚糖蔗糖酶。例如,葡聚糖蔗糖酶可包含一种氨基酸序列,该氨基酸序列与SEQ ID NOs:2、103、106-110、156和896中所示任一序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,葡聚糖蔗糖酶由一种核酸序列编码,该序列与SEQ ID NOs:104、105、157、158和895中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,第一酶是转葡萄糖苷酶。例如,转葡萄糖苷酶可包含例如一种氨基酸序列,该序列与SEQ ID NOs:163-291和723中任何一个的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,转葡萄糖苷酶包含或由SEQ ID NOs:3、95-102、163-291和723中任何一个的氨基酸序列组成。在一些实施方案中,第一种酶是β-葡萄糖苷酶。在一些实施方式中,β-葡萄糖苷酶包含一种氨基酸序列,该氨基酸序列与SEQ IDNOs:102、292、354-376和678-741中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,该细胞还包括一种编码尿苷二磷酸-葡萄糖基转移酶(UGT)的第二基因。在一些实施方案中,UGT包含一种氨基酸序列,该序列与SEQ ID NOs:4-9、15-19、125、126、128、129、293-307、407、409、411、413、439、441和444中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,UGT由一种核酸序列编码,该核酸序列与SEQ ID NOs:116-124、127、130、408、410、412、414、440、442、443和445中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,UGT由UGT 1495(SEQ ID NO:10)、UGT 1817(SEQ ID NO:11)、UGT 5914(SEQ ID NO:12)、UGT 8468(SEQ ID NO:13)或UGT 10391(SEQ ID NO:14)中所示的序列编码。在一些实施方案中,细胞还包括编码UGT 98或UGT SK98的第三基因。在一些实施例中,UGT 98或UGT SK98包含一种氨基酸序列,该序列与SEQ ID NO:9、407、16或306具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,UGT 98由SEQ ID NO:307中所述的核酸序列编码。
在一些实施方案中,细胞包含编码环氧化物水解酶的第四基因。在一些实施方案中,环氧化物水解酶包含一种氨基酸序列,该序列与SEQ ID NO:21-30和309-314中任一者具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性;或者由一种核酸序列编码,该核酸序列与SEQ ID NO:114和115中任何一者具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,细胞包含编码P450的第五序列。在一些实施方案中,P450包含一种氨基酸序列,该序列与SEQ ID NOs:20、49、308、315、430、872、874、876、878、880、882、884、886、888、890和891中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性;或由一种核酸序列编码,该核酸序列与SEQ ID NOs:31-48、316、431、871、873、875、877、879、881、883、885、887、889和892中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,P450由一种基因编码,该基因包含或由SEQID NOs:31-48、316和318中任何一个所示的序列组成。
在一些实施方案中,该细胞包含编码具有葫芦二烯醇合酶活性的多肽的第六序列。在一些实施方案中,具有葫芦二烯醇合酶活性的多肽是融合蛋白。在一些实施方案中,融合蛋白包含一个或多个融合结构域,其融合到葫芦二烯醇合酶的N-末端、C-末端或两者。融合结构域的长度可以变化,例如从约3到约1000个氨基酸长,或约5到约50个氨基酸长。在一些实施方案中,融合结构域是功能蛋白的主要部分或整个序列。在一些实施方案中,具有葫芦二烯醇合成酶活性的多肽包含一种氨基酸序列,该序列与SEQ ID NOs:70-73、75-77、319、321、323、325、327-333、417、420、422、424、426、446、902、904、906,906、851、854、856、1024、859、862、865、867、915、920、924、928、932、936、940、944、948、952、956、959、964、967、971、975、979、983、987、991、995、999、1003、1007和1011中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,具有葫芦二烯醇合成酶活性的多肽由与SEQ ID NOs:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905中任何一个具有至少70%序列同一性的核酸序列编码。
在一些实施方案中,该细胞还包括编码角鲨烯环氧化酶的第七基因。在一些实施方案中,角鲨烯环氧化酶包含一种氨基酸序列,该序列与SEQ ID NOs:50-56、60、61、334和335中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,角鲨烯环氧化酶由一种核酸序列编码,该核酸序列与SEQ ID NO:335具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,细胞还包含编码角鲨烯合酶的第八基因。在一些实施方案中,角鲨烯合酶包含一种氨基酸序列,该序列与SEQ ID NO:69或336具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,角鲨烯合酶由包含SEQ ID NO:337所示核酸序列或由SEQ ID NO:337所示核酸序列组成的序列编码。
在一些实施方案中,细胞还包含编码法呢基-PP合酶的第九基因。在一些实施方案中,法呢基-PP合酶包含一种氨基酸序列,该序列与SEQ ID NO:338具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,法呢基-PP合酶由与SEQ ID NO:339具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性的核酸序列编码。
在一些实施方案中,细胞是哺乳动物,植物,细菌,真菌或昆虫的细胞。例如,细胞可以是酵母细胞。在一些实施方案中,所述酵母选自假丝酵母属(Candida)、酵母属(Sacccharaomyces)、酵母亚门(Saccharomycotina)、外囊菌亚门(Taphrinomycotina)、裂殖酵母纲(Schizosaccharomycetes)、毕赤酵母属(Komagataella)、担子菌门(Basidiomycota)、伞菌亚门(Agaricomycotina)、银耳纲(Tremellomycetes)、柄锈菌亚门(Pucciniomycotina)、短梗霉属(Aureobasidium)、锥毛壳属(Coniochaeta)和微球黑粉菌纲(Microboryomycetes)。在一些实施方案中,所述植物选自罗汉果属(Siraitia)、苦瓜属(Momordica)、绞股蓝属(Gynostemma)、南瓜属(Cucurbita)、黄瓜属(Cucumis)、拟南芥属(Arabidopsis)、蒿属(Artemisia)、甜菊属(Stevia)、人参属(Panax)、睡茄属(Withania)、大戟属(Euphorbia)、苜蓿属(Medicago)、吊兰属(Chlorophytum)、五加属(Eleutherococcus)、楤木属(Aralia)、桑属(Morus)、苜蓿属(Medicago)、桦木属(Betula)、黄芪属(Astragalus)、麻疯树属(Jatropha)、山茶属(Camellia)、韧伞属(Hypholoma)、曲霉属(Aspergillus)、茄属(Solanum)、石杉属(Huperzia)、孩儿参属(Pseudostellaria)、黄麻属(Corchorus)、常春藤属(Hedera)、地钱属(Marchantia)和桑属(Morus)。在一些实施方案中,该真菌选自毛癣菌属(Trichophyton)、桑黄孔菌属(Sanghuangporus)、樟芝属(Taiwanofungus)、链疫孢属(Moniliophthora)、盘二孢属(Marssonina)、色二孢属(Diplodia)、微香菇属(Lentinula)、法夫酵母属(Xanthophyllomyces)、普可尼亚属(Pochonia)、炭疽菌属(Colletotrichum)、间座壳属(Diaporthe)、组织胞浆菌属(Histoplasma)、球孢子菌属(Coccidioides)、组织胞浆菌属(Histoplasma)、桑黄孔菌属(Sanghuangporus)、短梗霉属(Aureobasidium)、普可尼亚属(Pochonia)、青霉属(Penicillium)、孢子丝菌属(Sporothrix)、或黑僵菌属(Metarhizium)。
在一些实施方案中,细胞包含一种基因,该基因能够编码至少一种能够水解罗汉果苷V的水解酶。在一些实施方案中,化合物1在重组细胞中显示出对水解酶的耐受性,其中水解酶显示出水解罗汉果苷VI、罗汉果苷V、罗汉果苷IV至罗汉果苷IIIE的能力。
在一些实施方案中,重组细胞包含一种氧化角鲨烯环化酶例如一种环阿屯醇合酶或一种β-香树酯醇合酶,或一种编码氧化角鲨烯环化酶例如环阿屯醇合酶或β-香树酯醇合酶的核酸序列,其中氧化角鲨烯环化酶、环阿屯醇合酶或β-香树酯醇合酶β-经修饰以产生葫芦二烯醇或环氧葫芦二烯醇。
在一些实施方案中,氧化角鲨烯环化酶包含一种氨基酸序列,该序列与SEQ IDNO:341、343和346-347中的任一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,细胞包含细胞色素P450还原酶或编码细胞色素P450还原酶的基因。在一些实施方案中,细胞色素P450还原酶再生细胞色素P450活性。在一些实施方案中,细胞色素P450还原酶包含与SEQ ID NO:318具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性的序列。
在一些实施方案中,细胞包含SEQ ID NO:897、899、909、911、913、418、421、423、425、427、871、873、901、903和905中任何一个所示的序列。在一些实施方案中,细胞包含一种酶,该酶包含SEQ ID NO:315、316、420、422、424、426、430、431、446、871、845-949和951-1012所示的序列,或由SEQ ID NO:315、316、420、422、424、426、430、431、446、871、845-949和951-1012中任何一个的序列编码。
在一些实施方案中,该细胞包含编码能够水解第一罗汉果苷以产生罗汉果苷IIIE的水解酶的基因。在一些实施方案中,水解酶是β-葡聚糖水解酶。在一些实施方案中,水解酶为EXG1或EXG2。在一些实施方案中,水解酶包含一种氨基酸序列,该氨基酸序列与SEQ IDNO:292、366-368、372、376-398、447-520、524-845、1013、1014和1023中任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,第一罗汉果苷是罗汉果苷IV、罗汉果苷V、罗汉果苷VI或其组合。在一些实施方案中,第一罗汉果苷是罗汉果苷V、赛门苷I、罗汉果苷IVE、罗汉果苷VI、罗汉果苷IVA或其组合。
编码水解酶的基因与重组宿主细胞可以是异源或同源的。编码水解酶的基因可以在重组宿主细胞中以正常水平表达或过表达。在一些实施方案中,细胞是一种酵母细胞。在一些实施方案中,细胞是酿酒酵母(Saccharomyces cerevisiae)或解脂耶氏酵母(Yarrowia lipolytica)。
本发明还公开了产生具有以下结构的化合物1的方法:
在一些实施方案中,该方法包括:使第一罗汉果苷与一种或多种水解酶接触以产生罗汉果苷IIIE;使罗汉果苷IIIE与能够催化从罗汉果苷IIIE产生化合物1的酶接触。
在一些实施方案中,水解酶是一种β-葡聚糖水解酶。在一些实施方案中,水解酶是EXG1,例如EXG1包含一种氨基酸序列,该序列与SEQ ID NO:1012或1014具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,水解酶是EXG2,例如EXG2包含一种氨基酸序列,该序列与SEQ IDNO:1023具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。
在一些实施方案中,第一罗汉果苷是罗汉果苷IV、罗汉果苷V、罗汉果苷VI或其组合。在一些实施方案中,第一罗汉果苷是罗汉果苷V、赛门苷I、罗汉果苷IVE、罗汉果苷VI、罗汉果苷IVA或其组合。
在一些实施方案中,使第一罗汉果糖苷与一种或多种水解酶接触包括使第一罗汉果糖苷与重组宿主细胞接触,所述重组宿主细胞包含编码水解酶的第一基因和编码能够催化化合物1产生的酶的第二基因。在一些实施方案中,第一罗汉果苷与重组宿主细胞中的一种或多种水解酶接触,所述重组宿主细胞包含编码水解酶的第一基因和编码能够催化化合物1产生的酶的第二基因。在一些实施方案中,第一罗汉果苷由重组宿主细胞产生。在一些实施方案中,第一基因对于重组宿主细胞是天然的。在一些实施方案中,第一基因以正常水平表达。在一些实施方案中,第一基因对于重组宿主细胞是异源的。在一些实施方案中,第一基因过表达。在一些实施方案中,第二基因对于重组宿主细胞是异源的。在一些实施方案中,能够催化化合物1产生的酶是UDP糖基转移酶、环麦芽糊精葡聚糖转移酶(CGTases)、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。
本发明公开了一种重组细胞,其包含:第一基因,其编码能够水解第一罗汉果苷以产生罗汉果苷IIIE的水解酶;和第二基因,其编码能够催化从罗汉果苷IIIE产生化合物1的酶,其中化合物1具有以下结构:
在一些实施方案中,水解酶是一种β-葡聚糖水解酶。例如,水解酶可以是EXG1或EXG2。在一些实施方案中,EXG2蛋白包含一种氨基酸序列,该序列与SEQ ID NO:1023具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,第一罗汉果苷是罗汉果苷IV、罗汉果苷V、罗汉果苷VI或其组合。在一些实施方案中,第一罗汉果苷是罗汉果苷V、赛门苷I、罗汉果苷IVE、罗汉果苷VI、罗汉果苷IVA或其组合。第一基因可以与重组宿主细胞是异源的或同源的。第一基因可以在宿主细胞中过表达或正常表达。该细胞可以是例如酵母细胞。在一些实施方案中,细胞是酿酒酵母(Saccharomyces cerevisiae)或解脂耶氏酵母(Yarrowia lipolytica)。
本发明还公开了一种具有葫芦二烯醇合酶活性的融合多肽,其中所述融合多肽包含与葫芦二烯醇合酶融合的融合结构域。融合结构域可与葫芦二烯醇合酶的N-末端、C-末端或两者融合。融合结构域可以是例如约3至约1000个氨基酸长,或约5至约50个氨基酸长。在一些实施方案中,融合结构域包含功能蛋白的主要部分或整个序列。在一些实施方案中,融合结构域是功能蛋白的主要部分或整个序列。在一些实施方案中,融合结构域包含酵母蛋白的一部分或全部序列。在一些实施方案中,融合结构域是酵母蛋白的一部分或全部序列。在一些实施方案中,融合多肽包含一种氨基酸序列,该序列与SEQ ID NO:851、854、856、1024、859、862、865、867、915、920、924、928、932、936、940、944、948、952、956、959,964、967、971、975、979、983、987、991、995、999、1003、1007和1011中的任一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,融合多肽包含或由以下任一项所示的氨基酸序列组成:SEQ ID NO:851、854、856、1024、859、862、865、867、915、920、924、928、932、936、940、944、948、952、956、959、964、967、971、975、979、983、987、991、995、999、1003、1007和1011。在一些实施方案中,融合多肽的融合结构域包含一种氨基酸序列,该序列与SEQ ID NOs:866、870、917、921、925、929、933、937,941、945、949、953、957、961、968、972、976、980、984、988、992、996、1000、1004、1008和1012中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,融合多肽的融合结构域包含或由以下任一序列组成:SEQ ID NO:866、870、917、921、925、929、933、937、941、945、949、953、957、961、968、972、976、980、984、988、992、996、1000、1004、1008和1012。
在一些实施方案中,葫芦二烯醇合酶包含一种氨基酸序列,该序列与SEQ ID NOs:70-73、75-77、319、321、323、325、327、329-333、420、422、424、426、446、902、904和906中的任一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,葫芦二烯醇合酶包含或由以下任一序列中所示的氨基酸序列组成:SEQ ID NOs:70-73、75-77、319、321、323、325、327、329-329、420、422、424、426、446、902、904和906。在一些实施方案中,葫芦二烯醇合酶由包含核酸序列的基因编码,该核酸序列与SEQ ID NO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905中任一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,葫芦二烯醇合酶由包含或由以下所示任一核酸序列组成的基因编码:SEQ ID NO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905。
本发明公开了一种重组核酸分子,其包含编码本发明公开的且具有葫芦二烯醇合酶活性的任何融合多肽的核酸序列。本发明公开了一种重组细胞,其包含本发明公开的且具有葫芦二烯醇合酶活性的任何一种融合多肽和/或本发明公开且编码具有葫芦二烯醇合酶活性的融合多肽的任何重组核酸分子。本发明还公开了一种方法,该方法使用本文公开的且具有葫芦二烯醇合酶活性的任何融合多肽。该方法可包括使葫芦二烯醇合酶的底物与具有葫芦二烯醇合酶活性的融合多肽接触。在一些实施方案中,该接触导致产生葫芦二烯醇(curcurbitadienol)、24,25-环氧葫芦二烯醇或其组合。在一些实施方案中,葫芦二烯醇合酶的底物包含2,3-氧化角鲨烯、二氧化角鲨烯和二环氧角鲨烯中的一种或多种。在一些实施方案中,接触包括使底物与包含编码融合多肽的核酸序列的重组宿主细胞接触。重组宿主细胞能够例如表达融合多肽。在一些实施方案中,底物提供给重组宿主细胞,存在于重组宿主细胞中和/或由重组宿主细胞产生。
本发明还公开了一种具有化合物(1)结构的化合物:
其中化合物是分离和纯化的形式。
本发明还公开了一种组合物,其含有具有化合物(1)结构的化合物:
其中所述组合物包含按重量计大于50%的化合物。
在一些实施方案中,该组合物包含按重量计小于1%,0.5%或0.1%的罗汉果苷III
本申请公开了一种组合物,其包含具有化合物(1)的结构的化合物的溶液:
在一些实施方案中,化合物在溶液中的浓度大于500ppm,0.1%,0.5%,1%,5%或10%。在一些实施方案中,该组合物包含的罗汉果苷III
本申请也公开了一种组合物,其包含一种增量剂(bulking agent)和一种或多种具有化合物(1)的结构的化合物:
在一些实施方案中,该组合物包含按重量计大于0.5%,1%或2%的所述化合物。在一些实施方案中,该组合物包含按重量计大于30%,50%,70%,90%或99%的所述增量剂。
在一些实施方案中,该组合物包含化合物(1)和至少一种另外的甜味剂和/或甜味改良剂。
本申请还公开了包括本文公开的任何组合物的用途,例如所述组合物,其包含化合物(1)和至少一种另外的甜味剂和/或甜味改良剂,以传达、增强、改良或改善可消费产品的甜味感。
附图说明
图1显示了用CGTase处理罗汉果苷IIIE后产生的化合物1的HPLC数据和质谱数据(插图)。
图2显示了用变形链球菌(Streptococcus mutans)Clarke ATCC25175葡聚糖转移酶处理罗汉果苷IIIE后产生的化合物1的HPLC数据和质谱数据(插图)。
图3显示了在木聚糖存在下用Celluclast处理后,罗汉果苷糖基化反应的HPLC数据和质谱数据(插图)。
图4和图5显示了用UDP-糖基转移酶处理后的罗汉果苷糖基化反应的HPLC数据和质谱数据(插图)。
图6显示了用UDP-糖基转移酶UGT73C6处理罗汉果苷I后的罗汉果醇的HPLC数据和质谱数据(插图)。
图7-图9显示了罗汉果苷I、罗汉果苷IIA和两种不同罗汉果苷III产品经UDP-糖基转移酶(338)(SEQ ID NO:405)处理后的罗汉果醇的HPLC数据和质谱数据(插图)。
图10和图11显示了用UDP-糖基转移酶处理罗汉果苷IIIE以生产赛门苷I和罗汉果苷V产物的HPLC数据和质谱数据(插图)。
图12-图14显示了经UDP-糖基转移酶(339)(SEQ ID NO:409)处理罗汉果醇、赛门苷I或化合物1以分别产生罗汉果苷I、异罗汉果苷V和化合物1衍生物的HPLC数据和质谱数据(插图)。
图15-图20显示了用UDP-糖基转移酶(330)(SEQ ID NO:411)处理罗汉果苷IIA、罗汉果苷IIE、罗汉果苷IIIE、罗汉果苷IVA或罗汉果苷IVE以分别产生罗汉果苷IIIA、罗汉果苷IVA、罗汉果苷V的HPLC数据和质谱数据(插图)。
图21和图22显示了反应产物罗汉果苷IVE和赛门苷I的质谱图。
图23显示了用葫芦二烯合酶(SgCbQ)(SEQ ID NO:417)产生葫芦二烯醇。
图24显示了使用酶Cpep2(SEQ ID NO:420)产生葫芦二烯醇。
图25显示了使用酶Cpep4(SEQ ID NO:422)产生葫芦二烯醇。
图26显示了由环氧水解酶(SEQ ID NO:428)的催化产生二羟基葫芦二烯醇。
图27A-B显示了化合物1对微生物酶水解的耐受性。
图28显示了来自Hilic_80_20_method的α-罗汉果糖苷异构体混合物的UPLC色谱图。
图29显示了在Hilic_80_20_method上通过UPLC分析得到的样品纯度。
图30示出了用于产生化合物1的非限制性示例性途径的流程图。
图31示出图30所示的步骤1的二环氧化合物的紫外吸光度,以增强氧化角鲨烯。
图32示出了用厚皮甜瓜(Cucumis melo)和笋瓜(Cucurbita maxima)的酶在步骤2中生产葫芦二烯醇的方法。
图33显示了在步骤2中使用来自豌豆(Pisum sativum)的酶生产葫芦二烯醇。
图34显示了在步骤2中,使用来自盘基网柄菌(Dictyostelium sp.)的酶生产葫芦二烯醇。
图35显示了图30所示路线中步骤3的中间体。
图36显示了图30所示路线步骤4即罗汉果醇合成的中间产物的质谱数据。
图37显示了如图30所示的路线步骤7即化合物1合成的中间体。
图38是一个示意图,显示了通过糖基化酶产生高糖基化罗汉果苷,然后可以将其水解回罗汉果苷IIIE。
图39是一个示意图,展示了如何利用水解来水解高糖基化罗汉果苷以产生罗汉果苷IIIE,然后可将其转化为化合物1。
图40A-B显示在温育2天后,在酿酒酵母(S.cerevisiae)或解脂耶氏酵母(Y.lipolytica.)中,基本上所有的罗汉果苷都转化为罗汉果苷IIIE。
图41显示未从酿酒酵母(S.cerevisiae)或解脂耶氏酵母(Y.lipolytica.)中检测到来自化合物1的水解产物。
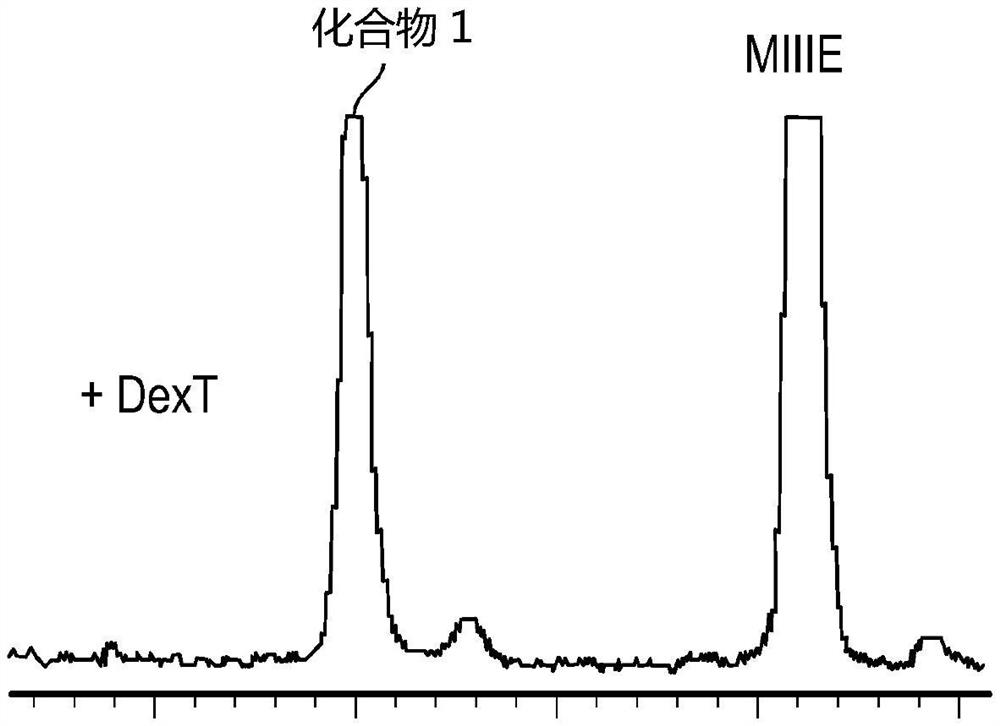
图42显示了在酿酒酵母(S.cerevisiae)中产生化合物1,该酿酒酵母经修饰以过表达葡聚糖蔗糖酶(DexT)。
图43显示了由311酶(UDP-糖基转移酶)催化的酶反应。
具体实施方式
除非另外定义,本文使用的所有技术术语和科学术语具有与本公开所属领域普通技术人员通常理解相同的含义。所有的专利、申请、公开申请和其他公开文本通过引用整体并入。在本文的术语存在多个定义的情况下,以本节的定义为准,除非另外说明。
“溶剂化物”是指由溶剂与本文所述的化合物或其盐的相互作用而形成的化合物。适合的溶剂化物是生理可接受的溶剂化物,包括水合物。
如本文使用的“甜味剂”、“甜味调味剂”、“甜味调味料实体”、“甜化合物”或“甜味化合物”是指在对象中引起可察觉的甜味的化合物或其生理可接受的盐。如本文使用的“甜味改良剂”是指能够增强、改良或改善甜味感的化合物或其生理可接受的盐。
如本文所用,术语“可操作地连接”用于描述调节元件(regulatory elements)与基因或其编码区之间的连接。通常,基因表达置于一种或多种调节元件的控制下,例如但不限于组成型或诱导型启动子、组织特异性调节成分和增强子。一个基因或编码区被称为“可操作地连接”或“可操作的连接”或“可操作地与”调控元件相关联,这意味着该基因或编码区受调控元件控制或影响。例如,如果启动子影响编码序列的转录或表达,则启动子可操作地连接到编码序列。
术语“调节元件”和“表达控制元件”(expression control element)可互换使用,并且是指可影响特定宿主生物体中可操作连接的编码序列表达的核酸分子。这些术语被广泛用于涵盖和覆盖所有促进或调节转录的元件,包括启动子、增强子序列、响应元件、蛋白质识别位点、诱导元件、蛋白质结合序列、5'和3'非翻译区(UTR)、转录起始位点、终止序列、聚腺苷酸化序列、反式(intrans)、RNA聚合酶与转录因子基本相互作用所需的核心元件、上游元件、增强子、反应元件(参见,例如Lewin,“Genes V”(牛津,牛津大学出版社),第847-873页)及其任意组合。原核生物中的示例性调控元件包括启动子,操纵子序列和核糖体结合位点。真核细胞中使用的调节元件可以包括但不限于转录和翻译控制序列,例如启动子、增强子、剪接信号、聚腺苷酸化信号、终止子、蛋白质降解信号、内部核糖体进入元件(IRES)、2A序列,等,在宿主细胞中提供和/或调节编码序列的表达和/或编码的多肽的产生。在本文的一些实施方案中,本文所述的重组细胞包含可操作地连接于调节元件的基因。
如本文所用,2A序列或元件是指一种小肽,其作为两个蛋白质之间的连接引入,从而允许多蛋白的自主核糖体内自我处理(参见例如de Felipe.Genetic Vaccines andTher.2:13(2004);de Felipe et al.Traffic5:616-626(2004))。这些短肽允许从单个载体共表达多种蛋白质。许多2A元件是本领域已知的。可以在本文公开的方法和系统中使用的2A序列的实例包括但不限于,包括来自口蹄疫病毒(F2A),马鼻炎A病毒(E2A),明脉扁刺蛾(Thosea asigna)病毒(T2A)和如美国专利公开号20070116690中所述的猪细小病毒1(P2A)。
如本文所用,术语“启动子”是允许RNA聚合酶结合并指导基因转录的核苷酸序列。通常,启动子位于基因的5'非编码区中,靠近基因的转录起始位点。启动子中在转录起始中起作用的序列元件通常以一致的核苷酸序列为特征。启动子的实例包括但不限于来自细菌、酵母、植物、病毒和哺乳动物(包括人)的启动子。启动子可以是诱导型、阻遏型和/或组成型的。响应于培养条件的某些变化(例如温度变化),诱导型启动子在其控制下启动DNA转录水平的提高。
如本文所使用的,术语“增强子”是指一种能够提高转录效率的一种调控元件,而不管增强子相对于转录起始位点的距离或方向如何。
如本文所用,术语“转基因”是指通过人为干预整合到靶细胞的一个或多个染色体中的任何核苷酸或DNA序列。在一些实施方案中,转基因包含编码目标蛋白质的多核苷酸。编码蛋白质的多核苷酸通常可操作地连接至可用于获得目标基因的期望表达的其他序列,例如转录调控序列。在一些实施方案中,转基因可以另外包含用于标记整合了染色体的核酸或其他分子。
在本文中,关于多核苷酸或多肽序列的“百分比(%)序列同一性”,用作在将两个序列对齐后,比对后候选序列中的碱基或氨基酸残基与另一序列中的碱基或氨基酸残基相同的百分比。如果需要,可以将空隙引入序列比对中,以实现最大的序列同一性百分比。保守取代不被视为序列同一性的一部分。为了确定百分比(%)序列同一性的目的,比对可以通过本领域技术范围内的各种方式来实现,例如,使用公开可用的计算机方法和程序,例如BLAST、BLAST-2、ALIGN、FASTA(美国威斯康星州麦迪逊市的遗传学计算组(GCG)软件包)或Megalign(DNASTAR)。本领域技术人员可以确定用于测量比对的合适参数,包括在所比较的序列的全长上实现最大比对所需的任何算法。
例如,可使用WU-BLAST-2计算机程序(描述在例如Altschul等人,《酶学方法》,1996,266:460-480)获得氨基酸序列的百分比值。本领域技术人员可以调整WU-BLAST-2计算机程序中的许多搜索参数。例如,可以使用以下值设置某些可调参数:重叠跨度=1、重叠分数=0.125、单词(word)阈值(t)=11和评分矩阵=BLOSUM62。当使用WU-BLAST-2时,氨基酸序列同一性%值通过以下方式确定:将(a)第一目标蛋白质的氨基酸序列与第二目标蛋白质的氨基酸序列之间匹配的相同氨基酸残基的数量除以通过WU-BLAST-2确定的(b)第一目标蛋白质的氨基酸残基的总数。
氨基酸序列同源性百分比也可以使用序列比较程序NCBI-BLAST2(例如描述在Altschul等人,《核酸研究》,1997,25:3389-3402)来确定。NCBI-BLAST2序列比较程序可从http://www.ncbi.nlm.nih.gov下载,或从马里兰州贝塞斯达国家卫生研究所获得。NCBI-BLAST2使用多个可调搜索参数。这些可调搜索参数中的一些默认值是,例如,unmask=yes,strand=all,预期出现次数=10,最小低复杂度长度=15/5,多通E值(multi-pass e-value)=0.01,多通常数=25,最终间隙对齐的drop-off=25和得分矩阵=BLUSOM62。
在使用NCBI-BLAST2进行氨基酸序列比较的情况下,给定氨基酸序列A与或对给定氨基酸序列B的%氨基酸序列同一性(也可以称为给定氨基酸序列A,其具有或包含与给定氨基酸序列B相同的氨基酸序列的百分比)的计算如下:
X/Y的100倍
其中X是根据序列比对程序NCBI-BLAST2,在A和B比对中评分为相同匹配的氨基酸残基的数目,其中Y是B中氨基酸残基的总数。当氨基酸序列A的长度不等于氨基酸序列B的长度时,可以理解为A与B的氨基酸序列同一性百分比将不等于B与A的氨基酸序列同一性的百分比。
如本文使用的,“分离的”意指所示化合物已从其天然环境中分离,使得天然状态中与该化合物一同存在的一种或多种其他化合物或生物试剂不再存在。
如本文使用的,“纯化的”意指所示化合物以相对于通常与所示化合物一起存在的其他化合物(例如,在其天然环境中)更高的量存在。在一些实施方案中,纯化的化合物的相对量提高了大于1%、5%、10%、20%、30%、40%、50%、80%、90%、100%、120%、150%、200%、300%、400%或1000%。在一些实施方案中,相对于与纯化的化合物结合的其他化合物,纯化的化合物以大于1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%、99%或99.5%的重量百分比水平存在。在一些实施方案中,相对于与纯化的化合物结合的其他化合物,由本文的实施方案产生的化合物1以大于1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%、99%或99.5%的重量百分比水平存在。
如本文所述的“纯化”可以指从细胞裂解物和/或上清液中提取化合物1的方法,其中细胞正在分泌产物化合物1。如本文所述,“裂解物”包括细胞壁和细胞膜破裂后的细胞内容物,例如可以包括蛋白质、糖和罗汉果苷。纯化可包括硫酸铵沉淀以去除蛋白质、盐析以去除蛋白质、疏水分离(HPLC)和使用亲和柱。考虑到通过本文的方法生产的产物,用吸附树脂除去特定的罗汉果苷时考虑用亲和介质。
如本文所述,“HPLC”是指液相色谱法,其可用于分离溶解在溶液中的化合物。不受限制,HPLC仪器可以包括流动相储液罐、泵、注射器、分离柱和检测器。然后可以通过将样品混合物注入色谱柱来分离化合物。由于在流动液相和固定相之间的分配行为不同,混合物中的不同组分可以以不同的速率通过色谱柱。有几种柱子可以使用。柱子可以是正相柱、反相柱、尺寸排阻(size exclusion)类型柱和离子交换柱,而没有限制。
还考虑使用固相萃取和分馏,其可用于使蛋白质和糖样品脱盐。其他方法可以包括使用HPLC,液相色谱法分析样品以及液-液萃取,如Auréa Andrade-Eiroa等人(TrAC在分析化学中的趋势,第80卷,2016年6月,第641-654页)所述;文献全文以引用方式并入本文。
如本文所述,用于纯化的“固相萃取”(SPE)是指根据其物理和化学性质将溶解或悬浮在液体混合物中的化合物与混合物中的其他化合物分离的样品制备过程。例如,分析实验室可以使用固相萃取来浓缩和纯化分析用样品。固相萃取也可用于从多种基质中分离出感兴趣的分析物,例如尿液、血液、水、饮料、土壤和动物组织。在本文的实施方案中,可以通过固相萃取纯化位于细胞裂解物或细胞介质中的化合物1。
SPE利用溶解或悬浮在液体(称为流动相)中的溶质对固体的亲和力,使样品通过该固体(称为固定相),从而将混合物分离为所需成分和需要的成分。SPE还可以直接用于气相-固相和液相-固相中,或通过使用例如热脱附和随后的色谱分析而间接应用于固体样品。这可能导致所需的目标分析物或样品中的不良杂质被保留在固定相上。这可能导致需要的分析物或样品中不需要的杂质保留在固定相上。通过固定相的部分可以被收集或丢弃,这取决于它是否含有所需的分析物或不需要的杂质。如果保留在固定相上的部分包括所需的分析物,则可在附加步骤中将其从固定相上移除以进行收集,该附加步骤中,用适当的洗脱液冲洗固定相。
固相萃取的方法不受限制。在不受限制的情况下,可以包括:正相固相萃取、反相固相萃取、离子交换固相萃取、阴离子交换固相萃取、阳离子交换固相萃取和固相微萃取。固相萃取在Sajid等人和
在一些实施方案中,通过固相萃取纯化由细胞产生的化合物1。在一些实施方案中,化合物1的纯度,例如通过固相萃取纯化的纯度为70%、80%、90%或100%,或由任何上述值定义的任何纯度水平。
如本文所述的“发酵”,广义上指宿主细胞在宿主培养基中大量生长以产生特定产物。在这里的实施方案中,所产生的最终产物是化合物1。这也可以包括在有空气或没有空气的情况下实施的方法,例如可以在厌氧环境中进行。整个细胞(重组宿主细胞)可以在发酵液或反应缓冲液中。
化合物1和用于生产化合物1的中间罗汉果苷化合物,可通过从重组细胞裂解物或上清液中收集中间罗汉果苷化合物和化合物1来分离。裂解液可以在收集细胞并通过剪切力(高压细胞裂解(French press cell)或超声波)或通过洗涤剂处理使细胞裂解后获得。然后用硫酸铵过滤和处理裂解物以去除蛋白质,并在C18 HPLC(5x10cm Atlantis Prep T3OBD柱,5um,Waters)上进行分离,并在30分钟内使用10→30%B的A/B梯度(A=水B=乙腈)进行注射,用95%B洗涤,然后重新平衡在1%(总运行时间=42分钟)。可在去皮重的试管(12馏分/板,每次3板)中以30ml/馏分的速度收集。所述裂解物还可以离心裂解液以除去固体和颗粒物。
然后将板在Geneva HT12/HT24中干燥。预期目标化合物将与其他异构体一起在馏分21中洗脱。合并的馏分可以在氟苯基HPLC柱(3x10cm,Xselect氟苯基OBD柱,5um,Waters)上,在35分钟内使用15→30%B的A/B梯度(A=水,B=乙腈),用95%B洗涤,然后重新平衡在15%(总运行时间=45分钟),在47次运行中进一步分馏。每一次在12个去皮重的试管(12馏分/板,每次1个板)中以30ml/馏分收集。可以根据UPLC分析合并含有所需峰和所需纯度的馏分,并在减压下干燥,得到白色粉末状固体。可以将纯化合物重新悬浮/溶解在10mL水中,然后冻干以获得至少95%的纯度。
如本文使用的,“糖苷键”是指将两个呋喃糖和/或吡喃糖基团连接在一起的共价键。通常,糖苷键是一个呋喃糖部分或吡喃糖部分的异头碳与另一个呋喃糖部分或吡喃糖部分的氧之间的键。使用连接的碳原子的编号以及α/β定向来命名糖苷键。根据环中离C1最远的异头位置和立构中心的相对立体化学来区分α-糖苷键和β-糖苷键。例如,蔗糖是由通过α1-2糖苷键连接的一个分子的葡萄糖和一个分子的果糖组成的二糖,如下文所示。
β1-4糖苷键的实例可以见于纤维素中:
必须注意,如本说明书和所附权利要求书中使用的,单数形式“一种(a)”、“一个(an)”和“该/所述(the)”包括复数指代物,除非上下文中另外明确指明。因此,例如,提及“一种芳香族化合物”包括芳香族化合物的混合物。
通常,范围在本文表述为从“约”一个具体值,和/或至“约”另一个具体值。当表述此类范围时,另一个实施方案包括从一个具体值和/或至另一个具体值。类似地,当值通过使用前缀“约”表述为近似值时,应理解具体的值形成了另一个实施方案。还应理解,各个范围的端点均对于另一个端点是重要的,并且独立于另一个端点。
如本文所述,“密码子优化”是指将密码子改变为已知可增加最大蛋白质表达效率的密码子的设计过程。在一些替代方案中,描述了用于在细胞中表达的密码子优化,其中可以通过使用本领域技术人员已知的算法来进行密码子优化,以便产生针对人的高mRNA和蛋白质产量而优化的合成遗传转录本。例如,可以优化密码子以在细菌细胞、哺乳动物细胞、酵母细胞、昆虫细胞或植物细胞中表达蛋白质。包含用于人类密码子优化算法的程序很容易获得。这样的程序可以包括例如OptimumGene
如本文所使用的,术语“核酸”、“核酸分子”和“多核苷酸”是可互换的,并且是指任何核酸,无论是由磷酸二酯键或改性键组成,例如磷酸三酯、磷酰胺(phosphoramidate)、硅氧烷、碳酸盐、羧甲基酯、乙酰亚胺酯、氨基甲酸酯、硫醚、桥连磷酰胺、桥连亚甲基膦酸盐、桥连磷酰胺、桥连磷酰胺、桥连亚甲基膦酸盐、硫代磷酸酯、甲基膦酸盐、桥连二硫代磷酸酯、桥连硫代磷酸酯或磺酸内酯(sultone)键,以及这些键的组合。术语“核酸”和“多核苷酸”还具体包括由五种生物发生的碱基(腺嘌呤、鸟嘌呤、胸腺嘧啶、胞嘧啶和尿嘧啶)以外的碱基组成的核酸。
多核苷酸的非限制性实例包括脱氧核糖核酸(DNA)或核糖核酸(RNA)、寡核苷酸、聚合酶链反应(PCR)产生的片段以及任何连接、切断、内切酶作用和外切酶作用产生的片段。核酸分子可以由天然核苷酸的单体(如DNA和RNA)或天然核苷酸的类似物(如天然核苷酸的对映体形式)或两者的组合组成。修饰核苷酸可在糖部分和/或嘧啶或嘌呤碱部分发生改变。糖修饰包括例如用卤素、烷基、胺和叠氮基替换一个或多个羟基,或者糖可以功能化为醚或酯。此外,整个糖部分可以替换为空间和电子上类似的结构,如氮杂糖和碳环糖类似物。碱基部分中的修饰示例包括烷基化嘌呤和嘧啶、酰化嘌呤或嘧啶,或其他众所周知的杂环替代物。核酸单体可通过磷酸二酯键或此类键的类似物连接。磷酸二酯键的类似物包括硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯、二硒代磷酸酯、苯胺硫代磷酸酯(phosphoroanilothioate)、苯胺磷酸酯(phosphoroanilidate)、磷酰胺(phosphoramidate)等。术语“核酸分子”还包括所谓的“肽核酸”,其包含附着在聚酰胺主链上的自然存在的或经修饰的核酸碱。核酸可以是单链或双链。在一些替代方案中,提供了编码融合蛋白的核酸序列。在一些替代方案中,核酸是RNA或DNA。在一些实施方案中,核酸包含SEQ ID NO:1-1023中的任何一个。
这里使用“编码”(“Coding for")或“编码”(“encoding”),指的是多核苷酸中核苷酸的特定序列的性质,例如基因、cDNA或mRNA,用作合成其他大分子(例如已定义的氨基酸序列)的模板。因此,如果与该基因对应的mRNA的转录和翻译在细胞或其他生物系统中产生蛋白质,则该基因编码蛋白质。在本文的一些实施方案中,提供重组细胞,其中重组细胞包含编码酶的基因,所述酶例如葡聚糖蔗糖酶、UDP糖基转移酶、CGTase、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶和/或UGT。在一些实施方案中,转葡糖苷酶包含由SEQ ID NO:163-290和723中的任何一个所示的氨基酸序列。在一些实施方案中,CGTase由SEQ ID NO:1、3、78-101、147和154中的任何一个编码或具有其序列。在一些实施方案中,编码酶如葡聚糖蔗糖酶、UDP糖基转移酶、CGTase、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶和/或UGT的基因为了在宿主细胞中表达而进行了密码子优化。“编码多肽的核酸序列”包括彼此为简并形式(degenerate versions)并且编码相同氨基酸序列的所有核苷酸序列。
还可以进行优化以减少多核苷酸中二级结构的出现。在该方法的一些替代方案中,还可以对载体中的序列进行优化以降低总GC/AT比。严格的密码子优化可能会导致不想要的二级结构,或者导致二级结构的GC含量过高。这样,二级结构影响转录效率。密码子使用优化之后,可以使用诸如GeneOptimizer之类的程序进行二级结构避免和GC含量优化。这些附加程序可在初始密码子优化后用于进一步的优化和故障排除,以限制在第一轮优化后可能出现的二级结构。优化的替代程序很容易获得。在该方法的一些替代方案中,载体包含针对二级结构避免而优化的序列、和/或针对减少总GC/AT比而优化的序列、和/或针对在细菌或酵母细胞中表达而优化的序列。
“载体”、“表达载体”或“构建体”是用于将异源核酸引入细胞的核酸,其具有调节元件以提供异源核酸在细胞中的表达。载体包括但不限于质粒、小环、酵母和病毒基因组。在一些替代方案中,载体是质粒、小环、酵母或基因组。在一些替代方案中,载体用于在细菌系统例如大肠杆菌中表达蛋白质。在一些替代方案中,载体用于在细菌系统例如大肠杆菌中表达蛋白质。在一些替代方案中,该载体用于在酵母系统中表达蛋白质。在一些实施方案中,用于表达的载体是病毒载体。在一些实施方案中,载体是重组载体,其包含用于上调基因表达的启动子序列。“调控元件”可以指具有核苷酸序列的核酸,该核苷酸序列可以影响转录或翻译的起始以及转录或翻译产物的速率、稳定性和迁移性。
如本文所述,“重组宿主”或“重组宿主细胞”是宿主,其基因组已被至少一个掺入的DNA序列增强。所述掺入的DNA序列可以是编码一种或多种多肽的异源核酸。这样的DNA序列包括但不限于非天然存在的基因,通常不转录成RNA或翻译成蛋白质(“表达的”)的DNA序列,以及希望引入非结合宿主的其他基因或DNA序列。在一些实施方案中,重组宿主细胞用于防止诸如密码子偏倚(codon-bias)之类的表达问题。存在用于表达蛋白质的商业宿主,例如BL21-CodonPlus
重组宿主可以是可商购获得的细胞,例如用于表达可能具有稀有密码子的酶的Rosetta细胞。
在一些实施方案中,重组细胞包含用于产生细胞色素P450多肽的重组基因,所述细胞色素P450多肽包含CYP533、CYP937、CYP1798、CYP1994、CYP2048、CYP2740、CYP3404、CYP3968、CYP4112、CYP4149、CYP4491、CYP5491、CYP6479、CYP7604、CYP8224、CYP8728、CYP10020和CYP10285中的任何一个的氨基酸序列。在一些实施方案中,P450多肽在包含SEQID Nos:31-48、316、431、871、873、875、877、879、881、883、885、887和891中任一个所示序列的基因中编码。
在一些实施方案中,P450酶由至少一种CYP激活剂例如CPR4497辅助。在一些实施方案中,重组宿主细胞进一步包含编码CPR4497的基因,其中该基因包含SEQ ID NO:112所示的核酸序列。在一些实施方案中,重组宿主细胞进一步包含编码CPR4497的基因,其中氨基酸CPR4497的氨基酸序列如SEQ ID NO:113所示。
在其中重组宿主细胞是酵母细胞的一些实施方案中,重组细胞具有EXG1基因和/或EXG2基因的缺失以防止葡聚糖酶活性的降低,葡聚糖酶活性的降低可导致罗汉果苷的去糖基化。
宿主细胞的类型可以不同。例如,宿主细胞可以选自:伞菌属(Agaricus)、曲霉属(Aspergillus)、芽孢杆菌属(Bacillus)、假丝酵母属(Candida)、棒状杆菌属(corynebacterium)、埃希氏菌属(Escherichia)、镰刀菌属/赤霉菌属(Fusarium/Gibberella)、克鲁维酵母属(Kluyveromyces)、硫磺菌属(Laetiporus)、香菇属(Lentinus)、红法夫酵母属(Phaffia)、平革菌属(Phanerochaete)、毕赤酵母属(Pichia)、小立碗藓属(Physcomitrella)、红酵母属(Rhodoturula)、酵母属(Saccharomyces)、裂殖酵母纲(Schizosaccharomycetes)、痂圆孢属(Sphaceloma)、法夫酵母属(Xanthophyllmoyces)、耶氏酵母属(Yarrowia)、虎皮香菇(Lentinus tigrinus)、硫磺菌(Laetiporus sulphureus)、黄孢原毛平革菌(Phanerochaete chrysosporium)、巴斯德毕赤酵母(Pichia pastoris)、小立碗藓(Physcomitrella patens)、粘红酵母(Rhodoturulaglutinis)、胶红酵母(Rhodoturula mucilaginosa)、红法夫酵母(Phaffia rhodozyma)、红法夫酵母(Xanthophyllomyces dendrorhous)、藤仓镰刀菌(Fusarium fujikuroi)/藤仓赤霉(Gibberella fujikuroi)、产朊假丝酵母(Candida utilis)、解脂耶氏酵母(Yarrowialipolytica)、罗汉果属(Siraitia)、苦瓜属(Momordica)、绞股蓝属(Gynostemma)、南瓜属(Cucurbita)、黄瓜属(Cucumis)、拟南芥属(Arabidopsis)、蒿属(Artemisia)、甜菊属(Stevia)、人参属(Panax)、睡茄属(Withania)、大戟属(Euphorbia)、苜蓿属(Medicago)、吊兰属(Chlorophytum)、五加属(Eleutherococcus)、楤木属(Aralia)、桑属(Morus)、苜蓿属(Medicago)、桦木属(Betula)、黄芪属(Astragalus)、麻疯树属(Jatropha)、山茶属(Camellia)、韧伞属(Hypholoma)、曲霉属(Aspergillus)、茄属(Solanum)、石杉属(Huperzia)、孩儿参属(Pseudostellaria)、黄麻属(Corchorus)、常春藤属(Hedera)、地钱属(Marchantia)和桑属(Morus)、毛癣菌属(Trichophyton)、桑黄孔菌属(Sanghuangporus)、樟芝属(Taiwanofungus)、链疫孢属(Moniliophthora)、盘二孢属(Marssonina)、色二孢属(Diplodia)、微香菇属(Lentinula)、法夫酵母属(Xanthophyllomyces)、普可尼亚属(Pochonia)、炭疽菌属(Colletotrichum)、间座壳属(Diaporthe)、组织胞浆菌属(Histoplasma)、球孢子菌属(Coccidioides)、组织胞浆菌属(Histoplasma)、桑黄孔菌属(Sanghuangporus)、短梗霉属(Aureobasidium)、普可尼亚属(Pochonia)、青霉属(Penicillium)、孢子丝菌属(Sporothrix)、黑僵菌属(Metarhizium)、曲霉属(Aspergillus)、耶氏酵母属(Yarrowia)、油脂酵母属(Lipomyces)、构巢曲霉(Aspergillus nidulans)、解脂耶氏酵母(Yarrowia lipolytica)、圆红冬孢酵母菌(Rhodosporin toruloides)、假丝酵母属(Candida)、酵母属(Sacccharaomyces)、酵母亚门(Saccharomycotina)、外囊菌亚门(Taphrinomycotina)、裂殖酵母纲(Schizosaccharomycetes)、毕赤酵母属(Komagataella)、担子菌门(Basidiomycota)、伞菌亚门(Agaricomycotina)、银耳纲(Tremellomycetes)、柄锈菌亚门(Pucciniomycotina)、短梗霉属(Aureobasidium)、锥毛壳属(Coniochaeta)、红冬孢酵母属(Rhodosporidium)和微球黑粉菌纲(Microboryomycetes)、藤仓赤霉(Gibberella fujikuroi)、乳酸克鲁维酵母(Kluyveromyces lactis)、粟酒裂殖酵母(Schizosaccharomyces pombe)、黑曲霉(Aspergillus niger)、酿酒酵母(Saccharomyces cerevisiae)、大肠杆菌(Escherichiacoli)、类球红细菌(Rhodobacter sphaeroides),和荚膜红细菌(Rhodobactercapsulatus)。以酿酒酵母为例,介绍了提高产品收率的方法。制造重组微生物的方法是众所周知的。
WO2014086842中描述了从曲霉属(Aspergillus spp.)中制备重组宿主细胞的方法,文献全文以引用方式并入本文。基因组的核苷酸序列可以通过公开提供的基因数据库获得,并允许合理设计和修改途径,以提高和提高产品产量。
如本文所述的“培养基”,可以是用于细胞在其生产阶段的生长和维持的营养丰富的肉汤。用于维持和繁殖各种菌株的酵母培养物,可能需要用于克隆和蛋白质表达的复杂介质的特定配方,并且本领域技术人员理解。例如,可以从ThermoFisher获得使用市售的培养基。培养基可以是YPD肉汤或可以具有酵母氮碱基。酵母可以在30℃的YPD或合成培养基中生长。
溶源性肉汤(LB)通常用于细菌细胞。用于酶和罗汉果苷生长的细菌细胞可以具有抗生素抗性,以防止培养基中其他细胞的生长和污染。这些细胞可以具有对抗生素例如氯霉素、青霉素、卡那霉素和氨苄青霉素具有抗性的抗生素基因盒。
如本文所述,“融合蛋白”是通过将两个或更多个核酸序列连接在一起而产生的蛋白质,所述两个或更多个核酸序列最初编码分离蛋白的一部分或全部氨基酸序列。例如,融合蛋白可包含功能蛋白(例如酶(包括但不限于葫芦二烯醇合酶))和一个或多个融合结构域。如本文所述,融合结构域可以是蛋白质(例如,功能性蛋白包括但不限于酶、转录因子、毒素和翻译因子)的全长或部分/片段。融合蛋白中一个或多个融合结构域的位置可以变化。例如,一个或多个融合结构域可以在融合蛋白的N-和/或C-末端区域(例如,N-和/或C-末端)。一个或多个融合结构域也可以在融合蛋白的中心区域。融合结构域不需要位于融合蛋白的末端。可以选择融合结构域以赋予期望的性质。例如,融合结构域可影响(例如,增加或减少)其融合到的酶的酶活性,或影响(例如,增加或减少)其融合到的蛋白质的稳定性。融合结构域可以是多聚(例如,二聚和四聚)域和/或功能域。在一些实施方案中,融合结构域可以增强或减少与其融合的蛋白质的多聚化。作为非限制性实例,融合蛋白可包含全长蛋白A和融合至全长蛋白A的N末端区域和/或C末端区域的融合结构域。在一些实例中,融合蛋白包括蛋白质A的部分序列和融合至蛋白的部分序列的N末端区域和/或C末端区域(例如,N末端和C末端)的融合结构域。融合结构域可以是例如蛋白质A的一部分或全部序列,或与蛋白质A不同的蛋白质的一部分或全部序列。在一些实施方案中,一种或多种适合在本文公开的方法、体系和组合物中使用的酶可为融合蛋白。在一些实施方案中,融合蛋白由与表1中所列核酸序列之一具有至少70%、80%、90%、95%或99%序列同一性的核酸序列编码。在一些实施方案中,融合蛋白包含与表1中所列氨基酸序列之一具有至少70%、80%、90%、95%或99%序列同一性的氨基酸序列。在一些实施方案中,融合蛋白包含与表1中所列氨基酸序列之一具有至少80%、90%、95%或99%序列同一性的氨基酸蛋白质序列,以及在融合蛋白的N-、C-或两个末端区域的融合结构域。在一些实施方案中,融合蛋白包含表1中所列的氨基酸蛋白序列之一,以及位于融合蛋白的N-、C-或两个末端区域的融合结构域。
融合结构域的长度可以变化,例如,3、4、5、6、7、8、9、10、12、15、20、25、30、40、50、60、70、80、90、100、125、150、200、300、400、500、600、700、800、900、1000、1100、1200、1300、1400、1500个或这些数字中任何两个之间的范围数量的氨基酸。在一些实施方案中,融合结构域的长度约为3、4、5、5、6、7、8、9、10、12、15、20、25、30、40、50个,或这些数字中任何两个之间的范围数量的氨基酸。在一些实施方案中,融合结构域是功能蛋白(例如,酶、转录因子或翻译因子)的主要部分或整个序列。在一些实施方案中,融合蛋白是具有葫芦二烯醇合酶活性的蛋白质。
还考虑了在培养基中优化细胞生长和蛋白质表达技术。对于培养基中的生长,诸如酵母之类的细胞可能对低pH值敏感(Narendranath et al.,Appl EnvironMicrobiol.2005May;71(5):2239–2243;文献全文以引用方式并入本文)。在生长过程中,酵母必须保持恒定的细胞内pH。在生长和代谢过程中,酵母细胞内有许多酶在起作用。每种酶都在其最佳pH值下发挥最佳作用,由于酵母本身具有嗜酸性质,因此该酶呈酸性。当细胞外pH偏离最佳水平时,酵母细胞需要投入能量以抽入或抽出氢离子,以维持最佳的细胞内pH。这样,包含用于控制pH的缓冲液的培养基将是最佳的。或者,如果监测的pH值很高,也可以将细胞转移到新的培养基中。
细菌和酵母细胞的生长优化也可以通过向培养基中添加营养物质和补充剂来实现。或者,培养物可以在设计用于温度、pH值控制和控制曝气速率的发酵罐中生长。必要时,溶解氧和氮气可流入培养基。
本文中使用的术语“可操作地连接”是指调节序列和导致后者表达的异源核酸序列之间的功能连接。
“罗汉果苷”和“罗汉果苷化合物”在本文可互换使用,并且是指三萜糖苷家族。罗汉果苷的非限制性示例性实例包括例如罗汉果苷V、赛门苷I、罗汉果苷IVE、异罗汉果苷V、罗汉果苷IIIE、11-脱氧-罗汉果苷V、11-氧代-罗汉果苷V、罗汉果苷VI、罗汉果苷IVA、罗汉果苷IIA、罗汉果苷IIA1、罗汉果苷IIA2、罗汉果苷IA、11-氧代-罗汉果苷VI、11-氧代-罗汉果苷IIIE、11-氧代-罗汉果苷IVE、罗汉果苷IE、罗汉果醇(Mogrol)、11-氧代-罗汉果醇、罗汉果苷IIE、罗汉果苷IIIA2和罗汉果苷III,这些都是从罗汉果(Siraitia grosvenorii)(Swingle)的果实中鉴定出来的,它们是造成果实甜味的原因。在本文的实施方案中,罗汉果苷中间体可用于体内、离体或体外产生具有以下结构的化合物1:
在一些实施方案中,用于产生化合物1的重组细胞进一步产生罗汉果苷,并且包含编码用于产生罗汉果苷的酶的基因。WO2014086842中进一步描述了能够产生罗汉果苷的重组细胞,文献全文以引用方式并入本文。在一些实施方案中,重组细胞在培养基中生长以允许酶的表达以及化合物1和罗汉果苷中间体的产生。在一些实施方案中,化合物1通过用剪切力(即高压细胞裂解或超声处理)裂解细胞或通过洗涤剂裂解方法获得。在一些实施方案中,在生长培养基中向细胞补充前体分子例如罗汉果醇以促进化合物1的产生。
如本文所用,“启动子”是指指导结构基因转录的核苷酸序列。在一些替代方案中,启动子位于基因的5'非编码区中,最接近结构基因的转录起始位点。启动子内在转录起始中起作用的序列元件通常以共有核苷酸序列为特征。不受限制地,这些启动子元件可包括RNA聚合酶结合位点、TATA序列、CAAT序列、分化特异性元件(DSE;McGehee等人,Mol.Endocrinol.7:551(1993);文献全文以引用方式并入本文)、环状AMP反应元件(CREs)、血清反应元件(SREs;Treismanet等人,Seminars in Cancer Biol.1:47(1990);文献全文以引用方式并入本文),糖皮质激素反应元件(GREs)和结合其他转录因子的位点,例如CRE/ATF(O'Reilly等人,J.Biol.Chem.267:19938(1992);文献全文以引用方式并入本文)、AP2(Ye et等人,J.Biol.Chem.269:25728(1994);文献全文以引用方式并入本文)、SP1、cAMP反应元件结合蛋白(CREB;Loeken等人,Gene Expr.3:253(1993);文献全文以引用方式并入本文)和八聚体因子(一般参见Watson等编辑,Molecular Biology of the Gene,4th ed.(The Benjamin/Cummings Publishing Company,Inc.1987;文献全文以引用方式并入本文)),以及Lemaigre和Rousseau,Biochem.J.303:1(1994);文献全文以引用方式并入本文)。如本文所使用的,启动子可以是组成型活性的、可抑制的或可诱导的。如果一个启动子是一个可诱导的启动子,那么转录速率会随着诱导剂的反应而增加。相反,如果启动子是组成性启动子,则转录速率不受诱导剂的调节。
如本文所述,“核糖体跳跃(skip)序列”是指在翻译过程中迫使核糖体“跳跃”核糖体跳跃序列并在核糖体跳跃序列之后翻译该区域而不形成肽键的序列。例如,一些病毒具有核糖体跳跃序列,该序列允许在单个核酸上顺序翻译几种蛋白质,而无需通过肽键连接蛋白质。如本文所述,这是“接头”(“linker”)序列。在本文提供的核酸的一些替代方案中,核酸在本文描述的酶的基因的序列之间包含核糖体跳跃序列,使得蛋白质被共表达并且不通过肽键连接。在一些替代方案中,核糖体跳跃序列是P2A、T2A、E2A或F2A序列。在一些替代方案中,核糖体跳跃序列是T2A序列。
如本文所公开的,化合物1是具有以下结构(1)的化合物或其盐:
化合物1是一种高强度甜味剂,其可以用于需要甜味的多种产品中。化合物1与蔗糖或果糖等其他甜味剂相比具有低热量优势。
在一些实施方案中,化合物1为分离和纯化的形式。在一些实施方案中,化合物1存在于组合物中,在该组合物中,化合物1被基本上纯化。
在一些实施方案中,化合物1或其盐是分离的并且为固体形式。在一些实施方案中,固体形式是无定形的。在一些实施方案中,固体形式是晶体。在一些实施方案中,该化合物为冻干剂形式。在一些实施方案中,化合物1是分离的并且在缓冲液内。
本领域技术人员将认识到,本文描述的一些结构可以是化合物的共振形式或互变异构体,即使在动力学上也可以由其他化学结构合理地代表;本领域技术人员认识到,此类结构可能仅代表此类化合物样品的很小一部分。此类化合物被认为在所描述的结构的范围内,尽管本文中未示出此类共振形式或互变异构体。
化合物1中可能存在同位素。以化合物结构表示的每个化学元素都可以包括该元素的任何同位素。例如,在化合物结构中,氢原子可以被明确公开或理解为存在于化合物中。在化合物可以存在氢原子的任何位置,氢原子可以是氢的任何同位素,包括但不限于氢-1(氕)和氢-2(氘)。因此,除非上下文另外明确指出,否则本文中提及的化合物涵盖所有潜在的同位素形式。在一些实施方案中,相对于此类同位素的自然普遍性,本文所述的化合物富含一种或多种同位素。在一些实施方案中,本文所述的化合物富含氘。在一些实施方案中,本文描述的化合物中大于0.0312%的氢原子是氘。在一些实施方案中,本文描述的化合物中大于0.05%、0.08%或0.1%的氢原子是氘。
在一些实施方案中,化合物1由于存在氨基和/或羧基或与其类似的基团而能够形成酸和/或碱盐。
在一些实施方案中,化合物1是基本上分离的。在一些实施方案中,化合物1是基本上纯化的。在一些实施方案中,该化合物为冻干剂形式。在一些实施方案中,该化合物是结晶的。在一些实施方案中,该化合物是无定形的。
在一些实施方案中,产品组合物不含有不期望的化合物,或者含有小于某一量的不期望的化合物。在一些实施方案中,组合物不含有罗汉果苷I、罗汉果苷II和罗汉果苷III的一种或多种异构体。在一些实施方案中,组合物含有小于5%、3%、2%、1%、0.5%、0.3%、0.1%、800ppm、500ppm、200ppm或100ppm的重量百分比的罗汉果苷I、罗汉果苷II和罗汉果苷III的所有异构体。在一些实施方案中,组合物不含有罗汉果苷IIIE、11-氧代-罗汉果苷IIIE、罗汉果苷IIIA2、罗汉果苷IE、罗汉果苷IIE和11-氧代-罗汉果醇中的一种或多种。在一些实施方案中,组合物含有小于5%、3%、2%、1%、0.5%、0.3%、0.1%、800ppm、500ppm、200ppm或100ppm的重量百分比的罗汉果苷IIIE、11-氧代-罗汉果苷IIIE、罗汉果苷IIIA2、罗汉果苷IE、罗汉果苷IIE和11-氧代-罗汉果醇中的一种或多种。在一些实施方案中,组合物含有小于5%、3%、2%、1%、0.5%、0.3%、0.1%、800ppm、500ppm、200ppm或100ppm的重量百分比的罗汉果苷IIIE。在一些实施方案中,组合物含有小于5%、3%、2%、1%、0.5%、0.3%、0.1%、800ppm、500ppm、200ppm或100ppm的重量百分比的11-氧代-罗汉果苷IIIE。在一些实施方案中,组合物含有小于5%、3%、2%、1%、0.5%、0.3%、0.1%、800ppm、500ppm、200ppm或100ppm的重量百分比的11-氧代-罗汉果醇。
在一些实施方案中,产品组合物为固体形式,其可以是结晶的或无定形的。在一些实施方案中,组合物为颗粒形式。可以使用任何适合的技术产生组合物的固体形式,所述适合的技术包括但不限于重结晶、过滤、溶剂蒸发、研磨、碾磨、喷雾干燥、喷雾团聚、流化床团聚、湿法粒化或干法粒化及其组合。在一些实施方案中,提供了可流动的颗粒组合物以便于进一步用于食品制造过程。在一些此类实施方案中,得到50μm至300μm、80μm至200μm、或者80μm至150μm的粒径。
一些实施方案提供了包含溶液形式的化合物1的生产组合物。例如,在一些实施方案中,通过本文所述的生产方法之一生产的溶液在未经进一步纯化的情况下使用。在一些实施方案中,溶液中期望化合物的浓度以重量计大于300ppm、500ppm、800ppm、0.1%、0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%或20%。在一些实施方案中,罗汉果苷I、罗汉果苷II和罗汉果苷III的所有异构体的浓度小于5%、3%、2%、1%、0.5%、0.3%、0.1%、800ppm、500ppm、200ppm或100ppm。在一些实施方案中,罗汉果苷IIIE、11-氧代-罗汉果苷IIIE、罗汉果苷IIIA2、罗汉果苷IE、罗汉果苷IIE和11-氧代-罗汉果醇中的一种或多种的浓度小于5%、3%、2%、1%、0.5%、0.3%、0.1%、800ppm、500ppm、200ppm、100ppm、50ppm、30ppm、20ppm、10ppm、5ppm、1ppm或0.1ppm。在一些实施方案中,罗汉果苷IIIE的浓度小于5%、3%、2%、1%、0.5%、0.3%、0.1%、800ppm、500ppm、200ppm、100ppm、50ppm、30ppm、20ppm、10ppm、5ppm、1ppm或0.1ppm。在一些实施方案中,11-氧代-罗汉果苷IIIE的浓度小于5%、3%、2%、1%、0.5%、0.3%、0.1%、800ppm、500ppm、200ppm、100ppm、50ppm、30ppm、20ppm、10ppm、5ppm、1ppm或0.1ppm。在一些实施方案中,11-氧代-罗汉果醇的浓度小于5%、3%、2%、1%、0.5%、0.3%、0.1%、800ppm、500ppm、200ppm、100ppm、50ppm、30ppm、20ppm、10ppm、5ppm、1ppm或0.1ppm。
在一些实施方案中,化合物1是由各种起始和/或中间化合物与一种或多种酶接触而产生的。接触可以是在体内(例如,在重组细胞中)或在体外。用于生产化合物1的起始化合物和中间化合物可包括但不限于罗汉果苷V、罗汉果苷IIE、罗汉果苷IIIE、罗汉果苷I、罗汉果苷VI异构体、罗汉果苷IIA、罗汉果苷IVE或罗汉果苷IVA。
在一些实施方案中,如本文所述的化合物1在体内的重组宿主细胞中产生,或通过对这些方法的调整而产生。调整方法的方法包括,尤其包括本领域技术人员已知的温度、溶剂、试剂等。本文所示和描述的方法仅为说明性的,不打算也不应将其解释为以任何方式限制权利要求的范围。本领域技术人员将能够识别对所公开的方法的调整,并基于本文中的公开设计替代路线;所有这些调整和替代路线都在权利要求的范围内。
在一些实施方案中,本文公开的化合物1通过从重组细菌细胞,酵母细胞,植物细胞或昆虫细胞中纯化和/或分离而获得。在一些实施方案中,重组细胞来自罗汉果(Siraitia grosvenorii)。在一些这样的实施方案中,使用合适的纯化技术将得自罗汉果(Siraitia grosvenorii)的提取物分级分离。在一些实施方案中,使用HPLC对提取物进行分级分离,并收集适当的级分以获得分离和纯化形式的所需化合物。
在一些实施方案中,化合物1是通过对从罗汉果(Siraitia grosvenorii)分离的化合物进行酶改性而产生的。例如,在一些实施方案中,从罗汉果(Siraitia grosvenorii)中分离的化合物1与一种或多种酶接触以获得所需化合物。接触可以是在体内(例如,在重组细胞中)或在体外。制备化合物1的起始和中间化合物包括但不限于罗汉果苷V、罗汉果苷IIE、罗汉果苷IIIE、罗汉果苷I、罗汉果苷VI异构体、罗汉果苷IIA、罗汉果苷IVE或罗汉果苷IVA。这些化合物中的一种或多种可以在体内制备。适合用于产生本文所述化合物的酶可包括但不限于果胶酶、β-半乳糖苷酶(例如Aromase)、纤维素酶(例如Celluclast)、环磷酰胺转移酶(例如Toruzyme)、转化酶、葡萄糖转移酶(例如UGT76G1)、右旋糖酶、乳糖酶、arabanse、木聚糖酶,半纤维素、淀粉酶或其组合。在一些实施方案中,该酶是Toruzyme,其包含SEQ ID NO:89-94中任一个所示的氨基酸序列。
一些实施方案提供了制备化合物1的方法,
该方法包括在HPLC柱上分离罗汉果(Siraitia grosvenorii)的提取物,并收集包含化合物1的洗脱级分。
一些实施方案提供了制备化合物1的方法,
其中该方法包括用葡萄糖转移酶UGT76G1处理罗汉果苷III
各种罗汉果苷化合物可用作生产化合物1的中间体。此类罗汉果苷化合物的一个非限制性实例是具有以下结构的化合物12:
在一些实施方案中,用于产生化合物12的方法包括使罗汉果苷VI与表达一种或多种转化酶的细胞(例如重组宿主细胞)接触。
各种罗汉果苷化合物可用作生产化合物1的中间体化合物。此类罗汉果苷化合物的一个非限制性实例是具有以下结构的化合物5:
在一些实施方案中,产生化合物5的方法包括将罗汉果苷III
各种罗汉果苷化合物可用作生产化合物1的中间体化合物。此类罗汉果苷化合物的一个非限制性实例是具有以下结构的化合物4:
在一些实施方案中,生产化合物4的方法包括使罗汉果苷III
在一些实施方案中,通过与一种或多种水解酶接触,将一种或多种高糖基化罗汉果苷水解成罗汉果苷IIIE。在一些实施方案中,高糖基化罗汉果苷选自罗汉果苷IV、罗汉果苷V、罗汉果苷VI及其组合。在一些实施方案中,高糖基化罗汉果苷选自罗汉果苷V、赛门苷I、罗汉果苷IVE、异罗汉果苷V、11-脱氧-罗汉果苷V、11-氧代-罗汉果苷V、罗汉果苷VI、罗汉果苷IVA、11-氧代-罗汉果苷VI、11-氧代-罗汉果苷IVE及其组合。
令人惊讶地发现,化合物1显示出对某些水解酶水解的耐受性,即使这种酶显示出将高糖基化罗汉果苷水解为罗汉果苷IIIE的能力。化合物1中存在的α-键的糖苷由于其对水解的耐受性而提供了优于其他罗汉果苷(例如,β-连接的糖苷)的独特优势。在一些实施方案中,在化合物1的微生物生产期间,微生物宿主将不需要的β-连接的罗汉果糖苷水解回到罗汉果糖苷IIIE。由于以下原因,这将提高化合物1的纯度:1)降低不需要的罗汉果苷VI、罗汉果苷V和罗汉果苷IV的水平,2)水解将增加可用作生产化合物前体的罗汉果苷IIIE的量。
图38说明了通过糖基化酶产生的高糖基化罗汉果苷,然后可以水解回罗汉果苷IIIE。结果是罗汉果苷的混合物具有低于期望的高糖基化罗汉果苷的产率。这种水解酶可以被去除,但是仍然会得到一种罗汉果苷的混合物,并且生产有机体的寿命可能会缩短。然而,由于化合物1具有抗水解性,水解可用于将高糖基化的罗汉果苷转化为罗汉果苷IIIE,后者随后可转化为化合物1(如图39所示)。
在一些实施方案中,水解酶是β-葡聚糖水解酶。在一些实施方案中,水解酶是EXG1。EXG1蛋白可包含与SEQ ID NO:1013或1014具有至少70%、80%、90%、95%、98%、99%或更多序列同一性的氨基酸序列。在一些实施方案中,EXG1蛋白包含SEQ ID NO:1013或1014所示的氨基酸序列或由SEQ ID NO:1013或1014所示的氨基酸序列组成。在一些实施方案中,水解酶是EXG2。EXG2蛋白可包含与SEQ ID NO:1023具有至少70%、80%、90%、95%、98%、99%或更多序列同一性的氨基酸序列。在一些实施方案中,EXG2蛋白包含SEQID NO:1023所示的氨基酸序列或由其组成。水解酶可以是例如本文公开的任何一种水解酶。
化合物1可由罗汉果苷IIIE通过与一种或多种能够将罗汉果苷IIIE转化为化合物1的酶接触而产生。在一些实施方案中,能够催化化合物1的产生的酶是UDP糖基转移酶、环麦芽糊精葡聚糖转移酶(CGTases)、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。
在一些实施方案中,能够催化化合物1产生的酶是CGTase。在一些实施方案中,CGTase包含一种氨基酸序列,该氨基酸序列与SEQ ID NO:1、3、78-101、148和154中任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,CGTase包含SEQ ID NO:1、3、78-101、148和154的氨基酸序列。在一些实施方案中,能够催化化合物1产生的酶是葡聚糖酶。在一些实施方案中,葡聚糖酶包含一种氨基酸序列,该序列与SEQ ID NO:2、103、106-110、156和896中任一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列Y的同一性。在一些实施方案中,葡聚糖酶包含或由以下任一序列的氨基酸序列组成:SEQID NO:2、103、106-110、156和896。在一些实施方案中,葡聚糖酶由核酸序列编码,该核酸序列与SEQ ID NO:104、105、157、158和895中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,葡聚糖酶由核酸序列编码,该核酸序列包含或或由以下任一序列组成:SEQ ID NO:104、105、157、158和895中的任何一个。在一些实施方案中,能够催化化合物1的产生的酶是转葡糖苷酶。在一些实施方案中,转葡糖苷酶包含一种氨基酸序列,该序列与SEQ ID NO:163-290和723中的任一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,转葡糖苷酶包含SEQ ID NO:163-292和723中的任一个的氨基酸序列或由其组成。序列同一性百分比可使用BLAST检索(ncbi.nih.gov)的ClustalW软件来进行。这些程序的使用可以确定蛋白质同源物之间的一致性。
在一些实施方案中,能够催化化合物1产生的酶是尿苷二磷酸-葡萄糖基转移酶(UGT)。UGT可包含例如一种氨基酸序列,该序列与SEQ ID NOs:4-9、15-19、125、126、128、129、293-307、407、409、411、413、439、441和444中任何一个的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,UGT包含或由以下任一序列的氨基酸序列组成:SEQ ID NOs:4-9、10-14、125、126、128、129、293-304、306、407、409、411、413、439、441和444。在一些实施方案中,UGT由一种核酸序列编码,该核酸序列与UGT1495(SEQ ID NO:10)、UGT1817(SEQ ID NO:11)、UGT5914(SEQ ID NO:12)、UGT8468(SEQ ID NO:13)、UGT10391(SEQ ID NO:14)和SEQ IDNO:116-124、127、130、408、410、412、414、440、442、443和445具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,UGT由核酸序列编码,所述核酸序列包含UGT1495(SEQ ID NO:10)、UGT1817(SEQ IDNO:11)、UGT5914(SEQ ID NO:12)、UGT8468(SEQ ID NO:13)、UGT10391(SEQ ID NO:14)和SEQ ID NO:116-124、127、130、408、410、412、414、440、442、443和445中任一个。在一些实施方案中,酶可以是UGT98或UGT SK98。例如,如本文所述,能够产生化合物1的重组宿主细胞可以包含编码UGT98和/或UGT SK98的第三基因。在一些实施方案中,UGT98或UGT SK98包含与SEQ ID NO:9或16具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性的序列。在一些实施方案中,UGT包含一种氨基酸序列,该序列与UGT73C3(SEQ ID NO:4)、UGT73C6(SEQ ID NO:5)、UGT85C2(SEQ ID NO:6)、UGT73C5(SEQ ID NO:7)、UGT73E1(SEQ ID NO:8)、UGT98(SEQ ID NO:9)、UGT1576(SEQ ID NO:15)、UGT SK98(SEQ ID NO:16)、UGT430(SEQ ID NO:17)、UGT1697(SEQ ID NO:18)和UGT11789(SEQ ID NO:19)具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,UGT包含或由以下任一种的氨基酸序列组成:UGT73C3(SEQ ID NO:4)、UGT73C6(SEQ ID NO:5)、85C2(SEQ ID NO:6)、UGT73C5(SEQID NO:7)、UGT73E1(SEQ ID NO:8)、UGT98(SEQ ID NO:9)、UGT1576(SEQ ID NO:15)、UGTSK98(SEQ ID NO:16)、UGT430(SEQ ID NO:17)、UGT1697(SEQ ID NO:18)和UGT11789(SEQID NO:19)。在一些实施方案中,UGT由一种核酸序列编码,该序列与UGT1495(SEQ ID NO:10)、UGT1817(SEQ ID NO:11)、UGT5914(SEQ ID NO:12)、UGT8468(SEQ ID NO:13)或UGT10391(SEQ ID NO:14)具有至少70%、80%、90%、95%、98%、99%或更多的序列同一性。在一些实施方案中,UGT由核酸序列编码,该核酸序列包含UGT1495(SEQ ID NO:10)、UGT1817(SEQ ID NO:11)、UGT5914(SEQ ID NO:12)、UGT8468(SEQ ID NO:13)和UGT10391(SEQ ID NO:14)中的任何一个序列或由其组成。如本文所公开的,能够催化化合物1产生的酶,可以包含与本文公开的任何一种UGT酶具有至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或更多的序列同一性的氨基酸序列。此外,能够产生化合物1的重组宿主细胞可以包含一种酶,该酶包含或由一种序列组成,该序列与本文公开的任何一种UGT酶具有至少70%、至少80%、至少90%、至少95%、至少98%、至少具有99%或更高的序列同一性。在一些实施方案中,重组宿主细胞包含酶,其包含本文公开的UGT酶中的任一种或由其组成。
在一些实施方案中,产生化合物1的方法包括用葡萄糖转移酶UGT76G1处理罗汉果苷III
如本文所述,UDP糖基转移酶、环麦芽糊精葡聚糖转移酶(CGTases)、糖基转移酶、葡聚糖蔗糖酶、纤维素、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶的酶可以包含本文序列表中描述的氨基酸序列,并且也可以由序列表中描述的核酸序列编码。另外,这些酶还可以包括与序列表中描述的氨基酸序列具有至少70%序列同一性的功能同系物。可以使用Blast检索(ncbi.nih.gov)的ClustalW软件执行确定序列同一性百分比的参数。这些程序的使用可以确定蛋白质同系物之间的一致性。
在一些实施方案中,转葡糖苷酶包含一种氨基酸序列,该序列与SEQ ID NO:163-290和723中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,CGTase酶包含或由一种氨基酸序列组成,该氨基酸序列与SEQ ID NO:1、3、78-101和154中任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,转葡糖苷酶包含一种氨基酸序列或由一种核酸序列编码,该序列与SEQ IDNO:163-290和723中任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。
本文中的方法还包括将基因结合到重组细胞中以产生中间体,例如丙酮酸、乙酰辅酶A、柠檬酸盐和其他TCA中间体(柠檬酸循环)。中间体可进一步用于生产用于生产化合物1的罗汉果苷化合物。Gruchattka等人和Rodriguez等人(PLoS One.2015Dec 23;10(12;Microb Cell Fact.2016Mar 3;15:48;文献全文以引用方式并入本文)介绍了提高角鲨烯含量的方法。
进一步考虑了产生氧化角鲨烯和二环氧角鲨烯的酶的表达。利用角鲨烯合酶和/或角鲨烯环氧化酶,可使用酶产生氧化角鲨烯和二环氧角鲨烯来促进角鲨烯合成。例如,Su等描述了编码SgSQS的基因,SgSQS是一种来自罗汉果(Siraitia grosvenorii)的角鲨烯合酶的一种417个氨基酸的蛋白质(Biotechnol Lett.2017Mar 28;文献以全文引用方式并入本文)。对重组细胞进行基因工程改造以表达HMG CoA还原酶,也可用于角鲨烯合成(ApplEnviron Microbiol.1997Sep;63(9):3341-4.;Front Plant Sci.2011Jun 30;2:25;FEBSJ.2008Apr;275(8):1852-9.;文献以全文引用方式并入本文)。在一些实施方案中,2,3-氧化角鲨烯或二环氧角鲨烯是由包含一种序列的酶产生,该序列与SEQ ID NO:898或900具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,2,3-氧化角鲨烯或二环氧角鲨烯是由一种核酸序列编码的酶产生,该序列与SEQ ID NO:897或899具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。
还考虑了制备葫芦二烯醇/环氧葫芦二烯醇的酶的表达。还考虑将来自美洲南瓜(C PEPO)、罗汉果(S grosvenorii)、厚皮甜瓜(C melo)、中国南瓜(C moschata)和笋瓜(Cmaxim)的葫芦二烯醇合酶用于通过表达载体进入重组细胞。还考虑了在重组细胞中表达的用于三萜(titerpene)生物合成的氧化角鲨烯环化酶,这将导致无环底物环化成各种多环三萜,也可以用作产生化合物1的中间体(Org Biomol Chem.2015Jul14;13(26):7331-6;文献以引用方式并入本文)。
还考虑了表现出环氧水解酶活性以制备羟基-葫芦二烯醇的酶的表达。在本文的一些实施方案中,用于生产化合物1的重组细胞还包括编码显示环氧化物水解酶活性的酶的基因,所述酶被提供以制备羟基环化酶。此类酶由Itkin等人描述,通过引用将其全部内容并入本文。本文提供的序列表表1提供了Itkin等人描述的酶。Ikin等人还描述了用于制备关键的罗汉果苷、UGS族、糖基转移酶和水解酶的酶,可以对其进行遗传修饰以用于诸如糖基化的逆反应。
还考虑了在重组细胞中针对羟基化罗汉果苷化合物的酶的表达以产生罗汉果醇。这些酶可以包括CAZY族的蛋白,UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、转葡糖苷酶、果胶酶和葡聚糖酶、酵母和真菌水解酶。此类酶可用于例如将罗汉果苷V水解为罗汉果苷IIIE,其中罗汉果IIIE可被进一步处理以例如在体内产生化合物1。在一些实施方案中,真菌乳糖酶包含一种氨基酸序列,该序列与SEQ ID NO:678-722中任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个序列之间范围的序列同一性。
在一些实施方案中,制备了罗汉果醇前体例如角鲨烯或氧化角鲨烯(oxidosqualine)、罗汉果醇或罗汉果苷。罗汉果醇的前体可以在化合物1的生产中用作前体。角鲨烯可以用角鲨烯合酶从法呢基焦磷酸(famesyl pyrophosphate)中产生,可以使用角鲨烯环氧化酶从角鲨烯生产氧化角鲨烯。角鲨烯合酶可以是来自葫芦科植物绞股蓝(Gynostemma pentaphyllum)(蛋白质登记编号:C4P9M2)的角鲨烯合酶。角鲨烯合酶还可包括来自以下的角鲨烯合酶:拟南芥(Arabidopsis thaliana)(蛋白质登记编号C4P9M3),甘蓝型油菜(甘蓝型油菜(Brassica napus)),大叶莱檬(Citrus macrophylla),绿玉树(Euphorbia tirucalli)(蛋白质登记编号B9WZW7),大豆(Glycine max),光果甘草(Glycyrrhiza glabra)(蛋白质登记编号Q42760,Q42761),甘草(Glycrrhiza uralensis)(蛋白质登记编号:D6QX40、D6QX41、D6QX42、D6QX43、D6QX44、D6QX45、D6QX47、D6QX39、D6QX55、D6QX38、D6QX53、D6QX37、D6QX35、B5AID5、B5AID4、B5AID3、C7EDD0、C6KE07、C6KE08、C7EDC9),百脉根(Lotus japonicas)(蛋白质登记编号Q84LE3)、蒺藜苜蓿(Medicagotruncatula)(蛋白质登记编号Q8GSL6),豌豆(Pisum sativum),蓖麻(Ricinus communis)(蛋白质登记编号B9RHC3)。WO 2016/050890中描述了各种角鲨烯合酶,其内容以引用方式并入本文。
本文公开的任何一种酶可以在体外、离体或体内产生。例如,编码该酶的核酸序列(包括但不限于UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶、细胞色素P450、环氧化物水解酶、葫芦二烯醇合酶、角鲨烯环氧酶、角鲨烯合酶、水解酶和氧化角鲨烯环化酶)可以引入宿主重组细胞,例如在体内以包含编码核酸序列的表达载体的形式引入。可以通过例如标准转化技术(例如,热转化)或通过转染将表达载体引入宿主细胞。表达系统可以产生用于生产罗汉果苷和化合物1的酶,以便在体内细胞中产生化合物1。有用的表达系统包括但不限于细菌、酵母和昆虫细胞系统。例如,昆虫细胞系统可以感染用于表达感兴趣酶的重组病毒表达系统。在一些实施方案中,对基因进行密码子优化以在特定细胞中表达。在一些实施方案中,基因与启动子可操作地连接以驱动酶蛋白的转录和翻译。如本文所述,可以获得密码子优化,然后可以将优化的序列设计成用于转化重组宿主细胞的载体。
表达载体可进一步包含转录或翻译调节序列,转录或翻译因子的编码序列或各种启动子(例如,GPD1启动子)和/或增强子,以促进酵母细胞中目的基因的转录。
在一些实施方案中,如本文所述的重组细胞经基因修饰以在体内产生化合物1。另外,可以在细胞生长期间或细胞生长后向细胞提供罗汉果醇前体或罗汉果苷前体,以提高用于体内产生化合物1的途径(pathway)的特定中间体的产生速率。细胞可以悬浮或固定。该细胞可以在发酵液中或在反应缓冲液中。在一些实施方案中,渗透剂用于将罗汉果醇前体或罗汉果苷前体转移至细胞中。在一些实施方案中,可以纯化形式或作为组合物或提取物的一部分提供罗汉果醇前体或罗汉果苷前体。
重组宿主细胞可以是例如植物、双壳类、鱼类、真菌、细菌或哺乳动物的细胞。例如,该植物可选自罗汉果属(Siraitia)、苦瓜属(Momordica)、绞股蓝属(Gynostemma)、南瓜属(Cucurbita)、黄瓜属(Cucumis)、拟南芥属(Arabidopsis)、蒿属(Artemisia)、甜菊属(Stevia)、人参属(Panax)、睡茄属(Withania)、大戟属(Euphorbia)、苜蓿属(Medicago)、吊兰属(Chlorophytum)、五加属(Eleutherococcus)、楤木属(Aralia)、桑属(Morus)、苜蓿属(Medicago)、桦木属(Betula)、黄芪属(Astragalus)、麻疯树属(Jatropha)、山茶属(Camellia)、韧伞属(Hypholoma)、曲霉属(Aspergillus)、茄属(Solanum)、石杉属(Huperzia)、孩儿参属(Pseudostellaria)、黄麻属(Corchorus)、常春藤属(Hedera)、地钱属(Marchantia)和桑属(Morus)。真菌可选自毛癣菌属(Trichophyton)、桑黄孔菌属(Sanghuangporus)、樟芝属(Taiwanofungus)、链疫孢属(Moniliophthora)、盘二孢属(Marssonina)、色二孢属(Diplodia)、微香菇属(Lentinula)、法夫酵母属(Xanthophyllomyces)、普可尼亚属(Pochonia)、炭疽菌属(Colletotrichum)、间座壳属(Diaporthe)、组织胞浆菌属(Histoplasma)、球孢子菌属(Coccidioides)、组织胞浆菌属(Histoplasma)、桑黄孔菌属(Sanghuangporus)、短梗霉属(Aureobasidium)、普可尼亚属(Pochonia)、青霉属(Penicillium)、孢子丝菌属(Sporothrix)、黑僵菌属(Metarhizium)、曲霉属(Aspergillus)、耶氏酵母属(Yarrowia)和油脂酵母属(Lipomyces)。在一些实施方案中,真菌为构巢曲霉(Aspergillus nidulans)、解脂耶氏酵母(Yarrowia lipolytica)或圆红冬孢酵母菌(Rhodosporin toruloides)。在一些实施方案中,重组宿主细胞是酵母细胞。在一些实施方案中,酵母选自假丝酵母属(Candida)、酵母属(Sacccharaomyces)、酵母亚门(Saccharomycotina)、外囊菌亚门(Taphrinomycotina)、裂殖酵母纲(Schizosaccharomycetes)、毕赤酵母属(Komagataella)、担子菌门(Basidiomycota)、伞菌亚门(Agaricomycotina)、银耳纲(Tremellomycetes)、柄锈菌亚门(Pucciniomycotina)、短梗霉属(Aureobasidium)、锥毛壳属(Coniochaeta)、红冬孢酵母属(Rhodosporidium)、耶氏酵母属(Yarrowia)和微球黑粉菌纲(Microboryomycetes)。在一些实施方案中,该细菌选自弗兰克氏菌属(Frankia)、放线菌门(Actinobacteria)、链霉菌属(Streptomyces)和肠球菌属(Enterococcus)。在一些实施方案中,细菌为粪肠球菌(Enterococcus faecalis)。
在一些实施方案中,对重组基因进行密码子优化以在细菌、哺乳动物、植物、真菌或昆虫的细胞中表达。在一些实施方案中,一个或多个基因包含对所编码酶的活性增加的功能性突变。在一些实施方案中,培养重组宿主细胞包括监测培养条件的pH、溶解氧水平、氮水平或其组合。
产生化合物1的方法的一些实施方案包括产生用于产生化合物1的中间体。具有以下结构的化合物1在重组宿主体内产生。
在一些实施方案中,化合物在重组宿主细胞中,被分泌到重组细胞生长的培养基中,或两者都在其中生长的培养基中。在一些实施方案中,重组细胞在体内进一步产生诸如罗汉果苷化合物的中间体。在表达本文公开的基因的条件下,重组细胞可以生长在培养基中。本文描述了生长细胞的方法的一些实施方案。
在一些实施方案中,该中间体是或包含角鲨烯、氧化角鲨烯、葫芦二烯醇、罗汉果醇和罗汉果苷中的至少一种。在一些实施方案中,罗汉果苷是罗汉果苷IIE。如本文所述,罗汉果苷是可例如从植物或水果天然分离的罗汉果苷家族。如本文所述,罗汉果苷可以由重组宿主细胞产生。
在本文描述的方法的一些替代方案中,重组宿主细胞包含多核苷酸或包含以下一种或多种的序列:
编码角鲨烯环氧酶的基因;
编码葫芦二烯醇合酶的基因;
编码细胞色素P450的基因;
编码细胞色素P450还原酶的基因;和
编码环氧化物水解酶的基因。
在一些实施方案中,角鲨烯环氧酶包含一种序列,该序列与SEQ ID NO:54具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,角鲨烯环氧酶包含一种序列,该序列来自拟南芥(Arabidopsisthaliana)(蛋白质登记编号:Q9SM02、065403、065402、065404、081000或Q9T064)、甘蓝型油菜(甘蓝型油菜(Brassica napus))(蛋白质登记编号:10 065727、065726)、绿玉树(Euphorbia tirucalli)(蛋白质登记编号:A7VJN1)、蒺藜苜蓿(Medicago truncatula)(蛋白质登记编号:Q8GSM8,Q8GSM9)、豌豆(Pisum sativum)和蓖麻(Ricinus communis)(蛋白质登记编号:B9R6VO、B9S7W5、B9S6Y2、B9TOY3、B9S7TO和B9SX91)和与它们具有至少70%、例如至少80%、例如至少90%、例如至少95%、例如至少98%序列同一性的上述任一种的功能同系物。在一些实施方案中,鲨烯环氧酶包含或由以下氨基酸序列组成:该氨基酸序列与SEQ ID NO:50-56、60、61、334或335具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。
在一些实施方案中,细胞包含编码ERG7(羊毛甾醇合酶)的基因。在一些实施方案中,羊毛甾醇合酶包含一种序列,该序列与SEQ ID NO:111具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,P450多肽在基因中编码,所述基因包含一种序列,该序列与权利要求31-48中任何一项的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,可以通过核糖体跳跃序列来分离这些序列以制备分离的蛋白质。
在一些实施方案中,重组宿主细胞包含编码具有葫芦二烯醇合酶活性的多肽的基因。在一些实施方案中,具有葫芦二烯醇合酶活性的多肽包含如SEQ ID NO:70-73、75-77、319、321、323、325、327-333、420、422、424、426、446、902、904和906中任一个所示的氨基酸序列。在一些实施方案中,具有葫芦二烯醇合酶活性的多肽包含一种序列,该序列与SEQ IDNO:70-73、75-77、319、321、323、325、327-333、420、422、424、426、446、902、904和906中任何一个的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,具有葫芦二烯醇合酶活性的多肽包含C端部分,该C端部分包含SEQ ID NO:73所示的序列。在一些实施方案中,编码具有葫芦二烯醇合酶活性的多肽的基因是密码子优化的。在一些实施方案中,密码子优化的基因包含SEQ IDNO:74所示的核酸序列。
在一些实施方案中,具有葫芦二烯醇合酶活性的多肽是包含与葫芦二烯醇合酶融合的融合结构域的融合多肽。融合结构域可以融合至例如葫芦二烯醇合酶的N-末端或C-末端。融合结构域可以位于例如融合多肽的N-末端区域或C-末端区域。融合结构域的长度可以变化。例如,融合结构域可以是或约为3、4、5、6、7、8、9、10、12、15、20、25、30、40、50、100、150、200、300、400、500、600、700、800、900、1000、1500、2000或这些数字中任意两个氨基酸之间的范围长。在一些实施方案中,融合结构域长3至1000个氨基酸。在一些实施方案中,融合结构域长5至50个氨基酸。在一些实施方案中,融合结构域包含功能蛋白的主要部分或全部序列。在一些实施方案中,融合结构域包含酵母蛋白的一部分或全部序列。例如,具有葫芦二烯醇合酶活性的融合多肽可包含与SEQ ID NO:851、854、856、1024、859、862、865、867、915、920、924、928、932、936、940、944、948、952、956、959、964、967、971、975、979、983、987、991、995、999、1003、1007和1011中任一个序列具有或具有至少70%、80%、85%、90%、95%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,融合多肽包含或由以下任一序列中所示的氨基酸序列组成:SEQ ID Nos:851、854、856、1024、859、862、865、867、915、920、924、928、932、936、940、944、948、952、956、959、959、964、967、971、975、979、983、987、991、995、999、1003、1007和1011。在一些实施方案中,融合多肽的融合结构域包含一种氨基酸序列,该序列与SEQ ID NO:866、870、917、921、925、929、933、937、941、941、945、949、953、957,961、968、972、976、980、984、988、992、996、1000、1004、1008和1012具有或具有至少70%、80%、85%、90%、95%、98%、99%或100%的序列同一性。在一些实施方案中,所述融合多肽的融合结构域包含或由以下任一序列中所示的氨基酸序列组成:SEQ ID NO:866、870、917、921、925、929、933、937、941、945、949、953、957、961、968、972、976、980、984、988、992、996、1000、1004、1008和1012。在一些实施方案中,与融合结构域融合的葫芦二烯醇合酶包含一种氨基酸序列,所述氨基酸序列与SEQ ID NO:70-73、75-77、319、321、323、325、327、329-333、420、422、424、426、446、902、904和906中任一个具有或具有至少70%、80%、85%、90%、95%、98%、99%或100%的同一性。在一些实施方案中,与融合结构域融合的葫芦二烯醇合酶包含或由SEQ ID NO:70-73、75-77、319、321、323、325、327、329-333、420、422、424、426、446、902、904和906中任一个所示的氨基酸序列组成。在一些实施方案中,与融合结构域融合的葫芦二烯醇合酶是由包含下述核酸序列的基因编码:该核酸序列与SEQ ID NOs:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905中的任何一个序列具有或具有至少70%、80%、85%、90%、95%、98%、99%或100%的同一性。在一些实施方案中,与融合结构域融合的葫芦二烯醇合酶由一种基因编码,该基因包含或由SEQ ID NOs:74、320、322、324、326、328、418、421、423、425、427、897、897、901、903和905中任一序列中所示核酸序列组成。本发明包括一种重组核酸分子,其包含编码具有葫芦二烯醇合酶活性的融合多肽的核酸序列。还公开了一种重组细胞,其包含具有葫芦二烯醇合酶活性的融合多肽或编码该融合多肽的重组核酸分子。
本文公开的具有葫芦二烯醇合酶活性的融合多肽可以用于催化葫芦二烯醇合酶的酶反应。例如,葫芦二烯醇合酶的底物可以与这些融合多肽中的一种或多种接触以产生反应产物。反应产物的非限制性实例包括葫芦二烯醇(curcurbitatedienol)、24,25-环氧葫芦二烯醇及其任何组合。葫芦二烯醇合酶的底物的非限制性实例包括2,3-氧化角鲨烯、二氧化角鲨烯、二环氧角鲨烯及其任意组合。在一些实施方案中,可使底物与重组宿主细胞接触,所述重组宿主细胞包含编码具有葫芦二烯醇合酶活性的一种或多种融合多肽的核酸序列。可以将底物提供给重组宿主细胞、在重组宿主细胞中存在、由重组宿主细胞产生、或其任何组合。
在一些实施方案中,细胞色素P450是CYP5491。在一些实施方案中,细胞色素P540包含一种氨基酸序列,该氨基酸序列与SEQ ID NO:44和/或SEQ ID NO:74具有或具有至少50%、60%、70%、80%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,P450还原酶多肽包含一种氨基酸序列,该氨基酸序列与SEQID NO:46具有或具有至少50%、60%、70%、80%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,P450多肽由包含一种序列的基因编码,该序列与SEQ ID NO:31-48、316、431、871、873、875、877、879、881、883、885、887和891中任何一个具有或具有至少50%、60%、70%、80%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。
在一些实施方案中,环氧化物水解酶包含一种序列,该序列与SEQ ID NO:38或40具有或具有至少70%、80%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,环氧化物水解酶包含或由SEQ ID NO:38或40所示的序列组成。
角鲨烯是一种天然的30碳有机分子,可以在动植物中产生,是类固醇家族的生化前体。此外,角鲨烯可以作为在宿主重组细胞体内合成罗汉果醇的前体。角鲨烯的末端双键之一的氧化(通过角鲨烯单加氧酶)产生2,3-角鲨烯氧化物,其经历酶催化环化以提供羊毛甾醇,然后将其精制为胆固醇和其它甾体。如Gruchattkaet等人所述(“In VivoValidation of In Silico Predicted Metabolic Engineering Strategies in Yeast:Disruption ofα-Ketoglutarate Dehydrogenase and Expression of ATP-CitrateLyase for Terpenoid Production.”PLOS ONE December 23,2015;文献以引用方式并入本文),角鲨烯的合成最初可以从糖酵解循环的前体开始制备角鲨烯。反过来,角鲨烯可以通过ATP-柠檬酸裂解酶的过度表达来上调,从而增加角鲨烯的产量。本文公开的一些实施方案包括在重组宿主细胞(例如重组酵母细胞中)用于产生角鲨烯和/或促进角鲨烯产生的酶。在酵母中发现,ATP柠檬酸裂解酶还可以介导可用于角鲨烯和甲羟戊酸酯制备的乙酰辅酶A的合成,其可见于酵母酿酒酵母(S.cerevisiae)(Rodrigues等人.“ATP citrate lyasemediated cytosolic acetyl-CoA biosynthesis increases mevalonate production inSaccharomyces cerevisiae”Microb Cell Fact.2016;15:48.;文献以引用方式并入本文)。一种编码用于介导乙酰辅酶A合成的酶的基因的实例在SEQ ID NO:130中列出。在本文的一些实施方案中,重组细胞包含用于介导乙酰辅酶A合成的序列。
本文公开的一些实施方案提供了产生具有以下结构的化合物1的方法:
在一些实施方案中,所述方法还包括在体内产生化合物1的途径中产生中间体。在一些实施方案中,产生化合物1的重组宿主细胞包含至少一种能够将双氧化角鲨烯转化为24,25环氧葫芦二烯醇,将氧化角鲨烯转化为葫芦二烯醇,催化24,25环氧葫芦二烯醇羟化为11-羟基-24,25环氧葫芦二烯醇的酶,催化将葫芦二烯醇羟化为11-羟基-葫芦二烯醇的酶,将葫芦二烯醇环氧化为24,25环氧葫芦二烯醇的酶,能催化11-羟基-葫芦二烯醇环氧化生成11-羟基-24,25环氧葫芦二烯醇的酶,将11-羟基-葫芦二烯醇转化为11-羟基-24,25环氧葫芦二烯醇的酶,催化11-羟基-24,25环氧葫芦二烯醇转化以产生罗汉果醇的酶和/或催化罗汉果苷前体的糖基化以产生罗汉果苷化合物。在一些实施方案中,用于糖基化的酶由SEQ ID NO:121、122、123和124中任一个所示的序列编码。
在一些实施方案中,用于催化24,25环氧葫芦二烯醇形成11-羟基-24,25环氧葫芦二烯醇的羟基化的酶是CYP5491。在一些实施方案中,CYP5491包含SEQ ID NO:49所示的序列。在一些实施方案中,角鲨烯环氧酶包含一种序列,该序列与SEQ ID NO:54的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。
在一些实施方案中,能够环氧化11-羟基-葫芦二烯醇的酶包含SEQ ID NO:74所示的氨基酸序列。
在一些替代方案中,重组细胞包含表达酶的基因,该酶能够将二氧化角鲨烯转化为24,25环氧葫芦二烯醇,将氧化角鲨烯转化为葫芦二烯醇,将24,25环氧葫芦二烯醇羟基化为11-羟基-24,25环氧葫芦二烯醇,葫芦二烯醇的羟基化以产生11-羟基-葫芦二烯醇,葫芦二烯醇的环氧化以产生24,25环氧葫芦二烯醇,和/或11-羟基葫芦二烯醇的环氧化以产生11-羟基-24,25环氧葫芦二烯醇。在本文的这些实施方案中,中间体和罗汉果苷是在体内产生的。
在一些实施方案中,产生化合物1的方法进一步包括产生一种或多种罗汉果苷化合物和中间体,例如氧化角鲨烯、二氧化角鲨烯、葫芦二烯醇、24,25环氧葫芦二烯醇、11-羟基-葫芦二烯醇、11-羟基24,25种环氧葫芦二烯醇、罗汉果醇和罗汉果苷化合物。
本文描述了生产罗汉果苷化合物的方法,例如,罗汉果化合物中的一种在WO2014086842中描述(文献以引用方式并入本文)。罗汉果苷化合物可以被细胞用作中间体,以进一步产生本文公开的化合物1。
重组宿主,例如微生物、植物细胞或植物,可用于表达对罗汉果醇(三萜核)和各种罗汉果醇糖苷(罗汉果苷)的生物合成有用的多肽。
在一些实施方案中,该生产方法可以以任何顺序包括以下一个或多个步骤:
(1)增强氧化角鲨烯的水平
(2)增强二氧化角鲨烯的水平
(3)氧化角鲨烯->葫芦二烯醇
(4)二氧化角鲨烯->24,25环氧葫芦二烯醇
(5)葫芦二烯醇->11-羟基葫芦二烯醇
(6)24,25环氧葫芦二烯醇->11-羟基-24,25环氧葫芦二烯醇
(7)11-羟基葫芦二烯醇->罗汉果醇
(8)11-羟基-24,25环氧葫芦二烯醇->罗汉果醇
(9)罗汉果醇->各种罗汉果苷化合物。
在本文的实施方案中,还可以通过重组细胞产生氧化角鲨烯、二氧化角鲨烯、葫芦二烯醇、24,25环氧葫芦二烯醇或罗汉果醇。该方法可以包括在培养基中生长重组微生物,所述培养基中表达本发明方法的一个或多个酶催化步骤,例如合成酶、水解酶、CYP450s和/或UGTs。重组微生物可以分批或连续培养。通常,重组微生物在规定的温度下在发酵罐中生长一段所需的时间,以增加化合物1的产量。
在一些实施方案中,可以使用整个细胞来生产罗汉果苷化合物,对所述整个细胞提供含有前体分子的原料以增加化合物1的产率。可以在细胞生长期间或细胞生长后提供原料。整个细胞可以悬浮或固定。整个细胞可以在发酵液中或在反应缓冲液中。
在一些实施方案中,重组宿主细胞可以包含异源核酸,所述异源核酸编码一种酶或酶的混合物,该酶或酶的混合物能够催化氧化-角鲨烯至葫芦二烯醇,将葫芦二烯醇转化为11-羟基葫芦二烯醇,将11-羟基-葫芦二烯醇转化为罗汉果醇和/或罗汉果醇到罗汉果苷。在一些实施方案中,细胞可进一步包含异源核酸,所述异源核酸编码一种酶或酶的混合物,该酶或酶的混合物能够催化二氧化角鲨烯催化24,25环氧葫芦二烯醇,24,25环氧葫芦二烯醇至羟基-24,25环氧葫芦二烯醇,11-羟基-24,25环氧葫芦二烯醇到罗汉果醇,和/或罗汉果醇到罗汉果苷。
宿主细胞可包含编码葫芦二烯醇合酶的重组基因和/或编码细胞色素P450多肽的重组基因。
在一些实施方案中,细胞包含一种蛋白质,该蛋白质与SEQ ID NO:70-73、75-77、319、321、323、325、327-333、420、422、424、426、446、902、904和906(葫芦二烯醇合酶)中任一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。
在一些实施方案中,将氧化-角鲨烯转化为葫芦二烯醇,是通过SEQ ID NO:70-73、75-77、319、321、323、325、327-333、420、422、424、426、446、902、904和906中任一项的葫芦二烯醇合酶或其功能同系物催化,所述同系物与上述合酶具有至少70%、例如至少80%、例如至少90%、例如至少95%、例如至少98%的序列同一性。在一些实施方案中,葫芦二烯醇合酶多肽包含C末端部分,其包含SEQ ID NO:73所示的序列。在一些实施方案中,编码葫芦二烯醇合酶多肽的基因是密码子优化的。在一些实施方案中,密码子优化的基因包含SEQID NO:74所示的核酸序列。
在一些实施方案中,将葫芦二烯醇转化为11-羟基葫芦二烯醇,是由SEQ ID NO:49的CYP5491或其功能同系物催化,CYP5491与其功能同系物具有至少70%、例如至少80%、例如至少90%、例如至少95%、例如至少98%的序列同一性。
在一些实施方案中,11-羟基-葫芦二烯醇向罗汉果醇的转化包含一种多肽,该多肽选自SEQ ID NO:29的环氧化物水解酶1、SEQ ID NO:30的环氧化物水解酶2和它们的功能同系物,以上水解酶与它们的同系物具有至少70%、例如至少80%、例如至少90%、例如至少95%、例如至少98%的序列同一性。在一些实施方案中,将编码环氧化物水解酶1和环氧化物水解酶2的基因密码子优化用于表达。在一些实施方案中,用于环氧化物水解酶的密码子优化的基因包含SEQ ID NO:114或115所示的核酸序列。
在一些实施方案中,环氧化物水解酶包含如SEQ ID NO:21-28(Itkin等,以引用方式并入本文)中列出的氨基酸序列。
在一些实施方案中,在宿主重组细胞中,一个或多个UGT催化罗汉果醇转化为罗汉果苷,所述UGT选自:SEQ ID NO:15的UGT1576、SEQ ID NO:9的UGT98、SEQ ID NO:68的UGTSK98,和与它们具有至少70%、例如至少80%、例如至少90%、例如至少95%、例如至少98%序列同一性的功能同系物。
在一些实施方案中,宿主重组细胞包含编码细胞色素P450多肽的重组基因,所述细胞色素P450多肽由SEQ ID NO:31-48、316、431、871、873、875、877、879、881、883、885、887和891中的任一序列编码。
在一些实施方案中,宿主重组细胞包含编码角鲨烯环氧酶多肽的重组基因,该多肽包含SEQ ID NO:50中的序列。
在一些实施方案中,宿主重组细胞包含一种重组基因,该基因编码SEQ ID NO:70-73、75-77、319、321、323、325、327-333、420、422、424、426、446、902、904和906中任一项的葫芦二烯醇合酶多肽。在一些实施方案中,葫芦二烯醇合酶多肽包含C端部分,该C端部分包含SEQ ID NO:73所示的序列。在一些实施方案中,编码葫芦二烯醇合酶多肽的基因是密码子优化的。在一些实施方案中,密码子优化的基因包含SEQ ID NO:74所示的核酸序列。
在一些实施方案中,产生化合物1的方法包括使罗汉果苷IIIE与能够催化从罗汉果苷IIIE产生化合物1的第一酶接触。在一些实施方案中,该方法在体内进行,其中重组细胞包含编码第一酶的基因,该第一酶能够催化从罗汉果苷IIIE生产化合物1。在一些实施方案中,细胞进一步包含编码能够催化从罗汉果醇产生罗汉果苷IE1的酶的基因。在一些实施方案中,该酶包含SEQ ID NO:4-8中任一项所示的序列。
在一些实施方案中,细胞还包含将罗汉果苷IIE转化为罗汉果苷IV、罗汉果苷V、11-氧代罗汉果苷V和赛门苷I的酶。在一些实施方案中,用于将罗汉果苷IIE转化为罗汉果苷IV、罗汉果苷V、11-氧代-罗汉果苷V和赛门苷I的酶由包含SEQ ID NO:9-14和116-120中所示核酸序列的基因编码。在一些实施方案中,产生化合物1的方法包括用葡萄糖转移酶UGT76G1处理罗汉果苷IIIE。
在一些实施方案中,该方法包括在HPLC柱上分离来自重组细胞的裂解物,并收集包含化合物1的洗脱级分。
在一些实施方案中,该方法包括使罗汉果苷IIIE与能够催化由罗汉果苷IIIE产生化合物1的第一酶接触。在一些实施方案中,使罗汉果苷IIIE与第一酶接触包括,将罗汉果苷IIIE与包含编码第一酶的第一基因的重组宿主细胞接触。在一些实施方案中,第一基因对于重组宿主细胞是异源的。在一些实施方案中,罗汉果苷IIIE与重组宿主细胞中的第一酶接触,重组宿主细胞包含编码第一酶的第一多核苷酸。在一些实施方案中,罗汉果苷IIIE存在于重组宿主细胞中。在一些实施方案中,罗汉果苷IIIE由重组宿主细胞产生。在一些实施方案中,该方法包括在表达第一酶的条件下,在培养基中培养重组宿主细胞。在一些实施方案中,第一酶是UDP糖基转移酶、环麦芽糊精葡聚糖转移酶(CGTases)、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。在一些实施方案中,第一酶是CGTase。在一些实施方案中,CGTase包含一种氨基酸序列,该序列与SEQ ID NO:1、3、78-101、148和154中任一个的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,转葡糖苷酶由SEQ ID NO:163-290和723中的任一个编码。在一些实施方案中,CGT酶包含SEQ ID NO:1、3、78-101、148和154中任何一个所示的序列或由其组成。在一些实施方案中,第一酶是葡聚糖蔗糖酶。在一些实施方案中,葡聚糖蔗糖酶包含一种氨基酸序列,该序列与SEQ ID NO:2、103、106-110、156和896中的任何一个的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,DexT包含SEQ ID NO:2、103、106-110、156和896中任何一个的氨基酸序列。在一些实施方案中,DexT包含SEQ ID NO:104或105所示的核酸序列。在一些实施方案中,葡聚糖蔗糖酶包含SEQ ID NO:2或106-110的氨基酸序列。在一些实施方案中,第一酶是转葡糖苷酶。在一些实施方案中,转葡糖苷酶包含一种氨基酸序列,该序列与SEQ ID NO:3163-291和723中任一个的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,转葡糖苷酶包含SEQ ID NO:163-291和723的氨基酸序列。在一些实施方案中,转葡糖苷酶由SEQ ID NO:163-291和723中任何一个编码。在一些实施方案中,转葡糖苷酶包含SEQ ID NO:163-290和723任一个所示的氨基酸序列。在一些实施方案中,基因编码CGTase,CGTase包含SEQ ID NOs:1、3、78-101和154中序列的任何一个。
在一些实施方案中,所述方法包括使罗汉果苷IIA与重组宿主细胞接触以产生罗汉果苷IIIE,其中所述重组宿主细胞还包含编码第二酶的第二基因,所述第二酶能够催化从罗汉果苷IIA产生罗汉果苷IIIE。在一些实施方案中,罗汉果苷IIA由重组宿主细胞产生。在一些实施方案中,第二种酶是UDP糖基转移酶、CGTase、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。在一些实施方案中,第二酶是尿苷二磷酸-葡萄糖基转移酶(UGT)。在一些实施方案中,转葡糖苷酶包含SEQ ID NO:163-290和723中任一个所示的氨基酸序列。在一些实施方案中,基因编码CGTase,CGTase包含SEQ ID NO:1、3、78-101、148和154中所示的氨基酸序列。在一些实施方式中,UGT是UGT73C3(SEQ ID NO:4)、UGT73C6(SEQ ID NO:5、444或445),85C2(SEQ ID NO:6)、UGT73C5(SEQ ID NO:7)、UGT73E1(SEQ ID NO:8)、UGT98(SEQ ID NO:9或407)、UGT1576(SEQ ID NO:15)、UGT SK98(SEQ ID NO:16)、UGT430(SEQ ID NO:17)、UGT1697(SEQ ID NO:18)或UGT11789(SEQ ID NO:19)或SEQ ID NO:4、5、7-9、15-19、125、126、128、129、293-304、306、307、407、439、441和444中的任何一个。在一些实施方案中,UGT由UGT1495(SEQ ID NO:10)、UGT1817(SEQ ID NO:11)、UGT5914(SEQ ID NO:12),UGT8468(SEQ ID NO:13)或UGT10391(SEQ ID NO:14)中所示的基因编码。
在一些实施方案中,所述方法包括使罗汉果醇与重组宿主细胞接触以产生罗汉果苷IIIE,其中重组宿主细胞进一步包含一种或多种基因,该基因编码一种或多种能够催化从罗汉果醇产生罗汉果苷IIIE的酶。在一些实施方案中,罗汉果醇是由重组宿主细胞产生的。在一些实施方案中,一种或多种酶包括UDP糖基转移酶、CGTase、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。在一些实施方案中,第二酶是尿苷二磷酸-葡萄糖基转移酶(UGT)。在一些实施方案中,UGT是UGT73C3、UGT73C6、85C2、UGT73C5、UGT73E1、UGT98、UGT1495、UGT1817、UGT5914、UGT8468、UGT10391、UGT1576、UGT SK98、UGT430、UGT1697或UGT11789。
在一些实施方案中,该方法包括使罗汉果苷化合物与重组宿主细胞接触以产生罗汉果苷IIIE,其中重组宿主细胞还包含一种或多种基因,该基因编码一种或多种能够催化从罗汉果苷化合物中产生罗汉果苷IIIE的酶,其中罗汉果苷化合物是罗汉果苷IA1、罗汉果苷IE1、罗汉果苷IIA1、罗汉果苷IIE,罗汉果苷IIIA1、罗汉果苷IIIA2、罗汉果苷III、罗汉果苷IV、罗汉果苷IVA、罗汉果苷V或赛门苷中的一种或多种。在一些实施方案中,罗汉果苷化合物由重组宿主细胞产生。在一些实施方案中,所述一种或多种酶包括UDP糖基转移酶、CGTase、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。在一些实施方案中,转葡糖苷酶包含SEQ ID NO:163-290和723中任一个所示的氨基酸序列。在一些实施方案中,基因编码CGTase,其包含SEQ ID NO:1、3、78-101、148和154中所示的氨基酸序列。在一些实施方案中,该方法包括使罗汉果苷IA1与重组宿主细胞接触,其中所述重组宿主细胞包含编码UGT98或UGT SK98的基因。在一些实施方案中,UGT98或UGT SK98酶包含一种氨基酸序列,该序列与SEQ ID NO:9、407或16具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,接触导致在细胞中产生罗汉果苷IIA。在一些实施方案中,一种或多种酶包含由SEQ ID NO:1、3、78-101、106-109、147、154、163-303、405、411、354-405、447-723、770、776和782中任一个所示的氨基酸。
在一些实施方案中,该方法进一步包括使11-羟基-24,25环氧葫芦二烯醇与重组宿主细胞接触,其中所述重组宿主细胞还包含编码环氧化物水解酶的第三基因。在一些实施方案中,11-羟基-24,25环氧葫芦二烯醇是由重组宿主细胞产生。在一些实施方案中,该方法进一步包括使11-羟基-葫芦二烯醇与重组宿主细胞接触,其中所述重组宿主细胞包含编码细胞色素P450或环氧化物水解酶的第四基因。在一些实施方案中,P450多肽在包含SEQID NO:31-48、316、431、871、873、875、877、879、881、883、885、887和891中任一序列的基因中编码,在一些实施方案中,所述11-羟基-葫芦二烯醇是由重组宿主细胞产生。
在一些实施方案中,该方法进一步包括使3,24,25三羟基葫芦二烯醇与重组宿主细胞接触,其中该重组宿主细胞还包含编码细胞色素P450的第五基因。在一些实施方案中,P450多肽由包含SEQ ID NO:31-48、316和318中任一个所示序列的基因中编码。在一些实施方案中,由重组宿主细胞产生3,24,25三羟基葫芦二烯醇。在一些实施方案中,接触导致在重组宿主细胞中产生罗汉果醇。在一些实施方案中,细胞色素P450包含一种氨基酸序列,该序列与SEQ ID NO:20、308或315的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,P450多肽在基因中编码,该基因包含SEQ ID NO:31-48、316、431、871、873、875、877、879、881、883、885、887和891中任何一个所示的序列。在一些实施方案中,环氧化物水解酶包括与SEQ ID NO:21-30和309-314中的任何一个具有至少70%序列同一性的氨基酸序列。
在一些实施方案中,该方法进一步包括使葫芦二烯醇与重组宿主细胞接触,其中该重组宿主细胞包含编码细胞色素P450的基因。在一些实施方案中,接触导致产生11-葫芦二烯醇。在一些实施方案中,11-羟基葫芦二烯醇在包含编码CYP87D18或SgCPR蛋白的基因的细胞中表达。在一些实施方案中,CYP87D18或SgCPR包含SEQ ID NO:315、872或874中列出的序列。在一些实施方案中,CYP87D18或SgCPR由SEQ ID NO:316、871或873编码。在一些实施方案中,葫芦二烯醇由重组宿主细胞产生。在一些实施方案中,编码细胞色素P450的基因包含一种核酸序列,该序列与SEQ ID NO:31-48、316、431、871、873、875、877、879、881、883、885、887和891中任何一个的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,细胞色素P450包含一种氨基酸序列,该序列与SEQ ID NO:31-48、316、431、871、873、875、877、879、881、883、885、887和891具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,P450多肽在基因中编码,该基因包含SEQ ID NOs:31-48、316、431、871、873、875、877、879、881、883、885、887和891中任何一个所示的序列。
在一些实施方案中,该方法进一步包括将2,3-氧化角鲨烯与重组宿主细胞接触,其中该重组宿主细胞包含编码葫芦二烯醇合酶的第七基因。在一些实施方案中,葫芦二烯醇合酶包含SEQ ID NO:70-73、75-77、319、321、323、325、327-333、420、422、424、426、446、902、904或906中所示的一种氨基酸序列。在一些实施方案中,葫芦二烯醇合酶由SEQ IDNO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905中所示的任何一个序列编码。在一些实施方案中,接触产生葫芦二烯醇。在一些实施方案中,由重组宿主细胞产生2,3-氧化角鲨烯。在一些实施方案中,2,3-氧化鲨烯或二环氧角鲨烯由包含SEQID NO:898或900中所示的序列的酶产生。在一些实施方案中,通过由SEQ ID NO:897或899所示的核酸序列编码的酶产生2,3-氧化角鲨烯或二环氧角鲨烯。
在一些实施方案中,葫芦二烯醇合酶由包含SEQ ID NO:74所示序列的基因编码。在一些实施方案中,葫芦二烯醇合酶由包含以下任一核酸序列的基因编码:SEQ ID NO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905。在一些实施方案中,细胞产生11-羟基葫芦二烯醇。在一些实施方案中,11-羟基葫芦二烯醇(11-OHcucurbitadienol)在包含编码CYP87D18或SgCPR蛋白的基因的细胞中表达。在一些实施方案中,CYP87D18或SgCPR包含SEQ ID NO:315、872或874中的序列。在一些实施方案中,CYP87D18或SgCPR由SEQ ID NO:316、871或873编码。在一些实施方案中,葫芦二烯醇合酶多肽包含C末端部分,其包含SEQ ID NO:73所示的序列。在一些实施方案中,编码葫芦二烯醇合酶多肽的基因是密码子优化的。在一些实施方案中,密码子优化的基因包含SEQ ID NO:74所示的核酸序列。在一些实施方案中,葫芦二烯醇合酶包含与SEQ ID NO:70-73、75-77、319、321、323、325、327-333、420、422、424、426、446、902、904和906(例如包括来自美洲南瓜(C pepo)、罗汉果(S grosvenorii)、黄瓜(C sativus)、厚皮甜瓜(C melo)、中国南瓜(Cmoschata)和笋瓜(Cmaxim)的葫芦二烯醇合酶)中的任一个具有至少70%序列同一性的氨基酸序列。在一些实施方案中,葫芦二烯醇合酶多肽包含C末端部分,该C末端部分包含SEQID NO:73所示的序列。在一些实施方案中,编码葫芦二烯醇合酶多肽的基因是密码子优化的。在一些实施方案中,密码子优化的基因包含SEQ ID NO:74中列出的核酸序列。在一些实施方案中,葫芦二烯醇合酶包含一种氨基酸,该氨基酸包含来自百脉根(Lotus japonicas)(BAE53431)、毛果杨(Populus trichocarpa)(XP_002310905)、黑升麻(Actaea racemosa)(ADCWO84219)、白桦(Betula platyphylla)(BAB83085)、光果甘草(Glycyrrhiza glabra)(BAA76902)、葡萄(Vitis vinifera)(XP_002264289)、积雪草(Centella asiatica)(AAS01524)、人参(Panax ginseng)(BAA33460)和白桦(Betula platyphylla)(BAB83086)的多肽,如WO 2016/050890中描述,在此其全部内容以引用方式并入。
在一些实施方案中,该方法包括使角鲨烯与重组宿主细胞接触,其中该重组宿主细胞包含编码角鲨烯环氧酶的第八基因。在一些实施方案中,接触产生2,3-氧化角鲨烯。在一些实施方案中,角鲨烯由重组宿主细胞产生。在一些实施方案中,角鲨烯环氧酶包含一种氨基酸序列,该序列与SEQ ID NO:50-56、60、61、334或335具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。
在一些实施方案中,该方法包括使法呢基焦磷酸与重组宿主细胞接触,其中该重组宿主细胞包含编码鲨烯合酶的第九基因。在一些实施方案中,接触导致角鲨烯的产生。在一些实施方案中,法呢基焦磷酸由重组宿主细胞产生。在一些实施方案中,角鲨烯合酶包含一种氨基酸序列,该序列与SEQ ID NO:69或336具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。
在一些实施方案中,该方法进一步包括使香叶基-PP与重组宿主细胞接触,其中所述重组宿主细胞包含编码法呢基-PP合酶的第十基因。在一些实施方案中,接触导致法呢基-PP的产生。在一些实施方案中,香叶基-PP由重组宿主细胞产生。在一些实施方案中,法呢基-PP合酶包含与SEQ ID NO:338具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围序列同一性的氨基酸序列。在一些实施方案中,第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个与异源启动子可操作地连接。在一些实施方案中,异源启动子是CMV、EF1a、SV40、PGK1、人β-肌动蛋白、CAG、GAL1、GAL10、TEF1、GDS、ADH1、CaMV35S、Ubi、T7、T7lac、Sp6、araBAD、trp、Lac、Ptac、pL启动子或其组合。在一些实施方案中,启动子是诱导型、阻遏型或组成型启动子。在一些实施方案中,在重组宿主细胞中丙酮酸,乙酰基辅酶A,柠檬酸和TCA循环中间体中的一种或多种的产生被上调。在一些实施方案中,在重组宿主细胞中细胞质定位已被上调。在一些实施方案中,第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个包含编码2A自裂肽的至少一个序列。如本文所使用的,术语第一、第二、第三、第四、第五、第六、第七、第八、第九、第十等和类似的术语,不推断特定顺序和/或存在较早编号的要求。例如,本文所述的重组宿主细胞可包含第一基因和第三基因,但不包含第二基因。作为另一个例子,重组宿主细胞可包含第一基因、第五基因和第十基因,但不包含第二基因、第三基因、第四基因、第六基因、第七基因、第八基因和第九个基因。
重组宿主细胞可以是例如植物、双壳类、鱼类、真菌、细菌或哺乳动物的细胞。例如,植物选自罗汉果属(Siraitia)、苦瓜属(Momordica)、绞股蓝属(Gynostemma)、南瓜属(Cucurbita)、黄瓜属(Cucumis)、拟南芥属(Arabidopsis)、蒿属(Artemisia)、甜菊属(Stevia)、人参属(Panax)、睡茄属(Withania)、大戟属(Euphorbia)、苜蓿属(Medicago)、吊兰属(Chlorophytum)、五加属(Eleutherococcus)、楤木属(Aralia)、桑属(Morus)、苜蓿属(Medicago)、桦木属(Betula)、黄芪属(Astragalus)、麻疯树属(Jatropha)、山茶属(Camellia)、韧伞属(Hypholoma)、曲霉属(Aspergillus)、茄属(Solanum)、石杉属(Huperzia)、孩儿参属(Pseudostellaria)、黄麻属(Corchorus)、常春藤属(Hedera)、地钱属(Marchantia)和桑属(Morus)。在一些实施方案中,真菌选自毛癣菌属(Trichophyton)、桑黄孔菌属(Sanghuangporus)、樟芝属(Taiwanofungus)、链疫孢属(Moniliophthora)、盘二孢属(Marssonina)、色二孢属(Diplodia)、微香菇属(Lentinula)、法夫酵母属(Xanthophyllomyces)、普可尼亚属(Pochonia)、炭疽菌属(Colletotrichum)、间座壳属(Diaporthe)、组织胞浆菌属(Histoplasma)、球孢子菌属(Coccidioides)、组织胞浆菌属(Histoplasma)、桑黄孔菌属(Sanghuangporus)、短梗霉属(Aureobasidium)、普可尼亚属(Pochonia)、青霉属(Penicillium)、孢子丝菌属(Sporothrix)、黑僵菌属(Metarhizium)、曲霉属(Aspergillus)、耶氏酵母属(Yarrowia)和油脂酵母属(Lipomyces)。在一些实施方案中,所述真菌是构巢曲霉(Aspergillus nidulans)、解脂耶氏酵母(Yarrowialipolytica)或圆红冬孢酵母菌(Rhodosporin toruloides)。在一些实施方案中,重组宿主细胞是酵母细胞。在一些实施方案中,所述酵母选自假丝酵母属(Candida)、酵母属(Sacccharaomyces)、酵母亚门(Saccharomycotina)、外囊菌亚门(Taphrinomycotina)、裂殖酵母纲(Schizosaccharomycetes)、毕赤酵母属(Komagataella)、担子菌门(Basidiomycota)、伞菌亚门(Agaricomycotina)、银耳纲(Tremellomycetes)、柄锈菌亚门(Pucciniomycotina)、短梗霉属(Aureobasidium)、锥毛壳属(Coniochaeta)、红冬孢酵母属(Rhodosporidium)和微球黑粉菌纲(Microboryomycetes)。在一些实施方案中,细菌选自弗兰克氏菌属(Frankia)、放线菌门(Actinobacteria)、链霉菌属(Streptomyces)和肠球菌属(Enterococcus),在一些实施方案中,细菌是粪肠球菌(Enterococcus faecalis)。在一些实施方案中,已经对第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个进行密码子优化,以在细菌、哺乳动物、植物、真菌或昆虫的细胞中表达。在一些实施方案中,第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个包含对所编码酶的活性增加的功能性突变。在一些实施方案中,培养重组宿主细胞包括监测培养条件的pH、溶解氧水平、氮水平或其组合。在一些实施方案中,该方法包括分离化合物1。在一些实施方案中,分离化合物1包括裂解重组宿主细胞。在一些实施方案中,分离化合物1包括从培养基分离化合物1。在一些实施方案中,该方法包括纯化化合物1。在一些实施方案中,纯化化合物1包括HPLC、固相萃取或其组合。在一些实施方案中,纯化包括收获重组细胞,保存上清液并裂解细胞。在一些实施方案中,裂解包括使细胞经受剪切力或洗涤剂洗涤,从而获得裂解物。在一些实施方案中,剪切力来自超声法、高压细胞裂解(frenchpressurized cells)或珠子。在一些实施方案中,包括将裂解物进行过滤和纯化步骤。在一些实施方案中,通过固相萃取来过滤和纯化裂解物。
在一些实施方案中,提供了具有以下结构(1)的化合物1:
其中该化合物通过本文提供的任一种替代方法产生。
在一些实施方案中,细胞裂解物包含具有以下结构(1)的化合物1:
在一些实施方案中,重组细胞包含具有以下结构(1)的化合物1:
以及一种编码酶的基因,该酶能够催化从罗汉果苷IIIE产生化合物1。在一些实施方案中,该基因是重组细胞的异源基因。
在一些实施方案中,重组细胞包含编码第一酶的第一基因,该第一酶能够催化从罗汉果苷IIIE产生具有以下结构(1)的化合物1:
在一些实施方案中,第一酶包含一种氨基酸序列,该序列与SEQ ID NO:1、3、78-101、148或154(CGTase)的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,第一酶包含SEQ ID NO:1、3、78-101、148或154(CGTase)的氨基酸序列。在一些实施方案中,第一酶是葡聚糖蔗糖酶。在一些实施方案中,葡聚糖蔗糖酶包含或由一种氨基酸序列组成,所述氨基酸序列与SEQ ID NO:2、103、106-110、156和896中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,葡聚糖蔗糖酶包含或由SEQ ID NO:2、103、104或105的氨基酸序列组成。在一些实施方案中,葡聚糖蔗糖酶包含或由SEQ ID NO:2、103-110和156-162和896中任一个的氨基酸序列组成。在一些实施方案中,DexT包含SEQ ID NO:104或105所示的核酸序列。在一些实施方案中,第一酶是转葡糖苷酶。在一些实施方案中,转葡糖苷酶包含一种氨基酸序列,该氨基酸序列与SEQ ID NO:201或SEQ ID NO:291的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个序列之间范围的序列同一性。在一些实施方案中,重组细胞还包含编码尿苷二磷酸-葡萄糖基转移酶(UGT)的第二基因。在一些实施方案中,UGT包含一种氨基酸序列,该序列与SEQ ID NO:4、5、6、7、8、9、15、16、17、18和19中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个序列之间范围的序列同一性。在一些实施方案中,UGT包含或由SEQ ID NO:4、5、6、7、8、9、15、16、17和18任何一个组成。在一些实施方案中,UGT由UGT1495(SEQ ID NO:10),UGT1817(SEQ IDNO:11),UGT5914(SEQ ID NO:12),UGT8468(SEQ ID NO:13)或UGT10391(SEQ ID NO:14)中所示的序列编码。在一些实施方案中,细胞包含编码UGT98或UGT SK98的第三基因。在一些实施方案中,UGT98或UGT SK98包含一种氨基酸序列,该序列与SEQ ID NO:9、407或16的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,细胞包含编码环氧化物水解酶的第四基因。在一些实施方案中,环氧化物水解酶包含一种氨基酸序列,该序列与SEQ ID NO:21-30和309-314中任一项的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,细胞包含编码P450的第五序列。在一些实施方案中,P450包含一种氨基酸序列,该序列与SEQ ID NO:20、49、308、315或317序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,P450由包含SEQ ID NO:31-48、316、431、871、873、875、877、879、881、883、885、887和891中任一个序列的基因编码。在一些实施方案中,还包含编码葫芦二烯醇合酶的第六序列。在一些实施方案中,葫芦二烯醇合酶包含一种氨基酸序列,该序列与SEQ ID NO:70-73、75-77、319、321、323、325、327-333、420、422、424、426、446、902、904和906中的任何一个的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,葫芦二烯醇合酶多肽包含一个C端部分,该C端部分包含SEQ ID NO:73所示的序列。在一些实施方案中,编码葫芦二烯醇合酶多肽的基因是密码子优化的。在一些实施方案中,密码子优化的基因包含SEQ ID NO:74所示的核酸序列。在一些实施方案中,细胞还包含编码角鲨烯环氧酶的第七基因。在一些实施方案中,角鲨烯环氧酶包含一种氨基酸序列,该序列与SEQ ID NO:50-56、60、61、334和335中的任一个的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,细胞进一步包含编码角鲨烯合酶的第八基因。在一些实施方案中,第八基因包含一种氨基酸序列,该序列与SEQ ID NO:69或SEQ ID NO:336的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,细胞进一步包含编码法呢基-PP合酶的第九基因。在一些实施方案中,法呢基-PP合酶包含与SEQ ID NO:338序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围序列同一性的氨基酸序列。在一些实施方案中,细胞是哺乳动物、细菌、真菌或昆虫的细胞。在一些实施方案中,所述细胞是酵母细胞。酵母的非限制性实例包括假丝酵母属(Candida)、酵母属(Sacccharaomyces)、酵母亚门(Saccharomycotina)、外囊菌亚门(Taphrinomycotina)、裂殖酵母纲(Schizosaccharomycetes)、毕赤酵母属(Komagataella)、担子菌门(Basidiomycota)、伞菌亚门(Agaricomycotina)、银耳纲(Tremellomycetes)、柄锈菌亚门(Pucciniomycotina)、短梗霉属(Aureobasidium)、锥毛壳属(Coniochaeta)和微球黑粉菌纲(Microboryomycetes)。在一些实施方案中,所述植物选自由罗汉果属(Siraitia)、苦瓜属(Momordica)、绞股蓝属(Gynostemma)、南瓜属(Cucurbita)、黄瓜属(Cucumis)、拟南芥属(Arabidopsis)、蒿属(Artemisia)、甜菊属(Stevia)、人参属(Panax)、睡茄属(Withania)、大戟属(Euphorbia)、苜蓿属(Medicago)、吊兰属(Chlorophytum)、五加属(Eleutherococcus)、楤木属(Aralia)、桑属(Morus)、苜蓿属(Medicago)、桦木属(Betula)、黄芪属(Astragalus)、麻疯树属(Jatropha)、山茶属(Camellia)、韧伞属(Hypholoma)、曲霉属(Aspergillus)、茄属(Solanum)、石杉属(Huperzia)、孩儿参属(Pseudostellaria)、黄麻属(Corchorus)、常春藤属(Hedera)、地钱属(Marchantia)和桑属(Morus)。在一些实施方案中,真菌为毛癣菌属(Trichophyton)、桑黄孔菌属(Sanghuangporus)、樟芝属(Taiwanofungus)、链疫孢属(Moniliophthora)、盘二孢属(Marssonina)、色二孢属(Diplodia)、微香菇属(Lentinula)、法夫酵母属(Xanthophyllomyces)、普可尼亚属(Pochonia)、炭疽菌属(Colletotrichum)、间座壳属(Diaporthe)、组织胞浆菌属(Histoplasma)、球孢子菌属(Coccidioides)、组织胞浆菌属(Histoplasma)、桑黄孔菌属(Sanghuangporus)、短梗霉属(Aureobasidium)、普可尼亚属(Pochonia)、青霉属(Penicillium)、孢子丝菌属(Sporothrix)或黑僵菌属(Metarhizium)。
在一些实施方案中,细胞包含SEQ ID NO:897、899、909、911、913、418、421、423、425、427、871、873、901、903或905中任一个所示酶的序列。在一些实施方案中,该酶包含SEQID NO:420、422、424、426、446、872、874-896、898、900、902、904、906、908、910、912和951-1012中的序列或由该序列编码的序列。
在一些实施方案中,可以通过基因合成获得DNA。例如,可以通过Genescript或IDT执行此操作。可以通过标准分子生物学技术将DNA克隆到过表达载体中,例如:pQE1,pGEX-4t3,pDest-17,pET系列,pFASTBAC。大肠杆菌宿主菌株可用于产生酶(即Top10或BL21系列+/-密码子plus),使用1mM IPTG在OD600为1时诱导。大肠杆菌菌株可在37℃,250rpm繁殖并在诱导过程中切换到室温或30℃(150转/分)。当指示时,也可以使用pFASTBAC和优化的MOI通过SF9昆虫细胞系表达某些酶。含酶的粗提物可通过超声处理产生,并用于本文所述的反应。所有的UDP-糖基转移酶反应都含有蔗糖合酶,可以通过基因合成从拟南芥(A.thaliana)中获得并在大肠杆菌中表达。
在一些实施方案中,高糖基化罗汉果苷可以被水解以产生化合物1。高糖基化罗汉果苷的非限制性实例包括罗汉果苷V、赛门苷I、罗汉果苷IVE、异罗汉果苷V、罗汉果苷IIIE、11-脱氧-罗汉果苷V、11-氧代-罗汉果苷V、罗汉果苷VI、罗汉果苷IVA、罗汉果苷IIA、罗汉果苷IIA1、罗汉果苷IIA2、罗汉果苷IA、11-氧代-罗汉果VI、11-氧代-罗汉果IIIE、11-氧代-罗汉果IVE、罗汉果苷IE、罗汉果醇、11-氧代-罗汉果醇、罗汉果苷IIE、罗汉果苷IIIA2和罗汉果苷III。能够催化水解过程以产生化合物1的酶可以是,例如,CGT酶(例如,显示出没有淀粉的水解)、纤维素酶、β-葡糖苷酶、转葡糖苷酶、淀粉酶、果胶酶、葡聚糖酶和真菌乳糖酶。表1列出了其中一些酶的氨基酸序列和编码其中一些酶的核酸序列。
在一些实施方案中,化合物1显示出对重组细胞中水解酶的耐受性,其中所述水解酶显示出将罗汉果苷VI、罗汉果苷V、罗汉果苷IV水解为罗汉果苷IIIE的能力。由于其对水解的耐受性,化合物1中存在的α-连接的糖苷相对于其他罗汉果苷(β-连接的糖苷)具有独特的优势。在化合物1的微生物生产过程中,重组宿主细胞(例如,微生物宿主细胞)可以将不需要的β-连接的罗汉果糖苷水解回罗汉果糖苷IIIE。不受任何特定理论的束缚,我们认为,宿主细胞的水解可由于以下原因而提高化合物1的纯度:1)降低不需要的罗汉果苷VI、罗汉果苷V和罗汉果苷IV的水平,和/或2)水解将会增加可用于生产化合物1的前体的罗汉果苷IIIE的量。
一些实施方案包括分离罗汉果苷化合物,例如化合物1。在一些实施方案中,分离化合物1包括裂解重组宿主细胞。在一些实施方案中,分离化合物1包括从培养基分离化合物1。在一些实施方案中,该方法进一步包括纯化化合物1。在一些实施方案中,纯化化合物1包括HPLC、固相萃取或其组合。在一些实施方案中,纯化包括收获重组细胞,保存上清液并裂解细胞。在一些实施方案中,裂解包括使细胞经受剪切力或洗涤剂洗涤,从而获得裂解物。在一些实施方案中,剪切力来自超声法、高压细胞裂解或珠子。在一些实施方案中,将裂解物进行过滤和纯化步骤。在一些实施方案中,通过固相萃取过滤和纯化裂解物。然后可以将裂解物过滤并用硫酸铵处理以除去蛋白质,并C18 HPLC(5X10cm Atlantis prep T3 OBD色谱柱,5um,Waters)过滤,在30分钟内使用10→30%B的A/B梯度(A=水B=乙腈)进行注射,并用95%B洗涤,然后重新平衡在1%(总运行时间=42分钟)。可以以30mL/馏分的速度将其收集在去皮重的试管中(12馏分/板,每次3板)。裂解物也可以离心去除固体和颗粒物。然后将板在Geneva HT12/HT24中干燥。预期所需化合物与其他异构体一起在馏分21中洗脱。合并的馏分可以在在氟苯基HPLC柱(3x10cm,Xselect氟苯基OBD柱,5um,Waters)上,在35分钟内使用15→30%B的A/B梯度(A=水,B=乙腈)用95%B洗涤,然后重新平衡在15%(总运行时间=45分钟),在47次运行中进一步分馏。每次运行以30mL/馏分收集在12个去皮重的试管中(12馏分/板,每次1个板)。可以根据UPLC分析合并含有所需峰和所需纯度的馏分,并在减压下干燥,得到白色粉末状固体。可以将纯化合物重新悬浮/溶解在10mL水中,然后冻干以获得至少95%的纯度。
为了纯化化合物1,在一些实施方案中,可以通过固相萃取来纯化化合物,可以不需要HPLC。可以将化合物1纯化至例如约70%、80%、90%、95%、98%、99%或100%的纯度或在任何上述两个值所描述的范围内的任何纯度。在一些实施方案中,通过固相萃取纯化的化合物1与HPLC纯化的纯度相同或基本相同。在一些实施方案中,该方法包括在HPLC柱上分离来自重组细胞的裂解物,并收集包含化合物1的洗脱级分。
宿主细胞可以如本文所述进行发酵以生产化合物1。这还可以包括例如在有空气或没有空气的情况下进行,并且可以在例如厌氧环境中进行的方法。整个细胞(例如重组宿主细胞)可以在发酵液中或在反应缓冲液中。
僧果(Monk fruit(罗汉果(Siraitia grosvenorii)))提取物也可以用于接触细胞以制备化合物1。在一些实施方案中,提供了产生化合物1的方法。该方法可以包括使僧果提取物与能够催化从罗汉果苷产生化合物1的第一酶接触。罗汉果苷例如罗汉果苷V、赛门苷I、罗汉果苷IVE、异罗汉果苷V、罗汉果苷IIIE、11-脱氧-罗汉果苷V、11-氧代-罗汉果苷V、罗汉果苷VI、罗汉果苷IVA、罗汉果苷IIA、罗汉果苷IIA1、罗汉果苷IIA2、罗汉果苷IA、11-氧代-罗汉果苷VI、11-氧代-罗汉果苷IIIE、11-氧代-罗汉果苷IVE、罗汉果苷IE、罗汉果醇、11-氧代-罗汉果醇、罗汉果苷IIE、罗汉果苷IIIA2和罗汉果苷III。在一些实施方案中,接触包括使罗汉果醇提取物与包含编码第一酶的第一基因的重组宿主细胞接触。在一些实施方案中,第一基因对于重组宿主细胞是异源的。在一些实施方案中,罗汉果醇提取物在包含编码第一酶的第一多核苷酸的重组宿主细胞中与第一酶接触。在一些实施方案中,罗汉果苷IIIE在罗汉果醇提取物中。在一些实施方案中,罗汉果苷IIIE也由重组宿主细胞产生。在一些实施方案中,该方法进一步包括在表达第一酶的条件下在培养基中培养重组宿主细胞。在一些实施方案中,第一酶是UDP糖基转移酶、环麦芽糊精葡聚糖转移酶(CGTases)、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。在一些实施方案中,第一酶是CGTase。例如,CGTase可包含一种氨基酸序列,该序列与SEQ ID NO:SEQ ID NO:1、3、78-101、148和154中任何一个具有至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或更多的序列同一性。在一些实施方案中,CGTase包含SEQ ID NO:SEQ ID NO:1、3、78-101、148和154中任一个的氨基酸序列。在一些实施方案中,CGTase包含SEQ ID NO:78-101中任一个的氨基酸序列。在一些实施方案中,第一酶是葡聚糖蔗糖酶。在一些实施方案中,葡聚糖蔗糖酶包含一种氨基酸序列,该序列与SEQ IDNO:2、103、106-110、156和896中所示的任何一个序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,葡聚糖蔗糖酶包含SEQ ID NO:2、103、106-110、156和896中任何一个的氨基酸序列。在一些实施方案中,第一酶是转葡糖苷酶。在一些实施方案中,转葡糖苷酶包含一种氨基酸序列,该序列与SEQ ID NO:163-290和723中任一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,转葡糖苷酶包含SEQ ID NO:163-290和723中任一个的氨基酸序列。在一些实施方案中,第一酶是β-葡糖苷酶。在一些实施方案中,β-葡糖苷酶包含一种氨基酸序列,该序列与SEQ IDNO:292具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,罗汉果醇提取物包含罗汉果苷IIA,重组宿主细胞包含第二基因,其编码能够催化罗汉果苷IIA以产生罗汉果苷IIIE的第二酶。在一些实施方案中,罗汉果苷IIA也由重组宿主细胞产生。在一些实施方案中,第二酶是UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。在一些实施方案中,第二酶是尿苷二磷酸-葡萄糖基转移酶(UGT)。在一些实施方案中,UGT是UGT73C3(SEQ ID NO:4)、UGT73C6(SEQ ID NO:5、444或445)、85C2(SEQ ID NO:6)、UGT73C5(SEQ ID NO:7)、UGT73E1(SEQ ID NO:8)、UGT98(SEQ IDNO:9或407)、UGT1576(SEQ ID NO:15)、UGT SK98(SEQ ID NO:16)、UGT430(SEQ ID NO:17)、UGT1697(SEQ ID NO:18)、UGT11789(SEQ ID NO:19),或包含一种氨基酸序列,该序列与UGT73C3(SEQ ID NO:4)、UGT73C6(SEQ ID NO:5、444或445)、85C2(SEQ ID NO:6)、UGT73C5(SEQ ID NO:7)、UGT73E1(SEQ ID NO:8)、UGT98(SEQ ID NO:9或407)、UGT1576(SEQ ID NO:15)、UGT SK98(SEQ ID NO:16)、UGT430(SEQ ID NO:17)、UGT1697(SEQ ID NO:NO:18),UGT11789(SEQ ID NO:19)具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,UGT由UGT1495(SEQ ID NO:10)、UGT1817(SEQ ID NO:11)、UGT5914(SEQ ID NO:12)、UGT8468(SEQ ID NO:13)或UGT10391(SEQ ID NO:14)中的基因编码。在一些实施方案中,僧果提取物包含罗汉果醇。在一些实施方案中,该方法进一步包括使僧果提取物的罗汉果醇接触,其中重组宿主细胞进一步包含一种或多种编码一种或多种能够催化从罗汉果醇产生罗汉果苷IIIE的酶的基因。在一些实施方案中,罗汉果醇也由重组宿主细胞产生。在一些实施方案中,所述一种或多种酶包括UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。在一些实施方案中,第二酶是尿苷二磷酸-葡萄糖基转移酶(UGT)。在一些实施方案中,UGT是UGT73C3、UGT73C6、85C2、UGT73C5、UGT73E1、UGT98、UGT1495、UGT1817、UGT5914、UGT8468、UGT10391、UGT1576、UGT SK98、UGT430、UGT1697或UGT11789,或包含一种氨基酸序列,该序列与上述UGT的序列具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个数字之间的范围的序列同一性。在一些实施方案中,该方法进一步包括使僧果提取物与重组宿主细胞接触以产生罗汉果苷IIIE,其中重组宿主细胞还包含一种或多种编码一种或多种能够催化从罗汉果苷化合物产生罗汉果IIIE的酶的基因,其中罗汉果苷化合物是罗汉果苷IA1、罗汉果苷IE1、罗汉果苷IIA1、罗汉果苷IIE、罗汉果苷IIA、罗汉果苷IIIA1、罗汉果苷IIIA2、罗汉果苷III、罗汉果苷IV、罗汉果苷IVA、罗汉果苷V或赛门苷中的一种或多种。在一些实施方案中,重组宿主细胞还产生罗汉果苷化合物。在一些实施方案中,所述一种或多种酶包括UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。在一些实施方案中,罗汉果苷化合物是罗汉果苷IIE。在一些实施方案中,一种或多种酶包含由SEQ ID NO:293-303中的任一个所示的氨基酸。在一些实施方案中,罗汉果苷化合物是罗汉果苷IIA或罗汉果苷IIE,其中使僧果提取物与表达一种或多种酶的重组细胞接触可产生罗汉果苷IIIA、罗汉果苷IVE和罗汉果苷V。在一些实施方案中,一种或多种酶包含SEQ ID NO:304中所示的氨基酸。在一些实施方案中,一种或多种酶由SEQ ID NO:305中所示的序列编码。在一些实施方案中,僧果提取物包含罗汉果苷IA1。在一些实施方案中,该方法进一步包括使僧果提取物与重组宿主细胞接触,其中重组宿主细胞包含编码UGT98或UGT SK98的基因。在一些实施方案中,UGT98或UGT SK98酶包含氨基酸序列,该氨基酸序列与SEQ ID NO:9、407、16或306具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,UGT98由SEQ ID NO:307所示的序列编码。在一些实施方案中,接触导致产生罗汉果苷IIA在细胞中。在一些实施方案中,僧果提取物包含11-羟基-24,25环氧葫芦二烯醇。在一些实施方案中,该方法进一步包括使僧果提取物与重组宿主细胞接触,其中该重组宿主细胞还包含编码环氧化物水解酶的第三基因。在一些实施方案中,重组宿主细胞也产生11-羟基-24,25环氧葫芦二烯醇。在一些实施方案中,该方法进一步包括使僧果提取物与重组宿主细胞接触,其中该重组宿主细胞包含编码细胞色素P450或环氧化物水解酶的第四基因。在一些实施方案中,所述11-羟基-葫芦二烯醇也由重组宿主细胞产生。在一些实施方案中,僧果提取物包含3,24,25三羟基葫芦二烯醇。在一些实施方案中,该方法进一步包括使僧果提取物与重组宿主细胞接触,其中该重组宿主细胞进一步包含编码细胞色素P450的第五基因。在一些实施方案中,3,24,25三羟基葫芦二烯醇也由重组宿主细胞产生。在一些实施方案中,与罗汉果醇提取物接触导致在重组宿主细胞中产生罗汉果醇。在一些实施方案中,细胞色素P450包含一种氨基酸序列,该序列与SEQ ID NO:20或308具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,环氧化物水解酶与SEQ ID NO:21-30和309-314中任何一个具有至少70%、70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,僧果提取物包含葫芦二烯醇。在一些实施方案中,该方法进一步包括使葫芦二烯醇与重组宿主细胞接触,其中该重组宿主细胞包含编码细胞色素P450的基因。在一些实施方案中,所述接触导致产生11-羟基葫芦二烯醇。在一些实施方案中,所述11-羟基葫芦二烯醇在包含编码CYP87D18或SgCPR蛋白的基因的细胞中表达。在一些实施方案中,CYP87D18或SgCPR包含SEQ ID NO:315、872或874中的序列。在一些实施方案中,CYP87D18或SgCPR由SEQ ID NO:316、871或873编码。在一些实施方案中,葫芦二烯醇也由重组宿主细胞产生。在一些实施方案中,编码细胞色素P450的基因包含一种核酸序列,该序列与SEQ ID NO:31-48、316、431、871、873、875、877、879、881、883、885、887和891中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,细胞色素P450包含一种氨基酸序列,该序列与SEQ IDNO:20或49具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,僧果提取物包含2,3-氧化角鲨烯。在一些实施方案中,该方法进一步包括使僧果提取物的2,3-氧化角鲨烯与重组宿主细胞接触,其中所述重组宿主细胞包含编码葫芦二烯醇合酶的第七基因。在一些实施方案中,葫芦二烯醇合酶包含一种氨基酸序列,该序列与SEQ ID NO:70-73、75-77、319、321、323、325、327-333、420、422、424、426、446、902、904或906具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,葫芦二烯醇合酶被一种序列编码,该序列与SEQ ID NO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903或905具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,僧果提取物包含罗汉果苷中间体,例如罗汉果苷V、赛门苷I、罗汉果苷IVE、异罗汉果苷V、罗汉果苷IIIE、11-脱氧-罗汉果苷V、11-氧代-罗汉果苷V、罗汉果苷VI、罗汉果苷IVA、罗汉果苷IIA、罗汉果苷IIA1、罗汉果苷IIA2、罗汉果苷IA、11-氧代-罗汉果苷VI、11-氧代-罗汉果苷IIIE、11-氧代-罗汉果苷IVE、罗汉果苷IE、罗汉果醇、11-氧代-罗汉果醇、罗汉果苷IIE、罗汉果苷IIIA2和罗汉果苷III。在一些实施方案中,所述方法进一步包括使罗汉果苷中间体与重组宿主细胞接触,其中所述重组宿主细胞包含编码葫芦二烯醇合酶的第七基因。在一些实施方案中,葫芦二烯醇合酶包含一种氨基酸序列,该序列与SEQ ID NO:70-73、75-77、319、321、323、325、327-333、420、422、424、426、446、902、904或906具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,葫芦二烯醇合酶由一种序列编码,该序列与SEQ ID NO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903或905具有至少70%、80%、85%、90的%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性。在一些实施方案中,所述接触产生葫芦二烯醇。在一些实施方案中,2,3-氧化鲨烯和二环氧角鲨烯也由重组宿主细胞产生。在一些实施方案中,2,3-氧化鲨烯或二环氧角鲨烯由包含一种序列的酶产生,该序列与SEQ IDNO:898或900具有与至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性,或包含SEQ ID NO:898或900所示的序列。在一些实施方案中,2,3-氧化角鲨烯或二环氧角鲨烯由一种核酸序列编码的酶产生,该核酸序列与SEQ IDNO:897或899具有至少70%、80%、85%、90%、95%、98%、99%、99%、100%或这些数字中任何两个之间范围的序列同一性,或由SEQ ID NO:897或899所示的核酸编码。
在一些实施方案中,葫芦二烯醇合酶包含一种氨基酸序列,该序列与SEQ ID NO:70-73、75-77、319、321、323、325、327-333、420、422、424、426、446、902、904和906中的任何一个至少具有70%、80%、85%、90%、95%、98%、99%、100%或其中任何两个数字之间范围的同一性。在一些实施方案中,葫芦二烯醇合酶是来自美洲南瓜(Cpepo)、罗汉果(Sgrosvenorii)、黄瓜(C sativus)、厚皮甜瓜(C melo)、中国南瓜(C moschata)或笋瓜(Cmaxim)的葫芦二烯醇合酶。在一些实施方案中,葫芦二烯醇合成酶由包含核酸序列的基因编码,所述核酸序列与SEQ ID NO:74、320、322、324、326、328、418、418、421、423、425、427、897、899、901、903和905中的任何一个具有至少、70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性,或由SEQ ID NO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905中任一序列所示的核酸序列编码。在一些实施方案中,11-OH葫芦二烯醇由该细胞产生。在一些实施方案中,11-OH葫芦二烯醇在包含编码CYP87D18或SgCPR的基因的细胞中表达。在一些实施方案中,CYP87D18或SgCPR包含一种序列,该序列与SEQ ID NO:315、872或874具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性,或包含SEQ ID NO:315、872或874中所示的序列。在一些实施方案中,CYP87D18或SgCPR由一种序列编码,该序列与SEQ ID NO:316、871或873具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间范围的序列同一性,或由SEQ ID NO:316、871或873中所示的序列编码。在一些实施方案中,僧果提取物含有角鲨烯。在一些实施方案中,由包含与SEQ IDNO:898或900具有至少70%、80%、85%、90%、95%、98%、99%或更高序列同一性的序列的酶产生2,3-氧化角鲨烯或二环氧角鲨烯,或由SEQ ID NO:898或900编码的酶产生。在一些实施方案中,2,3-氧化鲨烯或二环氧角鲨烯由一种核酸序列编码的酶产生,该序列与SEQID NO:897或899具有至少70%、80%、85%、90%、95%、98%、99%、100%或者在这些数字中任何两个之间范围的序列同一性,或由SEQ ID NO:897或897编码的酶。在一些实施方案中,该方法进一步包括使角鲨烯与重组宿主细胞接触,其中重组宿主细胞包含编码角鲨烯环氧酶的第八基因。在一些实施方案中,接触产生2,3-氧化角鲨烯。在一些实施方案中,角鲨烯也由重组宿主细胞产生。在一些实施方案中,角鲨烯环氧酶包含一种氨基酸序列,该序列与SEQ ID NO:50-56、60、61、334或335中的任何一个具有至少70%、80%、85%、90%、95%、98%、99%、100%或这些数字中任何两个之间的范围的序列同一性。在一些实施方案中,角鲨烯环氧化合物由SEQ ID NO:335中列出的核酸序列编码。在一些实施方案中,僧果提取物包含法呢基焦磷酸。在一些实施方案中,该方法进一步包括使法呢基焦磷酸与重组宿主细胞接触,其中该重组宿主细胞包含编码角鲨烯合酶的第九个基因。在一些实施方案中,接触产生角鲨烯。在一些实施方案中,法呢基焦磷酸也由重组宿主细胞产生。在一些实施方案中,角鲨烯合酶包含与SEQ ID NO:69和336中任何序列具有至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或更多的序列同一性的氨基酸序列。在一些实施方案中,角鲨烯合酶由包含SEQ ID NO:337所示核酸序列的序列编码。在一些实施方案中,僧果提取物包含香叶基-PP。在一些实施方案中,该方法还包括使香叶基-PP与重组宿主细胞接触,其中重组宿主细胞包括编码法呢基-PP合成酶的第十基因。在一些实施方案中,接触导致法呢基-PP的产生。在一些实施方案中,香叶基-PP也由重组宿主细胞产生。在一些实施方案中,法呢基-PP合成酶包含氨基酸序列,该氨基酸序列与SEQ ID No:338具有至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或更多的序列同一性。在一些实施方案中,法呢基-PP合酶由SEQ ID No:339中所示的核酸序列编码。在一些实施方案中,第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个可操作地连接到异源启动子。在一些实施方案中,异源启动子是CMV、EF1A、SV40、PGK1、人β-肌动蛋白、CAG、GAL1、GAL10、TEF1、GDS、ADH1、CaMV35s、Ubi、T7、T7lac、Sp6、araBAD、trp、lac、Ptac、pL启动子或其组合。在一些实施方案中,启动子是诱导型、阻遏型或组成型启动子。在一些实施方案中,丙酮酸盐、乙酰辅酶A、柠檬酸盐和TCA循环中间产物的一个或多个的产生在重组宿主细胞中被上调。在一些实施方案中,重组宿主细胞中的细胞质定位被上调。在一些实施方案中,第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个包含编码2A自裂肽的至少一个序列。在一些实施方案中,重组宿主细胞是植物、双壳类、鱼类、真菌、细菌或哺乳动物的细胞。在一些实施方案中,植物选自罗汉果属(Siraitia)、苦瓜属(Momordica)、绞股蓝属(Gynostemma)、南瓜属(Cucurbita)、黄瓜属(Cucumis)、拟南芥属(Arabidopsis)、蒿属(Artemisia)、甜菊属(Stevia)、人参属(Panax)、睡茄属(Withania)、大戟属(Euphorbia)、苜蓿属(Medicago)、吊兰属(Chlorophytum)、五加属(Eleutherococcus)、楤木属(Aralia)、桑属(Morus)、苜蓿属(Medicago)、桦木属(Betula)、黄芪属(Astragalus)、麻疯树属(Jatropha)、山茶属(Camellia)、韧伞属(Hypholoma)、曲霉属(Aspergillus)、茄属(Solanum)、石杉属(Huperzia)、孩儿参属(Pseudostellaria)、黄麻属(Corchorus)、常春藤属(Hedera)、地钱属(Marchantia)和桑属(Morus)。在一些实施方案中,真菌选自毛癣菌属(Trichophyton)、桑黄孔菌属(Sanghuangporus)、樟芝属(Taiwanofungus)、链疫孢属(Moniliophthora)、盘二孢属(Marssonina)、色二孢属(Diplodia)、微香菇属(Lentinula)、法夫酵母属(Xanthophyllomyces)、普可尼亚属(Pochonia)、炭疽菌属(Colletotrichum)、间座壳属(Diaporthe)、组织胞浆菌属(Histoplasma)、球孢子菌属(Coccidioides)、组织胞浆菌属(Histoplasma)、桑黄孔菌属(Sanghuangporus)、短梗霉属(Aureobasidium)、普可尼亚属(Pochonia)、青霉属(Penicillium)、孢子丝菌属(Sporothrix)、黑僵菌属(Metarhizium)、曲霉属(Aspergillus)、耶氏酵母属(Yarrowia)和油脂酵母属(Lipomyces)。在一些实施方案中,该真菌为构巢曲霉(Aspergillus nidulans)、解脂耶氏酵母(Yarrowia lipolytica)或圆红冬孢酵母菌(Rhodosporin toruloides)。在一些实施方案中,重组宿主细胞是酵母细胞。在一些实施方案中,酵母选自假丝酵母属(Candida)、酵母属(Sacccharaomyces)、酵母亚门(Saccharomycotina)、外囊菌亚门(Taphrinomycotina)、裂殖酵母纲(Schizosaccharomycetes)、毕赤酵母属(Komagataella)、担子菌门(Basidiomycota)、伞菌亚门(Agaricomycotina)、银耳纲(Tremellomycetes)、柄锈菌亚门(Pucciniomycotina)、短梗霉属(Aureobasidium)、锥毛壳属(Coniochaeta)、红冬孢酵母属(Rhodosporidium)和微球黑粉菌纲(Microboryomycetes)。在一些实施方案中,所述细菌选自由弗兰克氏菌属(Frankia)、放线菌门(Actinobacteria)、链霉菌属(Streptomyces)和肠球菌属(Enterococcus)。在一些实施方案中,所述细菌为粪肠球菌(Enterococcus faecalis)。在一些实施方案中,第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个已被优化以在细菌、哺乳动物、植物、真菌或昆虫细胞中表达。在一些实施方案中,第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个包含对所编码酶的活性增加的功能突变。在一些实施方案中,培养重组宿主细胞包括监测培养的pH、溶解氧水平、氮水平或培养条件的组合。在一些实施方案中,该方法包括分离化合物1。在一些实施方案中,分离化合物1包括裂解重组宿主细胞。在一些实施方案中,分离化合物1包括从培养基分离化合物1。在一些实施方案中,该方法还包括纯化化合物1。在一些实施方案中,纯化化合物1包括HPLC、固相萃取或其组合。在一些实施方案中,纯化进一步收获重组细胞,保存处理细胞的上清液并裂解细胞。在一些实施方案中,溶解包括使细胞受到剪切力或洗涤剂洗涤,从而获得溶解物。在一些实施方案中,剪切力来自超声法、高压细胞裂解(frenchpressurized cells)或珠子。在一些实施方案中,对裂解物进行过滤和纯化步骤。在一些实施方案中,通过固相萃取过滤和纯化裂解产物。在一些实施方案中,该方法还包括将僧果提取物第二或第三次添加到重组宿主细胞的生长培养基中。此外,该方法可通过将僧果提取物与重组细胞裂解物接触来进行,其中重组细胞裂解物包含本文所列的经表达的酶。
一般而言,本文中所公开和描述的化合物,单独或组合地可在诸如可摄取的组合物之类的组合物中提供。在一个实施方案中,如本文所公开和描述的化合物,单独或组合地可向可摄取组合物提供甜味。在其他实施方案中,本文中公开和描述的化合物可单独或组合地作为甜味剂以增强另一甜味剂的甜味性。通过将本文公开和描述的一种或多种化合物与甜味剂组合物中的一种或多种其他甜味剂组合,本文公开的化合物赋予甜味剂组合物更类似于糖的时间特性和/或风味特性。在另一个实施方案中,如本文所公开和描述的化合物,单独或组合地可通过将其组合物与如本文所公开和描述的化合物接触以形成经改性的组合物,从而增加或增强组合物的甜味。在另一个实施方案中,如本文所公开和描述的化合物,单独或组合地可以用在一种组合物中,该组合物调制在味蕾以外的身体中表达的甜味受体和/或其配体。
本文所用的“可摄取组合物”包括打算用于或不用于食用且可单独或与另一物质一起经口服用的任一物质。可摄取组合物包括“食物或饮料产品”和“非食物性产品”二者。“食物或饮料产品”意指打算供人类或动物食用的任一食物性产品,包括固体、半固体或液体(例如,饮料),还包括功能性食品(例如:任何声称具有促进健康和/或预防疾病特性的新鲜或加工食品,其营养功能超出了提供营养的基本营养功能)。术语“非食品或饮料产品”或“非食性组合物”包括可出于除食用或作为食物或饮料以外的目的由人类或动物口服的任一产品或组合物。例如,非食品或饮料产品或非食性组合物包括补充品、营养品、药品和非处方药、口腔护理产品,如牙膏和漱口水和口香糖。
在一些方面,本文公开的组合物还包含至少一种另外的甜味剂和/或甜味改良剂。所述的至少一种另外的甜味剂和/或甜味改良剂可以是人造甜味剂和/或甜味改良剂,或者是天然甜味剂和/或甜味改良剂。所述至少一种另外的甜味剂和/或甜味改良剂可以从由如下构成的群组中选出:合欢皂苷(abiziasaponin)、相思子三萜苷类(abrusosides)特别是相思子三萜苷A、相思子三萜苷B、相思子三萜苷C、相思子三萜苷D、乙酰舒泛钾(acesulfamepotassium)、爱德万甜(advantame)、合欢皂苷(albiziasaponin)、阿力甜(alitame)、阿斯巴甜(aspartame)、超级阿斯巴甜(superaspartame)、白云参苷类(bayunosides)特别是白云参苷1、白云参苷2,布拉齐因(brazzein),葫芦烷型三糖链糖苷(bryoside),葫芦烷型四糖链糖皂苷(bryonoside),异株泻根甜味甙(bryonodulcoside),肉质雪胆皂苷(carnosifloside),N-[[(3,5-二氯苯基)氨基][(二苯基甲基)氨基]亚甲基]甘氨酸(carrelame),仙茅甜蛋白(curculin),花青苷(cyanin),绿原酸,环己氨基磺酸酯及其盐,青钱柳苷I(cyclocaryoside I),二氢槲皮素-3-乙酸酯,二氢核黄素,杜尔可苷,gaudichaudioside,甘草甜素,甘草次酸(glycyrrhetin acid),七叶胆苷(gypenoside),苏木素、异罗汉果苷类特别是异罗汉果苷V,N-(4-氰苯基)-N-(2,3-亚甲二氧苄基)胍乙酸(lugduname),magap,马槟榔甜蛋白(mabinlins),神秘果蛋白(micraculin),罗汉果苷类(罗汉果)特别是罗汉果苷IV和罗汉果苷V,莫纳甜及其衍生物,莫奈林(monellin),无患子倍半萜苷,柚苷二氢查耳酮(NarDHC),新橙皮苷二氢查耳酮(NDHC),纽甜,欧亚水龙骨甜素(osladin),潘塔亭(pentadin),巴西甘草甜素I-V,紫苏葶(perillartine)、D-苯丙氨酸,糙苏苷(phlomisosides)特别是糙苏苷1、糙苏苷2、糙苏苷3、糙苏苷4,根皮苷,叶甜素(phyllodulcin),聚波朵苷类(polpodiosides),聚波朵苷A(polypodoside A)、蝶卡苷类(pterocaryosides),莱鲍迪苷类特别是莱鲍迪苷A、莱鲍迪苷B、莱鲍迪苷C、莱鲍迪苷D、莱鲍迪苷F、莱鲍迪苷G、莱鲍迪苷H、莱鲍迪苷M,甜叶悬钩子苷(rubusosides),糖精及其盐和衍生物,藤三七雪胆苷(scandenoside),蓨蕨素A(selligueain A),赛门苷类(siamenosides)特别是赛门苷I,甜叶菊、甜菊双糖苷、甜菊苷和其他的甜菊糖苷类,马来叉柱花素类(strogines)特别是马来叉柱花素1、马来叉柱花素2、马来叉柱花素4,甜茶苷A(suavioside A),甜茶苷B,甜茶苷G,甜茶苷H,甜茶苷I,甜茶苷J,三氯蔗糖,sucronate、sucrooctate,索马甜(talin),夜来香苷(telosmoside)A15,奇异果甜蛋白(thaumatin)特别是奇异果甜蛋白I和II,反式-大茴香脑,反式-肉桂醛,三叶苷,D-色氨酸,赤藓糖醇,半乳糖醇,氢化淀粉糖浆(包括麦芽糖醇糖浆和山梨醇糖浆),肌醇,异麦芽酮糖醇(isomalt)、乳糖醇,麦芽糖醇,甘露醇,木糖醇,阿拉伯糖,糊精,右旋糖,果糖,高果糖玉米糖浆,低聚果糖,低聚果糖糖浆,半乳糖,低聚半乳糖,葡萄糖,葡萄糖和(氢化)淀粉糖浆/水解物,异麦芽酮糖(isomaltulose),乳糖,水解乳糖,麦芽糖,甘露糖,鼠李糖,核糖,蔗糖,塔格糖,海藻糖和木糖。
本文公开还包括组合物,例如可摄取组合物,其包含本文所公开的罗汉果苷化合物中的一种或多种,包括但不限于化合物1和图43中所示的化合物。在一些实施方案中,可摄取组合物可以是饮料。例如,饮料可以选自增强型起泡饮料,可乐、柠檬-酸橙味起泡饮料、橙子味起泡饮料、葡萄味起泡饮料、草莓味起泡饮料、菠萝味起泡饮料、姜汁啤酒、根啤酒、果汁、水果味果汁、果汁饮料、蜜汁饮料、蔬菜汁、蔬菜味汁、运动饮料、能量饮料、强化水饮料、含维生素强化水、近水饮料、椰子水、茶类饮料、咖啡、可可饮料、含牛奶成分的饮料、含谷类提取物的饮料和冰沙。在一些实施方案中,饮料可以是软饮料。
一种“摄取可接收成分”是一种适于口服的物质,可与本文所述化合物结合形成可摄取组合物。取决于产品的预期用途,摄取可接收成分可以是任何形式,例如固体、半固体、液体、糊状物、凝胶、乳液、奶油、泡沫材料、悬浮液、溶液或其任何组合(例如含有固体成分的液体)。摄取可接收成分可以是人工的或天然的。摄取可接收成分包括许多常见的食物成分,如中性、酸性或碱性pH的水、水果或蔬菜汁、醋、腌料、啤酒、葡萄酒、天然水/脂肪乳液(如牛奶或炼乳)、食用油和起酥油、脂肪酸及其烷基酯,低分子量的丙二醇寡聚物、脂肪酸甘油酯和此类疏水物质在水介质中的分散液或乳液、盐(如氯化钠)、小麦粉、溶剂(如乙醇)、固体食用稀释剂(如植物粉或面粉)或其他液体载体;分散或悬浮助剂;表面活性剂;等渗剂;增稠剂或乳化剂、防腐剂;固体粘合剂;润滑剂等。
其他摄取可接受成分包括酸,包括但不限于柠檬酸、磷酸、抗坏血酸、硫酸钠、乳酸或酒石酸;苦味成分,包括例如咖啡因、奎宁、绿茶、儿茶素、多酚、罗布斯塔咖啡生豆提取物、咖啡生豆提取物,乳清蛋白分离物,或氯化钾;着色剂,包括例如焦糖色、红色#40、黄色#5、黄色#6、蓝色#1、红色#3、紫色胡萝卜、黑胡萝卜汁、紫甘薯、蔬菜汁、果汁、β胡萝卜素、姜黄姜黄素或二氧化钛;防腐剂,包括例如苯甲酸钠、苯甲酸钾、山梨酸钾、偏硫酸氢钠、山梨酸或苯甲酸;抗氧化剂,包括例如抗坏血酸、乙二胺四乙酸钙二钠、α-生育酚、混合生育酚、迷迭香提取物、葡萄籽提取物、白藜芦醇或六偏磷酸钠;维生素或功能性成分,包括例如白藜芦醇、Co-Q10、ω3脂肪酸、茶氨酸、氯化胆碱(胞磷胆碱(Citocoline))、纤维醇、菊粉(菊苣根)、牛磺酸、人参提取物、瓜拉那提取物、生姜提取物、L-苯丙氨酸、L-肉碱、L-酒石酸盐、D-葡萄糖醛酸内酯、肌醇、生物类黄酮、紫锥菊、银杏(Ginkgo Biloba)、马黛茶(yerbamate)、亚麻籽油、藤黄果(Garcinia cambogia)皮提取物、白茶提取物、核糖、奶蓟草(milkthistle)提取物、葡萄籽提取物、盐酸吡多醇(维生素B6)、氰钴胺(维生素B12)、烟酰胺(维生素B3)、生物素、乳酸钙、泛酸钙(泛酸)、磷酸钙、碳酸钙、氯化铬、多烟酸铬、硫酸铜、叶酸、焦磷酸铁、铁、乳酸镁、碳酸镁、硫酸镁、磷酸一钾、磷酸一钠、磷、碘化钾、磷酸钾、核黄素、硫酸钠、葡萄糖酸钠、聚磷酸钠、碳酸氢钠、硝酸硫胺、维生素D3、维生素A棕榈酸酯、葡萄糖酸锌、乳酸锌或硫酸锌;起云剂,包括例如酯胶、溴化植物油(BVO)或蔗糖乙酸异丁酸酯(SAIB);缓冲液,包括例如柠檬酸钠、柠檬酸钾或盐;调味料,包括例如丙二醇、乙醇、甘油、阿拉伯树胶(阿拉伯胶)、麦芽糊精、改性玉米淀粉,右旋糖,天然调味料,具有其他天然调味料的天然调味料(天然调味料WONF),天然和人造调味料,人造调味料,二氧化硅,碳酸镁,或磷酸三钙;稳定剂,包括例如果胶,黄原胶,羧甲基纤维素(CMC),聚山梨酯60,聚山梨酯80,中链甘油三酯,纤维素凝胶,纤维素胶,酪蛋白酸钠,改性食品淀粉,阿拉伯树胶(阿拉伯胶),或卡拉胶。
实施例
在下面的实施例中进一步详细地公开了上述实施方案的一些形态,这些实施例绝不旨在限制本公开的范围。
如本文所公开的,赛门苷I可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可以将赛门苷I水解以产生罗汉果苷IIIE,然后可用于制备化合物1。例如,用于制备赛门苷I的方法可以包括:使罗汉果醇与表达一种或多种UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶的重组宿主细胞接触。例如,可以使用表达来自棘孢曲霉(Aspergillusaculeatus)的果胶酶的重组细胞。
作为另一非限制性例子,用于产生赛门苷I的方法可包括:使罗汉果苷V、罗汉果苷IV
如本文公开的,罗汉果苷IV
作为另一实例,用于产生罗汉果苷IV
如本文公开的,罗汉果苷III
作为另一实例,用于产生罗汉果苷III
如本文公开的,罗汉果苷IV
例如,用于产生罗汉果苷IV
作为另一实例,用于产生罗汉果苷IV
如本文公开的,罗汉果苷II
作为另一实例,用于产生罗汉果苷II
如本文公开的,罗汉果苷III
如本文所公开的,在本文公开的化合物1的产生过程中产生化合物4。例如,产生化合物4的方法也可以导致化合物1的产生,该方法可以包括使罗汉果苷IIIE与表达一种或多种UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶的重组宿主细胞接触。
作为另一实例,用于产生化合物4的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IVE、异罗汉果苷V、罗汉果苷IIIE、11-脱氧罗汉果苷V、11-氧代罗汉果苷V、罗汉果苷VI、罗汉果苷IVA、罗汉果苷IIA、罗汉果苷IIA1、罗汉果苷IIA2、罗汉果苷IA、11-氧代罗汉果苷VI、11-氧代罗汉果苷IIIE、11-氧代罗汉果苷IVE、罗汉果苷IE、罗汉果醇、11-氧代罗汉果醇、罗汉果苷IIE、罗汉果苷IIIA2和罗汉果苷III中的一种或多种与一种重组宿主细胞接触,该重组宿主细胞表达UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。例如,该酶可以是来自地衣芽孢杆菌(Bacillus lichenformis)的环麦芽糊精葡聚糖转移酶和/或Toruzyme。
如本文所公开的,化合物5可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,产生化合物5的方法也可以导致化合物1的产生,该方法可以包括使罗汉果苷IIIE与表达一种或多种UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶的重组宿主细胞接触。
作为另一实例,用于产生化合物5的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物6可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,产生化合物6的方法也可以导致产生化合物1,该方法可以包括使罗汉果苷III
作为另一实例,用于产生化合物6的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物7可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,产生化合物7的方法也可以导致产生化合物1,该方法可以包括使罗汉果苷III
作为另一实例,用于产生化合物7的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物8可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,产生化合物8的方法也可以导致产生化合物1,该方法可以包括使罗汉果苷III
作为另一实例,用于产生化合物8的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物9可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,产生化合物9的方法也可以导致产生化合物1,该方法可以包括使罗汉果苷IIIE与表达一种或多种UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶的重组宿主细胞接触。
作为另一实例,用于产生化合物9的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IVE、异罗汉果苷V、罗汉果苷IIIE、11-脱氧罗汉果苷V、11-氧代罗汉果苷V、罗汉果苷VI、罗汉果苷IVA、罗汉果苷IIA、罗汉果苷IIA1、罗汉果苷IIA2、罗汉果苷IA、11-氧代罗汉果苷VI、11-氧代罗汉果苷IIIE、11-氧代罗汉果苷IVE、罗汉果苷IE、罗汉果醇、11-氧代罗汉果醇、罗汉果苷IIE、罗汉果苷IIIA2和罗汉果苷III中的一种或多种与一种重组宿主细胞接触,该重组宿主细胞表达UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。例如,可以使用来自地衣芽孢杆菌(Bacillus lichenformis)的CGTase或Toruzyme。
如本文所公开的,化合物10可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,产生化合物10的方法也可以导致产生化合物1,该方法可以包括使罗汉果苷III
作为另一实例,用于产生化合物10的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物11可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,产生化合物11的方法也可以导致产生化合物1,该方法可以包括使罗汉果苷III
作为另一实例,用于生产化合物11的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IVE、异罗汉果苷V、罗汉果苷III
如本文所公开的,化合物12可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,产生化合物12的方法也可以导致产生化合物1,该方法可以包括使罗汉果苷VI异构体与表达一种或多种UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶的重组宿主细胞接触。例如,该酶可以是面包酵母中的转化酶。
作为另一实例,用于产生化合物12的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物13可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,该方法可以包括使罗汉果苷III
作为另一实例,用于产生化合物13的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物14可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,该方法可以包括使罗汉果苷III
作为另一实例,用于产生化合物14的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物15可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,该方法可以包括使罗汉果苷II
作为另一实例,用于生产化合物15的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物16可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,该方法可以包括使罗汉果苷II
作为另一实例,用于生产化合物16的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
例如,这种酶可以是Toruzyme。重组细胞还可包括编码环麦芽糊精葡聚糖转移酶(例如Toruzyme)、转化酶、葡糖转移酶(例如UGT76G1)的基因。
如本文所公开的,化合物17可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将化合物17水解以产生罗汉果苷III
作为另一实例,用于产生化合物17的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物18可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将化合物18水解以产生罗汉果苷IIIE,然后可将其用于产生化合物1。例如,用于制备化合物18的方法可包括:使罗汉果苷III
作为另一实例,用于产生化合物18的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物19可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将化合物19水解以制备化合物1。例如,用于制备化合物19的方法可包括:使罗汉果苷III
作为另一实例,用于产生化合物19的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物20可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将化合物20进一步水解以产生化合物1。例如,用于产生化合物20的方法可包括:使罗汉果苷III
作为另一实例,用于产生化合物20的方法可包括:使罗汉果苷V、赛门苷I、罗汉果苷IV
如本文所公开的,化合物21可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将化合物21进一步水解以产生化合物1。例如,用于产生化合物21的方法也能导致产生化合物1,该方法可包括:使罗汉果苷IV
作为另一实例,用于产生化合物21的方法可包括:使罗汉果苷V、罗汉果苷IV
如本文所公开的,化合物22可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将化合物22进一步水解以产生化合物1。例如产生化合物22的方法也可导致产生化合物1,该方法可以包括:使罗汉果苷IVA与表达一种或多种UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶的重组宿主细胞接触。该酶可以是例如Sus1和UGT76G1。
作为另一实例,用于产生化合物22的方法可包括:使罗汉果苷V、罗汉果苷IV
如本文所公开的,化合物23可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将化合物23进一步水解以产生化合物1。例如,用于产生化合物22的方法也可以导致产生化合物1,该方法包括:使罗汉果苷IV
作为另一实例,用于产生化合物23的方法可包括:使罗汉果苷V、罗汉果苷IV
如本文所公开的,罗汉果苷II
作为另一实例,用于产生罗汉果苷II
如本文所公开的,罗汉果苷
作为另一实例,用于产生罗汉果苷
如本文所公开的,化合物24可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将化合物24进一步水解以产生化合物1。用于产生化合物24的方法也可以导致产生化合物1,该方法可包括:使罗汉果苷III
作为另一实例,用于产生化合物24的方法可包括:使罗汉果苷V、罗汉果苷IV
如本文所公开的,化合物25可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将化合物25进一步水解以产生化合物1。用于产生化合物25的方法也可以导致产生化合物1,该方法可包括:使罗汉果苷III
作为另一实例,用于产生化合物25的方法可包括:使罗汉果苷V、罗汉果苷IV
如本文所公开的,化合物26可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将化合物26进一步水解以产生化合物1。产生化合物26的方法也可以导致产生化合物1,该方法可包括:使罗汉果苷III
作为另一实例,用于产生化合物26的方法可包括:使罗汉果苷V、罗汉果苷IV
如本文所公开的,罗汉果醇和罗汉果苷I
作为另一实例,用于产生罗汉果醇和罗汉果苷I
如本文所公开的,罗汉果苷IIE可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将罗汉果苷IIE进一步水解以产生化合物1。例如,用于产生罗汉果苷IIE的方法可以导致产生化合物1,该方法包括:使罗汉果苷V与表达一种或多种UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶的重组宿主细胞接触。例如,该酶可以是来自棘孢曲霉(Aspergillusaculeatus)的果胶酶。
作为另一实例,用于产生罗汉果苷IIE的方法可包括:使罗汉果苷V、罗汉果苷IV
如本文所公开的,化合物32和33可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将化合物32和33进一步被糖基化合水解以产生化合物1。用于产生化合物32和33的方法也可以导致产生化合物1,该方法可包括:使罗汉果苷V、罗汉果苷IV
作为另一实例,用于产生化合物32和33的方法可包括:使罗汉果苷V、罗汉果苷IV
如本文所公开的,化合物34和35可以是用于产生本文所公开的化合物1的中间体罗汉果苷化合物。例如,可将化合物32和33进一步水解以产生化合物1。用于产生化合物34和35的方法也可以导致产生化合物1,该方法可包括:使罗汉果苷III
作为另一实例,用于产生化合物34和35的方法可包括:使罗汉果苷V、罗汉果苷IV
如本文所公开的,罗汉果苷III
例如,罗汉果苷III
用于产生罗汉果苷III
作为另一实例,用于产生罗汉果苷III
在1ml反应体积中,将5mg罗汉果苷IIIE、50mg可溶性淀粉、0.1M NaOAC pH 5.0、125ul CGT-SL酶(来自嗜热脂肪芽孢杆菌(Geobaccilus thermophillus))和水混合,并用搅拌棒混合并在50℃下孵育。取时间点样品用于HPLC分析。
HPLC数据:如图1所示的化合物1的产生的质谱。在一些实施方案中,CTG-SL可包含SEQ ID NO:3、148或154所示的一种序列。
生长条件:将BL21 Codon Plus RIL菌株在37℃,250rpm的2xYT中生长,直到OD600为1。加入10mM乳糖诱导,在室温下以150rpm孵育过夜。用于反应的粗提取物是通过超声或渗透冲击获得的。
在一些实施方案中,葡聚糖蔗糖酶包含或由SEQ ID NOs:2、103、106-110、156和896中任一个的氨基酸序列组成。在一些实施方案中,DexT包含SEQ ID NO:103中所示的氨基酸序列。在一些实施方案中,DexT包含SEQ ID NO:104或SEQ ID NO:105所示的核酸序列。
生长条件:如Wenham、Henessey和Cole(1979)所述,通过添加葡萄糖使上述菌株厌氧生长,以刺激葡聚糖蔗糖酶的产生。向生长培养基中加入5mg/ml罗汉果苷IIIE。取时间点样品用于HPLC分析。HPLC数据在图2中以化合物1的产生的质谱图表示。
在1ml反应体积中,用搅拌棒混合5mg的罗汉果苷IIIE、50mg的可溶性淀粉、0.1M的NaOAC pH 5.0、125ul的酶和水,用搅拌棒下混合,并在50℃下孵育。取时间点样品用于HPLC分析。使用的酶是CGTase。如图1所示,在HPLC数据和质谱数据中可以看到化合物1产物。质量峰对应于化合物1的大小。
用罗汉果苷IIIE和来自天然宿主里氏木霉(Trichoderma reesei)的celluclast进行Celluclast糖基化
反应条件:将5mg的罗汉果苷IIIE、100mg的木聚糖、50ul的Celluclast以1ml的总体积与0.1M的乙酸钠pH 5.0混合,在50℃下搅拌孵育。取时间点样品用于HPLC分析。
木糖基化产物如图3高亮所示。来自木糖基化的产物可以用作化合物1的产生中的中间体。Celluclast的序列包含在表1中,并且在本文中用于木糖基化产物的产生。
在该实施例中,使用了糖基转移酶AGY15763.1(Amano Enzyme U.S.A.Co.,Ltd.,伊利诺伊州;SEQ ID NO:434,参见表1)。将20mL去离子水、0.6ml 0.5M MES pH 6.5、6g可溶性淀粉、150mg罗汉果苷IIIE和3ml酶添加到40ml平底螺旋盖小瓶中。将小瓶用黑帽密封,在30℃下孵育,并使用磁力棒以500rpm的转速搅拌。以600mg的罗汉果苷IIIE为原料,又进行了3个相同的反应。24小时后停止反应。通过离心(4000rpm 5分钟,Eppendorf)除去不溶性淀粉。在搅拌(500rpm)下,将上清液加热至80℃30分钟,然后离心(4000rpm 10分钟,Eppendorf)。将上清液通过250毫升0.22微米PES过滤并通过LC-MS检查(Sweet Naturals2016-Enzymatic_2016Q4_A.SPL,第1254行)以获得HPLC数据。
AGY15763.1蛋白(SEQ ID NO:434)可以由天然gDNA(SEQ ID NO:437)或经密码子优化的(对于大肠杆菌)DNA序列(SEQ ID NO:438)编码。
预期反应性类似的其他糖基转移酶的实例来自甜叶菊(Stevia rebaudiana)(SEQID NO:439)的UGT76G1蛋白,其可以在大肠杆菌中表达。SEQ ID NO:440提供了UGT76G1(SEQID NO:439)的天然编码序列。
罗汉果醇与UDP-糖基转移酶反应,产生了罗汉果苷I和罗汉果苷II。将1mg/ml的罗汉果醇与200ul含UGT73C5(拟南芥(A.thaliana))(334)的粗提物、2ul含蔗糖合酶的粗提物、5mM UDP、1x M221蛋白酶抑制剂、200mM蔗糖、0.5mg/ml大观霉素的粗提物在0.1M Tris-HCl pH7.0中反应,在30℃下孵育。2天后取样用于HPLC分析。如图4和图5所示,反应产物从罗汉果醇到罗汉果苷I和罗汉果苷II。
UGT73C5的蛋白质序列示于SEQ ID NO:441,UGT73C5的天然DNA编码序列(SEQ IDNO:441)示于SEQ ID NO:442,UGT73C5编码序列(针对大肠杆菌优化的密码子)示于SEQ IDNO:443。
反应条件:使1mg/ml的罗汉果醇与200ul含有UGT73C6的粗提物、2ul含蔗糖合酶的粗提物、5mM UDP、1x M221蛋白酶抑制剂、200mM的蔗糖、0.5mg/ml的大观霉素在0.1M Tris-HCl pH7.5中反应,在30℃下孵育。2天后取样用HPLC分析。反应产物是来自罗汉果醇的罗汉果苷I。如图6的HPLC数据和质谱数据所示。
蛋白和编码拟南芥(A.thaliana)UGT73C6的gDNA序列分别示于SEQ ID NO:444和SEQ ID NO:445。
反应条件:使1mg/ml的罗汉果醇或罗汉果苷IIA与200ul含有338的粗提物、2ul含蔗糖合酶的粗提物、5mM UDP、1x M221蛋白酶抑制剂、200mM蔗糖、0.5mg/ml大观霉素在0.1MTris-HCl pH8.5中反应,在30℃下孵育。2天后取样品进行HPLC分析。
罗汉果醇与芽孢杆菌(Bacillus sp.)UDP-糖基转移酶(338)的反应(在Pandey等人,2014中描述;文献以引用方式并入本文)得到反应产物:罗汉果苷I、罗汉果苷IIA和两种不同的罗汉果苷III产物。图7-9显示了反应后获得的产物的HPLC和质谱数据。图8显示了与罗汉果醇IIA大小相关的峰。
蛋白和编码UGT 338的gDNA序列分别在SEQ ID NO:405和SEQ ID NO:406中示出。
反应条件:使1mg/ml的罗汉果苷IIIE与200ul含有301的粗提物、2ul含蔗糖合酶的粗提物、5mM UDP、1x M221蛋白酶抑制剂、200mM蔗糖、0.5mg/ml大观霉素在0.1M Tris-HClpH7.0中反应,在30℃下孵育。2天后取样以进行HPLC和质谱分析。如图10-11所示,罗汉果苷IIIE的反应产物是赛门苷I和罗汉果苷V。
蛋白和编码罗汉果(S.grosvenorii)301UGT98的gDNA序列分别在SEQ ID NO:407和SEQ ID NO:408中示出。
反应条件:使1mg/ml的罗汉果醇l、赛门苷I或化合物1与200ul含339的粗提物(在Itkin等人中描述,文献以引用方式并入本文)、2ul含蔗糖合酶的粗提物、5mM UDP、1x M221蛋白酶抑制剂、200mM蔗糖、0.5mg/ml大观霉素在0.1M Tris-HCl pH7.0中反应,在30℃下孵育。2天后取样品进行HPLC分析。
来自罗汉果醇的反应产物得到罗汉果苷I,赛门苷I获得异罗汉果苷V,并且化合物1得到化合物1衍生物(图12-14)。
蛋白和编码罗汉果(S.grosvenorii)UGT339的DNA序列分别在SEQ ID NO:409和SEQ ID NO:410中示出。
如本文所述,使用如Noguchi等人,2008(文献以引用方式并入本文)所述的UDP-糖基转移酶(330)获得反应产物罗汉果苷IIIA、罗汉果苷IVA、罗汉果苷V。天然宿主为芝麻(Sesamum indicum),生产宿主为大肠杆菌(E.coli)。对于该反应,将1mg/ml的罗汉果苷IIA、罗汉果苷IIE,罗汉果苷IIIE、罗汉果苷IVA或罗汉果苷IVE与200ul含330的粗提物、2ul含蔗糖合酶的粗提物、5mM UDP、1x M221蛋白酶抑制剂、200mM蔗糖、0.5mg/ml大观霉素在0.1M Tris-HCl pH7.0中反应,在30℃下孵育。2天后取样用HPLC分析。
反应产生例如罗汉果苷IIIA、罗汉果苷IVA、罗汉果苷V。如图15-20所示,所产生的化合物的大小对应于罗汉果苷IIIA、罗汉果苷IVA和罗汉果苷V。
蛋白和编码罗汉果(S.grosvenorii)UGT330蛋白的gDNA序列分别在SEQ ID NO:411和SEQ ID NO:412中示出。
反应条件:使1mg/ml的罗汉果苷IIIE与200ul含有330的粗提物、2ul含蔗糖合酶的粗提物、5mM UDP、1x M221蛋白酶抑制剂、200mM蔗糖、0.5mg/ml大观霉素在0.1ul Tris-HClpH7.0中反应,在30℃下孵育。2天后取样品进行HPLC分析。
反应产物是罗汉果苷IVE和罗汉果苷I。如图21-22所示,质谱数据中的产物大小对应于罗汉果苷IVE和赛门苷I。罗汉果(S.grosvenorii)UGT328蛋白(糖基转移酶)和其编码序列分别在SEQ ID NO:413和414中示出。
蔗糖合酶AtSus1蛋白序列和编码AtSus1蛋白的gDNA分别在SEQ ID NO:415和416中示出。
DNA是通过基因合成获得的,无论是通过Genescript还是IDT。对于某些葫芦二烯醇合酶,通过10~60日龄的幼苗获得cDNA或基因组DNA,然后使用特异性和简并引物(degenerate primers)进行PCR扩增。通过标准分子生物学技术将DNA克隆到以下过表达载体之一中:pESC-Ura,pESC-His或pESC-LEU。酿酒酵母菌株YHR072(erg7的杂合子)购自GEDharmacon。使用Zymo酵母转化试剂盒II转化/共转化含有罗汉果醇合成基因的质粒(pESC载体)。菌株在含有2%葡萄糖或2%半乳糖的适当选择的标准培养基(YPD或SC)中培养,在30℃、220rpm下诱导异源基因。当指示时,加入羊毛甾醇合酶)抑制剂Ro48-8071(CaymanChemicals)(50ug/ml)。诱导2天后,产生了罗汉果醇及其前体的酵母,然后进行裂解(YeastBuster)、乙酸乙酯萃取、干燥、并悬浮于甲醇中。通过HPLC分析样品。
葫芦二烯醇合酶罗汉果(S grosvernorii)SgCbQ在无抑制剂的生长条件下催化葫芦二烯醇的产生。
在HPLC和质谱数据中显示了葫芦二烯醇的产生,其显示了所指示产物的质量峰(图23)。蛋白序列和编码罗汉果(S.grosvernorii)SgCbQ的DNA序列分别在SEQ ID NO:446和418中示出。
Cpep2也用于在酵母中产生葫芦二烯醇。如图24所示,质谱图显示了与葫芦二烯醇相对应的峰和特征片段。Cpep2的蛋白序列和编码Cpep2蛋白的DNA序列分别在SEQ ID NO:420和421中示出。
美洲南瓜(Cucurbita pepo)(Jack O’Lantern)Cpep4也用于在没有抑制剂的生长条件下制备葫芦二烯醇。在图24和图25所示的质谱数据中显示了葫芦二烯醇的产生。如图所示,峰和片段与葫芦二烯醇对应。蛋白序列和编码Cpep4的DNA序列分别在SEQ ID NO:422和423中提供。
代表Cmax的葫芦二烯醇合酶蛋白序列是从天然宿主笋瓜(Cmaxima)中获得的。推导的编码DNA序列将用于基因合成和表达。蛋白质的葫芦二烯醇合酶序列和编码葫芦二烯醇合酶的DNA如下所示:
下面的蛋白质和DNA编码序列是通过将基因组DNA PCR产物序列与可从公共数据库(Pubmed)获得的已知葫芦二烯醇合酶序列进行比对而获得的。预期这些Cmax蛋白中的任何一种均可用于本文公开的方法、体系、组合物(例如宿主细胞)中,以产生化合物1。非限制性示例性Cmax蛋白是由Cmax1(DNA)(SEQ ID NO:424)编码的Cmax1(蛋白)(SEQ ID NO:425)。
代表Cmos1的推测的葫芦二烯醇合酶蛋白序列获自天然宿主中国南瓜(Cucurbitamoschata)。推导的编码DNA序列用于基因合成和表达。通过将基因组DNA PCR产物序列与可从公共数据库(Pubmed)获得的已知葫芦二烯醇合酶序列进行比对,可以获得以下所示的蛋白质和DNA编码序列。这些Cmos蛋白中的任何一种均可用于本文公开的方法,系统、组分(例如宿主细胞)中,以产生化合物1。非限制性示例性Cmos1蛋白为由Cmos1(DNA)(SEQ ID NO:427)编码的Cmos1(蛋白)(SEQ ID NO:426)。
考虑使用葫芦二烯醇合酶和环氧化物水解酶在酵母中产生二羟基葫芦二烯醇。这些酶的天然宿主是罗汉果(S.grosvenorii)。
生长条件:在羊毛甾醇合酶抑制剂的存在下,SgCbQ与环氧水解酶(EPH)共表达。
可能的二羟基葫芦二烯醇产品如图26所示。
EPH蛋白序列和编码EPH蛋白的DNA(密码子优化的酿酒酵母)分别在SEQ ID NO:428和429中示出。
在酿酒酵母中共表达四种酶,包括葫芦二烯醇合酶、环氧化物水解酶、细胞色素P450和细胞色素P450还原酶。对于生长条件,在羊毛甾醇合酶抑制剂存在下,共表达了SgCbQ、EPH、CYP87D18和AtCPR(来自拟南芥的细胞色素P450还原酶)。预计通过酿酒酵母产生罗汉果醇。蛋白序列和编码SgCbQ、EPH、CYP87D18和AtCPR(来自拟南芥的细胞色素P450还原酶)的DNA序列是:CYP87D18(蛋白)(SEQ ID NO:430)和CYP87D18(DNA)(SEQ ID NO:431);和AtCPR(蛋白)(SEQ ID NO:432)和AtCPR(DNA)(SEQ ID NO:433)。
在补充有1mg/ml罗汉果苷V或化合物1的YPD中孵育酵母菌株酿酒酵母(Saccharomyces cerevisiae)、解脂耶氏酵母(Yarrowia lipolytica)和熊蜂生假丝酵母(Candida bombicola)。3天后,通过HPLC分析上清液。
如HPLC数据所示,菌株将罗汉果苷V水解为罗汉果苷IIIE。化合物1未观察到水解产物(图27A和27B)。
变形链球菌(Streptococcus mutans)Clarke可通过补充葡萄糖而厌氧生长。生长条件的一个例子可以在Wenham、Henessey和Cole(1979)中找到,其中该方法用于刺激例如葡聚糖蔗糖酶的产生。向生长培养基中加入5mg/ml罗汉果苷IIIE。例如,可以采用HPLC监测时间点样品。各种葡聚糖蔗糖酶的序列可在表1中找到,其包括葡聚糖蔗糖酶的蛋白序列和编码葡聚糖蔗糖酶的核酸序列(例如,SEQ ID NO:157-162)。在一些实施方案中,葡聚糖蔗糖酶包含或由SEQ ID NO:2、103、106-110、156和896中任一个的氨基酸序列组成。在一些实施方案中,DexT包含SEQ ID NO:103所示的氨基酸序列。在一些实施方案中,DexT包含SEQID NO:104或105所示的核酸序列。在一些实施方案中,本文的重组细胞编码包含SEQ IDNO:156-162中任一个所示序列的蛋白质,和/或包含编码葡聚糖蔗糖酶的核酸序列。本实施例用于产生化合物1。
通过用葡聚糖蔗糖酶/葡聚糖酶反应处理罗汉果苷III
将100mL的pH 5.5 1M乙酸钠缓冲液、200g的蔗糖、100mL的葡聚糖这样酶DexT(1mg/ml的粗提物、pET23a、BL21-Codon Plus-RIL、在2X YT中生长)、12.5g的罗汉果苷III
根据UPLC分析(图28和图29),混合物分别以5:90:5%的比率具有3种特征化的α-罗汉果苷异构体;11-氧代化合物1、化合物1和罗汉果苷V异构体。根据1H和13C-NMR(吡啶-d
在2016年11月10日进行了纯的化合物1与90%纯的化合物1的三角检验。对两种不同的组成:(1)LSB+175ppm纯的化合物1(标准)和(2)LSB+175ppm 90%纯的化合物1进行了测试。用pH约7.1并包含0%乙醇的低钠缓冲液(LSB)制备组合物的所有样品。
结论:专家们发现,组成(1)LSB+175ppm纯的化合物1(标准)与组成(2)LSB+175ppm的90%纯的化合物1(测试)并无显著差异(p>0.05)。表2-4列出了一些测试分析结果。
表2.正确选择其他样品的小组成员(panelists)的频率。n=38(19小组成员x2reps)。
表3.分析结果:测试日
表4.分析结果:试验前一天
DNA是通过基因合成获得的,无论是通过Genescript、IDT还是Genewiz。对于某些葫芦二烯合酶,通过10~60日龄的幼苗获得cDNA或基因组DNA,然后使用特异性和简并引物进行PCR扩增。通过标准分子生物学技术或酵母缺口修复克隆(Joska等,2014)将DNA克隆到以下过表达载体之一:pESC-Ura,pESC-His或pESC-LEU。基因表达受到以下启动子之一的调控:Gal1,Gal10,Tef1或GDS。使用Zymo酵母转化试剂盒II进行酵母转化。酵母菌株在标准培养基(YPD或SC)中生长,该培养基含有适当选择的2%葡萄糖或2%半乳糖以诱导异源基因。酵母菌株在30℃、140-250rpm的摇瓶或96孔板中生长。当指示时,加入羊毛甾醇合酶抑制剂Ro 48-8071(Cayman Chemicals)(50ug/ml)。通过裂解(Yeast Buster)、乙酸乙酯萃取、干燥、并悬浮在甲醇中,产生了罗汉果醇及其前体的酵母。使用A/B梯度(A=H
为了分析二环氧角鲨烯,LCMS方法包括使用C18 2.1x50mm色谱柱,5%B持续1.5min,梯度5%至95%B或5.5min,95%B持续6min,100%B持续进行3分钟,5%B持续1.5分钟,所有流速均为0.3ml/min。
为了分析葫芦二烯醇,第一种LCMS方法包括使用C4 2.1x100mm色谱柱、梯度1至95%B持续6分钟、流速为0.55ml/min。第二种LCMS方法包括使用Waters Acquity UPLC蛋白BEH C4 2.1x100mM、1.7um,带防护罩,62%至67%B持续2分钟,100%B持续1分钟,流速为0.9ml/min。
为了分析11-OH葫芦二烯醇,LCMS方法包括使用C8 2.1x100mm色谱柱,以60%至90%B的梯度以0.55ml/min的流速进行6分钟。
为了分析罗汉果醇,LCMS方法包括使用C8 2.1x100mm色谱柱,以50至90%B梯度以0.55ml/min的流速进行6分钟
为了分析罗汉果苷IIIE和化合物1,LCMS方法包括使用氟苯基2.1x100mm色谱柱,以15%至30%B的梯度以0.55ml/min的流速进行6分钟。
酿酒酵母菌株YHR072(羊毛甾醇合酶erg7的杂合子)购自GE Dharmacon。通过用cup1替换启动子,可降低活性erg7基因的表达(Peng等,2015)。在GDS启动子的控制下截短的酵母HMG-CoA还原酶(tHMG-CoA)和在Tef1启动子的控制下酵母角鲨烯环氧酶(erg1)被整合到基因组中。如HPLC和UV吸光度所示,通过生成二环氧角鲨烯来监测氧化角鲨烯的增强作用(图31)。
tHMG-CoA(蛋白质)SEQ ID NO:898(途径1)
tHMG-CoA(DNA)SEQ ID NO:897(途径1)
Erg1(蛋白质)SEQ ID NO:900;Erg1(DNA)SEQ ID NO:899
在一些实施方案中,tHMG-CoA酶用于生产二环氧角鲨烯。
选择罗汉果(S.grosvenorii)(Itkins等人,2016)中所假定的角鲨烯环氧化酶的基因,以促进氧化氧化鲨烯/二环氧角鲨烯的产生。表1中列出了3种角鲨烯环氧酶的氨基酸序列和编码序列(SEQ ID NO:50-56、60、61、334或335)。适用于在本文中公开的方法、体系和组合物中的角鲨烯环氧化酶的其他序列包括:SQE1(蛋白质)SEQ ID NO:908,SQE1(DNA)SEQ ID NO:909;SQE2(蛋白质)SEQ ID NO:910,SQE2(DNA)SEQ ID NO:911;SQE3(蛋白质)SEQ ID NO:912,和SQE3(DNA)SEQ ID NO:913,上述方法、体系和组合物是用于产生氧化角鲨烯和/或二环氧角鲨烯、和用于提高氧化角鲨烯和/或二环氧角鲨烯的产量。
将含有罗汉果(S.grosvernorii)葫芦二烯醇合酶基因(SGCBQ)的质粒转化到提高了氧化角鲨烯的酵母菌株中。菌株在30℃、150-250rpm下生长1~3天。葫芦二烯醇的产生在HPLC和质谱数据中显示,该数据显示了所示产物的质量峰(图23)。SEQ ID NO:446和SEQ IDNO:418分别提供了SgCbQ蛋白和编码SgCbQ的gDNA。美洲南瓜(Cucurbita pepo)(Jack O’Lantern)蛋白Cpep2也用于在酵母中产生葫芦二烯醇。图24显示了质谱图,其中包含与葫芦二烯醇相对应的峰和特征片段。Cpep2蛋白和编码Cpep2的DNA分别在SEQ ID NO:420和SEQID NO:421中提供。美洲南瓜(Cucurbita pepo)(Jack O’Lantern)蛋白Cpep4也用于产生葫芦二烯醇。在无抑制剂的生长条件下培养宿主细胞。在图25所示的质谱数据中证明了葫芦二烯醇的产生。如图所示,峰和片段对应于葫芦二烯醇。Cpep4蛋白和编码Cpep4的DNA分别在SEQ ID NO:422和SEQ ID NO:423中提供。笋瓜(Cucurbita maxima)蛋白Cmax也用于在酵母中产生南瓜二烯醇。图32显示了质谱图,其中包含与葫芦二烯醇相对应的峰和特征片段。Cmax1蛋白序列在SEQ ID NO:424中提供,并且Cmax1(DNA)的编码序列在SEQ ID NO:425中提供。厚皮甜瓜Cucumis meloCmelo也用于在酵母中生产葫芦二烯醇。图32显示了质谱图,其中包含与葫芦二烯醇相对应的峰和特征性片段。Cmelo蛋白序列在SEQ ID NO:902中提供,Cmelo(DNA)的编码序列在SEQ ID NO:901中提供。预期中国南瓜(Cucurbita moschata)蛋白Cmos1也可用于重组宿主细胞例如酵母细胞中的葫芦二烯醇的产生。Cmos1序列Cmos1(蛋白质)(SEQ ID NO:426)和Cmos1(DNA)(SEQ ID NO:427)是通过将基因组DNA PCR产物序列与已知的葫芦二烯醇合酶序列进行比对而获得的,该序列可通过公共数据库(Pubmed)获得。预期Cmost 1蛋白(SEQ ID NO:426)可用于重组宿主细胞例如酵母细胞中的葫芦二烯醇的产生。
将含有修饰的氧化角鲨烯基因的质粒转化为提高了氧化角鲨烯的酵母菌株。菌株在30℃,150-250rpm下生长1~3天。
来自天然宿主豌豆(Pisum sativum)的蛋白质PSX Y118L也用于在酵母中生产葫芦二烯醇。图33示出了质谱图,其包含当位置118处的酪氨酸转化为亮氨酸时对应于葫芦二烯醇的峰和特征片段。蛋白质和编码修饰的氧化角鲨烯环化酶的DNA的序列为:PSXY118L(蛋白质)(SEQ ID NO:904)和PSXY118L(DNA,密码子优化)(SEQ ID NO:903)。
来自盘基网柄菌(Dictyostelium sp.)的氧化角鲨烯环化酶也用于酵母中葫芦二烯醇的产生。如图34所示,葫芦二烯醇的HPLC峰是在80位酪氨酸转化为亮氨酸时出现的。蛋白质和编码修饰的氧化角鲨烯环化酶的DNA的序列是:DdCASY80L(蛋白质)(SEQ ID NO:906)和DdCASY80L(DNA)(SEQ ID NO:905)。
对编码厚皮甜瓜(Cucumis melo)形式的葫芦二烯醇合酶的基因(SEQ ID:907)进行密码子优化,并用作产生修饰库的起点。通过标准分子生物学技术引入修饰,该技术由位于酶N端(即5')或C端(即3')末端的融合肽组成。将经修饰的葫芦二烯醇合酶基因的质粒库转化到提高了氧化角鲨烯的酵母菌株中。使用上述LCMS方法2,通过在葫芦二烯醇与内标的预期保留时间处峰高或409和427阳性质量碎片的峰高或面积之比进行酶活性的测量。酶性能的评分为:相对于母体酶的平均活性(n=8)的平均活性%。酶的步骤1序列和编码该酶的序列可以在SEQ ID Nos:951-1012中找到。步骤1序列还包括融合体SS2c-G10,SS2e-A7b,SS2d-G11,SS2e-A7a,SS4d-G5,SS4d-C7,SS3b-D8和SS2c-A10a,如表1所述。
CYP87D18(CYP450,罗汉果(S.grosvenorii))和SgCPR(CYP450还原酶,罗汉果(S.grosvenorii))在酿酒酵母菌株中产生葫芦二烯醇。使用HPLC和质谱数据观察到11-OH葫芦二烯醇(即11-羟基葫芦二烯醇)(图35)。罗汉果(S.grosvenorii)CYP87D18蛋白质序列显示在SEQ ID NO:872中,而CYP87D18(密码子优化的DNA)编码序列显示在SEQ ID NO:871中。罗汉果(S.grosvenorii)SgCPR蛋白序列示于SEQ ID NO:874中,SgCPR1(密码子优化的DNA)编码序列示于SEQ ID NO:873中。
来自罗汉果(S.grosvenorii)和甘草(Glycyrrhiza)(CYP88D6)的其他CYP450(CYP88D6)在由酿酒酵母菌株中产生的葫芦二烯醇中表达。酶的蛋白质序列和DNA编码序列在SEQ ID NO:875-890中提供。
CYP1798(CYP450酶,罗汉果(S.grosvenorii))和EPH2A(环氧水解酶,罗汉果(S.grosvenorii))在酿酒酵母菌株中表达以产生11-OH葫芦二烯醇。使用HPLC和质谱数据观察到了罗汉果醇(图36)。对于序列,酶的DNA编码和蛋白质序列在SEQ ID NO:891-894中提供。
来自罗汉果(S.grosvenorii)和甘草(Glycyrrhiza)(CYP88D6)的其他CYP450和SQEs(CYP88D6)也在由酿酒酵母菌株中产生的葫芦二烯醇或11-OH葫芦二烯醇中表达,以测试环氧化反应。
对于SQE,该酶的蛋白质和DNA编码序列在SEQ ID NO:882-888中提供。对于CYP450,酶的蛋白质和DNA编码序列在SEQ ID NO:875-890中提供。
将表达截短的葡聚糖蔗糖酶(tDexT)的酿酒酵母菌株在含有7mg/ml罗汉果苷V的YPD(30C,250rpm)中孵育1~2天,从而水解成罗汉果苷IIIE。收获酿酒酵母细胞,裂解,然后与含有罗汉果苷IIIE的YPD上清液混合。为了开始葡聚糖蔗糖酶反应,加入蔗糖至终浓度为200g/L,然后在30℃,250rpm下孵育2天。使用HPLC观察到化合物1的产生(图37)。tDexT的蛋白质序列在SEQ ID NO:896中显示,而tDexT的DNA编码序列在SEQ ID NO.895中显示。
酿酒酵母(S.cerevisiae)或解脂耶氏酵母(Y.lipolytica)在罗汉果苷V存在下生长,以使酵母中的水解酶产生罗汉果苷IIIE。1或2天后,通过HPLC分析裂解细胞以确定罗汉果苷含量。孵育1天后,酿酒酵母产生了罗汉果苷V、罗汉果苷IV和罗汉果IIIE的混合物。孵育2天后,基本上所有的罗汉果苷都转化为罗汉果苷IIIE,如图40A所示。
类似地,孵育2天后,解脂耶氏酵母(Y.lipolytica)主要产生罗汉果苷IIIE(如图40B所示)。
酿酒酵母(S.cerevisiae)或解脂耶氏酵母(Y.lipolytica)在化合物1的存在下生长。与其他罗汉果苷(参见实施例64)不同,未观察到由于化合物1的水解而产生的水解产物,如图41所示。
酿酒酵母(S.cerevisiae)被修饰以过表达葡聚糖蔗糖酶(DexT)。该修饰的菌株在罗汉果苷混合物的存在下生长,以使酿酒酵母中的水解酶产生罗汉果苷IIIE。孵育2天后,裂解细胞以释放DexT酶,并补充蔗糖。24小时后,产生了大量化合物1(如图42所示)
制备了葫芦二烯醇合酶基因(SEQ ID NO:907中提供的DNA编码序列,以及SEQ IDNO:902中提供的蛋白序列)的酿酒酵母(S.cerevisiae)框内(in-frame)融合多核苷酸的集合或库。将框内融合多核苷酸克隆到酵母载体分子中以产生融合蛋白。
产生了多种融合蛋白并测试了葫芦二烯醇合酶的活性。表2显示了该实施例中产生的一些融合蛋白的测试结果。
反应条件:向装有17ml水、3ml pH 7.0 1M Tris-HCl、0.12g UDP(Carbosynth)、3g蔗糖、300ul蛋白酶抑制剂100x M221、150ul卡那霉素(50mg/ml)的50ml Falcon管中加入1.185ml蔗糖合酶Sus1(1mg/ml粗提物)、150mg起始罗汉果苷和6ml 311酶(1mg/ml粗提物),并在30℃、150rpm下孵育。通过LC-MS定期监测反应进程。3天后,通过在搅拌(500rpm)下加热至80℃、30分钟来终止反应。然后离心反应(4000rpm 10分钟,Eppendorf),并将上清液通过50ml 0.22微米PVDF过滤。所识别的反应产物如图43所示。
尽管本发明已就其优选的实施方案进行了具体显示和描述,但本领域技术人员应该理解的是,在不脱离本发明的真实精神和范围的情况下,可以做出各种改变并且可以用等同方案代替。这包括不提供本文阐述的所有益处和特征的实施方案。另外,可以做出许多修改以使特定情况、材料、物质组成、过程,一个或多个工艺步骤适应本发明的目的、精神和范围。所有这些修改旨在落入所附权利要求的范围内。因此,本发明的范围仅通过参考所附权利要求来限定。
进一步的实施方案
1.一种产生具有以下结构的化合物1的方法:
该方法包括:
使罗汉果苷IIIE与能够催化从罗汉果苷IIIE产生化合物1的第一酶接触。
2.如实施方案1所述的方法,其中,使罗汉果苷IIIE与第一酶接触包括使罗汉果苷IIIE与包含编码该第一酶的第一基因的重组宿主细胞接触。
3.如实施方案2所述的方法,其中,所述第一基因与所述重组宿主细胞是异源的。
4.如实施方案2或3所述的方法,其中罗汉果苷IIIE存在于所述重组宿主细胞中和/或由所述重组宿主细胞产生。
5.如实施方案2-4中任一项所述的方法,包括在表达第一酶的条件下在培养基中培养该重组宿主细胞。
6.如实施方案1-5中任一项所述的方法,其中,所述第一酶是UDP糖基转移酶、环麦芽糊精葡聚糖转移酶(CGTases)、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。
7.如实施方案1-6中任一项所述的方法,其中,所述第一酶是CGTases。
8.如实施方案7所述的方法,其中,所述CGTases包含与SEQ ID NO:1、3、78-101、148和154中任何一者的序列具有至少70%序列同一性的氨基酸序列。
9.如实施方案7所述的方法,其中,所述CGTases包含SEQ ID NO:1、3、78-101、148和154中任何一者的氨基酸序列。
10.如实施方案7所述的方法,其中,所述CGTases由SEQ ID NO:1、3、78-101或154的氨基酸序列组成。
11.如实施方案1-6中任一项所述的方法,其中,所述第一酶为葡聚糖蔗糖酶。
12.如实施方案11所述的方法,其中所述葡聚糖蔗糖酶包含与SEQ ID NO:2、103、106-110、156、159-162和896中所示任一序列具有至少70%序列同一性的氨基酸序列。
13.如实施方案11所述的方法,其中所述葡聚糖蔗糖酶由与SEQ ID NO:104、105、157、158和895中任何一者具有至少70%序列同一性的核酸序列编码。
14.如实施方案1-6中任一项所述的方法,其中所述第一酶是转葡糖苷酶。
15.如实施方案14所述的方法,其中所述转葡糖苷酶包含与SEQ ID NO:163-291和723中任何一者的序列具有至少70%序列同一性的氨基酸序列。
16.如实施方案14所述的方法,其中所述转葡糖苷酶包含SEQ ID NO:163-291和723中任何一者的氨基酸序列。
17.如实施方案1-6中任一项所述的方法,其中,所述第一酶是β-葡糖苷酶。
18.如实施方案17所述的方法,其中所述β-葡糖苷酶包含与SEQ ID NO:102、292、354-374和678-741中任何一者的序列具有至少70%序列同一性的氨基酸序列。
19.如实施方案1-18中任一项所述的方法,其中包括将罗汉果苷IIA与能够催化从罗汉果苷IIA产生罗汉果苷IIIE的第二酶接触。
20.如实施方案19所述的方法,其中将罗汉果苷IIA与第二酶接触包括将罗汉果苷IIA与重组宿主细胞接触以产生罗汉果苷IIIE,并且其中所述重组宿主细胞包含编码所述第二酶的第二基因。
21.如实施方案20所述的方法,其中罗汉果苷IIA由所述重组宿主细胞产生和/或存在于所述重组宿主细胞中。
22.如实施方案20或21所述的方法,其中第二酶是UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。
23.如实施方案22所述的方法,其中第二酶是尿苷二磷酸-葡萄糖基转移酶(UGT)。
24.如实施方案23所述的方法,其中所述UGT是UGT73C3(SEQ ID NO:4)、UGT73C6(SEQ ID NO:5)、UGT85C2(SEQ ID NO:6)、UGT73C5(SEQ ID NO:7)、UGT73E1(SEQ ID NO:8)、UGT98(SEQ ID NO:9或407)、UGT1576(SEQ ID NO:15)、UGT SK98(SEQ ID NO:16)、UGT430(SEQ ID NO:17)、UGT1697(SEQ ID NO:NOT:18)、UGT11789(SEQ ID NO:19),或包含与SEQID NO:4-9、15-19、125、126、128、129、293-307、407、409、411、413、439、441和444中任何一者具有至少70%序列同一性的氨基酸序列。
25.如实施方案24所述的方法,其中所述UGT由包含与UGT1495(SEQ ID NO:10)、UGT1817(SEQ ID NO:11)、UGT5914(SEQ ID NO:12)、UGT8468(SEQ ID NO:13)、UGT10391(SEQ ID NO:14)和SEQ ID NO:116-124、127、130、408、410、412、414、440、442、443和445中所示任一序列具有至少70%序列同一性的核酸序列编码。
26.如实施方案1-25中任一项所述的方法,其中包括使罗汉果醇与一种或多种能够催化从罗汉果醇产生罗汉果苷IIIE的酶接触。
27.如实施方案2-26中任一项所述的方法,其中使罗汉果醇与一种或多种能够催化从罗汉果醇产生罗汉果苷IIE和/或IIIE的酶接触包括使罗汉果醇与重组宿主细胞接触以产生罗汉果苷IIE和/或IIIE,其中所述重组宿主细胞包含一种或多种基因,其编码一种或多种能够催化从罗汉果醇产生罗汉果苷IIE和/或IIIE的酶。
28.如实施方案27所述的方法,其中所述罗汉果醇由所述重组宿主细胞产生和/或存在于所述重组宿主细胞中。
29.如实施方案27-28中任一项所述的方法,其中所述一种或多种能够催化从罗汉果醇产生罗汉果苷IIE和/或IIIE的酶中的至少一种包含与SEQ ID NO:315、316、420、422、424、426、430、431、446、871、845-949和951-1012中任何一者的序列具有至少70%序列同一性的序列,或者由与SEQ ID NO:315、316、420、422、424、426、430、431、446、871、845-949和951-1012中任何一者的序列具有至少70%序列同一性的序列编码。
30.如实施方案27-29中任一项所述的方法,其中,所述一种或多种酶包括UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。
31.如实施方案27-30中任一项所述的方法,其中,所述一种或多种酶中的至少一种是尿苷二磷酸-葡萄糖基转移酶(UGT)。
32.如实施方案31所述的方法,其中所述UGT是UGT73C3、UGT73C6、85C2、UGT73C5、UGT73E1、UGT98、UGT1495、UGT1817、UGT5914、UGT8468、UGT10391、UGT1576、UGT SK98、UGT430、UGT1697或UGT11789,或包含与SEQ ID NO:4-9、15-19、125、126、128、129、293-307、405、406、407、409、411、413、439、441和444中任何一者具有至少70%序列同一性的氨基酸序列。
33.如实施方案1-32中任一项所述的方法,其包括使罗汉果苷化合物与一种或多种能够催化从罗汉果苷化合物产生罗汉果苷IIIE以产生罗汉果苷IIIE的酶接触,其中所述罗汉果苷化合物是罗汉果苷IA1、罗汉果苷IE1、罗汉果苷IIA1、罗汉果苷IIE、罗汉果苷IIA、罗汉果苷IIIA1、罗汉果苷IIIA2、罗汉果苷III、罗汉果苷IV、罗汉果苷IVA、罗汉果苷V和赛门苷中的一种或多种。
34.如实施方案33所述的方法,其中使罗汉果苷化合物与一种或多种能够催化从罗汉果苷化合物产生罗汉果苷IIIE以产生罗汉果苷IIIE的酶接触包括使罗汉果苷化合物与重组宿主细胞接触,其中所述重组宿主细胞包括一种或多种编码一种或多种能够催化从罗汉果苷化合物产生罗汉果IIIE的酶的基因。
35.如实施方案34所述的方法,其中所述罗汉果苷化合物由所述重组宿主细胞产生和/或存在于所述重组宿主细胞中。
36.如实施方案33-35中任一项所述的方法,其中所述一种或多种能够催化从所述罗汉果苷化合物产生罗汉果苷IIIE的酶包括UDP糖基转移酶、CGTases、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。
37.如实施方案33-36中任一项所述的方法,其中所述罗汉果苷化合物是罗汉果苷IIE。
38.如实施方案33-37中任一项所述的方法,其中所述一种或多种能够催化由所述罗汉果苷化合物产生罗汉果苷IIIE的酶包含与SEQ ID NO:1、3、78-101、106-109、147、154、163-303、405、411、354-405、447-723、770、776和782中任何一者具有至少70%序列同一性的氨基酸序列。
39.如实施方案33-38中任一项所述的方法,其中所述罗汉果苷化合物是罗汉果苷IIA或罗汉果苷IIE,并且其中与一种或多种酶的接触产生了罗汉果苷IIIA、罗汉果苷IVE和罗汉果苷V中的一种或多种。
40.如实施方案33-37中任一项所述的方法,其中所述一种或多种酶包含SEQ IDNO:304、405、411、872、874、978、880、882、884、886、886、888、890、892、894和896中任何一者所示的氨基酸。
41.如实施方案33-37中任一项所述的方法,其中所述一种或多种酶由SEQ ID NO:305、406、412、873、875、877、879、881、883、885、887、889、891、893和895中任何一者所示的序列编码。
42.如实施方案2-41中任一项所述的方法,包括使罗汉果苷IA1与重组宿主细胞接触,其中所述重组宿主细胞包含编码UGT98或UGT SK98酶的基因。
43.如实施方案42所述的方法,其中所述UGT98或UGT SK98酶包含与SEQ ID NO:9、407、16或306具有至少70%序列同一性的氨基酸序列。
44.如实施方案42所述的方法,其中所述UGT98由SEQ ID NO:307所示的序列编码。
45.如实施方案42-44中任一项所述的方法,其中所述接触导致在所述细胞中产生罗汉果苷IIA。
46.如实施方案2-45中任一项所述的方法,其中所述方法包括使11-羟基-24,25环氧葫芦二烯醇与所述重组宿主细胞接触,其中所述重组宿主细胞包含编码环氧化物水解酶的第三基因。
47.如实施方案46所述的方法,其中所述11-羟基-24,25环氧葫芦二烯醇存在于所述重组宿主细胞中和/或由所述重组宿主细胞产生。
48.如实施方案2-47中任一项所述的方法,其中所述方法包括使11-羟基-葫芦二烯醇与所述重组宿主细胞接触,其中所述重组宿主细胞包含编码细胞色素P450或环氧化物水解酶的第四基因。
49.如实施方案48所述的方法,其中所述11-羟基-葫芦二烯醇由所述重组宿主细胞产生和/或存在于所述重组宿主细胞中。
50.如实施方案1-49中任一项所述的方法,其中所述方法包括使3,24,25-三羟基葫芦二烯醇与所述重组宿主细胞接触,其中所述重组宿主细胞包含编码细胞色素P450的第五基因。
51.如实施方案50所述的方法,其中所述3,24,25-三羟基葫芦二烯醇存在于所述重组宿主细胞中和/或由所述重组宿主细胞产生。
52.如实施方案47-51中任一项所述的方法,其中所述接触导致在所述重组宿主细胞中产生罗汉果醇。
53.如实施方案50-52中任一项所述的方法,其中所述细胞色素P450包含与SEQ IDNO:20、49、308、315、430、872、874、876、878、880、882、884、886、888、889和892中任何一者具有至少70%序列同一性的氨基酸序列;或所述细胞色素P450由与SEQ ID NO:31-48、316、431、871、873、875、877、879、881、881、883、885、887、890和891中任何一者具有至少70%序列同一性的核酸序列编码。
54.如实施方案46-53中任一项所述的方法,其中所述环氧化物水解酶包含与SEQID NO:21-30和309-314中任何一者具有至少70%序列同一性的氨基酸序列,或所述环氧化物水解酶由与SEQ ID NO:114和115中任何一者具有至少70%序列同一性的核酸序列编码。
55.如实施方案2-54中任一项所述的方法,其中所述方法包括使葫芦二烯醇与所述重组宿主细胞接触,并且其中所述重组宿主细胞包含编码细胞色素P450的基因。
56.如实施方案55所述的方法,其中所述接触导致产生11-羟基葫芦二烯醇。
57.如实施方案55或56所述的方法,其中所述葫芦二烯醇由所述重组宿主细胞产生和/或存在于所述重组宿主细胞中。
58.如实施方案55-57中任一项所述的方法,其中所述细胞色素P450由与SEQ IDNO:31-48、316、431、871、873、875、877、879、881、883、885、887、889和892中任何一者具有至少70%序列同一性的核酸序列编码。
59.实施方案55-57中任一项所述的方法,其中所述细胞色素P450包含与SEQ IDNO:20、31、49、308、315、430、872、874、876、878、880、882、884、886、888、890和891中任何一者具有至少70%序列同一性的氨基酸序列。
60.如实施方案2-59中任一项所述的方法,其中所述方法包括使2,3-氧化角鲨烯、二氧化角鲨烯和二环氧角鲨烯中的一种或多种与所述重组宿主细胞接触,其中所述重组宿主细胞包含第七基因,所述第七基因编码具有葫芦二烯醇合酶活性的多肽。
61.如实施方案60所述的方法,其中所述具有葫芦二烯醇合酶活性的多肽是包含与葫芦二烯醇合酶融合的融合结构域的融合蛋白。
62.如实施方案61所述的方法,其中所述融合蛋白包含与葫芦二烯醇合酶的N-末端区域、C-末端区域或两者融合的融合结构域。
63.如实施方案62所述的方法,其中所述融合结构域长约3至约1000个氨基酸。
64.如实施方案62所述的方法,其中所述融合结构域长约5至约50个氨基酸。
65.如实施方案62所述的方法,其中所述融合结构域是功能蛋白的主要部分或整个序列。
66.如实施方案61所述的方法,其中所述具有葫芦二烯醇合酶活性的多肽包含与SEQ ID NO:70-73、75-77、319、321、323、325、327-333、417、420、422、424、426、446、902、904或906具有至少70%序列同一性的氨基酸序列。
67.如实施方案61或62所述的方法,其中具有葫芦二烯醇合酶活性的多肽由与SEQID NO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903或905具有至少70%序列同一性的核酸序列编码。
68.如实施方案60-67中任一项所述的方法,其中所述接触导致生成葫芦二烯醇和/或24,25-环氧葫芦二烯醇。
69.如实施方案60-68中任一项所述的方法,其中2,3-氧化角鲨烯、二氧化角鲨烯和二环氧角鲨烯中的一种或多种由所述重组宿主细胞产生和/或存在于所述重组宿主细胞中。
70.如实施方案69所述的方法,其中所述2,3-氧化角鲨烯或二环氧角鲨烯是由包含SEQ ID NO:898或900所示序列的酶产生的。
71.如实施方案69所述的方法,其中2,3-氧化角鲨烯、二氧化角鲨烯和二环氧角鲨烯中的一种或多种的产生涉及由SEQ ID NO:897或899所示核酸序列编码的酶。
72.如实施方案60所述的方法,其中所述具有葫芦二烯醇合酶活性的多肽包含与SEQ ID NO:70-73、75-77、319、321、323、325、327、329-333、420、422、424、426、446、902、904和906中任何一者具有至少70%序列同一性的氨基酸序列。
73.如实施方案60所述的方法,其中所述具有葫芦二烯醇合酶活性的多肽由基因编码,所述基因包含与SEQ ID NO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905中任何一者具有70%序列同一性的核酸序列。
74.如实施方案56-73中任一项所述的方法,其中所述11-羟基葫芦二烯醇由所述重组宿主细胞产生和/或存在于所述重组宿主细胞中。
75.如实施方案74所述的方法,其中该重组宿主细胞包含编码CYP87D18或SgCPR蛋白质的基因。
76.如实施方案75所述的方法,其中所述CYP87D18或SgCPR蛋白包含与SEQ ID NO:872或SEQ ID NO:874具有至少70%序列同一性的氨基酸序列。
77.如实施方案75的方法,其中所述CYP87D18或SgCPR蛋白由与SEQ ID NO:871或SEQ ID NO:873具有至少70%序列同一性的核酸序列编码。
78.如实施方案2-77中任一项所述的方法,其中所述方法包括使角鲨烯与重组宿主细胞接触,其中所述重组宿主细胞包含编码角鲨烯环氧酶的第八基因。
79.如实施方案78所述的方法,其中所述接触导致2,3-氧化角鲨烯的产生。
80.如实施方案78或79所述的方法,其中所述角鲨烯由所述重组宿主细胞产生和/或存在于所述重组宿主细胞中。
81.如实施方案78-80中任一项所述的方法,其中所述角鲨烯环氧酶包含与SEQ IDNO:50-56、60、61、334和335中任何一者具有至少70%序列同一性的氨基酸序列。
82.如实施方案78-80中任一项所述的方法,其中所述角鲨烯环氧酶由与SEQ IDNO:335具有至少70%序列同一性的核酸序列编码。
83.如实施方案2-82中任一项所述的方法,其中所述方法包括使法呢基焦磷酸与所述重组宿主细胞接触,其中所述重组宿主细胞包含编码角鲨烯合酶的第九基因。
84.如实施方案83所述的方法,其中所述接触导致角鲨烯的产生。
85.如实施方案83或84所述的方法,其中所述法呢基焦磷酸由所述重组宿主细胞产生和/或存在于所述重组宿主细胞中。
86.如实施方案83-85中任一项所述的方法,其中所述角鲨烯合酶包含与SEQ IDNO:69和336中任何一者具有至少70%序列同一性的氨基酸序列。
87.如实施方案83-85中任一项所述的方法,其中所述角鲨烯合酶由包含与SEQ IDNO:337具有至少70%序列同一性的核酸序列的序列编码。
88.实施方案2-87中任一项的方法,其中所述方法包括使香叶基-PP与重组宿主细胞接触,其中所述重组宿主细胞包含编码法呢基-PP合酶的第十基因。
89.如实施方案88所述的方法,其中所述接触导致法呢基-PP的产生。
90.如实施方案88或89所述的方法,其中,所述香叶基-PP由所述重组宿主细胞产生和/或存在于所述重组宿主细胞中。
91.如实施方案88-90中任一项的方法,其中所述法呢基-PP合酶包含与SEQ IDNO:338具有至少70%序列同一性的氨基酸序列。
92.如实施方案88-90中任一项的方法,其中所述法呢基-PP合酶由与SEQ ID NO:339具有至少70%序列同一性的核酸序列编码。
93.如实施方案2-92中任一项所述的方法,其中所述第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个与异源启动子可操作地连接。
94.如实施方案93所述的方法,其中所述异源启动子是CMV、EF1a、SV40、PGK1、人β-肌动蛋白、CAG、GAL1、GAL10、TEF1、GDS、ADH1、CaMV35S、Ubi、T7、T7lac、Sp6、araBAD、trp、lac、Ptac、pL启动子或其组合。
95.如实施方案93或94所述的方法,其中所述启动子是诱导型、阻遏型或组成型启动子。
96.如实施方案2-95中任一项所述的方法,其中在重组宿主细胞中丙酮酸、乙酰辅酶A、柠檬酸盐和TCA循环中间体中的一种或多种的产生已被上调。
97.如实施方案2-96中任一项所述的方法,其中在重组宿主细胞中细胞质定位已经被上调。
98.如实施方案2-97中任一项所述的方法,其中所述第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个包含至少一个编码2A自裂肽的序列。
99.如实施方案2-98中任一项的方法,其中所述重组宿主细胞是植物、双壳类、鱼类、真菌、细菌或哺乳动物的细胞。
100.如实施方案99所述的方法,其中所述植物选自罗汉果属(Siraitia)、苦瓜属(Momordica)、绞股蓝属(Gynostemma)、南瓜属(Cucurbita)、黄瓜属(Cucumis)、拟南芥属(Arabidopsis)、蒿属(Artemisia)、甜菊属(Stevia)、人参属(Panax)、睡茄属(Withania)、大戟属(Euphorbia)、苜蓿属(Medicago)、吊兰属(Chlorophytum)、五加属(Eleutherococcus)、楤木属(Aralia)、桑属(Morus)、苜蓿属(Medicago)、桦木属(Betula)、黄芪属(Astragalus)、麻疯树属(Jatropha)、山茶属(Camellia)、韧伞属(Hypholoma)、曲霉属(Aspergillus)、茄属(Solanum)、石杉属(Huperzia)、孩儿参属(Pseudostellaria)、黄麻属(Corchorus)、常春藤属(Hedera)、地钱属(Marchantia)和桑属(Morus)。
101.如实施方案99所述的方法,其中,所述真菌选自毛癣菌属(Trichophyton)、桑黄孔菌属(Sanghuangporus)、樟芝属(Taiwanofungus)、链疫孢属(Moniliophthora)、盘二孢属(Marssonina)、色二孢属(Diplodia)、微香菇属(Lentinula)、法夫酵母属(Xanthophyllomyces)、普可尼亚属(Pochonia)、炭疽菌属(Colletotrichum)、间座壳属(Diaporthe)、组织胞浆菌属(Histoplasma)、球孢子菌属(Coccidioides)、组织胞浆菌属(Histoplasma)、桑黄孔菌属(Sanghuangporus)、短梗霉属(Aureobasidium)、普可尼亚属(Pochonia)、青霉属(Penicillium)、孢子丝菌属(Sporothrix)、黑僵菌属(Metarhizium)、曲霉属(Aspergillus)、耶氏酵母属(Yarrowia)、油脂酵母属(Lipomyces)。
102.如实施方案99所述的方法,其中,所述真菌是构巢曲霉(Aspergillusnidulans)、解脂耶氏酵母(Yarrowia lipolytica)或圆红冬孢酵母菌(Rhodosporintoruloides)。
103.如实施方案99所述的方法,其中所述重组宿主细胞是酵母细胞。
104.如实施方案103所述的方法,其中所述酵母选自假丝酵母属(Candida)、酵母属(Sacccharaomyces)、酵母亚门(Saccharomycotina)、外囊菌亚门(Taphrinomycotina)、裂殖酵母纲(Schizosaccharomycetes)、毕赤酵母属(Komagataella)、担子菌门(Basidiomycota)、伞菌亚门(Agaricomycotina)、银耳纲(Tremellomycetes)、柄锈菌亚门(Pucciniomycotina)、短梗霉属(Aureobasidium)、锥毛壳属(Coniochaeta)、红冬孢酵母属(Rhodosporidium)和微球黑粉菌纲(Microboryomycetes)。
105.如实施方案99所述的方法,其中所述细菌选自弗兰克氏菌属(Frankia)、放线菌门(Actinobacteria)、链霉菌属(Streptomyces)和肠球菌属(Enterococcus)。
106.如实施方案99所述的方法,其中,所述重组宿主细胞是酿酒酵母(Saccharomyces cerevisiae)细胞或解脂耶氏酵母(Yarrowia lipolytica)细胞。
107.如实施方案2-106中任一项所述的方法,其中所述第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个是用于在细菌、哺乳动物、植物、真菌和/或昆虫细胞中表达密码子优化的基因。
108.如实施方案2-107中任一项所述的方法,其中所述第一、第二、第三、第四、第五、第六、第七、第八、第九和第十基因中的一个或多个包含对所编码的酶的活性增加的功能性突变。
109.如实施方案5-108中任一项所述的方法,其中培养所述重组宿主细胞包括监测所述培养条件的pH、溶解氧水平、氮水平或其组合。
110.如实施方案1-109中任一项所述的方法,包括分离化合物1。
111.如实施方案110所述的方法,其中分离化合物1包括裂解所述重组宿主细胞和/或从所述培养基分离化合物1。
112.如实施方案1-111中任一项所述的方法,包括纯化化合物1。
113.如实施方案112所述的方法,其中纯化化合物1包括HPLC、固相萃取或其组合。
114.如实施方案112或113所述的方法,其中所述纯化包括:收获所述重组宿主细胞;保存上清液;以及裂解重组宿主细胞。
115.如实施方案114的方法,其中所述裂解包括使细胞经受剪切力或去污剂洗涤,从而获得裂解物。
116.如实施方案115所述的方法,其中,所述剪切力来自超声法、高压细胞裂解或珠子。
117.如实施方案115或116所述的方法,其中使所述裂解物经历过滤和纯化步骤。
118.如实施方案117所述的方法,其中将所述裂解物通过固相萃取进行过滤和纯化。
119.如实施方案1-118中任一项所述的方法,包括在使罗汉果苷IIIE与第一酶接触之前,使第一罗汉果苷与一种或多种水解酶接触以产生罗汉果苷IIIE。
120.如实施方案119所述的方法,其中所述水解酶是β-葡聚糖水解酶。
121.如实施方案119所述的方法,其中所述水解酶是EXG1或EXG2。
122.如实施方案119所述的方法,其中所述水解酶包含氨基酸序列,所述氨基酸序列与SEQ ID NO:292、366-368、372、376-398、447-520、524-845、1013、1014和1023中任何一者具有至少70%的序列同一性。
123.实施方案119-122中任一项所述的方法,其中所述第一罗汉果苷选自罗汉果苷IV、罗汉果苷V、罗汉果苷VI及其组合。
124.实施方案119-122中任一项所述的方法,其中所述第一罗汉果苷选自罗汉果苷V、赛门苷I、罗汉果苷IV
125.实施方案119-124中任一项所述的方法,其中使所述第一罗汉果苷与一种或多种水解酶接触包括使所述第一罗汉果苷与包含编码所述水解酶的基因的宿主细胞接触。
126.如实施方案125的方法,其中包含编码所述水解酶的基因的宿主细胞是重组宿主细胞。
127.如实施方案125所述的方法,其中包含编码所述水解酶的基因的宿主细胞不是包含编码能够催化化合物1产生的第一酶的第一基因的重组宿主细胞。
128.实施方案125-127中任一项所述的方法,其中所述第一罗汉果苷由所述宿主细胞产生和/或存在于所述宿主细胞中。
129.实施方案125-128中任一项的方法,其中编码所述水解酶的基因与宿主细胞同源。
130.权利要求125-129中任一项所述的方法,其中编码所述水解酶的基因在所述宿主细胞中以正常水平表达。
131.如实施方案125-130中任一项的方法,其中编码所述水解酶的基因在宿主细胞中过表达。
132.如实施方案125-131中任一项所述的方法,其中编码所述水解酶的基因与宿主细胞异源。
133.如实施方案2至132中任一项所述的方法,其中所述重组细胞进一步包含氧化角鲨烯环化酶例如环阿屯醇合酶或β-香树酯醇合酶,或编码氧化角鲨烯环化酶例如环阿屯醇合酶或β-香树酯醇合酶的核酸序列,并且其中氧化角鲨烯环化酶、环阿屯醇合酶或β-香树酯醇合酶已被修饰以生产葫芦二烯醇或环氧葫芦二烯醇。
134.如实施方案133所述的方法,其中所述氧化角鲨烯环化酶包含SEQ ID NO:341、343和346-347中任何一者所示的序列。
135.如实施方案2-134中任一项所述的方法,其中所述重组细胞包含细胞色素P450还原酶或编码细胞色素P450还原酶的基因。
136.如实施方案135所述的方法,其中所述细胞色素P450还原酶包含SEQ ID NO:318所示的序列。
137.一种具有化合物1的结构的化合物:
其中所述化合物通过实施方案1-136中任一项所述的方法制备。138.一种细胞裂解物,其包含具有以下结构的化合物1:
139.一种重组细胞,其包含:具有以下结构的化合物1:
和编码能够催化从罗汉果苷IIIE产生化合物1的酶的基因。
140.如实施方案139所述的重组细胞,其中所述基因是重组细胞的异源基因。
141.一种重组细胞,其包含第一基因,该第一基因编码能够催化从罗汉果苷IIIE产生具有以下结构的化合物1的第一酶:
142.如实施方案141所述的细胞,其特征在于,所述第一酶是UDP糖基转移酶、环麦芽糊精葡聚糖转移酶(CGTases)、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。
143.如实施方案141所述的细胞,其中所述第一酶是CGTases。
144.如实施方案143的细胞,其中所述CGTases包含与SEQ ID NO:1、3、78-101、148和154中任何一者的序列具有至少70%序列同一性的氨基酸序列。
145.如实施方案141所述的细胞,其中所述CGTases包含SEQ ID NO:1、3、78-101、148和154中任何一者的氨基酸序列。
146.如实施方案141所述的细胞,其中所述第一酶是葡聚糖蔗糖酶。
147.如实施方案146所述的细胞,其中,所述葡聚糖蔗糖酶包含与SEQ ID NO:2、103、106-110、156和896中所示任一序列具有至少70%序列同一性的氨基酸序列。
148.如实施方案146所述的细胞,其中,所述葡聚糖蔗糖酶由与SEQ ID NO:104、105、157、158和895中任何一者具有至少70%序列同一性的核酸序列编码。
149.如实施方案141所述的细胞,其中所述第一酶是转葡糖苷酶。
150.如实施方案149所述的细胞,其中,所述转葡糖苷酶包含与SEQ ID NO:163-291和723中任何一者的序列具有至少70%序列同一性的氨基酸序列。
151.如实施方案149所述的细胞,其中所述转葡糖苷酶包含SEQ ID NO:3、95-102、163-291和723中任何一者的氨基酸序列。
152.如实施方案141所述的细胞,其中所述第一酶是β-葡糖苷酶。
153.如实施方案152的细胞,其中所述β-葡糖苷酶包含与SEQ ID NO:102、292、354-376和678-741具有至少70%序列同一性的氨基酸序列。
154.如实施方案141-153中任一项所述的细胞,其包含编码尿苷二磷酸-葡萄糖基转移酶(UGT)的第二基因。
155.如实施方案154所述的细胞,其中,所述UGT包含与SEQ ID NO:4-9、15-19、125、126、128、129、293-307、407、409、411、413、439、441或444具有至少70%序列同一性的氨基酸序列。
156.如实施方案154所述的细胞,其中所述UGT由与SEQ ID NO:116-124、127、130、408、410、412、414、440、442、443和445中任何一者具有至少70%序列同一性的核酸序列编码。
157.如实施方案154所述的细胞,其中,所述UGT由UGT1495(SEQ ID NO:10)、UGT1817(SEQ ID NO:11)、UGT5914(SEQ ID NO:12)、UGT8468(SEQ ID NO:13)或UGT10391(SEQ ID NO:14)中所示的序列编码。
158.如实施方案141-157中任一项所述的细胞,其包含编码UGT98或UGT SK98的第三基因。
159.如实施方案158所述的细胞,其中UGT98或UGT SK98包含与SEQ ID NO:9、407、16或306具有至少70%序列同一性的氨基酸序列。
160.如实施方案158所述的细胞,其中UGT98由SEQ ID NO:307所示的核酸序列编码。
161.如实施方案141-160中任一项所述的细胞,其包含编码环氧化物水解酶的第四基因。
162.如实施方案161所述的细胞,其中所述环氧化物水解酶包含与SEQ ID NO:21-30和309-314中任何一者具有至少70%序列同一性的氨基酸序列,或由与SEQ ID NO:114和115中任何一者具有至少70%序列同一性的核酸序列编码。
163.如实施方案141-162中任一项所述的细胞,其包含编码P450的第五序列。
164.如实施方案163所述的细胞,其中所述P450包含与SEQ ID NO:20、49、308、315、430、872、874、876、878、880、882、884、886、888、890和891中任何一者具有至少70%序列同一性的氨基酸序列;或由与SEQ ID NO:31-48、316、431、871、873、875、877、879、881、883、885、887、889和892中任何一者具有至少70%序列同一性的核酸序列编码。
165.如实施方案163所述的细胞,其中所述P450由包含SEQ ID NO:31-48、316和318中任何一者所示序列的基因编码。
166.如实施方案141-165中任一项所述的细胞,其包含编码具有葫芦二烯醇合酶活性的多肽的第六序列。
167.如实施方案166所述的方法,其中具有葫芦二烯烯合酶活性的多肽是融合蛋白。
168.如实施方案167所述的方法,其中,所述融合蛋白包含与葫芦二烯烯合酶的N-末端、C-末端或两者融合的融合结构域。
169.如实施方案168所述的方法,其中所述融合结构域长约3至约1000个氨基酸。
170.如实施方案169所述的方法,其中所述融合结构域长约5至约50个氨基酸。
171.如实施方案168或169所述的方法,其中所述融合结构域是功能蛋白的主要部分或整个序列。
172.如实施方案166所述的细胞,其中所述具有葫芦二烯醇合酶活性的多肽包含与SEQ ID NO:70-73、75-77、319、321、323、325、327-333、417、420、422、424、426、446、902、904、906、851、854、856、1024、859、862、865、867、915、920、924、928、932、936、940、944、948、952、956、959、964、967、971、975、979、983、987、991、995、999、1003、1007和1011中任何一者具有至少70%序列同一性的氨基酸序列。
173.如实施方案166所述的细胞,其中所述具有葫芦二烯醇合酶活性的多肽由与SEQ ID NO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905中任何一者具有至少70%序列同一性的核酸序列编码。
174.如实施方案141-173中任一项所述的细胞,其包含编码角鲨烯环氧酶的第七基因。
175.如实施方案174所述的细胞,其中所述角鲨烯环氧酶包含与SEQ ID NO:50-56、60、61、334和335中任何一者具有至少70%序列同一性的氨基酸序列。
176.如实施方案174所述的细胞,其中所述角鲨烯环氧酶由与SEQ ID NO:335具有至少70%序列同一性的核酸序列编码。
177.如实施方案141-176中任一项所述的细胞,其包含编码角鲨烯合酶的第八基因。
178.如实施方案177所述的细胞,其中所述角鲨烯合酶包含与SEQ ID NO:69或336具有至少70%序列同一性的氨基酸序列。
179.如实施方案177所述的细胞,其中所述角鲨烯合酶由包含SEQ ID NO:337所示核酸序列的序列编码。
180.如实施方案141-179中任一项所述的细胞,其包含编码法呢基-PP合酶的第九基因。
181.如实施方案180所述的细胞,其中所述法呢基-PP合酶包含与SEQ ID NO:338具有至少70%序列同一性的氨基酸序列。
182.如实施方案180所述的细胞,其中所述法呢基-PP合酶由与SEQ ID NO:339具有至少70%序列同一性的核酸序列编码。
183.如实施方案141-182中任一项所述的细胞,其中所述细胞是哺乳动物、植物、细菌、真菌或昆虫的细胞。
184.如实施方案141-182中任一项所述的细胞,其中所述细胞是酵母细胞,其中所述酵母选自假丝酵母属(Candida)、酵母属(Sacccharaomyces)、酵母亚门(Saccharomycotina)、外囊菌亚门(Taphrinomycotina)、裂殖酵母纲(Schizosaccharomycetes)、毕赤酵母属(Komagataella)、担子菌门(Basidiomycota)、伞菌亚门(Agaricomycotina)、银耳纲(Tremellomycetes)、柄锈菌亚门(Pucciniomycotina)、短梗霉属(Aureobasidium)、锥毛壳属(Coniochaeta)和微球黑粉菌纲(Microboryomycetes)。
185.如实施方案183所述的细胞,其中,所述植物选自罗汉果属(Siraitia)、苦瓜属(Momordica)、绞股蓝属(Gynostemma)、南瓜属(Cucurbita)、黄瓜属(Cucumis)、拟南芥属(Arabidopsis)、蒿属(Artemisia)、甜菊属(Stevia)、人参属(Panax)、睡茄属(Withania)、大戟属(Euphorbia)、苜蓿属(Medicago)、吊兰属(Chlorophytum)、五加属(Eleutherococcus)、楤木属(Aralia)、桑属(Morus)、苜蓿属(Medicago)、桦木属(Betula)、黄芪属(Astragalus)、麻疯树属(Jatropha)、山茶属(Camellia)、韧伞属(Hypholoma)、曲霉属(Aspergillus)、茄属(Solanum)、石杉属(Huperzia)、孩儿参属(Pseudostellaria)、黄麻属(Corchorus)、常春藤属(Hedera)、地钱属(Marchantia)和桑属(Morus)。
186.如实施方案183所述的细胞,其中所述真菌是毛癣菌属(Trichophyton)、桑黄孔菌属(Sanghuangporus)、樟芝属(Taiwanofungus)、链疫孢属(Moniliophthora)、盘二孢属(Marssonina)、色二孢属(Diplodia)、微香菇属(Lentinula)、法夫酵母属(Xanthophyllomyces)、普可尼亚属(Pochonia)、炭疽菌属(Colletotrichum)、间座壳属(Diaporthe)、组织胞浆菌属(Histoplasma)、球孢子菌属(Coccidioides)、组织胞浆菌属(Histoplasma)、桑黄孔菌属(Sanghuangporus)、短梗霉属(Aureobasidium)、普可尼亚属(Pochonia)、青霉属(Penicillium)、孢子丝菌属(Sporothrix)、或黑僵菌属(Metarhizium)。
187.如实施方案141-186中任一项所述的细胞,其中所述重组细胞包含编码至少一种能够水解罗汉果苷V的水解酶的基因。
188.如实施方案141-187中任一项所述的细胞,其中化合物1显示出对重组细胞中水解酶的耐受性,其中所述水解酶显示出将罗汉果苷VI、罗汉果苷V、罗汉果苷IV水解为罗汉果苷IIIE的能力。
189.如实施方案141-188中任一项所述的细胞,其中所述重组细胞进一步包含氧化角鲨烯环化酶例如环阿屯醇合酶或β-香树酯醇合酶,或编码氧化角鲨烯环化酶例如环阿屯醇合酶或β-香树酯醇合酶的核酸序列,并且其中氧化角鲨烯环化酶、环阿屯醇合酶或β-香树酯醇合酶经修饰以产生葫芦二烯醇或环氧葫芦二烯醇。
190.如实施方案189所述的细胞,其中所述氧化角鲨烯环化酶包含与SEQ ID NO:341、343和346-347中任何一者具有至少70%序列同一性的氨基酸序列。
191.如实施方案141-190中任一项所述的细胞,其中所述细胞包含细胞色素P450还原酶或编码细胞色素P450还原酶的基因。
192.如实施方案191所述的细胞,其中所述细胞色素P450还原酶再生细胞色素P450活性。
193.如实施方案191所述的细胞,其中所述细胞色素P450还原酶包含与SEQ IDNO:318具有至少70%序列同一性的序列。
194.如实施方案141-193中任一项所述的细胞,其中所述细胞包含SEQ ID NO:897、899、909、911、913、418、421、423、425、427、871、873、901、903或905中所示的序列。
195.如实施方案141-193中任一项所述的细胞,其中,所述细胞包含酶,所述酶包含SEQ ID NO:315、316、420、422、424、426、430、431、446、871、845-949或951-1012所示的序列,或由SEQ ID NO:315、316、420、422、424、426、430、431、446、871、845-949或951-1012所示的序列编码。
196.如实施方案141-195中任一项所述的细胞,其包含编码能够水解第一罗汉果苷以产生罗汉果苷IIIE的水解酶的基因。
197.如实施方案196所述的细胞,其中所述水解酶是β-葡聚糖水解酶。
198.如实施方案196所述的细胞,其中所述水解酶是EXG1或EXG2。
199.如实施方案196所述的细胞,其中所述水解酶包含氨基酸序列,所述氨基酸序列与SEQ ID NO:292、366-368、372、376-398、447-520、524-845、1013、1014和1023中任何一者具有至少70%的序列同一性。
200.如实施方案196-199中任一项所述的细胞,其中所述第一罗汉果苷选自罗汉果苷IV、罗汉果苷V、罗汉果苷VI及其组合。
201.如实施方案196-200中任一项所述的细胞,其中所述第一罗汉果苷选自罗汉果苷V、赛门苷I、罗汉果苷IVE、罗汉果苷VI、罗汉果苷IVA及其组合。
202.如实施方案196-201中任一项所述的细胞,其中编码所述水解酶的基因与重组宿主细胞同源。
203.如实施方案196-202中任一项所述的细胞,其中编码所述水解酶的基因以正常水平表达。
204.如实施方案196-202中任一项所述的细胞,其中编码所述水解酶的基因是过表达的。
205.如实施方案196-204中任一项所述的细胞,其中编码所述水解酶的基因与该细胞是异源的。
206.如实施方案195-205中任一项所述的细胞,其中所述细胞是酵母细胞。
207.如实施方案206所述的细胞,其中所述细胞是酿酒酵母(Saccharomycescerevisiae)或解脂耶氏酵母(Yarrowia lipolytica)。
208.一种产生具有以下结构的化合物1的方法:
该方法包括:
使第一罗汉果苷与一种或多种水解酶接触以产生罗汉果苷IIIE;和
使罗汉果苷III
209.如实施方案208所述的方法,其中所述水解酶是β-葡聚糖水解酶。
210.如实施方案208所述的方法,其中所述水解酶是EXG1。
211.如实施方案210所述的方法,其中所述EXG1包含与SEQ ID NO:1012或1014具有至少70%序列同一性的氨基酸序列。
212.如实施方案208所述的方法,其中所述水解酶是EXG2。
213.如实施方案210所述的方法,其中所述EXG2包含与SEQ ID NO:1023具有至少70%序列同一性的氨基酸序列。
214.如实施方案208-213中任一项所述的方法,其中所述第一罗汉果苷选自罗汉果苷IV、罗汉果苷V、罗汉果苷VI及其组合。
215.如实施方案214所述的方法,其中第一罗汉果苷选自罗汉果苷V、赛门苷I、罗汉果苷IV
216.如实施方案208-215中任一项所述的方法,其中使所述第一罗汉果糖苷与一种或多种水解酶接触包括使所述第一罗汉果糖苷与重组宿主细胞接触,所述重组宿主细胞包含编码所述水解酶的第一基因和编码能够催化化合物1产生的酶的第二基因。
217.如实施方案208-216中任一项所述的方法,其中所述第一罗汉果苷在重组宿主细胞中接触所述一种或多种水解酶,所述重组宿主细胞包含编码所述水解酶的第一基因和编码能够催化化合物1产生的酶的第二基因。
218.如实施方案208-217中任一项所述的方法,其中所述第一罗汉果苷由所述重组宿主细胞产生。
219.如实施方案208-218中任一项所述的方法,其中所述第一基因对于所述重组宿主细胞是天然的。
220.如实施方案208-219中任一项所述的方法,其中所述第一基因以正常水平表达或过表达。
221.如实施方案208-218中任一项所述的方法,其中所述第一基因与所述重组宿主细胞是异源的或异源的。
222.如实施方案208-221中任一项所述的方法,其中所述能够催化化合物1产生的酶是UDP糖基转移酶、环麦芽糊精葡聚糖转移酶(CGTases)、糖基转移酶、葡聚糖蔗糖酶、纤维素酶、β-葡糖苷酶、淀粉酶、转葡糖苷酶、果胶酶和葡聚糖酶中的一种或多种。
223.一种重组细胞,其包含:
第一基因,其编码能够水解第一罗汉果苷以产生罗汉果苷IIIE的水解酶;和
第二基因,其编码能够催化从罗汉果苷III
224.如实施方案223所述的细胞,其中,所述水解酶是β-葡聚糖水解酶。
225.如实施方案223所述的细胞,其中所述水解酶是EXG1或EXG2。
226.如实施方案228所述的细胞,其中所述EXG2蛋白包含与SEQ ID NO:1023具有至少70%序列同一性的氨基酸序列。
227.如实施方案223-226中任一项所述的细胞,其中,所述第一罗汉果苷选自罗汉果苷IV、罗汉果苷V、罗汉果苷VI及其组合。
228.如实施方案223-226中任一项所述的细胞,其中所述第一罗汉果苷选自罗汉果苷V、赛门苷I、罗汉果苷IV
229.如实施方案223-238中任一项所述的细胞,其中所述第一基因与所述重组宿主细胞是同源的或异源的。
230.如实施方案223-229中任一项所述的细胞,其中所述第一基因以正常水平表达或过表达。
231.如实施方案223-230中任一项所述的细胞,其中所述细胞是酵母细胞。
232.如实施方案231所述的细胞,其中所述细胞是酿酒酵母(Saccharomycescerevisiae)或解脂耶氏酵母(Yarrowia lipolytica)。
233.一种具有葫芦二烯醇合酶活性的融合多肽,其中所述融合多肽包含与葫芦二烯醇合酶融合的融合结构域。
234.如实施方案233所述的融合多肽,其中所述融合结构域与葫芦二烯醇合酶的N-末端融合。
235.如实施方案233所述的融合多肽,其中所述融合结构域与葫芦二烯醇合酶的C-末端融合。
236.如实施方案233-235中任一项所述的融合多肽,其中所述融合结构域长约3至约1000个氨基酸。
237.如实施方案233-236中任一项所述的融合多肽,其中所述融合结构域长约5至约50个氨基酸。
238.如实施方案233-236中任一项所述的融合多肽,其中所述融合结构域包含功能蛋白的主要部分或整个序列。
239.如实施方案233-236中任一项所述的融合多肽,其中所述融合结构域是功能蛋白的主要部分或整个序列。
240.如实施方案233-239中任一项所述的融合多肽,其中所述融合结构域包含酵母蛋白的一部分或全部序列。
241.如实施方案233-239中任一项所述的融合多肽,其中所述融合结构域是酵母蛋白的一部分或全部序列。
242.如实施方案241所述的融合多肽,其中所述融合多肽包含与SEQ ID NO:851、854、856、1024、859、862、865、867、915、920、924、928、932、936、940、944、948、952、956、959、964、967、971、975、979、983、987、991、995、999、1003、1007和1011中任何一者具有至少70%序列同一性的氨基酸序列。
243.如实施方案241所述的融合多肽,其中所述融合多肽包含SEQ ID NO:851、854、856、1024、859、862、865、867、915、920、924、928、932、936、940、944、948、952、956、959、964、967、971、975、979、983、987、991、995、999、1003、1007和1011中任何一者所示的氨基酸序列。
244.如实施方案233-235中任一项所述的融合多肽,其中所述融合多肽的融合结构域包含与SEQ ID NO:866、870、917、921、925、929、933、937、941、945、949、953、957、961、968、972、976、980、984、988、992、996、1000、1004、1008和1012中任何一者具有至少70%序列同一性的氨基酸序列。
245.如实施方案233-235中任一项所述的融合多肽,其中所述融合多肽的融合结构域包含SEQ ID NO:866、870、917、921、925、929、933、937、941、945、949、953、957、961、968、972、976、980、984、988、992、996、1000、1004、1008和1012中任何一者所示的氨基酸序列。
246.如实施方案233-241、244和245中任一项所述的融合多肽,其中所述葫芦二烯醇合酶包含与SEQ ID NO:70-73、75-77、319、321、323、325、327、329-333、420、422、424、426、446、902、904和906中任何一者具有至少70%序列同一性的氨基酸序列。
247.如实施方案233-241、244和245中任一项所述的融合多肽,其中所述葫芦二烯醇合酶包含SEQ ID NO:70-73、75-77、319、321、323、325、327、329-333、420、422、424、426、446、902、904和906中任何一者所示的氨基酸序列。
248.如实施方案233-241、244和245中任一项所述的融合多肽,其中所述葫芦二烯醇合酶由包含与SEQ ID NO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905中任何一者具有70%序列同一性的核酸序列的基因编码。
249.如实施方案233-241、244和245中任一项所述的融合多肽,其中所述葫芦二烯醇合酶由包含SEQ ID NO:74、320、322、324、326、328、418、421、423、425、427、897、899、901、903和905中任何一者核酸序列的基因编码。
250.一种重组核酸分子,其包含编码实施方案233-249中任一项的融合多肽的核酸序列。
251.一种重组细胞,其包含实施方案233-249中任一项的融合多肽或权利要求250的重组核酸分子。
252.一种方法,其包括使葫芦二烯醇合酶的底物与实施方案233-249中任一项的具有葫芦二烯醇合酶活性的融合多肽接触。
253.如实施方案252所述的方法,其中所述接触导致产生葫芦二烯醇、24,25-环氧葫芦二烯醇或其组合。
254.如实施方案252或253所述的方法,其中所述葫芦二烯醇合酶的底物包含2,3-氧化角鲨烯、二氧化角鲨烯和二环氧角鲨烯中的一种或多种。
255.如实施方案252-254中任一项所述的方法,其中所述接触包括使所述底物与重组宿主细胞接触,所述重组宿主细胞包含编码所述融合多肽的核酸序列。
256.如实施方案255所述的方法,其中所述底物存在于所述重组宿主细胞中和/或由所述重组宿主细胞产生。
257.一种具有化合物1的结构的化合物:
其中所述化合物是分离纯化的形式。
258.一种组合物,包括具有化合物1的结构的化合物:
其中所述组合物包含按重量计大于50%的化合物。
259.实施方案258的组合物,其包含按重量计少于1%,0.5%或0.1%的罗汉果苷IIIE。
260.实施方案258或259的组合物,其包含按重量计小于0.3%,0.1%,0.05%或0.01%的11-氧代-罗汉果苷III
261.实施方案258的组合物,其包含按重量计少于1%,0.5%或0.1%的罗汉果苷I,罗汉果苷II和罗汉果苷III的所有异构体。
262.实施方案258的组合物,其包含按重量计少于0.1%的罗汉果苷IIIE,11-氧代-罗汉果苷IIIE,罗汉果苷IIIA2,罗汉果苷IE和罗汉果苷IIE。
263.实施方案258-262中任一项的组合物,其包含按重量计小于1%,0.5%或0.1%的11-氧代-罗汉果醇。
264.实施方案258-263中任一项的组合物,其包含按重量计大于70%,80%或90%的化合物。
265.实施方案258-264中任一项的组合物,其中该组合物为固体形式。
266.一种组合物,其包含具有化合物(1)的结构的化合物的溶液:
267.实施方案266的组合物,其中该化合物在溶液中的浓度大于500ppm,0.1%,0.5%,1%,5%或10%。
268.实施方案266的组合物,其包含罗汉果苷IIIE的浓度小于100ppm,50ppm,20ppm或5ppm。
269.实施方案266-268中任一项的组合物,其包含浓度小于30ppm,10ppm,1ppm或0.1ppm的11-氧代-罗汉果苷IIIE。
270.实施方案266的组合物,其包含罗汉果糖苷I,罗汉果糖苷II和罗汉果糖苷III的所有异构体的组合浓度小于1%,0.5%,0.1%,500ppm或100ppm。
271.实施方案266的组合物,其包含少于500ppm或100ppm的罗汉果苷IIIE,11-氧代-罗汉果苷IIIE,罗汉果苷IIIA2,罗汉果苷IE和罗汉果苷IIE的组合浓度。
272.实施方案266-271中任一项的组合物,其包含小于0.5%或100ppm的浓度的11-氧代-罗汉果醇。
273.一种组合物,其包含增量剂和一种或多种具有化合物(1)结构的化合物:
274.实施方案273的组合物,包含按重量计大于0.5%,1%或2%的所述化合物。
275.实施方案273的组合物,包含按重量计大于30%,50%,70%,90%或99%的所述增量剂。
276.一种组合物,其包含实施方案257的化合物和至少一种另外的甜味剂和/或甜味改良剂。
277.实施方案276的组合物用于传达、增强、改良或改善可消费产品的甜味的用途。
- 制备高强度甜味剂的方法
- 制备高强度甜味剂的方法
