改善植物性状的方法、组合物和培养基
文献发布时间:2023-06-19 13:46:35
相关申请的交叉引用
本申请要求2018年12月21日提交的美国临时专利申请系列号62/784,277的优先权,其公开内容通过引用全文纳入本文。
背景技术
植物通过一个共同的代谢组群与微生物群组相连。特定作物性状和潜在的代谢组之间的多维关系的特点是具有许多局部最大值的关系。通过改变微生物组对代谢组的影响,从一个较低的局部最大值优化到另一个代表更好性状的最大值可能出于多种原因是所需的,例如作物优化。为了满足日益增长的全球人口需要,必须对农业和粮食生产采取经济、环境和社会可持续的办法。到2050年,联合国粮食及农业组织预测,粮食总产量必须增加70%才能满足不断增长的人口的需求,这一挑战由于许多因素而加剧,包括淡水资源减少,对耕地的竞争加剧,能源价格上涨,投入成本增加以及作物可能需要适应干旱、炎热和更加极端的全球气候的压力。
感兴趣的领域之一是改进氮固定。氮气(N
发明概述
在一些实施方式中,本发明提供了一种预测微生物菌株的植物原位表型的方法,该方法包括在植物排出物培养基(PEM)中培养微生物菌株;测定微生物菌株的体外表型;和利用体外表型预测该菌株的植物原位表型。在某些情况下,微生物菌株是从土壤样品中分离出来的。在某些情况下,微生物菌株是一种遗传修饰的微生物菌株。在某些情况下,遗传修饰的微生物菌株是通过随机突变产生的。在某些情况下,遗传修饰的微生物菌株是通过转座子突变产生的。在某些情况下,遗传修饰的微生物菌株是通过定点突变产生的。在某些情况下,遗传修饰的微生物菌株是内生菌。在某些情况下,遗传修饰的微生物菌株是附生菌。在某些情况下,遗传修饰的微生物菌株是根际的。在某些情况下,预测的植物原位表型是一种改良表型。在某些情况下,预测的植物原位表型是一种劣化表型。在某些情况下,体外表型是固氮活性。在某些情况下,固氮活性是用乙炔还原法测定的。在某些情况下,体外表型是铵排出。在某些情况下,植物的植物原位表型是植物定殖能力。在某些情况下,体外表型是生长速率。在某些情况下,体外表型是微生物菌株培养物的峰值光密度。
在某些情况下,植物原位表型是根际适应性。在某些情况下,根际适应性是用定殖试验测定的。在某些情况下,定殖试验是在水培系统中植物原位进行的。在某些情况下,定殖试验是在生长室中植物原位进行的。在某些情况下,定殖试验是在温室的植物原位进行的。在某些情况下,定殖试验是在田间植物原位进行的。在某些情况下,根际适应性是用细胞生长竞争试验测定的。在某些情况下,体外表型是细胞生长竞争试验中的生长。在某些情况下,细胞生长竞争试验是在细胞培养板上进行的。在某些情况下,细胞生长竞争试验是在培养瓶中进行的。在某些情况下,细胞生长竞争试验是在水培系统的植物原位进行的。在某些情况下,细胞生长竞争试验是在生长室或温室的植物原位进行的。在某些情况下,细胞生长竞争试验是在田间植物原位进行的。在某些情况下,根际适应性是用两个或更多个细胞生长竞争试验测定的。在某些情况下,两个或更多个细胞生长竞争试验是在不同的环境条件下进行的。
在一些实施方式中,本发明提供了一种选择具有改变的植物原位表型的遗传修饰的微生物菌株的方法,该方法包括:在植物排出物培养基(PEM)中培养遗传修饰的微生物菌株;测定所述遗传修饰的微生物菌株的体外表型;以及如果其与在类似条件下培养的同一物种的非遗传修饰的微生物菌株相比在体外表型上表现出改变,则选择该遗传修饰的微生物菌株,从而选择具有改变的植物原位表型的遗传修饰的微生物菌株。在某些情况下,改变的植物原位表型是一种改良表型。在某些情况下,改变的植物原位表型是一种劣化表型。在某些情况下,该方法还包括将遗传改变引入亲本微生物菌株以产生遗传修饰的微生物菌株。在某些情况下,亲本微生物菌株是与遗传修饰的微生物菌株属于相同物种的非遗传修饰的微生物菌株。在某些情况下,该方法还包括在PEM中培养亲本微生物菌株。在某些情况下,体外表型是固氮活性。在某些情况下,固氮活性是用乙炔还原法测定的。在某些情况下,体外表型是铵排出。在某些情况下,植物原位表型是促进植物生长。在某些情况下,植物原位表型是植物定殖能力。在某些情况下,体外表型是生长速率。在某些情况下,体外表型是微生物菌株培养物的峰值光密度。在某些情况下,植物原位表型是根际适应性。在某些情况下,根际适应性是用定殖试验测定的。在某些情况下,定殖试验是在水培系统的植物原位进行的。在某些情况下,定殖试验是在生长室中植物原位进行的。在某些情况下,定殖试验是在温室的植物原位进行的。
在某些情况下,定殖试验是在田间植物原位进行的。在某些情况下,根际适应性是用细胞生长竞争试验测定的。在某些情况下,体外表型是细胞生长竞争试验中的生长。在某些情况下,细胞生长竞争试验是在细胞培养板上进行的。在某些情况下,细胞生长竞争试验是在培养瓶中进行的。在某些情况下,细胞生长竞争试验是在水培系统的植物原位进行的。在某些情况下,细胞生长竞争试验是在生长室或温室的植物原位进行的。在某些情况下,细胞生长竞争试验是在田间植物原位进行的。在某些情况下,根际适应性是用两个或更多个细胞生长竞争试验测定的。在某些情况下,两个或更多个细胞生长竞争试验是在不同的环境条件下进行的。在某些情况下,遗传修饰的微生物菌株是通过随机突变产生的。在某些情况下,遗传修饰的微生物菌株是通过转座子突变产生的。在某些情况下,遗传修饰的微生物菌株是通过定点突变产生的。在某些情况下,遗传修饰的微生物菌株是内生菌。
在某些情况下,遗传修饰的微生物菌株是附生菌。在某些情况下,遗传修饰的微生物菌株是根际的。在某些情况下,当遗传修饰的微生物菌株与植物一起生长时,可以观察到植物原位表型。在某些情况下,这种植物是谷类植物。在一些情况下,所述植物选自下组:玉米、大豆、油菜、高粱、马铃薯、水稻、大麦、非洲小米(fonio)、燕麦、帕尔默草(Palmer’sgrass)、黑麦、珍珠粟、高粱、斯佩耳特小麦(spelt)、埃塞俄比亚画眉草(teff)、黑小麦、小麦、面包果、荞麦、香蒲、芡欧鼠尾草(chia)、亚麻、籽粒苋、邯杂(hanza)、藜麦和芝麻。在一些情况下,所述植物选自下组:玉米、小麦和水稻。
在一些实施方式中,本发明提供了一种选择被植物排出物培养基(PEM)的组分吸引的植物相关微生物的方法,所述方法包括获得或提供包含多个区域的半固体琼脂平板,所述多个区域包括:第一区域,包括溶解在丰富培养基中的琼脂;最后区域,包括溶解在PEM中的琼脂;以及多个中间区域,每个中间区域包括丰富培养基和PEM的混合物,以形成从所述第一区域到所述最后区域的梯度;将多个假定的植物相关微生物施加到所述第一区域;将所述多个假定的植物相关微生物培养一段时间;以及收集从第一区域向最后区域迁移最远的一种或多种微生物,从而选择与植物相关的微生物。
在一些情况下,该方法还包括选择如上收集的多个植物相关微生物并获得附加的如同所述的半固体琼脂平板;将从步骤收集的多个植物相关微生物施加到额外的半固体琼脂平板上;以及收集从第一区域向最后区域迁移最远的一种或多种微生物。在一些情况下,将所述多个假定的植物相关微生物和/或所述多个收集的植物相关微生物培养至少6小时。在一些情况下,将所述多个假定的植物相关微生物和/或所述多个收集的植物相关微生物培养至少16小时。在一些情况下,将所述多个假定的植物相关微生物和/或所述多个收集的植物相关微生物培养至少一天。在一些情况下,将所述多个假定的植物相关微生物和/或所述多个收集的植物相关微生物培养至少两天。
在某些情况下,该方法还包括在执行最后步骤之前使收集的微生物接触诱变剂。在一些情况下,所述诱变剂选自下组:化学诱变、离子化辐射、和紫外线辐射。在某些情况下,多个假定的植物相关微生物包括野生型菌株。在某些情况下,所述多个假定的植物相关微生物包括从环境样品中分离的微生物。在某些情况下,所述多个假定的植物相关微生物包含由诱变形成的菌株库。在某些情况下,多个假定的植物相关微生物包含一种或多种具有DNA修复缺陷的菌株。在某些情况下,所述多个假定的植物相关微生物包括遗传修饰的微生物。在某些情况下,所述多个假定的植物相关微生物包括一种或多种内生菌。在某些情况下,所述多个假定的植物相关微生物包括一种或多种附生菌。在某些情况下,所述多个假定的植物相关微生物包括一种或多种根际微生物。
在一些实施方式中,本发明提供了一种产生与微生物菌株变体的亲本微生物菌株相比具有改变的植物定殖活性的微生物菌株变体的方法,所述方法包括:将遗传变异引入亲本微生物菌株,从而产生多个微生物菌株变体;在植物排出物培养基(PEM)中培养多个微生物菌株变体;以及从所述多个微生物菌株变体中分离出与所述亲本微生物菌株相比在所述PEM中具有改变的生长的微生物菌株变体。在某些情况下,多种基因变异的微生物菌株作为一个群落在PEM中培养。在某些情况下,改变的植物定殖活性是提高的植物定殖活性。在某些情况下,改变的植物定殖活性是劣化的植物定殖活性。在一些情况下,该方法还包括至少重复步骤2、3、4或5次。在一些实施方式中,本发明提供了一种对植物有益的微生物菌株进行田间试验的方法,包括:在植物排出物培养基(PEM)中培养多个植物有益微生物菌株;测定所述多个植物有益微生物菌株的体外表型;选择具有所需体外表型的植物有益微生物菌株;将所选植物有益微生物菌株与田间植物接触;以及评估所述田间植物的植物表型,将其与不接触所选植物有益微生物菌株的相似田地中的相似植物进行比较。在某些情况下,多个植物有益的微生物菌株包括多个不同种类的微生物。在某些情况下,多个植物有益的微生物菌株包括单一微生物物种的多个遗传变体。在某些情况下,该方法还包括当所需的体外表型是PEM中的高滴度生长时选择植物有益的微生物菌株。在某些情况下,该方法还包括当所需的体外表型是PEM中的高速生长时选择植物有益的微生物菌株。
在一些实施方式中,本发明提供了一种对植物有益的微生物菌株进行田间试验的方法,包括:在植物排出物培养基(PEM)中培养植物有益微生物菌株;测定所述植物有益微生物菌株的体外表型;如果体外表型在给定范围内,将植物有益微生物菌株与田间植物接触;以及评估所述田间植物的植物表型,将其与不接触植物有益微生物菌株的相似田地中的相似植物进行比较。在某些情况下,体外表型是生长速率。在某些情况下,植物表型是植物产量。在某些情况下,这些植物是谷类植物。在某些情况下,所述方法还包括鉴定与植物天然相关的微生物;分析PEM中微生物的生长情况;以及在PEM中鉴定具有所需生长速率的微生物。在某些情况下,该方法还包括将遗传改变引入一种或多种与植物天然相关的微生物中。在一些实施方式中,本发明提供了一种改善植物生长的方法,该方法包括使植物接触在PEM中具有所需生长速率的微生物。
在某些情况下,所需的生长速率是先前与植物生长的改善相关联的微生物的生长速率。在某些情况下,所需的生长速率如下确定:(i)鉴定能够在植物上定殖的微生物;(ii)测定PEM中微生物的生长情况;(iii)测定微生物对植物生长的影响;(iv)将PEM中微生物的所需生长速率确定为与植物生长的改善相关联的PEM中微生物的生长速率。在某些情况下,该方法还包括在(iii)和(iv)之间,将基因突变引入微生物。在某些情况下,该方法还包括通过以下方式筛选在PEM中具有所需生长速率的微生物:(i)鉴定能够在植物上定殖的一个或多个微生物;(ii)测定一个或多个微生物在PEM中的生长;(iii)测定一个或多个微生物对植物生长的影响;以及(iv)将在PEM中具有所需生长速率的微生物确定为与所述植物的改善生长相关联的一个或多个微生物中的微生物。在一些情况下,所述方法还包括,在步骤(iii)之后将基因突变引入所述微生物以产生遗传修饰的微生物,并且对所述遗传修饰的微生物重复步骤(i)到(iii)。在某些情况下,植物的生长是通过植物的产量来测量的。在某些情况下,植物的产量是通过植物产生的谷物的产量来测量的。在某些情况下,这种微生物是固氮生物。在某些情况下,这种微生物是一种溶磷微生物。在某些情况下,这种微生物是一种基因改变的微生物。在某些情况下,这种微生物是附生菌。在某些情况下,这种微生物是内生菌。在某些情况下,这种微生物是根际的。在某些情况下,这种植物是谷类植物。
在一些情况下,所述植物选自下组:玉米、大豆、油菜、高粱、马铃薯、水稻、大麦、非洲小米(fonio)、燕麦、帕尔默草(Palmer’s grass)、黑麦、珍珠粟、高粱、斯佩耳特小麦(spelt)、埃塞俄比亚画眉草(teff)、黑小麦、小麦、面包果、荞麦、香蒲、芡欧鼠尾草(chia)、亚麻、籽粒苋、邯杂(hanza)、藜麦和芝麻。在一些情况下,所述植物选自下组:玉米、小麦和水稻。
在一些实施方式中,本发明提供了一种用微生物菌株预测植物生长表型的方法,包括:在植物排出物培养基(PEM)中培养微生物菌株;测定微生物菌株的体外表型;以及使用(b)中的体外表型来预测与该微生物菌株一起生长的植物的表型。在某些情况下,微生物菌株的体外表型是PEM中的微生物生长。在某些情况下,与微生物菌株一起生长的植物的表型是植物生长。在某些情况下,与微生物菌株一起生长的植物的表型是植物产量。在某些情况下,与微生物菌株一起生长的植物是谷类植物。在一些情况下,与微生物菌株一起生长的植物选自下组:玉米、大豆、油菜、高粱、马铃薯、水稻、大麦、非洲小米(fonio)、燕麦、帕尔默草(Palmer’s grass)、黑麦、珍珠粟、高粱、斯佩耳特小麦(spelt)、埃塞俄比亚画眉草(teff)、黑小麦、小麦、面包果、荞麦、香蒲、芡欧鼠尾草(chia)、亚麻、籽粒苋、邯杂(hanza)、藜麦和芝麻。
在某些情况下,PEM是一种天然PEM(NPEM)。在某些情况下,NPEM是通过将植物的根系浸泡在水性溶液中形成的。在某些情况下,NPEM是通过将植物的根系浸泡在气培系统中形成的。在某些情况下,NPEM是通过将植物的根系浸泡在半固体琼脂中形成的。在某些情况下,NPEM是通过将植物的根系浸泡在吸收表面上形成的。在某些情况下,NPEM是通过将植物的根系浸泡在吸附表面上形成的。在某些情况下,NPEM是通过将植物部分在水性溶液中匀浆形成的。在某些情况下,NPEM是通过将植物根系在水性溶液中匀浆形成的。在某些情况下,这种植物是谷类植物。在一些情况下,所述植物选自下组:玉米、大豆、油菜、高粱、马铃薯、水稻、大麦、非洲小米(fonio)、燕麦、帕尔默草(Palmer’sgrass)、黑麦、珍珠粟、高粱、斯佩耳特小麦(spelt)、埃塞俄比亚画眉草(teff)、黑小麦、小麦、面包果、荞麦、香蒲、芡欧鼠尾草(chia)、亚麻、籽粒苋、邯杂(hanza)、藜麦和芝麻。在一些情况下,所述植物选自下组:玉米、小麦和水稻。在某些情况下,PEM是合成PEM。
在一些实施方式中,本发明提供一种工程化微生物,其包含改变对植物排出物培养基(PEM)的组分的化学吸引的修饰。在某些情况下,改变的化学吸引是化学吸引的改进。在某些情况下,改变的化学吸引是化学吸引的减少。在某些情况下,工程化的微生物是固氮细菌。在某些情况下,工程化的微生物是一种溶磷细菌。在某些情况下,PEM是一种天然PEM(NPEM)。在某些情况下,NPEM是通过将植物的根系浸泡在水性溶液中形成的。在某些情况下,NPEM是通过将植物的根系浸泡在气培系统中形成的。在某些情况下,NPEM是通过将植物的根系浸泡在半固体琼脂中形成的。在某些情况下,NPEM是通过将植物的根系浸泡在吸收表面上形成的。在某些情况下,NPEM是通过将植物的根系浸泡在吸附表面上形成的。在某些情况下,NPEM是通过将植物部分在水性溶液中匀浆形成的。在某些情况下,NPEM是通过将植物根系在水性溶液中匀浆形成的。在某些情况下,这种植物是谷类植物。在一些情况下,所述植物选自下组:玉米、大豆、油菜、高粱、马铃薯、水稻、大麦、非洲小米(fonio)、燕麦、帕尔默草(Palmer’s grass)、黑麦、珍珠粟、高粱、斯佩耳特小麦(spelt)、埃塞俄比亚画眉草(teff)、黑小麦、小麦、面包果、荞麦、香蒲、芡欧鼠尾草(chia)、亚麻、籽粒苋、邯杂(hanza)、藜麦和芝麻。在一些情况下,所述植物选自下组:玉米、小麦和水稻。在某些情况下,PEM是合成PEM。
在一些实施方式中,本发明提供了一种选择具有改善的植物原位表型的微生物菌株的方法,该方法包括:将遗传变异引入亲本菌株,从而产生遗传变异菌株库,在植物排出物培养基中培养遗传变异菌株和亲本菌株,在植物排出物培养基中测定遗传变异菌株的表型,在相似条件下,选择一中在植物排出物培养基中表现出比亲本菌株表型改善的遗传变异菌株;从而筛选出一种在植物原位具有改良表型的微生物菌株。在某些情况下,表型是固氮活性。在某些情况下,固氮试验是乙炔还原试验。在某些情况下,表型是铵排出。在某些情况下,铵排出试验是铵排出试验。在某些情况下,表型是植物定殖能力。在某些情况下,试验是植物定殖试验。在某些情况下,表型是根际适应性。在某些情况下,该分析是细胞生长竞争分析。在某些情况下,细胞生长竞争试验在体外进行。在某些情况下,细胞生长竞争试验是在96孔板上进行的。在某些情况下,细胞生长竞争试验是在培养瓶中进行的。在某些情况下,细胞生长竞争试验是在水培系统的植物原位进行的。在某些情况下,细胞生长竞争试验在植物原位进行。某些情况下,细胞生长竞争试验是在生长室或温室的植物原位进行的。
在某些情况下,细胞生长竞争试验是在田间植物原位进行的。
在某些情况下,两个或更多个细胞生长竞争试验是在不同的环境条件下进行的。在某些情况下,细胞生长竞争试验是在96孔板上进行的。在某些情况下,遗传变异是由随机突变产生的。在某些情况下,遗传变异是由转座子产生的。在某些情况下,遗传变异是由定点突变产生的。在某些情况下,微生物是内生菌。在某些情况下,微生物是附生菌。在某些情况下,微生物是根际的。在某些情况下,植物排出物培养基是天然植物排出物培养基。在某些情况下,天然植物排出物培养基是通过将植物的根系在水性溶液中培养形成的。在某些情况下,天然植物排出物培养基是通过将植物的根系在气培系统中培养形成的。在某些情况下,天然植物排出物培养基是通过将植物的根系在半固体琼脂中培养形成的。在某些情况下,天然植物排出物培养基是通过将植物的根系在吸收表面上培养形成的。在某些情况下,天然植物排出物培养基是通过将植物的根系在吸附表面上培养形成的。在某些情况下,植物是谷类植物。在一些情况下,所述植物选自下组:玉米、大豆、油菜、高粱、马铃薯、水稻、大麦、非洲小米(fonio)、燕麦、帕尔默草(Palmer’s grass)、黑麦、珍珠粟、高粱、斯佩耳特小麦(spelt)、埃塞俄比亚画眉草(teff)、黑小麦、小麦、面包果、荞麦、香蒲、芡欧鼠尾草(chia)、亚麻、籽粒苋、邯杂(hanza)、藜麦和芝麻。在一些情况下,所述植物选自下组:玉米、小麦和水稻。
在一些实施方式中,本发明提供了一种进化与进化的微生物菌株变体的亲本微生物菌株相比具有改善植物定殖活性的微生物菌株的方法,所述方法包括:(a)将遗传变异引入亲本菌株,从而产生遗传变异菌株库,(b)将遗传变异菌株作为一个群落在植物排出物培养基中培养,以及(c)从遗传变异菌株中分离进化的微生物,其中,与亲本菌株相比,分离的进化微生物具有改进的植物定殖活性。在一些情况下,该方法还包括至少重复步骤(b)和(c)两次。在一些情况下,该方法还包括至少重复步骤(b)和(c)三次。在一些情况下,该方法还包括至少重复步骤(b)和(c)四次。在一些情况下,该方法还包括至少重复步骤(b)和(c)五次。在一些实施方式中,本发明提供一种经修饰的工程化微生物,其对植物排出物培养基的组分具有增强的化学吸引力。在某些情况下,微生物是固氮细菌。在某些情况下,微生物是一种溶磷细菌。
在一些实施方式中,本公开提供了一种选择被植物排出物培养基的组分吸引的微生物的方法,该方法包括:获得具有多个区域的半固体琼脂平板,所述多个区域至少包括第一区域,所述第一区域包括溶解在丰富培养基中的琼脂;最后区域,包括溶解在植物排出物培养基中的琼脂;以及多个中间区域,每个中间区域包括丰富培养基和植物排出物培养基的混合物,从而形成从丰富培养基到植物排出物培养基的梯度;将多个微生物施加到所述半固体琼脂平板的第一区域,对所述半固体琼脂平板进行一段时间的培养,并从所述半固体琼脂平板的具有微生物的最后区域中收集微生物。在某些情况下,所述方法还包括重复所述步骤以富集吸引到植物排出物培养基的微生物。在一些情况下,培养半固体琼脂平板至少16小时。在一些情况下,培养半固体琼脂平板至少两天。在一些情况下,培养半固体琼脂平板至少一天。在一些情况下,培养半固体琼脂平板至少6小时。在某些情况下,该方法还包括在重复步骤(a)-(d)之前使收集的微生物接触诱变剂。在一些情况下,所述诱变剂选自下组:化学诱变、离子化辐射、和紫外线辐射。在某些情况下,多个微生物包括野生型菌株。在某些情况下,多个微生物包括菌株的突变库。在某些情况下,多个微生物包含一个或多个具有DNA修复缺陷的菌株。在某些情况下,所述多个微生物包括从环境样品中分离的微生物。在某些情况下,多个微生物包括微生物菌株库。在某些情况下,多个微生物包括遗传变体文库。
通过引用纳入
本说明书中提到的所有发表物、专利和专利申请通过引用纳入本文,就好像将各篇单独的发表物、专利或专利申请专门和单独地通过引用纳入本文那样。
附图简要说明
所附权利要求书中具体说明了本发明的新特征。可参考以下详述更好地理解本发明的特征和优点,这些详述阐述了利用本发明原理的说明性实施方式和附图,其中:
图1A说明了合成和天然排出物培养基上变栖克雷伯氏菌(K.variicola)的生长。所有培养基均添加10mM谷氨酰胺。
图1B说明了合成和天然排出物培养基上蔗糖小迫氏菌(K.sacchari)的生长。所有培养基均添加10mM谷氨酰胺。
图1C说明了合成的排出物培养基上的水生浅粉不全光合杆菌(R.aquatilis)的生长。所有培养基均添加10mM谷氨酰胺。
图2显示了用变栖克雷伯氏菌株137-2084在对照培养基(ARA)和合成排出物培养基FN1.0中进行乙炔还原分析(ARA)的结果。所有培养基均添加5mM磷酸铵。
图3说明了暴露于玉米根样品的水的氨基酸分析结果。
图4说明了暴露于玉米根样品的水的氨基酸分析结果。
图5A显示了在温室浆液培养基中生长的三种菌株的峰值光密度值。
图5B显示了图5A中的三种微生物在玉米根上生长时的定殖水平。
图6A显示了在温室浆液培养基中生长的五种菌株的峰值光密度值。
图6B显示了图6A中的五种微生物在玉米根上生长时的定殖水平。
图7A显示了在温室浆液培养基中生长的两种菌株的峰值光密度值。
图7B显示了图7A中的两种微生物在玉米根上生长时的定殖水平。
图8显示了在温室浆液培养基中生长的图6A的五种菌株的倍增时间。
图9A显示了在温室浆液培养基中生长的三种菌株在HTP读板仪中的效价。
图9B显示了在温室浆液培养基中以微型发酵罐形式生长的三种菌株的效价。
图9C显示了图9A和图9B中的三种微生物在玉米根上生长时的定殖水平。
图10A显示了在温室浆液培养基中生长的三种菌株的倍增时间。
图10B显示了图10A中的三种微生物在玉米根上生长时的定殖水平。
图11A显示了在生长室浆液培养基中生长的两种菌株的倍增时间。
图11B显示了接种了图11A中每种菌株的植物的鲜重。
图12A显示了在生长室浆液培养基中生长的三种微生物的效价。
图12B显示了图12A中三种微生物在生长室浆液培养基中生长时的倍增时间。
图12C显示了图12A中的三种微生物在田间玉米根上生长时的定殖水平。细胞/gFW是指每克根鲜重的细胞数。
图12D显示了使用图12C中的微生物物种进行第二次田间试验的结果。
具体实施方式
如本文所用,“植物原位”(in planta)通常指植物中、植物上或植物附近。例如,植物原位生长的细菌可以在植物的间隙、植物细胞、植物表面定殖,也可以生长在植物的根际。植物可包括叶、根、茎、种子、胚珠、花粉、花、果实等。“植物原位”一词也可用于描述在培养基中或培养基上生长的微生物,培养基中也含有植物或植物的部分,如植物的根。
如本文所使用的术语“多核苷酸”通常指包含多个核苷酸或核苷酸类似物的分子。多核苷酸可具有核苷酸(或核酸)序列。多核苷酸可以是任何长度的核苷酸链,并且可以包含脱氧核糖核苷酸、核糖核苷酸或其类似物。多核苷酸可以具有任何三维结构,并且可以进行已知或未知的任何功能。多核苷酸的非限制性实例包括:基因或基因片段的编码或非编码区域,由连锁分析定义的基因座,外显子,内含子,信使RNA(mRNA),转移RNA,核糖体RNA,短干扰RNA(siRNA),短发夹RNA(shRNA),微RNA(miRNA),核酶,cDNA,重组多核苷酸,支链多核苷酸,质粒,载体,任意序列的分离DNA,任意序列的分离RNA,核酸探针和引物。多核苷酸可包括一个或多个修饰的核苷酸,如甲基化的核苷酸和核苷酸类似物。如果存在,对核苷酸结构的修饰可在聚合物的组装之前或之后赋予。核苷酸序列可间插有非核苷酸组分。多核苷酸聚合后可被进一步修饰,如通过与标记性组分偶联。
如本文所用,“表达”通常指多核苷酸从脱氧核糖核酸(DNA)模板转录(例如转录成mRNA或其他RNA转录物)的过程和/或转录的mRNA随后被翻译成肽、多肽或蛋白质的过程。转录物和编码的多肽可以统称为“基因产物”。如果多核苷酸源自基因组DNA,则表达可包括真核细胞中mRNA的剪接。
术语“多肽”通常指氨基酸的聚合物。聚合物可以是线性或支化聚合物,可以包含经修饰的氨基酸,和/或可间插有非氨基酸。该术语也可包括修饰的氨基酸聚合物;例如,通过二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其它操作,如与标记性组分偶联。
本文所用术语“氨基酸”通常指天然和/或非天然或合成的氨基酸,包括甘氨酸,以及D和/或L光学异构体,氨基酸类似物和/或肽模拟物。
本文所用术语“约”与术语“大致”同义。使用与数量相关的术语“约”一词通常指略高于所引用值的值,例如,加或减0.1%至10%。
如本文所使用的,术语“生物纯培养物”或“基本纯的培养物”通常是指本文所描述的细菌物种的培养物,其不包含数量足以干扰培养物的复制或可由正常细菌学技术检测的其它细菌种类。
如本文所使用的,在基因或基因片段的上下文中的术语“异源”通常指在非天然背景下存在的基因或基因片段。在某些情况下,非天然背景可能是非天然细胞。在某些情况下,非天然背景可能在基因或基因片段的天然细胞内,但在非天然基因组位置。在一些情况下,异源启动子可以是在细菌菌株内移动的启动子,使其现在调节其天然不调节的编码序列。
根排出物营养成分
植物(例如谷类作物)的根排出物可形成相关根际和根系相关细菌、真菌或其他微生物或微生物的营养源。这些排出物通常包含简单和复杂的多糖、有机酸、粘液、酚类化合物、脂肪酸、甾醇、维生素和氨基酸的混合物。根系排出物提供的营养物质具有多种功能,包括吸引和/或维持微生物,而微生物又可能:直接向植物提供或溶解关键营养素(如但不限于氮或磷);合成植物激素,如生长素和细胞分裂素;调节植物激素水平;和/或提供局部病原体控制和真菌和细菌疾病的其他生物控制。在某些情况下,这些根系排出物的成分可能包括但不限于表1中列出的成分。
表1:植物排出物的一些成分
通常,根排出物可以是简单和复杂的多糖、有机酸、粘液、酚类化合物、脂肪酸、甾醇、维生素和氨基酸的混合物。这些排出物可包含一种或多种糖、一种或多种有机酸、一种或多种氨基酸、一种或多种脂肪酸、一种或多种糖酸、一种或多种糖醇、一种或多种维生素或其组合。
在某些情况下,根排出物可包含糖。例如,糖可以是葡萄糖、阿拉伯糖、果糖、蔗糖、蜜二糖、麦芽糖、乳糖、异麦芽糖、甘露糖、甘油、海藻糖、肌醇、阿洛酮糖、山梨糖、鼠李糖或任何其他合适的糖。
在某些情况下,根排出物可包含有机酸。有机酸可以是例如乳酸、草酸、富马酸、苹果酸、柠檬酸、琥珀酸、苯甲酸、乌头酸、t-乌头酸、酒石酸、谷氨酸、富马酸、丙二酸、天冬氨酸、丁酸、乙酰乙酸或任何其他合适的有机酸。
在某些情况下,根排出物可包含氨基酸。例如,氨基酸可以是精氨酸、组氨酸、赖氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、硒代半胱氨酸、甘氨酸、脯氨酸、丙氨酸、缬氨酸、异亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸、酪氨酸、色氨酸或任何其他合适的氨基酸。
在某些情况下,根排出物可包含脂肪酸。脂肪酸可以是例如己二酸、棕榈酸、硬脂酸、棕榈油酸、己二酸、油酸、硬脂酸、亚油酸或任何其他合适的脂肪酸。
在某些情况下,根排出物可包含糖酸。糖酸可以是例如苏氨酸、d-阿拉伯糖酸、葡萄糖酸或任何其他合适的糖酸。
在某些情况下,根排出物可包含糖醇。糖醇可以是例如myo-肌醇、木糖醇或任何其他合适的糖醇。
在某些情况下,根排出物可包含维生素。例如,维生素可以是硫胺素、核黄素、吡哆醇、烟酸、泛酸或任何其他合适的维生素。
微生物可以在包括植物排出物的培养基或包含模拟或设计用于模拟植物排出物的成分的培养基中进行培养和/或试验。这种培养基可称为植物排出物培养基(PEM)。PEM可形成微生物可在体外培养的替代物,但与在常规实验室培养基中培养微生物相比,其条件可更好地模拟微生物在田间可能遇到的那些情况。
在一些实施方式中,可通过在水性溶液中接触、浸渍、煮沸、挤压、浸泡、匀浆、研磨、培养或浸润一个或多个植物或植物部分(例如幼苗或植物根组织)来收集植物排出物。这种水性溶液可以是水基溶液,其可以包含微量或大量的缓冲液、盐或其他分子。在某些情况下,水性溶液只能包含水。这种水性溶液中的水可以是自来水、蒸馏水、去离子水、泉水、过滤水或其他类型的水。在某些情况下,水性溶液可包含一种或多种普通农业肥料。在某些情况下,水性溶液可包含一种或多种普通农业除草剂或杀虫剂。植物组织可将碳源、氨基酸和/或其他代谢物排到和/或排出到周围环境中(例如,水性溶液中)。通过收集与此类植物组织接触的水性溶液(例如PEM),可以在更好地模拟微生物在田间可能遇到的环境或基质中培养微生物。PEM可作为微生物生长的培养基。在某些情况下,PEM可以模拟植物根系环境中微生物的生长状况(例如,不生长实际植物)。在某些情况下,可以通过研磨、切碎、磨碎、挤压、振摇、旋转、搅拌或以其他方式对植物组织(例如根组织)匀浆获得PEM,以将化合物和/或代谢物释放到水性溶液中(例如,所有或基本上所有化合物和代谢物)。
植物根系排出物可以促进微生物吸引力。在某些情况下,植物根系排出物可以在土壤中提供化学或营养梯度,从而吸引微生物到植物根系。PEM可以配制成一种成分的浓度,这种浓度与从根开始沿着自然梯度的某处发现的浓度一致。例如,在某些情况下,成分的浓度可以与靠近根的根排出物的浓度相同,也可以与远离根的根排出物的浓度相同。在某些情况下,一种成分的浓度可以与在根1cm、5cm、10cm、20cm、25cm或30cm范围内的根排出物中该成分的浓度相同。在各种情况下,成分的浓度可与距离根至少1cm、至少10cm、至少20cm、至少25cm或至少30cm的根排出物中成分的浓度相同。在某些情况下,一种成分的浓度可与离根约1cm、约10cm、约20cm、约25cm或约30cm的根排出物中成分的浓度相同。
在某些情况下,一种成分的浓度可与距根1厘米至30厘米,距根1厘米至25厘米,距根1厘米至20厘米,距根1厘米至15厘米,距根1厘米至10厘米,距根1厘米至5厘米,距根5厘米至30厘米,距根5厘米至25厘米,距根5厘米至20厘米,距根5厘米至15厘米,距根5厘米至10厘米,距根10厘米至30厘米,距根10厘米至25厘米,距根10厘米至20厘米,距根10厘米至15厘米,距根15厘米至30厘米,距根15厘米至25厘米,距根15厘米至20厘米,距根20厘米至30厘米,距根20厘米至25厘米,或距根25厘米至30厘米的根排出物中的成分浓度相同。
在一些情况下,根排出物或PEM可促进微生物的生长和/或维持,这些微生物可向植物提供(例如,直接提供)或溶解营养物。在一些情况下,微生物可以提供或溶解氮、磷或其他营养物质。在各种情况下,微生物可以合成植物激素,例如生长素和细胞分裂素。在某些情况下,微生物可以调节植物激素水平。在某些情况下,微生物可以对植物的真菌和/或细菌疾病提供局部病原体控制或生物防治。
被植物(如谷类作物)根排出物吸引或维持的微生物可适应根排出物。这些微生物可以利用基于土壤的营养物,这可能是生长或营养物生产所需的(例如固氮)。在一些情况下,此类微生物可利用的基于土壤的营养物可包括例如磷酸钾、硫酸盐、氮、氧、氢、镁、钙、硼和氯,或诸如钼、铁、钒、铜、锰、锌和镍等金属。
与根排出物相比,传统的细菌实验室培养基通常包括一种或多种简单糖类(如葡萄糖或蔗糖)和氮源。在某些情况下,可以添加其他营养物,如微量金属、磷酸盐和维生素。
细菌的代谢可能很大程度受到营养、温度、压力、湿度和氧气环境的综合影响,以及竞争性影响,包括植物和微生物排出的其他排出物。新陈代谢的变化反过来可能会影响微生物在各种环境中的适应性。
在某些情况下,微生物适应性可定义为在植物生长的不同阶段,根系(内生和/或附生)和/或根际的存活率(活力)增加。微生物适应性可定义为在植物生长的不同阶段,根系(内生和/或附生)和/或根际的增殖(定殖)增加。微生物适应性可以定义为在植物生长的一个特定阶段后,目标微生物的持久性得到改善。例如,微生物适应性可以定义为在玉米生长的V5阶段后,目标微生物的持久性得到改善。微生物适应性可以定义为在上述环境中提高天然和合成群落的种间竞争力。此外,微生物适应性可定义为与提高营养物利用率、根附着和渗透(包括生物膜生成)、生长速率和耐温度、氧气、pH、渗透压和/或干燥条件有关的标志物的基因表达的变化。
由于所定义的实验室培养基可能与根排出物显著不同,因此使用合成或天然根排出物可提供一种改进的模型,用于在体外筛选如上所述的微生物适应性。在某些情况下,利用合成或天然根排出物可以为筛选不同表型的微生物提供一个改进的模型,而这些表型是当微生物在植物原位培养时所需的。
在天然或合成植物排出物中筛选微生物的表型可以更好地预测植物原位生长时微生物的表型。在某些情况下,可以选择不同的PEM来更好地模拟微生物在不同类型植物或植物不同发育阶段内、上或周围的微环境。
在某些情况下,可通过将水性溶液与植物或植物的一部分接触来产生天然PEM(NPEM)。例如,天然PEM可通过在水性溶液中浸渍、切碎、磨碎、挤压、振摇、旋转、搅拌、培养或浸泡幼苗或植物根组织来制备。植物根可以将碳源、氨基酸和/或其他代谢物排到水性溶液中。在浸没或培养幼苗或植物组织的水性溶液中(例如,在天然PEM中)培养微生物,可以使微生物生长在一种基质中,该基质可以更好地模拟或代表微生物在温室或田间植物根际可能遇到的环境。在某些情况下,植物排出物可以通过在水性溶液中研磨或以其他方式使根组织匀浆来获得,从而将碳源、氨基酸、代谢物等释放到水性溶液中用于微生物培养或生长。
在某些情况下,可通过混合、切碎、研磨、匀浆、振摇、旋转、浸没或浸渍在水性介质中的植物组织,或以其他方式使植物组织接触水性介质来产生包含植物排出物的培养基(例如天然PEM)。这种接触或混合可产生液体、浆液、凝胶、混合物、溶液或糊状的培养基。
在各种情况下,合成PEM(SPEM)可以是模拟天然PEM的培养基。合成PEM可包含选自表1的一种或多种组分。合成PEM可包含糖、有机酸、氨基酸、盐、植物激素和/或次级代谢物。在某些情况下,合成PEM还可包含土壤中常见的成分,例如含氮化合物、农业肥料、杀虫剂、除草剂和/或杀真菌剂。表2-4提供了几种合成PEM配方的示例。在某些情况下,合成PEM可包含表2-4中化合物和浓度的任何组合。合成PEM可进一步包含Na
表2:示例合成性PEM
表3:示例合成性PEM
表4:示例合成性PEM
野生型或重建/工程化/突变/进化微生物的适应性可通过使用合成或天然根排出物在体外试验中评估,以模拟农田环境中不同生长阶段的谷类作物的根际和根环境。在某些情况下,体外培养物可在液体或半固体PEM中在密封玻璃小瓶、试管、培养瓶或细胞培养板(例如96孔或384孔板)中在本文所述的任何条件下生长。在某些情况下,可以改变体外环境的温度、氧含量、压力和/或pH值。例如,温度可在约4℃至约45℃、约10℃至约40℃、或约15℃至约37℃、氧从0.1%至21%和pH从4.5-8.5的范围内。
这种体外环境的氧含量可为至少0.1%O
这种体外环境的pH可为约4.5、约5.0、约5.5、约6.0、约6.5、约7.0、约7.5、约8.0或约8.5。在一些实施方式中,pH可为至少4.5、至少5.0、至少5.5、至少6.0、至少6.5、至少7.0、至少7.5、至少8.0或至少8.5。在各种实施方式中,pH值可不大于4.5、不大于5.0、不大于5.5、不大于6.0、不大于6.5、不大于7.0、不大于7.5、不大于8.0或不大于8.5。
可通过使载体(例如水)接触植物来收集天然植物排出物。在一些情况下,可通过使载体(例如水)接触玉米植物来收集天然植物排出物。在某些情况下,可通过以下方法在不同植物生长阶段收集天然植物排出物:水培,从土壤、沙子或其他常用的植物生长介质转移到液体收集系统。在某些情况下,可以直接从土壤、沙子或植物生长的其他介质中收集自然排出物(例如,通过过滤、真空、抽吸等)。在各种情况下,可使用气培系统收集天然排出物,其中根排出物通过真空捕获。可在半固体培养基(例如半固体琼脂)或基质(例如滤纸或另一吸收或吸附基质)上捕获天然排出物。在某些情况下,可通过以下方法在不同的玉米植物生长阶段(从萌发到V10)收集天然植物排出物:水培,气培,或从土壤、沙子或其他常用的植物生长介质转移到液体收集系统。在某些情况下,可以从植物中收集天然排出物(例如,通过浸泡、切碎、研磨、挤压、振摇、旋转、搅拌、培养或在水性溶液中浸泡泥土、沙子、植物生长介质、幼苗或植物根组织)。在某些情况下,收集的排出物可通过蒸发或其他适当方法浓缩。
在一些实施方式中,合成PEM可从例如从收集的天然排出物的化学成分分析、文献或其他研究中衍生的配方制备。
合成的和天然的PEM都可以补充土壤中常见的营养物(例如,如上所述),包括例如常用的农业肥料,以更接近地模拟不同的根和/或土壤环境。
可以用许多不同的方法来测定微生物适应性。在某些情况下,适应性可以通过将单一培养物的体外增殖、生长速率和/或活力与根上和/或根际定殖和活力测量值来测量。在某些情况下,可通过在合成或天然微生物群落(例如,微生物群落,包括目标微生物加上一种或多种其他常见的土壤和根细菌和/或真菌)背景下比较相对体外增殖、生长速率和/或活力和目标微生物的根上和/或根际定殖来测定适应性。在某些情况下,根定殖可能是通过施用微生物作为种衣或在播种时或萌发后进行沟施诱导的。在某些情况下,可能诱导根定殖直到玉米V5期。在某些情况下,植物可以在实验室、温室或田间环境中生长。在某些情况下,活力和体外增殖可通过稀释和在受纳培养基上铺板,用指示染料染色、流式细胞术,基于ATP的分析,蛋白质定量,转录分析或本领域已知的任何其它方法来测量。在某些情况下,根定殖可通过使用物种特异性引物的定量PCR、16s分析和/或使用天然发现或导入基因组的独特条形码来测量。在某些情况下,转录谱(RNA-Seq或类似)和代谢物分析也可用于使用已知和新的微生物功能指标来评估适应性。在某些情况下,单一和混合培养物的分析可能包括使用荧光、蛋白质、代谢物或其他天然或引入的标志物。
植物(如玉米植物)可以在实验室、温室或田间环境中生长。在某些情况下,微生物在PEM中的体外增殖或生长速率可与微生物的根或根际定殖进行比较。定殖可通过稀释和在受纳培养基上铺板、指示染料染色、流式细胞术、基于ATP的分析、蛋白质定量、转录分析或其组合来测量。体外增殖可通过稀释和在受纳培养基上铺板、指示染料染色、流式细胞术、基于ATP的分析、蛋白质定量、转录分析或其组合来测量。根定殖也可以通过定量PCR的方法进行测量,使用物种特异性引物、16s图谱、天然发现的或引入基因组的独特条形码,或两者的组合。
本文描述了用于预测微生物菌株的植物原位表型的方法。这种方法可以包括在植物排出物培养基中培养微生物菌株和评估微生物的体外表型。在某些情况下,体外表型可以用来预测植物原位表型。例如,在PEM中生长良好的微生物菌株可能比在PEM中生长不佳的微生物菌株更好地定殖植物根系。在某些情况下,可以在体外而不在植物原位测定不同表型。在某些情况下,预测的植物表型可能是理想表型或不理想表型。
该方法还可以包括测定微生物菌株的体外表型。在某些情况下,与生长在植物根际区或植物根部附近的相同微生物相比,体外表型可以改善或劣化。在某些情况下,,例如,与自然界中发现的相同微生物相比(例如,在田间、温室、生长室或水培系统中),或与亲本菌株相比体外表型可以改善或劣化。体外表型可包括微生物在培养时(例如,在实验室环境中,或在植物排出物培养基中培养但不存在根)显示的表型。体外表型的实例可包括培养物的峰值光密度、颜色、气味、蛋白质表达、基因表达、生长速率、抗菌性、固氮能力、铵排出、定殖能力或根际适应性。
峰值光密度可以测量为培养物中微生物的最大光密度。光密度可以用来测量悬浮液中细菌的浓度。在某些情况下,峰值光密度可以指示在给定条件下培养物中可能出现的细菌的最大浓度。可在分光光度计中,例如在600nm或另一适当波长下测量光密度。在某些情况下,可以在微生物生长的中间对数阶段测量光密度。培养物的峰值光密度可以高于或低于在不同条件下(例如,不同的培养条件、田间、生长室、水培系统、温室、根际区等)生长的相同微生物的峰值光密度。
培养物的颜色可以用肉眼来测定,也可以用例如分光光度计来测定。在某些情况下,颜色可以通过培养物照片的像素分析来确定。培养物的颜色可以不同于在不同条件下(例如,不同的培养条件、田间、生长室、水培系统、温室、根际区等)生长的相同微生物的颜色。
在微生物生长的任何阶段,都可以定性地测量培养物的气味。在某些情况下,气味可以由实验室技术人员通过将培养物上方的空气拂向鼻子来确定。培养物的气味可以不同于在不同条件下(例如,不同的培养条件、田间、生长室、水培系统、温室、根际区等)生长的相同微生物的气味。
蛋白质表达可以是在培养物中表达的一种蛋白质的量、在培养物中表达的蛋白质总量、在培养物中表达的两种或更多种蛋白质的比率或其组合的测量结果。蛋白质表达可被测量为绝对值(例如,蛋白质总量)或相对值(例如,标准化,与在不同或天然条件下生长的相同微生物的蛋白质表达相比较,或与培养物中另一蛋白质的表达相比较)。在某些情况下,可以测量对生长、抗微生物性、固氮能力、铵排出、定殖能力或根际适应性有用或必需的蛋白质的表达。在某些情况下,可以测量对生长、抗微生物性、固氮能力、铵排出、定殖能力或根际适应性有害的蛋白质的表达。可以用任何合适的方法在从培养物中收集的蛋白质样品上测量蛋白质表达。蛋白质表达可以通过斑点杂交、western印迹法、二喹啉甲酸分析、Bradford分析、荧光分析、快速蛋白质液相色谱或其他合适的方法来测量。蛋白质表达可以高于或低于或等于在不同条件下(例如,不同的培养条件、田间、生长室、水培系统、温室、根际区等)生长的相同微生物的蛋白质表达。
基因表达可以是在培养物中表达的一种或多种基因的量、在培养物中表达的基因的总量、在培养物中表达的两种或更多种基因的比率或其组合的测量值。基因表达可被测量为绝对值(例如,基因总量)或相对值(例如,标准化,与在不同或天然条件下生长的相同微生物的基因表达相比较,或与培养物中另一基因的表达相比较)。在某些情况下,基因表达可以被测量为一种基因的mRNA数量、多种基因的mRNA数量或总mRNA数量。在某些情况下,可以测量基因产物对生长、抗微生物性、固氮能力、铵排出、定殖能力或根际适应性有用或必需的基因表达。在某些情况下,可以测量基因产物对生长、抗微生物性、固氮能力、铵排出、定殖能力或根际适应性有害的基因的表达。可以用任何合适的方法在从培养物中收集的样品上测量基因表达。在某些情况下,可以在从培养物中提取或纯化的mRNA上测量基因表达。基因表达可以通过PCR、q-PCR、RT-PCR、原位杂交或任何其他合适的方法来测量。基因表达可以高于或低于或等于在不同条件下(例如,不同的培养条件、田间、生长室、水培系统、温室、根际区等)生长的相同微生物的基因表达。
生长速率可以衡量培养物的生长速度(即微生物的复制速度,或微生物的复制速度与微生物的死亡率的总和)。生长速率可以用光密度测量技术来测量。在某些情况下,可以在培养微生物的不同时间点测量光密度,并计算生长速率。例如,可以以5分钟、15分钟、30分钟、1小时、2小时、3小时、4小时、5小时、6小时、12小时、1天或其组合的增量来测量光密度。生长速率可以高于或低于或等于在不同条件下(例如,不同的培养条件、田间、生长室、水培系统、温室、根际区等)生长的相同微生物的生长速率。
抗微生物特性可以衡量培养物在抗菌剂存在下的存活或生长情况。在某些情况下,可以通过测量在抗菌剂存在下培养物的生长速率来测量抗菌剂抗性。在一些情况下,抗菌剂抗性可以高于或低于或等于在不同条件下(例如,不同的培养条件、田间、生长室、水培系统、温室、根际区等)生长的相同微生物的抗菌剂抗性。
固氮能力可以衡量微生物或微生物培养物固氮的能力。固氮能力可以用支持固氮的蛋白质的表达、支持固氮的基因的表达或氮固定的测定来衡量。固氮可通过植物原位测定或乙炔还原测定(ARA)来测定。可在根、液体培养皿、琼脂平板、细胞培养板(如96孔板)、实验室、温室、田间、生长室、水培系统或其他适当位置或容器中测量固氮。固氮可以高于或低于或等于在不同条件下(例如,不同的培养条件、田间、生长室、水培系统、温室、根际区等)生长的相同微生物的氮固定。
铵排出可以是一定量的铵(例如,固定的氮),它可以从微生物或培养物中排到微生物的环境中。铵排出可以通过支持铵排出的蛋白质表达、支持铵排出的基因表达或测量铵排出量来测量。例如,可以通过铵排出分析或植物原位分析来测量铵排出。可在根、液体培养皿、琼脂平板、细胞培养板(如96孔板)、实验室、温室、田间、生长室、水培系统或其他适当位置或容器中测量铵排出。铵排出可以高于、低于或等于在不同条件下(例如,不同的培养条件、田间、生长室、水培系统、温室、根际区等)生长的相同微生物的铵排出。
定殖能力可以是衡量微生物或培养物定殖在环境中或在根、田地、液体、土壤或植物上形成菌落的能力。在某些情况下,定殖能力可以衡量微生物定殖的速度、菌落的密度或大小,或者菌落的生长速度。定殖能力可以通过定殖分析来衡量。可在生长在温室、田地、生长室、水培系统或其他合适的位置或容器中的植物或植物部分(例如,根)上测量定殖能力。
根际适应性可以指例如植物根际的适应性。根际可以是土壤或培养基的一个区域,它可以受到根排出物和/或在根或根附近存在的天然或引入的微生物的影响。根际适应性可以指微生物的定殖、微生物的多样性、微生物的质量、固定的氮、排出的铵、营养物质的存在、可用的氧、水的可用性或根际带的其他特性。在某些情况下,可以使用定殖分析(例如,根际适合度可以与定殖相关,使得更好的根际适应性可以与更好的定殖相关)来测量根际适应性。例如,可以在植物原位进行定殖分析。这种分析可以在任何合适的环境中进行,例如生长室、水培系统、温室、田地或其他环境。在某些情况下,根际适应性可以用细胞生长竞争试验来测定。细胞生长竞争试验可以测量微生物的复制适应性。例如,可将多个微生物菌株接种在植物或培养基上并允许其生长。在相同的条件下,微生物菌株可以竞争细胞目标、营养物、氧气或其他有价值的物质。在某些情况下,可以进行两个或多个细胞生长竞争分析。这两个或多个细胞生长竞争分析可以在不同的条件下进行,例如不同的大气条件下。例如,可以在不同的温度、湿度、降水量、冻/融、风、营养可用性或其他条件下进行这两个或更多个细胞生长竞争分析。在某些情况下,可以进行三、四、五、六或多个细胞生长竞争分析。在细胞生长竞争分析中,根际适应性可以相比其它微生物菌株增加、减少,或相同。
如本文所提供的此类方法还可包括使用经测定的体外表型来预测微生物菌株的植物原位表型。在某些情况下,微生物菌株的体外表型可以指示微生物菌株在植物原位的相同表型。在某些情况下,植物原位表型与微生物菌株的体外表型直接相关。例如,图5A显示两种遗传修饰的菌株6_2425和6_2634在PEM培养基中的生长不如亲本菌株6。图5B显示,图5A的两种遗传修饰的菌株在生长室中定殖玉米根的能力低于亲本菌株。类似地,在图12A中,评估了PEM中三种不同细菌的效价和倍增时间。多粘类芽孢杆菌(P.polymixa)菌株41的OD峰值最低,倍增时间最慢。类似的,菌株多粘类芽孢杆菌41在温室和田间试验中表现出最低的根系定殖水平。因此,表明体外表型可用于评估多个微生物菌株,并可用于选择可能具有或表现出所需的植物原位表型的菌株。
在某些情况下,微生物菌株的体外表型可以指示微生物菌株在植物原位的不同表型。在某些情况下,体外微生物表型测量值的增加可能表明植物原位不同表型测量值的增加。例如,能够在体外支持固氮的基因或蛋白质表达的增加可以指示植物原位固氮的增加。在某些情况下,体外微生物表型测量值的增加可能表明植物原位不同表型测量值的减少。例如,能够在体外阻碍或抑制固氮的基因或蛋白质表达的增加可以指示植物原位固氮的减少。在某些情况下,体外微生物表型测量值的减少可能表明植物原位不同表型测量值的减少。例如,能够在体外支持固氮的基因或蛋白质表达的减少可以指示植物原位固氮的减少。在某些情况下,体外微生物表型测量值的减少可能表明植物原位不同表型测量值的增加。例如,能够在体外阻碍或抑制固氮的基因或蛋白质表达的减少可以指示植物原位固氮的增加。
本文还描述了用于选择具有改变的植物原位表型的遗传修饰的微生物菌株的方法。可以基于菌株的一种或多种体外表型选择遗传修饰的微生物菌株。在某些情况下,所测试的体外表型可能与所需的植物原位表型相同。例如,体外表型可以是铵排出,并且期望的植物原位表型可以是高铵排出。在某些情况下,体外表型可以与植物原位表型相关。例如,体外表型可以是生长速率或最大化生长,而在植物原位表型可以是植物定殖。在某些情况下,可以产生多个遗传修饰的微生物菌株,并针对优选的体外表型进行筛选。在某些情况下,遗传修饰的微生物菌株可能具有预期改变体外表型的遗传修饰。例如,可筛选在固氮或氮同化基因调控网络中具有遗传改变的遗传修饰的微生物菌株的体外固氮或氮同化活性。在某些情况下,遗传修饰的微生物菌株可能具有未预期改变体外表型的遗传修饰。例如,可筛选在固氮或氮同化基因调控网络中具有遗传改变的遗传修饰的微生物菌株的体外生长速率或体外总生长以预测菌株的植物原位定殖。
筛选可以包括正筛或负筛。正筛选包括选择具有有益或期望的植物原位表型的微生物菌株。此类例子可包括但不限于与未修饰微生物菌株及/或其它修饰的微生物菌株相比具有改良或优越的固氮能力、铵排出、定殖能力、根际适应性或其组合的微生物菌株。负筛包括不选择植物原位表型可能无益或可能不需要的微生物菌株。此类例子可包括但不限于与未修饰微生物菌株及/或其它修饰的微生物菌株相比具有劣化的固氮能力、铵排出、定殖能力、根际适应性或其组合的微生物菌株。
本文进一步描述了选择被PEM吸引的植物相关微生物的方法。被吸引到PEM的微生物在PEM附近可以向PEM迁移或移动。在某些情况下,被PEM吸引的微生物在PEM存在下可以生长得更好或更快。在某些情况下,与不被PEM吸引的微生物相比,被PEM吸引的微生物具有更好的根际适应性。在某些情况下,与具有类似植物有益特性但不被PEM吸引的微生物相比,被PEM吸引且具有植物有益特性的微生物可能对植物产生更大的益处。例如,如果第一固氮微生物被PEM吸引而第二固氮微生物没有被吸引,则在体外(在常规培养基或PEM中)测定时,第一和第二微生物可显示相同水平的固氮活性,但第一微生物可赋予植物更大的生长优势。
本文还描述了对植物有益的微生物菌株进行田间试验的方法。在某些情况下,在开始假定的植物有益微生物的田间试验之前的第一步可能包括在PEM中测定假定的植物有益微生物的相关表型。相关表型可能包括但不限于PEM中的生长率、最大OD和效价。在某些情况下,相关表型也可能包括固氮或铵排出。在某些情况下,如果假定的植物有益微生物在PEM中表现出非常缓慢的生长速度、较低的最大OD和较低的效价,则该微生物可能不会被选择用于田间试验。在某些情况下,可在PEM中筛选多个假定的植物有益微生物以获得相关表型,并且这些结果可用于选择一个或多个微生物进行田间试验。一般来说,优选的体外表型包括但不限于快速生长率、高最大OD和高PEM效价。
本文还描述了改善植物生长(例如,生长速率)的方法。一种提高植物生长速率的方法可包括用在PEM中具有所需表型的微生物菌株接种植物或将要生长植物的土壤。在一些实施方式中,一种改善植物生长的方法可包括使植物接触在PEM中具有所需生长速率的微生物。期望的生长速率可以是微生物的生长速率,该微生物先前已与植物的改良生长相关。可通过鉴定能够在植物上定殖的微生物;测定PEM中微生物的生长;测定微生物对植物生长的影响;将PEM中微生物的所需生长速率确定为与植物生长的改善相关联的PEM中微生物的生长速率,来确定所需的生长速率。在某些情况下,该方法可进一步包括将基因突变引入微生物。
在一些情况下,该方法还包括选择在PEM中具有所需生长速率的微生物,所述选择通过:(i)鉴定能够在植物上定殖的一个或多个微生物;(ii)测定一个或多个微生物在PEM中的生长;(iii)测定一个或多个微生物对植物生长的影响;以及(iv)将在PEM中具有所需生长速率的微生物确定为与所述植物的改善生长相关联的一个或多个微生物中的微生物。在一些情况下,如果在先前步骤中没有鉴定出所需微生物,可重复该方法,通过在步骤(iii)之后将基因突变引入所述微生物以产生遗传修饰的微生物,并且对所述遗传修饰的微生物重复步骤(i)到(iii)。该方法如所需可重复多次。
例如,可以用在PEM中生长时生长速度快、最大OD高和/或效价高的微生物菌株接种植物。在某些情况下,改善植物的生长可包括增加植物的鲜重。在某些情况下,改善植物的生长可包括增加植物的产量。在某些情况下,改善植物的生长可包括增加植物产生的叶、种子、谷物、坚果、水果和/或块茎的产量。
使用合成或天然排出物培养基更好地预测植物原位表型(例如固氮)
由于最常用的细菌实验室生长培养基与根排出物显著不同,使用合成排出物培养基可为体外筛选提供一种改进的模型,以预测细菌表型,例如提高固氮和/或植物原位的排出。合成根排出物的优势在于其高度一致且易于改变-减少因介质变化而产生的噪音。
如上所述,在根排出物上维持的细菌也可以利用生长和营养生产(如固氮)所需的土壤养分。这些土壤养分可能包括但不限于磷酸盐、钾、硫酸盐、氮、氧、氢、镁、钙、硼和氯,以及钼、铁、钒、铜、锰、锌和镍等金属。
可以通过使用任何一种合成的根排出物培养基来模拟农田环境中不同生长阶段的谷类作物的根际和根环境来评估改良的细菌表型。体外培养物可在密封玻璃小瓶、试管、培养瓶或细胞培养板(例如96孔或384孔板)中的液体或半固体培养基中,在本文所述的任何条件下在排出物培养基中生长。
可通过任何合适的方法测量氮固定和排出的改善。例如,改良的固氮可通过ARA来测量,改良的氮排出可通过铵排出分析来测量,并且都可通过植物原位分析来测量。在某些情况下,可以测量不同合成排出物上的相对存活率和生长率(+/-补充物)这些可作为光密度、活细胞计数、ATP或酶测定或本领域已知的任何其它方法的函数来测量。在某些情况下,可使用铵排出分析、铵探针或本领域已知的任何其它试验来定量作为铵的体外氮排放。氮排放可通过使用排出物测量、氨探针、酶测定、15N摄取、15N同位素稀释、植物N代谢基因标志物、植物生物量测定、生物传感器或本领域已知的任何其他方法与植物原位排放相关。在某些情况下,可以如上所述测量其他形式的氮排放,包括氨基酸的排出。在某些情况下,体外固氮可以使用乙炔还原作为代表,使用ARA量化。这可通过使用植物原位ARA测量、15N摄取、15N同位素稀释、植物N代谢基因标志物、植物生物量测定、生物传感器或本领域已知的任何其他方法与植物原位固氮相关。
在某些情况下,当在合成或天然微生物群落(例如,包括目标微生物加上一个或多个其他常见土壤和根细菌和/或真菌的微生物群落)中生长时,可定量目标微生物的相对固氮和排出。这些结果可与上述植物原位活性进行比较。在某些情况下,转录谱分析(RNA-Seq或类似)和代谢物分析也可用于评估固氮酶途径的表达或其他相关途径,无论是在体外还是在植物原位。在某些情况下,纯和混合培养物的分析可能包括使用荧光、蛋白质、代谢物或其他天然或引入的标志物。
在某些情况下,在PEM中生长的微生物的体外表型可用于预测与该微生物一起生长的植物的表型。例如,假定的植物有益微生物可在PEM中生长并测定体外表型,例如效价或生长速率。高效价或快速生长率可以预测,与体外不具有相同表型的不同微生物一起生长的植物相比,与假定的植物有益微生物一起生长的植物将生长得更快或更大。在某些情况下,微生物的体外表型可以预测与微生物一起生长的植物的大小、生长速率和/或产量。在某些情况下,所述预测可能具有相对质量,即,与第二微生物相比,多个微生物中的第一微生物在PEM中可能具有更高的效价,或在PEM中具有更快的生长速率,从而得到这样一种预测,即当植物与第一种微生物一起生长时,与第二种微生物相比,第一种微生物将导致更大的植物生长或更大的植物产量。
用作趋化性测定的诱饵
天然植物排出物培养基(NPEM)可以是从活植物不同生长阶段收集的排出物制备的培养基。合成植物排出物培养基(SPEM)可以是由多种成分制成的培养基,旨在模拟NPEM。两种培养基都可含有多糖、有机酸、氨基酸和多肽。
众所周知,植物会释放化学引诱剂来吸引不同的微生物群聚到其根际。这些微生物可以与它们移向的植物形成互利的关系。NPEM可以包含这些化学引诱剂,其可用来分离由植物天然吸收来定殖在其根际的微生物。
为了确定哪些微生物被植物排出物吸引,可以用丰富培养基(如LB培养基)/基本培养基/水和NPEM的混合物制成半固体琼脂平板。平板的第一阶段(或区域)可以是100%LB培养基,第二阶段可以是90%LB和10%NPEM,第三阶段可以是80%LB和20%NPEM,等等。然后将土壤样品铺在平板的一侧,随着时间的推移,可以看到被NPEM吸引的微生物通过半固体琼脂向NPEM浓度较高的区域迁移。在各种情况下,可获得具有多个区域的半固体琼脂平板,所述多个区域包括溶解在丰富培养基中的琼脂的第一区域、溶解在PEM中的琼脂的最后区域和多个中间区域,每个中间区域包括丰富培养基和PEM的混合物以形成从第一区域到最后区域的梯度。多个假定的植物相关微生物可施加于第一区域,然后培养一段时间。被PEM吸引的微生物可以穿过平板向PEM迁移,并且可以通过收集从第一个区域向最后区域迁移得最远的一个或多个微生物来识别。在某些情况下,与植物相关的微生物可被PEM吸引。
本文描述了产生具有改变的植物定殖活性的变异微生物菌株的方法。SPEM和NPEM可以用来进行进化试验,产生出更适合在植物排出物上生长的菌株,从而增加定殖。野生型菌株、菌株突变文库或具有缺陷DNA修复基因(mut基因)的菌株可以在NPEM/SPEM上反复生长,然后再次分离。在某些情况下,可以使用化学诱变剂、电离辐射或紫外线辐射生成菌株的诱变文库。化学诱变剂的实例包括但不限于甲磺酸乙酯和N-乙基-N-亚硝基脲。最终,菌株可能获得基因改变,使其在SPEM/NPEM中生长得更好。这些进化的菌株可能是比它们的野生型亲本更好或更差的定殖菌。
在某些情况下,可以对通常被吸引到PEM的微生物进行诱变筛选。这样的筛选可鉴定不被PEM吸引的突变微生物,并且突变微生物测序可识别涉及感受PEM以及向PEM迁移或移动的基因和调控序列。
本文进一步描述了工程化微生物,其包含改变对PEM的化学吸引的修饰。在某些情况下,可通过复制从上述诱变筛选中发现的PEM化学吸引相关的突变来产生工程化微生物。在某些情况下,这种工程化微生物可能是通过改变一种已知参与营养感应或迁移的基因的调控而产生的。在某些情况下,工程化微生物可能会提高PEM组分的化学吸引力。在某些情况下,工程化微生物可能会降低PEM组分的化学吸引力。
植物物种
本文所述的方法和微生物可与多种植物中的任何一种的排出物一起使用,诸如大麦属(genera Hordeum)、稻属(genera Oryza)、玉蜀黍属(genera Zea)和小麦属(generaTriticeae)的植物。适合植物的其他非限制性例子包括苔藓、地衣和藻类。
在某些情况下,这些植物具有经济、社会和/或环境价值,例如粮食作物、纤维作物、油料作物、林业或制浆造纸工业的植物、生物燃料生产的原料和/或观赏植物。在一些实例中,植物可用于生产经济上有价值的产品,例如谷物、面粉、淀粉、糖浆、膳食、油、膜、包装、营养产品、纸浆、动物饲料、鱼饲料、工业化学品的装填材料、麦片产品、加工人类食品、糖、酒精、和/或蛋白质。作物的非限制性实例包括,玉米,水稻,小麦,大麦,高粱,粟,燕麦,黑小麦,荞麦,甜玉米,甘蔗,洋葱,番茄,草莓和芦笋。
在一些实例中,可使用本文公开的方法和组合物获得或改善的植物可以包括对农业,园艺,用于生产生物燃料分子和其它化学品的生物质和林业至关重要或有意义的植物。这些植物的一些实例可包括,菠萝,香蕉,椰子,百合,草豌豆(grasspea)和禾草;和双子叶植物,如豌豆,苜蓿,绿番茄,甜瓜,鹰嘴豆,菊苣,三叶草,羽衣甘蓝,小扁豆,大豆,烟草,土豆,甘薯,萝卜,卷心菜,油菜(rape),苹果,葡萄,棉花,向日葵,拟南芥,油菜(canola),柑橘(包括橙,橘,金橘,柠檬,酸橙,葡萄柚,橘子,橘柚,香橼和柚子),胡椒,豆,莴苣,柳枝稷(Panicum virgatum)(枝条),双色高粱(Sorghum bicolor)(高粱,苏丹),芒草(Miscanthusgiganteus),甘蔗种(Saccharum sp.)(energycane),杨树(Populus balsamifera),玉米(Zea mays),大豆(Glycine max),油菜(Brassica napus),小麦(Triticum aestivum),棉花(Gossypium hirsutum),稻(Oryzasativa),向日葵(Helianthus annuus),紫花苜蓿(Medicago sativa),甜菜(Betavulgaris),狼尾草(Pennisetum glaucum),黍种(Panicumspp.),高粱种(Sorghum spp.),芒草种(Miscanthus spp.),甘蔗种(Saccharum spp.),蔗茅种(Erianthus spp.),杨种(Populus spp.),黑麦(Secale cereale),柳种(Salixspp.),桉种(Eucalyptus spp.)(桉树(eucalyptus)),小黑麦种(Triticosecale spp.)(小麦属-25小麦X黑麦),竹子,红花(Carthamustinctorius),麻风树(Jatropha curcas),蓖麻(Ricinus communis),油棕(Elaeisguineensis),枣椰树(Phoenix dactylifera),国王棕榈(Archontophoenixcunninghamiana),女王棕榈(Syagrus romanzoffiana),亚麻(Linumusitatissimum),芥菜(Brassica juncea),木薯(Manihot esculenta),番茄(Lycopersicon esculentum),莴苣(Lactuca saliva),香蕉(Musa paradisiaca),马铃薯(Solanum tuberosum),甘蓝(Brassica oleracea)(西兰花,花椰菜,抱子甘蓝),茶(Camellia sinensis),草莓(Fragaria ananassa),可可树(Theobroma cacao),咖啡树(Coffea arabica),葡萄(Vitisvinifera),菠萝(Ananas comosus),辣椒(Capsicumannum),洋葱(Allium cepa),甜瓜(Cucumis melo),黄瓜(Cucumis sativus),笋瓜(Cucurbita maxima),南瓜(Cucurbitamoschata),菠菜(Spinacea oleracea),西瓜(Citrullus lanatus),秋葵(Abelmoschusesculentus),茄子(Solanum melongena),罂粟(Papaver somniferum),Papaverorientale,欧洲紫杉(Taxus baccata),短叶红豆杉(Taxus brevifolia),青蒿(Artemisiaannua),大麻(Cannabis saliva),喜树(Camptotheca acuminate),长春花(Catharanthusroseus),蔓长春花(Vinca rosea),金鸡纳树(Cinchona officinalis),秋水仙(Coichicum autumnale),藜芦(Veratrumcalifornica),毛地黄(Digitalis lanata),洋地黄(Digitalis purpurea),薯蓣种(Dioscorea 5spp.),穿心莲(Andrographis paniculata),颠茄(Atropa belladonna),曼陀罗(Datura stomonium),小檗种(Berberis spp.),三尖杉种(Cephalotaxus spp.),草麻黄(Ephedra sinica),麻黄种(Ephedra spp.),古柯(Erythroxylum coca),绿色雪花莲(Galanthus wornorii),赛莨菪种(Scopolia spp.),石松(Lycopodiumserratum),石松种(Lycopodium spp.),蛇根木(Rauwolfia serpentina),萝芙木种(Rauwolfia spp.),血根草(Sanguinaria canadensis),莨菪种(Hyoscyamus spp.),金盏花(Calendulaofficinalis),小白菊(Chrysanthemum parthenium),毛喉鞘蕊花(Coleusforskohlii),艾菊(Tanacetum parthenium),银胶菊(Parthenium argentatum),橡胶树种(Hevea spp.),绿薄荷(Mentha spicata)(薄荷),欧薄荷(Mentha piperita)(薄荷),红木(Bixaorellana),六出花种(Alstroemeria spp.),蔷薇属(Rosa spp.)(玫瑰),康乃馨(Dianthuscaryophyllus),矮牵牛种(Petunia spp.)(矮牵牛花),一品红(Poinsettiapulcherrima),烟草(Nicotiana tabacum),羽扇豆(Lupinus albus),燕麦(Uniolapaniculata),大麦(Hordeum vulgare)和黑麦草种(Lolium spp.)(黑麦)。
在一些实例中,可使用单子叶植物,包括属于泽泻目(Alismatales),天南星目(Arales),槟榔目(Arecales),凤梨目(Bromeliales),鸭跖草目(Commelinales),环花目(Cyclanthales),莎草科(Cyperales),谷精草目(Eriocaulales),水鳖目(Hydrocharitales),灯芯草目(Juncales),百合目(Lilliales),茨藻目(Najadales),兰目(Orchidales),露兜树目(Pandanales),禾本目(Poales),帚灯草目(Restionales),霉草目(Triuridales),香蒲目(Typhales)和姜目(Zingiberales)的单子叶植物。属于裸子植物纲(Gymnospermae)的植物有苏铁目(Cycadales),银杏目(Ginkgoales),麻黄目(Gnetales)和松目(Pinales)。在一些实例中,单子叶植物可选自玉米,水稻,小麦,大麦和甘蔗。
在一些实例中,可以使用双子叶植物,包括属于以下目的植物:马兜铃目(Aristochiales),菊目(Asterales),肉穗果目(Batales),桔梗目(Campanulales),白花菜目(Capparales),石竹目(Caryophyllales),木麻黄目(Casuarinales),卫矛目(Celastrales),山茱萸目(Cornales),岩梅目(Diapensales),五桠果目(Dilleniales),川续断目(Dipsacales),柿树目(Ebenales),欧石楠目(Ericales),杜仲(Eucomiales),大戟目(Euphorbiales),豆目(Fabales),壳斗目(Fagales),龙胆目(Gentianales),牻牛儿苗目(Geraniales),小二仙草目(Haloragales),金缕梅目(Hamamelidales),米德目(Middles),胡桃目(Juglandales),唇形目(Lamiales),樟目(Laurales),玉蕊目(Lecythidales),塞子木目(Leitneriales),木兰目(Magniolales),锦葵目(Malvales),杨梅目(Myricales),桃金娘目(Myrtales),睡莲目(Nymphaeales),罂粟目(Papeverales),胡椒目(Piperales),车前草目(Plantaginales),蓝雪目(Plumb aginales),川苔草目(Podostemales),花葱目(Polemoniales),远志目(Polygalales),蓼目(Polygonales),报春花目(Primulales),山龙眼目(Proteales),大花草目(Rafflesiales),毛茛目(Ranunculales),鼠李目(Rhamnales),蔷薇目(Rosales),茜草目(Rubiales),杨柳目(Salicales),檀香目(Santales),无患子目(Sapindales),瓶子草目(Sarraceniaceae),玄参目(Scrophulariales),山茶目(Theales),昆栏树目(Trochodendrales),伞形目(Umbellales),荨麻目(Urticales)和万乐目(Violates)。在一些例子中,双子叶植物可以从棉花、大豆、辣椒和番茄中选择。
在一些情况下,待改善的植物可能不易适合实验条件。例如,作物可能要花费过长时间生长,以至于不足以在多次迭代中实际上连续评估改善的性状。因此,最初从中分离出细菌的第一植物和/或施加基因操纵的细菌的多种植物可以是模式植物,例如在期望条件下更适于评估的植物。模式植物的非限制性例子包括狗尾草、短梗草和拟南芥。根据本发明方法用模式植物分离的微生物(例如,细菌)的能力随后可应用于另一类型的植物(例如,农作物)以确认改良性状的赋予。
可以通过本文所公开的方法改善的性状包括植物的任何可观测特性,包括例如,生长速率,高度,重量,颜色,味道,气味,由植物产生的一种或多种化合物的变化(包括例如,代谢物,蛋白质,药物,碳水化物,油和其它任何化合物)。还设想了基于基因型信息选择植物(例如,包括响应细菌的植物基因表达模式,或鉴定遗传标志物的存在,诸如与固氮提高相关的那些)。选择植物还可以基于不存在、抑制或限制与某种特征或性状(诸如期望的特征或性状)的存在相反的某种特征或性状(诸如不需要的特征或性状)。
植物生产力通常指可能是植物生长的原因的植物生长或发育的任何方面。在某些情况下,对于粮食作物(可包括谷物或蔬菜),植物生产力可指从特定作物收获的谷物或水果的产量。如本文所用,提高的植物生产力可广泛地指产量的提高,例如,谷物、水果、花或可为某一目的而收获的其它植物部分的产量的提高。在某些情况下,植物生产力的提高可能泛指植物部分(包括茎、叶和根)生长的改善。在某些情况下,提高植物生产力可广义地指促进植物生长、保持叶片中的高叶绿素含量、增加果实或种子数量、增加果实或种子单位重量和/或由于减少氮肥使用而减少NO
粮食作物中及其周围的微生物会影响这些作物的性状。在某些情况下,可能受微生物影响的植物性状可包括:产量(例如,谷物产量、生物质产生、果实发育、花期);营养(如氮、磷、钾、铁、微量营养物质的获得);非生物胁迫管理(如耐旱、耐盐、耐热);以及生物胁迫管理(如害虫、杂草、昆虫、真菌和细菌)。在某些情况下,改变作物性状的策略可以包括:增加关键代谢物的浓度;改变微生物对关键代谢物影响的时间动态;将微生物代谢物生产/降解与新的环境线索相关联;减少负代谢物;和改善代谢物或基础蛋白质的平衡。
在某些情况下,控制序列可以是一种序列,它可以是一个操作子、启动子、沉默子或终止子。在一些实施方式中,本公开的基因的天然或内源控制序列可被一个或多个属内控制序列替代。
在某些情况下,引入可能是指使用现代生物技术引入,并可能不是天然发生的引入。在一些实施方式中,本公开的细菌已经被修饰,使得它们可能不是天然存在的细菌。
在一些实施方式中,本公开的细菌可以至少10
本公开内容的肥料和/或外源性氮可包含下述含氮分子:铵,硝酸盐,亚硝酸盐,氨,谷氨酰胺等。本发明的氮源可包括无水氨、硫酸铵、尿素、磷酸二铵、尿素形态、磷酸氢二铵、硝酸铵、氮溶液、硝酸钙、硝酸钾、硝酸钠等。
在一些情况下,外性源氮指在非氮限制条件下存在于土壤、田地或生长介质中容易获得的非大气氮,包括氨,铵,硝酸盐,亚硝酸盐,尿素,尿酸,铵酸等。
在某些情况下,非氮限制条件可指土壤、田地或培养基中的非大气氮,其浓度可能大于约4mM、3mM、2mM、1mM、0.5mM、0.25mM或0.05mM氮。
在一些实施方式中,氮固定和同化的遗传调控网络包括:引导、调整和/或调节微生物氮固定和/或同化的非编码序列和编码基因的多核苷酸,并且有时还可以包含nif簇(例如,nifA、nifB、nifC、……nifZ)的多核苷酸序列,编码氮调节蛋白C的多核苷酸,编码氮调节蛋白B的多核苷酸,glN簇(例如,glnA和glnD)的多核苷酸序列,draT和氨转运体/通透酶。在一些情况中,Nif簇可以包含NifB,NifH,NifD,NifK,NifE,NifN,NifX,hesa和NifV。在一些情况中,Nif簇可以包含NifB,NifH,NifD,NifK,NifE,NifN,NifX,hesa和NifV的子集。
在一些实施方式中,本公开的肥料可包含至少5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%氮干重。
在一些实施方式中,本公开的肥料可包含至少约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约71%、约72%、约73%、约74%、约75%、约76%、约77%、约78%、约79%、约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%或约99%氮干重。
在一些实施方式中,本发明的肥料可包含以重量计约5%至50%、约5%至75%、约10%至50%、约10%至75%、约15%至50%、约15%至75%、约20%至50%、约20%至75%、约25%至50%、约25%至75%、约30%至50%、约30%至75%、约35%至50%、约35%至75%、约40%至50%,约40%至75%、约45%至50%、约45%至75%或约50%至75%的氮。
在一些实施方式中,可相对于可能未暴露于本发明的某些细菌的植物(其可以是对照植物)来测量植物中固氮的增加和/或1%或更多氮的产生。在某些情况下,细菌的部分或全部增加或减少是相对于作为对照细菌的细菌来测量的。在某些情况下,植物的部分或全部增加或减少是相对于作为对照植物的植物来测量的。
在一些情况下,组成型启动子可以是这样的启动子,其在大多数条件下和/或在大多数发育阶段具有活性。在可用于生物技术的表达载体中使用组成性启动子可能具有若干优点。这些优点可以包括以下情况:可用于选择转基因细胞或生物体的高水平蛋白质生产;高水平的报告蛋白和/或可评分标志物的表达,这可能使得易于检测和/或定量;转录因子的高水平产生,该转录因子可以是调节转录系统的一部分;产生需要在生物体内普遍存在的活性的化合物;和/或在任何发育阶段、多个发育阶段或所有发育阶段可能需要的化合物的生产。非限制性示范性组成性启动子可包括抗生素抗性基因启动子,例如四环素抗性基因启动子。
在一些情况下,“非组成型启动子”可以是这样的启动子,其是在某些条件下在某些类型的细胞中和/或在某些发育阶段可具有活性的启动子。例如,在某些情况下,这些可包括组织特异性、组织优选性、细胞类型特异性、细胞类型优选性或诱导型启动子。在某些情况下,发育控制下的启动子可能包括非组成性启动子。发育控制下的启动子的实例可包括可在某些组织中优先启动转录的启动子。
如本文所用,诱导型或抑制型启动子可以是受化学或环境因素控制的启动子。可能影响诱导型启动子转录的环境条件的实例可包括厌氧条件、某些化学物质、光的存在、酸性和/或碱性条件等。
如本文所用,组织特异性启动子可以是在一些组织中,可能是仅在某些组织中启动转录的启动子。与基因的组成型表达不同,组织特异性表达可以是基因调控的几个相互作用水平的结果。在植物相关微生物的情形中,组织特异性启动子可以是依赖于与微生物相关联的植物组织调节基因(例如,连锁基因)表达的启动子。例如,组织特异性启动子可以在微生物定殖于植物叶片时导致基因表达,但在定殖于植物根部时不导致基因表达。
在某些情况下,可操作性连接可指核酸序列的结合,其可在单个核酸片段上,使得一个核酸片段的功能可由另一个核酸片段调节。例如,在一些例子中,当启动子能够在至少有时调节编码序列的表达时,启动子可操作地与编码序列连接。编码序列可以例如正义或反义方向与调控序列可操作地连接。在另一个非限制性实例中,本公开的互补RNA区可以直接或间接地与靶mRNA的5'或与靶mRNA的3'或在靶mRNA内可操作地连接,或者第一互补区是5'且其互补物是靶mRNA的3'。
可通过本文所述方法靶向调控的性状可包括固氮、氮排出、脱水耐受性、氧敏感性和其它性状。
可以通过本文描述的方法调控而靶向的一种性状是氮固定。氮肥是农场最大的运营费用,也是玉米和小麦等中耕作物增产的最大推动力。本文所述的微生物产品可在非豆科作物中提供可再生形式的氮。尽管某些内生菌具有在纯培养中固定氮所需的遗传,但通常根本的技术挑战是谷物和草类的野生型内生菌在施肥田中停滞氮固定。化肥的施用和土壤中的残留氮水平向微生物发出了关闭固氮生化途径的信号。
需要改变固氮调控网络的转录水平和翻译后水平,才能培育出在肥料存在下能够将氮固定并转移到玉米上的微生物。为此,本文描述了宿主微生物进化(HoME)技术,该技术精确地进化调控网络并产生新的表型。本文还描述了从玉米中分离的固氮内生菌的独特的、专有的文库,以及在不同环境条件下(如氮胁迫和过量)微生物与寄主植物相互作用的大量组学数据。这项技术使内生菌基因调控网络的精确进化成为可能,即使在田间施用肥料的情况下,也能产生积极固氮的微生物。本文还描述了定殖于玉米根组织并为经施肥的植物产生氮的进化微生物的可能技术进行评估,以及内生菌与标准配方实践和不同土壤的兼容性评估,以确定将微生物整合到现代氮中的可行性管理策略。
为了利用元素氮(N)进行化学合成,生命形式将大气中可用的氮气(N
在变形菌门(Proteobacteria)中,固氮的调节围绕着σ
NifA转录自nifLA操纵子,所述nifLA操纵子的启动子由磷酸化的NTRC,另一个σ
响应环境氮,NifA的活性也被翻译后调节,最典型地是通过NifL介导的NifA活性抑制。通常,NilL和NifA的相互作用受到经由GlnK的PII蛋白信号转导级联的影响,尽管GlnK和NifL/NifA之间相互作用的性质在固氮生物之间差异很大。在肺炎链球克雷伯氏菌(Klebsiella pneumoniae)中,两种形式的GlnK抑制NifL/NifA相互作用,而GlnK与NifL/NifA之间的相互作用取决于细胞内游离的GlnK的总体水平。在氮过量的条件下,去尿苷酰基化的GlnK与铵转运体AmtB相互作用,其有助于阻止AmtB的铵摄取以及螯合GlnK至膜,从而使NifL抑制NifA。另一方面中,在棕色固氮菌(Azotobacter vinelandi)中,NifL/NifA相互作用和NifA抑制需要与去尿苷酰基化的GlnK相互作用,而GlnK的尿苷酰基化抑制其与NifL的相互作用。在缺乏nifL基因的固氮生物中,有证据表明,在氮过量条件下,通过与GlnK和GlnB的去尿苷酰基化形式相互作用直接抑制了NifA活性。在某些细菌中,Nif簇可能受glnR调控,并且在一些情况中,这可能包含负调控。无论机制如何,NifA的翻译后抑制作用是大多数已知固氮生物中nif簇的重要调节剂。此外,nifL、amtB、glnK和glnR是可在本文所述方法中改变其表达的基因。
除了调节nif基因簇的转录以外,许多固氮生物已经进化了直接翻译后修饰和抑制固氮酶本身的机制,称之为固氮酶关闭。这是通过氮过量条件下Fe蛋白(NifH)的ADP核糖基化介导的,其破坏了它与MoFe蛋白复合物(NifDK)的相互作用并消除了固氮酶活性。DraT催化铁蛋白的ADP核糖基化和固氮酶的关闭,而DraG催化ADP核糖的去除和固氮酶的再活化。与nifLA转录和NifA抑制一样,固氮酶的关闭也通过PII蛋白信号级联进行调节。在氮过量的条件下,去尿苷酰化的GlnB与DraT相互作用并活化DraT,而去尿苷酰化的GlnK与DraG和AmtB都相互作用,形成复合物,将DraG螯合到膜上。在氮限制条件下,GlnB和GlnK的尿苷酰化形式不与DraT和DraG分别相互作用,导致DraT失活和DraG向Fe蛋白扩散,从而去除ADP-核糖并活化固氮酶。本文所描述的方法还考虑通过操纵nifH、nifD、nifK和draT基因来改变表达。
虽然某些内生菌具有体外固定氮的能力,但是高水平的外源化肥在田间常常使基因沉默。可以将外源性氮的感测与固氮酶的表达去偶联以促进基于田间的固氮。提高固氮酶活性在一段时间内的完整性,有助于增加供作物利用的氮素产量。使用本文所述方法改变表达以促进基于田间的氮固定的特定靶标包括选自下组的一个或多个基因:nifA、nifL、ntrB、ntrC、glnA、glnB、glnK、draT、amtB、glnD、glnE、nifJ、nifH、nifD、nifK、nifY、nifE、nifN、nifU、nifS、nifV、nifW、nifZ、nifM、nifF、nifB和nifQ。
使用本文所述方法改变表达以促进基于田间的氮固定的另一靶标是NifA蛋白。NifA蛋白是典型的固氮基因表达活化剂。增加NifA的产生(无论是组成性的还是在高氨条件下)绕过了天然氨感应途径。此外,减少NifA抑制剂NifL蛋白的产生,也会导致游离活性NifA水平的增加。此外,增加nifAL操纵子的转录水平(无论是组成性的还是在高氨条件下)也会导致NifA蛋白的总体水平更高。nifAL表达水平的提高是通过改变启动子本身或通过降低NtrB的表达来实现的(NtrB和ntrC信号级联的一部分,最初会导致高氮条件下nifAL操纵子的关闭)。通过这些或本文所述的任何其他方法获得的高水平NifA增加内生菌的固氮活性。
使用本文所述方法改变表达以促进基于田间的氮固定的另一靶标是GlnD/GlnB/GlnK PII信号转导级联。细胞内的谷氨酰胺水平通过GlnD/GlnB/GlnK-PII信号级联来感应。GlnD中的活性位点突变消除了GlnD的尿苷酰基去除活性,从而破坏了氮感测级联。此外,GlnB浓度的降低使谷氨酰胺感应级联短路。这些突变“欺骗”细胞进入感知氮限制状态,从而增加了氮固定水平活性。这些过程也可能响应氨、尿素或硝酸盐的胞内或胞外水平。
amtB蛋白可使用本文所述方法改变表达以促进基于田间的氮固定的靶标。可以通过降低amtB蛋白的表达水平来减少从环境中的氨摄取。没有细胞内的氨,内生菌无法感应高水平的氨,阻止固氮基因的下调。任何进入细胞内的氨都会转化为谷氨酰胺。胞内谷氨酰胺水平是氮感测的主要手段。降低细胞内谷氨酰胺水平会阻止细胞感应环境中的高铵水平。这种效果可以通过增加谷氨酰胺酶(一种将谷氨酰胺转化为谷氨酸的酶)的表达水平来实现。此外,细胞内谷氨酰胺也可以通过降低谷氨酰胺合酶(一种将氨转化为谷氨酰胺的酶)来减少。在固氮生物中,固定的氨会迅速被同化为谷氨酰胺和谷氨酸,以用于细胞过程。氨同化的中断可能使固定的氮作为氨从细胞中输出。固定的氨主要被glnA编码的谷氨酰胺合酶(GS)同化为谷氨酰胺,随后被谷氨酰胺氧谷氨酸转氨酶(GOGAT)转化为谷氨酰胺。在一些例子中,glnS编码谷氨酰胺合酶。GS通过GS腺苷酰基转移酶(GlnE)的翻译后调控,GlnE是由glnE编码的双功能酶,其分别通过其腺苷酰基转移酶(AT)和腺苷酰基去除(AR)的活性催化GS的腺苷酰化作用和去腺苷酰化作用。在氮限制条件下,表达glnA,GlnE的AR结构域使GS去腺苷酰化,从而使其具有活性。在氮过量的情况下,glnA的表达被关闭,GlnE的AT结构域被谷氨酰胺别构激活,导致GS的腺苷酰化和失活。
此外,draT基因也可以是使用本文所述方法改变表达以促进基于田间的氮固定的靶标。一旦细胞产生固氮酶,固氮酶的关闭代表了在高氮条件下细胞下调固氮活性的另一个水平。可以通过降低DraT的表达水平来消除这种关闭。
改变微生物基因表达的方法可以在转录、翻译或翻译后水平上影响微生物。转录水平包括启动子的改变(如改变sigma因子亲和力或转录因子的结合位点,包括全部或部分启动子的缺失)或改变转录终止子和衰减子。翻译水平包括核糖体结合位点的改变和mRNA降解信号的改变。翻译后水平包括酶活性位点的突变和蛋白质相互作用的改变。
相反,本文所述基因的表达水平可通过增强启动子来实现。为了确保在高氮水平条件下(或任何其他条件下)高启动子活性,可以获得高氮水平条件下整个基因组的转录谱,并且可以从该数据集中选择具有所需转录水平的活性启动子来替换弱启动子。可以使用能够增强弱或强启动子的排出物。
增加植物中氮固定的水平可以导致用于作物生产所需的化学肥料数量减少并减少温室气体排放量(例如,一氧化二氮)。
细菌群体的产生
细菌的分离
可通过从天然植物的表面或组织提取微生物来获得在本文所公开的方法和组合物中有用的微生物。可以通过研磨种子来分离微生物来获得微生物。微生物可以通过在不同的土壤样品中播种和从组织中回收微生物来获得。此外,可以通过将外源微生物接种到植物上并确定哪些微生物出现在植物组织中来获得微生物。植物组织的非限制性实例可包括种子、幼苗、叶、切块、植物、鳞茎或块茎。
从土壤中分离细菌是获得微生物的一种方法。细菌可以从各种土壤中收集。在一些实例中,土壤的特征可以在于这样的性状,诸如高或低肥力,水分水平,矿物水平和各种耕作实践。例如,土壤可能涉及作物轮作,即在连续的种植季节,不同的作物种植在同一土壤中。不同作物在同一土壤上的连续生长可以防止某些矿物质的过度消耗。可以从选定土壤中生长的植物中分离出细菌。幼苗可在生长2-6周时收获。例如,一轮收获至少可以收集400个分离物。土壤和植物类型揭示了植物表型以及允许某些表型下游富集的条件。
可以从植物组织中分离微生物以评估微生物性状。可以改变用于处理组织的参数以分离不同类型的关联微生物,例如根际菌,附生或内生菌。分离物可以在无氮培养基中培养,以富集进行固氮的细菌。或者,微生物可以获自全球菌株库(global strain bank)。
进行植物中分析以评估微生物性状。在一些实施方式中,可以通过高通量处理DNA和RNA来处理植物组织以进行筛选。此外,非侵入性测量可用于评估植物特性,如定殖。对野生微生物的测量可以逐株获得。野生微生物的测量也可以在田间使用中等通量的方法获得。测量可以随着时间的推移连续进行。模式植物系统可用于包括但不限于狗尾草。
可以通过植物系统中微生物的转录谱来筛选植物系统中的微生物。通过转录谱分析进行筛选的实例是使用方法:定量聚合酶链反应(qPCR),用于转录本检测的分子条形码,下一代测序以及使用荧光标志物进行的微生物标记。可以测量影响因素来评估温室中的定殖,包括但不限于微生物组、非生物因素、土壤条件、氧气、水分、温度、接种条件和根定位。如本文所述,可以通过使用IRMS或NanoSIMS测量15N气体/肥料(稀释)来评估细菌中的氮固定,NanoSIMS是高分辨率二次离子质谱(secondary ion mass spectrometry)。NanoSIMS技术是从生物样品中研究化学活性的一种方法。在细胞、亚细胞、分子和元素水平上,可以研究减少驱动微生物代谢的氧化反应的催化作用。NanoSIMS可以提供大于0.1μm的高空间分辨率。NanoSIMS可以检测同位素示踪剂的使用,如
自动化温室可用于植物分析。响应微生物暴露的植物指标包括但不限于,生物质、叶绿体分析、CCD相机(camera),体积断层摄影术测量。
富集微生物群体的一种方法是根据基因型。例如,用靶向引物或特异性引物进行聚合酶链反应(PCR)分析。针对nifH基因设计的引物可用于鉴定固氮生物,因为固氮生物在氮固定过程中表达nifH基因。也可以通过独立于单细胞培养的方法和趋化性指导的分离方法来富集微生物群体。或者,可以通过在选择培养基上培养微生物来进行靶向微生物分离。可以通过生物信息学数据指导富集微生物群体所需性状的预先设计的方法,并在本文中进行描述。
用生物信息学富集具有固氮能力的微生物
生物信息学工具可用于鉴定和分离植物生长促进根际细菌(PGPRs),这些细菌是根据其固氮能力选择的。固氮能力强的微生物能促进植物的优良性状。用于鉴定PGPR的生物信息学分析模式包括但不限于基因组学、宏基因组学、靶向分离、基因测序、转录组测序和建模。
基因组学分析可用于鉴定PGPR,并通过本文所述的下一代测序方法和微生物版本控制来确认突变的存在。
可以用使用定殖的预测算法通过宏基因组学鉴定和分离PGPR。宏数据还可用于鉴定环境和温室样品中是否存在工程化菌株。
转录组测序可用于预测导致PGPR表型的基因型。此外,转录组学数据被用来确定改变基因表达的启动子。转录组数据可以结合全基因组序列(WGS)进行分析,以生成代谢和基因调控网络的模型。
微生物的驯化
分离自自然界的微生物可能经历驯化过程,其中微生物经转化形成为可遗传追踪且可鉴定的形式。驯化微生物的一种方法是将其工程改造具有抗生素抗性。工程改造抗生素抗性的过程可以通过确定野生型微生物菌株中抗生素敏感性开始。如果细菌对抗生素敏感,那么抗生素可以作为抗药性工程改造的良好候选物。随后,可以使用重组工程改造方法将抗生素抗性基因或可反选择的自杀载体纳入微生物的基因组中。可反选择的自杀载体可以由感兴趣的基因的缺失,可选择标志物和可反选择标志物sacB组成。反选择可用于将天然微生物DNA序列与抗生素抗性基因交换。中等通量方法可用于评估多个微生物,同时允许平行驯化。驯化的替代方法包括使用归巢核酸酶以防止自杀载体序列环出(loop out)或获得间插载体序列。
可以经由几种方法将DNA载体引入细菌,包括电穿孔和化学转化。可以使用标准的载体文库进行转化。基因编辑方法的实例是CRISPR,之前进行Cas9测试,以确保微生物中的Cas9活性。
微生物的非转基因工程改造
具有有利性状的微生物群体可以经由定向进化获得。定向进化是这样一种方法,其中模仿了自然选择过程以朝着用户定义的目标进化蛋白质或核酸。定向进化的一个实例是当将随机突变引入微生物群体时,选择具有最有利性状的微生物,并且使所选微生物的生长继续。生长促进根际细菌(PGPR)中最有利的性状可能是氮固定。基于每次迭代后的选择过程,定向进化的方法可以是迭代的和适应性的。
可以产生具有高氮固定能力的植物生长促进根际细菌(PGPR)。PGPR的进化可以经由引入遗传变异来进行。可以通过以下引入遗传变异:聚合酶链反应诱变,寡核苷酸定向诱变,饱和诱变,片段改组诱变,同源重组,CRISPR/Cas9系统,化学诱变及其组合。这些方法可以将随机突变引入微生物群体。例如,可以使用经由寡核苷酸定向诱变的合成DNA或RNA产生突变体。可以使用质粒中包含的工具生成突变体,然后将其固化。可以使用来自性状改善的其他物种的文库来鉴定感兴趣的基因,这些性状包括但不限于,PGPR特性改善,谷物定殖改善,氧敏感性增加,固氮能力增加和氨分泌增加。可以使用诸如Geneious或Platypus设计软件之类的软件基于这些文库设计属内基因。可以借助机器学习来设计变异。可以借助代谢模型来设计变异。可以使用la Platypus完成突变的自动化设计,并将指导Cas定向诱变的RNA。
属内基因可以被转移到宿主微生物中。此外,报告物系统也可以被转移到微生物。报道物系统表征启动子,确定转化成功,筛选突变体,并充当阴性筛选工具。
携带突变的微生物可以通过连续传代培养。微生物菌落包含微生物的单个变体。借助于自动菌落选择器和液体处理器来筛选微生物菌落。具有基因重复和增加拷贝数的突变体表达所需性状较高的基因型。
基于氮固定的植物生长促进微生物的选择
可以使用各种试验筛选微生物菌落以评估氮固定能力。测量氮固定的一种方法是通过单一发酵试验,其测量氮排出。另一种方法是随时间的ARA。ARA可以在微管试验的高通量板中进行。ARA可以使用活植物和植物组织进行。可以改变ARA试验中的培养基配方和培养基氧浓度。筛选微生物变体的另一种方法是使用生物传感器。NanoSIMS和拉曼显微镜检的使用可用于研究微生物的活性。在一些情况中,也可以使用生物反应器中的发酵方法培养和扩增细菌。生物反应器旨在改善细菌生长的稳健性并降低细菌对氧气的敏感性。基于中至高的TP板的微发酵罐用于评估氧气敏感性,营养需求,氮固定和氮分泌。细菌还可以与竞争性或有益微生物共培养以说明隐藏途径。流式细胞术可用于使用化学、比色或荧光指示剂筛选产生高水平氮的细菌。可以存在或不存在氮源的情况下培养细菌。例如,可以将细菌与谷氨酰胺、氨、尿素或硝酸盐一起培养。
在某些情况下,可以在植物原位分析或模拟植物原位分析的分析中筛选微生物。在某些情况下,微生物可以与田间植物、温室中的植物、水培系统中的植物、在暴露于植物根、叶或茎的培养基(例如,天然PEM)或设计用于模拟植物环境的培养基(例如,合成PEM)中一起生长。例如,微生物可以在体外培养基中生长,该培养基被构造成模拟植物根排出物。PEM可能成为微生物体外研究的替代物,但条件更接近于微生物在田间可能遇到的环境。在某些情况下,可通过将幼苗或根组织(例如玉米根组织)浸入水性溶液中来产生PEM。植物根可以将碳源、氨基酸和/或其他代谢物排到其附近。收集与这种植物组织接触的水性溶液可以使微生物在基质中生长,这种基质可以更好地模拟微生物在田间遇到的环境。如上所述,例如,通过在水性溶液中研磨根组织以将代谢物释放到水性溶液中以供微生物生长,可以获得植物排出物。
引入遗传变异可包括在靶位点插入和/或删除一个或多个核苷酸,例如1、2、3、4、5、10、25、50、100、250、500或更多核苷酸。引入本文公开的方法中的一个或多个细菌中的遗传变异可以是敲除突变(例如,缺失启动子、插入或缺失以产生过早终止密码子、缺失整个基因),或者它可以是蛋白质结构域活性的消除或废除(例如影响活性位点的点突变,或者编码蛋白质产物相关部分的基因部分的缺失),或者它可以改变或废除靶基因的调控序列。还可以插入一个或多个调控序列,包括异源调控序列和在与引入遗传变异的细菌相对应的细菌物种或属的基因组内发现的调控序列。此外,可基于基因在细菌培养物或植物组织内的表达水平来选择调控序列。遗传变异可以是特异性引入到目标位点的预先确定的遗传变异。遗传变异可能是靶位点内的随机突变。遗传变异可能是一个或多个核苷酸的插入或缺失。在一些情况中,在将细菌暴露于植物用于评估性状改善之前,将多个不同的遗传变异(例如,2、3、4、5、10或更多个)引入一个或多个分离细菌中。多个遗传变异可以是上述类型中的任何一种,相同或不同的类型,并且可以是任何组合。在一些情况中,依次引入多个不同的遗传变异,在第一分离步骤后引入第一遗传变异,在第二分离步骤后引入第二遗传变异等,以便在细菌中积累多个遗传变异,逐渐改善相关植物的性状。
遗传变异可以称之为“突变”,且包含遗传变异的序列或生物体可以称之为“遗传变体”或“突变体”。遗传变异可以具有多种作用,如增加或减少某些生物活性,包括基因表达、代谢和细胞信号传导。遗传变异可以特异性地引入靶位点,或随机引入。存在能够用于引入遗传变异的各种分子工具和方法。例如,可以通过以下引入遗传变异:聚合酶链反应诱变,寡核苷酸定向诱变,饱和诱变,片段改组诱变,同源重组,重组工程改造,λRed介导的重组,CRISPR/Cas9系统,化学诱变及其组合。引入遗传变异的化学方法包括,将DNA暴露于化学诱变剂,例如,甲磺酸乙酯(EMS),甲磺酸甲酯(MMS),N-亚硝基脲(ENU),N-甲基-N-硝基-N'-亚硝基胍,4-硝基喹啉N-氧化物,硫酸二乙酯,苯并芘,环磷酰胺,博来霉素,三乙基三聚氰胺,丙烯酰胺单体,氮芥,长春新碱,二环氧烷烃(例如二环氧丁烷),ICR-170,甲醛,盐酸甲基苄肼,环氧乙烷,二甲基亚硝胺,7,12二甲基苯并(a)蒽,苯丁酸氮芥,六甲基磷酰胺,亚砜等。辐射突变诱导剂包括,紫外线辐射,γ辐照,X射线和快速中子轰击。还可使用例如三甲基补骨脂素在紫外线光下将遗传变异引入核酸。随机或靶向插入移动DNA元件(例如,可转座元件)是用于产生遗传变异的另一合适方法。遗传变异可以在扩增期间引入无细胞体外系统中的核酸中,例如,使用聚合酶链反应(PCR)技术,诸如易错PCR。可以使用DNA改组技术(例如,外显子改组,结构域交换等)将遗传变异体外引入核酸中。由于细胞中DNA修复酶缺乏的结果,也可以将遗传变异引入核酸中,例如,在细胞中存在编码突变DNA修复酶的突变基因预期将会在细胞基因组中产生高频率的突变(即,大约1个突变/100个基因-1个突变/10,000个基因)。编码DNA修复酶的基因的实例包括但不限于,Mut H,Mut S,Mut L,和Mut U,和其他物种中的同源物(例如,MSH 1 6,PMS 1 2,MLH 1,GTBP,ERCC-1等)。用于引入遗传变异的各种方法的实例描述在例如,Stemple(2004)Nature 5:1-7;Chiang等(1993)PCR Methods Appl 2(3):210-217;Stemmer(1994)Proc.Natl.Acad.Sci.USA91:10747-10751;和美国专利号6,033,861和6,773,900中提供。
引入微生物的遗传变异可分为转基因,顺基因(cisgenic),基因组内,基因内,基因间,合成的,进化的,重排的或SNP。
可以将遗传变异引入微生物内的许多代谢途径中以引发上述性状的改善。代表性途径包括硫摄取途径,糖原生物合成,谷氨酰胺调节途径,钼摄取途径,氮固定途径,氨吸收,氨分泌或分泌,氮摄取,谷氨酰胺生物合成,厌氧氨氧化(annamox),磷酸盐溶解,有机酸转运,有机酸生产,凝集素生产,活性氧自由基清除基因,吲哚乙酸生物合成,海藻糖生物合成,植物细胞壁降解酶或途径,根附着基因,胞外多糖分泌,谷氨酸盐/酯合酶途径,铁摄取途径,铁载体途径,几丁质酶途径,ACC脱氨酶,谷胱甘肽生物合成,磷信号转导基因,群体(quorum)猝灭途径,细胞色素途径,血红蛋白途径,细菌性血红蛋白样途径,小RNA rsmZ,根瘤菌毒素生物合成,lapA粘附蛋白,AHL群体感测途径,吩嗪生物合成,环脂肽生物合成和抗生素生产。
CRISPR/Cas9(规律成簇的间隔短回文重复)/CRISPR相关的(Cas)系统可用于引入所需突变。通过使用CRISPR RNA(crRNA)指导入侵的核酸沉默,CRISPR/Cas9为细菌和古细菌提供了针对病毒和质粒的适应性免疫力。Cas9蛋白(或其功能性等同物和/或变体,即Cas9样蛋白)天然包含DNA内切核酸酶活性,其取决于蛋白质与两个天然存在的或合成的RNA分子(称为crRNA和tracrRNA(也称为向导RNA)))之间的关联。在一些情况中,这两个分子共价连接形成单个分子(也称为单向导RNA(“sgRNA”)。因此,Cas9或Cas9样蛋白与靶向DNA的RNA结合(该术语涵盖了双分子向导RNA构型和单分子向导RNA构型)相关联,其激活Cas9或Cas9样蛋白并将蛋白质引导至靶核酸序列。如果Cas9或Cas9样蛋白保留其天然酶功能,那么它将切割靶DNA以产生双链断裂,从而导致基因组改变(即编辑:缺失,插入(当存在供体多核苷酸时),置换等),从而改变基因表达。Cas9的某些变体(其中变体包含在术语Cas9-样中)已经改变,以使它们的DNA切割活性降低(在一些情况中,它们切割目标DNA的单链而不是两条链,而在其他情况下,它们严重地导致没有DNA切割活性)。用于引入遗传变异的CRISPR系统的其他示例性描述可以在例如US8795965中找到。
作为一种循环扩增技术,聚合酶链反应(PCR)诱变使用诱变引物来引入所需的突变。通过变性、退火和延伸的循环进行PCR。通过PCR扩增后,可以通过以下步骤完成选择突变DNA和去除亲本质粒DNA:1)在PCR过程中用羟甲基化的-dCTP替换dCTP,然后用限制性酶消化,以仅除去非羟甲基化的亲本DNA;2)对抗生素抗性基因和研究的基因进行同时诱变,所述研究的基因将质粒改变为不同的抗生素抗性,新的抗生素抗性有助于其后选择所需的突变;3)引入所需的突变后,通过限制性酶Dpn1消化亲本甲基化模板DNA,所述限制性酶Dpn1仅切割甲基化DNA,由此回收诱变的未甲基化链;或4)在额外的连接反应中使突变的PCR产物环化,以增加突变DNA的转化效率。示例性方法的其他说明述于例如,US7132265,US6713285,US6673610,US6391548,US5789166,US5780270,US5354670,US5071743和US20100267147。
寡核苷酸定向诱变,也称为定点诱变,通常利用合成DNA引物。该合成引物包含所需的突变并且与突变位点周围的模板DNA互补,因此其可以与感兴趣的基因中的DNA杂交。突变可以是单碱基变化(点突变),多碱基变化,缺失或插入,或这些的组合。然后,使用DNA聚合酶延伸单链引物,其复制基因的其余部分。如此复制的基因包含突变位点,然后可以将其作为载体引入宿主细胞并克隆。最后,可以通过DNA测序以检查它们是否包含所需的突变来选择突变体。
可以使用易错PCR引入遗传变异。在该技术中,在缺乏序列复制的保真度的条件下,使用DNA聚合酶扩增感兴趣的基因。结果是扩增产物在序列中包含至少一个错误。当与模板分子相比,在扩增基因并且反应的所得产物在序列上包含一个或多个改变时,与模板相比诱变了所得产物。引入随机突变的另一种方法是将细胞暴露于化学诱变剂,例如亚硝基胍或甲磺酸乙酯(Nestmann,Mutat Res 1975年6月;28(3):323-30),然后由宿主分离出含有该基因的载体。
饱和诱变是随机诱变的另一种形式,其中人们试图在基因的特定位点或狭窄区域产生所有或几乎所有可能的突变。在一般意义上,饱和诱变包括诱变处理确定的待诱变的多核苷酸序列(其中待诱变的序列长度为例如15-100,000个碱基)中的整套诱变盒(其中各盒的长度为例如1-500个碱基)。因此,将一组突变(例如,1至100个突变)引入待诱变的各盒中。在应用一轮饱和诱变期间,待引入一个盒的突变的分组可以与待引入第二盒的突变的第二分组不同或相同。这类分组的实例为特定密码子的缺失、添加、分组和特定核苷酸盒的分组。
片段改组诱变,也称为DNA改组,是一种快速传播有益突变的方法。在改组过程的一个实例中,DNA酶用于将一组亲本基因片段化成长度为例如约50-100bp的片段。然后进行没有引物的聚合酶链反应(PCR)——具有足够重叠的同源序列的DNA片段将彼此退火,然后通过DNA聚合酶进行延伸。在某些DNA分子达到亲本基因的大小后,允许进行几轮这种PCR延伸。然后可以使用另一PCR扩增这些基因,这次添加了设计为与链末端互补的引物。引物可在其5'末端具有其他序列,如连接到克隆载体中所需的限制性酶识别位点的序列。US20050266541中提供了改组技术的其他实例。
同源重组诱变涉及外源性DNA片段和靶向多核苷酸序列之间的重组。双链断裂发生后,断裂的5'末端附近的DNA区段在称为切除的过程中被切除。在随后的链入侵步骤中,断裂的DNA分子的突出3'端随后“侵入”未断裂的相似或相同的DNA分子。该方法可用于缺失基因,去除外显子,添加基因和引入点突变。同源重组诱变可以是永久的或有条件的。通常,还提供重组模板。重组模板可以是另一载体的组分,包含在单独的载体中,或以单独的多核苷酸提供。在一些实施方式中,重组模板被设计成用作同源重组中的模板,如在被位点特异性核酸酶造成缺口或切割的靶序列之内或附近。模板多核苷酸可以为任何合适的长度,如长度为约或大于约10、15、20、25、50、75、100、150、200、500、1000或更多个核苷酸。在一些实施方式中,模板多核苷酸与包含靶序列的多核苷酸的部分互补。当最佳比对时,模板多核苷酸可能与靶序列的一个或多个核苷酸重叠(例如,约或大于约1、5、10、15、20、25、30、35、40、45、50、60、70,80、90、100或更多个核苷酸)。在一些实施方式中,当模板序列和包含靶序列的多核苷酸最佳比对时,模板多核苷酸的最近核苷酸距离靶序列约1、5、10、15、20、25、50、75、100、200、300内,400、500、1000、5000、10000或更多个核苷酸内。能够用于同源重组方法的定点核酸酶的非限制性实例包括锌指核酸酶,CRISPR核酸酶,TALE核酸酶和大范围核酸酶。对于这类核酸酶用途的进一步描述,参见例如,US8795965和US20140301990。
主要产生点突变和短缺失,插入,转化和/或转变的诱变剂(包括化学诱变剂或辐射)可用于产生遗传变异。诱变剂包括但不限于,甲磺酸乙酯,甲磺酸甲酯,N-乙基-N-硝基脲,三乙基三聚氰胺,N-甲基-N-亚硝基脲,甲基苄肼,苯丁酸氮芥,环磷酰胺,硫酸二乙酯,丙烯酰胺单体,美法仑,氮芥,长春新碱,二甲基亚硝胺,N-甲基-N'-硝基-亚硝基胍,亚硝基胍,2-氨基嘌呤,7,12二甲基-苯并(a)蒽,环氧乙烷,六甲基磷酰胺,亚砜,二环氧烷烃(二环氧辛烷,二环氧丁烷等),2-甲氧基-6-氯-9[3-(乙基-2-氯-乙基)氨基丙基氨基]吖啶二氢氯化物和甲醛。
引入遗传变异可能是一个不完整的过程,因此,经过处理的细菌群体中的某些细菌会携带所需的突变,而其他细菌则不会。在一些情况中,期望施加选择压力以富集携带期望遗传变异的细菌。通常,选择成功的遗传变体涉及选择遗传变异赋予或废除的某些功能或针对其进行选择,诸如在插入抗生素抗性基因或废除能够将非致死化合物转化为致死代谢物的代谢活性的情况下。也可能基于多核苷酸序列本身施加选择压力,使得仅需要引入所需遗传变异(例如,也不需要选择标记物)。在这种情况下,选择压力可以包括切割缺乏引入靶位点的遗传变异的基因组,使得选择有效地针对寻求引入遗传变异的参照序列。通常,切割发生在靶位点的100个核苷酸内(例如,距靶位点75、50、25、10或更少个核苷酸内,包括在靶位点处或靶位内的切割)。切割可以由选自下组的位点特异性核酸酶指导:锌指核酸酶,CRISPR核酸酶,TALE核酸酶(TALEN)或大范围核酸酶。除了没有提供用于同源重组的模板之外,这类过程类似于用于增强靶位点处同源重组的过程。因此,缺乏所需遗传变异的细菌更容易发生切割,如果不进行修复,那么会导致细胞死亡。然后可以分离存活于选择的细菌,用于暴露于植物以评估改良性状的赋予。
CRISPR核酸酶可以用作位点特异性核酸酶以将切割引导至靶位点。可以通过使用Cas9杀死未突变的细胞获得对突变的微生物改善的选择。然后用突变的微生物接种植物以重新确认共生并产生进化压力以选择有效的共生体。然后可以从植物组织中重新分离出微生物。用于针对非变体的选择的CRISPR核酸酶系统可以采用与上述关于引入遗传变异的那些相似的元件,不同之处在于不提供用于同源重组的模板。因此,针对靶位点的切割增加了受影响细胞的死亡。
存在用于在靶位点特异性诱导切割的其他选择,如锌指核酸酶,TALE核酸酶(TALEN)系统和大范围核酸酶。锌指核酸酶(ZFN)是通过将锌指DNA结合域与DNA切割域融合而产生的人工DNA内切核酸酶。ZFN可以经工程改造以靶向所需的DNA序列,并且这可以使锌指核酸酶切割独特的靶序列。当引入细胞中时,ZFN可用于通过诱导双链断裂来编辑细胞中的靶DNA(例如,细胞的基因组)。转录激活子样效应物核酸酶(TALEN)是通过将TAL(转录激活子样)效应物DNA结合结构域与DNA切割结构域融合来产生的人工DNA内切核酸酶。可以快速工程改造TALENS以结合基本上任何所需DNA序列,并且当引入细胞中时,TALENS可用于通过诱导双链断裂来编辑细胞中的靶DNA(例如,细胞的基因组)。大范围核酸酶(归巢内切核酸酶)是通过大识别位点(12至40个碱基对的双链DNA序列)表征的内切脱氧核糖核酸酶。大范围核酸酶可用于以高度靶向的方式替换、消除或修饰序列。通过经由蛋白质工程改造修饰其识别序列,可以改变靶向的序列。大范围核酸酶可以用于修饰所有基因组类型,无论是细菌、植物或动物,并且通常分为四个家族:LAGLIDADG家族、GIY-YIG家族、His-Cyst箱家族和HNH家族。示例性寻靶核酸内切酶包括I-SceI、I-CeuI、PI-PspI、PI-Sce、I-SceIV、I-CsmI、I-PanI、I-SceII、I-PpoI、I-SceIII、I-CreI、I-TevI、I-TevII和I-TevIII。
可以采用本公开的方法以引入或改善多种所需要的性状中的一种或多种。可引入或改善的性状的实例包括:根生物量,根长度,高度,枝条长度,叶数,水分利用效率,总生物量,产量,果实大小,籽粒大小,光合作用率,耐旱性,耐热性,耐盐性,对线虫胁迫的抗性,对真菌病原体的抗性,对细菌病原体的抗性,对病毒病原体的抗性,代谢物的水平和蛋白质组表达。所需要的性状,包括高度,总生物量,根和/或枝条生物量,种子发芽,幼苗存活,光合效率,蒸腾速率,种子/果实数量或质量,植物籽粒或果实产量,叶绿素含量,光合速率,根长度或其任意组合,可用于测量生长,并与相同条件下生长的参照农业植物(例如,不具有改良的性状的植物)的生长速率进行比较。
如本文所述,待引入或改善的优选性状是氮固定。在一些情况中,本文所述方法产生的植物表现出的性状差异比相同条件下土壤中生长的参照农业植物大至少约5%,例如,至少约5%、至少约8%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约60%、至少约75%、至少约80%、至少约80%、至少约90%或至少100%、至少约200%、至少约300%、至少约400%或更大。在额外的实施方式中,本文所述方法产生的植物表现出的性状差异比相似条件下土壤中生长的参照农业植物大至少约5%,例如,至少约5%、至少约8%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约60%、至少约75%、至少约80%、至少约80%、至少约90%或至少100%、至少约200%、至少约300%、至少约400%或更大。
可在包括施用一种或多种生物或非生物胁迫源(stressor)的条件下评估待改良的性状。胁迫源的实例包括非生物胁迫(如热胁迫,盐胁迫,干旱胁迫,冷胁迫和低营养胁迫)和生物胁迫(如线虫胁迫,昆虫食草胁迫,真菌病原体胁迫,细菌病原体胁迫和病毒病原体胁迫)。
氮固定
本文所述的一些方法可提供使用天然或合成PEM来改变固氮基因。氮固定可以是这样的过程,其中细菌在植物中产生1%或更多的氮(例如2%,5%,10%或更多),这可以表示相较于不存在细菌的植物至少2倍的氮固定能力。在补充有谷氨酰胺、尿素、硝酸盐或氨的肥料存在的情况下,细菌可能产生氮。遗传变异可以是本文所述的任何遗传变异,包括以上提供的实例,以任何数目和任何组合。遗传变异可以引入选自下组的基因中,但不限于:nifA,nifL,ntrB,ntrC,谷氨酰胺合成酶,glnA,glnB,glnK,draT,amtB,谷氨酰胺酶,glnD,glnE,nifJ,nifH,nifD,nifK,nifY,nifE,nifN,nifU,nifS,nifV,nifW,nifZ,nifM,nifF,nifB,和nifQ。遗传变异可以是导致下述内容中一个或多个的突变:nifA或谷氨酰胺酶的表达或活性增加;nifL,ntrB,谷氨酰胺合成酶,glnB,glnK,draT,amtB的表达或活性降低;GlnE去除腺苷酰基的活性降低;或GlnD去除尿苷酰基的活性降低。
本文所述植物中出现的氮固定的量可以几种方式测量,例如,通过ARA试验。ARA可以在体外或体内进行。定细菌向植物提供固定的氮的证据可以包括:1)接种后,植物总氮显著增加,例如植物中氮浓度伴随增加;2)接种后,氮缺乏症状在氮限制条件下缓解(这可包括增加干物质);3)通过使用
微生物物种
能够用于本文所公开的方法和组合物中的微生物可以获自任何来源。在一些情况中,微生物可能是细菌,古细菌,原生动物或真菌。本公开的微生物可以是固氮微生物,例如固氮细菌,固氮古细菌,固氮真菌,固氮酵母或固氮原生动物。能够用于本文所公开的方法和组合物中的微生物可以是形成孢子的微生物,例如形成孢子的细菌。在一些情况中,能够用于本文所公开的方法和组合物中的细菌可以是革兰氏阳性细菌或革兰氏阴性细菌。在一些情况中,细菌可以是厚壁菌门的内生孢子形成细菌。在一些情况中,细菌可能是固氮生物(diazatroph)。在一些情况中,细菌可能不是固氮生物。
本公开的方法和组合物可以与古细菌,例如,嗜热自养甲烷杆菌(Methanothermobacter thermoautotrophicus)一起使用。
在某些情况中,可用的细菌包括但不限于:放射土壤杆菌(Agrobacteriumradiobacter),酸热芽孢杆菌(Bacillus acidocaldarius),酸杆菌芽孢杆菌(Bacillusacidoterrestris),农田芽孢杆菌(Bacillus agri),艾寨外芽孢杆菌(Bacillusaizawai),阿博乳酸芽孢杆菌(Bacillus albolactis),嗜碱芽孢杆菌(Bacillusalcalophilus),蜂房芽孢杆菌(Bacillus alvei),氨糖性芽孢杆菌(Bacillusaminoglucosidicus),氨沃芽孢杆菌(Bacillus aminovorans),解淀粉芽孢杆菌(Bacillusamylolyticus)(也称之为解淀粉类芽孢杆菌(Paenibacillus amylolyticus)),淀粉液化芽孢杆菌(Bacillus amyloliquefaciens),解硫胺素芽胞杆菌(Bacillusaneurinolyticus),萎缩芽孢杆菌(Bacillus atrophaeus),固氮芽孢杆菌(Bacillusazotoformans),栗褐芽孢杆菌(Bacillus badius),蜡样芽胞杆菌(Bacillus cereus)(同义词:内生芽孢杆菌(Bacillus endorhythmos),水母芽孢杆菌(Bacillus medusa)),几丁质芽孢杆菌(Bacillus chitinosporus),圆形芽孢杆菌(Bacillus circulans),凝结芽孢杆菌(Bacillus coagulans),生寄生芽孢杆菌(Bacillus endoparasiticus),苛求芽胞杆菌(Bacillus fastidiosus),坚定芽孢杆菌(Bacillus firmus),库尔斯塔克芽孢杆菌(Bacillus kurstaki),乳酸杆菌芽孢杆菌(Bacillus lacticola),乳毒病芽孢杆菌(Bacillus lactimorbus),乳酸杆菌芽孢杆菌(Bacillus lactis),侧孢芽孢杆菌(Bacillus laterosporus)(也称之侧孢短芽孢杆菌(Brevibacillus laterosporus)),月桂芽孢杆菌(Bacillus lautus),慢杆菌芽孢杆菌(Bacillus lentimorbus),迟缓芽孢杆菌(Bacillus lentus),地衣芽孢杆菌(Bacillus licheniformis),摩洛哥芽孢杆菌(Bacillus maroccanus),巨大芽孢杆菌(Bacillus megaterium),美添芽孢杆菌(Bacillusmetiens),蕈状芽孢杆菌(Bacillus mycoides),纳豆芽孢杆菌(Bacillus natto),杀线虫芽孢杆菌(Bacillus nematocida),黑生芽孢杆菌(Bacillus nigrificans),龙葵芽孢杆菌(Bacillus nigrum),泛酸芽孢杆菌(Bacillus pantothenticus),金龟子芽孢杆菌(Bacillus popillae),冷解糖芽孢杆菌(Bacillus psychrosaccharolyticus),短小芽胞杆菌(Bacillus pumilus),暹罗芽孢杆菌(Bacillus siamensis),史密斯芽孢杆菌(Bacillus smithii),球形芽孢杆菌(Bacillus sphaericus),枯草芽孢杆菌(Bacillussubtilis),苏云金芽孢杆菌(Bacillus thuringiensis),单鞭毛芽孢杆菌(Bacillusuniflagellatus),日本短根缓生根瘤菌(Bradyrhizobium japonicum),短短芽孢杆菌(Brevibacillus brevis),侧孢短芽孢杆菌((原侧孢短芽孢杆菌(Brevibacilluslaterosporus)侧孢芽胞杆菌(Bacillus laterosporus)),沙不丝色素细菌(Chromobacterium subtsugae),代尔夫特食酸菌(Delftia acidovorans),嗜酸乳杆菌(Lactobacillus acidophilus),抗生素溶菌杆菌(Lysobacter antibioticus),酶基因溶杆菌(Lysobacter enzymogenes),蜂房芽孢杆菌(Paenibacillus alvei),多粘类芽孢杆菌(Paenibacillus polymyxa),流行类芽孢杆菌(Paenibacillus popilliae(原流行芽孢杆菌),成团泛生菌(Pantoea agglomerans),穿刺巴斯德氏芽菌(Pasteuria penetrans)(原穿刺芽孢杆菌),尤氏巴斯德氏芽菌(Pasteuria usgae),胡萝卜杆菌假单胞菌(Pectobacterium carotovorum(之前称之为胡萝卜欧文氏杆菌(Erwinia carotovora)),铜绿假单胞菌(Pseudomonas aeruginosa),金黄色假单胞菌(Pseudomonasaureofaciens),洋葱假单胞菌(Pseudomonas cepacia(之前称之为洋葱伯克霍尔德菌(Burkholderia cepacia)),绿脓假单胞菌(Pseudomonas chlororaphis),荧光假单胞菌(Pseudomonas fluorescens),矛盾假单胞菌(Pseudomonas proradix),恶臭假单胞菌(Pseudomonas putida),丁香假单胞菌(Pseudomonas syringae),嗜虫沙雷氏菌(Serratiaentomophila),粘质沙雷氏菌(Serratia marcescens),哥伦比亚链霉菌(Streptomycescolombiensis),鲜黄链霉菌(Streptomyces galbus),戈氏链霉菌(Streptomycesgoshikiensis),灰链霉菌(Streptomyces griseoviridis),淡紫色链霉菌(Streptomyceslavendulae),绿链霉菌(Streptomyces prasinus),沙瑞特链霉菌(Streptomycessaraceticus),委内瑞斯链霉菌(Streptomyces venezuelae),野油菜黄单胞菌(Xanthomonas campestris),发光异短杆菌(Xenorhabdus luminescens),嗜线虫致病杆菌(Xenorhabdus nematophila),球状红球菌(Rhodococcus globerulus)AQ719(NRRL登录号B-21663)芽孢杆菌种(Bacillus sp.)AQ175(ATCC登录号55608),芽孢杆菌种AQ 177(ATCC登录号55609),芽孢杆菌种AQ178(ATCC登录号53522)和链霉菌种(Streptomyces sp.)菌株NRRL登录号B-30145。在某些情况中,细菌可以是圆褐固氮菌(Azotobacterchroococcum)),巴克甲烷八叠球菌(Methanosarcina barkeri),肺炎克雷伯氏菌(Klesiella pneumoniae),棕色固氮菌(Azotobacter vinelandii),球形红细菌(Rhodobacter spharoides),荚膜红细菌(Rhodobacter capsulatus),沼泽红细菌(Rhodobcter palustris),深红红螺菌(Rhodosporillum rubrum),豌豆根瘤菌(Rhizobiumleguminosarum)或菜豆根瘤菌(Rhizobium etli)。
在一些情况中,细菌可以是梭菌(Clostridium)的物种,例如,巴氏梭菌(Clostridium pasteurianum),拜氏梭菌(Clostridium beijerinckii),产气荚膜梭菌(Clostridium perfringens),破伤风梭菌(Clostridium tetani),或丙酮丁醇梭菌(Clostridium acetobutylicum)。
在一些情况中,与本公开的方法和组合物一起使用的细菌可以是蓝细菌(cyanobacteria)。蓝细菌属的实例包括:鱼腥藻(Anabaena)(例如,鱼腥藻种(Anagaenasp.)PCC7120),念珠藻(Nostoc)(例如,点形念珠藻(Nostoc punctiforme))或集胞藻(Synechocystis)(例如集胞藻种(Synechocystis sp.)PCC6803)。
在一些情况中,与本公开的方法和组合物一起使用的细菌可以属于叶绿藻门(phylum Chlorobi),例如,绿硫细菌(Chlorobiumtepidum)。
在一些情况中,与本公开的方法和组合物一起使用的微生物可以包含与已知NifH基因同源的基因。已知NifH基因的序列可以在例如,Zehr实验室NifH数据库(https://wwwzehr.pmc.ucsc.edu/nifH_Database_Public/,2014年4月4日),或Buckley实验室NifH数据库(http://www.css.cornell.edu/faculty/buckley/nifh.htm,和Gaby,JohnChristian,和Daniel H.Buckley."综合比对的nifH基因数据库:用于固氮细菌研究的多功能工具(A comprehensive aligned nifH gene database:a multipurpose tool forstudies of nitrogen-fixing bacteria.)"Database 2014(2014):bau001.)。在一些情况中,与本公开的方法和组合物一起使用的微生物可包含这样的序列,所述序列编码与来自Zehr实验室NifH数据库(https://wwwzehr.pmc.ucsc.edu/nifH_Database_Public/,2014年4月4日)的序列具有至少60%、70%、80%、85%、90%、95%、96%、96%、98%、99%或超过99%序列相同性的多肽。在一些情况中,与本公开的方法和组合物一起使用的微生物可包含这样的序列,所述序列编码与来自Buckley实验室NifH数据库(http://www.css.cornell.edu/faculty/buckley/nifh.htm,和Gaby,John Christian,和DanielH.Buckley."综合比对的nifH基因数据库:用于固氮细菌研究的多功能工具"Database2014(2014):bau001.)的序列具有至少60%、70%、80%、85%、90%、95%、96%、96%、98%、99%或超过99%序列相同性的多肽。
可用于本文公开方法和组合物中的微生物可以这样获得,通过从天然植物的表面或组织中提取微生物;研磨种子以分离微生物;在各种土壤样品中种植种子并从组织中回收微生物;或用外源性微生物接种植物并确定哪些微生物出现在植物组织中。植物组织的非限制性实例包括种子、幼苗、叶、切块、植物、鳞茎或块茎。在一些情况中,细菌分离自种子。可以改变用于处理样品的参数以分离不同类型的关联微生物,例如根际微生物,附生或内生菌。细菌也可以从库诸如环境菌株收集物获得,而不是最初从第一植物中分离。可以对微生物进行基因分型和表型分型,经由对分离的微生物的基因组进行测序,对植物中群落的组成进行概况;表征群落或分离的微生物的转录组学功能;或使用选择性或表型培养基(例如,固氮或磷酸盐溶解表型)筛选微生物特征。选定的候选菌株或种群可以这样获得,经由序列数据;表型数据;植物数据(例如,基因组,表型和/或产量数据);土壤数据(例如,pH,N/P/K含量和/或大量土壤生物群落);或这些的任何组合。
本文所述细菌和产生细菌的方法可以应用于能够在叶片表面、根表面或植物组织内部有效地自我繁殖而不会引起有害的植物防御反应的细菌,或对植物防御反应具有抗性的细菌。可以通过在不添加氮的培养基中培养植物组织提取物或叶表面洗涤液来分离本文所述的细菌。然而,细菌可能是不可培养的,也就是说,未知是可培养的或者难以使用本领域已知的标准方法来培养。本文所述的细菌可以是内生菌或附生菌或栖息在植物根际中的细菌(根际细菌)。在重复引入遗传变异,暴露于多个植物并从具有改善的性状的植物中分离细菌的步骤一次或多次(例如1、2、3、4、5、10、15、25,或更多次)后获得的细菌可能是内生的,附生的或根际的。内生菌是这样的生物体,其进入植物内部而不会引起疾病症状或引起共生结构形成,并具有农艺学意义,因为它们可以增强植物生长并改善植物的营养(例如,通过氮固定)。细菌可以是种传内生菌。种传内生菌包括与草或植物的种子相关联或衍生自其的细菌,如在成熟、干燥、未受损(例如,无裂缝,可见的真菌感染或过早发芽)的种子中发现的种传细菌内生菌。种传细菌内生菌可以与种子的表面相关联或衍生自种子的表面;替代地或另外地,其可以与(例如,表面消毒的种子的)内部种子隔室相关联或衍生自内部种子隔室。在一些情况中,种传细菌内生菌能够在植物组织内例如种子的内部复制。同样,在一些情况中,种传细菌内生菌能够在干燥存活。
根据本公开的方法分离的或用于本公开的方法或组合物中的细菌可以包含多种不同细菌分类单元的组合。例如,细菌可以包括变形菌门(如假单胞菌(Pseudomonas),肠杆菌(Enterobacter),寡养单胞菌(Stenotrophomonas),伯克霍尔德菌(Burkholderia),根瘤菌(Rhizobium),草螺菌(Herbaspirillum),泛菌属(Pantoea),沙雷氏菌(Serratia),拉恩氏菌(Rahnella),固氮螺菌(Azospirillum),根瘤菌(Azorhizobium),固氮菌(Azotobacter),杜擀氏菌(Duganella),代尔夫特菌(Delftia),慢生根瘤菌(Bradyrhizobiun),中华根瘤菌(Sinorhizobium)和盐单胞菌(Halomonas),厚壁菌门(Firmicutes)(诸如芽孢杆菌(Bacillus)),类芽孢杆菌(Paenibacillus),乳酸菌(Lactobacillus),支原菌(Mycoplasma),和醋杆菌(Acetabacterium)和放线菌(Actinobacteria)(诸如链霉菌(Streptomyces)),红球菌(Rhodacoccus),微细菌(Microbacterium),和短小杆菌(Curtobacterium)。在本公开的方法和组合物中使用的细菌可以包括两种或更多种物种的固氮细菌菌群。在一些情况中,细菌菌群的一种或多种细菌物种能够固定氮。在一些情况中,一种或多种细菌菌群可以促进或增强其他细菌固氮的能力。固定氮的细菌和增强其他细菌固定氮能力的细菌可以相同或不同。在一些实例中,当与不同的细菌菌株结合时或在某些细菌菌群中,细菌菌株可能能够固定氮,但是在单培养中可能不能固定氮。可以在固氮细菌菌群中发现的细菌属的实例,包括但不限于,草螺菌(Herbaspirillum),固氮螺菌(Azospirillum),肠杆菌(Enterobacter)和芽孢杆菌(Bacillus)。
可以通过本文所公开的方法产生的细菌包括,固氮菌种(Azotobacter sp.),缓生根瘤菌种(Bradyrhizobium sp.),克雷伯氏菌种(Klebsiella sp.)和中华根瘤菌种(Sinorhizobium sp.)。在一些情况中,细菌可以选自:棕色固氮菌(Azotobactervinelandi),日本短根缓生根瘤菌(Bradyrhizobium japonicum),肺炎链球克雷伯氏菌(Klebsiella pneumoniae)和美利特中华根瘤菌(Sinorhizobium meliloti)。在一些情况中,细菌可以是肠杆菌属(genus Enterobacter)或拉恩氏菌属(genus Rahnella)。在某些情况下,细菌可以是弗兰克氏菌属(genus Frankia)或梭菌属(genus Clostridium)。梭菌属的细菌的实例包括但不限于:艾氏梭菌(Clostridium acetobutilicum),巴氏梭菌(Clostridium pasteurianum),拜氏梭菌(Clostridium beijerinckii),产气荚膜梭菌(Clostridium perfringens)和破伤风梭菌(Clostridium tetani)。在一些情况中,细菌可以是类芽孢杆菌属(genus Paenibacillus),例如,偶氮固定芽孢杆菌(Paenibacillusazotofixans),北方孔氏芽孢杆菌(Paenibacillus borealis),硬质芽孢杆菌(Paenibacillus durus),硬皮芽孢杆菌(Paenibacillus macerans),多粘芽孢杆菌(Paenibacillus polymyxa),肺炎芽孢杆菌(Paenibacillus alvei),解淀粉芽孢杆菌(Paenibacillus amylolyticus),坎皮纳斯类芽孢杆菌(Paenibacillus campinasensis),弯曲杆菌芽孢杆菌(Paenibacillus chibensis),谷氏芽孢杆菌(Paenibacillusglucanolyticus),伊力诺丝芽孢杆菌(Paenibacillus illinoisensis),幼虫芽孢杆菌幼虫亚种(Paenibacillus larvae subsp.Larvae),幼虫芽孢杆菌尘埃亚种(Paenibacilluslarvae subsp.Pulvifaciens),劳氏芽孢杆菌(Paenibacillus lautus),浸麻类芽孢杆菌(Paenibacillus macerans),马阔里类芽孢杆菌(Paenibacillus macquariensis),马阔里类芽孢杆菌(Paenibacillus macquariensis),饲料类芽孢杆菌(Paenibacillus pabuli),派瑞艾芽孢杆菌(Paenibacillus peoriae),或多粘类芽孢杆菌(Paenibacilluspolymyxa)。
在一些实例中,根据本文公开的方法分离的细菌可以是下述分类单位中的一个或多个的成员:无色菌(Achromobacter),硫杆菌(Acidithiobacillus),食酸菌(Acidovorax),酸性菌(Acidovoraz),不动杆菌(Acinetobacter),游动放线菌(Actinoplanes),艾德西寨菌(Adlercreutzia),气球菌(Aerococcus),气单胞菌(Aeromonas),阿菲波菌(Afipia),壤霉菌(Agromyces),艾西巴特杆菌(Ancylobacter),节杆菌(Arthrobacter),艾特丝特菌(Atopostipes),固氮螺菌(Azospirillum),芽孢杆菌(Bacillus),蛭弧菌(Bdellovibrio),拜叶林克氏菌(Beijerinckia),波氏菌(Bosea),慢生根瘤菌(Bradyrhizobium),短芽胞杆菌(Brevibacillus),短波单胞(Brevundimonas),伯克霍尔德菌(Burkholderia),暂定种光瑞迪菌(Candidatus Haloredivivus),柄杆菌(Caulobacter),纤维菌(Cellulomonas),纤维弧菌(Cellvibrio),金黄杆菌(Chryseobacterium),柠檬酸杆菌(Citrobacter),梭菌(Clostridium),科拉玛格丽塔菌(Coraliomargarita),棒状杆菌(Corynebacterium),卡普迪菌(Cupriavidus),短小杆菌(Curtobacterium),克韦菌(Curvibacter),异常球菌(Deinococcus),代尔夫特菌(Delftia),德库菌(Desemzia),戴沃斯菌(Devosia),独岛菌(Dokdonella),戴氏菌(Dyella),水栖菌(Enhydrobacter),肠杆菌(Enterobacter),肠球菌(Enterococcus),欧文氏菌(Erwinia),埃希氏杆菌(Escherichia),埃希氏杆菌/志贺氏杆菌(Escherichia/Shigella),微小杆菌属(Exiguobacterium),铁球菌(Ferroglobus),菲立莫那斯菌(Filimonas),奋戈迪亚菌(Finegoldia),菲韦索菌(Flavisolibacter),黄杆菌(Flavobacterium),菲戈瑞菌(Frigoribacterium),葡糖醋杆菌(Gluconacetobacter),哈夫尼菌(Hafnia),盐棒杆菌(Halobaculum),盐单胞菌(Halomonas),盐简菌(Halosimplex),草螺菌(Herbaspirillum),薄层菌(Hymenobacter),克雷伯氏菌(Klebsiella),考克氏菌(Kocuria),考萨特尼菌(Kosakonia),乳酸杆菌(Lactobacillus),勒克氏菌(Leclercia),伦茨氏菌(Lentzea),卢特氏菌(Luteibacter),藤黄色单胞菌(Luteimonas),马赛菌(Massilia),生根瘤菌(Mesorhizobium),甲基杆菌(Methylobacterium),细杆菌(Microbacterium),微球菌(Micrococcus),微威娜菌(Microvirga),分支杆菌(Mycobacterium),奈瑟氏菌(Neisseria),诺卡氏菌(Nocardia),大洋杆菌(Oceanibaculum),苍白杆菌(Ochrobactrum),直杆菌(Okibacterium),寡营养菌(Oligotropha),奥兹胡姆菌(Oryzihumus),嗜草酸菌(Oxalophagus),类芽孢杆菌(Paenibacillus),潘诺阿菌(Panteoa),潘托亚菌(Pantoea),佩洛莫纳斯菌(Pelomonas),透明球菌(Perlucidibaca),植物杆菌(Plantibacter),多核杆菌(Polynucleobacter),丙酸杆菌(Propionibacterium),丙酸熔岩菌(Propioniciclava),假棒形杆菌(Pseudoclavibacter),假单胞菌(Pseudomonas),假诺卡氏菌(Pseudonocardia),假黄色单胞菌(Pseudoxanthomonas),嗜冷杆菌(Psychrobacter),拉恩氏菌(Rahnella),罗尔斯通菌(Ralstonia),莱茵海默拉菌(Rheinheimera),根瘤菌(Rhizobium),红球菌(Rhodococcus),红假单胞菌(Rhodopseudomonas),玫瑰菌(Roseateles),瘤胃球菌(Ruminococcus),塞巴尔德拉菌(Sebaldella),沉积物芽盹杆菌(Sediminibacillus),沉积菌(Sediminibacterium),沙雷氏菌(Serratia),志贺氏杆菌(Shigella),氏尼拉菌(Shinella),中华根瘤菌(Sinorhizobium),中国孢子囊菌(Sinosporangium),鞘氨醇杆菌(Sphingobacterium),鞘氨醇单胞菌(Sphingomonas),鞘氨醇菌(Sphingopyxis),鞘氨醇单胞菌(Sphingosinicella),葡萄球菌(Staphylococcus),寡养单胞菌(Stenotrophomonas),嗜单胞菌(Strenotrophomonas),链球菌(Streptococcus),链霉菌(Streptomyces),憎叶菌(Stygiolobus),硫化叶菌(Sulfurisphaera),塔特姆菌(Tatumella),特派迪氏菌(Tepidimonas),热单胞菌(Thermomonas),产硫酸杆菌(Thiobacillus),贪噬菌(Variovorax),WPS-2属未定地位(incertae sedis),黄单胞菌(Xanthomonas)和齐默尔内拉菌(Zimmermannella)。
细菌可以获自任何一般陆地环境,包括其土壤,植物,真菌,动物(包括无脊椎动物)和其他生物区系,包括沉积物,水和湖泊和河流的生物区系;来自海洋环境,其生物区系和沉积物(例如海水,海洋泥浆,海洋植物,海洋无脊椎动物(例如,海绵),海洋脊椎动物(例如,鱼));陆地和海洋地圈(碎石和岩石,例如,破碎的地下岩石,沙子和粘土);冰冻圈及其融水;大气(例如,过滤后的空中灰尘,云雾和雨滴);城市,工业和其他人造环境(例如,混凝土,路边排水沟,屋顶表面和道路表面上积累的有机和矿物质)。
获得细菌的植物可以是具有一个或多个期望性状的植物,例如,在特定环境或感兴趣的某些条件下自然生长的植物。例如,某种植物可以自然生长于高盐度的沙质土壤或沙子中,或在极端温度下,或使用很少的水,或者可以抵抗环境中存在的某些害虫或疾病,并且这对于要在这样的条件下生长的商品作物来说,特别是如果例如这些是在特定理位置上仅有的条件时可能是理想的。例如,细菌可以收集自在这类环境中生长的商业作物,或更具体地,收集自在任何下述特定环境中生长的作物中最能表现出感兴趣的性状的个体作物:例如,在盐分有限的土壤中生长的作物中生长最快的植物,或暴露于严重昆虫破坏或疾病流行的作物中受损最小的植物,或具有所需量的某些代谢物和其他化合物(包括纤维含量,油含量等)的植物,或表现出所需颜色、味道或气味的植物。细菌可以收集自感兴趣的植物或在感兴趣的环境中出现的任何材料,包括真菌和其他动植物生物区系,土壤,水,沉积物和之前所述环境的其他元素。
细菌可以分离自植物组织。这种分离可以发生自植物中的任何适当的组织,包括例如根,茎和叶以及植物生殖组织。例如,用于由植物分离的常规方法通常包括对感兴趣的植物材料(例如,根或茎长度,叶片)进行无菌切除,用适当溶液(例如,2%次氯酸钠)进行表面灭菌,然后再将植物材料置于营养培养基上以进行微生物生长。或者,可以在无菌液体(通常是水)中压碎经表面灭菌的植物材料,然后将液体悬浮液(包括压碎的植物材料的小片)涂布在合适的一个或多个固体琼脂培养基的表面上,所述培养基可以具有或不具有选择性(例如,仅包含植酸作为磷的来源)。该方法特别适用于形成分离菌落的细菌并可以单独提取以分离营养培养基的板,并通过众所周知的方法进一步纯化为单个物种。或者,可以不对植物根部或枝叶样品进行表面灭菌,而仅对其进行轻微地洗涤,从而在分离过程中包括表面驻留的附生微生物,或者可以通过印迹和剥离留在琼脂培养基表面的植物根部,茎或条的方式分别分离附生微生物,然后如上所述分离单个菌落。该方法对于细菌特别有用。或,可以在不洗掉附着于根部的少量土壤的情况下处理根部,从而包括定殖在植物根际中的微生物。否则,附着于根部的土壤可以被去除,稀释并散布于合适的选择性和非选择性培养基的琼脂上,以分离根际细菌的单个菌落。
水生拉恩氏菌(Rahnella aquatilis)和蔗糖肠杆菌(Enterobacter sacchari)的生物纯培养物于2015年7月14日存放在美国典型培养物保藏中心(ATCC;国际保藏机构,马纳萨斯,弗吉尼亚州,美国),并分别指定了ATTC专利保藏指定号PTA-122293和PTA-122294。这些保藏根据《国际承认用于专利程序的微生物保存布达佩斯条约》(《布达佩斯条约》)的规定进行。
组合物
包含根据本文所述方法生产的细菌或细菌群体和/或具有本文所述特征的组合物可以是液体、泡沫或干燥产品的形式。在一些实例中,包含细菌群体的组合物可以是干粉,粉和水的浆液或可流动种子处理的形式。
组合物可以在生物反应器如连续搅拌釜反应器、间歇反应器和农场中制备。在一些实例中,组合物可以存储在容器中,诸如水罐的或以小体积存储。在一些实例中,组合物可以存储在选自下组的对象内:瓶,广口瓶,安瓿,包裹,容器,袋,盒,箱,容器,信封,纸箱,容器,筒仓,运输容器,卡车床和/机箱。
组合物也可用于改善植物性状。在一些实例中,可以将一种或多种组合物被覆到种子上。在一些实例中,可以将一种或多种组合物被覆到幼苗上。在一些实例中,可以将一种或多种组合物被覆到种子表面。在一些实例中,可以将一种或多种组合物作为层被覆到种子表面上。在一些实例中,被覆在种子上的组合物可以是液体形式,干燥产品形式,泡沫形式,粉末和水的浆液形式或可流动的种子处理形式。在一些实例中,可以通过喷洒,浸没,被覆,包封和/或撒粉种子和/或幼苗以及一种或多种组合物将一种或多种组合物施用于种子和/或幼苗。在一些实例中,可以将多种细菌或细菌群体被覆到植物的种子和/或幼苗上。在一些实例中,细菌组合的至少两个,至少三个,至少四个,至少五个,至少六个,至少七个,至少八个,至少九个,至少十个或十个以上的细菌可以选自以下属之一:食酸菌(Acidovorax),土壤杆菌(Agrobacterium),芽孢杆菌(Bacillus),伯克霍尔德菌(Burkholderia),金黄杆菌(Chryseobacterium),短小杆菌(Curtobacterium),肠杆菌(Enterobacter),埃希氏杆菌(Escherichia),甲基杆菌(Methylobacterium),类芽孢杆菌(Paenibacillus),泛生菌(Pantoea),假单胞菌(Pseudomonas),罗尔斯通菌(Ralstonia),糖芽胞杆菌(Saccharibacillus),鞘氨醇单胞菌(Sphingomonas)和寡养单胞菌(Stenotrophomonas)。
在一些实例中,内生组合的至少两个,至少三个,至少四个,至少五个,至少六个,至少七个,至少八个,至少九个,至少十个或十个以上的细菌和细菌群体可以选自以下科之一:芽胞杆菌(Bacillaceae),伯克氏菌(Burkholderiaceae),丛毛单胞菌(Comamonadaceae),(肠杆菌Enterobacteriaceae),黄杆菌(Flavobacteriaceae),甲基杆菌(Methylobacteriaceae),微杆菌(Microbacteriaceae),类芽孢杆菌(Paenibacillileae),假桑菌(Pseudomonnaceae),根瘤菌(Rhizobiaceae),鞘脂单胞菌(Sphingomonadaceae),黄单胞菌(Xanthomonadaceae),枝孢霉(Cladosporiaceae),日规壳菌(Gnomoniaceae),未定地位(Incertae sedis),毛球壳(Lasiosphaeriaceae),耐却西菌(Netriaceae)和孢腔菌(Pleosporaceae)。
在一些实例中,内生组合的至少两个,至少三个,至少四个,至少五个,至少六个,至少七个,至少八个,至少九个,至少十个或十个以上的细菌和细菌群体可以选自以下科之一:芽胞杆菌(Bacillaceae),伯克氏菌(Burkholderiaceae),丛毛单胞菌(Comamonadaceae),(肠杆菌Enterobacteriaceae),黄杆菌(Flavobacteriaceae),甲基杆菌(Methylobacteriaceae),微杆菌(Microbacteriaceae),类芽孢杆菌(Paenibacillileae),假桑菌(Pseudomonnaceae),根瘤菌(Rhizobiaceae),鞘脂单胞菌(Sphingomonadaceae),黄单胞菌(Xanthomonadaceae),枝孢霉(Cladosporiaceae),日规壳菌(Gnomoniaceae),未定地位(Incertae sedis),毛球壳(Lasiosphaeriaceae),耐却西菌(Netriaceae)和孢腔菌(Pleosporaceae)。
组合物的实例可以包括用于商业上重要的农作物,例如高粱,油菜籽,番茄,草莓,大麦,水稻,玉米和小麦的种子包衣。组合物的实例还可包括用于玉米,大豆,油菜籽,高粱,马铃薯,水稻,蔬菜,谷物和油料种子的种子包衣。本文提供的种子可以是转基因生物(GMO),非GMO,有机的或常规的。在一些实例中,可将组合物喷洒到植物的地上部分,或通过插入种植植物种子的犁沟中,浇水至土壤或将根浸入组合物的悬浮液中而施用于根。在一些实例中,可以合适的方式使组合物脱水,以维持细胞活力以及人工接种和定殖宿主植物的能力。细菌物种可以以10
可以将包含本文所述的细菌群体的组合物被覆到种子的表面上。因此,也考虑了这样的组合物,其包含用本文所述的一个或多个细菌被覆的种子。种子被覆可以通过将细菌群体与多孔的化学惰性颗粒状运载体混合而形成。或者,可将组合物直接插入种植种子的犁沟中,或喷洒到植物叶子上,或将根部浸入组合物的悬浮液中进行施用。有效量的组合物可用于植入活细菌生长的植物根附近的亚土壤区域,或植入活细菌生长的额植物的叶。通常,有效量是足以产生具有改善的性状(例如,所需水平的氮固定)的植物的量。
可以使用农业上可接受的运载体来配制本文所述的细菌组合物。能够用于这些实施方式的制剂可以包括选自下组的至少一种:增粘剂,微生物稳定剂,杀真菌剂,抗菌剂,防腐剂,稳定剂,表面活性剂,抗复合剂,除草剂,杀线虫剂,杀虫剂,植物生长调节剂,肥料,灭鼠剂,干燥剂,杀菌剂,营养物或其任意组合。在一些实例中,组合物可以是贮存稳定的。例如,本文所述的任何组合物可以包括农业上可接受的运载体(例如,以下的一种或多种:肥料,如非天然存在的肥料,粘附剂,如非天然存在的粘合剂,和杀虫剂,如非天然存在的杀虫剂)。非天然存在的粘合剂可以是,例如,聚合物,共聚物或合成蜡。例如,本文所述的任何被覆的种子,幼苗或植物可以在种子包衣中包含这类农业上可接受的运载体。在本文所述的任何组合物或方法中,农业上可接受的运载体可以是或可以包括非天然存在的化合物(例如,非天然存在的肥料,非天然存在的粘附剂,如聚合物,共聚物或合成蜡或非天然存在的杀虫剂)。以下描述了农业上可接受的运载体的非限制性实例。
在一些情况中,细菌与农业上可接受的运载体混合。运载体可以是固体运载体或液体运载体,并且可以是各种形式,包括微球,粉末,乳液等。运载体可以是赋予多种性质,如增加稳定性、润湿性或分散性的各种运载体中的任何一种或多种。组合物中可以包括润湿剂,如天然或合成的表面活性剂,其可以是非离子或离子表面活性剂,或其组合。油包水乳液也可用于配制包含分离细菌的组合物(参见,例如,美国专利号7,485,451)。可以制备的合适的制剂包括可湿性粉剂,颗粒剂,凝胶剂,琼脂条或丸剂,增稠剂等,微囊化的颗粒等,液体,如水性流动剂,水性悬浮液,油包水乳液等。该制剂可以包括谷物或豆类产品,例如,磨碎的谷物或豆类,衍生自谷物或豆类的肉汤或粉状物质,淀粉,糖或油。
在一些实施方式中,农业运载体可以是土壤或植物生长培养基。可以使用的其他农业运载体包括水,肥料,植物油,保湿剂或其组合。或者,农业运载体可以是固体,如硅藻土,壤土,二氧化硅,海藻酸,粘土,膨润土,蛭石,种子箱,其他动植物产品或组合,包括颗粒,沉淀或悬浮液。还考虑了将任意前述成分的混合物作为运载体,例如但不限于,壤土,沙子或粘土中的酱状物质(粉状物质和高岭土),琼脂或基于粉状物质的沉淀。制剂可以包括,细菌的食物来源,如大麦,水稻,或其他生物材料,如种子,植物部分,甘蔗渣,谷物加工产生的壳或茎,来自建筑场地垃圾中的地面植物材料或木材,来自回收纸中,织物或木头的锯末或细纤维。
例如,肥料可用于帮助促进种子、幼苗或植物的生长或提供营养。肥料的非限制性实例包括氮,磷,钾,钙,硫,镁,硼,氯化物,锰,铁,锌,铜,钼和硒(或其盐)。肥料的其他实例包括一种或多种氨基酸,盐,碳水化合物,维生素,葡萄糖,NaCl,酵母提取物,NH
在一些实施方式中,粘合剂可以是,例如,蜡,如巴西棕榈蜡,蜂蜡,中国蜡,虫胶蜡,鲸蜡,小烛树蜡,蓖麻蜡,草皮蜡和小冠巴西棕蜡,和米糠蜡,多糖(例如,淀粉,糊精,麦芽糖糊精,海藻酸和壳聚糖),脂肪,油,蛋白质(例如,明胶和玉米蛋白),阿拉伯树胶和虫胶。粘合剂可以是非天然存在的化合物,例如,聚合物,共聚物和蜡。例如,可用作粘合剂的聚合物的非限制性实例包括:聚乙酸乙烯酯,聚乙酸乙烯酯共聚物,乙烯乙酸乙烯酯(EVA)共聚物,聚乙烯醇,聚乙烯醇共聚物,纤维素(例如,乙基纤维素,甲基纤维素,羟甲基纤维素,羟丙基纤维素和羧甲基纤维素),聚乙烯吡咯烷酮,氯乙烯,偏二氯乙烯共聚物,木质素磺酸钙,丙烯酸共聚物,聚乙烯丙烯酸酯,聚环氧乙烷,酰胺聚合物和共聚物,聚丙烯酸羟乙酯,甲基丙烯酰胺单体和聚氯丁二烯。
在一些实例中,一种或多种粘附剂,抗真菌剂,生长调节剂和杀虫剂(例如,杀虫剂)是非天然存在的化合物(例如,以任何组合)。农业上可接受的运载体的其他实例包括分散剂(例如,聚乙烯吡咯烷酮/乙酸乙烯酯PVPIVA S-630),表面活性剂,粘合剂和填充剂。
该制剂还可以包含表面活性剂。表面活性剂的非限制性实例包括:氮表面活性剂混合物,诸如Prefer 28(Cenex),Surf-N(US),Inhance(Brandt),P-28(Wilfarm)和Patrol(Helena);酯化的种子油,包括Sun-It II(AmCy),MSO(UAP),Scoil(Agsco),Hasten(Wilfarm)和Mes-100(Drexel);和有机硅表面活性剂,包括Silwet L77(UAP),Silikin(Terra),Dyne-Amic(Helena),Kinetic(Helena),Sylgard 309(Wilbur-Ellis)和Century(Precision)。在一个实施方式中,表面活性剂以0.01%v/v-10%v/v的浓度存在。
在一些情况中,制剂包括微生物稳定剂。这类试剂可以包括干燥剂,其可以包括这样的任何化合物或化合物的混合物,其被分类为干燥剂,无论所述一种或多种化合物是否以实际上对液体接种剂具有干燥作用的浓度使用。这类干燥剂与所使用的细菌群体理想地相容,并且应当促进微生物群体在施用到种子上后存活并在干燥中存活的能力。合适的干燥剂的实例包括海藻糖,蔗糖,甘油和甲二醇中的一种或多种。其他合适的干燥剂包括但不限于,非还原糖和糖醇(例如,甘露醇或山梨糖醇)。引入制剂中的干燥剂的量可以在约5%至约50%的重量/体积范围内,例如,约10%至约40%之间,在约15%至约35%之间,或在约20%至约30%之间。在一些情况中,制剂中含有试剂,诸如杀真菌剂,抗菌剂,除草剂,杀线虫剂,杀虫剂,植物生长调节剂,灭鼠剂,杀菌剂或营养剂是有利的。在一些实例中,试剂可包括保护剂,其提供保护以抵抗种子表面传播的病原体。在一些实例中,保护剂可以提供对土壤传播的病原体一定程度的控制。在一些实例中,保护剂可以主要在种子表面上有效。
在一些实例中,杀真菌剂可包括可抑制真菌生长或杀死真菌的化学或生物化合物或试剂。在一些实例中,杀真菌剂可包括可以是抑真菌的或杀真菌的化合物。在一些实例中,杀真菌剂可以是保护剂,或主要在种子表面上有效的试剂,提供针对种子表面传播的病原体的保护并提供对土壤传播的病原体的一定程度的控制。保护性杀真菌剂的非限制性实例包括克菌丹(captan),代森锰(maneb),福美双(thiram)或咯菌腈(fludioxonil)。
在一些实例中,杀真菌剂可以是系统性杀真菌剂,其可以被吸收到出苗的幼苗中并抑制或杀伤宿主植物组织内的真菌。用于种子处理的系统性杀真菌剂包括但不限于下述内容:嘧菌酯(azoxystrobin),萎锈灵(carboxin),精甲霜灵(mefenoxam),甲霜灵(metalaxyl),噻苯咪唑(thiabendazole),肟菌酯(trifloxystrobin)和各种三唑杀真菌剂,包括苯醚甲环唑(difenoconazole),种菌唑(ipconazole),戊唑醇(tebuconazole),和灭菌唑(triticonazole)。精甲霜灵和甲霜灵主要用于靶向水霉真菌腐霉(Pythium)和疫霉(Phytophthora)。取决于植物物种,某些杀真菌剂比其他杀真菌剂更优选,这是因为致病真菌物种的敏感性中存在细微差异,或者由于植物的杀菌剂分布或敏感性不同。在一些实例中,杀真菌剂可以是生物控制剂,如细菌或真菌。这类生物体可能是病原性真菌的寄生虫,或者分泌毒素或其他可以杀死或阻止真菌生长的物质。任何类型的杀真菌剂,尤其是通常在植物上使用的杀真菌剂,都可用作种子组合物中的控制剂。
在一些实例中,种子包衣组合物可包含具有抗菌特性的控制剂。在一个实施方式中,具有抗菌性质的控制剂选自本文其他地方所述的化合物。在另一个实施方式中,该化合物是链霉素(Streptomycin),氧四环素(oxytetracycline),噁喹酸(oxolinic acid)或庆大霉素(gentamicin)。可以用作种子包衣组合物部分的抗菌化合物的其他实例包括基于二氯酚和苄醇半缩甲醛(
在一些实施方式中,生长调节剂选自下组:脱落酸,酰氨基氯(amidochlor),嘧啶醇(ancymidol),6-苄氨基嘌呤,芸苔甾内酯(brassinolide),仲丁灵(butralin),矮壮素(chlormequat)(氯化矮壮素(chlormequat chloride)),氯化胆碱(choline chloride),环丙酰草胺(cyclanilide),丁酰肼(daminozide),调呋酸(dikegulac),噻节因(dimethipin),2,6-二甲基吡啶(2,6-dimethylpuridine),乙烯利(ethephon),氟节胺(flumetralin),氟嘧醇(flurprimidol),嗪草酸(fluthiacet),氯吡脲(forchlorfenuron),赤霉酸(gibberellic acid),抗倒胺(inabenfide),吲哚-3-乙酸,顺丁烯二酰肼,氟磺酰草胺(mefluidide),助壮素(mepiquat)(氯化助壮素(mepiquatchloride)),萘乙酸(naphthaleneacetic acid),N-6-苄基腺嘌,多效唑(paclobutrazol),调环酸(prohexadione)三硫代磷酸酯(phosphorotrithioate),(2,3,5-三-碘代苯甲酸,抗倒酯(trinexapac-ethyl)和烯效唑。生长调节剂的其他非限制性实例包括油菜素内酯(brassinosteroids),细胞分裂素(例如,激动素和玉米素),植物生长激素(例如,吲哚乙酸和吲哚乙酰天冬氨酸),类黄酮和异类黄酮(例如,芒柄花黄素(formononetin)和香叶木素(diosmetin)),植物抗毒素(phytoaixins)(例如,大豆抗毒素(glyceolline)),和植物抗毒素诱导的寡糖(例如,果胶,几丁质,壳聚糖,多聚半乳糖醛酸(polygalacuronic acid)和寡半乳糖醛酸,和吉贝勒林素(gibellerin)。这类试剂与在其上施用该制剂的农业种子或幼苗理想地相容(例如,不应对植物的生长或健康有害)。此外,理想地,试剂是不会引起人、动物或工业用途的安全性问题的试剂(例如,没有安全问题,或者化合物非常不稳定以至于源自植物的商品植物产品只含有可忽略量的化合物)。
线虫拮抗生物控制剂的一些实例包括ARF18;30节丛孢种(Arthrobotrys spp.);毛壳种(Chaetomium spp.);柱孢种(Cylindrocarpon spp.);外瓶霉种(Exophilia spp.);镰孢种(Fusarium spp.);帚霉种(Gliocladium spp.);被毛孢种(Hirsutella spp.);轮枝种(Lecanicillium spp.);单顶孢种(Monacrosporium spp.);漆斑菌种(Myrotheciumspp.);新赤壳种(Neocosmospora spp.);拟青霉种(Paecilomyces spp.);普可尼亚种(Pochoniaspp.);壳多胞菌种(Stagonospora spp.);囊状树霉菌根真菌(vesicular-arbuscularmycorrhizal fungi)、伯克氏菌种(Burkholderia spp.);巴斯德氏芽菌种(Pasteuria spp.)、短芽孢杆菌种(Brevibacillus spp.);假单胞菌种;和根际细菌。特别优选的线虫拮抗生物控制剂包括:ARFl8、少孢节丛孢(Arthrobotrys oligospora)、指状节丛孢(Arthrobotrys dactyloides)、球毛壳菌(Chaetomium globosum)、异丝藻柱孢(Cylindrocarpon heteronema)、Exophilia jeanselmei、Exophilia pisciphila、Fusariumaspergilus、腐皮镰孢(Fusarium solani)、链孢粘帚霉(Gliocladiumcatenulatum)、粉红粘帚霉(Gliocladium roseum)、雌狐粘帚霉(Gliocladium vixens)、洛斯里被毛孢(Hirsutellarhossiliensis)、明尼苏达被毛孢(Hirsutella minnesotensis)、蜡蚧轮枝菌(Lecanicillium lecanii)、德氏单顶孢(Monacrosporium drechsleri)、戈氏单顶孢(Monacrosporiumgephyropagum)、Myrotehcium verrucaria、侵管新赤壳菌(Neocosmospora vasinfecta)、淡紫色拟青霉(Paecilomyces lilacinus)、厚垣孢普可尼亚菌(Pochonia chlamydosporia)、异皮壳多孢菌(Stagonospora heteroderae)、菜豆壳多孢菌(Stagonospora phaseoli)、囊状树霉菌根真菌、洋葱伯克霍尔德菌(Burkholderiacepacia)、穿刺巴斯德氏芽菌(Pasteuria penetrans)、索雷巴斯德氏芽菌(Pasteuriathornei)、尼氏巴斯德氏芽菌(Pasteurianishizawae)、分支巴斯德氏菌(Pasteuriaramosa)、尤氏巴斯德氏芽菌(Pastrueia usage)、侧孢短芽孢杆菌G4株、荧光假单胞菌和根际细菌。
营养物的一些实例可选自氮肥,包括但不限于尿素、硝酸铵、硫酸铵、无压力氮溶液、氨水、无水氨、硫代硫酸铵、硫被覆的尿素、尿素-甲醛、IBDU、聚合物被覆的尿素、硝酸钙、脲甲醛(Ureaform)和亚甲基脲,磷肥,如磷酸氢二铵、磷酸二氢铵、多聚磷酸铵、浓缩的磷酸盐和三过磷酸盐,和钾肥,如氯化钾、硫酸钾、硫酸镁钾、硝酸钾。这类组合物可以作为种子包衣组合物中的游离盐或离子存在。或者,营养物/肥料可以复合或螯合以随时间提供持续释放。
灭鼠剂的一些实例可包括选自下组的物质:2-异戊酰基茚-1,3-二酮、4-(喹喔啉-2-基氨基)苯磺酰胺、α-氯代醇、磷化铝、安妥(antu)、氧化砷、碳酸钡、双鼠脲(bisthiosemi)、溴鼠隆(brodifacoum)、溴敌隆(bromadiolone)、溴鼠胺(bromethalin)、氰化钙、氯醛糖、氯敌鼠(chlorophacinone)、胆钙化醇、氯灭鼠灵(coumachlor)、克灭鼠(coumafuryl)、杀鼠迷(coumatetralyl)、鼠立死(crimidine)、鼠得克(difenacoum)、噻鼠灵(difethialone)、敌鼠(diphacinone)、麦角钙化醇(ergocalciferoi)、氟鼠灵(flocoumafen)、氟乙酰胺(fluoroacetamide)、氟鼠啶(flupropadine)、氟鼠啶盐酸盐、氰化氢、碘甲烷、林丹(lindane)、磷化镁、甲基溴、鼠特灵(norbormide)、毒鼠磷(phosacetim)、磷化氢、磷、杀鼠酮(pindone)、亚砷酸钾、灭鼠优(pyrinuron)、海葱糖苷(scilliroside)、亚砷酸钠、氰化钠、氟乙酸钠、士的宁(strychnine)、硫酸铊、华法林和磷化锌。
在液体形式(例如,溶液或悬浮液)中,细菌群体可以在水中或水性溶液中混合或悬浮。合适的液体稀释剂或运载体包括水、水性溶液、石油馏出物或其它液体运载体。
固体组合物可以这样制备,通过将细菌群体分散在适当分开的固体运载体如泥炭、小麦、麸皮、蛭石、粘土、滑石、膨润土、硅藻土、漂白土、巴氏杀菌的土壤等中和其上。当这类制剂用作可湿性粉剂时,可使用生物相容分散剂,诸如非离子型、阴离子型、两性或阳离子型分散剂和乳化剂。
制剂时使用的固体运载体包括,例如,高岭土,叶蜡石,膨润土,蒙脱石,硅藻土,酸性白土,蛭石和珠光体等矿物运载体,和无机盐,诸如硫酸铵、磷酸铵、硝酸铵、尿素、氯化铵和碳酸钙等。另外,可以使用有机细粉,诸如小麦粉、麦麸、米糠等。液体运载体包括植物油(如大豆油和棉籽油),甘油,乙二醇,聚乙二醇,丙二醇,聚丙二醇等。
细菌群体在农作物上的施用
本文所述的细菌或细菌群体的组合物可以施用于犁沟中、滑石中或作为种子处理。该组合物可以施用于大批量,小批,袋中或滑石中的种子包装。
播种机可以根据常规方式,以双排或不需要耕种的方式,种植经处理的种子并使作物生长。可以使用控制料斗或单个料斗分配种子。也可以使用压缩空气或手动分配种子。可以使用可变速率技术进行种子布置。另外,可以使用可变速率技术施用本文所示的细菌或细菌群体。在一些实例中,细菌可以施加至玉米、大豆、油菜、高粱、马铃薯、稻、蔬菜、谷物、假谷物(pseudocereals)和油籽的种子。谷物的实例可包括大麦,非洲小米(fonio),燕麦,帕尔默草(palmer’s grass),草皮草、黑麦,珍珠粟,高粱,斯佩耳特小麦(spelt),埃塞俄比亚画眉草(teff),黑小麦和小麦。假谷物的实例可包括面包果,荞麦,香蒲,芡欧鼠尾草(chia),亚麻,籽粒苋(grain amaranth),邯杂(hanza),藜麦和芝麻。在一些例子中,种子可以是转基因生物(GMO),非GMO,有机的或常规的。
可以另外使用添加剂来处理作物,所述添加剂诸如微肥、PGR、除草剂、杀虫剂和杀真菌剂等。添加剂的实例包括作物保护剂,如杀虫剂,杀线虫剂,杀真菌剂,增强剂,如着色剂,聚合物,造粒剂,引发剂和消毒剂,以及其它试剂,如接种剂,PGR,软化剂和微量营养物。PGR可以是影响根生长、开花或茎伸长的天然或合成的植物激素。PGR可包括生长素,赤霉素,细胞分裂素,乙烯和脱落酸(ABA)。
该组合物可以与液体肥料组合一起施用于犁沟中。在一些实例中,液体肥料可以容纳在罐中。NPK肥料含有钠,磷和钾的巨量营养素。
组合物可以改善植物性状,如促进植物生长,维持叶片中的高叶绿素含量,增加果实或种子数量以及增加果实或种子单位重量。可引入或改善的性状的实例包括:根生物量,根长度,高度,枝条长度,叶数,水分利用效率,总生物量,产量,果实大小,籽粒大小,光合作用率,耐旱性,耐热性,耐盐性,对线虫胁迫的抗性,对真菌病原体的抗性,对细菌病原体的抗性,对病毒病原体的抗性,代谢物的水平和蛋白质组表达。根生物量,根长度,高度,枝条长度,叶数,水分利用效率,总生物量,产量,果实大小,籽粒大小,光合作用率,耐旱性,耐热性,耐盐性,对低氮胁迫的耐受性,氮利用效率,对线虫胁迫的抗性,对真菌病原体的抗性,对细菌病原体的抗性,对病毒病原体的抗性,代谢物的水平,代谢物水平的调节,蛋白质组表达。所需要的性状,包括高度,总生物量,根和/或枝条生物量,种子发芽,幼苗存活,光合效率,蒸腾速率,种子/果实数量或质量,植物籽粒或果实产量,叶绿素含量,光合速率,根长度或其任意组合,可用于测量生长,并与相同条件下生长的参照农业植物(例如,不具有引入的和/或改良的性状的植物)的生长速率进行比较。在一些实例中,所需要的性状,包括高度,总生物量,根和/或枝条生物量,种子发芽,幼苗存活,光合效率,蒸腾速率,种子/果实数量或质量,植物籽粒或果实产量,叶绿素含量,光合速率,根长度或其任意组合,可用于测量生长,并与类似条件下生长的参照农业植物(例如,不具有引入的和/或改良的性状的植物)的生长速率进行比较。
宿主植物的农艺性状可包括但不限于:相较于未使用所述种子处理制剂的种子生长的等同植物,改变的油含量,改变的蛋白质含量,改变的种子碳水化合物组成,改变的种子油组成和改变的种子蛋白质组成,化学耐受性,耐寒性,延迟衰老,抗病性,耐旱性,穗重,生长改善,健康增强,耐热性,除草剂耐受性,食草动物抗性,改善的固氮,提高的氮利用率,改善的根系结构,提高的水分利用效率,增加的生物量,增加的根长度,增加的种子重量,增加的枝条长度,增加的产率,限水条件下增加的产率,籽粒质量,籽粒含水量,金属耐受性,穗数,籽粒数,豆荚数,营养强化,病原菌抗性,抗虫性,光合能力提高,耐盐性,保持绿色,活力提高,成熟种子的干重增加,成熟种子的鲜重增加,各株成熟种子数增加,叶绿素含量增加,各株豆荚数增加,各株豆荚长度增加,各株枯萎叶数减少,各株严重枯萎叶数减少及各株非枯萎叶数增加,可检测的代谢物水平调节,可检测的转录物水平调节及可检测的蛋白质组调节。
在一些情况中,使用细菌或细菌群体来接种植物,所述细菌或细菌群体分离自与接种植物的植物元素相同种的植物。例如,通常在玉米(Zea mays)(谷物)的一个品种中发现的细菌或细菌群体与玉米植物的另一个品种的植物元素相关,所述玉米的另一个品种在其天然状态下缺乏所述细菌和细菌群体。在一个实施方式中,细菌和细菌群体源自与接种植物的植物元素相关的植物物种的植物。例如,将通常在大刍草(Zea diploperennisIltis)等(类玉米(diploperennial teosinte))中发现的细菌和细菌群体施用于玉米(Zeamays),或反之亦然。在一些情况中,使用与接种植物的植物元素异源的细菌和细菌群体接种植物。在一个实施方式中,细菌和细菌群体源自另一个物种的植物。例如,将通常在双子叶植物中发现的细菌和细菌群体施用于单子叶植物(例如,使用大豆来源的细菌和细菌群体接种玉米),或反之亦然。在其它情况中,待接种到植物上的细菌和细菌群体源自正在接种的植物的相关物种。在一个实施方式中,细菌和细菌群体源自相关的分类群,例如,来自相关物种。另一物种的植物可以是农业植物。在另一个实施方式中,细菌和细菌群体是接种到任何宿主植物元素中的设计组合物的部分。
在一些实例中,细菌或细菌群体是外源的,其中细菌和细菌群体分离自与接种植物不同的植物。例如,在一个实施方式中,细菌或细菌群体可以分离自与接种植物相同物种的不同植物。在一些情况中,细菌或细菌群体可以分离自与接种植物相关的物种。
在一些实例中,本文所述的细菌和细菌群体能够从一种组织类型移动到另一组织类型。例如,本发明在种子外部被覆后检测和分离植物成熟组织内的细菌和细菌群体证明了它们从种子外部移动到成熟植物营养组织中的能力。因此,在一个实施方式中,细菌和细菌群体能够从种子外部移动到植物的营养组织中。在一个实施方式中,被覆在植物种子上的细菌和细菌群体在种子萌发成营养状态后能够定位于植物的不同组织。例如,细菌和细菌群体可以能够定位于植物中的任何一种组织,包括:根,不定根,种子根,根毛,枝条,叶,花,芽,穗,分生组织,花粉,雌蕊,子房,雄蕊,果实,匍匐茎,根茎,结节,块茎,毛状体,保卫细胞,排水器,花瓣,萼片,颖片,轴,维管形成层,韧皮部和木质部。在一个实施方式中,细菌和细菌群体能够定位于植物的根和/或根毛。在另一个实施方式中,细菌和细菌群体能够定位于光合组织,例如,植物的叶和芽。在其它情况下,细菌和细菌群体定位于植物的维管组织,例如,木质部和韧皮部。在另一个实施方式中,细菌和细菌群体能够定位于植物的生殖组织(花,花粉,雌蕊,子房,雄蕊,果实)。在另一个实施方式中,细菌和细菌群体能够定位于植物的根、芽、叶和生殖组织。在又一个实施方式中,细菌和细菌群体定殖于植物的果实或种子组织。在另一个实施方式中,细菌和细菌群体能够定殖于植物,从而使其存在于植物表面(即,其存在可检测地存在于植物的外部或植物的上半球)。在其它实施方式中,细菌和细菌群体能够定位于植物的所有或基本上所有组织。在某些实施方式中,细菌和细菌群体不定位于植物的根。在其它情况下,细菌和细菌群体不定位于植物的光合组织。
还可以通过测量作物或作物加热单元(CHU)的相对成熟度来评估组合物的有效性。例如,可以将细菌群体施用于玉米,并且可以根据玉米粒的相对成熟度或玉米粒处于最大重量时的时间来评估玉米生长。作物加热单元(CHU)也可用来预测玉米作物的成熟。CHU通过测量作物生长的每日最高温度来确定热量积累的量。
在实例中,细菌可定位于植物中的任何一种组织,包括:根,不定根,种子根,根毛,枝条,叶,花,芽,穗,分生组织,花粉,雌蕊,子房,雄蕊,果实,匍匐茎,根茎,结节,块茎,毛状体,保卫细胞,排水器,花瓣,萼片,颖片,轴,维管形成层,韧皮部和木质部。在另一个实施方式中,细菌或细菌群体能够定位于光合组织,例如,植物的叶和芽。在其它情况下,细菌和细菌群体定位于植物的维管组织,例如,木质部和韧皮部。在另一个实施方式中,细菌和细菌群体能够定位于植物的生殖组织(花,花粉,雌蕊,子房,雄蕊,果实)。在另一个实施方式中,细菌和细菌群体能够定位于植物的根、芽、叶和生殖组织。在另一个实施方式中,细菌或细菌群体定殖于植物的果实或种子组织。在又一个实施方式中,细菌或细菌群体能够定殖于植物,使其存在于植物的表面。在另一个实施方式中,细菌或细菌群体能够定位于植物的基本上所有或所有组织。在某些实施方式中,细菌和细菌群体不定位于植物的根。在其它情况下,细菌和细菌群体不定位于植物的光合组织。
施用于作物的细菌组合物的有效性可以通过测量作物生长的各种特征来评估,包括但不限于种植率,播种活力,根强度,耐旱性,植物高度,干燥和测试重量。
实施例
本文提供的实施例描述了细菌分离、细菌和植物分析和植物性状改善的方法。这些实施例仅作为说明行目的,无论如何不应被解释为对本发明的限制。
实施例1:天然植物排出物的分析
按以下工艺制备天然玉米植物排出物培养基。玉米植株在生长室的花盆中生长三周,然后从花盆中取出。清洗植物根,然后放入装有500-1000毫升无菌水的培养瓶中。植物的茎和叶暴露在空气和光照下,仍保持在液面以上。培养瓶被铝箔覆盖,放回生长室两天。培养瓶中的水性溶液每4-8小时过滤消毒一次。两天后,移出植物,并再次对天然植物排出物培养基进行过滤消毒。然后对两次重复产生的天然玉米植株排出物培养基进行分析,以测定氨基酸浓度。每种氨基酸的浓度如表5和表6以及图3和图4所示。
表5:水中的样品玉米根排出物
表6:水中的样品玉米根排出物
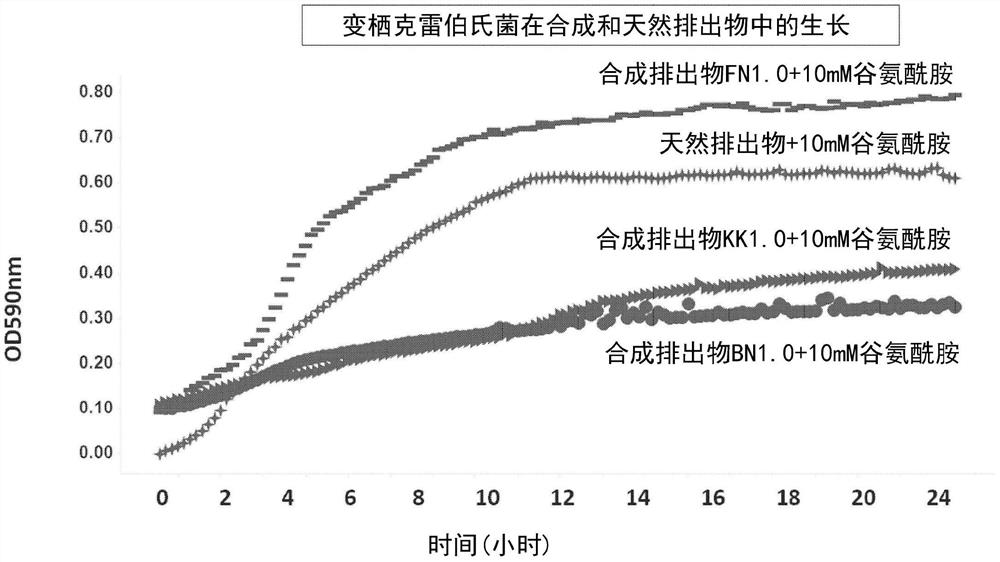
变栖克雷伯氏菌、蔗糖小迫氏菌和水生浅粉不全光合杆菌在人工和天然的排出物培养基中培养。按以下步骤获得天然排出物培养基。玉米植株在生长室的花盆中生长三周,然后从花盆中取出。清洗植物根,然后放入装有500-1000毫升无菌水的培养瓶中。植物的茎和叶暴露在空气和光照下,仍保持在液面以上。培养瓶被铝箔覆盖,放回生长室两天。培养瓶中的水性溶液每4-8小时过滤消毒一次。两天后,移出植物,并再次对天然植物排出物培养基进行过滤消毒。根据表2-4的配方获得合成排出物培养基。天然和合成植物排出物培养基均添加10mM谷氨酰胺。四种培养基中的变栖克雷伯氏菌和蔗糖小迫氏菌的生长曲线分别如图1A和1B所示。三种合成培养基中的水生浅粉不全光合杆菌的生长曲线如图1C所示。变栖克雷伯氏菌在表4的合成排出物培养基中生长最好,在天然植物排出物培养基中显示相似生长。
此外,用变栖克雷伯氏菌菌株137-2084在对照培养基(ARA,表7)、添加5mM磷酸铵的表4合成排出物培养基和添加5mM磷酸铵和额外磷酸盐(25g/L Na
表7:ARA培养基
为了评估在根浆液或排出物中进行的试验结果是否与植物原位试验结果相关,制备了根浆液样品。在浆液中进行确定不同物种及其衍生突变体的生长指标的实验。此外,还进行了定殖试验,以评估这些物种在玉米根际的相对定殖表型。
排出物/浆液制备方法产生两种玉米根浆液:1)温室浆液或在无菌蛭石中生长5周的植物产生的浆液,以及2)生长室泥浆,或在无菌沙中生长5周的植物产生的浆液。在这两种情况下,植物都是在氮肥的存在下生长的。为了捕获植物浆液,玉米植株在温室或生长室的无菌深井播种盆中生长,并使用适当的盆栽培养基:在生长室使用无菌沙或在温室使用无菌蛭石。对于生长室浆液,植物生长在受控环境的生长室中,在每天16小时的LED照明下,保持28℃的白天温度和22℃的夜间温度,50-65%的湿度,从种植后5天开始,每天浇水和每隔一天用含16毫米氮的Hoagland施肥。对于温室浆液,植物维持在标准温室条件下,白天15小时,温度设定值为25℃,夜间22℃,每隔一天浇水一次,第7天之后开始用含有8mM总氮的Hoagland溶液施肥。植物生长到5周,然后从花盆中取出,洗去根部残渣。然后在冠部下方0.5英寸处切割植株,并将茎与根物质分开。将在相同条件下生长的植物的根球混合,称重至约500g。向根中加入等量的水(即约500毫升),然后混合,直到达到均匀的稠度。该浆液在4℃下静置24小时。然后,浆液通过多孔布去除大碎片,然后旋转沉淀,将溶解的代谢物与较小的颗粒分离。旋转后,上清液通过0.2微米的滤膜,对浆液进行消毒。
生长曲线方法将所有菌株接种在超级优化肉汤(SOB)琼脂平板上,获得先前证实的甘油储液的单菌落。将每个菌株的4个菌落接种到含有1ml SOB肉汤的2ml、96孔深孔板中。用0.2μM透气密封件覆盖平板,并在30℃、200RPM下培养20-24小时。第二天,在无菌2ml深孔板中,向新的无菌96孔深孔板的每个孔中添加950ml磷酸盐缓冲盐水。过夜培养后,将50μL SOB平板上的过夜培养物转移至1:20稀释平板中,并在每次转移后混合。为了建立生长曲线,将180μL的分析培养基/培养液添加到无菌0.3ml透明加盖的Greiner分析板的每个孔中。然后,按照与稀释板相同的顺序将20μL 1:20稀释培养物从1:20稀释板转移到Greiner分析板中。然后将分析平板置于Molecular Devicesi3X读板仪中。使用下表8中的设置在i3X上捕获数据。
表8:数据采集的i3X设置
记录了峰值OD,即在实验过程中测得的最高OD。在适用的情况下,使用采用行业标准计算的内部应用程序计算倍增时间。倍增时间也可以手动计算,如下所示:
生长-室定殖实验方法。在无菌沙培养基中,每个菌株至少有12个重复植株。种植时,每株植物接种1毫升指定的细菌菌株的过夜SOB培养物,对应于~1x10
播种后4天,将1ml细菌过夜培养物(约10
图5A和5B显示了蔗糖小迫氏菌6及其衍生物6-2425和6-2634的生长和定殖测量。图5A显示了温室浆液中菌株的至少三次重复峰值OD测量的箱形图。图5B显示了至少10株接种了指定菌株的复制玉米植株每克鲜重根组织的细胞定殖(CFU/g FW)。与野生型6菌株相比,两个衍生菌株6-2425和6-2634的峰值OD和定殖率都有所下降。
图6A和6B显示了变栖克雷伯氏菌137及其衍生物137-1034、137-1968、137-2084和137-2219的生长和定殖测量。图6A显示了温室浆液中菌株的至少三次重复峰值OD测量的箱形图。图6B显示了至少10株接种了指定菌株的复制玉米植株的定殖(CFU/g FW)。与野生型137菌株相比,所有衍生菌株的峰值OD和定殖率都有所下降。
图7A和7B显示了两个变栖克雷伯氏菌137突变株的生长和定殖测量。菌株137-2285是菌株137-2084的突变衍生物。图7A显示了温室浆液中菌株的至少三次重复峰值OD测量的箱形图。图7B显示了至少10株接种了指定菌株的复制植株的定殖(CFU/g FW)。在玉米根浆液OD峰值和玉米根定殖中,137-2285与亲本菌株137-2084相比,适应性降低。
图5A-7B中的结果显示了测量玉米根浆液中的峰值OD如何允许在两种不同的固氮营养细菌中选择具有改变的玉米根定殖表型(例如定殖能力降低)的菌株。
使用实施例1中描述的相同浆液和方法,进一步分析固氮菌株在玉米根浆液中的倍增时间和玉米根的定殖。
图8显示了变栖克雷伯氏菌137及其衍生物137-1034、137-1968、137-2084和137-2219的生长测量,特别是从生长室玉米根浆中菌株的至少三条重复生长曲线得出的倍增时间箱形图。与野生型137菌株相比,所有衍生菌株均表现出倍增时间增加(即生长速率降低)和玉米根定殖减少(图6B)。
图8中的结果显示了测量玉米根浆液中生长速率如何允许在两种不同的固氮营养细菌中选择具有改变的玉米根定殖表型(例如定殖能力降低)的菌株。
使用实施例3中描述的相同浆液和方法,进一步分析固氮菌株在玉米根浆液中的生长和玉米根的定殖。在本实施例中,如实施例3所述,在温室浆液中测量峰值OD。此外,在BioLector微型发酵罐中测量温室浆液中的生长。
BioLector生长分析方法。将所有菌株接种在SOB琼脂平板上,获得先前证实的甘油储液的单菌落。将每个菌株的一个菌落接种到5mL SOB肉汤中,在30℃200RPM下培养20小时。用2%接种液接种温室玉米根浆液,将1ml移入48孔花盘中,在BioLector(Microbioreactor公司)微型发酵罐系统中30℃有氧培养24小时。BioLector设置如下文表9所述。
表9:BioLector设置
图9A-9C显示了变栖克雷伯氏菌137及其两种衍生突变株137-2219和137-2237的生长和定殖测量。图9A显示了温室浆液中菌株的至少六次重复峰值OD测量的均值。图9B显示了BioLector生长实验中温室泥浆的平均峰值收获。在这两种实验形式中,137-2237显示出比137-2219更强的生长。图9C显示了接种了指定菌株的至少10个复制植株的定殖(CFU/gFW)。在本实例中,与137-2219相比,137-2237在玉米根浆液中的生长更强,对应于玉米根中更强的定殖能力。
图10A和10B显示了小肠麦特萨科森氏菌(Metakosakonia intenstini)910及其两种衍生突变株910-3994和910-3963的生长和定殖测量。图10A显示了在生长室玉米根浆液中菌株至少三次重复生长曲线的倍增时间箱形图。图10B显示了至少10株接种了指定菌株的复制植株的定殖(CFU/g FW)。在本实例中,与910-3963相比,910-3994在玉米根浆液中的生长更强,对应于玉米根中更强的定殖能力。
图9A-10B中的结果显示了玉米根浆液中的生长基质如何允许在两种不同的固氮营养细菌中选择具有改变的玉米根定殖表型(例如定殖能力提高)的菌株。
使用实施例3中描述的相同浆液和方法,进一步分析固氮菌株在玉米根浆液中的倍增时间。通过温室试验,研究了用所选菌株接种对玉米植株早期营养生长的影响。
玉米生长分析方法。在标准温室条件下进行玉米生长试验,白昼光照15小时,温度设定值为25℃,夜间22℃。种子种植在1:1与加钙粘土混合的标准盆栽混合物中,用种植工具在每个盆栽中心附近压两个2英寸的孔。然后将一粒种子置于每个准备好的孔中,并用无菌PBS(UTC对照)或等体积的细菌悬浮液使用稀释至设定光密度的细胞接种。对于阳性对照植物,在种植时将1.8g硝仿(Nitroform)控释尿素修正到每盆顶部1-2英寸处。除此之外,这些植株与阴性对照一样用PBS处理,种植时不接种微生物。第一周只给幼苗浇水,然后通过选择最有活力的幼苗并在种植后约7天移去剩余的植株,将幼苗稀释到每盆一株。种植后一周,所有植物开始使用含8mM总氮的改良Hoagland溶液进行施肥。施肥通常每周进行两次,在整个试验期间,根据需要向所有植物提供额外的水。在收获后,通过在土壤表面处切割茎杆并立即称量植物组织的地上部分,立即测量新枝条鲜重。
图11A和11B显示了小肠麦特萨科森氏菌910菌株910-3655和910-3961在根浆液中的生长,以及接种各菌株后玉米植株的生物质。910-3655在生长室和玉米根浆液中表现出更快的倍增时间(即更高的生长速率)(图11A)。在玉米生长试验中,接种910-3655的植株表现出比接种910-3961的植株更高的鲜重(图11B)。这些结果表明,利用玉米根浆液的生长可以筛选出对玉米生长影响较大的菌株。
使用实施例3中所述的相同浆液和方法,分析多个植物在根排出物中生长的差异和玉米根定殖的差异。如实施例3所述进行生长室定殖试验。此外,还进行了多地点田间试验,以评估菌株在相关农业条件下的定殖情况。
定殖田间实验方法在九个州的十个地点进行了玉米根微生物定殖的田间试验:德克萨斯州、乔治亚州、加利福尼亚州、南卡罗来纳州、路易斯安那州、密苏里州、内布拉斯加州、俄亥俄州和伊利诺伊州。试验包括随机完全区块设计,在66%的推荐氮肥下进行4次重复试验(每个地点在当地确定),并在2019年3月至6月期间种植。对种子进行由浓缩培养物组成的微生物处理,并将处理过的种子保持在4℃直到种植。在V4-V6和V10-V12两个时间点从每个地块的三个代表性植株中采集根样品。根在冰上立即包装,连夜运输,在第二天用同样的程序处理,施加到温室植物样品上。到达后,将根从土壤中冲洗干净,并将种子正下方1英寸长的种子根和根的第一结匀浆,提取总基因组DNA(植物和微生物)。如WO 2019/032926A1,第303和304段所述,使用对输入组织鲜重标准化的微生物特异性qPCR测量定殖,并与未经处理的对照植物进行比较。
图12A-12D显示了玉米根浆液中的生长和三种固氮物种的定殖:热带副伯克霍尔德菌(Paraburkholderia tropica)8、多粘类芽孢杆菌(Paenibacillus polymyxa)41和水草螺菌(Herbaspirillum aquaticum)3069。显示每个菌株至少三个重复的生长数据。在玉米根浆液中,菌株热带副伯克霍尔德菌8表现出最高的OD峰值(图12A),菌株水草螺菌3069表现出最快的倍增时间(图12B),而菌株多粘类芽孢杆菌41的OD峰值最低(图12A),倍增时间最慢(图12B)。图12C和12D显示了这些菌株在两个不同地点的田间试验中的定殖情况,表明热带副伯克霍尔德菌菌株8和水草螺菌3069与副伯克霍尔德菌菌株41定殖最高。这些结果表明,在玉米根浆液中生长可用于从一组不同物种中选择具有优异玉米根定殖表型的菌株。
虽然本文显示和描述了本发明的优选实施方式,但本领域技术人员显然了解这些实施方式仅以举例方式提供。本领域技术人员在不背离本发明的情况下可以作出多种改变、变化和替代。应理解,本文所述的本发明实施方式的各种替代形式可用于实施本发明。所附权利要求书确定了本发明范围,这些权利要求范围内的方法和结构以及其等同物均为本发明所涵盖。
