抗菌肽衍生物在制备核酸载体中的用途及核酸载体
文献发布时间:2023-06-19 13:48:08
本发明是申请号为“201710527268.4”、发明名称为“抗菌肽衍生物及其用途”、申请日为2017年6月30日的中国发明专利申请的分案申请。中国发明专利申请“201710527268.4”要求了申请日为2016年7月1日、申请号为“201610517446.0”的中国发明专利申请,以及申请日为2016年7月1日、申请号为“201610517372.0”的中国发明专利申请的优先权。本发明也要求上述两件中国发明专利申请“201610517446.0”和“201610517372.0”的优先权。
技术领域
本发明属于生物医药领域,主要涉及抗菌肽衍生物在制备核酸载体中的用途及核酸载体,尤其是疏水化修饰的抗菌肽DP7衍生物在制备核酸载体中的用途及核酸载体。
背景技术
抗菌肽,又称为宿主防御肽(Host Defense Peptides,HDPs),一般由l2到100个氨基酸残基组成,是一类碱性多肽,绝大部分的抗菌肽带正电荷。抗菌肽具有广谱的抗菌作用,能有效地抑制杀伤真菌、病毒、寄生虫等病原体,并能选择性的杀伤肿瘤细胞,不易产生耐药性,构成宿主防御病原微生物入侵的第一道屏障,是机体免疫系统的重要成分,抗菌肽已成为替代抗生素预防和控制疾病的潜在药物,且具有广阔的开发前景。尽管抗菌肽有巨大的应用潜力,但只有极少的抗菌肽在临床上广泛使用,主要原因是它的稳定性和毒性。一些研究表明,抗菌肽纳米化可以使其获得较好稳定性及减少毒性,这为抗菌肽的应用提供一个新研究方向。
抗菌肽或HDPs的免疫调节活性受到越来越多的关注,包括通过改变信号通路诱导细胞因子和趋化因子的产生、直接或间接招募效应细胞包括吞噬细胞、增强细胞内和细胞外细菌杀伤、促进树突状细胞成熟和巨噬细胞分化以及介导伤口修复、凋亡。多种抗菌肽因其良好的免疫调节作用而展现出了佐剂活性,主要方式为激活天然免疫反应和介导获得性免疫反应。
抗菌肽DP7是用计算机辅助设计新型抗菌肽的筛选方法,通过对模板抗菌肽HH2替换了2个氨基酸得到的具有更高的细菌识别特异性与更强的抗菌活性的抗菌肽(HH2的专利号:WO08022444)。经过研究表明,相较于HH2,抗菌肽DP7具有更好的抗菌活性、更低的红细胞溶血毒性及更强的免疫调节活性。在体外抗菌活性研究中,抗菌肽DP7具有很明显的细菌细胞壁的破坏作用和细胞膜的扰乱作用,从而实现抗菌的功能。在体内抗菌活性研究中,从致病性金黄色葡萄球菌感染小鼠腹腔模型研究发现,通过诱导免疫细胞清除细菌的作用,DP7表现出了非常好的治疗效果。但是高浓度DP7经静脉注射方法给药后,会导致红细胞发生溶血现象和小鼠死亡的现象出现,说明高浓度的DP7对红细胞有毒性,会破坏红细胞。DP7是带正电荷的亲水性抗菌肽,我们将其用疏水片段进行修饰可得到具有自组装成纳米粒子的两亲化合物,可大大降低静脉给药的毒性,保持其体内抗菌作用、免疫调节作用,并能作为小核酸药物的传递系统,在药物领域具有较广的用途。
发明内容
本发明的目的是提供一种新型的修饰的抗菌肽,以期为本领域的抗感染治疗、新型免疫佐剂的制备及siRNA运载载体制备提供一种新的有效选择。
为了解决上述技术问题,本发明采取的技术方案是提供一种疏水化修饰的抗菌肽,所述的疏水化修饰为在抗菌肽的氮末端偶联疏水片段(或叫氮末端偶联疏水化合物)。所述的抗菌肽DP7的氨基酸序列为VQWRIRVAVIRK(SEQ ID No.1)。为提高稳定,DP7的碳末端一般会进行酰胺化修饰,此时其结构为VQWRIRVAVIRK-NH
上述疏水化修饰的抗菌肽中,所述的疏水化合物(疏水片段)为甾醇类化合物或饱和直链脂肪酸。优选的,所述甾醇类化合物为胆固醇类化合物或胆酸类化合物。
上述疏水化修饰的抗菌肽中,所述的甾醇类化合物为丁二酰化胆固醇、胆酸或去氧胆酸。
上述疏水化修饰的抗菌肽中,所述的长链脂肪酸为C6到C20的脂肪酸。优选的,所述饱和直链脂肪酸为C8~C18中的至少一种。
上述疏水化修饰的抗菌肽中,所述的长链脂肪酸为硬脂酸(C18)、软脂酸(C16)、月桂酸(C12)或正辛酸(C8)中的至少一种。
上述疏水化修饰的抗菌肽中,所述的抗菌肽的氮端与疏水片段(疏水化合物)偶联的方式为通过疏水片段(疏水化合物)上的-CO-OH与抗菌肽上的-NH
上述疏水化修饰的抗菌肽中,所述疏水化修饰的抗菌肽的结构为:
其中,所述的R为胆固醇类化合物、胆酸、长链脂肪酸。
上述疏水化修饰的抗菌肽中,所述的R为
本发明还提供了由上述疏水化修饰的抗菌肽制成的胶束。
上述胶束中,所述的胶束为的疏水化修饰的抗菌肽在溶液中自组装而成。
上述胶束中,所述的胶束经过了冷冻干燥处理。
上述胶束中,所述的胶束里还装载有核酸、小分子药物、多肽或者蛋白中的至少一种。
本发明还提供了上述疏水化修饰的抗菌肽的方法,包括以下步骤:
A、准备多肽VQWRIRVAVIRK-NH
B、在多肽VQWRIRVAVIRK-NH
本发明还提供了上述疏水化修饰的抗菌肽或者上述胶束在制备抗菌药物中的用途。
上述在制备抗菌药物中的用途中,所述的抗菌为抗细菌或抗真菌。
上述在制备抗菌药物中的用途中,所述的细菌为金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia colibacillus)、鲍曼不动杆菌(Acinetobacter baumanmii)、绿脓杆菌(Pseudomonas aeruginosa)或伤寒杆菌(Salmonella typhi)中的至少一种。
上述在制备抗菌药物中的用途中,所述的真菌为白色念珠菌(Canidia Albicans)或近平滑念珠菌(Candida parapsilosis)中的至少一种。
本发明还提供了一种抗菌药物,是由上述疏水化修饰的抗菌肽或者上述胶束作为主要活性成分制备而成。
进一步的,上述抗菌药物中还含有其他抗菌药物。
更进一步的,上述抗菌药物中所述的其他抗菌药物为抗生素。
其中,上述抗菌药物中所述的抗生素为糖肽类抗生素、氨基苷类抗生素、大环内脂类抗生素、β-内酰胺类抗生素中的至少一种。
其中,上述抗菌药物中所述的β-内酰胺类抗生素为青霉素类抗生素或头孢菌素类抗生素中的至少一种。
进一步的,所述的青霉素类抗生素为青霉素G、青霉素V、氟氯西林、苯唑青霉素、氨苄西林、羧苄西林、匹氨西林、磺苄西林、替卡西林、哌拉西林或阿莫西林中的至少一种。所述的头孢菌素类抗生素为:头孢羟氨苄、头孢氨苄、头孢唑啉、头孢拉啶、头孢丙烯,头孢呋辛脂、头孢克洛、头孢孟多、头孢噻肟、头孢曲松、头孢克肟、头孢地尼、头孢皮罗、头孢吡肟或头孢唑南中的至少一种。
其中,上述抗菌药物中所述的氨基苷类抗生素为链霉素、庆大霉素、卡那霉素、妥布霉素、丁胺卡那霉素、新霉素、西索米星、妥布霉素、阿米卡星、奈替米星、核糖霉素、小诺霉素或阿斯霉素中的至少一种。
其中,上述抗菌药物中所述的多肽类抗生素为万古霉素、去甲万古霉素、多粘菌素B或替考拉宁中的至少一种
其中,上述抗菌药物中所述的大环内脂类抗生素为红霉素、白霉素、无味红霉素、依托红霉素、乙酰螺旋霉素、麦迪霉素、交沙霉素或阿奇霉素中的至少一种。
进一步的,上述抗菌药物的其剂型为注射剂。
本发明还提供了上述疏水化修饰的抗菌肽或者上述胶束在制备免疫佐剂中的用途。
本发明还提供了一种免疫佐剂,是由上述疏水化修饰的抗菌肽或者上述胶束作为免疫佐剂与抗原制备而成。
上述免疫佐剂中,还含有单链脱氧寡核苷酸(CpG ODNs)。进一步的,所述的疏水化修饰的抗菌肽与CpG ODNs之间的配比为:1:0.5~1:5。
本发明还提供了上述疏水化修饰的抗菌肽或者上述胶束在制备核酸转运载体中的用途。
上述在制备核酸转运载体中的用途中,所述的核酸为RNA。
上述在制备核酸转运载体中的用途中,所述的核酸为信使RNA(message RNA,mRNA)、用于RNA干扰的siRNA(Small interfering RNA)或者为用于基因组编辑的sgRNA(small guide RNA)。
本发明还提供了核酸转运载体,由上述的疏水化修饰的抗菌肽或者上述述的胶束装载核酸而得。
上述核酸转运载体中,所述核酸为RNA。
上述核酸转运载体中,中所述的核酸为信使RNA(message RNA,mRNA)、用于RNA干扰的siRNA(Small interfering RNA)或者为用于基因组编辑的sgRNA(small guide RNA)。
上述核酸转运载体中,所述的疏水化修饰的抗菌肽与核酸的质量比为1:1~20:1。
本发明也提供了制备上述核酸转运载体的方法。该方法包括以下步骤:
a、称取适量权利要求1~9任一项所述的疏水化修饰的抗菌肽,加入溶液溶解,自发形成胶束;或取权利要求9~12任一项所述的胶束形成溶液;
b、将核酸加入胶束溶液,室温孵育,即得。
上述的抗菌肽DP7与疏水片段偶联产物可以以冻干粉形式保存,使用时直接用无菌水或者生理盐水溶解即可。
本发明的有益效果在于:本发明涉及的疏水化修饰的抗菌肽DP7中的抗菌肽DP7分子量小,可以方便的使用Fmoc固相多肽合成法合成,与疏水片段经化学合成偶联方法简单易行。本发明的疏水化DP7能自组装成胶束,有较好的单分散性和Zeta电位,冻干再溶解也很稳定;疏水化DP7的胶束能显著降低抗菌肽DP7对红细胞的裂解等毒性,实现了静脉系统给药;虽然疏水化DP7在体外抗菌活性很低,但在在斑马鱼及小鼠体内具有很好的抗菌活性,在体内抗菌不是通过直接杀菌,而是通过募集巨噬细胞、单核细胞、中性粒细胞等淋巴细胞以及调控一些免疫细胞因子的表达,从而实现对机体免疫保护作用。同时,疏水化DP7也可作为免疫佐剂,诱导机体产生针对目的抗原的较高的免疫应答。此外,本发明的疏水化DP7阳离子胶束,能够高效地复合siRNA并导入到结肠癌和黑色素瘤等肿瘤细胞中,通过腹腔注射、瘤内注射和尾静脉注射的方式实现对肿瘤组织生长的抑制作用,并展示出较高的安全性。
本发明涉及到的英文缩写如下:
(1)万古霉素:VAN
本发明所涉及到的菌株:
(1)金黄色葡萄球菌菌株:ATCC 33591、ATCC 25923
(2)大肠杆菌菌株:ATCC 25922
(3)绿脓杆菌菌株:ATCC 10145、ATCC 10145GFP
附图说明
图1:抗菌肽DP7与疏水片段偶联物的合成路线图。
图2:DP7疏水片段修饰后的质谱图。A为胆固醇修饰后DP7-C的质谱图;B为硬脂酸修饰后DP7-SA的质谱图。
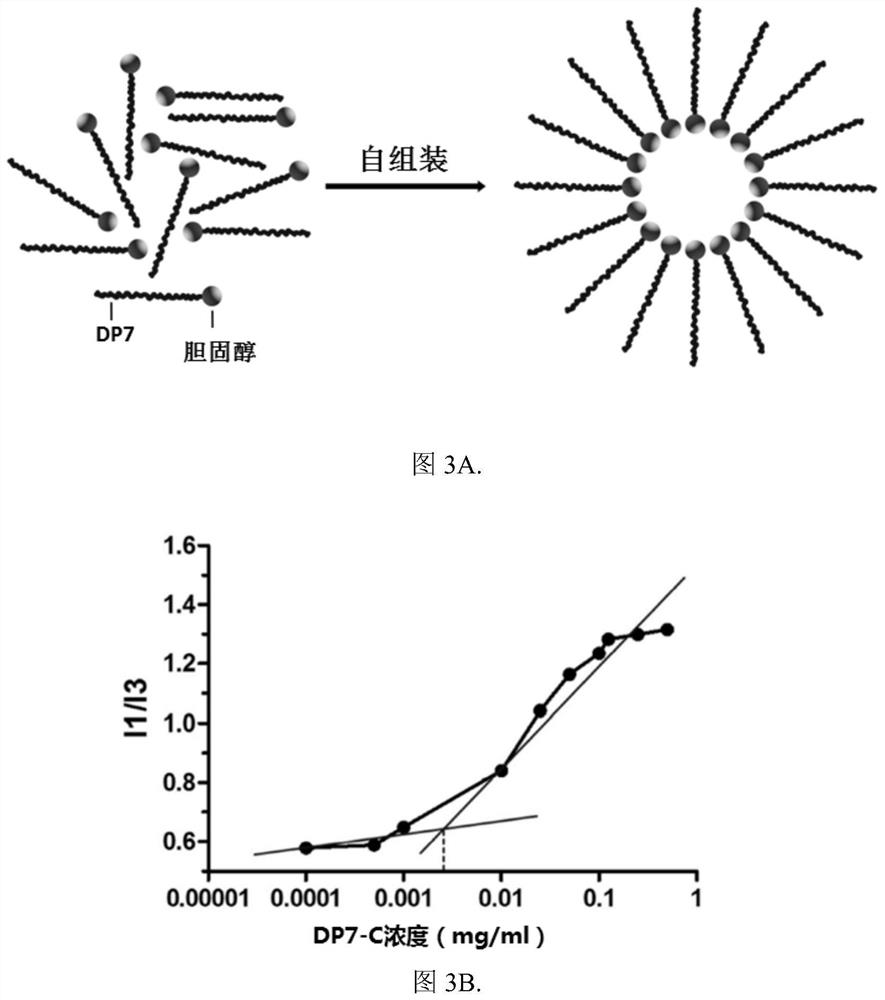
图3:DP7-C胶束的自组装及临界胶束浓度测定:A为DP7-C胶束自组装示意图;B为DP7-C胶束的临界胶束浓度的测定。
图4:DP7-C胶束的物理特征:A为粒径大小;B为Zeta电位;C为原子力显微镜图谱;D为外观形态。
图5:DP7和DP7-C胶束体外溶血活性比较:A为血红蛋白测定曲线图;B为溶血实验外观图。
图6:DP7-C的体内抑菌活性:A为绿脓杆菌斑马鱼腹腔感染模型大体及荧光图;B为荧光灰度积分示意图;C为金黄色葡萄球菌小鼠腹腔感染模型菌落数示意图。
图7:DP7-C的体内抑菌的机制研究:A为DP7-C刺激后腹腔中单核细胞、中性粒细胞检测的流式图谱;B为DP7-C刺激后腹腔中巨噬细胞检测的流式图谱;C为DP7-C刺激后腹腔中总细胞、巨噬细胞、中性粒细胞及单核细胞数量比较示意图;D为DP7-C刺激PBMC后Q-PCR检测免疫相关细胞因子的表达情况比较;E为DP7-C联合LPS刺激PBMC后Q-PCR检测免疫相关细胞因子的表达情况比较。
图8:DP7-C/CpG复合物的免疫效果检测:A为第5周不同免疫组的抗OVA抗体滴度示意图;B为预防性模型中,各组小鼠肿瘤的生长曲线;C为预防性模型中,各组小鼠的生存期变化;D为治疗性模型中,各组小鼠肿瘤的生长曲线。
图9:DP7-C促进树突状细胞的成熟的试验。
图10:DP7-C促进DC对OVA抗原的摄取的试验。
图11:CpG/DP7-C复合物激发固有免疫反应的试验。
图12:CpG/DP7-C复合物激发细胞免疫反应的试验。
图13:CpG/DP7-C佐剂激发高效的抗肿瘤免疫的试验。
图14:DP7-C胶束/siRNA复合物的电镜形态图:A为DP7-C胶束;B为DP7-C/siRNA复合物。
图15:DP7-C携带siRNA的体外转染效率检测:A为DP7-C与PEI25K和lipofectamine2000携带siRNA转染肿瘤细胞的效果比较图;B为流式检测B16细胞的转染效率示意图;C为流式检测C26细胞的转染效率示意图。
图16:DP7-C的细胞毒性测定(CCK-8法)。
图17:DP7-C传输VEGF siRNA治疗C26小鼠结肠癌腹腔转移瘤模型。
图18:DP7-C传输VEGF siRNA治疗C26小鼠结肠癌皮下移植瘤模型。
图19:DP7-C传输VEGF siRNA治疗B16小鼠黑色素瘤肺转移瘤模型。
具体实施方式
DP7是一个带正电荷的亲水性抗菌肽,常用的是其碳末端进行酰胺化修饰的形式,在本发明实施例使用的DP7是QWRIRVAVIRK-NH
抗菌肽DP7具有良好的免疫调节活性,能够介导天然免疫反应,此特性使其成为疫苗免疫佐剂,与抗原共同免疫能够增强宿主的细胞免疫并介导抗原特异性的免疫球蛋白的产生。经研究表明,疏水化的抗菌肽展现了良好的佐剂特性。在体外试验中,疏水化DP7可自组装成纳米粒子,通过静电作用吸附CpG可作为新型的免疫佐剂,可增强抗原呈递细胞对抗原的摄取,促进抗原呈递细胞的成熟以及细胞因子的表达。在动物肿瘤模型试验中,疏水化Dp7/CpG复合物延长了接种肿瘤小鼠的生存期,明显抑制了肿瘤的生长,增强了抗原特异性抗体的水平。
同时,由于DP7带阳电荷,使得所自组装形成的疏水化DP7胶束在水溶液中呈正电,展示出作为一种非病毒基因传输,特别是siRNA传输载体的潜力。结合针对肿瘤靶点的siRNA沉默作用,疏水化DP7将在基于siRNA的肿瘤治疗研究和应用中发挥重要作用。
目前,疏水片段偶联水溶性多肽形成纳米的研究很多,与抗菌肽偶联还未见报道,疏水片段偶联抗菌肽的抗菌及免疫调节作用及机制也有待于研究。同时,本研究还利用DP7-C偶联物所形成的阳离子胶束,成功实现对肿瘤细胞的高效siRNA导入,并有效抑制多种肿瘤模型的生长,得到一种新型的siRNA传输载体。而目前基于抗菌肽偶联物的基因传输载体也尚未见报道。
以下将结合附图和实施例详细说明本发明,应当说明的是,实施例是对本发明的技术方案的进一步说明,并不表明本发明仅限于这些实施例。
实施例1抗菌肽DP7与胆固醇偶联物(DP7-C)的合成
抗菌肽DP7与疏水片段偶联物是由图1所示合成路线进行合成的。其中,疏水片段包括:胆固醇、胆酸、软脂酸、硬脂酸、月桂酸等。
2-chlorotrityl chloride Resin,其名称为2-氯三苯甲基氯树脂;Fmoc-RinkAmide MBHA Resin,其名称是4-(2’,4’-二甲氧基苯基-芴甲氧羰基-氨甲基)-苯氧基乙酰氨基-甲基二苯甲胺树脂;Fmoc:芴甲氧羰基;pbf、tbu、Otbu、Trt、Boc都是保护基,名称分别是2,2,4,6,7-五甲基二氢苯并呋喃-5-磺酰基、叔丁基、叔丁氧基、三苯甲基、叔丁氧羰基。
具体的合成方法如下所述:
1.树脂的溶胀活化及脱保护:
溶胀:称取1.0g Rink MBHA(4-(2′,4′-二甲氧基苯基-芴甲氧羰基-氨甲基)-苯氧基乙酰氨基-甲基二苯甲胺)树脂(取代值0.36mmol/g)放入多肽合成仪反应瓶中,用DCM/DMF(1:1)进行溶胀活化,上下摇动反应瓶,使树脂充分溶胀,溶胀大约20min,去除溶剂。
脱保护:用20%Piperdine/DMF(N,N-二甲基甲酰胺)溶液15mL脱除树脂上Fmoc保护基,反应15min,用DCM/DMF(二氯甲烷/N,N-二甲基甲酰胺)交替洗涤树脂三次,取少量树脂用甲醇/DCM/DMF依次洗涤后加入到装有5%茚三酮的无水乙醇溶液的EP管中,沸水浴三分钟,树脂呈现蓝色,即阳性反应,则洗涤两次后继续进行下步反应,否则继续重复脱保护过程。
2.第一个氨基酸(Lys)的偶联
称取Fmoc-Lys(Boc)-OH(1.44mmol,0.93g,4eq),用DMF(约5mL)溶解后加入反应瓶,随后再加入5mL HBTu(苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸酯)(1.44mmol,0.54g,4eq)、5mL DIEA(二异丙基乙胺)(2.88mmol,0.474mL,8eq)DMF溶液,最后再补加5mLDMF,开始反应,上下来回震荡反应瓶50min,而后排出反应液,取出少量树脂用CH
3.氨基酸链的延长
将步骤2得到Fmoc-Lys(Boc)-MBHA Resin脱Fmoc后,加入N,N-二甲基甲酰胺、Fmoc-Arg(pbf)-OH、1-羟基苯丙三唑、苯并三氮唑-N,N,N’,N’-四甲基脲六氟磷酸酯、N,N’-二异丙基乙胺,在氮气保护下进行反应得到Fmoc-Arg(pbf)-Lys(Boc)-MBHA Resin;按照该方法再依次连接Fmoc-Ile-OH、Fmoc-Val-OH、Fmoc-Ala-OH、Fmoc-Val-OH、Fmoc-Arg(pbf)-OH、Fmoc-Ile-OH、Fmoc-Arg(pbf)-OH、Fmoc-Trp(Boc)-OH、Fmoc-Gln(Trt)-OH、Fmoc-Val-OH,
上述合成得到即为全保护的DP7序列肽。
4.乙酰化封闭
当缩合反应不理想时,为避免缺失肽对后续反应影响,一般要对游离氨基进行乙酰化封闭,将配好的封闭液(醋酐:吡啶:DMF 3:3:4)加入到装有树脂的反应瓶中,上下震荡反应瓶约20min,茚三酮检测,若树脂呈现黄色即反应完全,可进行后续反应,若未封闭完全,则需延长封闭时间,或调整封闭液的配比,以使反应尽量完全。
5.DP7的疏水化修饰
1)用丁二酰化胆固醇对DP7进行疏水化修饰
称取丁二酰化胆固醇0.67g(1.44mmol,4.0eq),用DCM(约10mL)溶解后加入反应瓶,随后再加入随后再加入HBTu(1.44mmol,0.54g,4eq)、DIEA(2.88mmol,0.474mL,8eq)DMF溶液各5mL,上下来回震荡反应瓶50min,而后排出反应液,取出少量树脂用CH
2)用胆酸对DP7进行疏水化修饰
称取胆酸0.59g(1.44mmol,4.0eq),用DCM(约10mL)溶解后加入反应瓶,随后再加入随后再加入HBTu(1.44mmol,0.54g,4eq)、DIEA(2.88mmol,0.474mL,8eq)DMF溶液各5mL,上下来回震荡反应瓶50min,而后排出反应液,取出少量树脂用CH
3)用硬脂酸对DP7进行疏水化修饰
称取硬脂酸0.41g(1.44mmol,4.0eq),用DCM(约10mL)溶解后加入反应瓶,随后再加入随后再加入HBTu(1.44mmol,0.54g,4eq)、DIEA(2.88mmol,0.474mL,8eq)DMF溶液各5mL,上下来回震荡反应瓶50min,而后排出反应液,取出少量树脂用CH
4)用软脂酸对DP7进行疏水化修饰
称取软脂酸0.37g(1.44mmol,4.0eq),用DCM(约10mL)溶解后加入反应瓶,随后再加入随后再加入HBTu(1.44mmol,0.54g,4eq)、DIEA(2.88mmol,0.474mL,8eq)DMF溶液各5mL,上下来回震荡反应瓶50min,而后排出反应液,取出少量树脂用CH
5)用软月桂酸对DP7进行疏水化修饰
称取月桂酸0.29g(1.44mmol,4.0eq),用DCM(约10mL)溶解后加入反应瓶,随后再加入随后再加入HBTu(1.44mmol,0.54g,4eq)、DIEA(2.88mmol,0.474mL,8eq)DMF溶液各5mL,上下来回震荡反应瓶50min,而后排出反应液,取出少量树脂用CH
由于固相合成多肽技术已经较为成熟,抗菌肽DP7与疏水片段的偶联物还可交由合成公司合成。比如将丁二酰化胆固醇修饰的DP7-C((Chol-suc-VQWRIRVAVIRK-NH
由于实验表明上述制得的疏水化修饰的DP7具有相似的性质,故以下的实施例均以胆固醇化的DP7(DP7-C)进行具体的描述。
实施例2 DP7-C的临界胶束浓度
DP7-C在水溶液中可发组装成胶束,我们采用芘荧光探针光谱法检测DP7-C的临界胶束浓度(CMC)。
芘(Pyrene)不溶于水,芘在水中的溶解度约为6×10
图3A为DP7-C在水溶液中自组装形成胶束的示意图,其胶束的CMC测定值为3.47μg/mL(结果见如图3B)。
实施例3 DP7-C胶束的物理特征
我们采用原子力显微镜和马尔文粒径仪检测DP7-C胶束的粒径、Zeta电位等一些物理特征。
1.原子力显微镜拍照:配置不同浓度DP7-C溶液,滴加到云母片,自然晾干,将涂有DP7-C的云母片置于原子力显微镜上拍照。
2.粒径及Zeta电位检测:用MilliQ水溶解DP7-C,采用马尔文粒径仪测定粒径和Zeta电位,每个样品检测4次,取平均值。
3.DP7-C外观形态及溶液状态:观察MilliQ水、DP7-C水溶液及冻干粉的外观,并用相机拍照。a为MilliQ水,b为溶于水溶液中的DP7-C,c为DP7-C冻干粉复溶后的状态,d为DP7-C冻干粉的形态和颜色。
结果见图4,DP7-C胶束形态呈球形或椭球形(图4C),DP7-C胶束的粒径约为24.3±1.5nm(图4A),Zeta电位约为28.8±0.27mV(图4B)。DP7-C冻干粉呈白色蓬松状,易溶于水,溶液呈无色透明状。
实施例4 DP7和DP7-C胶束体外溶血活性
在溶血试验中,用同一浓度下的DP7与DP7-C对红细胞的裂解溶血情况进行检测。
1.取健康自愿者的血液于抗凝管中,轻轻混匀。
2.取出抗凝血并向其加入等体积的生理盐水,缓慢混匀,400×g离心10分钟,去上清。
3.用PBS将红细胞缓慢混匀洗涤,400×g离心10分钟,去上清,细胞沉淀用PBS洗涤,重复3次。
4.用PBS稀释,得到20%(v/v)红细胞溶液,可立即使用或于4摄氏度保存2周左右(未发生溶血)。
5.用PBS将药物稀释成一系列浓度梯度,取100μLL药物对应加入到96孔板中,阳性对照用100μLL 2%的吐温20,阴性对照加入100μL PBS,每个浓度药物设置3个复孔。
6.取20%(v/v)的红细胞溶液,用PBS按照体积比1:20稀释,混匀后加入96孔板中,药物浓度分别为100、200、400、600、800、1000、1200、1600μg/mL,37℃孵育1h。
7.药物和红细胞混合物孵育后,900×g离心10分钟,分别取上清160μLL加入新的96孔板中,在OD 450nm处读取吸光值。
8.根据A450的吸光值,计算出各个浓度药物所对应的溶血百分比。
溶血百分比的计算公式为:
溶血实验结果见图5A,当药物浓度大于0.8mg/mLmL时,DP7-C胶束对红细胞的裂解程度远小于DP7,说明了抗菌肽DP7偶联胆固醇后能够极大地降低对红细胞毒性的作用。图5B直观展示了红细胞在不同条件下的溶血情况,其中阴性对照组(PBS)(a组)不发生溶血,红细胞沉降于瓶底,阳性对照组(2%Tween-20)(b组)和DP7溶液(c组)红细胞裂解,呈现澄清的红色溶液,而DP7-C胶束(d组)则不裂解红细胞,但由于其胶束特性,红细胞均匀悬浮于溶液中。
实施例5 DP7-C的体内抑菌活性
我们之前的试验表明胆固醇化的DP7-C胶束在体外抗菌活性较低(对多个菌株的MIC>1024mɡ/L),我们分别采用小鼠及斑马鱼的腹腔感染模型进一步检测其体内的抗菌活性。
(一)、DP7-C在小鼠体内的抗菌活性检测(革兰氏阳性菌——金黄色葡萄球菌)
采用腹腔感染模型测定DP7-C的抗感染活性,实验分组如下:
NS组:100μL生理盐水/只小鼠;
DP7-C组:0.3mg/kg;
万古霉素(VANC)阳性对照组:10mg/kg。
实验步骤如下:
(1)实验前一天用MHB活化金黄色葡萄球菌33591,实验当天取活化后的菌株,用生理盐水洗涤两次,测定菌液浓度后备用。
(2)建立小鼠的腹腔感染模型,每只小鼠腹腔注射菌液1.5×10
(3)感染1小时后,按分组分别静脉注射药物,0.mL1mL/只。
(4)24小时后向小鼠腹腔注射5mL的生理盐水,轻柔腹部,并处死,用75%酒精消毒,5min后剪开腹腔上皮,在腹腔开个小口,用1mL注射器从中吸取尽量多的腹水,然后转移至无菌的EP管中混匀。
(5)用生理盐水进行10倍的梯度稀释,如稀释10倍,100倍,1000倍,10000倍等,并取三个合适的浓度的菌液20μL,涂MHA平板,细菌孵箱培养过夜。
(6)挑取一个长有20~200个菌落的平板数菌落数,换算成计算5mL腹水中每毫升的菌量。
DP7-C治疗小鼠腹腔感染模型的结果见图6C,结果表明静脉给药后的DP7-C组(1mg/kg)和阳性药物组(20mg/kg万古霉素)的金黄色葡萄球菌平均集落形成单位(CFU)均显著低于NS组(p<0.01)。此外,DP7-C组与阳性药物组的抑菌效果基本一致,无统计学差异。说明在小鼠的全身感染模型中,DP7-C具有很好的抗菌活性。
(二)、DP7-C在斑马鱼体内的抗菌活性(革兰氏阴性菌——绿脓杆菌)
其次,我们采用带有荧光的绿脓杆菌(PAO1-GFP)建立斑马鱼的腹腔感染模型进一步验证DP7-C的抗感染作用。
将雌雄AB野生型斑马鱼按照配对繁殖程序进行配对,待其产卵后,收集鱼卵,然后将鱼卵培养于含PTU的海水中,于28℃温箱中培养,每天换一次含PTU的海水,斑马鱼孵化后48h开始腹腔注射采用DP7-C和生理盐水稀释的带荧光的绿脓杆菌(PAO1-GFP),在3、8、18h荧光显微镜下观察拍照,观察PAO1-GFP在斑马鱼腹部生长情况。
结果见图6(A、B),斑马鱼腹腔中PAO1-GFP的生长速率与绿色荧光荧光总强度成正相关,DP7-C组的PAO1-GFP生长速率远远小于NS,结果表明低浓度的DP7-C胶束(1mg/mL)在斑马鱼具有很好的抗菌活性。
实施例6 DP7-C的体内抑菌的机制研究
对DP7-C抗菌活性检测中,发现DP7-C具有较低的体外活性,然而却具有很高的体内抗菌活性,这可能是由于DP7-C调节机体免疫系统来实现抗菌作用。我们从细胞水平及细胞因子水平检测DP7-C对机体免疫功能的影响。
(一)、激活免疫相关细胞的检测
分组:将小鼠随机分成两组(NS组和DP7-C组),每组5只。检测的免疫细胞及其表面marker如下表:
DP7-C组每只小鼠给药200μl的1mg/mL DP7-C,NS组每只小鼠注射200μl生理盐水,24小时后处死小鼠,每只小鼠腹腔注射5mL生理盐水,轻柔腹腔,然后吸取腹腔中的腹水,计算腹水中的细胞浓度及总细胞数。采用流式细胞仪检测腹水中淋巴细胞的分型,分析巨噬细胞、中性粒细胞、炎性单核细胞在总细胞中所占比例;根据流式细胞仪结果和腹水中总细胞数量计算出巨噬细胞、中性粒细胞、炎性单核细胞的数量。
结果如图7C所示,小鼠腹腔注射DP7-C后,腹腔内细胞总数显著上升,包括巨噬细胞、中性粒细胞及单核细胞的数量都有显著差异,特别是单核细胞所占比例由2.7%提高到32.8%(图7A)和巨噬细胞所占比例由38.8%提高到50.8%(图7B)。
(二)、与免疫相关细胞因子的测定
采用小鼠PBMC测定经DP7-C刺激后的细胞因子的变化情况。将分离得到的小鼠PBMC稀释至1×10
DP7-C刺激PBMC相关细胞因子的表达结果见图7D,IL-1β、IL-6、MCP-1、M-CSF和TNF-α等与免疫激活相关细胞因子的表达均大幅提高,同时DP7-C与LPS共同刺激PBMC时,发现与细胞因子风暴相关的主要细胞因子,如IL-1β、MCP-1和TNF-α的基因表达明显降低,说明DP7-C会降低败血症等相关感染性疾病的损伤程度。
实施例7 DP7-C作为免疫佐剂的研究
由于在之前的试验中,发现DP7-C能显著上调小鼠PBMC免疫相关细胞因子的表达,我们预测DP7-C与CpG ODNs联合可作为一种新型的免疫佐剂,且DP7-C可以自发形成胶束,更是启发了发明人是否有可能替代铝佐剂的使用。本研究中,发明人以OVA为模式抗原研究DP7-C/CpG复合佐剂的免疫调节作用,以及在小鼠预防性和治疗性肿瘤模型中的抗肿瘤效果。
(1)动物分组:
C57BL/6J雌性小鼠随机分为4组,每组10只,具体如下:
NS组:100μL生理盐水
CpG组:10μg OVA+20μg CpG
DP7-C组:10μg OVA+40μg DP7-C
CpG/DP7-C组:10μg OVA+40μg DP7-C+20μg CpG
(2)预防性免疫肿瘤模型:0、2、4周多点皮下免疫,检测第5周接种肿瘤前总抗体滴度。第5周每只小鼠背部皮下接种肿瘤细胞EG7-OVA:2×10
治疗性免疫肿瘤模型:第0天每只小鼠背部皮下接种2×10
结果见图8,在预防性模型中(A和B),对第5周的OVA特异性抗体进行检测发现,DP7-C/CpG组产生的抗OVA特异性抗体显著升高,与其他组相比均具统计学差异。在接种肿瘤后第26天,DP7-C/CpG组的肿瘤生长受到明显抑制。在治疗性模型中(C和D),DP7-C/CpG组显著地延长了接种肿瘤小鼠的生存期,并很大程度上抑制了肿瘤的生长。结果表明,DP7-C/CpG是一种具有良好的免疫刺激活性的新型免疫佐剂。
实施例8 DP7-C体外促抗原摄取作用的研究
佐剂激活免疫反应的机理可能在于促进DC细胞的成熟,提高其对抗原的摄取和加工。我们研究了DP7-C胶束在体外对DC活性的影响。
(一)促进树突状细胞的成熟
树突状细胞(dendritic cell,DC)的成熟状况在很大程度上决定机体产生免疫应答或免疫耐受。随着DC的成熟,其表面抗原CD80、CD86、MHC-II明显上调。因此我们用流式细胞术检测了DP7-C佐剂对树突状细胞成熟的影响。
实验步骤如下:
(1)分离C57/BL小鼠原代骨髓细胞,用含10ng/ml GM-CSF和10ng/ml IL-4的诱导培养基培养至第5天。
(2)将DP7-C佐剂加入DC细胞培养物中混匀,孵育16h。
(3)收集刺激后的DC细胞,经PBS洗2次后,用100μl PBS重悬细胞,加入1μl anti-mouse CD16/CD32 4℃封闭30min。
(4)用PBS洗3次,再加入1μg FITC-anti-CD80,APC-anti-CD86,PE-anti-MHC-II,室温孵育30min后,PBS洗3次后用200μl PBS重悬,进行流式检测。
结果见图9,DP7-C佐剂作用于DCs细胞后,细胞成熟分子MHCII以及共表达分子CD80和CD86的表达增强,并且与NS相比,差异具有统计学意义。
(二)增强树突状细胞的抗原摄取
DC细胞是机体内功能最强的抗原呈递细胞,可摄取外源物质,对其进行加工处理,并将其呈递给T细胞,激发免疫反应。DC细胞在T细胞免疫应答及T细胞依赖的抗体生成中具有重要的作用。我们采用流式细胞数检测了DP7-C对DC呈递抗原的作用。
实验步骤如下:
(1)分离C57/BL小鼠原代骨髓细胞,用含10ng/ml GM-CSF和10ng/ml IL-4的诱导培养基培养至第5天。
(2)将OVA蛋白标记FITC,OVA或DP7-C/OVA加入DC细胞培养物中混匀,孵育3h。
(3)收集刺激后的DC细胞,经PBS洗2次后,用300μl PBS重悬细胞,进行流式检测
结果见图10,DC细胞对单独的OVA抗原摄取率较低,40μg/ml DP7在一定程度上稍微增强DC细胞对OVA的摄取,而2.5μg/ml DP7-C能够显著增加DC细胞对抗原的摄取,并且随着DP7-C的浓度增加,摄取作用增强。
实施例9 DP7-C激发固有免疫反应
固有免疫在抗肿瘤免疫中起着重要作用。我们检测了小鼠免疫DP7-C佐剂后,对小鼠NK细胞的杀伤活性。
实验步骤如下:
(1)效应细胞制备
初次免疫48h后颈椎脱臼法处死小鼠,用小鼠淋巴细胞分离液分离小鼠的脾淋巴细胞作为效应细胞。
(2)靶细胞制备
复苏培养YAC-1细胞,实验前1天传代,保持2×10
(3)效应细胞与靶细胞共孵育
①按靶细胞10000个/孔,靶效比=1:25,1:50,1:100,1:200四个梯度将靶细胞和效应细胞加入96孔板中,37℃共孵育4h。
②250g离心取上清,进行LDH释放检测。
结果见图11,NS组基本无NK细胞活性,CpG和DP7-C展示了稍强的NK细胞杀伤活性,而CpG/DP7-C复合物能够有效的增强NK细胞的活性,差异具有显著性。
实施例10 DP7-C激发细胞免疫反应
上述结果中,我们得知DP7-C与CpG联用可以刺激抗原的特异性免疫反应,并能有效抑制肿瘤生长及转移,延长小鼠的生存期。并且,DP7-C与CpG能显著上调OVA抗原的特异性抗体滴度,增强体液免疫反应,因而我们进一步检测DP7-C激活的细胞免疫反应。
具体步骤如下:
(1)脾淋巴细胞体外刺激。
①3次免疫7天后,分离小鼠脾脏淋巴细胞,计数并将其稀释为5×10
②5×10
③每孔加入1μl Golgiplug混匀后再孵育6-12h。
(2)荧光抗体标记
①收集细胞,加入2ml 1×BD Pharmlyse涡旋,避光室温孵育10min,500g离心5min弃上清。
②经1×instaining buffer清洗后,用100μl1×instaining buffer重悬,加入1μl anti-mouse CD16/CD32 4℃孵育15min封闭。
③经1×instaining buffer清洗后,用100μl staining buffer重悬细胞,分别加入1μlPE-anti-mouse CD8、perCP-cy5-anti-mouse CD4 4℃避光孵育30min。
④经staining buffer清洗2次后,加入250μl fixation/permeabilization涡旋充分悬起,室温避光孵育20min固定透化细胞。
(7)加入2ml BD Perm/wash buffer,500g离心5min弃上清。
(8)加入100μl BD perm/wash buffer重悬细胞,加入胞内抗原抗体(FITC-IFN-γ或PE-IL-17A)室温避光孵育30min,然后加入2ml BD Perm/wash buffer,500g离心5min弃上清,加入500μl含2%多聚甲醛的PBS重悬,涡旋充分悬起,即可进行流式分析。
结果见图12,NS组中CD4
实施例11 CpG/DP7-C佐剂激发高效的抗肿瘤免疫
上述结果中,我们得知在EG7-OVA肿瘤模型中,免疫CpG/DP7-C复合物的小鼠肿瘤生长受到抑制。我们进一步以NY-ESO-1为抗原,与CpG/DP7-C佐剂形成疫苗,检测此疫苗是否能够抑制高表达该抗原的黑色素瘤的生长。
具体步骤如下:
(1)疫苗制备
20μg CpG和40μg DP7-C在37℃孵育15min;最后加入5μg NY-ESO-1蛋白,并用无菌PBS补足至体积100μl。
(2)分组及给药方案
在本研究中动物实验共分为5组:NS、CpG、DP7-C和CpG/DP7-C组,每组10只小鼠,每只小鼠给药剂量如下:
①NS组:100μl PBS;
②CpG组:5μg NY-ESO-1蛋白+20μg CpG;
③DP7-C组:5μg NY-ESO-1蛋白+40μg DP7-C;
④CpG/DP7-C组:5μg NY-ESO-1蛋白+20μg CpG+40μg DP7-C;
每只小鼠总给药量体积为100μl,不足100μl的加入无菌PBS补至100μl。
(3)预防性免疫肿瘤模型:0、2、4周多点皮下免疫,检测第5周接种肿瘤前总抗体滴度。第5周每只小鼠背部皮下接种肿瘤细胞NY-ESO-1
结果见图13,无论在预防性(图13A)还是治疗性模型(图13B)中,NS组小鼠的肿瘤生长迅速。而免疫单独的CpG或者DP7-C佐剂在一定程度上能够抑制肿瘤的生长。而免疫CpG/DP7-C复合物佐剂能够有效地抑制肿瘤的生长,与NS组相比,差异具有显著性差异。
实施例12电镜观察DP7-C胶束/siRNA复合物形态
由于DP7带阳电荷,使得所自主装形成的DP7-C胶束在水溶液中呈正电,展示出作为一种非病毒基因传输,特别是siRNA传输载体的潜力。DP7-C通过自主装所形成的胶束及DP7-C/siRNA复合物的形态通过透射电镜(H-6009IV,日立公司,日本)观察。观察前,1mg\mL的胶束溶液用蒸馏水稀释并且涂布于一张铜载网上,并用硝酸纤维素覆盖,随后用磷酸钨酸负染,室温干燥后,于电镜下观察。结果可见DP7-C胶束为球状,分布均一。电镜下DP7-C胶束粒径约为60nm,与siRNA复合后粒径约为100nm(结果见图14)。
实施例13 DP7-C/siRNA复合物体外转染效率检测
转染前24小时,C26小鼠结肠癌细胞或B16小鼠黑色素瘤细胞以5×10
转染结果如图15所示,检测观察均显示:DP7-C能够将FAM修饰的荧光siRNA转染到Ct26(图15c)和B16(图15b)细胞中,其转染效率分别为42.4±3.5%和53.3±4.0%;而PEI复合物的对应转染效率分别为19.0±1.8%和72.0±4.1%;Lipofectamin2000复合物的对应转染效率分别为29.5±3.2%和25.6±4.2%,这也能够从图15a中直观体现出来。我们的结果显示,DP7-C胶束相对于PEI25K和Lipofectamin2000具有更高的siRNA转染效率。
实施例14 DP7-C细胞毒性检测
阳离子的细胞毒性是制约siRNA转染应用的重要因素之一。我们通过细胞存活实验检测DP7-C胶束对正常细胞——293T人胚肾细胞株的毒性。293T细胞以每孔3×10
检测结果如图16所示,PEI25K和Lipofectamin2000均展示出极强的毒性,其IC
实施例15 DP7-C传输VEGF siRNA治疗C26小鼠结肠癌腹腔转移瘤模型
为了进一步表征DP7-C胶束在肿瘤治疗中的应用潜力,我们建立了C26小鼠结肠癌腹腔转移模型,并使用DP7-C传输抗VEGF的siRNA治疗基因用于治疗研究。
(1)建立腹腔转移模型:第0天时,6-8周龄雌性BALB/c小鼠腹腔注射0.1mL细胞悬液(约含1×10
(2)第3天时,小鼠被随机分为4组,每组8只并标记。
(3)4组小鼠分别腹腔注射10次剂量的生理盐水(空白对照组)、空白DP7-C胶束(17.5μg)、DP7-C/无义对照siRNA(Scramble siRNA)复合物(17.5μg/3.5μg)、或DP7-C/VEGFsiRNA复合物(17.5μg/3.5μg)。
(4)第20天时,当对照组的小鼠已经非常虚弱时,断颈法处死所有的小鼠,其腹腔内肿瘤组织以及心、肝、脾、肺和肾脏组织被立即采集、称重和分析。每组小鼠的腹水体积也同样被收集和测量,对每个实验组的肿瘤组织进行CD31免疫组化染色分析;对所收集的心、肝、脾、肺、肾组织进行HE染色分析。
图17显示了使用DP7-C/VEGF siRNA复合物经过腹腔注射治疗腹腔转移C26肿瘤模型的效果。图17a为每组动物中具有代表性的小鼠的腹腔照片。其中,DP7-C/VEGF siRNA复合物治疗组的平均肿瘤重量为1.07±0.5g,生理盐水对照组重量为8.82±0.63g,空载DP7-C组重量为7.94±0.53g,DP7-C/无义对照siRNA复合物为5.3±0.72g(图17c)。用DP7-C/VEGF siRNA复合物治疗的小鼠的腹腔转移肿瘤结节数量相对于其他治疗组明显更少。因此,用DP7-C/VEGF siRNA复合物治疗的小鼠的肿瘤生长得到了极大的抑制。
同时,如同图17b显示,各组的小鼠所产生的腹水体积差别具有显著性差异。DP7-C/VEGF siRNA复合物治疗组的平均肿瘤重量为0.2±0.1mL,生理盐水对照组重量为1.17±0.4mL,空载DP7-C组重量为1.17±0.51mL,DP7-C/无义对照siRNA复合物为0.58±0.11mL。没有使用DP7-C/VEGF siRNA复合物治疗的各组小鼠的腹水呈明显的血样红色,证实这些组的小鼠存在严重的肠系膜损伤。相对于其他实验组,DP7-C/VEGF siRNA复合物更有效地抑制了C26腹腔转移肿瘤模型的生长,以及所伴随的严重肿瘤浸润和炎症的产生。
此外,CD31免疫组化染色结果显示,相对于其他三个实验组,DP7-C/VEGF siRNA复合物治疗组的肿瘤组织中,新生血管的数量更少,证实DP7-C通过传输抗VEGF的siRNA更有效地抑制了肿瘤组织血管的生成(图17d)。此外,HE染色结果显示(图17e),DP7-C胶束通过腹腔关注给药并未在主要脏器组织中产生明显的病理变化,证实DP7-C的副作用较小。
实施例16 DP7-C传输VEGF siRNA治疗C26小鼠结肠癌皮下移植瘤模型
为了进一步表征DP7-C胶束在肿瘤治疗中的应用潜力,我们建立了C26小鼠结肠癌皮下移植瘤模型,并使用DP7-C传输抗VEGF的siRNA治疗基因用于治疗研究。
(1)第0天时,6-8周龄雌性BALB/c小鼠皮下接种0.1mL细胞悬液(约含1.5×10
(2)第8天时,待扪及肿瘤,小鼠被随机分为4组,每组8只并标记。
(3)小鼠分别瘤内注射10次剂量的生理盐水(空白对照组)、空白DP7-C胶束(25μg)、DP7-C/无义对照siRNA复合物(25μg/5μg)、或DP7-C/VEGF siRNA复合物(25μg/5μg)。
(4)第20天时,当对照组的小鼠已经非常虚弱时,断颈法处死所有的小鼠,其腹腔内肿瘤组织以及心、肝、脾、肺和肾脏组织被立即采集、称重和分析。每组小鼠的腹水体积也同样被收集和测量,对每个实验组的肿瘤组织进行CD31免疫组化染色分析;对所收集的心、肝、脾、肺、肾组织进行HE染色分析。
图18显示了使用DP7-C/VEGF siRNA复合物经过瘤内注射治疗C26皮下移植肿瘤模型的效果。图18a展示的是每组动物中小鼠皮下肿瘤的照片。其中,DP7-C/VEGF siRNA复合物治疗组的平均肿瘤体积为261.4±115.51mm
此外,CD31免疫组化染色结果显示(图18c),相对于其他三个实验组,DP7-C/VEGFsiRNA复合物治疗组的肿瘤组织中,新生血管的数量更少,证实DP7-C通过传输抗VEGF的siRNA更有效地抑制了肿瘤组织血管的生成。此外,HE染色结果显示(图18d),DP7-C胶束通过腹腔关注给药并未在主要脏器组织中产生明显的病理变化,证实DP7-C的副作用较小。
实施例17 DP7-C传输VEGF siRNA治疗B16小鼠黑色素瘤肺转移瘤模型
为了进一步表征DP7-C胶束在肿瘤治疗中的应用潜力,我们建立了B16小鼠黑色素瘤肺转移瘤模型,并使用DP7-C传输抗VEGF的siRNA治疗基因用于治疗研究。
(1)第0天时,6-8周龄雌性C57小鼠皮下接种0.1mL细胞悬液(约含2.5×10
(2)第3天时,小鼠被随机分为4组,每组8只并标记。
(3)小鼠分别尾静脉注射7次剂量的生理盐水(空白对照组)、空白DP7-C胶束(60μg)、DP7-C/无义对照siRNA复合物(60μg/12μg)、或DP7-C/VEGF siRNA复合物(60μg/12μg)。
(4)第20天时,当对照组的小鼠已经非常虚弱时,断颈法处死所有的小鼠,其肺部肿瘤组织以及心、肝、脾、肺和肾脏组织被立即采集、称重和分析;对所收集的心、肝、脾、肺、肾组织进行HE染色分析。
图19显示了使用DP7-C/VEGF siRNA复合物经过静脉注射治疗B16肺转移肿瘤模型的效果。图19a展示的是每组动物中小鼠肺部肿瘤的照片。其中,DP7-C/VEGF siRNA复合物治疗组的平均肿瘤结节数为30±12个,生理盐水对照组为172±16个,空载DP7-C组为132±22个,DP7-C/无义对照siRNA复合物为106±15个。此外,DP7-C/VEGF siRNA复合物治疗组的平均肺组织重量为0.22±0.02克,生理盐水对照组重量为0.52±0.18克,空载DP7-C组重量为0.41±0.1克,DP7-C/无义对照siRNA复合物为0.42±0.17克。用DP7-C/VEGF siRNA复合物治疗的小鼠的肺转移肿瘤结节个数相对于其他治疗组明显更少(图19a),小鼠肺部平均重量相对于其他治疗组明显更轻(图19b)。因此,用DP7-C/VEGF siRNA复合物治疗的小鼠的肿瘤生长得到了极大的抑制。
此外,HE染色结果显示(图19c),DP7-C胶束通过腹腔关注给药并未在主要脏器组织中产生明显的病理变化,证实DP7-C的副作用较小。
序列表
<110> 四川大学
<120> 抗菌肽衍生物在制备核酸载体中的用途及核酸载体
<150> 201610517446.0
<151> 2016-07-01
<150> 201610517372.0
<151> 2016-07-01
<160> 1
<170> SIPOSequenceListing 1.0
<210> 1
<211> 12
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 1
Val Gln Trp Arg Ile Arg Val Ala Val Ile Arg Lys
1 5 10
- 抗菌肽衍生物在制备核酸载体中的用途及核酸载体
- 核酸适体衍生物及其在制备药物载体中的应用
