全浆分泌调节剂的评价和/或选择方法
文献发布时间:2023-06-19 18:32:25
技术领域
本发明涉及全浆分泌(holocrine)调节剂的评价和/或选择方法、皮脂腺细胞的三维结构物、皮脂腺细胞的三维结构物的制备方法、全浆分泌调节剂等。
背景技术
皮脂腺附随于具有毛发器官的部分而存在。皮脂腺从在毛孔内表面开口的皮脂腺开口部分泌皮脂。皮脂腺为袋状结构,内部密集堆积有皮脂腺细胞,该皮脂腺细胞的作用是释放皮脂。皮脂由蜡酯、甘油三酯、脂肪酸等构成,该皮脂与汗等水分混合而乳化成皮表膜。该皮表膜也称为皮脂膜,用于保护皮肤表面。
作为皮脂腺大量存在的部位,可举出头皮部分的被发头部、包括鼻部等在内的前额、腋下、胸部、外阴部等。在这些区域附近容易发生皮脂腺所参与的毛孔堵塞等肌肤问题。毛孔堵塞是需要预防、改善或治疗的肌肤问题的一种。
专利文献1中公开了一种成熟人皮脂腺细胞的制备方法,其以提供可形成或蓄积油滴的培养皮脂腺细胞为目的,包括在低氧条件下培养未成熟人皮脂腺细胞的步骤。
非专利文献1中公开一种层叠皮脂腺细胞层而得到的层叠片(非专利文献1)。
另外,还公开有将多个皮脂腺细胞埋入基质胶进行培养,制成成熟的皮脂腺细胞聚集在中心部分的球状体(非专利文献2)。
现有技术文献
专利文献
专利文献1:日本特开平4-35718号公报
非专利文献
非专利文献1:Christine Barrault,et al.,ExperimentalDermatology.2012Apr,21(4):314-316.
非专利文献2:Alona Feldman,et al.,Nature.Communications.2019;10:2348
发明内容
发明要解决的问题
很长时间以来一直认为粉刺(以下也称为“毛孔堵塞”)的形成是由于角质层增厚阻塞毛孔出口,并且皮脂在毛孔内部堆积固化。此外,以往着眼于皮脂产生量作为毛孔堵塞的原因之一,并且主要研究了如专利文献1~3所记载的用于评价皮脂产生量的实验系统并加以利用。
但是,这种现有的观点无法解释在毛孔出口打开的状态下毛孔发生堵塞的病状、即开放性粉刺和微粉刺的形成。由此,毛孔堵塞形成的详细机制仍然无法解释。
因此,本发明的主要目的在于提供一种与毛孔堵塞形成相关的技术。
用于解决问题的手段
本发明人对毛孔堵塞形成的详细机制进行了深入研究,结果发现毛孔堵塞形成与皮脂腺细胞的全浆分泌存在关联。更具体而言,本发明人发现通过对皮脂腺细胞调节自噬条件可调节皮脂腺细胞的全浆分泌状态(正常或异常),以及该皮脂腺细胞的全浆分泌状态参与毛孔堵塞形成。
本说明书中,皮脂腺细胞在细胞内生产和存储皮脂,最终细胞死亡破裂而将皮脂腺细胞内的皮脂分泌到外部,将该分泌形式称为全浆分泌。
此外,本发明人进一步研究了与皮脂腺细胞的全浆分泌调节相关的技术,结果首次发现从发出荧光的活皮脂腺细胞的状态来看,若发生全浆分泌,则皮脂腺细胞的荧光消失,另一方面,若不发生全浆分泌,则皮脂腺细胞的荧光维持。而且,本发明人首次发现了通过经时对发出荧光的皮脂腺细胞的状态进行荧光观察能够经时把握皮脂腺细胞的全浆分泌的状态,以及对皮脂腺细胞的全浆分泌调节条件,并且首次发现了使用该技术的全浆分泌调节剂的评价和/或选择方法。此外,本发明人首次发现了能够更好地观察皮脂腺细胞全浆分泌的新型皮脂腺细胞的三维结构物及其制备方法。
这样,在本发明中,作为与毛孔堵塞形成相关的技术,可提供对皮脂腺细胞有效的全浆分泌调节剂的评价和/或选择方法、含有通过该方法选择得到的物质的全浆分泌调节剂、新型的皮脂腺细胞的三维结构物及其制备方法。
即,本发明如下。
本发明提供一种全浆分泌调节剂的评价和/或选择方法,包括以下工序,
观察工序:使单个或多个皮脂腺细胞与受试物质存在之后,对发出荧光的皮脂腺细胞的状态进行荧光观察;以及
判别工序:根据所述发出荧光的皮脂腺细胞的状态,将所述受试物质判别为全浆分泌调节剂或全浆分泌调节剂的候选。
全浆分泌调节剂可以是选自全浆分泌促进剂、全浆分泌抑制剂、毛孔堵塞形成调节剂、以及皮脂腺细胞的自噬调节剂中的1种或2种以上。
所述皮脂腺细胞可以是由多个皮脂腺细胞构成的三维结构物。
所述观察可使用延时摄影进行观察。
所述观察可使用荧光显微镜进行观察。
所述观察工序中,可以在全浆分泌调节条件下,使单个或多个皮脂腺细胞与受试物质存在,对发出荧光的皮脂腺细胞的状态进行荧光观察。
所述全浆分泌调节条件为自噬调节条件,该自噬调节条件可以为自噬抑制条件或自噬诱导条件。
可根据每单位体积的荧光消失细胞数判别所述发出発光的皮脂腺细胞的状态。
另外,本发明提供一种全浆分泌调节剂的评价和/或选择方法,包括以下工序,
观察工序:使单个或多个皮脂腺细胞与受试物质存在之后,对采集的发出荧光的角栓的状态进行荧光观察;以及
判别工序:根据所述发出荧光的角栓的状态判别所述受试物质为全浆分泌调节剂或全浆分泌调节剂的候选。
所述观察工序中的所述角栓是用粘合片从哺乳动物的皮肤表面采集并附着于该粘合片上的多个角栓,和/或
所述判别工序中的所述角栓的状态为将所述受试物质使用后的角栓最大直径的平均值除以使用前的角栓最大直径的平均值而得到的角栓最大直径的变化率。
本发明提供一种全浆分泌调节剂,其以选自低聚糖和大环内酯化合物中的1种或2种化合物作为有效成分。
另外,本发明提供一种皮脂腺细胞的三维结构物,其表面层由成熟的皮脂腺细胞构成。
另外,本发明提供一种皮脂腺细胞的三维结构物的制备方法,其中,将播种的多个皮脂腺细胞在研钵状凹部的细胞粘附抑制处理表面上培养,得到皮脂腺细胞的三维结构物。
所述三维结构物可以为球状。
所述三维结构物可用于荧光观察。
可用于全浆分泌调节剂的评价和/或选择方法。
所述研钵状凹部可以是多个皮脂腺细胞可集合于该凹部的底部中心区域的形状。
发明效果
根据本发明,可提供与毛孔堵塞形成相关的技术。应予说明,这里记载的效果并非限定,可以是本说明书中记载的任何效果。
附图说明
图1中A是毛囊器官的截面示意图。图1中B是关于自噬抑制剂的添加对人源皮脂腺导管附近的毛孔堵塞的影响的确认试验的结果。图1中B-1为对照(未添加自噬抑制剂的DMSO溶液)培养后,图1中B-2为在自噬抑制剂(含巴佛洛霉素A1的DMSO溶液)存在下的培养后,图1中B-3为在自噬抑制剂(含MHY1485的DMSO溶液)存在下的培养后。
图2是关于添加自噬抑制剂对人源皮脂腺导管附近的毛孔堵塞的影响的确认试验的结果。从左侧开始依次为培养前、对照(DMSO)存在下的培养后、自噬抑制剂(巴佛洛霉素A1)存在下的培养后、自噬抑制剂(MHY-1485)存在下的培养后的毛-毛囊壁间距离(μm)。*为MEAN±SEM P<0.05,表示存在显著差异。
图3表示将播种的多个皮脂腺细胞在经过细胞粘附抑制处理的研钵状凹部的细胞粘附抑制处理表面上培养而得到的皮脂腺细胞的三维结构物。图3中A是研钵状凹部的底部为V字形时的示意图,图3中B是研钵状的底部为U字形时的示意图。图3中C是表示在研钵状凹部的细胞粘附抑制处理表面(亲水化表面)上培养得到的皮脂腺细胞的三维结构物(球状体)的光学显微镜的照片图。
图4中A是表示将成熟皮脂腺细胞荧光染色时的皮脂腺细胞的三维结构物(球状体)的总体面貌的共焦激光显微镜的照片图。此时,作为成熟标志物,使用脂肪分化相关蛋白(Adipophilin)进行染色。图4中B是图4中A经染色的球状体从表面向中心的深度方向的截面图,是表示本实施方式中得到的球状体中成熟皮脂腺细胞的存在场所的图像。
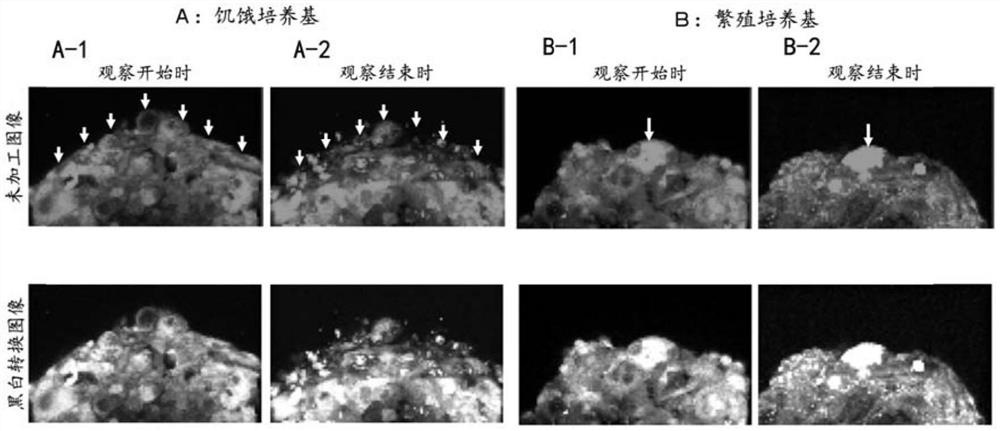
图5中A是使用本实施方式中得到的球状体,在使用了饥饿培养基的自噬诱导条件下培养中的观察开始时(图A-1)以及观察结束时(图A-2)的图像,是表示球状体的表面层存在的皮脂腺细胞破裂而每单位体积的荧光消失细胞数多的延时图像(特别是箭头部分)。图5中B是使用本实施方式中得到的球状体,在使用了繁殖培养基的自噬抑制条件下培养中的观察开始时(图B-1)以及观察结束时(图B-2)的图像,是表示球状体的表面层存在的皮脂腺细胞未破裂而每单位体积的荧光消失细胞数少的延时图像(特别是箭头部分)。
图6是使用本实施方式中得到的球状体和饥饿培养基在自噬诱导条件下培养时的球状体的图像A~C。图6中A~C表示图6中A(视场1:视场框为下部)、图6中B(视场2:视场框为左上部)、图6中C(视场3:视场框为右下框)中的框内每单位体积的荧光消失的细胞数。四边形框:62.4μmx125μmx50μm。由该图像A~C中的视场1~3分别得到荧光消失的细胞,计算出它们的平均值作为每单位体积的荧光消失细胞数,将结果示于图面下段。
图7是使用本实施方式中得到的球状体和饥饿培养基在自噬诱导条件下培养时的球状体的延时图像A~C。图7中A(观察时间600分钟的箭头部分)、图7中B(观察时间610分钟的箭头部分)、图7中C(观察时间620分钟的箭头部分)表示球状体表面层的1个细胞消失荧光的过程。
图8是表示用胶布粘贴去除角栓,对该胶布上的多个角栓照射激发光检测自发荧光,接着再构建这些角栓图像的三维结构,对发出荧光的角栓的状态进行荧光观察的图。
图9是作为连用4周含或不含海藻糖的化妆水对鼻部角栓大小的影响的评价,表示角栓最大直径的变化率的图。角栓最大直径的变化率(样品使用前=1)。无海藻糖组(N=6)平均值1.07500(标准误差0.04200)、有海藻糖组(N=8)平均值0.86644(标准误差0.02755)。对各受试者的样品,计量11~24个角栓的最大直径求出平均值。用受试物质使用后的平均值除以使用前的平均值,算出角栓最大直径的变化率。
具体实施方式
以下对用于实施本发明的方式进行说明。应予说明,以下说明的实施方式表示本发明的代表实施方式的一例,并不由此限定本发明的范围。应予说明,本说明书中,若没有特别说明,“%”表示质量%,使用“~”表示数值范围时,该范围包含两端的数值。另外,数值中的上限值和下限值可根据需要任意组合。
<1.本实施方式所涉及的全浆分泌调节剂的评价和/或选择方法>
作为本发明所涉及的实施方式的一个方面,也可以以提供对皮脂腺细胞的全浆分泌调节剂的评价和/或选择方法为目的。
<本发明第一实施方式的方法>
本发明第一实施方式的方法是全浆分泌调节剂的评价和/或选择方法,包括以下工序。观察工序:使单个或多个皮脂腺细胞与受试物质存在,对发出荧光的皮脂腺细胞的状态进行荧光观察;和/或判别工序:根据所述发出荧光的皮脂腺细胞的状态,将受试物质判别为全浆分泌调节剂或全浆分泌调节剂的候选。在该观察工序中,更适宜在全浆分泌调节条件下进行荧光观察。
作为现有的毛孔堵塞的评价方法,已知有人使用放大镜通过显微镜观察来评价毛孔堵塞是否变小的方法;例如使用VISIA这种面部摄像设备对要评价的部位照射UVA光于暗处进行拍摄,由于毛孔堵塞部分发出红色或淡绿色光,所以采用该方法拍摄,可根据拍摄图像来评价发光毛孔的数量是否减少的方法;若毛孔堵塞则肌肤表面粗糙,所以通过人的触诊断来评价粗糙感触是否减小的方法等。
然而,作为使用这些现有评价方法评价全浆分泌调节剂的方法或全浆分泌调节剂而使用的物质的选定方法中,由于以受试者为对象或者采用感官评价,所以当受试物质数量多时,难以迅速对所有的全浆分泌调节剂进行评价,也难以获得结果的再现性。另外,毛孔堵塞涉及多种机制,因此这些现有评价方法不适合作为毛孔堵塞初期阶段的全浆分泌的直接评价方法。
对此,本发明第一实施方式的方法中,可使用动物细胞进行体外试验,试验的实施或重现也容易进行,因此即使存在多个受试物质也容易进行评价或选定,结果的再现性也较高。此外,本实施方式中,能够使用观察设备(例如荧光显微镜相关设备)和/或全浆分泌调节条件,因此能够更加客观且高精度地评价皮脂腺细胞的全浆分泌调节,而且这些操作并不复杂。
因此,在本实施方式中,能够简便地评价受试物质是否适合作为全浆分泌调节剂和/或选定受试物质作为全浆分泌调节剂(具体而言,具有全浆分泌调节作用的物质)。此外,本实施方式中,客观性高,结果的再现性也良好。
此外,本发明第一实施方式的方法可用于阐释或分析毛孔堵塞的肌肤问题,还能够对毛孔堵塞的肌肤问题提出对策。
例如,作为毛孔堵塞的肌肤问题,可举出毛孔黑头、毛孔张开、毛孔粗糙、毛孔发红、粉刺(痤疮)、脂溢性皮炎等。
本说明书中,毛孔堵塞是指角质层异常堆积堵塞毛孔出口,皮脂在毛孔内部变硬造成堵塞。
本说明书中,毛孔黑头是指堵塞于毛孔的物质被空气氧化而发黑。
本说明书中,毛孔张开是指皮脂在毛孔内部积存变硬导致表面上的毛孔呈扩张状态。
本说明书中,毛孔粗糙是指皮脂在毛孔内部积存变硬导致毛孔略微凸起而感受到的感觉。
本说明书中,认为毛孔发红的发生是由于皮脂在毛孔内部积存变硬导致毛囊内的皮脂组成发生变化或者存在于皮肤(皮脂腺、毛囊内、表层等)的菌种繁殖环境发生变化。
本说明书中,认为粉刺(痤疮)和脂溢性皮炎的发生是由于皮脂在毛孔内部积存变硬导致毛囊内的皮脂组成发生变化或者存在于皮肤(皮脂腺、毛囊内、表层等)的菌种繁殖环境发生变化。
本发明第一实施方式优选包括观察工序和/或判别工序,更优选按先观察工序后判别工序的顺序进行。
本发明第一实施方式更优选包括皮脂腺细胞的培养工序、观察工序和判别工序,更优选依次进行这些工序。
此外,本发明第一实施方式优选在培养工序和观察工序之间包括使皮脂腺细胞与受试物质接触的接触工序,更优选包括培养工序、接触工序、观察工序和判别工序,进一步优选依次进行这些工序。
应予说明,另外,在本发明第一实施方式中的全浆分泌调节剂等的说明中,也可将下文的本发明第二实施方式、“2.”~“3.”的说明适用于本发明第一实施方式,可适当采用。
<1-1.皮脂腺细胞的培养工序>
本发明第一实施方式中,可以在接触工序之前设置皮脂腺细胞的培养工序,也可以省略该培养工序。该培养工序可采用通常的皮脂腺细胞(优选人源)的体外培养条件来进行。该培养工序中,优选播种未成熟的皮脂腺细胞,培养至可全浆分泌的状态。通过该培养工序,能够获得处于可全浆分泌状态的皮脂腺细胞。
本说明书中,“成熟的皮脂腺细胞(或成熟皮脂腺细胞)”是指分化的皮脂腺细胞,在该细胞内具有皮脂,处于可全浆分泌的状态。
本说明书中,“未成熟的皮脂腺细胞(或未成熟皮脂腺细胞)”是用于与上述“成熟皮脂腺细胞”进行区別的用语,是指非上述“成熟皮脂腺细胞”的未分化皮脂腺细胞或细胞内不具有皮脂的皮脂腺细胞。
本发明第一实施方式中的皮脂腺细胞的培养工序优选将多个皮脂腺细胞播种到培养用容器内的培养基中进行培养(参照图3)。该培养基为通常用于增殖、维持、分化等繁殖的动物细胞用繁殖培养基,可适当使用下文<全浆分泌抑制用培养基>中记载的皮脂腺细胞的培养中通常使用的繁殖培养基。
播种的皮脂腺细胞没有特别限定,优选源自哺乳类。作为该哺乳类,可举出人、仓鼠、猪、小鼠、大鼠等,从获得性和培养维持的观点考虑,优选人和/或仓鼠。另外,该皮脂腺细胞也可以使用市售品。另外,源自人时,可举出高加索人种、亚洲人种、非洲人种等,并不限定于此。本实施方式中,可以是其中的任意人种,优选高加索人种。
培养基中皮脂腺细胞的播种浓度优选为1×10
培养用的容器可使用通常的皮脂腺细胞体外培养条件下使用的培养用容器(例如塑料制、玻璃制等),例如可举出培养皿,微孔板(例如6孔型、24孔型等)等细胞培养板等。
皮脂腺细胞的培养工序可采用通常的皮脂腺细胞(优选人源)的体外培养条件,优选在使用繁殖培养基的培养条件下(以下也称为“繁殖培养基培养条件下”)进行。作为培养条件,例如培养基pH优选为7~8左右,培养CO
培养期间没有特别限定,播种后优选为5~15天,更优选为6~13天,进一步优选为7~12天。
培养可在静置、振荡或旋转条件下、优选为静置状态实施,培养基更换可以是平均天数的更换次数,优选为1~3天1次,适宜为1~2天1次。
此外,皮脂腺细胞的培养工序更优选采用下文「2.」中说明的皮脂腺细胞的三维结构物的制备方法。该培养工序中,优选使用用于播种多个未成熟皮脂腺细胞进行培养的具有研钵状凹部的容器。该培养工序更优选将播种的多个皮脂腺细胞在研钵状凹部内面的细胞粘附抑制处理表面(更优选为亲水化表面)上进行培养。
另外,培养工序后的皮脂腺细胞在接触工序或观察工序中使用时优选转移至荧光显微镜用容器,可以在转移时进行接触工序。
应予说明,本发明第一实施方式中,可以使用以实施皮脂腺细胞的培养工序的方式构成的动物细胞用培养装置,该培养装置可以在观察工序中用于维持观察对象。作为该动物细胞用培养装置,例如可具备培养箱、湿度·温度·气体控制部等。
<1-2.接触工序>
本发明第一实施方式优选在观察工序之前设置接触工序。
本发明第一实施方式中的接触工序优选在上述繁殖培养基培养条件下(适宜为下文的球状体制作条件下)使皮脂腺细胞与受试物质接触。通过含有该接触工序,在接下来的观察工序中,能够对受试物质施加于皮脂腺细胞的全浆分泌调节作用更良好地进行荧光观察,由此能够更容易地判别受试物质的全浆分泌调节作用。
接触工序中的接触期间没有特别限定,可考虑受试物质对皮脂腺细胞的全浆分泌调节作用的快慢适当调整。作为全浆分泌调节作用的快慢的原因,例如假定有受试物质的起效速度(即效性、迟效性)、受试物质的溶解度(易溶解性、难溶解性)等,并不限定于此。
从容易高精度地获得荧光观察结果的观点考虑,接触期间优选设置在添加荧光试剂之前。
接触工序中的接触期间优选为与受试物质接触后至少2小时,作为适宜的下限值,更优选为4小时以上,进一步优选为6小时以上,更优选为8小时以上,更优选为12小时以上,作为适宜的上限值,没有特别限定,例如可举出48小时以下、36小时以下、24小时以下等。该适宜的接触期间优选为6~24小时。
应予说明,优选在接触工序后添加荧光试剂对皮脂腺细胞进行荧光观察,但从能够更良好地观察受试物质的全浆分泌调节作用的情况的观点出发,优选在该荧光观察的期间内也在使皮脂腺细胞与受试物质接触的状态下进行观察,此时更优选在全浆分泌调节条件下进行荧光观察。
另外,本发明第一实施方式(优选接触工序之后)优选在荧光显微镜用容器内进行,作为该容器的材质,例如优选为玻璃、塑料以及它们的组合,更具体而言,可举出玻璃底培养皿等,但并不限定于此。该容器内含有皮脂腺细胞时,该容器内优选成为适合采用上述<皮脂腺细胞的培养工序>生成皮脂腺细胞的条件(例如CO
应予说明,本发明第一实施方式中,可以在接触工序之前进行预处理工序,例如使用上述繁殖培养基进行清洗等。
<1-3.观察工序>
以下,对本发明第一实施方式中的观察工序进行说明。
本发明第一实施方式中的观察工序优选为使单个或多个皮脂腺细胞与受试物质存在,对发出荧光的皮脂腺细胞的状态进行荧光观察。由此,能够对受试物质对皮脂腺细胞的全浆分泌调节作用的情况进行荧光观察,还能够获得此时皮脂腺细胞的状态作为观察结果(适宜为观察图像)。例如,考虑与比较对照的差异,还可以将受试物质评价和/或选择为全浆分泌调节剂或全浆分泌调节剂的候选。
观察工序中,培养条件没有特别限定,例如可适当采用上述<1-1.皮脂腺细胞的培养工序>中记载的培养条件等进行。此时使用的培养基没有特别限定,可以是公知或市售等任意培养基,可以考虑荧光观察时发出発光的皮脂腺细胞的状态适当选择培养基。
作为观察工序更优选的方式,是在全浆分泌调节条件下进行所述观察工序,进一步优选在全浆分泌调节条件下,使单个或多个皮脂腺细胞与受试物质存在,对发出荧光的皮脂腺细胞的状态进行荧光观察。
<1-3-1.全浆分泌调节条件>
作为本发明第一实施方式中的全浆分泌调节条件,优选为能够调节皮脂腺细胞(适宜为成熟皮脂腺细胞)中全浆分泌的诱导和全浆分泌的抑制的条件。
作为全浆分泌调节的条件,例如可举出选自生理活性剂(促进剂或抑制剂)等药剂的添加条件、培养基条件(例如培养基组成、温度等)、皮脂腺细胞的状态(例如表面层具有成熟皮脂腺细胞的三维结构物等)等的1种或2种以上的组合,但并不限定于此。
其中,使用培养基条件能够客观地获得高精度、再现性高的观察结果,因而优选。另外,使用皮脂腺细胞的状态容易对全浆分泌调节作用进行荧光观察,因而优选。进一步优选为将培养基条件和皮脂腺细胞的状态组合而成的条件。
本发明第一实施方式中的全浆分泌调节条件优选为全浆分泌诱导条件和/或全浆分泌抑制条件。本发明第一实施方式中,通过采用全浆分泌的诱导条件,成熟的皮脂腺细胞死亡,此时细胞自身破裂,同时包括作为皮脂腺细胞内容物的皮脂在内的分泌物被释放到皮脂腺细胞外。本发明第一实施方式中,通过采用全浆分泌的抑制条件,皮脂腺细胞的细胞不发生破裂而得以维持,从而作为皮脂腺细胞内容物的皮脂等不会释放到皮脂腺细胞外。
<1-3-1-1.自噬调节条件>
作为本发明第一实施方式中的全浆分泌调节条件,更具体而言,优选自噬调节条件。
本实施方式中的自噬调节条件更优选自噬诱导条件和/或自噬抑制条件。通过调节自噬的诱导和/或抑制,能够容易地进行皮脂腺细胞的全浆分泌调节,因此操作性佳,此外,通过采用该条件,好具有全浆分泌调节剂的评价和/或选定相关的精度和再现性高的优点。
关于自噬,通常认为是一种生存系统,当细胞处于饥饿状态时,会分解细胞自身的细胞内小器官或蛋白质来获取营养物质进行再利用。然而,本发明人首次发现当对成熟的皮脂腺细胞诱导自噬时,成熟的皮脂腺细胞能够正常进行全浆分泌。
更详细而言,本发明人首次发现了通过对成熟的皮脂腺细胞诱导自噬,成熟的皮脂腺细胞的细胞膜破裂,皮脂腺细胞的内部成分被分泌到细胞外(参照图5、图6、图7)。这样,通过对成熟的皮脂腺细胞诱导自噬,能够正常诱导皮脂腺细胞的全浆分泌,由此能够使皮脂腺细胞进行正常全浆分泌。
此外,本发明人首次发现通过对成熟的皮脂腺细胞抑制自噬,成熟的皮脂腺细胞的细胞膜不发生破裂(参照图5),另外由此产生的结块会堵塞毛孔的导管等造成毛孔堵塞(参照图1、图2)。
这样,通过对成熟的皮脂腺细胞抑制自噬,能够抑制皮脂腺细胞的全浆分泌,由此能够使皮脂腺细胞异常全浆分泌。
<1-3-1-2.全浆分泌调节的培养基条件>
作为本发明第一实施方式中的全浆分泌调节条件,优选对皮脂腺细胞采用培养基条件。在该培养基条件下,能够观察皮脂腺细胞的全浆分泌调节的状态。
本发明人首次发现通过对皮脂腺细胞调节培养基组成条件,能够容易地调节皮脂腺细胞的全浆分泌。这样,通过采用对皮脂腺细胞调节培养基条件这样的技术,即使不是熟练者,也能够容易地进行皮脂腺细胞的全浆分泌调节。采用该技术,有操作性高、全浆分泌调节剂的评价和/或选定相关的精度和再现性优异的优点。
作为培养基条件,没有特别限定,例如可举出培养基组成、培养基pH、容器中CO
所述培养基条件中,优选调节培养基组成,由此能够容易地调节皮脂腺细胞的全浆分泌,因此具有操作性高、全浆分泌调节剂的评价和/或选定相关的精度和再现性优异的优点。
对于本实施方式的培养基条件下使用的培养基组成,不损害本发明效果的范围内,可以在繁殖用(具体而言增殖、维持、分化等)或饥饿用等的培养基组成中适当添加选自增殖用等的添加剂、抗生素、血清、增殖因子等中的1种或2种以上。
本发明第一实施方式中除了培养基组成的调节以外的培养基条件可采用通常的动物培养细胞的荧光观察条件。该观察工序优选在使皮脂腺细胞存活同时能够进行观察的条件下进行观察,例如可采用通常的人皮脂腺细胞的体外荧光观察条件,也可以采用上述<1-1.培养工序>的培养条件。例如培养基的pH优选为培养pH(7~8)左右,容器中的CO
作为所述培养基组成,优选全浆分泌抑制用培养基和/或全浆分泌诱导用培养基。
本发明第一实施方式通过使用全浆分泌抑制用培养基,能够抑制或阻碍成熟皮脂腺细胞的全浆分泌,因此可用作毛孔堵塞形成的诱导模型。该毛孔堵塞形成的诱导模型中,通过使受试物质存在,能够简便且高精度地进行受试物质作为全浆分泌促进剂的评价或选定。而且能够在使用该全浆分泌抑制用培养基的全浆分泌抑制条件下对受试物质对皮脂腺细胞的全浆分泌促进作用进行荧光观察。通过该观察,能够判别受试物质是否适合预防和改善毛孔堵塞等。
本发明第一实施方式通过使用全浆分泌诱导用培养基,能够诱导或促进成熟皮脂腺细胞的全浆分泌,因此可用作毛孔堵塞形成的抑制模型。该该毛孔堵塞形成的抑制模型中,通过使受试物质存在,能够简便且高精度地进行受试物质作为全浆分泌抑制剂的评价或选定。而且能够在使用该全浆分泌诱导用培养基的全浆分泌诱导条件下对受试物质对皮脂腺细胞的全浆分泌抑制作用进行观察。通过该观察,能够判别受试物质是否参与毛孔堵塞的形成促进等。
<全浆分泌抑制用培养基>
作为全浆分泌抑制条件下使用的全浆分泌抑制用培养基,优选使用通常用于增殖、维持、分化等繁殖的动物细胞培养用繁殖培养基。该动物细胞培养用繁殖培养基可举出基础培养基、减血清培养基、无血清培养基等,但并不限定于此。通过使用通常的繁殖培养基,能够抑制成熟皮脂腺细胞的全浆分泌。
通常基础培养基在含有氨基酸、维生素、无机盐(例如钙)和葡萄糖等碳源的基础培养基成分中进一步添加有血清。无血清培养基是在基础培养基成分中将血清替换成适宜的营养成分和激素成分。
作为本发明第一实施方式中使用的全浆分泌抑制用培养基,优选在基础培养基成分中添加有血清或与血清相同的成分,可以是自噬抑制用培养基。作为全浆分泌抑制用培养基,优选非成为营养饥饿状态这样的不含氨基酸的培养基,更优选为以不成为营养饥饿状态的方式在基础培养基组成中含有氨基酸的繁殖培养基。通过使用该通常的繁殖培养基,能够抑制成熟皮脂腺细胞的全浆分泌。
作为本发明第一实施方式中使用的全浆分泌抑制培养基,更优选通常用于皮脂腺细胞培养的繁殖培养基,更具体而言,例如可举出William’s E Medium、D-MEM、RPMI1640、Ham’s F-12、Modified D-MEM/Ham’s F-12(1:1)(例如SebomedTM basal medium)、EpiLife培养基系列(Thermo Fisher Scientific公司)、HuMedia培养基系列(KURABO公司);CnT-Prime培养基系列(CELLnTEC公司)等的基础培养基。此外,优选在基础培养基中添加选自血清、EGF、氢化可的松、胰岛素等的1种或2种以上,基础培养基中例如血清优选为0.1%~20%,更优选为10%,EGF(Epidermal Growth Factor)优选为1~10ng/mL,更优选为3~6ng/mL,氢化可的松优选为0.1~20μg/mL,更优选为5~15μg/mL,胰岛素优选为5~50μg/mL,更优选为8~20μg/mL。
另外,作为本发明第一实施方式中使用的全浆分泌抑制用培养基,优选使用能够使未成熟的皮脂腺细胞分化的分化培养基,更具体而言,优选不含分化抑制因子(例:EGF、BPE等)或减量的分化培养基。作为该分化培养基,例如可举出William’s E Medium、D-MEM、RPMI-1640、Ham’s F-12、Modified D-MEM/Ham’s F-12(1:1)(例如SebomedTM basalmedium)、EpiLife培养基系列(Thermo Fisher Scientific公司)、HuMedia培养基系列(KURABO公司);CnT-Prime培养基系列(CELLnTEC公司))等,但并不限定于此。
<全浆分泌诱导用培养基>
作为本发明第一实施方式中使用的全浆分泌诱导用培养基,优选为从上述“动物细胞培养用繁殖培养基”的基础培养基成分中去除部分或全部氨基酸的培养基,从诱导成熟皮脂腺细胞的全浆分泌的观点出发,更优选为不含氨基酸的培养基,进一步优选为未添加血清的无血清不含氨基酸培养基。此外,更优选为使动物细胞成为营养饥饿状态的饥饿培养基,例如可举出自噬诱导用培养基等。通过使用营养饥饿培养基,能够诱导成熟皮脂腺细胞的全浆分泌。从诱导成熟皮脂腺细胞的全浆分泌的观点出发,动物细胞培养用培养基中更优选为皮脂腺细胞培养用培养基。
作为全浆分泌诱导用培养基,例如优选为从通常的含氨基酸的D-MEM培养基中去除1种或2种以上或全部而得到的不含氨基酸的D-MEM培养基,从能够更良好地成为营养饥饿状态的观点出发,更优选完全不含氨基酸且无血清的D-MEM培养基。应予说明,通常的D-MEM培养基中,作为氨基酸,含有L-精氨酸盐酸盐、L-胱氨酸、L-谷氨酰胺、甘氨酸、L-组氨酸盐酸盐、L-异亮氨酸、L-亮氨酸、L-赖氨酸盐酸盐、L-甲硫氨酸、L-苯丙氨酸、L-丝氨酸、L-苏氨酸、L-色氨酸、L-酪氨酸和L-缬氨酸。
作为全浆分泌诱导用培养基的一例自噬诱导用培养基,例如可举出无血清的D-MEM(Dulbecco's modified Eagle's medium)、无血清的不含氨基酸D-MEM(高糖(4500mg/L))(含丙酮酸Na(110mg/L)不含氨基酸)(富士胶片和光纯药株式会社制)、Hank'sBalanced Salt Solution(无血清)等,但并不限定于此。其中优选无血清不含氨基酸的D-MEM。
<1-3-1-3.全浆分泌调节的添加药剂条件>
本发明第一实施方式的观察工序中,可以适当使用添加药剂,使单个或多个皮脂腺细胞与受试物质存在,对发出荧光的皮脂腺细胞的状态进行荧光观察。
作为本发明第一实施方式中使用的全浆分泌调节的添加药剂条件,例如可举出全浆分泌促进剂和/或全浆分泌抑制剂的添加条件。
此外,可通过将使用上述“动物细胞培养用繁殖培养基”的培养基条件与全浆分泌促进剂添加条件组合来形成全浆分泌诱导条件。作为全浆分泌促进剂添加条件中使用的添加药剂,例如可举出自噬促进剂等。
另外,可通过将使用上述“动物细胞培养用繁殖培养基”的培养基条件与全浆分泌抑制剂添加条件组合来形成全浆分泌抑制条件。作为全浆分泌抑制剂添加条件中使用的添加药剂,例如可举出自噬抑制剂等。
动物细胞培养用中,更优选皮脂腺细胞培养用。
添加药剂的添加量可参考现有自噬抑制实验或促进实验相关的文献。
通常自噬经历如下工序:(1)称为自噬体的小泡包裹细胞内的降解对象,其后(2)称为溶酶体的降解酶与大量堆积的小泡融合,(3)上述2个小泡融合而成的自溶酶体中将降解对象降解。
作为抑制所述(1)之前的药剂,例如可举出MHY-1485(C
作为抑制所述(1)的初期阶段的药剂,可举出3-Methyladenine(3-MA)等,但并不限定于此。
作为抑制所述(2)(抑制自噬体与溶酶体的融合)的药剂,可举出巴弗洛霉素A1等巴弗洛霉素类、氯喹等,但并不限定于此。
作为所述(3)中的降解酶的抑制剂,可举出胃酶抑素A等,但并不限定于此。
其中,优选mTORC1激活剂(适宜为MHY-1485)和/或自噬体与溶酶体的融合抑制剂(适宜为巴弗洛霉素类)。
可使用选自所述自噬抑制剂中的1种或2种以上。
通过采用使用繁殖培养基的通常培养基条件且用于全浆分泌调节的添加药剂条件,能够容易地调节皮脂腺细胞的全浆分泌,获得所期望的全浆分泌调节条件。在该全浆分泌调节条件下,能够对受试物质对皮脂腺细胞的全浆分泌调节作用进行荧光观察。通过使用该全浆分泌调节条件,能够客观地获得高精度、高再现性的观察结果。
<皮脂腺细胞>
对于本发明第一实施方式中使用的皮脂腺细胞,可以将上述“皮脂腺细胞的培养工序”中事先制备的皮脂腺细胞冷冻保管并根据需要进行使用,本实施方式的工序可以包括皮脂腺细胞的培养工序。
本发明第一实施方式中使用的皮脂腺细胞优选为处于可全浆分泌状态的成熟皮脂腺细胞。
本发明第一实施方式中使用的皮脂腺细胞与二维培养得到的多个细胞相比更优选为三维培养得到的三维结构物。该三维结构物优选为多个细胞聚集并三维化而得到的结构物,例如可举出细胞群、细胞块、三维结构物(更优选为球状体)等,但并不限定于此。
作为皮脂腺细胞的三维结构物,例如可举出层叠片状、管状、棒状、球状体等,但并不现对于此,可以从中选择1种或2种以上。
皮脂腺细胞的三维结构物可通过多个皮脂腺细胞聚集和凝聚而形成。通常球状体是指细胞彼此聚集·凝聚而成的球状细胞聚集体。
此外,本发明第一实施方式中使用的皮脂腺细胞进一步优选为表面层由成熟的皮脂腺细胞构成的皮脂腺细胞的三维结构物(参照图3和4)。从用于全浆分泌观察的观点考虑,更优选该三维结构物具有表面层存在的成熟皮脂腺细胞全浆分泌而消失后其下方的皮脂腺细胞成为表面层这样的构成。进一步优选使用下文“2.”中说明的本实施方式所涉及的皮脂腺细胞的三维结构物。
<受试物质>
本发明第一实施方式等中使用的受试物质没有特别限定,可以是天然由来或人工制备,另外,可以是单体或混合物或者含有单体或混合物的组合物。作为该组合物,例如可以是制剂、化妆料、皮肤外用剂、医药组合物或食品饮料组合物等。
可以适当调整受试物质的浓度,例如可以制备含有不同浓度受试物质的水溶液,用于观察浓度依赖效应。
另外,受试物质优选为选自化合物、微生物或其培养物、提取物、以及它们的混合物、组合物等中的1种或2种以上。化合物可以是无机化合物、有机化合物中的任一者。
作为无机化合物,例如可举出金属元素(主族元素、过渡元素)或非金属元素(硼、硅等)的化合物等,但并不限定于此。
作为有机化合物,为含碳的化合物,例如可举出脂质化合物、糖化合物、肽化合物、核酸化合物、生物碱化合物、甾体化合物(萜烯化合物)、酶、激动剂、拮抗剂、激素、高分子化合物、抗生素等,但并不限定于此。
作为微生物,例如可举出细菌类(例如真细菌、古细菌等)、真菌类(例如霉菌、蕈、酵母等)、微藻类、病毒等以及它们的裂解物等,但并不限定于此。
作为培养物,可举出培养微生物所获得的培养物等,但并不限定于此,例如可以是乳酸菌、双歧杆菌、酵母等有益菌的发酵物。
作为提取物,可举出从天然物(例如动物、植物、微生物等)、有机化合物、无机化合物、培养物、发酵物和矿物等提取得到的物质,但并不限定于此。
<观察>
本发明第一实施方式优选在接触工序后使受试物质存在,对发出荧光的皮脂腺细胞状态进行荧光观察。由此,能够容易对皮脂腺细胞对受试物质的全浆分泌的状态进行荧光观察。更优选在接触工序后在全浆分泌调节条件下进行荧光观察。
作为所述发出荧光的皮脂腺细胞的状态,可根据经时的皮脂腺细胞的荧光发光变化来检测全浆分泌的正常或异常。
关于所述发出荧光的皮脂腺细胞的状态,优选以每单位体积的荧光消失细胞数为基准。对于每单位体积的荧光消失细胞数,在规定区域内且规定观察期间内,1个皮脂腺细胞的荧光消失时计为1。
皮脂腺细胞的全浆分泌正常发生时,在一定期间的观察中,荧光消失的细胞数变多。正常情况下,存活的1个皮脂腺细胞裂解时,蓄积于细胞内部的荧光释放到细胞外,从而荧光消失。特别是在三维结构物的表面层存在的皮脂腺细胞中全浆分泌正常发生时,该皮脂腺细胞的荧光在表面层于短期间内消失。其后,其下方存在的发出荧光的皮脂腺细胞转移至表面层侧,因此三维结构物的表面层看起来是始终发出荧光的状态。
这样,根据观察图像内各皮脂腺细胞的荧光发光的变化,能够高精度地判断受试物质的全浆分泌促进作用。
皮脂腺细胞的全浆分泌异常时,一定期间的观察中,荧光消失的细胞数减少。特别是在三维结构物的表面层存在的皮脂腺细胞中全浆分泌未正常发生而异常时,该皮脂腺细胞的荧光在表面层不会消失而得以维持。
这样,根据观察图像内各皮脂腺细胞的荧光发光的变化,能够高精度地判断受试物质的全浆分泌抑制作用。
<荧光试剂添加工序>
本发明第一实施方式优选在接触工序后对皮脂腺细胞和受试物质添加荧光试剂。此时,由于容易判别皮脂腺细胞的全浆分泌状态(正常或异常),所以优选使活细胞发出荧光。对皮脂腺细胞和受试物质添加荧光试剂时,更优选在接触工序后的全浆分泌调节条件下进行。
荧光试剂是含有荧光色素的荧光试剂,该荧光色素具有使活细胞发出荧光同时细胞死亡后荧光消失的特性。本实施方式的荧光观察中,更优选为含有使活皮脂腺细胞至少能够发出荧光的荧光色素的荧光试剂。通过使用这样的荧光试剂,能够经时求出每单位体积的荧光消失细胞数,此外,根据每单位体积的荧光消失细胞数,能够检测皮脂腺细胞数的经时变化。
作为荧光试剂,例如可使用市售品Live/Dead(TM)试剂盒,作为该试剂盒,例如可举出live/dead(TM)Cell Imaging Kit(488/570)(Thermo Fisher Scientific公司)等,但并不限定于此。可按照这种市售品试剂盒中附带的使用说明的记载步骤,观察发出荧光的或皮脂腺细胞的状态。
例如以绿色荧光观察皮脂腺细胞的活细胞时,激发光的波长优选为480~490nm,此时的检测光的波长优选为490~580nm。
<荧光显微镜观察工序>
本发明第一实施方式的观察优选使用荧光显微镜进行观察。该荧光显微镜例如可使用选自激光、超高压汞灯、氙灯和LED(紫外线LED等)等中的1种以上作为光源。作为该荧光显微镜,例如可举出不以激光为光源的简易荧光显微镜、激光扫描型显微镜、共焦激光扫描显微镜等共焦激光显微镜、双光子激光扫描激发显微镜等多光子激发显微镜、光片荧光显微镜等,可使用选自其中的1种或2种以上。应予说明,通常简易荧光显微镜例如主要使用选自超高压汞灯、氙灯、可照射紫外线的LED等中的1种以上的光源,可将试样作为二维结构物进行观察。其中,从能够将试样作为三维结构物进行观察的观点考虑,优选激光扫描型显微镜、共焦激光显微镜、多光子激发显微镜和光片荧光显微镜,更优选共焦激光显微镜。
此外,本发明第一实施方式的荧光观察中,优选使用图像解析软件(更优选为高精细3D/4D图像解析软件)对所观察的皮脂腺细胞进行图像解析。本实施方式的观察工序中,可以将构成为进行荧光显微镜观察的观察部、构成为对观察对象进行拍摄的拍摄部、构成为对所拍摄的观察图像进行图像解析的图像解析部等以及具备上述各部的公知或市售装置中的1种或2种以上组合来使用。作为该公知或市售装置,例如可举出共焦激光显微镜装置(例如卡尔蔡司LSM800)和安装有图像解析软件(优选3D/4D图像解析软件(例如高精细3D/4D图像解析软件(Imaris))进行执行的图像解析装置(例如计算机等)等,但并不限定于此。应予说明,通常3D/4D图像解析软件能够实现图像数据的多维可视化(例如立体图像构建)和3D/4D图像的解析(例如定量解析)。
本发明第一实施方式的观察中,优选将照射了照射光的观察对象拍摄为观察图像(动态图像和/或静止图像)。通过对观察对象的皮脂腺细胞照射照射光(激发光),能够使该皮脂腺细胞发出荧光并进行检测,该发光的皮脂腺细胞为活细胞。
从减轻对观察对象(皮脂腺细胞)的损坏的观点考虑,照射的光优选拍摄时从照射部照射而除了拍摄时以外不照射。观察图像优选存储于内部或外部存储部。
另外,优选将观察对象整体中的“某区域”设定为“视场”,在规定期间观察该视场内的荧光消失细胞数。该视场的设定位置可任意设定,视场数可以是单个或多个(例如1~5等),优选将视场数设为3个。另外,1个视场的范围优选设定为50~70μm×100~140μm×25~70μm。该规定期间优选为自荧光试剂添加后(起点)的观察时间,没有特别限定,优选为8~20小时,更优选为10~15小时,进一步优选为11~13小时。优选在开始观察皮脂腺细胞时开始拍摄该皮脂腺细胞。
优选算出1个视场中每单位体积的荧光消失细胞数,更优选算出多个视场中每单位体积的荧光消失细胞数的平均值。
观察对象为三维结构物时,优选在自表面至深度方向(中心部方向)100μm的范围内,从三维结构物的表面开始向内部的中心部以0.5~2μm(优选1μm)逐渐改变焦点面进行拍摄。通过将由此拍摄到的各焦点面的图像进行立体重建,可以对三维结构物进行三维表示和评价。
本发明第一实施方式的观察优选使用延时摄影进行观察,由此能够在时间序列中以规定间隔获得多个观察图像(优选静止图像)而获得延时图像。基于该延时图像观察皮脂腺细胞的状态,能够判别受试物质对皮脂腺细胞的全浆分泌调节作用。优选根据该延时图像对规定期间且规定视场内的荧光消失细胞数进行计数。
通常,“延时图像”被称为低速摄影或微速摄影,是一种逐帧拍摄数秒(或数分)并将所得图像连接回放,由此呈现出逐帧图像的拍摄方法。另外,也可以事先获得视频,从该视频中以规定间隔获取多份图像数据作为静止图像,形成延时图像这种图像数据。
本发明第一实施方式中,延时图像的拍摄条件可适当设定。例如可通过按时间序列拍摄并存储包含在照射光的作用下从观察对象发出的荧光的观察图像来获得延时图像。优选在拍摄延时图像时或之前从光源对观察对象照射照射光(激发光),由此能够减轻观察对象的损坏,能够长时间进行荧光观察。
具体而言,拍摄间隔短时,照射光对皮脂腺细胞的损坏量大,因此皮脂腺细胞的荧光可能会消失,另一方面,拍摄间隔长时,可能会漏拍受试物质对皮脂腺细胞的全浆分泌调节作用中的重要图像。
因此,拍摄条件中每帧的拍摄间隔(以分钟为单位)优选为每帧3~20分钟,更优选为每帧5~15分钟,进一步优选为每帧8~12分钟,更优选为每帧9~11分钟(更优选10分钟)。由此能够减轻对皮脂腺细胞的损坏,同时能够以高精度长时间观察皮脂腺细胞的全浆分泌状态。
另外,拍摄条件中的拍摄时间优选为8~20小时,更优选为10~15小时,进一步优选为11~13小时。拍摄时间的起点没有特别限定,优选为荧光试剂添加后。
另外,更适宜的拍摄条件是拍摄间隔优选为每帧9~11分钟(更优选10分钟),拍摄时间优选为11~13小时(更优选60~90帧,进一步优选为66~78帧)。
应予说明,本发明第一实施方式中,更优选使用构成为可对观察对象照射照射光(激发光),检测从观察对象发出的荧光,可对观察对象进行荧光观察的荧光检测装置。该荧光检测装置更优选具备显微镜,此外优选具备构成为对观察对象(优选发出荧光的皮脂腺细胞)照射照射光(激发光)的光源(例如激光、LED等)、构成为接收来自观察对象的荧光并进行检测的检测部(例如图像传感器等)、以及构成为对该观察对象进行拍摄的拍摄部。该激发光和检测光可根据所使用的荧光试剂适当设定。
作为荧光检测装置,例如可举出荧光显微镜装置、共焦激光显微镜装置、多光子激发显微镜装置以及光片显微镜装置等,只要是能够对观察对象进行荧光观察的装置即可,并不限定于此。其中,由于能够对观察对象进行三维观察,优选选自共焦激光显微镜装置、多光子激发显微镜装置和光片显微镜装置中的1种或2种以上,更优选共焦激光显微镜装置。例如共焦激光显微镜装置能够从光源照射激光,以物镜聚焦于观察对象(皮脂腺细胞),获得从该观察对象发出的荧光作为检测光。另外,例如光片显微镜装置可从光源仅对观察对象的焦点面照射片状的激发光,获得从该观察对象发出的荧光作为检测光,由此获得光学切片图像。
荧光检测装置可用CCD、CMOS等图像传感器拍摄观察对象,经时监测观察对象的状态。荧光检测装置例如能够进行模拟图像信号的AD(Analog to Digital)转换或拍摄信号处理等拍摄处理。对于荧光检测装置,用于观察而输出的图像可以是彩色图像或黑白图像中的任一者,但优选彩色图像。彩色图像例如可通过RGB(红、绿、蓝)表示,黑白图像例如可通过亮度来表示。
荧光检测装置优选进一步具备构成为可延时摄影的延时摄影装置,或者以能够对外部发送和接收信息的状态在外部设有延时摄影装置。该延时摄影装置优选构成为可按上述延时图像的拍摄条件进行实施。另外,荧光检测装置可在外部或内部设有构成为对所拍摄的观察图像进行图像解析的图像解析部或装置。
<1-4.判别工序>
以下对本发明第一实施方式中的判别工序进行说明。
本发明第一实施方式的判别工序优选根据所述发出荧光的皮脂腺细胞的状态将受试物质判别为全浆分泌调节剂或全浆分泌调节剂的候选。
本发明第一实施方式中,可根据每单位体积的荧光消失细胞数来判别发出荧光的皮脂腺细胞的状态。通过以该每单位体积的荧光消失细胞数为指标,能够客观且简便地判别受试物质对皮脂腺细胞的全浆分泌调节作用。
更具体而言,荧光消失细胞数多时,可判别为受试物质具有更强全浆分泌促进作用,另一方面,该荧光消失细胞数少时,可判别为受试物质具有更强的全浆分泌抑制作用。
作为更优选的方式,可根据全浆分泌调节条件下的荧光消失细胞数进行判别。进一步优选,全浆分泌抑制条件下荧光消失细胞数多时,可判别为受试物质具有更强的全浆分泌促进作用,另一方面,全浆分泌诱导条件下该荧光消失细胞数少时,可判别为受试物质具有更强的全浆分泌抑制作用。
本发明第一实施方式中,作为评价受试物质的全浆分泌调节作用的方法,例如可举出以下(1)~(3),但并不限定于此。
例如(1)将全浆分泌调节的阳性对照(指标物质)作为指标。更具体而言,在与阳性对照的比较中,受试物质的每单位体积的荧光消失细胞数与阳性对照的每单位体积的荧光消失细胞数为同等程度时,将受试物质评价为全浆分泌调节剂和/或将受试物质选定为具有全浆分泌调节作用的物质。对于该同等的基准,将阳性对照的每单位体积的荧光消失细胞数设为100%时,受试物质的每单位体积的荧光消失细胞数例如为100%±30%,优选为100%±20%,更优选为100%±10%。例如为使用饥饿培养基作为阳性对照的培养中的荧光细胞消失数的100%±30%时,可将受试物质判别为全浆分泌促进剂或全浆分泌促进剂的候选,选定为具有全浆分泌促进作用的物质。另外,例如为使用繁殖培养基作为阳性对照的培养中的荧光细胞消失数的100%±30%时,可将受试物质判别为全浆分泌抑制剂或全浆分泌抑制剂的候选,选定为具有全浆分泌抑制作用的物质。所比较的两者的观察期间优选相同。
更具体而言,作为一例,在与促进全浆分泌的阳性对照的对比中,受试物质为与该阳性对照同等程度以上的荧光消失细胞数时,可将受试物质评价或选定为全浆分泌促进剂。例如可将该“促进全浆分泌的阳性对照的每单位体积的荧光消失细胞数”设定为“使用饥饿培养基无添加受试物质的每单位体积的荧光消失细胞数”,优选使所比较的两者的延时摄影期间相同。将受试物质评价或选定为全浆分泌促进剂时,优选在全浆分泌抑制条件下进行。
另外,作为一例,在与抑制全浆分泌的阳性对照的对比中,受试物质为与该阳性对照同等程度以下的荧光消失细胞数时,可将受试物质评价或选定为全浆分泌抑制剂。例如可将该“抑制全浆分泌的阳性对照的每单位体积的荧光消失细胞数”设定为“使用繁殖培养基无添加受试物质的每单位体积的荧光消失细胞数”,优选使所比较的两者的延时摄影期间相同。将受试物质评价或选定为全浆分泌抑制剂时,优选在全浆分泌诱导条件下进行。
例如(2)受试物质浓度依赖性地增加全分泌调节作用。更具体而言,使用多个不同浓度的受试物质进行上述观察工序,获得各浓度的每单位体积的荧光消失细胞数,求出这些荧光消失细胞数与浓度的相关系数,判断相关关系的程度。此时,优选当相关系数为0.4以上时,判断为受试物质的效果具有浓度依赖性,将受试物质评价为全浆分泌调节剂和/或将受试物质选定为具有全浆分泌调节作用的物质。相关系数为0.7以上时,判断为相关性更强,可判别为具有更强的全浆分泌调节作用的可能性高。这些观察期间优选相同。
更具体而言,作为一例,受试物质的浓度与荧光消失细胞数的相关系数为0.4以上且显示出具有全浆分泌促进作用的倾向(正)时,可判断为受试物质具有全浆分泌促进作用,可将受试物质评价或选定为全浆分泌促进剂。将受试物质评价或选定为全浆分泌促进剂时,优选在全浆分泌抑制条件下进行。
另外,作为一例,受试物质的浓度与荧光消失细胞数的相关系数为0.4以上且显示出具有全浆分泌抑制作用的倾向(负)时,可判断为受试物质具有全浆分泌抑制作用,可将受试物质评价或选定为全浆分泌抑制剂。将受试物质评价或选定为全浆分泌抑制剂时,优选在全浆分泌诱导条件下进行。
例如(3)对多个受试物质进行排序。更具体而言,根据多个受试物质的观察工序,获得各受试物质的每单位体积的荧光消失细胞数,根据该荧光消失细胞数,可判别受试物质的全浆分泌调节作用的强弱顺序。此外,可按照与上述(1)的阳性对照接近的值来排序,另外,优选按照上述(2)的相关系数的高低顺序来排序。这些观察期间优选相同。
此外,具体而言,作为一例,使用多个受试物质分别进行观察工序,根据各自的荧光消失细胞数,按照荧光消失细胞数多少对受试物质降序排序。从该顺位的上位,作为具有强全浆分泌促进作用的顺位,可将受试物质评价或选定为全浆分泌促进剂或其候选。将受试物质评价或选定为全浆分泌促进剂时,优选在全浆分泌抑制条件下进行。
另外,作为一例,使用多个受试物质分别进行观察工序,根据各自的荧光消失细胞数,按照荧光消失细胞数多少对受试物质升序排序。从该顺位的上位,作为具有强全浆分泌抑制作用的顺位,可将受试物质评价或选定为全浆分泌抑制剂或其候选。将受试物质评价或选定为全浆分泌抑制剂时,优选在全浆分泌诱导条件下进行。
根据该评价或选定结果,将上述(1)或(2)的方法可进一步提高该结果的精度。另外,根据该评价或选定结果,可对上位者进行体内试验、人等动物评价试验等。
<全浆分泌调节剂的评价和/或选定>
通过本发明第一实施方式,能够评价受试物质是否适合作为全浆分泌调节剂和/或能够简便地选定受试物质作为全浆分泌调节剂(具体而言具有全浆分泌调节作用的物质)。
作为该全浆分泌调节剂,没有特别限定,例如可举出皮脂腺细胞的全浆分泌调节剂(更优选为全浆分泌促进剂、全浆分泌抑制剂)、毛孔堵塞形成调节剂(更优选为毛孔堵塞形成促进剂、毛孔堵塞抑制剂)、以及皮脂腺细胞的自噬调节剂(更优选为自噬促进剂、自噬抑制剂)等,可从中选择1种或2种以上。
通过本发明第一实施方式,作为全浆分泌调节剂,评价和/或选定的受试物质可选定为具有全浆分泌调节作用的物质。由此,该选定的物质可以进一步进行体外试验、体内试验、人等动物评价试验,进一步确认全浆分泌调节作用。
采用本发明第一实施方式的方法得到的选定物质,如下文所述,可含有在全浆分泌调节剂中发挥全浆分泌调节作用。
另外,在本发明第一实施方式的全浆分泌调节剂等的说明中,也可将下文的“3.”的说明适用于<全浆分泌调节剂的评价和/或选定>,可适当采用。
<本发明第二实施方式的方法>
本发明第二实施方式的方法的说明中,适当省略与上述<第一实施方式的方法>重复的全浆分泌、受试物质、全浆分泌调节剂、荧光显微镜等、图像解析软件等各构成等的说明,该<第一实施方式的方法>和下文“2.”、“3.”的说明也适用于本发明第二实施方式,可适当采用该说明。
本发明人通过下文〔实施例〕的<实验例1>等对以下内容进行了说明:毛孔堵塞形成与皮脂腺细胞的全浆分泌存在关联性;培养后的皮肤片的毛孔导管部分处于全浆分泌不全的趋势时,皮脂腺细胞的破裂、消化的不良等导致的皮脂腺细胞的遗骸、皮脂、角质层等堆积,作为堆积物的角栓横向膨胀,遗骸等无法排出到外部。而且,本发明人发现,不测量毛孔出口的直径,采集堵塞于该毛孔内部的角栓,测量成为堵塞原因的角栓膨胀最大时的最大直径,由此能够推测出皮脂腺细胞的全浆分泌是否正常发生。
因此,本发明第二实施方式的方法可提供全浆分泌调节剂的评价和/或选择方法,其包括:观察工序,使单个或多个皮脂腺细胞与受试物质存在之后,对采集的角栓状态进行荧光观察;和/或判别工序,根据所述发出荧光的角栓状态,将受试物质判别为全浆分泌调节剂或全浆分泌调节剂的候选。另外,发出荧光的角栓的状态可以不采用感官评价,因此还具有能够进行包括精度更高地判别为全浆分泌调节剂或全浆分泌调节剂的候选的判别工序的全浆分泌调节剂的评价和/或选择方法这样的优点。
由此,采用本发明第二实施方式的方法,当以提供与毛孔堵塞形成相关的技术作为主要目的时,可实现该目的。更详细而言,本发明第二实施方式的方法在以不评价皮肤表面的毛孔直径的变化(即外观上的毛孔状态),更简便地推测全浆分泌状态,提供全浆分泌调节剂的评价和/或选择方法等为主要课题时,还能够解决该课题。
此外,本发明第二实施方式的方法可用于毛孔堵塞的肌肤问题的阐明或解析,还可提出解决毛孔堵塞的肌肤问题的对策。
本发明第二实施方式的方法可在人评价试验和使用人以外的哺乳动物(小鼠、大鼠、猪等)的动物评价试验或使用含有毛囊皮脂腺部的哺乳动物(人、猪等)的皮肤片的试验中进行,用于判别或评价受试物质是否具有全浆分泌调节作用。由此可提供一种选地方法,从受试物质中的全浆分泌调节剂的评价和/或受试物质中选定可用作全浆分泌调节剂的有效成分的物质。
所述全浆分泌调节剂优选为选自全浆分泌促进剂、全浆分泌抑制剂、毛孔堵塞形成调节剂和皮脂腺细胞的自噬调节剂中的1种或2种以上。
本发明第二实施方式优选包括观察工序和/或判别工序,更优选按从观察工序至判别工序的顺序进行。
本发明第二实施方式更优选包括接触工序、观察工序和判别工序,进一步优选依次进行这些工序。
<接触工序>
本发明第二实施方式中的接触工序优选为使单个或多个皮脂腺细胞与受试物质存在。
此外,本发明第二实施方式中,作为所述动物评价试验中的接触工序,更优选使作为受试动物的哺乳动物的皮肤表面与受试物质或含有受试物质的试样接触。通过使皮肤与受试物质接触,受试物质也与存在于毛囊皮脂腺部等的单个或多个皮脂腺细胞接触。
作为哺乳动物,没有特别限定,优选为选自人、猪、小鼠、大鼠等中的1种或2种以上。另外,考虑到性别和年龄导致的皮脂分泌的差异,可适当设定男性(雄性)、女性(雌性)、儿童、成人(青年(15~34岁)、中年(35~64岁)、老年(65岁以上)等)等。
哺乳动物的接触部位没有特别限定,优选皮脂分泌多的部位,例如皮脂腺多的部位(人的情况下,例如为头皮、鼻部、额头等),为人时,更优选为鼻部。另外,接触部位优选为了调整受试动物间角栓的形成期间而去除一次角栓后再次形成角栓的部位。
接触工序中,优选以单个或多个皮脂腺细胞与受试物质能够存在的方式给药受试物质。作为给药,没有特别限定,例如可举出注射、涂布、喷雾、渗透、经口等,但并不限定于此。其中,优选非侵入性给药,例如涂布、喷雾、渗透等。给药受试物质时,可以制备成含有受试物质的试样,作为该试样,例如可举出含有受试物质的化妆料或皮肤外用剂等。作为该化妆料或皮肤外用剂,例如可举出化妆水、乳液、浸渍袋、皮肤粘贴用片、乳膏剂等,但并不限定于此。
接触条件(例如期间等)没有特别限定,考虑通常的人等动物评价试验设定即可,可以在受试动物的通常生活环境中使用受试物质。给药次数可以是1天给药1次或者1天分多次给药。给药间隔可以是连续或者间断。作为给药期间或接触期间,例如为1周~2个月,优选为2周~6周,更优选为3周~5周。
另外,本发明第二实施方式中,在使用所述皮肤片的试验的情况下,从全浆分泌调节的观点考虑,作为该皮肤片,更优选含有单个或多个毛囊皮脂腺部的哺乳动物的皮肤片。作为该皮肤片,例如可举出从哺乳动物采集的皮肤片、培养该皮肤片而得到的培养皮肤片等,但并不限定于此。该皮肤片可使用生体试样,另外也可以是在对家畜进行食肉处理时采集的皮肤片。
本发明第二实施方式中,可以在使用所述皮肤片的试验中的接触工序前或接触工序中包括培养采集的皮肤片等的培养工序,例如如下文<试验例1>中记载,可以在37℃、5%CO
另外,皮肤片的培养工序中,可适当采用上述<1-3-1.全浆分泌调节条件>的全浆分泌调节的培养基条件等,由此容易进行受试物质的全浆分泌调节的评价或筛选,因此能够调节皮肤片中存在的皮脂腺细胞中的全浆分泌的诱导和全浆分泌的抑制。
另外,本发明第二实施方式中,使用皮肤片的试验中的接触工序中,以受试物质或含有受试物质的试样能与皮肤片的毛囊皮脂腺部中含有的单个或多个皮脂腺细胞接触的方式,对皮肤片以涂布、喷雾、粘贴等方式进行给药,可以将受试物质添加于培养基。该试样与动物评价试验相同,可以制备成通常的化妆料或皮肤外用剂。接触工序的条件可考虑通常的皮肤片的培养条件来设定,例如接触期间没有特别限定,例如可举出1天~4周。
<观察工序>
第二实施方式中的观察工序中,优选使单个或多个皮脂腺细胞与受试物质存在后对采集的角栓的状态进行荧光观察。
所述采集的角栓优选为从接触了受试物质的皮肤表面采集的角栓,更优选为预先去除角栓经过规定期间后从接触了受试物质的皮肤表面采集的角栓。除去后的规定期间没有特别限定,可适当设定,为人的情况下,例如可以设定为3~5周。
对照试验中使用的角栓优选为从不接触受试物质的皮肤表面采集的角栓,更优选为预先去除角栓经过规定期间后从未接触受试物质的皮肤表面采集的角栓。
作为更优选的方式,使用同一受试动物,按照先进行对照试验,接着经过规定期间后使用受试物质进行试验的顺序进行试验,对分别采集的角栓的状态进行荧光观察,由此能够高精度且高效率地进行受试物质的全浆分泌调节的判别。另外,也可以将受试动物分为使用组和对照组以同时期进行。
另外,在开始受试物质有无接触的试验之前,作为前阶段,为了统一受试动物间的角栓的形成时间,减少受试动物间的差异,可以预先去除角栓。
另外,可以设定受试动物的相同皮肤表面部位、近似区域不同皮肤表面部分(例如人鼻部的左右部分、猪背部的左右部分等),同时期进行试验。然后将从未接触受试物质的部分的皮肤表面与接触受试物质的部分的皮肤表面分别采集的角栓的状态进行对比,由此可同时期进行受试物质的全浆分泌的判别。另外,未接触受试物质的部分中,可使用未添加受试物质的试样,或者使用添加有对照药剂的试样(所谓的阴性、阳性)。
作为所述角栓的状态,例如可举出角栓的形状(立体形状或尺寸、其横截面的形状或尺寸等)、角栓的荧光状态(强度、荧光颜色、自发荧光等)等,但并不限定于此。其中,优选未角栓的形状,更优选为立体形状的尺寸(优选角栓的立体形状下的最大直径)。角栓的荧光可使用上述第一实施方式中说明的荧光试剂,但优选不使用荧光试剂的自发荧光。此外,更优选以自发荧光对角栓的立体形状的尺寸进行荧光观察。
应予说明,本说明书中的横截面的形状是指与角栓的立体形状(更优选为纵长的长椭圆体这样的形状)的高度方向垂直的面的形状。另外,角栓的立体形状的三维图像在高度方向上层叠有多个横截面的形状,本说明书中的角栓的最大直径是指在角栓的立体形状中最凸出部分的横截面的直径(参照图8)。
进行荧光观察的角栓优选为用粘合片从作为受试动物的哺乳动物的皮肤表面采集而附着于该粘合片上的多个角栓。
粘合片没有特别限定,只要是作为肌肤角栓除去用片市售的市售品即可。皮肤表面优选为上述接触部位中的任一部位,更优选为鼻部。
本发明第二实施方式中的荧光观察优选对采集的角栓照射激发光,对来自角栓的荧光进行荧光观察。对来自角栓的荧光进行观察时,可以使用公知的荧光试剂使角栓发出荧光,观察该发出荧光的角栓。从操作效率和简便性的观点考虑,更优选对采集的角栓的自发荧光进行荧光观察。通常用于细胞生物学用观察的荧光波长为300~800nm的范围,因此对角栓的自发荧光进行荧光观察时,可以考虑该荧光波长的范围设定激发波长和荧光波长。对角栓的自发荧光进行荧光观察时,可以设定为能够对在激发光(例如550nm左右等)的作用下从角栓发出的全部自发荧光进行检测的荧光波长。作为更具体的优选方式,对角栓照射的激发光(激发波长)为540~570nm左右,用于检测角栓自发荧光的荧光波长为545nm以上(更优选为545~575nm以上)。
本发明第二实施方式中的荧光工序中,优选对1个角栓的单个或多个立体的形状(角栓的总体面貌)进行荧光观察。而且优选以能够层叠1个角栓的横截面形状的层状的方式进行拍摄,进一步优选层叠该层状数据,最终将1个角栓重建成三维图像。
另外,本发明第二实施方式中的荧光观察中,优选计量该1个角栓的直径最大处作为最大直径。此外,优选计量重建的角栓的总体面貌的最大直径。
作为本发明第二实施方式中的荧光工序的更优选方式,对1个角栓的单个或多个立体形状(角栓的总体面貌)进行荧光观察以及计量该1个角栓的直径最大处作为最大直径。对多个角栓进行荧光观察时,优选根据这些角栓的最大直径的合计值/这些角栓的总数求出角栓的最大直径的平均值。
对角栓的状态进行荧光观察时使用的荧光检测装置适当采用上述第一实施方式中说明的荧光检测装置和荧光显微镜等的构成即可,优选为共焦激光显微镜或共焦激光显微镜装置。
本发明第二实施方式中使用的优选荧光检测装置具备构成为进行荧光显微镜观察的观察部、构成为对观察对象进行拍摄的拍摄部、以及构成为对所拍摄的观察图像进行图像解析的图像解析部。
此外,本发明第二实施方式中使用的荧光检测装置优选具备构成为能够对1个角栓的单个或多个立体的形状(角栓的总体面貌)进行荧光观察的观察部,进一步优选具备构成为以能够层叠1个角栓的横截面形状的层状的方式进行拍摄的拍摄部。由此,通过图像解析软件,能够将该层状数据层叠而最终将1个角栓重建成三维图像。另外,荧光检测装置可进一步具备构成为能够求出该1个角栓的直径最大处作为最大直径的图像解析部。
此外,荧光检测装置优选能够对1个角栓的总体面貌进行拍摄,此外具备构成为可使用图像解析软件(优选可构建立体图像的3D/4D图像解析软件,例如ZEN Black Edition或IMARIS等)将所拍摄的角栓图像重建成三维图像的图像解析部,可将重建的角栓图像的数据以能够读取的方式存储在存储部。
此外,更优选使用图像解析软件,由重建的角栓的总体面貌计量该角栓于横向凸出的最大直径,该图像解析软件可存储于荧光检测装置进行执行。
<判别工序>
本发明第二实施方式中的判别工序中,优选根据发出荧光的角栓的状态,将受试物质判别为全浆分泌调节剂或全浆分泌调节剂的候选。由此能够以更高的精度简便地判别受试物质的全浆分泌调节。
作为更优选的方式,所述角栓的状态优选为将使用受试物质后的角栓最大直径的平均值除以使用前角栓最大直径的平均值而求出的角栓最大直径的变化率,可以将受试物质使用前的角栓最大直径的变化率设为1。此时,求出该变化率时的角栓数优选为5~30个,更优选为11~24个。此时的平均值是指将采用图像解析重建的角栓三维图像中角栓最大直径的合计值平均化而得到的平均值。由此能够容易地以高精度判断全浆分泌的状态。
作为进一步优选的方式,将接触工序中未使用受试物质的试验组(即对照试验组)的角栓最大直径的变化率与接触工序中使用了受试物质的组的角栓最大直径的变化率进行对比,判别受试物质的全浆分泌调节。此外,进一步优选通过求出两组角栓最大直径的变化率的平均值并将该两组进行对比,判别受试物质的全浆分泌调节。
作为更优选的方式,对于所述判别工序中所述角栓的状态,将使用了受试物质的组的角栓最大直径的变化率与未使用受试物质的组的角栓最大直径的变化率进行对比,该使用组的变化率小于未使用组的变化率时,判别为受试物质具有全浆分泌促进作用,和/或该使用组的变化率大于未使用组的变化率时,判别为受试物质具有全浆分泌抑制作用。此时,优选受试动物的性別、接触条件(期间等)相同。
例如如图9所示,使用了受试物质(具体而言海藻糖)的受试者(具体而言男性)的角栓最大直径的变化率与对照试验的角栓最大直径的变化率相比变小,由此该受试物质良好地促进全浆分泌,可评价或判别为该受试物质具有全浆分泌促进作用。
<本发明第三实施方式的方法>
作为本发明第三实施方式的方法,可以将第一实施方式的方法和第二实施方式的方法适当组合,例如可以按照先第一实施方式的方法再第二实施方式的方法的顺序进行实施,也可以反过来按照先第二实施方式的方法再第一实施方式的方法的顺序进行实施。由此,能够精度更高地判断受试物质是否具有全浆分泌调节作用。
<1-5.全浆分泌调节剂的评价和/或选择的装置或系统>
应予说明,作为本实施方式的其它方面,可提供全浆分泌调节剂的评价和/或选择用的装置或系统。
本实施方式所涉及的全浆分泌调节剂的评价和/或选择用的装置优选构成为能够执行上述说明的全浆分泌调节剂的评价和/或选择方法(例如第一实施方式的方法、第二实施方式的方法和将它们组合而成的方法),更优选具备构成为能够执行上述全浆分泌调节剂的评价和/或选择方法的控制部。可以进一步设置该控制部或具备该控制部的装置与其它部(单元或部分)或其它装置可通过无线和/或有线发送和接收信息的通信部。
本实施方式的装置或系统优选具有具备所述控制部的管理装置和/或含有荧光显微镜的荧光检测装置。此外,培养皮脂腺细胞或皮肤片等时,本实施方式的装置或系统更优选具有具备所述控制部的管理装置、动物细胞用培养装置、以及含有荧光显微镜的荧光检测装置。含有荧光显微镜的荧光检测装置优选具备构成为进行荧光显微镜观察的观察部、构成为对观察对象进行拍摄的拍摄部、构成为对拍摄的观察图像进行图像解析的图像解析部。含有该荧光显微镜的荧光检测装置或荧光检测系统可以是荧光显微镜观察装置或荧光显微镜观察系统。
另外,本实施方式所涉及的方法也可通过含有用于管理全浆分泌调节剂的评价和/或选择等的CPU等的装置(例如计算机、PLC、服务器、云服务等)或含有该管理装置所具备的CPU等的控制部来实现。另外,也可将本实施方式所涉及的方法作为程序存储于具备记录媒体或存储单元(非易失性存储器(USB存储器等)、HDD、CD、DVD、蓝光、服务器、云服务等)等的硬件资源,通过控制部来实现。这样,也能够提供可执行本实施方式所涉及的方法的控制部或具备该控制部的装置。另外,该管理装置可以具备键盘、触摸屏等输入部、网络等通信部、显示器、触摸屏等显示部等。
<2.皮脂腺细胞的三维结构物和皮脂腺细胞的三维结构物的制备方法>
本实施方式中的皮脂腺细胞的三维结构物和皮脂腺细胞的三维结构物的制备方法的说明中,可适当省略与上述“1.”充分的全浆分泌调节剂、评价、选择等各构成、各处理方法、各装置等的说明,但该“1.”的说明也适用于本实施方式,可适当采用该说明。另外,本实施方式中的全浆分泌调节剂等的说明中,也可将下文的“3.”的说明适用于本实施方式,可适当采用。
作为本实施方式的其它方面,也可以以提供皮脂腺细胞的三维结构物和/或皮脂腺细胞的三维结构物的制备方法作为目的。由此,能够提供皮脂腺细胞的三维结构物和/或其制备方法,特别是能够提供新型三维结构物及其制备方法。
<2-1.本实施方式所涉及的皮脂腺细胞的三维结构物>
本实施方式可提供表面层由成熟皮脂腺细胞构成的皮脂腺细胞的三维结构物(参照图3)。该三维结构物优选用于荧光观察。此外,从用于全浆分泌的观察的观点考虑,更优选具有表面层存在的成熟皮脂腺细胞发生全浆分泌而裂解后存在于其下方的皮脂腺细胞成为表面层这样的构成的三维结构物。本实施方式中,表面层由于具有成熟的皮脂腺细胞,因此具有能够容易地进行与全浆分泌调节的状态或情况相关的观察(优选共焦激光观察)的优点。
本实施方式的皮脂腺细胞的三维结构物可用于皮脂腺细胞参与的全浆分泌或皮肤炎相关的技术(实验系统或模型等)。例如可用于全浆分泌调节剂的评价或选定方法、毛孔堵塞形成的细胞实验系统、阐明皮脂腺的全浆分泌机制的细胞实验系统、阐明全浆分泌与自噬相关性的细胞实验系统、阐明脂溢性皮炎和粉刺等发病机制的细胞实验系统、或者它们的各模型等。
现有的使用皮脂腺细胞的实验中,仅对皮脂产生量进行评价。因此,对皮脂腺细胞进行二维培养的二维培养物中,用平面显微镜观察经荧光色素染色的皮脂区域,计量该皮脂区域,从二维培养物的皮脂腺细胞提取皮脂,对提取的皮脂进行定量,评价皮脂产生量。而且,二维培养中,由于考虑皮脂产生量,所以本发明人认为直到全浆分泌的阶段,皮脂腺细胞未成熟。
另外,现有技术中,将皮肤细胞的层层叠得到层叠片,观察其截面的皮脂生产分布,进行皮脂产生量的评价(非专利文献1)。另外,将多个皮脂腺细胞埋入基质胶进行培养,得到成熟细胞聚集到中心部分而形成的球状体,对存在于内部的皮脂产生量进行评价(非专利文献2)。
这样,现有技术中,二维培养和三维培养都只对皮脂产生进行评价。
对此,本发明人首次阐明了毛孔堵塞形成机制,即,皮脂腺细胞的自噬诱导使全浆分泌正常发生,自噬障碍使全浆分泌异常,皮脂腺细胞无法正常裂解而堵塞毛孔,与发现皮脂腺细胞的皮脂产生量无关,皮脂腺细胞的全浆分泌状态(正常或异常状态)密切参与毛孔堵塞形成(参照图1和图2)。由此,本发明人获得了皮脂腺细胞的全浆分泌这种新构想和技术。此外,本发明人根据皮脂腺细胞的全浆分泌的构想和技术,对能够更良好地进行观察的皮脂腺细胞的培养方法进行了研究,首次结果获得了表面层由成熟的皮脂腺细胞构成的皮脂腺细胞的三维结构物。
本实施方式的皮脂腺细胞的三维结构物的形状没有特别限定,可举出管状、球状、片状等,但优选大致球状,更优选球状体(参照图3和4)。
对于本实施方式的皮脂腺细胞的三维结构物的大小,最小长度优选为200~600μm,更优选为250~550μm,进一步优选为300~500μm,另外最大长度优选为300~700μm,更优选为350~650μm,进一步优选为400~600μm。截面为椭圆(大致旋转椭圆体)形状时,最小长度可替换为短径,最大长度可替换为长径。
本实施方式的皮脂腺细胞的三维结构物为大致球状时,直径更优选为250~650μm,进一步优选为300~600μm,更进一步优选为350~550μm,更优选为400~500μm。
本实施方式的皮脂腺细胞的三维结构物优选在观察侧的表面层存在成熟的皮脂腺细胞。该皮脂腺细胞的三维结构物更优选在表面层存在大量成熟的皮脂腺细胞,另一方面,进一步优选在中心部附近的内部存在大量未成熟的皮脂腺细胞(参照图4)。该皮脂腺细胞的三维结构物从内部向外部,未成熟的皮脂腺细胞成熟后,成熟皮脂腺细胞存在与表面层。
该成熟皮脂腺细胞存在的表面层中该层的厚度(深度方向)距表面侧优选为50μm以内,更优选为40μm以内,进一步优选为30μm以内。
从观察的观点考虑,优选该表面层密集存在成熟皮脂腺细胞。
存在于三维结构物表面的成熟皮脂腺细胞区域的比例例如优选为表面的约60%以上、约70%以上、约80%以上或约90%以上。
该成熟细胞区域的比例可通过如下方式算出:将存在于三维结构物的成熟皮脂腺细胞荧光染色后,对三维结构物进行荧光观察,对三维结构物进行二维拍摄,获取表面图像(或表面照片),根据该二维表面图像中成熟皮脂腺细胞的荧光发光总面积,通过〔成熟细胞的荧光发光的总面积/皮脂腺细胞的三维结构物的表面图像面积〕×100(%)计算。
本实施方式的三维结构物的表面层存在成熟的皮脂腺细胞,所以容易进行成熟皮脂腺细胞的染色、荧光染色和荧光观察等,因此适宜将本实施方式的三维结构物用于染色观察或荧光观察。
此外,本实施方式的三维结构物由于容易对存在于表面层的成熟皮脂腺细胞的活细胞进行荧光染色并进行荧光观察,因此适用于共焦激光显微镜观察。这样,容易对表面层的成熟皮脂腺细胞进行染色或荧光染色。而且,由于能够容易地对该表面层进行荧光观察,所以也能够容易地进行全浆分泌调节剂的评价和/或选择方法。因此,本实施方式的三维结构物适宜用于实施方式的评价和/或方法。
<2-2.本实施方式所涉及的皮脂腺细胞的三维结构物的制备方法>
本实施方式可提供一种皮脂腺细胞的三维结构物的制备方法,其通过将播种的多个皮脂腺细胞在研钵状凹部的细胞粘附抑制处理表面(更优选为亲水化表面)上培养来获得皮脂腺细胞的三维结构物。由此能够获得本实施方式的皮脂腺细胞的三维结构物、更优选为表面层由成熟皮脂腺细胞构成的皮脂腺细胞的三维结构物。
所述研钵状凹部的底部优选为该凹部的底部中心区域可聚集多个皮脂腺细胞的形状。该凹部的底部更优选为V字形或U字形,播种的皮脂腺细胞容易聚集在V字形或U字形凹陷内,因此能够形成更良好的球状细胞块的形状,成熟皮脂腺细胞容易存在于该表面层。
作为播种皮脂腺细胞的容器的形状,可举出培养皿、烧瓶、具有多个孔的板等,但并不限定于此,优选一次性制品。作为其材质,可举出玻璃制、塑料树脂制(优选聚苯乙烯树脂制)等,但并不限定于此。
优选对播种皮脂腺细胞的凹部实施细胞粘附抑制处理,通过该表面处理,能够抑制细胞粘附于凹部表面,培养后容易将三维结构物剥离。通过该表面处理,播种的皮脂腺细胞易于聚集在中心区域,细胞易于彼此粘附,由此能够形成更良好的球状细胞块的形状,成熟皮脂腺细胞容易存在于其表面层。作为该细胞粘附抑制处理,没有特别限定,例如可举出亲水化的表面处理等。
更优选对所述凹部实施亲水化表面处理,作为该亲水化,例如可举出等离子体处理、电晕放电处理、氧化剂处理、亲水物质(优选聚乙二醇等细胞粘附抑制剂等)涂覆处理等,但并不限定于此。作为亲水物质涂覆,可举出高分子聚合物涂覆等。
本实施方式的制备方法中,所述研钵状凹部以外可采用通常的人皮脂腺细胞的体外培养条件来进行。此外,本实施方式的制备方法中,可适用上述“1.”的培养条件(特别是自噬抑制条件),也可以将该培养条件用作球状体制作条件。此时,优选使用通常用于增殖、维持、分化等繁殖的动物细胞培养用繁殖培养基,其中优选分化培养基,更具体而言,优选不含分化抑制因子(例:EGF、BPE等)或减量的分化培养基。作为该动物细胞培养用繁殖培养基,可举出基础培养基、减血清培养基、无血清培养基等,但并不限定于此。
本实施方式的培养条件优选采用通常的动物培养细胞的培养条件,例如pH为7~8左右,培养CO
培养可以在静置或旋回条件下,优选为静置状态下实施。
培养基中皮脂腺细胞的播种浓度优选为1×10
<3.全浆分泌调节剂>
本实施方式中的全浆分泌调节剂的说明中,适当省略与上述“1.”~“2.”重复的全浆分泌调节剂、评价、选择等各构成、各处理方法、各装置等的说明,但该“1.”~“2.”的说明也适用于本实施方式,可适当采用该说明。
作为本实施方式的其它方面,能够以提供具有全浆分泌调节作用的物质、或全浆分泌调节剂的有效成分、和/或全浆分泌调节剂为目的。由此,能够提供与皮脂腺细胞的全浆分泌调节相关的技术,具体而言,能够提供具有全浆分泌调节作用的物质、或全浆分泌调节剂的有效成分、和/或全浆分泌调节剂。由此,能够提供针对毛孔堵塞的肌肤问题的药剂。
通过本实施方式的全浆分泌调节剂的评价和/或选择方法(例如本发明第一实施方式~本发明第三实施方式的方法),能够提供所选择的物质(以下也称为“选定物质”)作为具有全浆分泌调节作用的物质或者作为全浆分泌调节剂的有效成分。
另外,该全浆分泌调节剂的评价和/或选择方法也可以是本实施方式的全浆分泌调节剂的评价和/或选择装置或系统。
作为全浆分泌调节作用,例如可举出调节皮脂腺细胞的全浆分泌的作用、调节毛孔堵塞形成的作用、调节皮脂腺细胞自噬的作用等,但并不限定于此。作为该调节作用,可举出促进或诱导作用、抑制或阻碍作用、维持作用等。更具体而言,例如可举出促进皮脂腺细胞全浆分泌的作用、抑制皮脂腺细胞全浆分泌的作用、促进毛孔堵塞形成的作用、抑制毛孔堵塞形成的作用、促进皮脂腺细胞自噬的作用、抑制皮脂腺细胞自噬的作用等。可从中选择1种或2种以上。
因此,采用本实施方式的全浆分泌调节剂的评价和/或选择方法得到的选定物质具有全浆分泌调节作用,能够对毛孔堵塞调节发挥出效果。
所述选定物质没有特别限定,可以是天然来源或人工制备,另外可以是单体或混合物。另外,选定物质优选为选自化合物、微生物或其培养物、提取物、它们的混合物、以及组合物等中的1种或2种以上。化合物可以是无机化合物、有机化合物中的任一者。
作为所述选定物质,优选例如可举出维甲酸等类视色素(retinoid);过氧化苯甲酰;油酸;姜黄素等姜黄色素;海藻糖等低聚糖;维生素D;雷帕霉素、巴弗洛霉素等大环内酯化合物;渥曼青霉素等磷脂酰肌醇3-激酶抑制剂;氯喹等,可使用选自其中的1种或2种以上。
其中,优选选自大环内酯化合物、姜黄色素、类视色素、低聚糖和磷脂酰肌醇3-激酶抑制剂中的1种或2种以上的化合物,更优选低聚糖和/或大环内酯化合物。
另外,其中,维甲酸等类视色素、过氧化苯甲酰和油酸优选用作毛孔堵塞调节剂。其中,姜黄素、海藻糖、维生素D、雷帕霉素、渥曼青霉素、氯喹优选用作自噬调节剂。
作为本实施方式中使用的低聚糖,例如可举出海藻糖(α,α-海藻糖)、新海藻糖(α,β-海藻糖)、异海藻糖(β,β-海藻糖)、蔗糖等二糖类;棉子糖等三糖类等2~10糖类(优选二~四糖类),其中,优选海藻糖等非还原低聚糖,更优选海藻糖。
本实施方式中使用的大环内酯化合物为大环内酯,优选为环成员12或其以上的化合物。作为大环内酯化合物,例如可举出雷帕霉素和巴弗洛霉素等。其中更优选雷帕霉素和巴弗洛霉素。
作为本实施方式中使用的姜黄色素,例如可举出姜黄素;去甲氧基姜黄素、双去甲氧基姜黄素、四氢姜黄素等姜黄素类似物等。其中更优选姜黄素。
作为本实施方式中使用的类视色素,可以是天然系或合成系,例如可举出视黄醇、视黄醇衍生物(视黄醇乙酸酯、视黄醇棕榈酸酯、视黄醇丙酸酯等)、维甲酸、异维甲酸、莫维A胺、阿维A酯、阿曲汀、全反式维甲酸或全反式维甲酸锌、合成类视色素(阿达帕林等)等。其中更优选视黄醇、维甲酸。
另外,作为具有自噬促进作用的化合物,优选为海藻糖等非还原二糖類、雷帕霉素等大环内酯化合物、姜黄素等姜黄色素、视黄醇或维甲酸等类视色素等,这些化合物可用作自噬促进剂或全浆分泌促进剂的有效成分。
另外,作为具有自噬抑制作用的化合物,优选为巴弗洛霉素等大环内酯化合物、渥曼青霉素等磷脂酰肌醇3-激酶抑制剂,这些化合物可用作自噬抑制剂或全浆分泌抑制剂的有效成分。
本实施方式中,可使用选自其中的1种或2种以上的所述选定物质。
所述选定物质可作为全浆分泌调节剂(优选全浆分泌促进剂、全浆分泌抑制剂)、毛孔堵塞形成调节剂(优选毛孔堵塞形成促进剂、毛孔堵塞形成抑制剂)、自噬调节剂(优选自噬促进剂、自噬抑制剂)、毛孔堵塞预防·改善·治疗剂(以下、也称为“全浆分泌调节剂等”)的有效成分而含有,或者可用作全浆分泌调节剂等。应予说明,该剂可以是组合物。
另外,所述选定物质可用来制备全浆分泌调节剂等。
另外,本实施方式还可提供调节全浆分泌或为了全浆分泌调节等或用于全浆分泌调节等的所述选定物质或其使用。该全浆分泌调节等可以是选自全浆分泌调节(优选全浆分泌促进、全浆分泌抑制)、毛孔堵塞形成调节(优选毛孔堵塞形成促进、毛孔堵塞形成抑制)、自噬调节(优选自噬促进、自噬抑制)、毛孔堵塞预防·改善·治疗中的1种或2种以上。
本实施方式还可提供使用所述选定物质的全浆分泌调节方法、自噬调节方法、毛孔堵塞预防·改善·治疗方法、或使用含所述选定物质的药剂的全浆分泌调节方法、自噬调节方法、毛孔堵塞预防·改善·治疗的方法。
<疾病、症状>
所述选定物质可发挥该生理活性作用,因此可用于由毛孔堵塞引起的疾病或毛孔堵塞的症状的预防、改善或治疗的方法。
作为由毛孔堵塞引起的疾病或毛孔堵塞的症状,没有特别限定,例如可举出毛孔的黑头、毛孔开裂、毛孔粗糙、毛孔发红、粉刺(痤疮)、脂溢性皮炎等,可选自其中的1种或2种以上。
另外,作为容易产生毛孔堵塞的部位,可举出皮脂腺多的部位,更具体而言可举出头皮、面部肌肤(鼻部、额头等)、胸部等。
另外,作为本实施方式的用途,例如可举出毛孔堵塞的预防、改善或治疗用等,但并不限定于此。
本实施方式中,“预防”是指应用对象的症状或疾病的发病的防止或发病的迟延、或降低应用对象的症状或疾病发病的危险性等。在本技术中,“改善”是指应用对象的疾病、症状或状态的好转或维持;恶化的防止或迟延;发展的逆转、防止或迟延。
本实施方式可将所述选定物质用于例如化妆料、皮肤外用剂、准药品、饮食品、饲料等,但并不限定于此。
另外,所述“全浆分泌调节剂等”例如可用作化妆料、皮肤外用剂、准药品、饮食品、饲料等,但并不限定于此。其中优选化妆料、皮肤外用剂、医药、和准药品等。
另外,所述“全浆分泌调节剂等”可用作组合物中的配合剂或添加剂,例如可以是用于配合或添加在化妆料、皮肤外用剂、准药品、饮食品、饲料等组合物的“全浆分泌调节剂等”。
本实施方式例如为化妆料和皮肤外用剂时,可将所述选定物质或全浆分泌调节剂等例如配合于乳液、乳膏、化妆水、面膜、洗面奶、彩妆、分散液、软膏、液剂、气雾剂、贴剂、膏药、擦剂等各种形式的化妆料或皮肤外用剂,但并不限定于此。
本实施方式例如为医药和准药品时,可将所述选定物质或全浆分泌调节剂等配合于例如片剂、胶囊剂、颗粒剂、散剂、液剂、混悬剂等口服制剂;外皮用剂、贴剂、点眼剂、点鼻剂、口腔剂、坐剂等外用剂;点滴剂、注射剂等非口服剂,但并不限定于此。
所述选定物质或全浆分泌调节剂等可采用公知制备方法制备。所述选定物质可使用市售品。
所述选定物质的含量没有特别限定,制剂总量中可含有所述选定物质优选为0.001~99质量%,更优选为0.005~90质量%,进一步优选为0.01~90质量%左右。“制剂总量中”的“制剂”可以是所述“全浆分泌调节剂等”。
所述选定物质或全浆分泌调节剂等的应用对象可以是人和非人动物(例如宠物、家畜等)等。其中优选人和宠物,更优选为人。
作为所述选定物质或全浆分泌调节剂等的使用方法,可举出经皮给药、口服给药、注射给药等给药;口服摄入;皮肤涂布等,但并不限定于此。
作为所述选定物质的使用量或给药量,只要是可获得本发明效果的量就没有特别限制,可根据该制剂的剂型、应用部位、年龄、性別等适当调整。
全浆分泌调节剂等可采用公知的制备方法制备。另外,该全浆分泌调节剂等除了所述选定物质之外,可根据需要合用各种添加剂等任意成分。
作为所述任意成分,可以适当配合化妆料、皮肤外用剂、医药、饮食品或饲料等允许的成分,例如可适当使用选自赋形剂、着色剂、增稠剂、粘合剂、崩解剂、分散剂、稳定剂、凝胶剂、抗氧化剂、表面活性剂、保存剂、保湿剂、pH调节剂等中的1种或2种以上,由此可获得所期望的剂型。
另外,本技术可采用以下构成。
·〔1〕一种全浆分泌调节剂的评价和/或选择方法,包括
观察工序:使单个或多个皮脂腺细胞与受试物质接触之后,对发出荧光的皮脂腺细胞的状态进行观察;以及
判别工序:根据所述发出荧光的皮脂腺细胞的状态,将受试物质判别为全浆分泌调节剂或全浆分泌调节剂的候选。
作为优选的方式,所述观察工序中,在全浆分泌调节条件下使单个或多个皮脂腺细胞与受试物质存在,对发出荧光的皮脂腺细胞的状态进行荧光观察。
作为更优选的方式,所述观察工序中,在繁殖培养基培养条件下(优选球状体制作条件下)使单个或多个皮脂腺细胞与受试物质接触后,在全浆分泌调节条件下观察发出荧光的皮脂腺细胞的状态。
·〔2〕如上述〔1〕中记载的全浆分泌调节剂的评价和/或选择方法,其中,全浆分泌调节剂为选自全浆分泌促进剂、全浆分泌抑制剂、毛孔堵塞形成调节剂和皮脂腺细胞的自噬调节剂中的1种或2种以上。
·〔3〕如上述〔1〕或〔2〕中记载的全浆分泌调节剂的评价和/或选择方法,其中,所述皮脂腺细胞为由多个皮脂腺细胞构成的三维结构物。
·〔4〕如上述〔1〕至〔3〕中任一项所述的全浆分泌调节剂的评价和/或选择方法,其中,所述观察为使用延时摄影的观察。
·〔5〕如上述〔1〕至〔4〕中任一项所述的全浆分泌调节剂的评价和/或选择方法,其中,所述观察为使用荧光显微镜的观察。该观察优选使用荧光检测装置或荧光显微镜观察装置进行观察,这些装置具备构成为进行荧光显微镜观察的观察部、构成为对观察对象进行拍摄的拍摄部、构成为对拍摄的观察图像进行图像解析的图像解析部,此外,还可具备为了维持观察对象而培养的动物细胞用培养部。
·〔6〕如上述〔1〕至〔5〕中任一项所述的全浆分泌调节剂的评价和/或选择方法,其中,所述观察工序中,使单个或多个皮脂腺细胞与受试物质接触之后,对发出荧光的皮脂腺细胞的状态进行观察,
该全浆分泌调节条件为自噬调节条件。
该自噬调节条件为自噬抑制条件或自噬诱导条件。
·〔7〕如上述〔1〕至〔6〕中任一项所述的全浆分泌调节剂的评价和/或选择方法,其中,根据每单位体积的荧光消失细胞数,判别所述发出荧光的皮脂腺细胞的状态。
·〔8〕如上述〔1〕至〔7〕中任一项所述的全浆分泌调节剂的评价和/或选择方法,其中,所述发出荧光的皮脂腺细胞对活细胞进行荧光标记并使其发光。
·〔9〕如上述〔1〕至〔8〕中任一项所述的全浆分泌调节剂的评价和/或选择方法,其中,所述皮脂腺细胞为表面层由成熟的皮脂腺细胞构成的皮脂腺细胞的三维结构物。
·〔10〕如上述〔1〕至〔9〕中任一项所述的全浆分泌调节剂的评价和/或选择方法,其中,所述皮脂腺细胞是通过将播种的多个皮脂腺细胞在研钵状凹部的细胞粘附抑制处理表面(更优选为亲水化表面)上培养而得到的皮脂腺细胞的三维结构物。
·〔11〕一种皮脂腺细胞的三维结构物,其表面层由成熟的皮脂腺细胞构成。
·〔12〕如上述〔11〕中记载的皮脂腺细胞的三维结构物,其中,所述三维结构物为球状。
·〔13〕如上述〔11〕或〔12〕中记载的皮脂腺细胞的三维结构物,其中,荧光观察优选使用荧光显微镜观察。更优选用于选自共焦激光显微镜观察、多光子激发显微镜观察和光片显微镜观察中的1种或2种以上,进一步优选用于共焦激光显微镜。
·〔14〕如上述〔11〕至〔13〕中任一项所述的皮脂腺细胞的三维结构物,其用于全浆分泌调节剂的评价和/或选择方法。
·〔15〕一种皮脂腺细胞的三维结构物的制备方法,其中,通过将播种的多个皮脂腺细胞在研钵状凹部的细胞粘附抑制处理表面(优选亲水化表面)上培养来获得皮脂腺细胞的三维结构物。
所述细胞粘附抑制处理表面或所述亲水化表面优选为选自等离子体处理、电晕放电处理、氧化剂处理、亲水物质涂覆处理等中的1种或2种以上,亲水物质涂覆中,优选使用光交联型亲水性聚合物等细胞粘附抑制剂进行处理。
·〔16〕如上述〔15〕中记载的皮脂腺细胞的三维结构物的制备方法,其中,所述研钵状凹部为多个皮脂腺细胞可聚集在该凹部的底部中心区域的形状。
所述研钵状凹部的底部优选为V字形或U字形。
·〔17〕一种全浆分泌调节剂的评价和/或选择方法,其包括
观察工序:使单个或多个皮脂腺细胞与受试物质存在之后,对采集的角栓状态进行荧光观察;以及
判别工序:根据所述发出荧光的角栓状态,将受试物质判别为全浆分泌调节剂或全浆分泌调节剂的候选。
·〔18〕如上述〔17〕中记载的全浆分泌调节剂的评价和/或选择方法,其中,全浆分泌调节剂为选自全浆分泌促进剂、全浆分泌抑制剂、毛孔堵塞形成调节剂和皮脂腺细胞的自噬调节剂中的1种或2种以上。
·〔19〕如上述〔17〕或〔18〕中记载的全浆分泌调节剂的评价和/或选择方法,其中,所述观察为使用荧光显微镜的观察。该观察优选为使用荧光检测装置或荧光显微镜观察装置的观察,这些装置具备构成为进行荧光显微镜观察的观察部、构成为对观察对象进行拍摄的拍摄部、构成为对拍摄的观察图像进行图像解析的图像解析部。
·〔20〕
如上述〔17〕至〔19〕中任一项所述的全浆分泌调节剂的评价和/或选择方法,其中,所述观察工序中的角栓是使用粘合片从哺乳动物的皮肤表面采集的附着于粘合片上的多个所述角栓;和/或
所述判别工序中的所述角栓的状态是将使用受试物质后的角栓最大直径的平均值除以使用前的角栓最大直径的平均值而求得的角栓最大直径的变化率。
·〔21〕一种全浆分泌调节剂等,其为采用所述〔1〕~〔10〕、所述〔17〕~〔20〕中任一项所述的全浆分泌调节剂的评价和/或选择方法进行了评价和/或选择的选择物质;或含有该选择物质作为有效成分。
·〔22〕一种全浆分泌调节剂等,其含有选择物质。
所述选择物质优选为选自化合物、微生物、发酵物、提取物和它们的混合物、以及组合物等中的1种或2种以上。该选择物质可以是天然或合成。
·〔23〕如上述〔21〕中记载的选择物质或含有该选择物质作为有效成分的全浆分泌调节剂等或者上述〔22〕中记载的全浆分泌调节剂等,其中,所述选择物质为选自类视色素、过氧化苯甲酰、油酸、姜黄素、海藻糖、维生素D、雷帕霉素、渥曼青霉素和氯喹中的1种或2种以上或它们的混合物。
·〔24〕如上述〔21〕中记载的选择物质或含有该选择物质作为有效成分的全浆分泌调节剂等或者上述〔22〕中记载的全浆分泌调节剂等,其中,所述选择物质为选自低聚糖、类视色素、姜黄色素、大环内酯化合物、和磷脂酰肌醇3-激酶抑制剂中的1种或2种以上的化合物(更优选为低聚糖和/或大环内酯化合物)或它们的混合物。
·〔25〕化妆料、皮肤外用剂、准药品、或医药、食品,其含有上述〔21〕至〔24〕中任一项所述的选择物质,或者含有含该选择物质的全浆分泌调节剂等。
·〔26〕用于制备全浆分泌调节剂等的上述〔21〕至〔24〕中任一项所述的选择物质或其用途。
·〔27〕用于全浆分泌调节等或为了全浆分泌调节等的上述〔21〕至〔24〕中任一项所述的选择物质或其用途。
·〔28〕将上述〔21〕至〔24〕中任一项所述的选择物质用于哺乳动物的全浆分泌调节方法、毛孔堵塞形成调节方法、自噬调节方法或毛孔堵塞预防·改善·治疗方法。
【实施例】
以下举出实施例和比较例对本发明的实施方式进行说明。应予说明,本发明的范围并不限定于实施例。
通常,理想的肌肤外观具有均匀性和光滑这两个特征,两者均受到毛孔形态变化(毛孔扩大、粉刺等)的不良影响。一般认为毛孔堵塞是引起毛孔形态变化的主要原因之一。以往长时间以来一直认为毛孔堵塞的形成与肥厚的角质层导致的毛孔出口闭塞及其后的毛孔内部皮脂积存和固化有关。然而,该以往的观点无法说明毛孔出口张开时毛孔堵塞的病态、即开放性痤疮(开放性粉刺)和微小痤疮(微粉刺)的形成,也未能阐明毛孔堵塞形成的详细机制。
<试验例1:使用人摘除皮肤和自噬抑制剂的毛孔堵塞的确认试验>
试样:皮肤(无毛孔堵塞)片(1cm
<毛发器官的皮脂染色法>
将皮肤片在37℃、5%CO
<自噬调节条件下培养皮肤的荧光观察>
如以下试验例1a~1b所述,添加自噬抑制剂,采集边抑制自噬边培养的皮肤,进行荧光染色后,进行荧光观察。试验例1a中,使用巴弗洛霉素A1作为自噬抑制剂,试验例1b中,使用MHY-1485作为自噬抑制剂。应予说明,试验例1c用作阴性对照,除了使用不含自噬抑制剂的DMSO溶剂以外,与试验例1a同样地进行。
作为试验例1a、1b和1c的培养条件,在37℃、5%CO
试验例1a、1b、1c中,将皮肤(无毛孔堵塞)片培养6天后,从皮肤片摘除全毛囊皮脂腺部,使用4%多聚甲醛溶液在4℃固定一夜,其后用1μg/mL的尼罗红溶液(Sigma公司)和DAPI染色(Sigma公司)在室温下染色30分钟,将毛孔和皮脂腺导管中存在的皮脂染色。以毛囊皮脂腺部中含有的毛、与其相对的毛囊壁、与毛孔相连的皮脂腺导管为中心对该染色的皮脂进行荧光显微镜观察。
此时,测定毛的毛囊侧和与该毛相对的毛囊壁所夹持的部分的距离,该部分中密集填充荧光染色,将最长的距离作为毛-毛囊壁间距离(图中为相对的三角形前端之间)。
与以不同机制抑制自噬的药剂巴弗洛霉素A1或MHY-1485一起培养人皮肤6天后,使用共焦激光显微镜(卡尔蔡司LSM800)和图像解析软件Imaris(高精细3D/4D图像解析软件))对毛孔和皮脂腺进行三维观察。
图1中B-1是试验例1c中采用对照(未添加自噬抑制剂的DMSO溶液)的培养,图1中B-2是试验例1a中自噬抑制剂(含巴佛洛霉素A1的DMSO溶液)“存在”下的培养,图1中B-3是试验例1b中自噬抑制剂(含MHY1485的DMSO溶液)“存在”下的培养。
三角箭头与三角箭头之间的距离表示毛(左侧)与毛囊壁(右侧)之间填充满经色素染色的皮脂油且最长距离的位置(毛-毛囊壁间距离:μm)。
如图1和图2所示,培养后添加自噬抑制剂(巴佛洛霉素A1)时;培养后添加自噬抑制剂(MHY-1485)时的毛-毛囊壁间距离(μm)与对照(DMSO)相比,巴佛洛霉素A1为1.8倍,MHY-1485为1.6倍,分别存在显著差异(p<0.05)。
上述结果确认了自噬抑制导致的毛孔堵塞。由这些结果可知,皮脂腺细胞的自噬障碍使得皮脂腺细胞的全浆分泌无法顺利进行,引起皮脂腺导管和毛囊堵塞。
本发明人通过上述结果首次明确了毛孔堵塞形成的机制。本发明人发现有毛孔堵塞的皮肤中皮脂腺细胞的自噬障碍引起皮脂腺细胞的全浆分泌不全以及皮脂腺管和毛囊处的细胞堆积。由此认为皮脂腺细胞的自噬障碍引起毛孔堵塞。
本发明人的上述发现提供了与用于保持毛孔健康的分子机制相关的重要见解。此外,通过本研究,可以期待适当保持皮脂腺细胞的自噬,可提供防止毛孔扩大和粉刺,打造美丽、均匀、光滑的肌肤的新型护肤。
<试验例2:皮脂腺细胞的三维结构物的制作方法和观察方法>
<球状体制作方法>
使用的皮脂腺细胞为人源皮脂腺细胞(2×10
将冷冻的人源皮脂腺细胞(1mL)在30℃左右的温浴中溶解。将溶解的皮脂腺细胞混悬于培养基4mL,将该混悬物离心后,去除上清,回收皮脂腺细胞。向该皮脂腺细胞中添加CnT-Prime的分化培养基(CELLnTEC公司),培养基中制备5x10
在孔底面的垂直截面为V字形或U字形且具有在研钵状凹部的底部中心区域可聚集多个皮脂腺细胞的形状的孔的96孔板中,每孔添加100μL细胞悬液,以每孔5x10
得到的皮脂腺细胞的三维结构物为大致球状,其最小直径为400μm,最大直径为500μm,该直径大概在400~500μm的范围内(参照图3和图4)。
对所得皮脂腺细胞的三维结构物,使用脂肪分化相关蛋白作为成熟标志物,将成熟的皮脂腺细胞荧光染色进行观察。图4中A是表示将成熟皮脂腺细胞荧光染色时的皮脂腺细胞的三维结构物(球状体)的总体面貌的照片图。图4中B是从图4中A经染色的球状体表面层向深度方向的截面图,是表示本实施方式中得到的球状体中成熟皮脂腺细胞的存在位置的图像。如图4所示,三维结构物的表面层附近的大部分范围确认到了脂肪分化相关蛋白荧光染色。
由此,所得皮脂腺细胞的三维结构物的表面层大量密集存在成熟的皮脂腺细胞,另一方面,越靠近中心部附近,越观察不到成熟的皮脂腺细胞。应予说明,该成熟皮脂腺细胞存在的表面层中该层的厚度约为30μm。
三维结构物的表面存在的成熟皮脂腺细胞区域的比例为表面的约80~100%。该区域的比例通过如下方式算出:将三维结构物中存在的成熟皮脂腺细胞荧光染色后对三维结构物进行荧光观察拍摄三维结构物的表面图像,根据该表面图像中的成熟皮脂腺细胞的荧光发光的总面积,通过〔成熟皮脂腺细胞的荧光发光的总面积/皮脂腺细胞的三维结构物的表面图像面积〕×100%算出。
<全浆分泌调节条件>
将细胞播种后第11天的皮脂腺细胞的球状体在室温(20℃)、大气下转移至玻璃底培养皿。本发明人经过深入研究,结果首次发现通过改变市售培养基的种类,三维结构物的表面层存在的成熟皮脂腺细胞成为“全浆分泌或不全浆分泌”的状态,由此本发明人发现了皮脂腺细胞的三维结构物的全浆分泌调节条件。
<饥饿培养基(自噬诱导用培养基)>
无氨基酸的基础培养基(血清未添加):D-MEM(Dulbecco改良-Eagle/高糖;含丙酮酸钠;不含氨基酸)培养基(富士胶片和光纯药公司:048-33575)。
<繁殖培养基(自噬抑制用培养基)>
添加有10%胎牛血清的D-MEM(Dulbecco改良-Eagle/L-谷氨酸;不含酚红)培养基(富士胶片和光纯药社:040-30095)。
<细胞/死细胞成像试剂盒>
细胞/死细胞成像试剂盒(LIVE/DEAD
<共焦激光显微镜>
共焦激光显微镜(卡尔蔡司LSM800)和图像解析软件(Imaris(高精细3D/4D图像解析软件)):常温(10~30℃)下对玻璃底培养皿(加入饥饿培养基或繁殖培养基,加入受试物质,CO
<成熟皮脂腺细胞发生全浆分泌的状态(使用饥饿培养基的条件的情况)>
将少量饥饿培养基添加于加入有成熟皮脂腺细胞球状体的玻璃底培养皿,去除该饥饿培养基,将球状体用饥饿培养基清洗,使球状体适应饥饿培养基后,在培养箱内(37℃、5%CO
其后,在该培养箱内将球状体和饥饿培养基300μL与活细胞/死细胞成像试剂盒(LIVE/DEAD
如上所述,在全浆分泌发生的条件下将活细胞检测用荧光物质添加于含有球状体和饥饿培养基的玻璃底培养皿进行混合,对皮脂腺细胞的活细胞进行荧光染色,使用共焦激光显微镜观察玻璃底培养皿内含有的发出荧光的皮脂腺细胞的三维结构物。该玻璃底培养皿内调整为37℃、5%CO
应予说明,对具有全浆分泌抑制作用的物质进行评价和/或选定时,添加荧光物质加至少2小时前向含有球状体的球状体制作培养基中添加受试物质。对于起效慢的受试物质,在添加荧光物质24小时前向含有球状体的球状体制作培养基添加受试物质。
这样,将含有球状体、受试物质和球状体制作培养基的混合液培养规定时间后,将球状体转移至受试物质和饥饿培养基,向该混合液中进一步添加荧光物质。将含有这些荧光物质的混合液中的球状体在引起全浆分泌的状态条件下经时进行荧光观察。在经时荧光观察中,将每单位体积的经时荧光消失细胞数作为指标,判别受试物质是否具有全浆分泌抑制作用,可进行全浆分泌抑制剂的评价和/或选定。
<成熟皮脂腺细胞不发生全浆分泌的状态(使用繁殖培养基的条件的情况)>
将少量繁殖培养基添加于加入有成熟皮脂腺细胞的球状体的玻璃底培养皿,去除该繁殖培养基,将球状体用繁殖培养基清洗,使球状体适应繁殖培养基后,在培养箱内(37℃、5%CO
其后,在该培养箱内将球状体和繁殖培养基300μL与活细胞/死细胞成像试剂盒(LIVE/DEAD
如上所述,在不发生全浆分泌的条件下,将活细胞检测用的荧光物质添加于含有球状体和繁殖培养基的玻璃底培养皿进行混合,对皮脂腺细胞的活细胞进行荧光染色,使用共焦激光显微镜观察玻璃底培养皿内中含有的发出荧光的皮脂腺细胞的三维结构物。该玻璃底培养皿内调整为37℃、5%CO
应予说明,对具有全浆分泌促进作用的药剂的评价和/或选定时,在添加荧光物质的至少2小时前向含有球状体的球状体制作培养基中添加受试物质。对于效果不明显的受试物质,优选在添加荧光物质的24小时前向含有球状体的球状体制作培养基中添加受试物质。
这样,将含有球状体、受试物质和球状体制作培养基的混合液培养规定期间后,将球状体转移至受试物质和繁殖培养基,向该混合液中添加荧光物质。将含有这些荧光物质的混合液中的球状体在全浆分泌不发生的状态条件下进行经时荧光观察。在经时荧光观察中,将每单位体积的经时荧光消失细胞数作为指标,判别受试物质是否具有全浆分泌促进作用,能够进行全浆分泌促进剂的评价和/或选定。
<共焦激光显微镜观察>
使用共焦激光显微镜,在37℃、5%CO
该共焦激光显微镜的物镜x20,为了观察活细胞,采用488nm的激光激发波长和490~570nm的检测波长,在从球状体表面层至100μm的范围内以1μm逐渐改变焦点面进行拍摄。此外,每隔10分钟对皮脂腺细胞的三维结构物进行1组激光照射和荧光发光拍摄,观察12小时皮脂腺细胞的活细胞的经时变化。本次的拍摄条件为每10分钟拍摄1帧(静止图像),共计拍摄12小时(72帧)。
对于上述取得的拍摄图像,在以1μm间隔拍摄的深度方向的拍摄图像的基础上,使用解析软件Imaris将该二维拍摄图像构建为三维图像。此时,可任意切出纵(或横)62.4μmx横(或纵)125μm x深50μm的范围,本次切出3处。将上述取得的静止图像以视频进行播放,从拍摄开始时(添加荧光试剂时)计数12小时内绿色荧光消失的细胞数。
计数这3处绿色荧光消失的细胞数的合计数,求出平均值,将该平均值作为每单位体积的荧光消失细胞数(平均值)。由此判断存在于三维结构物表面层的成熟细胞的全浆分泌的状态(参照图6)。
在全浆分泌发生的条件下,荧光物质添加后经过12小时后的观察中,每单位体积的荧光消失细胞数的平均值为10个左右(参照图5中A和图6)。另一方面,在全浆分泌不发生的条件下,添加荧光物质后经过12小时后的观察中,每单位体积的荧光消失细胞数的平均值为1个左右(参照图5中B)。
图5中A是使用本实施方式中得到的球状体,在使用了饥饿培养基的自噬诱导条件的培养中观察开始时(图A-1)和观察结束时(图A-2)的图像,是表示球状体的表面层存在的皮脂腺细胞裂解,每单位体积的发出荧光的细胞数减少的延时图像(特别是箭头部分)。
图5中B是使用本实施方式中得到的球状体,在使用了繁殖培养基的自噬抑制条件的培养中观察开始时(图B-1)和观察结束时(图B-2)的图像,是表示球状体的表面层存在的皮脂腺细胞不裂解,每单位体积的发出荧光的细胞数未减少的延时图像(特别是箭头部分)。
在自噬诱导条件下的培养中,绿色荧光消失的皮脂腺细胞是发生了全浆分泌的皮脂腺细胞,延时图像中,可观察到1个皮脂腺细胞的荧光在短期间内消失。在消失的区域中,其正下方的发出荧光的皮脂腺细胞露出在最外表面(参照图5中A和图6)。这样在全浆分泌過程中,皮脂腺细胞使细胞膜裂解而将内部的皮脂释放到细胞外,被释放的皮脂通过皮脂腺导管和毛囊而不堵塞导管和毛孔,能够被良好地释放到皮肤表面。成熟皮脂腺细胞正常发生全浆分泌,从而可防止、改善毛孔堵塞。
另一面,在自噬抑制条件下的培养中,绿色荧光未消失的皮脂腺细胞是全浆分泌未发生的皮脂腺细胞,延时图像中,存在于三维结构物表面的皮脂腺细胞未消失经过12小时后也可观察到。这样的死细胞为未全浆分泌的状态,因此该死细胞堆积于皮脂腺导管和毛囊,成为毛孔堵塞的状态。成熟细胞的全浆分泌未正常发生,发生毛孔堵塞,毛孔堵塞恶化。
<试验例3:全浆分泌调节剂的评价和/或选择方法>
作为试验例3A,在上述<成熟皮脂腺细胞不发生全浆分泌的状态(使用繁殖培养基的条件的情况)>中记载的全浆分泌调节条件下,使用荧光试剂、球状体、共焦激光显微镜观察,使用海藻糖作为受试物质,进行受试物质的全浆分泌调节剂的评价和/或选择方法。
在使用CnT-Prime的分化培养基(CELLnTEC公司)的球状体制作条件下,使本实施方式的1个球状体与作为受试物质的海藻糖接触6小时以上且24小时以内。
在培养箱内(37℃、5%CO
作为发出荧光的皮脂腺细胞的状态,算出720分钟拍摄中每单位体积的荧光消失细胞数,在使用饥饿培养基作为阳性对照的培养中的荧光细胞消失数为100%±30%时,将该海藻糖判别为全浆分泌促进剂或全浆分泌促进剂的候选,选定未具有全浆分泌促进作用的物质。
通过将海藻糖作为选定物质,本实施方式中,能够提供含有海藻糖作为有效成分的全浆分泌促进剂;全浆分泌诱导剂;毛孔堵塞预防、改善或治疗剂等。
另外,代替海藻糖,可分别使用类视色素、过氧化苯甲酰、油酸、姜黄素、维生素D、雷帕霉素、渥曼青霉素、氯喹作为受试物质,与上述试验例3A同样地进行,将类视色素、过氧化苯甲酰、姜黄素、维生素D、雷帕霉素作为全浆分泌促进剂,将油酸、渥曼青霉素、氯喹作为全浆分泌抑制剂,进行评价或选定。
此外,作为试验例3B,在自噬诱导条件下进行受试物质的全浆分泌抑制剂的评价和/或选择方法。此时,在球状体制作条件下使本实施方式的1个球状体与作为受试物质的海藻糖接触6小时以上且24小时以内后,在使用自噬诱导用培养基的自噬诱导条件下,使球状体与海藻糖存在,添加荧光试剂进行荧光染色和荧光观察。对于该接触工序和该观察工序中使用的受试物质的培养基中的浓度,两者相同。荧光染色和荧光观察与上述试验例3A同样地进行。
作为发出荧光的皮脂腺细胞的状态,算出720分钟拍摄中每单位体积的荧光消失细胞数,使用繁殖培养基作为阳性对照的培养中的荧光细胞消失数为100%±30%时,将受试物质判别为全浆分泌抑制剂或全浆分泌抑制剂的候选,选定为具有全浆分泌抑制作用的物质。
由此能够从众多受试物质评价或选定全浆分泌抑制剂。
对表1所示的受试物质,按照上述试验例3A,使用球状体评价是否具有全浆分泌促进作用或全浆分泌抑制作用,选定具有这些作用的化合物。使用的球状体可按照上述试验例2的<球状体制作方法>制备。
海藻糖、雷帕霉素采用繁殖培养基进行。作为该繁殖培养基,使用上述试验例3A的“添加有10%胎牛血清的D-MEM(Dulbecco改良-Eagle/L-谷氨酸;不含酚红)培养基”。作为饥饿培养基(自噬诱导用培养基),使用“无血清不含氨基酸的D-MEM(高糖(4500mg/L))(含丙酮酸Na(110mg/L)不含氨基酸)(富士胶片和光纯药株式会社制)”。
表1中“荧光消失的皮脂腺细胞数的合计数(3处)”为每单位体积(62.4μm×125μm×50μm;如图6所示)的荧光消失后的细胞数(相当于试验例3的“荧光细胞消失数”)。该栏的“13,8,10”这3个数为同一球状体内不同3处的计量值。
表1中全浆分泌促进剂候选的选择中的“荧光消失细胞比(/饥饿培养基·药剂无添加)(%)”的分母为“饥饿培养基且添加药剂(-:无)”的“平均”为9.7。
作为发出荧光的皮脂腺细胞的状态,算出720分钟拍摄中每单位体积的荧光消失细胞数,作为阳性对照使用饥饿培养基
培养中荧光细胞消失数为100%±30%时,将受试物质判别为全浆分泌促进剂或全浆分泌促进剂的候选,选定为具有全浆分泌促进作用的物质。
应予说明,作为发出荧光的皮脂腺细胞的状态,算出720分钟拍摄中每单位体积的荧光消失细胞数,作为阳性对照使用繁殖培养基进行培养中荧光细胞消失数为100%±30%时,将受试物质判别为全浆分泌抑制剂或全浆分泌抑制剂的候选,能够选定为具有全浆分泌抑制作用的物质。
该结果可确认海藻糖、雷帕霉素具有更良好的全浆分泌促进作用或自噬促进作用,可用作全浆分泌调节剂的有效成分。
【表1】
<试验例4:基于评价试验的受试物质的全浆分泌调节作用的评价或选定>
<连用4周海藻糖化妆水对鼻部角栓尺寸的影响解析>
海藻糖化妆水的使用和角栓采集
·对象受试者:20-40岁鼻部角栓严重的男性
·受试者数:含有海藻糖(3%)化妆水使用组8名
不含海藻糖化妆水使用组6名
<试验内容>
1.试验化妆水使用开始的4周前用鼻部角栓除去贴拔取鼻部角栓(该操作是面向4周后化妆水使用开始时进行的角栓采集,为了受试者间统一角栓形成时间而实施的。因此废弃拔去的角栓)。
2.上述4周后,用鼻部角栓除去贴拔取鼻部角栓,拔取的角栓用于共焦点显微镜观察,在附着于鼻贴的状态下冻存。从该日开始使用化妆水。
3.上述4周后,用鼻部角栓除去贴拔取鼻部角栓,拔取的角栓用于共焦点显微镜观察,在附着于鼻贴的状态下冻存。
如上所述,对每个受试者,回收化妆水使用前和使用后的2份角栓样品,由此从各受试者分别采集使用前和使用后的角栓。
<使用共焦激光显微镜的角栓的观察和直径计量>
1.将附着有角栓的鼻贴片解冻后,将贴片展平,将角栓附着面作为观察面,固定于共焦点显微镜(ZEISS公司,正置共焦激光显微镜LSM700)的观察台。此外,共焦点显微镜的激发波长设定为555nm,检测用的荧光波长设定为559nm以上。通常用于细胞生物学用观察的荧光波长通常为300~800nm的范围。
2.对角栓照射555nm(激发光)的激光,荧光波长559nm以上检测从角栓发出的自发荧光。采用该方法对1个角栓整体拍摄连续的光学断层图像,将拍摄的连续图像使用ZEISS公司的解析软件ZEN black edition重建三维图像。构建角栓的三维图像后,用该软件测的最大直径。
拍摄角栓的连续断层照片(连续断层图像),最终可制成三维图像。
重建该角栓的三维图像的理由并非要比拟为细胞的三维结构物,而是要判断角栓直径最大的位置。应予说明,细胞的三维结构物是以活皮脂腺细胞的集合体模拟生体的皮脂腺,但另一方面,此时角栓中混杂有皮脂腺细胞的遗骸、皮脂、角质层。
2.针对1个样品(1张附着有角栓的鼻贴片),对11-24个角栓实施上述操作。
3.针对1个样品,计算全部角栓的最大直径的平均值,将使用化妆水后的上述平均值除以使用化妆水前的平均值,得到角栓最大直径的变化率。
本解析法中,并非要评价皮肤表面的毛孔直径的变化(即毛孔外观),而是以推测皮脂腺细胞的全浆分泌(皮脂腺细胞的破裂·消化)是否正常发生为目的而进行的。在该目的中,并非测定毛孔出口的直径,而是判断为适合测定堵塞于毛孔内部的角栓的直径,因此采用本方法。
<结果和考察>
若皮脂腺的全浆分泌为顺利进行,则皮脂腺细胞的遗骸堆积在毛孔中。堆积的结果可确认角栓尺寸,也就是角栓最大直径变大。换言之,只要促进皮脂腺的全浆分泌,就能够减少皮脂腺细胞遗骸在毛孔中的堆积,可减小角栓最大直径。而且,根据本结果,认为通过使用加入有作为自噬促进剂(认为是全浆分泌促进剂)的海藻糖的化妆水,减小了该最大直径。
- 脂联素分泌调节剂的评价或选择方法
- 脂联素分泌调节剂的评价或选择方法
