一种多价脑膜炎球菌多糖结合疫苗的制备方法
文献发布时间:2023-06-19 18:34:06
技术领域
本发明涉及疫苗制备领域,具体涉及一种多价脑膜炎球菌多糖结合疫苗的制备方法。
背景技术
流行性脑脊髓膜炎是由脑膜炎奈瑟菌(Neisseria meningitides,Nm)引起的严重性疾病。世界卫生组织(World health organization,WHO)的数据表明,若不及时治疗,流行性脑膜炎的致死率高达50%。儿童为主要易感人群,不仅致死率较高,且会造成严重的后遗症。因此,对脑膜炎的治疗和预防显得十分重要。已知有12个致病血清型,其中A、B、C、W135、Y群造成了约95%的病例,我国的主要致病血清型为A型,且C型有逐年上升的趋势。
脑膜炎球菌荚膜多糖疫苗免疫2岁以下儿童无法产生免疫记忆,免疫效果差。脑膜炎球菌多糖蛋白结合疫苗是通过化学键的方式将荚膜多糖与各种载体蛋白结合,形成稳定的化学结构,使T细胞非依赖性抗原转变为T细胞依赖性抗原。多糖蛋白结合疫苗能有效地激发2岁以下儿童以及免疫缺陷者的免疫反应与免疫记忆,且抗体维持时间长。相比多糖疫苗而言,多糖蛋白结合疫苗的覆盖年龄范围更广,免疫效果更好。因此,采用多价脑膜炎球菌多糖结合疫苗来预防流行性脑膜炎是当前最佳医疗策略。
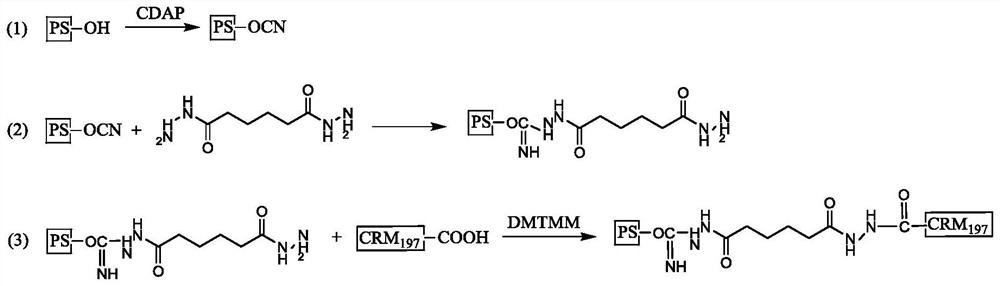
目前,通用的脑膜炎球菌多糖结合疫苗的结合路线如下:(1)在碱性条件下使用溴化氰(CNBr)或1-氰-4-二甲氨基-吡啶四氟硼酸盐(CDAP)将多糖上的羟基活化为氰基;(2)将活化后的多糖与己二酸二酰肼(ADH)的一个肼基连接,形成多糖-酰肼基衍生物;(3)多糖-酰肼基衍生物在碳二亚胺(EDAC)的作用下与白喉类毒素(DT)或破伤风类毒素(TT)形成稳定的结合物。实际生产使用上述载体蛋白时存在以下问题:这两种类毒素发酵时具有感染风险,需要使用大量有机试剂处理脱毒,且类毒素有回复毒性的风险。
白喉类毒素突变体(CRM197)是白喉毒素丧失了毒性的一种突变体,它是DT的核苷酸序列中由一个碱基G突变为A,从而导致了第52位氨基酸Gly突变为Glu。CRM197具有完整的DT功能结构,但不具有细胞毒性。因此,CRM197已经作为结合疫苗的载体蛋白在疫苗中得到了应用。由于在CRM197蛋白在EDAC作用下与多糖的结合效果较差,采用CRM197作载体蛋白通用的结合路线如下:首先使用高碘酸或高碘酸钠将多糖的羟基氧化为醛基,然后使醛基和CRM197蛋白的氨基反应,再加入硼氢化钠等还原剂将碳氮双键还原为碳氮键达到结合的目的。但以上结合路线所用如高碘酸、硼氢化钠等试剂的毒性及对环境污染均较大。
发明内容
为解决上述问题,本发明目的在于提供一种多价脑膜炎球菌多糖结合疫苗的制备方法,该方法采用将多糖-ADH衍生物与蛋白在DMTMM的作用下进行缩合反应,避免了使用毒性试剂及其对环境的污染。本发明采用DMTMM的优势还在于缩短了工艺周期,常规路线使用高碘酸氧化多糖,硼氢化钠还原双键一般实验周期为一周左右,而采用DMTMM试剂进行酰胺化路线则只需要4天。其次,同样作为酰胺化试剂,使用DMTMM试剂的收率是在同等条件下使用常规酰胺化试剂EDAC的3倍左右,即本发明的收率提升了200%。
本发明通过下述技术方案实现:
一种多价脑膜炎球菌多糖结合疫苗的制备方法,包括:将多糖衍生化获得多糖-ADH衍生物,再将多糖-ADH衍生物与蛋白结合,最后对产物进行分离纯化,所述多糖衍生物与蛋白结合步骤具体为:将多糖-ADH衍生物与白喉类毒素突变体CRM197在缩合剂4-(4,6-二甲氧基三嗪)-4-甲基吗啉盐酸盐DMTMM的作用下进行缩合反应,其中白喉类毒素突变体CRM197浓度为3~4毫克/毫升,DMTMM的浓度为10~30毫克/毫升,反应溶液调pH值为5.5~6.5,多糖-ADH衍生物与白喉类毒素突变体CRM197质量比为1:1。
多糖衍生化步骤中,需将反应溶液调节pH值9.0~10.0。调节pH值9.0~10.0具体方式为:加入多糖溶液等体积的0.1-0.3mol/L的NH
所述NH
进一步的,多糖衍生物与蛋白结合步骤中,调pH值为5.5~6.5具体为:在加入反应物后,加入与白喉类毒素突变体CRM197蛋白溶液等体积的0.1-0.3mol/L的磷酸盐缓冲液。现有技术均是采用酸或者碱进行pH调整,但采用酸、碱调pH时难以精确控制,对反应环境造成不必要的波动影响。本发明中磷酸盐缓冲液对于缩合剂在多糖-ADH衍生物与白喉类毒素突变体CRM197进行缩合反应的过程中起到辅助增强的作用。发明人在实验中发现,CRM197蛋白对于pH非常敏感,pH过高或过低,蛋白都会析出,如此在反应环境中,DMTMM并不能很好的发挥出作用,发明人最终选择了加入磷酸盐溶液作为反应环境的缓冲,磷酸盐溶液能够对反应环境的pH值起到动态调控的作用,以此能够将pH值对反应的影响降低到足够小,不仅如此,磷酸盐溶液还能够对反应激烈程度起到缓解的作用,从而辅助增强缩合剂在此反应环境中起到的促进反应作用,最后获得的收率有较高的提升。
所述NH
DMTMM的浓度为10毫克/毫升。
本发明与现有技术相比,具有如下的优点和有益效果:
本发明采用全新的结合路线,以CRM197作为载体蛋白制备A、C、Y、W135群四价脑膜炎球菌多糖结合疫苗,有效规避了还原胺化工艺存在的污染以及安全隐患,极大提高了疫苗制备的安全性。本发明流程简单,反应周期短,与传统工艺相比,整整缩短了四天,适用于工业生产。
附图说明
此处所说明的附图用来提供对本发明实施例的进一步理解,构成本申请的一部分,并不构成对本发明实施例的限定。在附图中:
图1为本发明反应示意图。
图2为A、C、W135、Y群脑膜炎球菌多糖结合CRM197蛋白的4FF层析柱分离图谱。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例和附图,对本发明作进一步的详细说明,本发明的示意性实施方式及其说明仅用于解释本发明,并不作为对本发明的限定。
实施例1 A群脑膜炎球菌多糖结合疫苗的制备方法(图1展示了反应原理。)
(1)A群脑膜炎球菌多糖的衍生化
将5毫克A群脑膜炎球菌多糖溶于250微升水中,加入0.2M NaOH溶液调节pH值至10。加入250微升浓度为20毫克/毫升的CDAP溶液进行活化,于室温下活化3min。结束活化后,与500微升浓度为40毫克/毫升的ADH混合,于4℃下反应过夜。反应结束后,用截留分子量为100kDa膜包超滤换液,超滤溶液为纯水,超滤体积为3升,除去未反应的CDAP和ADH。收集衍生化的多糖。
(2)衍生化多糖与蛋白结合
CRM197与衍生化的A群脑膜炎球菌多糖反应。CRM197与衍生化的A群脑膜炎球菌多糖以质量比1:1的比例混合,加入1毫升浓度为10毫克/毫升的DMTMM溶液,于室温下反应3h,得到A群脑膜炎球菌多糖结合物。用截留分子量为100kDa膜包超滤换液,超滤溶液为纯水,超滤体积为3升,除去DMTMM。收集多糖结合物。
(3)结合物的分离纯化
多糖结合物用凝胶过滤柱进行分离纯化,洗脱液为Tris Buffer,流速为1毫升/分钟。用波长为280nm的紫外检测器检测柱子的流出液。如图2所示,经缓冲液洗脱后出现2个洗脱峰。其中峰1对应于结合物,为主要的洗脱峰;2峰对应了没有结合的CRM197,为次洗脱峰。这表明A群脑膜炎球菌多糖结合CRM197后,分子量显著增加,出峰时间提前。收集峰1,使用注射用水超滤换液,除菌过滤后得到A糖脑膜炎球菌多糖结合疫苗原液。
实施例2 A群脑膜炎球菌多糖结合疫苗的另一种制备方法
(1)A群脑膜炎球菌多糖的衍生化
将5毫克A群脑膜炎球菌多糖溶于250微升水中,加入0.1mol/L的NH
(2)衍生化多糖与蛋白结合
CRM197与衍生化的A群脑膜炎球菌多糖反应。CRM197与衍生化的A群脑膜炎球菌多糖以质量比1:1的比例混合,加入等多糖溶液体积的0.2mol/L的磷酸盐缓冲液,加入1毫升浓度为10毫克/毫升的DMTMM溶液,于室温下反应3h,得到A群脑膜炎球菌多糖结合物。用截留分子量为100kDa膜包超滤换液,超滤溶液为纯水,超滤体积为3升,除去DMTMM。收集多糖结合物。
(3)结合物的分离纯化
多糖结合物用凝胶过滤柱进行分离纯化,洗脱液为Tris Buffer,流速为1毫升/分钟。用波长为280nm的紫外检测器检测柱子的流出液。如图2所示,经缓冲液洗脱后出现2个洗脱峰。其中峰1对应于结合物,为主要的洗脱峰;2峰对应了没有结合的CRM197和多糖,为次洗脱峰。这表明A群脑膜炎球菌多糖结合CRM197后,分子量显著增加,出峰时间提前。收集峰1,使用注射用水超滤换液,除菌过滤后得到A糖脑膜炎球菌多糖结合疫苗原液。根据层析图将峰1洗脱液收集,测得的结合率为40%;结合物KD值在0.2以前的洗脱液多糖回收率均大于90%。
实施例3
(1)A群脑膜炎球菌多糖的衍生化
将5毫克A群脑膜炎球菌多糖溶于250微升水中,加入0.1mol/L的NH
(2)衍生化多糖与蛋白结合
CRM197与衍生化的A群脑膜炎球菌多糖反应。CRM197与衍生化的A群脑膜炎球菌多糖以质量比1:1的比例混合,加入1毫升浓度为10毫克/毫升的DMTMM溶液,于室温下反应3h,得到A群脑膜炎球菌多糖结合物。用截留分子量为100kDa膜包超滤换液,超滤溶液为纯水,超滤体积为3升,除去DMTMM。收集多糖结合物。
(3)结合物的分离纯化
多糖结合物用凝胶过滤柱进行分离纯化,洗脱液为Tris Buffer,流速为1毫升/分钟。用波长为280nm的紫外检测器检测柱子的流出液。如图2所示,经缓冲液洗脱后出现2个洗脱峰。其中峰1对应于结合物,为主要的洗脱峰;2峰对应了没有结合的CRM197,为次洗脱峰。这表明A群脑膜炎球菌多糖结合CRM197后,分子量显著增加,出峰时间提前。收集峰1,使用注射用水超滤换液,除菌过滤后得到A糖脑膜炎球菌多糖结合疫苗原液。根据层析图将峰1洗脱液收集,测得的结合率为40%;结合物KD值在0.2以前的洗脱液多糖回收率均大于90%。
实施例4 C群四价脑膜炎球菌多糖结合疫苗的制备方法
(1)C群脑膜炎球菌多糖的衍生化
将20毫克C群脑膜炎球菌多糖溶于1毫升水中,加入0.1mol/L的NH
(2)衍生化多糖与蛋白结合
CRM197与衍生化的C群脑膜炎球菌多糖反应。CRM197与衍生化的C群脑膜炎球菌多糖以质量比1:1的比例混合,加入等多糖溶液体积的0.2mol/L的磷酸盐缓冲液,加入4毫升浓度为5毫克/毫升的4-(4,6-二甲氧基三嗪)-4-甲基吗啉盐酸盐(DMTMM)溶液,于室温下反应4h,得到A群脑膜炎球菌多糖结合物。用截留分子量为100kDa膜包超滤换液,超滤溶液为纯水,超滤体积为15升,除去DMTMM。收集多糖结合物。
(3)结合物的分离纯化
多糖结合物用凝胶过滤柱进行分离纯化,洗脱液为Tris Buffer,流速为1毫升/分钟。用波长为280nm的紫外检测器检测柱子的流出液。如图2所示,经缓冲液洗脱后出现2个洗脱峰。其中峰1对应于结合物,为主要的洗脱峰;2峰对应了没有结合的CRM197和多糖,为次洗脱峰。这表明C群脑膜炎球菌多糖结合CRM197后,分子量显著增加,出峰时间提前。收集峰1,使用注射用水超滤换液,除菌过滤后得到C糖脑膜炎球菌多糖结合疫苗原液。根据层析图将峰1洗脱液收集,测得的结合率大于40%;结合物KD值在0.2以前的洗脱液多糖回收率均大于90%。
实施例5 W135群脑膜炎球菌多糖结合疫苗的制备方法
(1)W135群脑膜炎球菌多糖的衍生化
将50毫克W135群脑膜炎球菌多糖溶于2.5毫升水中,加入0.1mol/L的NH
(2)衍生化多糖与蛋白结合
CRM197与衍生化的W135群脑膜炎球菌多糖反应。CRM197与衍生化的W135群脑膜炎球菌多糖以质量比1:1的比例混合,加入等多糖溶液体积的0.2mol/L的磷酸盐缓冲液,加入10毫升浓度为10毫克/毫升的DMTMM溶液,于室温下反应4h,得到W135群脑膜炎球菌多糖结合物。用截留分子量为100kDa膜包超滤换液,超滤溶液为纯水,超滤体积为4升,除去DMTMM。收集多糖结合物。
(3)结合物的分离纯化
多糖结合物用凝胶过滤柱进行分离纯化,洗脱液为Tris Buffer,流速为1毫升/分钟。用波长为280nm的紫外检测器检测柱子的流出液。如图2所示,经缓冲液洗脱后出现2个洗脱峰。其中峰1对应于结合物,为主要的洗脱峰;2峰对应了没有结合的CRM197,为次洗脱峰。这表明W135群脑膜炎球菌多糖结合CRM197后,分子量显著增加,出峰时间提前。收集峰1,使用注射用水超滤换液,除菌过滤后得到W135糖脑膜炎球菌多糖结合疫苗原液。根据层析图将峰1洗脱液收集,测得的结合率大于40%;结合物KD值在0.2以前的洗脱液多糖回收率均大于90%。
实施例6 Y群脑膜炎球菌多糖结合疫苗的制备方法
(1)Y群脑膜炎球菌多糖的衍生化
将50毫克Y群脑膜炎球菌多糖溶于2.5毫升水中,加入0.1mol/L的NH
(2)衍生化多糖与蛋白结合
CRM197与衍生化的Y群脑膜炎球菌多糖反应。CRM197与衍生化的Y群脑膜炎球菌多糖以质量比1:1的比例混合,加入等多糖溶液体积的0.2mol/L的磷酸盐缓冲液,加入10毫升浓度为10毫克/毫升的DMTMM溶液,于室温下反应4h,得到Y群脑膜炎球菌多糖结合物。用截留分子量为100kDa膜包超滤换液,超滤溶液为纯水,超滤体积为4升,除去DMTMM。收集多糖结合物。
(3)结合物的分离纯化
多糖结合物用凝胶过滤柱进行分离纯化,洗脱液为Tris Buffer,流速为1毫升/分钟。用波长为280nm的紫外检测器检测柱子的流出液。如图2所示,经缓冲液洗脱后出现2个洗脱峰。其中峰1对应于结合物,为主要的洗脱峰;2峰对应了没有结合的CRM197和Y群多糖,为次洗脱峰。这表明Y群脑膜炎球菌多糖结合CRM197后,分子量显著增加,出峰时间提前。收集峰1,使用注射用水超滤换液,除菌过滤后得到Y糖脑膜炎球菌多糖结合疫苗原液。根据层析图将峰1洗脱液收集,测得的结合率大于40%;结合物KD值在0.2以前的洗脱液多糖回收率均大于90%。
对比例1传统制备A群脑膜炎球菌多糖结合疫苗的方法
50毫克A群脑膜炎球菌多糖溶于2.5毫升水中,加入一定质量的高碘酸钠氧化多糖,在23℃下避光反应19小时,反应结束,使用100KD膜包用纯化水超滤10次以上。超滤结束,用0.22um的囊氏滤器过滤。然后加入25倍多糖质量的蔗糖冻干。冻干后使用0.21mol/L的pH为7的磷酸盐缓冲溶液溶解,然后加入7倍多糖质量的氰基硼氰化纳还原,在室温下,避光反应48小时。反应结束,加入硼氢化纳避光封闭5小时。反应结束,用截留分子量为100kDa膜包超滤换液,超滤溶液为纯水,超滤体积为4升,除去未反应的氰基硼氢化纳。收集多糖结合物。
对比例2和实施例2类似,将缩合剂换成EDAC。
对比例3和实施例2类似,将第一步的缓冲液换成BBS缓冲液。
实验结果如下:
表1实施例和对比例收率和工艺周期
实施例7 A、C、Y、W135群脑膜炎球菌多糖蛋白结合疫苗安全性及免疫原性试验
(1)疫苗安全性评价
小鼠皮下注射ACYW135群脑膜炎球菌结合疫苗(MCV4)0.5ml/只,观察小鼠7天内的存活情况以及有无异常反应,并在注射前及注射后第7天称量小鼠体重,体重增加判为合格。对照小鼠注射等体积的生理盐水。安全性评价结果显示,在注射后7天内,小鼠全部存活且未出现明显异常反应,且每只小鼠的体重均增加,见表1。实验结果表明本发明制备的MCV4疫苗接种对小鼠体重增长无影响,疫苗的安全性良好
表1小鼠安全性评价试验结果
(2)免疫原性采用60只18~22g BaLb/C小鼠,随机分为6组,每组10只。分别于0天和14天皮下注射单价疫苗原液或MCV4,每次注射剂量为0.5ml/只,在首免后第7天、21天采血。对照组小鼠注射生理盐水。分别用A、C、Y、W135群脑膜炎球菌抗体检测ELISA试剂盒对小鼠血清IgG抗体进行测定,具体的方法按照说明书进行。计算抗体阳转率:cut-off值,阴性对照平均吸光度(A)值×2.1,疫苗组A值>cut-off值时即判定为阳性。结果显示各单价疫苗原液和MCV4接种小鼠的抗体阳转均为100%。
本发明中,未详细描述的均是现有技术。
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
