用于抑制细胞外囊泡的分泌的细胞外囊泡分泌抑制剂及其用途
文献发布时间:2023-06-19 19:07:35
技术领域
本发明涉及一种用于抑制来自细胞的细胞外囊泡的分泌的细胞外囊泡分泌抑制剂及其用途。
背景技术
近年来,由细胞分泌的外泌体等细胞外囊泡备受关注。所述细胞外囊泡内含微小RNA(miRNA)等核酸、蛋白质。然后,由于这些内含物从分泌所述细胞外囊泡的细胞经由所述细胞外囊泡传递至接受侧的细胞,因此细胞外囊泡被认为是作为细胞间的通讯工具发挥作用。作为具体例,例如,已报告了关于癌的转移,也有由原发癌分泌的细胞外囊泡的参与。
发明内容
发明要解决的课题
然而,来自细胞的细胞外囊泡的分泌是如何控制的,其分泌的机制尚未被阐明。一旦所述细胞外囊泡的分泌的机制被阐明,也可以例如通过基于该机制抑制所述细胞外囊泡的分泌,容易地分析所述细胞外囊泡的分泌对生物体的影响。此外,如果是由所述细胞外囊泡的分泌引起的疾病等,也可以通过基于所述机制抑制所述细胞外囊泡的分泌来治疗该疾病。
因此,本发明的目的是提供一种针对来自细胞的细胞外囊泡的分泌的、新的分泌抑制剂及分泌抑制方法。
用于解决课题的手段
为了实现所述目的,本发明是一种用于抑制来自细胞的细胞外囊泡的分泌的细胞外囊泡分泌抑制剂,其特征在于,含有丝氨酸合成途径的阻滞剂。
本发明的分泌抑制方法是来自细胞的细胞外囊泡的分泌的抑制方法,其特征在于,包括将本发明的细胞外囊泡分泌抑制剂施用于给药对象的步骤。
本发明的筛选方法是一种用于抑制来自细胞的细胞外囊泡的分泌的细胞外囊泡分泌抑制剂的候选物质的筛选方法,其特征在于,从被检物质中选择阻滞丝氨酸合成途径的阻滞物质作为抑制来自细胞的细胞外囊泡的分泌的候选物质。
发明的效果
本发明人等经过深入研究,结果发现,丝氨酸合成途径参与来自细胞的细胞外囊泡的分泌,能够通过阻滞丝氨酸合成途径,抑制来自细胞的细胞外囊泡的分泌。如上所述,关于来自细胞的细胞外囊泡的分泌的机制尚未被阐明,本发明人等首次发现了这一点。根据本发明,能够通过丝氨酸合成途径的阻滞抑制来自细胞的细胞外囊泡的分泌。因此,通过根据本发明进行分泌抑制,也可以例如分析细胞外囊泡的分泌或分泌的抑制对生物体的影响。因而,本发明可以说是例如在医疗领域中非常有用的技术。
附图说明
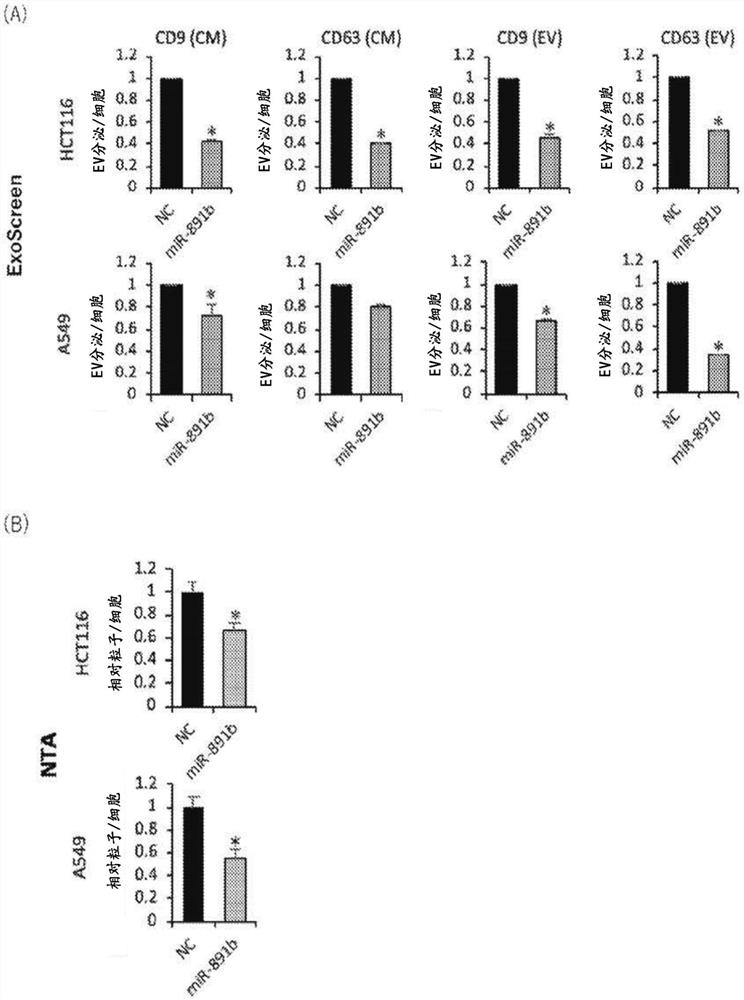
【图1】图1中,(A)是示出了对于转染了miR-891b的转化体(miR-891b)和作为阴性对照的转化体(NC),利用ExoScreen法的EV量的相对值的图;(B)是示出了利用NTA法的EV量的相对值的图。
【图2】图2中,(A)是示出了对于转染了siPSAT1的转化体(siPSAT1)和作为阴性对照的转化体(NC),利用ExoScreen法的EV量的相对值的图;(B)是示出了利用NTA法的EV量的相对值的图。
【图3】图3中,(A)是示出了对于所述转化体(miR-891b)和所述转化体(NC)的PSAT1基因的表达量的相对值的图;(B)是示出了PSAT1蛋白的相对值的图;(C)是示出了PSAT1基因的3’UTR与miR-891b的关系的图;(D)是示出了转染了PSAT1基因和miR-891b的转化体中PSAT1的表达量的图。
【图4】图4是示出了对于用siPSAT1转染各种癌细胞的转化体(siPSAT1)和作为阴性对照的转化体(NC),利用NTA法的分泌EV量的相对值的图。
【图5】图5是示出了对于用siPSAT1转染癌细胞的转化体(siPSAT1)和作为阴性对照的转化体(NC),细胞内CD63阳性EV的相对量的图。
【图6】图6是对于用siPSAT1转染癌细胞的转化体(siPSAT1)和作为阴性对照的转化体(NC),在不含丝氨酸的培养基或含有丝氨酸的培养基中的培养的结果,其中,(A)是示出了利用ExoScreen法的分泌EV量的相对值的图;(B)是示出了利用NTA法的分泌EV量的相对值的图。
【图7】图7是示出了细胞内CD63阳性EV的相对量的图。
【图8】图8是示出了对于使丝氨酸合成的阻滞剂共存的癌细胞,利用NTA法的分泌EV量的相对值的图。
【图9】图9是示出了对于用siPSAT1转染各种癌细胞的转化体(siPSAT1)和作为阴性对照的转化体(NC),利用NTA法的分泌EV量的相对值的图。
【图10】图10是乳腺癌转移株MDA-MB-231_Luc_D3H2LN的结果,其中,(A)是示出了利用NTA法的分泌EV量的相对值的图;(B)是示出了PSAT1蛋白的表达的免疫印迹法的照片。
【图11】图11是移植了乳腺癌转移株的小鼠的结果,其中,(A)是示出了小鼠的原发灶(乳腺)的肿瘤体积的图;(B)是原发灶(乳腺)的肿瘤重量的图。
【图12】图12是沉默了PSAT1或PHGDH的肺癌细胞的结果,其中,(A)是细胞存活率的结果;(B)是示出了利用NTA法的分泌EV量的相对值的图;(C)是示出了利用ExoScreen法的分泌EV量的相对值的图。
【图13】图13是沉默了PSAT1或PHGDH的大肠癌细胞的结果,其中,(A)是细胞存活率的结果;(B)是示出了利用NTA法的分泌EV量的相对值的图;(C)是示出了利用ExoScreen法的分泌EV量的相对值的图。
【图14】图14是示出了每个细胞的EV分泌量的图,其中,(A)是大肠的正常上皮细胞的结果;(B)是肺的正常上皮细胞的结果。
具体实施方式
本发明的细胞外囊泡(extracellular vesicle;EV)分泌抑制剂,以下称为EV分泌抑制剂。
根据本发明的EV分泌抑制剂,例如,所述阻滞剂为抑制丝氨酸合成途径中的酶蛋白的表达的表达抑制物质或抑制丝氨酸合成途径中的酶蛋白的催化功能的催化功能抑制物质。
根据本发明的EV分泌抑制剂,例如,所述丝氨酸合成途径为包含PSAT1的合成途径。
根据本发明的EV分泌抑制剂,例如,所述丝氨酸合成途径的阻滞剂为PSAT1蛋白的表达抑制物质或催化功能抑制物质。
根据本发明的EV分泌抑制剂,例如,所述丝氨酸合成途径的阻滞剂为PHGDH蛋白的表达抑制物质或催化功能抑制物质。
根据本发明的EV分泌抑制剂,例如,所述丝氨酸合成途径的阻滞剂为PSPH蛋白的表达抑制物质或催化功能抑制物质。
根据本发明的EV分泌抑制剂,例如,所述细胞为癌细胞。
根据本发明的EV分泌抑制剂,例如,所述癌细胞为选自由大肠癌细胞、肺癌细胞、黑色素瘤细胞、乳腺癌细胞、胰腺癌细胞以及多发性骨髓瘤细胞组成的组中的至少一种。
根据本发明的EV分泌抑制剂,例如,所述细胞为病毒感染细胞。
根据本发明的EV分泌抑制剂,例如,所述阻滞剂为低分子化合物、蛋白质或肽。
根据本发明的EV分泌抑制剂,例如,针对所述酶蛋白的表达抑制物质为选自由抑制自编码所述酶蛋白的基因的转录的物质、降解经转录的转录产物的物质以及抑制自所述转录产物的蛋白的翻译的物质组成的组中的至少一种。
根据本发明的EV分泌抑制剂,例如,所述表达抑制物质为选自由miRNA、siRNA、反义物以及核酶组成的组中的至少一种核酸物质。
根据本发明的EV分泌抑制剂,例如,所述表达抑制物质为表达所述核酸物质的表达载体。
根据本发明的EV分泌抑制剂,例如,所述蛋白的功能抑制物质为针对所述酶蛋白的活性阻滞物质或活性中和物质。
根据本发明的EV分泌抑制剂,例如,所述活性中和物质为针对所述蛋白的抗体或抗原结合片段。
根据本发明的EV分泌抑制剂,例如,所述功能抑制物质为表达所述活性中和物质的表达载体。
根据本发明的EV分泌的抑制方法,例如,所述细胞为癌细胞。
根据本发明的EV分泌的抑制方法,例如,所述癌细胞为选自由大肠癌细胞、肺癌细胞、黑色素瘤细胞、乳腺癌细胞、胰腺癌细胞以及多发性骨髓瘤细胞组成的组中的至少一种。
根据本发明的EV分泌的抑制方法,例如,所述细胞为病毒感染细胞。
根据本发明的EV分泌的抑制方法,例如,所述给药对象为人或非人动物。
根据本发明的EV分泌的抑制方法,例如,所述给药在体内或体外进行。
根据本发明的EV分泌抑制剂的候选物质的筛选方法,例如,所述细胞为癌细胞。
根据本发明的EV分泌抑制剂的候选物质的筛选方法,例如,所述癌细胞为选自由大肠癌细胞、肺癌细胞、黑色素瘤细胞、乳腺癌细胞、胰腺癌细胞以及多发性骨髓瘤细胞组成的组中的至少一种。
根据本发明的EV分泌抑制剂的候选物质的筛选方法,例如,所述细胞为病毒感染细胞。
<细胞外囊泡分泌抑制剂>
本发明的细胞外囊泡(EV)分泌抑制剂(以下称为EV分泌抑制剂)为用于抑制来自细胞的细胞外囊泡的分泌的抑制剂。如上所述,本发明的EV分泌抑制剂的特征在于含有丝氨酸合成途径的阻滞剂。本发明的EV分泌抑制剂的特征在于含有所述阻滞剂,其他的结构和条件没有特别限制。此外,本发明的EV分泌抑制剂,可以援引后述的本发明的EV分泌的抑制方法等的记载。
本发明中,所述阻滞剂可以是针对丝氨酸合成途径中的酶蛋白的表达抑制物质,也可以是针对丝氨酸合成途径中的酶蛋白的催化功能抑制物质。如上所述,本发明的特征在于发现丝氨酸合成途径的表达行为控制EV分泌,通过阻滞丝氨酸的合成,能够抑制来自细胞的EV分泌。因此,关于阻滞丝氨酸合成的物质的种类及阻滞的方法没有任何限制。
所述阻滞剂只要能够阻滞丝氨酸合成途径即可,对于该阻滞的形式没有特别限制。即,可以通过抑制丝氨酸合成途径中的酶蛋白的表达来阻滞,也可以通过抑制丝氨酸合成途径中的酶蛋白的催化功能来阻滞。在前一种情况下,所述阻滞剂是例如针对丝氨酸合成途径中的酶蛋白的表达抑制物质;在后一种情况下,所述阻滞剂是例如针对丝氨酸合成途径中的酶蛋白的催化功能抑制物质。根据本发明的EV分泌抑制剂,例如,作为有效成分的所述阻滞剂,可以包含所述表达抑制物质,也可以包含所述催化功能抑制物质,还可以包含前者和后者两者。
所述阻滞剂的种类没有特别限制,例如可以举出核酸物质等低分子化合物、抗体等蛋白质、抗原结合片段等肽等。
所述表达抑制物质,例如,可以是抑制在来自编码所述酶蛋白的基因(以下,也称为靶基因)的所述酶蛋白(以下,也称为靶蛋白)的表达中的转录及翻译中的任一步骤的物质,没有特别限制。作为转录的抑制,例如可以举出从DNA到mRNA前体的转录的阻滞、由mRNA前体形成成熟mRNA的RNA加工的阻滞、mRNA前体或成熟mRNA的降解等。作为所述翻译的抑制,例如可以举出自成熟mRNA的翻译的阻滞、翻译产物的修饰的阻滞等。
所述表达抑制物质,例如是核酸物质(以下,也称为核酸型抑制物质),可以是直接抑制表达的形态(第1形态),也可以是在体内(in vivo)、体外(in vitro)或离体(ex vivo)的环境下成为抑制表达的状态的前体的形态(第2形态)。
所述第1形态的表达抑制物质,例如可以举出反基因、反义物(反义寡核苷酸)、RNA干扰(RNAi)物质、核酶等。RNAi物质,例如可以举出siRNA、miRNA等。反基因例如阻滞mRNA的转录;反义物和miRNA例如阻滞自mRNA的翻译;siRNA和核酶例如降解mRNA。对于这些表达抑制物质,例如所述靶基因的整个区域和部分区域中的任一区域都可以作为靶区域。作为具体例,反义物和miRNA例如能够被设计成结合至自靶基因转录的mRNA的3'UTR区域;siRNA和核酶例如能够被设计成完全互补地结合至自靶基因转录的mRNA的一部分区域。
所述第1形态的表达抑制物质例如可以通过后述的筛选方法获得,或者也可以根据所述靶基因的序列来设计。
所述第1形态的表达抑制物质例如可以是单链或双链。所述表达抑制物质的结构单元没有特别限制,例如可以举出含有糖、嘌呤或嘧啶等碱基和磷酸的脱氧核糖核苷酸骨架或核糖核苷酸骨架,除此之外,例如还可以是含有吡咯烷或哌啶等碱基的非核苷酸骨架等。这些骨架可以是修饰型或非修饰型。此外,所述结构单元例如可以是天然型或人工非天然型。所述表达抑制物质例如可以由相同的结构单元形成或由两个种类以上的结构单元形成。
如上所述,所述第2形态的表达抑制物质是所述前体,作为具体例,可以举出表达所述第1形态的表达抑制物质的前体。例如,所述前体,可以通过施用于对象,例如,在体内、体外或离体的环境下,使所述第1形态的表达抑制物质表达并发挥作用。
所述前体,例如可以举出含有所述第1形态的表达抑制物质和接头的形态。作为具体例,所述前体可以举出用所述接头连结siRNA的两条链的形态。根据这样的前体,例如,可以在体内、体外或离体的环境下,通过切断所述前体,从所述前体除去所述接头,生成(表达)双链siRNA。作为所述前体的具体例,例如可以例示通过切断生成siRNA的shRNA等。
此外,所述前体例如可以是插入了所述第1形态的表达抑制物质的编码序列的表达载体。根据所述表达载体,例如,可以在体内、体外或离体的环境下,表达所述第1形态的表达抑制物质。在所述表达载体中,例如可以插入前述shRNA等前体的编码序列。所述表达载体的种类没有特别限制,例如可以举出质粒载体、病毒载体等,所述病毒载体,例如可以举出腺病毒载体、仙台病毒载体等。
所述催化功能抑制物质,例如可以举出阻滞所述酶蛋白的活性的活性阻滞物质、中和所述酶蛋白的活性的活性中和物质。
所述活性阻滞物质没有特别限制,可以举出低分子化合物等。
所述活性中和物质,例如可以举出针对所述酶蛋白的抗体或抗原结合片段(抗原结合肽)(以下,统称为抗体型抑制物质)。所述抗体型抑制物质,例如通过与所述酶蛋白的结合,能够抑制所述酶蛋白的功能,因此也称为中和抗体或中和抗原结合片段。所述抗体型抑制物质,例如也可以通过后述的筛选方法获得。
所述抗体例如可以是单克隆抗体、多克隆抗体中的任一种,此外,其同种型没有特别限制,例如可以举出IgG、IgM、IgA等。所述抗体在施用于人时,例如优选完全人抗体、人源化抗体、嵌合抗体等。
所述抗原结合片段例如可以举出具有所述抗体的互补性决定区域(CDR)的片段,只要能够识别并结合所述靶蛋白的目标部位即可。作为具体例,所述抗原结合片段,例如可以举出Fab、Fab’、F(ab’)等片段等。
所述催化功能抑制物质,例如可以是直接抑制所述酶蛋白的催化功能的第1形态也可以是在体内、体外或离体的环境下成为抑制表达的状态的前体的第2形态。所述第1形态的催化功能抑制物质,例如是如上所述的抗体型抑制物质。此外,所述第2形态的前体,例如可以举出插入了抑制所述酶蛋白的催化功能的蛋白质或肽的编码序列的表达载体。所述表达载体的种类没有特别限制,与前述同样,可以举出质粒载体、病毒载体等。
此外,所述催化功能抑制物质,例如可以是所述酶蛋白具有催化活性且不失去其作为催化剂的功能但抑制其能够发挥作用的状态的物质。即,作为具体例,可以是使所述酶蛋白发挥作用所需的基质减少或使基质改变等抑制物质。所述基质的减少,例如可以是基质的生成的抑制,也可以是基质的分解。
丝氨酸合成途径,例如可以举出下式所示的合成途径(I)。本发明的EV分泌抑制剂,例如优选含有包含PSAT1的丝氨酸合成途径(I)的阻滞剂。如上所述,本发明人等发现丝氨酸合成途径的表达行为控制EV分泌。具体地,得到了以下见解:例如,癌细胞等非正常细胞由于丝氨酸合成途径的基因及其编码的蛋白的表达过度,与正常细胞相比较,EV分泌量增加。然后,对于该丝氨酸合成途径中的蛋白,具体地,例如下述丝氨酸合成途径(I)中的蛋白,确认通过抑制(阻滞)对其进行编码的基因的表达或抑制(阻滞)功能,能够抑制非正常细胞的EV分泌的增加,从而确立了本发明。本发明中的EV分泌的抑制例如可以说是EV分泌的增加的抑制,具体地,例如也可以说是抑制EV分泌增加超过正常水平。
【化1】
PHGDH是D-3-磷酸甘油酸脱氢酶(D-3-Phosphoglycerate Dehydrogenase)。人PHGDH蛋白及对其进行编码的PHGDH基因在数据库(Genetic Testing Registry(GTR))中以Gene ID:26227注册。针对PHGDH的表达抑制物质,例如可以根据PHGDH基因的序列来设定。此外,针对所述PHGDH的催化功能抑制物质,例如可以使用NCT-503、CBR-5884等阻滞剂、PHGDH抗体等中和抗体。
PSAT1是磷酸丝氨酸氨基转移酶1(Phosphoserine Aminotransferase 1)。人PSAT1蛋白及对其进行编码的PSAT1基因在数据库(GTR)中以Gene ID:29968注册。针对PSAT1的表达抑制物质,例如可以根据PSAT1基因的序列来设定,作为具体例,可以使用miR-891b等。此外,针对所述PSAT1的催化功能抑制物质,例如可以使用PSAT1抗体等中和抗体。
PSPH是磷酸丝氨酸磷酸酶(Phosphoserine Phosphatase)。人PSPH蛋白及对其进行编码的PSPH基因在数据库(GTR)中以Gene ID:5723注册。针对PSPH的表达抑制物质,例如可以根据PSPH基因的序列来设定。此外,针对所述PSPH的催化功能抑制物质,例如可以使用PSPH抗体等中和抗体。
本发明中,丝氨酸合成途径的阻滞剂,例如可以是PSAT1蛋白的表达抑制物质和催化功能抑制物质、PHGDH蛋白的表达抑制物质和催化功能抑制物质、以及PSPH蛋白的表达抑制物质和催化功能抑制物质中的任一种,可以包括其中任一个种类,也可以包括两个种类以上。
本发明的EV分泌抑制剂,例如可以仅含有所述有效成分,也可以进一步含有其他添加成分。所述添加成分没有特别限制,例如可以举出以下成分,优选药理学上可容许的成分。所述添加成分,例如可以根据所述EV分泌抑制剂的给药方法、给药对象及剂型等适当设定。
所述添加成分,例如可以举出赋形剂。所述赋形剂,例如可以举出水性溶剂、醇溶剂、多元醇溶剂、油性溶剂、它们的混合溶剂(例如,乳化溶剂)等液体介质、乳糖、淀粉等。所述水性溶剂,例如可以举出水、生理盐水、氯化钠等的等渗液等;油性溶剂,例如可以举出大豆油等。所述添加成分除此之外,例如还可以举出淀粉糊等粘合剂;淀粉、碳酸盐等崩解剂;滑石、蜡等润滑剂等。此外,所述添加成分例如可以包括用于将所述有效成分递送至目的部位的DDS剂。
本发明中,成为EV的分泌抑制的对象的细胞没有特别限制,通过抑制细胞外囊泡的分泌,希望确认分泌的影响或分泌抑制的影响的细胞成为对象。所述细胞例如可以是正常细胞,也可以是对于目的项目非正常的细胞。所谓对于所述目的项目非正常,没有特别限制,例如,在所述项目为癌的情况下,非正常的细胞可以是癌细胞;在所述项目为病毒感染的情况下,非正常的细胞可以是病毒感染细胞。根据本发明,例如由于能够分析癌的发生、转移、治疗等机制,因此作为所述细胞,优选癌细胞。特别地,如上所述,由于细胞外囊泡起到细胞间的信息传递的作用,因此优选转移至其他器官(脏器)的原发癌的癌细胞。所述癌细胞没有特别限制,例如可以举出大肠癌细胞、肺癌细胞、黑色素瘤细胞、乳腺癌细胞、胰腺癌细胞或多发性骨髓瘤细胞等。此外,根据本发明,例如,由于可以分析病毒感染的机制,因此作为所述细胞,优选病毒感染细胞。所述病毒的种类没有特别限制,例如可以举出流感病毒、冠状病毒等。
本发明中,细胞外囊泡例如是通过内吞途径分泌的外泌体、微囊泡(microvesicle)、凋亡小体等,其中,例如是外泌体。外泌体通常可以通过Alix、Tsg101、CD81、CD63、CD9、筏蛋白(flotillin)等标记分子来检测。
本发明的EV分泌抑制剂的使用方法没有特别限制,例如可以添加到希望抑制细胞外囊泡的分泌的对象中,添加方法没有特别限定,例如,可以是体内、体外或离体。本发明的EV分泌抑制剂的添加对象例如是细胞或组织、或者生物体等。所述细胞和组织的种类以及生物体的部位(器官)没有特别限制,例如可以举出大肠、肺、皮肤、乳房、乳管、乳腺、胰腺以及骨髓等。所述细胞和组织例如可以是从生物体分离的,也可以是细胞系或其培养物。所述添加对象的细胞和组织例如可以人来源,也可以是非人动物来源。此外,所述添加对象的生物体例如可以是人,也可以是非人动物。所述非人动物,例如可以举出小鼠、大鼠、兔、马、羊、牛、骆驼等哺乳动物。在所述添加对象为非人动物来源或非人动物的情况下,所述EV分泌抑制物质例如优选为与该特定的非人动物来源的靶蛋白(所述酶蛋白)或靶基因相对特异性地对应的抑制物质,此外,在所述添加对象为人来源或人的情况下,所述抑制物质例如优选为与人来源的所述靶蛋白或靶基因相对特异性地对应的抑制物质。
本发明的EV分泌抑制方法是抑制来自细胞的EV的分泌的方法,其特征在于,包括将所述本发明的EV分泌抑制剂施用于给药对象的步骤。本发明的要点在于使用所述本发明的EV分泌抑制剂,其他的步骤和条件没有特别限制。关于所述本发明的EV分泌抑制方法,可以援引所述本发明的EV分泌抑制剂中的记载。
在所述给药对象为细胞的情况下,例如,在培养基的存在下,通过添加所述EV分泌抑制剂并孵育,能够抑制来自所述细胞的EV分泌。所述孵育条件没有特别限制,例如可以根据细胞的种类来设定所述培养基、温度、时间、湿度等。
在所述给药对象为组织的情况下,例如,在培养基的存在下,通过添加所述EV分泌抑制剂并孵育,能够抑制来自构成所述组织的细胞的EV分泌。所述孵育条件没有特别限制,例如可以根据组织的种类、大小等来设定所述培养基、温度、时间、湿度等。
在所述给药对象为生物体的情况下,所述EV分泌抑制剂的给药方法没有特别限制,例如可以举出非口服给药、口服给药、静脉给药等。给药条件没有特别限制,例如可以根据生物体的种类、给药对象的器官的种类等适当决定。
在所述非口服给药的情况下,给药部位例如可以是对象器官,即具有希望抑制EV分泌的细胞的器官(也称为对象部位),也可以是能够将作为所述EV分泌抑制剂的有效成分的所述阻滞剂递送至所述对象部位的部位。作为具体例,例如,在对象细胞为大肠细胞的情况下,给药部位可以是作为对象部位的大肠,也可以是能够将所述阻滞剂递送至大肠的部位。此外,例如,在对象细胞是肺细胞的情况下,给药部位可以是作为对象部位的肺,也可以是能够将所述阻滞剂递送至肺的部位,对于其他器官也是同样的。所述非口服给药的方法例如可以举出患部注射、静脉注射、皮下注射、皮内注射、滴注、经皮给药等。所述EV分泌抑制剂的形态没有特别限制,如上所述,可以根据给药方法等适当设定,可以援引前述记载。
在非口服给药的情况下,剂型没有特别限制,可以根据给药方法适当决定,例如为液状、乳膏状、凝胶状等,可以通过将介质与所述阻滞剂混合来制备。所述介质中,水性溶剂例如为生理盐水、等渗液等;油性溶剂例如为大豆油等;乳化溶剂例如为它们的混合液。所述非口服给药剂例如可以进一步含有醇、多元醇、表面活性剂等。此外,所述非口服给药剂可以包含用于将所述阻滞剂从对象部位以外的部位有效地递送至所述对象部位的DDS剂。另外,在所述对象部位的组织中,例如,在将所述阻滞剂有效地递送至癌细胞的情况下,所述非口服给药剂例如也可以包含特异性地识别所述癌细胞的DDS剂。
在所述口服给药的情况下,口服给药剂的剂型没有特别限制,例如可以举出片剂、丸剂、颗粒剂、散剂、胶囊剂、糖浆剂等。所述口服给药剂例如可以含有稀释剂、赋形剂、载体等。此外,所述口服给药剂例如可以包含用于将所述阻滞剂有效地递送至所述对象部位的DDS剂。另外,在所述对象部位的组织中,例如,在将所述阻滞剂有效地递送至癌细胞的情况下,所述口服给药剂例如也可以包含特异性地识别所述癌细胞的DDS剂。
在对所述生物体的给药中,本发明的EV分泌抑制剂的给药条件例如可以根据年龄、体重、给药对象的器官的种类、性别等适当决定。
本发明人等报告了作为癌的转移的机制,通过原发癌的癌细胞分泌细胞外囊泡,经由所述细胞外囊泡的细胞间的信息传递,产生癌的转移。根据本发明的EV分泌抑制剂,如上所述,通过对已患癌的患者的对象部位(癌器官)的给药,抑制来自所述对象部位中癌细胞的细胞外囊泡的分泌,能够抑制癌的进展并抑制癌向其他器官的转移。因此,本发明的EV分泌抑制剂例如也可以用作癌治疗剂。本说明书中,治疗包括例如所谓的用于减缓癌的进展、治愈癌等的行为,以及用于预防癌的患病、复发的行为。本发明的EV分泌抑制剂例如可以用作任一种目的,也可以用作两种及以上的目的。
在这种情况下,在对所述生物体的给药中,本发明的EV分泌抑制剂的给药条件例如除了前述例示的项目之外,可以进一步根据癌的种类(例如大肠癌、肺癌、黑色素瘤、乳腺癌、胰腺癌以及多发性骨髓瘤等)、癌的进展度等适当决定。此外,所述生物体例如,从治疗的观点来看,可以是已患所述癌的对象,从预防的角度来看,可以是未患所述癌的对象或患病的有无不明的对象。
作为本发明的EV分泌抑制的用途,不限于这样的例示。近年来,例如,有报告称外泌体等EV参与体内细胞间的传递。作为具体例,例如可以举出感染的病毒(例如,流感病毒、冠状病毒等)在体内的传递。因此,根据本发明的EV分泌抑制剂,通过EV的分泌抑制,例如抑制病毒的传递,其结果是,也能够阻滞病毒感染在体内的扩大。
已知通过本发明的EV分泌抑制剂分泌被抑制的EV,如上所述,例如通过将某个细胞内的信息物质转运至其他细胞,起到进行细胞间的信息传递的作用。因此,本发明的EV分泌抑制剂例如也可以称为细胞间的信息传递抑制剂,此外,本发明的EV分泌抑制方法例如也可以称为细胞间的信息传递抑制方法。
<筛选方法>
本发明的筛选方法是一种用于抑制来自细胞的EV的分泌的EV分泌抑制剂的候选物质的筛选方法,其特征在于,从被检物质中选择阻滞丝氨酸合成途径的阻滞物质作为抑制来自细胞的细胞外囊泡的分泌的候选物质。所述细胞的种类没有特别限制,如上所述,例如可以例示癌细胞。如上所述,所述癌细胞例如可以举出大肠癌细胞、肺癌细胞、黑色素瘤细胞、乳腺癌细胞、胰腺癌细胞以及多发性骨髓瘤细胞等。
在筛选所述表达抑制物质的候选物质的情况下,本发明的筛选方法例如包括:使所述被检物质共存于表达来自编码所述酶蛋白的基因(所述靶基因)的所述酶蛋白(所述靶蛋白)的表达体系并使所述靶蛋白表达的步骤;检测所述表达体系中所述靶蛋白的表达的步骤;以及选择所述靶蛋白的表达量相对低于未使所述被检物质共存的对照表达体系的所述被检物质作为所述候选物质的步骤。
在筛选所述催化功能抑制物质的候选物质的情况下,本发明的筛选方法例如包括:使所述被检物质与所述酶蛋白(所述靶蛋白)接触的步骤;检测所述酶蛋白的催化活性的步骤;以及选择所述酶蛋白的催化活性相对低于未使所述被检测物质共存的对照体系的所述被检测物质作为所述候选物质的步骤。
在筛选所述活性中和物质作为所述催化功能抑制物质的候选物质的情况下,本发明的筛选方法例如包括:使所述被检物质与所述酶蛋白(所述靶蛋白)接触的步骤;检测所述靶蛋白与所述被检物质的结合的步骤;以及选择与所述靶蛋白结合的所述被检物质作为所述候选物质的步骤。
<用途>
本发明是用于来自细胞的细胞外囊泡的分泌抑制的所述阻滞剂。所述抑制物质可以援引所述本发明的EV分泌抑制剂和所述本发明的EV分泌抑制方法的记载。
实施例
以下,对本发明的实施例进行说明。然而,本发明不受下述实施例的限制。除非另有说明,否则市售试剂是基于其协议使用的。
(细胞)
人结肠腺癌细胞株HCT116(ATCC CCL-247)用作大肠癌细胞、人肺泡基底上皮腺癌细胞株A549(ATCC CCL-185)用作肺癌细胞。人黑色素瘤细胞株A375(ATCC CRL-1619)用作黑色素瘤细胞、人乳腺癌细胞株MM231(ATCC HTB-26)用作乳腺癌细胞、人胰腺癌细胞株Panc-1(ATCC CRL-1469)用作胰腺癌细胞、人多发性骨髓瘤细胞株RPMI8226(ATCC CCL-155)用作多发性骨髓瘤细胞。
(核酸分子)
miR-891b(也称为miR-891b mimic。序列号1:GCAACUUACCUGAGUCAUUGA)(产品号4464066、Ambion公司)用作核酸分子miRNA、miRNA Mimic Negative Control#1(4464058)(Ambion)用作阴性对照用的核酸分子miRNA。siPSAT1(产品号siGENOME SMART pool siRNAM-010398、Dharmacon公司)用作核酸分子siRNA、ALL STAR阴性对照siRNA(SI03650318)(均为Qiagen)用作阴性对照用的核酸分子siRNA。
(细胞培养)
MM231用的培养基使用在RPMI 1640培养基(Gibco)中添加了10%热灭活胎牛血清(FBS)和抗生物质-抗真菌溶液(Gibco)的RPMI完全培养基。HCT116用的培养基使用在Maccoy5A中添加了10%热灭活FBS和抗生素-抗真菌剂的Maccoy5A完全培养基、其他细胞用的培养基使用在DMEM培养基(Gibco)中添加了10%热灭活FBS和抗生素-抗真菌剂的DMEM完全培养基。培养条件为37℃、5%二氧化碳、95%相对湿度(RH)。将约100000个细胞接种在18mL所述完全培养基中,孵育3-4天,使用继代数少于20的细胞。
(分泌EV的回收)
将培养的癌细胞用磷酸盐缓冲生理盐水(PBS)洗涤,并将培养基置换为含有所述抗生物质-抗真菌剂和2mmol/L L-谷氨酰胺(Gibco)的advanced RPMI或advanced DMEM。将置换后的调整培养液以2000×g离心分离10分钟除去细胞,得到的上清液用0.22μm过滤器(Millipore)过滤。将得到的滤液以110000×g离心分离70分钟,得到EV浓缩后的颗粒。用11mL的PBS洗涤所述颗粒,进一步地以110000×g超离心分离70分钟,再回收。
(Exo Screen法)
EV的检测使用由AlphaScreen链霉亲和素包被供体珠(6760002)、AlphaLISA非结合受体珠(6062011)和AlphaLISA通用缓冲液(AL001F)构成的AlphaLISA试剂(PerkinElmer)、96孔半区白板(6005560、Perkin Elmer)和检测装置EnSpire Alpha2300Mutilabel读板器(Perkin Elmer)。具体地,在所述板的各孔中添加5μL EV或10μL CM(细胞的培养上清液)、10μL用所述缓冲液制备的5nmol/L生物素化抗体、以及10μL 50μg/mLAlphaLISA受体珠结合抗体。CD9/CD9双重阳性EV的检测使用生物素化抗人CD9抗体和AlphaLISA受体珠结合抗人CD9抗体;CD9/CD63双重阳性EV的检测使用生物素化抗人CD9抗体和AlphaLISA受体珠结合抗人CD63抗体。此外,CD63/CD63双重阳性EV的检测使用生物素化抗人CD63抗体和AlphaLISA受体珠结合抗人CD63抗体。然后,将所述板在37℃下孵育1小时后,添加25μL 80μg/mL AlphaScreen链霉亲和素包被供体珠,进一步在37℃下暗处孵育30分钟。接着,将所述检测装置设定为激发波长680nm及发射检测波长615nm,测定所述板的孔中的发射。抗体使用小鼠单克隆抗人CD9(克隆12A12)和CD63抗体(克隆8A12)(均属CosmoBio),均为市售品。
(利用纳米粒子跟踪分析(NTA)的EV的分析)
将回收的分泌EV悬浮于PBS中,进一步用PBS制备稀释体系,用NanoSight粒子跟踪分析(LM10,软件版本2.03)进行分析。所述粒子跟踪以相机水平14从各样本获得至少5个60秒视频。分析设定经最优化并在样本间维持恒定。EV浓度计算为培养液的粒子/细胞,得到净EV分泌率。由于利用所述ExoScreen法的EV的测定结果与利用NTA分析的EV的测定结果呈相关关系,能够确认可以利用ExoScreen法测定分泌EV量。
(一次性转染试验)
在1.0×10
(RNA提取和qPCR分析)
使用市售试剂(商品名QIAzol、商品名miRNeasy Mini Kit、Qiagen)从培养细胞中提取总RNA。使用市售试剂盒(商品名High-Capacity cDNA Reverse Transcription Kit、Applied Biosystems)和随机六聚体引物进行逆转录反应。使用市售试剂盒(商品名StepOne Plus、商品名TaqMan Universal PCR MasterMix、Thermo Fisher Scientific)进行实时PCR分析。用β-肌动蛋白标准化mRNA的表达。PSAT1用的探针使用TaqMan探针(Applied Biosystems)。
除非另有说明,否则实施例中的数据以平均值±标准误差表示。统计显著性由学生t检验决定。在点图中,条形表示中位数和四分位数范围,统计显著性由学生t检验决定。P<0.05被认为具有统计显著性。
*P<0.05、**P<0.01。
[实施例A]
[实施例A1]
鉴定了参与大肠癌和肺癌中EV分泌的调节的靶基因。
(1)由癌细胞分泌的EV的检测
用miR-891b分别转染大肠癌细胞HCT116和肺癌细胞A549,回收其转化体(miR-891b)的培养上清液(CM)和含有由所述转化体(miR-891b)分泌的EV的EV级分,并利用所述ExoScreen法测定了分泌EV量作为强度信号。此外,利用NTA分析确认了各转化体的分泌EV量。作为阴性对照,对转染了miR-891b miRNA Mimic Negative Control#1的A549的转化体(NC)也同样测定了分泌EV量。然后,将转化体(NC)的分泌EV量设为1,求出转化体(miR-891b)的分泌EV的相对值(n=3)。
这些结果示于图1。图1中,(A)是示出了利用ExoScreen法的分泌EV量的相对值的图;(B)是示出了利用NTA法的分泌EV量的相对值的图。如图1(A)所示,转染了miR-891b的大肠癌细胞HCT116和肺癌细胞A549的转化体(miR-891b),在所述CM和EV级分中,与转化体(NC)相比,分泌EV量均被显著地抑制。此外,如图1(B)所示,利用NTA方也获得了同样的结果。由这些结果可知,在大肠癌细胞和肺癌细胞中,miR-891b抑制EV分泌。
(2)miR-891b的靶基因
所述(1)中,由于通过miR-891b的转染抑制了EV分泌,因此发明人等通过进一步的深入研究发现了PSAT1基因作为被miR-891b抑制表达的靶基因。因此,用抑制PSAT1基因的表达的siRNA(siPSAT1)转染大肠癌细胞HCT116和肺癌细胞A549,并利用ExoScreen法和NTA法确认了分泌EV量。此外,作为阴性对照,转染ALL STAR阴性对照siRNA并进行同样的确认。这些结果示于图2。图2中,(A)是示出了利用ExoScreen法的分泌EV量的相对值的图;(B)是示出了利用NTA法的分泌EV量的相对值的图。
如图2(A)所示,转染了siPSAT1的大肠癌细胞HCT116和肺癌细胞A549的转化体(siPSAT1),在所述CM和EV级分中,与转化体(NC)相比,分泌EV量均被显著地抑制。此外,如图2(B)所示,利用NTA方也获得了同样的结果。以此方式,通过siPSAT1对PSAT1基因的下调,EV分泌被抑制,因此结合所述(1)的结果,可知miR-891b的靶基因为PSAT1基因。
(3)靶基因的确认
对于所述(2)中的PSAT1基因,进行其为miR-891b的直接靶基因的确认。
首先,对于所述转化体(miR-891b)和针对其的作为对照的所述转化体(NC),检测PSAT1基因的表达。然后,将所述转化体(NC)的表达量设为1,求出所述转化体(miR-891b)的表达量的相对值。这些结果示于图3(A)。图3(A)是示出了PSAT1基因的表达量的相对值的图。此外,对于所述转化体(miR-891b)和针对其的作为对照的所述转化体(NC),利用免疫印迹法检测PSAT1蛋白的表达。此外,作为对照,还检测了β-肌动蛋白。这些结果示于图3(B)。图3(B)是示出了PSAT1蛋白的表达的免疫印迹法的照片。
接下来,如图3(C)所示,miR-891b具有与人PSAT1 mRNA的3’UTR(序列号2:UGGACUUAAUAAUGCAAGUUGC为3’UTR的部分区域)中的连续7个碱基区域完美匹配的序列。因此,使用3’UTR的所述7个碱基区域为野生型序列(序列号3:AAGTTGC)的野生型PSAT1基因和3’UTR’的所述7个碱基区域为突变型序列(序列号4:TTCAACG)的突变型PSAT1基因,确认miR-891b的影响。具体地,进行了如下实验。将野生型PSAT1基因或突变型PSAT1基因亚克隆到质粒载体psiCHECK2中,使用Lipofectamine3000用该重组载体连同miR-891b或阴性对照用的miRNA转染人胚肾细胞(HEK293细胞)。转染48小时后,根据双荧光素酶报告基因检测系统(Dual-Luciferase Reporter Assay System)的操作程序,用读板器定量转化体的荧光素酶活性。
这些结果示于图3(D)。图3(D)是示出了用萤光素酶活性相对值表示PSAT1的表达量的图。
如图3(D)所示,miR-891b的转染抑制了PSAT1基因的表达和PSAT1蛋白的表达。进一步地,在miR-891b的识别区域的序列为野生型的野生型PSAT1的情况下,通过miR-891b的转染,PSAT1的表达量显著地降低,但通过miR-891b的识别区域的序列为突变型,PSAT1的表达量没有降低。由此可知,miR-891b识别PSAT1的3’UTR并切断PSAT1。即,证实了PSAT1基因是miR-891b的直接靶基因。
[实施例A2]
通过PSAT1基因的表达抑制,确认了来自各种癌细胞的EV分泌的抑制。
除了使用黑色素瘤细胞A375、乳腺癌细胞MM231、胰腺癌细胞Panc-1、多发性骨髓瘤细胞RPMI8226以外,与实施例A1(2)同样,用siRNA(siPSAT1)进行转染,并利用纳米粒子跟踪分析(NTA)法测定了EV分泌量。这些结果示于图4。图4是示出了利用NTA法的分泌EV量的相对值的图。
如图4所示,在所有癌细胞中,与作为阴性对照的转化体(NC)相比,转染了siPSAT1的转化体(siPSAT1)的分泌EV量被显著地抑制。由这些结果可知,不仅是大肠癌细胞和肺癌细胞,各种癌细胞的EV分泌也可以通过PSAT1的表达抑制来抑制。由此,通过抑制PSAT1的表达,抑制来自各种癌细胞的EV分泌,可以治疗这些癌、预防癌向其他器官转移。
[实施例A3]
与所述实施例A1(2)同样,用siRNA(siPSAT1)转染大肠癌细胞HCT116和肺癌细胞A549,确认了PSAT1沉默后的EV生物发生。对于沉默后的各转化体,通过免疫荧光确认了CD63和PSAT1,确认在PSAT1沉默后的细胞质中,作为EV的标记的CD63的蓄积。此外,在转染了miR-891b的情况下,也同样能够确认CD63的蓄积。从该结果可以确认,通过抑制PSAT1的表达,EV的产生本身得以维持,但产生的EV在细胞质内蓄积,抑制了从细胞向外部的EV分泌。
进一步地,对于PSAT1沉默后的所述转化体,进行作为EV的标记的CD63和作为早期内体标记的EEA1或作为晚期内体标记的Rab7的共免疫染色。其结果为:在PSAT1沉默后的转化体和作为阴性对照的转化体中均未确认EEA1与CD63之间的重复。另一方面,在作为阴性对照的转化体中,CD63与Rab7之间的大部分重叠,但在PSAT1沉默后的转化体中,CD63与Rab7之间的重叠很少。因此,基于强度测定了CD63单阳性的面积。该结果示于图5。确认了如图5所示,对于HCT116和A549,通过进行PSAT1沉默,CD63单阳性的面积均显著增加,EV在细胞内蓄积。这些结果表明,PSAT1可能在晚期内体合成的过程中在EV分泌中发挥作用。
[实施例B]
确认了在所述实施例A中,PSAT1参与EV分泌,通过PSAT1的表达抑制,能够抑制EV分泌。由于PSAT1是丝氨酸合成途径的酶蛋白,丝氨酸合成途径参与EV分泌,推测可以通过丝氨酸合成途径的阻滞,即丝氨酸合成的阻滞来抑制EV分泌。因此,确认了在实施例B中,无论PSAT1如何,通过阻滞丝氨酸合成途径的任一步骤都可以抑制EV分泌。
[实施例B1]
由于普通DMEM培养基中含有丝氨酸,因此使用不含丝氨酸的培养基,确认了添加丝氨酸对EV分泌的影响。
使用含有1×胰岛素、运铁蛋白、硒溶液(100×ITS-G)、1×MEM维生素溶液和丝氨酸(4mmol/L)的无血清含有丝氨酸的MEM培养基和除不含丝氨酸以外组成相同的无血清不含丝氨酸的MEM培养基。将大肠癌细胞HCT116和肺癌细胞A549以使其成为5×10
其结果为:与使用所述含有丝氨酸的MEM培养基的情况相比较,在使用所述不含丝氨酸的MEM培养基的情况下,PSAT1沉默后的转化体生长缓慢。
进一步地,利用ExoScreen法和NTA的测定结果示于图6。对于利用所述ExoScreen法的分泌EV量,将用siRNA(siPSAT1)转染的转化体的结果设为1,求出相对值;对于利用NTA的分泌EV量,将用siRNA(siPSAT1)转染的转化体的分泌EV量设为1,求出相对值。图6中,(A)是示出了利用ExoScreen法的分泌EV量的相对值的图;(B)是示出了利用NTA法的分泌EV量的相对值的图。
如图6所示,PSAT1未沉默的阴性对照(NC)在所述不含丝氨酸的MEM培养基和所述含有丝氨酸的MEM培养基中的结果几乎相同。另一方面,用siRNA(siPSAT1)转染的转化体在所述不含丝氨酸的MEM培养基中培养的结果,与作为阴性对照的转化体(NC)相比,EV分泌量减少。其次,用siRNA(siPSAT1)转染的转化体的EV分泌量通过所述含有丝氨酸的MEM培养基的使用(即,丝氨酸的添加),与使用所述不含丝氨酸的MEM培养基的结果相比,显著地增加,成为与阴性对照(NC)同程度的结果。由这些结果可知,丝氨酸合成参与EV分泌,可以通过丝氨酸合成的阻滞来抑制EV分泌。
[实施例B2]
在丝氨酸合成途径中使用阻滞剂,并确认了对EV分泌的影响。
在丝氨酸合成途径中使用酶蛋白(PHGDH)的阻滞剂NCT-503作为所述阻滞剂。
【化2】
具体地,进行了如下试验。将大肠癌细胞HCT116和肺癌细胞A549以使其成为1.5×10
对于细胞内的蓄积EV,如下进行分析。即,对回收的细胞进行免疫染色,基于荧光强度测定CD63单阳性的面积,求出除以核数的值作为细胞内蓄积的EV量。这些结果示于图7。另一方面,对于分泌EV,从所述回收的培养基回收EV并进行NTA。将阴性对照的分泌EV量设为1,利用NTA的分泌EV量作为相对值求出。该结果示于图8。
首先,确认了免疫荧光观察的结果为:通过使癌细胞与阻滞剂共存,与所述实施例A3中的PSAT1沉默的转化体的结果同样,CD63阳性EV的细胞内蓄积。该结果在图7中也同样。即,在图7中,使阻滞剂共存的细胞与NC相比较,EV量增加,因此也可以确认EV在细胞内蓄积,分泌受到阻滞。此外,与此相对应,如图8所示,使阻滞剂共存的细胞的培养基与NC相比较,EV量减少,因此可以确认来自细胞的EV分泌受到阻滞。由这些结果也可知,可以通过丝氨酸合成的阻滞来抑制EV分泌。
[实施例C]
使用各种癌细胞确认了丝氨酸合成对EV分泌的控制。另外,已确认在本实施例中,利用了PSAT1沉默作为丝氨酸合成途径的阻滞,但如上所述,并不限定于PSAT1的沉默,只要是丝氨酸合成的阻滞,同样地可以抑制EV分泌。
大肠癌细胞株(HCT15、COLO201、COLO205、HT-29)和正常大肠成纤维细胞(CCD-18co)、肺癌细胞株(A427、H1650、H2228)和正常肺上皮细胞用作细胞。从这些细胞制备总RNA并确认了PSAT1的表达水平,对于大肠细胞连同肺细胞,癌细胞中PSAT1的表达水平明显地高于正常细胞。此外,除大肠癌和肺癌之外,对于卵巢癌、乳腺癌、黑色素瘤、头颈癌、多发性骨髓瘤、胰腺癌的细胞也同样地确认了癌细胞中PSAT1的表达水平明显地高于正常细胞。此外,肺癌患者中PSAT1的表达水平与存活率呈高度相关关系,具体地,表达水平越高,存活率越低。
因此,在本实施方式中,与所述实施例A2同样地,对于用siRNA(siPSAT1)转染所述各种癌细胞并沉默了PSAT1的转化体,利用NTA进行EV分泌量的测定。这些结果示于图9。图9是示出了利用NTA法的分泌EV量的相对值的图。
如图9所示,在所有癌细胞中,与作为阴性对照的转化体(NC)相比,转染了siPSAT1的转化体(siPSAT1)的分泌EV量被显著地抑制。由这些结果可知,各种癌细胞的EV分泌也可以通过PSAT1的表达抑制来抑制。由此,确认了通过抑制PSAT1的表达,丝氨酸合成受到阻滞,可以抑制来自各种癌细胞的EV分泌。因此,可以说通过PSAT1的表达抑制等阻滞丝氨酸合成,可以治疗这些各种癌、预防癌向其他器官转移。
[实施例D]
在丝氨酸合成途径中使用酶蛋白(PHGDH)的阻滞剂NCT-503,确认了体内肿瘤体积的减少、EV分泌的抑制等。
MDA-MB-231_Luc_D3H2LN细胞株(以下,称为D3H2LN)用作乳腺癌转移株。该细胞株是亲株乳腺癌细胞MDA-MB-231的修饰株,已确认相对于所述亲株,其外泌体分泌量显著地高且PSAT1的表达量显著地高。即,对于所述亲株和所述D3H2LN,与所述实施例A1同样地,利用NTA分析测定EV分泌量,此外,利用免疫印迹法测定PSAT1的表达。该结果示于图10。在图10中,(A)是示出了利用NTA法的分泌EV量的相对值的图;(B)是示出了PSAT1蛋白的表达的免疫印迹法的照片。如图10所示,已确认相对于所述亲株,D3H2LN的外泌体分泌量显著地高且PSAT1的表达量显著地高。
免疫缺陷小鼠C.B-17scid mouse(雌性、6周龄)用作小鼠。将所述D3H2LN悬浮于PBS中以制备1×10
这些结果示于图11。在图11中,(A)是示出了第21天和第35天的小鼠的原发灶(乳腺)的肿瘤体积的图(计算值);(B)是第35天的小鼠的原发灶(乳腺)的肿瘤重量的图(实测值)。
如图11(A)所示,与所述非给药组相比较,施用了所述阻滞剂的给药组的原发灶的肿瘤的体积经时显著地减小。此外,如图11(B)所示,与所述非给药组相比较,施用了所述阻滞剂的给药组的原发灶的肿瘤的重量也显著地减少。另外,在通过HE染色确认作为转移灶的肺时,与所述非给药组的肺相比较,所述给药组的肺倾向于具有更少的转移灶。
[实施例E]
对于作为丝氨酸合成途径的酶蛋白的PHGDH,将上述实施例中确认EV分泌抑制的PSAT1作为阳性对照,通过各个基因(PHGDH基因和PSAT1基因)的表达抑制,确认了来自癌细胞的EV分泌的抑制。除非另有说明,否则与所述实施例B1的方法同样地进行。
对于PHGDH基因,siPHGDH(产品号M-9518-01-0010、Dharmacon公司)用作siRNA。对于PSAT1基因,与所述实施例A同样地,使用siPSAT1。
将肺癌细胞A549和大肠癌细胞HCT116以使其成为5×10
图12示出了肺癌细胞A549的结果;图13示出了大肠癌细胞HCT116的结果。在图12和图13中,(A)是细胞存活率的结果;(B)是示出了利用NTA法的分泌EV量的相对值的图。
如图12(A)和图13(A)所示,与未沉默的对照相比较,所有癌细胞的沉默的转化体的存活率几乎没有变化。此外,如图12(B)和12(C)所示,与对照相比较,沉默的转化体的EV分泌减少。
[实施例F]
确认了在所述实施例B2中,使用阻滞丝氨酸合成途径的PHGDH的阻滞剂NCT-503可以抑制癌细胞中的EV分泌。此处,示出了不是由于细胞的细胞死亡而抑制EV分泌,而是通过NCT-503的添加,丝氨酸合成途径的阻滞抑制癌细胞等非正常细胞中特有的EV分泌的补充数据。
在本例中,作为癌细胞中特有的EV分泌被抑制的间接数据,确认了正常细胞中NCT-503的影响。在所述实施例B2中,添加了NCT-503以使其相对于孔的培养基成为2.5μmol/L。因此,对于肺(HBEC)和大肠(HCoEpiC)的各自的正常上皮细胞,使用未添加NCT-503(添加DMSO)的培养基或添加了NCT-503以达到规定浓度(0.15625~2.5μmol/L)的添加NCT-503的培养基进行培养,确认了细胞存活率和利用ExoScreen的EV分泌量。
具体地,进行了如下正常试验。将所述正常上皮细胞以使其成为5000个细胞/孔接种至96孔板(第0天),在培养基中孵育24小时(第1天)。所述大肠细胞的培养基使用CoEpiCM1×anti-anti培养基,所述肺细胞的培养基使用BEBM 1×anti-anti培养基。在所述孵育后,确认细胞的粘附,进一步地,与所述实施例B2同样地添加所述阻滞剂溶液(NCT-503/DMSO),以使NCT-503成为2.5μmol/L,进一步进行48小时的孵育(第3天)。然后,回收所述孔中的培养基,并进行所述孔中的细胞的计数。此外,作为对照,除了添加DMSO代替所述阻滞剂溶液之外,同样进行所述孔中的细胞的计数。然后,将作为对照的所述未添加(0M)NCT的培养基(即添加DMSO的培养基)中的细胞数设为相对值1,计算细胞存活率。另外,利用ExoScreen测定EV分泌量。
这些结果示于图14。图14是示出了每个细胞的EV分泌量的图,其中,(A)是大肠的正常上皮细胞的结果;(B)是肺的正常上皮细胞的结果。其结果为:就所述添加NCT-503的培养基的EV分泌量相对于作为未添加(0M)NCT的添加DMSO的培养基的EV分泌量,大肠及肺的正常上皮细胞几乎看不到差别。作为具体例,例如,在添加了2.5μmol/L的NCT-503的情况下,就所述添加NCT-503的培养基的EV分泌量相对于未添加(0M)NCT的添加DMSO的培养基的EV分泌量,大肠的正常上皮细胞相对值为0.98,肺的正常上皮细胞相对值为1.17,几乎看不到差别。即,NCT-503的添加对正常上皮细胞中的EV分泌没有影响。与这些结果相对,在所述实施例B2中,通过对癌细胞添加2.5μmol/LNCT-503,与仅添加了作为NCT-503的溶剂的DMSO的对照相比较,能够显著地抑制EV分泌。由这些结果确认,由癌细胞中NCT-503的添加引起的EV抑制不是由于细胞死亡,而是由于细胞的癌化上调丝氨酸合成体系的表达,与此相对,阻滞剂NCT-503阻滞所述合成体系的PHGDH,其结果是,EV分泌被抑制。
以上,参照实施方式及实施例对本发明进行说明,但本发明并非仅限于上述实施方式及实施例。对于本发明的结构和细节,本领域技术人员可以在本发明的范围内进行能够理解的各种变更。
本申请要求以2020年4月7日申请的日本申请特愿2020-069392及2021年2月16日申请的日本申请特愿2021-022825为基础的优先权,并将这些公开全部并入本文。
【产业上的可利用性】
根据本发明,能够通过丝氨酸合成途径的阻滞抑制来自细胞的细胞外囊泡的分泌。因此,通过根据本发明进行分泌抑制,可以分析细胞外囊泡的分泌或分泌的抑制对生物体的影响。因而,本发明可以说是例如在医疗领域中非常有用的技术。
序列表
<110> 理论科学公司(Theoria Science, Inc.)
<120> 用于抑制来自癌细胞的细胞外囊泡的分泌的抑制剂、癌症治疗剂及其用途
<130> THS20004WO
<150> JP2020/69392
<151> 2020-04-07
<150> JP2021/22825
<151> 2021-02-16
<160> 2
<170> PatentIn 3.5版
<210> 1
<211> 21
<212> RNA
<213> 人工序列
<220>
<223> PSAT1的miRNA
<220>
<221> miR-891b
<222> (1)..(21)
<400> 1
gcaacuuacc ugagucauug a 21
<210> 2
<211> 22
<212> RNA
<213> 智人
<220>
<221> 3'UTR
<222> (1)..(22)
<400> 2
uggacuuaau aaugcaaguu gc 22
- 一种细胞外囊泡捕获或细胞外囊泡定量分析或细胞外囊泡内含物定量分析的试剂盒及方法
- 制备细胞外囊泡的方法及细胞外囊泡的用途
