一种利用渗透性全细胞生产单一聚合度麦芽糊精的方法
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及一种利用渗透性全细胞生产单一聚合度麦芽糊精的方法,属于生物技术领域。
背景技术
麦芽糊精是指以淀粉为原料,将淀粉经酸法或酶法低程度水解得到的DE值在20%以下的产品。其主要成分为聚合度(即DP值)在10以上的糊精和聚合度在10以下的低聚糖。
由于麦芽糊精可作为增稠剂、乳化剂或稳定剂等配料添加到食品中,可作为赋形剂、填充剂等配料添加到药品中,且可作为优良载体添加到日化产品中,因此,麦芽糊精在食品、医药和日化等领域均具有重要的应用,这也意味着麦芽糊精具有很大的市场。
但是,受到现有麦芽糊精制备方法的局限,目前生产得到的麦芽糊精中,高聚合度的麦芽糊精(一般为DE值在4%~12%的麦芽糊精)含有较多的直链糊精且DP值分布不均匀,添加了此类麦芽糊精的溶液放置一段时间后容易出现沉淀(具体可见参考文献:李才明,李阳,顾正彪,洪雁,程力,李兆丰.麦芽糊精的支化修饰及其特性研究进展[J].中国食品学报.2018(10):1-8),低聚合度的麦芽糊精(一般为DE值在13%~20%的麦芽糊精)则具有很高的还原能力,易与其他物质发生反应,并且,当其与氨基酸或蛋白质共存时易产生美拉德反应,降低了含有此类麦芽糊精的产品的质量。
另外,受到现有麦芽糊精制备方法的局限,目前生产得到的麦芽糊精均是多种物质(包括葡萄糖、麦芽糖、低聚糖和多聚糖等)的混合物,这在很大程度上提高了聚合度均一的麦芽糊精产品的分离纯化难度,进而增加了单一聚合度麦芽糊精产品的分离纯化成本。
目前可通过多酶级联反应制备单一聚合度麦芽糊精,但是普通酶法制备通常需要经过多次发酵产酶和细胞破碎才能获得可供酶促反应的可溶性酶。过程复杂繁琐,这既耗时也增加了资源消耗的负担。上述缺陷均极大限制了麦芽糊精市场的进一步发展。因此,急需找到一种经济高效生产单一聚合度麦芽糊精的方法。
发明内容
本发明要解决的技术问题是现有技术分离出单一聚合度麦芽糊精产品很难,并且制备单一聚合度麦芽糊精产品过程繁琐和资源消耗大的技术问题。
本发明提供一种重组的基因工程菌,所述基因工程菌是表达编码环麦芽糊精酶的基因cdase或同时表达编码环麦芽糊精酶的基因cdase和编码麦芽寡糖基海藻糖合成酶的基因mtsase,出发菌株为渗透性全细胞;所述渗透性全细胞是敲除大肠杆菌的细胞外膜脂多糖合成相关基因lpxM,获得的大肠杆菌底盘细胞;所述细胞外膜脂多糖合成相关基因lpxM的基因序列如SEQ ID NO:1所示。
在一种实施方式中,获得出发菌为E.coli BL21(DE3)。
在一种实施方式中,所述环麦芽糊精酶的基因cdase的基因序列如SEQ ID NO:4所示;所述麦芽寡糖基海藻糖合成酶的基因mtsase的基因序列如SEQ ID NO:5所示。
本发明提供一种用于生产麦芽糊精的全细胞的制备方法,在渗透性全细胞中表达编码环麦芽糊精酶的基因cdase或同时表达编码环麦芽糊精酶的基因cdase和编码麦芽寡糖基海藻糖合成酶的基因mtsase,经发酵后获得的含有相应酶液的渗透性全细胞。
在一种实施方式中,表达编码环麦芽糊精酶的基因cdase发酵获得的全细胞是含有环麦芽糊精酶的全细胞;同时表达编码环麦芽糊精酶的基因cdase和编码麦芽寡糖基海藻糖合成酶的基因mtsase发酵获得的全细胞是含有环麦芽糊精酶和麦芽寡糖基海藻糖合成酶的全细胞;所述环麦芽糊精酶的氨基酸序列如SEQ ID NO:2所示;麦芽寡糖基海藻糖合成酶的氨基酸序列如SEQ ID NO:3所示。
本发明提供一种生产麦芽糊精的方法,所述方法为将环糊精加入到上述的重组基因工程菌发酵液中进行发酵10~20小时。
或者,所述方法为将上述的制备方法获得含有相应酶液的渗透性全细胞加入到含有环糊精的反应液中反应3~6小时。
在一种实施方式中,权利要求3所述的重组基因工程菌在环糊精溶液中的添加量为0.1~10U/g环糊精。
在一种实施方式中,环糊精的添加浓度为10g/L~200g/L;所述环糊精为α-环糊精、β-环糊精和/或γ-环糊精;所述反应的温度为25~65℃、pH为5.0~8.5。
本发明提供上述的基因工程菌或上述的制备方法在生产单一聚合度麦芽糊精或单一聚合度非还原性麦芽糊精中的应用。
本发明提供上述的方法在制备麦芽糊精、含有麦芽糊精的食品、含有麦芽糊精的药品或含有麦芽糊精的日化产品中的应用。
有益效果:(1)本发明提供了一种渗透性全细胞(lpxM的基因全基因敲除后可以促进细胞的通透性,仅限于β-环糊精底物可以进入细胞,而环麦芽糊精酶、麦芽寡糖基海藻糖合成酶不会被分泌出细胞外)可用于酶反应生产单一聚合度非还原性麦芽糊精的方法,利用本发明的方法酶反应6h,即可使反应液中麦芽五糖基海藻糖(4-O-maltopentaosyltrehalose,NDP7)的含量高达49.31~51.81%,转化率高达40.16~49.46%。
(2)本发明提供了一种利用渗透性全细胞发酵可用于生产单一聚合度非还原性麦芽糊精的方法,利用本发明的方法持续发酵20h,即可使反应液中麦芽五糖基海藻糖(4-O-maltopentaosyl trehalose,NDP7)的含量高达50.84~65.70%,转化率高达40.98~56.12%。
(3)本发明提供了一种渗透性全细胞可用于酶反应生产单一聚合度还原性麦芽糊精的方法,利用本发明的方法反应3~6.5h,即可使反应液中还原性麦芽糊精的含量高达30.74~43.05%。
综上所述,利用本发明的方法仅需通过一次发酵获得渗透性全细胞,无需多次发酵和细胞破碎产酶即可反应获得纯度很高的单一聚合度还原性或非还原性麦芽糊精,转化率高,进一步降低生产成本。
附图说明
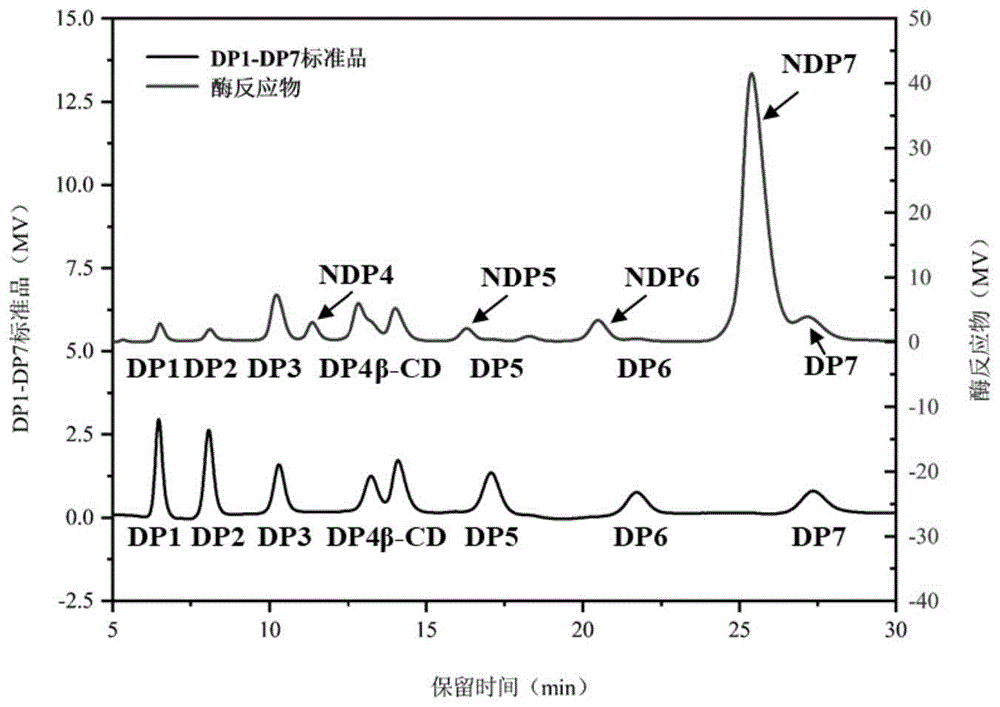
图1为反应液6中产物的液相分布图;葡萄糖(DP1)、麦芽糖(DP2)、麦芽三糖(DP3)、麦芽四糖(DP4)、麦芽五糖(DP5)、麦芽六糖(DP6)、麦芽七糖(DP7)、β-环糊精(β-CD)、非还原性麦芽四糖(NDP4)、非还原性麦芽五糖(NDP5)、非还原性麦芽六糖(NDP6)、非还原性麦芽七糖(NDP7);
图2为模板DNA-lpxM的PCR扩增结果,其中,M:DNAmarker;1:上游同源片段;2:下游同源片段;3:模板DNA-lpxM;
图3为lpxM基因敲除后PCR扩增结果,其中,M:DNA marker;1:阴性对照(未添加DNA模板);2:未敲除lpxM基因;3:敲除lpxM基因;
图4为重组环麦芽糊精酶的SDS-PAGE检测,其中,M:蛋白Marker;1:未诱导的重组细胞;2:全细胞重悬液;3:细胞破碎后的上清液;4:纯化后的环麦芽糊精酶;
图5为基因cdase和mtsase载体构建示意图;
图6为重组环麦芽糊精酶和麦芽寡糖基海藻糖合成酶的SDS-PAGE检测,其中,M:蛋白Marker;1-6:细胞破碎后的上清液,重组菌包含的质粒分别为:pRSF-cdase-mtsase,pCOLA-cdase-mtsase,pACYC-cdase-mtsase,pCDF-cdase-mtsase,pET-28a(+)-cdase和pET-28a(+)-mtsase;7:纯化后的环麦芽糊精酶;8:纯化后的麦芽寡糖基海藻糖合成酶。
具体实施方式
下述实施例中涉及的大肠杆菌(Escherichia coli)DH5α、E.coli BL21(DE3)购自Novagen公司;下述实施例中涉及的pET-28a(+)载体购自Invitrogen公司;下述实施例中涉及的β-环糊精购自上海生工有限公司。质粒pTargetF(62225)和pCas9(62226)购自淼灵生物公司。
下述实施例中涉及的培养基如下:
LB固体培养基:胰蛋白胨10g/L、酵母提取物5g/L、氯化钠10g/L、琼脂15g/L。
LB液体培养基:胰蛋白胨10g/L、酵母提取物5g/L、氯化钠10g/L。
TB液体培养基(改良版):胰蛋白胨6g/L、酵母提取物12g/L、K
单一聚合度麦芽糊精是由单一聚合度还原性麦芽糊精和单一聚合度非还原性麦芽糊精组成。还原性和非还原性麦芽糊精的区别在于碳链最后的一个糖苷键,还原性麦芽糊精的全部由α-1,4-糖苷键组成,具有醛基,因此具有还原性。而非还原性麦芽糊精最后的糖苷键是α-1,1-糖苷键,没有醛基,不具有还原性,因此被称为非还原性麦芽糊精。
麦芽糊精是一个混合物,例如包含葡萄糖,麦芽糖,麦芽三糖-麦芽七糖等。单一聚合度的麦芽糊精是指成分单一的,仅含有一种麦芽糊精的成分,例如麦芽七糖就可以被称为单一聚合度的麦芽糊精,麦芽六糖也可以被称为单一聚合度的麦芽糊精。
下述实施例中涉及的检测方法如下:
反应液中葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖、麦芽七糖、α-环糊精、β-环糊精或γ-环糊精含量的检测方法:
采用高效液相色谱(HPLC)法;
色谱柱:氨基柱(OMNI Hubble NH 2.5μm);
流动相:乙腈:水=60~65%(v/v);
标准品:称取葡萄糖(DP1)、麦芽糖(DP2)、麦芽三糖(DP3)、麦芽四糖(DP4)、麦芽五糖(DP5)、麦芽六糖(DP6)、麦芽七糖(DP7)、α-环糊精(α-CD)、β-环糊精(β-CD)或γ-环糊精(γ-CD)(纯度=99.5%)的标准品0.5g,精确至0.0001g,用超纯水溶解并定容至50mL,摇匀,用0.22μm微孔滤膜过滤,收集滤液供测定用(标准品的液相分布见图1);
样品制备:将反应结束的反应液12000r/min离心10min,用0.22μm微孔滤膜过滤,收集滤液供测定用;
试样的测定:先用流动相以1mL/min的流速冲洗管路30min,装上色谱柱,正式进样分析前,将所用流动相输入参比池60min,走基线,待基线走稳后,将标准溶液和制备好的试样分别进样10μL;根据标准品的保留时间定性样品中的糖组分,根据样品的峰面积,以内标法计算糖组分的比例。
环麦芽糊精酶酶活的检测方法:
在250μL浓度为20g/L的β-环糊精溶液中分别加入10μL环麦芽糊精酶的胞外发酵液、全细胞重悬液和粗酶液,然后用20mM磷酸缓冲液补足至500μL,得到反应体系;将反应体系在温度为35℃、pH为7.5的条件下反应30min后煮沸灭酶后,通过液相检测麦芽七糖的生成量,得到的酶活分别为环麦芽糊精酶胞外、全细胞和胞内酶活。
环麦芽糊精酶酶活的定义:在温度为35℃、pH为7.5的条件下,1min内作用于β-环糊精生成1μmol麦芽七糖所需的酶量为一个酶活力单位(1U)。
麦芽寡糖基海藻糖合成酶酶活的检测方法:
在250μL浓度为20g/L的麦芽糊精溶液中加入5μL麦芽寡糖基海藻糖合成酶的胞外发酵液、全细胞重悬液和粗酶液,然后用20mM磷酸缓冲液补足至500μL,得到反应体系;将反应体系在温度为45℃、pH为7.0的条件下反应10min后煮沸灭酶后,通过DNS法(具体可见参考文献:彦繁鹤,周金梅,吴如春.DNS法测定甘蔗渣中还原糖含量[J].食品研究与开发.36(02):126-128。)检测反应液中还原力的下降量,得到的酶活分别为麦芽寡糖基海藻糖合成酶胞外、全细胞和胞内酶活。
麦芽寡糖基海藻糖合成酶酶活的定义:在温度为45℃、pH为7.0的条件下,1min内作用于麦芽糊精生成1μmol非还原性麦芽糊精所需的酶量为一个酶活力单位(1U)。
实施例1:大肠杆菌渗透性细胞制备方法
大肠杆菌渗透性细胞制备方法如下:
大肠杆菌渗透性细胞的制备是以E.coli BL21(DE3)为宿主,通过CRISPR/Cas9系统敲除细胞外膜脂多糖合成相关基因lpxM(碱基序列如SEQ ID NO:1所示)来实现。
1.构建pTargetF-lpxM载体
以pTargetF质粒为模板,使用引物对lpxM-N20-F/lpxM-N20-R扩增整个质粒,替换特异性的20个碱基序列(acagattgattaacgcacga,SEQ ID NO:6)。PCR产物经DpnI消化30min,直接化转到E.coli DH5α感受态细胞,经测序验证成功后,得到敲除靶向质粒pTargetF-lpxM。lpxM-N20-F:5′-ACAGATTGATTAACGCACGAGTTTTAGAGCTAGAAATAGCAAGTT-3′(SEQ ID NO:9);
lpxM-N20-R:5′-TCGTGCGTTAATCAATCTGTACTAGTATTATACCTAGGACTGAGC-3′(SEQ IDNO:10);
2.模板DNA-lpxM的扩增
以E.coli BL21(DE3)的基因组为模板,使用两个引物对lpxM-upflank-F/lpxM-upflank-R和lpxM-downflank-F/lpxM-downflank-R分别扩增出上游同源片段500bp(cgacaatgtggaagaagctattgccatgtcagcaatgtacgcagctaaccacctgaaaggcgttacggcgatcatcaccatgaccgaatcg ggtcgtaccgcgctgatgacctcccgtatcagctctggtctgccaattttcgccatgtcgcgccatgaacgtacgctgaacctgactgctctctatcgtggcgttacgccggtgcactttgatagcgctaatgacggcgtagcagctgccagcgaagcggttaatctgctgcgcgataaaggttacttgatgtctggtgacctggtgattgtcacccagggcgacgtgatgagtaccgtgggttctactaataccacgcgtattttaacggtagagtaagtacgttgccggatgcggcgaaaacgccacatccggcctacagttcaatgatagttcaacagatttcgaatattctgaagcaaacttgaacttatcatcaggcgaaggcctctcctcgcgagaggctttt,SEQ ID NO:7)和下游同源片段500bp(gcttttccagtttcggataaggcaaaaatcaatctggtgatagtgtagcggcgcaacttgccccgcaccaaataaaaaaagccggtactgact gcgtaccggctgcgaatggatgttaattaatcaaaccgtagctgcggcacaatctctttggcctgcgccaggaattcgcgacgatcggagccggtcagcccttcggtacgcggcagttttgccgtcagcgggtttacggcctgctggtttatccatacttcatagtgcagatgcggcccggttgaacgtccggtattaccggaaagcgcgatacggtcgccacgtttcaccttctgtcccggtttcaccagaatcttgcgcaagtgcatataacgcgtggtgtagctgcgaccatgacgaatagccacataataacctgctgcgccactgcgtttggcaaccaccacttcaccgtcacccactgaaagcactggcgtaccctgcggcatggcgaaatcaacacctct,SEQ ID NO:8),两个片段分别胶回收,通过重叠延伸PCR获得打靶片段模板DNA-lpxM。模板扩增结果见图2,上下游同源片段大小符合预期值。
lpxM-upflank-F:5′-CGACAATGTGGAAGAAGCTATTGCCATGTC-3′(SEQ ID NO:11);
lpxM-upflank-R:5′-AAAAGCCTCTCGCGAGGAGAGGCCTTCGCC-3′(SEQ ID NO:12);
lpxM-downflank-F:5′-TCGCGAGAGGCTTTTGCTTTTCCAGTTTCG-3′(SEQ ID NO:13);
lpxM-downflank-R:5′-AGAGGTGTTGATTTCGCCATGCCGCAGGGT-3′(SEQ ID NO:14);
3.将pCas质粒(pCas9的空载体)通过化学转化导入化转感受态细胞E.coli BL21(DE3)中,平板长出单菌落之后,挑取新鲜的单菌落制备电转感受态,在感受态细胞生长过程中,添加终浓度为30mM L-阿拉伯糖诱导pCas质粒表达Red重组蛋白。将制备好的含pCas质粒的E.coli BL21(DE3)感受态细胞中,混和100ng靶向质粒pTargetF-lpxM和800ng模板DNA-lpxM,并一同转入电转杯中进行电转。电转化后涂布在含卡那霉素和壮观霉素的LB平板上。30℃培养16~24h,待平板上长出单菌落,用鉴定引物进行菌落PCR验证,得到阳性克隆单菌落。然后将其接种到LB试管中,添加终浓度为0.5mM IPTG和卡那霉素去除pTargetF-lpxM质粒,42℃过夜培养去除pCas质粒,完成对lpxM基因的敲除。敲除lpxM后的细胞记为E.coli BL21(DE3)-ΔlpxM。以引物对lpxM-upflank-F/lpxM-downflank-R分别对敲除lpxM前后的基因片段进行扩增。lpxM由1018bp组成,引物对可扩增lpxM前后各500bp序列,因此在lpxM未敲除时,共可扩增约2018bp,当lpxM被敲除后,可扩增约1000bp。结果由图3可知,PCR扩增结果符合预期值。并将PCR产物测序,测序结果显示lpxM序列已被全部敲除。
实施例2:过表达环麦芽糊精酶的制备方法
1.合成编码氨基酸序列如SEQ ID NO:2所示的环麦芽糊精酶的基因(核苷酸序列如SEQ ID NO:4所示);使用同源重组的方法对合成得到的基因与pET-28a(+)载体进行连接,得到连接产物,利用引物序列如下;
cdase-F1:5′-TGGTGCCGCGCGGCAGCCATATGATGATTATGCTGGAAGC-3′(SEQ ID NO:15);cdase-R1:5′-TGGTGGTGGTGGTGCTCGAGCTCAGCCGTTCCTGCTATAG-3′(SEQ ID NO:16);
pET-F:5′-CTCGAGCACCACCACCACC-3′(SEQ ID NO:17);
pET-R:5′-ATGGCTGCCGCGCGGCAC-3′(SEQ ID NO:18);
2.将获得的连接产物于37℃下过夜连接30min后,转化至大肠杆菌DH5α感受态细胞中;将转化后的大肠杆菌DH5α感受态细胞涂布LB固体培养基(含有50μg/mL的卡那霉素),37℃倒置培养12~14h;挑取阳性转化子,提取质粒,测序验证结果表明连接成功,获得重组质粒pET-28a(+)-cdase;
3.将获得的重组质粒pET-28a(+)-cdase化转至渗透性大肠杆菌E.coli BL21(DE3)-ΔlpxM中,获得渗透性重组大肠杆菌E.coli BL21(DE3)-ΔlpxM/pET-28a(+)-cdase;将获得的渗透性重组大肠杆菌E.coli BL21(DE3)-ΔlpxM/pET-28a(+)-cdase划线于LB固体培养基上,于37℃恒温培养箱中培养18h,获得单菌落;挑取单菌落分别接种于LB液体培养基中,于37℃、250rpm的摇床中培养14h,获得活化好的菌液;将活化好的菌液按1%(v/v)的接种量分别接种至TB液体培养基中,于温度为37℃、转速为250rpm的条件下培养至细胞对数期,加入终浓度为0.5mM IPTG,于温度为25℃、转速为250rpm的条件下诱导20h获得发酵液;将发酵液离心,分别获得发酵上清液和沉淀。此发酵上清液即为氨基酸序列如SEQ ID NO:2所示的环麦芽糊精酶的胞外发酵液。将沉淀重悬于20mM磷酸钠缓冲液(pH7.0)中,所获得的重悬液即为氨基酸序列如SEQ ID NO:2所示的环麦芽糊精酶的全细胞重悬液。选取部分全细胞重悬液超声破碎,离心取上清液,所获得的上清液即为即为氨基酸序列如SEQ ID NO:2所示的环麦芽糊精酶的粗酶液。重组环麦芽糊精酶的SDS-PAGE检测结果如图4所示。
实施例3:共表达环麦芽糊精酶和麦芽寡糖基海藻糖合成酶的制备方法
合成编码氨基酸序列如SEQ ID NO:3所示的麦芽寡糖基海藻糖合成酶的基因(核苷酸序列如SEQ ID NO:5所示);与环麦芽糊精酶的基因使用同源重组的方法与pACYCDuet1、pCDFDuet1、pRSFDuet 1,pCOLADuet 1载体进行连接,得到连接产物:pACYCDuet cdase-mtsase、pCDFDuet cdase-mtsase、pRSFDuet cdase-mtsase,pCOLADuet cdase-mtsase。载体对应的抗生素添加分别为25μg/mL氯霉素、50μg/mL链霉素、50μg/mL卡那霉素、50μg/mL卡那霉素。
其中环麦芽糊精酶的基因cdase位于第一个多克隆位点,麦芽寡糖基海藻糖合成酶的基因mtsase位于第二个多克隆位点。或者麦芽寡糖基海藻糖合成酶的基因mtsase位于第一个多克隆位点,环麦芽糊精酶的基因cdase位于第二个多克隆位点。以载体pRSF-mtsase-cdase构建为例,引物序列如表1所示:
表1载体pRSF-mtsase-cdase构建所用引物
/>
载体构建如图5所示,以cdase构建至pRSF-Duet1的第一个多克隆位点,mtsase构建至pRSF-Duet1的第二个多克隆位点为例。
将获得的重组质粒pRSF-mtsase-cdase(其余三种重组质粒的培养方法与之相同)化转至渗透性大肠杆菌E.coli BL21(DE3)-ΔlpxM中,获得渗透性重组大肠杆菌E.coliBL21(DE3)-ΔlpxM/pRSF-mtsase-cdase;将获得的渗透性重组大肠杆菌E.coli BL21(DE3)-ΔlpxM/pRSF-mtsase-cdase划线于LB固体培养基上,于37℃恒温培养箱中培养18h,获得单菌落;挑取单菌落分别接种于LB液体培养基中,于37℃、250rpm的摇床中培养14h,获得活化好的菌液;将活化好的菌液按1%(v/v)的接种量分别接种至TB液体培养基中,于温度为37℃、转速为250rpm的条件下培养至细胞对数期,加入终浓度为0.5mM IPTG,于温度为25℃、转速为250rpm的条件下诱导20h获得发酵液;将发酵液离心,分别获得发酵上清液和沉淀。此发酵上清液即为氨基酸序列如SEQ ID NO:2所示的环麦芽糊精酶和氨基酸序列如SEQ ID NO:3所示的麦芽寡糖基海藻糖合成酶的胞外发酵液。将沉淀重悬于20mM磷酸钠缓冲液(pH 7.0)中,所获得的重悬液即为氨基酸序列如SEQ ID NO:2所示的环麦芽糊精酶和氨基酸序列如SEQ ID NO:3所示的麦芽寡糖基海藻糖合成酶的全细胞重悬液。选取部分全细胞重悬液超声破碎,离心取上清液,所获得的上清液即为即为氨基酸序列如SEQ ID NO:2所示的环麦芽糊精酶和氨基酸序列如SEQ ID NO:3所示的麦芽寡糖基海藻糖合成酶的粗酶液。共表达重组环麦芽糊精酶和麦芽寡糖基海藻糖合成酶的SDS-PAGE检测结果如图6所示,四种重组质粒均成功分泌环麦芽糊精酶和麦芽寡糖基海藻糖合成酶,其中不同质粒之间的分泌水平略有差异,重组质粒pRSF-mtsase-cdase和pCDF-mtsase-cdase的酶分泌能力优于pACYC-mtsase-cdase和pCOLA-mtsase-cdase。
实施例4:环糊精溶液的制备方法
将β-环糊精加入浓度为20mM的磷酸钠缓冲液中,得到β-环糊精浓度为20和100g/L的环糊精溶液。
一、酶活测定
分别将环麦芽糊精酶、麦芽寡糖基海藻糖合成酶胞外发酵液、全细胞重悬液和粗酶液在相同条件下(环麦芽糊精酶酶活在温度为35℃、pH为7.5的条件下,1min内作用于β-环糊精生成1μmol麦芽七糖所需的酶量为一个酶活力单位(1U)。麦芽寡糖基海藻糖合成酶酶活在温度为45℃、pH为7.0的条件下,1min内作用于麦芽糊精生成1μmol非还原性麦芽糊精所需的酶量为一个酶活力单位(1U)。)进行酶活检测,所得的酶活分别为环麦芽糊精酶、麦芽寡糖基海藻糖合成酶胞外、全细胞和胞内酶活。
酶活结果如表2所示。当以缺陷型宿主E.coli BL21(DE3)-ΔlpxM时环麦芽糊精酶、麦芽寡糖基海藻糖合成酶具有全细胞酶活,而当以原始宿主E.coli BL21(DE3)时便不存在全细胞酶活,说明敲除E.coli BL21(DE3)细胞外膜脂多糖合成相关基因lpxM提高了细胞膜的通透性。由于这两种酶都没有检测到胞外酶活的存在,所以可以推断出细胞渗透性的提高仅限于底物可以进入细胞,而酶不会被分泌出细胞外。
表2环麦芽糊精酶、麦芽寡糖基海藻糖合成酶的酶活分布
二、麦芽糊精的制备
具体步骤如下:
将过表达环麦芽糊精酶的渗透性全细胞(E.coli BL21(DE3)-ΔlpxM/pET-28a(+)-cdase)重悬液以3U/g-
检测反应液1中麦芽糊精含量随时间的变化趋势,还原性麦芽七糖用DP7表示,结果如表3所示。环麦芽糊精酶全细胞单独作用于环糊精生成单一聚合度还原性麦芽糊精,在反应6.5h时DP7在总反应体系中的占比最大达到43.05%,随后被环麦芽糊精酶水解导致含量下降。
表3反应液1中麦芽七糖(DP7)随时间的含量变化
三、非还原性麦芽糊精的制备(渗透性全细胞法)
具体步骤如下:
将共表达环麦芽糊精酶和麦芽寡糖基海藻糖合成酶的渗透性全细胞重悬液以3U/g-
检测反应液2~5中麦芽糊精的聚合度分布见表4。
由表4可知,麦芽寡糖基海藻糖合成酶是生成非还原性低聚合度麦芽糊精的关键。并且,以pRSFDuet-mtsase-cdase作为载体时,从β-环糊精利用率可以得出此时酶反应速度最快,虽然NDP7(非还原性麦芽七糖)的含量和转化率低于以pCDFDuet-mtsase-cdase作为载体时,这是由于NDP7已经被水解。
表4反应液2~5中麦芽糊精的聚合度分布
四、非还原性麦芽糊精的制备(发酵法)
具体步骤如下:
将100g/Lβ-环糊精加入含有共表达环麦芽糊精酶和麦芽寡糖基海藻糖合成酶的渗透性大肠杆菌发酵液中,在25℃持续发酵,获得含有麦芽糊精的反应液。不同的载体获得不同的反应液。其中以pRSFDuet-mtsase-cdase作为载体时获得反应液6;以pCOLADuet-mtsase-cdase作为载体时获得反应液7;以pACYCDuet-mtsase-cdase作为载体时获得反应液8;以pCDFDuet-mtsase-cdase作为载体时获得反应液9。检测反应液6~9中麦芽糊精的聚合度分布。
由表5~8可知,以pRSFDuet-mtsase-cdase作为载体时,发酵过程中合成NDP7最快,并且在20h时在总麦芽糊精中的含量占比达到最大值为65.31%,此时NDP7转化率为50.12%,β-环糊精利用率为96.26%。
表5检测反应液6中麦芽糊精的聚合度分布
/>
表6检测反应液7中麦芽糊精的聚合度分布
表7检测反应液8中麦芽糊精的聚合度分布
表8检测反应液9中麦芽糊精的聚合度分布
五、温度对麦芽糊精产率的影响(发酵法)
选取pRSFDuet-mtsase-cdase作为载体,将100g/Lβ-环糊精加入含有共表达环麦芽糊精酶和麦芽寡糖基海藻糖合成酶的渗透性大肠杆菌(E.coli BL21(DE3)-ΔlpxM/pRSF-mtsase-cdase)发酵液中,分别在25、28、30、33℃下持续发酵20h,获得含有麦芽糊精的反应液,记为反应液10。检测反应液10中麦芽糊精的聚合度分布,检测结果见表9。
由表9可知,以发酵温度为28℃时,发酵过程中合成NDP7最快,并且在20h时NDP7已经发生水解。
表9检测反应液10中麦芽糊精的聚合度分布
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
SEQ ID NO:1
lpxM核酸序列:
atggaaacgaaaaaaaataatagcgaatacattcctgagtttgataaatcctttcgccacccgcgctactggggagcatggctgggcgtagcagcgatggcgggtatc
gctttaacgccgccaaagttccgtgatcccattctggcacggctgggacgttttgccggacgactgggaaaaagctcacgccgtcgtgcgttaatcaatctgtcgctct
gctttccagaacgtagtgaagctgaacgcgaagcgattgttgatgagatgtttgccaccgcgccgcaagcgatggcaatgatggctgagttggcaatacgcgggccg
gagaaaattcagccgcgcgttgactggcaagggctggagatcatcgaagagatgcggcgtaataacgagaaagttatctttctggtgccgcacggttgggccgtcga
tattcctgccatgctgatggcctcgcaagggcagaaaatggcagcgatgttccataatcagggcaacccggtttttgattatgtctggaacacggtgcgtcgtcgctttg
gcggtcgtctgcatgcgagaaatgacggtattaaaccattcatccagtcggtacgtcaggggtactggggatattatttacccgatcaggatcatggcccagagcaca
gcgaatttgtggatttctttgccacctataaagcgacgttgcccgcgattggtcgtttgatgaaagtgtgccgtgcgcgcgttgtaccgctgtttccgatttatgatggcaa
gacgcatcgtctgacgattcaggtgcgcccaccgatggatgatctgttagaggcggatgatcatacgattgcgcggcggatgaatgaagaagtcgagatttttgttggt
ccgcgaccagaacaatacacctggatactaaaattgctgaaaactcgcaaaccgggcgaaatccagccgtataagcgcaaagatctttatcccatcaaataa
SEQ ID NO:2
环麦芽糊精酶氨基酸序列
mmimleavyhrmgqnwsyayndstlhirirtkrdnvpridlhcgekydpekyketipmermasdglfdywqaavqpryrrlvyyfalhsdngdavyfme
kgffdqppkvmyeglfdfpylnrqdvhtppawvkeaifyqifperfangdpsndpegvqewggtpsagnffggdlqgvidhldylsdlgvnalyfnplfaatt
nhkydtadymkidpqfgtneklkelvdachargmrvlldavfnhcghtfppfvdvlnnglnsryadwfhvrewplrvvdgiptydtfafepimpklntgnee
vkayllnvgrywleemgldgwrldvanevdhqfwrefrseikrinpsayilgeimhdsmpwlqgdqfdavmnypftnillnffarrltnaaefaqaigtqlag
ypqqvtevsfnllgshdttrlltlcsgnvermklatlfqltyqgtpciyygdeigmdgeydplnrkcmewdkskqntellaffrsmislrkahpalrgsglrflpvle
hpqllvyerwddnerflimlnnedapvnvvipaaqpgaswrtvngepcavveessiqaalppygyailhapiagtae
SEQ ID NO:3
麦芽寡糖基海藻糖合成酶氨基酸序列
mrtpvstyrlqirkgftlfdaaktvpylhslgvdwvylspvltaeqgsdhgydvtdpsavdperggpeglaavskaaraagmgvlidivpnhvgvatpaqnpw
wwsllkegrqsryaeafdvdwdlaggrirlpvlgsdddldqleirdgelryydhrfplaegtyaegdaprdvharqhyeligwrradnelnyrrffavntlagvrv
eipavfdeahqevvrwfredladglridhpdgladpegylkrlrevtggaylliekilepgeqlpasfecegttgydaladvdrvlvdprgqepldrldaslrggep
adyqdmirgtkrritdgilhseilrlarlvpgdanvsidagadalaeiiaafpvyrtylpegaevlkeacelaarrrpeldqaiqalqpllldtdlelarrfqqtsgmvm
akgvedtaffrynrlgtltevgadptefavepdefharlarrqaelplsmttlsthdtkrsedtrarisvisevagdwekalnrlrdlaplpdgplsallwqaiagawp
asrerlqyyalkaareagnstnwtdpapafeeklkaavdavfdnpavqaevealvellepygasnslaaklvqltmpgvpdvyqgtefwdrsltdpdnrrpfsf
ddrraaleqldagdlpasftdertkllvtsralrlrrdrpelftgyrpvlasgpaaghllafdrgtaaapgaltlatrlpygleqsggwrdtavelntamkdeltgagfgp
gavkiadifrsfpvallvpqtgges
SEQ ID NO:4
环麦芽糊精酶核酸序列
atgatgattatgctggaagccgtttaccaccggatgggacaaaactggtcctatgcctacaatgattcgaccttgcatatccgcatccgcaccaagcgggacaatgtcc
cgcgcatcgacctgcactgcggcgagaagtacgatccggagaagtacaaggaaaccattcccatggagcgtatggcttctgacggactgtttgattattggcaagcc
gccgtgcagcccagataccgtagattagtttattacttcgcgctgcattccgacaacggcgatgccgtttactttatggagaagggattctttgatcagccgcccaaggt
gatgtatgaaggattgttcgacttcccttatctgaatcggcaggatgtgcacacgcctccggcatgggttaaggaagcgatattctatcagattttccccgagcgcttcgc
gaacggcgatccgtccaacgatcccgaaggcgtgcaggaatggggaggtacgcccagcgccggcaatttcttcggcggggatttgcaaggcgtgatcgatcatct
ggactatctaagcgatctgggcgttaatgctttgtatttcaaccccctattcgcggccaccaccaaccataaatacgatacggcggactatatgaagatcgacccccaat
tcggcacgaacgaaaagctcaaggagctggtcgatgcctgccatgcccggggcatgcgcgtgctgctggacgccgtgttcaaccactgcggccatacgtttccgcc
gttcgtggacgtgttgaacaacggtctgaattcgcgttacgcggattggttccatgttcgggaatggcctctgcgggtcgttgacgggattccgacctacgatacgttcg
cattcgaaccaatcatgcccaagctcaataccggcaatgaagaagtgaaggcttacctgttgaatgtcggccgttactggctggaggagatggggctggacggctgg
cggctggatgtcgccaatgaggtggaccatcaattctggcgggaattccggagcgagatcaaacggatcaatccttcggcctatatcttaggcgagattatgcatgatt
ccatgccgtggctgcaaggcgaccaattcgacgcggtcatgaattatcccttcacgaacatcctgctgaacttcttcgcccgcaggctgacgaacgcggccgaattcg
cccaggcgatcggcacgcagctcgccggttatccgcagcaggttacggaagtgtcattcaatctgctcggcagccatgacacgacgaggctattgacgttgtgcagc
ggcaatgtggagcgcatgaagctggcgaccttattccagctgacctatcaggggacgccatgcatctattacggcgacgagatcggcatggacggcgagtatgacc
ccctcaaccgcaagtgcatggaatgggacaagagcaagcagaatacggagctgcttgcgttcttccggagcatgatcagcctgcgcaaggctcaccctgcgctgcg
cggaagcggactgcgcttcctgccggtgctggagcacccgcagttgctggtctatgagcgctgggacgataatgagcgattcctcatcatgctgaataatgaggatg
ctcccgtgaacgttgttatcccggcagctcagcccggcgcttcttggcgcaccgtgaacggcgagccatgcgcagtagtcgaggaaagttcgatacaggcggctctc
cctccttacggttatgccatactgcatgcgcctatagcaggaacggctgagtaa
SEQ ID NO:5
麦芽寡糖基海藻糖合成酶核酸序列
atgagaacgccagtctccacgtacaggctgcagatcaggaagggattcacactcttcgacgcggccaaaaccgttccgtacctgcactcgctcggcgtcgactgggt
ctacctttctccggtcctgactgccgagcagggctccgaccacgggtacgacgtcaccgatccctccgccgtcgaccccgaacgcggcgggccggagggcctcg
cggcggtttccaaggcggcccgcgccgcgggcatgggcgtgctgatcgacatcgtgcccaaccacgtgggcgtcgcgacgccggcgcagaacccctggtggtg
gtcgctgctcaaggagggacgccagtcccgttacgcggaggcgttcgacgtcgattgggacctcgccgggggacgcatccggctgccggtgctcggcagcgacg
atgacctcgaccagctcgaaatcagggacggggagctgcggtactacgaccaccgattcccgctcgccgagggaacctacgccgaaggcgacgccccgcggga
tgtccacgcccggcagcactacgagctcatcggctggcgccgcgcggacaacgagctgaactaccgccgctttttcgcggtgaacacgctcgccggcgtccgcgt
ggaaatccccgccgtcttcgacgaggcacaccaggaggtggtgcgctggttccgcgaggaccttgcggacggcctgcggatcgaccacccggacggcctcgctg
accccgaggggtacctgaagcgactccgggaagtcaccggcggcgcttacctgctgatcgaaaagatcctggagccgggggagcagctgcccgccagcttcgag
tgtgaaggcaccacaggctacgacgccctcgccgacgtcgaccgggttctcgtggacccgcgcggccaggaaccgctggaccggcttgacgcgtccctgcgtgg
cggcgagcccgccgactaccaggacatgatccgcggaaccaagcgccggatcaccgacggtatcctgcactcggagatcctgcggctggcccggctggttccgg
gcgacgccaacgtttcaatcgacgccggagccgacgctctcgccgaaatcatcgccgccttcccggtctaccgcacctacctgccggagggcgccgaggtcctga
aggaggcgtgcgagcttgccgcgcgtaggcggccggaactcgaccaggccatccaggctctgcagccgctgctgctggacacggacctcgagcttgcccggcg
cttccagcagacctcgggcatggtcatggccaagggcgtggaggacaccgcgttcttccgctacaaccgcctgggcaccctcacggaagtgggcgccgacccca
ccgagttcgccgtggagccggacgagttccacgcccggctggcacgccggcaggccgagcttccgctgtccatgacgacgctgagcacgcacgacaccaagcg
cagcgaggacacccgagcaaggatttcggtcatttccgaggttgcgggtgactgggaaaaggccttgaaccggctgcgcgacctggccccgctgccggacggcc
cgctgtccgcgctgctctggcaggccattgccggcgcctggcccgccagccgggaacgcctgcagtactacgcgctgaaggccgcgcgtgaagcggggaactc
gaccaactggaccgatccggcccccgcgttcgaggagaagctgaaggccgcggtcgacgccgtgttcgacaatcccgccgtgcaggccgaggtggaagccctc
gtcgagctcctggagccgtacggagcttcgaactccctcgccgccaagctcgtgcagctgaccatgcccggcgtcccggacgtctaccagggcacggagttctgg
gaccggtcgctgacggacccggacaaccggcggccgttcagcttcgacgaccgccgcgccgcgctggagcagctggatgccggcgaccttcccgcgtcatttac
cgatgagcggacgaagctgctagtgacgtcgcgcgcgctgcggctgcgccgggaccgtccggagctgttcacggggtaccggccggtcctggccagcgggccc
gccgccgggcacctgctcgcgttcgaccgcggcaccgcggcggcgccgggtgcattgaccctcgccacgcggcttccctacgggctggaacagtcgggtggatg
gcgggacaccgccgtcgaacttaacaccgccatgaaagacgaactgaccggtgccggcttcggaccgggggcagtgaagatcgccgacatcttccggtcgttccc
cgttgcgctgctggtgccgcagacaggaggagagtcataa。
- 一种利用固定化酶制备系列单一聚合度的新琼寡糖的方法
- 一种利用重组大肠杆菌全细胞转化生产宝丹酮的方法
- 一种利用全细胞转化生产1,2-氨基醇类化合物的方法
- 一种大米蛋白生产废水的资源化全利用方法
- 一种枯草芽孢杆菌全细胞转化苯丙氨酸生产苯乳酸的方法
- 一种多酶耦合生产单一聚合度麦芽糊精的方法
- 一种多酶耦合生产单一聚合度麦芽糊精的方法
