酿酒酵母工程菌株及其在合成苄基硫苷中的应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于酿酒酵母工程技术领域。
背景技术
硫苷是一类具有高附加值的植物次生代谢产物,具有抗癌等作用。硫苷-硫苷酶二元系统释放的水解产物-异硫氰酸酯在植物的防御保护以及人类健康营养方面中起到重要作用,例如在抗癌、抑菌、抗氧化等方面,具有广阔的应用前景。
苄基硫苷(Benzyl glucosinolate,BG),又称苄基芥子油苷或金莲葡糖硫苷,是硫苷类化合物中合成途径最简单的一种,主要存在于玛咖和番木瓜等植物中。苄基硫苷在拟南芥中的合成途径已经被研究清楚,包括七个酶参与的七步反应,途径具体为:苯丙氨酸由细胞色素P450家族蛋白CYP79A2催化生成苄基醛肟;再由该家族另外一个蛋白CYP83B1催化生成腈类氧化物,该产物为强亲电子产物在谷胱甘肽硫转移酶(GSTF)的作用和谷胱甘肽反应生成谷胱甘肽共轭物,在由γ-谷酰基蛋白酶(GGP1)作用下生成S-烷基磺肟酸共轭物;C-S裂解酶(SUR1)进一步催化反应生成苄基磺肟酸、丙酮酸、NH3;葡糖转移酶(UGT74B1)将尿苷二磷酸葡萄糖苷(UDPG)上的葡萄糖基团转移到磺肟酸上形成苄基脱硫硫苷;磺基转移酶(SOT18)在3-氧-磷酸腺苷-5-磷硫酸(PAPS)参与下催化脱硫硫苷生成苄基硫苷。
目前硫苷的主要生产方法是从植物中提取,由于苄基硫苷属于植物的次生代谢产物,含量很低,利用植物细胞或者组织培养物提取的方法面临着成本高产量低和污染环境等问题,无法实现大规模生产。
发明内容
有鉴于此,本发明提供了一株酿酒酵母工程菌株YS58-BG,将打靶片段连同筛选标记ura3打靶到酿酒酵母YS58的delta位点并反筛消除ura3基因后获得;所述打靶片段是由CYP79A2、CYP83B1、ATR2、GSTF9、GGP1、SUR1、UGT74B1和SOT18基因片段依次连接;所述CYP79A2基因片段是由CYP79A2基因两端分别连接其对应的启动子P
在本发明的具体实施例中,所述YS58-BG菌株在发酵产苄基硫苷中的应用。
第二,本发明提供了一株酿酒酵母工程菌株YS58-BG-1,所述YS58-BG菌株敲除pah1基因获得。
在本发明的具体实施例中,所述YS58-BG-1菌株在发酵产苄基硫苷中的应用。
第三,本发明提供了一株酿酒酵母工程菌株YS58-BG-2,在所述YS58-BG-1菌株中转入质粒YEp352-P
在本发明的具体实施例中,所述YS58-BG-2菌株在发酵产苄基硫苷中的应用。
第四,本发明提供了一株酿酒酵母工程菌株YS58-BG-3,在所述YS58-BG-1菌株中转入质粒YEp352-P
在本发明的具体实施例中,所述酿酒酵母工程菌株YS58-BG-3在发酵产苄基硫苷中的应用。
本发明提供的酿酒酵母工程菌株能发酵产苄基硫苷,进一步改造该菌株,能进一步提高苄基硫苷的产量。
附图说明
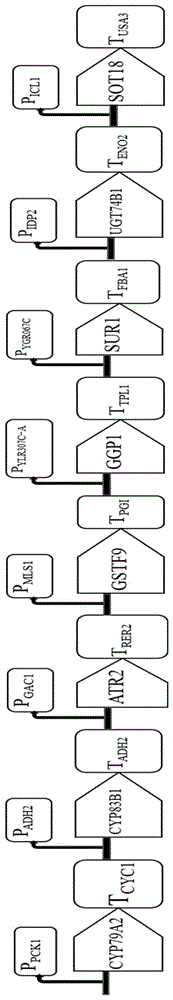
图1是具体的启动子与终止子搭配与顺序图。
图2是ura3基因的位置与发生同源重组反筛消除ura3图。
图3是苄基硫苷标准品LC-MS的结果图。
图4是菌株YS58-BGLC-MS的结果图。
图5是YS58-BG-1菌株打靶片段图。
具体实施方式
实施例1
YPD培养基,其配方为:1%酵母粉(购自Oxoid公司)、2%蛋白胨(购自Oxoid公司)、2%葡萄糖(购自源叶生物),115℃灭菌20min。以上含量为质量含量比例。
1.制备打靶片段基因与启动子和终止子
酿酒酵母YS58是一种单倍体的尿嘧啶营养缺陷型工程菌株,在其基因组上存在一类长末端重复序列——delta序列,位于酿酒酵母染色体DNA的逆转录转座子Ty上。在酿酒酵母染色体上,大约存在35个Ty相关联拷贝数与至少100个delta位点。利用delta序列的同源重组方法,将苄基硫苷基因整合到酿酒酵母染色体组的方法快速高效,而且目的基因的遗传与表达稳定。
对拟南芥中苄基硫苷合成途径的相关基因进行密码子偏好优化合成,包括参与七步反应的七个基因CYP79A2、CYP83B1、GSTF9、GGP1、SUR1、UGT74B1、SOT18以及一个细胞色素还原酶基因ATR2。同时以酿酒酵母YS58的基因组为模板,扩增出酿酒酵母的8个启动子和8个终止子。
表1.基因与对应的启动子和终止子的序列信息对应表
2.将由基因及对应的启动子和终止子构成的打靶片段一次性打靶到酿酒酵母YS58的delta位点
利用Gibson组装法将启动子、终止子分别与八个基因进行组装搭配到质粒pUC19上,再以质粒为模板,扩增获得了苄基硫苷合成途径8个基因的打靶片段,每个打靶片段包括一个启动子,一个基因与一个终止子,片段的5’与3’端各包含20bp同源臂。将打靶一次性打靶到酿酒酵母YS58的delta位点。
具体的启动子与终止子搭配与顺序,如图1所示。
3.获得消除ura3基因的YS58-BG菌株
利用ura3基因作为筛选标记,将ura3基因与苄基硫苷合成途径的8个打靶片段通过电转化的方法转入到酿酒酵母YS58的感受态细胞中,ura3基因的位置如图2所示。
酵母嘧啶核苷酸的从头生物合成需要乳清酸核苷酸脱羧酶基因参与,该基因由ura3基因编码,是嘧啶生物合成所必需的酶;若ura3基因缺失,嘧啶生物合成途径将中断,在没有外源尿嘧啶补给条件下酵母无法存活,因此ura3做为一种选择性标记基因,常用于酿酒酵母等酵母菌的遗传操作或遗传操作系统的构建。
将所有的打靶片段通过电转化的方法转入到酿酒酵母YS58的感受态细胞中,使用Bio-Red电转仪进行电转化,方法为100μL感受态细胞,每个片段各加入200ng,使用0.2cm的电转杯(购自博迈德公司),2.5kV电压进行电击,电击时间为5ms左右。然后加入1ml YPD培养基(配方:1%酵母粉、2%蛋白胨、2%葡萄糖,115℃灭菌20min,其中为质量百分数)复苏培养2h。之后用1M的山梨醇溶液清洗三次洗掉复苏培养基,用1ml重悬后涂布于不含有尿嘧啶的SC-URA培养基(配方:0.8% SC/-URA Broth、2%葡萄糖、2%琼脂,115℃灭菌20min)上培养96h,长出来菌落后进行菌落PCR验证ura3基因,对验证正确的菌提取基因组对苄基硫苷合成途径的8个基因分别PCR验证并进行测序。
通过PCR鉴定,得到了苄基硫苷合成的8个基因全部整合到酿酒酵母YS58的基因组delta位点的菌株。之后利用5-氟乳清酸反筛,筛选出发生同源重组消除ura3基因的菌株。ura3基因编码的乳清酸核苷酸脱羧酶可以使5-氟乳清酸变成对细胞有毒性的物质,使酵母细胞在含5-氟乳清酸的培养基上不能生长,从而筛选出发生了同源重组消除了ura3的菌株。
将全部整合的菌株接种到YPD培养基中培养12h后,用1M山梨醇清洗三次后接种到含有尿嘧啶和5-氟乳清酸的SC液体培养基中培养12h,然后涂布到含有尿嘧啶和5-氟乳清酸的SC培养基平板上,SC培养基是在SC-URA培养基的基础上添加尿嘧啶和5-氟乳清酸,其中尿嘧啶的浓度为30mg/L,5-氟乳清酸的浓度为1g/L,最后筛选出ura3已经被消除的菌株,并且命名为YS58-BG。
4.YS58-BG菌株发酵制备苄基硫苷
对YS58-BG菌株进行发酵。将菌株接种到YPD培养基中,30℃培养18h,按照2%接种量接种到发酵培养基中(配方:0.8% SC/-URA Broth、2%葡萄糖、30mg/L尿嘧啶、0.5g/L苯丙氨酸,其中为质量百分数),30℃,200rpm发酵72h,采用LC-MS检测上清中的苄基硫苷。
检测的条件如下:色谱柱C18,流动相:A为含0.1% TFA的水溶液,B为含0.1% TFA的乙腈溶液,梯度洗脱:0-10min,A从98%到90%,B从2%到10%;10-20min,A从90%到0,B从10%到100%;保持到25min;25-30min,A从0到98%,B从100%到2%;保持到35min,流速:0.5mL/min,检测波长214nm,柱温:30℃,进样量:10uL。LC-MS的结果如图4所示:
根据信号强度计算,YS58-BG在发酵72h后的苄基硫苷的产量为2ug/L。
5.制备敲除pah1的YS58-BG-1菌株
pah1基因编码磷脂酸磷酸酶,它催化磷脂酸而产生中性甘油三酯,敲除pah1基因后可以使得内质网发生扩张。
通过利用酵母菌自身的同源重组能力,利用以博来霉素抗性和mazF毒蛋白为筛选标记的表达盒,实现无痕敲除。该表达盒主要包括由半乳糖诱导的P
YS58-BG-1菌株发酵和检测方法同第4步中YS58-BG菌株发酵的发酵和检测方法相同,YS58-BG-1菌株经过发酵测定,YS58-BG-1苄基硫苷产量为16ug/L。
6.制备YS58-BG-2菌株
选择了三个不同强度启动子,从强到弱依次是P
将P
所述hac1基因序列如序列表SEQ ID NO.25所示。
所述三个转入质粒的菌株分别进行发酵和检测的方法同第4步中YS58-BG菌株发酵的发酵和检测方法相同。
7.制备YS58-BG-3菌株
选择强启动子P
用YS58-BG-3菌株发酵制备苄基硫苷并检测苄基硫苷的产量为32.6ug/L,所述YS58-BG-3菌株分别进行发酵和检测的方法同第4步中YS58-BG菌株发酵的发酵和检测方法相同。
所述scCYb5基因序列如序列表SEQ ID NO.26所示。
- 从头合成莱鲍迪苷M的酿酒酵母工程菌及其应用
- 多形汉逊酵母重组菌株及其在龙胆苦苷生物合成中的应用
