检测腺病毒抗原的胶体金免疫层析试纸及其制备方法、试纸盒、检测方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及免疫检测分析技术领域,特别涉及一种检测腺病毒抗原的胶体金免疫层析试纸及其制备方法、试纸盒、检测方法。
背景技术
胶体金免疫层析技术是一种将抗原抗体免疫反应与胶体金标记示踪技术结合用于抗原、抗体含量定性定量检测的技术。抗体的胶体金标记主要是通过胶体金与蛋白质之间的静电作用力进行牢固结合的,由于其快速、简便、成本低、稳定性好等优点,特别是为现场快速检测叩开了一扇崭新的大门。
人腺病毒是人类重要的病毒性致病原,可导致多种疾病,主要包括急性呼吸道感染、眼结膜炎、胃肠道疾病等。
在制备免疫标签的过程中,需要使用纳米金溶液与抗体进行反应,以在纳米金表面标记上抗体,在标记过程中会出现标记效率低的问题,如何提高标记效率是需要解决的问题。
发明内容
本发明的主要目的是提供一种检测腺病毒抗原的胶体金免疫层析试纸,旨在提高标记效率。
为实现上述目的,本发明提出的一种检测腺病毒抗原的胶体金免疫层析试纸,所述检测腺病毒抗原的胶体金免疫层析试纸包括底板、以及依次设置在所述底板上的样本垫、结合垫、层析膜和吸水垫,所述层析膜上设有检测线和质控线;
所述结合垫包被有胶体金标记的腺病毒抗体,所述胶体金的粒径为58nm-62nm,所述检测线处的抗体包括用以识别腺病毒抗原的第一抗体,所述质控线处的抗体包括用以识别所述腺病毒抗体的第二抗体。
可选地,所述胶体金的粒径为60nm;
和/或,所述腺病毒抗体包括7B5M克隆号抗体,所述第一抗体包括2B10克隆号抗体;
和/或,所述第二抗体包括羊抗鼠IgG;
和/或,所述检测腺病毒抗原的胶体金免疫层析试纸的最低检出限为4×10
和/或,所述第一抗体为单抗或多抗;
和/或,所述检测线处第一抗体的划线浓度为1ul/cm;
和/或,所述结合垫包被有胶体金标记的腺病毒抗体的涂覆浓度为10ul/cm;
和/或,所述底板的材料包括聚氯乙烯、聚乙烯和玻璃中的至少一种;
和/或,所述样本垫的材料包括玻璃纤维膜,所述玻璃纤维膜包括ahlstrom8964;
和/或,所述结合垫的材料包括玻璃纤维膜和/或聚酯纤维膜,所述玻璃纤维膜包括ahlstrom 8980;
和/或,所述层析膜的材料包括硝酸纤维素膜,所述硝酸纤维素膜包括sartorius140;
和/或,所述样本垫、所述结合物垫、所述层析膜和所述吸水垫依次相互搭接地贴在所述底板上。
本申请还提供一种检测腺病毒抗原的胶体金免疫层析试纸的制备方法,包括以下步骤:
将腺病毒抗体与粒径为58nm-62nm的胶体金颗粒结合形成免疫标签,将所述免疫标签固定于结合垫,备用;
在层析膜上设置检测线和质控线,将用以识别腺病毒抗原的第一抗体固定在所述检测线,将用以识别所述腺病毒抗体的第二抗体固定在所述质控线,备用;
将样本垫、固定有所述免疫标签的结合垫、固定有所述第一抗体和所述第二抗体的层析膜以及吸水垫依次设置在底板上,形成检测腺病毒抗原的胶体金免疫层析试纸。
可选地,在将腺病毒抗体与粒径为58nm-62nm的胶体金颗粒结合形成免疫标签,将所述免疫标签固定于结合垫,备用的步骤中,包括以下步骤:
准备质量体积浓度为万分之四、粒径为58nm-62nm的胶体金颗粒构成的胶体金溶液,并调节所述胶体金溶液的pH,然后加入浓度为10ug/mL-30ug/mL腺病毒抗体,反应预设时间,再加入封闭剂,封闭预设时间,得到反应后的溶液并浓缩,得到免疫标签,采用复溶液将所述免疫标签重悬,得到免疫标签复溶液,将所述免疫标签复溶液涂覆于结合垫,烘干,备用。
可选地,在将腺病毒抗体与粒径为58nm-62nm的胶体金颗粒结合形成免疫标签,将所述免疫标签固定于结合垫,备用的步骤中,包括以下步骤:
准备质量体积浓度为万分之四、粒径为58nm-62nm的胶体金颗粒构成的胶体金溶液,并调节所述胶体金溶液的pH7.0-9.0,然后加入浓度为10ug/mL-30ug/mL的腺病毒抗体,在室温下振荡反应4h-5h,再加入质量体积浓度为0.1%-0.3% BSA溶液将未被抗体包被的裸露的金表面位点覆盖,封闭30min-60min,在离心转速为6000r/min-8000r/min条件下离心10min-15min,去除上清液,得到浓缩10倍的免疫标签,采用复溶液将所述免疫标签重悬,得到稀释5-10倍的免疫标签复溶液,将所述免疫标签复溶液涂覆于结合垫,于4542℃烘干16h-18h,备用。
可选地,在将腺病毒抗体与粒径为58nm-62nm的胶体金颗粒结合形成免疫标签,将所述免疫标签固定于结合垫,备用的步骤之前,还包括以下步骤:
配置结合垫预处理液,将结合垫置于所述结合垫预处理液中浸泡,浸泡预设时间后,将所述结合垫取出干燥,备用;
其中,所述结合垫预处理液的成分包括10mM-20mM Tris-HCI,100mM-150mM NaCI,质量体积浓度为1%-1.5% BSA,质量体积浓度为3%-5%蔗糖,体积浓度为0.5%-1%Tween-20,质量体积浓度为0.1%-0.2%PEG 20000,体积浓度为0.1%-0.2%proclin 300。
可选地,在将样本垫、固定有所述免疫标签的结合垫、固定有所述第一抗体和所述第二抗体的层析膜以及吸水垫依次设置在底板上,形成检测腺病毒抗原的胶体金免疫层析试纸的步骤之前,还包括以下步骤:
配置样本垫预处理液,将样本垫置于所述样本垫预处理液中浸泡,浸泡预设时间后,将所述样本垫取出干燥,备用;
其中,所述样本垫预处理液的成分包括10mM-20mM PBS,体积浓度为1%-1.5%Tween-20,质量体积浓度为0.2%-0.5% S9,质量体积浓度为4%-6%蔗糖,质量体积浓度为0.5%-0.8% PEG6000,质量体积浓度为1.5%-2%BSA,体积浓度为0.1%-0.2%proclin300。
可选地,所述胶体金溶液的pH为8.5;
和/或,所述腺病毒抗体的浓度为20μg/ml;
和/或,所述复溶液包括50mM的NaCl,质量体积浓度为0.1%的BSA,质量体积浓度为1.5%的蔗糖和质量体积浓度为1.5%的酪蛋白钠;
和/或,所述腺病毒抗体包括深圳重链生物科技有限公司的7B5M克隆号抗体;
和/或,所述第一抗体包括珠海博美生物技术有限公司的2B10克隆号抗体;
和/或,所述第二抗体包括羊抗鼠IgG;
和/或,所述检测线处第一抗体的划线浓度为1ul/cm;
和/或,所述结合垫上免疫标签的涂覆浓度为10ul/cm;
和/或,所述第一抗体的浓度为0.5mg/mL-2mg/mL;
和/或,所述底板的材料包括聚氯乙烯、聚乙烯和玻璃中的至少一种;
和/或,所述样本垫的材料包括玻璃纤维膜,所述玻璃纤维膜包括ahlstrom8964;
和/或,所述结合垫的材料包括玻璃纤维膜,所述玻璃纤维膜包括ahlstrom8980;
和/或,所述层析膜的材料包括硝酸纤维素膜,所述硝酸纤维素膜包括sartorius140。
本申请还提供一种检测腺病毒抗原的胶体金免疫层析试纸盒,包括检测试纸条待测样本稀释液和如上述的检测腺病毒抗原的胶体金免疫层析试纸,或者通过如上述的检测腺病毒抗原的胶体金免疫层析试纸的制备方法制得的检测腺病毒抗原的胶体金免疫层析试纸;
所述检测腺病毒抗原的胶体金免疫层析试纸盒包括卡盒,所述卡盒包括卡壳盖和卡壳底,所述卡壳盖和所述卡壳底围设形成用以容纳所述检测腺病毒抗原的胶体金免疫层析试纸的空间,所述卡壳上开设有加样区和显色区;
所述待测样本稀释液包括:10mM-20mM PBS、0.05%-0.1%Triton X100、0.05%-0.1% Tween 20以及0.1%-0.2%鱼明胶。
本申请还提供一种检测方法,采用如上述的检测腺病毒抗原的胶体金免疫层析试纸对待测样品进行检测,包括以下步骤:
将待测样品加到所述检测腺病毒抗原的胶体金免疫层析试纸的样本垫上,免疫层析反应10min-15min;
观察所述检测腺病毒抗原的胶体金免疫层析试纸上检测线和质控线上的颜色,得到检测结果。
本申请的检测腺病毒抗原的胶体金免疫层析试纸,包括底板、以及依次设置在底板上的样本垫、结合垫、层析膜和吸水垫,层析膜上设有检测线和质控线;结合垫包被有胶体金标记的腺病毒抗体,胶体金的粒径为58nm-62nm,检测线处的抗体包括用以识别腺病毒抗原的第一抗体,质控线处的抗体包括用以识别腺病毒抗体的第二抗体。采用粒径为58-62nm的胶体金,可增加抗体分子与胶体金的有效碰撞,使抗体与胶体金结合效率增加,提高纳米金的有效标记数量,将该高效率标记的纳米金包被至结合垫,提高结合垫上有效标记的纳米金的数量,从而有利于提高腺病毒的检测灵敏度;且粒径为58-62nm胶体金的体积比表面积小,使用的抗体量较少,降低了抗体的使用量,也即本申请不仅提升了胶体金的标记效率,还节省了抗体的成本。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图示出的结构获得其他的附图。
图1是本申请一实施例检测腺病毒抗原的胶体金免疫层析试纸的结构示意图;
图2是本申请检测腺病毒抗原的胶体金免疫层析试纸的制备方法流程示意图;
图3是本申请胶体金免疫层析试剂检测卡;
图4为胶体金的紫外-可见光谱图。
附图标号说明:
本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
以下,适当地参照附图详细说明具体公开了本申请的检测腺病毒抗原的胶体金免疫层析试纸的实施方式。但是会有省略不必要的详细说明的情况。例如,有省略对已众所周知的事项的详细说明、实际相同结构的重复说明的情况。这是为了避免以下的说明不必要地变得冗长,便于本领域技术人员的理解。此外,附图及以下说明是为了本领域技术人员充分理解本申请而提供的,并不旨在限定权利要求书所记载的主题。
本申请所公开的“范围”以下限和上限的形式来限定,给定范围是通过选定一个下限和一个上限进行限定的,选定的下限和上限限定了特别范围的边界。这种方式进行限定的范围可以是包括端值或不包括端值的,并且可以进行任意地组合,即任何下限可以与任何上限组合形成一个范围。例如,如果针对特定参数列出了60~120和80~110的范围,理解为60~110和80~120的范围也是预料到的。此外,如果列出的最小范围值1和2,和如果列出了最大范围值3,4和5,则下面的范围可全部预料到:1~3、1~4、1~5、2~3、2~4和2~5。在本申请中,除非有其他说明,数值范围“a-b”表示a到b之间的任意实数组合的缩略表示,其中a和b都是实数。例如数值范围“0~5”表示本文中已经全部列出了“0~5”之间的全部实数,“0~5”只是这些数值组合的缩略表示。另外,当表述某个参数为≥2的整数,则相当于公开了该参数为例如整数2、3、4、5、6、7、8、9、10、11、12等。
如果没有特别的说明,本申请的所有实施方式以及可选实施方式可以相互组合形成新的技术方案。
如果没有特别的说明,本申请的所有技术特征以及可选技术特征可以相互组合形成新的技术方案。
如果没有特别的说明,本申请的所有步骤可以顺序进行,也可以随机进行,优选是顺序进行的。例如,所述方法包括步骤(a)和(b),表示所述方法可包括顺序进行的步骤(a)和(b),也可以包括顺序进行的步骤(b)和(a)。例如,所述提到所述方法还可包括步骤(c),表示步骤(c)可以任意顺序加入到所述方法,例如,所述方法可以包括步骤(a)、(b)和(c),也可包括步骤(a)、(c)和(b),也可以包括步骤(c)、(a)和(b)等。
如果没有特别的说明,本申请所提到的“包括”和“包含”表示开放式,也可以是封闭式。例如,所述“包括”和“包含”可以表示还可以包括或包含没有列出的其他组分,也可以仅包括或包含列出的组分。
如果没有特别的说明,在本申请中,术语“或”是包括性的。举例来说,短语“A或B”表示“A,B,或A和B两者”。更具体地,以下任一条件均满足条件“A或B”:A为真(或存在)并且B为假(或不存在);A为假(或不存在)而B为真(或存在);或A和B都为真(或存在)。
免疫胶体金技术是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术。胶体金是由氯金酸(HAuCl
腺病毒(human adenovirus,HAdV)是一种无包膜的双链DNA病毒,最初由人的腺体细胞中分离而来,目前已发现超过50种血清型,常诱发儿童呼吸道感染、结膜炎和胃肠炎等一系列症状。感染腺病毒的患儿以6个月至2岁为主,若不及时治疗,容易发展成重症,累及大脑、肝脏、肾脏等多个器官炎症,甚至引起死亡。
提高检测腺病毒的灵敏度能及时和有效地发现腺病毒的感染情况,早做治疗,有效保障人体健康安全。
提高标记效率有利于提高检测灵敏度,为此,本申请提供一种检测腺病毒抗原的胶体金免疫层析试纸,其具有高的标记效率,以提高检测灵敏度。
检测腺病毒抗原的胶体金免疫层析试纸包括底板、以及依次设置在底板上的样本垫、结合垫、层析膜和吸水垫,层析膜上设有检测线和质控线;结合垫包被有胶体金标记的腺病毒抗体,胶体金的粒径为58nm-62nm,检测线处的抗体包括用以识别腺病毒抗原的第一抗体,质控线处的抗体包括用以识别腺病毒抗体的第二抗体。
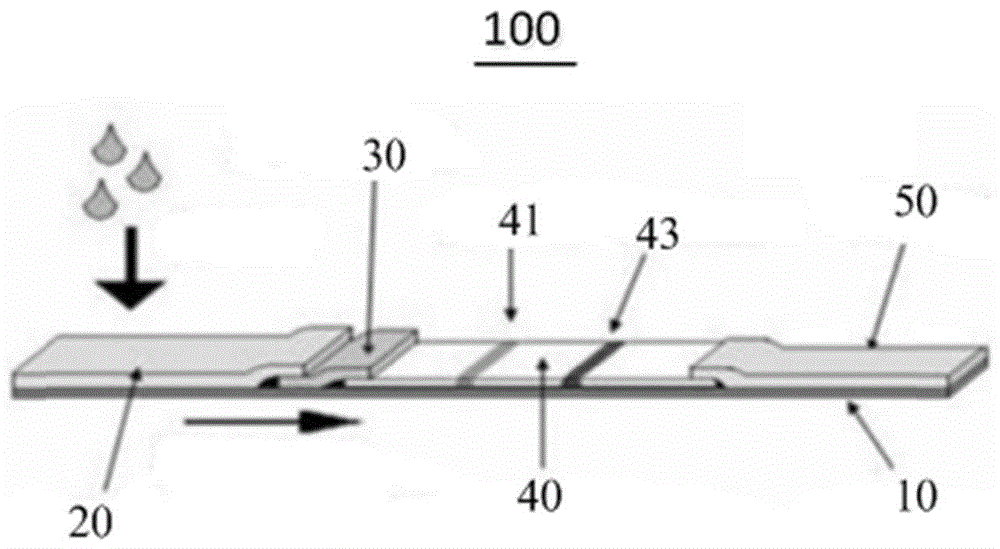
如图1所示,检测腺病毒抗原的胶体金免疫层析试纸100一般由底板10、样本垫20、结合垫30、层析膜40、吸水垫50等构成,层析膜上划有检测线41和质控线43,结合垫上固定的抗原或抗体标记的固相载体与样本中待测物发生特异性免疫反应后,形成复合物通过层析膜上的层析作用,在检测线处再次发生特异性免疫反应,固相载体作为信号放大标志物,通过肉眼观察或者相应设备检测,获得检测结果。
本申请中结合垫包被有胶体金标记的腺病毒抗体,检测线处的抗体包括用以识别腺病毒抗原的第一抗体,质控线处的抗体包括用以识别腺病毒抗体的第二抗体。当在样本垫上滴加待测样本,样本中的腺病毒在样本垫上流动,到达结合垫后,腺病毒与结合垫上的胶体金标记的腺病毒抗体特异性结合,形成“抗原-抗体-金结合物”,同时,“抗原-抗体-金结合物”从结合垫上被释放出来,通过毛细作用,“抗原-抗体-金结合物”向层析膜流动,当“抗原-抗体-金结合物”到达检测线处时,“抗原-抗体-金结合物”与检测线处的第一抗体结合,在检测线处形成“抗体-抗原-抗体-金结合物”,从而使得纳米金在检测线处的聚集显色,同时,未与腺病毒抗体特异性结合的胶体金标记的腺病毒抗体继续向质控线流动,并到达质控线后与第二抗体结合,形成“二抗-抗体-金结合物”,纳米金在质控线处聚集显色,其中,质控线显色,说明该试纸有效。
本申请采用粒径为58nm-62nm的胶体金,使得在制备胶体金标记的腺病毒抗体时,可增加抗体分子与胶体金的有效碰撞,使抗体与胶体金结合效率增加,提高纳米金的有效标记数量,将该高效率标记的纳米金包被至结合垫,提高结合垫上有效标记的纳米金的数量,从而有利于提高腺病毒的检测灵敏度;且粒径为58nm-62nm胶体金的体积比表面积小,使用的抗体量较少,降低了抗体的使用量,也即本申请不仅提升了胶体金的标记效率,还节省了抗体的成本。
上述58nm-62nm中,取值包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及58nm、59nm、60nm、61nm、62nm等。
进一步地,胶体金的粒径为60nm;和/或,腺病毒抗体包括7B5M克隆号抗体,第一抗体包括2B10克隆号抗体;和/或,第二抗体包括羊抗鼠IgG;和/或,检测腺病毒抗原的胶体金免疫层析试纸的最低检出限为4×10
本申请中采用的胶体金的粒径为60nm,60nm胶体金的体积比表面积小,使用的抗体量较少。
本申请中腺病毒抗体包括深圳重链生物科技有限公司的7B5M克隆号抗体,第一抗体包括珠海博美生物技术有限公司的2B10克隆号抗体,通过筛选国内外不同供应商的腺病毒抗体,其中有深圳重链生物科技有限公司,珠海博美生物技术有限公司,深圳重链生物科技有限公司,杭州贤至生物有限公司,厦门同仁心生物科技有限公司的抗体对,其中筛选出来的抗体对为珠海博美生物技术有限公司的2B10克隆号抗体及深圳重链生物科技有限公司的7B5M克隆号抗体,采用上述筛选出来的抗体对灵敏度高。
第二抗体包括羊抗鼠IgG,筛选了国内外不同供应商的羊抗鼠抗体,其中有上海墨迪斯医疗技术有限公司,珠海博美生物技术有限公司,杭州贤至生物有限公司,杭州隆基生物技术有限公司,宁波迈跃生物技术有限公司,筛选出的羊抗鼠抗体以宁波迈跃生物技术有限公司为质控线抗体,羊抗鼠抗体的批号为EC00102。
检测腺病毒抗原的胶体金免疫层析试纸的最低检出限为4×10
第一抗体为单抗或多抗,本申请中,第一抗体为固定在检测线处的用以识别腺病毒抗原的抗体,其可以是单抗,也可以是多抗。
检测线处第一抗体的划线浓度为1ul/cm,在检测线处固定第一抗体的步骤为:准备浓度为0.5mg/mL-2mg/mL、用以识别腺病毒抗原的第一抗体溶液,用三维划膜仪将第一抗体溶液划线于层析膜上,在层析膜上形成检测线,烘干后,备用,此时检测线处第一抗体的划线浓度为1ul/cm。
结合垫包被有胶体金标记的腺病毒抗体的涂覆浓度为10ul/cm,在结合垫上包被胶体金标记的腺病毒抗体的过程中,采用喷点的方式将胶体金标记的腺病毒抗体涂覆在结合垫上,结合垫上涂覆的胶体金标记的腺病毒抗体浓度为10ul/cm。
底板的材料包括聚氯乙烯、聚乙烯和玻璃中的至少一种,具体不作限定。样本垫的材料包括玻璃纤维膜,玻璃纤维膜包括ahlstrom 8964。结合垫的材料包括玻璃纤维膜和/或聚酯纤维膜,玻璃纤维膜包括ahlstrom 8980。层析膜的材料包括硝酸纤维素膜,硝酸纤维素膜包括sartorius 140。样本垫、结合物垫、层析膜和吸水垫依次相互搭接地贴在底板上。
进一步地,本申请提供一种检测腺病毒抗原的胶体金免疫层析试纸的制备方法,包括以下步骤:将腺病毒抗体与粒径为58nm-62nm的胶体金颗粒结合形成免疫标签,将免疫标签固定于结合垫,备用;在层析膜上设置检测线和质控线,将用以识别腺病毒抗原的第一抗体固定在检测线,将用以识别腺病毒抗体的第二抗体固定在质控线,备用;将样本垫、固定有免疫标签的结合垫、固定有第一抗体和第二抗体的层析膜以及吸水垫依次设置在底板上,形成检测腺病毒抗原的胶体金免疫层析试纸。
如图2所示,为检测腺病毒抗原的胶体金免疫层析试纸的制备方法流程示意图。将腺病毒抗体与粒径为58nm-62nm的胶体金颗粒结合形成免疫标签,将免疫标签固定于结合垫,备用;在层析膜上设置检测线和质控线,将用以识别腺病毒抗原的第一抗体固定在检测线,将用以识别腺病毒抗体的第二抗体固定在质控线,备用;将样本垫、固定有免疫标签的结合垫、固定有第一抗体和第二抗体的层析膜以及吸水垫依次设置在底板上,形成检测腺病毒抗原的胶体金免疫层析试纸。
采用粒径为58nm-62nm的胶体金,使得在制备胶体金标记的腺病毒抗体时,可增加抗体分子与胶体金的有效碰撞,使抗体与胶体金结合效率增加,提高纳米金的有效标记数量,将该高效率标记的纳米金包被至结合垫,提高结合垫上有效标记的纳米金的数量,从而有利于提高腺病毒的检测灵敏度;且粒径为58nm-62nm胶体金的体积比表面积小,使用的抗体量较少,降低了抗体的使用量,也即本申请不仅提升了胶体金的标记效率,还节省了抗体的成本。
进一步地,在将腺病毒抗体与粒径为58nm-62nm的胶体金颗粒结合形成免疫标签,将免疫标签固定于结合垫,备用的步骤中,包括以下步骤:准备质量体积浓度为万分之四、粒径为58nm-62nm的胶体金颗粒构成的胶体金溶液,并调节胶体金溶液的pH,然后加入浓度为10ug/mL-30ug/mL腺病毒抗体,反应预设时间,再加入封闭剂,封闭预设时间,得到反应后的溶液并浓缩,得到免疫标签,采用复溶液将免疫标签重悬,得到免疫标签复溶液,将免疫标签复溶液涂覆于结合垫,烘干,备用。
质量体积浓度,指的是溶质的质量除以溶剂的体积,得到的质量体积浓度。例如,纳米金的质量除以溶剂的体积得到纳米金溶液的浓度。
采用万分之四的胶体金溶液,且纳米金的粒径为58nm-62nm,相比常规万分之一的胶体金溶液,本申请采用高浓度的胶体金溶液,可增加抗体分子与胶体金的有效碰撞,使抗体与胶体金结合效率增加,且58nm-62nm的胶体金相比40nm的胶体金,58nm-62nm胶体金的体积比表面积小,使用的抗体量较少,因此,通过高浓度的大颗粒胶体金来制备免疫标签,降低了抗体的使用量,提升了胶体金的标记效率,节省抗体的成本。
在制备免疫标签的过程中,调节胶体金溶液的pH,然后加入浓度为10ug/mL-30ug/mL腺病毒抗体,优选腺病毒抗体浓度为20ug/mL-25ug/mL,使抗体在胶体金溶液中带正电荷,吸附在带负电荷的胶体金表面,反应预设时间,再加入封闭剂,封闭预设时间,将未被抗体包被的裸露的金表面位点覆盖,得到反应后的溶液,并将反应后的溶液进行浓缩,例如,采用离心的方式,去除掉上清液,得到免疫标签,采用复溶液将免疫标签重悬,得到免疫标签复溶液,将免疫标签复溶液涂覆于结合垫,烘干,备用。
上述10ug/mL-30ug/mL腺病毒抗体中,取值包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及10ug/mL、15ug/mL、20ug/mL、25ug/mL、21ug/mL、22ug/mL、23ug/mL、24ug/mL、30ug/mL等。
进一步地,在将腺病毒抗体与粒径为58nm-62nm的胶体金颗粒结合形成免疫标签,将免疫标签固定于结合垫,备用的步骤中,包括以下步骤:准备质量体积浓度为万分之四、粒径为58nm-62nm的胶体金颗粒构成的胶体金溶液,并调节胶体金溶液的pH,然后加入浓度为10ug/mL-30ug/mL腺病毒抗体,反应预设时间,再加入封闭剂,封闭预设时间,得到反应后的溶液并浓缩,得到浓缩10倍的免疫标签,采用复溶液将免疫标签重悬,得到稀释5倍-10倍的免疫标签复溶液,将免疫标签复溶液涂覆于结合垫,烘干,备用。
在制备免疫标签的过程中,将得到的反应后的溶液进行浓缩,得到浓缩10倍的免疫标签,采用复溶液将免疫标签重悬,得到稀释5倍-10倍的免疫标签复溶液,将免疫标签复溶液涂覆于结合垫,烘干,备用。
上述5倍-10倍中,取值包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及5倍、6倍、7倍、8倍、9倍、10倍等。
进一步地,在将腺病毒抗体与粒径为58nm-62nm的胶体金颗粒结合形成免疫标签,将免疫标签固定于结合垫,备用的步骤中,包括以下步骤:准备质量体积浓度为万分之四、、粒径为58nm-62nm的胶体金颗粒构成的胶体金溶液,并调节胶体金溶液的pH7.0-9.0,然后加入浓度为10ug/mL-30ug/mL的腺病毒抗体,在室温下振荡反应4h-5h,再加入质量体积浓度为0.1%-0.3% BSA溶液将未被抗体包被的裸露的金表面位点覆盖,封闭30min-60min,在离心转速为6000r/min-8000r/min条件下离心10min-15min,去除上清液,得到浓缩10倍的免疫标签,采用复溶液将免疫标签重悬,得到稀释5-10倍的免疫标签复溶液,将免疫标签复溶液涂覆于结合垫,于45±2℃烘干16h-18h,备用。
胶体金溶液在pH值为7.0-9.0时,胶体金带负电荷,有利于抗体与胶体金的结合。在室温下振荡反应4h-5h,使反应完全,再加入质量体积浓度为0.1%-0.3% BSA溶液将未被抗体包被的裸露的金表面位点覆盖,封闭30min-60min,在离心转速为6000r/min-8000r/min条件下离心10min-15min,去除上清液,得到浓缩10倍的免疫标签,采用复溶液将免疫标签重悬,得到稀释5-10倍的免疫标签复溶液,将免疫标签复溶液涂覆于结合垫,于45±2℃烘干16h-18h,备用。
上述pH值为7.0-9.0中,取值包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及7.0、7.5、8.0、8.5、9.0等。
上述在室温下振荡反应4h-5h中,取值包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及4h、4.5h、5h等。
上述0.1%-0.3% BSA溶液中,取值包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及0.1%、0.2%、0.3%等。
进一步地,胶体金溶液的pH为8.5;和/或,腺病毒抗体的浓度为20μg/ml;和/或,复溶液包括50mM的NaCl,质量体积浓度为0.1%的BSA,质量体积浓度为1.5%的蔗糖和质量体积浓度为1.5%的酪蛋白钠;和/或,腺病毒抗体包括深圳重链生物科技有限公司的7B5M克隆号抗体;和/或,第一抗体包括珠海博美生物技术有限公司的2B10克隆号抗体;和/或,第二抗体包括羊抗鼠IgG;和/或,检测线处第一抗体的划线浓度为1ul/cm;和/或,结合垫上免疫标签的涂覆浓度为10ul/cm;和/或,第一抗体的浓度为0.5mg/mL-2mg/mL;和/或,底板的材料包括聚氯乙烯、聚乙烯和玻璃中的至少一种;和/或,样本垫的材料包括玻璃纤维膜,玻璃纤维膜包括ahlstrom 8964;和/或,结合垫的材料包括玻璃纤维膜,玻璃纤维膜包括ahlstrom 8980;和/或,层析膜的材料包括硝酸纤维素膜,硝酸纤维素膜包括sartorius140。
由于不同抗体的等电点各有差异,因此需要探索抗体在不同的pH值与胶体金标记的效率,探索了pH为7.0、7.1、7.3、7.5、8.0、8.1、8.5,当pH值为8.5时,抗体在胶体金溶液带正电荷,吸附在带负电荷的胶体金表面,此时的标记效率最高,因此,优选的pH值为8.5。
腺病毒抗体的浓度为20μg/ml,避免腺病毒抗体浓度过低造成标记不完全,避免浓度过高,浪费抗体。
复溶液包括50mM的NaCl,质量体积浓度为0.1%的BSA,质量体积浓度为1.5%的蔗糖和质量体积浓度为1.5%的酪蛋白钠。
腺病毒抗体包括深圳重链生物科技有限公司的7B5M克隆号抗体;第一抗体包括珠海博美生物技术有限公司的2B10克隆号抗体;第二抗体包括羊抗鼠IgG;结合垫上免疫标签的涂覆浓度为10ul/cm,采用上述的胶体金免疫层析试纸,其得到的免疫标签具有高的标记效率,并且在结合垫上涂覆的胶体金标记的腺病毒抗体浓度为10ul/cm,通过高浓度的胶体金标记的腺病毒抗体的涂覆,有助于低浓度的腺病毒有效检出;底板的材料包括聚氯乙烯、聚乙烯和玻璃中的至少一种;样本垫的材料包括玻璃纤维膜,玻璃纤维膜包括ahlstrom8964;结合垫的材料包括玻璃纤维膜,玻璃纤维膜包括ahlstrom 8980;层析膜的材料包括硝酸纤维素膜,硝酸纤维素膜包括sartorius 140。
在检测线处固定第一抗体的步骤为:准备浓度为0.5mg/mL-2mg/mL、用以识别腺病毒抗原的第一抗体溶液,用三维划膜仪将第一抗体溶液划线于层析膜上,在层析膜上形成检测线,烘干后,备用,此时检测线处第一抗体的划线浓度为1ul/cm。浓度为0.5mg/mL-2mg/mL的第一抗体溶液,避免浓度过低,第一抗体的固定量不够,检测线处的显色不明显,同时,也避免浓度过高,造成抗体浪费。上述0.5mg/mL-2mg/mL中,取值包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及0.5mg/mL、0.8mg/mL、1mg/mL、1.5mg/mL、1.8mg/mL、2mg/mL等。
进一步地,在将腺病毒抗体与粒径为58nm-62nm的胶体金颗粒结合形成免疫标签,将免疫标签固定于结合垫,备用的步骤之前,还包括以下步骤:配置结合垫预处理液,将结合垫置于结合垫预处理液中浸泡,浸泡预设时间后,将结合垫取出干燥,备用,其中,结合垫预处理液的成分包括10mM-20mM Tris-HCI,100mM-150mM NaCI,质量体积浓度为1%-1.5%BSA,质量体积浓度为3%-5%蔗糖,体积浓度为0.5%-1%Tween-20,质量体积浓度为0.1%-0.2%PEG 20000,体积浓度为0.1%-0.2%proclin 300。
Tris-HCI缓冲体系稳定溶液的pH,盐离子物质为氯化钠,盐离子可以除去样本中的粘性物质,使粘性物质沉降,不影响样本在试剂条上的流动和渗透;Tween-20是表面活性剂,作用是更快地润湿结合垫,便于免疫标签附着和复溶,有助于待测物质与免疫标签更好地结合;蔗糖的作用是对胶体金上标记的抗体蛋白起到保护作用,使抗体更稳定;BSA的作用是对胶体金上标记的抗体蛋白起到保护作用,使蛋白更稳定,另外对于非特异性反应有抑制作用,有助于防止非特异性结合,释放完全;PEG 20000大分子物质作为胶体金干燥后均匀散布的骨架,有利于金标记物的快速溶解和释放;proclin 300作为防腐剂,可以使结合垫处理液稳定,延长其保存期。上述成分配合协同作用,使得该结合垫处理液的缓冲体系有利于免疫标签在结合垫上的结合与释放。
其中,10mM-20mM Tris-HCI的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及10mM、12mM、14mM、16mM、18mM、20mM。100mM-150mM NaCI的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及100mM、120mM、140mM、150mM。质量体积浓度为1%-1.5% BSA的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及1%、1.2%、1.4%、1.5%。质量体积浓度为3%-5%蔗糖的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及3%、3.5%、4%、5%。体积浓度为0.5%-1%Tween-20的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及0.5%、0.7%、0.9%、1%。质量体积浓度为0.1%-0.2%PEG 20000的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及0.1%、0.15%、0.2%。体积浓度为0.1%-0.2%proclin 300的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及0.1%、0.15%、0.2%。
其中,浸泡时间为20min-30min,干燥温度为45℃-50℃,干燥时间为16h-18h。
结合垫处理的步骤为,配制结合物垫预处理液,组成为10-20mM Tris-HCI,100-150mM NaCI,1-1.5% BSA,3-5%蔗糖,0.5-1%Tween-20,0.1-0.2%PEG20000,0.1-0.2%proclin 300,将配制的液体倾倒在亚克力材质或不锈钢材质的容器中,容器的大小约为30cm×30cm×10cm。采用的结合物垫材质为玻璃纤维素膜,型号为ahlstrom 8980,将其放入液体中,须使液体浸没过玻璃纤维素膜,浸泡时间约20min-30min。浸泡结束后,将玻璃纤维素膜捞出,平铺在筛网上,放入设置温度为45℃-50℃的鼓风干燥箱中,干燥时间约为16h-18h,干燥结束后,作为预处理结合物垫,室温密封保存备用。
进一步地,在将样本垫、固定有免疫标签的结合垫、固定有第一抗体和第二抗体的层析膜以及吸水垫依次设置在底板上,形成检测腺病毒抗原的胶体金免疫层析试纸的步骤之前,还包括以下步骤:配置样本垫预处理液,将样本垫置于样本垫预处理液中浸泡,浸泡预设时间后,将样本垫取出干燥,备用,其中,样本垫预处理液的成分包括10mM-20mM PBS,体积浓度为1%-1.5%Tween-20,质量体积浓度为0.2%-0.5% S9,质量体积浓度为4%-6%蔗糖,质量体积浓度为0.5%-0.8% PEG6000,质量体积浓度为1.5%-2%BSA,体积浓度为0.1%-0.2%proclin 300。
PBS作为缓冲体系,稳定体系的pH,通过封闭剂BSA、亲水性大分子物质PEG6000、表面活性剂Tween-20和S9,有效防止样本物质非特异地吸附到免疫层析试纸条上;使用上述处理液处理样品垫,能够增加样品垫的亲水性,有助于样品垫的快速润湿,促进层析作用发生;同时,由于悬浮分散作用和稳定的pH环境,样品垫还能够在对样本中抗体起到保护作用,以及降低非特异性结合。以有助于低浓度的腺病毒有效检出和避免假阳性问题。
其中,10mM-20mM PBS的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及10mM、12mM、14mM、16mM、18mM、20mM。1%-1.5%Tween-20的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及1%、1.3%、1.5%。0.2%-0.5% S9的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及0.2%、0.3%、0.4%、0.5%。4%-6%蔗糖的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及4%、5%、6%。0.5%-0.8% PEG6000的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及0.5%、0.6%、0.7%、0.8%。1.5%-2%BSA蔗糖的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及1.5%、1.8%、2%。0.1%-0.2%proclin 300的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及0.1%、0.15%、0.2%。
其中,浸泡时间为20min-30min,干燥温度为45℃-50℃,干燥时间为16h-18h。
样本垫的处理步骤为:配制样本垫处理液,组成为10mM-20mM PBS,1%-1.5%Tween-20,0.2%-0.5% S9,4%-6%蔗糖,0.5%-0.8% PEG6000,1.5%-2%BSA,0.1%-0.2%proclin 300,将配制的液体倾倒在亚克力材质或不锈钢材质的容器中。采用的样本垫材质为玻璃纤维素膜,型号为ahlstrom 8964,将其放入液体中,须使液体浸没过玻璃纤维素膜,浸泡时间约20min-30min。浸泡结束后,将玻璃纤维素膜捞出,平铺在筛网上,放入设置温度为45℃-50℃的鼓风干燥箱中,干燥时间约为16h-18h,干燥结束后,作为预处理样本垫,室温密封保存备用。
上述方法中,结合垫和样本垫均通过相应的预处理液进行处理,有助于降低检测过程中的非特异性结合,降低假阳性,基于上述多方面性能的改善,使得采用胶体金免疫层析试纸的制备方法制备得到的试纸灵敏度高,假阳性低。
本申请还提供一种检测腺病毒抗原的胶体金免疫层析试纸盒,包括检测试纸条待测样本稀释液和上述的检测腺病毒抗原的胶体金免疫层析试纸,或者通过如上述的检测腺病毒抗原的胶体金免疫层析试纸的制备方法制得的检测腺病毒抗原的胶体金免疫层析试纸。
进一步地,检测腺病毒抗原的胶体金免疫层析试纸盒包括卡盒和上述的检测腺病毒抗原的胶体金免疫层析试纸,卡盒包括卡壳盖和卡壳底,卡壳盖和卡壳底围设形成用以容纳容纳检测腺病毒抗原的胶体金免疫层析试纸的空间,卡壳上开设有加样区和显色区;和/或,待测样本稀释液包括:10mM-20mM PBS、0.05%-0.1%Triton X100、0.05%-0.1%Tween 20以及0.1%-0.2%鱼明胶。
如图3所示,为本申请胶体金免疫层析试剂检测卡,卡盒包括卡壳盖和卡壳底,卡壳盖和卡壳底围设形成用以容纳容纳检测腺病毒抗原的胶体金免疫层析试纸的空间,卡壳上开设有加样区和显色区,测试样本时,将稀释后的样本滴加在加样区,经过反应时间后在显色区观察颜色,判断检测结果。
PBS缓冲液作为缓冲基质,使样品的基本理化特性保持稳定。Triton X-100溶液、Tween-20混合液作为表面活性剂加入稀释液中,可以有效去除污物,使病毒抗原暴露,而且,本发明选择的表面活性剂均为温和型的,有利于蛋白保持稳定。鱼明胶是一种常见的生物高聚物,以鱼皮和鱼骨为原料提取,然后加工成的高分子多肽聚合物。组成鱼明胶的氨基酸一般有20多种,以甘氨酸、脯氨酸、羟脯氨酸和丙氨酸为主。鱼明胶一方面抗原性差,另一方面与哺乳动物的物种亲缘性远,这决定了鱼明胶取代ELISA试剂盒中BSA的优越性,稀释液中包括鱼明胶可以避免假阳,屏蔽样本中的干扰物。鱼明胶具有良好的乳化性,以及通过增加溶液的相黏度来降低气液相的表面张力而表现出来的发泡性和成膜性,能够保护蛋白的结构不被破坏,增强蛋白的稳定性。
10mM-20mM PBS的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及10mM、12mM、14mM、16mM、18mM、20mM。0.05%-0.1%Triton X100的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及0.05%、0.07%、0.09%、0.1%。0.05%-0.1% Tween 20的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及0.05%、0.07%、0.09%、0.1%。0.1%-0.2%鱼明胶的取值浓度范围包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值,具体示例包括但不限于实施例中的点值以及0.1%、0.15%、0.2%。
本申请还提供一种检测方法,采用上述的检测腺病毒抗原的胶体金免疫层析试纸对待测样品进行检测,包括以下步骤:将待测样品加到检测腺病毒抗原的胶体金免疫层析试纸的样本垫上,免疫层析反应10min-15min;观察检测腺病毒抗原的胶体金免疫层析试纸上检测线和质控线上的颜色,得到检测结果。
采用上述的检测方法,胶体金试纸条依照抗原和抗体的特异性反应测定腺病毒的抗原,通过一次性操作即可检测腺病毒抗原,读取结果快捷而直观,15分钟以内即可获得检测结果。并且本发明的检测腺病毒抗原方法,无需特殊仪器设备,也不需要专业人员的操作,摆脱了对专业仪器的依赖。与传统的双抗体夹心法相比,本发明的检测方法通过金浓度(万分之一提高到万分之四)和粒径(由40nm提高到60m)改善了标记金胶体金标记效率,提高检测灵敏度。本发明的检测结果的总体符合率较高,特异性为97%,灵敏度为96%,适合于现场检测。
实施例
1)胶体金的制备与表征
首先取200mL超纯水于500mL圆底球形蒸馏瓶中,加入2.0mL 1%HAuCl
取出2mL备用的胶体金溶液,使用紫外-可见光分光光度计测试,在波长400nm~700nm范围内进行扫描,扫描间距为1nm,最高吸收峰在541nm±2nm处为合格。
按照上述胶体金制备的方法操作,结果显示,胶体金溶液呈酒红色,用由紫外-可见光谱图测试胶体金样本:如图4所示,显示制备的胶体金尖峰位于539nm处,且峰型狭窄,说明制备的金颗粒粒径均一,金颗粒粒径为60nm,分散性良好。
2)结合物垫预处理
配制结合物垫预处理液,组成为15mM Tris-HCI,125mM NaCI,1.25%BSA,4%蔗糖,0.75%Tween-20,0.15%PEG 20000,0.15%proclin 300,将配制的液体倾倒在亚克力材质或不锈钢材质的容器中,容器的大小约为30cm×30cm×10cm。采用的结合物垫材质为玻璃纤维素膜,型号为ahlstrom 8980,将其放入液体中,须使液体浸没过玻璃纤维素膜,浸泡时间约25min。浸泡结束后,将玻璃纤维素膜捞出,平铺在筛网上,放入设置温度为45℃-50℃的鼓风干燥箱中,干燥时间约为17h,干燥结束后,作为预处理结合物垫,室温密封保存备用。
3)样本垫处理
配制样本垫处理液,组成为15mM PBS,1.25%Tween-20,0.25% S9,5%蔗糖,0.75% PEG6000,1.75%BSA,0.15%proclin 300,将配制的液体倾倒在亚克力材质或不锈钢材质的容器中。采用的样本垫材质为玻璃纤维素膜,型号为ahlstrom 8964,将其放入液体中,须使液体浸没过玻璃纤维素膜,浸泡时间约25min。浸泡结束后,将玻璃纤维素膜捞出,平铺在筛网上,放入设置温度为45℃-50℃的鼓风干燥箱中,干燥时间约为17h,干燥结束后,作为预处理样本垫,室温密封保存备用。
4)金标-抗体结合物垫的制备
准备质量体积浓度为万分之四、粒径为60nm的胶体金颗粒构成的胶体金溶液,并调节所述胶体金溶液的pH8.5,然后加入浓度为20ug/mL的腺病毒抗体(深圳重链生物科技有限公司的7B5M克隆号抗体),在室温下振荡反应4.5h,再加入质量体积浓度为0.15% BSA溶液将未被抗体包被的裸露的金表面位点覆盖,封闭50min,在离心转速为7000r/min条件下离心15min,去除上清液,得到浓缩10倍的免疫标签,采用复溶液将所述免疫标签重悬,得到稀释70倍的免疫标签复溶液,将所述免疫标签复溶液涂覆于结合垫,于4542℃烘干17h,备用。
5)检测腺病毒抗原的胶体金免疫层析试纸条的组装
将宁波迈跃生物科技有限公司批号为EC00102DE羊抗鼠IgG(第二抗体)和腺病毒2B10抗体(第一抗体)(珠海博美生物技术有限公司的2B10克隆号抗体)分别作为质控线和检测线包被在硝酸纤维素膜(层析膜)上,然后将样本垫、金标-抗体结合物垫、硝酸纤维素膜和吸水纸依次贴在底板上,依照下图1进行组装即可。
将制备的试纸用于检测待测物,样本稀释液为15mM PBS,0.05%Triton X100,0.05% Tween 20,0.15%鱼明胶,将样本稀释液分装到抽提管中,用采样拭子将收集的样本,加入到抽提管中,抽提管的滴头倾斜至加样孔,在其中加入5-6滴稀释液,待15分钟后,观察检测的结果。当检测线和质控线均显示红色条带时,则说明所述待测样品中含有腺病毒抗原。如果被检测样品中不含有腺病毒抗原,样品移动到检测线处时,不会显示红色条带,只在质控线处显示红色条带;只要质控线不显色,即证明该试纸条无效,需要重新检测样品。
6)腺病毒抗体对的筛选
筛选步骤:其他条件不变的情况下,采用不同的腺病毒抗体对(腺病毒抗体和第一抗体),制备得到不同的金标-抗体结合物垫,以及层析膜,并组装形成不同的试纸,在相同的条件下应用不同的试纸对待测物测试,测试各试纸的灵敏度,结果如下表所示,珠海博美生物技术有限公司的2B10克隆号抗体(第一抗体)及深圳重链生物科技有限公司的深圳重链生物科技有限公司的7B5M克隆号抗体(腺病毒抗体)所制备得到的试纸灵敏度更高,因此,选择该腺病毒抗体。
表1不同抗体对筛选列表
7)检测腺病毒抗原的胶体金免疫层析试纸稳定性测试
连续生产了三批腺病毒抗原检测试纸,采用浓度为1×10
8)检测腺病毒抗原的胶体金免疫层析试纸特异性测试
用制备好的试纸条分别检测其他病原体(包括轮状病毒、流感病毒A、流感病毒B、新型冠状病毒、大肠杆菌、白色念珠菌、阴道加德纳菌、嗜肺军团菌、结核分枝杆菌、A族链球菌、B族链球菌、诺如病毒),和至少5例不同人份的腺病毒阳性参考品,通过观察结果分析试纸条的特异性。从实验结果表明,试纸条对其他病原体的检测结果为阴性,说明本申请的试纸条与其它病原体没有交叉反应。
表2 不同病原体检测列表
9)检出限对比实验
采用本申请制备的腺病毒抗原检测试纸条,与广州万孚生物技术股份有限公司试剂盒进行对比,其中检测抗原为腺病毒培养物,采用浓度为1×10
10)不同胶体金粒径的对比实验
在其他实验条件相同的情况下,改变胶体金的粒径,分别为40nm、58nm、60nm、62nm、70nm,来制备检测腺病毒抗原的胶体金免疫层析试纸,并将制备得到的不同试纸用于不同浓度的腺病毒阳性待测物的检测,每组测试平行测试3次,结果如下表所示,
11)在其他实验条件相同的情况下,改变胶体金的浓度,分别为质量体积浓度为万分之一、万分之四、万分之五,来制备检测腺病毒抗原的胶体金免疫层析试纸,并将制备得到的不同试纸用于不同浓度的腺病毒阳性待测物的检测,每组测试平行测试3次,结果如下表所示,
12)在其他实验条件不变的情况下,改变样本垫预处理液、结合垫预处理液与待测样本稀释液的配方,制备不同的检测腺病毒抗原的胶体金免疫层析试纸,并将制备得到的不同试纸用于200份相同浓度的阴性待测物的检测。
上仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明的专利保护范围内。
- 检测盐酸克伦特罗的荧光微球-胶体金双显色定性定量免疫层析试纸条及其制备方法
- 一种检测非洲猪瘟病毒抗原胶体金免疫层析试纸及制备方法和应用
- 一种检测非洲猪瘟病毒抗原胶体金免疫层析试纸及制备方法和应用
