细菌T6SS核心组分Hcp作为药物递送载体的构建方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于生物技术领域,涉及一种细菌VI型分泌系统(T6SS)核心组分Hcp作为药物递送载体的构建方法;尤其涉及一种T6SS核心组分Hcp分泌多肽和蛋白质类药物的体系的构建方法。
背景技术
近年来,制药行业趋向于复杂的大分子疗法,大分子药物包括基于蛋白质的疗法,如抗体、激素、生长因子和细胞因子,以及基于核酸的疗法,如短干涉RNA、DNA/RNA疫苗和基因疗法。大分子药物的分子大小和复杂性使其具有高度的特异性,因此与小分子药物相比,大分子药物具有更强的效力和更少的副作用。尽管如此,大分子药物仍然面临着小分子药物所没有的几个重大挑战,其中需要解决的关键问题之一就是药物的高效递送策略。
大分子药物往往极易在胃和肠道中降解,导致这些药物的剂型受到了限制,通常只能作为注射剂来使用,方便程度远低于口服;此外分子量太大和亲水性极大地限制了其对生物膜的渗透,从而导致生物利用度低。
细菌作为单细胞、结构简单的原核生物,种类和代谢类型多种多样,其生长速度快,便于大规模培养,其基因表达的调控机制研究的较为透彻,易于进行遗传操作,获得各类突变株。利用细菌作为药物的递送载体,则可以解决大分子药物在工业生产中的提纯和药物稳定性方面的困难,还可以按需对目的蛋白进行改造和修饰,从而改进药物的作用效果。其次,随着对细菌与自然宿主对抗机制了解的深入,研究者已发现多种细菌具有的独特的分泌系统,可以将目的蛋白直接递送到靶细胞的细胞质中,VI型分泌系统(T6SS)便是其中之一。T6SS是由13个组件组装成的一个大型复合体,主要位于细菌的细胞质内,其核心分泌装置包括Hcp六聚体组成的分泌内管,由TssB和TssC蛋白(也称为VipA和VipB)组成的收缩鞘以及VgrG和PAAR在Hcp管的顶端形成一个“尖刺”。鞘收缩时,Hcp管和尖端蛋白会刺穿细胞膜,被注射到靶细胞中。目前,已有研究将内酰胺酶与T6SS融合并成功用于真核细胞的传递试验。此外,还有研究利用霍乱弧菌(Vibrio cholerae)的T6SS成功地将Cre重组酶传递给受体细菌对其进行基因编辑,而不需要将外源DNA引入受体细菌,该系统还能够将外源抗菌毒素TseC注射到相邻的绿脓假单胞菌(Pseudomonas aeruginosa)中将其杀死。但目前并没有利用T6SS递送已上市或在研的多肽和蛋白质类药物的相关报道。
发明内容
基于以上技术问题,本发明的目的在于一种细菌T6SS核心组分Hcp作为药物递送载体的构建方法。
本发明的目的可以通过以下技术方案实现:
第一方面,本发明提供一种VI型分泌系统T6SS核心组分Hcp作为多肽和蛋白质类药物载体的构建方法,所述构建方法包括:在霍乱弧菌V52菌株中,将目的药物序列整合到细菌基因组中与Hcp蛋白序列相连,获得分泌多肽和蛋白质类药物的体系。
作为本发明的一个实施方案,所述霍乱弧菌V52菌株是以霍乱弧菌V52为原始菌株,失活突变了数个T6SS毒性蛋白的突变菌株,或为敲除了Hcp2编码序列的突变型霍乱弧菌V52菌株。所述数个T6SS毒性蛋白包括TseL,VasX,TseH和VgrG1。在一个具体实施示例中,所述霍乱弧菌V52菌株是以霍乱弧菌V52“RHH”(ΔhlyA(VCA0219),ΔhapA(VCA0865),ΔrtxA(VC1451))为原始菌株,将效应蛋白TseL(VC1418)第425位的天冬氨酸突变为丙氨酸,并将效应蛋白TseH(VCA0285)第64位的组氨酸突变为丙氨酸,且敲除了效应蛋白VasX(VCA0020)第852-867位的16个氨基酸,敲除VgrG1(VC1416)的C端肌动蛋白交联结构域(C-terminal actin crosslinking domain,ACD)第716-1149位共434个氨基酸得到的菌株作为背景菌株。或在该突变菌株基础上进一步敲除了Hcp2编码序列的突变型霍乱弧菌V52菌株。
作为本发明的一个实施方案,先将含有同源臂序列的目的药物片段用Goldengate克隆的方法克隆到自杀型质粒pDS132中;再将验证正确的质粒转化到供体大肠杆菌WM6026中,通过接合转移把质粒转入V.cholerae V52,利用同源重组双交换的方法在V.cholerae V52基因组的hcp1基因后插入目的药物蛋白序列实现融合表达。
作为本发明的一个实施方案,所述构建方法包括如下步骤:
S1、以霍乱弧菌V52 RHH菌株为模板,分别扩增突变hcp1的上游同源左臂和下游同源右臂;左右臂扩增连接,连接后的同源臂片段克隆到自杀型质粒pDS132中;得到pDS132-VChcp1-BsaI突变质粒;
S2、将目的药物片段克隆到pDS132-VChcp1-BsaI突变质粒,得到pDS132-VChcp1-X质粒,其中X指代目的药物序列;
S3、将pDS132-VChcp1-X质粒转化大肠杆菌,形成接合转移的供体菌;供体菌与所述霍乱弧菌V52菌株共培养,得到Hcp-X融合蛋白突变株。
作为本发明的一个实施方案,所述目的药物为DNA长度小于100bp药物。包括Etelcalcetide、Bradykinin、Tigapotide和Dirucotide。
第二方面,本发明提供一种所述构建方法构建得到的Hcp携带药物的分泌体系。
作为本发明的一个实施方案,目的药物与Hcp的融合蛋白能够在菌体内表达和合成。
作为本发明的一个实施方案,目的药物通过搭载Hcp,被分泌到细菌胞外。
第三方面,本发明提供一种用于构建Hcp携带药物分泌体系的质粒,所述质粒是通过包括如下步骤的方法构建而得:
A1、以霍乱弧菌V52 RHH菌株为模板,分别扩增突变hcp1的上游同源左臂和下游同源右臂;
A2、左右臂扩增连接,连接后的同源臂片段用Gibson组装的方法克隆到自杀型质粒pDS132中;
A3、将含有目的药物序列的两条单链引物磷酸化后配对形成双链DNA,通过“Golden Gate”克隆法,将双链DNA克隆到步骤A2得到的载体质粒上;
A4、验证正确,即得所述质粒。
作为本发明的一个实施方案,步骤A1中,扩增突变hcp1的上游同源左臂的引物为VChcp1-KI-1和BsaI-VChcp1 KI-2;扩增突变hcp1的下游同源右臂的引物为VChcp1-BsaIKI-3和VChcp1-KI-4。
作为本发明的一个实施方案,步骤A2中,左右臂扩增连接使用的引物为VChcp1-KI-1和VChcp1-KI-4。
作为本发明的一个实施方案,步骤A3中,单链引物分别为BsaI-X-F和X-BsaI-R,其中X指代目的药物序列。
本发明提供一种药物组合物,是在药学上可接受的制剂中加入所述分泌体系。
作为本发明的一个实施方案,该组合物为(口服的)液体剂型。
与现有技术相比,本发明具有如下有益效果:
(1)T6SS能够以自然构象分泌底物蛋白,该能力尤其适用于不太容易展开和重折叠的蛋白质;
(2)T6SS能够利用其多个蛋白运载途径同时分泌多种蛋白;
(3)T6SS能够直接将效应蛋白注射到所接触的原核和真核细胞中,而不需要细胞表面上有相应的受体;
(4)基于上述分泌方式和特点,T6SS在合成生物学、抗耐药病原菌和全健康上具有极为广泛的潜在应用价值;
(5)需要时,可在药学上可接受的制剂中加入该药物转运体系,制备成可口服的液体剂型。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
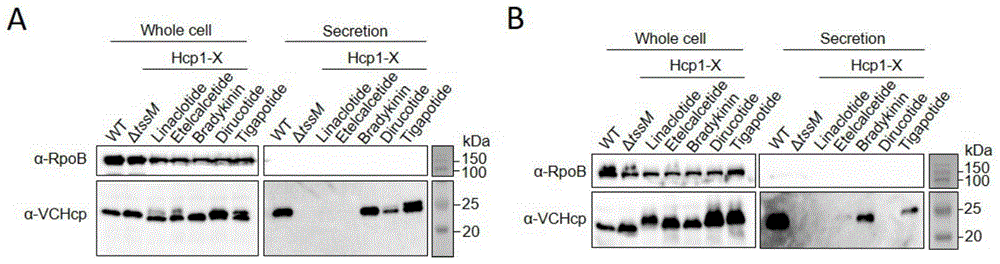
图1为pDS132-VChcp1-X突变质粒的构建示意图;A,pDS132-VChcp1-BsaI突变质粒示意图,其中含有野生型VChcp1,linker序列和BsaI酶切位点序列;B,引物BsaI-X-F和X-BsaI-R配对形成的双链DNA示意图,其中含有5’端AGGA和3’端ATTA的缺口,“NNNNNNNNNNNN”表示目的药物的基因序列;
图2所示为目的药物与Hcp的融合蛋白分泌情况的Western blot检测结果;A,融合蛋白在含有野生型Hcp的表达体系中的分泌情况,RNA聚合酶亚基RpoB用来指示相等的蛋白上样量和细菌裂解情况,WT:V.cholerae V52 rhh vipA-mCherry,tseL
具体实施方式
下面结合实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。
本发明实施例提供VI型分泌系统(T6SS)核心组分Hcp分泌多肽和蛋白质类药物的体系的构建方法。
首先选择V.cholerae V52作为载体细菌,并且由于体积相对较大的蛋白可能无法装入Hcp管的腔内,因此Hcp内管被选为DNA长度小于100bp的目的蛋白的搭载部位。
V.cholerae V52的基因组(NCBI数据库中编号为NZ_KQ410497)中含有两个编码Hcp蛋白的同源基因hcp1(VC1415)和hcp2(VCA0017)。因此,本发明构建了两套Hcp融合蛋白的表达体系。一种表达体系是将目的蛋白整合到含有两个hcp基因的V52菌株中,这样细菌内会同时表达野生型Hcp和融合型Hcp,另一种表达体系是将目的蛋白整合到敲除了Hcp2编码序列的突变型V52菌株的基因组中,这样细菌内只会表达融合型Hcp。本发明先将含有同源臂序列的目的药物片段用Golden gate克隆的方法克隆到自杀型质粒pDS132中。再将验证正确的质粒转化到供体大肠杆菌WM6026中,通过接合转移把质粒转入V.cholerae V52,利用同源重组双交换的方法在V.cholerae V52基因组的hcp1基因后插入目的药物蛋白序列实现融合表达。
表达目的药物与Hcp融合蛋白的菌株,在30℃水浴中诱导细菌分泌1h,通过离心分离菌体和上清。分别处理之后,通过Western blot检测,证明了T6SS能够携带多肽/蛋白质类药物并分泌到胞外。
本发明实施例涉及的具体培养基配方和培养条件:
本发明中所有菌株均培养于LB培养基(胰蛋白胨10g/L,酵母提取物5g/L,氯化钠5g/L)中,37℃条件下进行培养。不含NaCl的LB培养基(胰蛋白胨10g/L,酵母提取物5g/L)用于筛选质粒抗性丢失的菌株,使用前加入终浓度为6%的蔗糖,并置于22℃培养。抗生素使用浓度如下:100μg/mL链霉素(streptomycin),50μg/mL卡那霉素(kanamycin)。
本发明中能够被分泌的药物信息如表1所示:
表1本发明中能够被分泌的药物
本发明中用到的菌株如表2所示:
表2本发明所用菌株
*
1.Pukatzki,S.,et al.Identification of a conserved bacterial proteinsecretion system in Vibrio cholerae using the Dictyostelium host modelsystem.Proc Natl Acad Sci U S A.103,1528-33(2006).
2.Hersch,S.J.,et al.Envelope stress responses defend against type sixsecretion system attacks independently of immunity proteins.Nat Microbiol.5,706-14(2020).
3.Blodgett,J.A.,et al.Unusual transformations in the biosynthesis ofthe antibiotic phosphinothricin tripeptide.Nat Chem Biol.3,480-5(2007).
本发明中用到的引物如表3所示:
表3本发明所用引物
/>
本发明中用到的质粒如表4所示:
表4本发明所用质粒
*
4.Philippe,N.,et al.Improvement of pCVD442,a suicide plasmid for geneallele exchange in bacteria.Plasmid.51,246-55(2004).
本发明构建的融合蛋白序列如表5所示:
表5本发明的融合蛋白序列
/>
实施例1:Hcp-X融合蛋白表达菌株的构建(X表示药物名称)
背景菌株的获得:
背景菌株是在本实验室已发表的研究
1.Hcp2(VCA0017)敲除突变菌株的构建
以霍乱弧菌V52 RHH原始菌株的菌体为模板,使用表3中的VCA0017 KO-1和VCA0017 KO-2引物扩增基因组中hcp2序列的上游同源臂,使用VCA0017 KO-3和VCA0017KO-4引物扩增基因组中hcp2序列的下游同源臂,再同时以该上、下游同源臂为模板,使用引物VCA0017 KO-1和VCA0017 KO-4将上下游同源臂扩增连接到一起,将连接后的同源臂片段用Gibson组装的方法克隆到自杀型质粒pDS132中,通过PCR(引物为表3中的pDS132-F和pDS132-R)和Sanger测序验证质粒是否正确。将验证正确的质粒转化到大肠杆菌WM6026中,形成接合转移的供体菌。将过夜培养的供体菌株与受体背景V52菌株分别用100μl LB悬浮,1:1混合后点在含有100μg/mL DAP的固体LB培养基上,37℃共培养3h后,刮取菌体并重悬到500μl LB中,37℃,950r.p.m.恢复培养1h后涂布在含有100μg/mL链霉素和50μg/mL卡那霉素的LB固体平板上,37℃过夜培养,挑取接合转移子到500μl无抗LB中松弛培养4h,再涂布至含有6%蔗糖且无NaCl的LB平板上。22℃培养2d后,利用PCR(引物为表3中的VCA0017 KO-5和VCA0017 KO-6)和Sanger测序验证突变菌株是否正确。
2.pDS132-VChcp1-BsaI突变质粒的构建
以霍乱弧菌V52 RHH原始菌株的菌体为模板,使用表3中的VChcp1-KI-1和BsaI-VChcp1 KI-2引物扩增基因组中hcp1序列的上游同源左臂,使用VChcp1-BsaI KI-3和VChcp1-KI-4引物扩增基因组中hcp1序列的下游同源右臂,再同时以该上、下游同源臂为模板,使用引物VChcp1-KI-1和VChcp1-KI-4将左右臂扩增连接到一起,将连接后的同源臂片段用Gibson组装的方法克隆到自杀型质粒pDS132中,通过PCR(引物为表3中的pDS132-F和pDS132-R)和Sanger测序验证质粒是否正确,最终得到pDS132-VChcp1-BsaI质粒。此质粒在野生型hcp1(VC1415)基因序列的终止密码子TAA前面插入了序列gccgcaggaggaggaAGAGACCATTAGGTCTCT,其中gccgcaggaggagga编码氨基酸AAGGG,可作为linker,而AGAGACCATTAGGTCTCT中含有两个BsaI酶的识别位点,可被BsaI完全切除(如图1A)。
3.pDS132-VChcp1-X质粒的构建
先将表3中的引物BsaI-X-F和X-BsaI-R通过T4 PNK酶在37℃反应1h,使其单链DNA的两端充分磷酸化后,在体系中加入1M NaCl使其终浓度为200mM。先将样品在95℃变性3min,再以-1℃/10s的降温速度梯度退火,最终降至50℃,使两条单链引物配对形成双链DNA,且5’端含有AGGA和3’端含有ATTA的缺口(如图1B),此即为所要克隆的目的片段。通过“Golden Gate”克隆法,将目的片段克隆到载体pDS132-VChcp1-BsaI上,利用PCR(引物为表3中的pDS132-F和pDS132-R)和Sanger测序验证质粒是否正确。
3.Hcp-X融合蛋白相关突变株的构建
将验证正确的质粒转化到大肠杆菌WM6026中,形成接合转移的供体菌。将过夜培养的供体菌株与受体V52背景菌株或hcp2敲除突变菌株分别用100μl LB悬浮,1:1混合后点在含有100μg/mL DAP的固体LB培养基上,37℃共培养3h后,刮取菌体并重悬到500μl LB中,37℃,950r.p.m.恢复培养1h后涂布在含有100μg/mL链霉素和50μg/mL卡那霉素的LB固体平板上,37℃过夜培养,挑取接合转移子到500μl无抗LB中松弛培养4h,再涂布至含有6%蔗糖且无NaCl的LB平板上。22℃培养2d后,利用PCR(引物为表3中的VChcp1-confirm-F、-R)和Sanger测序验证突变菌株是否正确。
实施例2:Hcp-X融合蛋白分泌情况的检测(X表示药物名称)
1.诱导融合蛋白分泌实验
将表达融合蛋白的霍乱弧菌在含有100μg/mL链霉素的LB固体平板37℃过夜培养,第二天刮取适量的菌转接到500L含有100μg/mL链霉素的LB培养基中,37℃,950r.p.m.活化1h。将300L菌液转接到30mL含有100μg/mL链霉素的LB培养基中,30℃,200r.p.m.培养至OD
2.Western blot检测蛋白分泌
各样品中加入蛋白上样缓冲液,98℃处理10min。蛋白样品经SDS-PAGE电泳分离后转膜到PVDF膜上。使用5%[w/v]脱脂牛奶对膜进行封闭处理1h后,加入含1%[w/v]脱脂牛奶的一抗室温孵育1h。孵育结束后,TBST(50mM Tris,150mM NaCl,0.1%[v/v]Tween-20,pH7.6)清洗三次,在室温下二抗孵育1h。TBST清洗三次,最后使用ECL发光液进行显影。
结果见图2,由图可知,在野生型Hcp存在的条件下,Hcp-Dirucotide和Hcp-Tigapotide能够被分泌(图2A);在没有野生型Hcp存在的条件下,Hcp-Etelcalcetide、Hcp-Bradykinin和Hcp-Tigapotide能够被分泌(图2B)。
综上所述,本发明通过实验证明,多肽或蛋白质类药物与Hcp的融合蛋白可以在细菌内表达和合成,并通过搭载上述T6SS核心组分被分泌到胞外。该药物分泌体系在向真核细胞和生物体内输送大分子药物方面具有重要的应用潜力。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
- 一种新型细胞靶向药物递送载体、包含该载体的药物组合物以及利用该载体递送药物的方法
- 一种新型细胞靶向药物递送载体、包含该载体的药物组合物以及利用该载体递送药物的方法
