基于MALDI-TOF质谱检测七种猪呼吸道病毒的PCR引物、探针、试剂盒和方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生化检测技术领域,尤其涉及基于MALDI-TOF质谱检测七种猪呼吸道病毒的PCR引物、探针、试剂盒和方法。
背景技术
猪病毒性呼吸道疾病和繁殖障碍疾病是制约现代养猪业规模化和集约化发展的重要因素,不同猪呼吸道及繁殖障碍疾病在猪群间常出现混合感染和继发感染,并呈地方流行性发生,而其中80%以上的猪病为两种或两种以上病原体造成,例如猪伪狂犬病毒(Pseudorabies Virus,PRV)、猪圆环病毒2型(Porcine Circovirus 2,PCV-2)、猪圆环病毒3型(Porcine Circovirus 3,PCV-3)、猪博卡病毒(Porcine Bocavirus,PBoV)和非洲猪瘟病毒(African Swine Fever Virus,ASFV)等。PCV、PBoV可引起猪只呼吸系统疾病,PCV、PRV可导致猪只繁殖障碍性疾病的发生;而ASFV可导致猪只感染高度接触性传染病非洲猪瘟(African Swine Fever),其强毒株致死率100%,且病原学和流行病学十分复杂。由于这些病原体导致的猪病发病机制与临床症状较为相像,给疫病防控带来较大阻碍,也使得多种病原体的高通量快速检测成为疫病防控的重点环节。
我国养猪市场巨大,据统计,我国生猪养殖量占世界生猪总养殖量的40%以上,生猪饲养产值接近1.3万亿。随着生猪养殖业规模化和集约化程度的提高,猪病混合感染的几率也随之增加。此外,近年来由于猪博卡病毒、猪德尔塔冠状病毒等新发疫病在国内外流行范围的扩大以及非洲猪瘟等重大疫情的传播,加之部分病原体不同基因型病原体所引起的混合感染等,使得疫病防控难度进一步增大。此时若使用多种单目标检测方法对样本逐一进行检测,检测周期与成本都将大大增加,开发多目标高通量检测方法,提升检测诊断效率,将为疾病防控提供更强有力的保障。
目前动物疫病多重分子诊断技术主要以多重PCR方法、多重TaqMan或SYBR Green荧光定量RT-PCR方法及GeXP多重PCR技术为主,如本申请的申请人申请的中国发明专利(公开号:CN105936944A,公开日:20160914)公开了一种针对猪瘟病毒、猪繁殖与呼吸综合征病毒和猪流感病毒H1亚型的三重荧光RT-PCR检测试剂盒及引物、探针,该方法实现在猪中对上述3种病原的快速早期鉴别诊断,由于引物和探针具有很高的特异性和灵敏度,提高了早期鉴别检测效率,并简化了检测方法。申请人申请的中国发明专利(公开号:CN113322352A,公开日:20210831)公开了一种三重数字微滴PCR检测猪圆环病毒的方法、引物、探针和试剂盒,该方法基于ddPCR的优势,建立猪圆环病毒不同基因型的高灵敏、精确鉴别检测方法,可应用于常规动物检疫以及饲料、肉制品、疫苗等病毒含量低、基质复杂的动物源产制品的检疫监测和载量滴定。多重PCR方法的敏感性及特异性相较荧光方法较低,且退火温度容易受到扩增片段长度的影响;荧光定量的检测方法虽然具有高度的特异性和敏感性,检测时间短,但存在荧光通道的限制及多重引物间的交叉反应性,极大地限制了多重荧光定量PCR方法同时检测四重及以上的靶标的能力;GeXP多重RT-PCR技术则由于毛细管电泳灵敏度过高,可能造成检测结果假阳性。
基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)是一种新型生物大分子检测技术,它将生物大分子与基质分子结合生成共结晶,在激光轰击后根据质荷比对分析样本进行区分和检测。即通过与多重PCR联用,针对扩增后的多靶标核酸片段,分别设计对应的延伸探针(UEP)进行单碱基延伸,延伸后的产物经MALDI-TOF MS分析检测,得到不同特异性核酸片段的质量信号,从而对同一样本进行多靶标同步鉴别检测。MALDI-TOF MS技术最多一次可同时对2×386个样本进行多目标检测,每个反应最多可检测40个靶目标,大大提高了检测鉴定的效率。
MALDI-TOF MS在病原微生物的临床检测中已有较多应用,并在病原体高通量检测及分型诊断中展现出良好的前景。Liu等人建立了可以同时检测和区分7种人类冠状病毒(HCoV)的核酸质谱检测方法,检测限为1-5个拷贝/反应,为HCoV的大规模筛查提供了技术平台;刘宏钱等人建立了人呼吸道症候群相关病毒MALDI-TOF MS多目标检测技术,可同时对27种呼吸道病原体进行检测,灵敏度达10~1000拷贝/μL。在动物疫病诊断方面,Liu等人建立了10种鸭源性致病病毒的MALDI-TOF MS同步检测方法,体系的最低检测限均可达10拷贝/μL。但是,采用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)在猪多种病原体的高通量快速检测,目前还没有公开报道。
发明内容
为了解决上述的技术问题,本发明针对PRV、PCV-2、PCV-3、PBoV-G1、PBoV-G2、PBoV-G3和ASFV等常见的猪呼吸道DNA病毒设计多重引物及UEP探针,建立了能同步鉴定7种常见猪呼吸道病毒的MALDI-TOF MS高通量多目标技术体系,为猪群相关疫病监测和鉴别诊断以及进出口动物检疫提供了一种新的高效手段。
为了实现上述的目的,本发明采用了以下的技术方案:
一种基于MALDI-TOF质谱检测七种猪呼吸道病毒的PCR引物和探针,所述七种猪呼吸道病毒为猪伪狂犬病毒PRV、猪圆环病毒2型PCV-2、猪圆环病毒3型PCV-3、猪博卡病毒1型PBoV-G1、猪博卡病毒2型PBoV-G2、猪博卡病毒3型PBoV-G3和非洲猪瘟病毒ASFV,其中:
猪伪狂犬病毒PRV的PCR引物的序列为SEQ ID No.1、SEQ ID No.2所示,UEP延伸探针的引物序列为SEQ ID No.15所示;
猪圆环病毒2型PCV-2的PCR引物的序列为SEQ ID No.3、SEQ ID No.4所示,UEP延伸探针的引物序列为SEQ ID No.16所示;
猪圆环病毒3型PCV-3的PCR引物的序列为SEQ ID No.5、SEQ ID No.6所示,UEP延伸探针的引物序列为SEQ ID No.17所示;
猪博卡病毒1型PBoV-G1的PCR引物的序列为SEQ ID No.7、SEQ ID No.8所示,UEP延伸探针的引物序列为SEQ ID No.18所示;
猪博卡病毒2型PBoV-G2的PCR引物的序列为SEQ ID No.9、SEQ ID No.10所示,UEP延伸探针的引物序列为SEQ ID No.19所示;
猪博卡病毒3型PBoV-G3的PCR引物的序列为SEQ ID No.11、SEQ ID No.12所示,UEP延伸探针的引物序列为SEQ ID No.20所示;
非洲猪瘟病毒ASFV的引物PCR序列为SEQ ID No.13、SEQ ID No.14所示,UEP延伸探针的引物序列为SEQ ID No.21所示。
作为优选,上述SEQ ID No.1-SEQ ID No.24所示的每条PCR引物的5′端加入10个碱基的Tag,Tag的序列为ACGTTGGATG。
进一步,本发明还公开了一种基于MALDI-TOF质谱检测七种猪呼吸道病毒的试剂盒,该试剂盒包括所述的PCR引物和探针。
作为优选,该试剂盒还包括进行反转录和PCR反应所需的试剂。
作为优选,PCR引物的浓度为0.5-0.7μM,UEP延伸探针的浓度为3.5-6.5μM;再优选,猪伪狂犬病毒PRV的PCR引物的浓度为0.6μM,猪圆环病毒2型PCV-2的PCR引物的浓度为0.7μM、猪圆环病毒3型PCV-3的PCR引物的浓度为0.7μM、猪博卡病毒1型PBoV-G1的PCR引物的浓度为0.6μM、猪博卡病毒2型PBoV-G2的PCR引物的浓度为0.6μM、猪博卡病毒3型PBoV-G3的PCR引物的浓度为0.5μM,非洲猪瘟病毒ASFV的PCR引物的浓度为0.5μM;猪伪狂犬病毒PRV的延伸探针的浓度为6μM,猪圆环病毒2型PCV-2的延伸探针的浓度为5μM、猪圆环病毒3型PCV-3的延伸探针的浓度为5μM、猪博卡病毒1型PBoV-G1的延伸探针的浓度为5μM、猪博卡病毒2型PBoV-G2的延伸探针的浓度为3.5μM、猪博卡病毒3型PBoV-G3的延伸探针的浓度为6.5μM、非洲猪瘟病毒ASFV的延伸探针的浓度为5μM。
进一步,本发明还公开了所述的PCR引物和探针在制备基于MALDI-TOF质谱检测七种猪呼吸道病毒的试剂盒中的应用,所述七种猪呼吸道病毒为猪伪狂犬病毒PRV、猪圆环病毒2型PCV-2、猪圆环病毒3型PCV-3、猪博卡病毒1型PBoV-G1、猪博卡病毒2型PBoV-G2、猪博卡病毒3型PBoV-G3和非洲猪瘟病毒ASFV。
进一步,本发明还公开了一种基于MALDI-TOF质谱检测七种猪呼吸道病毒的方法,所述的方法为非疾病诊断方法,所述的七种猪呼吸道病毒,所述七种猪呼吸道病毒为猪伪狂犬病毒PRV、猪圆环病毒2型PCV-2、猪圆环病毒3型PCV-3、猪博卡病毒1型PBoV-G1、猪博卡病毒2型PBoV-G2、猪博卡病毒3型PBoV-G3和非洲猪瘟病毒ASFV,该方法采用所述的PCR引物和探针或所述的试剂盒进行检测。
作为优选,该方法包括以下的步骤:
1)多重PCR反应:将样本与PCR引物混合液进行混合,进行多重PCR反应;
2)SAP消化反应:将扩增后的产物用虾碱性磷酸酶将PCR步骤中多余的脱氧核糖核苷三磷酸消化为ddNTP,最后灭活;
3)延伸反应:将消化后的产物加入延伸探针进行延伸反应;
4)将反应结束后的延伸产物转至多孔板,放入质谱仪,加入树脂进行脱盐处理后进行质谱检测;数据采集及分析由MassARRAY Typer软件完成。
作为再优选,步骤1)多重PCR反应的反应程序为95℃2min,随后95℃15s、60℃30s和72℃60s进行40个循环,最后72℃5min;步骤2)将扩增后的产物用虾碱性磷酸酶补至7μL,37℃40min将PCR步骤中多余的脱氧核糖核苷三磷酸消化为ddNTP,最后85℃灭活5min;步骤3)消化产物中加入1μL延伸探针,0.2μL Inplex buffer及0.2μL Termination mix,用ddH2O补至9μL;反应程序为95℃30s,95℃5s,52℃5s,80℃5s进行40个循环,最后在72℃延伸3min;步骤4)将反应结束后的延伸产物转至384孔板,用ddH2O补至25μL,10000r/min离心2min。
作为优选,该方法还包括以下步骤:分别取0.5g样品,冻融3次后充分研磨,按1:10置于PBS缓冲液,10000r/min离心5min后取上清;全血样品冻融3次后,10000r/min离心5min后取上清;按核酸提取仪NP968-C配套试剂说明书进行核酸的纯化提取,并于-20℃保存备用。
本发明根据7种病原体基因的保守序列,分别设计7对引物及对应的单碱基延伸探针,通过引物浓度和反应条件优化,建立了常见猪呼吸道DNA病毒的核酸质谱(MALDI-TOFMS)多目标检测体系。MALDI-TOF MS与多重PCR联用技术,可使用质谱手段得到多个特异性核酸片段的质量信号,从而对同一样本进行多靶点检测。通过对产物在4000~10000道尔顿的质量范围进行分析,不但避开了多重PCR产物中的可能存在的引物二聚体及非特异性扩增产物,同时在延伸阶段通过单碱基延伸进一步提高了检测体系的特异性,在弥补了多重PCR缺陷的同时保持了质谱检测的灵敏度。此外,由于多重PCR与MALDI-TOF MS联用检测体系中引物及延伸探针干扰性较小,使得体系具有很好的扩充性,在更换部分引物及延伸探针的并优化引物浓度后,可进一步增加用于检测的靶点,以扩大检测体系所包含的病原体种类,能够满足对多种类病原体快速、高通量检疫的要求。
通过对本发明建立的MALDI-TOF MS体系进行方法学验证,结果显示该方法稳定性与特异性好。质谱分析显示,多目标检测体系的7种靶标产物峰,只在特定病毒阳性样品检测时产生,与其它病原体检测无交叉反应,均未出现产物峰,表明该方法对7种靶标病毒检测特异性良好。重复性试验结果分析显示,体系中每种病毒在高、中、低浓度时批内阳性均符合率≥98.0%,批间均≥98.3%,表明该方法重复性良好。以标准质粒为模板的检测灵敏性试验分析显示,体系中7种病原体每种病毒最低检测限在8.65~26.27拷贝/μL之间,与荧光PCR检测方法相当。
应用MALDI-TOF MS体系对总计108份样品进行检测,其中34份组织及全血疑似病料样品的混合感染率为54.76%,表明多种病毒性呼吸道疾病和繁殖障碍疾病病原体在患病猪只及猪群中造成的混合感染较为普遍,其中以PCV-2混合感染最多,高达67.6%;PBoV-G1、G2、G3三种基因型总检出率为47.6%(20/46),其中与别种病原体的混合感染占到95%(19/20)。24份猪肉样品中检出PCV-2、PCV-3阳性(16.7%、35.7%),混合感染率为29.17%,提示当前猪肉市场中存在一定程度的猪圆环病毒污染。而含猪源成分饲料作为深加工制品,原本猪肉含量不高,并且存在部分病毒在加工处理阶段被清除的因素,42份饲料样本中阳性检出率及混合感染率均最低,分别为42.9%和21.43%。养殖和流通环节样本中病原体的高混合感染率。此外,该体系对样本检测的通量大,最大可同时上样768个,可用于批量样本的规模化检测。
将108份样品的MALDI-TOF MS方法检测结果,与数字PCR及荧光PCR方法检测结果进行对比验证,结果显示7种靶标阳性检出的总符合率与荧光PCR、数字PCR结果基本相符(94.4%~100%),差异主要体现在数字PCR对PCV-2、PCV-3的饲料检测上(94.4%,96.3%),而与荧光PCR对PRV、PBoV-G1、PBoV-G2、PBoV-G3、ASFV的符合率较高(100%,99.1%,97.2%,100%,100%)。其原因可能是由于数字PCR检测的灵敏度更高,理论上可对样本靶标进行单拷贝检测,即使在病毒核酸含量极低的样本中也能检出,更适宜对饲料等此类含复杂基质的样本进行检测。
本发明通过核酸质谱(MALDI-TOF MS)技术建立了同步鉴定PRV、PCV-2、PCV-3、PBoV-G1、PBoV-G2、PBoV-G3和ASFV 7种猪呼吸道DNA病毒的多目标检测体系,具有高通量、高灵敏度、特异性强的特点,为猪群相关疫病监测和鉴别诊断以及进出口动物检疫提供了便利。
附图说明
图1为13组UEP探针混合后进行质谱check的图,13组时可看出存在交互作用(主峰外其他位置的杂峰)。
图2-图8为7种病毒单反应试验结果;其中:红色峰:ddH
图9为UEP探针初调前后的质谱结果对比图。
图10为以PBoV-G2为例,引物浓度调整前后对比(左)及其对应的延伸率(右,均≥80%)的对比图。
图11为引物、UEP探针优化后的质谱结果图。
图12为以PCV-2为例灵敏度试验的质谱结果图对比图。
图13为ddH
图14为7重核酸质谱体系特异性试验结果;其中:X:7重检测体系目标;Y:ddH2O、各病毒及100拷贝/μL的7种靶标混合质粒模板;Z:信噪比(SNR)。
图15为混合质粒及空白对照的质谱结果合并图;其中:红色峰:ddH2O作为模板;黑色峰:10
图16为7重核酸质谱敏感性试验结果;其中:X:7重检测体系目标;Y:ddH2O及各浓度7种靶标混合质粒模板;Z:20次重复试验结果的阳性次数。
具体实施方式
1.材料与方法
1.1病毒
猪瘟病毒灭活疫苗(CSFV,C株)和猪流感病毒灭活疫苗(SIV,TJ株)购自武汉科前生物股份有限公司,FMDV灭活疫苗购自金宇生物技术有限公司。猪繁殖与呼吸综合征病毒(PRRSV)、伪狂犬病毒(PRV,Bartha株)、猪流行性腹泻病毒(PEDV,CV777株)及PCV 2(JHSRJ株)由浙江大学惠赠,猪细小病毒(PPV)阳性样本由浙江农林大学惠赠,PCV3、PBoV-G1、PBoV-G2、PBoV-G3等阳性样本由本实验室保存。含ASFV-p72全基因包被的腺病毒于生物工程(上海)股份有限公司订制。按TaKaRa MiniBEST Viral RNA/DNA Extraction Kit配套试剂说明书对样品进行核酸的纯化提取,并将DNA或反转录后的cDNA模板于-20℃保存备用。
1.2试剂及仪器
TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0、PrimeScript
1.3引物和质量探针的设计与合成
根据GenBank发表的相关病毒基因序列,通过MEGA-X进行多重序列对比,分别选择PRV的gB基因、PCV-2的rep基因、PCV-3的cap基因、PBoV的NP1基因、ASFV的P72基因保守区域进行引物设计。通过ClustalW和MEGA-X对比190条PRV的gB、gM和gE基因,98条PCV-2和129条PCV-3的ORF1、ORF2基因,总共273条PBoV-G1、PBoV-G2和PBoV-G3的ORF1、NP1基因,249条ASFV编码P72蛋白的B646L、P17蛋白的编码基因D117L、CP530基因。
每个病毒选取1~2组基因片段,使用Primer 3分别设计3对引物,总共21对待选。根据所基因区域及引物使用
首先将13组引物PRV gB(3组)、PCV-2rep(2组)、PCV-3cap(2组)、PBoV NP1(共3组)、ASFV P72(3组)及其探针进行验证:
1)13组UEP探针混合后进行质谱check,确保探针质量无问题,如图1所示。
2)将单重引物分别与其对应的质粒进行单靶点延伸试验,即PCR+琼脂糖凝胶电泳,核验扩增可行性,去掉扩增不佳者。
3)将上述引物及对应UEP探针混合进行质谱check,查看探针峰是否与上述仅UEP探针混合时有查别,去掉会结合的UEP及对应引物。
4)将筛选后的引物探针(7个病毒靶点每个一组)进行PCR(单一质粒/混合质粒)+琼脂糖凝胶电泳,检验其是否存在互作。最终确定选择PRV gB、PCV-2rep、PCV-3cap、PBoV-G1NP1、PBoV-G2 NP1、PBoV-G3 NP1、ASFV P72基因对应的引物及探针各一组。
进一步,其中每条PCR引物的5′端加入10个碱基的Tag(ACGTTGGATG)以避免多重引物对质谱出峰位置的干扰,并用Primer-BLAST对所设计引物进行特异性检验。所选目的基因、引物序列及质量信息见表1。全部引物及探针均由生物工程(上海)股份有限公司合成和纯化。
表1 MALDI-TOF MS检测的PRV、PCV-2、PCV-3、PBoV-G1、PBoV-G2、PBoV-G3和ASFV引物探针
1.4标准质粒构建
根据GenBank中公布的PRV(KX880456.1)、PCV-2(AY691169.1)、PCV-3(NC_031753.1)、PBoV-G1(HQ223038.1)、PBoV-G2(NC_024453.2)、PBoV-G3(NC_016032.1)和ASFV(MN715134.1)基因序列序列为模板,参照引物扩增片段,由生物工程(上海)股份有限公司分别构建PUC-57标准质粒。使用Qubit 4(Thermofisher)测得质粒的浓度并确认拷贝数,分别为9.30×10
1.5单重反应试验
为了考察引物和延伸探针的反应状况及质谱结果,以1.4中每种中浓度质粒(10
1.6多重体系反应条件优化
以1.4中高浓度混合质粒(10
六重PCR反应体系为5μl,以表1引物进行PCR扩增。①多重PCR反应:将2μL的质粒与1.2μL的10×PCR mix、1μl的PCR引物混合液进行混合,用ddH
③延伸反应:将消化后的产物加入表1延伸探针进行延伸反应。消化产物中加入1μL延伸探针,0.2μL Inplex buffer及0.2μL Termination mix,用ddH
将反应结束后的延伸产物转至384孔板,用ddH
1.7特异性试验
将1.1中PRV、PCV-2、PCV-3、PBoV和ASFV等靶标病毒或假病毒DNA,SIV、PRRSV、CSFV、FMDV和PPV等非靶标常见猪病病毒DNA或cDNA做为模板,进行MALDI-TOF MS多重检测体系的特异性试验。同时以PRV、PCV-2、PCV-3、PBoV-G1、PBoV-G2、PBoV-G3和ASFV标准质粒混合模板为阳性对照,ddH
1.8敏感性试验
为了评价该方法的灵敏度,将10
1.9重复性试验
以高、中、低拷贝数(10
1.10样品检测应用
42份含猪源性成分饲料样品、34份组织或全血样本和24份新鲜猪肉样品由本实验室收集保存。8份ASFV假病毒人工污染样品,由10倍梯度稀释(10
分别取0.5g饲料、组织、猪肉或人工污染样品,冻融3次后充分研磨,按1:10置于PBS缓冲液,10000r/min离心5min后取上清。全血样品冻融3次后,10000r/min离心5min后取上清。按核酸提取仪NP968-C配套试剂说明书进行核酸的纯化提取,并于-20℃保存备用。使用本研究构建的MADLI-TOF MS多重检测体系对108份样本核酸进行PRV、PCV-2、PCV-3、PBoV-G1、PBoV-G2、PBoV-G3和ASFV检测,其中42份饲料样本经数字微滴PCR验证,其余样本均经荧光定量PCR验证。按照真阳性数/(真阳性数+假阴性数)×100%计算阳性符合率;真阴性数/(真阴性数+假阳性数)×100%计算阴性符合率;[(真阳性数+真阴性数)/检测总数]×100%计算试验结果的总符合率,并对结果进行评价。
2结果
2.1单重反应试验
以10
2.2多重反应体系的建立
将上述7组引物及探针进行以混合质粒(如10
1)UEP浓度初调:首先将UEP探针按5μM混合后进行质谱check,获得只存在探针峰的质谱图像,根据每组探针峰峰高调整每个靶点对应探针的比例(H
2)引物浓度调整:将引物按照初始浓度均为0.5μM混合,通过PCR-SAP消化-单碱基延伸,获得一组初始质谱图像,根据图像中是否存在UEP残留峰来适当增减PCR引物的浓度(如有残留,则按20%的比例增加引物浓度;如某些靶点无残留峰,且几组重复的扩增效率E均为100%,则降低引物浓度,减少其引物对PCR酶的竞争)。改变引物浓度后,重新配置新的混合引物重复上述过程,直至高浓度质粒为模板时无UEP峰残留且E≥0.8,即获得较适引物浓度。如图10所示,以PBoV-G2为例,引物浓度调整前后对比(左)及其对应的延伸率(右,均≥80%)。
3)UEP浓度优化:根据上述最适引物浓度,以及产物峰高,使之H
4)在灵敏度试验中获得每个靶点LOD后,对其引物浓度优化:低浓度(10
为获得清晰的质谱信号分析谱图,对PRV、PCV-2、PCV-3、PBoV-G1、PBoV-G2、PBoV-G3和ASFV病毒的每组引物及延伸探针的浓度进行优化,最终得到多重体系各引物的最佳浓度分别为0.6μM(PRV)、0.7μM(PCV-2)、0.7μM(PCV-3)、0.6μM(PBoV-G1)、0.6μM(PBoV-G2)、0.5μM(PBoV-G3)、0.5μM(ASFV),延伸探针的最佳浓度分别为6μM(PRV)、5μM(PCV-2)、5μM(PCV-3)、5μM(PBoV-G1)、3.5μM(PBoV-G2)、6.5μM(PBoV-G3)、5μM(ASFV)。
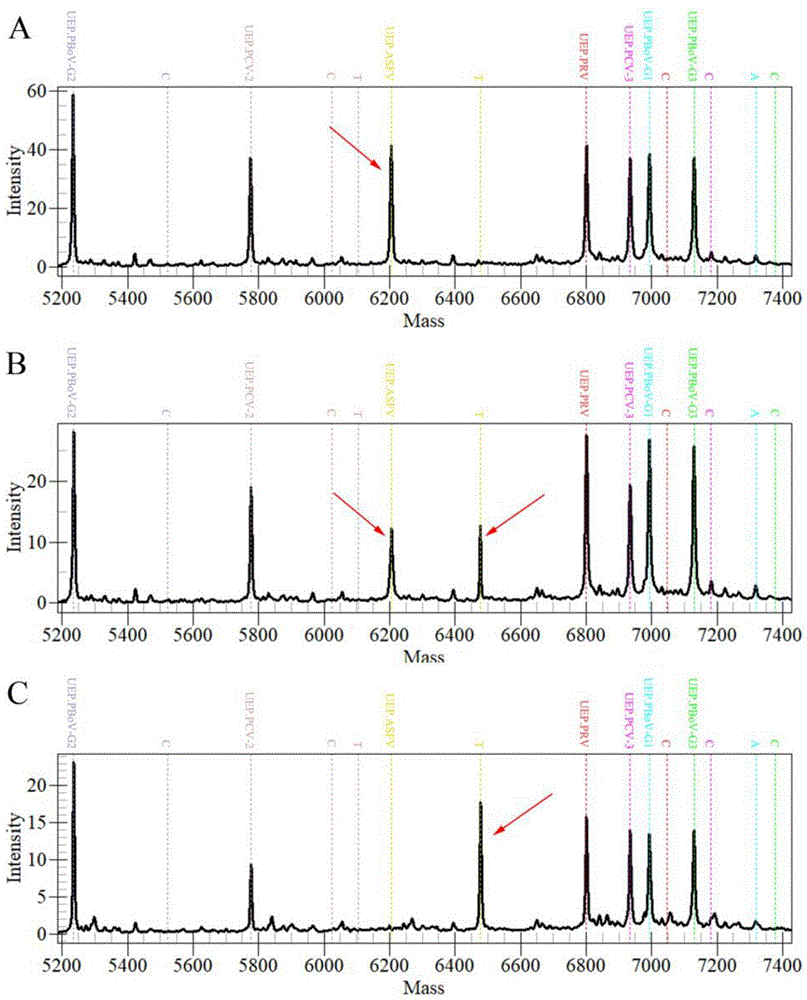
每种靶标在MALDI-TOF MS多重反应体系的分析中对应有延伸探针(UEP)和单碱基延伸产物两个峰位置,若延伸产物所对应的质量位置处出现单峰且SNR≥6,则表示检测结果为阳性,如无延伸产物峰或延伸产物峰SNR<6时则认为检测结果为阴性。以ASFV为例,阴性对照反应体系中的延伸探针未进行延伸反应,质谱图像中仅存在未被消耗的探针峰(图13-A);低浓度模版时(50拷贝/μL阳性质粒),ASFV延伸探针部分消耗,同时存在ASFV探针峰与产物峰(图13-B);当质粒模板浓度为100拷贝/μL时,延伸反应完全,ASFV延伸探针全部转化为延伸产物,只存在ASFV产物峰(图13-C),其与ASFV探针峰(6206.1Da)的差值即为所延伸单碱基的分子量。
2.3特异性分析
分别以PRV、PCV-2、PCV-3、PBoV和ASFV等靶标病毒或假病毒DNA,以及SIV、PRRSV、CSFV、FMDV和PPV等其它常见猪病病毒DNA或cDNA为模板,对MALDI-TOF MS多重体系进行特异性试验。结果显示,体系中7个靶标病毒在各自延伸产物处均分别产生单峰,且信号峰的SNR均≥6,非靶标模板及空白对照组的延伸产物处无峰(SNR均≤3),只存在延伸探针峰(图14),表明该方法能够准确识别目标病毒,且与其它非靶标病原无交叉反应,特异性好。
2.4敏感性分析
为评价该方法的敏感性,将10
2.5重复性分析
以10
表2重复性试验结果
2.6样品检测应用
利用MALDI-TOF MS方法对108份组织、饲料、猪肉或人工污染样品进行检测,结果如表3所示,34份组织样本中,31份样本能检出除ASFV外的6种病毒,其中23份组织样本能检出两种及以上病毒的混合感染,占比为67.6%;饲料样品中除ASFV和PRV外其余5种靶标均有检出,42份样品中检出阳性18份,其中两种及以上病毒混合感染的样品9份(21.4%);在24份新鲜猪肉样品中检出PCV-2和PCV-3阳性共15份,其中两种病毒混合感染样品7份,混合感染率为29.2%;8份不同浓度ASFV-p72假病毒人工污染的猪肉样品均可检出ASFV阳性,与质粒标准品试验结果相符。
表3 108份样品MALDI-TOF MS检测结果
/>
注:*同一样本同时检出多种阳性靶标;
将MALDI-TOF MS体系的检测结果与数字PCR(饲料)、荧光PCR(组织、猪肉和人工污染样本)检测进行比对验证,7种病毒靶标的阳性符合率、阴性符合率及总符合率分别为:PRV:100%、100%、100%;PCV-2:96.2%、92.9%、94.4%;PCV-3:90.9%、98.5%、96.3%;PBoV-G1:100%、98.9%、99.1%;PBoV-G2:81.3%、100%、97.2%;PBoV-G3:100%、100%、100%和ASFV:100%、100%、100%,两种方法检测结果基本相符(表4)。
表4 MALDI-TOF MS多重检测体系与数字PCR和荧光PCR监测结果符合率
/>
- 用于检测A型猪轮状病毒的引物及探针、荧光定量PCR试剂盒及方法和应用
- 用于检测猪传染性胃肠炎病毒的引物及探针、荧光定量PCR试剂盒及方法和应用
- 一种基于实时荧光PCR检测红串红球菌的引物和探针、试剂以及试剂盒与方法
- 一种基于实时荧光PCR检测短短芽孢杆菌的引物和探针、试剂及其试剂盒与方法
- 基于荧光定量PCR检测鲟鱼的引物和探针及其试剂盒与方法
- 基于多重PCR-飞行时间质谱检测34种呼吸道病原微生物的引物和探针组合及试剂盒
- 一种猪伪狂犬病毒和猪圆环病毒3型双重荧光定量PCR检测引物和探针、试剂盒及方法
