用于鉴定高龄父亲年龄相关表观遗传失调的方法和试剂盒
文献发布时间:2023-06-19 19:30:30
相关申请交叉引用
本申请要求于2020年4月21日提交的题为“用于鉴定高龄父亲年龄相关表观遗传失调的方法和试剂盒(Methods and Kits for Identifying Advanced Paternal AgeRelated Epigenetic Dysregulation)”的美国临时申请第63/013,090号的权益,所述美国临时申请通过引用并入本文。
技术领域
本发明涉及一种高龄父亲年龄和胚胎发生期间表观遗传事件风险增加的关联。本发明还涉及鉴定充当用于与胚胎发生期间的不良结果相关的表观遗传筛选的标志物的多个基因。
背景技术
高龄父亲年龄(APA)与不良后果相关,包含出生缺陷和儿童神经发育疾病,如自闭症谱系障碍、精神分裂症和双相情感障碍。尽管如此,美国第一次为人父母的平均年龄正在增加,使得在过去的25年中,第一次做母亲的平均怀孕年龄从约25岁增加至约26岁。同样的趋势也出现在第一次做父亲的人身上,因为自二十世纪八十年代以来,男性生育第一个孩子的平均年龄增加了约3岁。因此,可以预期与APA相关的不良结果的发生率将继续上升。本领域需要鉴定风险因素和为APA个体开发诊断筛选的能力,使得选择在较大年龄开始家庭的个体可以限制其生下具有不良结果的新生儿的风险。
本发明旨在克服上文所讨论的问题中的一个或多个问题。
发明内容
本文公开了可用于鉴定、筛选和诊断胚胎发生期间的表观遗传失调,例如胚泡中的表观遗传失调的方法和试剂盒。
本文中的实施例包含,例如,用于鉴定具有增加的表观遗传失调,并且具体地是与胚胎发生期间的不良结果相关的表观遗传失调的胚泡、精子或精子群体的方法。所述方法包含获得所关注的胚泡、精子或精子群体,并鉴定所述胚泡中的DNA甲基化误差。不良结果的风险增加与具有带有整体低甲基化转变的全局DNA的胚泡、精子或精子群体的表观遗传失调相关,或与使一个或多个或两个或更多个自闭症谱系障碍候选基因、精神分裂症候选基因或双相情感障碍候选基因被高甲基化的胚泡相关。在所述案例的各方面,所述自闭症谱系障碍候选基因包含:ABAT、ABCA7、ADSL、ANKRD11、CACNA1C、CACNA1H、CCDC88C、CDH11、CIC、CLSTN3、CNTNAP2、CSMD1、DDX3X、DHCR7、DPP6、EHMT1、FLT1、GLIS1、GNAS、GRIN1、GRM8、HDAC6、ITGB7、KCNQ2、NRP2、NSD1、P4HA2、PACS1、PIK3R2、PXDN、SGSH、SHANK2、SHANK3、SLC38A10、TET2、TT12、ZNF804A和UBE3B。在所述案例的一些方面,所述精神分裂症候选基因包含TCF3和ZNF804A。在所述案例的一些方面,所述双相情感障碍候选基因包含COMT、DRD4、GRIN1、MBP、PRKCZ、SHANK2、TRPM2和ZNF804A。在所述案例的一些方面,阿片类信号传导通路候选基因包含上述任何神经发育疾病候选基因。在一些情况下,所述方法可以用于筛选胚泡、精子或精子群体的表观遗传失调,其中如上文所描述具有表观遗传失调的胚泡、精子或精子群体不会用于体外受精期间的植入程序,或者在精子的情况下,不用于使卵子受精。在一些情况下,所述方法可以用于筛选胚泡、精子或精子群体的表观遗传失调,并且可以对胚泡、精子或精子群体进行排序以允许选择最健康的胚胎以进行植入或允许最健康的精子用于受精。
在其它实施例中,提供了用于确定胚泡的表观遗传状态的方法。方法包含确定胚泡中的一个或多个或两个或更多个自闭症谱系障碍候选基因、精神分裂症候选基因或双相情感障碍候选基因的甲基化水平和基因表达。在一些方面,将所述自闭症谱系障碍基因、精神分裂症基因或双相情感障碍基因的甲基化水平和基因表达与具有正常或非表型表观遗传状态的已知对照进行比较(在一些情况下,正常或非表型表观遗传状态与在较年轻父亲(通常小于35岁)的精子中发现的相同的一个或多个或两个或更多个自闭症谱系障碍基因的甲基化相关)。如上所述,所述自闭症谱系障碍候选基因可以是以下中的任一个:ABAT、ABCA7、ADSL、ANKRD11、CACNA1C、CACNA1H、CCDC88C、CDH11、CIC、CLSTN3、CNTNAP2、CSMD1、DDX3X、DHCR7、DPP6、EHMT1、FLT1、GLIS1、GNAS、GRIN1,GRM8、HDAC6、ITGB7、KCNQ2、NRP2、NSD1、P4HA2、PACS1、PIK3R2、PXDN、SGSH、SHANK2、SHANK3、SLC38A10、TET2、TT12、ZNF804A或UBE3B。所述精神分裂症候选基因可以是TCF3和ZNF804A。所述双相情感障碍候选基因可以是COMT、DRD4、GRIN1、MBP、PRKCZ、SHANK2、TRPM2和ZNF804A。阿片类信号传导通路候选基因可以是上述任何神经发育疾病候选基因,例如CACNA1H、GRIN1和PRKCZ。
在用于确定胚泡的表观遗传状态的替代性方法中,所述方法包含确定所述胚泡的全局DNA甲基化,其中与正常表观遗传状态相比,全局DNA甲基化的低甲基化或高甲基化转变被认为是异常表观遗传状态。与具有正常表观遗传状态的胚泡相比,异常表观遗传状态与胚泡导致不良结果的更高风险相关。
最后,本文中的实施例包含用于测试一个或多个细胞的表观遗传状态的试剂盒。一方面,所述一个或多个细胞来自胚泡,并且所述试剂盒包含用于确定所述胚泡的甲基化水平的装置,以及用于确定所述胚泡中的两个或更多个靶基因的基因表达的装置。所述胚泡中的所述两个或更多个基因可以是自闭症谱系障碍基因。在一些试剂盒中,提供了包含自闭症谱系障碍候选基因的甲基化和基因表达的正常范围的值的标准范围的说明书。说明书还可以包含用于进行甲基化和基因表达测试的方法。
附图说明
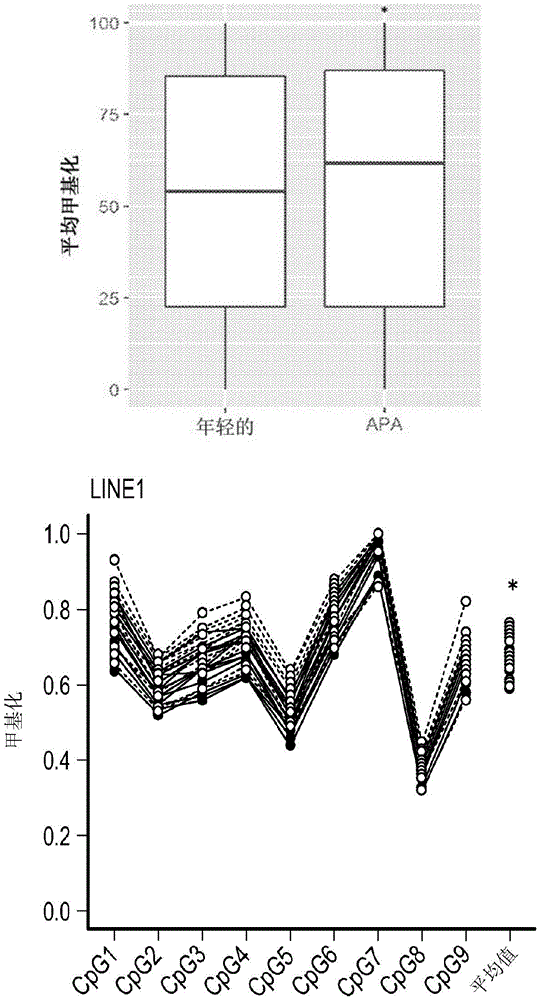
图1A和图1B展示了年轻和APA精子的全局DNA甲基化。图1A展示了使用箱线图可视化的显著精子CpG的平均年轻和APA平均值的分布。每个框的底部和顶部表示分布的第1和第3分位数,并且分隔线表示中位数。根据曼-惠特尼检验(Mann-Whitney test)(*p=1.33×10-21),分布显著不同。图1B示出了LINE1亚硫酸氢盐焦磷酸测序。x轴上的CpG位点后面是年轻(灰色)和APA(黑色)个体的所有CpG的平均甲基化百分比。每条线表示单独精子样品的结果(n=18个年轻精子样品并且n=18个APA精子样品)。相对于年轻的(67%),在APA(70%)中观察到显著的高甲基化,*p<0.05。
图2A至2L提供了精子甲基化验证结果的绘图。每个图表示在显著DMR内的不同CpG位点处的选定验证基因的焦磷酸测序结果:图2A–CACNA1H;图2B–COMT;图2C–DRD4;图2D–GRIN1;图2E–KCNQ1;图2F–PRKCZ;图2G–SHANK2;图2H–SHANK3;图2I–TCF3;图2J–TRPM2;图2K–CNTNAP2;图2L–MBP;图2M–ZNF804A。x轴上的CpG位点后面是年轻(灰色)和APA(黑色)个体的所有CpG的平均甲基化百分比。每条线表示单独精子样品的结果(n=18个年轻精子样品并且n=18个APA精子样品)。绘图(A-J)展示了APA相对于年轻的显著低甲基化,并且绘图(K-M)展示了APA相对于年轻的显著高甲基化;*p≤.01,**p≤.001
图3提供了展示父亲年龄的精子DNA甲基化变化的绘图。线性回归模型证明APA父亲的精子DNA甲基化与父亲年龄之间的显著负相关(≥50岁;n=18个APA精子样品)。使用R中的lm()函数和默认自变量拟合模型,p≤.05的模型被认为是显著的。R平方、斜率和p值显示在每个绘图的上方,并且每条黑色回归线周围的灰色阴影区域表示95%置信区间。
图4A和图4B展示了CACNA1H和SHANK2的精子和胚泡DNA甲基化验证结果。条形绘图示出了两个选定验证基因CACNA1H(图1A)和SHANK2(图1B)在年轻(灰色)和APA(黑色)父亲的精子(n=12)和胚泡(n=12)中的显著DMR内的平均甲基化变化。误差条表示一个标准偏差。CACNA1H中的精子和胚泡两者以及SHANK2中的精子均展示出显著的低甲基化。*p≤0.05。
具体实施方式
对基因组的表观遗传变化的研究已使得对多种疾病状态的理解和治疗取得进展。具体地,表观遗传修饰现已被鉴定为某些癌症、认知功能障碍、自身免疫疾病和可能的生殖障碍的促成因素。与本文特别相关的是,发明人已经鉴定了在胚胎发生期间发生的多种表观遗传事件,所述事件与新生儿的不良结果的更高可能性相关,例如出生缺陷、自闭症谱系障碍等。如本文所公开,“表观遗传事件”是改变基因活性而不改变DNA序列的任何过程。一方面,表观遗传事件是DNA甲基化。令人惊讶的是,发明人发现当父亲供体具有APA时,这些已鉴定的表观遗传事件更有可能发生。
在本公开之前,尚未阐明父亲年龄效应的因果机制,也未最终确定遗传模式。如本文所描述,可修改和可遗传的表观遗传信息,如DNA甲基化,可以代际传递。在配子发生期间和受精之后立即发生一系列表观遗传重新编程事件(Reik、Dean和Walter,2001)。甲基化标记的擦除和配子特异性建立发生在原始生殖细胞发育期间。受精之后,雄性原核立即经历快速、主动的脱甲基化过程,而雌性原核经历被动复制依赖性脱甲基化,然后在发育中的胚胎中重新建立。印记基因,或许还有其它发育关键区域,避开了表观遗传重新编程的胚胎部分,从而实现了表观遗传的代际遗传(Kobayashi等人,2012)。
本文公开并由实例中提供的数据证实,衰老精子中受损的DNA甲基化谱导致精子发生期间不完全重新编程的发现。发明人第一次证明了精子和胚胎中与高龄父亲年龄相关的改变的人类甲基化景观的代际相关性,这有助于整个人类胚泡基因组中甲基化重建的非等效效率。异常的表观遗传重新编程在APA精子和胚泡两者中神经发育所必需的基因处显著富集,并提供了父亲年龄效应与后代神经发育障碍之间的机制联系。
如本文所公开,与不良结果的较高可能性相关的表观遗传事件包含:(1)全局胚泡DNA的低甲基化转变;(2)胚泡中的任何一个或多个基因既显示异常甲基化又显示异常基因表达(增加或减少)的可能性更高;(3)胚泡中的以下基因中的一个或多个,或至少两个或更多个、三个更或多个、四个或更多个等的高甲基化:ABAT、ABCA7、ADSL、ANKRD11、CACNA1C、CACNA1H、CCDC88C、CDH11、CIC、CLSTN3、CNTNAP2、CSMD1、DDX3X、DHCR7、DPP6、EHMT1、FLT1、GLIS1、GNAS、GRIN1,GRM8、HDAC6、ITGB7、KCNQ2、NRP2、NSD1、P4HA2、PACS1、PIK3R2、PXDN、SGSH、SHANK2、SHANK3、SLC38A10、TET2、TT12、ZNF804A或UBE3B(本文中被称为自闭症谱系障碍候选基因);TCF3和ZNF804A(本文中被称为精神分裂症候选基因);COMT、DRD4、GRIN1、MBP、PRKCZ、SHANK2、TRPM2和ZNF804A(本文中被称为双极性候选基因);或者(4)胚泡中的任何一个或多个自闭症谱系障碍候选基因、精神分裂症候选基因或双相情感障碍候选基因的高甲基化和基因表达降低。
在胚泡中鉴定出上述表观遗传事件之一的情况下,则可以将其作为可能的体外受精候选物去除胚泡。在胚泡的精子供体具有APA的情况下,或者在精子供体经历了饥荒或某种其它压力环境或对表观遗传信息的情绪破坏的情况下,这尤其如此。在其它方面,一个或多个胚泡可以按表观遗传事件的程度或量进行排序,使得可以选择最健康的胚泡进行植入。
本文还公开了自闭症谱系障碍候选基因、精神分裂症候选基因和/或双相情感障碍候选基因可以用作表观遗传测试中的标志物,尤其是用作胚胎发生期间潜在不良事件的标志物。这些基因与改变的甲基化(高或低)和改变的表达(增加或减少)相关,并且现在显示(本文中)与APA相关。这些发现允许开发新的筛选策略。
本文中的实施例提供了用于鉴定和/或筛选胚泡的表观遗传事件,并且具体地是与繁殖期间的不良结果相关的表观遗传事件的方法和试剂盒。本文中的实施例提供了用于鉴定和/或筛选精子的表观遗传事件(例如,与后代中的神经发育障碍相关的表观遗传事件)的方法和试剂盒。
本文中的实施例包含用于鉴定具有增加的表观遗传失调,并且具体地是与胚胎发生期间的不良结果相关的表观遗传失调(即,导致后代受神经发育障碍影响的不良结果)的胚泡的方法。所述方法包含:获得所关注的胚泡并鉴定所述胚泡中的DNA甲基化误差。表观遗传失调的风险增加与具有带有整体低甲基化转变的全局DNA的胚泡相关,或与使一个或多个或两个或更多个自闭症谱系障碍候选基因、精神分裂症候选基因或双相情感障碍候选基因被高甲基化的胚泡相关。在所述案例的各方面,所述自闭症谱系障碍候选基因包含ABAT、ABCA7、ADSL、ANKRD11、CACNA1C、CACNA1H、CCDC88C、CDH11、CIC、CLSTN3、CNTNAP2、CSMD1、DDX3X、DHCR7、DPP6、EHMT1、FLT1、GLIS1、GNAS、GRIN1,GRM8、HDAC6、ITGB7、KCNQ2、NRP2、NSD1、P4HA2、PACS1、PIK3R2、PXDN、SGSH、SHANK2、SHANK3、SLC38A10、TET2、TT12、ZNF804A或UBE3B。所述精神分裂症候选基因包含TCF3和ZNF804A。所述双相情感障碍候选基因包含COMT、DRD4、GRIN1、MBP、PRKCZ、SHANK2、TRPM2和ZNF804A。阿片类信号传导通路候选基因可以是上述任何神经发育疾病候选基因,例如CACNA1H、GRIN1和PRKCZ。
在一些情况下,所述方法可以用于筛选胚泡的表观遗传失调,其中具有表观遗传失调的胚泡将不用于植入程序。
在本文中的其它实施例中,提供了用于确定胚泡的表观遗传状态的方法。方法包含确定胚泡中的一个或多个或两个或更多个自闭症谱系障碍候选基因、精神分裂症候选基因或双相情感障碍候选基因的甲基化水平和基因表达。在一些方面,将一个或多个或两个或更多个自闭症谱系障碍基因、精神分裂症基因或双相情感障碍基因的甲基化水平和基因表达与具有正常或非表型表观遗传状态的已知对照进行比较。如上所述,所述自闭症谱系障碍候选基因可以是以下中的任一个:ABAT、ABCA7、ADSL、ANKRD11、CACNA1C、CACNA1H、CCDC88C、CDH11、CIC、CLSTN3、CNTNAP2、CSMD1、DDX3X、DHCR7、DPP6、EHMT1、FLT1、GLIS1、GNAS、GRIN1,GRM8、HDAC6、ITGB7、KCNQ2、NRP2、NSD1、P4HA2、PACS1、PIK3R2、PXDN、SGSH、SHANK2、SHANK3、SLC38A10、TET2、TT12、ZNF804A或UBE3B。所述精神分裂症候选基因可以是TCF3和ZNF804A。所述双相情感障碍候选基因可以是COMT、DRD4、GRIN1、MBP、PRKCZ、SHANK2、TRPM2和ZNF804A。阿片类信号传导通路候选基因可以是上述任何神经发育疾病候选基因,例如CACNA1H、GRIN1和PRKCZ。
在用于确定胚泡的表观遗传状态的替代性方法中,所述方法包含确定所述胚泡的全局DNA甲基化,其中与正常表观遗传状态相比,所述全局DNA甲基化的低甲基化或高甲基化转变被认为是异常表观遗传状态。
最后,本文中的实施例包含用于测试胚泡的表观遗传状态的试剂盒,所述试剂盒包含用于确定所述胚泡的甲基化水平的装置,以及用于确定所述胚泡中的两个或更多个靶基因的基因表达的装置。所述胚泡中的所述两个或更多个基因可以是自闭症谱系障碍基因、精神分裂症基因或双相情感障碍基因。还可以提供标准对照值和如何进行测试的说明书。
本文中的实施例包含用于鉴定精子或具有产生患有神经发育障碍的后代的倾向的精子供体的方法。所述方法包含从所述精子供体获得射出精液样品,鉴定所述精子群体中的DNA甲基化误差程度,以及将所述供体精子群体中的DNA甲基化误差程度与对照样品中的DNA甲基化误差程度进行比较。如果供体精子群体中的DNA甲基化误差程度超过表明存在表观遗传失调累积风险的阈值,则供体精子将不会用于使用于体外受精的卵子受精。在一些方面,精子或精子群体中的表观遗传变化程度允许对精子或样品进行排序以确定用于体外受精的最健康的精子或精子样品。累积风险与具有带有总体低甲基化转变的全局DNA的精子群体相关,或与在一个或多个或两个或更多个被高甲基化的自闭症谱系障碍候选基因、精神分裂症候选基因或双相情感障碍候选基因中具有阈值程度的DNA甲基化误差的精子群体相关。在所述案例的各方面,所述自闭症谱系障碍候选基因包含ABAT、ABCA7、ADSL、ANKRD11、CACNA1C、CACNA1H、CCDC88C、CDH11、CIC、CLSTN3、CNTNAP2、CSMD1、DDX3X、DHCR7、DPP6、EHMT1、FLT1、GLIS1、GNAS、GRIN1,GRM8、HDAC6、ITGB7、KCNQ2、NRP2、NSD1、P4HA2、PACS1、PIK3R2、PXDN、SGSH、SHANK2、SHANK3、SLC38A10、TET2、TT12、ZNF804A或UBE3B。所述精神分裂症候选基因可以是TCF3和ZNF804A。所述双相情感障碍候选基因可以是COMT、DRD4、GRIN1、MBP、PRKCZ、SHANK2、TRPM2和ZNF804A。阿片类信号传导通路候选基因可以是上述任何神经发育疾病候选基因,例如CACNA1H、GRIN1和PRKCZ。
在一些情况下,所述方法可以用于鉴定表现出表观遗传失调的精子,其中具有表观遗传失调的精子不会用于体外受精。在一些方面,所述方法可以用于对精子或精子群体进行排序,以允许选择最健康的精子用于体外受精。
在本文中的其它实施例中,提供了用于确定个体精子的表观遗传状态或从精子供体获得的精子群体的表观遗传状态的方法。方法包含确定所述精子或精子群体中的一个或多个或两个或更多个自闭症谱系障碍候选基因、精神分裂症候选基因和/或双相情感障碍候选基因的甲基化水平和基因表达。在一些方面,将一个或多个或两个或更多个自闭症谱系障碍基因、精神分裂症基因和/或双相情感障碍基因的甲基化水平和基因表达与具有正常或非表型表观遗传状态的已知对照进行比较。如上所述,所述自闭症谱系障碍候选基因可以是以下中的任一个:ABAT、ABCA7、ADSL、ANKRD11、CACNA1C、CACNA1H、CCDC88C、CDH11、CIC、CLSTN3、CNTNAP2、CSMD1、DDX3X、DHCR7、DPP6、EHMT1、FLT1、GLIS1、GNAS、GRIN1,GRM8、HDAC6、ITGB7、KCNQ2、NRP2、NSD1、P4HA2、PACS1、PIK3R2、PXDN、SGSH、SHANK2、SHANK3、SLC38A10、TET2、TT12、ZNF804A或UBE3B。所述精神分裂症候选基因可以是TCF3和ZNF804A。所述双相情感障碍候选基因可以是COMT、DRD4、GRIN1、MBP、PRKCZ、SHANK2、TRPM2和ZNF804A。阿片类信号传导通路候选基因可以是上述任何神经发育疾病候选基因,例如CACNA1H、GRIN1和PRKCZ。
在用于确定精子或精子群体的表观遗传状态的替代性方法中,所述方法包含确定所述精子或精子群体的全局DNA甲基化,其中与正常表观遗传状态相比,所述全局DNA甲基化的低甲基化或高甲基化转变被认为是异常表观遗传状态。
最后,本文中的实施例包含用于测试精子或精子群体的表观遗传状态的试剂盒,所述试剂盒包含用于确定所述精子群体的甲基化水平的装置,以及用于确定所述精子中的一个或多个或两个或更多个靶基因的基因表达的装置。所述精子中的所述基因可以是自闭症谱系障碍基因、精神分裂症基因和/或双相情感障碍基因。还可以提供标准对照值和如何进行测试的说明书。
尽管已经参考多个实施例特别示出和描述了本发明,但是本领域技术人员将理解,可以对本文公开的各种实施例进行形式和细节上的改变而不背离本发明的精神和范围并且本文公开的各种实施例并不旨在充当对权利要求的范围的限制。
实例
仅出于说明性目的提供以下实例,并且所述实例并不旨在限制本发明的范围。统计分析包含学生t检验(Student's t test)、费舍尔精确检验(Fisher'sexact test)、曼-惠特尼U检验(Mann-Whitney U test)、Benjamini-Hochberg方法,其中显著性为p<0.05。
实例1:甲基化在胚泡的表观遗传失调中起作用
目的:APA与不良后果相关,包含出生缺陷和儿童神经发育疾病,如自闭症谱系障碍。表观遗传失调,如来自年老父亲的遗传性DNA甲基化误差,可能会导致后代的基因表达永久性改变,从而导致临床表型。此实例的目的是研究与APA相关的人类胚泡的甲基化组和随后的转录组。
材料和方法:经IRB批准和患者同意,捐赠了冷冻保存、可移植质量的人类胚泡。将精子正常的年老父亲(APA;≥50岁)与正常精子的年轻父亲(年轻;≤35岁)在只有供卵的情况下进行比较,以消除已知的女性因素。使用Methyl-MaxiSeq(Zymo研究公司)对胚泡DNA(n=12)进行亚硫酸氢盐转化和测序,而胚泡RNA(n=12)进行小细胞数RNA-seq(Illumina)。结合通路分析(DAVID 6.8)对结果进行了分析。转录验证(n=24)使用带有REST 2009的qPCR进行,并且甲基化验证(n=10)使用PyroMark Q24高级系统(凯杰公司(Qiagen))。统计分析包含学生t检验、R中的方差分析、费舍尔精确检验和适当的成对固定再分配随机化检验,其中显著性为p<0.05。
结果:在APA胚泡中观察到向低甲基化的总体转变(34% APA对40%年轻的;p<0.05),其中57,286个低甲基化和49,709个高甲基化CpG位点(p<0.05)。RNA测序揭示751个基因的表达显著降低,并且195个基因的表达显著增加(p<0.05)。组合甲基化组和转录组数据集,319个基因在两者中都发生了显著的定向改变(p<0.05)。通路分析将“疾病突变”鉴定为包含智力障碍、肿瘤抑制基因、神经退行性变和自闭症谱系障碍的高度重要的关键功能注释类别。迄今为止,自闭症谱系候选基因SHANK2(45% APA对33%年轻的;p<0.05)和ANKRD11(75% APA对43%年轻的;p<0.05)的甲基化增加的验证,以及观察到的对其基因表达的降低影响已得到证实(p<0.05)。
结论:这项新型研究调查了APA对胚胎发生期间表观遗传事件的影响。结果揭示了来自年老父亲的胚泡的整体低甲基化转变,导致转录显著改变。有趣的是,自闭症谱系候选基因主要是高甲基化的,随后基因表达降低,这提供了高龄父亲年龄效应与儿童神经发育障碍之间的机制联系。
实例2:父母年龄的增加显著加剧了低甲基化
六个年轻(≤35岁)和六个APA(≥50岁)精子样品被用于使用改进的还原表示亚硫酸氢盐序列(RRBS;来自Zymo研究公司的Methyl Mini-Seq平台)方法进行全局甲基化组分析,并且在APA精子表观基因组中观察到全局甲基化增加,并通过LINE1亚硫酸氢盐焦磷酸测序证实。参见图1。
使用两层PureSperm密度梯度离心(尼达康公司(Nidacon))制备精子样品,然后进行细胞裂解以去除圆形细胞污染并储存在裂解缓冲液(诺冠生物科技公司(NorgenBiotek))中。多余的冷冻保存的胚泡是从在知情同意和IRB批准的情况下接受IVF治疗的夫妇获得的。类似地,使用全基因组亚硫酸氢盐测序(WGBS;来自Zymo研究公司的MethylMaxi-Seq平台)分析了六个年轻和六个APA胚泡样品。在分别鉴定年轻组与APA组的精子和胚泡之间的49,722和106,995个CpG是统计学上显著的(p<0.05)之后,分析得出3,405个精子DMR和3,997个胚泡DMR。
表1:APA精子和胚泡DMR
/>
APA精子中的低甲基化DMR在CpG岛(p=1.80E-22)、货架(p=1.16E-175)和海岸(p=1.76E-26)处显著富集。从UCSC基因组浏览器hg19下载CpG岛注释。也观察到了APA胚泡中的低甲基化DMR的类似趋势。
比较精子和胚泡DMR相关基因,在父亲衰老时,两个甲基化组之间的基因高度显著富集(p=3.46E-55)。对两个甲基化组之间的167个低甲基化基因和61个高甲基化基因进行了鉴定,其中10个基因既表现出低甲基化又表现出高甲基化DMR。
表2:重叠DMR
另外12个年轻的和12个APA的精子正常的精子样品用于甲基化验证。参见图2。选择用于甲基化验证的基因包含改变的DMR、在重要通路中鉴定的基因、与神经发育障碍有关的基因、定位于重要细胞带的基因、印记基因以及与已发表的关于衰老精子的文献相对应的基因。参见表3。使用线性回归模型,随着父亲年龄从50岁增加到60岁以上,低甲基化显著加剧。参见图3。
表3:先前在衰老的人类精子中鉴定的DMR相关基因
/>
从与神经发育障碍相关的两个基因中选择了十二个胚泡(源自年轻的父亲年龄的父亲)和12个APA胚泡用于DMR中的胚泡甲基化验证。焦磷酸测序数据证实沿扩增的CACNA1HDMR区域存在显著的低甲基化(年轻的平均甲基化为40%,APA为25%,p,0.05),而SHANK2胚泡DMR的验证趋向于低甲基化(年轻的75%,APA 56%,p<0.1)。参见图4和表4。
表4:甲基化组读段映射统计
实例3:特定染色体区域更容易受到与年龄相关的甲基化改变
分析了单独细胞带中的DMR相关基因密度的染色体富集,以确定特定染色体区域是否更容易受到与年龄相关的甲基化改变的影响。甲基化改变不是跨基因组随机分布,而是聚集在某些染色体位置,其中19号染色体在年轻与APA样品之间具有最大的显著性(精子p=5.51E-7,胚泡p=9.01E-13,重叠p=7.28E-6)。在APA精子中的5个细胞带处鉴定了显著富集,五个中的四个在APA胚泡甲基化组中独立富集,并且3个在重叠的APA精子和胚泡基因列表中显著富集。参见表5。
表5:统计上显著的细胞带
所有三个数据集的最大富集是chr19p13.3(精子p=4.32E-19,胚泡p=3.76E-22,重叠p=5.62E-16)。分析DMR相关基因与精子中已知核小体保留区域的共定位,鉴定了APA精子DMR的单核小体富集是统计学上显著的(p=9.36E-29),并且存在抑制性组蛋白标记H3K27me3(p=7.21E-6)。这种与单核小体的共定位增强了在精子和胚泡数据集中鉴定的定向重叠DMR(p=2.52E-18)。参见表6。
表6:DMR相关基因与组蛋白和组蛋白修饰的共定位
*Hammoud,S.S.等人人类精子中独特的染色质包装了用于胚胎发育的基因(Distinctive chromatin in human sperm packages genes for embryo development.)《自然(Nature)》460,473-478,doi:10.1038/nature08162(2009)。
实例4:父亲衰老改变与神经发育障碍相关基因的甲基化的影响
在APA样品中差异甲基化的基因组区域中发现了神经信号传导通路。阿片类信号传导通路是在APA精子和胚泡数据集两者中发现的定向重叠基因的主要通路。从阿片类信号传导通路成功验证的基因包含APA精子中的CACNA1H、GRIN1和PRKCZ以及APA胚泡中的CACNA1H。神经元中涉及nNOS信号传导的通路被强调为影响APA精子甲基化组(p=2.08×10-4)的顶级典型通路,所述通路还包括类似的成功验证的基因(GRIN1和PRKCZ)。表7中可以找到受高龄父亲年龄影响的另外的通路。
表7:顶级典型通路
将公开可用的基因列表与DMR进行比较,在三种神经系统疾病中发现了高度显著的基因富集,特别是自闭症谱系障碍(p=1.94E-4)、精神分裂症(p=5.55E-4)和双相情感障碍(p=4.73E-5)。这种富集在APA精子DMR和APA胚泡DMR中独立地鉴定。参见表8。基因在与自闭症谱系障碍(CACNA1H、CNTNAP2、GRIN1、SHANK2、SHANK3、ZNF804A)、精神分裂症(TCF3、ZNF804A)、双相情感障碍(COMT、DRD4、GRIN1、MBP、PRKCZ、SHANK2、TRPM2、ZNF804A)相关的APA精子中和在APA胚泡(CACNA1H)中被验证。所有三个候选神经发育基因列表都共享阿片类信号传导通路。参见表9。
表8:神经发育障碍关联
表9:神经发育障碍的顶级典型通路
使用公开可用的甲基化分析阵列,分析了来自自闭症和非自闭症样品的两种脑组织;鉴定了141个(自闭症)和62个(非自闭症)DMR。这些DMR中的基因与APA精子(额叶皮层p=5.78E-9,扣带回皮层p=1.62E-4)和APA胚泡(额叶皮层p=1.94E-16,扣带回皮层p=3.24E-5)DMR相关基因列表显著重叠。使用与DMR相关基因的通路分析,确定额叶皮层显著富集阿片类信号传导(p=2.14E-3)。参见表10。
表10:与APA精子和APA胚泡相比,自闭症大脑中的DMR相关基因的通路分析
将APA数据集与当前已知和推定的人类印记基因列表进行了进一步比较。APA精子具有19个低甲基化和7个高甲基化的与印记基因相关的显著DMR。APA胚泡具有22个低甲基化和10个高甲基化的与印记基因相关的显著DMR,其中6个印记基因在两个数据集中重叠(p<0.05)。参见表11。
表11:DMR相关印记基因
/>
结论
上述研究首次证明了从人类精子到植入前胚胎的表观遗传失调的代际遗传。结果证明了从精子到后代的父亲年龄效应的机制,证实了与自闭症谱系障碍、精神分裂症和双相情感障碍相关的神经发育基因的显著易感性。此外,研究中鉴定的基因与自闭症大脑额叶皮层和扣带皮层差异甲基化的基因显著重叠(Nardone等人,2014)。在APA精子表观基因组中观察到全局甲基化增加;然而,DMR分析确定了相当数量的高甲基化和低甲基化区域。令人惊讶的是,在个体中,这些甲基化变化在经过验证的基因的每个CpG位点处以紧密的一致性发生,在原始和独立的精子队列中都可以看到。另外地,线性回归分析清楚地说明了随着父亲年龄的增加而显著的进行性甲基化改变。有趣的是,虽然在年轻与APA精子样品之间发现了相当大的DNA甲基化变化,但没有观察到小RNA的差异表达(数据未显示),这表明miRNA调节不是受父亲年龄增长影响的表观遗传机制。
在父亲衰老时,精子与胚泡甲基化组之间的DMR相关基因存在高度显著的重叠,这表明相同的基因组区域受到甲基化失调的影响。数据集中的甲基化改变并非跨基因组随机分布,而是聚集在某些染色体位置处。亚端粒区域高度富集甲基化改变,尤其是精子和胚泡两者的细胞带19p13.3。此细胞带包含大量基因(仅次于细胞带16p13.3,在所有三组中也很显著)。访问这些基因可能需要更松散的染色质构象,从而产生对表观遗传改变的脆弱性。像这样的亚端粒区域的甲基化可能会逃避大规模的表观遗传重新编程事件,并且因此具有潜在的破坏和传递给后代的敏感性。
由于甲基化改变不是随机分布的,这表明APA精子中的染色质包装的特定特征容易受到表观遗传误差的影响,从而导致胚泡中的相同区域内的异常重新编程。发明人假设在APA精子中鉴定的DMR与保留的组蛋白区域共定位。在精子发生期间,大部分组蛋白被鱼精蛋白交换,但多达15%的核小体保留在CpG密度高的区域,并富集在具有发育重要性的基因座处,包含发育基因启动子、印记基因座和编码miRNA的基因(de Vries等人,2013;Hammoud等人,2009)。通过将上文提供的数据与假定与保留的组蛋白结合的先前通过Hammoud等人,2009的ChIP数据鉴定的数据进行比较,与核小体保留相关的APA精子DMR相关基因的统计学显著富集。对于在精子和胚泡数据集两者中鉴定的定向重叠DMR,观察到了相当的富集。因此,由年龄增长引起的父亲种系甲基化改变在染色质环境中传递。具体地,低甲基化的DMR更可能与基因相关,与CpG岛和侧接区域相关,并且更可能与单核小体共定位。令人惊讶的是,虽然DMR相关基因与保留的组蛋白显著共定位,但只有少数DMR位于编码miRNA的基因附近,对APA精子中的miRNA表达没有显著影响。
APA精子和胚泡DMR均表现出与自闭症谱系障碍、精神分裂症和双相情感障碍相关的神经发育基因的显著富集。已知这些神经精神病状的发病率会随着父亲年龄的增加而逐渐增加(de Kluiver等人,2017),同样DNA甲基化改变与这些病症相关(Rutten和Mill,2009;Wockner等人,2014;Wong等人,2014)。基因组印记是一种表观遗传现象,它利用DNA甲基化将基因表达限制在仅一个遗传的等位基因上。印记基因在大脑发育中发挥关键作用,并且因此可能促成神经发育病症的病因(Crespi,2008)。许多印记障碍具有自闭症样特性,包含贝克威思-威德曼综合征综合征(Beckwith–Wiedemann syndrome)(chr11p15.5)、安格尔曼综合征(Angelman syndrome)和普拉德-威利综合征(Prader–Willi syndrome)(chr15q11-13)(Crespi,2008)。鉴于印记在种系中建立并通过逃避广泛的表观遗传重新编程而在后代中持续存在,因此考虑其涉及介导APA效应是合理的。事实上,高龄父亲年龄与小鼠模型中的大脑表达的印记基因座的甲基化差异相关,并伴有行为变化(Smith等人,2013)。两个APA数据集都展示了各种人类印记基因。DLGAP2与自闭症的发展有关(Nardone等人,2014;Rasmussen、Rasmussen和Silahtaroglu,2017;Soler等人,2018),在APA精子组和胚泡组中均显著低甲基化。另外,经典负责贝克威思-威德曼综合征综合征(chr11p15.5)的细胞带在APA精子以及DMR相关基因的重叠组中受到显著影响。KCNQ1的低甲基化在APA精子和胚泡中是统计学上显著的,并在APA精子样品中得到验证,这与先前观察到的老年人类精子的低甲基化一致(Jenkins等人,2014)。
后代的神经发育障碍也可能表现为APA精子中与神经发育和功能相关的基因的表观遗传误差,包含阿片类信号传导通路。阿片类信号传导被鉴定为影响APA精子和胚泡以及组合定向重叠DMR的主要通路,并由所有三个自闭症谱系障碍、精神分裂症和双相情感障碍的候选基因列表共享。自闭症大脑的额叶皮层也显著富集阿片类信号传导通路中的基因,并与APA精子和胚泡DMR相关基因列表显著重叠(Nardone等人,2014)。大脑中的阿片类信号传导通路是涉及情绪调节的神经递质系统,并且异常的大脑阿片类活性可能在神经发育障碍的发生中起作用。据报道,自闭症和精神分裂症病例中阿片类受体增加(Pellissier、Gandia、Laboute、Becker和Le Merrer,2018;Volk、Radchenkova、Walker、Sengupta和Lewis,2012),并且阿片成瘾症状与自闭症症状之间有很强的类似性(Kalat,1978)。相反,自闭症样症状已被证明可通过阿片类阻断在严重精神障碍者中减弱(Sandman等人,1983)。这些相反的反应表明,阿片类信号传导通路需要微妙的平衡,其中过量或缺乏都可能产生自闭症样症状(Pellissier等人,2018)。
CACNA1H是阿片类信号传导通路中鉴定的一种基因。它编码CaV3.2,这是一种在大脑中大量表达的T型钙通道,并且与神经元功能和大脑发育有关。它与阿片类信号传导通路中的阿片类受体相互作用以介导镇痛(Altier和Zamponi,2008),并且在患有自闭症谱系障碍的患者中发现了错义突变(Splawski等人,2006)。与年轻时的同一个体相比,先前在老年人类精子中观察到CACNA1H的低甲基化(Jenkins等人,2014)。不仅在APA精子甲基化组和验证数据中证实了这同一基因的异常DMR低甲基化,而且在源自APA父亲的胚胎中评估和验证了植入前胚泡甲基化组的DMR低甲基化。显然,CACNA1H在胚泡中需要一定程度的甲基化保留,然后在源自APA父亲的那些中丢失。改变的CaV3.2钙通道活性最终可能导致这些后代的神经元功能和大脑发育受到影响。
精子发生期间的DNA甲基化易受可以传播到下一代的误差的影响。虽然可以分析大部分精子射出精液的表观遗传改变,但受精中使用的单个精子中只有一种甲基化模式具有潜在遗传到胚泡的可能性。
APA对人类群体的影响是微妙的和变化的,并且同样,由于症状严重程度的范围很大,神经发育障碍也存在于一个范围内。并非每个APA父亲所生的孩子都是自闭症患者。因此,期望所有APA父亲或衍生的APA胚泡的精子DNA甲基化发生剧烈变化(类似于基因突变或敲除)是不合理的。
累积风险的阈值存在于精子中的异常表观遗传改变,如果超过,最终导致疾病易感性并最终在后代中观察到表型。上述数据证实了随着精子年龄的增长,DNA甲基化谱越来越受损,并证明了与APA相关的人类甲基化景观改变的精子和胚胎的代际相关性,对与神经发育障碍相关的基因具有显著易感性。
- 一种用于SCID遗传病筛查的引物、检测试剂盒及检测方法
- 免疫测定方法、用于鉴定免疫测定的系统和试剂盒
- 用于确定精子表观基因组的年龄相关改变对后代表型的影响的系统和方法
- 用于鉴定样本中失调基因的方法、试剂盒
