CTSS在皮肤纤维瘤中的应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及CTSS的医药用途,具体涉及CTSS在皮肤成纤维增殖与分化活性相关的疾病的应用,尤其是CTSS在皮肤纤维瘤中的应用。
背景技术
皮肤纤维瘤(dermatofibroma,DF),又名良性纤维组织细胞瘤(benign fibroushistiocytoma ,BFH),皮肤纤维瘤是成纤维细胞或组织细胞灶性增生引致的一种真皮内的良性肿瘤,是一种常见的皮肤病变,约占一个皮肤病理学实验室收到的皮肤病变标本的3%。 它的发生机制尚不明确,多认为是微小皮肤损伤所引起的一种反应性纤维增生。本病好发于中青年,女性多见,可见于身体任何部位,但以四肢较为多见,常表现为单发褐色皮肤结节,组织病理学上主要由成纤维细胞和组织细胞构成。典型皮肤纤维瘤易于诊断,但由于其在组织学上谱系广泛,且表现各异,这就给诊断带来了一定困难。该病的治疗方法以手术治疗和保守治疗为主。
CTSS是一种分泌蛋白酶,在多种器官纤维性疾病中发挥重塑多种细胞外基质成分的作用,如胶原蛋白和纤连蛋白。据以往报道,CTSS参与了肺肉芽肿、囊性纤维化样肺病等多种纤维化疾病的发展,CTSS在肺囊性纤维化患者中上调,靶向干预CTSS的表达减少了气道炎症。干预组织蛋白酶降解弹性胶原的过程可有效抑制皮肤老化。然而,CTSS在皮肤纤维疾病,尤其是皮肤纤维瘤形成中的作用仍未得到解答。
本领域迫切需要寻求皮肤纤维瘤诊断标志物,以及将标志物抑制剂应用到皮肤纤维瘤医药中,这是亟需要解决的技术问题。
发明内容
本发明旨在提供干预ctss表达或抑制其活性片段用于预防或治疗皮肤纤维瘤的医药用途。
为了实现上述目的,本发明提供了如下技术方案。
CTSS的表达水平的检测试剂制备辅助诊断皮肤成纤维增殖与分化活性相关的疾病产品中的应用。
进一步的,所述应用包括CTSS的表达水平的检测试剂制备辅助诊断皮肤纤维瘤产品中的应用
进一步的,所述的皮肤成纤维增殖与分化活性相关的疾病诊断筛查的产品以CTSS基因或CTSS蛋白作为诊断标记物。
进一步的,所述的CTSS表达水平在皮肤成纤维增殖与分化活性相关的疾病中表达上调。
进一步的,所述的诊断产品为芯片、制剂或试剂盒。
本发明提供CTSS抑制剂在制备用于治疗皮肤成纤维增殖与分化活性相关的疾病药物中的应用。
进一步的,包括CTSS抑制剂在制备用于治疗皮肤纤维瘤药物中的应用。
进一步的,所述CTSS抑制剂抑制人成纤维细胞分化,所述CTSS抑制剂通过抑制CTSS基因表达达到抑制皮肤纤维瘤的发生和发展。
进一步的,所述CTSS抑制剂的包括CTSS抑制剂LY30003283。
进一步的,所述CTSS抑制剂的包括shRNA干扰靶序列,所述shRNA的核苷酸序列如SEQ ID NO.1所示;所述shRNA的核苷酸序列如SEQ ID NO.2所示;所述shRNA的核苷酸序列如SEQ ID NO.3所示。
进一步地,所述药物为任何药物治疗学上可接受的剂型。
进一步地,所述药物为任何药物治疗学上可接受的剂量。
与现有技术相比本发明的有益效果。
发明人通过大量实验发现,在建立的模型中,ctss表达明显上调;反之,注射ctss抑制剂的小鼠改善皮肤纤维瘤。
在人体皮肤纤维瘤皮肤组织中,ctss表达明显上调。
细胞学水平发现,抑制ctss表达后可以抑制成纤维细胞分化,进而抑制皮肤纤维瘤发生和发展。
以上结果表明,ctss在皮肤纤维瘤过程中起重要调控作用。
附图说明
图1是人正常皮肤和皮肤纤维瘤组织中的CTSS mRNA表达水平。
图2是人正常皮肤和皮肤纤维瘤组织中的CTSS的蛋白表达水平。
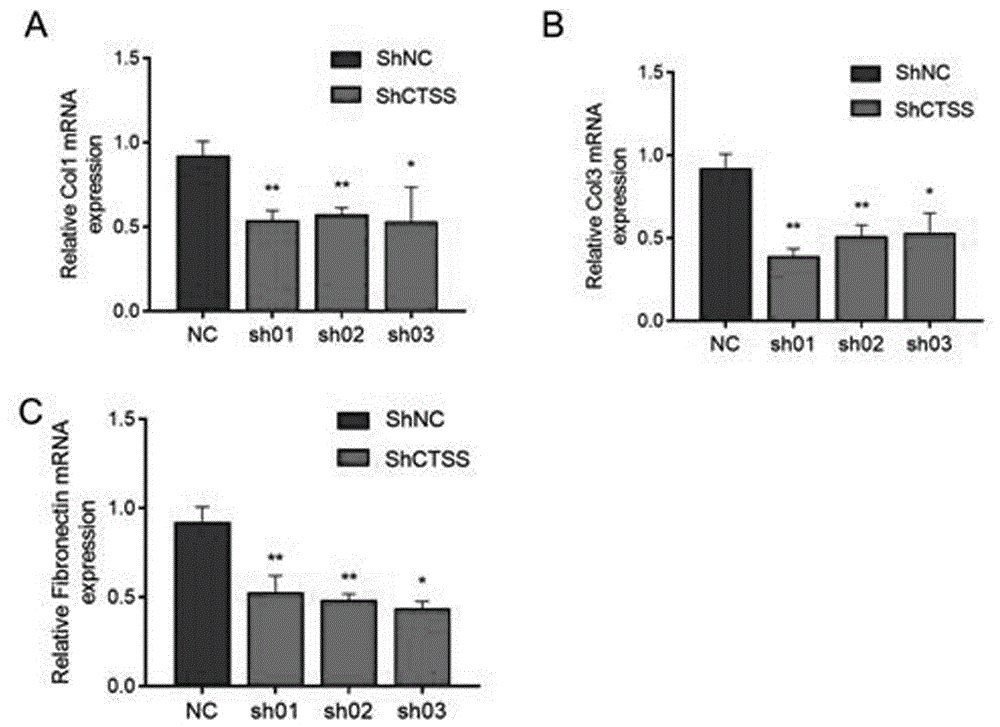
图3是敲低CTSS后,I型胶原蛋白(collagenI,Col1)、III型胶原蛋白(collagenIII,Col3)和纤连蛋白(fibronectin,Fn)的mRNA表达图。
图4是敲低CTSS后,I型胶原蛋白(collagenI,Col1)、III型胶原蛋白(collagenIII,Col3)和纤连蛋白(fibronectin,Fn)的蛋白表达图。
图5是对照小鼠和LY3000328治疗小鼠病变面积表达图。
图6是两组的H&E染色图和α-SMA IHC染色图像及对应的病变面积表达图。
具体实施方式
实施例1。
1、皮肤组织或细胞中总RNA提取及qRT-PCR。
1.1、组织中总RNA提取。
向装有组织的Ep管中加入1mlTrizol裂解液,使用低温组织匀浆仪充分裂解组织至均一状态。冰上静置组织10min等待进一步裂解充分。向EP管中加入200μL氯仿,使用涡旋机充分震荡15s将液体混匀,静置于冰上10min。之后使用低温离心机按12000g离心10min,取上层透明液体于新的EP管中,并加等体积异丙醇,上下颠倒混匀,静置于冰上10min。之后使用低温离心机按12000g离心10min。弃上清,加入1ml 75%乙醇清洗沉淀,使用低温离心机按7000g离心5min,弃上清。使用滤纸吸干乙醇并置于通风橱将残留液体挥发。使用去RNA酶水溶沉淀,进行后续实验。
1.2、RNA定量、逆转录,实时荧光定量PCR。
RNA定量:用 NanoDrop 2000分光光度计检测 RNA 在260mm 和 280mm 处的吸光度,获得比值,若A260/A 280位于1.8-2.0,表示RNA的纯度较好,测得的RNA浓度可以用于后续实验。
RNA逆转录:将RNA反转录成为cDNA,按照以下步骤进行。
表1 去基因组DNA反应体系。
。
反应条件:42℃加热 2 min;降温至4℃。反应体积:10μL。
表2 cDNA合成反应体系。
。
反应调节:37℃ 15min;85℃ 5 s;降温至4℃。反应体积:20μL
反转录结束后进行实时荧光定量PCR,以下是反应体系。
表3 PCR反应体系。
。
反应条件:第一阶段,预变性:95℃,5min;第二阶段,循环反应:95℃,15s;60℃,45s(40循环);第三阶段,溶解曲线:95℃,15s;60℃,60s,95℃,15s。
表4 PCR引物序列。
。
试验结论:如图1中所示,CTSS的mRNA在皮肤纤维瘤患者的皮肤组织中均显著增加。
Western-Blot方法检测细胞纤维瘤中ctss表达情况。
Western-Blot实验:实验组为皮肤纤维瘤组织,对照组为正常皮肤。
蛋白提取和定量:将待检测样本置于冰上,以1:100配置PMSF与RIPA混合溶液,根据细胞和组织的量和大小酌情加入混合液。私用组织研磨仪和超声破碎组织,低温置于冰上30min。按照4℃,15000g离心25min样本。去上层清液于新的EP管中,标记好样品名称。按照BCA试剂盒配置并检测总蛋白浓度,按照比例配置蛋白混合溶液并加入6xloadingbuffer混匀,95℃加热5min,进行后续实验或-20℃保存。
配胶:按试剂盒说明书配置浓缩胶和分离胶,先将分离胶快速加入玻璃板槽内,使用去离子水压齐胶上层平面。20min左右会看到胶体与水面间出现明显分界,弃上层水,使用滤纸吸干残留液体。将浓缩胶加入槽中,将梳子延槽壁从左往右水平插入,挤出多余气泡。待胶体完全凝固后,进行后续阶段实验。
电泳:将配好的胶放入电泳槽中,使用1x电泳液,拔梳子,按照所需蛋白量加入对应的体积,前后两端加入marker标记位置。浓缩胶电压初始为80V,后转为100V进行分离,至溴酚蓝跑出分离胶底部可停止。
转印:取出电泳后的凝胶,使用1x转印液,采用“湿转法”进行转印,“黑胶白膜”一一对应组装湿转装置,固定在转印槽中。按照90V恒压转印1h左右,转印时使用冰对转印槽进行降温。
一抗孵育:将转印后的PVDF膜取出,使用TBST洗3次,按照目的条带位置裁剪膜,使用目的基因的抗体于孵育盒中孵育,4℃摇床孵育过夜。
二抗孵育和化学发光:隔日回收一抗,TBST于摇床上清洗膜3次,每次10min,配置对应二抗室温孵育1-2h。使用TBST于摇床上洗膜3次,每次10min。使用发光液进行曝光成像,保存图片后进行分析。蛋白的表达情况采用相对光密度来表示,以GAPDH为内参,保证实验结果独立重复3次以上。
试验结论;如图2所示,人类皮肤纤维瘤组织中CTSS的蛋白表达明显增加。
实施例2。
1、ctss低表达皮肤成纤维细胞模型的建立。
通过shRNA干扰技术敲低质粒和对照,shRNA干扰靶序列:SEQ ID NO.1:CTSSshRNA01(Human):GGGAATGCACTCATACGATCT;SEQ ID NO.2:CTSS shRNA02(Human):GCTTCATGACAACGGCTTTCC;SEQ ID NO.3:CTSS shRNA03(Human):GGATATATTCGGATGGCAAGA。
shRNA干扰实验中使用的siRNA购自辽宁百昊生物合成,具体步骤如下。
使用JetPRIME试剂转染,在每孔2 mL培养基中用1.8μg质粒转染HSFs。6小时候换液,累积培养48h后收获细胞。
荧光实时定量PCR(Real-time PCR)方法检测检测ctss低表达对标志物I型胶原蛋白(collagenI,Col1)、III型胶原蛋白(collagenIII,Col3)和纤连蛋白(fibronectin,Fn)表达的影响。
提取试验组和对照组皮肤成纤维细胞中总RNA,比较CTSS表达对人成纤维细胞在细胞纤维瘤形成过程中的影响,实验组为人皮肤成纤维细胞(HSFs)转染 CTSS 敲低质粒,对照组为人皮肤成纤维细胞(HSFs)转染空白对照。
2.1、组织中总RNA提取。
向装有组织的Ep管中加入1mlTrizol裂解液,使用低温组织匀浆仪充分裂解组织至均一状态。冰上静置组织10min等待进一步裂解充分。向EP管中加入200μL氯仿,使用涡旋机充分震荡15s将液体混匀,静置于冰上10min。之后使用低温离心机按12000g离心10min,取上层透明液体于新的EP管中,并加等体积异丙醇,上下颠倒混匀,静置于冰上10min。之后使用低温离心机按12000g离心10min。弃上清,加入1ml 75%乙醇清洗沉淀,使用低温离心机按7000g离心5min,弃上清。使用滤纸吸干乙醇并置于通风橱将残留液体挥发。使用去RNA酶水溶沉淀,进行后续实验。
2.2、RNA定量、逆转录,实时荧光定量PCR
RNA定量:用 NanoDrop 2000分光光度计检测 RNA 在260mm 和 280mm 处的吸光度,获得比值,若A260/A 280位于1.8-2.0,表示RNA的纯度较好,测得的RNA浓度可以用于后续实验。
RNA逆转录:将RNA反转录成为cDNA,按照以下步骤进行。
表5 去基因组DNA反应体系。
。
反应条件:42℃加热 2 min;降温至4℃。反应体积:10μL。
表6 cDNA合成反应体系。
。
反应调节:37℃ 15min;85℃ 5 s;降温至4℃。反应体积:20μL
反转录结束后进行实时荧光定量PCR,以下是反应体系。
表7PCR反应体系。
。
反应条件:第一阶段,预变性:95℃,5min;第二阶段,循环反应:95℃,15s;60℃,45s(40循环);第三阶段,溶解曲线:95℃,15s;60℃,60s,95℃,15s。
表8 PCR引物序列。
。
qRT-PCR结果统计分析
每个样本设置3个重复孔以减少实验误差。检测样本中要检测的目的基因和对应内参的Ct值。采用相对定量的方法计算各样本中ΔCt值(ΔCt=Ct目的-Ct内参),ΔΔCt=ΔCt目的-ΔCt内参平均值,最终计算 2
结果见图3:敲低CTSS后,I型胶原蛋白(collagenI,Col1)、III型胶原蛋白(collagenIII,Col3)和纤连蛋白(fibronectin,Fn)的转录水平明显低于对照组,抑制CTSS的表达可减少皮肤纤维瘤形成。
3、Western blot检测ctss低表达对标志物I型胶原蛋白(collagenI,Col1)、III型胶原蛋白(collagenIII,Col3)和纤连蛋白(fibronectin,Fn)表达的影响。
蛋白提取和定量:将实验组和对照组样本置于冰上,实验组为人皮肤成纤维细胞(HSFs)转染 CTSS 敲低质粒,对照组为人皮肤成纤维细胞(HSFs)转染空白对照。
以1:100配置PMSF与RIPA混合溶液,根据细胞和组织的量和大小酌情加入混合液。私用组织研磨仪和超声破碎组织,低温置于冰上30min。按照4℃,15000g离心25min样本。去上层清液于新的EP管中,标记好样品名称。按照BCA试剂盒配置并检测总蛋白浓度,按照比例配置蛋白混合溶液并加入6xloadingbuffer混匀,95℃加热5min,进行后续实验或-20℃保存。
配胶:按试剂盒说明书配置浓缩胶和分离胶,先将分离胶快速加入玻璃板槽内,使用去离子水压齐胶上层平面。20min左右会看到胶体与水面间出现明显分界,弃上层水,使用滤纸吸干残留液体。将浓缩胶加入槽中,将梳子延槽壁从左往右水平插入,挤出多余气泡。待胶体完全凝固后,进行后续阶段实验。
电泳:将配好的胶放入电泳槽中,使用1x电泳液,拔梳子,按照所需蛋白量加入对应的体积,前后两端加入marker标记位置。浓缩胶电压初始为80V,后转为100V进行分离,至溴酚蓝跑出分离胶底部可停止。
转印:取出电泳后的凝胶,使用1x转印液,采用“湿转法”进行转印,“黑胶白膜”一一对应组装湿转装置,固定在转印槽中。按照90V恒压转印1h左右,转印时使用冰对转印槽进行降温。
一抗孵育:将转印后的PVDF膜取出,使用TBST洗3次,按照目的条带位置裁剪膜,使用目的基因的抗体于孵育盒中孵育,4℃摇床孵育过夜。
二抗孵育和化学发光:隔日回收一抗,TBST于摇床上清洗膜3次,每次10min,配置对应二抗室温孵育1-2h。使用TBST于摇床上洗膜3次,每次10min。使用发光液进行曝光成像,保存图片后进行分析。蛋白的表达情况采用相对光密度来表示,以GAPDH为内参,保证实验结果独立重复3次以上。
结果见图4:与对照组相比,shRNA干扰的皮肤成纤维细胞中,与皮肤纤维瘤和组织纤维化呈正相关的各种细胞外基质包括I型胶原蛋白(collagenI,Col1)、III型胶原蛋白(collagenIII,Col3)和纤连蛋白(fibronectin,Fn)的表达均下降,表明成纤维细胞向肌成纤维细胞分化的活力下降。体外实验表明抑制CTSS的表达可抑制皮肤纤维瘤形成。
实施例3。
1、成年期小鼠纤维组织增生模型建立及表达
动物:4周龄SCID小鼠,方法:将人的皮肤纤维瘤组织皮片移植到小鼠背部,造模时间:1周。将12只小鼠随机分为两组,从第4天至第14天每天一次,一组皮内注射100ul(10mg/kg溶于10%DMSO)CTSS抑制剂(LY3000328,MedChemExpress),一组注射溶剂。14天后统一处死小鼠并获得皮肤样本用于后续实验。
如图5所示,LY3000328明显减轻了了纤维组织增生的生长。
2、制备组织石蜡切片和苏木素-伊红染色(hematoxylin-eosin,H&E)。
组织包埋切片:将新鲜正常小鼠皮肤组织和建模型的小鼠皮肤组织浸泡在4%多聚甲醛溶液里,48h固定组织,之后用于梯度酒精进行脱水(酒精浓度75% 2小时;浓度85% 2小时;浓度95%过夜;浓度100% 2小时)。然后依次在两个二甲苯缸中浸泡半小时,浸入60℃石蜡2小时。在浸蜡前确保提前将组织包埋机预热。浸蜡后的组织置于组织包埋盒中,进行石蜡包埋。后放在-20℃冷台中等待脱模。固定皮肤切割方向,制成厚度5μm的防脱石蜡切片,烤片2-4小时待用。
H&E染色:切片依次置于二甲苯缸I和II中脱蜡(2个二甲苯缸内各30分钟),在梯度酒精中依次进行复水(浓度100% I:10分钟,浓度100% II:10分钟,浓度100% III:10分钟,浓度95% 10分种,浓度85% 10分钟,浓度75% 10分钟),之后置于去离子水静置水化,苏木素染色10分钟,将玻片和架子置于流水下方返蓝30-40分钟去除余色,0.7%盐酸乙醇分化10秒钟。伊红染液染色1分钟,梯度酒精脱水(浓度75% 5分钟,浓度85%5分钟,浓度95% 5分钟,浓度100%
3、免疫组化。
切片先按照上述步骤中的时间和顺序进行脱蜡、脱水、水化。配置抗原修复液500ml于大烧杯中,锡箔纸封住杯口微波炉加热至沸腾后放入切片10min在烧杯中,后再一起加热修复液和切片至液体沸腾后取出烧杯,静置到室温,PBS浸润洗3洗,每次5min。用组化笔将组织位置圈出,使用组化试剂盒,片子的水尽量甩干,保证组织周边不可留水分。滴加A液,室温下孵育半小时,PBS洗3次,每次5min;滴加B液,PBS洗3次,每次5min;向组织滴加检测的稀释后抗体(PBS稀释)或阴性对照(PBS),4℃孵育过夜;次日PBS洗3次,每次5min,向组织滴加C液,室温孵育半小时;PBS洗3次,每次5min,向组织滴加D液,室温孵育半小时。DAB显色,使用苏木素(1:4比例稀释原液)染核3min,流水返蓝40min,梯度酒精脱水后封片,拍照。
我们在C57B1/6J小鼠的皮肤纤维瘤模型中研究了CTSS抑制剂对皮肤纤维瘤形成的影响。由于CTSS在成纤维细胞中促进了皮肤纤维瘤相关的细胞外基质的合成和沉积,我们将CTSS抑制剂——LY3000328在皮肤纤维瘤形成的肉芽和增殖阶段应用于小鼠。我们的结果表明,连续使用10天LY3000328明显减轻了了皮肤纤维瘤的生长,抑制率为65.1%(造模第14天)。同时,如图6所示皮肤纤维瘤组织的H&E染色显示LY3000328显著减少了皮损的横截面积。肌成纤维细胞标志物α-SMA的IHC染色结果表明LY3000328可有效抑制肌成纤维细胞活化,进一步抑制皮肤纤维瘤形成。
- ClZISO基因在制备黄瓤西瓜中的应用以及在鉴定黄瓤西瓜中的应用
- PRCC或其上调剂在肝癌治疗中的应用及PRCC在肝癌诊断或预后中的应用
