具有神经再生性应用的组合物
文献发布时间:2023-06-19 19:30:30
发明领域
本发明涉及治疗性蛋白及其在再生医学领域中的用途。具体而言,本文公开了运铁蛋白及乳铁蛋白的应用及其在促进神经祖细胞或神经干细胞的增殖、诱导、及/或分化中的用途。
背景
神经退行性疾病诸如肌肉萎缩性脊髓侧索硬化症、亨廷顿病、阿尔茨海默病、及帕金森病是以进行性神经元细胞死亡为特征的疾病并且与高发病率、患者痛苦、低生活质量、及高死亡率相关。随着人口结构愈来愈向老年人群转变,社会中神经退行性疾病的患病率正在迅速攀升。随着预期寿命不断提高,预计神经退行性病状将与癌症及心血管疾病竞争,成为将来世代的主要死亡原因。
无例外地,在撰写本文时,尚无经批准的疗法可以治愈或逆转神经退行性疾病的影响。在某些情况下,经批准的药物可以推迟疾病的进展。例如,利鲁唑(riluzole;RILUTEK)及依达拉奉(edaravone;RADICAVA)是两种已获批准的治疗肌肉萎缩性脊髓侧索硬化症的疗法,可推迟疾病的进展,但是一旦疾病的症状出现,这些分子就不能逆转这些症状。
鉴于缺乏治愈性疗法,因此大多数商业上批准的治疗方法是针对症状的就不足为奇了,尤其例如针对帕金森病及运动紊乱的多巴胺能治疗、针对痴呆的行为及心理症状的抗精神病药物以及用于疼痛管理的镇痛药物。
神经保护是可选的治疗神经退行性疾病的非恢复性方法。科学及专利文献中有大量关于神经保护化合物及分子的报告,这些化合物及分子试图限制神经退行性疾病造成的损害并减缓其衰虚进展。
一种这样的实例是以Grifols Worldwide Operations Ltd的名义的美国专利公布第2016008437号,该专利公布公开了原运铁蛋白及全铁运铁蛋白的混合物藉由在许多退行性疾病状态中调节低氧诱导因子(Hypoxia Inducible Factor;HIF)的活性而发挥神经保护作用。类似地,HealthPartners Research Foundation的国际专利申请公布第WO2006/20727号提出使用去铁胺作为低氧诱导因子-1α的调节剂,以便引起针对缺血患者中的再灌注的有害影响的神经保护反应。
尽管以上所述,但是明显地,缺乏能够治愈或逆转神经退行性疾病及状况的虚衰性影响的临床候选药物。经批准的临床疗法仅限于控制疾病的症状,并且对于除了经由神经保护作用及途径来减缓状况进展以外具有更大功效的治疗方法的需求仍未得到满足。能够治愈或至少部分逆转神经损害的创新仍然难以捉摸,因此是非常合乎需要的。
发明描述
用语“包含(comprises/comprising)”及用语“具有/包括”在本文中与本发明有关使用时用于指定存在所陈述特征、整数、步骤或组分但是不排除存在或添加一个或更多个其他特征、整数、步骤、组分或其群组。
本领域技术人员应认识到本文公开的特定实施方案不应孤立地阅读,并且本说明书意图所公开的实施方案彼此组合地阅读,而非个别地阅读。因此,各实施方案可以用作修改或限制本文公开的其他实施方案的基础。
浓度、量、及其他数值数据可在本文中以范围形式来表示或提供。应了解此范围形式仅仅为了方便及简明而使用,并且因此应灵活地理解为不仅包括明确地列举为范围极限的数值,而且包括涵盖于该范围内的所有个别数值或子范围,如同各数值及子范围明确列举一般。作为说明,“10至100”的数值范围应理解为不仅包括明确列举的10至100的值,而且包括所指示范围内的个别值及子范围。因此,在此数值范围中包括个别值诸如10、11、12、13...97、98、99、100及子范围诸如10至40、25至40及50至60等。此相同原则适用于仅列举一个数值的范围,诸如“至少10”。此外,不论所描述范围或特征的广度为何,此解释皆适用。
治疗方法
在第一方面,本发明提供在罹患神经退行性事件的患者中促进及或诱导新神经细胞的产生的方法,该方法包括将治疗有效量的选自运铁蛋白、乳铁蛋白、及其组合的蛋白施用至有相应需要的患者。
本领域技术人员理解在大量的哺乳动物铁结合蛋白之中,运铁蛋白及乳铁蛋白是具有61%序列同一性的运铁蛋白家族的相关蛋白。除了许多重叠及互补功能以外,运铁蛋白及乳铁蛋白亦表现出许多相互独立的功能。本发明在其范围内包括所有野生型哺乳动物运铁蛋白,然而,包含SEQ ID NO:1列出的氨基酸序列的人类运铁蛋白(UniProtKBSeq.No.Q06AH7)为特别优选的。类似地,本发明在其范围内包括所有野生型哺乳动物乳铁蛋白,然而,包含SEQ ID NO:2列出的氨基酸序列的人类乳铁蛋白(UniProtKBSeq.No.P02788)为特别优选的。
野生型运铁蛋白含有两个同源叶(homologous lobes)(N-叶及C-叶),并且各叶结合单一铁原子。因此,各野生型运铁蛋白分子每个分子可结合多达两个铁原子或离子。类似地,各野生型乳铁蛋白分子以类似的方式每个分子可结合两个铁原子。
运铁蛋白及乳铁蛋白可自天然来源提取或替代地使用重组产生/制备过程来制备。合适的天然来源可分别为人类血浆或人乳。
“运铁蛋白”在本说明书中应理解为意指治疗有效量的以下:
·野生型(哺乳动物,优选人类)运铁蛋白、
·其功能突变体、
·其功能片段、或
·其组合。
运铁蛋白、其功能突变体、或其功能片段的铁饱和度可为约50%或更少。优选地,铁饱和度为约40%或更少。在一种实施方案中,铁饱和度为约30%或更少。例如,铁饱和度可为约20%或更少,诸如约10%或更少。在一些实施方案中,铁饱和度为约5%或更少。在仍另一实施方案中,铁饱和度可为少于约1%。为避免任何疑问,本文中表示为小于X%的范围包括0至X%,即绝对没有结合的铁(0%铁饱和度)的运铁蛋白。
如本文使用,“原运铁蛋白(apo-transferrin)”意指具有少于1%的铁饱和度的运铁蛋白。类似地,“全铁运铁蛋白(holo-transferrin)”意指具有99%或更大的铁饱和度的运铁蛋白。
本领域技术人员将认识到运铁蛋白铁饱和水平可在没有过度负担的情况下、藉由量化具有已知运铁蛋白浓度的样品中的总铁水平来容易地测定。样品中的总铁水平可藉由本领域技术人员知道的许多方法中任一种来测量。合适的实例包括:
·比色测定-藉由在562nm处测量在乙酸盐缓冲液中菲洛嗪(ferrozine)与Fe
·感应耦合等离子体原子发射谱(Inductively Coupled Plasma AtomicEmission Spectroscopy;ICP-AES)是对样品中的金属的质量百分比进行量化的发射谱技术。ICP-AES基于使用等离子体(由正离子及自由电子组成的电离气体)来激发样品中的金属原子/离子并且分析该特定金属的典型的电磁辐射的发射波长。虽然该技术是本领域技术人员的公知常识内的标准分析技术,但是关于ICP-AES的其他信息可在
出于本发明的治疗性方法的目的来测定样品的铁含量的优选方法为ICP-AES。然后基于运铁蛋白浓度、样品的总铁含量、及野生型运铁蛋白具有两个铁结合位点的事实来计算运铁蛋白的铁饱和度。野生型人类运铁蛋白(分子量79,750)可结合两个铁原子使得含有1g运铁蛋白的样品将藉由1.4mg铁而变得100%饱和。
在特定样品的运铁蛋白浓度未知的情况下,其可藉由各种较好表征的免疫学方法(ELISA,浊度测定法)及非免疫学方法(吸光度,AU480化学分析)来容易地测定。
在撰写本文时,运铁蛋白尚未在全球任何主要司法管辖区被批准为药物。因此,没有关于运铁蛋白的药典专论。关于运铁蛋白的物理性质诸如铁饱和度的其他信息可自本领域技术人员查阅的主要参考文献获得;参见
“乳铁蛋白”在本说明书中应理解为意指治疗有效量的以下:
·野生型(哺乳动物,优选人类)乳铁蛋白、
·其功能突变体、
·其功能片段、或
·其组合。
乳铁蛋白、其功能突变体、或其功能片段的铁饱和度可为约50%或更少。优选地,铁饱和度为约40%或更少。在一种实施方案中,铁饱和度为约30%或更少。例如,铁饱和度可为约20%或更少,诸如约10%或更少。在一些实施方案中,铁饱和度为约5%或更少。在仍另一实施方案中,铁饱和度可为少于约1%。
如本文使用,“原乳铁蛋白(apo-lactoferrin)”意指具有少于1%的铁饱和度的乳铁蛋白。类似地,“全铁乳铁蛋白(holo-lactoferrin)”意指具有99%或更大的铁饱和度的乳铁蛋白。乳铁蛋白的铁含量、及饱和水平可与以上详细地论述的运铁蛋白类似地测量。
在使用术语运铁蛋白及乳铁蛋白中,本说明书在其范围内包括运铁蛋白及乳铁蛋白的重组衍生物,所述重组衍生物与分别在SEQ ID NO:1及SEQ ID NO:2中概述的人类蛋白的野生型氨基酸序列的不同在于相对于野生型蛋白可不实质性改变重组蛋白的结构、或亲水性质(hydropathic nature)的一个或更多个取代、一个或更多个缺失、或一个或更多个插入。本发明的范围内的运铁蛋白及乳铁蛋白的重组变体可另外包含至少一个翻译后修饰,诸如聚乙二醇化、糖基化、多唾液酸化或其组合。
在一种实施方案中,本发明设想在SEQ ID NO:1及SEQ ID NO:2中具有相对于野生型蛋白的一个或更多个保守取代的运铁蛋白及乳铁蛋白的重组变体。“保守取代”为其中一个氨基酸由具有类似性质的另一氨基酸取代以使得肽化学领域的技术人员可预测多肽的二级结构及亲水性质实质上不会改变的取代。总体上,以下氨基酸群组内的变化代表保守变化:(1)ala、pro、gly、glu、asp、gln、asn、ser、thr;(2)cys、ser、tyr、thr;(3)val、ile、leu、met、ala、phe;(4)lys、arg、his;及(5)phe、tyr、trp、his。
例如,本发明的治疗方法范围内的重组运铁蛋白或乳铁蛋白可与分别在SEQ IDNO:1及SEQ ID NO:2中概述的野生型人类运铁蛋白及人类乳铁蛋白具有至少90%、95%、96%、97%、98%或99%同源性。
在另一实施方案中,本发明包括运铁蛋白及/或乳铁蛋白的特定突变体形式,所述突变体形式保持其结构但是防止蛋白在一个或另一个铁结合结构域处与铁结合,例如N-叶、C-叶或其组合。
本发明的范围内的运铁蛋白突变体包括但不限于:
i)Y188F突变体N叶(SEQ ID NO:3);
ii)Y95F/Y188F突变体N叶(SEQ ID NO:4);及
iii)Y426F/Y517F突变体C叶(SEQ ID NO:5)。
本领域技术人员将认识到重组蛋白可利用在蛋白表达、产生及纯化技术中熟知的标准技术来获得。所关注的重组蛋白的核酸序列可插入适合于在选定宿主细胞中表达的任何表达载体中,例如哺乳动物细胞、昆虫细胞、植物细胞、酵母及细菌。
如本文使用,术语“表达载体”是指能够将蛋白表达构建体引入宿主细胞中的实体。一些表达载体亦在宿主细胞内部复制,从而增加藉由蛋白表达构建体的蛋白表达。一种类型的载体为“质粒”,其是指其内可连接其他DNA区段的环状双链DNA环。其他载体包括黏粒、细菌人工染色体(bacterial artificial chromosome;BAC)及酵母人工染色体(yeastartificial chromosome;YAC)、fosmid、噬菌体及噬菌粒。另一类型的载体为病毒载体,其中其他DNA区段可连接至病毒基因组中。某些载体能够在其引入其中的宿主细胞中自主复制(例如,具有在宿主细胞中起作用的复制起点的载体)。其他载体在引入宿主细胞中时可整合至宿主细胞的基因组中,并藉此连同宿主基因组一起复制。此外,某些优选载体能够引导其可操作地连接的基因的表达。
合适的细菌细胞包括大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillussubtilis)、鼠伤寒沙门氏菌(Salmonella typhimurium)、假单胞菌属的种(Pseudomonasspp.)、链霉菌属的种(Streptomyces spp.)、及葡萄球菌属的种(Staphylococcus spp.)。合适的酵母细胞包括酵母属的种(Saccharomyces spp.)、毕赤酵母属的种(Pichia spp.)及克鲁维酵母属的种(Kuyveromyces spp.)。合适的昆虫细胞包括衍生自中国桑蚕(Bombyxmori)、甘蓝夜蛾(Mamestra brassicae)、草地贪夜蛾(Spodoptera frugiperda)、粉纹夜蛾(Trichoplusia ni)及黑腹果蝇(Drosophila melanogaster)的昆虫细胞。此类哺乳动物宿主细胞包括但不限于CHO、VERO、BHK、HeLa、COS、MDCK、W138、BT483、Hs578T、HTB2、BT2O及T47D、NS0、CRL7O3O、HsS78Bst、人类肝细胞癌细胞(例如HepG2)、人类腺病毒转化的293细胞(例如HEK293)、PER.C6、小鼠L-929细胞、HaK仓鼠细胞系、衍生自Swiss、Balb-c或NIH小鼠的鼠3T3细胞及CV-1细胞系细胞。
本发明亦设想缀合或融合至任何其他蛋白、蛋白片段、蛋白结构域、肽、小分子或其他化学实体的野生型及重组运铁蛋白及乳铁蛋白的用途。例如,合适的融合或缀合配偶体包括血清白蛋白(例如,牛、兔或人类)、匙孔血蓝蛋白、免疫球蛋白分子(包括Fc结构域免疫球蛋白)、甲状腺球蛋白、卵白蛋白、破伤风类毒素、或来自其他病原性细菌的类毒素、或减毒毒素衍生物、细胞因子、趋化因子、胰高血糖素样肽-1、激动肽-4(exendin-4)、XTEN或其组合。
在本发明的一种实施方案中,用于本发明的方法中的运铁蛋白及乳铁蛋白是具有经改良的体内半衰期的融合蛋白,其中:
·野生型(哺乳动物,优选人类)运铁蛋白或乳铁蛋白融合至选自免疫球蛋白Fc结构域及白蛋白的融合配偶体;或
·本发明的方法的范围内的突变体运铁蛋白或乳铁蛋白融合至选自免疫球蛋白Fc结构域及白蛋白的融合配偶体。
在一种实施方案中,优选的融合配偶体为免疫球蛋白Fc结构域。例如,免疫球蛋白Fc结构域可包含恒定重链免疫球蛋白结构域的至少一部分。恒定重链免疫球蛋白结构域优选为包含CH2及CH3结构域的Fc片段及任选地铰链区的至少一部分。免疫球蛋白Fc结构域可为IgG、IgM、IgD、IgA或IgE免疫球蛋白Fc结构域,或由其衍生的经修饰免疫球蛋白Fc结构域。优选地,免疫球蛋白Fc结构域包含恒定IgG免疫球蛋白Fc结构域的至少一部分。IgG免疫球蛋白Fc结构域可选自IgG1、IgG2、IgG3或IgG4Fc结构域或其经修饰Fc结构域。
在一个种实施方案中,融合蛋白可包含融合至IgG1 Fc结构域的运铁蛋白。在一种实施方案中,融合蛋白可包含融合至IgG1 Fc结构域的运铁蛋白突变体。
神经退行性事件
令人惊讶地,本发明人发现运铁蛋白及乳铁蛋白在铁结合/递送至细胞之外具有意想不到的治疗作用,因为这两种蛋白在刺激来自神经祖细胞及/或神经干细胞的神经细胞的发育方面非常有效。因此,本发明提供在罹患神经退行性事件的患者中刺激神经细胞发育的方法,该方法包括向有相应需要的患者施用治疗有效量的选自运铁蛋白、乳铁蛋白、及其组合的蛋白。
如本文使用,术语“刺激神经细胞发育”用于意指运铁蛋白或乳铁蛋白对于患者的神经祖细胞及/或神经干细胞具有直接或间接作用以便产生新神经细胞。不希望限制本发明的普遍性,认为与未暴露于运铁蛋白、或乳铁蛋白的神经祖细胞/神经干细胞相比,施用运铁蛋白或乳铁蛋白导致以下中的至少一种增加:
i)患者体内的神经祖细胞及/或神经干细胞的增殖,或
ii)诱导神经祖细胞及/或神经干细胞分化成经分化的神经细胞。
“神经细胞”在本说明书中包括神经系统的所有细胞,包括但不限于神经胶质细胞及神经元细胞。在一种实施方案中,在本发明的方法中涉及的神经细胞是神经元细胞并且运铁蛋白及乳铁蛋白增强新神经元细胞的神经发生(neurogenesis)。
如本文使用,术语“神经退行性事件”是指引起神经细胞的结构及/或功能损失的事件并且包括神经细胞死亡。该事件可为导致立即神经细胞损害或死亡的孤立一次性事件/发生。或者,该事件可为逐步导致神经细胞损害或死亡水平增加的连续或慢性事件。在特定实施方案中,神经退行性事件引起大脑及/或脊髓中的结构损失、功能损失、或神经元细胞(或神经元)死亡,导致大脑及/或脊髓损害及功能障碍。
在一种实施方案中,神经退行性事件由神经退行性疾病导致。“神经退行性疾病”意指以神经元的功能异常及/或死亡为特征,导致大脑、脊髓、中枢神经系统、及/或周围神经系统的神经功能损失的任何疾病。本发明的范围内的神经退行性疾病可为慢性或急性的。
本发明范围内的神经退行性疾病的非限制性实例包括帕金森病、额颞叶痴呆、阿尔茨海默病、轻度认知障碍、弥漫性路易氏体病、路易氏体型痴呆、脱髓鞘病如多发性硬化症及急性横贯性脊髓炎,肌肉萎缩性脊髓侧索硬化症、亨廷顿病、克雅氏病、皮质基底节变性、周围神经病变、进行性核上性麻痹、脊髓小脑变性、脊髓性共济失调、Friedreich共济失调(Friedreich's ataxia)、小脑皮质变性、神经源性肌萎缩症、前角细胞变性、婴儿脊髓性肌萎缩症及青少年脊髓性肌萎缩症、亚急性硬化性全脑炎、Hallervorden-Spatz病、拳击性痴呆、皮克病、tau蛋白病、突触核蛋白病(synucleinopathies)及其组合。
在一种实施例中,神经退行性疾病可选自由以下组成的组:帕金森病、阿尔茨海默病、多发性硬化、肌肉萎缩性脊髓侧索硬化症、及亨廷顿病。例如,神经退行性疾病可为帕金森病。
作为非限制性/非束缚性理论,已知神经退行性伤害或损伤导致神经干细胞迁移至此伤害或损伤部位。参见
本领域技术人员应认识到以上段落内公开的特定实施方案不应孤立地阅读,并且本说明书意图所公开的这些实施方案与其他实施方案组合,而非个别地公开。例如,公开的各实施方案应诠释为明确地与各实施方案或其中公开的实施方案中的2种或更多种的任何排列的组合。
组合疗法
本发明的方法亦设想与运铁蛋白及/或乳铁蛋白组合的辅助活性化合物及分子的用途。辅助活性化合物及分子可与运铁蛋白、或乳铁蛋白共配制为单位剂型,即意图作为用于待治疗的受试者的单一剂量的物理上离散的单位。或者,辅助活性化合物及分子可以部件试剂盒(kit-of-parts)形式呈现,并且:
·与运铁蛋白及/或乳铁蛋白分开地,以分阶段或依序给药模式来施用;或
·同时从不同剂型来共同施用。
例如,本发明的方法设想施用与运铁蛋白、及/或乳铁蛋白组合的其他基于血清或血浆的蛋白。本发明的范围内的血清或血浆蛋白包括从合适的血浆来源诸如人类血浆纯化的蛋白、及使用重组制备技术制备的蛋白。例如,血清或血浆蛋白可选自由以下组成的组:白蛋白(例如ALBUTEIN)、α-1抗胰蛋白酶/α-1蛋白酶抑制剂(例如PROLASTIN)、抗凝血酶(例如THROMBATE III)、多克隆免疫球蛋白(IgG、IgA、及其组合)、多特异性免疫球蛋白(IgM)、C1酯酶抑制剂(例如BERINERT)、甲状腺素转运蛋白及其组合。
本发明的范围内的示例性多克隆免疫球蛋白包括商购多克隆IgG制剂诸如FLEBOGAMMA DIF 5%及10%、GAMUNEX–C 10%、BIVIGAM 10%、GAMMAGARD Liquid 10%等。
本发明的范围内的示例性多特异性免疫球蛋白(IgM)包括含有多特异性IgM的商购免疫球蛋白制剂诸如PENTAGLOBIN或TRIMODULIN。
在一种实施方案中,血清或血浆蛋白可选自由以下组成的组:白蛋白、抗凝血酶、α-1抗胰蛋白酶、C1酯酶抑制剂及其组合。例如,血清或血浆蛋白可选自由以下组成的组:抗凝血酶、α-1抗胰蛋白酶及其组合。在特定实施方案中,除了选自运铁蛋白、乳铁蛋白、及其组合的蛋白以外,将治疗有效量的α-1抗胰蛋白酶施用至患者。在特定实施方案中,除了选自运铁蛋白、乳铁蛋白、及其组合的蛋白以外,将治疗有效量的抗凝血酶施用至患者。
本发明的方法亦提供施用与运铁蛋白及/或乳铁蛋白组合的已知神经源性/神经营养性化合物及分子。例如,本发明的方法设想与运铁蛋白及/或乳铁蛋白一起,施用神经源性/神经营养性蛋白、肽及小分子。
合适的神经源性及/或神经营养性化合物及分子可选自由以下组成的组:BDNF(大脑衍生神经营养因子(brain-derived neurotrophic factor);NGF超家族;SEQ ID NO:6)、GNDF(胶质细胞系衍生神经营养因子(glial cell line-derived neurotrophic factor);TGF-β超家族;SEQ ID NO:7)、CNTF(睫状神经营养因子-1(cilliary neurotrophicfactor);神经因子超家族;SEQ ID NO:8)、PACAP(垂体腺苷酸环化酶活化多肽(pituitaryadenylate cyclase-activating polypeptide)的氨基酸1-38;SEQ ID NO:9)、Y-27632及其医药学上可接受的盐[反-4-[(1R)-1-氨基乙基]-N-4-吡啶基环己烷甲酰胺]、法舒地尔(Fasudil)及其医药学上可接受的盐[六氢-1-(5-异喹啉基-磺酰基)-1H-1,4-二氮
本领域技术人员将认识到本发明亦在其范围内设想了以上列出化合物及分子中的每一种与运铁蛋白及乳铁蛋白中的每一种的共价缀合物。此外,应认识到本发明亦在其范围内设想了以上列出蛋白及肽中的每一种与运铁蛋白及乳铁蛋白中的每一种的重组融合蛋白。
在一种实施方案中,运铁蛋白、乳铁蛋白、或其组合可占用于本发明的治疗性方法中的总蛋白含量的按重量计至少20%。例如,运铁蛋白、乳铁蛋白、或其组合可占用于本发明的组合疗法中的总蛋白含量的按重量计大于或等于约30%、40%、50%、60%、70%、75%、80%、85%、90%、93%、95%、96%、97%、98%或99%。
本领域技术人员应认识到以上段落内公开的特定实施方案不应孤立地阅读,并且本说明书意图所公开的这些实施方案与其他实施方案组合,而非个别地公开。例如,公开的各实施方案应诠释为明确地与各实施方案或其中公开的实施方案中的2种或更多种的任何排列的组合。
本发明的医药组合物
在另一方面,本发明亦提供用于在罹患神经退行性事件的患者中产生新神经细胞的医药组合物,该医药组合物包含运铁蛋白、乳铁蛋白或其组合。
本发明的医药组合物可任选地还包含至少一种医药学上可接受的载剂(carrier)。至少一种医药学上可接受的载剂可选自辅料(adjuvant)及媒介物。至少一种医药学上可接受的载剂包含适合于所需特定剂型的任何及所有溶剂、稀释剂、其他液体媒介物、分散助剂、悬浮助剂、表面活性剂、等渗剂、增稠剂、乳化剂、防腐剂。
合适的载剂描述于
本发明的医药组合物被配制成与其意图施用途径兼容。对于全身使用,本发明的医药组合物可被配制成藉由选自由以下组成的组的常规途径来施用:静脉内、皮下、肌肉内、皮内、腹膜内、大脑内、颅内、肺内、鼻内、脊椎内、鞘内、经皮、经黏膜、口服、阴道、及直肠。
在一种实施方案中,肠胃外施用为优选施用途径。医药组合物可封闭于由玻璃或塑料制成的安瓿、一次性注射器、密封袋或多剂量小瓶中。在一种实施方案中,如静脉内注射的施用为优选施用途径。制剂可藉由输注来连续施用或藉由团注(bolus injection)来施用。
本发明的医药组合物可以单位剂量单位形式呈现,即意图作为用于待治疗的受试者的单一剂量的实体上分立单位。
适合于可注射用途的医药组合物包括无菌水溶液(当可溶于水中时)或分散液及用于临时制备无菌可注射溶液或分散液的无菌粉剂。对于静脉内施用,合适的载剂包括生理盐水、抑菌水、CREMOPHOR EL、或磷酸盐缓冲盐水(phosphate buffered saline;PBS)。在所有情况下,组合物必须为无菌的,并且应该为流动的,达到易于注射的程度。
本发明的组成物应在制备及储存条件下为稳定的。此外,组合物应该被保存以防止微生物如细菌及真菌的污染作用。载剂可为含有例如水、乙醇、多元醇(例如,甘油、丙二醇、及液体聚乙二醇、及其类似物)、及其合适的混合物的溶剂或分散介质。
防止微生物作用可藉由各种抗细菌及抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞及其类似剂来达成。在多种情况下,优选地应于组合物中包括等渗剂,例如糖(诸如甘露糖醇、山梨糖醇等)、多元醇或氯化钠。可注射组合物的延长吸收可藉由在组合物中包括延迟吸收的剂,例如单硬脂酸铝或明胶来达成。
本发明的医药组合物的无菌可注射溶液可藉由将所需量的活性分子与如以上论述的成分的一种或组合一起并入合适的溶剂中随后过滤灭菌来制备。在用于制备无菌可注射溶液的无菌粉剂的情况下,制备方法包括真空干燥及冷冻干燥,提供活性成分的粉剂加上来自其先前无菌过滤溶液的任何另外所需成分。
除非任何常规介质或剂与本发明的活性分子不兼容,否则其在组合物中的使用被设想在本发明的范围内。
在一种实施方案中,运铁蛋白、乳铁蛋白、或其组合可占本发明的医药组合物的总蛋白含量的按重量计至少20%。例如,运铁蛋白、乳铁蛋白、或其组合可占本发明的医药组合物的总蛋白含量的按重量计大于或等于约30%、40%、50%、60%、70%、75%、80%、85%、90%、93%、95%、96%、97%、98%或99%。
本领域技术人员应认识到以上段落内公开的特定实施方案不应孤立地阅读,并且本说明书意图所公开的这些实施方案与其他实施方案组合,而非个别地公开。例如,公开的各实施方案应诠释为明确地与各实施方案或其中公开的实施方案中的2种或更多种的任何排列的组合。
给药
如以上论述,本发明人假定藉由增加神经退行性伤害或损伤部位附近的运铁蛋白、乳铁蛋白、或其组合的浓度,这样的分子可增强且/或促进身体的自身神经再生修复机制。运铁蛋白及乳铁蛋白可藉由本领域技术人员已知的任何常规药物递送手段来直接或间接地施用至神经退行性伤害或损伤部位。例如,运铁蛋白、乳铁蛋白、或其组合可藉由选自由大脑内、颅内、脊椎内、及鞘内组成的组的常规途径来施用至由神经退行性事件引起的损伤的局部或附近。例如,运铁蛋白、乳铁蛋白、及其组合可在外科手术期间局部施用。
替代地,运铁蛋白、乳铁蛋白、或其组合可藉由选自由静脉内、皮下、肌肉内、皮内、腹膜内、肺内、鼻内、经皮、经黏膜、口服、阴道及直肠组成的组的施用途径来间接地递送至神经退行性伤害或损伤部位。
为避免任何疑问,藉此机会澄清,本说明书在两个独立且不同的情形中述及运铁蛋白铁饱和水平:
a)在如概述的第一种情形中,本说明书述及待施用至患者的医药组合物中的经纯化外源运铁蛋白的铁饱和度。在此情况下,经纯化外源运铁蛋白的铁饱和水平可使用感应耦合等离子体原子发射谱来测定(但是亦可使用其他方法,诸如比色方法)。
b)在以下立即更详细地论述的第二种情形中,本说明书述及在将含有外源运铁蛋白的医药组合物施用至患者之后,测量患者中(即患者的血浆或血清中)的生理运铁蛋白的铁饱和度。
在正常生理条件下,实际上血浆中的所有铁结合至运铁蛋白并且生理运铁蛋白的所得铁饱和度为大约30%。在实施例6(参见下文)中,本发明人展示具有少于30%的铁饱和度的运铁蛋白导致意料之外的神经再生效应。作为非限制性假设,设想藉由向患者施用含有外源运铁蛋白(具有低铁饱和度)的医药组合物,患者的血浆内的运铁蛋白的生理浓度增加,导致生理运铁蛋白的铁饱和度下降至30%以下。因此,允许生理运铁蛋白利用神经再生效应。自然地,具有少于1%的铁饱和度的外源运铁蛋白可能比具有40%的铁饱和度的外源运铁蛋白更有效。
因此,在一种实施方案中,将选自运铁蛋白、乳铁蛋白、及其组合的蛋白以足以将患者的运铁蛋白(在患者的血清或血浆样品中)的铁饱和度减少至约30%以下的浓度来施用至患者。优选地,将选自运铁蛋白、乳铁蛋白、及其组合的蛋白以足以将患者的运铁蛋白(在患者的血清或血浆样品中)的铁饱和度减少至约20%以下,例如约10%以下的浓度来施用至患者。运铁蛋白、乳铁蛋白、或其组合可使用基于滴定的剂量方案来施用至患者以达成此血清或血浆运铁蛋白铁饱和水平。
本领域技术人员将认识到测量患者的血清或血浆中的运铁蛋白铁饱和水平通常使用如上文论述的比色方法来进行的常规测定。血浆或血清铁含量在化学分析仪上使用比色反应来测量,该反应使用ferene或菲洛嗪作为色原体以与铁形成有色复合物。经分析的样品产生两个值:
·样品铁含量(即结合至样品中的运铁蛋白的铁),及不饱和铁结合能力(unsaturated iron binding capacity;UIBC,即样品中的运铁蛋白上的未占用的铁结合位点的数目)。
·总铁结合能力(total iron binding capacity;TIBC)为样品铁含量及UIBC的总和。
·运铁蛋白饱和度(%)以[(样品铁含量/TIBC)x 100]来确定。
测量患者的血清或血浆中的运铁蛋白铁饱和水平的比色测定的操作是公知常识并且另外的信息可在各种文献综述,诸如
在本发明的方法的仍另一实施方案中,选自运铁蛋白、乳铁蛋白、及其组合的蛋白可以以约5mg/kg至约8400mg/kg的浓度施用至患者。例如,约10mg/kg至约7000mg/kg,诸如约20mg/kg至约6000mg/kg,例如约50mg/kg至约5000mg/kg。在一些实施方案中,选自运铁蛋白、乳铁蛋白、及其组合的蛋白可以以约50mg/kg至约1000mg/kg的浓度施用至患者。适当地,蛋白可以以约50mg/kg至约500mg/kg,诸如约50mg/kg至约250mg/kg,例如约50mg/kg至约150mg/kg的浓度施用。
在一种实施方案中,本发明的方法可包括将选自运铁蛋白、乳铁蛋白、及其组合的蛋白作为多次给药方案的一部分施用至有相应需要的患者。例如,在多次给药期期间,在施用期的第1天,初始剂量为约50mg/kg至约5000mg/kg,随后每个剂量为约50mg/kg至约1000mg/kg。例如,在多次给药期期间,在施用期的第1天,初始剂量为约50mg/kg至约1000mg/kg,随后每个剂量为约50mg/kg至约500mg/kg。例如,在多次给药期期间,在施用期的第1天,初始剂量为约50mg/kg至约500mg/kg,随后每个剂量为约50mg/kg至约250mg/kg。例如,在多次给药期期间,在施用期的第1天,初始剂量为约50mg/kg至约250mg/kg,随后每个剂量为约50mg/kg至约250mg/kg。多次给药期可包含约3至约30次施用直至总累积剂量。多次给药期可为约1至约30周。多个部分剂量可以以约1天至约30天的间隔施用。
本领域技术人员应认识到以上段落内公开的特定实施方案不应孤立地阅读,并且本说明书意图所公开的这些实施方案与其他实施方案组合,而非个别地公开。例如,公开的各实施方案应诠释为明确地与各实施方案或其中公开的实施方案中的2种或更多种的任何排列的组合。
附图简述
本发明的另外的特征及优势将在附图中变得更清楚,在附图中:
图1A至图1D示出响应于原运铁蛋白,SH-SY5Y细胞的轴突生长(neurite outgrowth)的诱导及增殖及β-III-微管蛋白浓度增加;
图2A至图2B展示原运铁蛋白诱导初代人类神经祖细胞变成β-III-微管蛋白阳性神经元及GFAP蛋白阳性星形胶质细胞;
图3A将相对于原运铁蛋白,各种浓度的甲磺酸去铁胺对于SH-SY5Y细胞的轴突生长的影响绘图;
图3B示出具有减少的铁结合能力的运铁蛋白突变体对于促进SH-SY5Y细胞的轴突生长的功效;
图4将各种不同蛋白对于SH-SY5Y细胞的轴突生长的影响绘图;
图5将脯氨酰基羟化酶抑制剂IOX2对于SH-SY5Y细胞的轴突生长的影响绘图;
图6A和图6B示出铁饱和度对于运铁蛋白在促进SH-SY5Y细胞的轴突生长方面的功效的作用;
图7A至图7D将与其他神经营养蛋白/肽片段组合的原运铁蛋白对于SH-SY5Y细胞的轴突生长的影响绘图。
图8将与小分子Y-27632组合的原运铁蛋白对于SH-SY5Y细胞的轴突生长的影响绘图;及
图9展示原运铁蛋白在MPTP诱导的小鼠帕金森病中的积极的再生效应。
发明具体实施方案
对于本领域普通技术人员应容易地明显的是,本文以下公开的实施例仅代表概括实例,并且能够再现本发明的其他布置及方法是可能的并且被本发明包涵。
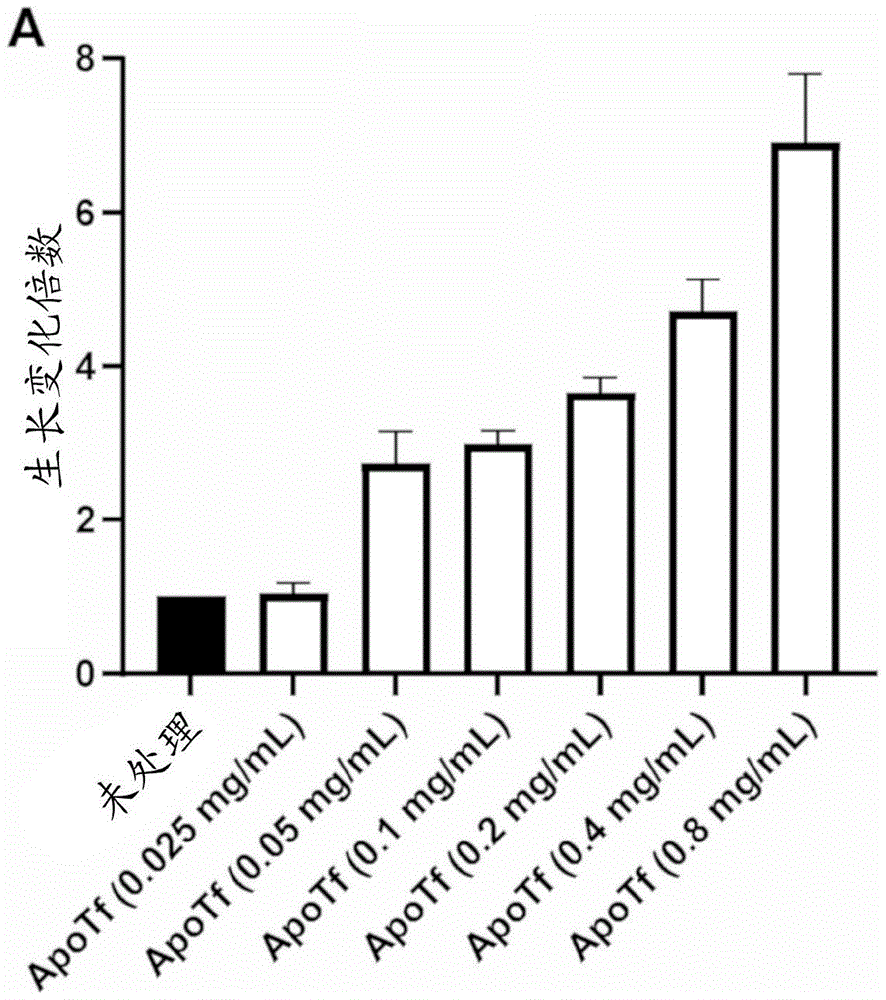
实施例1:原运铁蛋白(ApoTf)以剂量响应方式诱导SH-SY5Y细胞的分化及轴突生长
在细胞培养物中以及在体内利用运铁蛋白以将铁作为营养物递送至细胞。这通常经由全铁运铁蛋白(HoloTf)结合至其同源受体CD71运铁蛋白受体1(transferrinreceptor 1;TfR1)并且藉由其内吞来实现。通常认为运铁蛋白向细胞提供铁作为促进及维持代谢活动的手段。本发明人意外地发现原运铁蛋白(无铁形式的运铁蛋白)诱导很常见的神经元研究模型SH-SY5Y细胞的分化。神经元分化的诱导藉由轴突形成的形态参数(通常用作神经元分化、神经元健康、及功能的标志物的关键要素)根据以下程序来评估:
未分化的SH-SY5Y细胞接种于96孔透明底部板中的含有0.1% FBS的培养基中。无血清基础培养基如由SH-SY5Y细胞的供货商建议的来利用(Sigma,目录号94030304-1VL)。接种细胞之后二十四小时,将无血清基础培养基中的ApoTf的3x储备溶液(x轴指示的最终浓度)添加至细胞。ApoTf从汇集的人类血浆获得并纯化,并以0.2mg/mL的最终浓度给予。允许细胞分化6天。轴突生长藉由成像及图像分析来评估。在分析时,制备Tubulin Tracker(Molecular Probes,T34075)及Hoechst 33342(Molecular Probes#H3570)细胞核染色剂的10x溶液。
简言之,将溶解于DMSO中的Tubulin Tracker用Pluronic F-127以1:1稀释并且进一步稀释至HBSS中以产生10x溶液。将Hoechst 33342以10μg/mL添加至HBSS-TubulinTracker溶液以产生10x细胞核染色剂。将10x染色溶液(10μL)直接添加至经处理的测定孔并且在37℃培养30分钟。培养之后,将110μL的0.4%锥虫蓝直接添加至测定孔并且在Molecular Devices Nano成像仪器上成像。对于各图像,获得蓝色(细胞核)及绿色(微管蛋白)荧光通道中的九幅图像/孔。
获得图像之后,MetaExpress轴突生长分析模块(Molecular Devices)用于鉴别细胞、细胞主体、并且量化轴突。轴突分支的总数除以成像细胞的总数,以考虑到各测试孔中的不同数目的细胞。生长倍数变化藉由将未处理的对照细胞设定为1的值来确定,并且所有其他处理相对于未处理对照来示出。
从图1A明显的是,原运铁蛋白能够以剂量依赖性方式诱导轴突生长。原运铁蛋白浓度递增增加直至0.8mg/mL的最大值与SH-SY5Y细胞的经改良的生长响应相关。此现象与运铁蛋白的已知功能在直觉上相反,运铁蛋白主要以全铁或载铁形式的运铁蛋白起作用。
图1B示出原运铁蛋白诱导细胞数目的浓度依赖性增加。增加的细胞数目指示增加的细胞增殖,直至0.8mg/mL原运铁蛋白的最大测试剂量。
图1C提供用0.1mg/mL ApoTf处理的SH-SY5Y细胞(下图)与未处理对照(上图)的视觉比较。左图示出使用Hoechst 33342的细胞核染色。右侧图像示出细胞主体及轴突的微管蛋白染色。从图1C明显的是,ApoTf对于促进细胞增殖,及随后/同时促进诱导轴突/微管蛋白生长具有显著影响。
另外,如图1D示出,发现原运铁蛋白处理导致良好表征的传统神经元标志物β-III-微管蛋白增加。在此实验中,SH-SY5Y细胞如以上描述地分化。在分析时,细胞用多聚甲醛固定,针对β-III-微管蛋白来染色(R&D Systems,MAB1195),并且在Molecular DevicesNano成像仪器上成像。图像分析藉由评估用β-III-微管蛋白染色的细胞的荧光强度来进行。从所有的值减去来自单独二级抗体的背景。对于指示条件,带有标准偏差的值显示为“β-III-微管蛋白染色强度”。
SH-SY5Y细胞
“SH-SY5Y细胞”在本说明书意指衍生自SK-N-SH神经母细胞瘤细胞系的亚克隆细胞系。其充当神经退行性病症的模型,因为藉由添加特定化合物,该细胞可转化成各种类型的功能神经细胞。另外,SH-SY5Y细胞系广泛地用于实验神经学研究中,包括与神经退行性过程、神经中毒性、及神经保护相关的神经元分化、代谢、及功能的分析。
本文在以下概述经同行评审的涉及SH-SY5Y细胞系作为各种神经退行性病症的预测性模型的引文。该清单不构成本发明人对于先前技术的承认,而是将其用来说明本领域技术人员知道SH-SY5Y细胞作为神经退行性紊乱的预测性模型的效用。
神经发生
Dayem et al. Biologically synthesized silver nanoparticles induce
Fagerstrom et al.Protein Kinase C-epsilon Implicated in Neurite
情绪稳定(抑郁)
Yuan et al. The Mood Stabilizer Valproic Acid Activates
Tatroet al. Modulation of Glucocorticoid Receptor Nuclear
Laifenfeld etal.Norepinephrine alters the expression of genes
Cavarec et al.In Vitro Screening for Drug-Induced Depression and/or
Tau蛋白病(阿尔茨海默病、FTD及其他Tau蛋白异常的神经退行性疾病)
Jamsa et al.The retinoic acid and brain-derived neurotrophic factor
Seidelet.al.Induced Tauopathy in a Novel 3D-Culture Model Mediates
Karch et al.Extracellular Tau Levels Are Influencedby Variability in
阿尔茨海默病
Pettifer et al.Guanosine protects SH-SY5Ycells against
Tanii et al.Alzheimer's Disease Presenilin-1Exon 9Deletion And L250s
Li et al.Beta-amyloid induces apoptosis in human-derived neurotypic
ALS及额颞叶型痴呆
Lee et al.Hexanucleotide Repeats inALS/FTD Form Length-Dependent
Farg et al. C9ORF72, implicated in amytrophic lateral sclerosis and
Nonaka et al. Phosphorylated and ubiquitinatedTDP-43 pathological
帕金森病
Xing et al.Protective effects and mechanisms of Ndfipl on SH-SY5Y
Jung et al. Rosiglitazone protects human neuroblastoma SH-SY5Y cells
Choi et al. Signaling Pathway Analysis of MPP+-treated Human
Friedreich共济失调
Palomo et al. Silencing of frataxin gene expression triggers
亨廷顿病
Banez-Coronel et al. A Pathogenic Mechanism in Huntington's Disease
Vidoni et al. Resveratrol protects neuronal-like cells expressing
Vidoni et al. Dopamine exacerbates mutant Huntingtin toxicity via
Olsen et al.Examination of mesenchymal stem cell-mediated RNAi
实施例2:ApoTf对于初代人类神经祖细胞中的β-III-微管蛋白及GFAP蛋白浓度的影响
ApoTf的神经源性效应亦转移至初代人类大脑皮质衍生神经祖细胞,另一种既定成人神经发生模型(
保持为神经球(neurosphere)的神经祖细胞获自Lonza(PT-2599)。将细胞从神经球的冷冻小瓶中解冻并且在人类NeuroCult
实施例3:铁螯合并非由ApoTf引起的神经发生作用的唯一模式
甲磺酸去铁胺(deferoxamine mesylate;DFO)是用于铁过载的临床实践的小分子铁螯合剂。如同ApoTf,DFO对于铁具有高亲和力结合常数;但是仅具有单个铁结合位点。研究了DFO对于轴突生长的影响。ApoTf以接近于其功能剂量曲线底部的浓度来测试并且与DFO诱导轴突生长的能力进行比较。以2.4μM(0.2mg/mL)测试的ApoTf具有两个铁结合位点,并且因此与4.8μM的DFO的单个铁结合位点相当。
未分化的SH-SY5Y细胞如实施例1所描述来接种并且处理。轴突生长藉由成像及图像分析来评估。在分析时,制备Tubulin Tracker(Molecular Probes,T34075)及Hoechst33342(Molecular Probes#H3570)细胞核染色剂的10x溶液。简言之,将溶解于DMSO中的Tubulin Tracker用Pluronic F-1271:1稀释并且进一步稀释至HBSS中以产生10x溶液。将Hoechst 33342以10μg/mL添加至HBSS-Tubulin Tracker溶液以产生10x细胞核染色剂。将10x染色溶液(10μL)直接添加至经处理的测定孔并且在37℃培养30分钟。培养之后,将110μL的0.4%锥虫蓝直接添加至测定孔并且在Molecular Devices Nano成像仪器上成像。对于各图像,获得蓝色(细胞核)及绿色(微管蛋白)荧光通道中的九幅图像/孔。获得图像之后,MetaExpress轴突生长分析模块(Molecular Devices)用于鉴别细胞主体并且量化轴突。轴突分支的总数除以成像细胞的总数,以考虑到不同数目的细胞。生长倍数变化藉由将未处理的对照设定为1的值来确定,并且所有其他处理相对于未处理对照来示出。ApoTf从汇集的人类血浆获得并且纯化并且以0.2mg/mL的最终浓度给予。甲磺酸去铁胺(DFO)获自Tocris(目录号5764),按照制备商的建议来重悬并且储存。针对神经源性性质来评估的DFO的浓度在x轴上指示。
从图3A可发现DFO在1-3μM之间显示出最大轴突生长,并且超出该浓度,轴突形成极少,而ApoTf继续增加分化甚至一直到9.9μM(0.8mg/mL;20μM铁结合位点)。这些数据表明虽然铁螯合可在轴突生长中起作用,但是其并非主要作用机制;ApoTf的另一未识别功能方面亦必定在其神经源性能力中起作用。
本发明人进一步寻求确定是否藉由N末端铁结合位点的突变来减少运铁蛋白的铁结合活性足以介导神经发生。未分化的SH-SY5Y细胞如实施例1所描述来处理。轴突生长藉由成像及图像分析来评估。在分析时,制备Tubulin Tracker(Molecular Probes,T34075)及Hoechst 33342(Molecular Probes#H3570)细胞核染色剂的10x溶液。简言之,将溶解于DMSO中的Tubulin Tracker用Pluronic F-127 1:1稀释并且进一步稀释至HBSS中以产生10x溶液。将Hoechst 33342以10μg/mL添加至HBSS-Tubulin Tracker溶液以产生10x细胞核染色剂。将10x染色溶液(10μL)直接添加至经处理的测定孔并且在37℃培养30分钟。培养之后,将110μL的0.4%锥虫蓝直接添加至测定孔并且在Molecular Devices Nano成像仪器上成像。对于各图像,获得蓝色(细胞核)及绿色(微管蛋白)荧光通道中的九幅图像/孔。获得图像之后,MetaExpress轴突生长分析模块(Molecular Devices)用于鉴别细胞主体并且量化轴突。
轴突分支的总数除以成像细胞的总数,以考虑到不同数目的细胞。生长倍数变化藉由将未处理的对照设定为1的值来确定,并且所有其他处理相对于未处理对照来示出。所有蛋白以0.2mg/mL的最终浓度给予。
血浆来源的人类血清白蛋白(pdHSA)及ApoTf从汇集的人类血浆获得并且纯化;重组ApoTf(rec ApoTf;SEQ ID NO:1)、及N-叶突变体Tf(N-mut rec ApoTf;SEQ ID NO:4)藉由自293-6E细胞的细胞培养物表达来获得。
简言之,将野生型人类运铁蛋白(SEQ ID NO:1)及N-叶突变体人类运铁蛋白(SEQID 4)序列克隆至含有N末端6xHIS标签及TEV裂解位点的哺乳动物表达质粒中。将表达质粒转染至293-6E细胞系中,随后从细胞培养物上清液收获蛋白。蛋白在NI-NTA柱上纯化并且在洗涤之后洗脱。TurboTEV蛋白酶用于从运铁蛋白裂解N末端6xHIS标签及额外氨基酸。TEV裂解之后,藉由第二Ni-NTA捕获柱将运铁蛋白与裂解6xHIS标签及未裂解蛋白分离。然后,Ni-NTA捕获柱的流通级分经受低pH处理,以移除结合至这些蛋白的任何潜在残余铁,缓冲液交换至PBS pH 7.4,浓缩,并且无菌过滤供最终使用。
从图3B,我们发现血浆来源的人类血清白蛋白(pdHSA)不影响神经发生。然而,ApoTf及重组ApoTf均诱导SH-SY5Y的神经发生。具有减少的铁结合能力的ApoTf突变体(N-mut rec ApoTf)在诱导SH-SY5Y细胞的分化方面与ApoTf及rec ApoTf几乎相等。铁结合显示为并非ApoTf的神经源性潜力的唯一作用机制。
实施例4:对于SH-SY5Y的神经源性效应对于原运铁蛋白及原乳铁蛋白是特异性的
因为根据实施例3,发现铁螯合在ApoTf的神经源性能力中的作用不清楚,本发明人测定是否其他铁结合蛋白亦可介导SH-SY5Y细胞的神经发生。
未分化的SH-SY5Y细胞如实施例1所描述来处理。轴突生长藉由成像及图像分析来评估。在分析时,制备Tubulin Tracker(Molecular Probes,T34075)及Hoechst 33342(Molecular Probes#H3570)细胞核染色剂的10x溶液。简言之,将溶解于DMSO中的TubulinTracker用Pluronic F-127 1:1稀释并且进一步稀释至HBSS中以产生10x溶液。将Hoechst33342以10μg/mL添加至HBSS-Tubulin Tracker溶液以产生10x细胞核染色剂。将10x染色溶液(10μL)直接添加至经处理的测定孔并且在37℃培养30分钟。培养之后,将110μL的0.4%锥虫蓝直接添加至测定孔并且在Molecular Devices Nano成像仪器上成像。对于各图像,获得蓝色(细胞核)及绿色(微管蛋白)荧光通道中的九幅图像/孔。获得图像之后,MetaExpress轴突生长分析模块(Molecular Devices)用于鉴别细胞主体并且量化轴突。轴突分支的总数除以成像细胞的总数,以考虑到不同数目的细胞。生长倍数变化藉由将未处理的对照设定为1的值来确定,并且所有其他处理相对于未处理对照来示出。BSA获自Sigma;rHSA获自Albumedix;ApoTf及HoloTf从汇集的人类血浆获得并且纯化;原铁蛋白(马)获自Sigma;原乳铁蛋白获自Athens Research&Technology。所有蛋白以0.2mg/mL的最终浓度给予。
从图4,我们发现牛血清清蛋白(bovine serum albumin;BSA)及低亲和力铁结合形式的人类血清白蛋白均不影响神经发生。对于低亲和力铁结合形式的人类血清白蛋白(human serum albumin;rHSA)的其他信息,参见
令人惊讶地,原铁蛋白,即铁贫乏形式的铁蛋白,另一具有多个铁结合位点的高亲和力铁结合蛋白,在诱导SH-SY5Y细胞的分化方面是无效的。这推进了铁结合是ApoTf的神经源性潜力的唯一作用机制的假设。出乎意料地,原乳铁蛋白亦诱导这些细胞的分化。原乳铁蛋白是原运铁蛋白的结构及功能同源物,但是存在于母乳中而不是在血浆中。
原乳铁蛋白与原运铁蛋白具有61%同一性,而原铁蛋白及人类血清白蛋白(HSA)在结构上与原运铁蛋白或原乳铁蛋白无关。
实施例5:ApoTf诱导的SH-SY5Y细胞分化并非经由低氧诱导因子1α(HIF-1α)
已报道ApoTf及HoloTf均可诱导HIF-1α产生,导致相关神经保护效应(
为了证实ApoTf在HIF途径以外介导神经发生的假设,本发明人在SH-SY5Y细胞分化测定中测试一种熟知、高度特异性脯氨酰基羟化酶(PHD2)抑制剂。已知小分子PHD2抑制剂IOX2(N-[[1,2-二氢-4-羟基-2-氧代-1-(苯基甲基)-3-喹啉基]羰基]-甘氨酸)可经由其对于PHD2的作用来活化HIF途径。参见
未分化的SH-SY5Y细胞如实施例1所描述来接种并且处理。轴突生长藉由成像及图像分析来评估。在分析时,制备Tubulin Tracker(Molecular Probes,T34075)及Hoechst33342(Molecular Probes#H3570)细胞核染色剂的10x溶液。简言之,将溶解于DMSO中的Tubulin Tracker用Pluronic F-1271:1稀释并且进一步稀释至HBSS中以产生10x溶液。将Hoechst 33342以10μg/mL添加至HBSS-Tubulin Tracker溶液以产生10x细胞核染色剂。将10x染色溶液(10μL)直接添加至经处理的测定孔并且在37℃培养30分钟。培养之后,将110μL的0.4%锥虫蓝直接添加至测定孔并且在Molecular Devices Nano成像仪器上成像。对于各图像,获得蓝色(细胞核)及绿色(微管蛋白)荧光通道中的九幅图像/孔。获得图像之后,MetaExpress轴突生长分析模块(Molecular Devices)用于鉴别细胞主体并且量化轴突。轴突分支的总数除以成像细胞的总数,以考虑到不同数目的细胞。生长倍数变化藉由将未处理的对照设定为1的值来确定,并且所有其他处理相对于未处理对照来示出。ApoTf从汇集的人类血浆获得并且纯化并且以0.2mg/mL的最终浓度给予。IOX2获自Tocris(目录号4451),按照制备商的建议来重悬并且储存。
从图5明显的是,在IOX2处理细胞中未观察到轴突生长或分化。甚至在4μM IOX2的非常高浓度,未观察到效应(比在US2016008437中报道的诱导SH-SY5Y中的HIF-1α的浓度高4倍,并且比Chowdhury确定为用于PHD2蛋白的IC
实施例6:铁饱和度在运铁蛋白功效中的作用
将如表1概述的具有各种纯度及铁饱和量的ApoTf针对其神经源性潜力来进行评估。运铁蛋白样品根据本领域技术人员已知并且在
蛋白纯度藉由SDS-PAGE来确定。铁饱和水平使用ICP-AES根据
表1
未分化的SH-SY5Y细胞如实施例1所描述来处理。轴突生长藉由成像及图像分析来评估。在分析时,制备Tubulin Tracker(Molecular Probes,T34075)及Hoechst 33342(Molecular Probes#H3570)细胞核染色剂的10x溶液。简言之,将溶解于DMSO中的TubulinTracker用Pluronic F-127 1:1稀释并且进一步稀释至HBSS中以产生10x溶液。将Hoechst33342以10μg/mL添加至HBSS-Tubulin Tracker溶液以产生10x细胞核染色剂。将10x染色溶液(10μL)直接添加至经处理的测定孔并且在37℃培养30分钟。培养之后,将110μL的0.4%锥虫蓝直接添加至测定孔并且在Molecular Devices Nano成像仪器上成像。对于各图像,获得蓝色(细胞核)及绿色(微管蛋白)荧光通道中的九幅图像/孔。获得图像之后,MetaExpress轴突生长分析模块(Molecular Devices)用于鉴别细胞主体并且量化轴突。轴突分支的总数除以成像细胞的总数,以考虑到不同数目的细胞。生长倍数变化藉由将未处理的对照设定为1的值来确定,并且所有其他处理相对于未处理对照来示出。
图6A将以0.2mg/mL的最终浓度给予的纯度及铁含量在表1中概述的ApoTf A-D对于SH-SY5Y细胞的轴突生长的影响绘图。图6B将以0.2mg/mL的最终浓度给予的具有各种铁饱和水平(在X轴上列出)的运铁蛋白对于SH-SY5Y细胞的轴突生长绘图。
在从汇集的人类血浆纯化运铁蛋白之后,制备ApoTf(<0.3%饱和度)及HoloTf(100%饱和度),如von Bonsdorff,参见上文概述。藉由混合ApoTf及HoloTf以产生在图6B中绘制的所指示饱和度百分比,产生各种铁饱和含量。
从图6A,我们发现所有ApoTf制剂(ApoTf A-D),甚至具有仅94%蛋白纯度的样品,能够诱导SH-SY5Y的神经源性分化。图6B示出铁饱和程度对于运铁蛋白诱导SH-SY5Y细胞的分化的能力所具有的影响。在此实施例中,将具有至少99%的蛋白纯度的ApoTf或HoloTf以各种比率混合以便测定铁饱和度/含量的影响。具有少于30%的铁饱和含量的运铁蛋白显示出神经源性潜力。
实施例7:原运铁蛋白与神经营养蛋白及肽因子协同作用以便诱导分化
若干神经营养蛋白因子经考虑用于临床用途中,以便在神经退行性病状中以及在创伤性脑损伤之后刺激神经发生。
来自三个神经营养超家族的蛋白针对与ApoTf组合时的功能来进行测试。这些神经营养蛋白是:BDNF(大脑衍生神经营养因子;NGF超家族),GNDF(胶质细胞系衍生神经营养因子;TGF-β超家族),及CNTF(睫状神经营养因子-1;神经因子超家族)。另外,另一已知神经营养肽PACAP(垂体腺苷酸环化酶活化多肽的氨基酸1-38)针对与ApoTf组合时的功能来进行评估。
未分化的SH-SY5Y细胞如实施例1所描述来处理。轴突生长藉由成像及图像分析来评估。在分析时,制备Tubulin Tracker(Molecular Probes,T34075)及Hoechst 33342(Molecular Probes#H3570)细胞核染色剂的10x溶液。简言之,将溶解于DMSO中的TubulinTracker用Pluronic F-127 1:1稀释并且进一步稀释至HBSS中以产生10x溶液。将Hoechst33342以10μg/mL添加至HBSS-Tubulin Tracker溶液以产生10x细胞核染色剂。将10x染色溶液(10μL)直接添加至经处理的测定孔并且在37℃培养30分钟。培养之后,将110μL的0.4%锥虫蓝直接添加至测定孔并且在Molecular Devices Nano成像仪器上成像。对于各图像,获得蓝色(细胞核)及绿色(微管蛋白)荧光通道中的九幅图像/孔。获得图像之后,MetaExpress轴突生长分析模块(Molecular Devices)用于鉴别细胞主体并且量化轴突。轴突分支的总数除以成像细胞的总数,以考虑到不同数目的细胞。生长倍数变化藉由将未处理的对照设定为1的值来确定,并且所有其他处理相对于未处理对照来示出。
在图7A-图7D中,ApoTf单独或与指示神经营养因子组合以0.1mg/mL的最终浓度来给予。(A)BDNF获自Peprotech(目录号450-02)并且以25ng/mL给予。(B)GDNF获自Peprotech(目录号450-10)并且以1000ng/mL给予。(C)CNTF获自Peprotech(目录号450-13)并且以250ng/mL给予。(D)PACAP获自Tocris(目录号1186)并且以200nM给予。缩写SF表示无血清培养基。
检视图7A-图7D中的每一个,明显可见神经营养因子、及肽片段中的每一种以不同程度来诱导SH-SY5Y细胞的分化。在一些情况下,如BDNF,在不存在ApoTf的情况下,在所测试浓度,神经营养因子不诱导分化。在提供的所有实验中,与经测试的单独分子相比,与ApoTf组合的神经营养因子诱导更大分化。出乎意料地,ApoTf与其他神经营养因子及肽表现出对于SH-SY5Y细胞的轴突生长的协同效应。
实施例8:原运铁蛋白与神经源性小分子协同作用以便诱导分化
在实施例7中测试ApoTf与基于非蛋白的神经源性小分子化合物一起发挥作用的能力。评估与神经源性化合物Y-27632[反-4-[(1R)-1-氨基乙基]-N-4-吡啶基环己烷甲酰胺二盐酸盐]组合的ApoTf。Y-27632是Rock1及Rock2(Rho激酶)抑制剂。藉由小分子来抑制Rock1及Rock2具有诱导神经元分化(包括SH-SY5Y细胞)的已知能力。参见
未分化的SH-SY5Y细胞如实施例1所描述来处理。轴突生长藉由成像及图像分析来评估。在分析时,制备Tubulin Tracker(Molecular Probes,T34075)及Hoechst 33342(Molecular Probes#H3570)细胞核染色剂的10x溶液。简言之,将溶解于DMSO中的TubulinTracker用Pluronic F-127 1:1稀释并且进一步稀释至HBSS中以产生10x溶液。将Hoechst33342以10μg/mL添加至HBSS-Tubulin Tracker溶液以产生10x细胞核染色剂。将10x染色溶液(10μL)直接添加至经处理的测定孔并且在37℃培养30分钟。培养之后,将110μL的0.4%锥虫蓝直接添加至测定孔并且在Molecular Devices Nano成像仪器上成像。对于各图像,获得蓝色(细胞核)及绿色(微管蛋白)荧光通道中的九幅图像/孔。获得图像之后,MetaExpress轴突生长分析模块(Molecular Devices)用于鉴别细胞主体并且量化轴突。轴突分支的总数除以成像细胞的总数,以考虑到不同数目的细胞。生长倍数变化藉由将未处理的对照设定为1的值来确定,并且所有其他处理相对于未处理对照来示出。ApoTf单独或与指示小分子组合以0.1mg/mL的最终浓度来给予。Y-27632获自Tocris(目录号1254)并且以50μM给予。
图8示出Y-27632本身是强烈神经源性化合物,然而,在存在ApoTf的情况下,神经源性效应是协同的,显示出超过单独任一分子所表现出的效应的效应。ApoTf与许多已知蛋白、肽、及小分子神经源性实体协同起作用的能力是意想不到的及意外的发现。
实例9:在帕金森病小鼠模型中藉由原运铁蛋白处理实现的改善的步态及运动
为了说明上述体外结果将成功转化为积极临床效果,本发明人在帕金森病小鼠模型中试验了该疗法。向小鼠施用1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)以便破坏黑质(substantia nigra)中的多巴胺能神经元并且在小鼠中诱导帕金森病。关于更多细节参见
多巴胺能神经元的破坏有害地影响动物运动。小鼠的运动及步态可藉由视频分析来测量。如图9示出,相对于对照小鼠(n=15),在暴露于MPTP的小鼠中,可观察到运动及步态的实质性改变。与在实施例1-实施例8中的发现一致,MPTP诱导的小鼠的帕金森病藉由施用ApoTf(n=15)被显著改善。图9展示了ApoTf的神经再生特性,因为ApoTf极大地改善了患病小鼠的运动功能障碍,有效地使小鼠向对照动物方向正常化。
如由芬兰国家动物实验委员会(Animal Experiment Board of Finland)授权的许可证中所规定并且根据美国国立卫生研究院(Bethesda,MD,USA)关于实验室动物护理及使用的指南,在Charles River Laboratories(Finland)进行动物实验。8至12周龄的C57Bl/6J小鼠被圈养在标准温度(22±1℃)及光控环境中(上午7点至晚上8点照明开启),可随意获取食物及水。
MPTP溶液藉由将MPTP盐酸盐以2.42mg/mL溶解于无菌盐水中来制备;对应于2.0mg/mL的活性化合物。为了诱导帕金森病,MPTP藉由腹膜内注射每天两次以20mg/kg给予。MPTP注射液或用于对照小鼠的单独盐水连续两天(第0天及第1天)以4小时间隔来给予。
ApoTf蛋白在无菌PBS,pH 7.4中以51.5mg/mL的浓度施用。藉由腹膜内注射给予小鼠350mg/kg的ApoTf或用于对照小鼠的单独PBS。第1天至第7天每天一次给予ApoTf,并且在第1天最后一次MPTP剂量之后1小时,给予第一次ApoTf处理剂量。
在第7天,使用Motorater(TSE Systems GmbH,Bad Homburg,Germany)测试系统,对小鼠进行运动学步态分析。在上午7点至晚上8点之间的光照周期期间对动物进行测试。在运动及步态分析时间段之前,在小鼠身体的31个点上进行了标记,以方便对捕获的视频进行数据分析。使用高速摄影机(300fps)从三个不同方向(即从下方及两侧)捕获运动。
各小鼠的捕获视频首先转化成软件可读格式。为了获得原始数据,跟踪身体的标记点并且将三个方向中的每一种关联。其后,不同步态模式及运动使用由Charles RiverDiscovery Research Service Finland开发的专门定制软件来提取。步态模式及运动分析评估了100个不同参数,包括但不限于步幅时间、步幅期间的摆动时间、速度、步宽、站姿及四肢协调。数据藉由使用主要成分分析(PCA)来分析。总体步态分析基于各小鼠的所有参数的PCA,并且所获得的值示出对照小鼠及MPTP、或MPTP加上ApoTf小鼠之间的总体差异,这些总体差异被测量为“距离(distance)”。对照小鼠(对照)设定为0的值,并且对于仅MPTP小鼠(MPTP)、或随后进行ApoTf处理的MPTP小鼠(MPTP→ApoTf),示出“与对照的距离”。值显示为平均值+/-SEM(n=15)。
序列
在前述文本中涉及的序列在下文中以fasta格式概述。
SEQ ID NO:1人类运铁蛋白[UniProt Q06AH7]蛋白序列
VPDKTVRWCAVSEHEATKCQSFRDHMKSVIPSDGPSVACVKKASYLDCIRAIAANEADAVTLDAGLVYDAYLAPNNLKPVVAEFYGSKEDPQTFYYAVAVVKKDSGFQMNQLRGKKSCHTGLGRSAGWNIPIGLLYCDLPEPRKPLEKAVANFFSGSCAPCADGTDFPQLCQLCPGCGCSTLNQYFGYSGAFKCLKDGAGDVAFVKHSTIFENLANKADRDQYELLCLDNTRKPVDEYKDCHLAQVPSHTVVARSMGGKEDLIWELLNQAQEHFGKDKSKEFQLFSSPHGKDLLFKDSAHGFLKVPPRMDAKMYLGYEYVTAIRNLREGTCPEAPTDECKPVKWCALSHHERLKCDEWSVNSVGKIECVSAETTEDCIAKIMNGEADAMSLDGGFVYIAGKCGLVPVLAENYNKSDNCEDTPEAGYFAVAVVKKSASDLTWDNLKGKKSCHTAVGRTAGWNIPMGLLYNKINHCRFDEFFSEGCAPGSKKDSSLCKLCMGSGLNLCEPNNKEGYYGYTGAFRCLVEKGDVAFVKHQTVPQNTGGKNPDPWAKNLNEKDYELLCLDGTRKPVEEYANCHLARAPNHAVVTRKDKEACVHKILRQQQHLFGSNVTDCSGNFCLFRSETKDLLFRDDTVCLAKLHDRNTYEKYLGEEYVKAVGNLRKCSTSSLLEACTFRRP
SEQ ID NO:2人类乳铁蛋白[UniProt P02788]蛋白序列
GRRRRSVQWCTVSQPEATKCFQWQRNMRRVRGPPVSCIKRDSPIQCIQAIAENRADAVTLDGGFIYEAGLAPYKLRPVAAEVYGTERQPRTHYYAVAVVKKGGSFQLNELQGLKSCHTGLRRTAGWNVPIGTLRPFLNWTGPPEPIEAAVARFFSASCVPGADKGQFPNLCRLCAGTGENKCAFSSQEPYFSYSGAFKCLRDGAGDVAFIRESTVFEDLSDEAERDEYELLCPDNTRKPVDKFKDCHLARVPSHAVVARSVNGKEDAIWNLLRQAQEKFGKDKSPKFQLFGSPSGQKDLLFKDSAIGFSRVPPRIDSGLYLGSGYFTAIQNLRKSEEEVAARRARVVWCAVGEQELRKCNQWSGLSEGSVTCSSASTTEDCIALVLKGEADAMSLDGGYVYTAGKCGLVPVLAENYKSQQSSDPDPNCVDRPVEGYLAVAVVRRSDTSLTWNSVKGKKSCHTAVDRTAGWNIPMGLLFNQTGSCKFDEYFSQSCAPGSDPRSNLCALCIGDEQGENKCVPNSNERYYGYTGAFRCLAENAGDVAFVKDVTVLQNTDGNNNDAWAKDLKLADFALLCLDGKRKPVTEARSCHLAMAPNHAVVSRMDKVERLKQVLLHQQAKFGRNGSDCPDKFCLFQSETKNLLFNDNTECLARLHGKTTYEKYLGPQYVAGITNLKKCSTSPLLEACEFLRK
SEQ ID NO:3Y188F运铁蛋白N-叶突变体蛋白
VPDKTVRWCAVSEHEATKCQSFRDHMKSVIPSDGPSVACVKKASYLDCIRAIAANEADAVTLDAGLVYDAYLAPNNLKPVVAEFYGSKEDPQTFYYAVAVVKKDSGFQMNQLRGKKSCHTGLGRSAGWNIPIGLLYCDLPEPRKPLEKAVANFFSGSCAPCADGTDFPQLCQLCPGCGCSTLNQYFGFSGAFKCLKDGAGDVAFVKHSTIFENLANKADRDQYELLCLDNTRKPVDEYKDCHLAQVPSHTVVARSMGGKEDLIWELLNQAQEHFGKDKSKEFQLFSSPHGKDLLFKDSAHGFLKVPPRMDAKMYLGYEYVTAIRNLREGTCPEAPTDECKPVKWCALSHHERLKCDEWSVNSVGKIECVSAETTEDCIAKIMNGEADAMSLDGGFVYIAGKCGLVPVLAENYNKSDNCEDTPEAGYFAVAVVKKSASDLTWDNLKGKKSCHTAVGRTAGWNIPMGLLYNKINHCRFDEFFSEGCAPGSKKDSSLCKLCMGSGLNLCEPNNKEGYYGYTGAFRCLVEKGDVAFVKHQTVPQNTGGKNPDPWAKNLNEKDYELLCLDGTRKPVEEYANCHLARAPNHAVVTRKDKEACVHKILRQQQHLFGSNVTDCSGNFCLFRSETKDLLFRDDTVCLAKLHDRNTYEKYLGEEYVKAVGNLRKCSTSSLLEACTFRRP
SEQ ID 4Y95F/Y188F运铁蛋白N-叶突变体蛋白
VPDKTVRWCAVSEHEATKCQSFRDHMKSVIPSDGPSVACVKKASYLDCIRAIAANEADAVTLDAGLVYDAYLAPNNLKPVVAEFYGSKEDPQTFFYAVAVVKKDSGFQMNQLRGKKSCHTGLGRSAGWNIPIGLLYCDLPEPRKPLEKAVANFFSGSCAPCADGTDFPQLCQLCPGCGCSTLNQYFGFSGAFKCLKDGAGDVAFVKHSTIFENLANKADRDQYELLCLDNTRKPVDEYKDCHLAQVPSHTVVARSMGGKEDLIWELLNQAQEHFGKDKSKEFQLFSSPHGKDLLFKDSAHGFLKVPPRMDAKMYLGYEYVTAIRNLREGTCPEAPTDECKPVKWCALSHHERLKCDEWSVNSVGKIECVSAETTEDCIAKIMNGEADAMSLDGGFVYIAGKCGLVPVLAENYNKSDNCEDTPEAGYFAVAVVKKSASDLTWDNLKGKKSCHTAVGRTAGWNIPMGLLYNKINHCRFDEFFSEGCAPGSKKDSSLCKLCMGSGLNLCEPNNKEGYYGYTGAFRCLVEKGDVAFVKHQTVPQNTGGKNPDPWAKNLNEKDYELLCLDGTRKPVEEYANCHLARAPNHAVVTRKDKEACVHKILRQQQHLFGSNVTDCSGNFCLFRSETKDLLFRDDTVCLAKLHDRNTYEKYLGEEYVKAVGNLRKCSTSSLLEACTFRRP
SEQ ID NO:5Y426F/Y517F运铁蛋白C-叶突变体蛋白
VPDKTVRWCAVSEHEATKCQSFRDHMKSVIPSDGPSVACVKKASYLDCIRAIAANEADAVTLDAGLVYDAYLAPNNLKPVVAEFYGSKEDPQTFYYAVAVVKKDSGFQMNQLRGKKSCHTGLGRSAGWNIPIGLLYCDLPEPRKPLEKAVANFFSGSCAPCADGTDFPQLCQLCPGCGCSTLNQYFGYSGAFKCLKDGAGDVAFVKHSTIFENLANKADRDQYELLCLDNTRKPVDEYKDCHLAQVPSHTVVARSMGGKEDLIWELLNQAQEHFGKDKSKEFQLFSSPHGKDLLFKDSAHGFLKVPPRMDAKMYLGYEYVTAIRNLREGTCPEAPTDECKPVKWCALSHHERLKCDEWSVNSVGKIECVSAETTEDCIAKIMNGEADAMSLDGGFVYIAGKCGLVPVLAENYNKSDNCEDTPEAGFFAVAVVKKSASDLTWDNLKGKKSCHTAVGRTAGWNIPMGLLYNKINHCRFDEFFSEGCAPGSKKDSSLCKLCMGSGLNLCEPNNKEGYYGFTGAFRCLVEKGDVAFVKHQTVPQNTGGKNPDPWAKNLNEKDYELLCLDGTRKPVEEYANCHLARAPNHAVVTRKDKEACVHKILRQQQHLFGSNVTDCSGNFCLFRSETKDLLFRDDTVCLAKLHDRNTYEKYLGEEYVKAVGNLRKCSTSSLLEACTFRRP
SEQ ID NO:6BDNF
MFHQVRRVMTILFLTMVISYFGCMKAAPMKEANIRGQGGLAYPGVRTHGTLESVNGPKAGSRGLTSLADTFEHVIEELLDEDQKVRPNEENNKDADLYTSRVMLSSQVPLEPPLLFLLEEYKNYLDAANMSMRVRRHSDPARRGELSVCDSISEWVTAADKKTAVDMSGGTVTVLEKVPVSKGQLKQYFYETKCNPMGYTKEGCRGIDKRHWNSQCRTTQSYVRALTMDSKKRIGWRFIRIDTSCVCTLT IKRGR
SEQ ID NO:7GDNF
MQSLPNSNGAAAGRDFKMKLWDVVAVCLVLLHTASAFPLPAANMPEDYPDQFDDVMDFIQATIKRLKRSPDKQMAVLPRRERNRQAAAANPENSRGKGRRGQRGKNRGCVLTAIHLNVTDLGLGYETKEELIFRYCSGSCDAAETTYDKILKNLSRNRRLVSDKVGQACCRPIAFDDDLSFLDDNLVYHILRKHSAKRCGCI
SEQ ID NO:8 CNTF
MAFTEHSPLTPHRRDLCSRSIWLARKIRSDLTALTESYVKHQGLNKNINLDSADGMPVASTDQWSELTEAERLQENLQAYRTFHVLLARLLEDQQVHFTPTEGDFHQAIHTLLLQVAAFAYQIEELMILLEYKIPRNEADGMPINVGDGGLFEKKLWGLKVLQELSQWTVRSIHDLRFISSHQTGIPARGSHYIANNKKM
SEQ ID NO:9 PACAP
HSDGIFTDSYSRYRKQMAVKKYLAAVLGKRYKQRVKNK。
序列表
<110> 基立福环球运营有限公司
<120> 具有神经再生性应用的组合物
<130> 2100194
<160> 9
<170> PatentIn version 3.5
<210> 1
<211> 679
<212> PRT
<213> 智人(Homo sapiens)
<400> 1
Val Pro Asp Lys Thr Val Arg Trp Cys Ala Val Ser Glu His Glu Ala
1 5 1015
Thr Lys Cys Gln Ser Phe Arg Asp His Met Lys Ser Val Ile Pro Ser
202530
Asp Gly Pro Ser Val Ala Cys Val Lys Lys Ala Ser Tyr Leu Asp Cys
354045
Ile Arg Ala Ile Ala Ala Asn Glu Ala Asp Ala Val Thr Leu Asp Ala
505560
Gly Leu Val Tyr Asp Ala Tyr Leu Ala Pro Asn Asn Leu Lys Pro Val
65707580
Val Ala Glu Phe Tyr Gly Ser Lys Glu Asp Pro Gln Thr Phe Tyr Tyr
859095
Ala Val Ala Val Val Lys Lys Asp Ser Gly Phe Gln Met Asn Gln Leu
100 105 110
Arg Gly Lys Lys Ser Cys His Thr Gly Leu Gly Arg Ser Ala Gly Trp
115 120 125
Asn Ile Pro Ile Gly Leu Leu Tyr Cys Asp Leu Pro Glu Pro Arg Lys
130 135 140
Pro Leu Glu Lys Ala Val Ala Asn Phe Phe Ser Gly Ser Cys Ala Pro
145 150 155 160
Cys Ala Asp Gly Thr Asp Phe Pro Gln Leu Cys Gln Leu Cys Pro Gly
165 170 175
Cys Gly Cys Ser Thr Leu Asn Gln Tyr Phe Gly Tyr Ser Gly Ala Phe
180 185 190
Lys Cys Leu Lys Asp Gly Ala Gly Asp Val Ala Phe Val Lys His Ser
195 200 205
Thr Ile Phe Glu Asn Leu Ala Asn Lys Ala Asp Arg Asp Gln Tyr Glu
210 215 220
Leu Leu Cys Leu Asp Asn Thr Arg Lys Pro Val Asp Glu Tyr Lys Asp
225 230 235 240
Cys His Leu Ala Gln Val Pro Ser His Thr Val Val Ala Arg Ser Met
245 250 255
Gly Gly Lys Glu Asp Leu Ile Trp Glu Leu Leu Asn Gln Ala Gln Glu
260 265 270
His Phe Gly Lys Asp Lys Ser Lys Glu Phe Gln Leu Phe Ser Ser Pro
275 280 285
His Gly Lys Asp Leu Leu Phe Lys Asp Ser Ala His Gly Phe Leu Lys
290 295 300
Val Pro Pro Arg Met Asp Ala Lys Met Tyr Leu Gly Tyr Glu Tyr Val
305 310 315 320
Thr Ala Ile Arg Asn Leu Arg Glu Gly Thr Cys Pro Glu Ala Pro Thr
325 330 335
Asp Glu Cys Lys Pro Val Lys Trp Cys Ala Leu Ser His His Glu Arg
340 345 350
Leu Lys Cys Asp Glu Trp Ser Val Asn Ser Val Gly Lys Ile Glu Cys
355 360 365
Val Ser Ala Glu Thr Thr Glu Asp Cys Ile Ala Lys Ile Met Asn Gly
370 375 380
Glu Ala Asp Ala Met Ser Leu Asp Gly Gly Phe Val Tyr Ile Ala Gly
385 390 395 400
Lys Cys Gly Leu Val Pro Val Leu Ala Glu Asn Tyr Asn Lys Ser Asp
405 410 415
Asn Cys Glu Asp Thr Pro Glu Ala Gly Tyr Phe Ala Val Ala Val Val
420 425 430
Lys Lys Ser Ala Ser Asp Leu Thr Trp Asp Asn Leu Lys Gly Lys Lys
435 440 445
Ser Cys His Thr Ala Val Gly Arg Thr Ala Gly Trp Asn Ile Pro Met
450 455 460
Gly Leu Leu Tyr Asn Lys Ile Asn His Cys Arg Phe Asp Glu Phe Phe
465 470 475 480
Ser Glu Gly Cys Ala Pro Gly Ser Lys Lys Asp Ser Ser Leu Cys Lys
485 490 495
Leu Cys Met Gly Ser Gly Leu Asn Leu Cys Glu Pro Asn Asn Lys Glu
500 505 510
Gly Tyr Tyr Gly Tyr Thr Gly Ala Phe Arg Cys Leu Val Glu Lys Gly
515 520 525
Asp Val Ala Phe Val Lys His Gln Thr Val Pro Gln Asn Thr Gly Gly
530 535 540
Lys Asn Pro Asp Pro Trp Ala Lys Asn Leu Asn Glu Lys Asp Tyr Glu
545 550 555 560
Leu Leu Cys Leu Asp Gly Thr Arg Lys Pro Val Glu Glu Tyr Ala Asn
565 570 575
Cys His Leu Ala Arg Ala Pro Asn His Ala Val Val Thr Arg Lys Asp
580 585 590
Lys Glu Ala Cys Val His Lys Ile Leu Arg Gln Gln Gln His Leu Phe
595 600 605
Gly Ser Asn Val Thr Asp Cys Ser Gly Asn Phe Cys Leu Phe Arg Ser
610 615 620
Glu Thr Lys Asp Leu Leu Phe Arg Asp Asp Thr Val Cys Leu Ala Lys
625 630 635 640
Leu His Asp Arg Asn Thr Tyr Glu Lys Tyr Leu Gly Glu Glu Tyr Val
645 650 655
Lys Ala Val Gly Asn Leu Arg Lys Cys Ser Thr Ser Ser Leu Leu Glu
660 665 670
Ala Cys Thr Phe Arg Arg Pro
675
<210> 2
<211> 692
<212> PRT
<213> 智人(Homo sapiens)
<400> 2
Gly Arg Arg Arg Arg Ser Val Gln Trp Cys Thr Val Ser Gln Pro Glu
1 5 1015
Ala Thr Lys Cys Phe Gln Trp Gln Arg Asn Met Arg Arg Val Arg Gly
202530
Pro Pro Val Ser Cys Ile Lys Arg Asp Ser Pro Ile Gln Cys Ile Gln
354045
Ala Ile Ala Glu Asn Arg Ala Asp Ala Val Thr Leu Asp Gly Gly Phe
505560
Ile Tyr Glu Ala Gly Leu Ala Pro Tyr Lys Leu Arg Pro Val Ala Ala
65707580
Glu Val Tyr Gly Thr Glu Arg Gln Pro Arg Thr His Tyr Tyr Ala Val
859095
Ala Val Val Lys Lys Gly Gly Ser Phe Gln Leu Asn Glu Leu Gln Gly
100 105 110
Leu Lys Ser Cys His Thr Gly Leu Arg Arg Thr Ala Gly Trp Asn Val
115 120 125
Pro Ile Gly Thr Leu Arg Pro Phe Leu Asn Trp Thr Gly Pro Pro Glu
130 135 140
Pro Ile Glu Ala Ala Val Ala Arg Phe Phe Ser Ala Ser Cys Val Pro
145 150 155 160
Gly Ala Asp Lys Gly Gln Phe Pro Asn Leu Cys Arg Leu Cys Ala Gly
165 170 175
Thr Gly Glu Asn Lys Cys Ala Phe Ser Ser Gln Glu Pro Tyr Phe Ser
180 185 190
Tyr Ser Gly Ala Phe Lys Cys Leu Arg Asp Gly Ala Gly Asp Val Ala
195 200 205
Phe Ile Arg Glu Ser Thr Val Phe Glu Asp Leu Ser Asp Glu Ala Glu
210 215 220
Arg Asp Glu Tyr Glu Leu Leu Cys Pro Asp Asn Thr Arg Lys Pro Val
225 230 235 240
Asp Lys Phe Lys Asp Cys His Leu Ala Arg Val Pro Ser His Ala Val
245 250 255
Val Ala Arg Ser Val Asn Gly Lys Glu Asp Ala Ile Trp Asn Leu Leu
260 265 270
Arg Gln Ala Gln Glu Lys Phe Gly Lys Asp Lys Ser Pro Lys Phe Gln
275 280 285
Leu Phe Gly Ser Pro Ser Gly Gln Lys Asp Leu Leu Phe Lys Asp Ser
290 295 300
Ala Ile Gly Phe Ser Arg Val Pro Pro Arg Ile Asp Ser Gly Leu Tyr
305 310 315 320
Leu Gly Ser Gly Tyr Phe Thr Ala Ile Gln Asn Leu Arg Lys Ser Glu
325 330 335
Glu Glu Val Ala Ala Arg Arg Ala Arg Val Val Trp Cys Ala Val Gly
340 345 350
Glu Gln Glu Leu Arg Lys Cys Asn Gln Trp Ser Gly Leu Ser Glu Gly
355 360 365
Ser Val Thr Cys Ser Ser Ala Ser Thr Thr Glu Asp Cys Ile Ala Leu
370 375 380
Val Leu Lys Gly Glu Ala Asp Ala Met Ser Leu Asp Gly Gly Tyr Val
385 390 395 400
Tyr Thr Ala Gly Lys Cys Gly Leu Val Pro Val Leu Ala Glu Asn Tyr
405 410 415
Lys Ser Gln Gln Ser Ser Asp Pro Asp Pro Asn Cys Val Asp Arg Pro
420 425 430
Val Glu Gly Tyr Leu Ala Val Ala Val Val Arg Arg Ser Asp Thr Ser
435 440 445
Leu Thr Trp Asn Ser Val Lys Gly Lys Lys Ser Cys His Thr Ala Val
450 455 460
Asp Arg Thr Ala Gly Trp Asn Ile Pro Met Gly Leu Leu Phe Asn Gln
465 470 475 480
Thr Gly Ser Cys Lys Phe Asp Glu Tyr Phe Ser Gln Ser Cys Ala Pro
485 490 495
Gly Ser Asp Pro Arg Ser Asn Leu Cys Ala Leu Cys Ile Gly Asp Glu
500 505 510
Gln Gly Glu Asn Lys Cys Val Pro Asn Ser Asn Glu Arg Tyr Tyr Gly
515 520 525
Tyr Thr Gly Ala Phe Arg Cys Leu Ala Glu Asn Ala Gly Asp Val Ala
530 535 540
Phe Val Lys Asp Val Thr Val Leu Gln Asn Thr Asp Gly Asn Asn Asn
545 550 555 560
Asp Ala Trp Ala Lys Asp Leu Lys Leu Ala Asp Phe Ala Leu Leu Cys
565 570 575
Leu Asp Gly Lys Arg Lys Pro Val Thr Glu Ala Arg Ser Cys His Leu
580 585 590
Ala Met Ala Pro Asn His Ala Val Val Ser Arg Met Asp Lys Val Glu
595 600 605
Arg Leu Lys Gln Val Leu Leu His Gln Gln Ala Lys Phe Gly Arg Asn
610 615 620
Gly Ser Asp Cys Pro Asp Lys Phe Cys Leu Phe Gln Ser Glu Thr Lys
625 630 635 640
Asn Leu Leu Phe Asn Asp Asn Thr Glu Cys Leu Ala Arg Leu His Gly
645 650 655
Lys Thr Thr Tyr Glu Lys Tyr Leu Gly Pro Gln Tyr Val Ala Gly Ile
660 665 670
Thr Asn Leu Lys Lys Cys Ser Thr Ser Pro Leu Leu Glu Ala Cys Glu
675 680 685
Phe Leu Arg Lys
690
<210> 3
<211> 679
<212> PRT
<213> 人工序列(Artificial Sequence)
<220>
<223> Y188F突变体
<400> 3
Val Pro Asp Lys Thr Val Arg Trp Cys Ala Val Ser Glu His Glu Ala
1 5 1015
Thr Lys Cys Gln Ser Phe Arg Asp His Met Lys Ser Val Ile Pro Ser
202530
Asp Gly Pro Ser Val Ala Cys Val Lys Lys Ala Ser Tyr Leu Asp Cys
354045
Ile Arg Ala Ile Ala Ala Asn Glu Ala Asp Ala Val Thr Leu Asp Ala
505560
Gly Leu Val Tyr Asp Ala Tyr Leu Ala Pro Asn Asn Leu Lys Pro Val
65707580
Val Ala Glu Phe Tyr Gly Ser Lys Glu Asp Pro Gln Thr Phe Tyr Tyr
859095
Ala Val Ala Val Val Lys Lys Asp Ser Gly Phe Gln Met Asn Gln Leu
100 105 110
Arg Gly Lys Lys Ser Cys His Thr Gly Leu Gly Arg Ser Ala Gly Trp
115 120 125
Asn Ile Pro Ile Gly Leu Leu Tyr Cys Asp Leu Pro Glu Pro Arg Lys
130 135 140
Pro Leu Glu Lys Ala Val Ala Asn Phe Phe Ser Gly Ser Cys Ala Pro
145 150 155 160
Cys Ala Asp Gly Thr Asp Phe Pro Gln Leu Cys Gln Leu Cys Pro Gly
165 170 175
Cys Gly Cys Ser Thr Leu Asn Gln Tyr Phe Gly Phe Ser Gly Ala Phe
180 185 190
Lys Cys Leu Lys Asp Gly Ala Gly Asp Val Ala Phe Val Lys His Ser
195 200 205
Thr Ile Phe Glu Asn Leu Ala Asn Lys Ala Asp Arg Asp Gln Tyr Glu
210 215 220
Leu Leu Cys Leu Asp Asn Thr Arg Lys Pro Val Asp Glu Tyr Lys Asp
225 230 235 240
Cys His Leu Ala Gln Val Pro Ser His Thr Val Val Ala Arg Ser Met
245 250 255
Gly Gly Lys Glu Asp Leu Ile Trp Glu Leu Leu Asn Gln Ala Gln Glu
260 265 270
His Phe Gly Lys Asp Lys Ser Lys Glu Phe Gln Leu Phe Ser Ser Pro
275 280 285
His Gly Lys Asp Leu Leu Phe Lys Asp Ser Ala His Gly Phe Leu Lys
290 295 300
Val Pro Pro Arg Met Asp Ala Lys Met Tyr Leu Gly Tyr Glu Tyr Val
305 310 315 320
Thr Ala Ile Arg Asn Leu Arg Glu Gly Thr Cys Pro Glu Ala Pro Thr
325 330 335
Asp Glu Cys Lys Pro Val Lys Trp Cys Ala Leu Ser His His Glu Arg
340 345 350
Leu Lys Cys Asp Glu Trp Ser Val Asn Ser Val Gly Lys Ile Glu Cys
355 360 365
Val Ser Ala Glu Thr Thr Glu Asp Cys Ile Ala Lys Ile Met Asn Gly
370 375 380
Glu Ala Asp Ala Met Ser Leu Asp Gly Gly Phe Val Tyr Ile Ala Gly
385 390 395 400
Lys Cys Gly Leu Val Pro Val Leu Ala Glu Asn Tyr Asn Lys Ser Asp
405 410 415
Asn Cys Glu Asp Thr Pro Glu Ala Gly Tyr Phe Ala Val Ala Val Val
420 425 430
Lys Lys Ser Ala Ser Asp Leu Thr Trp Asp Asn Leu Lys Gly Lys Lys
435 440 445
Ser Cys His Thr Ala Val Gly Arg Thr Ala Gly Trp Asn Ile Pro Met
450 455 460
Gly Leu Leu Tyr Asn Lys Ile Asn His Cys Arg Phe Asp Glu Phe Phe
465 470 475 480
Ser Glu Gly Cys Ala Pro Gly Ser Lys Lys Asp Ser Ser Leu Cys Lys
485 490 495
Leu Cys Met Gly Ser Gly Leu Asn Leu Cys Glu Pro Asn Asn Lys Glu
500 505 510
Gly Tyr Tyr Gly Tyr Thr Gly Ala Phe Arg Cys Leu Val Glu Lys Gly
515 520 525
Asp Val Ala Phe Val Lys His Gln Thr Val Pro Gln Asn Thr Gly Gly
530 535 540
Lys Asn Pro Asp Pro Trp Ala Lys Asn Leu Asn Glu Lys Asp Tyr Glu
545 550 555 560
Leu Leu Cys Leu Asp Gly Thr Arg Lys Pro Val Glu Glu Tyr Ala Asn
565 570 575
Cys His Leu Ala Arg Ala Pro Asn His Ala Val Val Thr Arg Lys Asp
580 585 590
Lys Glu Ala Cys Val His Lys Ile Leu Arg Gln Gln Gln His Leu Phe
595 600 605
Gly Ser Asn Val Thr Asp Cys Ser Gly Asn Phe Cys Leu Phe Arg Ser
610 615 620
Glu Thr Lys Asp Leu Leu Phe Arg Asp Asp Thr Val Cys Leu Ala Lys
625 630 635 640
Leu His Asp Arg Asn Thr Tyr Glu Lys Tyr Leu Gly Glu Glu Tyr Val
645 650 655
Lys Ala Val Gly Asn Leu Arg Lys Cys Ser Thr Ser Ser Leu Leu Glu
660 665 670
Ala Cys Thr Phe Arg Arg Pro
675
<210> 4
<211> 679
<212> PRT
<213> 人工序列(Artificial Sequence)
<220>
<223> Y95F/Y188F突变体
<400> 4
Val Pro Asp Lys Thr Val Arg Trp Cys Ala Val Ser Glu His Glu Ala
1 5 1015
Thr Lys Cys Gln Ser Phe Arg Asp His Met Lys Ser Val Ile Pro Ser
202530
Asp Gly Pro Ser Val Ala Cys Val Lys Lys Ala Ser Tyr Leu Asp Cys
354045
Ile Arg Ala Ile Ala Ala Asn Glu Ala Asp Ala Val Thr Leu Asp Ala
505560
Gly Leu Val Tyr Asp Ala Tyr Leu Ala Pro Asn Asn Leu Lys Pro Val
65707580
Val Ala Glu Phe Tyr Gly Ser Lys Glu Asp Pro Gln Thr Phe Phe Tyr
859095
Ala Val Ala Val Val Lys Lys Asp Ser Gly Phe Gln Met Asn Gln Leu
100 105 110
Arg Gly Lys Lys Ser Cys His Thr Gly Leu Gly Arg Ser Ala Gly Trp
115 120 125
Asn Ile Pro Ile Gly Leu Leu Tyr Cys Asp Leu Pro Glu Pro Arg Lys
130 135 140
Pro Leu Glu Lys Ala Val Ala Asn Phe Phe Ser Gly Ser Cys Ala Pro
145 150 155 160
Cys Ala Asp Gly Thr Asp Phe Pro Gln Leu Cys Gln Leu Cys Pro Gly
165 170 175
Cys Gly Cys Ser Thr Leu Asn Gln Tyr Phe Gly Phe Ser Gly Ala Phe
180 185 190
Lys Cys Leu Lys Asp Gly Ala Gly Asp Val Ala Phe Val Lys His Ser
195 200 205
Thr Ile Phe Glu Asn Leu Ala Asn Lys Ala Asp Arg Asp Gln Tyr Glu
210 215 220
Leu Leu Cys Leu Asp Asn Thr Arg Lys Pro Val Asp Glu Tyr Lys Asp
225 230 235 240
Cys His Leu Ala Gln Val Pro Ser His Thr Val Val Ala Arg Ser Met
245 250 255
Gly Gly Lys Glu Asp Leu Ile Trp Glu Leu Leu Asn Gln Ala Gln Glu
260 265 270
His Phe Gly Lys Asp Lys Ser Lys Glu Phe Gln Leu Phe Ser Ser Pro
275 280 285
His Gly Lys Asp Leu Leu Phe Lys Asp Ser Ala His Gly Phe Leu Lys
290 295 300
Val Pro Pro Arg Met Asp Ala Lys Met Tyr Leu Gly Tyr Glu Tyr Val
305 310 315 320
Thr Ala Ile Arg Asn Leu Arg Glu Gly Thr Cys Pro Glu Ala Pro Thr
325 330 335
Asp Glu Cys Lys Pro Val Lys Trp Cys Ala Leu Ser His His Glu Arg
340 345 350
Leu Lys Cys Asp Glu Trp Ser Val Asn Ser Val Gly Lys Ile Glu Cys
355 360 365
Val Ser Ala Glu Thr Thr Glu Asp Cys Ile Ala Lys Ile Met Asn Gly
370 375 380
Glu Ala Asp Ala Met Ser Leu Asp Gly Gly Phe Val Tyr Ile Ala Gly
385 390 395 400
Lys Cys Gly Leu Val Pro Val Leu Ala Glu Asn Tyr Asn Lys Ser Asp
405 410 415
Asn Cys Glu Asp Thr Pro Glu Ala Gly Tyr Phe Ala Val Ala Val Val
420 425 430
Lys Lys Ser Ala Ser Asp Leu Thr Trp Asp Asn Leu Lys Gly Lys Lys
435 440 445
Ser Cys His Thr Ala Val Gly Arg Thr Ala Gly Trp Asn Ile Pro Met
450 455 460
Gly Leu Leu Tyr Asn Lys Ile Asn His Cys Arg Phe Asp Glu Phe Phe
465 470 475 480
Ser Glu Gly Cys Ala Pro Gly Ser Lys Lys Asp Ser Ser Leu Cys Lys
485 490 495
Leu Cys Met Gly Ser Gly Leu Asn Leu Cys Glu Pro Asn Asn Lys Glu
500 505 510
Gly Tyr Tyr Gly Tyr Thr Gly Ala Phe Arg Cys Leu Val Glu Lys Gly
515 520 525
Asp Val Ala Phe Val Lys His Gln Thr Val Pro Gln Asn Thr Gly Gly
530 535 540
Lys Asn Pro Asp Pro Trp Ala Lys Asn Leu Asn Glu Lys Asp Tyr Glu
545 550 555 560
Leu Leu Cys Leu Asp Gly Thr Arg Lys Pro Val Glu Glu Tyr Ala Asn
565 570 575
Cys His Leu Ala Arg Ala Pro Asn His Ala Val Val Thr Arg Lys Asp
580 585 590
Lys Glu Ala Cys Val His Lys Ile Leu Arg Gln Gln Gln His Leu Phe
595 600 605
Gly Ser Asn Val Thr Asp Cys Ser Gly Asn Phe Cys Leu Phe Arg Ser
610 615 620
Glu Thr Lys Asp Leu Leu Phe Arg Asp Asp Thr Val Cys Leu Ala Lys
625 630 635 640
Leu His Asp Arg Asn Thr Tyr Glu Lys Tyr Leu Gly Glu Glu Tyr Val
645 650 655
Lys Ala Val Gly Asn Leu Arg Lys Cys Ser Thr Ser Ser Leu Leu Glu
660 665 670
Ala Cys Thr Phe Arg Arg Pro
675
<210> 5
<211> 679
<212> PRT
<213> 人工序列(Artificial Sequence)
<220>
<223> Y426F/Y517F突变体
<400> 5
Val Pro Asp Lys Thr Val Arg Trp Cys Ala Val Ser Glu His Glu Ala
1 5 1015
Thr Lys Cys Gln Ser Phe Arg Asp His Met Lys Ser Val Ile Pro Ser
202530
Asp Gly Pro Ser Val Ala Cys Val Lys Lys Ala Ser Tyr Leu Asp Cys
354045
Ile Arg Ala Ile Ala Ala Asn Glu Ala Asp Ala Val Thr Leu Asp Ala
505560
Gly Leu Val Tyr Asp Ala Tyr Leu Ala Pro Asn Asn Leu Lys Pro Val
65707580
Val Ala Glu Phe Tyr Gly Ser Lys Glu Asp Pro Gln Thr Phe Tyr Tyr
859095
Ala Val Ala Val Val Lys Lys Asp Ser Gly Phe Gln Met Asn Gln Leu
100 105 110
Arg Gly Lys Lys Ser Cys His Thr Gly Leu Gly Arg Ser Ala Gly Trp
115 120 125
Asn Ile Pro Ile Gly Leu Leu Tyr Cys Asp Leu Pro Glu Pro Arg Lys
130 135 140
Pro Leu Glu Lys Ala Val Ala Asn Phe Phe Ser Gly Ser Cys Ala Pro
145 150 155 160
Cys Ala Asp Gly Thr Asp Phe Pro Gln Leu Cys Gln Leu Cys Pro Gly
165 170 175
Cys Gly Cys Ser Thr Leu Asn Gln Tyr Phe Gly Tyr Ser Gly Ala Phe
180 185 190
Lys Cys Leu Lys Asp Gly Ala Gly Asp Val Ala Phe Val Lys His Ser
195 200 205
Thr Ile Phe Glu Asn Leu Ala Asn Lys Ala Asp Arg Asp Gln Tyr Glu
210 215 220
Leu Leu Cys Leu Asp Asn Thr Arg Lys Pro Val Asp Glu Tyr Lys Asp
225 230 235 240
Cys His Leu Ala Gln Val Pro Ser His Thr Val Val Ala Arg Ser Met
245 250 255
Gly Gly Lys Glu Asp Leu Ile Trp Glu Leu Leu Asn Gln Ala Gln Glu
260 265 270
His Phe Gly Lys Asp Lys Ser Lys Glu Phe Gln Leu Phe Ser Ser Pro
275 280 285
His Gly Lys Asp Leu Leu Phe Lys Asp Ser Ala His Gly Phe Leu Lys
290 295 300
Val Pro Pro Arg Met Asp Ala Lys Met Tyr Leu Gly Tyr Glu Tyr Val
305 310 315 320
Thr Ala Ile Arg Asn Leu Arg Glu Gly Thr Cys Pro Glu Ala Pro Thr
325 330 335
Asp Glu Cys Lys Pro Val Lys Trp Cys Ala Leu Ser His His Glu Arg
340 345 350
Leu Lys Cys Asp Glu Trp Ser Val Asn Ser Val Gly Lys Ile Glu Cys
355 360 365
Val Ser Ala Glu Thr Thr Glu Asp Cys Ile Ala Lys Ile Met Asn Gly
370 375 380
Glu Ala Asp Ala Met Ser Leu Asp Gly Gly Phe Val Tyr Ile Ala Gly
385 390 395 400
Lys Cys Gly Leu Val Pro Val Leu Ala Glu Asn Tyr Asn Lys Ser Asp
405 410 415
Asn Cys Glu Asp Thr Pro Glu Ala Gly Phe Phe Ala Val Ala Val Val
420 425 430
Lys Lys Ser Ala Ser Asp Leu Thr Trp Asp Asn Leu Lys Gly Lys Lys
435 440 445
Ser Cys His Thr Ala Val Gly Arg Thr Ala Gly Trp Asn Ile Pro Met
450 455 460
Gly Leu Leu Tyr Asn Lys Ile Asn His Cys Arg Phe Asp Glu Phe Phe
465 470 475 480
Ser Glu Gly Cys Ala Pro Gly Ser Lys Lys Asp Ser Ser Leu Cys Lys
485 490 495
Leu Cys Met Gly Ser Gly Leu Asn Leu Cys Glu Pro Asn Asn Lys Glu
500 505 510
Gly Tyr Tyr Gly Phe Thr Gly Ala Phe Arg Cys Leu Val Glu Lys Gly
515 520 525
Asp Val Ala Phe Val Lys His Gln Thr Val Pro Gln Asn Thr Gly Gly
530 535 540
Lys Asn Pro Asp Pro Trp Ala Lys Asn Leu Asn Glu Lys Asp Tyr Glu
545 550 555 560
Leu Leu Cys Leu Asp Gly Thr Arg Lys Pro Val Glu Glu Tyr Ala Asn
565 570 575
Cys His Leu Ala Arg Ala Pro Asn His Ala Val Val Thr Arg Lys Asp
580 585 590
Lys Glu Ala Cys Val His Lys Ile Leu Arg Gln Gln Gln His Leu Phe
595 600 605
Gly Ser Asn Val Thr Asp Cys Ser Gly Asn Phe Cys Leu Phe Arg Ser
610 615 620
Glu Thr Lys Asp Leu Leu Phe Arg Asp Asp Thr Val Cys Leu Ala Lys
625 630 635 640
Leu His Asp Arg Asn Thr Tyr Glu Lys Tyr Leu Gly Glu Glu Tyr Val
645 650 655
Lys Ala Val Gly Asn Leu Arg Lys Cys Ser Thr Ser Ser Leu Leu Glu
660 665 670
Ala Cys Thr Phe Arg Arg Pro
675
<210> 6
<211> 255
<212> PRT
<213> 智人(Homo sapiens)
<400> 6
Met Phe His Gln Val Arg Arg Val Met Thr Ile Leu Phe Leu Thr Met
1 5 1015
Val Ile Ser Tyr Phe Gly Cys Met Lys Ala Ala Pro Met Lys Glu Ala
202530
Asn Ile Arg Gly Gln Gly Gly Leu Ala Tyr Pro Gly Val Arg Thr His
354045
Gly Thr Leu Glu Ser Val Asn Gly Pro Lys Ala Gly Ser Arg Gly Leu
505560
Thr Ser Leu Ala Asp Thr Phe Glu His Val Ile Glu Glu Leu Leu Asp
65707580
Glu Asp Gln Lys Val Arg Pro Asn Glu Glu Asn Asn Lys Asp Ala Asp
859095
Leu Tyr Thr Ser Arg Val Met Leu Ser Ser Gln Val Pro Leu Glu Pro
100 105 110
Pro Leu Leu Phe Leu Leu Glu Glu Tyr Lys Asn Tyr Leu Asp Ala Ala
115 120 125
Asn Met Ser Met Arg Val Arg Arg His Ser Asp Pro Ala Arg Arg Gly
130 135 140
Glu Leu Ser Val Cys Asp Ser Ile Ser Glu Trp Val Thr Ala Ala Asp
145 150 155 160
Lys Lys Thr Ala Val Asp Met Ser Gly Gly Thr Val Thr Val Leu Glu
165 170 175
Lys Val Pro Val Ser Lys Gly Gln Leu Lys Gln Tyr Phe Tyr Glu Thr
180 185 190
Lys Cys Asn Pro Met Gly Tyr Thr Lys Glu Gly Cys Arg Gly Ile Asp
195 200 205
Lys Arg His Trp Asn Ser Gln Cys Arg Thr Thr Gln Ser Tyr Val Arg
210 215 220
Ala Leu Thr Met Asp Ser Lys Lys Arg Ile Gly Trp Arg Phe Ile Arg
225 230 235 240
Ile Asp Thr Ser Cys Val Cys Thr Leu Thr Ile Lys Arg Gly Arg
245 250 255
<210> 7
<211> 202
<212> PRT
<213> 智人(Homo sapiens)
<400> 7
Met Gln Ser Leu Pro Asn Ser Asn Gly Ala Ala Ala Gly Arg Asp Phe
1 5 1015
Lys Met Lys Leu Trp Asp Val Val Ala Val Cys Leu Val Leu Leu His
202530
Thr Ala Ser Ala Phe Pro Leu Pro Ala Ala Asn Met Pro Glu Asp Tyr
354045
Pro Asp Gln Phe Asp Asp Val Met Asp Phe Ile Gln Ala Thr Ile Lys
505560
Arg Leu Lys Arg Ser Pro Asp Lys Gln Met Ala Val Leu Pro Arg Arg
65707580
Glu Arg Asn Arg Gln Ala Ala Ala Ala Asn Pro Glu Asn Ser Arg Gly
859095
Lys Gly Arg Arg Gly Gln Arg Gly Lys Asn Arg Gly Cys Val Leu Thr
100 105 110
Ala Ile His Leu Asn Val Thr Asp Leu Gly Leu Gly Tyr Glu Thr Lys
115 120 125
Glu Glu Leu Ile Phe Arg Tyr Cys Ser Gly Ser Cys Asp Ala Ala Glu
130 135 140
Thr Thr Tyr Asp Lys Ile Leu Lys Asn Leu Ser Arg Asn Arg Arg Leu
145 150 155 160
Val Ser Asp Lys Val Gly Gln Ala Cys Cys Arg Pro Ile Ala Phe Asp
165 170 175
Asp Asp Leu Ser Phe Leu Asp Asp Asn Leu Val Tyr His Ile Leu Arg
180 185 190
Lys His Ser Ala Lys Arg Cys Gly Cys Ile
195 200
<210> 8
<211> 200
<212> PRT
<213> 智人(Homo sapiens)
<400> 8
Met Ala Phe Thr Glu His Ser Pro Leu Thr Pro His Arg Arg Asp Leu
1 5 1015
Cys Ser Arg Ser Ile Trp Leu Ala Arg Lys Ile Arg Ser Asp Leu Thr
202530
Ala Leu Thr Glu Ser Tyr Val Lys His Gln Gly Leu Asn Lys Asn Ile
354045
Asn Leu Asp Ser Ala Asp Gly Met Pro Val Ala Ser Thr Asp Gln Trp
505560
Ser Glu Leu Thr Glu Ala Glu Arg Leu Gln Glu Asn Leu Gln Ala Tyr
65707580
Arg Thr Phe His Val Leu Leu Ala Arg Leu Leu Glu Asp Gln Gln Val
859095
His Phe Thr Pro Thr Glu Gly Asp Phe His Gln Ala Ile His Thr Leu
100 105 110
Leu Leu Gln Val Ala Ala Phe Ala Tyr Gln Ile Glu Glu Leu Met Ile
115 120 125
Leu Leu Glu Tyr Lys Ile Pro Arg Asn Glu Ala Asp Gly Met Pro Ile
130 135 140
Asn Val Gly Asp Gly Gly Leu Phe Glu Lys Lys Leu Trp Gly Leu Lys
145 150 155 160
Val Leu Gln Glu Leu Ser Gln Trp Thr Val Arg Ser Ile His Asp Leu
165 170 175
Arg Phe Ile Ser Ser His Gln Thr Gly Ile Pro Ala Arg Gly Ser His
180 185 190
Tyr Ile Ala Asn Asn Lys Lys Met
195 200
<210> 9
<211> 38
<212> PRT
<213> 智人(Homo sapiens)
<400> 9
His Ser Asp Gly Ile Phe Thr Asp Ser Tyr Ser Arg Tyr Arg Lys Gln
1 5 1015
Met Ala Val Lys Lys Tyr Leu Ala Ala Val Leu Gly Lys Arg Tyr Lys
202530
Gln Arg Val Lys Asn Lys
35
- 具有良好流动性的耐水解PBT组合物及其制备方法和应用
- 一种具有高可靠性的液晶组合物及其应用
- 具有氟联苯基的介电各向异性为负的液晶性化合物、液晶组合物及液晶显示元件
- 具有神经再生性应用的组合物
- 拒液性化合物、拒液性聚合物、固化性组合物、涂布用组合物、以及具有固化膜的物品、具有亲液性区域和拒液性区域的图案的物品及其制造方法
