变异金黄色葡萄球菌LukA和LukB多肽和疫苗组合物
文献发布时间:2024-01-17 01:26:37
交叉引用
本申请要求2020年09月28日提交的序列号为63/084,273的美国临时专利申请的优先权,该申请通过引用整体结合于此。
技术领域
本公开涉及变异的金黄色葡萄球菌杀白细胞素A(LukA)和杀白细胞素B(LukB)蛋白和多肽、包含这些LukA和LukB变体的疫苗组合物,以及所述疫苗组合物在受试者中诱导免疫应答以治疗和/或预防金黄色葡萄球菌感染的用途。
背景技术
金黄色葡萄球菌引起广泛的侵袭性疾病,包括败血症、感染性心内膜炎和中毒性休克,以及不太严重的皮肤和软组织感染(Tong等人,“Staphylococcus aureusInfections:Epidemiology,Pathophysiology,Clinical Manifestations,andManagement,”Clin.Microbiol.Rev.28(3):603-661(2015))。目前,没有批准用于对抗金黄色葡萄球菌的疫苗,治疗选择受到新出现的抗生素耐药性的进一步限制(Sause等人,“Antibody-BasedBiologics and Their Promise to Combat Staphylococcus aureusInfections,”Trends Pharmacol.Sci.37(3):231-241(2016))。金黄色葡萄球菌引起多种临床综合征的能力通常与基因组含量的主要变化有关(Copin等人,“After the Deluge:Mining Staphylococcus aureus Genomic Data for Clinical Associations and Host-Pathogen Interactions,”Curr.Opin.Microbiol.41:43-50(2018)和Recker等人,“ClonalDifferences in Staphylococcus aureus Bacteraemia-Associated Mortality,”Nat.Microbiol.2(10):1381-1388(2017))。值得注意的是,大约40%的基因组不是所有金黄色葡萄球菌分离株所共有的(Bosi等人,“Comparative Genome-Scale ModellingofStaphylococcus aureus Strains Identifies Strain-Specific MetabolicCapabilities Linked to Pathogenicity,”Proc.Natl.Acad.Sci.USA 113(26):E3801-3809(2016)),因而使疫苗和生物制品生产的保守靶标的鉴定更加复杂。
本公开旨在克服本领域中的这些和其他限制。
发明内容
本公开的第一方面涉及变异的金黄色葡萄球菌杀白细胞素A蛋白或其多肽。在一个方面,所述LukA变体是SEQ ID NO:25的LukA蛋白或多肽的变体,包括对应于SEQ ID NO:25的氨基酸残基Lys83、Ser141、Val113、Val193的一个或多个氨基酸残基上的氨基酸取代。
本公开的其他方面涉及具有一个或多个附加氨基酸取代、缺失和/或添加至上述氨基酸的LukA变体。本公开还涉及编码变异LukA蛋白或多肽的核酸分子,以及包含前述核酸分子的表达载体。
本公开的另一方面涉及变异的金黄色葡萄球菌杀白细胞素B蛋白或其多肽。在一个方面,LukB变体是SEQ ID NO:39的LukB蛋白或多肽的变体,包含对应于SEQ ID NO:39的氨基酸残基Val53上的氨基酸取代。
在一个方面,LukB变体是SEQ ID NO:39的LukB蛋白或多肽的变体,包含对应于氨基酸残基Glu45、Glu109、Thr121和Arg154的氨基酸残基上的氨基酸取代。
本公开的其他方面涉及具有一个或多个附加氨基酸取代、缺失和/或添加至上述氨基酸的LukB变体。本公开还涉及编码变异LukB蛋白或多肽的核酸分子,以及包含前述核酸分子的表达载体。
本公开的另一方面涉及一种表达载体,所述表达载体包含编码本文所述LukA变异多肽的核酸分子,所述核酸分子可操作地与编码本文所述LukB多肽或LukB变异多肽的核酸分子偶联。
本公开的另一方面涉及包含本文所述的任何一种或多种表达载体的宿主细胞。
本公开的另一个方面涉及包含本文所述LukA变异多肽的金黄色葡萄球菌疫苗组合物。
本公开的另一方面涉及包含本文所述的LukB变异多肽的金黄色葡萄球菌疫苗组合物。
本公开的另一个方面涉及金黄色葡萄球菌疫苗组合物,包含本文所述的LukA变异多肽和本文所述的LukB变异多肽。
本公开的另一方面涉及在受试者中产生针对金黄色葡萄球菌的免疫应答的方法。所述方法包括在所述受试者中可有效产生针对金黄色葡萄球菌的所述免疫应答的条件下,向所述受试者施用本文所述的疫苗组合物。
金黄色葡萄球菌(S.aureus)是导致大量医院和社区获得性感染的原因。为了逃避免疫系统的清除,金黄色葡萄球菌采用多种方法,包括分泌被称为杀白细胞素的双组分成孔毒素。每个杀白细胞素由两个约300个氨基酸长的多肽组成,分为宿主细胞靶向(S型,慢,基于其色谱洗脱曲线)和聚合作用(F型,快)的亚单位。在人类金黄色葡萄球菌分离株中已经记载了多达五种杀白细胞素:Panton-Valentine杀白细胞素(PVL,或LukSF-PV)、γ-溶血素(HlgAB和HlgCB)、杀白细胞素ED(LukED)和杀白细胞素AB(LukB,也称为LukGH)。杀白细胞素与特定的细胞表面蛋白受体结合,并组装成低聚孔,最终由于快速渗透失调而导致细胞溶解(Spaan等人,“Leukocidins:Staphylococcal Bi-Component Pore-Forming Toxinsfind their Receptors”Nat.Rev.Microbiol.15(7):435-447(2017))。
最近发现的杀白细胞素,LukAB(DuMont等,“Characterization ofaNewCytotoxinthat Contributes to Staphylococcus aureusPathogenesis”Mol.Microbiol.79(3):814-825(2011)),具有几个区别于其他双组分杀白细胞素的独特特征。LukA(S型)和LukB(F型)亚单位作为预组装的二聚体存在于溶液中,而不是单独的单体(DuMont等人,“Identification ofa Crucial Residue Required for Staphylococcusaureus LukAB Cytotoxicity and Receptor Recognition”Infection and Immunity 82(3):1268-1276(2014))。而且,LukAB靶向宿主细胞表面的CD11b/CD18整合素(DuMont等,“Staphylococcus aureus LukAB cytotoxin kills human neutrophils by targetingthe CD11b subunit of the integrin Mac-1”Proc Natl Acad Sci USA.110(26):10794-9(2013)),不同于PVL、LukED、HlgAB和HlgCB,它们与特定的七种跨膜趋化因子受体相互作用(Spaan等人,“Leukocidins:Staphylococcal Bi-Component Pore-Forming ToxinsfindtheirReceptors”Nat.Rev.Microbiol.15(7):435-447(2017))。最后,LukAB是在使用了原代人白细胞的体外感染模型中负责金黄色葡萄球菌介导的细胞裂解的主要毒素(DuMont等人,“Characterization ofaNew Cytotoxin that Contributes toStaphylococcus aureus Pathogenesis”Mol.Microbiol.79(3):814-825(2011))。这些独特的特征可能是由LukAB与其他杀白细胞素的差异来解释的。通常的,在每组中,S型和F型成分分别具有71-82%和65-81%的同一性,而LukA和LukB与其他杀白细胞素只有30%和39%的同一性。重要的是,杀白细胞素AB(LukAB)存在于迄今为止记载的所有人类感染分离株中,并且在最远的葡萄球菌谱系之间表现出高达20%的氨基酸差异。
鉴于LukAB毒素在金黄色葡萄球菌发病机理和感染中的重要性,本文公开了新的LukA和LukB变异蛋白和多肽。本文公开的LukA和LukB变异蛋白和多肽保留了它们相互之间二聚化的能力,因为它们可以维持天然毒素结构并向免疫系统呈现以产生强大的免疫反应使它们成为理想的疫苗候选物,但缺点是缺乏细胞毒性活性。鉴于每年有大量的人感染金黄色葡萄球菌,这些感染中很大一部分很可能对传统的抗生素治疗无效。本文记载的治疗,更重要的是预防此类感染的创新方法包括抑制金黄色葡萄球菌毒力因子,如LukAB,其负责杀死多形核白细胞(PMNs),多形核白细胞(PMNs)是参与防御金黄色葡萄球菌感染的最关键的先天免疫细胞。
附图说明
图1是15个不同的金黄色葡萄球菌LukA氨基酸序列的比对,包括克隆复合物(CC)8(SEQ ID NO:1)的LukA;CC45(SEQ ID NO:2);CC30(SEQ ID NO:27)的HMPREF 0772_044(TC60);CC30(SEQ ID NO:36)的SAR2108(MRSA252);CC45(SEQ ID NO:34)的SALG_02329(A9635);CC398(SEQ ID NO:35)的SAPIG 2061(ST398);CC10(SEQ ID NO:37)的SATG_01930(D139);CC8(SEQ ID NO:26)的NEWMAN;CC151(SEQ ID NO:32)的SAB1876C(RF122);CC5(SEQID NO:38)的SAV2005(Mu50);CC5(SEQ ID NO:31)的SA1813(N315);CC8(SEQ ID NO:33)的SACOL 2006;CC7(SEQ ID NO:29)的HMPRE0776_0173USA300(TCH 959);CC72(SEQ ID NO:28)的HMPREF0774_2356TCH 130;和CC1(SEQ ID NO:30)的MW1942(MW2)。通过比对产生的大部分LukA序列的氨基酸序列被表述为SEQ ID NO:25。本文所述的氨基酸取代的位置也在每个LukA序列中得到鉴定。
图2是14个不同的金黄色葡萄球菌LukB氨基酸序列的比对,包括LukB CC8(SEQ IDNO:15);CC45(SEQ ID NO:16);CC45(SEQ ID NO:40)的A9635;CC30(SEQ ID NO:43)的E1410;CC30(SEQ ID NO:45)的MRSA 252;CC10(SEQ ID NO:42)的D139;CC5(SEQ ID NO:46)的Mu.50;CC239(SEQ ID NO:44)的JKD6008;CC8(SEQ ID NO:41)的COL;CC8(SEQ ID NO:50)的USA300_FPR 3757;CC8(SEQ ID NO:51)的NEWMAN;CC151(SEQ ID NO:48)的RF122;CC1(SEQ ID NO:47)的MW2;和CC72(SEQ ID NO:49)的TCH130。通过比对产生的大多数LukB序列的氨基酸序列被表述为SEQ ID NO:39。本文所述的氨基酸取代的位置也在每个LukB序列中得到鉴定。
图3示出了用于免疫的不同LukAB变体的细胞毒性。通过滴定不同LukAB变体对原代人多形核白细胞(PMNs,n=4)进行1小时的中毒处理。用细胞滴度评估细胞活力。数据来自4个供体的平均值±SEM,在两个独立的实验中获得。
图4A–4B示出了用不同LukAB变体免疫的小鼠中针对LukAB CC8或CC45的抗体滴度。Envigo Hsd:向ND4(4周龄)小鼠(n=5/抗原)皮下注射20μg LukAB,所述LukAB溶于50μl10%甘油1X TBS中与50μl佐剂
图5提供了用针对各种LukAB毒素的不同LukAB变体进行免疫得到的小鼠的血清的中和曲线。在用指示抗原免疫的小鼠的4-0.031%血清存在的情况下,用0.156μg/ml(LD
图6A-6C示出了在不存在或存在用2%(图6A)、1%(图6B)和0.5%(图6C)来自指示性抗原免疫的小鼠血清的情况下,用LukAB毒素序列变体的LD
图7A-7D示出了高浓度的LukAB RARPR-33处理没有产生细胞毒性。将来自健康供体(n=4-6)的新鲜分离的人多形核白细胞与不同浓度的LukAB变体一起孵育1小时。细胞活力通过细胞滴度的吸光度来确定(图7A和7B)。死亡细胞的百分比是通过减去背景(健康细胞+PBS)并归一化到设定为100%死亡的Triton X100处理的细胞来计算的。显示为平均值±SEM。从健康供体(n=4-6)中分离的人多形核白细胞与不同浓度的LukAB变体一起孵育2小时。通过乳酸脱氢酶(LDH)释放确定(图7C和7D)细胞活力。显示为平均值±SEM。
图8A-8D示出了高浓度的LukAB RARPR-33和D39A/R23E类毒素的作用。来自健康供体(n=5)的新鲜分离的人多形核白细胞与不同浓度的LukAB变体一起孵育2小时。细胞活力通过细胞滴度的吸光度来确定(图8A和8B)。死亡细胞的百分比是通过减去背景(健康细胞+PBS)并归一化到设定为100%死亡的Triton X100处理的细胞来计算的。显示为平均值±SEM。从健康供体(n=5)中分离的人多形核白细胞与不同浓度的LukAB变体一起孵育2小时。通过LDH释放确定(图8C和8D)细胞活力。显示为平均值±SEM。
图9示出了用两种不同LukAB类毒素进行免疫得到的小鼠的血清对各种LukAB毒素的中和曲线。在用两种不同抗原免疫的小鼠的0.125%血清存在的情况下,用0.156μg/ml(LD
具体实施方式
本公开涉及变异的金黄色葡萄球菌杀白细胞素蛋白和多肽以及包含这些变异蛋白和多肽的组合物。本公开还涉及一种预防受试者金黄色葡萄球菌感染的方法。
定义
在描述本发明的组合物和方法之前,应当理解,本发明不限于所描述的特定组合物或方法,因为它们可以变化。还应当理解,说明书中使用的术语仅用于描述特定方案或实施例的目的,并不旨在限制本文实施例的范围,本发明实施例的范围将仅由所附权利要求书来限制。除非另有定义,本文使用的所有技术和科学术语与本领域普通技术人员通常理解的含义相同。尽管与本文描述的方法和材料相似或等同的任何方法和材料可用于本文实施例的实践或测试,但是现在描述优选的方法、装置和材料。本文中提到的所有出版物均通过引用整体并入本文。本文中的任何内容均不应被解释为承认本文中的实施例无权凭借现有发明先于此类公开。
必须注意的是,如本文和所附权利要求中所使用的,单数形式“一个”、“一种”和“该”包括复数指代形式,除非上下文另有明确规定。
除非另有说明,否则任何数值,如本文所述的浓度或浓度范围,应理解为在所有情况下都被术语“约”修饰。因此,数值通常包括所述值的10%浮动范围。例如,1mg/ml的浓度包括0.9mg/ml~1.1mg/ml。同样,1%~10%(w/v)的浓度范围包括0.9%(w/v)~11%(w/v)。如本文所使用的,数值范围的使用明确地包括所有可能的子范围,该范围内的所有单个数值,包括数值在该范围内的整数和分数,除非上下文明确地另外指出。
除非另有说明,一系列要素之前的术语“至少”应理解为指该系列中的每个要素。本领域技术人员将认识到或能够仅使用常规实验来确定这里描述的本发明的具体实施例的许多等同物。这些等同物旨在包含在本发明中。
如本文所使用的,术语“包含(comprises)”、“含有(comprising)”、“包括(includes)”、“包括(including)”、“具有”、“蕴含”、“由...构成”、“由...组成”或其任何其他不同表述,将被理解为包含所述整数或整数组,但不排除任何其他整数或整数组,并且旨在是非排他性的或开放式的。例如,包括一系列要素的组合物、混合物、工艺、方法、制品或设备不一定仅限于这些要素,而是可以包括未明确列出的或这种组合物、混合物、工艺、方法、制品或设备固有的其他要素。此外,除非有相反的明确说明,“或”指的是包含性的或,而不是排他性的或。例如,条件A或B由以下任一项满足:A为真(或存在),B为假(或不存在),A为假(或不存在),B为真(或存在),A和B都为真(或存在)。如本文所使用的,多个引用的要素之间的连接术语“和/或”被理解为包括单独的和组合的选项。例如,当两个要素通过“和/或”连接在一起时,第一个选项指的是第一个要素的适用性,而没有第二个要素。第二种选择是指没有第一种要素的第二种要素的适用性。第三种选择是指第一和第二要素一起的适用性。这些选项中的任何一个被理解为落入该含义内,因此满足这里使用的术语“和/或”的要求。一个以上选项的同时适用性也被理解为落入该含义内,因此满足术语“和/或”的要求。
如本文所用,术语“由...组成”或其不同表述诸如“由...构成”或“其组成为”,如在整个说明书和权利要求书中所使用的,表示包括任何引用的整数或整数组,但是没有额外的整数或整数组可以添加到特定的方法、结构或组成中。
如本文所使用的,术语“基本上由...组成(consists essentially of)”或不同表述,例如贯穿说明书和权利要求所使用的“基本上由...构成(consist essentially of)”或“基本上由...组成(consisting essentially of)”,表示包括任何列举的整数或整数组,以及任选包括任何列举的整数或整数组,其不会实质上改变特定方法、结构或组成的基本或新颖性。
如本文所用,“受试者”是指任何动物,优选哺乳动物,最优选人。本文使用的术语“哺乳动物”包括任何哺乳动物。哺乳动物的示例包括但不限于牛、马、羊、猪、猫、狗、小鼠、大鼠、兔子、豚鼠、猴子、人类等,更优选人类。
还应该理解的是,本文使用的术语“大约”、“近似”、“一般”、“基本上/实质上”和类似术语,当指优选发明的部件的尺寸或特性时,表示所述尺寸/特性不是严格的范围或参数,并且不排除功能上相同或相似的微小变化,如本领域普通技术人员所理解的。至少,包括数值参数的这种参考将包括使用本领域接受的数学和工业原理的变化(例如,舍入、测量或其他系统误差、制造公差等),不会改变最低有效数字。
在两种或多种核酸或多肽序列(例如,葡萄球菌LukA和LukB多肽以及编码它们的多核苷酸)的上下文中,术语“完全相同”或“同一性”百分比是指两种或多种序列或子序列,当使用以下序列比较算法之一或通过目测进行比较和比对以获得最大对应性时,它们是相同的或具有相同的特定百分比的氨基酸残基或核苷酸。
对于序列比较,通常将一个序列作为参考序列,测试序列与之进行比较。当使用序列比较算法时,测试和参考序列被输入到计算机中,必要时指定子序列坐标,并且指定序列算法程序参数。然后,序列比较算法根据指定的程序参数,计算测试序列相对于参考序列的序列同一性百分比。
用于比较的序列的最佳比对方法可以通过下述方法进行:例如通过Smith&Waterma的局部同源性算法(Adv.Appl.Math.2:482(1981)),通过Needleman&Wunsch的同源性比对算法(J.Mol.Biol.48:443(1970)),通过Pearson&Lipman的相似性搜索方法(Proc.Nat'l.Acad.Sci.USA 85:2444(1988)),这些算法通过计算机化(GAP,BESTFIT,FASTA,and TFASTAin the Wisconsin Genetics Software Package,Genetics ComputerGroup,575Science Dr.,Madison,WI),或通过视觉检查(一般参见,Current Protocols inMolecular Biology,F.M.Ausubel等人,eds.,Current Protocols,(1995Supplement))实现。
适用于确定序列同一性百分比和序列相似性的算法的例子是BLAST和BLAST 2.0算法,它们分别记载于Altschul等人((1990)J.Mol.Biol.215:403-410)和Altschul等人((1997)NucleicAcids Res.25:3389-3402)的研究中。用于执行BLAST分析的软件可通过国家生物技术信息中心公开获得。
除了计算序列同一性百分比,BLAST算法还对两个序列之间的相似性进行统计分析(例如,参见Karlin&Altschul,Proc.Nat'l.Acad.Sci.USA90:5873-5787(1993))。BLAST算法提供的一种相似性测量是最小和概率(P(N)),它提供了两个核苷酸或氨基酸序列之间偶然发生匹配的概率的指示。例如,如果测试核酸与参考核酸的比较中的最小和概率小于约0.1,更优选小于约0.01,最优选小于约0.001,则认为核酸类似于参考序列。
如下所述,两个核酸序列或多肽基本相同的进一步指示是由第一个核酸编码的多肽与由第二个核酸编码的多肽在免疫学上可进行交叉反应。因此,一种多肽通常与第二种多肽基本相同,例如,这两种多肽仅在保守取代上有所不同。两个核酸序列基本相同的另一个指示是这两个分子在严格的条件下可相互杂交。
如本文所用,术语“多核苷酸”,同义地称为“核酸分子”、“核苷酸”或“核酸”,是指任何多核糖核苷酸或多脱氧核糖核苷酸,其可以是未修饰的RNA或DNA或修饰的RNA或DNA。“多核苷酸”包括但不限于单链和双链DNA、单链和双链区域的混合物DNA、单链和双链RNA、单链和双链区域的混合物RNA、包含单链或更典型地双链的DNA和RNA的杂交分子或单链和双链区域的混合物。此外,“多核苷酸”是指包含RNA或DNA或RNA和DNA的三链区域。术语多核苷酸还包括含有一个或多个修饰碱基的DNA或RNA,以及为了稳定性或其他原因而进行骨架修饰的DNA或RNA。“修饰的”碱基包括,例如,三苯甲基化的碱基和独特的碱基,如肌苷。可以对DNA和RNA进行多种修饰;因此,“多核苷酸”包括通常在自然界中发现的多核苷酸的化学、酶促或代谢修饰形式,以及病毒和细胞特有的DNA和RNA的化学形式。“多核苷酸”也包括相对较短的核酸链,通常称为寡核苷酸。
如本文所用,术语“载体”是指例如任意数量的核酸,其中可以插入所需序列,例如限制性和连接,用于在遗传环境之间运输或在宿主细胞中表达。核酸载体可以是DNA或RNA。载体包括但不限于质粒、噬菌体、噬菌粒、细菌基因组、病毒基因组、自扩增RNA、复制子。
如本文所用,术语“宿主细胞”是指包含本发明核酸分子的细胞。“宿主细胞”可以是任何类型的细胞,例如原代细胞、培养的细胞或来自细胞系的细胞。在一个实施方案中,“宿主细胞”是用本发明的核酸分子转染或转导的细胞。在另一个实施方案中,“宿主细胞”是这种转染或转导细胞的后代或潜在后代。细胞的子代可能与亲代细胞相同,也可能不同,例如,由于突变或环境影响(可能发生在子代中)或核酸分子整合到宿主细胞基因组中。
本文所用,术语“表达”是指基因产物的生物合成。该术语包括将基因转录成RNA。该术语还包括将RNA翻译成一种或多种多肽,还包括所有天然存在的转录后和翻译后的修饰。表达的多肽可以在宿主细胞的细胞质内,进入细胞外环境,如细胞培养物的生长培养基,或固定在细胞膜上。
如本文所用,术语“肽”、“多肽”或“蛋白质”可以指由氨基酸组成的分子,并且可以被本领域技术人员认为为蛋白质。术语“肽”、“多肽”和“蛋白质”在本文中可以互换使用,指任何长度的氨基酸聚合物。聚合物可以是直链或支链的,它可以包含修饰的氨基酸,并且它可以被非氨基酸中断。该术语还包括天然的或通过干预修饰的氨基酸聚合物;例如二硫键形成、糖基化、脂质化、乙酰化、磷酸化或任何其他操作或修饰,例如与标记成分结合。定义还包括例如含有一种或多种氨基酸类似物(包括例如非天然氨基酸等)的多肽,以及本领域已知的其他修饰。
本文所述的多肽序列是根据通常的惯例书写的,其中肽的N-末端区域在左边,C-末端区域在右边。尽管氨基酸的异构形式是已知的,但是除非另另有明确说明,否则所代表的是氨基酸的左旋形式。
术语“分离的”可以指基本上不含细胞物质、细菌物质、病毒物质或其原始来源的培养基(当通过重组DNA技术产生时)、或化学前体或其他化学物质(当化学合成时)的核酸或多肽。此外,分离的多肽是指可以作为分离的多肽给予受试者的多肽;换句话说,如果多肽粘附在柱上或嵌入凝胶中,就不能简单地认为它是“分离的”。此外,“分离的核酸片段”或“分离的肽”是并非作为片段天然存在和/或通常不处于功能状态的核酸或蛋白质片段。
如本文所用,短语“免疫应答”或其等同的表述“免疫学应答”是指在受试者中针对本公开的蛋白质、肽、碳水化合物或多肽的体液(抗体介导的)、细胞(由抗原特异性T细胞或其分泌产物介导的)或体液和细胞应答的发展。这种应答可以是通过施用免疫原诱导的主动应答,也可以是通过施用抗体、含有抗体的物质或活化的T细胞诱导的被动应答。细胞免疫应答是通过与第一类或第二类MHC分子相关的多肽表位的呈递而引发的,以活化抗原特异性CD4(+)辅助性T细胞和/或CD8(+)细胞毒性T细胞。这种应答还可能涉及单核细胞、巨噬细胞、自然杀伤细胞、嗜碱性粒细胞、树突状细胞、星形胶质细胞、小胶质细胞、嗜酸性粒细胞或先天免疫的其他成分的活化。本文所用的“主动免疫”是指通过施用抗原而赋予受试者的任何免疫。
金黄色葡萄球菌杀白细胞素A变体
本公开的第一方面涉及变体,即非天然存在的金黄色葡萄球菌(S.aureus)杀白细胞素A(LukA)蛋白质或多肽。这些变异的LukA蛋白或多肽包含一个或多个氨基酸残基的插入、取代和/或缺失,使得LukAB双组分毒素无细胞毒性,稳定LukAB异二聚体,提高解链温度,和/或增加溶解度。如本文所述,这些变异的LukA蛋白和多肽是理想的疫苗抗原候选物,可以单独给药或与杀白细胞素B(LukB)野生型或变异蛋白或多肽联合给药。当与LukB蛋白或其多肽联合给药时,所得类毒素模拟金黄色葡萄球菌LukB毒素的结构,从而促进产生针对金黄色葡萄球菌最有效毒素之一的强大免疫应答。在任意的实施方案中,LukA变异多肽是全长LukA蛋白的变体,所述全长LukA蛋白包含对应于全长成熟LukA蛋白序列的所有氨基酸残基。本文所指的“成熟”杀白细胞素蛋白序列是缺乏氨基末端分泌信号的杀白细胞素蛋白序列,其通常包含氨基末端的前27-28个氨基酸残基。
在任意的实施方案中,LukA变异多肽是小于全长成熟LukA蛋白的变体。在任意的实施方案中,LukA变异多肽长度至少为100个氨基酸残基。在任意的实施方案中,LukA变异多肽是至少110、至少120、至少130、至少140、至少150、至少160、至少170、至少180、至少190、至少200、至少210、至少220、至少230、至少240、至少250、至少260、至少270、至少280、至少290、至少300个氨基酸残基的长度。
虽然本文描述的示例性LukA变异蛋白和多肽是克隆复合物CC8(SEQ ID NO:1)和CC45(SEQ ID NO:2)变异的LukA蛋白(见下表1),但是本领域技术人员将容易理解,鉴定LukA的氨基酸取代和/或缺失所基于的SEQ ID NO:1和SEQ ID NO:2是在各种克隆复合物中保守的氨基酸残基,或者是在各种克隆复合物中高度保守的LukA区域内的氨基酸残基。事实上,来自15个不同金黄色葡萄球菌菌株的LukA蛋白序列的比对(见图1)显示,本文中鉴定为易变异残基的氨基酸残基是在所有15个比对的LukA氨基酸序列中保守的残基。虽然所鉴定的变异残基的位置在单个LukA序列之间可能不同,但序列比对显示了这些位置之间的对应关系。为了清楚起见,从序列比对中产生具有SEQ ID NO:25的氨基酸序列的LukA共有序列,并用于指定特定氨基酸变异的位置。例如,SEQ ID NO:25中赖氨酸残基83位的氨基酸取代对应于SEQ ID NO:1的LukA序列中80位的赖氨酸残基,对应于SEQ ID NO:2的LukA序列中81位的赖氨酸残基,以及对应于SEQ ID NO:26–38的LukA序列中83位的赖氨酸残基。因此,本文所述的经鉴定的氨基酸变体可以普遍应用于现在已知的或将来的任何LukA氨基酸序列的相应氨基酸残基。
根据本公开的这个方面,在任意的实施方案中,LukA变异多肽包含对应于SEQ IDNO:25的残基Lys83、Ser141、Val113、Val193的一个或多个氨基酸残基上的氨基酸残基插入、取代和/或缺失。在任意的实施方案中,除了上述一个或多个氨基酸残基插入、取代和/或缺失之外,LukA变异多肽还包含对应于SEQ ID NO:25的Glu323的氨基酸残基上的氨基酸取代或缺失。在任意的实施方案中,在Glu323的氨基酸取代或缺失包括在SEQ ID NO:25的323位(Glu323Ala)的谷氨酸到丙氨酸的取代。
在任意的实施方案中,在LukA(以及本文所述的LukB)的一个或多个鉴定位置的氨基酸取代是保守取代。这种保守的取代包括用一个氨基酸残基替换另一个同一类型的氨基酸残基,这种替换作为功能等同物,导致无声的改变。也就是说,相对于天然序列的变化不会明显降低LukA的基本性质。这些种类的氨基酸残基包括非极性(疏水性)氨基酸(例如丙氨酸、亮氨酸、异亮氨酸、缬氨酸、脯氨酸、苯丙氨酸、色氨酸和甲硫氨酸);极性中性氨基酸(例如甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺和谷氨酰胺);带正电荷的(碱性)氨基酸(如精氨酸、赖氨酸和组氨酸);和带负电荷的(酸性)氨基酸(例如天冬氨酸和谷氨酸)。
在其他实施方案中,本文所述的变异杀白细胞素多肽的一个或多个鉴定位置的氨基酸取代是非保守性改变(即破坏鉴定区域的序列、结构、功能或活性的取代)。为了减少或减轻蛋白质的细胞毒性,这种取代可能是理想的。非保守取代包括用不同种类的氨基酸残基取代一个特定种类的氨基酸残基。例如,用极性中性氨基酸取代非极性(疏水性)氨基酸残基,反之亦然。在另一个实施方案中,非保守取代包括带正电荷(碱性)氨基酸残基被带负电荷(酸性)氨基酸残基(例如天冬氨酸和谷氨酸)取代,反之亦然。这种分子改变可以通过本领域熟知的方法完成,包括使用单链模板在质粒模板上进行引物延伸(Kunkel等人,Proc.Acad.Sci.,USA 82:488-492(1985),which is hereby incorporatedby referencein its entirety,在本文中通过全文引入作为参考),双链DNA模板(Papworth等人,Strategies 9(3):3-4(1996),在本文中通过全文引入作为参考),和通过PCR克隆(Braman,J.(ed.),IN VITRO MUTAGENESIS PROTOCOLS,2nd ed.HumanaPress,Totowa,N.J.(2002),其全部内容通过引用结合于此)。
在任意的实施方案中,本公开的LukA变异多肽在对应于SEQ ID NO:25的83位(Lys83Met)赖氨酸的残基上包含赖氨酸到甲硫氨酸的取代。在任意的实施方案中,本公开的LukA变异多肽在对应于SEQ ID NO:1的80位(Lys80Met)赖氨酸的残基上包含赖氨酸到甲硫氨酸的取代。在任意的实施方案中,本公开的LukA变异多肽包含在对应于SEQ ID NO:2的81位(Lys81Met)赖氨酸的残基上包含赖氨酸到甲硫氨酸的取代。
在任意的实施方案中,本公开的LukA变异多肽在对应于SEQ ID NO:25的141位(Ser141Ala)的丝氨酸的残基上包含丝氨酸到丙氨酸的取代。在任意的实施方案中,本公开的LukA变异多肽在对应于SEQ ID NO:1的138位(Ser138Ala)的丝氨酸的残基上包含丝氨酸到丙氨酸的取代。在任意的实施方案中,本公开的LukA变异多肽在对应于SEQ ID NO:2的139位(Ser139Ala)的丝氨酸的残基上包含丝氨酸到丙氨酸的取代。
在任意的实施方案中,本公开的LukA变异多肽在对应于SEQ ID NO:25的113位(Val113Ile)的缬氨酸的残基上包含缬氨酸到异亮氨酸的取代。在任意的实施方案中,本公开的LukA变异多肽在对应于SEQ ID NO:1的110位(Val110Ile)的缬氨酸的残基上包含缬氨酸到异亮氨酸的取代。在任意的实施方案中,本公开的LukA变异多肽在对应于SEQ ID NO:2的111位(Val111Ile)的缬氨酸的残基上包含缬氨酸到异亮氨酸的取代。
在任意的实施方案中,本公开的LukA变异多肽在对应于SEQ ID NO:25的193位(Val193Ile)的缬氨酸的残基上包含缬氨酸到异亮氨酸的取代。在任意的实施方案中,本公开的LukA变异多肽在对应于SEQ ID NO:1的190位(Val190Ile)的缬氨酸的残基上包含缬氨酸到异亮氨酸的取代。在任意的实施方案中,本公开的LukA变异多肽在对应于SEQ ID NO:2的191位(Val191Ile)的缬氨酸的残基上包含缬氨酸到异亮氨酸的取代。
在任意的实施方案中,本公开的LukA变异多肽除了对应于SEQ ID NO:25的Lys83、Ser141、Val113和Val193的残基上的任何一个或多个取代之外,还包含对应于SEQ ID NO:25的谷氨酸残基323位(Glu323Ala)的残基上的谷氨酸到丙氨酸的取代。在任意的实施方案中,本公开的LukA变异多肽除了对应于SEQ ID NO:1的Lys80、Ser138、Val110、Val190的残基上的任何一个或多个取代之外,还包含对应于SEQ ID NO:1的谷氨酸残基320位(Glu320Ala)的残基上的谷氨酸到丙氨酸的取代。在任意的实施方案中,本公开的LukA变异多肽除了对应于SEQ ID NO:25的Lys81、Ser139、Val111、Val191的残基上的任何一个或多个取代之外,还包含对应于SEQ ID NO:2的谷氨酸残基321位(Glu321Ala)的残基上的谷氨酸到丙氨酸的取代。
在任意的实施方案中,本公开的LukA变异多肽包含对应于SEQ ID NO:25的Lys83、Ser141、Val113和Val193的两个前述氨基酸残基上具有氨基酸残基插入、取代和/或缺失的多肽。在任意的实施方案中,LukA变异多肽包含在三个前述氨基酸残基上的氨基酸残基插入、取代和/或缺失。在任意的实施方案中,LukA变异多肽包含在所有四个前述氨基酸残基上的氨基酸残基插入、取代和/或缺失。在任意的实施方案中,LukA变异多肽在对应于SEQID NO:25的Lys83Met、Ser141Ala、Val113Ile和Val193Ile的上述氨基酸残基上包含赖氨酸到甲硫氨酸、丝氨酸到丙氨酸和缬氨酸到异亮氨酸的氨基酸取代。在任意的实施方案中,LukA变异多肽进一步包括对应于SEQ ID NO:25的残基323位(Glu323Ala)的氨基酸残基处谷氨酸到丙氨酸的氨基酸取代,即变异LukA包括对应于SEQ ID NO:25的Lys83Met、Ser141Ala、Val113Ile、Val193Ile和Glu323Ala的取代。
本公开的示例性变异LukA多肽具有对应于SEQ ID NO:25中的Lys83Met、Ser141Ala、Val113Ile、Val193Ile和Glu323Ala的氨基酸取代。在任意的实施方案中,LukA变异多肽是CC8 LukA变体,其包含对应于SEQ ID NO:1中Lys80Met、Ser138Ala、Val110Ile、Val190Ile和Glu320Ala的氨基酸取代。在任意的实施方案中,该LukA变异多肽具有SEQ IDNO:3的氨基酸序列,或具有与SEQ ID NO:3的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
在任意的实施方案中,LukA变异多肽是CC45 LukA变异多肽,其包含对应于SEQ IDNO:2中Lys81Met、Ser139Ala、Val111Ile、Val191Ile和Glu321Ala的氨基酸取代。在任意的实施方案中,该LukA变异多肽具有SEQ ID NO:4的氨基酸序列,或具有与SEQ ID NO:4的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。其他示例性的LukA变异多肽包括SEQ ID NO:26-38的LukA蛋白质中的任何一种,其包含对应于SEQ ID NO:25中Lys83Met、Ser141Ala、Val113Ile、Val193Ile和Glu323Ala的取代的氨基酸取代。
在任意的实施方案中,本文所述的LukA变异多肽包含对应于SEQ ID NO:25的氨基酸残基Tyr74、Asp140、Gly149和Gly156的一个或多个氨基酸残基上的氨基酸取代。在一个实施方案中,在一个或多个前述残基上的氨基酸取代引入了能够形成二硫键的半胱氨酸残基,以稳定LukAB异二聚体结构的构象。例如,在一个实施方案中,本文所述的LukA变异多肽在对应于SEQ ID NO:25的Tyr74(Tyr74Cys)的氨基酸残基上包含酪氨酸至半胱氨酸的取代,并且在对应于SEQ ID NO:25的Asp140(Asp140Cys)的氨基酸残基上包含天冬酰胺至半胱氨酸的取代。74位和140位处的这些半胱氨酸残基形成二硫键,从而相对于野生型LukA或相对于不含能形成二硫键的成对半胱氨酸残基的其他变异LukA多肽,增加了变异LukA的热稳定性。
在另一个实施方案中,本文所述的LukA变异多肽在对应于SEQ ID NO:25的Gly149(Gly149Cys)的氨基酸残基上包含甘氨酸到半胱氨酸的取代,并且在对应于SEQ ID NO:25的Gly156(Gly156Cys)的氨基酸残基上包含甘氨酸到半胱氨酸的取代。这些在149和156位引入的半胱氨酸残基形成二硫键,从而相对于野生型LukA或相对于不含能形成二硫键的成对半胱氨酸残基的其他变异LukA多肽增加了变异LukA的热稳定性。
在任意的实施方案中,LukA变异多肽在对应于SEQ ID NO:25的氨基酸残基Tyr74、Asp140、Gly149和Gly156的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,在任一氨基酸残基上的氨基酸取代都包括如上所述的半胱氨酸残基的引入。在任意的实施方案中,LukA变异多肽在对应于SEQ ID NO:1的氨基酸残基Tyr71、Asp137、Gly146和Gly153的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,任一氨基酸残基上的氨基酸取代都包括引入半胱氨酸残基。在任意的实施方案中,LukA变异多肽在对应于SEQ ID NO:2的氨基酸残基Tyr72、Asp138、Gly147和Gly154的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,任一氨基酸残基上的氨基酸取代都包括引入半胱氨酸残基。
在任意的实施方案中,LukA变异多肽包含在对应于Lys83、Ser141、Val113、Val193和Glu323的一个或多个氨基酸残基上的氨基酸取代,以及在对应于SEQ ID NO:25的氨基酸残基Tyr74、Asp140、Gly149和Gly156的一个或多个氨基酸残基上的氨基酸取代。在任意的实施方案中,LukA变异多肽包含对应于SEQ ID NO:25的残基Lys83、Ser141、Val113、Val193和Glu323以及残基Tyr74、Asp140、Gly149和Gly156的氨基酸残基上的氨基酸取代。
在任意的实施方案中,示例性的LukA变异多肽是CC8 LukA变异多肽,其在对应于SEQ ID NO:1的Lys80、Ser138、Val110、Val190、Glu320、Tyr71、Asp137、Gly146和Gly153中每一个的残基上具有氨基酸取代。在任意的实施方案中,示例性的LukA变异多肽是CC8LukA变异多肽,其在对应于SEQ ID NO:1的Lys80Met、Ser138Ala、Val110Ile、Val190Ile、Glu320Ala、Tyr71Cys、Asp137Cys、Gly146Cys和Gly153Cys中每一个的残基上具有氨基酸取代。在任意的实施方案中,该CC8 LukA变异多肽包含SEQ ID NO:5的氨基酸序列,或具有与SEQ ID NO:5的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
在任意的实施方案中,示例性的LukA变异多肽是CC45 LukA变异多肽,其在对应于SEQ ID NO:2的Lys81、Ser139、Val111、Val191、Glu321、Tyr72、Asp138、Gly147和Gly154中每一个的残基上具有氨基酸取代。在任意的实施方案中,示例性的LukA变异多肽是CC45LukA变异多肽,其在对应于SEQ ID NO:2的Lys81Met、Ser139Ala、Val111Ile、Val191Ile、Glu321Ala、Tyr72Cys、Asp138Cys、Gly147Cys和Gly154Cys中每一个的残基上具有氨基酸取代。在任意的实施方案中,该CC45 LukA变异多肽包含SEQ ID NO:6的氨基酸序列,或具有与SEQ ID NO:6的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
其他示例性的LukA变异多肽包括SEQ ID NO:26-38的LukA蛋白质中的任何一种,其包含对应于SEQ ID NO:25的Lys83Met、Ser141Ala、Val113Ile、Val193Ile、Glu323、Tyr74、Asp140、Gly149和Gly156的氨基酸取代。
在任意的实施方案中,本文所述的LukA变异多肽在对应于SEQ ID NO:25的氨基酸残基Thr249的氨基酸残基上包含氨基酸取代或缺失。在任意的实施方案中,LukA变体包含在对应于Thr249的残基上的取代,其中所述取代是在该残基(Thr249Val)上苏氨酸到缬氨酸的取代。在任意的实施方案中,本文所述的LukA变异多肽在对应于SEQ ID NO:1的氨基酸残基Thr246的氨基酸残基上包含氨基酸取代或缺失。在任意的实施方案中,本文所述的LukA变异多肽在对应于SEQ ID NO:2的氨基酸残基Thr247的氨基酸残基上包含氨基酸取代或缺失。
在任意的实施方案中,本文描述的LukA变异多肽包含在对应于SEQ ID NO:25的Thr249的氨基酸残基上的氨基酸取代,与本文描述的任何其他氨基酸残基取代相结合,即在对应于SEQ ID NO:25的Lys83、Ser141、Val113、Val193、Glu323、Tyr74、Asp140、Gly149和Gly156的残基上的取代。在任意的实施方案中,本文所述的LukA变异多肽包含对应于SEQID NO:25的Thr249的氨基酸残基上的氨基酸取代,以及本文所述的至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个或所有九个其他氨基酸残基取代。在任意的实施方案中,LukA变异多肽在对应于SEQ ID NO:25的Lys83、Ser141、Val113、Val193、Glu323和Thr249的每个残基上包含氨基酸取代。
在任意的实施方案中,示例性的LuCA变异多肽是CC8 LukA变异多肽,其在对应于SEQ ID NO:1的Lys80、Ser138、Val110、Val190、Glu320和Thr246中每一个的残基上具有氨基酸取代。在任意的实施方案中,示例性的LukA变异多肽是CC8 LukA变异多肽,其在对应于SEQ ID NO:1的Lys80Met、Ser138Ala、Val110Ile、Val190Ile、Glu320Ala和Thr246Val中每一个的残基上具有氨基酸取代。在一个实施方案中,在对应于上述每个位置的残基上具有氨基酸取代的示例性的LukA变异多肽具有SEQ ID NO:7的氨基酸序列,或具有与SEQ IDNO:7的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
在任意的实施方案中,示例性的LukA变异多肽是CC45 LukA变异多肽,其在对应于SEQ ID NO:2的Lys81、Ser139、Val111、Val191、Glu321和Thr247中每一个的残基上具有氨基酸取代。在任意的实施方案中,示例性的LukA变异多肽是CC45 LukA变异多肽,其在对应于SEQ ID NO:2的Lys81Met、Ser139Ala、Val111Ile、Val191Ile、Glu321Ala和Thr247Val中每一个的残基上具有氨基酸取代。在一个实施方案中,在对应于上述每个位置的残基上具有氨基酸取代的示例性的LukA变异多肽具有SEQ ID NO:8的氨基酸序列,或具有与SEQ IDNO:8的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
其他示例性的LukA变异多肽包括SEQ ID NO:26-38的LukA蛋白中的任何一种,其在对应于SEQ ID NO:25的Lys83、Ser141、Val113、Val193、Glu323和Thr249的氨基酸残基上包含所述氨基酸取代。
在任意的实施方案中,LukA变异多肽在对应于SEQ ID NO:25的Lys83、Ser141、Val113、Val193、Glu323、Thr249、Tyr74、Asp140、Gly149和Gly156的每个残基上包含氨基酸取代。
在任意的实施方案中,示例性的LukA变异多肽是CC8 LukA变异多肽,其在对应于SEQ ID NO:1的Lys80、Ser138、Val110、Val190、Glu320、Tyr71、Asp137、Gly146、Gly153和Thr246中每一个的残基上具有氨基酸取代。在任意的实施方案中,示例性的LukA变异多肽是CC8 LukA变异多肽,其在对应于SEQ ID NO:1的Lys80Met、Ser138Ala、Val110Ile、Val190Ile、Glu320Ala、Tyr71Cys、Asp137Cys、Gly146Cys、Gly153Cys和Thr246Val中每一个的残基上具有氨基酸取代。在一个实施方案中,在对应于上述每个位置的残基上具有氨基酸取代的示例性的LukA变异多肽具有SEQ ID NO:9的氨基酸序列,或具有与SEQ ID NO:9的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
在任意的实施方案中,示例性的LukA变异多肽是CC45 LukA变异多肽,其在对应于SEQ ID NO:2的Lys81、Ser139、Val111、Val191、Glu321、Tyr72、Asp138、Gly147、Gly154和Thr247中每一个的残基上具有氨基酸取代。在任意的实施方案中,示例性的LukA变异多肽是CC45 LukA变异多肽,其在对应于SEQ ID NO:2的Lys81Met、Ser139Ala、Val111Ile、Val191Ile、Glu321Ala、Tyr72Cys、Asp138Cys、Gly147Cys、Gly154Cys和Thr247Ala中每一个的残基上具有氨基酸取代。在一个实施方案中,在对应于上述每个位置的残基上具有氨基酸取代的示例性的LukA变异多肽具有SEQ ID NO:10的氨基酸序列,或具有与SEQ ID NO:10的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
其他示例性的LukA变异多肽包括SEQ ID NO:26-38的LukA蛋白质中的任一种,其在对应于SEQ ID NO:25的Lys83、Ser141、Val113、Val193、Glu323、Thr249、Tyr74、Asp140、Gly149和Gly156的残基上包含所述氨基酸取代。
下表1提供了本文公开的示例性的变异LukA氨基酸序列。
表1.示例性LukA多肽氨基酸序列
金黄色葡萄球菌杀白细胞素B(LukB)变体
本公开的另一方面涉及金黄色葡萄球菌杀白细胞素B(LukB)变异多肽。这些LukB变异多肽包含一个或多个氨基酸残基插入、取代和/或缺失,它们提高了LukB的稳定性,从而有助于LukB类毒素的稳定性。如本文所述,这些LukB变异多肽是理想的疫苗抗原候选物,其可以单独给药或与杀白细胞素A(LukA)野生型或变异蛋白或多肽联合给药。当与LukA野生型或变异多肽联合给药时,所得类毒素模拟金黄色葡萄球菌LukAB毒素的结构,从而促进产生针对金黄色葡萄球菌最有效毒素之一的强大免疫应答。在任意的实施方案中,LukB变异多肽是全长LukB蛋白的变体,包含对应于全长成熟LukB蛋白序列的所有氨基酸残基。在任意的实施方案中,LukB变体包含比全长成熟LukB蛋白更少的参考蛋白的氨基酸链。在一个实施方案中,LukB变异多肽长度至少为100个氨基酸残基。在任意的实施方案中,LukB变异多肽是至少110、至少120、至少130、至少140、至少150、至少160、至少170、至少180、至少190、至少200、至少210、至少220、至少230、至少240、至少250、至少260、至少270、至少280、至少290、至少300个氨基酸残基的长度。
虽然本文描述的示例性LukB变异多肽是克隆复合物CC8(SEQ ID NO:15)和CC45(SEQ ID NO:16)的LukB变体(见下表2),但是本领域技术人员容易理解,鉴定LukB的氨基酸取代和/或缺失所基于的SEQ ID NO:15和SEQ ID NO:16是在各种克隆复合物之间保守的氨基酸残基,或在各种克隆复合物之间高度保守的LukB区域内保守的氨基酸残基。来自14个不同金黄色葡萄球菌菌株的LukB蛋白序列的比对(见图2)显示,本文中鉴定为易变异残基的氨基酸残基是在所有14个比对的LukB氨基酸序列中保守的残基。虽然所鉴定的变异残基的位置在各个LukB序列之间可能不同,但序列比对显示了这些位置之间的对应关系。为了清楚起见,从序列比对中产生具有SEQ ID NO:39的氨基酸序列的LukB共有序列,并用于指定特定氨基酸变异的位置。例如,SEQ ID NO:39中谷氨酸残基109位的氨基酸取代对应于SEQ ID NO:15、42、44和46–51的LukB序列中109位的谷氨酸残基,对应于SEQ ID NO:41的LukB序列中110位的谷氨酸残基,以及对应于SEQ ID NO:41的LukB序列中60位的谷氨酸残基。因此,本文所述的经鉴定的氨基酸变体可以普遍应用于现在已知的或将来的任何LukB氨基酸序列中的相应氨基酸残基。
在任意的实施方案中,本文公开的LukB变异多肽在对应于SEQ ID NO:39的氨基酸残基Val53的氨基酸残基上包含氨基酸取代或缺失。在任意的实施方案中,Val53处的氨基酸取代包括缬氨酸到亮氨酸(Val53Leu)的取代。在一个实施方案中,示例性的LukB变异多肽包含对应于SEQ ID NO:39中的Val53Leu取代的取代。
在任意的实施方案中,示例性的LukB变异多肽是CC8 LukB变异多肽,其在对应于SEQ ID NO:15的53位的氨基酸具有氨基酸取代。在任意的实施方案中,示例性的LukB变异多肽是CC8 LukB变异多肽,其在对应于SEQ ID NO:15的53位具有缬氨酸到亮氨酸的氨基酸取代。在任意的实施方案中,在53位具有缬氨酸到亮氨酸取代的示例性CC8 LukB序列包含SEQ ID NO:17的氨基酸序列,或具有与SEQ ID NO:17的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
在任意的实施方案中,示例性的LukB变异多肽是CC45 LukB变异多肽,其在对应于SEQ ID NO:16的53位的氨基酸具有氨基酸取代。在任意的实施方案中,示例性的LukB变异多肽是CC45 LukB变异多肽,其在对应于SEQ ID NO:16的53位具有缬氨酸到亮氨酸的氨基酸取代。在一个实施方案中,包含对应于SEQ ID NO:39中的Val53Leu取代的示例性LukB变异多肽包含SEQ ID NO:18的氨基酸序列,或具有与SEQ ID NO:18的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
其他示例性的LukB变异多肽包括SEQ ID NO:40-51的任意一种LukB蛋白,所述LukB蛋白包含对应于Val53Leu的氨基酸取代。
在任意的实施方案中,本文所述的LukB变异多肽包含对应于SEQ ID NO:39的氨基酸残基Glu45、Glu109、Thr121和Arg154的一个或多个氨基酸残基上的氨基酸取代。在一个实施方案中,在一个或多个前述残基上的氨基酸取代引入了能够形成二硫键的半胱氨酸残基,以稳定LukAB异二聚体结构的构象。例如,在一个实施方案中,本文所述的LukB变异蛋白或多肽对应于SEQ ID NO:39的Glu45(Glu45Cys)的氨基酸残基上包含谷氨酸到半胱氨酸的取代,并且在对应于SEQ ID NO:39的Thr121(Thr121Cys)的氨基酸残基上包含苏氨酸到半胱氨酸的取代。45位和121位的这些半胱氨酸残基形成二硫键,从而相对于野生型LukB或相对于本文所述的不含能形成二硫键的成对半胱氨酸残基的其他变异LukB蛋白和多肽,增加了变异LukB的热稳定性。
在另一个实施方案中,本文所述的LukB变异蛋白或多肽在对应于SEQ ID NO:39的Glu109(Glu109Cys)的氨基酸残基上包含谷氨酸到半胱氨酸的取代,并且在对应于SEQ IDNO:39的Arg154(Arg154Cys)的氨基酸残基上包含精氨酸到半胱氨酸的取代。这些在109位和154位引入的半胱氨酸残基形成二硫键,从而相对于野生型LukB或相对于不含能形成二硫键的成对半胱氨酸残基的其他LukB变异多肽,增加了LukB变异体的热稳定性。
在任意的实施方案中,LukB变异多肽在对应于SEQ ID NO:39的氨基酸残基Glu45、Glu109、Thr121和Arg154的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,在任一氨基酸残基上的氨基酸取代都包括如上所述的半胱氨酸残基的引入。
在任意的实施方案中,LukB变异多肽是CC8 LukB变异多肽,其包含在对应于SEQID ID NO:15的氨基酸残基Glu45、Glu109、Thr121和Arg154的任何一个或多个氨基酸残基上的氨基酸取代。在任意的实施方案中,LukB变异多肽是CC8 LukB变异多肽,其在对应于SEQ ID NO:15的氨基酸残基Glu45、Glu109、Thr121和Arg154的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,任一氨基酸残基上的氨基酸取代都包括如上所述的半胱氨酸残基的引入。在一个实施方案中,包含在对应于SEQ ID ID NO:39的Glu45、Glu109、Thr121和Arg154的残基处的半胱氨酸氨基酸取代的示例性LukB变异多肽包含SEQ ID NO:21的氨基酸序列,或具有与SEQ ID NO:21的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
在任意的实施方案中,LukB变异多肽是CC45 LukB变异多肽,其在对应于SEQ IDNO:16的氨基酸残基Glu45、Glu110、Thr122和Arg155的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,LukB变异多肽是CC45 LukB变异多肽,其在对应于SEQ ID NO:16的氨基酸残基Glu45、Glu110、Thr122和Arg155的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,任一氨基酸残基上的氨基酸取代都包括如上所述的半胱氨酸残基的引入。在另一个实施方案中,在对应于SEQ ID ID NO:39的Glu45、Glu110、Thr122和Arg155的残基上包含半胱氨酸氨基酸取代的LukB变异多肽包含SEQ ID NO:22的氨基酸序列,或具有与SEQID NO:22的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
其他示例性的LukB变异多肽包括SEQ ID NO:40-51的LukB蛋白中的任何一种,其在对应于SEQ ID NO:39的残基Glu45、Glu109、Thr121和Arg154的残基上包含所述氨基酸取代。
在任意的实施方案中,本文公开的LukB变异多肽包含对应于SEQ ID NO:39的Val53的氨基酸残基上的氨基酸取代,以及对应于SEQ ID NO:39的Glu45、Glu109、Thr121和Arg154的一个或多个氨基酸残基上的氨基酸残基取代。在任意的实施方案中,LukB变异多肽是CC8 LukB变异多肽,其在对应于SEQ ID NO:15的氨基酸残基Val53、Glu45、Glu109、Thr121和Arg154的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,LukB变异多肽是CC8 LukB变异多肽,其在对应于SEQ ID NO:15的氨基酸残基Val53Leu、Glu45Cys、Glu109Cys、Thr121Cys和Arg154Cys的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,示例性的CC8 LukB变异多肽包含SEQ ID NO:19的氨基酸序列,或具有与SEQ ID NO:19的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
在任意的实施方案中,LukB变异多肽是CC45 LukB变异多肽,其在对应于SEQ IDNO:16的氨基酸残基Val53、Glu45、Glu110、Thr122和Arg155的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,LukB变异多肽是CC45 LukB变异多肽,其在对应于SEQ IDNO:16的氨基酸残基Val53Leu、Glu45Cys、Glu110Cys、Thr123Cys和Arg155Cys的每个氨基酸残基上包含氨基酸取代。在对应于上述每个位置的残基上具有氨基酸取代的示例性CC45LukB变异多肽具有SEQ ID NO:20的氨基酸序列,或具有与SEQ ID NO:20的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
其他示例性的LukB变异多肽包括SEQ ID NO:40-51的LukB蛋白中的任一种,其在对应于SEQ ID NO:39的Val53、Glu45、Glu109、Thr121和Arg154的残基上包含所述氨基酸取代。
下表2提供了本文公开的示例性的变异LukB氨基酸序列。
表2.示例性LukB多肽氨基酸序列
根据本文公开内容的所有方面,本文公开的LukA和/或LukB变异多肽可以进一步包含一个或多个异源氨基酸序列。合适的异源氨基酸序列包括但不限于标签序列、免疫原、信号序列等。合适的标签序列包括但不限于聚组氨酸标签、多聚精氨酸标签、FLAG标签、Step-标签II、泛素标签、NusA标签、几丁质结合域、钙调蛋白结合肽、纤维素结合域、Hat标签、S标签、SBP、麦芽糖结合蛋白、谷胱甘肽S-转移酶(参见Terpe K.,Terpe K.,“OverviewofTag Protein Fusions:From Molecular and Biochemical Fundamentals toCommercial Systems,”Appl.Microbiol.Biotechnol.60:523-33(2003),在此引入作为参考)。合适的免疫原包括但不限于T细胞表位、B细胞表位。合适的信号序列包括但不限于PelB信号序列、Sec信号序列、Tat信号序列、AmyE信号序列(参见Freudl R.,“SignalPeptides for Recombinant Protein Secretion in Bacterial Expression Systems,”Microbial Cell Factories 17:52(2018),该文献在此引入作为参考)。在任意的实施方案中,本文所述的LukA和/或LukB变异多肽包含PelB序列(MKYLLPTAAAGLLLLAAQPAMA;SEQ IDNO:23)。在任意的实施方案中,本文所述的LukA和/或LukB变异多肽包含His标签(例如,NSAHHHHHHGS;SEQ ID NO:24)。在任意的实施方案中,本文所述的LukA和/或LukB变异多肽包含前述PelB序列和His标签。
变异LukA和LukB多核苷酸和构建体
本公开的另一方面涉及编码本文所述的LukA和LukB变异多肽的核酸分子。本文所述的核酸分子包括分离的多核苷酸、重组多核苷酸序列、部分表达载体或部分线性DNA或RNA序列,包括用于体外或体内转录/翻译的线性DNA或RNA序列,以及与原核和真核细胞表达和分泌本文所述的LukA和LukB变异多肽兼容的载体。在任意的实施方案中,本文所述的LukA和LukB多核苷酸包含DNA。在任意的实施方案中,本文所述的LukA和LukB多核苷酸包含RNA,特别是mRNA。
本公开的多核苷酸可以通过化学合成产生,例如在自动多核苷酸合成器上进行固相多核苷酸合成,并组装成完整的单链或双链分子。或者,本公开的多核苷酸可以通过其他技术产生,例如PCR,然后常规克隆。用于产生或获得给定序列的多核苷酸的技术是本领域公知的。
在任意的实施方案中,本公开的多核苷酸编码LukA变异多肽,该多肽在对应于SEQID NO:25的83位(Lys83Met)赖氨酸的残基上包含赖氨酸到甲硫氨酸的取代。在任意的实施方案中,本公开的多核苷酸编码LukA变异多肽,其在对应于SEQ ID NO:25的141位(Ser141Ala)的丝氨酸的残基上包含丝氨酸到丙氨酸的取代。在任意的实施方案中,本公开的多核苷酸编码LukA变异多肽,该多肽在对应于SEQ ID NO:25的113位(Val113Ile)的缬氨酸的残基上包含缬氨酸到异亮氨酸的取代。在任意的实施方案中,本公开的多核苷酸编码LukA变异多肽,该多肽在对应于SEQ ID NO:25的193位(Val193Ile)的缬氨酸的残基上包含缬氨酸到异亮氨酸的取代。在任意的实施方案中,本公开的多核苷酸编码LukA变异多肽,其在对应于前述氨基酸残基的残基(即SEQ ID NO:25的Lys803Met、Ser141Ala、Val113Ile和Val193Ile)上包含赖氨酸到甲硫氨酸、丝氨酸到丙氨酸和缬氨酸到异亮氨酸的氨基酸取代。在任意的实施方案中,本公开的多核苷酸编码LukA变异多肽,其进一步包含对应于Glu323Ala的氨基酸取代,即多核苷酸编码LukA变体,其包含对应于SEQ ID NO:25的Lys83Met、Ser141Ala、Val113Ile、Val193Ile和Glu323Ala取代的取代。
在一个实施方案中,示例性核酸分子是编码CC8 LukA变体序列的核酸分子,例如编码SEQ ID NO:1的变体,其包含对应于SEQ ID NO:1中Lys80Met、Ser138Ala、Val110Ile、Val190Ile和Glu320Ala的氨基酸取代。本文编码CC8LukA的示例性核酸分子表述为SEQ IDNO:52。因此,在任意的实施方案中,示例性核酸分子是SEQ ID NO:52的变体,其中所述变体包含具有与SEQ ID NO:52的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列。
在一个实施方案中,编码CC8 Luk8变体的示例性核酸分子是编码LukA变体序列(LukACC8 Glu320Ala、Lys80Met、Ser138Ala、Val110Ile、Val190Ile)的核酸分子,所述LukA变体序列为SEQ ID NO:3或具有与SEQ ID NO:3的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。编码这种LukACC8变体的示例性核酸分子包含与SEQ ID NO:54具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列。在任意的实施方案中,编码这种LukACC8变异体的核酸分子包含SEQ IDNO:54的核苷酸序列。
在另一个实施方案中,示例性核酸分子是编码CC45 LukA变体序列的核酸分子,例如,编码SEQ ID NO:2的变体,其包含对应于SEQ ID NO:2中Lys81Met、Ser139Ala、Val111Ile、Val191Ile和Glu321Ala的氨基酸取代。本文中编码CC45 LukA的示例性核酸分子表述为SEQ ID NO:53。因此,在任意的实施方案中,示例性核酸分子是SEQ ID NO:53的变体,其中所述变体包含与SEQ ID NO:53的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列。
在一个实施方案中,本公开的示例性核酸分子是编码CC45 LukA变体序列(LukACC45Glu321Ala、Lys81Met、Ser139Ala、Val111Ile、Val191Ile)的核酸分子,所述CC45LukA变体序列为SEQ ID NO:4或具有与SEQ ID NO:4的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。编码这种LukACC45变体的示例性核酸分子包含与SEQ ID NO:55具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列。在任意的实施方案中,编码这种LukACC8变异体的核酸分子包含SEQ ID NO:55的核苷酸序列。
在任意的实施方案中,本公开的多核苷酸编码LukA变异多肽,所述多肽包含对应于SEQ ID NO:25的氨基酸残基Tyr74、Asp140、Gly149和Gly156的一个或多个氨基酸残基上的氨基酸取代。在一个实施方案中,所述多核苷酸编码LukA变异多肽,该多肽在对应于SEQID NO:25的Tyr74(Tyr74Cys)的氨基酸残基上包含酪氨酸至半胱氨酸的取代,并且在对应于SEQ ID NO:25的Asp140(Asp140Cys)的氨基酸残基上包含天冬酰胺至半胱氨酸的取代。在任意的实施方案中,本公开的多核苷酸编码LukA变异多肽,所述多肽在对应于SEQ IDNO:25的Gly149(Gly149Cys)的氨基酸残基上包含甘氨酸到半胱氨酸的取代,并且对应于SEQ ID NO:25的Gly156(Gly156Cys)的氨基酸残基上包含甘氨酸到半胱氨酸的取代。在任意的实施方案中,本公开的多核苷酸编码LukA变异多肽,所述多肽在对应于SEQ ID NO:25的氨基酸残基Tyr74、Asp140、Gly149和Gly156的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,这些氨基酸残基中每一个的氨基酸取代都是如上所述的半胱氨酸残基。
在任意的实施方案中,本公开的多核苷酸编码LukA变异多肽,所述多肽包含在对应于Lys83、Ser141、Val113、Val193和Glu323的一个或多个氨基酸残基上的氨基酸取代,以及对应于SEQ ID NO:25的氨基酸残基Tyr74、Asp140、Gly149和Gly156的一个或多个氨基酸残基上的氨基酸取代。在任意的实施方案中,所述多核苷酸编码LukA变异多肽,所述多肽在对应于SEQ ID NO:25的残基Lys83、Ser141、Val113、Val193和Glu323以及残基Tyr74、Asp140、Gly149和Gly156的氨基酸残基上包含氨基酸取代。
在一个实施方案中,示例性核酸分子是编码CC8 LukA变体序列的核酸分子,例如,编码SEQ ID NO:1的变体,其包含对应于SEQ ID NO:1的Lys80Met、Ser138Ala、Val110Ile、Val190Ile、Glu320Ala、Tyr71Cys、Asp137Cys、Gly146Cys和Gly153Cys中每一个的氨基酸取代。在一个实施方案中,示例性核酸分子是编码LukA变体序列(LukA CC8 Glu320Ala、Lys80Met、Ser138Ala、Val110Ile、Val190Ile、Tyr71Cys、Asp137Cys、Gly146Cys、Gly153Cys)的核酸分子,所述LukA变体序列为SEQ ID NO:5或与SEQ ID NO:5的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
在另一个实施方案中,示例性核酸分子是编码CC45 LukA变异体序列的核酸分子,例如,编码SEQ ID NO:2的变体,其包含对应于SEQ ID NO:2的Lys81Met、Ser139Ala、Val111Ile、Val191Ile、Glu321Ala、Tyr72Cys、Asp138Cys、Gly147Cys和Gly154Cys中每一个的氨基酸取代。在一个实施方案中,本公开的示例性核酸分子是编码LukA变体序列(LukACC45Glu321Ala、Lys81Met、Ser139Ala、Val111Ile、Val191Ile、Tyr72Cys、Asp138Cys、Gly147Cys、Gly154Cys)的核酸分子,所述LukA变体序列为SEQ ID NO:6或与该序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
在任意的实施方案中,本公开的多核苷酸编码LukA变异多肽,该多肽在对应于SEQID NO:25的氨基酸残基Thr249的氨基酸残基处包含氨基酸的取代或缺失。在任意的实施方案中,多核苷酸编码LukA变异体,该变异体在对应于SEQ ID NO:25的249位的残基上包含苏氨酸到缬氨酸的取代。在任意的实施方案中,本公开的多核苷酸编码LukA变异多肽,该多肽包含在对应于Thr249的位置上的氨基酸取代,以及对应于SEQ ID NO:25的Lys83、Ser141、Val113、Val193、Glu323、Tyr74、Asp140、Gly149和Gly156的残基上的任何一个或全部氨基酸取代。
在一个实施方案中,示例性核酸分子是编码CC8 LukA变体序列的核酸分子,例如,编码SEQ ID NO:1的变体,其包含对应于SEQ ID NO:1的Lys80Met、Ser138Ala、Val110Ile、Val190Ile、Glu320Ala和Thr246Val中每一个的氨基酸取代。在任意的实施方案中,本公开的示例性核酸分子是编码LukA变体序列(LukA CC8 Glu320Ala、Lys80Met、Ser138Ala、Val110Ile、Val190Ile和Thr246Val)的核酸分子,所述LukA变体序列为SEQ ID NO:7或具有与SEQ ID NO:7的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。在任意的实施方案中,本公开的示例性核酸分子是编码SEQ ID NO:9的CC8 LukA变体序列的核酸分子,其包含对应于Glu320Ala、Lys80Met、Ser138Ala、Val110Ile、Val190Ile、Thr246Val、Tyr71Cys、Asp137Cys、Gly146Cys和Gly153Cys的氨基酸取代。本公开的示例性核酸分子包括编码与SEQ ID NO:9的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列的核酸分子。在任意的实施方案中,编码SEQ ID NO:9的这种LukACC8变体的示例性核酸分子包含与SEQ ID NO:56具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列。在任意的实施方案中,编码这种LukACC8变体的核酸分子包含SEQ ID NO:56的核苷酸序列。
在另一个实施方案中,示例性核酸分子是编码CC45 LukA变体序列的核酸分子,例如,编码SEQ ID NO:2的变体,其包含对应于SEQ ID NO:2的Lys81Met、Ser139Ala、Val111Ile、Val191Ile、Glu321Ala和Thr247Val中每一个的氨基酸取代。在任意的实施方案中,本公开的示例性核酸分子是编码LukA变体序列(LukA CC45 Glu321Ala、Lys81Met、Ser139Ala、Val111Ile、Val191Ile、Thr247Val)的核酸分子,所述LukA变体序列为SEQ IDNO:8或具有与SEQ ID NO:8的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。在任意的实施方案中,本公开的示例性核酸分子是编码SEQID NO:10的LukA变体序列的核酸分子,其包含对应于Glu321Ala、Lys81Met、Ser139Ala、Val111Ile、Val191Ile、Thr247Val、Tyr72Cys、Asp138Cys、Gly147Cys和Gly154Cys的氨基酸取代。本公开的示例性核酸分子包括编码与SEQ ID NO:10的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列的核酸分子。在任意的实施方案中,编码SEQ ID NO:10的这种LukACC45变体的示例性核酸分子包含与SEQ ID NO:57具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列。在任意的实施方案中,编码这种LukACC8变体的核酸分子包含SEQ ID NO:57的核苷酸序列。
本公开的另一方面涉及编码本文公开的LukB变异多肽的多核苷酸。在一个实施方案中,多核苷酸编码LukB变异多肽,该多肽在对应于SEQ ID NO:39的氨基酸残基Val53的氨基酸残基上包含氨基酸取代或缺失。在任意的实施方案中,Val53处的氨基酸取代包括缬氨酸到亮氨酸(Val53Leu)的取代。在一个实施方案中,示例性核酸分子是编码CC8 LukB变体序列的核酸分子,例如,编码SEQ ID NO:15的变体,其包含SEQ ID NO:15的53位处的氨基酸取代。编码CC8 LukB的示例性核酸分子在此表述为SEQ ID NO:58。因此,在任意的实施方案中,示例性核酸分子是SEQ ID NO:58的变体,其中所述变体包含与SEQ ID NO:58的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列。
在一个实施方案中,本公开的示例性核酸分子编码LukB变异多肽,所述变异多肽为SEQ ID NO:17(LukB CC8 V53L)或具有与SEQ ID NO:17的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。编码这种LukB CC8 V53L变体的示例性核酸分子包含具有与SEQ ID NO:60至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列。在任意的实施方案中,编码这种LukACC8变体的核酸分子包含SEQ ID NO:60的核苷酸序列。
在另一个实施方案中,示例性核酸分子是编码CC45 LukB变体序列的核酸分子,例如,编码SEQ ID NO:16的变体,其包含SEQ ID NO:16的53位的氨基酸取代。编码CC45 LukB的示例性核酸分子在此表述为SEQ ID NO:59。因此,在任意的实施方案中,示例性核酸分子是SEQ ID NO:59的变体,其中所述变体包含与SEQ ID NO:59的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列。
在另一个实施方案中,本公开的示例性多核苷酸编码LukB变异多肽,所述变异多肽为SEQ ID NO:18(LukB CC45 V53L)或具有与SEQ ID NO:18的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。编码这种LukB CC45 V53L变体的示例性核酸分子包含具有与SEQ ID NO:61至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列。在任意的实施方案中,编码这种LukACC45变体的核酸分子包含SEQ ID NO:61的核苷酸序列。
在任意的实施方案中,本公开的多核苷酸编码LukB变异多肽,该多肽包含对应于SEQ ID NO:39的氨基酸残基Glu45、Glu109、Thr121和Arg154的一个或多个氨基酸残基上的氨基酸取代。在一个实施方案中,在一个或多个前述残基上的氨基酸取代引入了一个或多个能够形成二硫键的半胱氨酸残基,以稳定LukAB异二聚体结构的构象。在一个实施方案中,所述多核苷酸编码LukB变异蛋白或多肽,所述蛋白或多肽包含对应于SEQ ID NO:39的Glu45(Glu45Cys)的氨基酸残基上的谷氨酸到半胱氨酸的取代,以及对应于SEQ ID NO:39的Thr121(Thr121Cys)的氨基酸残基上的苏氨酸到半胱氨酸的取代。在另一个实施方案中,多核苷酸编码LukB变异蛋白或多肽,其包含对应于SEQ ID NO:39的Glu109(Glu109Cys)的氨基酸残基上的谷氨酸到半胱氨酸的取代,以及对应于SEQ ID NO:39的Arg154(Arg154Cys)的氨基酸残基上的精氨酸到半胱氨酸的取代。
在任意的实施方案中,本公开的多核苷酸编码LukB变异多肽,该多肽在对应于SEQID NO:39的氨基酸残基Glu45、Glu109、Thr121和Arg154的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,任一氨基酸残基上的氨基酸取代都包括如上所述的半胱氨酸残基的引入。
在一个实施方案中,示例性核酸分子是编码CC8 LukB变体序列的核酸分子,例如,编码SEQ ID NO:15的变体,所述变体在对应于SEQ ID NO:15的氨基酸残基Glu45、Glu109、Thr121和Arg154的每个氨基酸残基上包含氨基酸取代。在一个实施方案中,多核苷酸编码LukB变异多肽,其包含SEQ ID NO:21的氨基酸序列(LukB CC8 Glu45Cys、Glu109Cys、Thr121Cys和Arg154Cys)或具有与SEQ ID NO:21的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。在另一个实施方案中,示例性核酸分子是编码CC45 LukB变体序列的核酸分子,例如编码SEQ ID NO:16的变体,其在对应于SEQID NO:16的氨基酸残基Glu45、Glu110、Thr122和Arg155的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,多核苷酸编码LukB变异多肽,该多肽包含SEQ ID NO:22的氨基酸序列(LukB CC45 Glu45Cys、Thr122Cys、Glu110Cys、Arg155Cys)或具有与SEQ ID NO:22的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列。
在任意的实施方案中,本公开的多核苷酸编码LukB变异多肽,其包含对应于SEQID NO:39的Val53的氨基酸残基上的氨基酸取代,以及对应于SEQ ID NO:39的Glu45、Glu109、Thr121和Arg154的一个或多个氨基酸残基上的氨基酸残基取代。在一个实施方案中,示例性核酸分子是编码CC8 LukB变体序列的核酸分子,例如,编码SEQ ID NO:15的变体,其在对应于SEQ ID NO:15的氨基酸残基Val53、Glu45、Glu109、Thr121和Arg154的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,多核苷酸编码具有SEQ ID NO:19的氨基酸序列(LukB CC8 Val53Leu、Glu45Cys、Glu109Cys、Thr121Cys和Arg154Cys)的LukB变异多肽,或者编码具有与SEQ ID NO:19的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列的LukB变异多肽。在另一个实施方案中,示例性核酸分子是编码CC45 LukB变体序列的核酸分子,例如,编码SEQ ID NO:16的变体,其在对应于SEQ ID NO:16的氨基酸残基Val53、Glu45、Glu110、Thr122和Arg155的每个氨基酸残基上包含氨基酸取代。在任意的实施方案中,多核苷酸编码具有SEQ ID NO:20的氨基酸序列(LukB CC45 Val53Leu、Glu45Cys、Thr122Cys、Glu110Cys、Arg155Cys)的LukB变异多肽,或编码具有与SEQ ID NO:20的氨基酸序列至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的氨基酸序列的LukB变异多肽。
在另一个实施方案中,本公开的示例性核酸分子是编码本文公开的LukA序列和LukB序列的核酸分子。在一个实施方案中,示例性核酸分子是编码CC45 LukA序列(变体或非变体)和CC45 LukB序列(变体或非变体)的多核苷酸。例如,编码本文公开的CC45 LukA变体序列和CC45 LukB非变体序列的多核苷酸,或编码本文公开的CC45 LukA非变体序列和CC45 LukB变体序列的多核苷酸。
在另一个实施方案中,示例性核酸分子是编码CC8 LukA序列(变体或非变体)和CC8LukB序列(变体或非变体)的多核苷酸。例如,编码本文公开的CC8 LukA变体序列和CC8LukB非变体序列的多核苷酸,或编码本文公开的CC8 LukA非变体序列和CC8 LukB变体序列的多核苷酸。
在另一个实施方案中,示例性核酸分子是编码CC45 LukA序列(变体或非变体)和CC8LukB序列(变体或非变体)的多核苷酸。例如,编码本文公开的CC45 LuCA变体序列和CC8LukB非变体序列的多核苷酸,或编码本文公开的CC45 LuCA非变体序列和CC8 LukB变体序列的多核苷酸。
在另一个实施方案中,示例性核酸分子是编码CC8 LukA序列(变体或非变体)和CC45LukB序列(变体或非变体)的核酸分子。例如,编码本文公开的CC8 LukA变体序列和CC45LukB非变体序列的多核苷酸,或编码本文公开的CC8 LukA非变体序列和CC45 LukB变体序列的多核苷酸。
在另一个实施方案中,本公开的示例性核酸分子是编码LukA变体序列和LukB野生型序列的多核苷酸。例如,编码选自SEQ ID NO:3、4、5、6、7、8、9、10、11、12、13或14中任一项所述的LukA变体序列的多核苷酸,与SEQ ID NO:15或SEQ ID NO:16的LukB野生型(即非变体)序列组合。
在任意的实施方案中,本公开的示例性核酸分子是编码LukA野生型序列和LukB变体序列的多核苷酸。例如,编码SEQ ID NO:1或SEQ ID NO:2的LukA野生型序列与选自SEQID NO:17、18、19、20、21或22中任一个的LukB变体序列组合的多核苷酸。
在任意的实施方案中,本公开的示例性核酸分子是编码LukA变体序列和LukB变体序列的多核苷酸。例如,编码选自SEQ ID NO:3、4、5、6、7、8、9、10、11、12、13或14中任一个的LukA变体序列的多核苷酸,与选自SEQ ID NO:17、18、19、20、21或22中任一个的LukB变体序列组合。
在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:3的LukA变体序列和SEQ ID NO:15或16的LukB非变体序列、SEQ ID NO:17或18的LukB变体序列、SEQ IDNO:19或20的LukB变体序列或SEQ ID NO:21或22的LukB变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:4的LukA变体序列和SEQ ID NO:15或16的LukB非变体序列、SEQ ID NO:17或18的LukB变体序列、SEQ ID NO:19或20的LukB变体序列或SEQ IDNO:21或22的LukB变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ IDNO:5的LukA变体序列和SEQ ID NO:15或16的LukB非变体序列、SEQ ID NO:17或18的LukB变体序列、SEQ ID NO:19或20的LukB变体序列或SEQ ID NO:21或22的LukB变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:6的LukA变体序列和SEQ ID NO:15或16的LukB非变体序列、SEQ ID NO:17或18的LukB变体序列、SEQ ID NO:19或20的LukB变体序列或SEQ ID NO:21或22的LukB变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:7的LukA变体序列和SEQ ID NO:15或16的LukB非变体序列、SEQ IDNO:17或18的LukB变体序列、SEQ ID NO:19或20的LukB变体序列或SEQ ID NO:21或22的LukB变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:8的LukA变体序列和SEQ ID NO:15或16的LukB非变体序列、SEQ ID NO:17或18的LukB变体序列、SEQID NO:19或20的LukB变体序列或SEQ ID NO:21或22的LukB变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:9的LukA变体序列和SEQ ID NO:15或16的LukB非变体序列、SEQ ID NO:17或18的LukB变体序列、SEQ ID NO:19或20的LukB变体序列或SEQ ID NO:21或22的LukB变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:10的LukA变体序列和SEQ ID NO:15或16的LukB非变体序列,SEQ ID NO:17或18的LukB变体序列,SEQ ID NO:19或20的LukB变体序列,或SEQ ID NO:21或22的LukB变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:11的LukA变体序列和SEQ ID NO:15或16的LukB非变体序列,SEQ ID NO:17或18的LukB变体序列,SEQ ID NO:19或20的LukB变体序列,或SEQ ID NO:21或22的LukB变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:12的LukA变体序列和SEQ ID NO:15或16的LukB非变体序列,SEQ ID NO:17或18的LukB变体序列,SEQ ID NO:19或20的LukB变体序列,或SEQ IDNO:21或22的LukB变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ IDNO:13的LukA变体序列和SEQ ID NO:17或18的LukB变体序列,SEQ ID NO:19或20的LukB变体序列,或SEQ ID NO:21或22的LukB变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:14的LukA变体序列和SEQ ID NO:17或18的LukB变体序列,SEQ ID NO:19或20的LukB变体序列,或SEQ ID NO:21或22的LukB变体序列。
在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:17的LukB变体序列和SEQ ID NO:1或2的LukA非变体序列,SEQ ID NO:3或4的LukA变体序列,SEQ ID NO:5或6的LukA变体序列,SEQ ID NO:7或8的LukA变体序列,SEQ ID NO:9或10的LukA变体序列,SEQ ID NO:11或12的LukA变体序列,或SEQ ID NO:13或14的LukA变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:18的LukB变体序列和SEQ ID NO:1或2的LukA非变体序列,SEQ ID NO:3或4的LukA变体序列,SEQ ID NO:5或6的LukA变体序列,SEQID NO:7或8的LukA变体序列,SEQ ID NO:9或10的LukA变体序列,SEQ ID NO:11或12的LukA变体序列,或SEQ ID NO:13或14的LukA变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:19的LukB变体序列和SEQ ID NO:1或2的LukA非变体序列,SEQ IDNO:3或4的LukA变体序列,SEQ ID NO:5或6的LukA变体序列,SEQ ID NO:7或8的LukA变体序列,SEQ ID NO:9或10的LukA变体序列,SEQ ID NO:11或12的LukA变体序列,或SEQ ID NO:13或14的LukA变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:20的LukB变体序列和SEQ ID NO:1或2的LukA非变体序列,SEQ ID NO:3或4的LukA变体序列,SEQ ID NO:5或6的LukA变体序列,SEQ ID NO:7或8的LukA变体序列,SEQ ID NO:9或10的LukA变体序列,SEQ ID NO:11或12的LukA变体序列,或SEQ ID NO:13或14的LukA变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:21的LukB变体序列和SEQ ID NO:1或2的LukA非变体序列,SEQ ID NO:3或4的LukA变体序列,SEQ ID NO:5或6的LukA变体序列,SEQ ID NO:7或8的LukA变体序列,SEQ ID NO:9或10的LukA变体序列,SEQID NO:11或12的LukA变体序列,或SEQ ID NO:13或14的LukA变体序列。在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:22的LukB变体序列和SEQ ID NO:1或2的LukA非变体序列,SEQ ID NO:3或4的LukA变体序列,SEQ ID NO:5或6的LukA变体序列,SEQ IDNO:7或8的LukA变体序列,SEQ ID NO:9或10的LukA变体序列,SEQ ID NO:11或12的LukA变体序列,或SEQ ID NO:13或14的LukA变体序列。
在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:4的CC45 LukA变体序列和SEQ ID NO:16的CC45 LukB序列。编码这种LukAB异二聚体(RARPR-15)的示例性核酸分子包含与SEQ ID NO:55(CC45 LukA变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列,该核苷酸序列可操作地与SEQ IDNO:59(CC45 LukB)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列偶联。编码这种LukAB异二聚体的示例性核酸分子包含SEQ IDNO:55的核苷酸序列,其可操作地与SEQ ID NO:59的核苷酸序列偶联。
在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:4的CC45 LukA变体序列和SEQ ID NO:18的CC45 LukB变体序列。编码这种LukAB异二聚体(RARPR-30)的示例性核酸分子包含与SEQ ID NO:55(CC45 LukA变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列,所述核苷酸序列与SEQ ID NO:61(CC45 LukB变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列可操作地偶联。编码这种LukAB异二聚体的示例性核酸分子包含SEQ ID NO:55的核苷酸序列,其可操作地与SEQ ID NO:61的核苷酸序列偶联。
在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:3的CC8 LukA变体序列和SEQ ID NO:15的CC8 LukB序列。编码这种LukAB异二聚体(RARPR-32)的示例性核酸分子包含与SEQ ID NO:54(CC8 LukA变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列,所述核苷酸序列与SEQ ID NO:58(CC8 LukB)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列可操作地偶联。编码这种LukAB异二聚体的示例性核酸分子包含SEQ IDNO:54的核苷酸序列,其可操作地与SEQ ID NO:58的核苷酸序列偶联。
在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:3的CC8 LukA变体序列和SEQ ID NO:18的CC45 LukB变体序列。编码这种LukAB异二聚体(RARPR-33)的示例性核酸分子包含与SEQ ID NO:54(CC8 LukA变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列,所述核苷酸序列与SEQ ID NO:61(CC45 LukB变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列可操作地偶联。编码这种LukAB异二聚体的示例性核酸分子包含SEQ ID NO:54的核苷酸序列,其可操作地与SEQ ID NO:61的核苷酸序列偶联。
在任意的实施方案中,本公开的示例性核酸分子编码SEQ ID NO:3的CC8 LukA变体序列和SEQ ID NO:17的CC8 LukB变体序列。编码这种LukAB异二聚体(RARPR-34)的示例性核酸分子包含与SEQ ID NO:54(CC8 LukA变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列,所述核苷酸序列与SEQ ID NO:60(CC8 LukB变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列可操作地偶联。编码这种LukAB异二聚体的示例性核酸分子包含SEQ ID NO:54的核苷酸序列,其可操作地与SEQ ID NO:60的核苷酸序列偶联。
下表3提供了本公开的示例性核酸分子序列。
表3.示例性LukA和LukB多核苷酸序列
在任意的实施方案中,编码如本文所述的编码变异LukA和LukB多肽的核酸分子被密码子优化以在哺乳动物细胞,优选人细胞中进行表达。密码子优化的方法是已知的,并且已经在前面描述过(例如授予Seed的国际专利申请公开号WO1996/09378,其全部内容通过引用结合于此)。如果与野生型序列相比,至少一个非优选密码子被更优选的密码子取代,则序列被认为是密码子优化的。这里,非优选密码子是在生物体中使用频率低于编码相同氨基酸的另一个密码子的密码子,更优选的密码子是在生物体中使用频率高于非优选密码子的密码子。用于特定生物体的密码子使用频率可以在本领域公知的和可获得的密码子频率表中找到。优选多于一个非优选密码子,例如多于10%、40%、60%、80%的非优选密码子,优选大多数(例如,至少90%)或所有非优选密码子被更优选的密码子替换。优选地,生物体中最常用的密码子用于密码子优化的序列。优选密码子的替换通常导致更高的表达。
本公开的多核苷酸序列可以使用常规分子生物学技术来进行克隆,或者通过DNA合成从头生成,这可以由在DNA合成和/或分子克隆领域有业务的服务公司(例如GeneArt、GenScript、Invitrogen、Eurofins)使用常规程序来进行。
在任意的实施方案中,将前述核酸分子插入载体,即用于本文所述疫苗组合物的表达载体。或者,可以将这些核酸分子插入到表达载体中,该表达载体被转化或转染到合适的宿主细胞中,用于表达和分离编码的变异LukA蛋白、变异LukB蛋白或变异LukB复合物(作为稳定的异二聚体),其中变异LukB复合物包含本文公开的变异LukA和非变异LukB、非变异LukA和变异LukB、或变异LukA和变异LukB。
根据本公开的这一方面,编码本文所述的金黄色葡萄球菌LukA和/或LukB蛋白及其多肽的核酸分子可以加入到能够表达由核酸序列构建体编码的LukA和/或LukB蛋白或多肽的任何表达载体中。合适的表达载体包含控制、调节、引起或允许由这种载体编码的LukA和/或LukB蛋白或多肽表达的核酸序列要素。这些要素可以包括转录增强子结合位点、RNA聚合酶起始位点、核糖体结合位点和其他促进编码多肽在给定表达系统中表达的位点。合适的载体包括但不限于DNA载体、质粒载体、线性核酸和病毒载体,例如腺病毒载体。
在一个实施方案中,所述表达载体是环形质粒(参见,例如,Muthumani等人,“Optimized and Enhanced DNA Plasmid Vector Based In vivo Construction of aNeutralizing anti-HIV-1Envelope Glycoprotein Fab,”Hum.Vaccin.Immunother.9:2253-2262(2013),其全部内容通过引用结合于此)。质粒可以通过整合到细胞基因组中来转化靶细胞,或者存在于染色体外(例如,具有复制起点的自主复制质粒)。示例性的质粒载体包括但不限于pCEP4、pREP4、pVAX、pcDNA3.0、provax或能够表达由重组核酸序列构建体编码的变异LukA和/或变异LukB蛋白或多肽的任何其他质粒表达载体。
在另一个实施方案中,表达载体是线性表达盒(“LEC”)。LEC能够通过电穿孔被有效地递送至受试者,以表达由本文所述重组核酸分子编码的LukA和/或LukB蛋白或多肽。LEC可以是任何没有磷酸骨架的线性DNA。在一个实施方案中,LEC不包含任何抗生素抗性基因和/或磷酸骨架。在另一个实施方案中,LEC不包含与所需基因表达无关的其他核酸序列。
LEC可以来自任何能够线性化的质粒。该质粒能够表达本文所述重组核酸分子编码的LukA和/或LukB蛋白或多肽。示例性质粒包括但不限于pNP(Puerto Rico/34)、pM2(NewCaledonia/99)、WLV009、pVAX、pcDNA3.0或provax,或能够表达由重组核酸序列构建体编码的变异LukA和/或变异LukB蛋白或多肽的任何其他表达载体。
在另一个实施方案中,所述表达载体是病毒载体。能够表达LukA和/或LukB蛋白或多肽的合适的病毒载体包括,例如,腺相关病毒(AAV)载体(参见,例如,Krause等人,“Delivery of Antigens by Viral Vectors for Vaccination,”Ther.Deliv.2(1):51-70(2011);Ura等人,“Developments in Viral Vector-Based Vaccines,”Vaccines 2:624-641(2014);Buning等人,"Recent Developments in Adeno-associated Virus VectorTechnology,"J.Gene Med.10:717-733(2008),其中每一篇都在此全文引入作为参考),慢病毒载体(参见,例如,Ura等人,“Developments in Viral Vector-Based Vaccines,”Vaccines 2:624-641(2014);和Hu等人,“Immunization Deliveredby LentiviralVectors for Cancer and Infection Diseases,”Immunol.Rev.239:45-61(2011),其在此全文引入作为参考)、逆转录病毒载体(例如参见Ura等人,“Developments in ViralVector-BasedVaccines,”Vaccines 2:624-641(2014),其在此全文引入作为参考)、牛痘病毒、复制缺陷型腺病毒载体和无骨腺病毒载体(gutless adenovirus vector)(例如参见美国专利No.5,872,005,其全部内容通过引用结合于此)。用于产生和分离适合作为载体的腺相关病毒(AAVs)的方法在本领域是已知的(参见,例如,Grieger&Samulski,"Adeno-associated Virus as a Gene Therapy Vector:Vector Development,Production andClinical Applications,"Adv.Biochem.Engin/Biotechnol.99:119-145(2005),Buning等人,"Recent Developments inAdeno-associated Virus Vector Technology,"J.GeneMed.10:717-733(2008),其中每一篇都通过引用整体结合于此)。
编码本文所述LukA和/或LukB蛋白或多肽的核酸分子通常与表达载体构建体中的启动子序列、翻译起始序列、3’非翻译区序列、聚腺苷酸化序列和转录终止序列结合,以实现最大表达。适于驱动LukA和/或LukB蛋白或其多肽表达的启动子序列包括但不限于延伸因子1-α(EF1a)启动子、磷酸甘油酸激酶-1(PGK)启动子、巨细胞病毒立即早期基因启动子(CMV)、嵌合肝特异性启动子(LSP)、巨细胞病毒增强子/鸡β-肌动蛋白启动子(CAG)、四环素应答启动子(TRE)、甲状腺素运载蛋白启动子(TTR)、猿猴病毒40启动子(SV40)和CK6启动子。本领域已知的适于驱动宿主细胞中基因表达的其他启动子也适于包含在本文公开的表达构建体中。
本公开的另一方面涉及包含载体的宿主细胞,所述载体包含编码本文所述LukA和/或LukB多肽的多核苷酸。编码本文所述LukA和LukB蛋白或多肽的表达构建体可以通过共转染、串联转染或分别转染到宿主细胞中。本文所述的LukA和LukB蛋白和多肽可以任选地由本领域所熟知的细胞系、混合细胞系、永生化细胞或永生化细胞的克隆群体产生(例如,参见Ausubel等人,ed.,Current Protocols in Molecular Biology,John Wiley&Sons,Inc.,NY,N.Y.(1987-2001);Sambrook等人,Molecular Cloning:ALaboratoryManual,2
在任意的实施方案中,本文所述的LukA和/或LukB多肽在细菌细胞中产生。合适的细菌宿主细胞包括但不限于埃希氏菌宿主细胞、假单胞菌宿主细胞、葡萄球菌宿主细胞、链霉菌宿主细胞、分枝杆菌宿主细胞和芽孢杆菌宿主细胞。在任意的实施方案中,宿主细胞是大肠杆菌宿主细胞。在任意的实施方案中,宿主细胞是金黄色葡萄球菌宿主细胞。
在任意的实施方案中,本文所述的LukA和/或LukB多肽在真核细胞中产生。示例性真核细胞可以来自哺乳动物、昆虫、鸟类或其他动物。哺乳动物真核细胞包括永生化细胞系如杂交瘤或骨髓瘤细胞系如SP2/0(美国典型培养物保藏中心(ATCC),弗吉尼亚州马纳萨斯,CRL-1581),NSO(欧洲细胞培养物保藏中心(ECACC),英国威尔特郡索尔兹伯里市,UK,ECACC No.85110503),FO(ATCC CRL-1646)和Ag653(ATCC CRL-1580)鼠细胞系。示例性的人骨髓瘤细胞系是U266(ATTC CRL-TIB-196)。其他有用的细胞系包括来自中国仓鼠卵巢(CHO)细胞的细胞系,如CHO-K1SV(Lonza Biologics,Walkersville,Md.)、CHO-K1(ATCCCRL-61)或DG44。
本文所述的LukA和LukB多肽可以使用上述分离的多核苷酸、载体和宿主细胞通过多种技术中的任何一种来制备。通常,蛋白质是通过标准克隆和细胞培养技术产生的,这些技术通常用于制备重组表达载体、转染宿主细胞、选择转化体、培养宿主细胞以及从培养基中回收蛋白质或多肽。转染宿主细胞可以使用多种常用于将外源性DNA导入原核或真核宿主细胞的技术来进行,例如通过电穿孔、磷酸钙沉淀、DEAE-葡聚糖转染等。
本文所述的LukA和/或LukB多肽可以通过诸如糖基化、异构化、去糖基化等过程进行翻译后修饰,或者通过非天然发生的共价修饰(诸如添加聚乙二醇(PEG)部分(聚乙二醇化)和脂质化等)进行翻译后修饰。这种修饰可以发生在体内或体外。
在任意的实施方案中,本文所述的LukA和LukB多核苷酸和/或多肽优选为“分离的”多核苷酸和/或多肽。当用于描述本文公开的多核苷酸和/或多肽时,“分离的”意味着多核苷酸和/或多肽已经从其生产环境的组分中鉴定、分离和/或回收。优选地,分离的多核苷酸和/或多肽不与来自其生产环境的其他组分结合。其生产环境中的污染物组分,例如由重组转染细胞产生的污染物成分,是通常会干扰药物使用的物质,可能包括酶、激素和其他蛋白质或非蛋白质溶质。通过已知方法从重组细胞培养物中回收和纯化多核苷酸和/或多肽,包括但不限于蛋白A纯化、硫酸铵或乙醇沉淀、酸提取、阴离子或阳离子交换色谱、磷酸纤维素色谱、疏水相互作用色谱、亲和色谱、羟基磷灰石色谱和凝集素色谱。高效液相色谱法(“HPLC”)也可用于纯化。
金黄色葡萄球菌疫苗组合物
本公开的另一方面涉及金黄色葡萄球菌疫苗组合物。在任意的实施方案中,所述金黄色葡萄球菌疫苗组合物包含本文所述的任何一种或多种LukA变异多肽,或编码本文所述LukA变异多肽的一种或多种核酸分子。特别的,所述疫苗组合物的LukA变异多肽,如本文鉴定和描述的,在一个或多个氨基酸残基的任何一个上包含氨基酸残基插入、取代和/或缺失。在任意的实施方案中,所述疫苗组合物的LukA变体包含SEQ ID NO:25的变体或SEQ IDNO:1、2或26-38中任何一个的变体。在任意的实施方案中,所述疫苗组合物的LukA变体包含SEQ ID NO:1(CC8)的变体。示例性的CC8LukA变体包括但不限于SEQ ID NO:3、5、7、9和13的LukA变体。在任意的实施方案中,所述疫苗组合物的LukA变体包含SEQ ID NO:2(CC45)的变体。示例性的CC45 LukA变体包括但不限于SEQ ID NOs:4、6、8、10、11、12和14的LukA变体。
在任意的实施方案中,本文公开的金黄色葡萄球菌疫苗组合物包含具有SEQ IDNO:3的氨基酸序列的CC8LukA变体。
在任意的实施方案中,本文公开的金黄色葡萄球菌疫苗组合物包含具有SEQ IDNO:7的氨基酸序列的CC8 LukA变体。
在任意的实施方案中,本文公开的金黄色葡萄球菌疫苗组合物包含具有SEQ IDNO:8的氨基酸序列的CC45 LukA变体。
在任意的实施方案中,本文公开的金黄色葡萄球菌疫苗组合物包含本文所述的任何一种或多种变异LukB蛋白或多肽,或编码本文所述的LukB变体蛋白或多肽的一种或多种核酸分子。特别的,所述疫苗组合物的LukB变异多肽,如本文鉴定和描述的,在一个或多个氨基酸残基的任何一个上包含氨基酸残基插入、取代和/或缺失。在任意的实施方案中,所述疫苗组合物的LukB变体包含SEQ ID NO:39的变体或SEQ ID NO:15、16或40-51中任何一个的变体。在任意的实施方案中,所述疫苗组合物的LukB变体包含SEQ ID NO:15(CC8)的变体。示例性的CC8 LukB变体包括但不限于SEQ ID NO:17、19和21的LukB变体。在任意的实施方案中,所述疫苗组合物的LukB变体包含SEQ ID NO:16(CC45)的变体。示例性的CC45 LukB变体包括但不限于SEQ ID NO:18、20和21的LukB变体。
在任意的实施方案中,本文公开的疫苗组合物同时包含LukA和LukB蛋白。因此,在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:1的CC8 LukA变体,同时包含SEQ IDNO:15的CC8 LukB非变体序列或具有与SEQ ID NO:15至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的变体序列。在任意的实施方案中,CC8 LukB序列变体序列包含选自SEQ ID NO:17、19和21的氨基酸序列。例如,在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:3的CC8 LukA变体,同时包含SEQID NO:15的CC8 LukB序列或与SEQ ID NO:15的CC8 LukB具有85%或更多序列同一性的变体,例如选自SEQ ID NO:17、19和21的CC8 LukB变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:5的CC8 LukA变体,同时包含SEQ ID NO:15的CC8 LukB序列或与SEQID NO:15的CC8 LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:17、19和21的CC8 LukB变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:7的CC8 LukA变体,同时包含SEQ ID NO:15的CC8 LukB序列或与SEQ ID NO:15的CC8 LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:17、19和21的CC8 LukB变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:9的CC8LukA变体,同时包含SEQ ID NO:15的CC8 LukB序列或与SEQ ID NO:15的CC8 LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:17、19和21的CC8 LukB变体序列。
在任意的实施方案中,所述疫苗组合物包含具有SEQ ID NO:3氨基酸序列的CC8LukA变体和具有SEQ ID NO:15氨基酸序列的CC8 LukB变体。
在任意的实施方案中,所述疫苗组合物包含具有SEQ ID NO:3氨基酸序列的CC8LukA变体和具有SEQ ID NO:17氨基酸序列的CC8 LukB变异体。
在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:1的CC8 LukA变体,同时包含SEQ ID NO:16的CC45 LukB序列或具有与SEQ ID NO:16至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的变体序列。在任意的实施方案中,CC45 LukB变体序列包含选自SEQ ID NO:18、20和22的氨基酸序列。例如,在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:3的CC8 LukA变体,同时包含SEQ ID NO:16的CC45 LukB序列或与SEQ ID NO:16的CC45 LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:18、20和22的CC45 LukB变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:5的CC8 LukA变体,同时包含SEQ ID NO:16的CC45 LukB序列或与SEQ ID NO:16的CC45 LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:18、20和22的CC45 LukB变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:7的CC8LukA变体,同时包含SEQ ID NO:16的CC45 LukB序列或与SEQ ID NO:16的CC45 LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:18、20和22的CC45 LukB变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:9的CC8 LukA变体,同时包含SEQ ID NO:16的CC45 LukB序列或与SEQ ID NO:16的CC45LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:18、20和22的CC45 LukB变体序列。
在任意的实施方案中,所述疫苗组合物包含具有SEQ ID NO:5氨基酸序列的CC8LukA变体和具有SEQ ID NO:16氨基酸序列的CC45 LukB变体。
在任意的实施方案中,所述疫苗组合物包含具有SEQ ID NO:5氨基酸序列的CC8LukA变体和具有SEQ ID NO:22氨基酸序列的CC45 LukB变体。
在任意的实施方案中,所述疫苗组合物包含具有SEQ ID NO:5氨基酸序列的CC8LukA变体和具有SEQ ID NO:18氨基酸序列的CC45 LukB变体。
在任意的实施方案中,所述疫苗组合物包含具有SEQ ID NO:5氨基酸序列的CC8LukA变体和具有SEQ ID NO:20氨基酸序列的CC45 LukB变体。
在任意的实施方案中,所述疫苗组合物包含具有SEQ ID NO:3氨基酸序列的变异LukA蛋白和具有SEQ ID NO:18氨基酸序列的LukB蛋白。
在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:2的CC45 LukA变体,同时包含SEQ ID NO:16的CC45 LukB序列或具有与SEQ ID NO:16至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的变体序列。在任意的实施方案中,CC45 LukB变体序列包含选自SEQ ID NO:18、20和22的氨基酸序列。例如,在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:4的CC45 LukA变体,同时包含SEQ ID NO:16的CC45 LukB序列或与SEQ ID NO:16的CC45 LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:18、20和22的CC45 LukB变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:6的CC45 LukA变体,同时包含SEQ ID NO:16的CC45 LukB序列或与SEQ ID NO:16的CC45 LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:18、20和22的CC45 LukB变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:8的CC45 LukA变体,同时包含SEQ ID NO:16的CC45 LukB序列或与SEQ ID NO:16的CC45 LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:18、20和22的CC45 LukB变体。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:10的CC45 LukA变体,同时包含SEQ IDNO:16的CC45 LukB序列或与SEQ ID NO:16的CC45 LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:18、20和22的CC45LukB变体。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:11的CC45 LukA变体,同时包含SEQ ID NO:16的CC45 LukB序列或与SEQ IDNO:16的CC45 LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:18、20和22的CC45 LukB变体。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:12的CC45 LukA变体,同时包含SEQ ID NO:16的CC45 LukB序列或与SEQ ID NO:16的CC45 LukB具有大于85%序列同一性的变体,例如选自SEQ ID NO:18、20和22的CC45 LukB变体。
在一个实施方案中,所述疫苗组合物包含具有SEQ ID NO:4的氨基酸序列的CC45LukA变体与具有SEQ ID NO:16的氨基酸序列的CC45 LukB的组合。
在一个实施方案中,所述疫苗组合物包含具有SEQ ID NO:11的氨基酸序列的CC45LukA变体与具有SEQ ID NO:16的氨基酸序列的CC45 LukB的组合。
在一个实施方案中,所述疫苗组合物包含具有SEQ ID NO:12的氨基酸序列的CC45LukA变体与具有SEQ ID NO:16的氨基酸序列的CC45 LukB的组合。
在一个实施方案中,所述疫苗组合物包含具有SEQ ID NO:8的氨基酸序列的CC45LukA变体与具有SEQ ID NO:16的氨基酸序列的CC45 LukB的组合。
在一个实施方案中,所述疫苗组合物包含具有SEQ ID NO:4的氨基酸序列的CC45LukA变体和具有SEQ ID NO:18的氨基酸序列的CC45 LukB变体的组合。
在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:2的CC45 LukA变体,同时包含SEQ ID NO:15的CC8 LukB序列或具有与SEQ ID NO:15至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的变体序列。在任意的实施方案中,CC8 LukB变体序列包含选自SEQ ID NO:17、19和21的氨基酸序列。例如,在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:4的CC45 LukA变体,同时包含SEQ ID NO:15的CC8 LukB序列或与SEQ ID NO:15的CC8 LukB序列具有大于85%序列同一性的变体,例如选自SEQ ID NO:17、19和21的变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:6的CC45 LukA变体,同时包含SEQ ID NO:15的CC8LukB序列或与SEQID NO:15的CC8 LukB序列具有大于85%序列同一性的变体,例如选自SEQ ID NO:17、19和21的变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:8的CC45 LukA变体,同时包含SEQ ID NO:15的CC8 LukB序列或与SEQ ID NO:15的CC8 LukB序列具有大于85%序列同一性的变体,例如选自SEQ ID NO:17、19和21的变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:9的CC45 LukA变体,同时包含SEQ ID NO:15的CC8 LukB序列或与SEQ ID NO:15的CC8 LukB序列具有大于85%序列同一性的变体,例如选自SEQ ID NO:17、19和21的变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:10的CC45LukA变体,同时包含SEQ ID NO:15的CC8LukB序列或与SEQ ID NO:15的CC8 LukB序列具有大于85%序列同一性的变体,例如选自SEQ ID NO:17、19和21的变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:11的CC45 LukA变体,同时包含SEQ ID NO:15的CC8LukB序列或与SEQ ID NO:15的CC8 LukB序列具有大于85%序列同一性的变体,例如选自SEQ ID NO:17、19和21的变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:12的CC45 LukA变体,同时包含SEQ ID NO:15的CC8 LukB序列或与SEQ ID NO:15的CC8LukB序列具有大于85%序列同一性的变体,例如选自SEQ ID NO:17、19和21的变体序列。
本公开的另一方面涉及金黄色葡萄球菌疫苗组合物,其包含本文所述的任何变异LukB变异多肽或编码LukB变体的核酸分子。特别地,所述疫苗组合物的LukB变异多肽包含一个或多个本文所述的氨基酸残基的插入、取代和/或缺失。在任意的实施方案中,所述疫苗组合物的LukB变体包含SEQ ID NO:15(CC8)的变体。示例性的CC8 LukB变体包括但不限于SEQ ID NO:17、19和21的LukB变体。在任意的实施方案中,所述疫苗组合物的LukB变体包含SEQ ID NO:16(CC45)的变体。示例性的CC45 LukB变体包括但不限于SEQ ID NO:18、20和22的LukB变体。
在任意的实施方案中,本文公开的疫苗组合物包含本文描述的LukB变异多肽和LukA蛋白或多肽。因此,在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:15的CC8LukB变体,例如SEQ ID NO:17、19和21的变体,同时包含SEQ ID NO:1的CC8 LukA序列或具有与SEQ ID NO:1至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:15的CC8 LukB变体,例如SEQ ID NO:17、19和21的变体,同时包含SEQ ID NO:2的CC45 LukA序列或具有与SEQ ID NO:2至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的变体序列。
在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:16的CC45 LukB变体,例如SEQ ID NO:18、20或22的变体,同时包含SEQ ID NO:1的CC8 LukA序列或具有与SEQ ID NO:1至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的变体序列。在任意的实施方案中,所述疫苗组合物包含SEQ ID NO:16的CC45 LukB变体,例如SEQ ID NO:18、20或22的变体,同时包含SEQ ID NO:2的CC45 LukA序列或具有与SEQ ID NO:2至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的变体序列。
本公开的疫苗组合物是通过将本文所述的LukA和/或LukB多肽与药学上可接受的载体和任选的药学上可接受的赋形剂一起配制而制备的。药学活性成分与药学上可接受的载体的制备在本领域是已知的,例如Remington:The Science and Practice ofPharmacy(例如第21版(2005)和任何更新的版本)。附加成分的非限制性例子包括:缓冲剂、稀释剂、溶剂、张力调节剂、防腐剂、稳定剂和螯合剂。一种或多种药学上可接受的载体可用于配制本发明的药物组合物。
如本文所用,术语“药学上可接受的载体”和“药学上可接受的赋形剂”(例如添加剂,如稀释剂、免疫刺激剂、佐剂、抗氧化剂、防腐剂和增溶剂)以其所用的剂量和浓度施用组合物对受试者无毒。药学上可接受的载体的例子包括水溶液,例如用磷酸盐、柠檬酸盐和另一种有机酸缓冲得到的水溶液。可用于本公开的药学上可接受的赋形剂的代表性例子包括抗氧化剂,如抗坏血酸;低分子量(小于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如乙二胺四乙酸;糖醇,如甘露醇或山梨醇;成盐抗衡离子,如钠;和/或非离子表面活性剂。
在任意的实施方案中,本文所述的疫苗组合物是液体制剂。液体制剂的优选实例是水性制剂,即包含水的制剂。液体制剂可以包括溶液、悬浮液、乳液、微乳液、凝胶等。水性制剂通常包含至少50%w/w的水,或至少60%、70%、75%、80%、85%、90%或至少95%w/w的水。
疫苗组合物可以进一步包含一种或多种佐剂。如本文所用,术语“佐剂”是指当与本文所述的LukA和/或LukB多肽联合给药时,可以增加、增强和/或促进对多肽的免疫应答的化合物。然而,当佐剂化合物单独给药时,不会对上述多肽或编码多肽的多核苷酸产生免疫应答。佐剂可以通过几种机制增强免疫应答,包括例如淋巴细胞募集、刺激B和/或T细胞以及刺激抗原呈递细胞。
本文所述的疫苗组合物包含LukA和/或LukB多肽和/或编码该多肽的多核苷酸,所述疫苗组合物包含佐剂或与佐剂联合施用。用于与本文所述疫苗组合物联合施用的佐剂可以在施用疫苗组合物之前、同时或之后施用。
合适的佐剂是本领域已知的,包括但不限于鞭毛蛋白、弗氏完全佐剂、弗氏不完全佐剂、氢氧化铝、溶血卵磷脂、pluronic多元醇、聚阴离子、肽、油乳剂、二硝基酚、ISCOMATRIX和脂质体聚阳离子DNA颗粒。佐剂的其他例子包括,例如,专利US6,355,625中描述的β-葡聚糖(该专利在此全文引入作为参考),或粒细胞集落刺激因子(GCSF)。
额外的示例性佐剂包括但不限于铝盐(明矾)(例如氢氧化铝、磷酸铝、硫酸铝和氧化铝,包括包含明矾或纳米明矾制剂的纳米颗粒)、磷酸钙(例如,Masson JD等人,ExpertRev Vaccines 16:289-299(2017),其在此全文引入作为参考)、单磷酰基脂质A(MPL)或3-脱氧-酰化单磷酰基脂质A(3D-MPL)(参见例如,GB2220211,EP0971739,EP1194166,US6491919,这些文献在此全文引入作为参考),AS01,AS02、AS03和AS04(例如参见EP1126876、记载了AS04的US7357936、EP0671948、EP0761231、记载了AS02的US5750110,其在此全文引入作为参考)、咪唑并吡啶化合物(参见WO2007/109812,其在此全文引入作为参考)、咪唑并喹喔啉化合物(参见WO2007/109813,其在此全文引入作为参考)、Δ-菊粉(例如Petrovsky N和PD Cooper,Vaccine 33:5920-5926(2015),其在此全文引入作为参考)、STING-激活合成环状二核苷酸(例如US20150056224,其在此全文引入作为参考)、卵磷脂和卡波姆均聚物的组合(例如US6,676,958,其在此全文引入作为参考),和皂苷,例如QuilA和QS21(例如参见Zhu D和W Tuo,2016,Nat Prod Chem Res 3:e113(doi:10.4172/2329-6836.1000e113),其在此全文引入作为参考),任选地与QS7(参见例如Kensil等人,inVaccine Design:The Subunit and Adjuvant Approach(eds.Powell&Newman,PlenumPress,NY,1995);US 5,057,540,其在此全文引入作为参考)组合。在任意的实施方案中,所述佐剂是弗氏佐剂(完全或不完全)。在任意的实施方案中,所述佐剂包含Quil-A,例如可从Brenntag(现称Croda)或Invivogen购买得到的Quil-A。Quil-A含有来自于QuillajasaponariaMolinatree的皂苷的水提成分。这些皂苷属于三萜皂苷类,具有共同的三萜骨架结构。已知皂苷可诱导对T依赖和T非依赖抗原的强佐剂反应,以及强细胞毒性CD8+淋巴细胞反应,并增强对粘膜抗原的反应。因此,在任意的实施方案中,所述佐剂包含皂苷。在任意的实施方案中,所述佐剂包含QS-21。
在任意的实施方案中,所述皂苷与胆固醇和磷脂结合,形成免疫刺激复合物(ISCOM),其可以启动抗体介导和细胞介导的针对不同来源的广泛抗原的免疫反应。在某些实施方案中,所述佐剂是AS01,例如AS01B。AS01是含有MPL(3-O-去十二烷基-4’-单磷酰基脂质A)、QS21(Quillaja saponariaMolina,馏分21)和脂质体的佐剂系统。在某些实施方案中,AS01是商业上可购买得到的,或者可以如WO 96/33739中所述制备,该文献通过引用整体结合于此。某些助剂包括乳液,乳液是两种不混溶的流体,例如油和水的混合物,其中一种以小液滴形式悬浮在另一种流体中,并通过表面活性剂稳定。水包油乳液具有形成连续相的水,围绕小油滴,而油包水乳液具有形成连续相的油。某些水包油乳液包含角鲨烯(一种可代谢的油)。某些助剂包括嵌段共聚物,它是当两种单体聚集在一起并形成重复单元的嵌段时形成的共聚物。包含嵌段共聚物、角鲨烯和微粒稳定剂的油包水乳液的一个例子是
任选地,乳剂可以与其他免疫刺激成分如TLR4激动剂结合或包含其他的免疫刺激成分。适用于本文公开的组合物中的佐剂组合的合适但非限制性的例子包括水包油乳液(如角鲨烯或花生油)、MF59(例如参见EP0399843、US 6299884、US6451325,其全部内容通过引用结合于此)和AS03,任选与免疫刺激剂如单磷酰脂质A和/或QS21如AS02(参见Stoute等人,N.Engl.J.Med336:86-91(1997)s,其全部内容通过引用结合于此)进行组合。佐剂的其他示例是含有免疫刺激剂如MPL和QS21的脂质体,如在AS01E和AS01B中(例如,参见US2011/0206758,其通过引用整体结合于此)。佐剂的其他例子是CpG和咪唑并喹啉(如咪喹莫特和R848)(例如,参见Reed G等人.,Nature Med,19:1597-1608(2013),其全部内容通过引用结合于此)。在本发明所述的任何实施方案中,所述佐剂是Th1佐剂。
在任意的实施方案中,本文公开的疫苗组合物的佐剂包含单独的toll样受体4(TLR4)激动剂或其与另一种佐剂的组合。TLR4激动剂在本领域中是众所周知的,例如参见Ireton GC和SG Reed,Expert Rev ventures 12:793-807(2013),其全部内容通过引用结合于此。在任意的实施方案中,佐剂是包含脂质A或其类似物或衍生物的TLR4激动剂。
在任意的实施方案中,所述疫苗组合物的佐剂包含脂质A或脂质A类似物或衍生物。如本文所用,术语“脂质A”是指脂多糖分子(LPS)的疏水脂质部分,其包含氨基葡萄糖,并通过酮苷键与脂多糖分子内核中的酮基-脱氧辛基酮糖酸连接,该酮苷键将脂多糖分子锚定在革兰氏阴性菌外膜的外小叶中。本文所用的脂质A包括天然存在的脂质A、其混合物、类似物、衍生物和前体。该术语包括单糖,例如脂质A的前体,称为脂质X;二糖脂质A;七酰基脂质A;六酰基脂质A;五酰基脂质A;四酰基脂质A,例如脂质A的四酰基前体,称为脂质IVA;去磷酸化脂质A;单磷酰基脂质A;二磷酰基脂质A,如来自大肠杆菌和球形红杆菌的脂质A。几种免疫激活脂质A结构含有6条酰基链。直接连接到葡糖胺糖上的四个初级(primary)酰基链是3-羟基酰基链,长度通常在10到16个碳之间。两个额外的酰基链通常连接在初级酰基链的3-羟基上。例如,大肠杆菌脂质A通常具有四个连接到糖上的C143-羟基酰基链,以及一个C12和一个C14分别连接到初级酰基链的2’和3’位的3-羟基上。
如本文所用,术语“脂质A类似物或衍生物”是指具有类似于脂质A的结构和免疫活性,但不一定天然存在的分子。脂质A类似物或衍生物可以被修饰以被缩短或缩合,和/或使它们的葡糖胺残基被另一个胺糖残基(例如半乳糖胺残基)取代,以在还原端含有2-脱氧-2-氨基葡萄糖酸盐以代替葡糖胺-1-磷酸盐,在4’位带有半乳糖醛酸部分而不是磷酸盐。脂质A类似物或衍生物可由从细菌中分离的脂质A制备,例如通过化学衍生,或化学合成,例如通过首先确定优选脂质A的结构并合成其类似物或衍生物。脂质A类似物或衍生物也可用作TLR4激动剂佐剂(参见,例如,Gregg KA等人,MBio 8,eDD492-17,doi:10.1128/mBio.00492-17(2017),其全部内容通过引用结合于此)。
MPL和3D-MPL是脂质A类似物或衍生物,已被修饰以减轻脂质A的毒性。脂质A、MPL和3D-MPL具有糖主链,有长脂肪酸链连接在糖主链上,其中所述主链包含糖苷键中的两个6碳糖和4位的磷酰基部分。典型地,五到八个长链脂肪酸(通常12-14个碳原子)连接到糖主链上。由于天然来源的衍生,MPL或3D-MPL可以以多种脂肪酸取代模式(例如七酰基、六酰基、五酰基等,其具有可变的脂肪酸长度)的复合物或混合物的形式存在。对于本文所述的一些其他脂质A类似物或衍生物也是如此,然而合成脂质A变异体也可以被定义和均质化。US4,436,727中记载了MPL及其批量生产,该专利在此全文引入作为参考。US4,912,094B1中描述了3D-MPL(该专利在此全文引入作为参考),并且与MPL的不同之处在于选择性去除了3-羟基肉豆蔻酰基残基,该残基在3位与还原端的氨基葡萄糖酯连接。适于本文所述疫苗组合物中的脂质A(类似物、衍生物)的例子包括MPL、3D-MPL、RC529(例如,参见EP1385541,其在此全文引入作为参考)、PET-脂质A、GLA(糖基吡喃糖脂佐剂,一种合成二糖糖脂;例如,参见US20100310602和US8722064,这两个专利在此全文引入作为参考),SLA(例如,参见Carter D等人,Clin.Transl.Immunology 5:e108(doi:10.1038/cti.2016.63)(2016),其在此全文引入作为参考,并且其描述了优化用于人类疫苗的TLR4配体的结构-功能方法),PHAD(磷酸化的六酰基二糖;其结构与GLA相同)、3D-PHAD、3D-(6-酰基)-PHAD(3D(6A)-PHAD)、E6020(CAS Number 287180-63-6)、ONO4007、OM-174等。在任意的实施方案中,所述疫苗组合物的佐剂是包含选自3D-MPL、GLA或SLA的脂质A类似物或衍生物的TLR4激动剂佐剂。在某些实施方案中,脂质类似物或衍生物被配制在脂质体中。
所述佐剂,优选包括TLR4激动剂,可以以各种方式配制,例如乳剂,例如油包水(w/o)乳剂或水包油(o/w)乳剂(例如MF59、AS03)、稳定(纳米)乳剂(SE)、脂质悬浮液、脂质体、(聚合)纳米颗粒、病毒体、明矾吸附的、水性制剂(AF)等,代表了用于佐剂中的免疫调节分子和/或针对免疫原的免疫调节分子的各种递送系统(例如参见Reed等人,Nature Med,19:1597-1608(2013)andAlving CR et al,Curr Opin Immunol 24:310-315(2012),其在此全文引入作为参考)。
在任意的实施方案中,免疫刺激性TLR4激动剂可以任选地与其他免疫调节成分组合,例如角鲨烯水包油乳剂(SE)(例如,MF59、AS03)、皂苷类(如QuilA、QS7、QS21、Matrix M、Iscoms、Iscomatrix等)、铝盐、其他TLR的激活剂(如咪唑并喹啉、鞭毛蛋白、dsRNA类似物、TLR9激动剂,如CpG等)、和类似成分(例如参见Reed G.等人,Nature Med,19:1597-1608(2013),其全部内容通过引用结合于此)。
在任意的实施方案中,本文公开的疫苗组合物的佐剂是TLR4激动剂,例如GLA与SE(即GLA-SE)的组合。在任意的实施方案中,本文公开的疫苗组合物的佐剂是TLR4激动剂,如GLA与皂苷(如GLS-QS21)的组合。在任意的实施方案中,上述佐剂可以配制成脂质体。因此,示例性佐剂还包括GLA-LSQ,其被配制成包含合成的TLR4激动剂(例如MPL)和皂苷(例如QS21)的脂质体。
用于本文所述疫苗组合物的其他示例性佐剂包括脂质A类似物或衍生物,包括例如SLA-SE(合成的MPL[SLA]、角鲨烯油/水乳剂)、SLA-纳米明矾(合成的MPL[SLA]、铝盐)、GLA-纳米明矾(合成的MPL[GLA]、铝盐)、SLA-AF(合成的MPL[SLA]、水悬浮液)、GLA-AF(合成的MPL[GLA]、水悬浮液)、、SLA-明矾(合成的MPL[SLA]、铝盐)、GLA-明矾(合成的MPL[GLA]、铝盐)、AS01(MPL、QS21,脂质体)、AS02(MPL、QS21,油/水乳剂)、AS25(MPL,油/水乳剂)、AS04(MPL,铝盐)、和AS15(MPL、QS21、CpG,脂质体)。参见例如WO2008/153541、WO2010/141861、WO2013/119856、WO2019/051149、WO 2013/119856、WO2006/116423、US 4,987,237、US 4,436,727、US 4,877,611、US 4,866,034、US 4,912,094、US 4,987,237、US 5,191,072、US5,593,969、US 6,759,241、US 9,017,698、US 9,149,521、US 9,149,522、US 9,415,097、US9,415,101、US 9,504,743;Reed G.等,Nature Med,19:1597-1608(2013),Johnson等人,JMed Chem,42:4640-4649(1999),和Ulrich和Myers,1995,Vaccine Design:The Subunitand Adjuvant Approach;Powell and Newman,Eds.;Plenum:NewYork,495-524,其全部内容通过引用结合于此。
在任意的实施方案中,所述疫苗组合物的LukA和/或LukB蛋白或多肽可以与免疫原性载体分子偶联。合适的免疫原性载体分子包括但不限于牛血清白蛋白、鸡蛋卵清蛋白、匙孔血蓝蛋白、破伤风类毒素、白喉类毒素、甲状腺球蛋白、肺炎球菌荚膜多糖、CRM 197和脑膜炎球菌外膜蛋白。
疫苗组合物可以进一步包括一种或多种附加的金黄色葡萄球菌抗原,所述抗原选自血清型336多糖抗原、聚集因子A、聚集因子B、纤维蛋白原结合蛋白、胶原结合蛋白、弹性蛋白结合蛋白、MHC类似蛋白、多糖细胞内粘附、β溶血素、Δ溶血素、Panton-Valentine杀白细胞素、杀白细胞素M、脱落毒素A、脱落毒素B、V8蛋白酶、透明质酸裂解酶、脂肪酶、葡激酶、肠毒素、肠毒素超抗原SEA、肠毒素超抗原SAB、中毒性休克综合征毒素-1、聚-N-琥珀酰β-1→6氨基葡萄糖、过氧化氢酶、β-内酰胺酶、磷壁酸、肽聚糖、青霉素结合蛋白、趋化抑制蛋白、补体抑制剂、Sbi、5型抗原、8型抗原和脂磷壁酸。适用于包含在本文所述疫苗组合物中的其他金黄色葡萄球菌抗原包括但不限于CP5、CP8、Eap、Ebh、Emp、EsaB、EsaC、EsxA、EsxB、EsxAB(融合)、IsdA、IsdB、IsdC、MntC、rTSST-1、rTSST-1v、TSST-1、SasF、vWbp、vWh玻连蛋白结合蛋白、Aaa、Aap、Ant、自溶素氨基葡糖苷酶、自溶素酰胺酶、Can、胶原结合蛋白、Csa1A、EFB、弹性蛋白结合蛋白、EPB、FbpA、纤维蛋白原结合蛋白、纤连蛋白结合蛋白、FhuD、FhuD2、FnbA、FnbB、GehD、HarA、HBP、免疫显性ABC转运蛋白、IsaA/PisA、层粘连蛋白受体、脂肪酶GehD、MAP、Mg
在任意的实施方案中,所述疫苗组合物被配制成可注射的,其可以例如通过注射装置(例如注射器或输注泵)注射。可以通过肌肉内、腹膜内、玻璃体内或静脉内进行注射。
本公开的疫苗组合物可以配制成肠胃外给药。该组合物的溶液、悬浮液或乳液可以在水中制备,适当地与表面活性剂如羟丙基纤维素混合。分散体也可以在甘油、液体聚乙二醇及其在油中的混合物中制备。示例性的油是石油、动物、植物或合成来源的油,例如花生油、大豆油或矿物油。一般来说,水、盐水、葡萄糖水溶液和相关的糖溶液,以及二醇,例如丙二醇或聚乙二醇,是优选的液体载体,特别是对于注射溶液。在通常的储存和使用条件下,这些制剂含有防腐剂以防止微生物的生长。
适于注射使用的药物疫苗组合物包括无菌水溶液或分散体以及用于临时制备无菌注射溶液或分散体的无菌粉末。在所有情况下,剂型必须是无菌的,并且必须是流动性的,达到易于注射的程度。它在生产和储存条件下必须是稳定的,并且必须防止微生物如细菌和真菌的污染作用。载体可以是溶剂或分散介质,其含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇)、及其合适的混合物和植物油。
在任意的实施方案中,本文所述的疫苗组合物是固体制剂,例如冻干或喷雾干燥的组合物,其可以原样使用,或者医生或患者在使用前向其添加溶剂和/或稀释剂。固体剂型可以包括片剂,例如压缩片剂和/或包衣片剂,以及胶囊(例如硬或软明胶胶囊)。疫苗组合物还可以是例如袋装粉剂、糖衣丸、粉剂、颗粒剂、锭剂或用于重构的粉末的形式。
疫苗组合物的剂型可以是速释的,在这种情况下,它们可以包含水溶性或可分散的载体,或者它们可以是延迟释放、持续释放或缓和释放,在这种情况下,它们可以包含可以调节制剂在胃肠道或皮肤下的溶解速率的水不溶性聚合物。
在其他实施方案中,所述疫苗组合物可以鼻内、口腔内或舌下递送。
疫苗组合物的水性制剂中的酸碱度可以在3至10之间。在一个实施方案中,所述疫苗组合物的酸碱度为约7.0至约9.5。在另一个实施方案中,所述疫苗组合物的酸碱度为约3.0至约7.0。
金黄色葡萄球菌疫苗组合物的用途
本公开的另一方面涉及本文所述疫苗组合物在预防或抑制受试者的金黄色葡萄球菌感染中的用途。在一个实施方案中,本公开涉及在受试者中产生针对金黄色葡萄球菌的免疫应答的方法,该方法包括在可有效地在所述受试者中产生针对金黄色葡萄球菌的免疫应答的条件下,将本文所述的疫苗组合物施用给受试者。另一个实施方案涉及在有需要的受试者中治疗或预防金黄色葡萄球菌感染的方法,包括施用有效量的本文公开的疫苗组合物。另一个实施方案涉及一种在有需要的受试者中再定殖或防止金黄色葡萄球菌的定殖或再定殖的方法,该方法包括施用有效量的本文公开的疫苗组合物。根据这一方面,本文所述的方法适用于在有需要的受试者中防止金黄色葡萄球菌的短期和持续定殖或再定殖。
这些方法包括将本文所述的任何一种疫苗组合物施用于有此需要的受试者,例如有金黄色葡萄球菌暴露或感染风险的受试者。在一个实施方案中,疫苗组合物包含LukA变异多肽(即SEQ ID NO:1或2的变体)和如上所述的野生型LukB蛋白或多肽。在另一个实施方案中,疫苗组合物包含如上所述的野生型LukA蛋白或多肽和LukB变异多肽(即SEQ ID NO:15或16的变体)。在另一个实施方案中,疫苗组合物包含如上所述的LukA变异多肽和LukB变异多肽。根据本公开的这一方面,适合治疗的受试者是有发展成金黄色葡萄球菌感染风险的受试者。
根据本公开的这一方面,向受试者施用预防有效量的疫苗组合物,以产生针对金黄色葡萄球菌感染的免疫应答。预防有效量是能够产生或引发体液(即抗体介导的)和细胞(T细胞)免疫应答所必需的量。诱导的体液应答足以预防或至少减少金黄色葡萄球菌感染的程度,否则在没有这种应答的情况下会恶化。优选地,施用预防有效量的本文所述疫苗组合物在受试者中诱导针对金黄色葡萄球菌的中和免疫应答。为了在受试者中实现有效的免疫应答,组合物可以进一步包含一种或多种额外的金黄色葡萄球菌抗原或如上所述的佐剂。在另一个实施方案中,佐剂与组合物分开给予受试者,在给予本公开的组合物之前、之后或同时给予。
出于本公开这一方面的目的,目标“受试者”包括任何动物,优选哺乳动物,更优选人。在为了预防、抑制或降低受试者中金黄色葡萄球菌感染和金黄色葡萄球菌定殖的严重性而施用疫苗组合物的情况下,目标受试者包括有被金黄色葡萄球菌感染风险的任何受试者。特别易感的受试者包括免疫功能低下的婴儿、青少年、成人和老年人。然而,任何有金黄色葡萄球菌感染风险的婴儿、少年、成人或老年成人都可以根据本文所述的方法和疫苗组合物进行治疗。特别合适的受试者包括有感染耐甲氧西林金黄色葡萄球菌(MRSA)或甲氧西林敏感金黄色葡萄球菌(MSSA)风险的受试者。其他合适的受试者包括那些可能患有或有风险患有由金黄色葡萄球菌感染引起的疾病,即金黄色葡萄球菌相关疾病的受试者,例如皮肤创伤和感染、组织脓肿、毛囊炎、骨髓炎、肺炎、烫伤样皮肤综合征、败血症、脓毒性关节炎、心肌炎、心内膜炎和中毒性休克综合征。
在任何实施方案中,受试者至少或最多1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、85或90岁(或其中可推导出的任何范围)。在某些实施方案中,本文描述的受试者或患者,例如人类受试者,是儿科受试者。儿科受试者被定义为小于18岁。在任意的实施方案中,儿科受试者为2岁或更小。在任意的实施方案中,儿科受试者小于1岁。在任意的实施方案中,儿科受试者小于6个月。在任意的实施方案中,儿科受试者为2个月或更小。在任意的实施方案中,人类患者为65岁或以上。在任意的实施方案中,人类患者是卫生保健工作者。在任意的实施方案中,患者是将接受外科手术的患者。
在可有效诱导强免疫反应的条件下施用疫苗组合物时,也可以考虑许多其他因素。这些因素包括但不限于,例如,组合物中活性剂的浓度、给药方式和频率,以及受试者的具体情况,例如年龄、体重和整体健康和免疫状况。例如,在国际协调会议的出版物和雷明顿制药科学(Mack Publishing Company 1990)的出版物中可以找到一般性的指导,在此将其全文引入作为参考。临床医生可以施用本文所述的疫苗组合物,直到达到所期望或所需预防效果的剂量,例如所需的抗体滴度。预防性反应的进展可以很容易地通过常规检测来监测。
在本公开的一个实施方案中,本文所述的疫苗组合物可以以预防性的方式施用,以预防、延迟或抑制有感染金黄色葡萄球菌病毒风险或有发展成相关病症风险的受试者中金黄色葡萄球菌病毒感染的发展。在本公开的任何实施方案中,疫苗组合物的预防性给药可有效地完全预防个体中的金黄色葡萄球菌感染。在其他实施方案中,预防性给药可有效预防在没有这种给药的情况下会发生感染的全部程度,即基本上预防或抑制个体中的金黄色葡萄球菌感染。
在使用预防性组合物预防金黄色葡萄球菌感染的情况下,该组合物的剂量应足以产生能够中和金黄色葡萄球菌LukAB介导的细胞毒性的抗体滴度,并能够减少许多症状,降低至少一种症状的严重性,或延缓至少一种症状的进一步发展,甚至完全缓解感染。
本文所述疫苗组合物的预防有效量将取决于是否共同施用佐剂,在没有佐剂的情况下需要更高的剂量。每名患者施用的变异LukA和/或LukB的量可以在1μg-500μg之间。在任何实施方案中,每次人体注射使用5、10、20、25、50或100μg。偶尔,每次注射使用1-50mg的较高剂量。通常,每次人体注射使用约10、20、30、40或50mg。注射的时间可以有很大的不同,从一年一次到十年一次。通常,有效剂量可以通过从受试者获得流体样品(通常是血清样品),并确定针对LukA、LukB或LukB产生的抗体的滴度来监测,所述滴度通过使用本领域公知的并且易于适用于待测特定抗原的方法进行测定。理想情况下,在首次给药前采集样本,并在每次免疫接种后采集后续样本并进行滴度测定。通常,在血清稀释度为1:100时,提供比对照或“背景”水平至少大四倍的可检测滴度的剂量或给药方案是理想的,其中背景是相对于对照血清或相对于酶联免疫吸附试验中的平板背景来定义的。
本公开的疫苗组合物可以通过胃肠外、局部、静脉内、口服、腹膜内、鼻内或肌内方式给药,用于预防性治疗。
本公开的疫苗组合物可以配制成肠胃外给药。该组合物的溶液、悬浮液或乳液可以在水中制备,适当地与表面活性剂如羟丙基纤维素混合。分散体也可以在甘油、液体聚乙二醇及其在油中的混合物中制备。示例性的油是石油、动物、植物或合成来源的油,例如花生油、大豆油或矿物油。一般来说,水、盐水、葡萄糖水溶液和相关的糖溶液,以及二醇,例如丙二醇或聚乙二醇,是优选的液体载体,特别是对于注射溶液。在通常的储存和使用条件下,这些制剂含有防腐剂以防止微生物的生长。
适于注射使用的药物疫苗制剂包括无菌水溶液或分散体以及用于临时制备无菌注射溶液或分散体的无菌粉末。在所有情况下,剂型必须是无菌的,并且必须是流动性的,达到易于注射的程度。它在生产和储存条件下必须是稳定的,并且必须能够防止微生物如细菌和真菌的污染。载体可以是溶剂或分散介质,其含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇)、其合适的混合物和植物油。
实施方案
本公开提供了以下非限制性实施方案。
实施方案1是SEQ ID NO:25变异的金黄色葡萄球菌杀白细胞素A(LukA)多肽,所述LukA变异多肽包含:对应于SEQ ID NO:25的氨基酸残基Lys83、Ser141、Val113和Val193的一个或多个氨基酸残基上的氨基酸取代。
实施方案2是实施方案1所述的LukA变异多肽,其中所述LukA变异多肽在对应于SEQ ID NO:25的Glu323的氨基酸残基上进一步包含氨基酸取代。
实施方案3是实施方案2所述的LukA变异多肽,其中对应于Glu323的氨基酸残基上的氨基酸取代包括谷氨酸到丙氨酸(Glu323Ala)的取代。
实施方案4是实施方案1-3中任一项所述的LukA变异多肽,其中对应于Lys83的氨基酸残基上的氨基酸取代包括赖氨酸到甲硫氨酸(Lys83Met)的取代。
实施方案5是实施方案1-4中任一项所述的LukA变异多肽,其中对应于Ser141的氨基酸残基上的氨基酸取代包括丝氨酸到丙氨酸(Ser141Ala)的取代。
实施方案6是实施方案1-5中任一项所述的LukA变异多肽,其中对应于Val113的氨基酸残基上的氨基酸取代包括缬氨酸到异亮氨酸(Val113Ile)的取代。
实施方案7是实施方案1-6中任一项所述的LukA变异多肽,其中对应于Val193的氨基酸残基上的氨基酸取代包括缬氨酸到异亮氨酸(Val193Ile)的取代。
实施方案8是实施方案2-7中任一项所述的LukA变异多肽,其中所述LukA变异多肽包含对应于SEQ ID NO:25的氨基酸残基Lys83、Ser141、Val113、Val193和Glu323的每个氨基酸残基上的氨基酸取代。
实施方案9是实施方案8所述的LukA变异多肽,其中氨基酸取代包括Lys83Met、Ser141Ala、Val113Ile、Val193Ile和Glu323Ala。
实施方案10是实施方案1所述的LukA变异多肽,其中所述变体是SEQ ID NO:1的CC8 LukA变体,包含对应于SEQ ID NO:1中Lys80Met、Ser138Ala、Val110Ile、Val190Ile和Glu320Ala的氨基酸取代。
实施方案11是实施方案10所述的LukA变异多肽,其中所述LukA变异多肽包含SEQID NO:3的氨基酸序列。
实施方案12是实施方案1所述的LukA变异多肽,其中所述变体是SEQ ID NO:2的CC45 LukA变体,包含对应于SEQ ID NO:2中Lys81Met、Ser139Ala、Val111Ile、Val191Ile和Glu321Ala的氨基酸取代。
实施方案13是实施方案12所述的LukA变异多肽,其中所述LukA变异多肽包含SEQID NO:4的氨基酸序列。
实施方案14是实施方案1-13中任一项所述的LukA变异多肽,其中所述LukA变异多肽进一步包含对应于SEQ ID NO:25的氨基酸残基Tyr74、Asp140、Gly149和Gly156的一个或多个氨基酸残基上的氨基酸取代。
实施方案15是实施方案14所述的LukA变异多肽,其中对应于Tyr74的氨基酸残基处的氨基酸取代包括酪氨酸至半胱氨酸(Tyr74Cys)的取代。
实施方案16是实施方案14或15所述的LukA变异多肽,其中对应于Asp140的氨基酸残基上的氨基酸取代包括天冬酰胺到半胱氨酸(Asp140Cys)的取代。
实施方案17是实施方案14-16中任一项所述的LukA变异多肽,其中对应于Gly149的氨基酸残基上的氨基酸取代包括甘氨酸到半胱氨酸(Gly149Cys)的取代。
实施方案18是实施方案14-17中任一项所述的LukA变异多肽,其中对应于Gly156的氨基酸残基上的氨基酸取代包括甘氨酸到半胱氨酸(Gly156Cys)的取代。
实施方案19是实施方案14-18中任一项所述的LukA变异多肽,其中所述LukA变异多肽包含对应于SEQ ID NO:25的氨基酸残基Tyr74、Asp140、Gly149和Gly156的每个氨基酸残基上的氨基酸取代。
实施方案20是实施方案14所述的LukA变异多肽,其中所述变体是SEQ ID NO:1的CC8 LukA变体,包含对应于SEQ ID NO:1的Lys80Met、Ser138Ala、Val110Ile、Val190Ile、Glu320Ala、Tyr71Cys、Asp137Cys、Gly146Cys和Gly153Cys的氨基酸取代。
实施方案21是实施方案20所述的LukA变异多肽,其中所述LukA变异多肽包含SEQID NO:5的氨基酸序列。
实施方案22是实施方案14所述的LukA变异多肽,其中所述变体是SEQ ID NO:2的CC45 LukA变体,包含对应于SEQ ID NO:2的Lys81Met、Ser139Ala、Val111Ile、Val191Ile、Glu321Ala、Tyr72Cys、Asp138Cys、Gly147Cys和Gly154Cys的氨基酸取代。
实施方案23是实施方案22所述的LukA变异多肽,其中所述LukA变异多肽包含SEQID NO:6的氨基酸序列。
实施方案24是实施方案1-23中任一项所述的LukA变异多肽,其中所述LukA变异多肽在对应于SEQ ID NO:25的氨基酸残基Thr249的氨基酸残基上进一步包含氨基酸取代。
实施方案25是实施方案24所述的LukA变异多肽,其中对应于Thr249的氨基酸残基上的氨基酸取代包括苏氨酸到缬氨酸(Thr249Val)的取代。
实施方案26是实施方案25所述的LukA变异多肽,其中所述变异LukA蛋白包含SEQID NO:7或SEQ ID NO:8的氨基酸序列。
实施方案27是实施方案1-26中任一项所述的LukA变异多肽,进一步包含氨基末端信号序列。
实施方案28是实施方案27所述的LukA变异多肽,其中氨基末端信号序列包含SEQID NO:23的氨基酸序列。
实施方案29是实施方案1-28中任一项所述的LukA变异多肽,其进一步包含氨基末端纯化序列。
实施方案30是一种编码实施方案1-29中任一项所述的LukA变异多肽的核酸分子。
实施方案31是一种包含实施方案30所述的核酸分子的表达载体。
实施方案32是一种包含实施方案31所述的表达载体的宿主细胞。
实施方案33是SEQ ID NO:39变异的金黄色葡萄球菌杀白细胞素B(LukB)蛋白或多肽,所述LukB变异多肽包含对应于SEQ ID NO:39的氨基酸残基Val53的氨基酸残基上的氨基酸取代。
实施方案34是实施方案33所述的LukB变异多肽,其中在对应于Val53的氨基酸残基上的氨基酸取代包括缬氨酸到亮氨酸(Val53Leu)的取代。
实施方案35是实施方案33所述的LukB变异多肽,其中所述变异体是SEQ ID NO:15的CC8 LukB变体,包含对应于SEQ ID NO:15的Val53Leu的氨基酸取代。
实施方案36是实施方案35所述的LukB变异多肽,其中所述LukB变异多肽包含SEQID NO:17的氨基酸序列。
实施方案37是实施方案33所述的LukB变异多肽,其中所述变体是SEQ ID NO:16的CC45 LukB变异体,包含对应于SEQ ID NO:16的Val53Leu的氨基酸取代。
实施方案38是实施方案37所述的LukB变异多肽,其中所述LukB变异多肽包含SEQID NO:18的氨基酸序列。
实施方案39是实施方案33或34所述的LukB变异多肽,其中所述变异体进一步包含对应于SEQ ID NO:39的氨基酸残基Glu45、Glu109、Thr121和Arg154的一个或多个氨基酸残基上的氨基酸取代。
实施方案40是实施方案39所述的LukB变异多肽,其中对应于Glu45的氨基酸残基上的氨基酸取代包括谷氨酸到半胱氨酸(Glu45Cys)的取代。
实施方案41是实施方案39或40所述的LukB变异多肽,其中对应于Glu109的氨基酸残基上的氨基酸取代包括谷氨酸到半胱氨酸(Glu109Cys)的取代。
实施方案42是实施方案39-41中任一项所述的LukB变异多肽,其中对应于Thr121的氨基酸残基上的氨基酸取代包括苏氨酸到半胱氨酸(Thr121Cys)的取代。
实施方案43是实施方案39-42中任一项所述的LukB变异多肽,其中对应于Arg154的氨基酸残基上的氨基酸取代包括精氨酸到半胱氨酸(Arg154Cys)的取代。
实施方案44是实施方案39-43中任一项所述的LukB变异多肽,其中所述LukB变异多肽包含对应于SEQ ID NO:39的氨基酸残基Glu45、Glu109、Thr121和Arg154的每个氨基酸残基上的氨基酸取代。
实施方案45是实施方案39所述的LukB变异多肽,其中所述变体是SEQ ID NO:15的CC8 LukB变体,包含对应于SEQ ID NO:15的Val53Leu、Glu45Cys、Glu109Cys、Thr121Cys和Arg154Cys的氨基酸取代。
实施方案46是实施方案45所述的LukB变异多肽,其中所述LukB变异多肽包含SEQID NO:19的氨基酸序列。
实施方案47是实施方案39所述的LukB变异多肽,其中所述变体是SEQ ID NO:16的CC45 LukB变体,包含对应于SEQ ID NO:16的Val53Leu、Glu45Cys、Glu110Cys、Thr123Cys和Arg155Cys的氨基酸取代。
实施方案48是实施方案47所述的LukB变异多肽,其中所述LukB变异多肽包含SEQID NO:20的氨基酸序列。
实施方案49是SEQ ID NO:39变异的金黄色葡萄球菌杀白细胞素B(LukB)蛋白或多肽,所述LukB变异多肽包含:对应于SEQ ID NO:39的氨基酸残基Glu45、Glu109、Thr121和Arg154的一个或多个氨基酸残基上的氨基酸取代。
实施方案50是实施方案49所述的LukB变异多肽,其中对应于Glu45的氨基酸残基上的氨基酸取代包括谷氨酸到半胱氨酸(Glu45Cys)的取代,对应于Thr121的氨基酸残基上的氨基酸取代包括苏氨酸到半胱氨酸(Thr121Cys)的取代。
实施方案51是实施方案49或50所述的LukB变异多肽,其中对应于Glu109的氨基酸残基上的氨基酸取代包括谷氨酸到半胱氨酸(Glu109Cys)的取代,对应于Arg154的氨基酸残基上的氨基酸取代包括精氨酸到半胱氨酸(Arg154Cys)的取代。
实施方案52是实施方案49-51中任一项所述的LukB变异多肽,其中所述LukB变异多肽包含在对应于SEQ ID NO:39的氨基酸Glu45、Glu109、Thr121和Arg154的每个氨基酸残基上的氨基酸取代。
实施方案53是实施方案52所述的LukB变异多肽,其中所述变体是SEQ ID NO:15的CC8 LukB变体,包含对应于SEQ ID NO:15的Glu45Cys、Glu109Cys、Thr121Cys和Arg154Cys的氨基酸取代。
实施方案54是实施方案53所述的LukB变异多肽,其中所述LukB变异多肽包含SEQID NO:21的氨基酸序列。
实施方案55是实施方案52所述的LukB变异多肽,其中所述变体是SEQ ID NO:16的CC45 LukB变体,包含对应于SEQ ID NO:16的Glu45Cys、Glu110Cys、Thr123Cys和Arg155Cys的氨基酸取代。
实施方案56是实施方案55所述的LukB变异多肽,其中所述LukB变异多肽包含SEQID NO:22的氨基酸序列。
实施方案57是实施方案33-56中任一项所述的LukB变异多肽,进一步包含:氨基末端信号序列。
实施方案58是实施方案57所述的LukB变异多肽,其中氨基末端信号序列包含SEQID NO:23的氨基酸序列。
实施方案59是实施方案33-58中任一项所述的LukB变异多肽,进一步包含:氨基末端纯化标签。
实施方案60是一种编码实施方案33-59中任一项所述的LukB变异多肽的核酸分子。
实施方案61是一种包含实施方案60的核酸分子的表达载体。
实施方案62是一种包含实施方案30的核酸分子的表达载体,该核酸分子可操作地与实施方案60的核酸分子偶联。
实施方案63是实施方案62所述的表达载体,其包含与SEQ ID NO:55(CC45 LukA变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列,所述核苷酸序列与和SEQ ID NO:59(CC45 LukB)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列可操作地偶联。
实施方案64是实施方案62所述的表达载体,其包含与SEQ ID NO:55(CC45 LukA变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列,所述核苷酸序列与和SEQ ID NO:61(CC45 LukB变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列可操作地偶联。
实施方案65是实施方案62所述的表达载体,其包含与SEQ ID NO:54(CC8 LukA变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列,所述核苷酸序列与和SEQ ID NO:58(CC8 LukB)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列可操作地偶联。
实施方案66是实施方案62所述的表达载体,其包含与SEQ ID NO:54(CC8 LukA变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列,所述核苷酸序列与和SEQ ID NO:61(CC45 LukB变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列可操作地偶联。
实施方案67是实施方案62所述的表达载体,其包含与SEQ ID NO:54(CC8 LukA变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列,所述核苷酸序列与和SEQ ID NO:60(CC8 LukB变体)的核苷酸序列具有至少85%、至少90%、至少95%、至少97%或至少99%序列相似性的核苷酸序列可操作地偶联。
实施方案68是包含实施方案61-67中任一项所述的表达载体的宿主细胞。
实施方案69是包含实施方案61-67中任一项所述的表达载体的金黄色葡萄球菌疫苗组合物。
实施方案70是一种金黄色葡萄球菌疫苗组合物,其包含实施方案1-29中任一项所述的一种或多种LukA变异多肽。
实施方案71是实施方案70所述的疫苗组合物,其中LukA变异多肽是SEQ ID NO:1的变体。
实施方案72是实施方案70或71所述的疫苗组合物,其进一步包含:杀白细胞素B(LukB)蛋白或多肽,所述LukB蛋白或多肽与SEQ ID NO:15的氨基酸序列具有至少85%的序列相似性。
实施方案73是实施方案70或71所述的疫苗组合物,其进一步包含:杀白细胞素B(LukB)蛋白或多肽,所述LukB蛋白或多肽与SEQ ID NO:16的氨基酸序列具有至少85%的序列相似性。
实施方案74是实施方案73所述的疫苗组合物,其中LukA变异多肽在对应于SEQ IDNO:1的氨基酸残基Lys80、Ser138、Val110、Val190和Glu320Ala的一个或多个氨基酸残基上包含氨基酸取代。
实施方案75是实施方案74所述的疫苗组合物,其中LukA变异多肽包含与SEQ IDNO:3的氨基酸序列具有至少90%序列同一性的氨基酸序列,并且LukB多肽包含与SEQ IDNO:18的氨基酸序列具有至少90%序列同一性的氨基酸序列。
实施方案76是实施方案74所述的疫苗组合物,其中LukA变异多肽包含SEQ ID NO:3的氨基酸序列,LukB多肽包含SEQ ID NO:18的氨基酸序列。
实施方案77是实施方案74所述的疫苗组合物,其中LukA变异多肽包含SEQ ID NO:3的氨基酸序列,LukB蛋白或多肽包含SEQ ID NO:22的氨基酸序列。
实施方案78是实施方案74所述的疫苗组合物,其中LukA变异多肽包含SEQ ID NO:3的氨基酸序列,LukB蛋白或多肽包含SEQ ID NO:20的氨基酸序列。
实施方案79是实施方案70所述的疫苗组合物,其中LukA变异多肽是SEQ ID NO:2的变体。
实施方案80是实施方案79所述的疫苗组合物,其进一步包含杀白细胞素B(LukB)蛋白或多肽,所述LukB蛋白或多肽与SEQ ID NO:16的氨基酸序列具有至少85%的序列相似性。
实施方案81是实施方案79所述的疫苗组合物,其进一步包含杀白细胞素B(LukB)蛋白或多肽,所述LukB蛋白或多肽与SEQ ID NO:15的氨基酸序列具有至少85%的序列相似性。
实施方案82是实施方案79-81中任一项所述的疫苗组合物,其中所述LukA变异多肽包含对应于SEQ ID NO:2的氨基酸残基Lys81、Ser139、Val111、Val191和Glu321Ala的一个或多个氨基酸残基上的氨基酸取代。
实施方案83是实施方案82所述的疫苗组合物,其中LukA变异多肽包含与SEQ IDNO:4的氨基酸序列具有至少90%序列同一性的氨基酸序列,并且LukB蛋白或多肽包含与SEQ ID NO:16的氨基酸序列具有至少90%序列同一性的氨基酸序列。
实施方案84是实施方案82所述的疫苗组合物,其中LukA变异多肽包含氨基酸序列SEQ ID NO:4,LukB蛋白或多肽包含氨基酸序列SEQ ID NO:16。
实施方案85是一种金黄色葡萄球菌疫苗组合物,其包含实施方案33-56中任一项所述的一种或多种变异LukB蛋白或多肽。
实施方案86是实施方案85所述的疫苗组合物,其进一步包含杀白细胞素A(LukA)蛋白或多肽,所述LukA蛋白或多肽与SEQ ID NO:1(CC8)的氨基酸序列具有至少85%的序列相似性。
实施方案87是实施方案85所述的疫苗组合物,其进一步包含杀白细胞素A(LukA)蛋白或多肽,所述LukA蛋白或多肽与SEQ ID NO:2(CC45)的氨基酸序列具有至少85%的序列相似性。
实施方案88是一种金黄色葡萄球菌疫苗组合物,其包含实施方案1-32中任一项所述的LukA变异多肽和实施方案33-56中任一项所述的LukB变异多肽。
实施方案89是实施方案74所述的疫苗组合物,其中LukA变异多肽包含与SEQ IDNO:3的氨基酸序列具有至少90%序列同一性的氨基酸序列,并且LukB蛋白或多肽包含与SEQ ID NO:15的氨基酸序列具有至少90%序列同一性的氨基酸序列。
实施方案90是实施方案74所述的疫苗组合物,其中LukA变异多肽包含SEQ ID NO:3的氨基酸序列,LukB蛋白或多肽包含SEQ ID NO:15的氨基酸序列。
实施方案91是实施方案74所述的疫苗组合物,其中LukA变异多肽包含与SEQ IDNO:3的氨基酸序列具有至少90%序列同一性的氨基酸序列,并且LukB蛋白或多肽包含与SEQ ID NO:17的氨基酸序列具有至少90%序列同一性的氨基酸序列。
实施方案92是实施方案74所述的疫苗组合物,其中LukA变异多肽包含SEQ ID NO:3的氨基酸序列,LukB蛋白或多肽包含SEQ ID NO:17的氨基酸序列。
实施方案93是实施方案74所述的疫苗组合物,其中LukA变异多肽包含与SEQ IDNO:4的氨基酸序列具有至少90%序列同一性的氨基酸序列,并且LukB蛋白或多肽包含与SEQ ID NO:18的氨基酸序列具有至少90%序列同一性的氨基酸序列。
实施方案94是实施方案74所述的疫苗组合物,其中LukA变异多肽包含SEQ ID NO:4的氨基酸序列,LukB蛋白或多肽包含SEQ ID NO:18的氨基酸序列。
实施方案95是实施方案69-94中任一项所述的疫苗组合物,其进一步包含佐剂。
实施方案96是实施方案69-94中任一项所述的疫苗组合物,其进一步包含一种或多种额外的金黄色葡萄球菌抗原。
实施方案97是一种在受试者中产生针对金黄色葡萄球菌的免疫应答的方法,所述方法包括:在所述受试者中有效产生针对金黄色葡萄球菌的所述免疫应答的条件下,向所述受试者施用实施方案69-94中任一项所述的疫苗组合物。
实施方案98是实施方案66-94中任一项所述的疫苗组合物,其中所述疫苗组合物用于在受试者中产生针对金黄色葡萄球菌的免疫应答的方法中。
实施例
提供以下实施例来说明本公开的实施例,但绝不旨在限制其范围。
实施例1–示例性的LukA变异多肽、LukB变异多肽和稳定的LukAB复合物
为了表达lukB异二聚体蛋白,将大肠杆菌BL21(DE3)细胞与克隆到pCDFDuet-1中的lukA构建体和克隆到pETDuet-1中的LukB构建体进行共转化。将转化体在50μg/ml氨苄青霉素和50μg/ml大观霉素中培养,以分别在37℃的Luria-Bertani液体培养基中选择pETDuet-1和pCDFDuet-1,并以190rpm振荡过夜。为了表达,在37℃下用1:50稀释的过夜培养物接种新鲜的Terrific Broth液体培养基,以190rpm的速度振荡,直到培养物达到OD
表4.本文所述研究中使用的示例性LukA、LukB和LukB异二聚体复合物
实施例2-野生型、LukA和LukAB类毒素的细胞毒性
通过与野生型LukB毒素比较,使用前单核白血病细胞系THP-1或新分离的原代人多形核白细胞(hPMNs)评估LukB类毒素蛋白(如表4所定义)的细胞毒性。
在检测细胞毒性之前,在佛波醇12-肉豆蔻酸13-乙酸酯的存在下分化THP-1细胞。对于THP-1细胞毒性测定,将包含总共1×10
LukA和LukAB类毒素对分化的THP-1细胞的细胞毒性列于下表5。分化的THP-1细胞对野生型毒素敏感,因为CC8和CC45 LukAB野生型毒素在低至0.313μg/ml的毒素浓度下杀死了30%或更多的细胞群体。在LukA(Δ10)的C-末端缺失最后10个氨基酸残基将CC8Δ10毒素的细胞毒性降低到在40g/mL时细胞死亡低于5%,但是没有降低CC45Δ10毒素对分化的THP-1细胞的细胞毒性。这两种LukA单体对分化的THP-1细胞都没有显示细胞毒性。这是预期的结果,因为在没有LukB的情况下,LukA不应形成活性孔复合物。每一种LukAB二聚体类毒素,包括RARPR-33、RARPR-34和RARPR-15,对分化的THP-1细胞显示出了显著降低的细胞毒性,在最高测试浓度40g/mL下,每一种测试类毒素的细胞死亡率为1%或更低。
表5.LukA或LukAB蛋白对分化的THP-1细胞的细胞毒性,人类单核细胞系,使用标准量的毒素。数据以死亡细胞百分比表示。
对于hPMNs,在中毒处理前,将所有毒素标准化为2.5μg/mL(每个亚单位),然后将20μl毒素移至96孔板的顶部孔中,并在10μl 1X PBS中连续稀释2倍。分离多形核白细胞(PMNs),标准化为每90μl RPMI(10mM HEPES+0.1%HSA)含有200,000个细胞。然后将90μl多形核白细胞移至每个孔中,并将毒素-PMN混合物在37℃和5%CO
LukA单体和LukAB二聚体类毒素对人原代PMN细胞的细胞毒性见下表6。在毒素浓度分别为0.313μg/ml和1.25μg/ml时,野生型CC8和CC45毒素对原代人类多形核白细胞的杀灭率超过90%。相比之下,LukB类毒素和LukA单体对这些细胞的细胞毒性显著降低。CC8LukA中10个C-末端残基的缺失基本上消除了对分化的THP-1细胞的细胞毒性,而这种毒素保留了对hPMNs的细胞毒性,在浓度等于或高于5μg/mL时观察到超过20%的杀灭率。CC8和CC45 LukA单体对hPMNs的细胞毒性很小,正如缺乏对活性孔复合物形成至关重要的LukB组分的类毒素所预期的那样。与CC8和CC45野生型LukB毒素相比,每种LukB二聚体类毒素对hPMN细胞的细胞毒性显著降低。RARPR-33LukAB类毒素以及相关类毒素RARPR-32和-34显示出比CC8Δ10更低的细胞毒性,RARPR-33在最高测试浓度(20g/mL)下仅杀死15%的细胞群。
表6.使用标准量的毒素测定LukA或LukAB蛋白对人原代多形核细胞的细胞毒性。数据以死亡细胞百分比表示
实施例3-RARPR-33LukAB类毒素和WT LukAB毒素的其他变体的细胞毒性。
进行了额外的实验来评估RARPR-33和WT LukAB毒素与LukA单体的不同变体的细胞毒性和免疫原性。将小鼠用于免疫原性研究。
在人类多形核白细胞上评估LukAB毒素、类毒素和单体的细胞毒性。中毒处理前,将所有毒素标准化至100μg/mL(每亚单位),然后将20μl毒素移至96孔板的顶部孔中,并在10μl 1X PBS中连续稀释2倍。PMN从不同的供体中分离出来,标准化为每90μl RPMI(10mMHEPES+0.1%HSA)含有200,000个细胞。将90μl多形核白细胞移至每个孔中,并将毒素-PMN混合物在37℃+5%CO
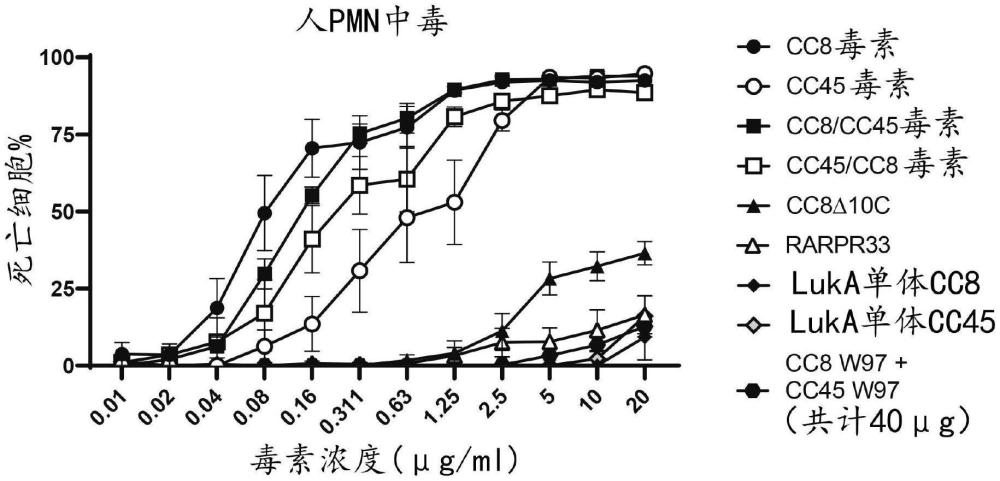
图3提供了LukA单体和LukAB毒素对人原代PMN细胞的细胞毒性。野生型LukAB CC8和CC45毒素在毒素浓度分别为2.5μg/ml和5μg/ml时,对原代人类多形核白细胞的杀灭率超过90%。在2.5μg/ml的浓度下,还观察到LukAB混合毒素CC8/CC45和CC45/CC8的最大杀灭率。相比之下,LukB类毒素和LukA单体对这些细胞的细胞毒性显著降低。CC8LukA中10个碳末端残基的缺失保留了对hPMNs的细胞毒性,在浓度等于或高于5μg/ml时观察到超过20%的杀灭率。CC8和CC45 LukA单体以及这些单体的组合对hPMNs几乎没有细胞毒性。RARPR-33LukAB类毒素显示出比CC8Δ10C更低的细胞毒性,在最高测试浓度(20g/mL)下,RARPR-33仅杀死15%的细胞群。
实施例4-在小鼠中的免疫原性。
为了确定不同LukAB变体的免疫原性,对Envigo Hsd:ND4(4周龄)小鼠(n=5/抗原)皮下注射20μg LukAB,所述LukAB溶于50μl 10%甘油1X TBS与50μl佐剂
为了测定抗LukAB抗体滴度,进行了酶联免疫吸附试验。将WT LukAB CC8或CC45在1XPBS中稀释至2μg/ml,并在96孔Immulon 2HB板(Thermo Fisher,cat no.3455)中用100μl溶液包被,并在4℃孵育过夜。然后用洗涤缓冲液(1X PBS+0.05%吐温)洗涤平板3次,然后用200μl封闭缓冲液(含2.5%牛奶的1X PBS)封闭1小时。产生从1:500血清到封闭缓冲液的五倍系列稀释,并允许在摇板上孵育1小时。然后再次洗涤平板3次,加入在封闭缓冲液中稀释1:5,000的小鼠IgG-HRP(Biorad)抗体,并允许在室温下孵育1小时。用洗涤缓冲液连续洗涤三次,洗去未结合的第二抗体。将升至室温的TMB(100μl)加入每个孔中,并覆盖培养25分钟。反应完成后,向每个反应孔中加入等量的2N硫酸以停止反应。然后在Envision酶标仪上读取平板的450nm吸光度。图4A和图4B所示的热力图显示了重复测量的平均吸光度值,黑色代表高吸光度和抗体与包被抗原的结合,白色代表低吸光度和无抗体结合。
RARPR-33诱导了强有力的抗CC8和抗CC45 LukAB IgG抗体滴度(图4A和图4B)。RARPR-33免疫诱导了与用CC8 WT毒素、CC8/CC45杂交毒素和CC8Δ10C类毒素免疫相当的抗CC8 IgG反应。由单个CC8 LukA单体诱导的抗CC8 LukAB IgG滴度不如由CC8LukAB毒素或CC8/CC45杂交毒素、CC45/CC8杂交毒素和RARPR 33杂交抗原诱导的抗体滴度高(图4A)。
RARPR-33免疫小鼠的抗CC45 LukAB滴度高于CC8/CC45 WT杂合抗原诱导的滴度,与CC45 WT抗原诱导的滴度相当。CC8和CC45 LukA单体组合可引起对CC8和CC45 LuKA的抗体滴度(图4B)。然而,由CC8和CC45 LukA单体组合引发的这些抗CC8和抗CC45 LukB滴度不如由RARPR 33引发的那些高。单个CC45 LukA单体可引发非常高的抗CC45 LukB滴度-类似于CC45/CC8混合物引发的水平,仅略低于RARPR-33或CC45 WT毒素引发的水平。这些结果表明,在RARPR-33免疫后,诱导了对LukAB CC8和CC45的高量级抗体反应。
实施例5-抗体介导的毒素细胞毒性中和
抗体介导的毒素细胞毒性的中和应用从如上实施例4所述免疫的小鼠获得的血清进行评估。将热灭活的混合血清在PBS中标准化为40%血清,然后将20μl血清移至96孔板的顶部孔中,并在10μl 1X PBS中连续稀释2倍。在室温下,将每种LukAB毒素克隆复合物序列变体的LD
来自用RARPR-33免疫的小鼠的血清显示出所有抗原中最有效的、广泛的中和LukAB的能力(图5)。来自RARPR 33免疫小鼠的血清强烈中和了检测低至0.25%血清的所有11种LukAB变体的细胞毒性,并且对于大多数LukAB变体也提供了检测低至0.063-0.125%血清的保护(图5)。用单个CC8和CC45 LukA单体免疫产生的血清具有高度偏向抗原骨架的LukAB中和能力(图5)。每次免疫以每种单体20μg(总蛋白40μg)施用的CC8 LukA单体与CC45LukA的组合产生了具有广泛和有效的LukAB中和能力的血清,在低至0.5%的血清中中和了所有11种测试的LukAB变体(图5),然而,这低于用RARPR-33免疫小鼠的血清观察到的水平。
结合实施例3-5中给出的数据显示,加入到RARPR-33的CC8/CC45 LukAB骨架中的减毒和稳定的突变提高了CC8/CC45 WT LukAB混合物的广泛免疫原性效应(图4和5),同时与CC8/CC45 WT LukAB毒素相比,RARPR-33也呈现高度减弱的毒性(图3)。
实施例6-抗血清毒素中和
用从用野生型LukAB、野生型LukB混合物(即CC8 LukA/CC45 LukB和CC45LukA/CC8LukB)、LukA单体或LukAB类毒素免疫的小鼠获得的血清评估抗体介导的毒素细胞毒性中和。将热灭活的混合血清在PBS中标准化为40%血清,然后将20μl血清移至96孔板的顶部孔中,并在10μl 1X PBS中连续稀释2倍。然后在室温下,将每种LukAB毒素克隆复合物序列变体的LD
用野生型CC8和CC45 LukAB免疫诱导抗体以反映免疫抗原序列组成的模式中和LukAB毒素的天然序列变体。由CC8 LukAB毒素引发的抗体有效地中和了来自CC8、CC1、CC5和其他金黄色葡萄球菌谱系的毒素,但它们不能完全中和来自CC30、CC45或ST22A金黄色葡萄球菌的毒素。同样,用CC45 LukAB毒素免疫诱导的抗体能有效中和来自CC30、CC45或ST22A金黄色葡萄球菌谱系的毒素,但不能中和来自其他谱系的毒素。
用非天然杂交LukAB免疫小鼠,无论是CC8 LukA与CC45 LukB的组合还是CC45LukA与CC8 LukB的组合,与天然存在的二聚体组合相比,都产生了对LukAB序列变体显示具有更广泛中和作用的抗体。在非天然杂交二聚体中,CC8 LukA和CC45 LukB显示出比相反组合稍好的中和谱,这种模式保留在LukA倒数第二个残基中具有Glu至Ala取代的蛋白质中(E323A)。正如针对野生型毒素诱导的抗体所观察到的,LukA单体诱导的抗体显示出指示其序列组成的中和模式。CC8LukA和CC45 LukA单体(RARPR-31+CC45 LukAW97)的组合引发了显示广泛中和模式的抗体,但是与二聚体抗原相比,中和的效力降低了,1%或0.5%血清的中和水平降低就证明了这一点。
在二聚体类毒素中,RARPR-15、RARPR-33和RARPR-34显示出对所有测试的LukAB序列变体的广泛中和抗体反应。非天然野生型二聚体组合也显示了广泛的中和谱,尽管中和反应的效力不如观察到的几种类毒素。当在2%(图6A)和1%(图6B)的血清中测试时,混合野生型和类毒素抗原都显示出广泛的中和特性,但是当在0.5%的血清中测试时,对类毒素反应的效力提高是明显的(图6C)。在此最低测试浓度下,RARPR-15、RARPR-32、RARPR-33和RARPR-34均显示出广泛的中和反应。特别是,RARPR-33引发的血清保留了广泛的中和反应,而混合野生型抗原和E323A类毒素在0.5%血清时未能引发广泛的保护反应,并且CC45类毒素RARPR-15在最低测试浓度下引发的中和模式反映了其序列组成,因为仅观察到CC30、CC45和ST22ALukAB毒素的高水平中和。混合二聚体类毒素RARPR-33引发了一种有效的广泛中和免疫反应。
实施例7–高浓度下RARPR-33的细胞毒性。
方法:
细胞毒性试验:为了评价每种LukAB蛋白复合物的细胞毒性,用金黄色葡萄球菌毒素对新鲜分离的人原代多形核白细胞(PMNs)进行中毒处理。从不同的供体中分离多形核白细胞,并标准化为每50μl RPMI(10mM HEPES+0.1%HSA)含有200,000个细胞。将PBS中的50μl毒素添加到细胞中,并将毒素-PMN混合物在37℃的5%CO
LDH测定:为了评估是否每一种相应的LukAB蛋白复合物都能引起细胞溶解,将来自不同供体的新鲜分离的人原代多形核白细胞(PMNs)用金黄色葡萄球菌LukAB毒素进行中毒处理,并测量LDH的释放。WT毒素在PBS中连续稀释2倍,并以5-0.0024μg/ml的浓度范围进行测试。将LukAB类毒素在PBS中稀释,并以2.5、2、1、1.5和0.5mg/ml进行测试。分离多形核白细胞,并标准化为每50μl RPMI(10mMHEPES+0.1%HSA)含有200,000个细胞。然后将50μlPMNs移至每个孔中,并在每个孔中加入50μl稀释的毒素。毒素-PMN混合物在37℃+5%CO
结果:
在前面的实施例中,LukAB类毒素RARPR-33对hPMNs的细胞毒性被确定达到20μg/ml的浓度。接下来,在存在更高浓度(高达2.5mg/ml)的RARPR-33的情况下,监测人PMN的细胞毒性。在约0.156g/ml毒素中毒处理1小时后,观察到基于CellTiter测量的WT LukABCC8、CC45和CC8/CC45毒素对人PMNs(4-6个供体)的最大细胞毒性(图7A)。对于RARPR-33和CC8 LukA单体,在浓度为0.5mg/ml时,用CellTiter测量的死亡细胞百分比约为10%(图7B)。对浓度高达2.5mg/ml的RARPR-33或CC8 LukA单体的多形核白细胞进行孵育不会进一步增加通过CellTiter测量确定的死亡细胞百分比。
LD
此外,在与不同的WT毒素、CC8 LukA单体或RARPR-33孵育两小时后,进行LDH测定以评估质膜损伤。暴露于WT毒素、CC8 WT、CC45 WT或CC8/CC45毒素混合物2小时后,诱导人PMN细胞毒性(图7C)。在毒素浓度为0.625μg/ml时,观察到由LDH测定的最大细胞死亡。相反,在暴露于浓度高达2.5mg/ml的RARPR-33或CC8 LukA单体两小时后,没有观察到人多形核白细胞的质膜损伤(图7D)。这些数据表明,在浓度高达2.5mg/ml时,RARPR-33已经脱毒,不能诱导人类多形核白细胞的细胞死亡。与CC8/CC45 WT LukAB毒素相比,结合到RARPR-33的CC8/CC45 LukAB骨架中的高度突变减弱了细胞毒性。
实施例8:RARPR-33与D39A/R23E类毒素的比较
产生了基于CC8骨架的LukB类毒素,其中LukA具有D39A突变,LukB具有R23E点突变。这种“D39A/R23E类毒素”在Kailasan,S.等人的“Rational Design of Toxoid VaccineCandidates for Staphylococcus aureus LeukocidinAB(LukAB),”Toxins 11(6):(2019)中有描述,该文献在此全文引入作为参考。这种类毒素是在LukAB CC8骨架上产生的,与WTCC8LukAB毒素相比,毒性减弱了36,000倍以上。用分化为PMN样的HL-60细胞系测定细胞毒性。在本实验中,对D39A/R23E类毒素和RARPR-33进行了比较。测定了对人多形核白细胞(PMNs)的细胞毒性,并评估了免疫后诱导广泛毒素中和抗体的能力。
方法:
细胞毒性试验:为了评价每种LukAB蛋白复合物的细胞毒性,采用金黄色葡萄球菌毒素对来自不同供体的新鲜分离的人原代多形核白细胞(PMNs)进行中毒处理。分离多形核白细胞,标准化为每50μl RPMI(10mM HEPES+0.1%HSA)含有200,000个细胞。向细胞中加入50μl PBS中的毒素,并将毒素-PMN混合物在37℃的5%CO
LDH测定:为了评估每种相应的LukAB蛋白复合物是否引起细胞裂解,采用金黄色葡萄球菌LukAB毒素对来自不同供体的新鲜分离的人原代多形核白细胞(PMNs)进行中毒处理,并测量LDH的释放。WT毒素在PBS中连续稀释2倍,并在0.5μg/ml~0.00024μg/ml的浓度范围内进行测试。将LukAB类毒素在PBS中稀释至1mg/ml~0.03125mg/ml的浓度,并进行测试。分离多形核白细胞,并标准化为每50μl RPMI(10mMHEPES+0.1%HSA)含有200,000个细胞。然后将PMNs(50μl)移至每个孔中,并在每个孔中加入50μl稀释的毒素。毒素-PMN混合物在37℃+5%CO
小鼠免疫接种:Envigo Hsd:ND4(4周龄)小鼠(n=5/抗原)皮下注射20μg LukAB,所述LukAB溶于50μl 10%甘油1X TBS与50μl佐剂
毒素中和试验:将每组免疫小鼠的血清混合,并在55C的水浴中加热灭活30分钟。然后用PBS将合并的热灭活血清稀释至40%。然后通过在96孔板中将40%储备液在10μlPBS中连续稀释2倍来实现血清的进一步稀释。将毒素(10μl)加入血清孔中,最终浓度为0.156μg/ml毒素(LD
结果:
据报道,D39A/R23E类毒素的细胞毒性试验高达约12μg/ml。在此,测定了浓度高达1mg/ml的RARPR-33和D39A/R23E类毒素对人多形核白细胞的细胞毒性。此外,对WT LukABCC8、CC45和CC8/CC45进行了对比测试。在约0.02μg/mlWT LukAB CC8/CC45、约0.03μg/mlLukAB CC8和0.125μg/mlLukAB CC45中毒处理1小时后,观察到基于CellTiter测量的人类多形核白细胞的最大细胞毒性(图8A)。图中显示了5名供体的平均值。对于D39A/R23E类毒素,在与1mg/ml孵育时观察到约22%的细胞毒性。对于RARPR-33,在1mg/ml的浓度下,用CellTiter测量的死亡细胞百分比约为3%(图8B)。
此外,在与不同的WT毒素、D39A/R23E类毒素和RARPR-33孵育两小时后,进行LDH测定以评估质膜损伤。在暴露于WT毒素、CC8 WT、CC45 WT和CC8/CC45毒素混合物的组合2小时后,诱导人PMN的细胞毒性(图8C)。在毒素浓度为0.25μg/ml时,观察到由LDH测定的最大细胞死亡率。在人PMN暴露于浓度高达1mg/ml的D39A/R23E类毒素两小时后,观察到约8%的细胞死亡。当用类似浓度的RARPR-33孵育人PMN时,没有观察到质膜损伤,表明没有细胞死亡(图8D)。这些结果表明,RARPR-33在检测中被减弱到检测极限以下,并且比D39A/R23E类毒素更弱。
来自用RARPR-33或D39A/R23E类毒素免疫的小鼠的血清在毒素中和试验中进行测试,以评估该血清在防止毒素诱导的人多形核白细胞细胞死亡的能力。在从4个供体分离的多形核白细胞上测试了对16种不同LukAB毒素的中和作用。
在来自RARPR 33免疫小鼠的0.125%血清的存在下,测试的所有16种LukAB变体的细胞毒性作用被中和(图9)。在相似的血清浓度下,来自D39A/R23E类毒素免疫小鼠的血清仅与来自RARPR-33免疫小鼠的血清同等地保护免受LukAB CC8的细胞毒性影响。针对所有其他毒素,对来自D39A/R23E类毒素免疫小鼠的血清没有观察到保护作用或观察到低得多的保护作用。这些结果表明,RARPR-33免疫诱导了比用D39A/R23E类毒素免疫更广泛的毒素中和反应。
实施例9:LukAB类毒素的热稳定性
与野生型蛋白质相比,LukAB类毒素的稳定性通过热展开实验来评估,该实验使用固有的色氨酸或酪氨酸荧光来估计熔化温度(Tm),该温度对应于蛋白质从折叠状态向展开状态转变的中点。使用NanoTemper's PromethiusNT.Plex仪器(NanoTemper Inc.,德国)来评估热稳定性。对0.3~1mg/ml的蛋白质样品(20μl,缓冲液:50mM磷酸钠缓冲液,200mM氯化钠,酸碱度7.4,10%甘油)进行热展开测量,每个样品重复进行。Prometheus NanoDSF用户界面(Melting Scan tab)用于设置运行的实验参数。典型样品的热扫描范围为20℃~95℃,速率为1.0℃/分钟。将用于样品的同一缓冲液中的标准单克隆抗体(CNTO5825或NIST)作为对照,重复进行试验。使用供应商软件PR.ThermControl分析热熔化曲线以测定50%蛋白质展开的温度(Tm)。
表7A和7B显示了通过nanoDSF评估的LukA和LukAB类毒素蛋白的热稳定性。显示了蛋白质展开开始的温度(Tonset)和蛋白质展开转变的中点(Tm1),以及具有和不具有稳定取代的可比构建体之间的Tm差异(ΔTm)。
表7A.CC45遗传背景中的单取代和混合CC8/CC45遗传背景中的组合取代。
LukA单体包括一个N-端PelB信号序列,用于指导表达到大肠杆菌的周质,以支持二硫键的形成。
携带支持二硫键形成的成对半胱氨酸取代对的LukAB二聚体在大肠杆菌Origami2(DE3)细胞的细胞质中表达。
表7B.CC8遗传背景中的单取代和混合物CC8/CC45遗传背景中的组合取代。
结果:热稳定性分析(表7A)显示,CC45 LukA
实施例1-9的讨论:
本文所述的稳定的LukAB变体异二聚体类毒素具有几个特征,使得它们非常适合作为金黄色葡萄球菌疫苗抗原候选物。
首先,本文所述的LukA单体和LukAB二聚体类毒素,包括RARPR-30、RARPR-31、RARPR-32、RARPR-33、RARPR-34和RARPR-15,与野生型毒素和其他已知类毒素(即CC8Δ10和CC45Δ10类毒素)相比,显示出对分化的人THP-1和人多形核白细胞的细胞毒性显著降低。即使浓度高达2.5mg/ml,RARPR-33仍无细胞毒性,证明其完全衰减。
其次,相对于仅含有单个取代的相应类毒素,在LukA和LukB变异体蛋白中引入的取代基的组合显著增强了异二聚体RARPR复合物的热稳定性。特别地,LuCA(RARPR-15)中取代的组合产生了比CC45 LukA
除了减弱的细胞毒性和增强的热稳定性之外,本文所述的LukAB RARPR类毒素,特别是RARPR-15、RARPR-33和RARPR-34,与野生型CC45和CC8毒素、野生型杂交毒素和类毒素,包括E323A类毒素和D39A/R23E类毒素相比,诱导了相当的或更广泛的毒素中和反应和更高滴度的中和抗体。
总之,减弱的细胞毒性、改善的热稳定性、强大的免疫原性和广泛的中和抗体特征使本文所述的LukAB RARPR类毒素成为理想的疫苗抗原候选物。
尽管本文已经详细描述了优选的实施例,但是对于相关领域的技术人员来说,很明显,在不脱离本公开的精神的情况下,可以进行各种修改、添加、替换等,因此这些都被认为在所附权利要求限定的本公开的范围内。
- 包含具有半乳聚糖酶活性的多肽和具有β-半乳糖苷酶活性的多肽的组合物
- 一种多肽、多肽组合物在治疗结肠癌中的应用
- 包含金黄色葡萄球菌杀白细胞素LUKA和LUKB来源的多肽的免疫原性组合物
- 基于多抗原提呈系统(MAPS)的金黄色葡萄球菌疫苗、免疫原性组合物以及它们的用途
