多取代烷基亚磺酸内酯及其制备方法
文献发布时间:2024-04-18 19:44:28
技术领域
本发明涉及有机合成技术领域,特别是涉及一种多取代烷基亚磺酸内酯及其制备方法。
背景技术
亚磺酸内酯化合物(sultine)广泛存在于多种天然产物和有机材料中,同时作为重要有机合成中间体,普遍应用于药物关键分子的合成和有光材料研发中。例如,其独特的分子结构使得他们广泛地应用于各种化学材料和活性分子中,如利尿剂,电解液添加剂,PET成像剂,氟碳表面活性剂等(ACS Appl.Energy Mater.2018,1,2582;Energy StorageMaterials 2017,6,26)。同时,在有机分子或者材料中引入氟原子或含氟基团,特别是三氟甲基,常常会引起其物理、化学性质以及药理生理活性的改变,因此使得含氟化合物在医药、农药及功能材料等领域的应用备受关注,把含氟基团插入到相关分子中成为有机合成的关键任务之一。
首例亚磺酸内酯在19世纪末期才被报道,此后,在实现亚磺酸内酯的多样性合成或者后续衍生转化等方面,有机化学工作者在该领域进行了有益的尝试,但是目前所报道的方法都非常局限(Russ.Chem.Rev.1996,65,147;Chem.Rev.2012,112,1650.),例如产率低,底物适用性不高,操作复杂,反应条件苛刻(如超高温),经常会使用有毒试剂(如氯气,二氧化硫),原料来源困难,尤其是含氟取代的亚磺酸内酯及其衍生物合成更加困难,这显著阻碍了亚磺酸内酯的实际应用和发展。
近年来,化学家也发展了一些新的合成方法,如自由基取代反应(L.Fensterbank,et al.Angew.Chem.Int.Ed.2006,45,633),碱催化亲核取代反应(C.D.Bray,etal.Angew.Chem.Int.Ed.2015,54,15236)等,但是此类方法仍然具有很大不足,例如原料来源困难,底物范围狭窄,产率偏低,三废较多,后处理繁琐,产物精致困难等,特别是原子经济性不佳。
发明内容
基于此,有必要针对上述提到的至少一个问题,提供一种多取代烷基亚磺酸内酯及其制备方法。
第一个方面,本申请提供了一种多取代烷基亚磺酸内酯,所述多取代烷基亚磺酸内酯的结构式为:
其中,n为是
在第一个方面的某些实现方式中,所述取代基团是氢、烷基、烃基、芳基、含硫杂环、含氧杂环、含氮杂环、酯基、酰基、酰胺、膦酸酯、磺酰基、硼酸酯、氰基、磺酸酯基或硫代羧酸酯中的一种。
第二个方面,本发明申请提供了一种如本申请第一个方面描述的多取代烷基亚磺酸内酯的制备方法,包括下列步骤:
将第一底物、光催化剂和第一有机溶剂加入反应容器内,混合均匀后在蓝色光源照射下于室温中反应完全,得反应后混合溶液;所述第一底物为烯基亚磺酸酯衍生物;
将所述反应后混合溶液经过滤和脱溶,通过柱层析或微量样品蒸馏仪处理得到所述多取代烷基亚磺酸内酯。
在第二个方面的某些实现方式中,所述第一底物的制备步骤包括:
在惰性气氛下,向反应容器中加入第二底物、YSO
结合第二个方面和上述实现方式,在第二个方面的某些实现方式中,所述有机碱为三乙胺或吡啶。
结合第二个方面和上述实现方式,在第二个方面的某些实现方式中,所述第二有机溶剂为二氯甲烷、二氯乙烷或四氢呋喃中的一种。
结合第二个方面和上述实现方式,在第二个方面的某些实现方式中,所述第三有机溶剂为乙酸乙酯或二氯甲烷。
结合第二个方面和上述实现方式,在第二个方面的某些实现方式中,所述第一有机溶剂为乙腈、丙腈、N,N-二甲基甲酰胺或二甲基亚砜中的一种。
结合第二个方面和上述实现方式,在第二个方面的某些实现方式中,所述光催化剂选自4CzIPN、Ir[dF(CF
结合第二个方面和上述实现方式,在第二个方面的某些实现方式中,所述柱层析处理的过程中使用的溶剂为石油醚和乙酸乙酯,石油醚与所述乙酸乙酯的体积比为20:1~1:1。
本发明的实施例中提供的技术方案带来如下有益技术效果:
本发明提供的多取代烷基亚磺酸内酯,其化合物形式多种多样,取代基种类丰富,具有重要应用前景,同时后续可以对其实现原位氧化和还原、开环等多样性官能团化合成含氟磺内酯,巯基硫醇等,为含硫有机功能分子的修饰提供重要的物质来源,具有重要的应用价值;其制备工艺简单,原辅料廉价易得,产物产率高提纯方便,三废少,具有100%的原子经济性。
本申请附加的方面和优点将在后续部分中给出,并将从后续的描述中详细得到理解,或通过对本发明的具体实施了解到。
附图说明
图1为本发明一实施例中多取代烷基亚磺酸内酯的制备方法的流程示意图;
图2为本发明实施例1中合成的氰基-γ-亚磺酸内酯的
图3为本发明实施例2中合成的甲基-γ-亚磺酸内酯的
图4为本发明实施例3中合成的甲基-δ-亚磺酸内酯的
图5为本发明实施例4中合成的3,5-二取代γ-亚磺酸内酯的
图6为本发明实施例5中合成的3,5-三取代γ-亚磺酸内酯的
图7为本发明实施例6中合成的芳基-γ-亚磺酸内酯的
图8为本发明实施例7中合成的酯基γ-亚磺酸内酯的
图9为本发明实施例8中合成的叔丁基-γ-亚磺酸内酯的
图10为本发明实施例9中合成的苄基-γ-亚磺酸内酯的
图11为本发明实施例10中合成的二氟取代甲基-γ-亚磺酸内酯的
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的可能的实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文已经通过附图描述的实施例。通过参考附图描述的实施例是示例性的,用于使对本发明的公开内容的理解更加透彻全面,而不能解释为对本发明的限制。此外,如果已知技术的详细描述对于示出的本发明的特征是非必要技术的,则可能将这些技术细节予以省略。
相关领域的技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语),具有与本发明所属领域中的普通技术人员的一般理解相同的意义。还应该理解的是,诸如通用字典中定义的那些术语,应该被理解为具有与现有技术中的意义一致的意义,并且除非像这里一样被特定定义,否则不会用理想化或过于正式的含义来解释。
本技术领域技术人员可以理解,除非特意声明,这里使用的单数形式“一”、“一个”、“所述”和“该”也可包括复数形式。应该进一步理解的是,本申请的说明书中使用的措辞“包括”是指存在所述特征、整数、步骤、操作、元件和/或组件,但是并不排除存在或添加一个或多个其他特征、整数、步骤、操作、元件、组件和/或它们的组。应该理解,这里使用的措辞“和/或”包括一个或更多个相关联的列出项的全部或任一单元和全部组合。
下面以具体地实施例对本发明的技术方案以及该技术方案如何解决上述的技术问题进行详细说明。
本申请第一个方面的实施例提供了一种多取代烷基亚磺酸内酯,多取代烷基亚磺酸内酯的结构式为:
其中,n
本发明提供的多取代亚磺酸内酯,其化合物形式多种多样,取代基种类丰富,具有重要应用前景,同时后续可以对其实现原位氧化和还原、开环等多样性官能团化合成含氟磺内酯,巯基硫醇等,为含硫有机功能分子的修饰提供重要的物质来源,具有重要的应用价值。
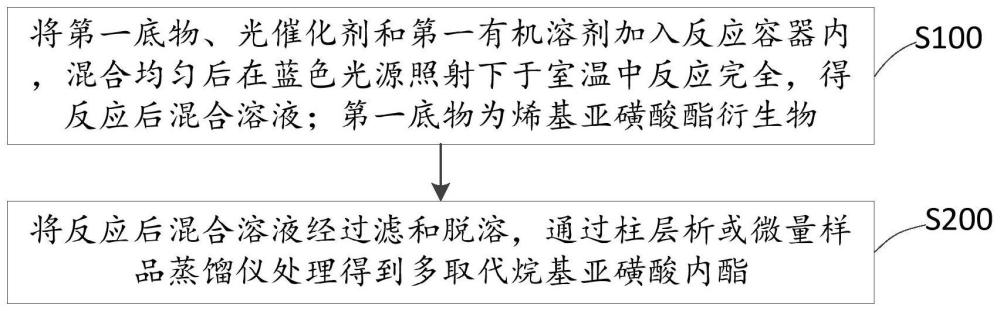
本发明申请第二个方面的实施例提供了一种如本申请第一个方面描述的多取代烷基亚磺酸内酯的制备方法,如图1所示,包括下列步骤:
S100:将第一底物、光催化剂和第一有机溶剂加入反应容器内,混合均匀后在蓝色光源照射下于室温中反应完全,得反应后混合溶液;第一底物为烯基亚磺酸酯衍生物。
S200:将反应后混合溶液经过滤和脱溶,通过柱层析或微量样品蒸馏仪处理得到多取代烷基亚磺酸内酯。
具体而言,在惰性气氛,比如氮气或氩气的气氛下,向反应瓶中加入第一底物1.0eq.,光催化剂的加入量不超过上述用量的5%,第一有机溶剂的反应浓度为0.05-1.0M,反应时间通常不大于30小时。第一有机溶剂为乙腈、丙腈、N,N-二甲基甲酰胺或二甲基亚砜中的一种。光催化剂选自4CzIPN、Ir[dF(CF
为直观理解本申请的上述方法,以下列举了多取代烷基亚磺酸内酯化合物的合成反应式A:
其中,PC为光催化剂,Solvent为第一溶剂。blue LED lamp选用发蓝色光的LED光源。
本发明申请提供的上述多取代烷基亚磺酸内酯的制备方法具有制备工艺简单,原辅料廉价易得,产物产率高提纯方便,三废少的基本特点,容易在工业生产中放大执行,设备条件要求不高,具有100%的原子经济性。
具体地,在本申请第二个方面的某些实现方式中,第一底物也可采用自行制备的方法制取,第一底物的制备步骤包括:
在惰性气氛下,向反应容器中加入第二底物、YSO
结合前述的内容,本申请的多取代烷基亚磺酸内酯的制备方法也可以采用以下反应式B:
LG=离去基团(F,Cl,Br,I,OTs,OMs,ONs)...
以下是具体实施例:
实施例1氰基-γ-亚磺酸内酯(+/-)-1的合成
在氮气氛围中,将烯烃1a(0.30mmol,64mg,1.0equiv)、光催化剂4CzIPN(0.015mmol,12mg,5.0mol%)加入反应瓶中,缓慢加入无水乙腈6mL,打开蓝色30W LED灯,灯泡距离反应瓶5-10厘米,室温搅拌20小时,用TLC(thin-layer chromatography,薄层层析)监测反应。反应完成后,把固体过滤,浓缩有机相,粗产物以V
HRMS(ESI+):calcd.for C
实施例2甲基-γ-亚磺酸内酯(+/-)-2的合成
在氮气氛围中,将烯烃1a(0.30mmol,61mg,1.0equiv)、光催化剂4CzIPN(0.015mmol,12mg,5.0mol%)加入反应瓶中,缓慢加入无水乙腈6mL,打开蓝色30W LED灯,灯泡距离反应瓶5-10厘米,室温搅拌20小时,用TLC监测反应。反应完成后,把固体过滤,浓缩有机相,粗产物以V
HRMS(ESI
克级规模放大:
在氮气氛围中,将烯烃2a(6.9mmol,1.4g,1.0equiv)、光催化剂4CzIPN(0.14mmol,106mg,2.0mol%)加入反应瓶中,缓慢加入无水乙腈50mL,打开蓝色两个30W LED灯,灯泡距离反应瓶5-10厘米,室温搅拌20小时,用TLC监测反应。反应完成后,把固体过滤,浓缩有机相,粗产物以V
实施例3甲基-δ-亚磺酸内酯(+/-)-3的合成
在氮气氛围中,将烯烃3a(0.30mmol,65mg,1.0equiv)、光催化剂4CzIPN(0.015mmol,12mg,5.0mol%)加入反应瓶中,缓慢加入乙腈6.0mL,打开蓝色30W LED灯,灯泡距离反应瓶5-10厘米,室温搅拌20小时,用TLC监测反应。反应完成后,把固体过滤,浓缩有机相,粗产物以V石油醚/V乙酸乙酯=2:1柱层析直接得到产物甲基-δ-亚磺酸内酯(+/-)-342mg(浅黄色固体),收率64%,纯度≥95%,顺反异构体比例为57比43。图4是本发明实施例3合成的甲基-δ-亚磺酸内酯3的主要构型1H NMR表征图谱。
实施例4 3,5-二取代γ-亚磺酸内酯(+/-)-4的合成
在氮气氛围中,将烯烃4a(0.30mmol,81mg,1.0equiv)、三氟亚磺酸钠(0.06mmol,10mg,0.2equiv)、光催化剂4CzIPN(0.015mmol,12mg,5.0mol%)加入反应瓶中,缓慢加入乙腈6.0mL,打开蓝色30W LED灯,灯泡距离反应瓶5-10厘米,室温搅拌25小时,用TLC监测反应。反应完成后,把固体过滤,浓缩有机相,粗产物以V石油醚/V乙酸乙酯=10:1柱层析直接得到产物3,5-二取代γ-亚磺酸内酯(+/-)-463mg(浅黄色固体),收率77%,纯度≥95%,顺反异构体比例为43比24比19比14。图5是本发明实施例4合成的3,5-二取代γ-亚磺酸内酯4的主要构型1H NMR表征图谱。
HRMS(ESI
实施例5 3,5-三取代γ-亚磺酸内酯(+/-)-5的合成
在氮气氛围中,将烯烃5a(0.50mmol,146mg,1.0equiv)、三氟亚磺酸钠(0.10mmol,16mg,0.2equiv)、光催化剂4CzIPN(0.025mmol,20mg,5.0mol%)加入反应瓶中,缓慢加入乙腈6.0mL,打开蓝色30W LED灯,灯泡距离反应瓶5-10厘米,室温搅拌20小时,用TLC监测反应。反应完成后,把固体过滤,浓缩有机相,粗产物以V石油醚/V乙酸乙酯=5:1柱层析直接得到产物3,5-三取代γ-亚磺酸内酯(+/-)-5111mg(浅黄色固体),收率76%,纯度≥95%,顺反异构体比例为70比15比14比1。图6是本发明实施例5合成的3,5-三取代γ-亚磺酸内酯5的主要构型1H NMR表征图谱。
实施例6芳基-γ-亚磺酸内酯(+/-)-6的的合成
在氮气氛围中,将烯烃6a(0.50mmol,116mg,1.0equiv)、三氟亚磺酸钠(0.10mmol,16mg,0.2equiv)、光催化剂4CzIPN(0.025mmol,20mg,5.0mol%)加入反应瓶中,缓慢加入乙腈6.0mL,打开蓝色30W LED灯,灯泡距离反应瓶5-10厘米,室温搅拌20小时,用TLC监测反应。反应完成后,把固体过滤,浓缩有机相,粗产物以V石油醚/V乙酸乙酯=3:1柱层析直接得到产物芳基-γ-亚磺酸内酯(+/-)-673mg(浅黄色固体),收率50%,纯度≥95%,顺反异构体比例为93比7。图7是本发明实施例6合成的芳基-γ-亚磺酸内酯6的主要构型1H NMR表征图谱。
HRMS(ESI
实施例7酯基γ-亚磺酸内酯(+/-)-7的合成
在氮气氛围中,将烯烃7a(0.50mmol,157mg,1.0equiv)、三氟亚磺酸钠(0.10mmol,16mg,0.2equiv)、光催化剂4CzIPN(0.025mmol,20mg,5.0mol%)加入反应瓶中,缓慢加入乙腈6.0mL,打开蓝色30W LED灯,灯泡距离反应瓶5-10厘米,室温搅拌30小时,用TLC监测反应。反应完成后,把固体过滤,浓缩有机相,粗产物以V石油醚/V乙酸乙酯=3:1柱层析直接得到产物酯基γ-亚磺酸内酯(+/-)-7126mg(浅黄色固体),收率80%,纯度≥95%,顺反异构体比例为75比25。图8是本发明实施例7合成的酯基γ-亚磺酸内酯7的主要构型1H NMR表征图谱。
HRMS(ESI
实施例8叔丁基-γ-亚磺酸内酯(+/-)-8的合成
在氮气氛围中,将烯烃8a(0.30mmol,73mg,1.0equiv)、光催化剂4CzIPN(0.015mmol,12mg,5.0mol%)加入反应瓶中,缓慢加入乙腈6.0mL,打开蓝色30W LED灯,灯泡距离反应瓶5-10厘米,室温搅拌23小时,用TLC监测反应。反应完成后,把固体过滤,浓缩有机相,粗产物以V石油醚/V乙酸乙酯=10:1柱层析直接得到产物叔丁基-γ-亚磺酸内酯(+/-)-856mg(浅黄色固体),收率77%,纯度≥95%,顺反异构体比例大于95比5。图9是本发明实施例8合成的叔丁基-γ-亚磺酸内酯8的主要构型1H NMR表征图谱。
HRMS(ESI
实施例9苄基-γ-亚磺酸内酯(+/-)-9的合成
在氮气氛围中,将烯烃5a(0.30mmol,83mg,1.0equiv)、光催化剂4CzIPN(0.015mmol,12mg,5.0mol%)加入反应瓶中,缓慢加入乙腈6.0mL,打开蓝色30W LED灯,灯泡距离反应瓶5-10厘米,室温搅拌25小时,用TLC监测反应。反应完成后,把固体过滤,浓缩有机相,粗产物以V石油醚/V乙酸乙酯=10:1柱层析直接得到产物苄基-γ-亚磺酸内酯(+/-)-943mg(浅黄色固体),收率52%,纯度≥95%,顺反异构体比例为70比30。图10是本发明实施例9合成的苄基-γ-亚磺酸内酯9的主要构型1H NMR表征图谱。
HRMS(ESI
实施例10二氟取代甲基-γ-亚磺酸内酯(+/-)-10的合成
在氮气氛围中,将烯烃5a(0.30mmol,55mg,1.0equiv)、二氟甲基亚磺酸钠(0.06mmol,8mg,0.2equiv)、光催化剂4CzIPN(0.015mmol,12mg,5.0mol%)加入反应瓶中,缓慢加入乙腈6.0mL,打开蓝色30W LED灯,灯泡距离反应瓶5-10厘米,室温搅拌30小时,用TLC监测反应。反应完成后,把固体过滤,浓缩有机相,粗产物以V石油醚/V乙酸乙酯=5:1柱层析直接得到产物二氟取代甲基-γ-亚磺酸内酯(+/-)-1020mg(浅黄色固体),收率65%,纯度≥95%,顺反异构体比例为67/33。图11是本发明实施例10合成的二氟取代甲基-γ-亚磺酸内酯10的主要构型1H NMR表征图谱。
HRMS(ESI
本技术领域技术人员可以理解,本申请中已经讨论过的各种操作、方法、流程中的步骤、措施、方案可以被交替、更改、组合或删除。进一步地,具有本申请中已经讨论过的各种操作、方法、流程中的其他步骤、措施、方案也可以被交替、更改、重排、分解、组合或删除。进一步地,现有技术中的具有与本申请中公开的各种操作、方法、流程中的步骤、措施、方案也可以被交替、更改、重排、分解、组合或删除。
术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本申请的描述中,除非另有说明,“多个”的含义是两个或两个以上。
在本说明书的描述中,具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
应该理解的是,虽然附图的流程图中的各个步骤按照箭头的指示依次显示,但是这些步骤并不是必然按照箭头指示的顺序依次执行。除非本文中有明确的说明,这些步骤的执行并没有严格的顺序限制,其可以以其他的顺序执行。而且,附图的流程图中的至少一部分步骤可以包括多个子步骤或者多个阶段,这些子步骤或者阶段并不必然是在同一时刻执行完成,而是可以在不同的时刻执行,其执行顺序也不必然是依次进行,而是可以与其他步骤或者其他步骤的子步骤或者阶段的至少一部分轮流或者交替地执行。
以上所述仅是本申请的部分实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本申请的保护范围。
- 5-芳基-3-(2-氨基磺酸酯基-5-取代亚苄基)丁烯内酯化合物及制备方法、应用
- 5-芳基-3-(2-氨基磺酸酯基-5-取代亚苄基)丁烯内酯化合物及制备方法、应用
