检测和治疗真菌感染的方法
文献发布时间:2024-04-18 19:44:28
本申请要求2021年2月5日提交的美国临时专利申请序列号63/146,212的权益,所述申请的公开内容以其整体通过引用并入本文。
本发明是用美国国家过敏和传染病研究所(NIH/NIAID)授予的联邦拨款号R21AI132978-01下的政府支持完成的。政府对本发明拥有某些权利。
念珠菌血症是美国最常见的医院血流感染之一,并引起住院患者显著的发病率和死亡率。能够区分住院患者的念珠菌血症与其他发热性疾病原因的改进快速诊断是至关重要的。基于病原体类别特异性生物标志物的诊断,诸如关注循环白细胞中宿主基因表达模式的诊断可能提供一种有前途的替代方案。
Zaas等人的US2016/0194715讨论了通过外周血样品的蛋白质组学测定来鉴定真菌感染(诸如念珠菌病)的方法。
提供概述以介绍在下面的详述中进一步描述的概念选择。该概述并不意欲鉴定所请求保护的主题的关键或基本特征,也不意欲用作限制所请求保护的主题的范围的帮助。
根据一些方面,本文提供了用于将受试者分类的方法,其包括:(a)从所述受试者获得生物样品;(b)在平台上测量指示所述生物样品中的真菌感染、和任选地,细菌感染、病毒感染、健康和/或非传染性疾病中的一种或多种的识别标志,所述识别标志包括预定义的一组基因的基因表达水平;(c)将所述基因表达水平输入真菌分类器、和任选地,选自细菌感染分类器、病毒分类器和对照分类器(健康和/或非传染性疾病)的一种或多种额外分类器,所述一种或多种分类器包括所述平台的预定义的一组基因的所述基因中的每一个的预定义的加权值(即系数);和(d)基于所述基因表达水平和一种或多种分类器,将所述受试者分类为患有真菌感染、和/或细菌感染、病毒感染或对照。
在一些实施方案中,所述方法包括将所述基因表达水平归一化以生成归一化的基因表达值;且所述输入包括将归一化的基因表达值输入一种或多种分类器中;且所述分类包括基于所述归一化的基因表达值和一种或多种分类器计算真菌感染、和任选地,细菌感染、病毒感染或对照的概率。
在一些实施方案中,所述方法进一步包括生成为所述受试者赋予表明真菌感染、和任选地,细菌感染、病毒感染、健康和/或非传染性疾病的概率的评分的报告。
在一些实施方案中,所述方法进一步包括:(e)基于所述分类向所述受试者施用适当的疗法。
在一些实施方案中,预定义的一组基因是1、5、10、15或20至30、40、50、60或70种基因的组。在一些实施方案中,预定义的一组基因是表1-5中列出的1、5、10、15或20至30、40、50、60或70种基因的组。在一些实施方案中,预定义的一组基因是表6-10中列出的1、5或10至15、20、25、30或33种基因(例如,选自表6-10中以粗体列出的基因)的组。
在一些实施方案中,所述受试者具有感染的症状(例如,发烧)。在一些实施方案中,所述受试者具有败血症的症状。
在一些实施方案中,所述生物样品选自外周血、痰液、脑脊液、尿液、鼻咽拭子、鼻咽洗液、支气管肺泡灌洗液、气管内抽吸物和它们的组合。在一些实施方案中,所述生物样品包括外周血样品。在一些实施方案中,所述生物样品包括支气管肺泡灌洗液。
在一些实施方案中,所述测量包括以下一个或多个步骤或之前有以下一个或多个步骤:从所述样品纯化细胞,破碎所述样品的细胞,和从所述样品分离RNA。
在一些实施方案中,所述测量包括PCR扩增、等温扩增、测序和/或核酸探针杂交。在一些实施方案中,所述平台包括阵列平台、热循环仪平台(例如,多重和/或实时PCR平台)、杂交和多信号编码的(例如,荧光)检测器平台、核酸质谱平台、核酸测序平台、等温扩增平台或它们的组合。
在一些实施方案中,所述真菌感染包括酵母,诸如念珠菌属、丝孢酵母属或隐球菌属。
在一些实施方案中,所述真菌分类器通过包括以下的方法产生:(i)从多个已知患有真菌感染的受试者获得生物样品;(ii)从多个未住院的健康对照和/或多个已知患有非传染性疾病的受试者获得生物样品;(iii)在所述平台上测量来自步骤(i)和(ii)的每个样品中的多种基因的基因表达水平;(iv)将步骤(iii)中获得的基因表达水平归一化以生成归一化的基因表达值;和(f)生成真菌分类器。
在一些实施方案中,所述真菌分类器通过包括以下的方法产生:(i)从多个已知患有真菌感染的受试者获得生物样品;(ii)从多个已知患有细菌感染的受试者获得生物样品;(iii)在所述平台上测量来自步骤(i)和(ii)的每个样品中的多种基因的基因表达水平;(iv)将步骤(iii)中获得的基因表达水平归一化以生成归一化的基因表达值;和(f)生成真菌分类器。
在一些实施方案中,所述真菌分类器通过包括以下的方法产生:(i)从多个已知患有真菌感染的受试者获得生物样品;(ii)从多个已知患有病毒感染的受试者获得生物样品;(iii)在所述平台上测量来自步骤(i)和(ii)的每个样品中的多种基因的基因表达水平;(iv)将步骤(iii)中获得的基因表达水平归一化以生成归一化的基因表达值;和(f)生成真菌分类器。
在一些实施方案中,所述生成迭代地包括:(i)为每个归一化基因表达值赋予权重,将每种基因的权重和表达值输入分类器(例如,线性回归分类器)方程中并为多个受试者中的每个的结果确定评分,然后(ii)确定多个受试者中每个结果的分类的准确性,且然后(iii)调整权重,直到对分类的准确性进行优化,以为所述平台提供所述真菌分类器、细菌分类器、病毒分类器和/或对照分类器,其中在各个分类器中包括具有非零权重的基因,和任选地将每个分类器的组分(基因、权重和/或病因学阈值)上传至一个或多个数据库上。
根据一些方面,还提供了用于检测受试者中的真菌感染的方法,其包括:提供所述受试者的生物样品;和在平台上测量预定义的一组基因的差异表达,所述预定义的一组基因包括表1至5中列出的基因中的5、10、15、20、25或30至50、60、70、80、90或全部94种;诸如表1中列出的基因中的3、5、8、10、12、15、18、20、25或全部29种;和任选地,表2中列出的基因中的3、5、8、10、12、15或全部18种;表3中列出的基因中的3、5、8、10、12、15、18或全部19种;表4中列出的基因中的3、5、8、10、12、15、18或全部19种;和/或表5中列出的基因中的3、4、5、6、7、8、9或全部10种,或其中所述预定义的一组基因包括表6至10中列出的基因中的5、10、15、20、25、30或全部33种(可测量,例如用与所述基因同源的寡核苷酸探针可测量);诸如表6中列出的基因中的1、2、3、4或全部5种;和任选地,表7中列出的基因中的1、2、3、4、5、6、7、8或全部9种;表8中列出的基因中的1、2、3、4、5、6、7或全部8种;表9中列出的基因中的1、2、3、4、5、6或全部7种;和/或表10中列出的基因中的1、2、3或全部4种,或其中所述预定义的一组基因包括ITGA2B、MKI67和AZU1;和任选地,HDAC4、DCAF15、SDHC、SAP30L、DNASE1和DCAF15;PIGT、HERC6和LY6E;SLC35E1、WIPI2、RELL1、MAP1LC3B、CASZ1和GABBR1;和/或RPS24和CTSB,其中预定义的一组基因的差异表达表明所述受试者中存在或不存在真菌感染。
在一些实施方案中,测量包括以下一个或多个步骤或之前有以下一个或多个步骤:从所述样品纯化细胞,破碎所述样品的细胞,和从所述样品分离RNA。
在一些实施方案中,测量包括半定量PCR、等温扩增和/或核酸探针杂交。在一些实施方案中,所述平台包括阵列平台、热循环仪平台(例如,多重和/或实时PCR平台)、等温扩增平台、杂交和多信号编码的(例如,荧光)检测器平台、核酸质谱平台、核酸测序平台或它们的组合。
在一些实施方案中,所述受试者正患有感染的症状(例如,发烧)。在一些实施方案中,所述受试者正患有败血症的症状。
在一些实施方案中,所述方法进一步包括当检测到真菌感染的存在时治疗所述受试者的真菌感染。
根据一些方面,进一步提供了治疗受试者中的真菌感染的方法,其包括当通过如本文所教导的方法确定所述受试者具有真菌感染时向所述受试者施用适当的治疗方案。还提供了当通过如本文所教导的方法确定所述受试者具有真菌感染时适当的治疗方案用于治疗受试者中的真菌感染的用途。
在一些实施方案中,所述适当的治疗方案包括施用抗真菌抗生素。在一些实施方案中,所述适当的治疗方案包括施用选自以下的治疗剂:棘白菌素类(例如,卡泊芬净、米卡芬净、阿尼芬净)、唑类抗真菌剂(例如,氟康唑、伏立康唑、艾沙康唑、泊沙康唑)、多烯类(例如,两性霉素B)、嘧啶类似物(例如,5-氟胞嘧啶(5-FC或氟胞嘧啶))、APX001(fosmanogepix)、APX879、苯并硫脲类、氯法齐明、肼类(hydrazycines)(例如,BHBM和B0)、ibomycin、单克隆抗体18B7、间苯二酚氨基吡唑(例如,化合物112)、舍曲林、他莫昔芬、VT-1598等,包括它们的组合。
在一些实施方案中,所述方法进一步包括通过使用如本文所教导的检测真菌感染的方法来监测受试者的适当的治疗方案的效力。
根据一些方面,进一步提供了用于检测受试者中的真菌感染的系统,其包括:至少一个处理器;样品输入回路,所述样品输入回路被配置成接收来自所述受试者的生物样品;样品分析回路,所述样品分析回路与所述至少一个处理器耦合并且被配置成确定所述生物样品中指示所述真菌感染的一组预定基因的基因表达水平;输入/输出回路,所述输入/输出回路与所述至少一个处理器耦合;存储回路,所述存储回路与所述至少一个处理器耦合并且被配置成存储数据、参数、和/或基因集合;和存储器,所述存储器与所述处理器耦合并且包括体现在所述存储器中的计算机可读程序代码,所述计算机可读程序代码当被所述至少一个处理器执行时引起至少一个处理器执行包括下列各项的操作:控制/执行通过所述样品分析回路的所述生物样品中的预定义的一组基因的基因表达水平的测量;将所述基因表达水平归一化以生成归一化的基因表达值;从所述存储回路获取所述预定义的一组基因的所述基因中的每一个的预定义的加权值(即系数);基于所述归一化的基因表达值的加权值计算真菌感染的可能性;和控制通过所述输入/输出回路的确定是否存在所述真菌感染的输出。
在一些实施方案中,所述预定义的一组基因包括表1至5中列出的基因中的5、10、15、20、25或30至50、60、70、80、90或全部94种;诸如表1中列出的基因中的3、5、8、10、12、15、18、20、25或全部29种;和任选地,表2中列出的基因中的3、5、8、10、12、15或全部18种;表3中列出的基因中的3、5、8、10、12、15、18或全部19种;表4中列出的基因中的3、5、8、10、12、15、18或全部19种;和/或表5中列出的基因中的3、4、5、6、7、8、9或全部10种,或其中所述预定义的一组基因包括表6至10中列出的基因中的5、10、15、20、25、30或全部33种;诸如表6中列出的基因中的1、2、3、4或全部5种;和任选地,表7中列出的基因中的1、2、3、4、5、6、7、8或全部9种;表8中列出的基因中的1、2、3、4、5、6、7或全部8种;表9中列出的基因中的1、2、3、4、5、6或全部7种;和/或表10中列出的基因中的1、2、3或全部4种,或其中所述预定义的一组基因包括ITGA2B、MKI67和AZU1;和任选地,HDAC4、DCAF15、SDHC、SAP30L、DNASE1和DCAF15;PIGT、HERC6和LY6E;SLC35E1、WIPI2、RELL1、MAP1LC3B、CASZ1和GABBR1;和/或RPS24和CTSB。
在一些实施方案中,所述系统包括计算机可读代码以将定量或半定量的基因表达检测转化为所述真菌感染的累积评分或概率。
在一些实施方案中,所述系统包括阵列平台、热循环仪平台(例如,多重和/或实时PCR平台)、杂交和多信号编码的(例如,荧光)检测器平台、核酸质谱平台、核酸测序平台、等温扩增平台或它们的组合。
随附附图和实施例通过举例说明的方式提供,而不是通过限制的方式提供。结合随附的涉及一个或多个实施方案的示例附图(也是“附图(FIG.)”),在以下描述中解释了本公开的前述方面和其他特征,其中:
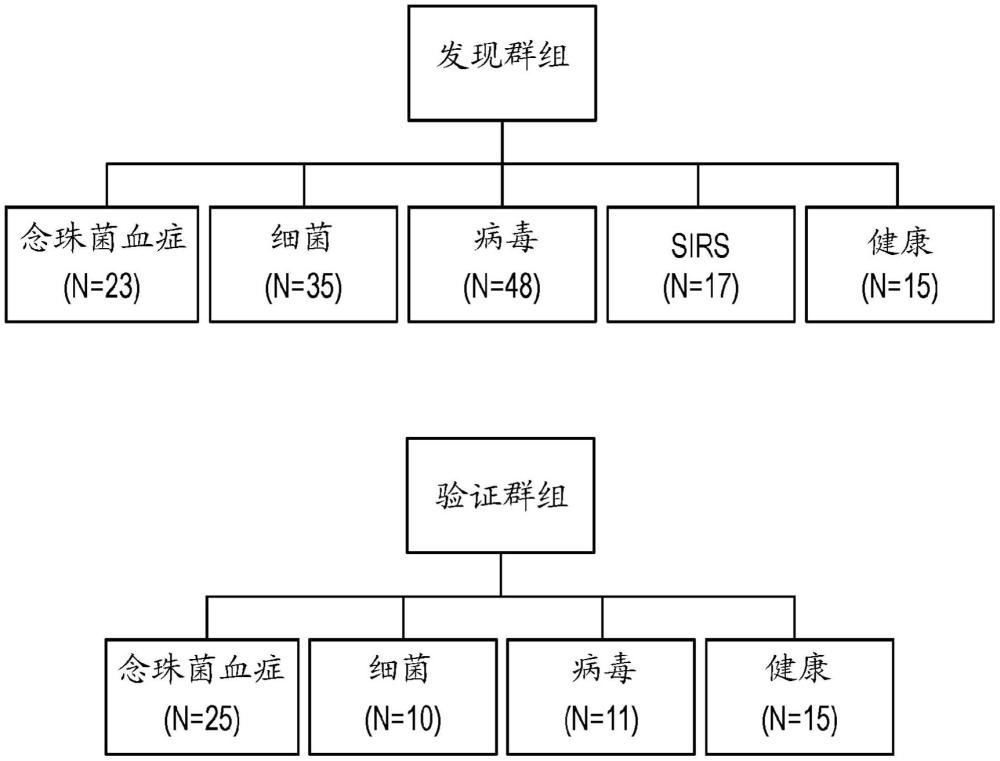
图1是显示根据本公开的一个实施方案的用于通过感染表型来分解发现和验证群组的实验设计的示意图。
图2A显示响应于不同感染表型的差异表达基因(adj P<0.05)。所有基因、感染表型与所有其他进行比较。
图2B显示响应于不同感染表型的差异表达基因(adj P<0.05)。所有基因、念珠菌与每种其他表型进行比较。
图3呈现显示根据本公开的实施方案的多项基因表达分类器的图。小图A.发现群组中每种感染表型的多项分类器性能的ROC。小图B.表明发现群组中每种感染表型的分类器的预测概率的箱线图。小图C.验证群组中每种感染表型的多项分类器性能的ROC。小图D.表明验证群组中每种感染表型的分类器的预测概率的箱线图。
图4呈现显示根据本公开的实施方案的验证群组的图。Tsalik等人群组中每种感染表型的多项分类器性能的ROC(小图A)和箱线图(小图B)。Ramilo等人群组中每种感染表型的多项分类器性能的ROC(小图C)和箱线图(小图D)。体外群组中每种感染表型的多项分类器性能的ROC(小图E)和箱线图(小图F)。如通过分类器建立的感染类别由每个受试者具有最高预测概率的表型确定。
图5是可以在根据本发明的平台中使用的分类系统和/或计算机程序产品的框图。分类系统和/或计算机程序产品1100可以包括处理器子系统1140,其包括一个或多个中央处理单元(CPU),在其上运行一个或多个操作系统和/或一个或多个应用程序。尽管显示了一个处理器1140,但应理解的是,可以存在多个处理器1140,其可以是互相电连接的或分开的。一个或多个处理器1140被配置成执行来自存储器设备、诸如存储器1150的计算机程序代码,以执行本文所述的操作和方法中的至少一些。存储回路1170可以存储数据库,所述数据库提供对分类系统1110使用的数据/参数/分类器、诸如识别标志、权重、阈值等的访问。输入/输出回路1160可以包括显示器和/或用户输入设备,诸如键盘、触摸屏和/或指针设备。可以使用与输入/输出回路1160连接的设备以通过分类系统1100的用户为处理器1140提供信息。与输入/输出回路1160连接的设备可以包括网络或通讯控制器、输入设备(键盘、鼠标、触摸屏等)和输出设备(打印机或显示器)。可以包括任选的升级回路1180作为用于为分类系统1100提供升级的接口,诸如针对由处理器1140执行的在存储器1150和/或存储回路1170中存储的代码的升级。通过升级回路1180提供的升级还可以包括针对与维护分类系统1100的信息、诸如识别标志、权重、阈值等的数据库和/或其他数据存储形式有关的存储回路1170的部分的升级。样品输入回路1110为分类系统1100提供接口以接收待分析的生物样品。样品处理回路1120还可以处理分类系统1100内的生物样品以制备用于自动分析的生物样品。
在它们与本文阐述的公开内容一致的程度上,本文引用的所有专利参考文献的公开内容均在此通过引用并入。
出于促进对本公开的原理的理解的目的,现在将参考优选实施方案并且将使用特定语言对其进行描述。然而将理解的是,并非因此意欲限制本公开的范围,如本文举例说明的本公开的此类改变和进一步的改进被认为是与本公开相关的领域的技术人员通常会想到的。
在本文中使用冠词“一个/种(a)”、“一个/种(an)”和“所述(the)”以指该冠词的语法对象的一个/种或多于一个/种(即至少一个/种)。通过实例的方式,“一个/种要素”意指至少一个/种要素并且可以包括多于一个/种要素。
“约”用于通过提供给定值可以稍微高于或稍微低于(例如,2%、5%、10%或15%)端点而不影响期望结果来为数值范围端点提供灵活性。
本文使用术语“包括”、“包含”或“具有”及其变型意欲涵盖其后列出的要素及其等同物以及额外要素。如本文所用,“和/或”是指并涵盖一个或多个相关列出项目的任何和所有可能的组合,以及当以替代方式(“或”)解释时缺乏组合。
如本文所用,过渡短语“基本上由...组成”(以及语法变体)应被解释为涵盖所列举的材料或步骤“以及不会实质上影响所请求保护的发明的基本和新型特征的那些”。因此,如本文所用的术语“基本上由...组成”不应被解释为等同于“包含”。
此外,本公开还设想,在一些实施方案中,可以排除或省略本文阐述的任何特征或特征的组合。为了举例说明,如果说明书规定复合物包含组分A、B和C,则其是专门意指A、B或C中的任一个或其组合可以单独地或以任何组合地被省略和放弃。
除非本文中另外指出,否则在本文中数值范围的叙述仅意在用作独立指代落在该范围内的各个单独的值的简写方法,并且各个单独的值并入说明书中,如同其在本文中独立叙述一样。例如,如果陈述浓度范围为1%至50%,则预期的是,在本说明书中明确地列举了值诸如2%至40%、10%至30%、或1%至3%等。这些仅是所具体预期的实例,并且在列举的最低值和最高值之间并且包括列举的最低值和最高值的数值的所有可能的组合被认为是在本公开中明确陈述的。
如本文所用的术语“识别标志(signature)”是指一组生物分析物和可测量的量的所述分析物,其特定组合表明存在或不存在指定的生物状态。这些识别标志发现于具有已知状态(例如,具有证实的细菌感染、病毒感染、真菌感染或对照(健康和/或非传染性疾病))的多个受试者中,并且辨别(单独或共同)一个或多个目标类别或结果。这些可测量的分析物,也被称为生物标志物,可以是(但不限于)基因表达水平、蛋白或肽水平、或代谢物水平。还参见Courchesne等人的US2015/0227681;Eden等人的US2016/0153993。
在如本文所公开的一些实施方案中,“识别标志”是特定的基因组合,当并入如本文所教导的分类器中时,其表达水平辨别病况、诸如真菌感染。参见,例如,下文提供的实施例。然而,识别标志可以以其他方式(诸如Courchesne等人的US2015/0227681以及Eden等人的US 2016/0153993中指出的那些)处理/解释。作为非限制性实例,Khatri等人的美国专利号10,533,224讨论了生物标志物水平与未感染对照受试者的参考值范围(诸如时间匹配的参考值范围)的比较,以及使用与生物标志物的对照参考值相比的生物标志物表达水平的几何平均值,以区分病况或生物状态。
如本文所用,术语“分类器”和“预测器”可互换使用并且是指数学函数,所述数学函数使用识别标志(例如,针对定义的一组基因的基因表达水平)的值和针对每个识别标志组分的预定的系数(或权重),以生成针对给定的观察或个体患者的评分,以用于分配至类别的目的。分类器可以是线性的和/或概率性的。如果评分是通过一组系数加权的总和识别标志值的函数,则分类器是线性的。此外,如果识别标志值的函数生成分别定量受试者或观察属于特定类别或将具有特定结果的可能性的概率,0至1.0(或0至100%)之间的值,则分类器是概率性的。Probit回归和逻辑回归(logistic regression)是分别使用probit和逻辑关联函数生成概率的概率线性分类器的实例。
如本文所教导的分类器可以通过被称为“训练”的程序获得,其利用含有具有已知类别成员(例如,真菌、病毒、细菌、对照等)的观察的一组数据。具体地,训练试图寻找针对给定识别标志(例如,基因表达水平组分)的每个组分的最佳系数(即权重),以及最佳识别标志,其中通过最高的可得到的分类准确性确定最佳结果。
如本文所用的“分类(classifying)”或“分类(classification)”是指为患有生物学状态、诸如感染(例如真菌感染)或处于其风险中的受试者分配一个或多个类别或结果(例如,患者被病原体感染或者未被感染)的方法。通过由分类器提供的评分值来确定结果或类别,所述评分值可以与截止值或阈值、置信度水平或限值进行比较。在其他情况下,可以给出属于特定类别的概率(例如,如果分类器报告概率的话)。
如本文所用,当与基因表达水平一起使用时,术语“指示(indicative)”意指与在替代生物状态或对照的表达水平相比上调或下调、改变、或更改基因表达水平。当与蛋白水平一起使用时,术语“指示”意指与标准蛋白水平或替代生物状态下的水平相比蛋白水平较高或较低、增加或降低、改变、或更改。
在一些实施方案中,分类器/分类是“不可知的”,因为它指示一般生物状态,诸如真菌感染、细菌感染、病毒感染或SIRS,但它不提供特定生物体(属和任选物种)作为状态的原因(例如,引起感染的特定真菌或细菌)的指示。
如本文所用,术语“生物标志物”或“生物的标志物”可互换使用,并且是指以各种浓度存在于受试者中的天然存在的生物分子,其可用于预测疾病或病况(诸如真菌感染)的风险或发病率。例如,生物标志物可以是在处于真菌感染诸如念珠菌血症的风险中或患有真菌感染诸如念珠菌血症的受试者中以较高或较低量存在的蛋白或基因表达。生物标志物可以包括但不限于核酸、核糖核酸或多肽,其用作受试者的生物状态的指标或标志物。在一些实施方案中,生物标志物包括RNA。在其他实施方案中,生物标志物包括DNA。在还有其他实施方案中,生物标志物包括蛋白。生物标志物还可以包括受试者中存在的任何天然或非天然存在的多态性(例如,单核苷酸多态性(SNP))或基因变体,其可用于预测真菌感染诸如念珠菌血症的风险或发病率。
如本文所用,“治疗(treating)”、“治疗(treatment)”、“疗法”和/或“疗法方案”是指响应于由患者显现或患者可能对其敏感的疾病、病症、生理状况或生物状态(例如,真菌感染)而进行的临床干预。治疗的目的包括缓解或预防/减少症状,减缓或停止疾病、病症或病况的进展或恶化和/或缓解疾病、病症或病况诸如感染。如本文所用,术语“预防(prevent)”、“预防(preventing)”、“预防(prevention)”、“预防性治疗”等是指降低未患有疾病、病症或病况(例如真菌感染,诸如念珠菌血症)、但处于其发展风险中或对其发展敏感的受试者中发展疾病、病症或病况的可能性。术语“有效量”或“治疗有效量”是指足以实现有益的或期望的生物学和/或临床结果的量。
如本文所用,术语向动物或细胞“施用”药剂(诸如治疗实体)意指将物质(例如,药物、疗法等)分配、递送或应用至预期目标。就治疗剂而言,术语“施用”意指通过任何合适的将治疗剂递送至动物中的期望位置的途径(包括通过肠胃外或口服途径递送、肌内注射、皮下/皮内注射、静脉内注射、鞘内施用、口腔施用、经皮递送、局部施用以及通过鼻内或呼吸道途径施用)将治疗剂与受试者接触或将治疗剂分配、递送或施加至受试者。
术语“适当的治疗方案”或“适当疗法”是指治疗特定疾病或病症所需的护理标准。通常,这样的方案需要向受试者施用能够在疾病状态下产生疗效的治疗剂的行为。例如,用于治疗具有真菌感染(例如念珠菌血症、隐球菌感染等)的受试者的治疗剂可以包括例如抗真菌抗生素。用于治疗具有真菌感染的受试者的具体治疗剂可以包括但不限于药物诸如棘白菌素类(例如,卡泊芬净、米卡芬净、阿尼芬净)、唑类抗真菌剂(例如,氟康唑、伏立康唑、艾沙康唑、泊沙康唑)、多烯类(例如,两性霉素B)、嘧啶类似物(例如,5-氟胞嘧啶(5-FC或氟胞嘧啶))、APX001(fosmanogepix)、APX879、苯并硫脲类、氯法齐明、肼类(例如,BHBM和B0)、ibomycin、单克隆抗体18B7、间苯二酚氨基吡唑(例如,化合物112)、舍曲林、他莫昔芬、VT-1598等,包括它们的组合。参见,例如,Iyer等人,″Treatment strategies forcrypococcal infection:challenges,advances and future outlook,″Nature ReviewsMicrobiology 19,454-466(2021)。
细菌感染的治疗可以包括抗生素,其包括但不限于青霉素类(penicillins)、头孢菌素类(cephalosporins)、氟喹诺酮类(fluroquinolones)、四环素类(tetracyclines)、大环内酯类(macrolides)、和氨基糖苷类(aminoglycosides)。用于治疗患有病毒感染的受试者的治疗剂包括但不限于奥司他韦(oseltamivir)、RNAi抗病毒剂(antiviral)、吸入的利巴韦林(ribavirin)、单克隆抗体respigam、扎那米韦(zanamivir)、和神经氨酸酶(neuraminidase)阻断剂。本公开考虑了使用本文教导的方法确定利用尚不可用的抗真菌剂、抗病毒剂或抗生素的治疗。
这样的方案也可以包括向受试者施用能够产生与疾病或生物学状态相关的症状的减轻的治疗剂的行为。这样的治疗剂的实例包括但不限于NSAIDS、醋氨酚(acetaminophen)、抗组胺剂、β-激动剂、镇咳药(anti-tussive)或减轻与疾病或感染过程相关的症状的其他药物。
如本文所用的术语“生物样品”包括但不限于从受试者分离的含有组织、细胞和/或生物流体的样品。生物样品的实例包括但不限于组织、细胞、活检组织、血液(例如,外周血)、淋巴液、血清、血浆、脑脊液、尿液、唾液、粘液、泪液、痰液、鼻咽拭子、鼻咽洗涤物、支气管肺泡灌洗液、气管内抽吸物等。在一些实施方案中,生物样品包括外周血。在一些实施方案中,生物样品包括支气管肺泡灌洗液。生物样品可以直接从受试者(例如,通过血液或组织采样)或从第三方(例如,从中介机构诸如健康护理提供者或实验室技术人员接收)获得。
术语“遗传物质”是指对应于用于在生物体细胞的细胞核或线粒体中存储遗传信息的物质的物质。遗传物质的实例包括但不限于双链和单链DNA、cDNA、RNA和mRNA。
如本文所用,术语“受试者”和“患者”在本文中可互换使用并且指人类和非人类动物。本公开的术语“非人类动物”包括所有脊椎动物,例如哺乳动物和非哺乳动物,诸如非人类灵长类动物、绵羊、狗、猫、马、牛、鸡、两栖动物、爬行动物等。本文公开的方法和组合物可用于体外样品(例如,分离的细胞或组织)或受试者体内(即,活生物体,诸如患者)。在一些实施方案中,受试者包括患有真菌感染诸如念珠菌血症或处于患有真菌感染诸如念珠菌血症的风险中的人。在一些实施方案中,受试者具有感染(例如发烧)的症状。在一些实施方案中,受试者具有败血症的症状。
如本文所用的“败血症”是指由宿主对感染的反应失调引起的器官功能障碍。参见Singer,M.等人The Third International Consensus Definitions for Sepsis andSeptic Shock(Sepsis-3).JAMA 315,801(2016)。器官功能障碍可以例如通过相继器官衰竭评价(也称为败血症相关器官衰竭评价,或SOFA)评分比基线增加两分或更多分来确定。
除非另有定义,否则本文使用的所有技术术语具有与本公开所属领域的普通技术人员通常理解的相同的含义。
本公开的一个方面提供了用于为平台生成病原体类别特异性分类器的方法,所述平台能够以高度精确性鉴定和区分跨多种宿主的真菌、病毒和/或细菌感染,所述方法包括以下、由以下组成或基本上由以下组成:(i)从多个已知患有真菌感染的受试者获得生物样品;(ii)从多个未住院健康对照获得生物样品;(iii)在所述平台上测量来自步骤(i)和(ii)的每个样品中的多种基因的基因表达水平;(iv)任选地将步骤(iii)中获得的基因表达水平归一化以生成归一化的基因表达值;和(f)生成一个或多个能够以高度准确性鉴定和区分多个宿主的真菌感染的分类器。
在一些实施方案中,所述方法提供了进一步从患有病毒和/或细菌感染和/或非感染性疾病(SIRS)的多个受试者获得生物样品以用于生成步骤。
在一些实施方案中,所述测量包括以下一个或多个步骤或之前有以下一个或多个步骤:从所述样品纯化细胞,破碎所述样品的细胞,和从所述样品分离RNA。
在一些实施方案中,所述测量包括PCR、逆转录(mRNA至cDNA)、等温扩增和/或核酸探针杂交。
如本文所用的“真菌感染”是指宿主受试者被致病性真菌(例如,酵母、霉菌、暗色真菌)感染(例如,血液感染、肺部感染等)。真菌可包括但不限于念珠菌属(其引起念珠菌血症和念珠菌病)、隐球菌属(例如新型隐球菌)、曲霉属、组织胞浆菌属(例如荚膜组织胞浆菌)、肺囊虫属、球孢子菌属(例如粗球孢子菌)、副球孢子菌属(例如巴西副球孢子菌)、孢子丝菌属(例如,申克孢子丝菌)等的真菌。
在一些实施方案中,所述真菌是酵母,诸如念珠菌、毛孢子菌或隐球菌。念珠菌的代表性物种包括但不限于白色念珠菌、光滑念珠菌、热带念珠菌、都柏林念珠菌、克鲁斯念珠菌、葡萄牙念珠菌、假丝念珠菌和诞沫念珠菌。毛孢子菌的代表性物种包括但不限于Trichosporon fungemia。隐球菌的代表性物种包括但不限于新型隐球菌和格特隐球菌。
如本文所用,“平台”或“技术”是指可以用于测量根据本公开的识别标志例如基因表达水平的装置(例如,仪器和相关部件、计算机、包括如在本文中教导的一个或多个数据库的计算机可读介质、试剂等)。平台的实例包括但不限于阵列平台、热循环仪平台(例如,多重和/或实时PCR平台)、核酸测序平台、等温扩增平台(例如,环介导的等温扩增(LAMP、RT-LAMP))、杂交和/或多信号编码的(例如,荧光)检测器平台等、核酸质谱平台、磁共振平台、northern印迹和它们的组合(例如,PCR和等温扩增的组合-参见,例如,Varlamov等人,″Combinations of PCR and Isothermal Amplification Techniques Are Suitable forFast and Sensitive Detection of SARS-CoV-2 Viral RNA,″Front.Bioeng.Biotechnol.,2020)。
在一些实施方案中,平台被配置成半定量地测量基因表达水平,也就是说,不是在离散或绝对表达中测量,作为估算值和/或相对于彼此或一种或多种指定标志物(例如,另一种“标准”或“参考”基因的表达)测量表达水平。
在一些实施方案中,半定量测量包括“实时PCR”,其通过进行PCR循环直到检测到指示指定mRNA的信号,并且使用直至检测所需的PCR循环数以提供在识别标志内的基因的估计或相对表达水平。
实时PCR平台包括,例如
磁共振平台包括,例如T2
术语“阵列”、“微阵列”和“微型阵列”是可互换的并且是指在基板上呈现的一组核苷酸序列的排列。可以在本文中提供的方法中使用任何类型的阵列。例如,阵列可以在固体基板(固相阵列)、诸如载玻片上或者在半固体基板如诸如硝酸纤维素膜上。阵列也可以在珠粒上呈现,即珠阵列。这些珠粒通常是微小的,并且可以由例如聚苯乙烯制成。阵列也可以在纳米颗粒上呈现,其可以由例如尤其是金制成,而且也可以由银、钯、或铂制成。参见,例如,Nanosphere
如本文教导的源自宿主的生物标志物方法提供了填补关键诊断领域(包括一次快速(甚至护理点)检测一种或多种病原体类别)的潜力。在一些实施方案中,所述平台可以在少于48、36或24小时内进行检测。在一些实施方案中,所述平台可以在少于22、20或16小时内进行检测。在一些实施方案中,所述平台可以在少于12、10或8小时内进行检测。在一些实施方案中,所述平台可以在少于6、4或2小时内进行检测。在一些实施方案中,所述平台可以在少于60、45或30分钟内进行检测。此类平台的具体实例可以包括但不限于基于PCR的平台。
在一些实施方案中,所述分类器生成迭代地包括:(i)为每个归一化基因表达值赋予权重,将每种基因的权重和表达值输入分类器(例如,线性回归分类器)方程中并为多个受试者中的每个的结果确定评分,然后(ii)确定多个受试者中每个结果的分类的准确性,且然后(iii)调整权重,直到对分类的准确性进行优化,以为所述平台提供所述细菌分类器、病毒分类器、真菌分类器和/或对照分类器,其中在各个分类器中包括具有非零权重的基因,和任选地将每个分类器的组分(基因、权重和/或病因学阈值)上传至一个或多个数据库上。
在另一个实施方案中,所述分类器包括线性回归分类器且所述生成包括将分类器的评分转换成概率。
在另一个实施方案中,所述方法进一步包括针对包括至少两种相关临床属性的已知数据集验证分类器。
本公开的另一个方面提供了根据本公开的方法制备的真菌、病毒、细菌和/或对照分类器,其中所述分类器包括表1至5中列出的基因中的5、10、15、20、25或30至50、60、70、80、90或全部94种(可测量,例如用与所述基因同源的寡核苷酸探针可测量)的表达水平。(注意,一种基因-TMEM199-分别出现在表1和3的真菌和病毒分类器中,尽管在真菌分类器中具有负系数(权重)且在病毒分类器中具有正系数(权重)。基因组参考:Homo sapiensGRCh38,版本96,于2019年6月15日下载自:ttp.ensembl.org/pub/release-96/fasta/homo_sapiens/dna/。转录本参考:Homo sapiens GRCh38,版本96,此处下载自:ftp.ensembl.org/pub/release-96/gtf/homo_sapiens/。例如,分类器可包括表1至5中列出的基因中的1、5、10、15或20至30、40、50、60或70种基因的表达水平。
例如,真菌分类器可以包括表1中列出的基因中的3、5、8、10、12、15、18、20、25或全部29种;细菌分类器可以包括表2中列出的基因中的3、5、8、10、12、15或全部18种;病毒分类器可以包括表3中列出的基因中的3、5、8、1 0、12、15、18或全部19种;SIRS分类器可以包括表4中列出的基因中的3、5、8、10、12、15、18或全部19种;和/或健康分类器可以包括表5中列出的基因中的3、4、5、6、7、8、9或全部10种。
在实施本公开教导的方法中可以包括这些分类器中的一种或多种,包括但不限于:仅真菌分类器;真菌分类器和细菌分类器;真菌分类器和病毒分类器;真菌、细菌和病毒分类器;真菌和非传染性疾病(SIRS)分类器;真菌和健康分类器;真菌、SIRS和健康分类器;真菌、细菌、病毒和SIRS分类器;真菌、细菌、病毒和健康分类器;以及真菌、细菌、病毒、SIRS和健康分类器。作为一个实例,方法可以包括使用真菌分类器和细菌分类器以确定是否存在真菌和细菌感染。作为另一个实例,方法可以包括使用真菌分类器和SIRS分类器以确定受试者中是否存在真菌感染和非传染性疾病。作为另一个实例,方法可以包括使用真菌分类器、细菌分类器和SIRS分类器以确定受试者中是否存在真菌感染、细菌感染和非传染性疾病。
本公开的另一个方面提供了根据本公开的方法制备的真菌、病毒、细菌和/或对照分类器,其中所述分类器包括表6至10中列出的基因(可测量,例如用与所述基因同源的寡核苷酸探针可测量)中的5、10、15、20、25、30、或全部33种的表达水平。与表1至5的分类器实例重叠的基因以粗体突出显示。
本公开的另一个方面提供了根据本公开的方法制备的真菌、病毒、细菌和/或对照分类器,其中分类器包括表6至10中粗体列出的基因的表达水平。也就是说,真菌分类器包括ITGA2B、MKI67和AZU1(各自具有正系数);细菌分类器包括HDAC4、DCAF15、SDHC、SAP30L和DNASE1(各自具有正系数)和DCAF15(具有负系数);病毒分类器包括PIGT、HERC6和LY6E(各自具有正系数);SIRS分类器包括SLC35E1、WIPI2、RELL1和MAP1LC3B2(各自具有正系数)以及CASZ1和GABBR1(各自具有负系数);健康分类器包括RPS24(具有正系数)和CTSB(具有负系数)。
如上所示,在实施本公开教导的方法中可以包括这些分类器中的一种或多种,包括但不限于:仅真菌分类器;真菌分类器和细菌分类器;真菌分类器和病毒分类器;真菌、细菌和病毒分类器;真菌和非传染性疾病(SIRS)分类器;真菌和健康分类器;真菌、SIRS和健康分类器;真菌、细菌、病毒和SIRS分类器;真菌、细菌、病毒和健康分类器;以及真菌、细菌、病毒、SIRS和健康分类器。作为一个实例,方法可以包括使用真菌分类器和细菌分类器以确定是否存在真菌和细菌感染。作为另一个实例,方法可以包括使用真菌分类器和SIRS分类器以确定受试者中是否存在真菌感染和非传染性疾病。作为另一个实例,方法可以包括使用真菌分类器、细菌分类器和SIRS分类器以确定受试者中是否存在真菌感染、细菌感染和非传染性疾病。
在一些实施方案中,这些识别标志的使用可以以高度准确性一次鉴定多种不同的疾病病因(真菌感染,诸如念珠菌血症、细菌感染、病毒感染、非传染性疾病(“SIRS”)和/或健康)。例如,在一些实施方案中,所述病因具有至少0.90、诸如至少0.91、至少0.92、至少0.93、至少0.94、至少0.95、至少0.96、至少0.97、至少0.98、或至少0.99;或至少0.80、诸如至少0.81、至少0.82、至少0.83、至少0.84、至少0.85、至少0.86、至少0.87、至少0.88或至少0.89的接受者操作特征下面积(auROC或ROC),其是受试者将具有准确分配的病因的概率。如本领域已知,0.80的auROC意味着将在80%的时间做出正确的分配,且高于0.80的auROC被认为是分类器的优秀性能。
本发明的一个方面是用于将受试者分类的方法,其包括:(a)从所述受试者获得生物样品;(b)在平台上测量指示所述生物样品中真菌感染、和任选地,细菌感染、病毒感染、健康和/或非传染性疾病中的一种或多种的识别标志,所述识别标志包括预定义的一组基因的基因表达水平;(c)将所述基因表达水平输入真菌分类器、和任选地,选自细菌感染分类器、病毒分类器和对照分类器(健康和/或非传染性疾病)的一种或多种额外分类器,所述一种或多种分类器包括所述平台的预定义的一组基因的所述基因中的每一个的预定义的加权值(即系数);和(d)基于所述基因表达水平和一种或多种分类器,将所述受试者分类为患有真菌感染、和/或细菌感染、病毒感染或对照。在一些实施方案中,所述方法包括将所述基因表达水平归一化以生成归一化的基因表达值;且所述输入包括将归一化的基因表达值输入一种或多种分类器中;且所述分类包括基于所述归一化的基因表达值和一种或多种分类器计算真菌感染、和任选地,细菌感染、病毒感染或对照的概率。在一些实施方案中,所述方法进一步包括生成为所述受试者赋予表明真菌感染、和任选地,细菌感染、病毒感染、健康和/或非传染性疾病的概率的评分的报告。在一些实施方案中,所述方法进一步包括:(e)基于分类向所述受试者施用适当的疗法。
本公开的另一个方面提供了用于在患有真菌感染(诸如念珠菌血症)或处于其风险中的受试者中诊断和/或治疗真菌感染(诸如念珠菌血症)的方法,其包括以下,由以下组成,或基本上由以下组成:(a)从所述受试者获得生物样品;(b)在平台上测量生物样品中预定义的一组基因(即识别标志)的基因表达水平;(c)任选地将所述基因表达水平归一化以生成归一化的基因表达值;(d)将归一化的基因表达值输入选自细菌感染分类器、病毒分类器、真菌分类器和/或对照分类器的一种或多种分类器,所述一种或多种分类器包括所述平台的预定义的一组基因的所述基因中的每一个的预定义的加权值(即系数),任选地其中所述一个或多个分类器是从一个或多个数据库获取的;(e)基于所述归一化的基因表达值和一个或多个分类器计算细菌、病毒和真菌和/或对照中的一种或多种的概率,从而确定受试者中是否存在真菌感染、诸如念珠菌血症,或受试者发生此类真菌感染的可能性;和(f)任选地,施用适当的疗法。
在一些实施方案中,所述方法进一步包括生成为受试者赋予表明真菌感染、诸如念珠菌血症的概率的评分的报告。
在一些实施方案中,预定义的一组基因包括表1至5中列出的基因中的5、10、15、20、25或30至50、60、70、80、90或全部94种的表达水平。例如,所述分类器可以包括表1至5中列出的基因中的1、5、10、15或20至30、40、50、60或70种基因的表达水平。
作为实例,预定义组可以以任何组合包括表1中列出的基因中的3、5、8、10、12、15、18、20、25或全部29种;和任选地,表2中列出的基因中的3、5、8、10、12、15或全部18种;表3中列出的基因中的3、5、8、10、12、15、18或全部19种;表4中列出的基因中的3、5、8、10、12、15、18或全部19种;和/或表5中列出的基因中的3、4、5、6、7、8、9或全部10种。
作为另一个实例,预定义的基因列表可以包括表6至10中列出的基因中的5、10、15、20、25、30或全部33种的表达水平。作为进一步实例,预定义的基因列表可以包括表6至10中粗体列出的基因的表达水平。
在一些实施方案中,所述生物样品选自外周血、痰液、鼻咽拭子、鼻咽洗液、支气管肺泡灌洗液、气管内抽吸物、脑脊液、尿液和它们的组合。在某些实施方案中,所述生物样品包括外周血样品。在某些实施方案中,所述生物样品包括支气管肺泡灌洗液。
参照图5,根据在本文所述的多个实施方案,可以在平台中或通过平台使用分类系统和/或计算机程序产品1100。分类系统和/或计算机程序产品1100可以作为一种或多种企业、应用、个人、普及和/或嵌入式计算机系统体现,其可操作以使用软件、固件和/或硬件的任何适合组合来接收、传输、处理和存储数据并且可以是独立的和/或通过任何常规、公共和/或私人、真实和/或虚拟、有线和/或无线网络(包括被称为互联网的全球通信网络的全部或一部分)互相连接,并且可以包括多种类型的有形的、非瞬时性计算机可读介质。
如图5中所示,分类系统1100可以包括处理器子系统1140,其包括一个或多个中央处理单元(CPU),在其上运行一个或多个操作系统和/或一个或多个应用程序。尽管显示了一个处理器1140,但应理解的是,可以存在多个处理器1140,其可以是互相电连接的或分开的。一个或多个处理器1140被配置成执行来自存储器设备如存储器1150的计算机程序代码,以进行在本文所述的操作和方法中的至少一些,并且可以是任何常规的或特殊目的的处理器,包括但不限于数字信号处理器(DSP)、现场可编程门阵列(FPGA)、专用集成电路(ASIC)、和多核处理器。
存储器子系统1150可以包括存储器设备层,诸如随机存取存储器(RAM)、只读存储器(ROM)、可擦除可编程只读存储器(EPROM)或闪存、和/或任何其他固态存储器设备。也可以提供存储回路1170,其可以包括,例如便携式计算机软盘、硬盘、便携式光盘只读存储器(CDROM)、光学存储设备、磁存储设备和/或任何其他类型的基于光盘或磁带的存储子系统。存储回路1170可以为分类系统1100提供数据/参数/分类器的非易失性存储。存储回路1170可以包括磁盘驱动器和/或网络存储组件。存储回路1170可以用于存储待执行的代码和/或待被处理器1140存取的数据。在一些实施方案中,存储回路1170可以存储数据库,所述数据库提供对分类系统1110使用的数据/参数/分类器诸如识别标志、权重、阈值等的访问。存储回路1170可以利用一种或多种计算机可读介质的任何组合。计算机可读介质可以是计算机可读信号介质或计算机可读存储介质。计算机可读存储介质可以是,例如,但不限于电子、磁、光学、电磁、红外、或半导体系统、装置、或设备,或前述的任何合适的组合。计算机可读存储介质的更具体的实例(非穷举列表)将包括以下:便携式计算机软盘、硬盘、随机存取存储器(RAM)、只读存储器(ROM)、可擦除可编程只读存储器(EPROM或闪存)、便携式光盘只读存储器(CD-ROM)、光学存储设备、磁存储设备、或前述的任何适合的组合。如本文所用,计算机可读存储介质可以是任何有形介质,其可以含有或存储被指令执行系统、装置、或设备使用的或与指令执行系统、装置、或设备相关的程序。
输入/输出回路1160可以包括显示器和/或用户输入设备,诸如键盘、触摸屏和/或指针设备。可以使用与输入/输出回路1160连接的设备以通过分类系统1100的用户为处理器1140提供信息。与输入/输出回路1160连接的设备可以包括网络或通讯控制器、输入设备(键盘、鼠标、触摸屏等)和输出设备(打印机或显示器)。输入/输出回路1160也可以提供与设备诸如显示器和/或打印机的接口,可以将分类系统1100的操作的结果通信至所述显示器和/或打印机从而提供给分类系统1100的用户。
可以包括任选的升级回路1180作为用于为分类系统1100提供升级的接口。升级可以包括针对由处理器1140执行的在存储器1150和/或存储回路1170中存储的代码的升级。通过升级回路1180提供的升级还可以包括针对与维护分类系统1100的信息诸如识别标志、权重、阈值等的数据库和/或其他数据存储形式有关的存储回路1170的部分的升级。
分类系统1100的样品输入回路1110可以为如上文所述的平台提供接口以接收待分析的生物样品。样品输入回路1110可以包括机械元件以及电元件,其接收由用户向分类系统1100提供的生物样品并且运输在分类系统1100和/或平台内待处理的生物样品。样品输入回路1110可以包括鉴定用于鉴定样品和/或测试顺序形式的带条形码容器的条形码读取器。样品处理回路1120还可以处理在分类系统1100和/或平台内的生物样品以制备用于自动分析的生物样品。样品分析回路1130可以自动分析被处理的生物样品。样品分析回路1130可以用于利用向分类系统1100提供的生物样品测量例如预定义的一组基因的基因表达水平。样品分析回路1130也可以通过将基因表达水平归一化来生成归一化的基因表达值。样品分析回路1130可以从存储回路1170中获取真菌感染分类器,以及任选地,病毒感染分类器、细菌感染分类器、非传染性疾病分类器和健康受试者分类器中的一种或多种。样品分析回路1130可以将归一化的基因表达值输入至所述分类器中。样品分析回路1130可以基于所述一种或多种分类器和对照输出值通过输入/输出回路1160计算针对真菌感染以及任选地还有病毒感染、细菌感染、非传染性疾病和健康受试者中的一种或多种的病因概率或可能性。
样品输入回路1110、样品处理回路1120、样品分析回路1130、输入/输出回路1160、存储回路1170、和/或升级回路1180可以至少部分地在分类系统1100的一个或多个处理器1140的控制下执行。如本文所用,在处理器1140的“控制下”执行意指由样品输入回路1110、样品处理回路1120、样品分析回路1130、输入/输出回路1160、存储回路1170、和/或升级回路1180执行的操作可以至少部分地通过处理器1140执行和/或引导,但是不排除单独电或机械自动化的那些组件的操作中的至少一部分。如本文所述,处理器1140可以通过执行计算机程序代码来控制分类系统1100的操作。
用于实施本公开的方面的操作的计算机程序代码可以以一种或多种编程语言的任何组合编写,包括面向对象的编程语言诸如Java、Scala、Smalltalk、Eiffel、JADE、Emerald、C++、C#、VB.NET、Python等,常规程序化编程语言诸如“C”编程语言、VisualBasic、Fortran 2003、Perl、COBOL 2002、PHP、ABAP,动态编程语言如Python、Ruby和Groovy,或其他编程语言。程序代码可以全部在分类系统1100上、部分在分类系统1100上、作为单机软件包、部分在分类系统1100上并且部分在远程计算机上或者全部在远程计算机或服务器上执行。在后一种情况中,远程计算机可以通过任何类型的网络连接至分类系统1100,包括局域网(LAN)或广域网(WAN),或者连接可以与外部计算机(例如,通过使用互联网服务提供商的互联网)或在云计算机环境中进行或者作为服务如软件作为服务(SaaS)提供。
在一些实施方案中,系统包括可以将定量或半定量的基因表达检测转化为真菌感染以及任选地还有病毒感染、细菌感染、非传染性疾病和健康受试者中的一种或多种的病因的累积评分或概率的计算机可读代码。
在一些实施方案中,系统是样品到结果的系统,并且组件被集成以使得用户可以简单地插入待测试的生物样品,并且一些时间后(优选短的时间量,例如多至30或45分钟,或多至1、2、或3小时,或多至8、12、24或48小时)从系统接收结果输出。
本公开的另一个方面提供了本文描述和举例说明的所有内容。
通过举例说明的方式而非限制的方式提供以下实施例。
实施例
实施例1.宿主对念珠菌血症的转录反应由中性粒细胞激活和血红素生物合成主导并支持新型诊断方法
A.方法
统计分析
用体外PBMC微阵列数据集进行额外的验证,所述数据集由健康人PBMC的病毒(流感)、细菌(大肠杆菌和肺炎链球菌)和真菌(白色念珠菌、新型隐球菌和格特隐球菌)感染组成。与Ramilo和Tsalik数据集类似,使用R Bioconductor包readAffy导入和处理CEL文件,使用gcrma进行归一化,并排除低表达探针(定义为在少于四个样品中检测到)和对照探针。微阵列探针标识符被映射至整体基因;数据被减少至映射到分类器基因列表的探针子集;并进行log2变换。此处应用发现分析中使用的相同正则化多项式建模、交叉验证程序和性能度量来估计不同基因表达平台上的分类器模型。
B.结果
i.研究群体
从2011年至2014年在杜克大学医学中心在首次血培养呈念珠菌属物种阳性时(初始血培养收集后最少2天),登记48个住院成人受试者,并对一小组患者进行连续采样。此外,我们还登记具有相似临床背景、但已证实具有急性呼吸道病毒感染、急性细菌(肺炎或菌血症)感染或临床判定为非传染性疾病的患者以及未感染的健康受试者(n=151,图1)。该研究包括来自各种临床背景的受试者,包括实体器官移植、干细胞移植、血液恶性肿瘤、ICU中使用中心静脉导管的患者等。鉴定了总共7种不同的念珠菌属物种,最常见的是白色念珠菌和光滑念珠菌。
表11.关于念珠菌血症受试者的临床信息
*两个受试者同时感染多于一种念珠菌属物种。
**九个受试者的医疗记录有限,且未记录体温。
ii发现和验证群组
受试者和对照被随机分为发现和验证组用于初步分析。发现群组和验证群组分别包括138个受试者和61个受试者(图1)。在发现群组中,23个受试者被判定为在没有其他类型感染的情况下具有念珠菌属物种的血流感染。包括35个具有证实的细菌感染的受试者和48个具有证实的病毒感染的受试者(均为单一微生物)作为对照。此外,由于患者在临床上也可能呈现急性非传染性疾病,因此包括17个具有急性非传染性疾病(标记为全身炎性反应综合征(SIRS))的受试者。在验证群组中,存在25个具有念珠菌血症的受试者,以及10个具有证实的细菌感染的受试者和11个具有证实的病毒感染的受试者(均为单一微生物)。每个群组中还包括15个健康受试者作为对照-健康对照的平均年龄在发现数据集中为20.9岁,且在验证数据集中为33.5岁。发现群组中65%的念珠菌血症受试者和验证群组中80%的念珠菌血症受试者在初次采样时接受抗真菌治疗。
iii.对念珠菌血症的转录反应是稳健的并揭示了抗真菌防御机制。
念珠菌血症在人类宿主中触发了强烈的转录组反应,与健康对照相比,1,641种基因差异上调。这些上调的基因对应于宿主对真菌感染的免疫反应的已知组分,包括先天免疫反应、对真菌的防御反应、白细胞迁移和对酵母的反应。其他应激相关的途径包括对细胞因子的反应、炎性反应、对氧化应激的细胞反应以及血红素合成和铁代谢的宿主调节。存在2,316种下调基因,其聚类在免疫过程、诸如适应性免疫反应、免疫反应调节、B细胞增殖、体液免疫反应、免疫球蛋白产生和T细胞共刺激。为了进一步阐明转录组反应如何定义宿主中的活性生物途径,进行加权基因共表达网络分析(WGCNA)来鉴定相比于健康对照的与念珠菌血症相关的相关基因簇。念珠菌血症中显著上调的簇包括免疫激活和炎症的途径,包括先天免疫反应和中性粒细胞激活、迁移和脱粒。
iv.与其他感染触发物相比,对念珠菌血症的转录反应是独特的。
除了健康对照之外,还在对念珠菌血症以及急性细菌和病毒感染以及非感染性SIRS的转录组反应之间进行单变量比较。尽管在感染表型中观察到一些保守的宿主反应组分,但与所有其他感染相比,在念珠菌血症期间也有342种(12%)基因存在独特的差异表达。当检查念珠菌的基因与其他临床表型相比的差异表达时,最大的区别出现在念珠菌血症和细菌感染之间(2,407种独特基因),随后为病毒感染和SIRS(分别为740种和149种基因)(图2A-2B)。这突出了与其他类别的感染相比,对念珠菌血症的转录反应具有独特的特征。有趣的是,当将对念珠菌血症的转录组反应与其他病原体类别的转录组反应进行比较时,念珠菌血症中上调的顶级基因再次聚类至权重偏向中性粒细胞激活和血红素生物合成的途径中,进一步突出了真菌感染期间这些反应的强度。
v.多项基因表达分类器区分念珠菌血症与病毒或细菌感染。
接下来使用正则化多项逻辑回归分析来确定在每组感染受试者的样品中最一致地共同调节的一组基因(“识别标志”)。对于念珠菌感染,先前在小鼠模型中的工作表明,基因表达识别标志可以区分早期和晚期侵袭性念珠菌病,并且信号强度随着时间而下降。因此,为了开发诊断分类器,我们仅利用在初始血培养阳性后(中值5天,范围2-23天)对每个念珠菌受试者获得的第一份RNA样品。所有其他急性感染表型每次发作时每个受试者只有一份RNA样品,所述样品在其各自感染初次呈现时采集。
用所有感染类别的auROC和混淆矩阵评价模型性能。所有性能量度均交叉验证。鉴定94-基因分类器,其可以准确地区分念珠菌血症、细菌性、病毒性、SIRS和健康表型。(图3)念珠菌血症的AuROC为0.98(95%CI0.96-1),细菌和病毒感染的AuROC为0.99(95%CI0.98-1),SIRS的AuROC为0.99(95%CI 0.97-1),且健康受试者的AuROC 为0.99(95%CI0.96-1)(图4,补充表7)。然后,使用从发现群组得出的识别标志来预测验证数据集中的感染类别。计算每类auROC和混淆矩阵。验证群组中的性能同样好:念珠菌血症的auROC为0.97(95%CI 0.90-1),且细菌感染(95%CI 1-1)、病毒感染(95%CI 1-1)和健康受试者(95%CI 0.99-1)的auROC为1。
vi.念珠菌血症的基于血液的基因表达识别标志在疾病高峰时表达最大,并随着时间强度降低。
一旦鉴定念珠菌特异性诊断识别标志,就试图检查信号强度随时间的变化,因为区分早期和晚期疾病以及定义对治疗的反应可能对患者的临床护理、治疗选项和预后具有影响。总共28个念珠菌血症受试者在培养呈阳性后超过一个日期(more than one date)采集了样品,每个受试者范围为2至14个样品。从初始培养起2至80天收集样品。当比较这些受试者的识别标志中基因表达的定量水平时,我们发现具有孤立性念珠菌血症的受试者中信号强度的总体趋势从第一个时间点到最后一个时间点下降。然而,受试者之间的定量信号强度和消散时间存在显著差异。定量基因表达和阳性血液培养起的天数之间观察到预期的负相关性(ρ=-0.441,p=.0009)。在可获得适当样品的几个受试者中,随着治疗时间推移,由识别标志得出的预测念珠菌血症的概率降低,并且最终,一旦念珠菌血症消退,模型就最终预测那些受试者是健康的。
鉴于该数据集的独特性以及缺乏关于念珠菌病受试者的公共基因表达数据,为了验证,我们接下来将分类器应用于来自患有急性细菌和病毒性疾病的人类受试者的两个独立基因表达数据集(Ramilo等人和Tsalik等人)(图4)。当应用于Ramilo等人数据集时,新型分类器表现良好,auROC为0.97(0.95%CI 0.94-1)。当应用于Tsalik等人数据集时,细菌感染的auROC为0.87(95%CI 0.80-0.93),病毒感染的auROC为0.88(95%CI 0.82-0.92),且非感染性疾病的auROC为0.89(95%CI 0.84-0.94)。
接下来,将念珠菌血症结果与来自体外刺激测定的基因表达数据进行比较,其中从健康个体分离外周血单核细胞(PBMC),且然后暴露于来自多种类别的病原体。在该模型中,然后在暴露后24小时收获细胞,以分析实验性病毒(流感)、细菌(肺炎链球菌或大肠杆菌)和真菌(白色念珠菌或新型隐球菌或格特隐球菌)感染期间的转录组反应。然后将人类念珠菌血症分类器应用于这些数据,其中其准确地鉴定相关病原体暴露-真菌感染的auROC为0.94(95%CI 0.88-0.99),细菌感染的auROC为0.96(95%CI 0.89-1),病毒感染的auROC为0.90(95%CI 0.69-1),且健康对照细胞的auROC为0.94(95%CI 0.86-0.99)(图4)。
vii.与BDG的比较
接下来试图将血清BDG水平的诊断准确性与新型转录组生物标志物识别标志进行比较。第一次血培养呈念珠菌血症阳性时BDG的平均水平为246pg/mL±192(范围<31至>500),其没有显著高于最后一次BDG的平均值235pg/mL±189(范围<31至>500,p=0.85)。连续BDG测量显示,只有43%(13/30)的受试者响应于治疗而具有递减的BDG值,且下降率变化很大。总体BDG auROC为0.90(95%CI 0.80-.97)。当分解为发现和验证群组时,基因表达分类器的念珠菌血症组分具有比BDG更高的性能特征,尽管该结果在统计上不显著。基因表达的发现auROC为1(95%CI 1-1),相比之下BDG为0.98(95%CI 0.94-1)(p=0.39),基因表达的验证auROC为0.94(95%CI 0.81-1),相比之下,BDG为0.83(95%CI 0.63-0.97)(p=0.35)。发现BDG水平与阳性血培养起的天数呈中度负相关(ρ=-0.29,p=0.05),并且与定量基因表达轻度相关(ρ=0.258,p=0.084)。
C.讨论
目前有多种基于病原体的念珠菌血症诊断方式,但经常因获得结果的时间延迟和/或敏感性和特异性欠佳而受到阻碍。宿主来源的生物标志物方法提供了填补关键诊断领域的潜力,包括一次快速(甚至是护理点)检测多种病原体类别,以及通过鉴定病理宿主反应来提高特异性。在这项工作中,我们首次定义了宿主对念珠菌血症的反应,如通过循环白细胞中的转录组的镜头所看到的。这使得宿主识别标志的开发能够区分急性真菌感染与也可能在高危宿主中引起类似的急性疾病的病毒、细菌和SIRS表型。
与其他病原体类别相比,宿主对念珠菌感染的反应既有共同的特征,又有独特的特征,并且这体现在外周血中的转录水平上。在念珠菌血症存在的情况下发现了超过1,600种与健康对照相比差异表达的基因(DEG)。这些DEG中的许多反映了对真菌感染或危重疾病的免疫反应的已知组分,诸如(while such)细胞因子信号传导、炎性反应和细胞对氧化应激的反应。已知一些如中性粒细胞激活和迁移在抗真菌防御中发挥作用,但即使当与具有急性细菌感染的类似疾病受试者相比时,这些反应的强度也令人惊讶,并突出了这些途径在清除念珠菌属物种方面的关键重要性。其他丰富的途径鉴定了对念珠菌感染的潜在新型的宿主反应机制,诸如血红素合成调节的改变。尽管已知铁在体外对于真菌病原体、诸如念珠菌至关重要,但结果表明人类宿主可能操纵该系统作为对真菌感染反应的一部分。
通过多项逻辑回归分析,我们鉴定了统一的识别标志,其可以高度准确性一次模拟宿主对多种不同疾病病因的反应(对于念珠菌血症,auROC 0.98)。该分类器的念珠菌血症组分的表现好于护理标准诊断BDG测试。重要的是,尽管超过70%的群组在初始测试时正在接受积极的经验性抗真菌治疗(这是一种常见的临床方法,其损害许多传统的病原体检测策略(诸如血培养)),但念珠菌血症识别标志表现出稳健的性能。此外,该分类器在各种各样的典型临床背景(包括中性粒细胞减少症和多种类型的免疫抑制)以及7种不同的念珠菌属物种中均表现良好。这里呈现的多项式方法的另一个优点是,单次测试可以同时告知多种病况(即真菌、细菌、病毒、SIRS、健康)的诊断。
该研究的一个限制是,尽管计算机芯片上和体外验证数据支持普遍性,但这是一项单中心研究,并且一旦有额外的群组/数据集,将需要在其他念珠菌血症群体中进行验证。尽管群组是多样化的,但相对小的念珠菌血症样品量限制了亚组分析,并且将有必要对更大组的中性粒细胞减少症和其他类型的免疫功能低下患者进行进一步工作。此外,研究设计限制了我们在念珠菌感染期间早期(此时治疗可能是最有效的)鉴定测试性能的能力,因为受试者直到他们的血培养转为阳性后才登记。尽管该研究定义了转录组识别标志用于诊断念珠菌血症的性能,但尚不清楚这种识别标志如何在其他真菌疾病(诸如侵袭性霉菌感染)中发挥作用或受到其他真菌疾病(诸如侵袭性霉菌感染)的影响。最后,该研究没有直接评估识别标志在无念珠菌血症的侵袭性念珠菌病(食道、腹部等)的病例中的性能,因此需要正式探索这些感染中的信号强度和效力。
D.结论
住院成人对念珠菌血症的宿主反应是高度保守的,并且与对急性病毒和细菌感染的转录组反应不同。能够操作本文证明的大小的基于PCR的识别标志的临床就绪平台已经存在,为这些发现的临床应用提供了接近的途径。利用这些病原体类别特异性反应可以更好地理解人类宿主中的真菌感染的免疫发病机制,并有望开发基于宿主基因表达的测定法,以同时区分急症疾病患者中的多种类型的临床疾病。
实施例2.真菌分类器在隐球菌感染中的性能
如上文实施例1中所示,我们将念珠菌血症结果与来自体外刺激测定的基因表达数据进行比较,其中从健康个体分离外周血单核细胞(PBMC),且然后暴露于来自多种类别的病原体。在该模型中,然后在暴露后24小时收获细胞,以分析实验性病毒(流感)、细菌(肺炎链球菌或大肠杆菌)和真菌(白色念珠菌或新型隐球菌或格特隐球菌)感染期间的转录组反应。然后,我们将人类念珠菌血症分类器应用于这些数据,并且其准确地鉴定了相关的病原体暴露-真菌感染的auROC为0.94(95%CI 0.88-0.99),细菌感染的auROC为0.96(95%CI0.89-1),病毒感染的auROC为0.90(95%CI 0.69-1),且健康对照细胞的auROC为0.94(95%CI 0.86-0.99)(图4)。
为了进一步阐明在念珠菌和隐球菌之间识别标志性能的区别,我们检查了激动剂水平下的预测概率和混淆矩阵。我们观察到在念珠菌和隐球菌之间没有统计上显著差异(ANOVA F检验p值=0.2866)。
因此,用念珠菌感染样品训练的真菌分类器能够鉴定其他真菌感染、诸如来自隐球菌的那些,这支持其更普遍地用于鉴定真菌感染。
实施例3.额外的实例分类器
使用相同的lasso逻辑回归与用于生成完整模型的嵌套交叉验证程序来生成大小减小的基因表达识别标志,如上面实施例1中所述,并进行一处修改:指定lasso模型,使得模型中的特征或基因的最大数量为40。所得的分类器呈现于表12中。
表12.大小减小的分类器
如上所示,大小减小的基因识别标志是使用与实施例1中报道的相同的过程新创建的,但对所涉及的基因数量有限制。这可能会导致识别标志之间的基因的一些变化。因此,它不仅仅是原始识别标志的子集,尽管一些基因确实出现在两者中。
本领域技术人员将会容易理解,本公开非常适用于实施对象并且获得所提及的结果和优点,以及在其中固有的那些。在本文所述的本公开代表优选的实施方案,其为示例性的,并且并非意欲作为本公开的范围的限制。对本领域技术人员来说,将会想到其变化和其他用途,如由权利要求的范围所限定的,它们包括在本公开的精神内。
不承认任何参考文献,包括本说明书中引用的任何非专利或专利文件,构成现有技术。具体而言,应理解,除非另有说明,否则对本文任何文件的引用并不构成承认这些文件中的任一者形成美国或任何其他国家的本领域公知常识的一部分。对参考文献的任何讨论都说明了其作者的主张,并且申请人保留挑战本文引用的任何文件的准确性和相关性的权利。除非另有明确说明,否则本文引用的所有参考文献均通过引用完全并入。如果在引用的参考文献中发现的任何定义和/或描述之间存在任何差异,则以本公开内容为准。
以上是说明本发明的,而不应被解释为限制本发明。本发明由以下权利要求与其中包括的权利要求的等同方案所定义。
- 一种用于检测真菌感染的试剂组、试剂盒以及检测方法
- 抗体、其用途、药物组合物,包括真菌感染诊断方法、真菌感染诊断试剂盒和真菌感染治疗方法
- 一种用于检测真菌感染的试剂组、试剂盒以及检测方法
