一种基于同位素示踪技术结合高分辨质谱的精准代谢流分析TCA循环的方法
文献发布时间:2024-04-18 19:52:40
技术领域
本发明属于生物分析领域,涉及一种基于同位素示踪技术结合高分辨质谱的精准代谢流分析TCA循环的方法。
背景技术
自DNA被发现以来,人类对基因及其蛋白质产物的认知不断增加,生物领域的研究也在不断推进。在过去的十年里,随着肥胖症和代谢综合征的持续流行,人们对代谢组学的兴趣日益增加,代谢也逐渐在生物学的众多领域中占据主流地位。如今,越来越多的研究从代谢的角度进行分析。总体来说,随着代谢物测量技术(尤其是质谱)的不断进步,代谢组学具有深远的研究价值。
从细菌到人类,氧化代谢和合成代谢的核心都围绕着柠檬酸循环(TCA循环)的连续酶促反应,它是构成机体新陈代谢的基石。线粒体中有众多交错的反应节点,代谢物在这些节点上的交换、回补和分散反应会使得代谢流分析变得复杂化。代谢活动可以用单位时间的物质流量来量化即代谢通量,测量代谢物浓度不可等同于代谢物通量,目前的研究方法无法精确分析错综复杂的代谢反应中代谢物的通量。这可能是因为在代谢过程中,代谢物的积累不仅是由于产量的增加,也可能是由于消耗量的减少。例如,当从酵母中去除葡萄糖时,虽然糖酵解途径流入量减少,但流出量会急剧增加,糖酵解流量降低,此时流出量中代谢物浓度的增加与糖酵解流量的减少不匹配。由于代谢物水平和通量提供了更全面的信息,研究人员对代谢的全面理解最好通过综合分析两者来实现。
质谱分析方法具有同时测量标记和未标记的代谢物、提高灵敏度以及分析单个同位素异构体的潜力,在这里我们提出了一个全面直接的代谢流平台,通过一种基于同位素示踪技术结合高分辨质谱的精准代谢流方法跟踪分析糖酵解和TCA循环的连续反应中质量同位素标记的逐步位置特异性转移。其中,这项技术主要包括直接解卷积由
发明内容
要解决的技术问题:细胞线粒体中代谢产物的定量计算需要测定代谢反应之间的通量,由于存在众多交错的反应节点,代谢物在这些节点上的交换、回补和分散反应会使得同位素标记变得复杂化。然而,目前的分析方法无法精确检测错综复杂的代谢反应中同位素流向。发明人使用LC-MS/MS逐步分析在糖酵解和TCA循环反应中从葡萄糖到后续代谢物的同位素(
技术方案:本发明提供了一种基于同位素示踪技术结合高分辨质谱的精准代谢流分析TCA循环的方法,包括如下步骤:
(1)培养基的准备:
无糖培养基的制备方法为:在DMEM培养基(sigma-D5030)中加入0.1~2.0%BSA,12~30mM碳酸氢钠,5~15mM HEPES,用磁力搅拌子混匀,pH调至6.8~7.8;
高糖培养基(第一培养基)的制备方法为:在DMEM培养基(sigma-D5030)中加入0.1~2.0%BSA,12~30mM碳酸氢钠,5~15mM HEPES、1~25mM生糖底物(生糖底物为葡萄糖、乳酸、丙酮酸或谷氨酰胺),用磁力搅拌子混匀,pH调至6.8~7.8;其中,若细胞为肝细胞,则生糖底物为1~20mM乳酸和1~20mM丙酮酸,若细胞为胰岛细胞,则生糖底物为1~20mM葡萄糖和1~20mM谷氨酰胺;
配制好的培养基用0.22μM的滤膜过滤,加入0.1%的青链霉素混合液,在4℃保存;
13
配制好的培养基用0.22μM的滤膜过滤,并加入0.1%的青链霉素混合液,在4℃保存;
(2)细胞培养:
当细胞密度为80%时,将细胞消化,用完全培养基(80%高糖培养基+10%FBS)以5×10
*标记潜伏期的时间因细胞而异,进行初步猝灭时间过程研究后,以确定细胞达到同位素稳态的点;
(3)细胞猝灭:
在冰上预冷5mM HEPES、淬灭缓冲液(10~40%甲醇、0.1~1%甲酸、0.5~5mM氟化钠、1~2mM苯丙氨酸和50~150μM乙二胺四乙酸)和V型96孔板,细胞培养结束后,将96孔板放在冰上,快速吸取培养基,每个孔中加入2mL预冷(4℃)过的5mM HEPES清洗细胞,然后将其吸出,加入150μL冰冷的猝灭缓冲液,用刮刀刮干净培养基上的细胞后,迅速将细胞和猝灭缓冲剂混合物转移到冰上的96孔板,将96孔板用铝膜密封,使用20g的针头在每个孔上戳一个洞,将其储存在–80℃冰柜中过夜后,冻干;
(4)液质样品准备:
在进行质谱分析之前准备样品,将离心机预冷却至4℃,V型96孔板置于冰上,将冻干后的细胞粉末重悬在预冷过的50uL超纯水(含2~100μM牛磺酸)中,以4000r/min离心96孔板5min;将上清液转移至新的96孔板中,重复上述操作至少3次以确保上清液中没有沉淀物,将其转移至样品瓶中,为了进行质量控制,通过从每个孔中抽取2~3μL来创建一个混合样品孔;
(5)液相质谱分析
将单个标准品用50%1M HCl和50%甲醇溶解制成5mM储存液,实验当天用含25μM牛磺酸(内标)的超纯水梯度稀释至200/100/50/25/12.5/6.75/3.125/1.5625/0.78125μM的混合标准品来绘制标准曲线,10个样品分析完成后,分析一次混合样品孔;采用质谱多反应监测模式(MRM模式),对在稳定同位素
色谱柱:ACQUITY UPLC@HSS T3色谱柱,2.1mm×100mm,1.8μm;
流动相:A相:0.1%甲酸水溶液,和B相:0.1%甲酸乙腈溶液;
液相梯度程序为:0.0~0.5min,99%A;0.5~4.0min,99%~95%A;4.01~6.0min,99%A;
柱温:20~55℃;
样品池温度:4~10℃;
流动相流速:0.2~0.5mL/min;
进样量:1μL;
质谱检测使用质谱仪Xevo TQ-S在电喷雾电离源(ESI)负离子检测模式下进行,质谱分析方法的源参数如下:
负离子模式下毛细管电压:0.2~3.2kV;
锥孔电压和碰撞电压设置取决于每个代谢产物特定的MRM通道(如下表1所示);
脱溶气体流量:800~1200L/h;
温度:450~600℃;
锥孔气体流量:100~250L/h;
雾化器设置:5~10Bar;
在MRM模式下同时筛选母/子离子来收集数据,以上所有操作均由MassLynx软件控制;
表1
/>
/>
(6)液质数据背景校正
在MassLynx软件中导出峰面积数据,用每一个
(7)自然丰度校正
为了除去自然界中
I′(P
p:母离子中的碳总数;
d:子离子中的碳总数;
m:母离子中
n:子离子中
I:对应于母离子P从0→p和子离子D从0→d的峰面积;
k=0.11(自然界中
m-v≤p-d.;
(8)柠檬酸的去卷积
13
在破碎模式中,切去Cit的C1、C6或者C5、C6得到子离子,因为这两个碳原子包含了来自PC通路与PDH通路的信息,对失去两个碳原子的所有子离子去卷积,可得到Cit族的代谢流信息;
不带
一共有两种方式可以产生带两个标记的Cit[M+2]:一是从PDH途径产生的Cit
由方程式1和2可以解出:
Cit
Cit
同理,可以得出:
Cit
Cit
Cit
Cit
Cit
Cit
(9)异柠檬酸脱氢酶的校正
去卷积的过程假设了碳直接从Cit流向α-酮戊二酸(αKG),然而,由于异柠檬酸脱氢酶(ICDH)的存在,该反应是可逆的,αKG也会反向转化为Cit,而这种反向通量将影响Cit的同位素标记模式,这种ICDH的反向通量只会影响C6含有
以下方程式使用ΦAcCit校正每个Cit的Q1/Q3片段,以消除反向ICDH通量,消除反向通量的影响:
195/70
194/70
194/69
193/69
193/68
(10)质量同位素分析分布-计算乙酰辅酶A和草酰乙酸的同位素富集
如果已知丙酮酸(pyruvate)和AcCOA富集,则可以确定葡萄糖氧化和β-氧化对柠檬酸合酶(CS)使用的AcCOA的相对贡献,在正式实验中,研究人员可能很难直接测量AcCOA和OAA的线粒体基质池的分数富集,本发明可以通过质量同位素分布分析(MIDA)解决;
对于反应A+B→AB,如果两个底物都部分富集(FE
其中(*)表示存在可测量标签。
(A+A
若存在未标记的污染A’B’,则AB+AB
生成双标记产品(D
下列方程式29和30描述了单标记产品与双标记产品的比率:
求解上述方程式可得到FE的等式:
Cit是利用CS将AcCOA和OAA缩合后在线粒体基质中形成,质谱可以评估单个分子,所以可以从同位素家族的去卷积中可以确定D
[1,2-
13
(11)基于同位素稳态的代谢流速率比计算
稳态同位素分析可以确定在连续或串联的代谢反应之间是否存在未标记代谢物的显著净进入或交换,一个或多个代谢途径可能有生成产物的酶反应,比如AcCOA的形成主要来自PDH或脂肪酸或某些氨基酸的β-氧化;如果可以选择性标记其中一个途径(例如丙酮酸脱氢或丙酮酸羧化),则可以确定流入途径的碳的相对来源;微分方程可以用来描述由于代谢流入而引起的底物标记代谢物富集的变化率(流入率减去流出率);对于广义反应:
其中A是通过酶E
在代谢和同位素稳定状态下,
如果V
附图说明
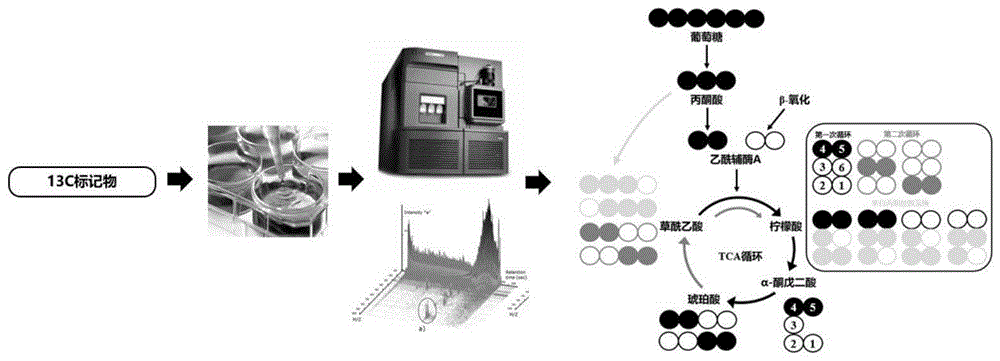
图1为本发明的实验流程,同位素标记细胞后进行液质分析,最后分析数据得到同位素的精准代谢流向;
图2为本发明对柠檬酸中碳原子的序号命名。
图3为本发明中柠檬酸去卷积的同位素异构体的母离子及子离子碎片表征;
图4为本发明实施例2中以乙酰辅酶A为中心的代谢通路,β氧化与丙酮酸脱氢酶途径流入乙酰辅酶A,而柠檬酸合酶途径则从乙酰辅酶A中流出的示意图;
图5为本发明实施例2中分别以葡萄糖氧化(左图)和V
图6为本发明实施例3中以草酰乙酸/苹果酸为中心的代谢通路,丙酮酸脱羧酶和柠檬酸合酶途径均流入草酰乙酸/苹果酸,而磷酸烯醇式丙酮酸羧激酶和柠檬酸合酶途径又流出草酰乙酸/苹果酸的示意图;
图7为本发明实施例3中不同葡萄糖浓度刺激下INS-1胰岛素分泌量变化(A)和Φ
具体实施方式
以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
实施例1
一种基于同位素示踪技术结合高分辨质谱的精准代谢流分析胰岛细胞中TCA循环的方法,包括如下步骤:
(1)培养基的准备:
无糖培养基的制备方法为:在DMEM培养基(sigma-D5030)中加入0.2%BSA,24mM碳酸氢钠,10mM HEPES,用磁力搅拌子混匀,pH调至7.4;
高糖培养基(第一培养基)的制备方法为:在DMEM培养基(sigma-D5030)中加入0.2%BSA,24mM碳酸氢钠,10mM HEPES、20mM葡萄糖,用磁力搅拌子混匀,pH调至7.4;
配制好的培养基用0.22μM的滤膜过滤,加入0.1%的青链霉素混合液,在4℃保存;
13
配制好的培养基用0.22μM的滤膜过滤,并加入0.1%的青链霉素混合液,在4℃保存;
(2)胰岛细胞培养:
当胰岛细胞密度为80%时,将胰岛细胞消化,用完全培养基(80%高糖培养基+10%FBS)以5×10
(3)细胞猝灭:
在冰上预冷5mM HEPES、淬灭缓冲液(20%甲醇、0.1%甲酸、3mM氟化钠、1mM苯丙氨酸和100μM乙二胺四乙酸)和V型96孔板,胰岛细胞培养结束后,将96孔板放在冰上,快速吸取培养基,每个孔中加入2mL预冷(4℃)过的5mM HEPES清洗胰岛细胞,然后将其吸出,加入150μL冰冷的猝灭缓冲液,用刮刀刮干净培养基上的胰岛细胞后,迅速将胰岛细胞和猝灭缓冲剂混合物转移到冰上的96孔板,将96孔板用铝膜密封,使用20g的针头在每个孔上戳一个洞,将其储存在–80℃冰柜中过夜后,冻干;
(4)液质样品准备:
在进行质谱分析之前准备样品,将离心机预冷却至4℃,V型96孔板置于冰上,将冻干后的胰岛细胞粉末重悬在预冷过的50ul超纯水(含25μM牛磺酸)中,以4000r/min离心96孔板5min。将上清液转移至新的96孔板中,重复上述操作至少3次以确保上清液中没有沉淀物,将其转移至样品瓶中,为了进行质量控制,通过从每个孔中抽取2.50μL来创建一个混合样品孔;
(5)液相质谱分析
将单个标准品用50%1M HCl和50%甲醇溶解制成5mM储存液,实验当天用含25μM牛磺酸(内标)的超纯水梯度稀释至200/100/50/25/12.5/6.75/3.125/1.5625/0.78125μM的混合标准品来绘制标准曲线,10个样品分析完成后,分析一次混合样品孔;采用质谱多反应监测模式(MRM模式),对在稳定同位素
色谱柱:ACQUITY UPLC@HSS T3色谱柱,2.1mm×100mm,1.8μm;
流动相:A相:0.1%甲酸水溶液,和B相:0.1%甲酸乙腈溶液;
液相梯度程序为:0.0~0.5min,99%A;0.5~4.0min,99%~95%A;4.01~6.0min,99%A;
柱温:35℃;
样品池温度:4℃;
流动相流速:0.4mL/min;
进样量:1μL;
质谱检测使用质谱仪Xevo TQ-S在电喷雾电离源(ESI)负离子检测模式下进行,质谱分析方法的源参数如下:
负离子模式下毛细管电压:2.50kV;
锥孔电压和碰撞电压设置取决于每个代谢产物特定的MRM通道(如下表1所示);
脱溶气体流量:1000L/h;
温度:550℃;
锥孔气体流量:150L/h;
雾化器设置:7.0Bar;
在MRM模式下同时筛选母/子离子来收集数据,以上所有操作均由MassLynx软件控制;
表1
/>
(6)液质数据背景校正
在MassLynx软件中导出峰面积数据,用每一个
(7)自然丰度校正
为了除去自然界中
I′(P
p:母离子中的碳总数;
d:子离子中的碳总数;
m:母离子中
n:子离子中
I:对应于母离子P从0→p和子离子D从0→d的峰面积;
k=0.11(自然界中
m-v≤p-d.;
(8)柠檬酸的去卷积
13
在破碎模式中,切去Cit的C1、C6或者C5、C6得到子离子,因为这两个碳原子包含了来自PC通路与PDH通路的信息,对失去两个碳原子的所有子离子去卷积,可得到Cit族的代谢流信息;
不带
一共有两种方式可以产生带两个标记的Cit[M+2]:一是从PDH途径产生的Cit
由方程式1和2可以解出:
Cit
Cit
同理,可以得出:
Cit
Cit
Cit
Cit
Cit
Cit
(9)异柠檬酸脱氢酶的校正
去卷积的过程假设了碳直接从Cit流向α-酮戊二酸(αKG),然而,由于异柠檬酸脱氢酶(ICDH)的存在,该反应是可逆的,αKG也会反向转化为Cit,而这种反向通量将影响Cit的同位素标记模式,这种ICDH的反向通量只会影响C6含有
以下方程式使用ΦAcCit校正每个Cit的Q1/Q3片段,以消除反向ICDH通量,消除反向通量的影响:
195/70
194/70
194/69
193/69
193/68
(10)质量同位素分析分布-计算乙酰辅酶A和草酰乙酸的同位素富集
如果已知丙酮酸(pyruvate)和AcCOA富集,则可以确定葡萄糖氧化和β-氧化对柠檬酸合酶(CS)使用的AcCOA的相对贡献,在正式实验中,研究人员可能很难直接测量AcCOA和OAA的线粒体基质池的分数富集,本发明可以通过质量同位素分布分析(MIDA)解决;
对于反应A+B→AB,如果两个底物都部分富集(FE
其中(*)表示存在可测量标签。
(A+A
若存在未标记的污染A’B’,则AB+AB
生成双标记产品(D
下列方程式29和30描述了单标记产品与双标记产品的比率:
求解上述方程式可得到FE的等式:
Cit是利用CS将AcCOA和OAA缩合后在线粒体基质中形成,质谱可以评估单个分子,所以可以从同位素家族的去卷积中可以确定D
[1,2-
13
(11)基于同位素稳态的代谢流速率比计算
稳态同位素分析可以确定在连续或串联的代谢反应之间是否存在未标记代谢物的显著净进入或交换,一个或多个代谢途径可能有生成产物的酶反应,比如AcCOA的形成主要来自PDH或脂肪酸或某些氨基酸的β-氧化;如果可以选择性标记其中一个途径(例如丙酮酸脱氢或丙酮酸羧化),则可以确定流入途径的碳的相对来源;微分方程可以用来描述由于代谢流入而引起的底物标记代谢物富集的变化率(流入率减去流出率);对于广义反应:
其中A是通过酶E
在代谢和同位素稳定状态下,
/>
如果V
实施例2
将上述提出的一种基于同位素示踪技术结合高分辨质谱的精准代谢流分析TCA循环的方法,用于探寻在胰岛素刺激的情况下,大鼠肌肉代谢底物偏好性与代谢速率比V
(1)大鼠的饲养
分组饲养250克雄性Sprague-Dawley大鼠(每笼3只),分为两组(对照组和胰岛素抵抗组),连续3周分别喂食正常饮食或高脂肪饮食。然后,所有大鼠在全身异氟醚麻醉下接受手术,将聚乙烯导管放置在颈总动脉(PE50管)和颈静脉(PE90管)中,将它们单独饲养。之后的1周,大鼠被分别喂食各自的饮食,之后进行研究。所有大鼠的体内研究均在16小时过夜禁食后进行。在每项研究结束时,大鼠通过静脉注射戊巴比妥安乐死。
(2)[U-
在所有研究中,同位素示踪剂([U-
为了测量基础禁食状态下的V
为了测量胰岛素刺激状态下的V
(3)液质样品制备
称取100mg大鼠骨骼肌样品,并加入0.1mmol牛磺酸(内标)。使用TissueLyser将样品在500ul冰冷的甲醇中均质化,并通过Nanosep过滤器过滤。
(4)液相质谱分析
将单个标准品用50%1M HCl和50%甲醇溶解制成5mM储存液,实验当天用含0.1mmol牛磺酸(内标)的超纯水梯度稀释至200/100/50/25/12.5/6.75/3.125/1.5625/0.78125μM的混合标准品来绘制标准曲线,10个样品分析完成后,分析一次混合样品孔;采用质谱多反应监测模式(MRM模式),对在稳定同位素
色谱柱:ACQUITY UPLC@HSS T3色谱柱,2.1mm×100mm,1.8μm;
流动相:A相:0.1%甲酸水溶液,和B相:0.1%甲酸乙腈溶液;
液相梯度程序为:0.0~0.5min,99%A;0.5~4.0min,99%~95%A;4.01~6.0min,99%A;
柱温:35℃;
样品池温度:4℃;
流动相流速:0.4mL/min;
进样量:1μL;
质谱检测使用质谱仪Xevo TQ-S在电喷雾电离源(ESI)负离子检测模式下进行,质谱分析方法的源参数如下:
负离子模式下毛细管电压:2.50kV;
锥孔电压和碰撞电压设置取决于每个代谢产物特定的MRM通道(如下表1所示);
脱溶气体流量:1000L/h;
温度:550℃;
锥孔气体流量:150L/h;
雾化器设置:7.0Bar;
在MRM模式下同时筛选母/子离子来收集数据,以上所有操作均由MassLynx软件控制;
表1
/>
(5)液质数据背景校正
在MassLynx软件中导出峰面积数据,用每一个
(6)自然丰度校正
为了除去自然界中
I′(P
p:母离子中的碳总数;
d:子离子中的碳总数;
m:母离子中
n:子离子中
I:对应于母离子P从0→p和子离子D从0→d的峰面积;
k=0.11(自然界中
m-v≤p-d.;
(7)代谢流速率比V
PDH将[U-
V
在稳定状态下,方程式1可以进一步简化并求解V
虽然真正的V
(8)关于速率比V
在代谢路径中,计算与代谢通路变化相关的V
如图5所示,为了验证在高脂诱导的胰岛素抵抗的大鼠中线粒体对于底物的偏好性是否发生改变,发明人给大鼠注射[U-
实施例3
将上述提出的一种基于同位素示踪技术结合高分辨质谱的精准代谢流分析TCA循环的方法,用于探寻目标代谢通路的变化与代谢速率比V
(1)培养基的准备:
无糖培养基的制备方法为:在DMEM培养基(sigma-D5030)中加入0.2%BSA,24mM碳酸氢钠,10mM HEPES,用磁力搅拌子混匀,pH调至7.4;
含有不同浓度葡萄糖(2.5、5、7或9mM)的培养基的制备方法为:在DMEM培养基(sigma-D5030)中加入0.2%BSA,24mM碳酸氢钠,10mM HEPES,4mM谷氨酰胺、0.05mM丙酮酸和0.45mM乳酸,最后分别加入2.5、5、7或9mM葡萄糖,用磁力搅拌子混匀,pH调至7.4;
配制好的培养基用0.22μM的滤膜过滤,加入0.1%的青链霉素混合液,在4℃保存;
含有不同浓度
配制好的培养基用0.22μM的滤膜过滤,并加入0.1%的青链霉素混合液,在4℃保存;
(2)胰岛细胞(INS-1)培养:
INS-1细胞最初在补充有葡萄糖(2.5、5、7和9mM)、谷氨酰胺(4mM)、丙酮酸(0.05mM)和乳酸(0.45mM)的DMEM培养基(D5030,Sigma-Aldrich)中预孵育3小时,在加入同位素标签之前达到代谢稳定状态。然后用不含葡萄糖的DMEM培养基洗涤它们,随后用2.5、5、7和9mM的[U-
(3)细胞猝灭:
在冰上预冷5mM HEPES、淬灭缓冲液(20%甲醇、0.1%甲酸、3mM氟化钠、1mM苯丙氨酸和100μM乙二胺四乙酸)和V型96孔板,INS-1细胞培养结束后,将96孔板放在冰上,快速吸取培养基,每个孔中加入2mL预冷(4℃)过的5mM HEPES清洗INS-1细胞,然后将其吸出,加入150μL冰冷的猝灭缓冲液,用刮刀刮干净培养基上的INS-1细胞后,迅速将INS-1细胞和猝灭缓冲剂混合物转移到冰上的96孔板,将96孔板用铝膜密封,使用20g的针头在每个孔上戳一个洞,将其储存在–80℃冰柜中过夜后,冻干;
(4)液质样品准备:
在进行质谱分析之前准备样品,将离心机预冷却至4℃,V型96孔板置于冰上,将冻干后的INS-1细胞粉末重悬在预冷过的50ul超纯水(含25μM牛磺酸)中,以4000r/min离心96孔板5min。将上清液转移至新的96孔板中,重复上述操作至少3次以确保上清液中没有沉淀物,将其转移至样品瓶中,为了进行质量控制,通过从每个孔中抽取2.50μL来创建一个混合样品孔;
(5)液相质谱分析
将单个标准品用50%1M HCl和50%甲醇溶解制成5mM储存液,实验当天用含25μM牛磺酸(内标)的超纯水梯度稀释至200/100/50/25/12.5/6.75/3.125/1.5625/0.78125μM的混合标准品来绘制标准曲线,10个样品分析完成后,分析一次混合样品孔;采用质谱多反应监测模式(MRM模式),对在稳定同位素
色谱柱:ACQUITY UPLC@HSS T3色谱柱,2.1mm×100mm,1.8μm;
流动相:A相:0.1%甲酸水溶液,和B相:0.1%甲酸乙腈溶液;
液相梯度程序为:0.0~0.5min,99%A;0.5~4.0min,99%~95%A;4.01~6.0min,99%A;
柱温:35℃;
样品池温度:4℃;
流动相流速:0.4mL/min;
进样量:1μL;
质谱检测使用质谱仪Xevo TQ-S在电喷雾电离源(ESI)负离子检测模式下进行,质谱分析方法的源参数如下:
负离子模式下毛细管电压:2.50kV;
锥孔电压和碰撞电压设置取决于每个代谢产物特定的MRM通道(如下表1所示);
脱溶气体流量:1000L/h;
温度:550℃;
锥孔气体流量:150L/h;
雾化器设置:7.0Bar;
在MRM模式下同时筛选母/子离子来收集数据,以上所有操作均由MassLynx软件控制;
表1
/>
(6)液质数据背景校正
在MassLynx软件中导出峰面积数据,用每一个
(7)自然丰度校正
为了除去自然界中
I′(P
p:母离子中的碳总数;
d:子离子中的碳总数;
m:母离子中
n:子离子中
I:对应于母离子P从0→p和子离子D从0→d的峰面积;
k=0.11(自然界中
m-v≤p-d.;
(8)柠檬酸的去卷积
13
在破碎模式中,切去Cit的C1、C6或者C5、C6得到子离子,因为这两个碳原子包含了来自PC通路与PDH通路的信息,对失去两个碳原子的所有子离子去卷积,可得到Cit族的代谢流信息;
不带
一共有两种方式可以产生带两个标记的Cit[M+2]:一是从PDH途径产生的Cit
由方程式1和2可以解出:
Cit
Cit
同理,可以得出:
Cit
Cit
Cit
Cit
Cit
Cit
(9)异柠檬酸脱氢酶的校正
去卷积的过程假设了碳直接从Cit流向α-酮戊二酸(αKG),然而,由于异柠檬酸脱氢酶(ICDH)的存在,该反应是可逆的,αKG也会反向转化为Cit,而这种反向通量将影响Cit的同位素标记模式,这种ICDH的反向通量只会影响C6含有
以下方程式使用ΦAcCit校正每个Cit的Q1/Q3片段,以消除反向ICDH通量,消除反向通量的影响:
195/70
194/70
194/69
193/69
193/68
(10)质量同位素分析分布-计算乙酰辅酶A和草酰乙酸的同位素富集
如果已知丙酮酸(pyruvate)和AcCOA富集,则可以确定葡萄糖氧化和β-氧化对柠檬酸合酶(CS)使用的AcCOA的相对贡献,在正式实验中,研究人员可能很难直接测量AcCOA和OAA的线粒体基质池的分数富集,本发明可以通过质量同位素分布分析(MIDA)解决;
对于反应A+B→AB,如果两个底物都部分富集(FE
其中(*)表示存在可测量标签。
(A+A
若存在未标记的污染A’B’,则AB+AB
生成双标记产品(D
下列方程式29和30描述了单标记产品与双标记产品的比率:
求解上述方程式可得到FE的等式:
/>
Cit是利用CS将AcCOA和OAA缩合后在线粒体基质中形成,质谱可以评估单个分子,所以可以从同位素家族的去卷积中可以确定D
[1,2-
13
(11)基于同位素稳态的代谢流速率比计算
稳态同位素分析可以确定在连续或串联的代谢反应之间是否存在未标记代谢物的显著净进入或交换,一个或多个代谢途径可能有生成产物的酶反应,比如AcCOA的形成主要来自PDH或脂肪酸或某些氨基酸的β-氧化;如果可以选择性标记其中一个途径(例如丙酮酸脱氢或丙酮酸羧化),则可以确定流入途径的碳的相对来源;微分方程可以用来描述由于代谢流入而引起的底物标记代谢物富集的变化率(流入率减去流出率);对于广义反应:
其中A是通过酶E
在代谢和同位素稳定状态下,
如果V
(12)代谢流速率比V
丙酮酸脱羧酶(PC)是一种线粒体酶,可将丙酮酸转化为草酰乙酸(OAA)(如图6)。从[U-
V
在稳定状态下,方程式4和5可以进一步简化并求解V
(13)INS-1细胞中胰岛素分泌的测定根据制造商的说明,使用大鼠高范围胰岛素ELISA试剂盒(ALPCO)测量培养基提取物的胰岛素浓度。使用索莱宝-BCA蛋白质测定试剂盒将所有培养基提取物标准化为细胞蛋白质浓度。
(14)速率比V
经实验验证,发明人发现代谢流速率比V
作为模型系统,胰腺β细胞将代谢中的葡萄糖依赖性变化与胰岛素分泌的功能输出联系起来。克隆胰岛素瘤细胞系INS-1已成为许多已发表实验的模式细胞,同时,在生理葡萄糖浓度(2.5~9mM)范围内胰岛素的释放量呈线性相关(如图7A)。发明人试图将代谢组学分析中代谢流速率比的变化与胰岛素分泌联系起来。其中,在线粒体代谢稳态过程中,只有葡萄糖浓度变化与PC到CS的相对通量(Φ
- 一种基于芯片纳升电喷雾质谱的稳定同位素标记代谢流的分析方法
- 一种基于芯片纳升电喷雾质谱的稳定同位素标记代谢流的分析方法
