一种电化学发光微乳液及生成方法、生成装置与应用
文献发布时间:2024-04-18 19:53:33
技术领域
本发明属于化学分析技术领域,尤其涉及一种电化学发光微乳液及生成方法、生成装置与应用。
背景技术
双乳液滴是由一种液滴以及内部包含的另一种与之不相溶的微小液滴组成,以双乳液滴为模板生成的核壳型、孔壳型、多腔室型功能微颗粒广泛应用于药物传输与控释、活性物质包封、化学催化以及生化分离等领域。制备所得材料性能主要取决于双乳液滴的结构,因此稳定高速的生成单分散双重乳液微滴是其应用的关键。应用微流控法生成的双乳液滴具有良好的单分散性、均一性和球形度,且具有高度可控性和原料利用率。
微流控法制备微液滴主要是利用互不相容的两种液体分别作为连续相和离散相,通过控制微管结构和两相流速比来控制液滴的生成。在固定体积流率的驱动泵的推动下,连续相和离散相分别进入不同的微通道,当两股流体在交叉点处相遇后,离散相流体继续延伸形成“塞状”或“喷射状”的液柱后在连续相流体的剪切和挤压作用下而被夹断,以微液滴的形式分散于连续相中。通常,微液滴的生成需要以足够大的作用力扰动连续相与分散相之间存在的界面张力。当待分散相某处施加的力大于其界面张力时,该处微量液体会突破界面张力进入连续相中形成液滴。在微尺度下,界面张力和液体黏度都起着非常重要的作用,其中最常用的调节手段就是加入不同的表面活性剂。
通过液滴微流控装置采集到的大小均匀且稳定的微乳液用于电化学生物检测,在此主要研究液滴碰撞,也称为纳米撞击法。纳米撞击法是一种电化学测量方法,涉及单个粒子在微电极上的随机碰撞和随后的法拉第电流瞬态。该方法起源于不溶性颗粒在甘汞电极上的碰撞。到目前为止,已经使用纳米撞击电化学方法对包括DNA、RNA、酶、细菌、囊泡和细胞在内的多种生物物种进行了研究。
纳米撞击法主要是当液滴与电极碰撞时,其成分在施加的电势下被氧化,从而产生电流尖峰信号。如果液滴中的成分是电化学发光体和共反应物,则后续反应会产生符合已报告ECL机制的光,从而允许使用电化学和ECL同时观察纳米和微米尺寸的液滴碰撞。将电位控制下的微电极浸入溶液中,溶液中自由扩散的分析物粒子将凭借其布朗运动与电极表面随机碰撞。可以通过感应各种电化学过程来识别电流信号。这种方法不需要复杂的仪器和操作,可以方便快捷地获取丰富的信息。
原发性肝癌(HCC)是最常见的原发性肝癌形式,是全球癌症相关死亡的主要原因之一。迫切需要早期和准确的HCC检测以实现有效的治疗和提高癌症存活率。蛋白质是特别有用的分子,可以作为血清生物标志物,因为它们往往是疾病的效应物,可以通过方便的非侵入性检测来诊断。甲胎蛋白(AFP)是最广泛使用的HCC临床诊断血清生物标志物,已被证明可以进行早期筛查,复发监测和预后估计。目前,已有多种分析技术,例如酶联免疫吸附试验酶联免疫吸附法(ELISA)、印迹法、和液相色谱-质谱法。纳米粒子碰撞电化学是近年来发展迅速的电分析方法,其基础是由布朗运动引起的单个纳米粒子与惰性超微电极的随机碰撞。
发明内容
本发明的目的在于针对现有技术的不足,提供一种电化学发光微乳液及生成方法、生成装置与应用。本发明的目的是通过以下技术方案来实现的:一种电化学发光微乳液,包括外相溶液;所述外相溶液包裹中间相溶液;所述中间相溶液包裹内相溶液;所述外相溶液、中间相溶液和内相溶液的体积比为4~20:1.25:1;所述外相溶液为含5wt%PVA的水溶液、矿物油或含2wt%tween 20的水溶液;所述中间相溶液为含2wt%氟表面活性剂的FC 40、含2wt%氟表面活性剂的HFE 7500或含15wt%甘油的水溶液;所述内相溶液为藻蓝素、胆绿素、中胆绿素或尿胆素。
进一步地,所述外相溶液、中间相溶液和内相溶液的体积比为8:1.25:1。
进一步地,所述内相溶液为藻蓝素。
一种上述的电化学发光微乳液的生成方法,包括以下步骤:
(1)配置外相溶液、中间相溶液和内相溶液;所述外相溶液为含5wt.%PVA的水溶液、矿物油或含2wt%tween 20的水溶液;所述中间相溶液为含2wt%氟表面活性剂的FC40、含2wt%氟表面活性剂的HFE 7500或含15wt%甘油的水溶液;
(2)将外相溶液、中间相溶液和内相溶液经过过滤和超声脱气处理;
(3)将中间相溶液和内相溶液混和,形成油包水单层乳液;
(4)将步骤(3)所形成的油包水单层乳液中通入外相溶液,形成水包油包水双层乳液,即电化学发光微乳液。
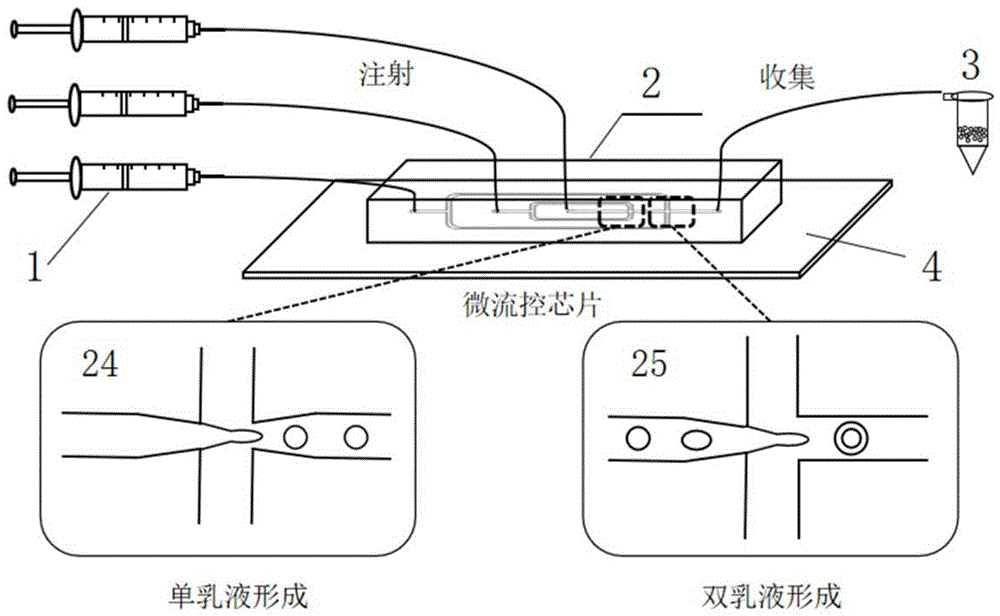
一种实现上述的生成方法的电化学发光微乳液生成装置,包括流体注射泵模块、微流控芯片、液滴收集装置和盖玻片;所述盖玻片上设置有微流控芯片;所述微流控芯片设置有外相通道入口、中间相通道入口、内相通道入口、第一个十字聚集结构、第二个十字聚集结构、通道出口;所述流体注射泵模块包括外相注射泵、中间相注射泵和内相注射泵,依次连接外相通道入口、中间相通道入口、内相通道入口;所述通道出口连接液滴收集装置;
所述第一个十字聚集结构设置有内相剪切口、单乳液生成口、中间相左侧剪切口和中间相右侧剪切口;所述内相剪切口和单乳液生成口进行了窄缩口处理;
所述第二个十字聚集结构设置有单乳液剪切口、双乳液生成口、外相左侧剪切口和外相右侧剪切口;所述单乳液剪切口进行了窄缩口处理。
进一步地,所述外相注射泵和外相通道入口的连接、中间相注射泵和中间相通道入口的连接、内相注射泵和内相通道入口的连接均是通过聚四氟乙烯微管来连接的。
进一步地,所述通道出口和液滴收集装置的连接是通过聚四氟乙烯微管来连接的。
上述的电化学发光微乳液在定量检测甲胎蛋白中的应用。本发明的有益效果是:
(1)本发明所搭建的微乳液生成平台能够快速且稳定的生成大小均一的水包油包水(W/O/W)双层乳液,该平台不仅能够高效生成藻蓝素及相关水溶性材料双乳液,而且能够实时观测双乳液生成状态,及时对流速进行调节。
(2)本发明采用具有光致发光性质的藻蓝素(PCB)作为研究对象,作为双乳液的内相,能够在电致化学发光平台中检测出较强的电流信号;
(3)本发明的微流控光学平台能够实时观察出双层乳液的包裹形态,可行性高;
(4)基于藻蓝素双乳液的碰撞ECL体系构建了免疫传感器检测样本中AFP含量,获得了0.05ng/mL到500ng/mL的线性范围,线性相关系数为0.99,与现有AFP检测试剂盒检测限相比,具有较低的检测限。
(5)本发明所构建的电化学发光微乳液生成平台,为软纳米粒子电化学碰撞提供了一种新的研究方向。附图说明为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
附图说明
图1为微流控芯片设计图;
图2为微流控通道装置示意图;
图3为微乳液生成系统图;
图4为双乳液明场显微图像(左图),双乳液荧光显微图像(右图),比例尺:100μm;
图5为双乳液粒径分布直方图;
图6为PCB双乳液的电化学循环伏安图;
图7为微乳液碰撞电化学强度图;
图8为藻蓝素(PCB)和藻蓝蛋白(CPC)的紫外光谱图;
图9为藻蓝素(PCB)和藻蓝蛋白(CPC)的荧光光谱图;
图10为甲胎蛋白(AFP)浓度和电致化学发光强度的关系曲线图。
具体实施方式
这里将详细地对示例性实施例进行说明,其示例表示在附图中。下面的描述涉及附图时,除非另有表示,不同附图中的相同数字表示相同或相似的要素。以下示例性实施例中所描述的实施方式并不代表与本发明相一致的所有实施方式。相反,它们仅是与如所附权利要求书中所详述的、本发明的一些方面相一致的装置和方法的例子。
在本发明使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本发明。在本发明和所附权利要求书中所使用的单数形式的“一种”、“所述”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。还应当理解,本文中使用的术语“和/或”是指并包含一个或多个相关联的列出项目的任何或所有可能组合。
应当理解,尽管在本发明可能采用术语第一、第二、第三等来描述各种信息,但这些信息不应限于这些术语。这些术语仅用来将同一类型的信息彼此区分开。例如,在不脱离本发明范围的情况下,第一信息也可以被称为第二信息,类似地,第二信息也可以被称为第一信息。取决于语境,如在此所使用的词语“如果”可以被解释成为“在……时”或“当……时”或“响应于确定”。
下面结合附图,对本发明进行详细说明。在不冲突的情况下,下述的实施例及实施方式中的特征可以相互组合。
实施例1:
一种电化学发光微乳液,外相溶液为5wt%PVA,中间相溶液为含2wt%氟表面活性剂的FC 40,内相溶液为0.1mM藻蓝素,将中间相溶液和内相溶液以体积比为1.25:1混合形成油包水单层乳液,再加入外相溶液形成电化学发光微乳液;其中,外相溶液和内相溶液以体积比为8:1。
在一些实施例中,藻蓝素的浓度是0.1-1Mm。
在一些实施例中,内相溶液为0.1-1Mm胆绿素、0.1-1Mm中胆绿素或0.1-1Mm尿胆素实施例2:
与实施例1不同的是,外相溶液为矿物油,中间相溶液为含2wt%氟表面活性剂的HFE7500,内相溶液为0.1-1Mm胆绿素,外相溶液、中间相溶液和内相溶液的体积比为4:1.25:1。
实施例3:
与实施例1不同的是,外相溶液为含2%的tween 20,中间相溶液为含15wt%甘油的水溶液,内相溶液为0.1-1Mm中胆绿素,外相溶液、中间相溶液和内相溶液的体积比为20:1.25:1。
实施例4:
与实施例1不同的是,内相溶液为尿胆素。
实施例5:
如图1所示,本发明的一种电化学发光微乳液生成装置,包括流体注射泵模块1、微流控芯片2、液滴收集装置3和盖玻片4;所述盖玻片4上设置有微流控芯片2;所述微流控芯片2设置有外相通道入口21、中间相通道入口22、内相通道入口23、第一个十字聚集结构24、第二个十字聚集结构25、通道出口26;所述流体注射泵模块1包括外相注射泵、中间相注射泵和内相注射泵,依次连接外相通道入口21、中间相通道入口22、内相通道入口23;所述通道出口26连接液滴收集装置3;
所述第一个十字聚集结构24设置有内相剪切口24-1、单乳液生成口24-2、中间相左侧剪切口24-3和中间相右侧剪切口24-4;所述内相剪切口24-1和单乳液生成口24-2进行了窄缩口处理;
所述第二个十字聚集结构25设置有单乳液剪切口25-1、双乳液生成口25-2、外相左侧剪切口25-3和外相右侧剪切口25-4;所述单乳液剪切口25-1进行了窄缩口处理。
本发明针对电化学发光微乳液生成的需求设计了微流控芯片2,如图2所示。采用十字型结构的芯片,并且在此结构上进行了窄缩口处理,主要是利用毛细不稳定性来乳化液滴,在窄缩口处流体流速会急剧增加,导致外相流对内相流对称的剪切力作用的增大,流体在窄缩口的挤压下产生聚焦效果完成乳化。
微流控芯片2的材质为聚二甲基硅氧烷(PDMS),通过电火花处理让PDMS芯片与盖玻片键合,形成封闭通道。流体注射泵模块1和聚四氟乙烯微管均能够耐受弱极性非水溶性试剂。流体注射泵模块1的外相注射泵、中间相注射泵和内相注射泵均可单独控制流速,也可以任一其中两个或三个同时控制。试剂通入通道后在第一个十字聚集结构24处形成油包水(W/O)单乳液,在第二个十字聚集结构25处形成水包油包水(W/O/W)双层乳液,最后在通道出口处通过收集瓶收集微乳液。本实施中收集瓶即为液滴收集装置3。
本发明的电化学发光微乳液生成装置,还可以通过控制外相、中间相和内相的流速来生成不同直径的双层乳液,直径80μm-200μm可调;内相为1.7μl/min,中间相为3.4μl/min,外相为13μl/min的流速控制可生成直径为80μm的双层乳液;当内相和中间相流速不变,外相流速为10μl/min时,可生成100μm的双层乳液;当内相流速不变,中间相流速为2μl/min,外相流速为6μl/min时,可生成200μm的双层乳液。
实施例6:
本发明的电化学发光微乳液生成方法,包括以下步骤:
S1:配置外相溶液、中间相溶液和内相溶液;外相溶液为5wt%PVA,中间相溶液为含2wt%氟表面活性剂的FC 40,内相溶液为0.1mM藻蓝素;
S2:将外相溶液、中间相溶液和内相溶液经过过滤和超声脱气处理;并分别装入外相注射泵、中间相注射泵和内相注射泵;
S3:依次通入外相溶液、中间相溶液和内相溶液,排出微流控芯片2内的气体;
S4:调节内相和中间相注射泵流速;其中,内相注射泵的流速为1.7μl/min,中间相注射泵的流速为3.4μl/min;在第一个十字聚集结构24处形成油包水单层乳液;
S5:再调节外相注射泵流速;其中,外相注射泵的流速为13μl/min;在第二个十字聚集结构25处形成水包油包水(W/O/W)双层乳液,即电化学发光微乳液;
S6:将步骤S5形成的电化学发光微乳液通过液滴收集装置3收集。
实施例7:
如图3所示,通过微乳液生成平台,调节内相、中间相和外相流速稳定生成大小均一的双层乳液,如图4双层乳液的明场显微图像和荧光显微图像所示,生成的双层乳液大小均一,形态稳定,直径范围在86.5μm附近,如图5所示。并且对收集的藻蓝素微乳液和藻蓝蛋白微乳液进行紫外和荧光光谱表征,如图8和图9所示,黑色虚线代表藻蓝素(PCB)的紫外和荧光曲线,黑色实线代表C-藻蓝蛋白(CPC)的紫外和荧光曲线。
将所制备的PCB双层乳液用于电化学碰撞,把液滴加入到电解池中进行电化学分析。通过循环伏安法(Cyclic Voltammetry,CV)检测微乳液的电流变化。首先将生成的1mL的双层乳液加入到2-3mL的PBS缓冲溶液中,使用10mM TOAB溶液修饰玻碳电极作为工作电极,银/氯化银电极为参比电极,铂片电极为对电极,对电化学参数进行设置,高电位设置为0V,低电位设置为-2V,正向扫描,扫描速率为0.1V/s,如图6双乳液碰撞电化学循环伏安图所示。在-0.6V处可以观察到明显的氧还原峰,以及-1.7V处的特征还原峰。并且在液滴碰撞电极时会产生电流信号的急剧变化,可以看出在-1.5V-2V之间存在大量的微乳液与电极之间的碰撞,且信号变化幅度与碰撞的强弱息息相关。从图中可以看出,在高电位时碰撞发生几率变大,这可能是由于过高的电压导致在电极表面析出气体从而导致电极界面的不稳定。图7是微乳液碰撞电化学的时间光强图,可以看出微乳液电化学碰撞的ECL强度稳定。以pH为7.4的三种缓冲液(Hepes、Tris、PBS)为电解液,通过电致化学发光仪对双乳液结构进行电致化学发光(ECL)的强度测试,得出最优的缓冲液为PBS。分别以不同扫描速度进行ECL强度测试,得出最优扫速为0.2V/s。后对共反应剂H
实施例8:
基于上述所制备的微乳液用于检测AFP;设计ECL免疫传感器:首先在电极表面修饰对氨基苯甲酸(ABA),然后修饰EDC-NHS活化羧基形成酰胺键组装在电极表面,加上AFP抗体37℃孵育30~60min,再加上牛血清蛋白(BSA)封闭后,修饰上AFP抗原,配制了6中不同浓度的AFP抗原(500ng/mL、50ng/mL、5ng/mL、0.5ng/mL、0.05ng/mL、0.005ng/mL)。将该修饰玻碳电极作为工作电极,银/氯化银电极为参比电极,铂片电极为对电极,双乳液微滴加入电解池中,对电化学参数进行设置,高电位设置为0V,低电位设置为-2V,正向扫描,扫描速率为0.1V/s,通过循环伏安法检测AFP浓度与电致化学发光强度之间的关系,如图10所示,可以得出当AFP浓度在0.05~500ng/mL范围时,它的对数函数与电致化学发光强度呈线性关系,关系式为y=3495.08x+5585.63,其中x为AFP浓度的对数,y为电致化学发光强度。
本发明的检测范围是0.05-500ng/ml,而现有AFP检测试剂盒的检测范围是2-480ng/ml,比现有AFP检测试剂盒的检测限低。而且人血清甲胎蛋白含量正常参考值小于25ng/ml,即可以用于检测人血清甲胎蛋白含量。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明保护的范围之内。
以上实施例仅用于说明本发明的设计思想和特点,其目的在于使本领域内的技术人员能够了解本发明的内容并据以实施,本发明的保护范围不限于上述实施例。所以,凡依据本发明所揭示的原理、设计思路所作的等同变化或修饰,均在本发明的保护范围之内。
本领域技术人员在考虑说明书及实践这里公开的内容后,将容易想到本申请的其它实施方案。本申请旨在涵盖本申请的任何变型、用途或者适应性变化,这些变型、用途或者适应性变化遵循本申请的一般性原理并包括本申请未公开的本技术领域中的公知常识或惯用技术手段。说明书和实施例仅被视为示例性的。
应当理解的是,本申请并不局限于上面已经描述并在附图中示出的精确结构,并且可以在不脱离其范围进行各种修改和改变。
- 一种基于生成对抗网络的音乐生成方法及装置
- 一种移动式作业表单的生成方法、生成系统及相关装置
- 一种口语测评方法、装置及一种生成口语测评模型的装置
- 一种移动应用生成方法及装置
- 一种图像文件格式及生成方法及装置及应用
- 圆盘式高通量微流控生物芯片、自动化乳液生成装置和乳液生成方法
- 圆盘式高通量微流控生物芯片、自动化乳液生成装置和乳液生成方法
