用于治疗炎性疾病的造血生长因子耗竭疫苗组合物
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及生物技术和医学的分支。其特别地描述了疫苗组合物,其抗原是造血生长因子,可以是粒细胞集落刺激因子和/或粒细胞和单核细胞集落刺激因子。
技术背景
炎症是复杂的过程,其中白细胞和血浆衍生效应蛋白被募集到特定的组织部位,以驱动局部免疫反应(Newton K,Dixit VM.(2012)Cold Spring Harb Perspect Biol.4(3):a006049)。虽然这是限制感染和启动组织重塑的有效方法,但必须加以控制以避免附带组织损伤。短期急性炎症允许抑制感染或损伤并使伤口愈合,但长期慢性炎症(由于产生细胞因子的细胞和粒细胞的活化增加了它们的产生,产生了正反馈回路)可引起增强的组织损伤局部和全身调节的免疫,特别是T细胞反应。
各种原因导致的慢性炎症缺乏完整的消退期,其永远不会结束。这有不同的原因,诸如与感染或刺激物的长期接触以及持续分泌炎症介质的细胞的存在。当炎症刺激成为永久性时,免疫抑制和免疫耐受就开始了。在这种情况下,亚临床但升高的水平的细胞因子诸如粒细胞集落刺激因子(G-CSF)和粒细胞-单核细胞集落刺激因子(GM-CSF)(粒细胞-巨噬细胞集落刺激因子)与免疫耐受相关,而显著升高的水平高与炎症恶化相关(Rogovskii V.(2020)Front Immunol.11:2061)。事实上,炎症细胞因子诸如G-CSF和GM-CSF,可能会介导增强的免疫耐受。增强的免疫耐受的代价是增强的对肿瘤的易感性(Stape T(2018)AsiaPac J Oncol Nurs 5:40-2)。
G-CSF和GM-CSF是骨髓中粒细胞生成和正常粒细胞前体分化中的主要细胞因子。其生理效应是通过与特定细胞表面受体结合来介导的。已知在炎性疾病中,G-CSF和GM-CSF及其受体的血浆浓度发生改变,表现为中性粒细胞增多症、发热、炎症、组织破坏,以及在某些情况下休克和死亡(Watari K等人(1989)Blood.73(1):117-22;Hamilton JA(2020)JExp Med.217(1):e20190945)。
当感染发生时,G-CSF和GM-CSF的释放自然增加,因为感染因子的一些组分刺激它们的产生。源于产生的反应链的中性粒细胞反过来攻击感染因子,这有利于它们的破坏。(Eyles JL等人(2006)Nat.Clin.Pract.Rheumatol.2(9):500-510;Ahandideh B等人(2020)Hum Immunol.81(5):206-217)。G-CSF和GM-CSF在癌症的发生、进展和转移中也起着关键作用(Do H等人(2020)Cancers.12(2):287)。肿瘤细胞产生的细胞因子的联合作用调节宿主免疫系统的细胞反应。对于几种类型的癌症,高水平的炎症细胞因子与晚期和不良预后相关(Silva Em等人(2017)PLoS ONE 12(7):e0181125.;Lippitz,BE(2013).;TheLancet Oncology,14(6),e218-e228)。
已知中性粒细胞在不同的病理学中起重要作用,所述病理学的特征在于慢性炎症,诸如肿瘤的发展、慢性阻塞性肺病、葡萄膜炎、关节炎、强直性脊柱炎、红斑狼疮、哮喘、综合征细胞因子释放等。中性粒细胞/淋巴细胞比率是(Lee Hn等人(2019)RheumatolInt.39(5):859-868)。
在临床上,G-CSF和GM-CSF已被广泛用于治疗化疗相关的中性粒细胞减少症和动员造血干细胞进行移植(Roberts,AW(2005)Growth Factors 23(1):33-4;Mehta Hm等人(2015)J.Immunol.195(4):1341-1349),然而,我们没有发现相反的先例。
已经描述了可以发挥诊断作用或作为被动疗法来对抗具有G-CSF受体(G-CSFR)的高表达的肿瘤的单克隆抗体(Ab)。据报道,针对G-CSFR的人源化中和单克隆抗体在灵长类动物中耐受性良好,不会导致中性粒细胞减少症。另外,鼠抗-G-CSFR单克隆抗体抑制了关节炎,并显著抑制了中性粒细胞在关节中的积聚,这在无中性粒细胞减少症的情况下发生,表明G-CSFR阻断影响了中性粒细胞在炎症部位的定位。(Campbell IK(2016).J.Immunol.197:4392-4402)。然而,没有发现抗增殖和抗肿瘤治疗的证据。由于G-CSF是中性粒细胞的控制和功能中的关键配体,使用抑制这种细胞因子活化的制剂作为患有这种类型疾病的患者的治疗性指是有用的和重要的。
有一项在健康志愿者中进行的I期研究,其使用抗-G-CSFR的单克隆抗体治疗化脓性汗腺炎和掌跖脓疱病(WO 2019/178645和WO 2020/113270),其中循环中性粒细胞的数量不会降至临界水平。
WO 2010/124163中描述了通过针对细胞因子本身或其受体的单克隆抗体阻断GM-CSF途径,目前正在对在难治性类风湿性关节炎患者进行临床试验(
在患者中检测到的G-CSF和GM-CSF细胞因子的浓度很高,因此即使高剂量的抗体也不能完全中和其活性。对于这些分子来说,破坏耐受性和产生免疫原性并不是显而易见的过程,因为它们在正常条件下存在于体内。目前还没有针对G-CSF或GM-CSF依赖性肿瘤提出任何能够抑制其生长的主动免疫疗法。
在本发明中,首次提出了这些造血生长因子的免疫反应的耗竭,并且显示了这种反应在炎症和癌症实验模型中的治疗效果的证据。所述组合物产生抗-G-CSF抗体和抗-GM-CSF抗体滴度的增加、循环中性粒细胞数量的减少、抗增殖、抗炎作用和高抗肿瘤作用。另外,它们可用于慢性情况,因为通过要求低剂量的活性成分,它们的毒性降低。
本文所述的疫苗组合物显示的效果令人惊讶且出乎意料。细胞因子网络的复杂性质及其多效性效应以及产生炎症的机制的冗余性并不表明由这些疫苗组合物产生的抗体可以选择性抑制中性粒细胞群,更不用说这种耗竭转化为抗炎和抗肿瘤效应。
发明简述
在一种实施方案中,本发明涉及一种用于诱导针对造血生长因子的免疫反应的治疗性疫苗组合物,其包含载体蛋白、佐剂和至少一种抗原,所述抗原可以是rG-CSF或rGM-CSF。
在这些疫苗组合物所使用的载体蛋白中包括霍乱毒素B、破伤风类毒素、KLH、脑膜炎奈瑟球菌(Neisseria meningitides)P64k、白喉类毒素、能够呈递针对G-CSF和GM-CSF的T表位的肽、免疫球蛋白G、免疫球蛋白M、抗体的Fc区、抗体的可变片段以及来自细菌、酵母或哺乳动物的蛋白质。这些载体蛋白可通过化学缀合或融合方法附接于抗原。
可用于本发明疫苗组合物的佐剂是弗氏不完全佐剂、弗氏完全佐剂、基于角鲨烯的佐剂、合成来源的佐剂、矿物来源的佐剂、植物来源的佐剂、动物蛋白佐剂、颗粒蛋白佐剂、蛋白脂质体型佐剂、脂质体以及前述任何一种佐剂的混合物。
在特定实施方案中,本发明涉及本文所述的疫苗组合物在治疗炎性疾病中的用途,所述炎性疾病选自包括癌症、慢性阻塞性肺病、葡萄膜炎、类风湿性关节炎、强直性脊柱炎、红斑狼疮、克罗恩病、哮喘、皮炎、细胞因子释放综合征和其中细胞脱粒起重要作用的疾病的组。
在另一个实施方案中,描述了治疗有需要的受试者的方法,其包括施用范围在0.01mg/kg体重与10mg/kg体重之间的治疗有效量的本发明疫苗组合物。特别地,进行通过至少每周施用1至6剂而产生的免疫反应诱导阶段,通过至少每周施用一剂至直至出现限制使用的毒性来进行所述免疫反应的维持阶段。该方法包括通过肌内、皮下或肿瘤内的途径施用疫苗组合物。
发明详述
疫苗组合物
本发明包括获得诱导针对造血生长因子G-CSF和GM-CSF的免疫反应的疫苗制剂,所述疫苗制剂还产生循环中性粒细胞数量的减少、抗增殖作用和体内高抗肿瘤作用。
本发明的疫苗组合物的活性成分是与载体蛋白结合的抗原(G-CSF和/或GM-CSF)之间的蛋白缀合物。所述载体蛋白选自但不限于霍乱毒素B、破伤风类毒素、KLH、来自脑膜炎奈瑟球菌的P64k;白喉类毒素和能够呈递针对G-CSF和GM-CSF的T表位的肽。在上述缀合物中,蛋白质可以与免疫球蛋白G、免疫球蛋白M、抗体的Fc区融合,无论是人还是来自另一种动物物种,所述Fc区可以是与Fc受体有限结合的变体,其由在Cγ2区域内突变的IgG1组成,具有突变L234A和L235A。另外,缀合物可以与抗体、细菌、酵母或哺乳动物蛋白质的可变片段融合。
另外,上述蛋白质缀合物包含佐剂,其增强或补充了它们的抗-G-CSF和/或抗-GM-CSF的抗体反应。这些佐剂可以是弗氏不完全佐剂、弗氏完全佐剂、基于角鲨烯的佐剂、合成来源的佐剂、矿物来源的佐剂、植物来源的佐剂、动物来源的佐剂、颗粒蛋白佐剂、蛋白脂质体型佐剂、脂质体或上述任何佐剂的混合物。
本发明中包含的抗-G-CSF和/或抗-GM-CSF系统使用合适的药物赋形剂。这些赋形剂包括但不限于:注射用水、氯化钠、磷盐和钾盐、氯化钙、氢氧化钠和柠檬酸盐以及EDTA。可在蛋白浓度为0.01mg/mL-10mg/mL,剂量为10-100μL/kg或10-100μg总蛋白/kg,或最高5mg总蛋白(更加推荐的剂量为10-60μg/kg)的肠胃外制剂中接种患者。
治疗性组合物可使用其液体形式在-80℃与8℃之间的温度下储存,或者在冻干过程后在2℃与8℃之间的温度下储存。
获得载体蛋白与重组G-CSF(rG-CSF)和/或重组G-CSF(rGM-CSF)之间的化学缀合物
根据对rGCSF和/或rGM-CSF蛋白与上述一些载体蛋白之间的化学缀合反应的条件的评估和优化,开发了一种化学缀合方法,所述方法需要高摩尔比的自体蛋白,以保证在缀合过程中两者之间的高缀合效率。然后通过超滤膜纯化方法消除缀合过程中必需的过量自体蛋白质,这允许获得具有高度均一性的疫苗制剂。
本发明中描述的方法保证了两种蛋白质之间的充分化学缀合,并且由单一步骤组成。首先,在缀合反应器中,将范围在0.1mg/mL与1mg/mL之间的预先浓缩的rGCSF和/或rGM-CSF蛋白与范围在0.6mg/mL与20mg/mL之间的将与其缀合的分子混合。随后向该蛋白质混合物中加入PBS/MgCl
随后,使用范围在50kDa与100kDa之间的超滤膜进行纯化,并且该纯化由两个阶段组成。在初始阶段,连续更换缓冲液(渗滤)以除去戊二醛和消除过量的自体蛋白质,所述自体同源蛋白是游离的或仅形成rGCSF蛋白或仅形成不同大小的rGM-CSF蛋白的缀合物。在此阶段,进行3至15次缓冲溶液更换。第二阶段是浓缩纯化的化学缀合物。
通过膜纯化获得的治疗制剂的特征在于在5∶1至20∶1的范围内的rGCSF蛋白与与其缀合的分子之间的化学缀合比,并且不含戊二醛。
通过融合蛋白表达方法获得治疗性组合物
本发明的疫苗组合物也可以通过设计基于rG-CSF和rGM-CSF基因的基因构建物来获得,所述rG-CSF和rGM-CSF基因被克隆在表达载体(优选为PCMX,但不限于其)中,并与任何前述载体蛋白的基因融合。用于转染的细胞可以是HEK-293T、HEK-293-GE、Expi293、HEK-293或CHOk1。培养6-10天后收集转染细胞的上清液。然后通过蛋白A亲和色谱或金属离子亲和色谱纯化所述重组蛋白。
治疗方法
上述系统在维持抗-G-CSF和/或抗-GM-CSF免疫反应方面是有效的,其中预先诱导了由本发明所述的系统产生的抗体。它们可用于治疗其中G-CSF和GM-CSF起相关作用的炎性疾病。这些疾病包括(但不限于)癌症(尤其是那些依赖于G-CSF或GM-CSF的肿瘤)、慢性阻塞性肺病、葡萄膜炎、关节炎、强直性脊柱炎、红斑狼疮、克罗恩病、哮喘、皮炎、细胞因子释放综合征,以及细胞脱粒在其中起重要作用的疾病。
将以1至6个诱导剂量肌内、皮下或肿瘤内施用批准用于人或动物的剂量,至少每周施用一次,然后在免疫反应维持阶段,肌内、皮下或肿瘤内施用1个剂量至直至出现限制其使用的毒性,至少每周施用一次,但也可以是每两周、每月、每季度或每年一次。
通过以下实施例和附图进一步阐述本发明。然而,这些实施例不应被解释为对本发明范围的限制。
附图说明
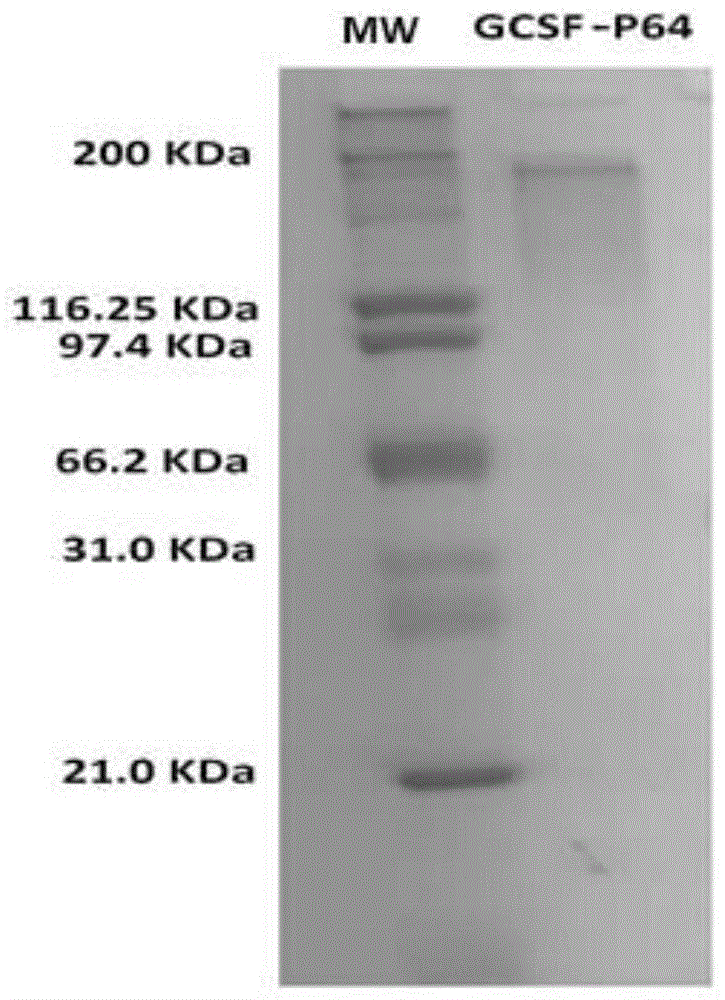
图1.通过SDS PAGE电泳表征rG-CSF-P64k系统。
图2.通过SDS PAGE电泳表征耦合到Fc的rG-CSF系统(rG-CSF-Fc)和耦合到Fc的rGM-CSF系统(rGM-CSF-Fc)。
图3.单独或与G-CSF联合施用治疗性组合物rG-CSF-P64k后,抗-G-CSF抗体滴度产生的动力学研究。
图4.A)施用不同剂量的治疗性组合物rG-CSF-P64k后,抗-G-CSF抗体滴度的产生,B)施用不同剂量的治疗性组合物rG-CSF-P64k后,产生抗-G-CSF抗体滴度的动力学。
图5.单独或与G-CSF联合施用治疗性组合物rG-CSF-P64k后,循环中性粒细胞计数的评价。
图6.抑制用治疗性组合物rGCSF-P64k免疫的小鼠的血清诱导的细胞增殖。
图7.在通过巴豆油的施用引起的炎症模型中,评价施用治疗性组合物rGCSF-P64k后的抗炎作用。A)减少的循环中性粒细胞计数,B)减少的心房水肿。
图8.单独或与G-CSF联合施用治疗性组合物rG-CSF-Fc后,产生抗-G-CSF抗体滴度的动力学研究。
图9A)研究以不同剂量施用治疗性组合物rG-CSF-Fc后,产生抗-G-CSF抗体的滴度,B)以不同剂量施用治疗性组合物rG-CSF-Fc后,产生抗-G-CSF抗体滴度的动力学。
图10.在Balb/c品系中施用治疗性组合物rG-CSF-Fc后,产生抗-G-CSF抗体滴度的动力学研究。
图11.单独或与G-CSF联合施用治疗性组合物rG-CSF-Fc后,循环中性粒细胞计数的评估。
图12.抑制用治疗性组合物rGCSF-Fc免疫的小鼠的血清诱导的细胞增殖。
图13.施用治疗性组合物rGM-CSF-Fc后,产生抗-GM-CSF抗体滴度的动力学研究。
图14.A)研究以不同剂量施用治疗性组合物rGM-CSF-Fc后,产生抗-GM-CSF抗体的滴度,B)以不同剂量施用治疗性组合物rGM-CSF-Fc后,产生抗-GM-CSF抗体滴度的动力学。
图15.由获自用治疗性组合物rGMCSF-Fc免疫的小鼠的血清诱导的细胞增殖的抑制。
具体实施方式
实施例1.获得重组蛋白rP64k与rG-CSF之间的化学缀合物
以20∶1的比例获得rGCSF与P64k蛋白之间的化学缀合物始于17.6mg的GCSF蛋白,将3mg P64k载体蛋白加入NaHCO
在10% SDS-PAGE凝胶和1μg蛋白质质量上评估纯化的蛋白质的纯度。图1显示获得的疫苗组合物大致对应于200kD的分子量。
实施例2.通过融合蛋白表达方法获得治疗性组合物。
设计了基于G-CSF基因的基因构建体和另一种具有融合至人免疫球蛋白G1的Fc区并克隆到PCMX表达载体中的GM-CSF基因的基因构建体。用评估的与聚乙烯亚胺混合的基因构建体转染Expi 293细胞。培养6天后收集转染细胞的上清液。通过与蛋白A基质的亲和力纯化所述重组蛋白。在7.5% SDS-PAGE凝胶中评估纯化的蛋白质的纯度,所用G-CSF-Fc的质量为2μg,在GM-CSF-Fc的情况下为9μg。
图2显示两种被评估的组合物的分子量都大致对应于35kD。
实施例3.治疗性组合物rG-CSF-P64k诱导抗-G-CSF抗体。
在第0天、第7天、第21天、第35天和第42天用50μg/Kg重量的以Montanide为佐剂的实施例1的制剂(V/V 1:1)肌内免疫C57BL/6品系的小鼠(n=5)。从第14天开始,每周三次向它们皮下注射G-CSF或PBS。
在第0天(免疫前)、第14天、第35天和第56天抽血进行血清处理。通过ELISA法测定抗-G-CSF特异性抗体的滴度。为此,用5μg/mL G-CSF覆盖平板,并在37℃孵育1小时。在相应的封闭后,加入血清稀释液(1/10、1/100、1/500、1/1000、1/5000、1/10000、1/20000)。使用抗鼠IgG抗体/碱性磷酸酶缀合物(Sigma)和相应的酶底物显现反应。在405nm处读取吸光度。免疫前血清用作阴性对照。抗体滴度被定义为最大血清稀释度,其显示ELISA光密度(OD)读数,加上在含有免疫前血清的孔中获得的平均OD的五个标准偏差。
每个实验组的通过ELISA估计的抗-G-CSF抗体滴度的几何平均值用于定义免疫反应的状况。
免疫小鼠产生特异性抗体,其滴度高于1/10,000,这表明疫苗组合物诱导针对G-CSF本身的免疫反应(图3)。
实施例4.不同浓度的治疗性组合物rG-CSF-P64k诱导抗-G-CSF抗体。
以14天的间隔用6剂不同浓度(50μg、25μg、12.5μg、6.25μg和3.125μg)的以Montanide为佐剂(V/V 1:1)的实施例1的制剂肌内免疫C57BL/6系小鼠(n=5)。从第二次免疫开始,每周两次向它们皮下注射G-CSF或PBS。
在第0天(免疫前)和每次免疫后第15天抽血进行血清处理。通过ELISA法测定抗-G-CSF特异性抗体的滴度。为此,用5ug/mL G-CSF覆盖平板,并在37℃孵育1小时。在相应的封闭后,加入血清稀释液(1/100、1/1000、1/10000、1/100000、1/1000000)。然后遵循实施例3中描述的程序。
免疫小鼠产生了特异性抗体,在不同浓度的疫苗组合物时其效价达到1/1000以上,这证明诱导了针对G-CSF的免疫反应。在用不同剂量的抗原免疫的小鼠中获得的滴度之间存在显著差异(图4A)。这证明了免疫组之间关于作为抗体滴度测量的获得的反应的剂量依赖性。
还在对应于3剂、4剂、5剂和6剂疫苗组合物的不同时间间隔评估了体液免疫反应。以不同浓度的疫苗制剂免疫的所有动物的抗体滴度以剂量依赖性方式增加,从第5次免疫开始达到抗体滴度的平台。
(图4B)。
实施例5.治疗性组合物rG-CSF-P64k减少了C57BL/6小鼠中循环中性粒细胞的计数。
按照实施例3的免疫方案,用以Montanide作为佐剂的实施例1的疫苗制剂(V/V 1:1)免疫C57BL/6小鼠(n=5)。从第14天开始,还每周3次向它们皮下注射G-CSF或PBS。在第0天(免疫前)和第一次免疫后第56天,从动物的上颌窦抽取外周血,并收集在含有EDTA(40μl/mL血液)的小瓶中。Carl Zeiss显微镜。
通过Kolmogorov-Smirnov检验来验证正态性,通过Levene检验得出方差齐性,并在免疫前以及第35天和第56天每只动物的值之间进行配对学生t检验,显著性水平为p<0.05。在用G-CSF-P64k缀合物治疗的动物中,在第56天观察到中性粒细胞的统计学上显著的减少,这表明该药物组合物能够通过其产生的抗-G-CSF抗体引起中性粒细胞减少症(图5)。还应该注意的是,中性粒细胞减少症并不意味着小鼠存活率的降低。
实施例6.治疗性组合物rGCSF-P64k抑制鼠成髓细胞系NFS60的细胞增殖。
使用实施例1的治疗性组合物和实施例3中描述的免疫方案,在免疫C57BL/6小鼠后,通过在鼠成髓细胞系NFS60(G-CSF依赖性)中进行的细胞增殖测定来评估在第14天和第28天获得的血清的效果。
预先将细胞解冻并在培养中保持48小时以实现指数生长。测试期间的孵育条件是温度37℃和5% CO
图6显示,施用疫苗组合物时,存在依赖于稀释度(稀释度越低,作用越大)和从治疗开始的时间的增殖抑制,因为第28天观察到的抑制作用比第14天的大,这表明疫苗制剂抑制G-CSF的增殖效果,这是所评估的肿瘤细胞系中粒细胞生成的关键。
实施例7.治疗性组合物rG-CSF-P64k具有抗炎作用。
在第0天、第7天和第21天用50μg/Kg重量的实施例1的疫苗制剂于弗氏完全佐剂(V∶V 1∶1)中皮下免疫C57BL/6小鼠。其余的免疫接种在弗氏不完全佐剂中进行。作为对照组,通过相同的途径和频率给小鼠施用盐水溶液。
在第0天、第7天和第21天,将10μL 0.4%的巴豆油局部施用于动物右耳的每一面。将等体积的盐水溶液施用于左耳。在第0天和第20天,在巴豆油施用开始之前,从所有动物中抽取血液样品进行嗜中性白细胞计数。在第35天,施用刺激性物质后4h,处死动物,测定对耳水肿的反应。对他们来说,直径为6mm的组织碎片取自耳朵,并在分析天平上称重。利用从每只动物的双耳的耳盘获得的重量,计算产生的水肿和炎症抑制的百分比,考虑:
水肿=肿胀耳朵(右耳)的重量-非肿胀耳朵(左耳)的重量炎症抑制%=[(Pc-Pt)/Pc]x 100,
其中:
Pc:对照组中体重变化的算术平均值,
Pt:治疗组中体重变化的算术平均值。
统计软件包MINITAB(Minitab Inc.16.1.0版MINITAB,2010)用于数据处理,在结果的解释中建立了90%的置信水平。进行组间数据比较,分别使用Kolmogorov-Smirnov(KS)和Levene检验分析正态性和方差齐性。为了确定实验组之间是否存在显著差异,对水肿进行了参数化学生t检验(中性粒细胞计数)和Mann-Whitney U检验。
作为先前方法的结果,在第20天,与对照组相比,在用GCSF-P64K缀合物处理的组的中性粒细胞计数中检测到统计学上显著的减少(p<0.1)(图7A),而在第35天,与对照组相比,在用GCSF-P64K缀合物处理的组中检测到急性炎症的抑制,其特征在于由巴豆油引起的耳内水肿的53.85%的统计学上显著的减少(p<0.1)(图7B),这表明疫苗制剂在急性炎症模型中具有抗炎作用。
实施例8.治疗性组合物rG-CSF-Fc诱导抗体反应。
在第0天、第14天、第28天和第42天用20μg/kg的实施例2中所述的疫苗组合物肌内免疫一组5只C57BL/6小鼠,所述疫苗组合物具有与Fc偶联的G-CSF作为抗原并以Montanide作为佐剂。在第14天和第56天抽血进行血清处理,通过ELISA测定抗-G-CSF特异性抗体滴度。为此,在4℃下用5μg/mL的G-CSFh包被平板16h至20h,G-CSFh的尾部有6个组氨酸分子。用在磷酸盐缓冲盐水中稀释的4%脱脂奶粉在25℃封闭平板1小时。加入封闭溶液中的免疫小鼠的血清和免疫前血清的系列稀释液(1/10-1/107),并在25℃孵育1小时。进行6次0.1%(V:V)Tween20溶液的洗涤。加入在封闭溶液中以1∶35000稀释的抗小鼠IgG免疫球蛋白-辣根过氧化物酶缀合物(Sigma,A2554-1 mL),并在25℃孵育1小时。在25℃下,在含0.015%过氧化氢的底物缓冲液(Na
滴度被确定为最高稀释度,在该稀释度下,观察到来自相同动物的免疫前血清的吸光度值的至少两倍的吸光度。
图8中显示的结果对应于在第14天和第56天获得的血清的滴定。该图显示,针对G-CSFh的免疫接种能够在小鼠中产生针对所述细胞因子的体液型应答和高滴度。
实施例9.不同浓度的治疗性组合物rG-CSF-Fc诱导抗-G-CSF抗体。
以14天的间隔用6剂不同浓度(80μg、40μg、20μg、10μg和5μg)的实施例2的制剂肌内免疫C57BL/6品系的小鼠(n=7),所述制剂含有与Fc偶联的GCSF(作为抗原)并以Montanide作为佐剂(V/V 1:1)。在第0天(免疫前)和每次免疫后第14天抽血进行血清处理。通过ELISA测定抗-G-CSF的特异性抗体的滴度,然后进行实施例3的程序。
免疫小鼠产生了特异性抗体,所述抗体达到了1/1000以上的滴度,在以不同浓度的疫苗组合物免疫的组之间没有统计学差异,这证明了在评估的间隔中诱导了不依赖于剂量的针对G-CSF的免疫反应(图9A)。
对于用40ug和5ug疫苗组合物免疫的动物,按照实施例4的程序,在不同的时间间隔评价体液免疫反应。从第3次免疫开始,抗体滴度的动力学保持在平台期,在第4次给药后有小的变化。在随时间推移的体液反应的发展中,保持了对浓度的非依赖性(图9B)。
实施例10.治疗性组合物rG-CSF-Fc在Balb/c品系中诱导抗-G-CSF抗体。
以14天的间隔分开地用5剂5ug的实施例2的治疗性组合物皮下免疫Balb/c小鼠,所述治疗性组合物具有与Fc融合的G-CSF作为抗原并以Montanide作为佐剂。在第0天(免疫前)、第42天、第70天和第77天抽血。
对于不同血清提取物,通过ELISA测定针对G-CSF的特异性抗体滴度。为此,用5ug/mL G-CSF覆盖平板,并在37℃孵育1小时。在相应的封闭后,加入血清稀释液(1/100、1/1000、1/10,000、1/100,000、1/1,000,000),然后如实施例3所述进行。
免疫Balb/c小鼠产生了特异性抗体,其平均滴度达到1/10,000,表明疫苗组合物诱导了针对G-CSF的强免疫反应(图10)。
实施例11.治疗性组合物rG-CSF-Fc减少了C57BL/6小鼠中循环中性粒细胞的计数。
按照实施例3中所述的免疫方案向C57BL/6小鼠(n=5)施用20μg/Kg重量的实施例2中所述的疫苗组合物,所述疫苗组合物具有与Fc偶联的G-CSF作为抗原并以Montanide作为佐剂。使用Carl Zeiss显微镜评估中性粒细胞计数。在第一次免疫的第0天(免疫前)和第56天,从动物的上颌窦抽取外周血,并收集在含有EDTA(40μl/mL血液)的小瓶中。使用CarlZeiss显微镜进行中性粒细胞计数。
通过Kolmogorov-Smirnov检验验证正态性,通过Levene检验得出方差齐性,并且在免疫前以及第35天和第56天每只动物的值之间进行配对学生t检验,显著性水平为p<0.05。
在用GCSF-P64k缀合物治疗的动物中,在第56天观察到中性粒细胞的统计学上显著的减少,这表明该药物组合物能够通过其产生的抗-G-CSF抗体导致中性粒细胞减少症(图11)。还应该注意的是,中性粒细胞减少症并不意味着小鼠存活率的降低。
实施例12.治疗性组合物rGCSF-Fc抑制鼠成髓细胞系NFS60的细胞增殖。
以14天的间隔分开地用7个肌内剂量将40ug和5ug的实施例2的治疗性组合物免疫C57BL/6小鼠,所述治疗性组合物具有与Fc融合的GCSF作为抗原并以Montanide为佐剂。
在鼠成髓细胞系NFS60(G-CSF依赖性)中使用细胞增殖测定,评估在第0天(免疫前)和免疫方案结束时获得的血清的效果,程序如实施例5中所述。
图12显示施用疫苗组合物时,发生增殖抑制,但在未免疫动物(免疫前)的血清中未发生增殖抑制,这表明疫苗制剂在NFS60细胞系中抑制关键G-CSF在粒细胞生成方面的增殖作用。被评估血清的增殖抑制未显示出对疫苗组合物浓度的依赖性。
实施例13.治疗性组合物rGM-CSF-Fc诱导抗体反应。
用20μg与IgG1 Fc链融合的人GM-CSF皮下免疫一组四只BALB/c小鼠。在第一次免疫前两天从小鼠抽取血清,用作免疫前血清对照。每隔14天进行6次免疫接种,并在第6次给药后7天抽血。在第0天,用20μg在弗氏完全佐剂中乳化的蛋白质(V:V 1:1)进行免疫。其余的免疫接种在弗氏不完全佐剂中进行。
在第0天、第35天、第49和第77天,抽取血液,通过ELISA用血清测定抗-GM-CSF的抗体滴度。为此,在4℃下,用5μg/mL的溶解在盐水磷酸盐缓冲液中的人GM-CSF包被96孔板,持续16h至20h。在25℃下,用在盐水磷酸盐缓冲液中稀释的4%的脱脂奶粉封闭平板1小时。加入封闭溶液中的免疫小鼠的血清和免疫前血清的系列稀释液(1/10-1/10
在图13中,该图显示了针对人GM-CSF的免疫产生了滴度高达1x10
实施例14.不同浓度的治疗性组合物rGM-CSF-Fc诱导抗-GM-CSF抗体。
以14天的间隔用6剂不同浓度(40μg、20μg、10μg、5μg和2.5μg)的实施例2的制剂肌内免疫C57BL/6品系的小鼠(n=7),所述制剂具有与Fc偶联的GM-CSF作为抗原并以Montanide为佐剂(V/V 1∶1)。
在第0天(免疫前)和每次免疫后第14天抽血进行血清处理。通过ELISA测定抗-GM-CSF特异性抗体的滴度。为此,按照实施例4的程序,用5μg/mL的GM-CSF覆盖平板,在37℃孵育1小时。
每个实验组通过ELISA评估的抗-GM-CSF抗体滴度的几何平均值用于定义免疫反应的状况。
免疫小鼠产生了特异性抗体,所述抗体达到了1/1000以上的滴度,在以不同浓度的疫苗组合物免疫的组之间没有统计学差异,这表明诱导了针对GM-CSF的免疫反应(图14A),该免疫反应在所测试的剂量范围内不是浓度依赖性的。
对于用20ug和5ug疫苗组合物免疫的动物,按照实施例4的程序,在不同的时间间隔评价体液免疫反应。抗体滴度的动力学随着剂量数的增加而增加。从第5次给药开始,观察到其中反应没有变化的平台期。在随时间推移的体液反应的发展中,保持了对浓度的非依赖性(图14B)。
实施例15.治疗性组合物rGMCSF-Fc抑制鼠成髓细胞系NFS60的细胞增殖。
以14天的间隔分开地用5剂5ug的实施例2的治疗性组合物皮下免疫Balb/c小鼠,所述治疗性组合物具有与Fc融合的GM-CSF作为抗原并以Montanide为佐剂。在第0天(免疫前)和最后一次免疫后第14天抽血。
通过在鼠成髓细胞系NFS60(G-CSF依赖性)中进行的细胞增殖测定的平均值来评估从免疫获得的血清的效果,并遵循实施例6中描述的相同程序。
图15显示,施用疫苗组合物rGM-CSF-Fc后,免疫动物中存在增殖抑制,而未免疫动物(免疫前)的血清中不存在增殖抑制,这表明疫苗制剂抑制了关键G-CSF对NFS60细胞系粒细胞生成方面的增殖作用。
- 用于治疗癌症和炎性疾病的化合物
- 嘧啶并-异喹啉-醌衍生的化合物、它们的盐、异构体、药学上可接受的互变异构体;药物组合物;制备方法;和它们在细菌性疾病和多重抗性的细菌性疾病的治疗中的用途
- 一种用于治疗抑郁症的中药组合物在调节免疫炎性反应中的应用
- 用于治疗炎性疾病、退行性疾病和神经退行性疾病的化合物、组合物和方法
- 用于治疗炎性疾病、退行性疾病和神经退行性疾病的化合物、组合物和方法
