外周血单个核细胞在制备治疗/预防阿尔茨海默病的药物中的用途
文献发布时间:2024-04-18 19:58:21
技术领域
本说明书涉及医药技术领域,特别涉及外周血单个核细胞在制备治疗阿尔茨海默病的药物中的用途。
背景技术
阿尔茨海默病(AD)是一种进展性神经退化性疾病,其临床特征在于认知受损、行为障碍、精神症状和日常生活活动中的无能。这些临床表现构成AD痴呆。
AD国际估计,到2050年,全球痴呆症人数将从目前的4700万增加到1.31亿。作为痴呆症的最常见原因,AD占痴呆病例的60%至80%。在美国,估计有520万美国人患有由AD引起的痴呆症,并且到2050年,除非找到有效的治疗,否则患病率将翻倍或变成三倍。
AD已成为严重危害中国乃至全世界老年人健康和社会经济可持续发展的主要疾病之一,是当前亟需解决的重大社会问题。AD的治疗药物目前已批准的多为单靶点药物,包括胆碱酯酶抑制剂、NMDA受体拮抗剂、Aβ单克隆抗体Aduhelm、靶向脑-肠轴的GV-971。过去30年,以Aβ和tau蛋白两大发病机制学说为单一靶点的药物临床试验多以失败告终,Aβ单克隆抗体Aduhelm带来的淀粉样蛋白相关成像异常(amyloid associated imagingabnormality,ARIA)可能是大脑水肿(ARIA-E)或微出血(ARIA-H)的迹象,而这种不良反应一定程度上限制了抗淀粉样蛋白抗体的使用剂量。AD是由多种机制共同影响所致,且发病机制仍未完全阐明,临床的治疗手段大多数采用单一治疗方法,主要以改善症状为主,难以逆转疾病的进程。所以开发出既能改善症状又能逆转疾病进程的药物成为极其迫切的临床需求。
发明内容
鉴于上述现有技术的缺点,本申请提供外周血单个核细胞在制备治疗/预防阿尔茨海默病的药物中的用途。
本说明书提出的外周血单个核细胞在制备治疗阿尔茨海默病的药物中的用途,带来的有益效果包括但不限于:所述药物中外周血单个核细胞(1)能够逆转阿尔茨海默病患者记忆力衰退;(2)能够减弱阿尔茨海默病患者陌生环境恐惧症状;(3)降低阿尔茨海默病患者大脑皮层和海马区的斑块面积百分比和斑块密度;(4)减少阿尔茨海默病患者大脑皮层和海马区的斑块数量;(5)降低阿尔茨海默病患者大脑皮层和海马区磷酸化tau蛋白的表达和密度。
附图说明
本申请将以示例性实施例的方式进一步说明,这些示例性实施例将通过附图进行详细描述。这些实施例并非限制性的,其中:
图1为根据本申请一些实施例所示的通过水迷宫试验和PET-CT扫描检测AD小鼠认知功能的结果图,图1A-图1C:WT和AD小鼠Morris水迷宫平台试验中的逃避潜伏期、穿台次数和行走距离,原始数据采用独立样本t检验(n=5)进行分析;图1D-图1E:Y迷宫实验中进入新颖臂的数目和交替百分比,主要采用独立样本t检验进行分析;图1F:PET-CT定量检测WT和AD小鼠的组织代谢;图1G:正常和AD小鼠的PET-CT的SUV值,SUV代表大脑对葡萄糖的吸收,原始数据采用独立样本t检验(n=5)进行分析;图1H:行为结果与SUV值的相关分析(n=5,线性回归),WT:野生型;AD:阿尔茨海默病;SUV:标准化摄取量。
图2为根据本申请一些实施例所示的外周血单个核细胞治疗后检测AD小鼠认知功能的结果图,图2A:外周血单个核细胞治疗时间:第1周水迷宫和Y迷宫筛查,第2周尾静脉注射外周血单个核细胞,治疗4周后检测AD小鼠的行为和形态;图2B-图2C:用Y迷宫检测WT组、AD对照组和治疗组大鼠进入新颖臂的次数和时间,n=5,对原始数据进行单因素方差分析,然后进行post hoc检验;图2D:在旷场实验中测试了站立时间。n=5,对原始数据进行单因素方差分析,然后进行post hoc检验;图2E-图2G:水迷宫实验检测小鼠的行为轨迹、逃避潜伏期和穿台次数,n=5,图2F图原始数据,用重复测量方差分析和单因素方差分析,图2G为post hoc检验,PBMC:外周血单个核细胞;WT:野生型;AD-Con:AD小鼠对照组;AD-Tre:AD小鼠治疗组;D:天;W:周。
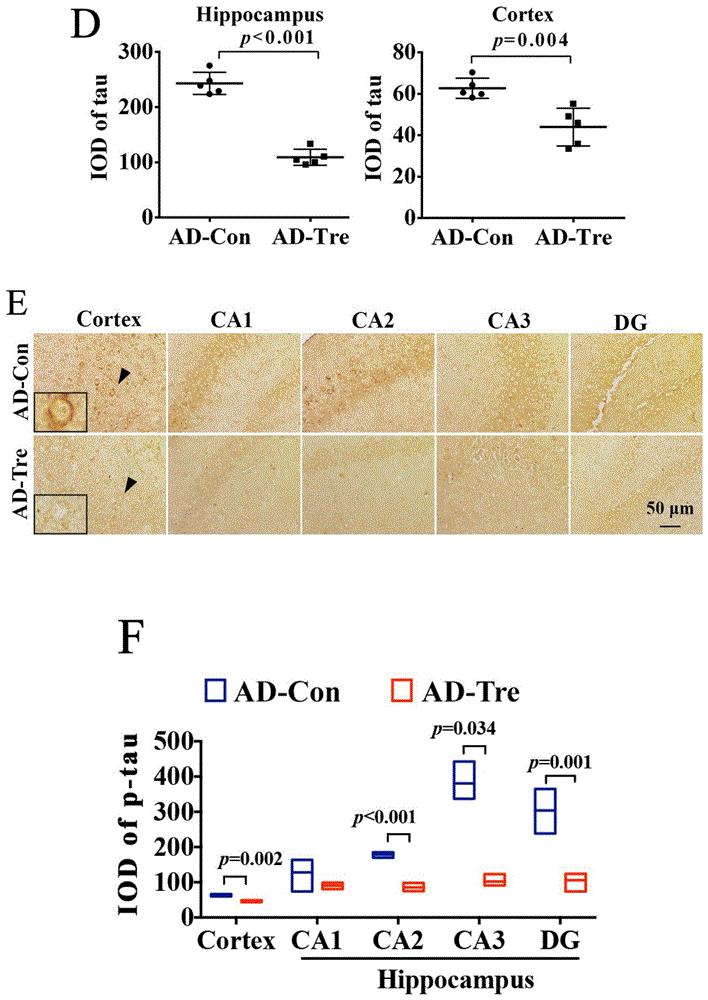
图3为根据本申请一些实施例所示的外周血单个核细胞治疗后Aβ斑块和p-tau蛋白的检测结果图,图3A:AD对照组和治疗组大鼠大脑皮层和海马区6E10免疫组织化学染色。黑色箭头表示Aβ斑块,比例尺=500μm;图3B:定量图显示AD治疗组和对照组大脑皮层和海马区Aβ斑块的比例和密度。n=5,提供原始数据,并使用独立样本t检验进行分析;图3C:大脑皮层和海马区p-tau蛋白的免疫组织化学染色,黑色箭头代表p-tau蛋白,比例尺=100μm;图3D:定量图显示AD治疗组和对照组大脑皮层和海马区p-tau蛋白的密度。n=5,提供了4个原始数据,并使用独立样本t检验进行分析;图3E:p-tau蛋白在海马CA1、CA2、CA3和DG区以及大脑皮层的免疫组织化学染色,黑色箭头代表p-tau蛋白,比例尺=50μm;图3F:定量图显示AD治疗组和对照组大脑皮层和海马CA1、CA2、CA3和DG区p-tau蛋白的密度,n=5;WT:野生型;AD-Con:AD小鼠对照组;AD-Tre:AD小鼠治疗组;IOD:积分光密度值。
图4为根据本申请一些实施例所示的外周血单个核细胞治疗后AD小鼠脑组织致密斑块的检测和器官的细胞形态检测结果图,图4A:WT组、AD对照组和治疗组大鼠大脑皮层和海马区刚果红染色,第1列比例尺=500μm,其余3列比例尺=100μm,黑色箭头代表粉红色致密斑块,蓝色圆点代表细胞核;图4B:定量图显示WT组、AD对照组和治疗组小鼠大脑皮层和海马区致密斑块的比例,n=5,对原始数据进行单因素方差分析,然后进行post hoc检验;图4C:取WT、AD对照组和治疗组小鼠的心、肝、脾、双侧肺、双侧肾和双侧睾丸进行HE染色,标尺=100μm,WT为野生型,AD-Con为AD小鼠对照组,AD-Tre为AD小鼠治疗组。
具体实施方式
为了更清楚地说明本说明书实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本说明书的一些示例或实施例,对于本领域的普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图将本说明书应用于其它类似情景。除非从语言环境中显而易见或另做说明,图中相同标号代表相同结构或操作。
如本说明书和权利要求书中所示,除非上下文明确提示例外情形,“一”、“一个”、“一种”和/或“该”等词并非特指单数,也可包括复数。一般说来,术语“包括”与“包含”仅提示包括已明确标识的步骤和元素,而这些步骤和元素不构成一个排它性的罗列,方法或者设备也可能包含其它的步骤或元素。
本说明书中使用了流程图用来说明根据本说明书的实施例的系统所执行的操作。应当理解的是,前面或后面操作不一定按照顺序来精确地执行。相反,可以按照倒序或同时处理各个步骤。同时,也可以将其他操作添加到这些过程中,或从这些过程移除某一步或数步操作。
阿尔茨海默症(Alzheimer’s disease,AD)是一种以认知功能退化、渐进性记忆障碍为主要特征,伴随着社会行为能力与日常生活能力严重下降的一种中枢神经系统退行性疾病。临床表现为记忆减退、语言与情感障碍、思维迟钝以及人格改变等。该病起病隐匿,病程缓慢,发病率与年龄增长相关,已成为当代社会严重危害人类健康特别是老年人生存质量的一项重大疾病。
目前,临床上治疗AD的生物药物分为五类:第一类抗胆碱酯酶药物:加兰他敏、多奈哌齐(安理申)、石杉碱甲和重酒石酸卡巴拉汀;第二类兴奋性氨基酸拮抗剂:美金刚;第三类抗β淀粉样蛋白:阿杜单抗;第四类M1受体拮抗剂、抗氧化剂;第五类肠道菌群、神经炎症:GV971。但是,这些药物也只是减缓病情的发展,并不能逆转AD逆转疾病进程。
本申请提供外周血单个核细胞在制备治疗/预防阿尔茨海默病的药物中的用途。在一些实施例中,所述外周血单个核细胞可以是所述药物的唯一有效成分。在一些实施例中,所述外周血单个核细胞可以是所述药物的有效成分之一。
术语“治疗/预防”(及其语法变体)指试图改变治疗个体中疾病的自然进程,并且可以是为了预防或在临床病理学的过程期间实施的临床干预。治疗的期望效果包括但不限于预防疾病的发生或复发、缓解症状、降低疾病的任何直接或间接病理学后果、预防转移、减缓疾病进展的速率、改善或减轻疾病状态、及免除或改善预后。
如本文所用,术语“治疗”通常意指在正被施用外周血单个核细胞的受试者中获得期望的药理学和/或生理学效果。因此,如本文使用的术语“治疗”包括:(a)抑制AD,例如遏制其发展;(b)逆转AD,例如使AD消退;或(c)与不接受治疗情况下的预期生存期相比延长生存期。在一些实施例中,治疗可以具有疾病调修效果。这意指治疗减缓或延缓潜在的病理性或病理生理性疾病过程,并且相对于安慰剂或对照组而言,AD的临床体征和症状有所改善。
在一些实施例中,治疗可以引起症状改善。这可能由认知增强、自主权更多和/或神经精神和行为功能障碍改善(即使只是有限的持续时间)组成。
在一些实施例中,所述外周血单个核细胞可以来源于非阿尔茨海默病患者。在一些实施例中,非阿尔茨海默病患者可以是无认知功能障碍或精神类疾病的人。在一些实施例中,非阿尔茨海默病患者可以是神经功能正常的人。
在一些实施例中,所述药物中,外周血单个核细胞可以用于减轻阿尔茨海默病患者的认知功能障碍。
术语“患者”意在包括需要对阿尔茨海默病进行诊断、预后、预防或治疗的任何人受试者,并且包括需要治疗的人受试者。需要治疗的患者包括已经患有AD的患者,以及易患AD的患者,或者需要预防AD表现的患者。
在一些实施例中,所述认知功能障碍可以包括记忆力衰退和陌生环境恐惧症。
在一些实施例中,所述药物中,外周血单个核细胞可以用于逆转阿尔茨海默病患者记忆力衰退。
在一些实施例中,所述药物中,外周血单个核细胞可以用于减弱阿尔茨海默病患者陌生环境恐惧症状。
AD的病理特征主要包括脑海马区及皮层区的β淀粉样蛋白(amyloidβpeptide,Aβ)在细胞外沉积成老年斑(senile plaque,SP);细胞内Tau蛋白过度磷酸化形成细胞内纤维缠结(neurofibrillary tangles,NFTs)以及神经元减少,神经炎症等。其中,细胞外淀粉样斑块和淀粉样血管病是区分AD与其他形式的痴呆和神经退行性疾病的明显特征。
在一些实施例中,所述药物中,外周血单个核细胞可以用于降低阿尔茨海默病患者大脑皮层和海马区的斑块面积百分比和斑块密度。在一些实施例中,所述药物中,外周血单个核细胞可以用于减少阿尔茨海默病患者大脑皮层和海马区的斑块数量。
在一些实施例中,所述药物中,外周血单个核细胞可以用于降低阿尔茨海默病患者大脑皮层和海马区磷酸化tau蛋白的表达和密度。tau蛋白是一种能与微管蛋白结合促进结合物聚合形成微管的微管相关蛋白,其功能包括维持微管稳定性,防止微管解离,促进微管成束等重要作用。正常机体中tau蛋白的磷酸化和去磷酸化是平衡的,但在异常情况下导致平衡被打破,磷酸化的tau蛋白增多。目前有两种猜测,一种是磷酸化的tau蛋白增多,会影响微管的结构和功能,但是微管与AD的具体作用机制目前还不太清楚。另一种是,Aβ寡聚物可以和卷曲蛋白受体结合,激活糖原合成激酶-3β(GSK-3β),导致tau蛋白过度磷酸化形成神经元纤维缠结(neurofibrillary tangles,NFTs)从而产生神经毒性。
在一些实施例中,所述海马区可以包括CA1、CA2、CA3和DG区。在一些实施例中,所述斑块可以选自总斑块、致密斑块或Aβ斑块中至少一种。Aβ是由β淀粉样蛋白前体蛋白(β-amyloid precursor protein,APP)被剪切酶剪切形成的正常代谢产物。一般情况下,Aβ在体内的含量处于平衡状态,当APP蛋白水解异常时,Aβ降解量减少或产生量过多即会产生沉积,Aβ中的β片层结构促进其聚集成不溶性纤维,从而聚集成难溶性沉淀,生成SPs,进而对神经元产生毒性作用。
在一些实施例中,所述治疗可以持续至少4周。
本发明提供一种治疗阿尔茨海默症的方法,所述方法包括向阿尔茨海默症患者施以治疗/预防有效量的外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)。在一些实施例中,所述PBMC可以通过静脉回输施以AD患者。
术语“有效量”指本申请的PBMC的数量或剂量,其以单一或多次剂量施用患者后,在治疗的患者中产生预期效果。有效量可以由作为本领域技术人员的主治医师通过考虑以下多种因素来容易地确定:诸如哺乳动物的物种;它的大小、年龄和一般健康;涉及的具体疾病;疾病的程度或严重性;个体患者的应答;施用模式;施用制剂的生物利用率特征;选择的给药方案;和任何伴随疗法的使用。
“治疗有效量”指以需要的剂量并持续需要的时间段,有效实现所需治疗结果的量。本申请的PBMC的治疗有效量可以根据多种因素如疾病状态、个体的年龄、性别和重量而变动。治疗有效量也是这样的一个量,其中PBMC的任何有毒或有害作用不及治疗有益作用。
“预防有效量”指以需要的剂量并持续需要的时间段,有效实现所需预防结果的量。通常,由于预防性剂量在对象中在疾病较早阶段之前或在疾病较早阶段使用,故预防有效量将小于治疗有效量。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂公司购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
实施例1--动物和分组
C57BL/6背景的APP/PS1转基因小鼠(AD小鼠)从昆明医科大学实验动物学部获得并饲养。所有动物都在SPF实验室动物室的标准条件下饲养。所有实验均符合美国国立卫生研究院出版的《实验动物护理和使用指南》。该动物研究方案由昆明医科大学动物保护与福利委员会依法批准,批准号为kmmu2019058。
实施例2--外周血单个核细胞样本制备和分离
根据制造商(Ficoll–PaqueTM Plus,GE Healthcare,Sweden)的说明,通过Ficoll梯度分离纯化来自9个月大的WT小鼠的PBMCs。简而言之,将3ml的Ficoll-Paque梯度移液到两个15ml离心管中。将血液在PBS中以1∶1稀释,并在Ficoll-Paque梯度上小心分层。将试管以400×g离心30分钟。小心收集单核细胞层(8ml/试管),并在PBS中洗涤细胞两次(以100×g离心10分钟)。使用PBS将细胞稀释至2.5×10
实施例3--小鼠PBMCs治疗
使用小鼠尾部可视化仪将提取的PBMCs(来自9个月大的WT小鼠)以每只小鼠200μl(约5×10
实施例4--Morris水迷宫
用Morris水迷宫检测WT和AD小鼠PBMCs治疗后1个月的空间记忆和学习能力。水池的内径为90cm,填满深度为0.5m,被分成四个相等的象限,在一个象限的中心,一个小的圆形平台放置在水面以下1.5cm。白色食用色素被添加到水中以隐藏平台。水迷宫实验包括位置定位航行实验和空间探测实验。在定位航行实验中,将小鼠放置在随机选择的一个象限的中点,并记录小鼠找到隐藏平台所用的时间(潜伏期)。在训练中,每只小鼠每天在4个象限的中心释放一次,持续5天;每次试验给它们最多60s的时间来寻找平台。如果老鼠在训练试验中未能在60秒内找到平台,它们将由实验室工作人员引导到平台。第六天,平台被拆除,空间探测器测试开始。小鼠被放置在平台原始位置对面象限的水中。记录和测量每只小鼠穿越目标区域的次数,以及小鼠在到达目标区域之前的训练时间和最后一天距离。最后,每次实验结束后,小鼠都被晾干,然后回到它们的笼子里。训练间隔时间为15-20min。
实施例5--旷场实验
本研究采用旷场实验,主要观察WT、AD对照组和AD治疗组小鼠在PBMCs治疗后1个月的自主、探索和焦虑样行为。实验装置由两部分组成:40cm高、底座40cm×40cm、内壁白色的开放式反应箱和自动数据采集与处理系统(上海鑫苑信息技术有限公司)。反应箱的封闭部分为正方形建筑面积,由16个10cm×10cm的正方形组成,在箱内底面上方2m处放置一台数码相机。每只动物都被放置在箱内底面中心,并同时对其行为进行录像和计时。每只小鼠观察10min。使用智能追踪系统记录动物站立次数。在测试期间,箱子的内壁和箱底都被清洗了。
实施例6--Y迷宫
用Y迷宫检测WT和AD小鼠在PBMCs治疗后1个月的空间识别记忆能力。Y迷宫由三个臂(长35cm,宽5cm,高15cm)组成,彼此成120°角。他们被放在一个臂的一端进入迷宫。本次测试分为以下两个部分。(1)自发交替实验:记录进入三臂的顺序和进入每臂的总次数。交替率计算为交替数/(总次数-2)×100%。(2)空间记忆实验:在第一次训练测试中,关闭一个臂(新异臂),让小鼠自由探索15min。在第二次实验之前,把动物放回笼子里1h。在第二次实验时,开放新异臂,并允许小鼠在迷宫中自由探索8min。测量和分析每只小鼠进入新异臂的次数和在新异臂上花费的总时间。
实施例7--PET-CT
实验在昆明医科大学附属第一医院核医学科(Discovery 690/Elite PET-CT,GE)进行,筛选WT和AD小鼠。实验开始前要做的第一件事是装备药物(18F-FDG),每只小鼠都被注射到腹膜内,并记录注射的数量和时间。半小时后行PET-CT检查。小鼠用异氟醚麻醉,仰卧固定在扫描床上进行正电子发射计算机断层扫描。最后用CT SUV值评价脑代谢。
实施例8--组织获取
小鼠在PBMCs处理后1个月用3%异氟烷麻醉,并用预冷的0.9%生理盐水灌注,直到肝脏变白。取出脑组织和其他器官,包括心脏、肝脏、脾脏、肺、肾脏和睾丸,并在4%多聚甲醛中固定72h,将修整过的脑组织块脱水,包埋在石蜡中。将前囟后2.66mm~4.3mm的区域切成冠状切片(5微米厚),随后在60℃下烘烤12小时并在室温下保存,用于尼氏染色、免疫组织化学染色、刚果红染色和苏木精-伊红(HE)染色。
实施例9--免疫组织化学染色
免疫组织化学染色观察PBMCs治疗后1个月皮质和海马区(CA1、CA2、CA3和DG区)后总斑块和磷酸化Tau的表达。制备的脑组织切片用3%的过氧化氢封闭15min以清除内源性过氧化物酶,然后用5%山羊血清和0.3%Triton X-100在室温下连续作用2h。然后将切片与一抗anti-β-Amyloid,1-16(1:1500,6E10,Mouse,Biolegend)或抗p-tau(1:200,phosphor-Ser396,Mouse,Abbkine)在4℃下孵育过夜,然后与二抗(MaxVision-HRP,mouse/rabbit)孵育15min,然后加入DAB溶液显色。最后,切片在梯度酒精和TO中脱水并用中性树脂封片。用数字化病理切片扫描仪(KF-PRO-005,KFBio,宁波,中国)观察脑组织的形态变化。每只动物随机选取5个视野(0.5mm
实施例10--刚果红染色
在PBMCs治疗后1个月后,在相同位置取脑切片进行刚果红染色,以识别皮质和海马区致密斑块。制片后用苏木精染色液(Solarbio)染色1min,再用酸性分化液(Solarbio)进行分化。再用刚果红溶液(刚果红溶液和Puchtler碱性溶液按100:1混合)染色10min,然后用无水乙醇洗涤3次,TO透明,中性树脂封闭。用数字化病理切片扫描仪(KF-PRO-005,KFBio,宁波,中国)观察脑组织的形态变化。用Image-ProPlus6.0软件(MediaContronetics,Silver Spring,MD,USA)对大脑皮质和海马区的5个区域(每个区域各0.5mm
实施例11--HE染色
于PBMCs治疗后1个月取心、肝、脾、肺、肾、睾丸组织进行HE染色观察。总之,在同一位置制备的切片进行HE染色(Beyotime生物技术研究所),并使用数字病理切片扫描仪(KF-PRO-005,KFBio,宁波,中国)观察器官和脑组织的形态变化。
实施例12--统计学分析
所有数据均用原始数据作图,误差棒表示标准差,P<0.05表示结果具有统计学意义,所有统计分析均使用SPSS 21.0软件(IBM Corporation,NY,USA)进行。使用独立样本T检验分析两组间的比较,使用单因素方差分析(one-way ANOVA)分析多组间的比较。对于水迷宫实验,比较不同时间点、不同组间使用重复测量方差分析。此外使用Pearson's相关系数分析SUV与逃潜伏期、穿台次数、交替百分比的相关性。
实验结果显示,PBMCs在阿尔茨海默病的治疗中具有重要作用和巨大潜力。
为了评估PBMCs在AD中的作用,我们首先对同系、性别和年龄匹配的C57BL/6(WT)和APP/PS1(经典AD模型)进行了行为分析,水迷宫结果表明AD小鼠表现出显著的记忆缺陷(图1A-C),进一步的Y迷宫实验表明,AD小鼠进入新颖臂的数量和交替的百分比显著低于WT小鼠(图1D-E)。PET-CT扫描发现AD小鼠的代谢活性明显低于WT小鼠(图1F-G),SUV值随逃避潜伏期的缩短而增加,而SUV值随穿台次数和交替百分比的增加而增加,并具有一定的相关性(图1H)。基于外周血单个核细胞在阿尔茨海默病中的重要作用这一事实,我们从9个月大的小鼠中提取外周血单个核细胞,并将它们注射到9个月大的AD小鼠尾静脉(图2A),一个月后的行为实验显示,治疗后的AD小鼠进入新颖臂的次数显著高于AD小鼠,找到目标平台的时间显著短于AD小鼠(图2B,F),其余的检测显示出在进入新颖臂的时间和旷场站立次数的数量以及在水迷宫中穿台次数显著改善趋势(图2C-E,G)。
此外,我们还发现,PBMCs干预的AD小鼠皮质和海马区的总斑块(6E10抗体免疫阳性)以及致密斑块(刚果红阳性)和p-tau的表达明显低于AD对照组,而在海马区的CA2、CA3和DG区的表达更显著减少(图3,图4A-B)。此外,HE染色在心、肝、脾、双侧肺、双侧肾脏和双侧睾丸的细胞形态上没有差异(图4C),表明PBMC处理对小鼠其他器官无损伤。
上文已对基本概念做了描述,显然,对于本领域技术人员来说,上述详细披露仅仅作为示例,而并不构成对本说明书的限定。虽然此处并没有明确说明,本领域技术人员可能会对本说明书进行各种修改、改进和修正。该类修改、改进和修正在本说明书中被建议,所以该类修改、改进、修正仍属于本说明书示范实施例的精神和范围。
同时,本说明书使用了特定词语来描述本说明书的实施例。如“一个实施例”、“一实施例”、和/或“一些实施例”意指与本说明书至少一个实施例相关的某一特征、结构或特点。因此,应强调并注意的是,本说明书中在不同位置两次或多次提及的“一实施例”或“一个实施例”或“一个替代性实施例”并不一定是指同一实施例。此外,本说明书的一个或多个实施例中的某些特征、结构或特点可以进行适当的组合。
一些实施例中使用了描述成分、属性数量的数字,应当理解的是,此类用于实施例描述的数字,在一些示例中使用了修饰词“大约”、“近似”或“大体上”来修饰。除非另外说明,“大约”、“近似”或“大体上”表明所述数字允许有±20%的变化。相应地,在一些实施例中,说明书和权利要求中使用的数值参数均为近似值,该近似值根据个别实施例所需特点可以发生改变。在一些实施例中,数值参数应考虑规定的有效数位并采用一般位数保留的方法。尽管本说明书一些实施例中用于确认其范围广度的数值域和参数为近似值,在具体实施例中,此类数值的设定在可行范围内尽可能精确。
最后,应当理解的是,本说明书中所述实施例仅用以说明本说明书实施例的原则。其他的变形也可能属于本说明书的范围。因此,作为示例而非限制,本说明书实施例的替代配置可视为与本说明书的教导一致。相应地,本说明书的实施例不仅限于本说明书明确介绍和描述的实施例。
- LLP2A-Ale在制备用于治疗和/或预防外周血淋巴细胞减少症的药物中的用途
- LLP2A-Ale在制备用于治疗和/或预防外周血淋巴细胞减少症的药物中的用途
