一种利用病毒样颗粒制备膜蛋白的方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于生物技术领域,具体涉及一种利用病毒样颗粒制备膜蛋白的方法。
背景技术
在生物细胞中,膜蛋白是维持细胞生理过程的最重要的组成部分,在物质运输、信号转导和细胞间识别等多种细胞功能中发挥着重要作用。人类基因组中编码的膜蛋白约占总蛋白质组的30%。这些膜蛋白与囊性纤维化、动脉粥样硬化、帕金森病和阿尔茨海默病等多种疾病相关。其中跨膜蛋白是目前最主要的药物靶点,占现阶段己知药物靶点的60%以上,以跨膜蛋白为靶点的创新药研发一直是医药领域的研究热点。但针对膜蛋白的靶点筛选及药物开发仍然面临巨大的挑战,其首要的困难是难以获得足量的、稳定的且有活性的膜蛋白。
最简单的方法是构建包含膜蛋白胞外肽段的融合蛋白,该方法适合Secretin膜蛋白和Adhesion膜蛋白家族,该家族成员蛋白N端胞外大且有重要的配体结合位点。但该方法制备的膜蛋白无法模拟蛋白的天然构象,表位遗漏或失真,并不适合多次跨膜蛋白。为了得到最接近天然蛋白的全长跨膜蛋白,科学家们创造了一系列卓越的类膜结构,包括脂质体liposomes和纳米圆盘nanodiscs。其中,liposomes制备批间差不稳定,组装入liposomes中的膜蛋白通常会导致样品浑浊和粘稠,这可能会限制一些生物化学分析技术的应用。Nanodiscs组装的膜蛋白更接近天然构象,但其制备方法复杂,产量很低,价格昂贵。
人类免疫缺陷病毒1(human immunodeficiency virus type 1,HIV-1)是逆转录病毒科的慢病毒,是获得性免疫缺陷综合症(AIDS)的病原体。HIV-1是一种包膜病毒,是具有9个功能基因的小RNA基因组(9.7kb),包含3个结构基因(gag,pol,env),2个调节基因(tat,rev)和4个辅助基因(vif,vpu,vpr,nef)。病毒样颗粒(Virus-Like Particles,简称VLPs)是模仿病毒结构的自组装颗粒,是由病毒的核心结构蛋白(gag)自组装的亚病毒颗粒,该蛋白具有在宿主细胞膜上自组装的固有特性,从而向细胞培养基释放大分子复合物。但是,它们不包含病毒基因组,因此是非感染性的。
发明内容
针对现有技术中的不足,本发明旨在提供一种利用病毒样颗粒制备膜蛋白的新方法,该方法不仅操作简单、批间差小,而且产量高,所得蛋白也最接近膜蛋白天然构象。
为了实现上述目的,本发明的技术方案具体如下:
一种利用病毒样颗粒制备膜蛋白的方法,包括以下步骤:
S1、分别构建Gag表达质粒和膜蛋白表达质粒,所述Gag表达质粒中含有编码gag蛋白的序列,所述膜蛋白表达质粒中含有编码目标膜蛋白的序列;
S2、将Gag表达质粒和膜蛋白表达质粒共转染细胞,培养所述细胞;
S3、收集细胞培养液,取上清,纯化,得到病毒样颗粒;所述病毒样颗粒包含gag蛋白和目标膜蛋白,所述gag蛋白的氨基酸序列如SEQ ID NO.1所示。
在上述制备膜蛋白的方法中,所述目标膜蛋白可以为外周膜蛋白(膜外在蛋白),也可以为跨膜蛋白(膜内在蛋白),还可以为脂锚定蛋白。作为优选地,本发明提供的制备方法尤其适用于跨膜蛋白的制备,所得膜蛋白能够模拟蛋白的天然构像,且产量高。
在本发明一个实施例中,跨膜蛋白具体为四次跨膜蛋白CLDN18.2,其氨基酸序列如SEQ ID NO.2所示;所得病毒样颗粒包膜结构完整,且ELISA活性检测结果表明,该病毒样颗粒与CLDN18.2药物抗体具有良好的结合活性。
在本发明另一实施例中,跨膜蛋白为四次跨膜蛋白CLDN6,其氨基酸序列如SEQ IDNO.3所示;所得病毒样颗粒包膜结构完整,且ELISA活性检测结果表明,该病毒样颗粒与CLDN6/9重组抗体具有良好的结合活性。
在本发明另一实施例中,跨膜蛋白为四次跨膜蛋白CLDN9,其氨基酸序列如SEQ IDNO.4所示;所得病毒样颗粒包膜结构完整,且ELISA活性检测结果表明,该病毒样颗粒与CLDN6/9重组抗体具有良好的结合活性。
在本发明另一实施例中,跨膜蛋白为四次跨膜蛋白CCR8,其氨基酸序列如SEQ IDNO.5所示;所得病毒样颗粒包膜结构完整,且ELISA活性检测结果表明,该病毒样颗粒与CCR8重组抗体具有良好的结合活性。
在上述制备膜蛋白的方法中,所述细胞为哺乳动物细胞,且哺乳动物细胞包括但并不限于HEK293F细胞、CHO细胞、已经构建好表达膜蛋白的稳转细胞株等。
在本发明一实施例中,所用哺乳动物细胞为HEK293F细胞,待将HEK293F细胞培养至处于指数期后,即可利用转染试剂将两种质粒转染至细胞。
在上述制备膜蛋白的方法中,Gag表达质粒和膜蛋白表达质粒可通过本领域常规方法将目标DNA分子(即编码gag蛋白的序列和编码目标膜蛋白的序列)或含有所述DNA分子的表达盒连接至表达载体中得到,且所用的表达载体可以是本领域常规的各种表达载体,只要所得表达质粒可以在相应的宿主细胞中正常复制并表达目的蛋白即可。在本发明一实施例中,所用表达载体为pSecTag2A载体。
在上述制备膜蛋白的方法中,步骤S3所述纯化的方式优选为:依次采用阴离子交换层析和分子筛层析处理。
针对上述优选的纯化方式,步骤S3具体含有以下几个操作步骤:
S31、将细胞培养液离心,取上清;
S32、用核酸酶处理上清后,用Tris-HCl缓冲液置换细胞培养液;
S33、过滤后上阴离子交换柱,用含有50-1000mM NaCl的Tris-HCl缓冲液洗脱,收集洗脱液;
S34、将洗脱液浓缩后,上SEC色谱柱分离,且所用平衡缓冲液为PBS。
更加优选地,步骤S31所述离心的条件为:3000-5000g离心10-20min。
更加优选地,步骤S34采用100kDa超滤管进行浓缩。
现有技术中,通常采用非常耗时的密度梯度离心技术纯化VLPs。然而,密度梯度离心需要超高速离心机,该设备依赖进口且价格昂贵,而且该设备通量低,较大通量的离心机操作一次2-3h可以处理约200ml细胞培养液;另外,设备操作要求高,VLPs超离时,转速10万g以上,需要实验员配平操作时绝对小心,否则就会给设备和人员带来安全隐患。本发明将澄清并过滤的细胞培养液上清直接在阴离子交换树脂上处理,大部分宿主细胞杂质通过阴离子交换柱,而本发明所得蛋白通过阶梯式盐梯度洗脱;洗脱后的VLPs,浓缩后上分子筛,进而得到更加纯净的组分。
本发明的有益效果为:
(1)本发明通过在同一哺乳动物细胞中分别表达HIV-1的gag蛋白和目标膜蛋白,利用gag蛋白自组装形成VLPs的性质,以及VLPs从细胞中分泌表达时会捕获宿主细胞质膜的性质,实现了gag蛋白对同一细胞中过表达的目标膜蛋白的捕获、富集和分泌。
(2)利用本发明方法制备的膜蛋白,呈类病毒颗粒样;而且该结构能有效展示目标膜蛋白的天然构像,活性十分良好。
(3)基于本发明制备的膜蛋白的性质,进一步改进了纯化方式,结合阴离子交换层析法和分子筛层析,通过两步纯化操作得到了组分更加纯净,尺寸更为均一的蛋白。相对于密度梯度离心技术,该方式成本低且所得产物质量高。
(4)本发明制备方法简单,批间差稳定,且产量高,适用于工业化生产。
附图说明
图1为本发明中Q柱经不同梯度洗脱液洗脱所得产物的SDS-PAGE检测结果,其中,泳道1为细胞培养原液,泳道2为20mM Trs-HCl、50mM NaCl pH7.5洗脱液,泳道3为20mMTrs-HCl、100mM NaCl pH7.5洗脱液,泳道3为20mM Trs-HCl、200mM NaCl pH7.5洗脱液,泳道3为20mM Trs-HCl、300mM NaCl pH7.5洗脱液,泳道3为20mM Trs-HCl、500mM NaCl pH7.5洗脱液,泳道3为20mM Trs-HCl、750mM NaCl pH7.5洗脱液,Marker从上到下分别为116.0,66.2,45.0,35.0,25.0,18.4,14.4kDa。
图2为本发明中经Q柱纯化后所得产物的SEC检测结果图;
图3为本发明中经SEC二次纯化后所得产物的SEC检测结果图。
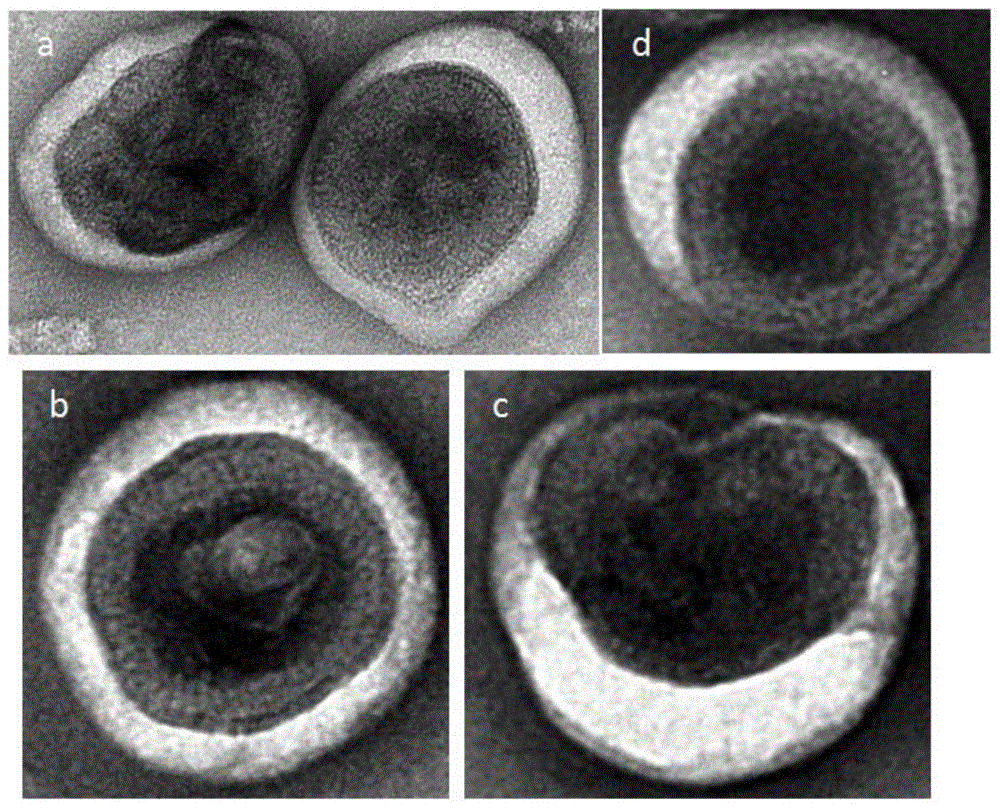
图4为本发明制备的VLPs-CLDN18.2、VLPs-CLDN6、VLPs-CLDN9和VLPs-CCR8的电镜检测图。
图5为本发明制备的VLPs-CLDN18.2的ELISA活性检测结果图。
图6为本发明制备的VLPs-CLDN6的ELISA活性检测结果图。
图7为本发明制备的VLPs-CLDN9的ELISA活性检测结果图。
图8为本发明制备的VLPs-CCR8的ELISA活性检测结果图。
具体实施方式
为了更好地理解本发明,下面结合具体实施例及其附图进一步阐明本发明的内容。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
下述实施例中,若无特殊说明,均为常规方法;所述试剂和材料,若无特殊说明,均可从商业途径获得。
实施例1
本例的目标膜蛋白为四次跨膜蛋白CLDN18.2,其氨基酸序列如序列表中SEQ IDNO.2所示,所涉及的HIV-1gag蛋白的氨基酸序列序列表中SEQ ID NO.1所示。具体通过以下步骤制备膜蛋白:
(1)表达载体的构建。
使用pSecTag2A载体,分别构建Gag表达质粒和膜蛋白表达质粒。
(2)膜蛋白/类病毒颗粒的表达。
使用生长处于指数期、存活率大于98%的HEK293F转染,将细胞密度稀释成3×10
(3)膜蛋白/类病毒颗粒的纯化。
离心后,立即取上清。100ml HEK293F细胞培养基上清用Benzonase(purity gradeII,Merck)处理,终浓度150U/ml,室温处理2h,温柔震荡。用平衡缓冲液(20mM Tris-HCl,pH7.5)置换细胞培养基。第二天用0.8μm滤器过滤,准备上柱(西安蓝晓Q柱)。洗脱缓冲使用20mM Tris-HCl,pH7.5,50-1000mM NaCl缓冲,并进行SDS-PAGE检测。
洗脱结果如图1所示,目的蛋白(箭头所示)在不同梯度的NaCl浓度下均有洗脱,其中低浓度50mM NaCl下目的蛋白比较杂,应将该梯度舍弃。
为了进一步纯化,合并剩余梯度的洗脱液,用100kDa超滤管(Millipore)进行浓缩,浓缩后的VLPs蛋白上SEC(GE,Superdex 200 16/600GL),平衡缓冲为PBS(pH7.4)。
纯化结果如图2所示,从阴离子交换洗脱得到的蛋白并不是均一的形态。收集最大的洗脱峰1,此为第二步纯化的洗脱蛋白。
将洗脱峰1再次过SEC检测,所得检测结果如图3所示。表明经过SEC二次纯化后所得的蛋白为均一形态,是更为纯净的VLPs组分。
将本例纯化后所得蛋白记为VLPs-CLDN18.2。
实施例2
与实施例1不同的是,本例的目标膜蛋白为四次跨膜蛋白CLDN6,其氨基酸序列如序列表中SEQ ID NO.3所示。其他均同实施例1一致。
将本例纯化后所得蛋白记为VLPs-CLDN6。
实施例3
与实施例1不同的是,本例的目标膜蛋白为四次跨膜蛋白CLDN9,其氨基酸序列如序列表中SEQ ID NO.4所示。其他均同实施例1一致。
将本例纯化后所得蛋白记为VLPs-CLDN9。
实施例4
与实施例1不同的是,本例的目标膜蛋白为七次跨膜蛋白CCR8,其氨基酸序列如序列表中SEQ ID NO.5所示。其他均同实施例1一致。
将本例纯化后所得蛋白记为VLPs-CCR8。
对实施例1~4所得蛋白进行以下检测:
(1)透射电镜(TEM)检测。
每个样品取10μl滴在200目的超薄碳涂层铜网格上2分钟,然后在滤纸上快速吸干网格。用1%醋酸铀酰(0.22μm过滤器过滤两次)对网格进行负染色。当完全干燥1分钟后,使用Hitachi HT-7700TEM在100kV电压下成像。
电镜检测结果如图4所示,VLPs-CLDN18.2(a)、VLPs-CLDN6(b)、VLPs-CLDN9(c)和VLPs-CCR8(d)的包膜结构完整。表明,通过本发明的表达方法和二次纯化方法,能够得到理想结构的类病毒颗粒。
(2)ELISA检测。
VLPs-CLDN18.2、VLPs-CLDN6、VLPs-CLDN9和VLPs-CCR8以及对照蛋白(VLPs,氨基酸序列如SEQ ID NO.1所示)分别使用CB缓冲稀释成5-10μg/ml后包板。包板时,设置空白对照组,阴性对照组,阳性对照组。其中,空白对照组,直接加入不含蛋白的CB缓冲液;阴性对照组与各个实验组,均包被蛋白(VLPs-CLDN18.2、VLPs-CLDN6、VLPs-CLDN9和VLPs-CCR8)以及对照蛋白(VLPs);阳性对照组,则包被CLDN18.2、CLDN6、CLDN9和CCR8抗体(1mg/mL)。4℃包被过夜使用封闭液(4%脱脂奶粉)在37℃温箱孵育2h封闭。然后分别使用CLDN18.2、CLDN6、CLDN9和CCR8抗体孵育,使用TMB显色15min后加入终止液终止实验。吸光度值读出后,在Graphpad软件里面进行数据分析,读取EC50数据,绘制曲线图。
VLPs-CLDN18.2的检测结果见表1和图5。
表1
VLPs-CLDN18.2的检测结果见表2和图6。
表2
VLPs-CLDN18.2的检测结果见表3和图7。
表3
VLPs-CLDN18.2的检测结果见表4和图8。
表4
从上述ELISA检测结果可知,VLPs-CLDN18.2、VLPs-CLDN6、VLPs-CLDN9和VLPs-CCR8的活性均十分良好。
综上所述,基于本发明的膜蛋白制备方法和纯化方法,能够获得最接近膜蛋白天然构象的足量膜蛋白,且制备、纯化操作简单,成本低,有利于工业化生产。另外,本发明展示的CLDN18.2、CLDN6、CLDN9和CCR8这4个多次跨膜蛋白均是近年热门的药物靶点蛋白,实验数据表明经本发明方法得到的上述蛋白不仅具有天然活性,而且组分纯净、尺寸均一,故本发明对以跨膜蛋白为靶点的创新药研发具有重要意义。
以上所述是本发明的优选实施方式,不能以此来限定本发明之权利范围,应当指出,对于本技术领域的普通技术人员来说,凡在本发明的精神和原则之内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 一种包含CASP8凋亡蛋白的病毒样颗粒及其制备方法和应用
- 一种免疫增强型重组PRRSV病毒样颗粒亚单位疫苗的制备方法
- 一种BK病毒样颗粒的制备及利用该病毒样颗粒检测BK病毒抗体的应用
- 一种猪圆环病毒2型病毒样颗粒的制备方法及通过该方法获得的病毒样颗粒
