单个B淋巴细胞克隆人IgG重链全长基因的方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及基因工程、抗体工程、细胞工程等技术领域,尤其涉及单个B淋巴细胞高效克隆人抗体IgG重链全长基因的方法。
背景技术
单克隆抗体药物作为一种具有独特优势的生物靶向药物,具有特异性高、靶向性强和毒副作用低的特点,在临床治疗方面获得了广泛的应用。
抗体分子的基本结构是由四条多肽链组成的。即由2条相同H链和L链组成,抗体重链基因(heavy chain,H)由65~100种可变区(V)、2种多变区(D)、6种结合区(J)和恒定区(C)四部分基因片段组成;轻链(lightchain,L)由可变区(V)、结合区(J)和恒定区(C)三部分基因片段组成。抗体重链恒定区分为CH1、CH2、CH3和CH4(依抗体类型不同)。
人抗体根据重链恒定区差别分为5类:IgG(γ)、IgM(μ)、IgA(α)、IgD(δ)、IgE(ε)。其中IgG约占血清总免疫球蛋白的75%~80%,IgG具有特异性结合抗原,中和毒素,阻止病原体入侵,清除病原微生物等免疫防御功能。
免疫球蛋白各个分区的功能,VH和VL区的作用负责识别及结合抗原,决定着抗体的特异性,从而发挥免疫效应。IgG的CH2和IgG的CH3负责激活补体,IgG的CH2/CH3负责与效应细胞(最主要是NK细胞)表面的Fc受体(FcRs)结合,介导效应细胞杀伤靶细胞(肿瘤细胞、被感染的细胞、致病性免疫细胞等)。由于不同的IgG亚型与不同的FcRs有不同的亲和活性,这导致不同亚型的IgG体外和体内功能活性有明显不同。例如IgG1可与除FcRL4之外的所有的IgGFcRs结合;IgG2可与FcγRI,FcγRIIB和FcRL4以外的IgG FcRs结合;IgG3可与所有IgGFcRs结合;IgG4可与FcγRIIIB以外的所有IgGFcRs结合,因此抗体C区序列在治疗中也发挥着重要作用。
利用人外周血中B淋巴细胞的抗体基因制备的全人源抗体,由于经历了人体免疫耐受机制的自然选择,具有特异性强、亲和力高、安全性好等优点。并充分利用人类优势自然资源(有些高效抗体是不能在非人物种中产生,只能来源于人)制备抗体,能够最大限度地解决抗体药物应用的免疫原性问题,为患者提供最大的安全性保障,极大地降低了研发和投资风险,大幅提升了成药率。因此成为单克隆抗体药物的研发重要方向。
目前制备B淋巴细胞制备人单克隆抗体的技术方案有2种,一是通过噬菌体表达文库进行筛选,即将编码人抗体基因的cDNA片段与噬菌体表面蛋白的编码基因融合后,以融合蛋白的形式呈现在噬菌体的表面,被展示的多肽或蛋白可保持相对的空间结构和生物活性,展示在噬菌体的表面。导入了各种各样外源基因的一群噬菌体,就构成一个展示各种各样外源肽的噬菌体展示库。当用一个抗原去筛查一个噬菌体展示库时,就会选择性地同与其有相互作用的某个外源肽相结合,从而分离出展示库里的某个特定的噬菌体,研究分析该噬菌体所含外源基因的序列和生物学功能,就能够获得有抗原结合活性的抗体轻链或重链的基因片段。作为一种抗体基因的发现技术,该方法获得的抗体IgG基因通常是不完整的,最终导致其与抗原的亲和力降低,后期需要利用抗体亲和力成熟技术,即通过构建突变体库的方法进一步筛选高亲和力的抗体。
二是利用B淋巴细胞分离筛选结合基因测序技术直接获得抗体重链可变区基因,然后与固定已知抗体C区序列进行拼接后进行配对、转染细胞后进行有活性单克隆抗体的筛选。由于单细胞转录组测序读长(150bp)的限制,目前尚不能够从单个B淋巴细胞同时获得匹配的重链全长基因,因此后期需要利用生物信息学技术对从多个单B测序获得的抗体可变区基因片段进行拼接,并进一步与已有固定的C区片段进行拼接,在体外重组后进行活性筛选。上述工艺破坏了抗体轻重链在可变区和恒定区之间铰链区的天然结构,后续需要对抗体重链基因进行配对再验证抗体活性,由于丧失了天然IgG抗体基因的C区结构,降低了抗体与抗原的亲和力,也不利于抗体治疗效果的发挥,并且增加了抗体引发抗药抗体产生的风险,制备的抗体不属于真正意义上的人源全结构抗体。
综上所述,现有技术中尚无法实现克隆人单个B淋巴细胞中IgG抗体重链基因全长,从而体外重组具有全天然结构的人IgG单克隆单克隆抗体。
RACE即cDNA末端快速扩增技术(rapid amplification of cDNA ends),是一种基于逆转录PCR从样本中快速扩增cDNA的5′端及3′端的技术,由Frohman等人于1988年发明。利用RACE可以通过已知的部分cDNA序列来得到完整的cDNA的5′和3′端。RACE的特点是在仅已知单侧序列可供设计特异性引物时,应用RACE技术仍能完成基因全长序列的扩增,因此RACE技术也称为单侧PCR。根据已知序列设计特异性引物,利用5′RACE获得5′端序列(基因特异性引物→5′末端),最终能够获得基因完整的cDNA序列。
发明内容
有鉴于此,本发明要解决的技术问题在于提供利用单个B淋巴细胞进行高效克隆人IgG重链全长基因的方法。为了解决现有技术中存在的问题,本发明利的目的是用单细胞5′RACE技术提供一种高效克隆人IgG抗体重链全长基因的制备方法。
为实现上述目的,本发明采用如下技术方案:
本发明提供一种单个B淋巴细胞克隆人IgG重链全长基因的方法,所述方法包括:
(1)人外周血淋巴细胞(Human peripheral blood B lymphocytes)加入无钙镁的PBS缓冲液,制备含B淋巴细胞的悬液;
(2)利用磁珠分选技术对步骤(1)所述的含B淋巴细胞的悬液进行第一次分选,得到阳性B淋巴细胞(分泌Ig G)悬液;利用微流控技术对所述的阳性B淋巴细胞悬液进行第二次分选,得到单个B淋巴细胞;
(3)用单细胞裂解液对步骤(2)所述的单个B淋巴细胞进行裂解,所得裂解液通过反转录酶SMARTScribe Reverse Transcriptase、5′末端接头序列、oligo dT引物和随机引物反转录合成cDNA;在反转录过程中,利用反转录酶SMARTScribe Reverse Transcriptase的模板转换活性,在RNA的5′末端添加接头序列,使IgG抗体重链基因反转录产生的cDNA的5′末端连接有我们自主设计的接头序列。
所述5′末端接头序列如下:
5′GGACCTGGAGCATCCTTTTrGrG+G 3
其中,rG为单脱氧鸟嘌呤,+G为锁核苷酸修饰的鸟嘌呤;
(4)以步骤(3)所述的cDNA为模板,以正向引物和反向引物进行PCR扩增,得到所述单个B淋巴细胞克隆人IgG重链全长基因;
所述正向引物的序列如下:
FP 5′GGACCTGGAGCATCCTTTT 3′
所述反向引物的序列为下列之一:
1-AP 5′TCATTTACCCGGAGACAG 3′
2-AP 5′CTCATTTACCCGGAGACA 3′
3-AP 5′CACTCATTTACCCGGAGAC 3′。
本发明提供了简单、快速、高效的从单个B淋巴细胞中克隆人IgG抗体重链可全长基因序列的方法。本发明采用终点法直接克隆人IgG抗体重链可全长基因序列的方法。
在本发明的一个实施例中,步骤(1)中,所述人外周血淋巴细胞可购买或自行制备。在本发明的一个实施例中,所述人外周血淋巴细胞购自上海酶联生物科技有限公司,货号:ml098362(含不同B淋巴细胞)。在本发明的另一个实施例中,步骤(1)中,所述人外周血淋巴细胞利用人淋巴分离液(Cytiva思拓凡公司,Ficoll-Paque PREMIUM,货号17544203)对人外周全血样本进行密度梯度分离得到(B淋巴细胞在内的单核细胞)。
优选地,步骤(1)中,所述含B淋巴细胞的悬液的细胞密度为1×10
在本发明的一个实施例中,步骤(2)中,第一次分选为:将生物素化抗人IgG抗体与链霉素亲和磁珠偶联,得到标记磁珠;将所述标记磁珠与步骤(1)所述的含B淋巴细胞的悬液于2-8℃下共孵育,通过磁力架分离上清后,以无钙镁的PBS缓冲液悬浮,得到阳性人B淋巴细胞悬液(分泌IgG抗体的B淋巴细胞)。进一步,所述生物素化抗人兔IgG抗体与所述链霉素亲和磁珠的质量比为20μg︰1mg;所述链霉素亲和磁珠的质量以步骤(1)所述的含B淋巴细胞的悬液的体积计为4μg/mL。
本发明避免了目前利用流式细胞仪进行分选时需要进行多种针对人B细胞表面抗原特异性抗体荧光标记的繁琐操作,显著的提高了人单个B淋巴细胞的分选效率。
在本发明的一个实施例中,步骤(2)中,第二次分选为:用无钙镁的PBS缓冲液将阳性B淋巴细胞悬液稀释,至细胞浓度为1×10
在本发明的一个实施例中,步骤(3)中,所述反转录的3′引物为序列长度为20的oligo dT引物。5′末端接头序列为5′GGACCTGGAGCATCCTTTTrGrG+G3′。所述反转录的体系中,5′末端接头序列的浓度为1.2uM、oligo dT引物的浓度为5uM、随机引物的浓度为1uM。
进一步,步骤(4)中,所述PCR扩增的反应体系为:50μL体系含有6μLcDNA溶液,2×PrimeSTAR Max DNA聚合酶预混液25μL,0.2μM正向引物和0.2μM反向引物。
更进一步,步骤(4)中,所述PCR扩增的反应步骤为:
①94℃预变性20s;
②5个PCR循环:98℃第一轮变性10sec,70℃第一轮退火10sec,72℃第一轮延伸15sec;
③30个PCR循环:98℃第二轮变性10sec,62-68℃第二轮退火10sec,72℃第二轮延伸15sec。
优选第二轮退火的温度为64℃。
与现有技术相比,本发明的有益效果在于:本发明采用的技术方案,通过对单个B淋巴细胞中mRNA转录生成cDNA的同时,充分利用反转率酶的模板转换特性,即只在能够完整反转录cDNA的5′末端进行模板转换,从而以添加的5′末端接头序列为模板,继续合成cDNA序列。从而在选择性的在所有能够完整转录的抗体基因cDNA的5′末端添加了一段共有序列,解决由于人抗体基因由于5′末端序列多态性丰富而难以设计PCR引物的难题,实现了利用PCR技术克隆抗体IgG基因全长序列。
本发明仅需外周血液样品10mL,就可以在1天内获得多达上百个IgG抗体的重链全长基因序列,与目前通过单细胞测序法仅克隆IgG可变区部分序列(150bp),然后利用同源比对的方法对从单个单细胞测序的结果进行分析和拼接,然后与固定IgG恒定区重组的方法相比,一方面极大的缩短了克隆抗体基因所需要的时间;另一方面由于保留了抗体可变区的天然结构而具有高亲和力,省略了前者需要进行亲和力成熟等过程,并且极大的降低了免疫原性;另外也保留不同IgG抗体的恒定区的特异性,有利于治疗性抗体的临床效果,从而为制备真正意义的全人源单克隆抗体发现项目提供了有力的技术支撑。
本发明所述的人源IgG抗体重链全长基因的克隆方法,包括分选、反转录和扩增等几个步骤。该方法从1个B淋巴细胞中克隆到IgG抗体重链全长基因,保留了抗体基因重链的天然结构,因此具有抗体亲和力好、特异性强等优势,为人IgG单克隆抗体发现提供了一个新的技术方案,因此是对现有人单克隆抗体基因克隆技术的显著提高。
本发明提供了高效全人源IgG抗体重链全长基因的克隆方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。
附图说明
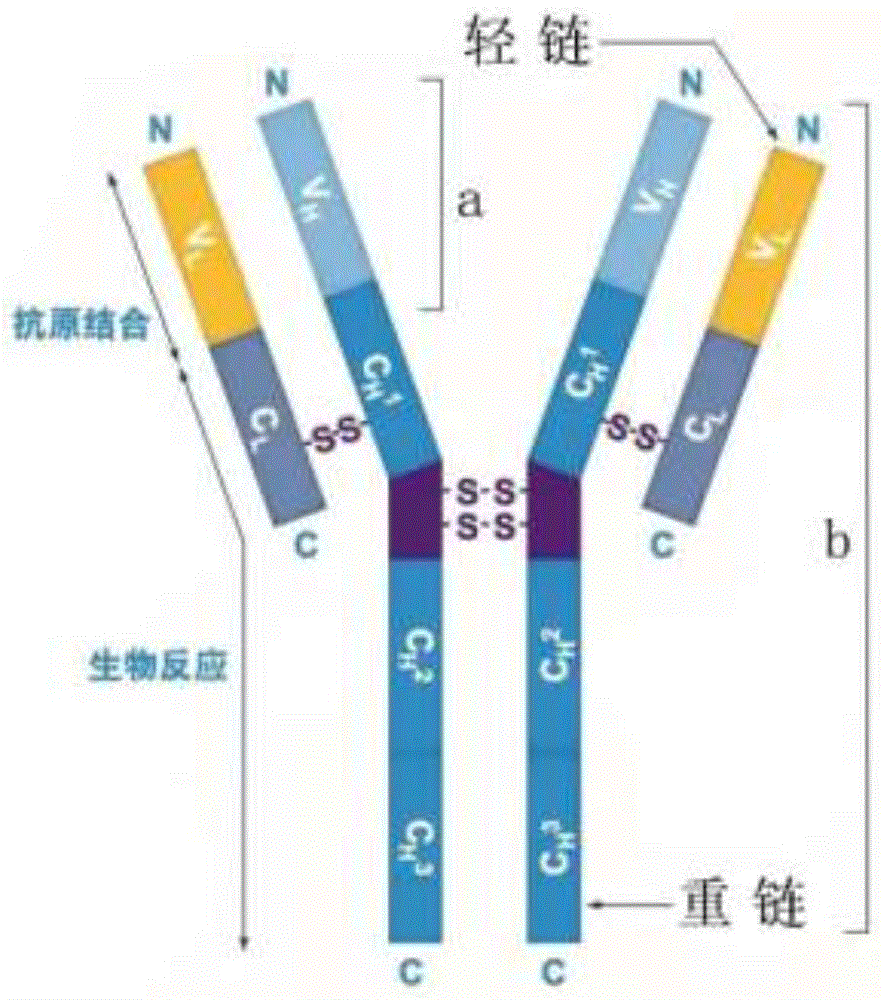
图1为IgG抗体轻重链全长基因的功能分区,以及现有技术和本专利申请技术扩增IgG抗体重链基因长度的序列差异结构示意图,a表示现有基因克隆技术仅能够直接获得人抗体IgG重链基因部分序列长度。b表示本专利申请技术能够直接扩增获得人抗体IgG重链的全长基因序列。
图2为RACE技术扩增IgG抗体重链全长基因的原理图。
图3为克隆人单个B淋巴细胞IgG抗体全长基因的流程图;
图4为利用正向引物FP与反向引物1-AP扩增IgG抗体重链全长基因的凝胶电泳图;
1泳道为2kb分子量marker、2、3和4泳道为单B淋巴细胞原位PCR扩增人抗体IgG全长基因序列电泳条带。其中2-4泳道PCR退火温度为68℃、66℃和64℃,箭头处为扩增的目的条带。
图5为以FP/2-AP为引物扩增的人IgG抗体重链全长基因的凝胶电泳图:1泳道为2kb分子量marker(宝日医生物技术(北京)有限公司,DL2,000DNA Marker货号:3427Q)、2和3泳道为PCR扩增IgG的H链产物电泳条带。其中2和3泳道PCR退火温度为66℃和68℃,箭头处为扩增的目的条带。
图6为以FP/3-AP为引物扩增的人IgG抗体重链全长基因的凝胶电泳图:1泳道为2kb分子量marker(宝日医生物技术(北京)有限公司,DL2,000DNAMarker货号:3427Q)、2、3、4和5泳道为PCR扩增IgG的H链产物电泳条带。其中2-5泳道PCR退火温度为62℃、64℃、66℃和68℃,箭头处为扩增的目的条带。
具体实施方式
本发明采用的试材皆为普通市售品,皆可于市场购得。下面结合实施例,进一步阐述本发明:
实施例1:制备B淋巴细胞悬液
将购买的新鲜人B淋巴细胞(上海酶联生物科技有限公司,货号:ml098362)悬液10mL转移到15ml无菌离心管中,以200×g的离心力离心5分钟,弃去上清液,加入5ml无钙镁的PBS缓冲液(Cytiva公司,货号:SH30256.01)重新悬浮细胞;同时吸取上述细胞悬液100μL适当稀释后用Screpter细胞计数器计数。然后以200×g的离心力离心5分钟,弃去上清液,根据细胞计数结果加入无钙镁的PBS缓冲液,调整细胞密度约为1×10
实施例2:制备人外周血单核细胞悬浮液
使用抗凝管取外周血10mL,上下颠倒4-5次混匀后,加入等体积含钙镁的PBS缓冲液混匀,得到抗凝血。另外准备1个50mL的密度分离离心管,加入20mL人淋巴分离液(Cytiva思拓凡公司,Ficoll-Paque PREMIUM,货号17544203),再将上述抗凝血加入淋巴分离液的上层,在19℃–20℃,400×g,水平离心30min。
再应用巴士吸管小心的吸取中间的白细胞层,加入到3倍体积的PBS缓冲液混匀,150×g,离心10min后,弃去上清液,然后重复该步骤1次。然后用6-8mL的PBS缓冲液悬浮细胞,即得人外周血单核细胞悬浮液。
实施例3:抗体与磁珠偶联
将生物素化抗人IgG抗体与链霉亲和素磁珠偶联,按照生物素化IgG抗体20μg︰1mg比例与直径1μm的磁珠进行偶联,充分振荡重悬磁珠。将离心管置于旋转混合仪上,室温旋转混合60min进行标记。然后将上述含有磁珠的混合液置于磁力架(赛默飞世尔中国公司,DynaMag
然后将内含磁珠的离心管取出后,加入10倍体积的无钙镁的PBS缓冲液(Cytiva公司,货号:SH30256.01)进行悬浮清洗;在将上述离心管置于磁力架上静置3min后,吸取上清液弃去。将内含磁珠的离心管从磁力架上取出,加入适量的无钙镁的PBS缓冲液悬浮,置于4℃备用。
实施例4:磁珠选择性吸附B细胞
使用标记磁珠分选分泌IgG抗体的抗原特异性B淋巴细胞,具体步骤包括,取准确计数的淋巴细胞(浓度约为1×10
实施例5:分选单B细胞
使用微流控单细胞分选技术将获得的B淋巴细胞悬液分选为单细胞,具体包括:根据实施例4细胞计数结果,使用无钙镁的PBS缓冲液对B淋巴细胞悬浮液进行适当稀释,使其细胞浓度保持在1×10
实施例6:反转录合成cDNA
单个B淋巴细胞通过反转录合成cDNA。将前述含有裂解液的单个B淋巴细胞置于室温裂解5分钟后,然后加入反转录预混液,按照20μl反应体系合成cDNA,预混液中还有1.2uM的5′末端接头序列、5uM oligo dT引物、1uM随机引物、dNTPs(1mM each)和1uL反转录酶(宝日医生物技术(北京)有限公司,货号639537,SMARTScribe Reverse Transcriptase),在PCR仪上运行42℃,40分钟;70℃,15min,4℃保存;或将制备cDNA放于-80℃可以保存。
实施例7:PCR扩增IgG抗体重链
以单个B淋巴细胞反转录生成的cDNA为模板、IgG重链全长基因的设计合成的反向引物1-AP与正向引物FP组成引物对、高保真PCR酶(宝日医生物技术(北京)有限公司,
PCR反应体系:50μL体系中含有6μL的cDNA为模板,2×PrimeSTAR Max DNA聚合酶预混液25μL,及0.2μM的IgG抗体正向引物和反向引物。
反应条件:预变性94℃,20S,
5个PCR循环,98℃×10sec,70℃×10sec,72℃×15sec;
30个PCR循环,98℃×10sec,X℃×10sec,72℃×15sec;引物对:引物对:
X分别为64℃、66℃、68℃
正向引物FP 5′GGACCTGGAGCATCCTTTT 3′
反向序列1-AP 5′TCATTTACCCGGAGACAG 3′
扩增的IgG重链全长基因片段用1.2%的琼脂糖凝胶电泳进行检测,结果见图4。
实施例8:PCR扩增IgG抗体重链
以单个B淋巴细胞反转录生成的cDNA为模板、IgG重链全长基因的设计合成的反向引物1-AP与正向引物FP组成引物对、高保真PCR酶(宝日医生物技术(北京)有限公司,
PCR反应条件体系:50μL体系中含有6μL的cDNA为模板,2×PrimeSTAR Max DNA聚合酶预混液25μL,及0.2μM的IgG抗体正向引物和反向引物。
反应条件:预变性94℃,20S,
5个PCR循环,98℃×10sec,70℃×10sec,72℃×15sec;
30个PCR循环,98℃×10sec,X℃×10sec,72℃×15sec;引物对:
X分别为66℃或68℃。
正向引物FP 5′GGACCTGGAGCATCCTTTT 3′
反向序列2-AP 5′CTCATTTACCCGGAGACA 3′
扩增的IgG重链全长基因片段用1.2%的琼脂糖凝胶电泳进行检测,结果见图5。
实施例9:PCR扩增IgG抗体重链
以单个B淋巴细胞反转录生成的cNDA为模板、IgG重链全长基因的设计合成的反向引物1-AP与正向引物FP组成引物对、高保真PCR酶(宝日医生物技术(北京)有限公司,
PCR反应条件体系:50μL体系中含有6μL的cDNA为模板,2×PrimeSTAR Max DNA聚合酶预混液25μL,及0.2μM的IgG抗体正向引物和反向引物。
反应条件:预变性94℃,20S,
5个PCR循环,98℃×10sec,70℃×10sec,72℃×15sec;
30个PCR循环,98℃×10sec,X℃×10sec,72℃×15sec;
X分别为62℃、64℃、66℃或68℃。
引物对:
正向引物FP 5′GGACCTGGAGCATCCTTTT 3′
反向序列3-AP 5′CACTCATTTACCCGGAGAC 3′
扩增的IgG重链全长基因片段片段用1.2%的琼脂糖凝胶电泳进行检测,结果见图6。
实施例10:对克隆获得的人IgG重链基因序列进行测序和功能区分析
将PCR扩增获得的IgG重链全长基因片段用1.2%的琼脂糖凝胶电泳进行检测,在紫外灯下切取最大的DNA片段,利用DNA吸附柱进行纯化回收。回收的纯化的PCR产物送样到测序公司进行PCR产物测序,测序的原始序列转换成fasta格式保存。使用IMGT数据库(http://www.imgt.org/)中IMGT/VQUEST选项下的“Analyse your Immunoglobulin(IG)orantibody nucleotide sequences”(https://www.imgt.org/IMGT_vquest/input)工具对克隆获得的IgG抗体的H链进行序列分析。
实施例6-8均能够成功扩增人IgG重链全长基因序列,此处以实施例1为例,对其扩增的测序结果进行抗体序列结构分析。
20230801的核苷酸序列见SEQ ID NO:1
利用IMGT/V-QUEST分析序列的20230801详细结果
连字符(-)表示核苷酸同一性,点(.)表示间隙
参考序列为IMGT中数据库中的人类IG重链序列
以下为IMGT自动注释
V-D-J-REGION
137..494
/CDR_length="[8.6.14]"
/FR_length="[25.17.38.11]"
/nucleotide sequence
ctggaactcctggtcgagtctgggggaggcgtagtccagcctgggaggtccctcagactctcctgtacagcctctgggttcacctttagcagctatgccatgagctgggtccgccaggctccagggaaggggctggagtggaagccgttgatcatgcaggtcgtagcacatactacgcagactccgagaagggccggttcaccatctccagagacaattccaagaacacagtgtatttggaaacagacaccctggaaactgaagacacggcggtatattcctgtgggaagggctgccctctggctttggagatggttttctcgatggggcctgggaaccctcgtcaccgtctcctcag
/translation
LELLVESGGGVVQPGRSLRLSCTASGFTFSSYAMSWVRQAPGKGLEWKPLIMQVVAHTTQTPRRAGSPSPETIPRTQCIWKQTPWKLKTRRYIPVGRAALWLWRWFSRWGLGTLVTVSS
V-REGION
137..424
/allele="Homsap IGHV3-33*02 F or Homsap IGHV3-7*01 F or HomsapIGHV3-7*03 F"
/gene="Homsap IGHV3-33 or Homsap IGHV3-7"
/nucleotide sequence
ctggaactcctggtcgagtctgggggaggcgtagtccagcctgggaggtccctcagactctcctgtacagcctctgggttcacctttagcagctatgccatgagctgggtccgccaggctccagggaaggggctggagtggaagccgttgatcatgcaggtcgtagcacatactacgcagactccgagaagggccggttcaccatctccagagacaattccaagaacacagtgtatttggaaacagacaccctggaaactgaagacacggcggtatattcctgtggga
/translation
LELLVESGGGVVQPGRSLRLSCTASGFTFSSYAMSWVRQAPGKGLEWKPLIMQVVAHTTQTPRRAGSPSPETIPRTQCIWKQTPWKLKTRRYIPVG
FR1-IMGT
137..211
/AA_IMGT="AA 1 to 26,AA 10 is missing"
/nucleotide sequence
ctggaactcctggtcgagtctgggggaggcgtagtccagcctgggaggtccctcagactctcctgtacagcctct
/translation
LELLVESGGGVVQPGRSLRLSCTAS
1st-CYS
200..202
/nucleotide sequence
tgt
/translation
C
CDR1-IMGT
212..235
/AA_IMGT="AA 27 to 38,AA 31,32,33 and 34 are missing"
/nucleotide sequence
gggttcacctttagcagctatgcc
/translation
GFTFSSYA
FR2-IMGT
236..286
/AA_IMGT="AA 39 to 55"
/nucleotide sequence
atgagctgggtccgccaggctccagggaaggggctggagtggaagccgttg
/translation
MSWVRQAPGKGLEWKPL
CONSERVED-TRP
242..244
/nucleotide sequence
tgg
/translation
W
CDR2-IMGT
287..304
/AA_IMGT="AA 56 to 65,AA 59,60,61 and 62 are missing"
/nucleotide sequence
atcatgcaggtcgtagca
/translation
IMQVVA
FR3-IMGT
305..418
/AA_IMGT="AA 66 to 104,AA 73 is missing"
/nucleotide sequence
catactacgcagactccgagaagggccggttcaccatctccagagacaattccaagaacacagtgtatttggaaacagacaccctggaaactgaagacacggcggtatattcct
/translation
HTTQTPRRAGSPSPETIPRTQCIWKQTPWKLKTRRYIP
CDR3-IMGT
419..460
/AA_IMGT="AA 105 to 117,AA 112.1 is added"
/nucleotide sequence
gtgggaagggctgccctctggctttggagatggttttctcga
/translation
VGRAALWLWRWFSR
JUNCTION
416..463
/in_frame
/nucleotide sequence
cctgtgggaagggctgccctctggctttggagatggttttctcgatgg
/translation
PVGRAALWLWRWFSRW
(N-D)-REGION
425..443
/nucleotide sequence
agggctgccctctggcttt
/translation
RAALWL
J-REGION
444..494
/allele="Homsap IGHJ5*02 F"
/gene="Homsap IGHJ5"
/codon_start=3
/nucleotide sequence
ggagatggttttctcgatggggcctgggaaccctcgtcaccgtctcctcag
/translation
RWFSRWGLGTLVTVSS
J-TRP
461..463
/nucleotide sequence
tgg
/translation
W
FR4-IMGT
461..494
/AA_IMGT="AA 118 to 128"
/nucleotide sequence
tggggcctgggaaccctcgtcaccgtctcctcag
/translation
WGLGTLVTVSS
- 巢式一步法RT-PCR从单个B细胞扩增鼠源抗体重链和轻链可变区基因全序列的方法
- 巢式一步法RT-PCR从单个B细胞扩增鼠源抗体重链和轻链可变区基因全序列的方法
